ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет на основании предварительной заявки США № 60/852861, поданной 19 октября 2006, и предварительной заявки США № 60/879218, поданной 6 января 2007, описания которых включены в данный документ в виде ссылки во всей полноте.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к агонистическим антителам против Notch3 и к их применению для улучшения, лечения или профилактики Notch3-ассоциированного заболевания или нарушения.
УРОВЕНЬ ТЕХНИКИ
Ген Notch впервые был описан в 1917 г., когда было обнаружено, что полотна крыльев штамма плодовой мушки Drosophila melanogaster имеют насечки (Morgan, Am Nat 51:513 (1917)). Спустя почти семьдесят лет ген клонировали и установили, что он кодирует клеточный поверхностный рецептор, играющий ключевую роль в развитии многих типов клеток и тканей Drosophila (Wharton et al., Cell 43:567 (1985)). Вскоре было обнаружено, что сигнальный путь Notch представляет собой механизм, опосредуемый контактированием клеток, и в эволюционном отношении является консервативным от дрозофилы до человека. Обнаружено, что рецепторы Notch участвуют во многих клеточных процессах, таких как дифференциация, решение о гибели клетки, поддержание стволовых клеток, двигательная активность клеток, пролиферация и апоптоз, в разных типах клеток в процессе развития и гомеостаза тканей (обзор можно найти в Artavanis-Tsakonas, et al., Science 268:225 (1995)).
У млекопитающих обнаружено четыре рецепторных белка Notch (обозначаемых Notch1-Notch4) и пять соответствующих лигандов (обозначаемых дельта-подобный лиганд-1 (DLL-1), дельта-подобный лиганд-3 (DLL-3), дельта-подобный лиганд-4 (DLL-4), Jagged-1 и Jagged-2). Гены рецептора Notch млекопитающих кодируют белки размером ~300 кДа, которые расщепляются при транспортировке к клеточной поверхности и существуют в виде гетеродимеров. Внеклеточный фрагмент рецептора Notch содержит тридцать четыре эпидермальных факторов роста (EGF)-подобных повторов и три повтора, обогащенных цистеином Notch/LIN12. Связь двух расщепляемых субъединиц осуществляется при участии последовательностей, находящихся непосредственно в N-концевой и C-концевой области участка расщепления, причем две указанные субъединицы составляют домены гетеродимеризации Notch (HD) (Wharton, et al., Cell 43:567 (1985); Kidd, et al., Mol Cell Biol 6:3431 (1986); Kopczynski, et al., Genes Dev 2:1723 (1988); Yochem, et al., Nature 335:547 (1988)).
В настоящее время пока не ясно, как сигнальный путь Notch регулируется разными рецепторами или как пять лигандов различаются по вкладу в передачу сигнала или регуляцию. Различия в передаче сигнала и/или регуляции могут определяться характером их экспрессии в разных тканях или разными условиями окружающей среды. Показано, что лигандные белки Notch, в том числе Jagged/Serrate и дельта/дельта-подобные, способны специфически связываться с участком повтора EGF и индуцировать рецептор-опосредованный сигнальный путь Notch (обзор опубликован Bray, Nature Rev Mol Cell Biol. 7:678 (2006), и Kadesch, Exp Cell Res. 260:1 (2000)). Из повторов EGF 10ый-12ый необходимы для связывания лиганда с рецептором Notch, а другие повторы EGF могут усиливать взаимодействие рецептора с лигандом (Xu, et al., J Biol Chem. 280:30158 (2005); Shimizu, et al., Biochem Biophys Res Comm. 276:385 (2000)). Хотя повторы LIN12 и домен димеризации не участвуют непосредственно в связывании лиганда, они играют важную роль в поддержании гетеродимерного белкового комплекса, предотвращая лиганд-независимое расщепление под действием протеазы и активацию рецептора (Sanche-Irizarry, et al., Mol Cell Biol. 24:9265 (2004); Vardar et al., Biochem. 42:7061 (2003)).
Самоподдержание и определение метаболического пути нормальных стволовых клеток из многих тканей, в том числе из ткани кишечника и нервной ткани, зависят от сигнального пути Notch (Fre, et al., Nature, 435: 964 (2005); van Es, et al., Nature, 435: 959 (2005); Androutsellis-Theotokis, et al., Nature, 442: 823 (2006)). Следовательно, агонистическое антитело Notch3 можно использовать для лечения дегенеративных заболеваний. CADASIL (церебральная аутосомно-доминантная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией) вызывает инсульт и деменцию, характерные признаки которых включают в себя подкорковые ишемические события и мультиинфарктную деменцию. Обнаружено, что CADASIL связана с локализацией мутантного гена в хромосоме 19 (Joutel, et al., Nature 383:707 (1996)). Joutel et al. идентифицировали у пациентов с CADASIL мутации, которые вызывают серьезное разрушение гена Notch 3, следовательно, пациенты с CADASIL могут иметь дефектный белок Notch3. К сожалению, данное заболевание, которое является в высокой степени инвалидизирующим и часто летальным, в основном остается недиагностированным, или диагностируется ошибочно как рассеянный склероз и болезнь Альцгеймера. Проводимые в настоящее время исследования имеют тенденцию демонстрировать, что данное состояние распространено гораздо шире, чем считалось вначале.
Другим примером Notch3-ассоциированного заболевания является семейная гемиплегическая мигрень (FHM), доминантно-аутосомная форма мигрени с предвестником эпилептического припадка, связанная с нарушением, расположенным в том же участке хромосомы 19, что и ген Notch3. Следует отметить, что более 30% пациентов, страдающих от CADASIL, также страдают от мигрени с предвестником эпилептического припадка. Однако последнее заболевание встречается приблизительно только у 5% населения, причем полученные результаты свидетельствуют о том, что ген Notch3 участвует в механизме данного состояния. Подобным образом, семейная парокситическая атаксия связана с геном, расположенным в том же участке хромосомы 19, и можно сделать вывод, что Notch3 участвует в развитии данного состояния. Другие состояния и заболевания, связанные с Notch3, включают в себя синдром Алагилля (Flynn, et al., J Pathol 204:55 (2004)).
В настоящее время проводят исследования, чтобы идентифицировать другие заболевания и состояния, связанные с недостаточностью экспрессии и/или сигнального пути Notch3. Поскольку существует большое число заболеваний человека, связанных с сигнальным путем Notch 3, важно определить новые способы профилактики и лечения данных заболеваний. Настоящее изобретение предлагает новые агонистические антитела против Notch3, которые можно использовать для удовлетворения данной потребности медицины.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает новые агонистические антитела и их фрагменты, которые специфически связываются с эпитопом человеческого рецептора Notch3 в домене LIN12. Другой аспект данного изобретения включает в себя эпитоп-связывающий участок и антитела, которые связывают такой же эпитоп, как и антитела настоящего изобретения. Антитела настоящего изобретения активируют Notch3-опосредованный сигнальный путь через рецептор Notch3 независимо от связывания лиганда.
Данное изобретение предлагает аминокислотные последовательности вариабельных участков тяжелых и легких цепей антител и соответствующие им нуклеотидные последовательности. Другое воплощение данного изобретения включает в себя последовательности CDR указанных антител.
Другое воплощение настоящего изобретения включает в себя клеточные линии и векторы, несущие последовательности антител настоящего изобретения.
Настоящее изобретение также включает в себя эпитоп, распознаваемый агонистическими антителами данного изобретения. Кроме того, настоящее изобретение включает в себя антитела, которые связывают данный эпитоп. Воплощения включают в себя эпитоп Notch3, содержащий домен Lin12, последовательность которого, по меньшей мере, на 80%, 85%, 90% или 95% идентична SEQ ID NO:10. Более конкретно, эпитоп Notch3 содержит SEQ ID NO:11. Настоящее изобретение включает в себя агонистические антитела, которые связывают данный эпитоп.
Другое воплощение настоящего изобретения относится к применению указанных антител в производстве лекарственного средства или композиции для лечения Notch3-ассоциированных заболеваний и нарушений, связанных, например, с инактивацией рецептора.
Другое воплощение настоящего изобретения относится к применению указанных антител для лечения Notch3-ассоциированных заболеваний или нарушений, связанных, например, с инактивацией рецептора, включающему в себя компенсацию указанных дефектов, например, путем активации сигнального пути Notch3 независимо от связывания лиганда. Notch3-ассоциированные нарушения могут включать в себя, без ограничения, CADASIL, семейную гемиплегическую мигрень (FHM), семейную парокситическую атаксию, синдром Алагилля и другие дегенеративные заболевания.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 изображена аминокислотная последовательность Notch3. Участок повтора EGF простирается от аминокислотного остатка 43 до аминокислотного остатка 1383; домен LIN12 простирается от аминокислотного остатка 1384 до аминокислотного остатка 1503; и домен димеризации простирается от аминокислотного остатка 1504 до аминокислотного остатка 1640.
На фиг.2 (A-H) приведено сравнительное изображение аминокислотных последовательностей человеческих Notch1, Notch2, Notch3 и Notch4.
На фиг.3 показан процент идентичности Notch 1, Notch 2, Notch 3 и Notch 4.
На фиг.4A и 4B изображены последовательности вариабельных участков тяжелой и легкой цепи моноклонального антитела MAb 256A-13 против Notch3 (SEQ ID NO: 2), причем участки CDR подчеркнуты.
На фиг.5 приведены результаты люциферазного репортерного анализа примера 5, демонстрирующие активирующее действие MAb против Notch3 на рецептор Notch3.
На фиг.6 показано влияние агонистических антител Notch3 на металлопротеазное расщепление Notch3.
На фиг.7 изображено эпитопное картирование связывающего участка 256A-13 из конструкций гибридных белков Notch3-Fc.
На фиг.8 приведено сравнительное изображение полученной рекомбинантным методом последовательности, кодирующей лидерный пептид Notch3, и нативной последовательности, кодирующей лидерный пептид Notch3 (номер доступа в NCBI GenBank: NM_000435), демонстрирующее, что рекомбинантная последовательность, кодирующая лидерный пептид Notch, несет изменения в нуклеотидном составе (8A) и обуславливает изменения транслируемой аминокислотной последовательности (8B). На фиг.8C изображен домен LIN12, а на фиг.8D изображен эпитоп субдомена LIN12.
На фиг.9 изображено получение конструкции с переставленными доменами методом PCR-SOE. Прямоугольники со стрелками обозначают праймеры ПЦР. Незакрашенные прямоугольники относятся к последовательности Notch3. Закрашенные прямоугольники относятся к последовательности Notch1.
На фиг.10 изображены аминокислотные последовательности, используемые при эпитопном картировании домена LIN12 Notch3 из MAb 256A-13.
На фиг.11 изображены аланиновые сканирующие пептиды, используемые для линейного эпитопного картирования 256A-13.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение не ограничивается описанными здесь конкретными методами, схемами, клеточными линиями, векторами или реагентами, поскольку они могут варьировать. Кроме того, используемая в данном документе терминология предназначена только для описания конкретных воплощений и не ограничивает объем настоящего изобретения. В данном описании и в прилагающейся формуле изобретения, если контекст не указывает иначе, единственное число включает в себя множественное, например термин "клетка-хозяин" включает в себя совокупность таких клеток-хозяев. Если не указано иначе, все используемые здесь технические и научные термины, а также все сокращения имеют традиционные значения, известные рядовым специалистам в области данного изобретения. В данном описании приводятся примеры способов, устройств и материалов, однако при осуществлении настоящего изобретения можно использовать любые способы и материалы, подобные или эквивалентные описанным.
Все упомянутые здесь патенты и публикации включены в данное описание в виде ссылки в степени, допускаемой законом для описания и раскрытия указанных в них белков, ферментов, векторов, клеток-хозяев и методов, пригодных для применения в настоящем изобретении. Однако приведенную здесь информацию не следует рассматривать как допущение, что настоящее изобретение дает право расценивать эту информацию как уровень техники и противопоставлять ее предыдущему изобретению.
Определения
Термины, используемые по тексту данной заявки, следует интерпретировать в их традиционных значениях, известных рядовому специалисту в данной области. Однако нижеследующие термины авторы данной заявки предлагают использовать в конкретных, указанных ниже значениях.
Фраза "практически идентичный" в отношении последовательности полипептидной цепи антитела может означать, что последовательность антитела, по меньшей мере, на 70%, или 80%, или 90%, или 95%, идентична сравниваемой полипептидной последовательности. В отношении нуклеотидной последовательности данный термин может означать, что последовательность нуклеотидов, по меньшей мере, на 85%, или 90%, или 95%, или 97% идентична сравниваемой нуклеотидной последовательности.
Термин "идентичность" или "гомология" следует понимать, как процент аминокислотных остатков в последовательности-кандидате, идентичных остаткам последовательности, с которой сравнивают последовательность-кандидат, определяемый после выравнивания последовательности и введения пробелов, если это необходимо для достижения максимального процента идентичности всей последовательности, причем консервативные замены не рассматриваются как часть идентичности последовательности. N- или C-концевые удлинения или вставки не должны истолковываться как уменьшение идентичности или гомологии. Способы выравнивания и компьютерные программы для их осуществления хорошо известны в данной области. Идентичность последовательности можно определить с помощью программы для анализа последовательностей.
Термин "антитело" используется в самом широком смысле, а именно он охватывает моноклональные антитела (в том числе полноразмерные моноклональные антитела), поликлональные антитела, и полиспецифичные антитела (например, биспецифичные антитела), а также фрагменты антител, обладающие желательной биологической активностью. Антитела (Ab) и иммуноглобулины (Ig) представляют собой гликопротеины, имеющие одинаковые структурные особенности. Тогда как антитела обладают специфичностью связывания по отношению к конкретной мишени, иммуноглобулины включают в себя и антитела, и другие антитело-подобные молекулы, не обладающие специфичностью по отношению к мишени. Антитела данного изобретения могут относиться к любому типу (например, IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу. Нативные антитела и иммуноглобулины, как правило, представляют собой гетеротетрамерные гликопротеины размером приблизительно 150000 дальтон, которые состоят из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь содержит на одном конце вариабельный домен (VL), а на другом конце константный домен.
В данном описании термин "антитело против Notch3" относится к антителу, которое специфически связывается с человеческим Notch3, активируя сигнальный путь Notch 3 независимо от лиганда.
Термин "вариабельный" в применении к домену антитела означает, что последовательности некоторых участков вариабельных доменов сильно различаются у разных антител и отвечают за специфическое связывание конкретного антитела с конкретной мишенью. Однако на протяжении вариабельных доменов антител вариабельность распределяется не равномерно. Она концентрируется в трех сегментах, называемых участки, определяющие комплементарность (CDR; т.е. CDR1, CDR2 и CDR3), или гипервариабельные участки, которые присутствуют в вариабельных доменах как легкой, так и тяжелой цепей. Более консервативные фрагменты вариабельных доменов называют каркасными участками (FR). Все вариабельные домены нативных тяжелых и легких цепей содержат четыре участка FR, которые, как правило, имеют β-складчатую конфигурацию и соединяются тремя CDR, образующими петлеобразное соединение и, в некоторых случаях, часть β-складчатой структуры. CDR одной цепи удерживаются вместе в непосредственной близости участками FR и вместе с CDR другой цепи участвуют в формировании участка связывания антитела с мишенью (см. Kabat, et al. Sequences of Proteins of Immunological Interest, National Institute of Health, Bethesda, Md. (1987)). Если не указано иначе, в данном описании для нумерации аминокислотных остатков иммуноглобулинов используется система нумерации аминокислотных остатков иммуноглобулинов Kabat, et al.
Термин "фрагмент антитела" относится к фрагменту полноразмерного антитела, как правило, к участку, связывающему мишень, или к вариабельному участку. Примеры фрагментов антител включают в себя фрагменты F(ab), F(ab'), F(ab')2 и Fv. Фраза "функциональный фрагмент или аналог" антитела относится к соединению, обладающему количественной биологической активностью, подобной биологической активности полноразмерного антитела. Например, Функциональный фрагмент или аналог антитела против Notch3 способен связываться с рецептором Notch3, предотвращая или существенно снижая способность рецептора связываться с лигандами или инициировать передачу сигнала. В данном описании термин "функциональный фрагмент" в применении к антителам относится к фрагментам Fv, F(ab) и F(ab')2. Фрагмент "Fv" представляет собой димер, состоящий из вариабельного домена одной тяжелой и вариабельного домена одной легкой цепи, находящихся в тесной нековалентной связи (димер VH-VL). В данной конфигурации три CDR каждого вариабельного домена взаимодействуют, образуя участок связывания с мишенью на поверхности димера VH-VL. Вместе шесть CDR определяют способность антитела специфически связываться с мишенью. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к мишени) обладает способностью распознавать и связывать мишень, хотя и с более низким сродством, чем целый связывающий участок.
Фрагменты антител "одноцепочечный Fv" или "sFv" содержат VH и VL домены антитела, причем указанные домены находятся в одной полипептидной цепи. Как правило, полипептид Fv также содержит полипептидный линкер между доменами VH и VL, позволяющий sFv формировать структуру, необходимую для связывания мишени.
Термин "диатела" относится к маленьким фрагментам антител, содержащим два антиген-связывающих участка, причем указанные фрагменты в одной полипептидной цепи содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL). Путем применения линкера, который является слишком коротким, чтобы позволить спариться двум доменам, расположенным на одной цепи, домены вынуждают спариваться с комплементарными доменами другой цепи с формированием двух антиген-связывающих участков.
Фрагмент F(ab) содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты F(ab') отличаются от фрагментов F(ab) добавлением нескольких остатков по карбоксильному концу домена СН1 тяжелой цепи, в том числе одного или нескольких остатков цистеина в шарнирном участке антитела. Фрагменты F(ab') получают путем расщепления дисульфидной связи, образованной остатками цистеина шарнирного участка, в продукте расщепления пепсином F(ab')2. Специалистам в данной области известны и другие химические способы соединения фрагментов антител.
Термин "моноклональное антитело" в данном описании относится к антителу, полученному из популяции практически гомогенных антител, т.е. из популяции, отдельные антитела которой являются идентичными за исключением возможных природных мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела в соответствии с настоящим описанием включают в себя "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующей последовательности антитела, полученного от животного конкретного вида или принадлежащего к конкретному классу или подклассу антител, а остальная часть цепи (цепей) идентична или гомологична соответствующей последовательности антитела, полученного от животного другого вида или принадлежащего к другому классу или подклассу антител, а также фрагменты таких антител, обладающие желательной биологической активностью (патент США № 4816567; и Morrison, et al., Proc Natl Acad Sci USA 81:6851 (1984)). Моноклональные антитела обладают высокой специфичностью и направлены против одного участка мишени. Кроме того, в отличие от традиционных (поликлональных) препаратов антител, которые обычно состоят из разных антител, направленных против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты мишени. Помимо специфичности преимуществом моноклональных антител является возможность их синтеза в гибридомной культуре, что позволяет избежать загрязнения другими иммуноглобулинами. Определение "моноклональный" указывает на то, что антитело получено из практически гомогенной популяции антитела, и не должно истолковываться как отнесение к какому-либо конкретному способу получения. Например, моноклональные антитела, пригодные для применения в настоящем изобретении, можно выделить из фаговых библиотек антител, используя хорошо известные методы. Исходные моноклональные антитела для применения в соответствии с настоящим изобретением можно получить с помощью гибридомного метода, впервые описанного Kohler, et al, Nature 256:495 (1975), или с помощью рекомбинантных методов.
"Гуманизированные" формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие мишень-связывающие субпоследовательности антител), которые содержат минимальную последовательность нечеловеческого иммуноглобулина. Как правило, практически все вариабельные домены гуманизированного антитела из, по меньшей мере, одного или, чаще всего, двух, содержат все или почти все участки CDR, соответствующие нечеловеческому иммуноглобулину, и все или почти все участки FR, соответствующие матричной последовательности человеческого иммуноглобулина. Гуманизированное антитело также может содержать, по меньшей мере, часть константного участка (Fc) иммуноглобулина, как правило, выбранного из человеческой матрицы иммуноглобулина.
Термины "клетка", "клеточная линия" и "клеточная культура" включают в себя потомство. Следует понимать, что не все потомство может быть полностью идентичным родительским клеткам по содержанию ДНК вследствие присутствия преднамеренных или непреднамеренных мутаций. В объем данного изобретения также входит вариантное потомство, обладающее такими же функциями или биологическими свойствами, как и исходная трансформированная клетка. "Клетки-хозяева", используемые в настоящем изобретении, обычно представляют собой прокариотические или эукариотические клетки.
"Трансформацию" клеточного организма, клетки или клеточной линии с помощью ДНК осуществляют путем введения ДНК в клетку-мишень либо в виде внехромосомного элемента, либо посредством встраивания в хромосому, с помощью способа, позволяющего сохранить способность ДНК к репликации. "Трансфекция" клетки или организма молекулой ДНК представляет собой поглощение ДНК, например, вектора экспрессии, клеткой или организмом независимо от того, экспрессируется ли фактически какая-либо кодирующая последовательность или нет. Термины "трансфицированная клетка-хозяин" и "трансформированная клетка-хозяин" относятся к клетке, в которую введена ДНК. Клетка, называемая "клетка-хозяин", может быть прокариотической или эукариотической. Типичные прокариотические клетки-хозяева включают в себя разные штаммы E. coli. Типичные эукариотические клетки-хозяева представляют собой клетки млекопитающих, такие как клетки яичника китайского хомячка или человеческие клетки. Вводимая последовательность ДНК может относиться к тому же виду, что и клетка-хозяин, или к другому виду, или она может представлять собой гибридную последовательность ДНК, содержащую несколько чужеродных и несколько гомологичных ДНК.
Термин "вектор" относится к конструкции ДНК, содержащей последовательность ДНК, функционально связанную с подходящей контрольной последовательностью, способной обеспечивать экспрессию ДНК в подходящем хозяине. Такие контрольные последовательности включают в себя промотор, обеспечивающий транскрипцию, необязательную последовательность оператора, контролирующую такую транскрипцию, последовательность, кодирующую подходящие участки связывания мРНК рибосомой, и последовательности, контролирующие терминацию транскрипции и трансляции. Вектор может представлять собой плазмиду, фаговую частицу или просто потенциальную геномную вставку. После трансформации в подходящего хозяина вектор может реплицироваться и функционировать независимо от генома хозяина, или в некоторых случаях, он может интегрироваться в геном как таковой. В настоящем описании термины "плазмида" и "вектор" иногда используются как взаимозаменяемые, поскольку плазмида представляет собой наиболее широко используемую форму вектора. Однако предполагается, что данное изобретение включает в себя и другие, известные в данной области, формы векторов, которые выполняют эквивалентную функцию.
"Млекопитающее", подлежащее лечению, может представлять собой любое животное, относящееся к классу млекопитающих, и включает в себя человека, ручных и сельскохозяйственных животных, отличных от человека приматов, а также диких животных, спортивных животных или домашних животных, таких как собаки, лошади, кошки, коровы и др.
Термин "маркер" в данном описании относится к детектируемому соединению или детектируемой композиции, которые могут быть конъюгированы непосредственно или через другие соединения с молекулой или белком, например антителом. Маркер сам может быть детектируемым (например, радиоизотопные метки или флуоресцентные метки) или, как в случае ферментного маркера, может катализировать детектируемое химическое изменение субстратного соединения или субстратной композиции.
В данном описании термин "твердая фаза" обозначает неводную основу, к которой может прилипать антитело настоящего изобретения. Примеры твердых фаз, входящих в объем данного изобретения, включают в себя фазы, полученные частично или полностью из стекла (например, стекло с контролируемым размером пор), полисахариды (например, агароза), полиакриламиды, полистирол, поливиниловый спирт и кремнийорганические соединения. В некоторых воплощениях, в зависимости от контекста, к твердой фазе может относиться лунка аналитического планшета; в других воплощениях твердая фаза может представлять собой колонку для очистки (например, колонку для аффинной хроматографии).
В данном описании термин "Notch3-опосредованое нарушение" относится к состоянию или заболеванию, которое характеризуется дефектной или пониженной экспрессией рецептора Notch3, а именно данный термин может включать в себя состояния, ассоциированные с дегенеративными заболеваниями, такие как CADASIL, FHM, семейная парокситическая атаксия, синдром Аллагиля и другие дегенеративные заболевания.
Рецептор NOTCH3 как иммуноген, вызывающий образование антител
Растворимые мишени или их фрагменты можно использовать в качестве иммуногенов для получения антител. Антитело направлено против представляющей интерес мишени. Предпочтительно, мишенью является биологически важный полипептид, и введение антитела млекопитающему, страдающему от заболевания или нарушения, может оказывать благоприятное терапевтическое действие на млекопитающего. В качестве иммуногена для получения антител можно использовать целые клетки. Иммуноген можно получить с помощью рекомбинантных или синтетических способов. Иммуноген также можно выделить из природного источника.
В случае трансмембранных молекул, таких как рецепторы, в качестве иммуногена можно использовать их фрагменты (например, внеклеточный домен рецептора). Альтернативно, в качестве иммуногена можно использовать клетки, экспрессирующие трансмембранные молекулы. Такие клетки можно получить из природного источника (например, из линии раковых клеток) или путем трансформации исходных клеток с использованием рекомбинантных методов, обеспечивающих повышенную экспрессию трансмембранной молекулы. Специалистам в данной области известны и другие формы иммуногенов, которые можно использовать для получения антител.
Альтернативно, ген или кДНК, кодирующую человеческий рецептор Notch3, можно клонировать в плазмиде или другом векторе экспрессии и экспрессировать в любой системе экспрессии с помощью способов, хорошо известных специалистам в данной области. Способы клонирования и экспрессии рецептора Notch3, а также кодирующей его нуклеотидной последовательности, описаны в литературе (см., например, патенты США №№ 5821332 и 5759546). Вследствие вырожденности генетического кода можно использовать большое число нуклеотидных последовательностей, кодирующих рецепторный белок или полипептиды Notch3. Нуклеотидную последовательность можно варьировать путем отбора сочетаний, исходя из возможных вариантов кодонов. Данные сочетания получают в соответствии с триплетным генетическим кодом, используемым в нуклеотидной последовательности, кодирующей природный рецептор Notch3, причем можно рассматривать все полученные вариации. Любой из указанных полипептидов можно использовать для иммунизации животного с целью получения антител, связывающих человеческий рецептор Notch3.
Вследствие высокой консервативности аминокислотной последовательности Notch3 в качестве иммуногенов для получения антител можно использовать также рекомбинантные белки Notch3 других видов. Сравнение человеческого и мышиного Notch3 показывает, что свыше 90% аминокислотных последовательностей двух видов являются идентичными.
Иммуногенный рецептор Notch3 при необходимости можно экспрессировать в виде гибридного белка, содержащего рецептор Notch3, соединенный с гибридизационным фрагментом. Гибридизационный фрагмент часто облегчает очистку белка, например позволяет выделить и очистить гибридный белок методом аффинной хроматографии, и, кроме того, его также можно использовать для повышения иммуногенности. Гибридные белки можно получить путем культивирования рекомбинантной клетки, трансформированной гибридной нуклеотидной последовательностью, кодирующей белок с присоединенным по карбоксильному или амино-концу гибридизационным фрагментом. Гибридизационные фрагменты могут включать в себя, без ограничения, участки Fc иммуноглобулинов, глутатион-S-трансферазу, β-галактозидазу, полигистидиновый фрагмент, способный связываться с двухвалентным ионом металла, и белок, связывающий мальтозу.
Рекомбинантный рецепторный белок Notch3, как описано в примере 1, используют для иммунизации мышей с целью получения гибридом, продуцирующих моноклональные антитела настоящего изобретения. Примеры полипептидов включают в себя полноразмерную последовательность SEQ ID NO:1 и ее фрагменты или их варианты.
Получение антител
Антитела настоящего изобретения можно получить с помощью любого подходящего способа, известного в данной области. Антитела настоящего изобретения могут включать в себя поликлональные антитела. Способы получения поликлональных антител известны опытным специалистам (Harlow, et al., Antibodies: a Laboratory Manual, Cold spring Harbor Laboratory Press, 2nd ed. (1988)), содержание данной публикации включено в настоящее описание в виде ссылки во всей полноте).
Например, как описано в примере 1, иммуноген можно вводить разным животным-хозяевам, включащим в себя, без ограничения, кроликов, мышей, крыс и др., индуцируя продукцию сыворотки, содержащей поликлональные антитела, специфичные к антигену. Введение иммуногена может включать в себя одну или несколько инъекций иммунизирующего средства и, при необходимости, адъюванта. Для усиления иммунологического ответа можно использовать разные адъюванты, которые зависят от вида хозяина и включают в себя, без ограничения, адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, плюрониловые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки, динитрофенол и потенциально полезные человеческие адъюванты, такие как BCG (бацилла Кальметта-Герена) и Corynebacterium parvum. Другие примеры пригодных для использования адъювантов включают в себя адъювант MPL-TDM (монофосфорил липида A, синтетический дикориномиколат трегалозы). Схемы иммунизации хорошо известны в данной области и могут проводиться любыми известными в данной области способами, которые вызывают иммунный ответ у выбранного животного-хозяина. Адъюванты также хорошо известны в данной области.
Как правило, иммуноген (вместе с адъювантом или без адъюванта) вводят млекопитающему путем нескольких подкожных или внутрибрюшинных инъекций, либо внутримышечно или внутривенно. Иммуноген может включать в себя полипептид Notch3, гибридный белок или их варианты. В зависимости от природы полипептида (т.е. от степени гидрофобности, степени гидрофильности, стабильности, суммарного заряда, изоэлектрической точки и др.), иногда полезно конъюгировать иммуноген с белком, который заведомо является иммуногенным для иммунизируемого млекопитающего. Такое конъюгирование проводят либо химическими способами путем дериватизации активных химических функциональных групп на подлежащих конъюгированию иммуногенах или иммуногенных белках с образованием ковалентной связи, либо с помощью способов получения гибридных белков, или других способов, известных специалистам в данной области. Примеры таких иммуногенных белков включают в себя, без ограничения, гемоцианин лимфы улитки, овальбумин, сывороточный альбумин, бычий тиреоглобулин, ингибитор соевого трипсина и различные пептиды T-хелперов. Как указано выше, для усиления иммунного ответа можно использовать разные адъюванты.
Антитела настоящего изобретения включают в себя моноклональные антитела. Моноклональные антитела представляют собой антитела, распознающие один антигенный участок. Их единообразная специфичность делает моноклональные антитела гораздо более полезными, чем поликлональные антитела, которые обычно содержат антитела, распознающие несколько разных антигенных участков. Моноклональные антитела можно получить с использованием гибридомной технологии, такой как описанная в Kohler, et al., Nature 256:495 (1975); Патент США № 4376110; Harlow, et al., Antibodies: A Laboratory Manual, Cold spring Harbor Laboratory Press, 2nd ed. (1988) и Hammerling, et al., Monoclonal Antibodies and T-Cell Hybridomas, Elsevier (1981), методов рекомбинантных ДНК или других методов, известных специалистам в данной области. Другие примеры методов, которые можно использовать для получения моноклональных антител, включают в себя, без ограничения, метод гибридом человеческих B-клеток (Kosbor, et al., Immunology Today 4:72 (1983); Cole, et al., Proc Natl Acad Sci USA 80:2026 (1983)), и метод EBV-гибридом (Cole, et al., Monoclonal Antibodies and Cancer Therapy, pp. 77-96, Alan R. Liss (1985)). Такие антитела могут относиться к любому классу иммуноглобулинов, в том числе IgG, IgM, IgE, IgA, IgD, а также к любому подклассу. Гибридомы, продуцирующие MAb данного изобретения, можно культивировать in vitro или in vivo.
В гибридомном методе хозяина, такого как мышь, гуманизированная мышь, мышь с человеческой иммунной системой, хомяк, кролик, верблюд или любого другого подходящего животного-хозяина иммунизируют, чтобы вызвать образование лимфоцитов, продуцирующих или способных продуцировать антитела, которые специфически связываются с белком, используемым для иммунизации. Альтернативно, лимфоциты можно иммунизировать in vitro. Затем лимфоциты гибридизуют с клетками миеломы, используя подходящий гибридизующий агент, такой как полиэтиленгликоль, и получают гибридомные клетки (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, pp.59-103 (1986)).
Как правило, для получения гибридом, продуцирующим антитела, используют либо лимфоциты периферической крови ("PBL"), если нужны человеческие клетки, либо клетки селезенки или лимфатического узла, если требуются клетки млекопитающего, отличного от человека. Затем лимфоциты гибридизуют с иммортализованной клеточной линией, используя подходящий гибридизующий агент, такой как полиэтиленгликоль, и получают гибридомные клетки (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, pp. 59-103 (1986)). Иммортализованные клеточные линии, как правило, представляют собой трансформированные клетки млекопитающих, в частности миеломные клетки грызунов, коров или человека. Обычно используют линию клеток миеломы крысы или мыши. Гибридомные клетки можно культивировать в подходящей питательной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание негибридизованных иммортализованных клеток. Например, если родительские клетки не содержат фермент гипоксантингуанин-фосфорибозилтрансферазу (HGPRT или HPRT), питательная среда для гибридом обычно содержит гипоксантин, аминоптерин и тимидин ("среда HAT"), вещества, которые предотвращают рост HGPRT-дефицитных клеток.
Предпочтительными иммортализованными клеточными линиями являются линии, которые эффективно гибридизуются, сохраняют стабильный высокий уровень продукции антител выбранными антитело-продуцирующими клетками и являются чувствительными к такой среде, как HAT. К указанным миеломным клеточным линиям относятся линии клеток мышиной миеломы, например, полученные из мышиных опухолей MOPC-21 и MPC-11, которые можно получить от Salk Institute Cell Distribution Center, San Diego, Calif. U.S. Application No., и клетки SP2/0 или X63-Ag8-653, которые можно получить от Американской коллекции типовых культур, Rockville, Md. USA. Также описано, что для получения человеческих моноклональных антител можно использовать линии клеток человеческой миеломы и мышино-человеческой гетеромиеломы (Kozbor, J Immunol 133:3001 (1984); Brodeur, et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc, pp.51-63 (1987)). Кроме того, можно использовать линию клеток мышиной миеломы NSO (Европейсккая коллекция клеточных культур, Salisbury, Wilshire, UK).
Культуральную среду, в которой выращивают гибридомные клетки, анализируют на присутствие моноклональных антител против Notch3. Специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, можно определить методом иммунопреципитации или с помощью анализа связывания in vitro, такого как радиоиммунологический анализ (RIA) или иммуноферментный твердофазный анализ (ELISA). Такие методы известны в данной области и относятся к сфере компетенции соответствующих специалистов. Сродство связывания моноклонального антитела против Notch3 можно определить, например, с помощью анализа Скэтчарда (Munson, et al., Anal Biochem 107:220 (1980)).
После идентификации гибридомных клеток, продуцирующих антитела с желательными специфичностью, аффинностью и/или активностью, клоны можно субклонировать методом серийных разведений и выращивать стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, pp.59-103 (1986)). Подходящие для данной цели культуральные среды включают в себя, например, модифицированную по Дульбекко среду Игла (D-MEM) или среду RPMI-1640. Кроме того, гибридомные клетки можно выращивать in vivo в организме животного в виде асцитных опухолей.
Моноклональные антитела, секретируемые субклонами, можно отделить или выделить из культуральной среды, асцитной жидкости или сыворотки с помощью традиционных методов очистки иммуноглобулинов, таких как, например, применение белок A-сефарозы, хроматография на гидроксилапатите, эксклюзионная гель-хроматография, гель-электрофорез, диализ или аффинная хроматография.
В данной области существует ряд способов получения моноклональных антител и, следовательно, данное изобретение не ограничивается только их продукцией в гибридомах. Например, моноклональные антитела можно получить с использованием методов рекомбинантных ДНК, таких как описанные в патенте США № 4816567. В данном контексте термин "моноклональные антитело" относится к антителу, полученному из одного эукариотического, фагового или прокариотического клона. ДНК, кодирующую моноклональные антитела данного изобретения, можно легко выделить и секвенировать с помощью традиционных способов (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител, или такие цепи из человеческих, гуманизированных или других источников) (Innis, et al. In PCR Protocols. A Guide to Methods and Applications, Academic (1990), Sanger, et al., Proc Natl Acad Sci 74:5463 (1977)). Клетки гибридомы служат источником ДНК. После выделения ДНК можно поместить в векторы экспрессии, которыми затем трансфицируют клетки-хозяева, такие как клетки E. coli, клетки NSO, обезьяньи клетки COS, клетки яичника китайского хомячка (CHO), или клетки миеломы, которые обычно не продуцируют иммуноглобулиновые белки, обеспечивая синтез моноклональных антител в рекомбинантных клетках-хозяевах. ДНК также можно модифицировать, например, путем введения последовательностей, кодирующих константные домены человеческих тяжелых и легких цепей вместо гомологичных мышиных последовательностей (патент США № 4816567; Morrison, et al., Proc Natl Acad Sci USA 81:6851 (1984)) или путем ковалентного присоединения к последовательности, кодирующей иммуноглобулин, полноразмерной или частичной последовательности, кодирующей полипептид, отличный от иммуноглобулина. Такой, отличный от иммуноглобулина, полипептид может использоваться вместо константных доменов антитела данного изобретения или вместо вариабельных доменов одного антиген-связывающего участка антитела данного изобретения с получением химерного бивалентного антитела.
Антитела могут быть моновалентными. Способы получения моновалентных антител хорошо известны в данной области. Например, один способ включает в себя рекомбинантную экспрессию легкой цепи и модифицированной тяжелой цепи иммуноглобулина. Как правило, тяжелую цепь укорачивают по любой точке участка Fc, чтобы предотвратить поперечное связывание тяжелых цепей. Альтернативно, чтобы предотвратить поперечное связывание, соответствующие остатки цистеина заменяют на другие аминокислотные остатки или удаляют.
Фрагменты антитела, распознающие конкретные эпитопы, можно получить с помощью известных методов. Обычно такие фрагменты получают путем протеолитического расщепления интактного антитела (см., например, Morimoto, et al., J Biochem Biophys Methods 24:107 (1992); Brennan, et al., Science 229:81 (1985)). Например, фрагменты Fab и F(ab')2 данного изобретения можно получить путем протеолитического расщепления молекул иммуноглобулина, используя такие ферменты, как папаин (с получением фрагментов Fab) или пепсин (с получением фрагментов F(ab')2). Фрагменты F(ab')2 содержат вариабельный участок, константный участок легкой цепи и домен CH1 тяжелой цепи. Однако данные фрагменты могут непосредственно продуцироваться рекомбинантными клетками-хозяевами. Например, фрагменты антител можно выделить из фаговой библиотеки антител. Альтернативно, фрагменты F(ab')2-SH можно непосредственно выделить из E. coli и химически соединить с получением фрагментов F(ab')2 (Carter, et al., Bio/Technology 10:163 (1992)). В соответствии с другим подходом, фрагменты F(ab')2 можно непосредственно выделить из культуры рекомбинантных клеток-хозяев. Квалифицированным специалистам известны и другие способы получения фрагментов антител. В других воплощениях выбранное антитело представляет собой одноцепочечный фрагмент Fv (Fv) (патентная заявка PCT WO 93/16185).
В некоторых случаях, включающих в себя применение антител у людей in vivo и детекционные анализы in vitro, предпочтительно использовать химерные, гуманизированные или человеческие антитела. Химерное антитело представляет собой молекулу, в которой разные фрагменты антител получены от животных разных видов, такую как антитело, содержащее вариабельный участок мышиного моноклонального антитела и константный участок человеческого иммуноглобулина. Способы получения химерных антител известны в данной области. См., например, Morrison, Science 229:1202 (1985); Oi, et al., BioTechniques 4:214 (1986); Gillies, et al., J Immunol Methods 125:191 (1989); патенты США №№ 5807715; 4816567; и 4816397, которые включены в настоящее описание ссылками во всей полноте.
Гуманизированное антитело обладает более высокой степенью гомологии по отношению к человеческому иммуноглобулину, чем моноклональные антитела, полученные из животных. Гуманизация представляет собой способ получения химерного антитела, в котором фрагмент, замененный на соответствующую нечеловеческую последовательность, существенно меньше интактного человеческого вариабельного домена. Гуманизированные антитела представляют собой молекулы антител, продуцирующиеся животными отличных от человека видов, которые связывают целевой антиген и содержат один или несколько гипервариабельных участков (CDR) отличных от человека видов и каркасные участки (FR) молекулы человеческого иммуноглобулина. Зачастую, чтобы изменить, предпочтительно улучшить, связывание антигена, каркасные остатки в человеческих каркасных участках заменяют на соответствующие остатки антитела-донора CDR. Указанные замены в каркасном участке определяют с помощью хорошо известных в данной области способов, например путем моделирования взаимодействий остатков CDR и каркасного участка, позволяющего идентифицировать остатки каркасного участка, участвующие в связывании антигена, и сравнения последовательностей, позволяющего идентифицировать необычные остатки каркасного участка в конкретных положениях. См., например, патент США № 5585089; Riechmann, et al., Nature 332:323 (1988), который полностью включен в данное описание в виде ссылки. Антитела можно гуманизировать с помощью ряда способов, известных в данной области, таких как прививка CDR (EP 239400; публикация PCT WO 91/09967; патенты США №№ 5225539; 5530101; и 5585089), облицовка или нанесение нового покрытия (EP 592106; EP 519596; Padlan, Molecular Immunology 28:489 (1991); Studnicka, et al., Protein Engineering 7:805 (1994); Roguska, et al., Proc Natl Acad Sci USA 91:969 (1994)) и перетасовка цепей (патент США № 5565332).
Как правило, гуманизированное антитело содержит один или несколько аминокислотных остатков из нечеловеческого источника. Такие нечеловеческие аминокислотные остатки, которые обычно берут из "импортного" вариабельного домена, зачастую называют "импортными" остатками. Гуманизацию в основном можно проводить по способу Winter и соавторов (Jones, et al., Nature 321:522 (1986); Riechmann, et al., Nature 332:323 (1988); Verhoeyen, et al., Science 239:1534 (1988)) путем использования нечеловеческих CDR или последовательностей CDR вместо соответствующих последовательностей человеческого антитела. Соответственно, такие "гуманизированные" антитела представляют собой химерные антитела (патент США № 4816567), в которых фрагмент, замененный на соответствующую нечеловеческую последовательность, существенно меньше интактного человеческого вариабельного домена. Фактически гуманизированные антитела обычно представляют собой человеческие антитела, в которых несколько остатков CDR и, необязательно, несколько остатков FR заменены на аналогичные участки антител грызунов.
Кроме того, важно, чтобы гуманизированные антитела сохраняли повышенное сродство к антигену и другие полезные биологические свойства. Для достижения данной цели, в соответствии с предпочтительным способом, гуманизированные антитела получают после анализа исходной последовательности и разных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются широко доступными и известны специалистам в данной области. Существуют компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных иммуноглобулиновых последовательностей-кандидатов. Анализ полученных изображений позволяет сделать вывод о возможной роли некоторых остатков в функционировании иммуноглобулиновой последовательности-кандидате, т.е. идентифицировать остатки, которые влияют на способность иммуноглобулина-кандидата связывать антиген. С помощью данного способа можно выбрать и скомбинировать остатки FR реципиентной и импортной последовательностей таким образом, чтобы максимизировать желательные характеристики антитела, такие как повышенное сродство к целевому антигену (антигенам), хотя непосредственное и самое сильное влияние на связывание антигена оказывают остатки CDR.
При получении гуманизированных антител выбор человеческих вариабельных доменов как легкой, так и тяжелой цепи, имеет большое значение для снижения антигенности. В соответствии с так называемым методом "наилучшего соответствия" последовательность вариабельного домена нечеловеческого антитела подвергают скринингу против целой библиотеки известных человеческих последовательностей вариабельных доменов. Затем человеческую последовательность, которая лучше всего соответствует последовательности нечеловеческого исходного антитела принимают как человеческий FR гуманизированного антитела (Sims, et al., J Immunol 151:2296 (1993); Chothia, et al., J Mol Biol 196:901 (1987)). В другом способе используют конкретный каркасный участок, полученный из консенсусной последовательности всех человеческих антител конкретной подгруппы легких или тяжелых цепей. Один и тот же каркасный участок можно использовать для нескольких разных гуманизированных антител (Carter, et al., Proc Natl Acad Sci USA 89:4285 (1992); Presta, et al., J Immunol 151:2623 (1993)).
Для терапевтического лечения пациентов-людей желательно использовать полностью человеческие антитела. Человеческие антитела можно получить с помощью ряда известных в данной области способов, которые включают в себя описанные выше методы фаговых дисплеев с использованием библиотек антител, полученных из последовательностей человеческих иммуноглобулинов. См. также патенты США №№ 4444887 и 4716111; и публикации PCT WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741; которые включены в данное описание в виде ссылки во всей полноте. Для получения человеческих моноклональных антител также можно использовать методы Cole, et al. и Boerder, et al. (Cole, et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Riss (1985); and Boerner, et al., J Immunol 147:86 (1991)).
Человеческие антитела также можно получить с использованием трансгенных мышей, которые не способны экспрессировать функциональные эндогенные иммуноглобулины, но могут экспрессировать гены человеческих иммуноглобулинов. Например, комплекс генов тяжелой и легкой цепей иммуноглобулина можно ввести произвольным образом или путем гомологичной рекомбинации в эмбриональные стволовые клетки мыши. Альтернативно, в эмбриональные стволовые клетки мыши помимо генов человеческих тяжелых и легких цепей можно ввести гены человеческих вариабельного участка, константного участка и D-участка. Гены мышиных тяжелых и легких цепей иммуноглобулина можно привести в нефункциональное состояние раздельно или одновременно с введением локуса человеческого иммуноглобулина путем гомологичной рекомбинации. В частности, гомологичная делеция участка JH предотвращает продукцию гомологичных антител. Модифицированные эмбриональные стволовые клетки выращивают и вводят методом микроинъекции в бластоцисты, получая химерных мышей. Затем химерных мышей скрещивают и получают гомозиготное потомство, экспрессирующее человеческие антитела. См., например, Jakobovitis, et al., Proc Natl Acad Sci USA 90:2551 (1993); Jakobovitis, et al., Nature 362:255 (1993); Bruggermann, et al., Year in Immunol 7:33 (1993); Duchosal, et al., Nature 355:258 (1992)). Трансгенных мышей иммунизируют обычным способом выбранным антигеном, например полноразмерным полипептидом данного изобретения или его фрагментом. Моноклональные антитела, направленные против антигена, можно получить из иммунизированных трансгенных мышей с помощью традиционной гибридомной технологии. Трансгены человеческих иммуноглобулинов, содержащиеся в трансгенных мышах, подвергаются реаранжировке в процессе дифференциации B-клеток и затем переключению класса и соматической мутации. Таким образом, с помощью данного метода можно получить антитела IgG, IgA, IgM и IgE, пригодные для терапевтического применения. Обзор по указанной технологии получения человеческих антител можно найти в Lonberg, et al., Int Rev Immunol 13:65-93 (1995). Подробное обсуждение данной технологии получения человеческих антител и человеческих моноклональных антител, а также способы получения таких антител можно найти, например, в публикациях PCT WO 98/24893; WO 92/01047; WO 96/34096; WO 96/33735; Европейском патенте № 0598877; патентах США №№ 5413923; 5625126; 5633425; 5569825; 5661016; 5545806; 5814318; 5885793; 5916771; и 5939598, которые включены в данное описание во всей полноте. Кроме того, компании, такие как Abgenix, Inc. (Freemont, Calif.), Genpharm (San Jose, Calif.) и Medarex, Inc. (Princeton, N.J.) могут изготавливать на заказ человеческие антитела против выбранного антигена с помощью технологии, подобной описанной выше.
Кроме того, человеческие MAb можно получить путем иммунизации мышей, которым были трансплантированы человеческие лейкоциты периферической крови, спленоциты или костный мозг (например, методы XTL Trioma). Полностью человеческие антитела, которые распознают выбранный эпитоп, можно получить с помощью метода, называемого "управляемая селекция". В данном способе выбранное нечеловеческое моноклональное антитело, например мышиное антитело, используют для управления селекцией полностью человеческого антитела, распознающего такой же эпитоп (Jespers, et al., Bio/technology 12:899 (1988)).
Кроме того, антитела против полипептидов данного изобретения, в свою очередь, можно использовать для получения антиидиотипических антител, которые "имитируют" полипептиды данного изобретения, с помощью способов, хорошо известных специалистам в данной области (см., например, Greenspan, et al., FASEB J 7:437 (1989); Nissinoff, J Immunol 147:2429 (1991)). Например, антитела, которые связываются с полипептидом и конкурентно ингибируют мультимеризацию полипептида и/или связывание полипептида данного изобретения с лигандом, можно использовать для получения антиидиотипов, которые "имитируют" мультимеризацию полипептида и/или связывающий домен, и, как следствие, связываются с полипептидом и/или его лигандом и нейтрализуют их. Такие нейтрализующие антиидиотипы или фрагменты Fab таких антиидиотипов можно использовать в терапевтических режимах для нейтрализации лиганда полипептида. Например, такие антиидиотипические антитела можно использовать для связывания полипептида данного изобретения, и/или для связывания его лигандов/рецепторов, блокируя таким образом его биологическую активность.
Антитела настоящего изобретения могут представлять собой биспецифичные антитела. Биспецифичные антитела представляют собой моноклональные, предпочтительно человеческие или гуманизированные антитела, которые способны специфически связываться, по меньшей мере, с двумя разными антигенами. В настоящем изобретении одна из специфичностей связывания может быть направлена на Notch3, а другая - на другой антиген, предпочтительно представляющий собой белок клеточной поверхности, рецептор, субъединицу рецептора, тканеспецифичный антиген, вирусный белок, белок вирусной оболочки, бактериальный белок или бактериальный поверхностный белок и др.
Способы получения биспецифичных антител хорошо известны. Обычно рекомбинантный способ получения биспецифичных антител основан на совместной экспрессии двух пар тяжелых/легких цепей иммуноглобулина, где две тяжелые цепи обладают разной специфичностью (Milstein, et al., Nature 305:537 (1983)). Вследствие случайной реаранжировки тяжелых и легких цепей иммуноглобулина, указанные гибридомы (квадрогибридомы) могут продуцировать смесь из десяти разных молекул антител, из которых только одна имеет правильную биспецифичную структуру. Выделение правильной молекулы обычно проводят методом аффинной хроматографии. Подобные способы описаны в WO 93/08829 и Traunecker, et al., EMBO J 10:3655 (1991).
Вариабельные домены антител с желательной специфичностью связывания (участки, по которым антитело соединяется с антигеном) можно гибридизовать с последовательностями константных доменов иммуноглобулинов. Для гибридизации предпочтительно используют константный домен тяжелой цепи иммуноглобулина, содержащий, по меньшей мере, часть шарнирного участка, участки CH2 и CH3. Он может содержать первый константный домен тяжелой цепи (CH1), включающий в себя участок, необходимый для связывания легкой цепи, присутствующий, по меньшей мере, в одном из гибридов. ДНК, кодирующие гибриды тяжелой цепи иммуноглобулина и, при желании, легкую цепь иммуноглобулина, вставляют в отдельные векторы экспрессии, которые совместно трансфицируют в организм подходящего хозяина. Более подробное описание способов получения биспецифичных антител можно найти, например, в Suresh, et al., Meth In Enzym 121:210 (1986).
Гетероконъюгированные антитела также входят в объем настоящего изобретения. Гетероконъюгированные антитела состоят из двух ковалентно связанных антител. Такие антитела, например, можно использовать для нацеливания клеток иммунной системы на нежелательные клетки (патент США № 4676980). Такие антитела можно получить in vitro с помощью способов, известных в области синтетической белковой химии, например с использованием поперечно-сшивающих реагентов. Например, иммунотоксины можно получить с помощью дисульфидной обменной реакции или путем образования тиоэфирной связи. Примеры реагентов, подходящих для таких реакций, включают в себя иминотиолат и метил-4-меркаптобутилимидат, а также реагенты, раскрытые, например, в патенте США № 4676980.
Также можно получить однодоменные антитела против Notch3. Способы получения таких антител описаны в WO9425591 на примере антитела, полученного из тяжелой цепи Ig Camelidae, кроме того, в US20030130496 описано выделение однодоменного полноразмерного человеческого антитела из фаговых библиотек.
Кроме того, можно получить одноцепочечные пептидные связывающие молекулы, которые содержат соединенные участки Fv тяжелой и легкой цепи. Одноцепочечные антитела ("scFv") и способ их получения описаны в патенте США № 4946778. Альтернативно, с помощью подобных методов можно сконструировать и экспрессировать Fab. Все полностью или частично человеческие антитела являются менее иммуногенными, чем полностью мышиные MAb, причем фрагменты и одноцепочечные антитела также являются менее иммуногенными.
Антитела или фрагменты антител можно выделить из фаговых библиотек антител, полученных с помощью способов, описанных в McCafferty, et al., Nature 348:552 (1990). Clarkson, et al., Nature 352:624 (1991) и Marks, et al., J Mol Biol 222:581 (1991), описывают соответственно выделение мышиных и человеческих антител с использованием фаговых библиотек. Последующие публикации описывают получение высокоаффинных (нМ диапазон) человеческих антител путем перетасовки цепей (Marks, et al., Bio/Technology 10:779 (1992)), а также комбинаторную инфекцию и рекомбинацию in vivo как способ получения очень больших фаговых библиотек (Waterhouse, et al., Nuc Acids Res 21:2265 (1993)). Указанные методы являются конкурентноспособными альтернативами традиционным гибридомным способам получения моноклональных антител.
Кроме того, можно модифицировать ДНК, например, путем введения последовательностей, кодирующих человеческие константные домены тяжелой и легкой цепей, вместо гомологичных мышиных последовательностей (патент США № 4816567; Morrison, et al., Proc Natl Acad Sci USA 81:6851 (1984)).
Другой альтернативой при получении гибридом является применение в большей степени электрической гибридизации, чем химической гибридизации. Данный метод хорошо разработан. Вместо гибридизации трансформацию B-клеток с получением иммортализованных клеток можно провести, например, с использованием вируса Эпштейна-Барр или трансформирующего гена. См., например, "Continuously Proliferating Human Cell Lines Synthesizing Antibody of Predetermined Specificity," Zurawaki, et al., in Monoclonal Antibodies, ed. by Kennett, et al, Plenum Press, pp.19-33. (1980)). MAb против Notch3 можно получить путем иммунизации грызунов (например, мышей, крыс, хомяков и морских свинок) белком Notch3, гибридным белком или его фрагментами, экспрессированными в эукариотических или прокариотических системах. Для иммунизации можно использовать и других животных, например отличных от человека приматов, трансгенных мышей, экспрессирующих иммуноглобулины, и мышей с тяжелым комбинированным иммунодефицитом (SCID), которым были трансплантированы человеческие B-лимфоциты. Гибридомы можно получить с помощью традиционных способов путем гибридизации B-лимфоцитов с миеломными клетками иммунизированных животных (например, Sp2/0 и NSO), как описано ранее (Kohler, et al., Nature 256:495 (1975)). Кроме того, антитела против Notch3 можно получить после скрининга рекомбинантных одноцепочечных Fv или библиотек Fab человеческих В-лимфоцитов с использованием фаговых дисплеев. Специфичность MAb в отношении Notch3 можно проанализировать с помощью методов ELISA, вестерн-иммуноблоттинга, или других иммунохимических методов. Ингибирующее действие антитела на активацию комплемента можно оценить с помощью гемолитических анализов классического пути комплемента с использованием сенсибилизированных красных кровяных клеток кур или овец. Гибридомы из положительных лунок клонируют методом серийных разведений. Антитела очищают и анализируют их специфичность к человеческому Notch3 с помощью описанных выше методов.
Идентификация антител против NOTCH3
Настоящее изобретение предлагает агонистические моноклональные антитела, которые активируют Notch3-опосредованный сигнальный путь независимо от лиганда. В частности, антитела настоящего изобретения связываются с Notch3 и активируют его. Антитела настоящего изобретения включают в себя антитело, обозначаемое 256A-13. Настоящее изобретение также включает в себя антитела, которые связываются с таким же эпитопом, как и 256A-13.
Антитела-кандидаты против Notch3 анализируют с помощью методов иммуноферментного твердофазного анализа (ELISA), вестерн-иммуноблоттинга, или других иммунохимических методов. Анализы, используемые для характеристики отдельных антител, описаны в примерах.
Антитела данного изобретения включают в себя, без ограничения, поликлональные, моноклональные, моновалентные, биспецифичные, гетероконъюгированные, полиспецифичные, человеческие, гуманизированные или химерные антитела, одноцепочечные антитела, однодоменные антитела, фрагменты Fab, фрагменты F(ab'), фрагменты, получаемые с использованием экспрессионной библиотеки Fab, антиидиотипические (анти-Id) антитела (включающие в себя, например, анти-Id антитела против антител данного изобретения), а также эпитоп-связывающие фрагменты указанных выше антител.
Антитела могут представлять собой человеческие антиген-связывающие фрагменты антител настоящего изобретения, которые включают в себя, без ограничения, Fab, Fab' и F(ab')2, Fd, одноцепочечные Fv (scFv), одноцепочечные антитела, дисульфид-связанные Fv (sdFv) и однодоменные антитела, содержащие либо VL, либо VH домен. Антиген-связывающие фрагменты антител, включающие в себя одноцепочечные антитела, могут содержать только вариабельный участок (участки), или вариабельный участок в сочетании с целыми шарнирными участками, доменами CH1, CH2 и CH3 или их частями. Настоящее изобретение также охватывает антиген-связывающие фрагменты, содержащие любые сочетания вариабельного участка (участков) с шарнирным участком, доменами CH1, CH2 и CH3. Антитела данного изобретения могут быть получены из любого животного источника, включающего в себя птиц и млекопитающих. Предпочтительно, антитела могут быть получены от человека, отличного от человека примата, грызуна (такого как мышь и крыса), осла, овцы, кролика, козы, морской свинки, верблюда, лошади или курицы.
В данном описании "человеческие" антитела" включают в себя антитела, имеющие аминокислотную последовательность человеческого иммуноглобулина, в том числе антитела, выделенные из библиотек человеческих иммуноглобулинов или из животных, трансгенных по одному или нескольким человеческим иммуноглобулинам, и не экспрессирующих эндогенные иммуноглобулины, как опиисано ниже и, например, в патенте США № 5939598, Kucherlapati, et al.
Антитела настоящего изобретения могут быть моноспецифичными, биспецифичными, триспецифичными или полиспецифичными. Полиспецифичные антитела могут быть специфичными к разным эпитопам Notch3, или они могут быть специфичными к Notch3 и к гетерологичному эпитопу, такому как гетерологичный полипептид или твердофазный носитель. См., например, публикации PCT WO 93/17715; WO 92/08802; WO 91/00360; WO 92/05793; Tutt, et al., J Immunol 147:60 (1991); патенты США №№ 4474893; 4714681; 4925648; 5573920; 5601819; Kostelny, et al., J Immunol 148:1547 (1992).
Антитела настоящего изобретения можно описать или охарактеризовать с точки зрения эпитопа (эпитопов) или фрагмента (фрагментов) Notch3, который они распознают и специфически связывают. Эпитоп (эпитопы) или полипептидный фрагмент (фрагменты) можно охарактеризовать, как указано в данном документе, например, по N-концевым и C-концевым положениям, по числу смежных аминокислотных остатков, или их можно найти в таблицах и чертежах.
Антитела настоящего изобретения также можно описать или охарактеризовать с точки зрения их перекрестной реактивности. В объем настоящего изобретения также входят антитела, которые связывают полипептиды Notch3 и являются, по меньшей мере, на 95%, по меньшей мере, на 90%, по меньшей мере, на 85%, по меньшей мере, на 80%, по меньшей мере, на 75%, по меньшей мере, на 70%, по меньшей мере, на 65%, по меньшей мере, на 60%, по меньшей мере, на 55%, и, по меньшей мере, на 50% идентичными Notch3 (идентичность рассчитывается с помощью известных в данной области и описанных в данном документе способов). Антитела против Notch3 также могут связываться с другими белками, такими как антитела против Notch3 из видов, отличных от вида, против которого направлено используемое антитело против Notch3, при этом KD может быть меньше чем приблизительно 10-7 M, меньше чем приблизительно 10-6 M, или меньше чем приблизительно 10-5 M.
В отдельных воплощениях антитела настоящего изобретения могут перекрестно взаимодействовать с обезьяньими гомологами человеческого Notch3 и их соответствующими эпитопами. В одном воплощении вышеуказанная способность к перекрестному взаимодействию относится к одному конкретному антигенному или иммуногенному полипептиду или к сочетанию (сочетаниям) конкретных антигенных и/или иммуногенных полипептидов, раскрытых в данном описании.
Настоящее изобретение также охватывает антитела, которые связывают полипептиды, кодируемые полинуклеотидами, которые в жестких условиях гибридизуются с полинуклеотидом, кодирующим Notch3. Антитела настоящего изобретения также могут быть описаны или охарактеризованы с точки зрения сродства связывания по отношению к полипептиду данного изобретения. Предпочтительное сродство связывания характеризуется равновесной константой диссоциации или KD, находящейся в интервале от 10-8 до 10-15 M, от 10-8 до 10-12 M, от 10-8 до 10-10 M, или от 10-10 до 10-12 M. Данное изобретение также предлагает антитела, которые конкурентно ингибируют связывание антител с эпитопом данного изобретения, что определяют с помощью любого известного в данной области способа определения конкурентного связывания, например, с помощью описанных здесь иммунологических анализов. В предпочтительных воплощениях антитело конкурентно ингибирует связывание с эпитопом, по меньшей мере, на 95%, по меньшей мере, на 90%, по меньшей мере, на 85%, по меньшей мере, на 80%, по меньшей мере, на 75%, по меньшей мере, на 70%, по меньшей мере, на 60%, или, по меньшей мере, на 50%.
Векторы и клетки-хозяева
В другом аспекте настоящее изобретение предлагает выделенные нуклеотидные последовательности, кодирующие вариант антитела, как описано в данном документе, векторные конструкции, содержащие нуклеотидную последовательность, кодирующую антитела настоящего изобретения, клетки-хозяева, содержащие такой вектор, а также рекомбинантные способы получения антител.
Чтобы получить вариант антитела рекомбинантным способом, кодирующую его нуклеиновую кислоту выделяют и вставляют в способный к репликации вектор для последующих клонирования (амплификации ДНК) или экспрессии. ДНК, кодирующую вариант антитела, можно легко выделить и секвенировать с помощью традиционных способов (например, путем использования олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи варианта антитела). Для получения клеточных линий, экспрессирующих антитела настоящего изобретения, можно использовать стандартные методы клонирования и трансформации.
Векторы
Существует много векторов. Как правило, вектор содержит, без ограничения, одну или несколько из последовательностей, включающих в себя: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов, энхансер, промотор и последовательность терминации транскрипции. Рекомбинантные векторы экспрессии, содержащие нуклеотидную последовательность, кодирующую антитела настоящего изобретения, можно получить с помощью хорошо известных методов. Векторы экспрессии содержат нуклеотидную последовательность, функционально связанную с подходящими нуклеотидными последовательностями, регулирующими транскрипцию или трансляцию, например, полученными из генов млекопитающих, микробов, вирусов или насекомых. Примеры регуляторных последовательностей включают в себя промоторы транскрипции, операторы, энхансеры, участки связывания рибосомальной мРНК и/или другие подходящие последовательности, контролирующие инициацию и терминацию транскрипции и трансляции. Нуклеотидные последовательности являются "функционально связанными", если регуляторная последовательность находится в функциональной связи с последовательностью, кодирующей соответствующий полипептид. Так, нуклеотидная последовательность промотора функционально связана, например, с последовательностью, кодирующей тяжелую цепь антитела, если нуклеотидная последовательность промотора регулирует транскрипцию соответствующей нуклеотидной последовательности.
Кроме того, векторы экспрессии могут содержать последовательности, кодирующие соответствующие сигнальные пептиды, которые в природе не связаны с последовательностями, кодирующими тяжелую и/или легкую цепь антитела. Например, нуклеотидная последовательность, кодирующая сигнальный пептид (секреторную лидерную последовательность), может быть связана в рамке считывания с последовательностью, кодирующей полипептид, так, чтобы антитело секретировалось в периплазматическое пространство или в среду. Сигнальный пептид, который является функциональным в предполагаемых клетках-хозяевах, увеличивает внеклеточную секрецию соответствующего антитела. Сигнальный пептид может отщепляться от полипептида при секреции антитела из клетки. Примеры таких секреторных сигналов хорошо известны и включают в себя, например, сигналы, описанные в патентах США №№ 5698435; 5698417; и 6204023.
Вектор может представлять собой плазмидный вектор, одноцепочечный или двухцепочечный фаговый вектор, или одноцепочечный или двухцепочечный РНК- или ДНК-вектор. Такие векторы можно вводить в клетки в виде полинуклеотидов с помощью хорошо известных способов введения ДНК и РНК в клетки. Фаговые и вирусные векторы также можно вводить в клетки в упакованном или инкапсулированном виде с помощью хорошо известных способов инфицирования и трансдукции. Вирусные векторы могут быть компетентными или дефективными по репликации. В последнем случае размножение вируса, как правило, происходит только в дополняющих клетках-хозяевах. Кроме того, для получения белка можно использовать бесклеточные системы трансляции с использованием РНК, полученной из конструкций ДНК настоящего изобретения. Такие векторы могут включать в себя нуклеотидную последовательность, кодирующую константный участок молекулы антитела (см., например, публикации PCT WO 86/05807 и WO 89/01036; и патент США № 5122464), в таком векторе можно клонировать вариабельный домен антитела с последующей экспрессией тяжелой или легкой цепи.
Клетки-хозяева
Антитела настоящего изобретения можно экспрессировать в любой подходящей клетке-хозяине. В настоящем изобретении в качестве клеток-хозяев можно использовать прокариотические, дрожжевые или высшие эукаритические клетки, примеры которых включают в себя, без ограничения, микроорганизмы, такие как бактерии (например, E. coli, B. subtilis), трансформированные ДНК рекомбинантного бактериофага, векторами экспрессии на основе плазмидной или космидной ДНК, содержащими последовательности, кодирующие антитело; дрожжи (например, Saccharomyces, Pichia), трансформированные дрожжевыми рекомбинантными векторами экспрессии, содержащими последовательности, кодирующие антитело; системы клеток насекомых, инфицированных рекомбинантными вирусными векторами экспрессии (например, Baculovirus), содержащими последовательности, кодирующие антитело; системы растительных клеток, инфицированных рекомбинантными вирусными векторами экспрессии (например, вирусом мозаики цветной капусты, CaMV; вирусом табачной мозаики, TMV), или трансформированных рекомбинантными плазмидными векторами экспрессии (например, плазмидой Ti), содержащими последовательности, кодирующие антитело; или системы клеток млекопитающих (например, клетки COS, CHO, BHK, 293, 3T3), несущих рекомбинантные экспрессионные конструкции, содержащие промоторы, полученные из генома клеток млекопитающих (например, промотор металлотионеина) или из вирусов млекопитающих (например, поздний промотор аденовируса; промотор вируса коровьей оспы 7.5K).
Прокариоты, пригодные для применения в качестве клеток-хозяев настоящего изобретения, включают в себя грамотрицательные или грамположительные организмы, такие как E. coli, B. subtilis, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, Serratia и Shigella, а также Bacilli, Pseudomonas и Streptomyces. Предпочтительным для клонирования хозяином E. coli является E. coli 294 (ATCC 31446), хотя можно использовать и другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Приведенные примеры являются скорее иллюстративными, чем ограничивающими.
Векторы экспрессии, используемые в прокариотических клетках-хозяевах, обычно содержат один или несколько маркерных генов фенотипической селекции. Маркерный ген фенотипической селекции представляет собой, например, ген, кодирующий белок, который отвечает за устойчивость к антибиотикам или за удовлетворение автотрофного требования. Примеры векторов экспрессии, которые можно использовать в прокариотических клетках-хозяевах, включают в себя векторы, полученные из коммерчески доступных плазмид, таких как pKK223-3 (Pharmacia Fine Chemicals, Uppsala, Sweden), pGEM1 (Promega Biotec, Madison, Wisconsin., USA) и серии векторов pET (Novagen, Madison, Wisconsin, USA) и pRSET (Invitrogen, Carlsbad, CA) (Studier, J Mol Biol 219:37 (1991); Schoepfer, Gene 124:83 (1993)). Промоторные последовательности, обычно используемые в векторах экспрессии рекомбинантных прокариотических клеток-хозяев, включают в себя T7, (Rosenberg, et al., Gene 56:125 (1987)), β-лактамазу (пенициллиназу), систему промотора лактозы (Chang, et al., Nature 275:615 (1978); Goeddel, et al., Nature 281:544 (1979)), систему промоторв триптофана (trp) (Goeddel, et al., Nucl Acids Res 8:4057 (1980)) и промотор tac (Sambrook, et al., Molecular Cloning, A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory (1990)).
Дрожжи или гифомицеты, пригодные для применения в настоящем изобретении, включают в себя организмы из родов Saccharomyces, Pichia, Actinomycetes, Kluyveromyces, Schizosaccharomyces, Candida, Trichoderma, Neurospora, а также такие гифомицеты, как Neurospora, Penicillium, Tolypocladium и Aspergillus. Дрожжевые векторы обычно содержат последовательность начала репликации из дрожжевой плазмиды 2µ, последовательность автономной репликации (ARS), промоторный участок, последовательности полиаденилирования, последовательности терминации транскрипции и маркерный ген селекции. Промоторные последовательности, подходящие для дрожжевых векторов, включают в себя, среди прочих, промоторы металлотионеина, 3-фосфоглицераткиназы (Hitzeman, et al., J Biol Chem 255:2073 (1980)) или других гликолитических ферментов (Holland, et al., Biochem 17:4900 (1978)), таких как енолаза, глицеральдегид-3-фосфат дегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозизомераза и глюкокиназа. Другие векторы и промоторы, подходящие для проведения экспрессии в дрожжах, также описаны в Fleer, et al., Gene 107:285 (1991). Другие промоторы и вектор, подходящие для дрожжей и трансформации дрожжей, хорошо известны в данной области. Способы трансформации дрожжей широко известны. Пример такого способа описан в Hinnen, et al., Proc Natl Acad Sci 75:1929 (1978). Способ Hinnen основан на селекции трансформантов Trp+ в селективной среде.
Для экспрессии рекомбинантных антител также можно использовать системы культур клеток-хозяев млекопитающих или насекомых. В принципе, можно использовать любую культуру высших эукариотических клеток как позвоночных, так и беспозвоночных животных. Примеры клеток беспозвоночных включают в себя клетки растений и насекомых (Luckow, et al., Bio/Technology 6:47 (1988); Miller, et al., Genetics Engineering, Setlow, et al., eds. Vol. 8, pp. 277-9, Plenam Publishing (1986); Mseda, et al., Nature 315:592 (1985)). Например, для получения гетерологичных систем можно использовать системы Baculovirus. В системах насекомых для экспрессии чужеродных генов в качестве вектора экспрессии можно использовать вирус ядерного полиэдроза совки калифорнийской люцерновой (AcNPV). Вирус выращивают в клетках Spodoptera frugiperda. Последовательность, кодирующую антитело, можно клонировать отдельно в неэссенциальных участках (например, гена полиэдрина) вируса под контролем промотора AcNPV (например, промотора полиэдрина). Другие идентифицированные хозяева включают в себя Aedes, Drosophila melanogaster и Bombyx mori. Ряд вирусных штаммов для трансфекции является общедоступным, например, вариант L-1 AcNPV и штамм Bm-5 Bombyx mori NPV, которые можно использовать в качестве вирусов в соответствии с настоящим изобретением, в особенности, для трансфекции клеток Spodoptera frugiperda. Кроме того, в качестве клеток-хозяев также можно использовать культуры растительных клеток хлопка, кукурузы, картофеля, соевых бобов, петунии, томатов и табака.
Применение клеток позвоночных, а также размножение клеток позвоночных в культуре (тканевой культуре) являются рутинными процедурами. См. Tissue Culture, Kruse, et al., eds., Academic Press (1973). Примерами пригодных линий клеток-хозяев млекопитающих являются клетки почки обезьяны; клетки почки эмбриона человека; клетки почки детеныша хомяка; клетки яичника китайского хомячка/-DHFR (CHO, Urlaub, et al., Proc Natl Acad Sci USA 77:4216 (1980)); мышиные клетки Сертоли; клетки карциномы шейки матки человека (HELA); клетки почки собаки; клетки легкого человека; клетки печени человека; клетки опухоли молочной железы мыши; и клетки NSO.
Клетки-хозяева трансформируют вышеуказанными векторами, чтобы обеспечить продукцию антитела, и культивируют в традиционной питательной среде, модифицированной, в зависимоти от обстоятельств, так, чтобы индуцировать промоторы, последовательности, контролирующие транскрипцию и трансляцию, осуществлять селекцию трансформантов или амплифицировать гены, кодирующие целевые последовательности. Обычно используют промоторные и энхансерные последовательности, полученные из вируса полиомы, аденовируса 2, вируса обезьян 40 (SV40) и человеческого цитомегаловируса (CMV). Последовательности ДНК из генома вируса SV40 можно использовать для получения других генных элементов, используемых для экспрессии последовательности структурного гена в клетках-хозяевах млекопитающих, которые включают в себя точку начала репликации SV40, ранний и поздний промотор, энхансер, точку сплайсинга и участки полиаденилирования. Особенно полезными являются вирусные ранний и поздний промоторы, поскольку и тот и другой можно легко получить из вирусного генома в виде фрагмента, который также может содержать вирусную точку начала репликации. Типовые векторы экспрессии для применения в клетках-хозяевах млекопитающих являются коммерчески доступными.
Клетки-хозяева, используемые для получения варианта антитела данного изобретения, можно культивировать в разных средах. Для культивирования клеток-хозяев можно использовать коммерчески доступные среды, такие как среда Хэма F10 (Sigma, St Louis, MO), минимальная эссенциальная среда (MEM, Sigma, St Louis, MO), RPMI-1640 (Sigma, St Louis, MO) и модифицированная по Дульбекко среда Игла (DMEM, Sigma, St Louis, MO). Кроме того, в качестве культуральной среды для клеток-хозяев можно использовать любую из сред, описанных в Ham, et al., Meth Enzymol 58:44 (1979), Barnes, et al., Anal Biochem 102:255 (1980), и в патентах США №№ 4767704; 4657866; 4560655; 5122469; 5712163; или 6048728. При необходимости любая из указанных сред может быть дополнена гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как X-хлориды, где X обозначает натрий, кальций, магний; и фосфаты), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCINTM), микроэлементами (неорганическими соединениями, конечные концентрации которых обычно находятся в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Также могут присутствовать в соответствующих концентрациях любые другие необходимые добавки, известные специалистам в данной области. Экспрессию проводят в условиях культивирования, включающих в себя температуру, pH и т.п., которые ранее использовались для выбранных клеток-хозяев и известны рядовым специалистам в данной области.
Полинуклеотиды, кодирующие антитела
Данное изобретение также предлагает полинуклеотиды или нуклеиновые кислоты, например ДНК, содержащие нуклеотидную последовательность, кодирующую антитело данного изобретения, а также их фрагменты. Примеры полинуклеотидов включают в себя полинуклеотиды, которые кодируют цепи антител, содержащие одну или несколько из описанных в данном документе аминокислотных последовательностей. Данное изобретение также охватывает полинуклеотиды, которые гибридизуются в жестких условиях или в условиях пониженной жесткости с полинуклеотидами, кодирующими антитело настоящего изобретения.
Получить полинуклеотиды и определить их нуклеотидную последовательность можно с помощью любого известного в данной области способа. Например, если нуклеотидная последовательность антитела известна, полинуклеотид, кодирующий антитело, можно собрать из химически синтезированных олигонуклеотидов (например, как описано в Kutmeier, et al., Bio/Techniques 17:242 (1994)), коротко говоря, данный способ включает в себя синтез перекрывающихся олигонуклеотидов, содержащих фрагменты последовательности, кодирующей антитело, отжиг и лигирование указанных олигонуклеотидов, и затем амплификацию лигированных олигонуклеотидов методом ПЦР.
Альтернативно, полинуклеотид, кодирующий антитело, можно получить из нуклеиновой кислоты, выделенной из подходящего источника. Если клон, содержащий нуклеиновую кислоту, кодирующую конкретное антитело, не доступен, но последовательность молекулы антитела известна, нуклеиновую кислоту, кодирующую иммуноглобулин, можно синтезировать химически или получить из подходящего источника (такого как библиотека кДНК антитела или библиотека кДНК, полученная из, или нуклеиновая кислота, предпочтительно поли A+ РНК, выделенная из любых тканей или клеток, экспрессирующих антитело, таких как клетки гибридомы, выбранные для экспрессии антитела данного изобретения) путем амплификации методом ПЦР с использованием синтетических праймеров, способных гибридизоваться с 3'- и 5'-концами последовательности, или путем клонирования с использованием олигонуклеотидного зонда, специфичного к конкретной последовательности, чтобы идентифицировать, например, клон кДНК из библиотеки кДНК, который кодирует антитело. Затем амплифицированные нуклеиновые кислоты, полученные методом ПЦР, можно клонировать в способных к репликации векторах клонирования с помощью любых известных в данной области методов.
После определения нуклеотидной последовательности и соответствующей аминокислотной последовательности антитела нуклеотидную последовательность антитела можно модифицировать с помощью хорошо известных в данной области способов модификации нуклеотидной последовательности, таких как, например, методы рекомбинантных ДНК, направленный мутагенез, ПЦР и др. (см., например, методы, описанные в Sambrook, et al., Molecular Cloning, A Laboratory Manual, 2nd ed, Cold Spring Harbor Laboratory (1990); Ausubel, et al., eds., Current Protocols in Molecular Biology, John Wiley & Sons (1998), которые включены в данное описание в виде ссылки во всей полноте), чтобы получить антитела с разными аминокислотными последовательностями, например, чтобы осуществить аминокислотные замены, делеции и/или инсерции.
В конкретном воплощении аминокислотная последовательность вариабельных доменов тяжелой и/или легкой цепи можно анализировать, чтобы идентифицировать последовательности CDR с помощью хорошо известных методов, например, путем сравнения с известными аминокислотными последовательностями других вариабельных участков тяжелой и легкой цепи, чтобы определить гипервариабельные участки последовательности. Используя рутинные методы рекомбинантных ДНК, один или несколько CDR можно вставить в каркасные участки, например в человеческие каркасные участки, чтобы гуманизировать нечеловеческое антитело, как указано выше. Каркасные участки могут представлять собой природные или консенсусные каркасные участки, предпочтительно, человеческие каркасные участки (перечисление человеческих каркасных участков можно найти, например, в Chothia, et al., J Mol Biol 278: 457 (1998)). Предпочтительно, полинуклеотид, полученный в результате сочетания каркасных участков и CDR, кодирует антитело, которое специфически связывает полипептид данного изобретения. Предпочтительно, как указано выше, в каркасных участках можно сделать одну или несколько аминокислотных замен, которые, предпочтительно, улучшают связывание антитела с антигеном. Кроме того, такие способы можно использовать для осуществления замен или делеций одного или нескольких остатков цистеина вариабельного участка, участвующих в образовании внутрицепочечной дисульфидной связи, с получением молекул антитела, утративших одну или несколько внутрицепочечных дисульфидных связей. Другие модификации полинуклеотидов входят в объем настоящего изобретения и относятся к компетенции специалистов в данной области.
Кроме того, можно использовать способы, разработанные для получения "химерных антител" (Morrison, et al., Proc Natl Acad Sci 81:851 (1984); Neuberger, et al., Nature 312:604 (1984); Takeda, et al., Nature 314:452 (1985)) путем сплайсинга генов молекулы мышиного антитела с соответствующей специфичностью к антигену и генов молекулы человеческого антитела с соответствующей биологической активностью. Как указано выше, химерное антитело представляет собой молекулу, которая содержит фрагменты, полученные из животных разных видов, такие как вариабельный участок мышиного MAb и константный участок человеческого иммуноглобулина, примером такой молекулы является гуманизированное антитело.
Альтернативно, методы, описанные для получения одноцепочечных антител (патент США № 4946778; Bird, Science 242:423 (1988); Huston, et al., Proc Natl Acad Sci USA 85:5879 (1988); и Ward, et al., Nature 334:544 (1989)), можно адаптировать для получения одноцепочечных антител. Одноцепочечные антитела получают путем соединения фрагментов участков Fv тяжелой и легкой цепи через аминокислотный мостик с получением одноцепочечного полипептида. Также можно использовать способы сборки функциональных фрагментов Fv в E.coli (Skerra, et al., Science 242:1038 (1988)).
Способы получения антител против NOTCH3
Антитела данного изобретения можно получить с помощью известных в данной области способов синтеза антител, в частности, путем химического синтеза, или, предпочтительно, с помощью методов рекомбинантной экспрессии.
Чтобы осуществить рекомбинантную экспрессию антитела данного изобретения, или его фрагмента, производного или аналога (например, тяжелой или легкой цепи антитела данного изобретения или одноцепочечного антитела данного изобретения), нужно сконструировать вектор экспрессии, содержащий полинуклеотид, который кодирует антитело или фрагмент антитела. После получения полинуклеотида, кодирующего молекулу антитела, с помощью технологии рекомбинантных ДНК можно получить вектор, обеспечивающий продукцию антитела. Конструируют вектор экспрессии, содержащий последовательности, кодирующие антитело, и подходящие последовательности, контролирующие транскрипцию и трансляцию. Данные способы включают в себя, например, методы рекомбинации ДНК in vitro, синтетические методы и методы генетической рекомбинации in vivo.
Вектор экспрессии переносят в клетку-хозяина с помощью традиционных методов, после чего трансфицированные клетки культивируют обычным способом, получая антитело данного изобретения. В одном аспекте данного изобретения векторы, кодирующие тяжелые и легкие цепи, можно совместно экспрессировать в клетке-хозяине с получением целой молекулы иммуноглобулина, как описано ниже.
Как описано выше, для экспрессии молекул антитела данного изобретения можно использовать ряд систем хозяин-вектор экспрессии. Такие системы хозяин-вектор экспрессии представляют собой средства, при помощи которых можно продуцировать и затем очищать представляющие интерес кодирующие последовательности, но они также представляют собой клетки, которые, после трансформации или трансфекции соответствующей нуклеотидной кодирующей последовательностью, могут экспрессировать молекулу антитела данного изобретения in situ. Для экспрессии рекомбинантной молекулы антитела, в особенности, для экспрессии целой рекомбинантной молекулы антитела обычно используют бактериальные клетки, такие как E.coli, и эукариотические клетки. Например, клетки млекопитающих, такие как CHO, в сочетании с вектором, содержащим, например, основной промежуточный ранний промотор гена из человеческого цитомегаловируса, являются эффективной системой экспрессии антител (Foecking, et al., Gene 45:101 (1986); Cockett, et al., Bio/Technology 8:2 (1990)).
Кроме того, можно выбрать штамм клетки-хозяина, который модулирует экспрессию введенной последовательности или модифицирует и процессирует генный продукт желательным образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут оказывать большое влияние на функционирование белка. Разные клетки-хозяева имеют характерные и специфические механизмы посттрансляционных процессинга и модификации белков и генных продуктов. Чтобы обеспечить правильные модификацию и процессинг экспрессируемого чужеродного белка, нужно выбрать подходящие клеточные линии или системы хозяев. Для данной цели можно использовать эукариотические клетки-хозяева, которые обладают клеточным механизмом, обеспечивающим соответствующий процессинг первичного транскрипта, а также соответствующее гликозилирование и фосфорилирование генного продукта. Такие клетки-хозяева млекопитающих включают в себя, без ограничения, клетки CHO, COS, 293, 3T3 или клетки миеломы.
Чтобы достичь долговременную продукцию рекомбинантных белков с высоким выходом предпочтительно использовать стабильную экспрессию. Например, методом генной инженерии можно получить клеточные линии, стабильно экспрессирующие молекулу антитела. Клетки-хозяева предпочтительнее трансформировать не векторами экспрессии, содержащими вирусные точки начала репликации, а ДНК, содержащей подходящие элементы регуляции экспрессии (такие как промотор, энхансер, последовательности терминации транскрипции, участки полиаденилирования и др.) и маркер селекции. После введения чужеродной ДНК рекомбинантные клетки оставляют расти в течение одного-двух дней в обогащенной среде, которую затем меняют на среду для селекции. Маркер селекции, присутствующий в рекомбинантной плазмиде, придает устойчивость к условиям селекции, позволяет плазмиде стабильно интегрироваться в хромосомы клетки и выращивать клетки до образования очагов, которые, в свою очередь, можно клонировать и выращивать с получением клеточных линий. Данный способ можно успешно использовать для получения клеточных линий, экспрессирующих молекулу антитела. Такие рекомбинантные клеточные линии, в частности, можно использовать для скрининга и анализа соединений, которые непосредственно или косвенно взаимодействуют с молекулой антитела.
Можно использовать ряд систем селекции, включающий в себя, без ограничения, применение генов тимидинкиназы вируса простого герпеса (Wigler, et al., Cell 11:223 (1977)), гипоксантин-гуанин-фосфорибозилтрансферазы (Szybalska, et al., Proc Natl Acad Sci USA 48:202 (1992)) и аденин-фосфорибозилтрансферазы (Lowy, et al., Cell 22:817 (1980)) в сочетании с tk-, hgprt- или aprt-клетками, соответственно. Кроме того, селекцию можно проводить на основе устойчивости к антиметаболитам с использованием следующих генов: dhfr, который придает устойчивость к метотрексату (Wigler, et al., Proc Natl Acad Sci USA 77:357 (1980); O'Hare, et al., Proc Natl Acad Sci USA 78:1527 (1981)); gpt, который придает устойчивость к микофеноловой кислоте (Mulligan, et al., Proc Natl Acad Sci USA 78:2072 (1981)); neo, который придает устойчивость к аминогликозиду G-418 (Wu, et al., Biotherapy 3:87 (1991)); и hygro, который придает устойчивость к гигромицину (Santerre, et al., Gene 30:147 (1984)). Для селекции желательного рекомбинантного клона можно использовать способы, широко известные в области технологии рекомбинантных ДНК, такие способы описаны, например, в Ausubel, et al., eds., Current Protocols in Molecular Biology, John Wiley & Sons (1993); Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press (1990); и в главах 12 и 13, Dracopoli, et al., eds, Current Protocols in Human Genetics, John Wiley & Sons (1994); Colberre-Garapin, et al., J Mol Biol 150:1 (1981), которые включены в данное описание в виде ссылки во всей полноте.
Уровень экспрессии молекулы антитела можно повысить путем амплификации вектора (обзор опубликован Bebbington, et al., "The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells," DNA Cloning, Vol.3. Academic Press (1987)). Если маркер из векторной системы, экспрессирующей антитело, способен амплифицироваться, повышение уровня ингибитора, присутствующего в культуре клетки-хозяина, приводит к увеличению числа копий маркерного гена. Поскольку амплифицируемый участок связан с геном антитела, продукция антитела также увеличивается (Crouse, et al., Mol Cell Biol 3:257 (1983)).
Клетку-хозяина можно совместно трансфицировать двумя векторами экспрессии данного изобретения, где первый вектор кодирует полипептид, входящий в состав тяжелой цепи, а второй вектор кодирует полипептид, входящий в состав легкой цепи. Два вектора могут содержать идентичные маркеры селекции, обеспечивающие одинаковый уровень экспрессии полипептидов тяжелой и легкой цепи. Альтернативно, можно использовать один вектор, который кодирует и обеспечивает экспрессию полипептидов и тяжелой и легкой цепи. В таких случаях, чтобы избежать избытка токсичной свободной тяжелой цепи, последовательность, кодирующую легкую цепь, следует располагать перед последовательностью, кодирующей тяжелую цепь (Proudfoot, Nature 322:52 (1986); Kohler, Proc Natl Acad Sci USA 77:2197 (1980)). Последовательности, кодирующие тяжелые и легкие цепи, могут содержать кДНК или геномную ДНК.
После получения молекулы антитела данного изобретения путем продукции в организме животного, химического синтеза или рекомбинантной экспрессии, ее можно очистить с помощью любого известного в данной области способа очистки молекул иммуноглобулина, такого как хроматография (например, ионообменная, аффинная, в частности, основанная на том, что сродство к конкретному антигену превышает сродство к белку A, и эксклюзионная хроматография), центрифугирование, использование разности в растворимостях, или с помощью любого другого стандартного способа очистки белков. Кроме того, чтобы облегчить очистку, антитела настоящего изобретения или их фрагменты можно гибридизовать с гетерологичными полипептидными последовательностями, описанными в данном документе, или известными в данной области.
Настоящее изобретение охватывает антитела, гибридизованные с полипептидом с помощью рекомбинантных методов, или конъюгированные с полипептидом с помощью химических методов (конъюгация может быть как ковалентная, так и нековалентная). Гибридизованные или конъюгированные антитела настоящего изобретения можно использовать для облегчения очистки. См., например, публикацию PCT WO 93/21232; EP 439095; Naramura, et al., Immunol Lett 39:91 (1994); патент США № 5474981; Gillies, et al., Proc Natl Acad Sci USA 89:1428 (1992); Fell, et al., J Immunol 146:2446 (1991), которые включены в данное описание в виде ссылки во всей полноте.
Чтобы облегчить очистку, антитела настоящего изобретения или их фрагменты также можно гибридизовать с маркерными последовательностями, такими как пептиды. В предпочтительных воплощениях маркерная аминокислотная последовательность представляет собой гексагистидиновый пептид, например маркер, поставляемый в векторе pQE (QIAGEN, Inc., Chatsworth, CA), однако можно использовать и другие последовательности, многие из которых являются коммерчески доступными. Как описано в Gentz, et al., Proc Natl Acad Sci USA 86:821 (1989), для традиционной очистки гибридного белка используют, например, гексагистидин. Другие пептидные маркеры, используемые для очистки, включают в себя, без ограничения, маркер "HA", который соответствует эпитопу белка гемагглютинина вируса гриппа (Wilson, et al., Cell 37:767 (1984)) и маркер "flag".
Очистка антитела
При использовании рекомбинантных методов вариант антитела может продуцироваться во внутриклеточное или периплазматическое пространство, или секретироваться непосредственно в среду. Если вариант антитела продуцируется внутри клетки, на первой стадии с помощью центрифугирования или ультрафильтрации можно удалить дисперсный дебрис, состоящий либо из клеток-хозяев, либо из лизированных фрагментов. Carter, et al., Bio/Technology 10:163 (1992) описывают способ выделения антител, которые секретируются в периплазматическое пространство E.coli. Коротко говоря, клеточную массу оттаивают в присутствии ацетата натрия (pH 3,5), EDTA и фенилметилсульфонилфторида (PMSF) в течение приблизительно 30 минут. Клеточный дебрис можно удалить центрифугированием. Если вариант антитела секретируется в среду, супернатанты таких систем экспрессии вначале концентрируют, используя коммерчески доступные фильтры для концентрирования белков, например приспособления для ультрафильтрации Amicon или Millipore Pellicon. На всех описанных выше стадиях можно использовать ингибиторы протеаз, такие как PMSF, чтобы ингибировать протеолиз, и антибиотики, чтобы предотвратить рост случайных загрязняющих организмов.
Композицию антитела, полученную из клеток, можно очистить, например, с помощью хроматографии на гидроксилапатите, гель-электрофореза, диализа и аффинной хроматографии, причем аффинная хроматография является предпочтительным методом очистки. Возможность применения белка A в качестве аффинного лиганда зависит от вида и изотипа домена Fc иммуноглобулина, присутствующего в варианте антитела. Белок A можно использовать для очистки антитела, содержащего тяжелые цепи человеческих IgG1, IgG2 или IgG4 (Lindmark, et al., J Immunol Meth 62:1 (1983)). Для очистки всех мышиных изотипов и человеческого IgG3 рекомендуют использовать белок G (Guss, et al., EMBO J 5:1567 (1986)). В качестве основы, к которой присоединяют аффинный лиганд, чаще всего используют агарозу, однако можно использовать и другие основы. Механически стабильные основы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, позволяют использовать более высокие скорости потока и более короткое время обработки, чем агароза. Если вариант антитела содержит домен CH3, для очистки используют смолу Bakerbond ABXTM (J. T. Baker; Phillipsburg, N.J.). Также можно использовать другие методы очистки белков, такие как фракционирование на ионнообменной колонке, осаждение этанолом, ВЭЖХ на обращенной фазе, хроматография на оксиде кремния, хроматография на гепарин-содержащей SEPHAROSETM, хроматография на анионо- или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE, и осаждение сульфатом аммония, в зависимости от получаемого варианта антитела.
После предварительной стадии (стадий) очистки смесь, содержащую представляющий интерес вариант антитела и загрязняющие примеси, можно подвергнуть хроматографии гидрофобных взаимодействий при низких значениях pH, используя для элюирования буфер, имеющий pH в диапазоне 2,5-4,5, предпочтительно, при низких концентрациях солей (например, приблизительно в диапазоне 0-0,25 M).
Фармацевтическая композиция
Терапевтические композиции полипептида или антитела можно получить для хранения в виде лиофилизированных композиций или водных растворов путем смешивания полипептида, имеющего желательную степень чистоты, с необязательными "фармацевтически приемлемыми" носителями, эксципиентами или стабилизаторами, обычно используемыми в данной области (все они имеют общее название "эксципиенты"), которые включают в себя, забуферивающие средства, стабилизирующие средства, консерванты, средства, придающие раствору изотоничность, неионные детергенты, антиоксиданты и другие разнородные добавки. См. Remington's Pharmaceutical Sciences, 16th edition, Osol, Ed. (1980). Такие добавки должны быть нетоксичными для реципиентов в используемых дозах и концентрациях.
Забуферивающие средства помогают поддерживать pH в интервале, близком к физиологическим условиям. Предпочтительно они присутствуют в концентрациях, варьирующих от приблизительно 2 мМ до приблизительно 50 мМ. Забуферивающие средства, подходящие для применения в настоящем изобретении, включают в себя органические и неорганические кислоты и их соли, такие как цитратные буферы (например, смесь цитрата мононатрия и цитрата динатрия, смесь лимонной кислоты и цитрата тринатрия, смесь лимонной кислоты и цитрата мононатрия и др.), сукцинатные буферы (например, смесь янтарной кислоты и сукцината мононатрия, например, смесь янтарной кислоты и гидроксида натрия, смесь янтарной кислоты и сукцината динатрия и др.), тартратные буферы (например, смесь винной кислоты и тартрата натрия, смесь винной кислоты и тартрата калия, смесь винной кислоты и гидроксида натрия и др.), фумаратные буферы (например, смесь фумаровой кислоты и фумарата мононатрия и др.), фумаратные буферы (например, смесь фумаровой кислоты и фумарата мононатрия, смесь фумаровой кислоты и фумарата динатрия, смесь фумарата мононатрия и фумарата динатрия и др.), глюконатные буферы (например, смесь глюконовой кислоты и глюконата натрия, смесь глюконовой кислоты и гидроксида натрия, смесь глюконовой кислоты и глюконата калия и др.), оксалатные буферы (например, смесь щавелевой кислоты и оксалата натрия, смесь щавелевой кислоты и гидроксида натрия, смесь щавелевой кислоты и оксалата калия и др.), лактатные буферы (например, смесь молочной кислоты и лактата натрия, смесь молочной кислоты и гидроксида натрия, смесь молочной кислоты и лактата калия и др.) и ацетатные буферы (например, смесь уксусной кислоты и ацетата натрия, смесь уксусной кислоты и гидроксида натрия и др.). Кроме того, можно упомянуть фосфатные буферы, гистидиновые буферы и соли триметиламина, такие как Tris.
Чтобы замедлить рост микробов, можно добавить консерванты в количествах, варьирующих от 0,2% до 1% (мас./об.). Консерванты, подходящие для применения в настоящем изобретении, включают в себя фенол, бензиловый спирт, мета-крезол, метилпарабен, пропилпарабен, октадецилдиметилбензиламмония хлорид, галогениды бензалкония (например, хлорид, бромид, иодид), хлорид гексония и алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцин, циклогексанол и 3-пентанол.
Чтобы обеспечить изотоничность жидких композиций настоящего изобретения, можно добавить средства, придающие раствору изотоничность, иногда называемые "стабилизаторы", которые включают в себя многоатомные сахарные спирты, предпочтительно, сахарные спирты, содержащие три или более гидроксильные группы, такие как глицерин, эритритол, арабит, ксилит, сорбит и маннит.
Стабилизаторы относятся к обширной категории эксципиетов, которая объединяет вещества, имеющие разные функции, от агентов-наполнителей до добавок, способствующих солюбилизации терапевтического средства или предотвращающих его денатурацию или прилипание к стенке контейнера. К типичным стабилизаторам относятся многоатомные сахарные спирты (перечисленные выше); аминокислоты, такие как аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутаминовая кислота, треонин и др., органические сахара или сахарные спирты, такие как лактоза, трегалоза, стахиоза, маннит, сорбит, ксилит, рибит, миоинозит, галактитол, глицерин и т.п., в том числе, циклические спирты, такие как инозитол; полиэтиленгликоль; аминокислотные полимеры; серосодержащие восстанавливающие средства, такие как мочевина, глутатион, тиоктовая кислота, тиогликолят натрия, тиоглицерин, альфа-монотиоглицерин и тиосульфат натрия; низкомолекулярные полипептиды (т.е. <10 остатков); белки, такие как человеческий сывороточный альбумин, бычий сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон, моносахариды, такие как ксилоза, манноза, фруктоза, глюкоза; дисахариды, такие как лактоза, мальтоза, сахароза, и трисахариды, такие как рафиноза; а также полисахариды, такие как декстран. Стабилизаторы могут присутствовать в количестве от 0,1 до 10000 массовых долей по отношению к массе активного белка.
Неионные поверхностно-активные вещества или детергенты (также известные как "увлажняющие средства") можно добавить для облегчения солюбилизации терапевтического средства, а также для защиты терапевтического белка от аггрегации, вызванной перемешиванием, данные средства также предотвращают денатурацию белка, возникающую при воздействии на композицию давления поверхностного сдвига. Подходящие неионные поверхностно-активные вещества включают в себя полисорбаты (20, 80 и др.), полиоксамеры (184, 188 и др.), полиолы Pluronic.RTM., простые моноэфиры полиоксиэтилена и сорбитана (TWEEN-20®, TWEEN-80® и др.). Неионные поверхностно-активные вещества могут присутствовать в количествах, варьирующих от приблизительно 0,05 мг/мл до приблизительно 1,0 мг/мл, предпочтительно от приблизительно 0,07 мг/мл до приблизительно 0,2 мг/мл.
Другие разнородные эксципиенты включают в себя агенты-наполнители (например, крахмал), хелатирующие средства (например, EDTA), антиоксиданты (например, аскорбиновая кислота, метионин, витамин E) и сорастворители. Композиция настоящего изобретения также может содержать несколько активных соединений, если это необходимо для лечения конкретных симптомов, предпочтительно такие соединения обладают взаимодополняющими активностями, которые не оказывают неблагоприятного влияния друг на друга. Например, иногда желательно дополнительно использовать иммунодепрессивное средство. Такие молекулы могут присутствовать в сочетании в количествах, эффективных для достижения предполагаемой цели. Активные ингредиенты также можно заключить в микрокапсулу, полученную, например, путем коацервации или межфазной полимеризации в случае гидроксиметилцеллюлозной или желатиновой микрокапсулы и поли(метилметакрилатной) микрокапсулы соответственно в коллоидные системы доставки лекарственных средств (такие как липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы), или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences, 16th edition, Osal, Ed. (1980).
Композиции, предназначенные для введения in vivo, должны быть стерильными. Стерилизацию можно легко осуществить, например, путем фильтрации через стерильные фильтрационные мембраны. Можно использовать препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают в себя полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие вариант антитела, данные матрицы могут находиться в виде профилированных изделий, таких как пленки или микрокапсулы. Примеры матриц с замедленным высвобождением включают в себя сложные полиэфиры, гидрогели (такие как поли(2-гидроксиэтилметакрилат), поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, недеградирующий этиленвинилацетат, деградирующие сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOTTM (пригодные для инъекций микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и лейпролида ацетата), и поли-D-(-)-3-гидроксимасляная кислота. Хотя полимеры, такие как этиленвинилацетат и молочная кислота-гликолевая кислота, способны высвобождать молекулы в течение 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов. Если заключенные в капсулу антитела остаются в организме в течение длительного времени, они могут денатурировать или агрегировать под действием влаги при 37°C, что может привести к потере биологической активности и возможным изменениям иммуногенности. В зависимости от задействованного механизма можно использовать рациональные стратегии стабилизации. Например, если показано, что механизм аггрегации включает в себя образование межмолекулярных связей S-S в результате тиодисульфидного взаимодействия, препарат можно стабилизировать путем модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контролирования содержания влаги, применения подходящих добавок и разработки специфических полимерных матриксных композиций.
Количество терапевтического полипептида, антитела или его фрагмента, эффективное для лечения конкретного нарушения или состояния, зависит от природы нарушения или состояния и может быть определено с помощью стандартных клинических методов. По возможности, перед тестированием на людях желательно получить кривую доза-ответ для фармацевтических композиций данного изобретения вначале in vitro и затем на подходящих животных модельных системах.
В предпочтительном воплощении водный раствор терапевтического полипептида, антитела или его фрагмента вводят путем подкожной инъекции. Каждая доза может варьировать от приблизительно 0,5 мкг до приблизительно 50 мкг на килограмм массы тела, или, более предпочтительно, от приблизительно 3 мкг до приблизительно 30 мкг на килограмм массы тела.
Дозировочный режим для подкожного введения может варьировать от одного раза в месяц до ежедневного введения, в зависимости от ряда клинических факторов, включающих в себя тип заболевания, тяжесть заболевания и восприимчивость субъекта к терапевтическому средству.
Терапевтическое применение антител против NOTCH3
Антитела настоящего изобретения предполагается использовать для лечения млекопитающих. В одном воплощении антитело вводят отличному от человека млекопитающему, например, с целью получения предклинических данных. Примеры отличных от человека млекопитающих, подлежащих лечению, включают в себя отличных от человека приматов, собак, кошек, грызунов и других млекопитающих, на которых проводят предклинические испытания. Таких млекопитающих можно использовать для получения животных моделей заболевания, подлежащего лечению антителом, или для исследования токсичности представляющего интерес антитела. Во всех описанных воплощениях исследования по влиянию повышения дозы можно проводить на млекопитающем.
Антитело, вводимое отдельно или в сочетании с другим фактором (факторами), можно использовать в качестве терапевтического средства. Настоящее изобретение относится к способам лечения антителами, которые включают в себя введение антитела данного изобретения животному, млекопитающему или человеку, для лечения Notch3-опосредованного заболевания, нарушения или состояния. Животное или субъект может представлять собой млекопитающее, нуждающееся в конкретном лечении, такое как млекопитающее, у которого диагностировано конкретное нарушение, например, связанное с Notch3. Антитела, направленные против Notch3, можно использовать для лечения дегенеративных заболеваний и других Notch3-ассоциированных заболеваний, включающих в себя CADASIL, FHM, синдром Алагилля, неврологические и дегенеративные нарушения у млекопитающих, таких как, без ограничения, коровы, свиньи, лошади, куры, кошки, собаки, отличные от человека приматы и др., а также у людей. Например, путем введения терапевтически приемлемой дозы антитела или антител против Notch3 настоящего изобретения, или смеси антител настоящего изобретения, или их сочетания с другими антителами из разных источников, симптомы заболевания можно улучшить или предотвратить у подвергающегося лечению млекопитающего, особенно человека.
Терапевтические соединения данного изобретения включают в себя, без ограничения, антитела данного изобретения (в том числе их фрагменты, аналоги и производные, как описано в данном документе) и нуклеиновые кислоты, кодирующие антитела данного изобретения, как описано ниже (в том числе их фрагменты, аналоги и производные, а также антиидиотипические антитела, как описано в данном документе). Антитела данного изобретения можно использовать для лечения, подавления или профилактики заболеваний, нарушений или состояний, связанных с аберрантной экспрессией и/или активностью Notch3, которые включают в себя, без ограничения, любое одно или несколько из заболеваний, нарушений или состояний, описанных в данном документе. Лечение и/или профилактика заболеваний, нарушений или состояний, связанных с аберрантной экспрессией и/или активностью Notch3, включает в себя, без ограничения, облегчение, по меньшей мере, одного симптома, связанного с указанными заболеваниями, нарушениями или состояниями. Антитела данного изобретения можно ввести в состав фармацевтически приемлемых композиций с помощью способов, известных в данной области или описанных в данном документе.
Антитела против Notch3 настоящего изобретения можно использовать для терапевтического лечения ряда заболеваний. Настоящее изобретение предлагает способ профилактики или лечения Notch3-опосредованных заболеваний у млекопитающих. Данный способ включает в себя введение млекопитающему эффективного для профилактики или лечения заболевания количества антитела против Notch3. Антитело против Notch3 связывается с Notch3 и подавляет его функционирование. Сигнальный путь Notch3 связан с разными заболеваниями, такими как CADASAL, FHM, семейная парокситическая атаксия, синдром Алагилля и другие дегенеративные заболевания и неврологические нарушения (Joutel, et al., Nature 383:707 (1996); Flynn, et al., J Pathol 204:55 (2004)). Полагают, что антитела против Notch3 можно эффективно использовать для лечения вышеуказанных заболеваний.
Количество антитела, эффективное для лечения, подавления и профилактики заболевания или нарушения, связанного с аберрантной экспрессией и/или активностью Notch3, можно определить с помощью стандартных клинических методов. Доза зависит от типа заболевания, подлежащего лечению, тяжести и течения заболевания, от того, с какой целью, профилактической или терапевтической, вводят антитело, предыдущей терапии, клинической истории пациента и ответа на антитело, а также от решения лечащего врача. Чтобы улучшить состояние заболевания, антитело можно вводить в режиме лечения, в зависимости от заболевания, например, в одной или нескольких дозах в течение от одного до нескольких дней, или дозы антитела можно вводить периодически в течение продолжительного времени, чтобы подавить развитие заболевания и предотвратить рецидив. Кроме того, оптимальные интервалы доз можно определить с помощью анализов in vitro. Точная доза, используемая в композиции, также зависит от способа введения, тяжести заболевания или нарушения, и устанавливается в соответствии с заключением лечащего врача и состоянием каждого пациента. Эффективные дозы можно определить на основании кривых доза-ответ, полученных in vitro или на животных модельных системах.
Антитела вводят пациенту в дозе, которая обычно составляет от 0,1 мг/кг до 150 мг/кг массы тела пациента. Предпочтительно, доза, вводимая пациенту, составляет от 0,1 мг/кг до 20 мг/кг массы тела пациента, более предпочтительно, от 1 мг/кг до 10 мг/кг массы тела пациента. Как правило, человеческие антитела имеют более длительный период полужизни в организме человека, чем антитела из других видов вследствие иммунного ответа на чужеродные полипептиды. Как правило, человеческие антитела зачастую можно использовать в более низких дозах и вводить их можно реже. Кроме того, дозу и частоту введения антител данного изобретения можно уменьшить путем повышения потребления и проникания в ткани (например, в мозг) антител путем модификаций, таких как, например, липидизация. При многократном введении в течение нескольких дней или дольше, в зависимости от состояния, обработку продолжают до желательного подавления симптомов заболевания. Однако можно использовать другие режимы дозирования. Результат данной терапии можно легко отслеживать с помощью традиционных методов и анализов.
Композицию варианта антитела можно получать, дозировать и вводить в соответствии с успешной медицинской практикой. Факторы, учитывающиеся в данном контексте, включают в себя конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние отдельного пациента, причину нарушения, участок доставки средства, способ введения, режим введения, а также другие факторы, известные врачам. "Терапевтически эффективное количество" вводимого варианта антитела зависит от таких факторов и представляет собой минимальное количество, необходимое для профилактики, улучшения или лечения заболевания или нарушения. Вариант антитела может необязательно входить в состав композиции наряду с одним или несколькими средствами, используемыми в настоящее время для профилактики или лечения рассматриваемого нарушения. Эффективное количество таких других средств зависит от количества антитела, присутствующего в композиции, типа нарушения или способа лечения, а также от других факторов, указанных выше. Как правило, их используют в таких же дозах с помощью таких же способов введения, как указано выше в данном документе, или в количествах, составляющих приблизительно от 1 до 99% от ранее используемых доз.
Антитела данного изобретения можно вводить отдельно или в сочетании с другими типами лечения.
В предпочтительном аспекте антитело является практически очищенным (например, практически не содержит веществ, которые ограничивают его действие или оказывают нежелательные побочные эффекты).
Известны разные системы доставки, которые можно использовать для введения антитела настоящего изобретения, в том числе путем инъекции, например, содержащие соединение липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать соединение, рецептор-опосредованный эндоцитоз (см., например, Wu, et al., J Biol Chem 262:4429 (1987)), конструкции нуклеиновой кислоты в составе ретровирусного или другого вектора и др.
Антитело против Notch3 можно вводить млекопитающему любым приемлемым способом. Способы введения включают в себя, без ограничения, парентеральный, подкожный, внутрибрюшинный, внутрилегочный, внутриназальный, эпидуральный, ингаляцию и пероральный, и, если это необходимо для иммунодепрессивного лечения, введение в участок пораженной ткани. Парентеральные инфузии включают в себя внутримышечное, внутрикожное, внутривенное, внутриартериальное или внутрибрюшинное введение. Антитела или композиции можно вводить с помощью любого традиционного способа, например путем инфузии или болюсной инъекции, путем абсорбции через эпителиальную или кожно-слизистую выстилки (такие как слизистая оболочка полости рта, ректальная и кишечная слизистые оболочки и др.), причем их можно вводить вместе с другими биологически активными средствами. Введение может быть системным или локальным. Кроме того, иногда желательно вводить терапевтические антитела или композиции данного изобретения в центральную нервную систему с помощью любого подходящего способа, включающего в себя внутрижелудочковое и внутриоболочечное введение; внутрижелудочковое введение можно осуществлять с помощью внутрижелудочкового катетера, например, присоединенного к резервуару, такому как резервуар Ommaya. Антитело также можно вводить путем импульсной инфузии, в особенности, с уменьшением доз антитела. Предпочтительно, введение осуществляют путем инъекций, наиболее предпочтительно, внутривенных или подкожных инъекций, отчасти, в зависимости от того, является ли введение кратким или хроническим.
Кроме того, можно использовать легочное введение, например, путем применения ингалятора или распылителя и композиции, содержащей средство, обеспечивающее аэрозолизацию. Антитело также можно вводить в легкие пациента в виде сухой порошкообразной композиции (см., например, патент США № 6514496).
В конкретном воплощении может быть желательно вводить терапевтические антитела или композиции данного изобретения локально в участок, нуждающийся в лечении; этого можно достичь, например, без ограничения, с помощью локальной инфузии, местного нанесения, инъекции, посредством катетера, посредством свечей или посредством имплантата, причем указанный имплантат состоит из пористого, не пористого или гелеобразного вещества, и включает в себя мембраны, такие как силиконовые мембраны, или волокна. Предпочтительно, при введении антитела данного изобретения следует соблюдать осторожность при применении веществ, на которых белок не абсорбируется.
В другом воплощении антитело может доставляться в везикуле, в частности, в липосоме (см. Langer, Science 249:1527 (1990); Treat, et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein, et al., eds., pp. 353-365 (1989); Lopez-Berestein, там же., pp. 317-27; см. в целом там же).
В следующем воплощении антитело можно доставлять в системе с контролируемым высвобождением. В одном воплощении можно использовать нагнетатель (см. Langer, Science 249:1527 (1990); Sefton, CRC Crit Ref Biomed Eng 14:201 (1987); Buchwald, et al., Surgery 88:507 (1980); Saudek, et al., N Engl J Med 321:574 (1989)). В другом воплощении можно использовать полимерные материалы (см. Medical Applications of Controlled Release, Langer, et al., eds., CRC Press (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen, et al., eds., Wiley (1984); Ranger, et al., J Macromol Sci Rev Macromol Chem 23:61 (1983); см. также Levy, et al., Science 228:190 (1985); During, et al., Ann Neurol 25:351 (1989); Howard, et al., J Neurosurg 71:105 (1989)). В следующем воплощении систему с контролируемым высвобождением можно поместить вблизи терапевтической мишени.
Настоящее изобретение также предлагает фармацевтические композиции. Такие композиции содержат терапевтически эффективное количество антитела и физиологически приемлемый носитель. В конкретном воплощении термин "физиологически приемлемый" относится к средству, утвержденному контрольным органом Федерального правительства или правительства штата, или перечисленному в Фармакопеи США или других широко известных фармакопеях для применения на животных, более конкретно на людях. Термин "носитель" относится к разбавителю, адъюванту, эксиципиенту или среде, которые вводят вместе с терапевтическим средством. Такие физиологические носители могут представлять собой стерильные жидкости, такие как вода и масла, в том числе нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Вода представляет собой предпочтительный носитель, если фармацевтическую композицию вводят внутривенно. Солевые растворы и водные растворы декстрозы и глицерина также можно использовать в качестве жидких носителей, в особенности, для инъецируемых растворов. Подходящие фармацевтические эксципиенты включают в себя крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропиленгликоль, воду, этанол и т.п. При необходимости композиция также может содержать минорные количества увлажняющих или эмульгирующих средств, или забуферивающие средства. Данные композиции могут находиться в виде растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, композиций с замедленным высвобождением и т.п. Композиция может находиться в виде свечи, содержащей традиционные связующие и носители, такие как триглицериды. Пероральные композиции могут включать в себя стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат натрия и др., имеющие фармацевтическую категорию чистоты. Примеры подходящих носителей описаны в "Remington's Pharmaceutical Sciences", E. W. Martin. Такие композиции содержат эффективное количество антитела, предпочтительно, в очищенном виде, наряду с количеством носителя, подходящим для получения формы для соответствующего введения пациенту. Композиция должна соответствовать способу введения.
В одном воплощении композицию получают в соответствии с рутинными способами как фармацевтическую композицию, адаптированную для внутривенного введения людям. Как правило, композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости композиция также может содержать солюбилизирующее средство и местный анестетик, такой как лигнокаин, чтобы уменьшить боль в участке инъекции. Как правило, ингредиенты поставляются по отдельности или в смеси в виде единичной дозированной формы, например в виде сухого лиофилизированного порошка или безводного концентрата в герметически закрытом контейнере, таком как ампула или пакет-саше, с указанием количества активного средства. Если композицию вводят путем инфузии, ее можно дозировать с помощью бутыли для инфузии, содержащей стерильную воду или стерильный физиологический раствор фармацевтической категории чистоты. Если композицию вводят путем инъекции, может предоставляться ампула со стерильной водой для инъекции или со стерильным физиологическим раствором для смешивания ингредиентов перед введением. Данное изобретение также предоставляет фармацевтическую упаковку или набор, содержащий один или несколько контейнеров, заполненных одним или несколькими ингредиентами фармацевтических композиций данного изобретения. С таким контейнером (контейнерами) может быть необязательно связано уведомление в форме, установленной государственным органом, контролирующим производство, применение или продажу фармацевтических средств или биологических продуктов, которое свидетельствует о том, что данный орган разрешает производство, применение или продажу средства для введения человеку.
Промышленные изделия
В другом воплощении данное изобретение предлагает промышленное изделие, содержащее вещества, используемые для лечения описанных выше нарушений. Промышленное изделие включает в себя контейнер и этикетку. Подходящие изделия включают в себя, например, бутыли, флаконы, шприцы и пробирки. Контейнеры могут быть изготовлены из разных материалов, например из стекла или пластмассы. Контейнер содержит композицию, эффективную для профилактики или лечения состояния, и может иметь отверстие для стерильного доступа (например, контейнер может представлять собой мешок для внутривенного раствора или флакон, имеющий пробку, которую можно проколоть иглой для подкожных инъекций). Активное средство в композиции представляет собой антитело. Этикетка, на контейнере или присоединенная к контейнеру, указывает, что композиция предназначена для лечения определенного состояния. Промышленное изделие может дополнительно включать в себя второй контейнер, содержащий фармацевтически приемлемый буфер, такой как забуференный фосфатом физиологический раствор и раствор декстрозы. Оно также может содержать другие компоненты, необходимые с точки зрения производителя и потребителя, в том числе другие буферы, разбавители, фильтры, иглы, шприцы и листки-вкладыши в упаковке с инструкциями по применению.
Генная терапия на основе антител
В другом аспекте данное изобретение предлагает способ генной терапии, в котором нуклеиновые кислоты, содержащие последовательности, кодирующие антитела или их функциональные производные, вводят для лечения, подавления или профилактики заболевания или нарушения, связанного с аберрантной экспрессией и/или активностью Notch3. Генная терапия относится к терапии, проводимой путем введения субъекту экспрессируемой или способной экспрессироваться нуклеиновой кислоты. В данном воплощении настоящего изобретения нуклеиновые кислоты продуцируют кодируемый ими белок, который опосредует терапевтический эффект. В соответствии с настоящим изобретением можно использовать любые доступные способы генной терапии. Примеры способов описаны ниже.
Общие обзоры по способам генной терапии можно найти в Goldspiel, et al., Clinical Pharmacy 12:488 (1993); Wu, et al., Biotherapy 3:87 (1991); Tolstoshev, Ann Rev Pharmacol Toxicol 32:573 (1993); Mulligan, Science 260:926 (1993); Morgan, et al., Ann Rev Biochem 62:191 (1993); May, TIBTECH 11:155 (1993).
В одном аспекте соединение включает в себя нуклеотидные последовательности, кодирующие антитело, причем указанные нуклеотидные последовательности являются частью векторов экспрессии, обеспечивающих экспрессию антитела или его фрагментов, или химерных белков на основе антитела, или тяжелых или легких цепей антитела в подходящем хозяине. В частности, такие нуклеотидные последовательности содержат промоторы, функционально связанные с участком, кодирующим антитело, причем указанный промотор является либо индуцируемым, либо конститутивным и, необязательно, тканеспецифичным.
В другом конкретном воплощении используют молекулы нуклеиновых кислот, в которых последовательности, кодирующие антитело, а также любые другие необходимые последовательности фланкируются участками, стимулирующими гомологичную рекомбинацию в целевом участке генома, обеспечивая, таким образом, внутрихромосомную экспрессию нуклеиновых кислот, кодирующих антитело (Koller, et al., Proc Natl Acad Sci USA 86:8932 (1989); Zijlstra, et al., Nature 342:435 (1989)). В конкретных воплощениях экспрессируемая молекула антитела представляет собой одноцепочечное антитело; альтернативно, нуклеотидные последовательности содержат последовательности, кодирующие и тяжелые и легкие цепи антитела, или их фрагменты.
Доставка нуклеиновых кислот пациенту может быть либо непосредственной, при которой пациенту непосредственно вводят нуклеиновую кислоту, или векторы, несущие нуклеиновую кислоту, или косвенной, при которой клетки вначале трансформируют нуклеиновой кислотой in vitro, а затем трансплантируют пациенту. Описанные способы известны как генная терапия in vivo или ex vivo соответственно.
В конкретном воплощении нуклеотидные последовательности непосредственно вводят в организм, где они экспрессируются и продуцируют кодируемый продукт. Такое введение можно осуществить с помощью любого из многочисленных способов, известных в данной области, например путем включения их в состав подходящего вектора экспрессии нуклеиновой кислоты с последующим его введением таким образом, чтобы последовательности стали внутриклеточными, например, путем инфицирования дефектными или ослабленными ретровирусами или другими вирусными векторами (см. патент США № 4980286), или путем непосредственного введения оголенной ДНК, или путем бомбардировки микрочастицами (например, с использованием генной пушки; Biolistic, Dupont), или путем покрытия липидами или клеточными поверхностными рецепторами или трансформирующими средствами, заключения в липосомы, микрочастицы или микрокапсулы, или путем введения нуклеотидных последовательностей, связанных с пептидом, способным проникать в ядро, или путем введения нуклеотидных последовательностей, связанных с лигандом, способным подвергаться рецептор-опосредованному эндоцитозу (см., например, Wu, et al., J Biol Chem 262:4429 (1987)) (которое можно использовать для направления к типам клеток, специфически экспрессирующим рецепторы) и др. В другом воплощении можно получить комплексы нуклеиновая кислота-лиганд, где лиганд содержит сливающий вирусный пептид, разрушающий эндосомы и позволяющий нуклеиновой кислоте избежать лизосомной деградации. В следующем воплощении нуклеиновая кислота, в результате ее направленности на конкретный рецептор, может специфически поглощаться клетками in vivo и экспрессироваться (см., например, публикации PCT WO 92/06180; WO 92/22635; WO92/20316; WO93/14188, WO 93/20221). Альтернативно нуклеиновую кислоту можно ввести внутрь клетки и внедрить в ДНК клетки-хозяина с последующей экспрессией путем гомологичной рекомбинации (Koller, et al., Proc Natl Acad Sci USA 86:8932 (1989); Zijlstra, et al., Nature 342:435 (1989)).
В конкретном воплощении используют вирусные векторы, которые содержат нуклеотидные последовательности, кодирующие антитело данного изобретения. Например, можно использовать ретровирусный вектор (см. Miller, et al., Meth Enzymol 217:581 (1993)). Указанные ретровирусные векторы содержат компоненты, необходимые для правильной укладки вирусного генома и интеграции его в ДНК клетки-хозяина. Нуклеотидные последовательности, кодирующие антитело, предназначающееся для применения в генной терапии, клонируют в одном или нескольких векторах, которые обеспечивают доставку гена пациенту. Более подробную информацию по ретровирусным векторам можно найти в Boesen, et al., Biotherapy 6:291 (1994), где описано применение ретровирусного вектора для доставки гена mdrl в кроветворные стволовые клетки, чтобы сделать данные клетки более устойчивыми к химиотерапии. Другие ссылки иллюстрируют применение ретровирусных векторов в генной терапии: Clowes, et al., J Clin Invest 93:644 (1994); Kiem, et al., Blood 83:1467 (1994); Salmons, et al., Human Gene Therapy 4:129 (1993); и Grossman, et al., Curr Opin Gen and Dev 3:110 (1993).
В настоящем изобретении также можно использовать аденовирусы. В соответствии с настоящим изобретением аденовирусы являются особенно эффективным средством доставки антител к эпителию дыхательных путей. В природе аденовирусы инфицируют эпителий дыхательных путей. Другими мишенями для систем доставки на основе аденовирусов являются печень, центральная нервная система, эндотелиальные клетки и мышцы. Преимущество аденовирусов заключается в том, что они способны инфицировать неделящиеся клетки. Kozarsky, et al., Curr Opin Gen Dev 3:499 (1993) опубликовали обзор по генной терапии на основе аденовирусов. Bout, et al., Human Gene Therapy 5:3 (1994) продемонстрировали применение аденовирусных векторов для переноса генов в эпителий дыхательных путей макак-резус. Другие случаи применения аденовирусов в генной терапии описаны в Rosenfeld, et al., Science 252:431 (1991); Rosenfeld, et al., Cell 68:143 (1992); Mastrangeli, et al., J Clin Invest 91:225 (1993); публикации PCT WO94/12649; Wang, et al., Gene Therapy 2:775 (1995). Для применения в генной терапии также предлагаются адено-ассоциированные вирусы (AAV) (Walsh, et al., Proc Soc Exp Biol Med 204:289 (1993); патенты США №№ 5436146; 6632670; и 6642051).
Другой подход к генной терапии включает в себя перенос гена в клетки тканевой культуры с помощью таких методов, как электропорация, липофекция, трансфекция, опосредованная фосфатом кальция или вирусная инфекция. Как правило, способ переноса включает в себя перенос в клетки маркера селекции. Затем клетки подвергают селекции, отбирая клетки, поглотившие и экспрессирующие переносимый ген. Такие клетки впоследствии вводят пациенту.
В данном воплощении нуклеиновую кислоту вводят в клетку до введения в организм, получая рекомбинантную клетку. Такое введение можно осуществлять с помощью любого известного в данной области способа, включающего в себя, без ограничения, трансфекцию, электропорацию, микроинъекцию, инфицирование вирусным или бактериальным вектором, содержащим нуклеотидные последовательности, гибридизацию клеток, хромосома-опосредованный перенос гена, опосредованный микропорами перенос гена, сферопластную гибридизацию и др. В данной области известно много способов введения чужеродных генов в клетки (см., например, Loeffler, et al., Meth Enzymol 217:599 (1993); Cohen, et al., Meth Enzymol 217:618 (1993); Cline, Pharmac Ther 29:69 (1985)), которые можно использовать в соответствии с настоящим изобретением, при условии, что они не нарушают важных функций, связанных с развитием, а также физиологических функций клеток-реципиентов. Способ должен обеспечивать стабильную трансфекцию нуклеиновой кислоты в клетку так, чтобы нуклеиновая кислота могла экспрессироваться клеткой и предпочтительно наследоваться и экспрессироваться потомством данной клетки.
Полученные рекомбинантные клетки можно доставить пациенту с помощью разных способов, известных в данной области. Рекомбинантные клетки крови (например, кроветворные стволовые клетки или предшественники кроветворных клеток) предпочтительно вводят внутривенно. Количество клеток, необходимое для применения, зависит от желательного эффекта, состояния пациента и др., и может определяться специалистом в данной области.
Клетки, в которые можно ввести нуклеиновую кислоту в целях генной терапии, охватывают любые желательные доступные типы клеток и включают в себя, без ограничения, эпителиальные клетки, эндотелиальные клетки, кератиноциты, фибробласты, мышечные клетки, гепатоциты; клетки крови, такие как T-лимфоциты, B-лимфоциты, моноциты, макрофаги, нейтрофилы, эозинофилы, мегакариоциты, гранулоциты; различные стволовые клетки или клетки-предшественники, в частности, кроветворные стволовые клетки и предшественники кроветворных клеток, например, полученные из костного мозга, крови пуповины, периферической крови, эмбриональной печени и др.
В одном воплощении клетка, используемая для генной терапии, является аутологичной по отношению к пациенту. Нуклеотидные последовательности, кодирующие антитело настоящего изобретения, вводят в клетки так, чтобы обеспечить их экспрессию клетками или их потомством, после чего рекомбинантные клетки вводят в организм, получая терапевтический эффект. В конкретном воплощении используют стволовые клетки или клетки-предшественники. В соответствии с данным воплощением настоящего изобретения можно использовать любые стволовые клетки и/или клетки-предшественники, которые можно выделить и поддерживать in vitro (см., например публикацию PCT WO 94/08598; Stemple, et al., Cell 71:973 (1992); Rheinwald, Meth Cell Bio 21A:229 (1980); Pittelkow, et al., Mayo Clinic Proc 61:771 (1986)).
ПРИМЕРЫ
Пример 1. Получение иммуногена: гибридного белка внеклеточного домена NOTCH3-FC
Моноклональные антитела против Notch3, специфически связывающие LIN12/домен димеризации (далее называемый "LD") человеческого Notch3, получают, используя в качестве иммуногена рекомбинантный гибридный белок Notch3-Fc, содержащий LD Notch3, по карбоксильному концу которого присоединен участок гамма 1 Fc, а именно иммуноген представляет собой гибридный белок (Notch3 LD/Fc), содержащий аминокислотные остатки 1378-1640 LD Notch3 (см. фиг.1) и человеческий фрагмент γ1Fc. Контрольное антитело получают, используя в качестве иммуногена участок повтора EGF Notch3, содержащий аминокислотные остатки 43-1377.
Последовательность белка Notch3 анализируют с помощью интерактивных исследовательских программных обепечений и служб (Motif Search, http://motif.genome.ip/). РНК человеческой печени и поджелудочной железы (Ambion, Inc. Austin, TX) используют в качестве матрицы для синтеза первой цепи кДНК с использованием стандартного коммерчески доступного набора для синтеза кДНК. кДНК, кодирующую LD Notch3, и участок повтора EGF, амплифицируют методом ПЦР в присутствии бетаина (1-2 M) и DMSO (5%). Синтезированные методом ПЦР фрагмент ДНК Notch3-LD (~0,8 т.о.) и фрагмент ДНК повтора Notch3-EGF (~4 т.о.) клонируют в векторах экспрессии, содержащих His-γ1Fc, в коммерчески доступном векторе pSec или в коммерчески доступном векторе pCD3.1, которые несут разные антибиотические маркеры. В результате клонирования получают две плазмиды экспрессии, одна из которых экспрессирует гибридный белок Notch3-LD/Fc, а другая экспрессирует гибридный белок Notch3-EGF/Fc.
Чтобы облегчить конструирование плазмиды и увеличить экспрессию разных рекомбинантных белков Notch 3, получают олигонуклеотиды, соответствующие лидерной пептидной последовательности, содержащей первые 135 пар оснований нуклеотидной последовательности, кодирующей Notch3. Полученные олигонуклеотиды содержат некоторые изменения в положениях неоднозначного кодирования, сводящиеся к уменьшению содержания GC. Все изменения в нуклеотидных последовательностях являются молчащими, т.е. не приводят к изменениям аминокислотных последовательностей (фиг.8A и 8B). После совместного отжига олигонуклеотидов рекомбинантную последовательность, кодирующую лидерный пептид, соединяют с остатком кодирующей последовательности методом PCR-SOE (Ho, et al., Gene 77:51 (1989); Horton, et al., BioTechniques 8:528 (1990)) (см. фиг.9). Полученную последовательность, кодирующую лидерный пептид, используют в конструкциях экспрессии Notch3-LD/Fc и Notch3. Таким образом, оба гибридных белка Fc содержат сигнальный пептид, связанный с N-концом, человеческую последовательность γ1Fc, соединенную с С-концом.
Экспрессию гибридных белков Notch3-EGF/Fc и Notch3-LD/Fc подтверждают путем транзиторной трансфекции плазмид экспрессии Notch3 в клетки 293Т (АТСС №CRL-11268, Manassas, VA) и СНО (Invitrogen, Carlsbad, СА) соответственно. Перед трансфекцией клетки культивируют в питательной среде DMEM (Invitrogen, Carlsbad, СА), содержащей 10% фетальной телячьей сыворотки (FCS), 2 мМ глутамина и 1× раствор эссенциальных аминокислот, затем высевают в количестве приблизительно 3-5×105 клеток на лунку в 6-луночный планшет и выращивают в течение приблизительно 24 часов. Три микрограмма каждой плазмиды экспрессии, несущей гибридный белок Notch3, трансфицируют в клетки каждой лунки, используя систему для трансфекции Lipofectamine 2000 (Invitrogen, Carlsbad, СА) в соответствии с инструкциями производителя. После трансфекции клетки культивируют в свежей питательной среде в инкубаторе CO2 в течение приблизительно 40-48 часов, и затем анализируют экспрессию гибридного белка Notch3. Альтернативно, после трансфекции клетки культивируют в питательной среде в течение 3-4 часов, после чего среду меняют на DMEM, содержащую 2% FCS, и культивируют в течение приблизительно 60-66 часов, после чего кондиционированную среду отделяют и анализируют на секретируемый белок.
Стабильные клеточные линии получают как для Notch3-LD/Fc (вектор His-Fcγ/pSec), так и для Notch3-EGF/Fc (вектор His-Fcγ/pSec). Каждую плазмиду трансфицируют в клетки CHO. После трансфекции клетки культивируют в питательной среде DMEM в течение ночи, затем среду меняют на среду, содержащую 800 мкг/мл гигромицина, и культивируют в течение, по меньшей мере, двух недель, пока клетки, не содержащие плазмиды экспрессии Notch3, не погибнут под действием антибиотиков. Кондиционированную среду стабильных клеточных линий анализируют методом вестерн-блоттинга.
Стабильно или транзиторно трансфицированные клетки анализируют на экспрессию и секрецию гибридного белка Notch3-LD/Fc или Notch3-EGF/Fc. Трансфицированные клетки, собранные из чашек для культивирования, промывают один раз физиологическим раствором, забуференным фосфатом (PBS), ресуспендируют в деионизированной воде, смешивают с равным объемом 2× буфера для загрузки белкового образца (BioRad, Hercules, CA) и затем нагревают примерно при 100°C в течение 10 минут. Секретируемый белок анализируют, используя кондиционированную среду, смешанную с равным объемом 2× буфера для загрузки белкового образца, и нагревают при 100°C в течение 10 минут. Образцы разделяют методом SDS-PAGE, используя 4-15% градиент. Белки переносят из геля на мембрану PVDF (BioRad, Hercules, CA), которую блокируют 5% обезжиренным сухим молоком в PBST (PBS, содержащий 0,05% TWEEN-20®) в течение, по меньшей мере, одного часа перед переносом белка.
Гибридные белки Notch3-EGF/Fc и Notch3-LD/Fc детектируют путем инкубации с γFc-специфичным HRP-конъюгированным антителом (Sigma, St Louis, MO) в блокирующем буфере в течение одного часа при комнатной температуре. Мембрану промывают три раза PBST и проявляют, используя хемилюминисцентный субстрат.
Чтобы очистить гибридный белок Notch3 домен/Fc, стабильные клеточные линии CHO, как описано выше, культивируют в DMEM, содержащей 2% FCS, в течение не более 5 дней. Собирают один литр кондиционированной среды и подвергают его аффинной хроматографии на колонке, содержащей гранулы с иммобилизованным белком А. Колонку промывают PBS, связанные белки элюируют 50 мМ цитратным буфером (pH 2,8), и pH доводят до нейтральных значений путем добавления 1 M буфера Tris-HCl (pH 8). Чистоту белка определяют путем гель-анализа белка методом SDS-PAGE с использованием 4-15% градиента. Концентрацию белка определяют с помощью Кумасси синего в соответствии с инструкциями производителя (Pierce, Rockford, IL). С помощью данного способа получают миллиграммовые количества очищенного белка Notch3-LD/Fc и Notch3-EGF/Fc, которые используют для иммунизации и анализов связывания методом ELISA.
Пример 2. Получение Mab против NOTCH3
Самцам мышей A/J (Harlan, Houston, TX) возрастом 8-12 недель подкожно вводят 25 мкг Notch3-EGF/Fc или Notch3-LD/Fc в полном адъюванте Фрейнда (Difco Laboratories, Detroit, MI) в 200 мкл PBS. Через две недели после инъекций и за три дня до умерщвления мышам снова вводят внутрибрюшинно 25 мкг такого же антигена в PBS. В случае каждого гибрида из селезенки иммунизированных мышей получают суспензии отдельных клеток, которые используют для гибридизации с клетками миеломы Sp2/0; 5×108 клеток Sp2/0 и 5×108 клеток селезенки гибридизуют в среде, содержащей 50% полиэтиленгликоля (МВ 1450) (Kodak, Rochester, NY) и 5% диметилсульфоксида (Sigma, St. Louis, MO). Затем концентрацию клеток доводят до 1,5×105 клеток селезенки на 200 мкл суспензии в среде Iscove (Invitrogen, Carlsbad, CA), дополненной 10% фетальной бычьей сывороткой, 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина, 0,1 мкМ гипоксантина, 0,4 мкМ аминоптерина и 16 мкМ тимидина. В каждую лунку приблизительно шестидесяти 96-луночных планшетов добавляют двести микролитров клеточной суспензии. Примерно через десять дней культуральные супернатанты отделяют и анализируют на антитело-связывающую активность методом ELISA.
96-луночные плоскодонные планшеты для микроанализа Immulon II (Dynatech, Laboratories, Chantilly, VA) покрывают, используя 100 мкл Notch3-EGF/Fc или Notch3-LD/Fc (0,1 мкг/мл) в (PBS), содержащие 1× феноловый красный и 3-4 капли pHix/литр (Pierce, Rockford, IL), и инкубируют в течение ночи при комнатной температуре. После удаления покрывающего раствора путем стряхивания планшета, в каждую лунку добавляют 200 мкл блокирующего буфера, содержащего 2% BSA в PBST и 0,1% мертиолята, и инкубируют один час, чтобы блокировать неспецифическое связывание. Затем лунки промывают PBST. Пятьдесят микролитров культурального супернатанта из каждой лунки, содержащей гибрид, собирают и смешивают с 50 мкл блокирующего буфера, поле чего добавляют в отдельные лунки микротитровальных планшетов. После часа инкубации лунки промывают PBST. Затем связанные мышиные антитела детектируют путем взаимодействия с конъюгированными с пероксидазой хрена (HRP) Fc-специфическими козлиными антителами против мышиных IgG (Jackson ImmunoResearch Laboratories, West Grove, PA). В лунки добавляют раствор субстрата HRP, содержащий 0,1% 3,3,5,5-тетраметилбензидина и 0,0003% пероксида водорода, после чего окрашивание развивается в течение 30 минут. Реакцию завершают путем добавления 50 мл 2 M H2SO4/лунку. Значения OD при 450 нм прочитывают с помощью планшет-ридера ELISA (Molecular Devices, Sunnyvale, CA).
Из 185 выделенных и анализированных гибридом один гибридомный клон, полученный из мышей, иммунизированных Notch3-LD/Fc, генерирует агонистическое антитело против Notch3 256A-13, которое дополнительно характеризуют. Метод ELISA проводят с использованием супернатанта гибридомного клона, продуцирующего MAb 256A-13. Результаты показывают высокую связывающую активность по отношению к очищенному гибридному белку Notch3 LD/FC, который использовался для иммунизации, и отсутствие связывания с человеческим Notch1-LD/Fc (LIN/домен димеризации, гибридизованный с участком Fc по карбоксильному концу) или контрольным человеческим белком Fc (данные не приведены) (таблица 1).
Значения OD для 256A-13, полученные методом ELISA с использованием гибридомного супернатанта
Гибридомный клон, положительный по результатам первичного скрининга ELISA, далее выделяют путем сортировки отдельных колоний и проводят вторичный анализ ELISA, как описано выше, чтобы подтвердить способность специфически связываться с выбранным иммуногеном. Утвержденный гибридомный клон выращивают в культуре более крупного масштаба. Моноклональные антитела (MAb) выделяют из среды указанных крупномасштабных культур с помощью аффинной колонки с белком A. Затем агонистические MAb против Notch3 характеризуют с помощью клеточных анализов связывания, микроскопии, вестерн-блоттинга и анализа FACS.
Пример 3. Клеточные анализы связывания Mab против NOTCH3
Для проведения клеточных анализов связывания, используемых для характеристики MAb против Notch3, требуется клонирование полноразмерной открытой рамки считывания человеческого Notch3 в векторе, в данном случае, pcDNA3.1/Hygro (Invitrogen, Carlsbad, CA). Участок, кодирующий Notch3, синтезируют методом ОТ-ПЦР, используя РНК опухоли печени человека (Ambion, Inc., Austin, TX) в качестве матрицы. Полученная конструкция плазмиды Notch3/Hygro, экспрессирует полноразмерный белок Notch3, как показано на фиг.1. Стабильную клеточную линию, экспрессирующую Notch3, получают путем трансфекции плазмидной конструкции Notch3/Hygro в клетки 293T (ATCC № CRL-11268) с использованием набора Lipofectamine 2000 по способу, описанному в примере 1. После трансфекции клетки культивируют в питательной среде DMEM в течение ночи, затем снова высевают в питательную среду, содержащую 200 мкг/мл гигромицина, и культивируют в течение 12-14 дней. Выделенные отдельные колонии сортируют и выращивают в отдельных лунках до достаточного увеличения числа клеток клонов. Стабильные клоны 293T, устойчивые к гигромициновой селекции и экспрессирующие высокие уровни белка Notch3, идентифицируют методами вестерн-блоттинга и флуоресцентной электронной микроскопии с использованием поликлональных антитела против Notch3 (R&D Systems, Minneapolis, MN).
Плазмиду экспрессии фрагмента Notch3, содержащую только Notch LIN12/домен димеризации (LD) и трансмембранный (TM) домен, также конструируют методом ПЦР и субклонируют в векторе pcDNA3.1.
Человеческую клеточную линию Sup-T1 (ATCC № CRL-1942), в естественном состоянии экспрессирующую Notch3, также анализируют методом вестерн-блоттинга. Клетки Sup-T1 выращивают в среде RPMI1640, содержащей 10% фетальной телячей сыворотки, 2 мМ глутамина и 1× раствор эссенциальных аминокислот.
Клеточный анализ связывания антитела проводят, используя FMATTM (флуоресцентный макроконфокальный скрининг с высокой пропускной способностью) с помощью системы 8100 HTS (Applied Biosystems, Foster City, CA) в соответствии с инструкциями производителя. Клеточные линии, в естественном состоянии экспрессирующие Notch3 или стабильно трансфицированные конструкциями экспрессии Notch3, высевают в 96-луночные планшеты. Альтернативно, транзиторно трансфицированные клетки 293T или CHO высевают в 96-луночный планшет. Клетки высевают с плотностью 30000-50000 клеток на лунку. Через 20-24 часов в лунки добавляют MAb против Notch3 и реакционный буфер 1× PBS и инкубируют один час при 37°C. После удаления первичных антител в лунки добавляют Cy-5-конъюгированные антитела против мышиных IgG.
Клеточный анализ связывания антитела также проводят с помощью клеточного сортера с активацией флуоресценции (FACS), используя сгенерированную внутри стабильную клеточную линию 293T/Notch3 и две раковые линии, человеческие клеточные линии Sup-T1 и A2780 (UK ECACC номер по каталогу 93112519), обе в естественном состоянии экспрессирующие Notch3 (данные не приведены). Клетки вначале инкубируют с Mab против Notch3 в 1× PBS. После трех промываний клетки инкубируют со вторичным антителом, конъюгированным с флуоресцентной молекулой. Клетки ресуспендируют, фиксируют в 1× PBS 0,1% раствором парафармальдегида и анализируют методом FACS (BD Sciences, Palo Alto, CA). Результаты показывают, что 256A-13 связывает рецептор Notch3, экспрессированный либо с использованием рекомбинантных плазмидных конструкций, либо как нативный белок в культивируемых клетках (таблица 2). Транзиторно трансфицированные клетки 293T, содержащие плазмиду Notch3/Hygro, также окрашивают иммунофлуоресцентным красителем, как описано выше, и анализируют методом флуоресцентной микроскопии.
Клеточные анализы FMAT и FACS подтверждают, что MAb 256A-13 действительно связывают рецептор Notch3, экспрессированный либо с использованием рекомбинантных плазмидных конструкций, либо как нативный белок в культивируемых клетках (таблица 2 и таблица 3).
Суммарные результаты клеточного анализа связывающей активности MAb против Notch3 методом FMAT
Положительный сигнал связывания, полученный при анализе методом FMAT, значительно превышает сигнал, полученный от контрольных IgG1 и от других отрицательных гибридомных клонов (p>0,01). Значения связывания контрольных IgG1 считаются фоном. Клетки 293T, транзиторно трансфицированные плазмидой Notch3/Hygro, также окрашивают иммунофлуоресцентным красителем, как описано выше, и анализируют методом флуоресцентной микроскопии.
Сродство связывания MAb 256A-13 анализируют с помощью системы Biacore (Biacore Inc., Piscataway, NJ). Антитело непосредственно иммобилизуют на чипе путем конденсации амина (уровень иммобилизации: 200 RU), после чего белок Notch3-LD/Fc (антиген) вводят в 5 разных концентрациях (варьирующих от 37,5 до 120 нМ со временем ассоциации в интервале 5-8 минут и временем диссоциации в интервале от 1 до 2 часов). В качестве подвижного буфера и буфера для образца используют PBS, содержащий 5 мМ Ca2+. Поверхность чипа регенерируют 10 мМ глицином, pH 2. Антитело характеризуют с использованием двойных повторов. В таблице 4 приведены статистическое значение, стандартные ошибки и расчетное значение кинетической константы диссоциации (KD). Антитело имеет высокое сродство, характеризующееся KD 280 пМ, и низкую скорость обратной реакции. Стандартные ошибки и хи-квадрат имеют низкие значения и хорошее совпадение (динамическая кривая не показана).
Анализ сродства связывания MAb 256A-13 с использованием Biacore
Пример 4. Анализ связывающей активности 256A-13 методом вестерн-блоттинга
Вестерн-блоттинг проводят, чтобы определить связывающую активность 256A-13 в отношении рецептора Notch3 в денатурирующих условиях, а также уровни экспрессии Notch3 и других родственных Notch белков в клеточных линиях млекопитающих. Очищенный гибридный белок Notch3-LD/Fc объединяют с буфером для загрузки белка. Образцы белка также получают из транзиторно или стабильно трансфицированных клеток, описанных в примере 1, которые собирают из чашек для культивирования, промывают один раз PBS, ресуспендируют в буфере для общего экстракта клеточных белков (Pierce, Rockford, IL) и нагревают при 100°C в течение 10 минут после добавления равного объема 2× буфера для загрузки белкового образца. Все образцы разделяют методом электрофореза в 4-15% градиенте SDS-PAGE. Белки переносят из геля на мембрану PVDF, а 256A-13 наносят на мембрану для вестерн-блоттинга в качестве первичного детекционного антитела. Вторичное антитело, конъюгированное с HRP, используют для детекции и генерирования сигнала с использованием хемилюминисцентного субстрата, как описано выше. Антитела против человеческих Fc, V5 tag, Notch3 и Notch1, используемые в качестве положительного контроля, получают от Invitrogen, R&D Systems, Santa Cruz Biotechnologies, и Orbigen.
Анализ методом вестерн-блоттинга демонстрирует, что MAb 256A-13 связывается с Notch3-LD/Fc в денатурирующих условиях, а также в нативной конформации молекулы, как показано с помощью анализов ELISA и FACS.
Пример 5. Анализ функциональных возможностей 256A-13 с использованием люциферазного репортера
A. Плазмидные конструкции
С помощью секвенирования проверяют последовательность конструкции для экспрессии полноразмерного Notch3, описанной выше в примере 3, и подтверждают ее идентичность опубликованной последовательности, изображенной на фиг.1. Экспрессию Notch3 подтверждают путем транзиторной трансфекции и вестерн-блоттинга, как описано в примере 4.
Чтобы получить люциферазную репортерную плазмиду для сигнального пути Notch, синтезируют два комплементарных олигонуклеотидных праймера, содержащих тандемные повторы связывающего мотива CBF1, которые имеют следующие последовательности:
5'GCTCGAGCTCGTGGGAAAATACCGTGGGAAAATGAACCGTGGGAAAATCTCGTGG (SEQ ID NO 12)
5'GCTCGAGATTTTCCCACGAGATTTTCCCACGGTTC (SEQ ID NO 13)
Два полученных олигонуклеотидных праймера отжигают при 65°C в 100 мМ NaCl при концентрации каждого олигонуклеотида 4 мМ. После отжига друг с другом праймеры удлиняют методом ПЦР. Продукт ПЦР клонируют в коммерчески доступном векторе. Методом секвенирования проверяют вставку, которая содержит четыре тандемных повтора связывающего мотива CBF1 и два фланкирующих участка XhoI. Вставку вырезают, используя XhoI, и лигируют ниже последовательности, кодирующей желтовато-красный люциферазный репортер. После анализа люциферазного репортера и секвенирования плазмидные клоны с восемью повторами связывающего мотива CBF1 отбирают и обозначают CBF1-Luc.
B. Получение стабильной клеточной линии
Две стабильные клеточные линии получают для функциональных анализов с использованием клеточных линий почек эмбрионов человека (HEK293). Одна клеточная линия содержит Notch3-экспрессирующую плазмиду и репортерную плазмиду CBF1-Luc, интегрированную в ядерный геном. Данную клеточную линию получают путем совместной трансфекции Notch3/гигромицина и плазмид CBF1-LUC в клетки 293T с использованием LipoFectamine 2000 в соответствии с инструкциями производителя. Стабильно трансфицированные клеточные клоны подвергают селекции против 200 мкг/мл гигромицина в питательной среде DMEM и скринингу путем анализа люциферазного репортера и вестерн-блоттинга. Клеточную линию с относительно высоким уровнем экспрессии рецептора Notch3 (по данным вестерн-блоттинга) и активности люциферазы отбирают для применения в функциональных анализах и обозначают NC85.
C. Анализ люциферазного репортера с использованием только клеток со сверхэкспрессией Notch3
Клетки NC85 культивируют в присутствии MAb 256-A13 в течение 24-48 часов. Затем среду удаляют аспирацией, клетки лизируют в 1× буфере для пассивного лизиса (E1501, Promega, Madison, WI), и анализируют активность люциферазы, используя систему для анализа люциферазы в соответствии с инструкциями производителя (E1501, Promega, Madison, Wl), с помощью люминометра TD-20/20 (Turner Designs Instrument, Sunnyvale, CA). Как показано на фиг.5, в клетках NC85, культивированных в присутствии MAb 256-A13, активность люциферазы почти в 4 раза выше, чем в присутствии контрольного антитела G3. Анализ люциферазного репортера показывает, что MAb 256-A13 вызывает сильное снижение активности люциферазы в отсутствии связывания лиганда, в отличие от агонистических антител против Notch3 MAb 256A-4 и 256A-8 (фиг.5).
Пример 8. Картирование связывающего эпитопа 256A-13
A. Стратегия картирования эпитопа и рациональное применение конструкций гибридных белков однодоменного Notch3 и Fc
LIN12/домены гетеродимеризации Notch3, также называемые LIN12-домен димеризации Notch3 (Notch3-LD), состоят из трех доменов LIN12, 1ый LIN12 (L1), 2ой LIN12 (L2) и 3ий LIN12 (L3) (см. фиг.10). Получают пять конструкций экспрессии гибридного белка однодоменный Notch3/Fc (фиг.7) и проводят вестерн-блоттинг, чтобы определить, какой домен является достаточным для связывания MAb 256A-13. После транзиторной трансфекции супернатанты, содержащие секретируемые гибридные белки однодоменный Notch3/Fc, анализируют методом SDS-PAGE. Результаты показывают, что MAb 256A-13 связывается только с Notch3-L1 и не связывается с другими доменами. Анализ ELISA также показывает, что MAb 256A-13 очень сильно связывается с Notch3-L1, слабо связывается с Notch3-L3 и не связывается с другими доменами (таблица 5).
A. Идентификация связывающего эпитопа (эпитопов) путем перетасовки субдоменов
Во-первых, агонистическое MAb против Notch3, 256A-13, связывается с LIN12/доменом димеризации (LD) Notch3, но не с гомологичным человеческим LIN12/доменом димеризации Notch1 (таблица 5). Во-вторых, MAb против Notch3 связывается с денатурированным Notch3 в вестерн-блоттинге, как описано в примерах 4 и 8, показывая, что 256A-13 связывается с одним эпитопом или с разными эпитопами, независимо друг от друга. В-третьих, Notch3 и Notch1 имеют приблизительно 55% гомологии аминокислотных последовательностей по LIN12/домену димеризации, следовательно, можно сделать вывод, что перетасовка субдоменов между Notch3 и Notch1 в данном участке не нарушает конформации белка. кДНК Notch1-LD амплифицируют с помощью стандартных методов ПЦР. Первую цепь матрицы кДНК синтезируют, используя общую РНК из клеток PA-1 (ATCC № CRL-1572). Последовательность, кодирующую лидерный пептид каппа-цепи человеческого IgG, амплифицируют методом ПЦР, присоединяют к 5'-концу Notch1-LD методом PCR-SOE и субклонируют в His-γ1 Fc/pSec.
Значения OD ELISA, полученные для MAb 256A-13 и контрольного IgG1, связывающихся с Notch3-LD/Fc или Notch1-LD/Fc
B. Получение конструкций гибридных белков с перетасовкой доменов
Испольуя результаты анализа ELISA, представленные выше в разделе A, целевой домен 1ого домена LIN12, или L1, дополнительно делят на три субдомена и отдельно перетасовывают их с соответствующими субдоменами Notch1-L1. Конструкции с перетасовкой доменов получают методом PCR-SOE (Ho, et al., Gene 77:51 (1989); Horton, et al., BioTechniques 8:528 (1990)), как показано на фиг.9 и 10. Реакции ПЦР и PCR-SOE проводят с использованием 1 M бетаина и 5% DMSO, которые добавляют в реакционную смесь. Конечный продукт PCR-SOE субклонируют и его последовательность проверяют секвенированием. Плазмидный клон с правильной последовательностью вставки расщепляют NheI и XhoI и вырезают вставку, которую подвергают очистке в геле и субклонируют. Пять конструкций с перетасовкой субдоменов Notch3/Notch1 показаны на фиг.7. Чтобы облегчить эпитопное картирование, в конструкциях с перетасовкой доменов в качестве лидерного пептида используют сигнальный пептид каппа цепи человеческого IgG. Аминокислотные последовательности конструкций субдоменов показаны на фиг.10.
C. Экспрессия гибридного белка с перестановкой субдоменов Notch3/Notch1
Плазмиды с перестановкой доменов Notch3/Notch1-LD транзиторно трансфицируют в клетки CHO с использованием LipoFectamine 2000. Клетки CHO высевают в питательную среду DMEM, содержащую 10% FCS, в количестве 0,8-1×106 клеток на лунку в 6-луночный планшет и держат в инкубаторе CO2 в течение ночи перед трансфекцией. После трансфекции клетки восстанавливают в питательной среде в течение примерно 3 часов, затем среду меняют на DMEM, содержащую 2% FCS, и культивируют в течение трех дней. Кондиционированную среду собирают и центрифугируют при 3500 об/мин в течение 10 минут. Супернатант, содержащий белок Notch3-LD с перестановкой доменов, секретирующийся из клеток CHO, собирают и готовят препараты для анализов связывания методами вестерн-блоттинга и ELISA. ELISA показывает, что все гибридные белки с перестановкой доменов экспрессируются и секретируются в кондиционированную среду (таблица 4), что также подтверждается результатами вестерн-блоттинга (данные не показаны). Результаты ELISA, полученные с использованием антитела против человеческого Fc в качестве детекционного антитела, показывают, что все белки экспрессируются в кондиционированную среду. В качестве контроля используют человеческий IgG/Fc. Исходная концентрация человеческого IgG/Fc, наносимого в каждую лунку, составляет 100 нг.
D. Анализ связывания эпитопа методом ELISA
96-луночные плоскодонные планшеты для микроанализов Immulon II (Dynatech, Laboratories, Chantilly, VA) покрывают антителом против человеческого Fc (Jackson ImmunoResearch) путем добавления 100 мкл раствора антитела (0,1 мкг/мл) в забуференном фосфатом физиологическом растворе (PBS), содержащем 1× феноловый красный и 3-4 капли pHix/литр (Pierce, Rockford, IL), и инкубируют в течение ночи при комнатной температуре. После удаления покрывающего раствора путем стряхивания планшета, в каждую лунку добавляют 200 мкл блокирующего буфера, содержащего 2% BSA в PBST и 0,1% мертиолята, и инкубируют один час, чтобы блокировать неспецифическое связывание. Затем лунки промывают PBST. Пятьдесят микролитров вышеуказанной кондиционированной среды от каждой трансфекции конструкции Notch3/Notch1 с перестановкой доменов собирают, смешивают с 50 мкл блокирующего буфера и добавляют в отдельные лунки титрационных микропланшетов. После инкубации в течение одного часа белок Notch3/Notch1-LD с перестановкой доменов улавливается нанесенным антителом против Fc, и затем лунки промывают PBST. MAb против Notch3 и контрольные MAb соответствующего изотипа подвергают серийным разведениям блокирующим буфером, как указано выше, после чего в каждую лунку добавляют 50 мкл разбавленных MAb и анализируют связывание со связанным белком Notch3/Notch1 с перестановкой доменов. Для детекции используют конъюгированные с пероксидазой хрена (HRP) Fc-специфические козлиные антитела против мышиных IgG. В лунки добавляют раствор субстрата HRP, содержащий 0,1% 3,3,5,5-тетраметилбензидина и 0,0003% пероксида водорода, после чего окрашивание развивается в течение 30 минут. Реакцию завершают путем добавления 50 мл 2 M H2SO4/лунку. Значения OD при 450 нм прочитывают с помощью ридера ELISA. Конструкции с переставленными доменами и кластеры мутаций анализируют подобным образом с помощью описанного выше метода ELISA.
Анализы связывания методом ELISA с использованием MAb 256A-13 против белков с переставленными доменами показывают, что перестановка 1ого субдомена из домена Notch3-L1 (L1) не влияет на связывание, свидетельствуя о том, что 256A-13 не связывается с данным участком. С другой стороны, перестановки 2ого и 3его субдоменов Notch3-L1 значительно уменьшают связывание. Следовательно, эти два субдомена содержат эпитоп (эпитопы), связывающийся с MAb 256A-13 (фиг.10). И наоборот, по данным ELISA, используемое в качестве отрицательного контроля антитело соответствующего изотипа, G3, не связывается ни с одним гибридным белком, полученным путем перестановки доменов (фиг.10). Описанные выше анализы позволяют сделать вывод, что 1ый домен LIN12 необходим для связывания MAb 256A-13, особенно участок, содержащий 2ой и 3ий субдомены.
Чтобы дополнительно картировать конкретный эпитоп, который связывает MAb 256A-13, 2ой и 3ий субдомены домена Notch3-L1 делят на пять аминокислотных кластеров, которые переставляют с соответствующими аминокислотными остатками Notch1 (фиг.10). Анализ связывания методом ELISA показывает, что перестановка из DRE (последовательность Notch3) в SQL (последовательность Notch1) полностью устраняет связывающую активность по данным ELISA, указывая на то, что только этот эпитоп необходим для связывания MAb 256A-13 в домене Notch3-L1.
Точечный анализ аминокислотных остатков, необходимых для связывания MAb 256A-13, проводят путем ди-аланинового сканирования пептида. Аланиновыми пептидами накрывают эпитоп DRE, картированный путем аминокислотной перестановки. Пептид синтезируют в виде пятна, поперечно связанного с нейлоновой мембраной-подложкой. Связывание антитела с пятном анализируют методом дот-блоттинга. В качестве контрольного IgG1 используют MAb G3. Пептидные последовательности представлены на фиг.11.
Пример 9. Секвенирование Mab против NOTCH3
Поскольку связывающие свойства антитела полностью определяются вариабельными участками тяжелой и легкой цепи, вариабельные последовательности 256A-13 секвенируют после отнесения к подтипу. Подтип антитела IgG определяют с помощью набора мышиных моноклональных антител Isostrip (Roche Diagnostics, Indianapolis, IN). Результаты показывают, что 256A-13 имеет тяжелую цепь IgG1 и легкую цепь каппа.
Последовательности вариабельных участков тяжелой и легкой цепи декодируют посредством ОТ-ПЦР и клонирования кДНК. Общую РНК из гибридомных клонов 256A-13 выделяют с использованием набора RNeasy Mini в соответствии с инструкциями производителя (Qiagen Sciences, Valencia, CA). Первую цепь кДНК синтезируют, используя матрицу РНК и набор Superscriptase III. Вариабельные участки легкой и тяжелой цепей кДНК амплифицируют методом ПЦР на основе первой цепи кДНК, используя вырожденные прямые праймеры, соответствующие 5'-концу кодирующего участка мышиной цепи каппа, и обратный праймер, совпадающий с константным участком в области соединения с 3'-концом вариабельного участка, или с использованием вырожденных прямых праймеров, соответствующих 5'-концу кодирующего участка мышиной тяжелой цепи, и обратного праймера, соответствующего константному участку мышиной тяжелой цепи. Продукт ПЦР клонируют в коммерчески доступном векторе и секвенируют путем Lone Star Lab (Houston, TX). Нуклеотидные последовательности анализируют, используя компьютерное программное обеспечение DNAStar (DNASTAR, Inc., Madison, Wl). При определении последовательности каждого MAb против Notch3 используют последовательности из нескольких клонов ПЦР, полученных из одного гибридомного клона.
Вариабельный участок тяжелой цепи Mab 256A-13 содержит 121 аминокислотный остаток, а вариабельный участок легкой цепи содержит 102 аминокислотных остатка (фиг.4A и 4B).
Пример 10. Влияние агонистических антител против NOTCH3 на расщепление NOTCH3 под действием металлопротеазы
Активация рецептора Notch включает в себя индуцированное лигандом расщепление под действием металлопротеазы по околомембранному участку (S2) с образованием внеклеточной субъединицы. Данное расщепление является необходимым условием для расщепления S3 с высвобождением активированного внутриклеточного участка Notch. Чтобы определить, действительно ли агонистические антитела могут индуцировать лиганд-независимые последовательные события активации Notch, включающие в себя два протеолитических расщепления, клетки 293T, стабильно экспрессирующие рекомбинантный рецептор Notch3 (клетки NC85), обрабатывают либо G3, либо 256-A13. Растворимые внеклеточные субъединицы, образующиеся в результате протеолитического расщепления и поступающие в культуральную среду, детектируют методом ELISA с использованием связанного с твердой поверхностью антитела, распознающего продукт расщепления Notch3. Как показано на фиг.6, агонистическое MAb против Notch3 значительно увеличивает поступление растворимых внеклеточных субъединиц Notch3 в кондиционированную среду, в отличие от контрольного антитела G3.
Пример 12. Диагностика NOTCH3-ассоциированных заболеваний
Чтобы диагностировать другие Notch3-ассоциированные заболевания, можно секвенировать ген Notch3 из образцов пациентов, или провести иммуногистохимический анализ, позволяющий выявить пониженную экспрессию рецептора Notch3 в ткани пациента. Кроме того, можно выделить и культивировать клетки пациента, предположительно имеющего Notch3-ассоциированное заболевание, и исследовать влияние агонистического антитела настоящего изобретения на сигнальный путь Notch3.
Для специалистов в данной области очевидны, или специалисты в данной области могут установить с помощью не более чем рутинного экспериментирования, многочисленные эквиваленты конкретных воплощений настоящего изобретения, описанных в данном документе. Такие эквиваленты входят в объем нижеследующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА-АНТАГОНИСТЫ ПРОТИВ Notch3 И ИХ ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СВЯЗАННЫХ С Notch3 ЗАБОЛЕВАНИЙ | 2007 |
|
RU2493167C2 |
| АНТИТЕЛА ПРОТИВ МИЕЛИН-АССОЦИИРОВАННОГО ГЛИКОПРОТЕИНА (MAG) | 2003 |
|
RU2303461C9 |
| НОВЫЕ АНТИ-IL 13 АНТИТЕЛА И ИХ ИСПОЛЬЗОВАНИЕ | 2004 |
|
RU2487887C2 |
| АНТИТЕЛА ПРОТИВ NOTCH1 | 2011 |
|
RU2622083C2 |
| ИММУНОТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ ЗАБОЛЕВАНИЙ В-КЛЕТОК И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ С ПРИМЕНЕНИЕМ КОНЪЮГИРОВАННЫХ И НЕКОНЪЮГИРОВАННЫХ АНТИТЕЛ, КОМБИНАЦИЙ АНТИТЕЛ И СЛИТЫХ БЕЛКОВ | 2003 |
|
RU2335297C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕСЯ С PSL PSEUDOMONAS, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2708977C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ IL-21 ЧЕЛОВЕКА | 2008 |
|
RU2504552C2 |
| АНТИТЕЛА ПРОТИВ ИНТЕРФЕРОНА-АЛЬФА | 2002 |
|
RU2314317C2 |
| АНТИТЕЛА ЧЕЛОВЕКА ПРОТИВ СЕМАФОРИНА 4D | 2018 |
|
RU2776443C2 |
| НОВЫЕ МОДУЛЯТОРЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2592672C9 |






























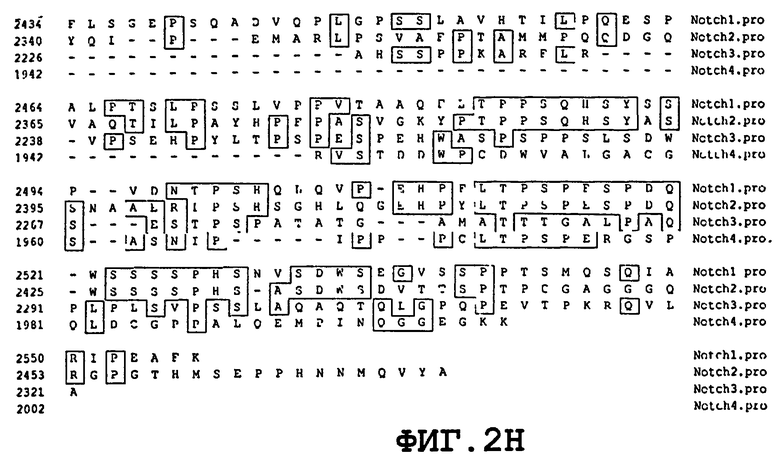
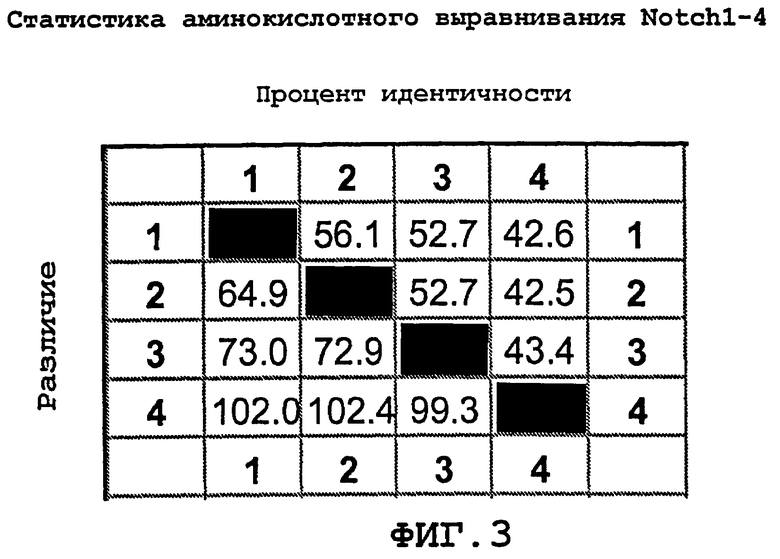


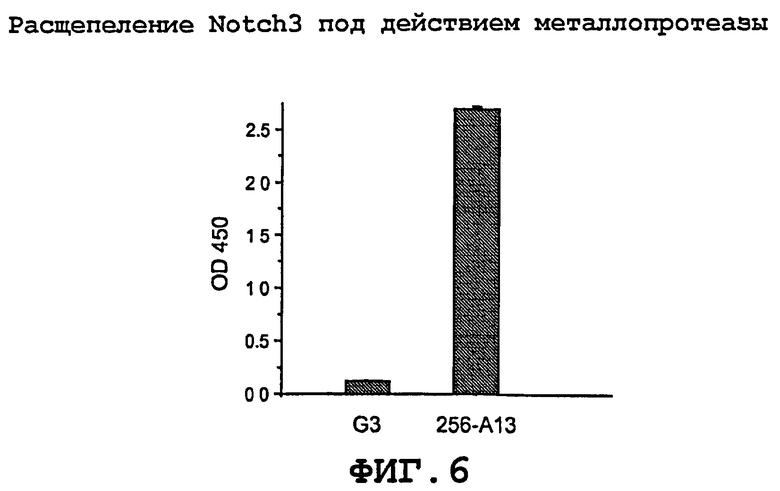
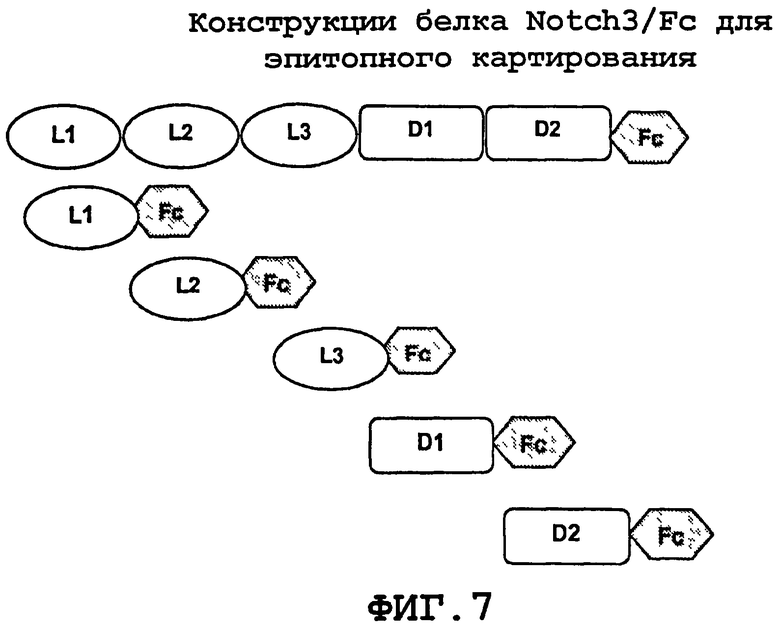

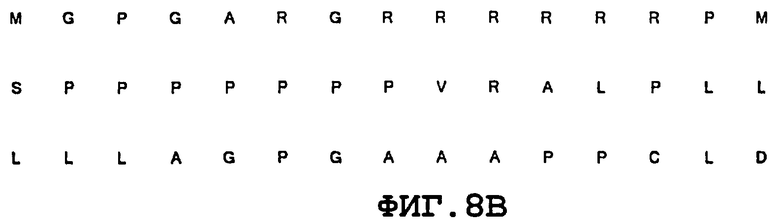




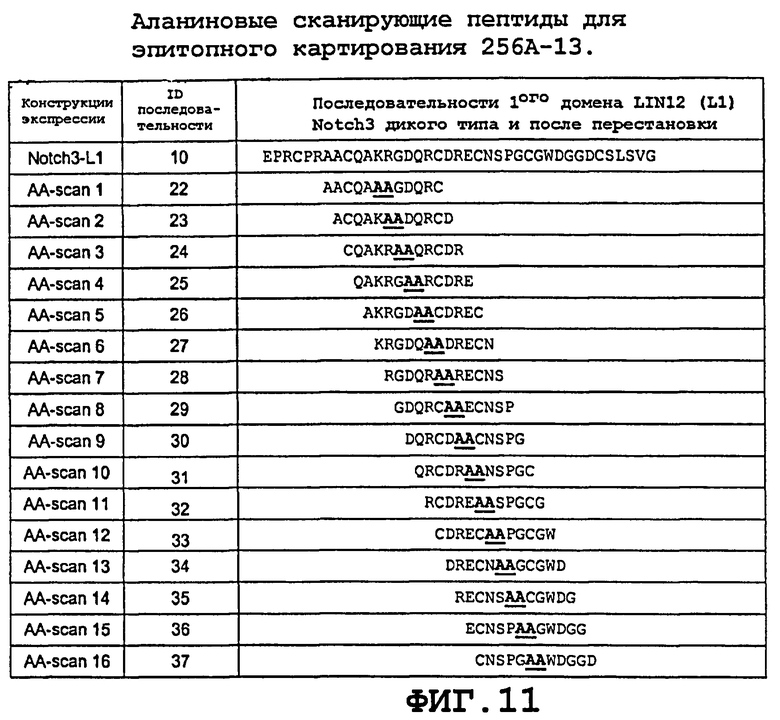
Настоящее изобретение относится к иммунологии и биотехнологии. Предложены: агонистическое антитело или его функционально активный фрагмен, которые специфически связываются с эпитопом, содержащим первый домен Lin12 Notch3, и активируют сигнальный путь Notch3. Описано меченое антитело и гуманизированное антитело на их основе. Предложены: кодирующая нуклеиновая кислота, клетка для получения антитела, содержащая указанную НК, а также вектор экспрессии. Описан способ получения антител путем культивирования клетки. Раскрыто применение антител для изготовления лекарственного средства для лечения Notch3-ассоциированных заболевания или нарушения. Описано применение антител для диагностики Notch3-ассоциированного заболевания или нарушения. Использование изобретения может найти применение в медицине в лечении и диагностике заболеваний CADASIL. 13 н. и 13 з.п. ф-лы, 11 ил., 6 табл., 11 пр.
1. Моноклональное антитело, которое специфически связывается с аминокислотами 1384-1503 аминокислотной последовательности Notch3 (SEQ ID NO:1), где антитело содержит последовательность вариабельной тяжелой (VH) цепи, включающей последовательности SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6, и последовательность вариабельной легкой (VL) цепи, включающей последовательности SEQ ID NO:7, SEQ ID NO:8 и SEQ ID NO:9, или его функционально активный фрагмент.
2. Антитело или его фрагмент по п.1, где последовательность VH-цепи включает последовательность SEQ ID NO:2.
3. Антитело или его фрагмент по п.1, где последовательность VL-цепи включает последовательность SEQ ID NO:3.
4. Антитело или его фрагмент по п.2, где последовательность VL-цепи включает последовательность SEQ ID NO:3.
5. Антитело или его фрагмент по п.1, где антитело или его фрагмент специфически связывается с эпитопом, включающим последовательность SEQ ID NO:10.
6. Антитело или его фрагмент по п.1, где антитело или его фрагмент специфически связывается с эпитопом, включающим последовательность SEQ ID NO:11.
7. Антитело или его фрагмент по п.1, где антитело или его фрагмент имеет сродство связывания, характеризующееся Kd от 10-8 до 10-10 М.
8. Антитело или его фрагмент по п.1, где антитело или его фрагмент активирует опосредованный Notch3 сигнальный путь.
9. Меченое антитело или его фрагмент, специфически связывающийся с аминокислотами 1384-1503 аминокислотной последовательности Notch3 (SEQ ID NO:1), включающее антитело или его фрагмент по любому из пп.1-8 и метку.
10. Гуманизированное антитело или его фрагмент, специфически связывающийся с аминокислотами 1384-1503 аминокислотной последовательности Notch3 (SEQ ID NO:1), которое представляет гуманизированнную форму антитела или его фрагмента по п.4.
11. Гуманизированное антитело или его фрагмент по п.10, где антитело или его фрагмент специфически связывается с эпитопом, включающим последовательность SEQ ID NO:10.
12. Гуманизированное антитело или его фрагмент по п.10, где антитело или его фрагмент специфически связывается с эпитопом, включающим последовательность SEQ ID NO:11.
13. Гуманизированное антитело или его фрагмент по п.10, где гуманизированное антитело или его фрагмент имеет сродство связывания, характеризующееся Kd от 10-8 до 10-10 М.
14. Гуманизированное антитело или его фрагмент по п.10, где гуманизированное антитело или его фрагмент активирует опосредованный Notch3 сигнальный путь.
15. Нуклеиновая кислота, кодирующая антитело или его фрагмент по п.1.
16. Вектор экспрессии, содержащий нуклеиновую кислоту по п.15.
17. Клетка, содержащая нуклеиновую кислоту по п.15 или вектор по п.16, где клетка способна продуцировать антитело или его фрагмент по п.1.
18. Способ получения антитела или его фрагмента, включающий культивирование клетки по п.17 в условиях, подходящих для продуцирования антитела и выделения продуцированного антитела или его фрагмента.
19. Нуклеиновая кислота, кодирующая гуманизированное антитело или его фрагмент по п.10.
20. Вектор экспрессии, содержащий нуклеиновую кислоту по п.19.
21. Клетка, содержащая нуклеиновую кислоту по п.19 или вектор по п.20, где клетка способна продуцировать антитело или его фрагмент по п.10.
22. Способ получения антитела или его фрагмента, включающий культивирование клетки по п.21 в условиях, подходящих для продуцирования антитела и выделения продуцированного антитела или его фрагмента.
23. Применение антитела или его фрагмента по любому из пп.1-14 для изготовления лекарственного средства для лечения Notch3-ассоциированного заболевания или нарушения.
24. Применение по п.23, где заболевание представляет собой нейродегенеративное заболевание.
25. Применение по п.23, где заболевание представляет собой CADASIL, семейную гемиплегическую мигрень (FHM), семейную парокситическую атаксию или синдром Алагилля.
26. Применение антитела или его фрагмента по любому из пп.1-14 для диагностики Notch3-ассоциированного заболевания.
| US 20060002924 А1, 05.01.2006 | |||
| US 20030186290 А1, 02.10.2003 | |||
| JOUTEL et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| - The LANCET, Vol 358, 15.12.2001 | |||
| RU 2003114746/13 A, 22.10.2001. | |||
Авторы
Даты
2012-09-20—Публикация
2007-10-18—Подача