Область изобретения
Настоящее изобретение относится к измененным антителам, которые связываются с миелин-ассоциированным гликопротеином (MAG) и нейтрализуют его функцию, полинуклеотидам, кодирующим такие антитела, фармацевтическим препаратам, содержащим указанные антитела, и к применению таких антител в лечении и/или профилактике неврологических заболеваний. Другие аспекты, объекты и преимущества настоящего изобретения станут понятны из следующего ниже описания.
Предшествующий уровень техники
Инсульт является важной причиной смерти и инвалидности в западном мире. Не существует зарекомендовавшего себя способа лечения инсульта за исключением t-PA (тканевого активатора плазминогена), который необходимо вводить не позже чем через 3 часа с момента начала, после CT (компьютерная томография) сканирования для того, чтобы избежать кровоизлияния. До сегодняшнего дня большая часть терапевтических агентов, направленных на лечение острого инсульта (т.е. нейропротекцию), преимущественно затрагивала целевые глутаматные рецепторы и нисходящие от них сигнальные пути, про которые известно, что они вовлечены в острый некроз клеток. Однако до настоящего времени эти стратегии оказывались неудачными при клинических испытаниях и часто бывают связаны с побочными действиями, ограничивающими дозу (Hill & Hachinski, The Lancet. 352: (suppi III) 10-14 (1998)). Следовательно, существует потребность в новых подходах, направленных на уменьшение гибели клеток после остановки кровотока.
После начала инсульта у многих пациентов наблюдается в некоторой степени спонтанное функциональное восстановление, что свидетельствует о том, что мозг обладает способностью (хотя и ограниченной) восстанавливаться и/или перестраиваться после повреждения. Агенты, которые могут усиливать это восстановление, могут, следовательно, позволить, чтобы вмешательство после начала ишемии мозга осуществлялось позднее (потенциально на несколько суток). Агенты, которые могут обеспечить как нейропротекцию в острой фазе, так и усиление функционального восстановления, могут иметь значительные преимущества по сравнению с другими имеющимися в настоящее время потенциальными стратегиями нейропротекции.
Механизмы, лежащие в основе функционального восстановления, в настоящее время не известны. В качестве одного из возможных механизмов предложен спрутинг поврежденных и неповрежденных аксонов. Однако хотя in vivo исследования показали, что лечение повреждения спинного мозга или инсульта нейротрофическими факторами приводит к усилению функционального восстановления и увеличению степени спрутинга аксонов, они не подтверждают прямую связь между степенью спрутинга аксонов и степенью функционального восстановления (Jakeman, et al. 1998, Exp. Neurol. 154: 170-184, Kawamata et al. 1997, Proc. Natl. Acad. Sci. USA. 94: 8179-8184, Ribotta, et al. 2000, J. Neurosci. 20: 5144-5152). Кроме того, для спрутинга аксонов требуется жизнеспособный нейрон. При таких заболеваниях, как инсульт, который связан с массовой гибелью клеток, усиление функционального восстановления, обеспечиваемое данным агентом после инсульта, следовательно, может осуществляться посредством механизмов, отличных от спрутинга аксонов, таких как дифференциация эндогенных стволовых клеток, активация резервных путей, изменения в распределении рецепторов или возбудимости нейронов или глии (Fawcett & Asher, 1999, Brain Res. Bulletin. 49: 377-391, Homer & Gage, 2000. Nature 407 963-970).
Предполагается, что ограниченная способность центральной нервной системы (ЦНС) восстанавливаться после повреждения частично объясняется наличием в ЦНС окружении молекул, которые обладают ингибиторным действием в отношении спрутинга аксонов (разрастания нейритов). Полагают, что миелин ЦНС содержит ингибиторные молекулы (Schwab M.E. and Caroni P. (1988) J. Neurosci 8, 2381-2193). Два миелиновых белка, миелин-ассоциированный гликопротеин (MAG) и Nogo были клонированы и идентифицированы как предполагаемые ингибиторы разрастания нейритов (Sato S. et al. (1989) Biochem. Biophys. Res. Comm. 163, 1473-1480; McKerracher L. et al. (1994) Neuron 13, 805-811; Mukhopadhyay G. et al. (1994) Neuron 13, 757-767; Torigoe K. and Lundborg G. (1997) Exp.Neurology 150, 254-262; Schafer et al. (1996) Neuron 16, 1107-1113; WO 9522344; WO 9701352; Prinjha R. et al. (2000) Nature 403, 383-384; Chen M.S. et al. (2000) Nature 403, 434-439; GrandPre Т. et al. (2000) Nature 403, 439-444; US 005250414 A; WO 200005364 A1; WO 0031235).
Миелин-ассоциированный гликопротеин представляет собой трансмембранную молекулу клеточной поверхности, экспрессируемую на поверхности миелина, состоящую из пяти внеклеточных иммуноглобулиновых доменов, одного трансмембранного домена и внутриклеточного домена. Экспрессия MAG ограничена миелинизированной глией в ЦНС и периферической нервной системе (ПНС). Предполагают, что MAG взаимодействует с рецептором(ами) нейронов, которые опосредуют воздействия на цитоскелет нейронов, включающие в себя фосфорилирование нейрофиламентов и ингибирование роста неврита in vitro. Хотя предполагалось, что антагонисты MAG полезны для активизации спрутинга аксонов после повреждения (WO 522344, WO 9701352 и WO 9707810), эти заявления не подтверждены in vivo данными. Кроме того, не доказана роль MAG в качестве ингибитора спрутинга аксонов ЦНС нейронов in vivo (Li C.M. et al. (1994) Nature 369, 747-750; Montag, D. et al. (1994) Neuron 13, 229-246; Lassmann H. et al. (1997) GLIA 19, 104-110; Li С et al. (1998) J. Neuro. Res. 51, 210-217; Yin X. et al. (1998) J. Neurosci. 18, 1953-1962; Bartsch U et al. (1995) Neuron 15 1375-1381; Li Metal (1996) 46, 404-414).
Антитела обычно включают в себя две тяжелые цепи, связанные друг с другом дисульфидными связями, и две легкие цепи. Каждая легкая цепь связана с соответствующей тяжелой цепью дисульфидными связями. На одном конце каждой тяжелой цепи имеется вариабельный домен, за которым следует некоторое количество константных доменов. У каждой легкой цепи имеется вариабельный домен на одном конце и константный домен на другом ее конце. Вариабельный домен легкой цепи совмещен с вариабельным доменом тяжелой цепи. Константный домен легкой цепи совмещен с первым константным доменом тяжелой цепи. Константные домены легкой и тяжелой цепей не вовлечены непосредственно в связывание антитела с антигеном.
Вариабельные домены каждой пары легкой и тяжелой цепей образуют антигенсвязывающий сайт. Вариабельные домены легкой и тяжелой цепей имеют одинаковую общую структуру, и каждый домен включает в себя каркас, состоящий из четырех областей, последовательности которых являются относительно консервативными, соединенными тремя определяющими комплементарность областями (CDR), часто называемыми гипервариабельными областями. Четыре каркасные области в значительной степени принимают конформацию бета-складок, и CDR образуют петли, связывающие и в некоторых случаях образующие часть структуры бета-складок. CDR удерживаются в непосредственной близости каркасными областями и вместе с CDR из другого домена участвуют в образовании антигенсвязывающего сайта. CDR и каркасные области антител могут быть определены согласно ссылке Kabat et al. («Sequences of proteins of immunological interest» US Dept. of Health and Human Services, US Government Printing Office, 1987).
Теперь обнаружено, что анти-MAG моноклональное антитело, описанное (Poltorak et al. (1987) Journal of Cell Biology 105, 1893-1899, DeBellard et al. (1996) Mol. Cell. Neurosci. 7, 89-101; Tang et al. (1997) Mol. Cell. Neurosci. 9, 333-346; Torigoe K. and Lundborg G. (1997) Exp.Neurology 150, 254-262) и имеющееся в продаже (МАВ1567 (Chemicon)), при введении как непосредственно в головной мозг, так и внутривенно после очаговой церебральной ишемии у крыс (модель инсульта), обеспечивает нейропротекцию и усиливает функциональное восстановление. Таким образом, анти-MAG антитела представляют собой сильные терапевтические агенты как для нейропротекции в острой фазе, так и для активизации функционального восстановления после инсульта. Это антитело представляет собой мышиное антитело. Хотя мышиные антитела часто используются в качестве диагностических агентов, их полезность в качестве терапевтического средства была подтверждена только в нескольких случаях. Их ограниченное применение частично является следствием того, что повторное введение моноклональных мышиных антител людям обычно вызывает у людей иммунные ответы против этих молекул. Для того чтобы преодолеть эти нежелательные свойства, присущие моноклональным мышиным антителам, «измененные» антитела, сконструированные так, чтобы включать в себя области человеческих антител, были разработаны и получили общее признание в данной области техники. Например, гуманизированное антитело содержит определяющие комплементарность области (CDR), происходящие не от людей, а большая часть остальной структуры происходит от человеческого антитела.
Процесс нейродегенерации лежит в основе многих неврологических заболеваний/расстройств, включая острые заболевания, такие как инсульт, травматическое повреждение головного мозга и повреждение спинного мозга, а также хронические заболевания, включая болезнь Альцгеймера, лобно-височные деменции (таупатии), периферическую невропатию, болезнь Паркинсона, болезнь Гентингтона и рассеянный склероз. Следовательно, анти-MAG моноклональные антитела (mabs) могут быть полезны в лечении этих заболеваний/расстройств посредством уменьшения клеточной гибели, связанной с этими заболеваниями/расстройствами, и активизации функционального восстановления.
Все публикации, как журнальные, так и патентные, описанные в настоящей заявке, прямо и полностью включены в данное описание изобретения посредством ссылки.
Краткое описание сущности изобретения
В данном изобретении предложено измененное антитело или его функциональный фрагмент, которые связываются с MAG и нейтрализуют его, и включают в себя одну или более следующую CDR. CDR идентифицированы, как описано Kabat (Kabat et al. (1991) Sequences of proteins of immunological interest; Fifth Edition; US Department of Health and Human Services; NIH publication №91-3242). CDR предпочтительно являются такими, как определено Kabat, но в соответствии с принципами структуры и укладки белков, определенными Chothia и Lesk (Chothia et al., (1989) Conformations of immunoglobulin hypervariable regions; Nature 342, p.877-883), очевидно, что дополнительные остатки также можно рассматривать в качестве фрагмента антигенсвязывающего центра, и они, таким образом, охваченные настоящим изобретением.
CDR легкой цепи
CDR тяжелой цепи
Настоящее изобретение также относится к антителу, которое связывается с тем же самым эпитопом, что и антитело, имеющее описанные выше CDR. Для картирования эпитопов антигена используют анализы конкурентного ингибирования. Таким образом, также предложено анти-MAG антитело (измененное или неизмененное), которое конкурентно ингибирует связывание с MAG, предпочтительно человеческим MAG, измененного антитела, имеющего описанные выше CDR.
В еще одном аспекте настоящего изобретения предложено измененное антитело или его функциональный фрагмент, которые содержат вариабельный домен тяжелой цепи, который включает в себя одну или более CDR, выбранную из CDRH1, CDRH2 и CDRH3, и/или вариабельный домен легкой цепи, который включает в себя одну или более CDR, выбранную из CDRL1, CDRL2 и CDRL3.
В данном изобретении также предложено измененное анти-MAG антитело или его функциональный фрагмент, которые содержат:
а) вариабельный домен тяжелой цепи (VH), который включает в себя последовательно CDRH1, CDRH2 и CDRH3,
и/или
б) вариабельный домен легкой цепи (VL), который включает в себя последовательно CDRL1, CDRL2 и CDRL3.
В еще одном аспекте данного изобретения предложена фармацевтическая композиция, содержащая измененное анти-MAG антитело по настоящему изобретению или его функциональный фрагмент вместе с фармацевтически приемлемым разбавителем или носителем.
В еще одном аспекте настоящего изобретения предложен способ лечения или профилактики инсульта и других неврологических заболеваний у человека, включающий введение указанному человеку, нуждающемуся в этом, эффективного количества анти-MAG антитела по настоящему изобретению или его функциональных фрагментов.
В еще одном аспекте в данном изобретении предложено применение анти-MAG антитела по данному изобретению или его функционального фрагмента в изготовлении лекарства для лечения или профилактики инсульта и других неврологических заболеваний.
В еще одном аспекте настоящего изобретения предложен способ замедления нейродегенерации и/или активизации функционального восстановления у человека-пациента, страдающего инсультом или другим неврологическим заболеванием, или имеющего риск их развития, включающий введение указанному человеку, нуждающемуся в этом, эффективного количества анти-MAG антитела по настоящему изобретению или его функционального фрагмента.
В еще одном аспекте данного изобретения предложено применение анти-MAG антитела по данному изобретению или его функционального фрагмента в изготовлении лекарства для замедления нейродегенерации и/или активизации функционального восстановления у человека-пациента, пораженного инсультом или другим неврологическим заболеванием, или имеющего риск их развития.
Другие аспекты и преимущества настоящего изобретения описаны ниже в подробном описании и его предпочтительных воплощениях.
Описание графических материалов
Фиг.1: Последовательность тяжелой цепи химерного мышиного/человеческого анти-MAG антитела (Seq ID No. 27).
Фиг.2: Последовательность легкой цепи химерного мышиного/человеческого анти-MAG антитела (Seq ID No. 28).
Фиг.3: Последовательность тяжелой цепи химерного мышиного/человеческого анти-MAG антитела (Seq ID No. 29).
Фиг.4: Химерное анти-MAG антитело связывается с крысиным MAG.
Фиг.5: Последовательности гуманизированных анти-MAG антител.
Фиг.6: Гуманизированные анти-MAG антитела связываются с крысиным MAG.
Фиг.7: Гуманизированные анти-MAG антитела связываются с крысиным MAG.
Фиг.8: Гуманизированные анти-MAG антитела связываются с человеческим MAG.
Фиг.9: Конкурентный ELISA (твердофазный иммуноферментный анализ) с мышиными и гуманизированными анти-MAG антителами.
Подробное описание изобретения
Анти-MAG антитело
Измененное антитело по данному изобретению предпочтительно представляет собой моноклональное антитело (mAb) и предпочтительно является химерным, гуманизированным или переформированным, причем гуманизированное является особенно предпочтительным из перечисленных.
Измененное антитело предпочтительно имеет структуру природного антитела или его фрагмента. Следовательно, антитело может включать в себя полное антитело, (Fab1)2 фрагмент, Fab фрагмент, димер легкой цепи или димер тяжелой цепи. Антитело может представлять собой IgG1, IgG2, IIgG3 или IgG4; или IgM; IgA, IgE или IgD, или его модифицированный вариант. Соответственно может быть выбран константный домен тяжелой цепи антитела. Константный домен легкой цепи может представлять собой константный домен каппа или лямбда. Кроме того, антитело может включать в себя модификации всех классов, например, IgG димеры, Fc мутанты, которые больше не связываются с Fc-рецепторами или опосредуют Clq-связывание (блокирующие антитела). Антитело может также представлять собой химерное антитело описанного в WO 86/01533 вида, которое включает в себя антигенсвязывающую область и неиммуноглобулиновую область. Антигенсвязывающая область представляет собой вариабельный домен легкой цепи или вариабельный домен тяжелой цепи антитела. Обычно антигенсвязывающая область включает в себя вариабельные домены как легкой, так и тяжелой цепи. Неиммуноглобулиновая область слита на своем С-конце с антигенсвязывающей областью. Неиммуноглобулиновая область обычно представляет собой неиммуноглобулиновый белок и может представлять собой фермент, токсин или белок, обладающий известной специфичностью связывания. Две области этого типа химерного антитела могут соединяться через расщепляемую линкерную последовательность. Иммуноадгезины, имеющие описанные выше CDR, также рассматриваются в настоящем изобретении.
Константную область выбирают в соответствии с требуемой функциональностью. Обычно IgG1 демонстрирует литическую способность посредством связывания с комплементом и/или опосредует ADCC (антитело-зависимую клеточную цитотоксичность). Если требуется нецитотоксичное блокирующее антитело, предпочтительным является IgG4. Однако IgG4-антитела могут демонстрировать нестабильность продуцирования и, следовательно, может быть более предпочтительно модифицировать в общем случае более стабильный IgG1. Предложенные модификации описаны в ЕР 0307434, предпочтительные модификации включены в позиции 235 и 237. Таким образом, в данном изобретении предложена литическая и нелитическая формы антитела по данному изобретению.
В предпочтительном аспекте измененное антитело представляет собой IgG, более предпочтительно IgG1 класс.
Следовательно, в предпочтительных формах антитело по данному изобретению представляет собой полноразмерное нелитическое IgG1-антитело, имеющее описанные выше CDR. В наиболее предпочтительных формах авторы данного изобретения предлагают полноразмерное нелитическое IgG1-антитело, имеющее CDR с SEQ ID NO: 13 и 16, и полноразмерное нелитическое IgG1-антитело, имеющее CDR с SEQ ID NO: 15 и 18.
В еще одном аспекте данного изобретения предложены полинуклеотиды, кодирующие CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3. Предпочтительные полинуклеотидные последовательности представляют собой:
CDR легкой цепи
CDR тяжелой цепи
В еще одном аспекте данного изобретения предложен полинуклеотид, кодирующий вариабельную область легкой цепи измененного анти-MAG антитела, включающий в себя по меньшей мере одну CDR, выбранную из CDRL1, CDRL2 и CDRL3, более предпочтительно включающий в себя последовательно все три CDR.
В еще одном аспекте данного изобретения предложен полинуклеотид, кодирующий вариабельную область тяжелой цепи измененного анти-MAG антитела, включающий в себя по меньшей мере одну CDR, выбранную из CDRH1, CDRH2 и CDRH3, более предпочтительно включающий в себя последовательно все три CDR.
В особенно предпочтительном аспекте анти-MAG антитело по данному изобретению представляет собой гуманизированное антитело.
Следовательно, в данном изобретении, кроме того, предложено гуманизированное антитело или его функциональный фрагмент, которое связывается с MAG и нейтрализует его, которое содержит вариабельную область тяжелой цепи, включающую в себя одну из следующих аминокислотных последовательностей:
QVQLVQSGSELKKPGASVKVSCKASGYTFTNYGMNWVRQAPGQGLEWMGWI
NTYTGEPTYADDFTGRFVFSLDTSVSTAYLQISSLKABDTAVYYCARNPIN
YYGINYEGYVMDYWGQGTLVTVSS (SEQ ID No 13).
QVQLVQSGSELKKPGASVKVSCKASGYTFTNYGMNWVRQAPGQGLEWMGWI
NTYTGEPTYADDFTGRFVFSLDTSVSTAYLQISSLKAEDTAVYFCARNPIN
YYGIMYEGYVMDYWGQGTLVTVSS (Sequence ID No 14)
QVQLVQSGSELKKPGASVKVSCKASGYTFTNYGMNWVRQAPGQGLEWMGWI
NTYTGEPTYADDFTGRFVFSLDTSVSTAYLQISSLKAEDTATYFCARNPIN
YYGINYEGYVMDYWGQGTLVTVSS (sequence ID No 15)
В еще одном аспекте данного изобретения предложено гуманизированное антитело или его функциональный фрагмент, которое связывается с MAG, которое содержит вариабельную область тяжелой цепи с Sequence ID No 13, 14 или 15 вместе с вариабельной областью легкой цепи, включающей в себя аминокислотные последовательности Sequence ID No 16, 17, 18 или 19:
DIVMTQSPDSLAVSLGERATINCKSSHSVLYSSNQKHYLAWYQQKPGQPPK
LLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEPVAVYYCHQYLSSLT
FGQGTKLEIKRTV (SEQ ID No 16)
DIVMTQSPDSLAVSLGERATINCKSSHSVLYSSNQKNYLAWYQQKPGQPPK
LLIYWASTRESGVPDRFSGSGSGTDFTLTIINLQABDVAVYYCHQYLSSLT
FGQGTKLEIKRTV (SEQ ID No 17)
DIVMTQSPDSLAVSLGERATINCKSSHSVLYSSYQKNYLAWYQQKPGQPPK
LLIYWASTRESGVPDRFSGSGSGTDFTLTISSLHTEDVAVYYCHQYLSSLT
FGQGTKLEIKRTV (SEQ ID No 18)
DIVMTQSPDSLAVSLGERATINCKSSHSVLYSSNQKNYLAWYQQKPGQPPK
LLIYWASTRESGVPDRFSGSGSGTDFTLTIINLHTEDVAVYYCHQYLSSLT
FGQGTKLEIKRTV (SEQ ID No 19)
В еще одном аспекте настоящего изобретения предложено гуманизированное антитело, содержащее:
вариабельный фрагмент тяжелой цепи, включающий в себя SEQ ID No 13, 14 или 15, и константную часть или ее фрагмент тяжелой цепи человека, и
вариабельный фрагмент легкой цепи, включающий в себя SEQ ID No 16, 17, 18 или 19, и константную область или ее фрагмент легкой цепи человека.
В предпочтительном аспекте гуманизированное антитело представляет собой класс IgG, более предпочтительно IgG1.
Предпочтительные антитела по данному изобретению содержат:
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 13, и вариабельную область легкой цепи, включающую в себя Seq ID No 16;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 13, и вариабельную область легкой цепи, включающую в себя Seq ID No 17;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 13, и вариабельную область легкой цепи, включающую в себя Seq ID No 18;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 13, и вариабельную область легкой цепи, включающую в себя Seq ID No 19.
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 14, и вариабельную область легкой цепи, включающую в себя Seq ID No 16;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 14, и вариабельную область легкой цепи, включающую в себя Seq ID No 17;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 14, и вариабельную область легкой цепи, включающую в себя Seq ID No 18;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 14, и вариабельную область легкой цепи, включающую в себя Seq ID No 19.
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 15, и вариабельную область легкой цепи, включающую в себя Seq ID No 16;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 15, и вариабельную область легкой цепи, включающую в себя Seq ID No 17;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 15, и вариабельную область легкой цепи, включающую в себя Seq ID No 18;
Вариабельную область тяжелой цепи, включающую в себя Seq ID No 15, и вариабельную область легкой цепи, включающую в себя Seq ID No 19.
В еще одном аспекте данного изобретения предложены полинуклеотиды, кодирующие вариабельную область тяжелой цепи, включающую в себя Sequence ID No 13, 14 и 15, и вариабельные области легкой цепи, включающие в себя Sequence ID No 16, 17, 18 и 19.
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 13, представляет собой:
CAGGTGCAGCTGGTGCAATCTGGGTCTGAGTTGAAGAAGCCTGGGGCCTCA
GTGAAGGTTTCGTGCAAGGCTTCTGGATACACCTTCACTAACTACGGCATG
AACTGGGTGCGACAGGCCCCTGGACAAGGGCTTGAGTGGATGGGATGGATC
AACACCTACACCGGCGAGCCCACCTACGCCGACGACTTCACCGGCCGGTTT
GTCTTCTCCTTGGACACCTCTGTCAGCACGGCATATCTGCAGATCAGCAGC
CTAAAGGCTGAGGACACTGCCGTGTATTACTGTGCGAGAAACCCCATCAAC
TACTACGGCATCAACTACGAGGGCTACGTGATGGACTACTGGGGCCAGGGC
ACACTAGTCACAGTCTCCTCA (SEQ ID No 20)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность Sequence ID No 14, представляет собой:
CAGGTGCAGCTGGTGCAATCTGGGTCTGAGTTGAAGAAGCCTGGGGCCTCA
GTGAAGGTTTCCTGCAAGGCTTCTGGATACACCTTCACTAACTACGGCATG
AACTGGGTGCGACAGGCCCCTGGACAAGGGCTTGAGTGGATGGGATGGATC
AACACCTACACCGGCGAGCCCACCTACGCCGACGACTTCACCGGCCGGTTT
GTCTTCTCCTTGGACACCTCTGTCAGCACGGCATATCTGCAGATCAGCAGC
CTAAAGGCTGAGGACACTGCCGTGTATTTCTGTGCGAGAAACCCCATCAAC
TACTACGGCATCAACTACGAGGGCTACGTGATGGACTACTGGGGCCAGGGC
ACACTAGTCACAGTCTCCTCA (SEQ ID No 21)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 15, представляет собой:
CAGGTGCAGCTGGTGCAATCTGGGTCTGAGTTGAAGAAGCCTGGGGCCTCA
GTGAAGGTTTCCTGCAAGGCTTCTGGATACACCTTCACTAACTACGGCATG
AACTGGGTGCGACAGGCCCCTGGACAAGGGCTTGAGTGGATGGGATGGATC
AACACCTACACCGGCGAGCCCACCTACGCCGACGACTTCACCGGCCGGTTT
GTCTTCTCCTTGGACACCTCTGTCAGCACGGCATATCTGCAGATCAGCAGC
CTAAAGGCTGAGGACACTGCCACCTATTTCTGTGCGAGAAACCCCATCAAC
TACTACGGCATCAACTACGAGGGCTACGTGATGGACTACTGGGGCCAGGGC
ACACTAGTCACAGTCTCCTCA (SEQ ID No 22)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 16, представляет собой:
GACATCGTGATGACCCAGTCTCCAGACTCCCTGGCTGTGTCTCTGGGCGAG
AGGGCACCATGCAACTGCAAGAGCAGCCACAGCGTGCTGTACAGCAGCAAC
CAGAAGAACTACCTGGCCTGGTACCAGCAGAAACCAGGACAGCCTCCTAAG
CTGCTCATTTACTGGGCATCTACCCGGGAATCCGGGGTCCCTGACCGATTC
AGTGGCAGCGGGTCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAG
GCTGAAGATGTGGCAGTTTATTACTGTCACCAGTACCTGAGCAGCCTGACC
TTTGGCCAGGGGACCAAGCTGGAGATCAAACGTACGGTG (SEQ ID No 23)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 17, представляет собой:
GACATCGTGATGACCCAGTCTCCAGACTCCCTGGCTGTGTCTCTGGGCGAG
AGGGCCACCATCAACTGCAAGAGCAGCCACAGCGTGCTGTACAGCAGCAAC
CAGAAGAACTACCTGGCCTGGTACCAGCAGAAACCAGGACAGCCTCCTAAG
CTGCTCATTTACTGGGCATCTACCCGGGAATCCGGGGTCCCTGACCGATTC
AGTGGCAGCGGGTCTGGGACAGATTTCACTCTCACCATCATCAACCTGCAG
GCTGAAGATGTGGCAGTTTATTACTGTCACCAGTACCTGAGCAGCCTGACC
TTTGGCCAGGGGACCAAGCTGGAGATCAAACGTACGGTG (SEQ ID No 24)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 18, представляет собой:
GACATCGTGATGACCCAGTCTCCAGACTCCCTGGCTGTGTCTCTGGGCGAG
AGGGCCACCATACGCTGCAAGAGCAGCCACAGCGTGCTGTACAGCAGCAAC
CAGAAGAACTACCTGGCCTGGTACCAGCAGAAACCAGGACAGCCTCCTAAG
CTGCTCATTTACTGGGCATCTACCCGGGAUTCCGGGGTCCCTGACCGATTC
AGTGGCAGCGGGTCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAC
ACCGAAGATGTGGCAGTTTATTACTGTCACCAGTACCTGAGCAGCCTGACC
TTTGGCCAGGGGACCAAGCTGGAGATCAAACGTACGGTG (SEQ ID No 25)
Предпочтительная полинуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID No 19, представляет собой:
GACATCGTGATGACCCAGTCTCCAGACTCCCTGGCTGTGTCTCTGGGCGAG
AGGGCCACCATCAAGTGCAAGAGCAGCCACAGCGTGCTGTACAGCAGCAAC
CAGAAGAACTACCTGGCCTGGTACCAGCAGAAACCAGGACAGCCTCCTAAG
CTGCTCATTTACTGGGCATCTACCCGGGAATCCGGGGTCCCTGACCGATTC
AGTGGCAGCGGGTCTGGGACAGATTTCACTCTCACCATCATCAACCTGCAC
ACCGAAGATGTGGCAGTTTATTACTGTCACCAGTACCTGAGCAGCCTGACC
TTTGGCCAGGGGACCAAGCTGGAGATCAAACGTACGGTG (SEQ ID No 26)
«Нейтрализующее» относится к общему или частичному ингибированию функции MAG, включая его связывание с нейронами и ингибирование роста нейрита.
«Измененное антитело» относится к белку, кодируемому областью кодирования измененного иммуноглобулина, который может быть получен посредством экспрессии в выбранной клетке хозяине. Такие измененные антитела включают в себя генно-инженерные антитела (например химерные, переформированные, гуманизированные или векторные антитела) или фрагменты антител, лишенные части или всей иммуноглобулиновой константной области, например Fv, Fab или F(ab)2 и т.п.
"Область, кодирующая измененный иммуноглобулин" относится к последовательности нуклеиновых кислот, кодирующей измененное антитело. Когда измененное антитело представляет собой CDR-трансплантированное или гуманизированное антитело, последовательности, которые кодируют определяющие комплементарность области (CDR) иммуноглобулина, не являющегося человеческим, встраивают в первого иммуноглобулинового партнера, содержащего человеческие вариабельные каркасные последовательности. Возможно, что первый иммуноглобулиновый партнер функциональным образом связан со вторым иммуноглобулиновым партнером.
«Первый иммуноглобулиновый партнер» относится к последовательности нуклеиновых кислот, кодирующей человеческую каркасную или человеческую иммуноглобулиновую вариабельную область, в которой природные (или встречающиеся в природе) CDR-кодирующие области заменены CDR-кодирующими областями донорного антитела. Человеческая вариабельная область может представлять собой тяжелую цепь, легкую цепь (или обе цепи) иммуноглобулина, ее аналог или функциональные фрагменты. Такие CDR области, расположенные в вариабельной области антител (иммуноглобулинов), могут быть известными в данной области техники способами. Например, в Kabat et al. (Sequences of Proteins of Immunological Interest. 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987)) описаны правила расположения CDR. Кроме того, известны компьютерные программы, которые полезны для идентификации CDR областей/структур.
«Второй иммуноглобулиновый партнер» относится к другой нуклеотидной последовательности, кодирующей белок или пептид, с которой слит первый иммуноглобулиновый партнер внутри рамки считывания или посредством возможной общепринятой связывающей последовательности (т.е. связан функциональным образом). Предпочтительно он представляет собой ген иммуноглобулина. Второй иммуноглобулиновый партнер может содержать последовательность нуклеиновых кислот, кодирующую полную константную область того же самого (т.е. гомологичного - первое и второе измененное антитело получены из одного и того же источника) или дополнительного (т.е. гетерологичного) интересующего антитела. Он может представлять собой тяжелую или легкую цепь иммуноглобулина (или обе цепи как часть одного полипептида). Второй иммуноглобулиновый партнер не ограничен конкретным классом или изотипом иммуноглобулинов. Кроме того, второй иммуноглобулиновый партнер может содержать часть константной области иммуноглобулина, так как обнаружено в Fab или F(ab)2 (т.е. дискретную часть подходящей человеческой константной области или каркасной области). Такой второй иммуноглобулиновый партнер может также содержать последовательность, кодирующую интегральный мембранный белок, экспонированный на внешней поверхности клетки хозяина, например, как часть фаговой дисплейной библиотеки, или последовательность, кодирующую белок для аналитического или диагностического обнаружения, например, пероксидазу хрена, (3-галактозидазу, и т.д.
Термины Fv, Fc, Fd, Fab или F(ab)2 используются в соответствии со своими обычными значениями (смотри, например, Harlow et al., Antibodies A Laboratory Manual. Cold Spring Harbor Laboratory, (1988)).
В данном контексте термин «генно-инженерное антитело» описывает тип измененного антитела, т.е. полноразмерного синтетического антитела (например, химерного, переформированного или гуманизированного антитела в противоположность фрагменту антитела), в котором часть вариабельных доменов легких и/или тяжелых цепей выбранного акцепторного антитела заменена на аналогичные части одного или более донорных антител обладающих специфичностью в отношении выбранного эпитопа. Например, такие молекулы могут включать антитела, характеризующиеся гуманизированной тяжелой цепью в ассоцииации с немодифицированной легкой целью (или химерной легкой цепью), или наоборот. Генно-инженерные антитела могут также характеризоваться изменением последовательностей нуклеиновых кислот, кодирующих каркасные области легкого и/или тяжелого вариабельного домена акцепторного антитела, для сохранения связывающей специфичности донорного антитела. Эти антитела могут включать замену одной или более CDR (предпочтительно всех) акцепторного антитела на CDR донорного антитела, описанного здесь.
«Химерное антитело» относится к типу генно-инженерного антитела, которое содержит встречающуюся в природе вариабельную область (легкая цепь и тяжелые цепи), происходящую от донорного антитела, в ассоциации с константными областями легких и тяжелых цепей, происходящими от акцепторного антитела.
«Гуманизированное антитело» относится к типу генно-инженерного антитела, имеющего CDR, полученные из иммуноглобулинов донора, не являющегося человеком, причем остальные происходящие от иммуноглобулина фрагменты молекулы происходят от одного (или более) человеческого(их) иммуноглобулина(ов). Кроме того, остатки основы каркаса могут быть изменены для сохранения аффинности связывания (смотри, например, Queen et al., Proc. Natl Acad Sci USA. 86: 10029-10032 (1989), Hodgson et al., Bio/Technology. 9: 421 (1991)). Подходящим человеческим акцепторным антителом может быть выбранное из обычной базы данных, например, КАВАТ® базы данных, базы данных Лос Аламоса и шведской базы данных белков, в соответствии с гомологией нуклеотидной и аминокислотной последовательности донорного антитела. Человеческое антитело, характеризующееся гомологией с каркасными областями донорного антитела (на аминокислотной основе), может быть подходящим для обеспечения встраивания донорных CDR в константную область тяжелой цепи и/или вариабельную каркасную область тяжелой цепи. Подходящее акцепторное антитело, способное предоставлять константные или вариабельные каркасные области легкой цепи, может быть выбрано аналогично. Следует понимать, что тяжелые и легкие цепи акцепторного антитела не обязательно должны происходить от одного и того же акцепторного антитела. В предшествующем уровне техники были описаны несколько путей продуцирования таких гуманизированных антител - смотри, например, ЕР-А-0239499 и ЕР-А-054951.
«Переформированное человеческое антитело» относится к измененному антителу, в котором минимально по меньшей мере одну CDR первого человеческого моноклонального донорного антитела заменяет CDR во втором человеческом акцепторном антителе. Предпочтительно заменены все шесть CDR. Более предпочтительно вся антигенсвязывающая область (например Fv, Fab или F(ab')2) первого человеческого донорного моноклонального антитела заменяет соответствующую область во втором человеческом акцепторном моноклональном антителе. Наиболее предпочтительно Fab область первого человеческого донора функциональным образом связана с соответствующими константными областями второго человеческого акцепторного антитела с образованием полноразмерного моноклонального антитела.
«Векторное антитело» относится к антителу, к которому присоединен агент для улучшения транспорта через гематоэнцефалический барьер (ВВВ) (смотри обзор Pardridge; Advanced Drug Delivery Review 36, 299-321, 1999). Присоединение может быть химическим или, альтернативно, эта группировка может быть введена генно-инженерным путем в антитело. Одним из примеров является получение химеры с антителом, направленным на рецептор эндотелиальных клеток капилляров головного мозга, например, с антителом против рецептора инсулина или антителом против рецептора трансферрина (Saito et al. (1995) Proc. Natl. Acad. Sci. USA 92 10227-31; Pardridge et al. (1995) Pharm. Res. 12 807-816; Broadwell et al. (1996) Exp.Neurol. 142 47-65; Bickel et al. (1993) Proc. Natl. Acad. Sci. USA 90, 2618-2622; Friden et al. (1996) J. Pharm. Exp. Ther. 278 1491-1498, US 5182107, US 5154924, US 5833988, US 5527527). Связавшись с рецептором, оба компонента биспецифичного антитела проходят через ВВВ посредством процесса трансцитоза. Альтернативно агент может представлять собой лиганд, который связывается с такими рецепторами клеточной поверхности, например инсулин, трансферрин или липопротеин низкой плотности (Descamps et al. (1996) Am. J. Physiol. 270 H1149-H1158; Duffy et al., (1987) Brain Res. 420 32-38; Dehouck et al., (1997) J. Cell Biol. 1997 877-889). Также можно использовать встречающиеся в природе пептиды, такие как пенетратин и SynB1 и SynB3, про которые известно, что они улучшают транспорт через ВВВ (Rouselle et al. (2000) Mol. Pharm. 57, 679-686 и Rouselle et al. (2001) Journal of Pharmacology and Experimental Therapeutics 296, 124-131).
Термин «донорное антитело» относится к антителу (моноклональному или рекомбинантному), которое предоставляет аминокислотные последовательности своих вариабельных областей, CDR или другие функциональные фрагменты или их аналоги первому иммуноглобулиновому партнеру, так чтобы получить кодирующую область измененного иммуноглобулина и в результате экспрессию измененного антитела с антигенной специфичностью и нейтрализующей активностью, характерной для донорного антитела.
Термин «акцепторное антитело» относится к антителу (моноклональному или рекомбинантному), гетерологичному донорному антителу, которое предоставляет все (или любую часть, но предпочтительно все) аминокислотные последовательности, кодирующие его каркасные области тяжелых и/или легких цепей, и/или его константные области тяжелых и/или легких цепей, первому иммуноглобулиновому партнеру. Предпочтительно человеческое антитело представляет собой акцепторное антитело.
«CDR» определены как аминокислотные последовательности области антигена, определяющей комплементарность, представляющие собой гипервариабельные области тяжелой и легкой цепей иммуноглобулина. Смотри, например, Kabat et al., Sequences of Proteins of Immunological Interest. 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). В вариабельной части иммуноглобулина имеются три CDR (или гипервариабельные области) с тяжелыми и три CDR с легкими цепями. Таким образом, в данном контексте «CDR» относится ко всем трем CDR с тяжелыми цепями или всем трем CDR с легкими цепями (или как к CDR с тяжелыми, так и ко всем CDR с легкими цепями, если это является подходящим). Структура и белковое сворачивание антитела может означать, что другие остатки рассматриваются как часть антигенсвязывающего центра, как должны понимать специалисты в данной области техники. Смотри, например, Chothia et al., (1989) Conformations of immunoglobulin hypervariable regions; Nature 342, p.877-883. Для удобства CDR, как они определены Kabat в SEQ ID No 13-26, подчеркнуты.
CDR обеспечивает большую часть контактных остатков для связывания антитела с антигеном или эпитопом. Интересующие в данном изобретении CDR происходят от вариабельных последовательностей тяжелых и легких цепи донорного антитела и включают аналоги встречающихся в природе CDR, которые также обладают частью или сохраняют такую же антигенсвязывающую специфичность и/или нейтрализующую способность, что и донорное антитело, от которого они происходят.
«Функциональный фрагмент» представляет собой частичную вариабельную последовательность тяжелой или легкой цепи (например минорные делеции на амино- или карбоксильном конце вариабельной области иммуноглобулина), которая сохраняет такую же антигенсвязывающую специфичность и/или нейтрализующую способность, что и антитело, от которого этот фрагмент был получен.
«Аналог» представляет собой аминокислотную последовательность, модифицированную по меньшей мере по одной аминокислоте, где указанная модификация может быть химической или представлять собой замещение или перегруппировку нескольких аминокислот (т.е. не более чем 10), причем эта модификация позволяет аминокислотной последовательности сохранять биологические характеристики, например, антигенную специфичность и высокую аффинность немодифицированной последовательности. Например, путем замещения могут быть созданы (молчащие) мутации, когда определенные сайты эндонуклеазной рестрикции создают в CDR-кодирующих областях или вокруг них. Настоящее изобретение предполагает применение аналогов антитела по данному изобретению. Хорошо известно, что минорные изменения в аминокислотных последовательностях или последовательностях нуклеиновых кислот могут привести, например, к аллельной форме исходного белка, которая сохраняет по существу аналогичные свойства. Таким образом, аналоги антитела по изобретению включают такие аналоги, в которых CDR в гипервариабельной области тяжелых и легких цепей имеют по меньшей мере 80%-ную гомологию, предпочтительно по меньшей мере 90%-ную гомологию, и более предпочтительно по меньшей мере 95%-ную гомологию с CDR, как они определены выше, такими как CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3, и сохраняют MAG-нейтрализующую активность. Аминокислотные последовательности имеют по меньшей мере 80%-ную гомологию, если они имеют 80% идентичных аминокислотных остатков в одинаковых положениях, когда последовательности оптимально выровнены, причем пропуски или вставки считают как неидентичные остатки. В данном изобретении также рассматриваются аналоги антител по данному изобретению, где каркасные области по меньшей мере на 80%, предпочтительно по меньшей мере на 90% и более предпочтительно по меньшей мере на 95% гомологичны каркасным областям, приведенным далее в Seq ID 1-5. Аминокислотные последовательности по меньшей мере на 80% гомологичны в том случае, если они имеют 80% идентичных аминокислотных остатков в одинаковых позициях, когда последовательности оптимально выровнены, причем пропуски или вставки считают как неидентичные остатки.
Аналоги могут также возникать как аллельные вариации. «Аллельная вариация или модификация» представляет собой изменение последовательности нуклеиновых кислот. Такие вариации или модификации могут являться следствием вырожденности генетического кода или могут быть специально созданы для получения желаемых характеристик. Эти вариации или модификации могут привести или могут не привести в результате к изменениям в какой-либо кодируемой аминокислотной последовательности.
Термин «эффекторные агенты» относится к небелковым молекулам-носителям, с которыми измененные антитела и/или природные или синтетические легкие или тяжелые цепи донорного антитела или другие фрагменты донорного антитела могут быть ассоциированы обычными способами. Такие небелковые носители могут включать традиционные носители, используемые в диагностической области, например полистирольные или другие пластмассовые гранулы, полисахариды, например такие, которые используются в системе BIAcore [Pharmacia], или другие небелковые вещества, полезные в медицинской области и безопасные для введения людям и млекопитающим. Другие эффекторные агенты могут включать макроцикл для хелатирования атома тяжелого металла или радиоизотопов. Такие эффекторные агенты также могут быть полезными для увеличения времени полужизни измененных антител, пример полиэтиленгликоль.
Нейтрализующее антитело, специфичное к MAG, было описано (Poltorak et al. (1987) Journal of Cell. Biology 105, 1893-1899, DeBellard et al. (1996) Mol. Cell. Neurosci. 7, 89-101; Tang et al. (1997) Mol. Cell. Neurosci. 9, 333-346; Torigoe K. and Lundborg G. (1997) Exp. Neurology 150, 254-262) и имеется в продаже (MAB1567 (Chemicon)).
Альтернативно можно сконструировать антитела, измененные антитела и фрагменты путем иммунизации видов, не являющихся людьми (например коров, овец, обезьян, цыплят, грызунов (например мышей или крыс) и т.д.), для выработки желаемого иммуноглобулина после презентации природного MAG из любых видов, против которых могут вырабатываться антитела, перекрестно-реактивные с человеческим MAG, например человека или цыплят. Обычные способы получения гибридом используются для получения клеточных линий гибридом, секретирующих нечеловеческий mAb к MAG. Такие гибридомы затем подвергают скринингу по связыванию, используя покрытые MAG 384- или 96-луночные планшеты с биотинилированным MAG, связанным с покрытым стрептавидином планшетом, или в гомогенном иммуноанализе с европием-АРС (аллофикоцианином) с использованием биотинилированного MAG.
Нативное человеческое антитело может продуцироваться мышью, продуцирующей человеческие антитела, такой как «Xenomouse» (Abgenix), у которой гены мышиных иммуноглобулинов удалены, и в мышиную хромосому встроены гены, кодирующие человеческие иммуноглобулины. Таких мышей иммунизируют так же, как нормальных, и у них развивается антителогенез, порождаемый человеческими генами. Таким образом, мышь продуцирует человеческие антитела, что устраняет необходимость гуманизации после отбора положительных гибридом (смотри Green L.L., J. Immunol. Methods 1999 Dec 10; 231 (1-2): 11-23).
В настоящее изобретение также включено применение Fab фрагментов или F(ab')2 фрагментов, полученных из mAbs, направленных против MAG. Эти фрагменты являются полезными в качестве агентов, оказывающих защитное действие in vivo. Fab фрагмент содержит полную легкую цепь и аминоконцевую часть тяжелой цепи; и F(ab')2 фрагмент представляет собой фрагмент, образованный двумя Fab фрагментами, связанными дисульфидными связями. Fab фрагменты и F(ab')2 фрагменты могут быть получены обычными способами, например расщеплением mAb подходящими протеолитическими ферментами, папаином и/или пепсином, или рекомбинантными способами. Fab и F(ab')2 фрагменты являются полезными сами по себе в качестве терапевтических или профилактических агентов, и в качестве доноров последовательностей, включающих в себя вариабельные области и CDR-последовательности, полезные в образовании рекомбинантных или гуманизированных антител, как описано здесь.
Fab и F(ab')2 фрагменты также могут быть сконструированы с использованием комбинаторной фаговой библиотеки (смотри, например, Winter et al., Ann. Rev. Immunol. 12: 433-455 (1994)) или путем перестановки иммуноглобулиновых цепей (смотри, например, Marks et al., Bio/Technology. 10: 779-783 (1992), оба из которых включены в данное описание изобретения ссылкой во всей своей полноте.
Таким образом, фрагменты человеческого антитела (Fv, scFv, Fab), специфичные к MAG, могут быть выделены с использованием фаговых дисплейных библиотек фрагментов человеческих антител. Библиотеку частиц бактериофагов с дисплеем белковых фрагментов человеческих антител подвергают пэннингу против MAG-белка. Фаг-дисплейные фрагменты антител, которые связываются с MAG, сохраняют в библиотеке и клонально амплифицируют. Гены человеческих антител затем вырезают из такого специфичного бактериофага и встраивают в конструкции, экспрессирующие человеческий IgG, содержащие константные области человеческого IgG с образованием интактной молекулы человеческого IgG с вариабельными областями из выделенного бактериофага, специфичного к MAG.
Донорные антитела могут предоставлять последовательности, такие как вариабельные пептидные последовательности тяжелых и/или легких цепей, каркасные последовательности, CDR-последовательности, их функциональные фрагменты и аналоги и кодирующие их последовательности нуклеиновых кислот, полезные в конструировании и получении различных измененных антител, которые характеризуются антигенсвязывающей специфичностью донорного антитела.
Учитывая вырожденность генетического кода, могут быть сконструированы различные кодирующие последовательности, которые кодируют вариабельные аминокислотные последовательности тяжелых и легких цепей, и CDR-последовательности, а также их функциональные фрагменты и аналоги, которые обладают антигенной специфичностью донорного антитела. Выделенные последовательности нуклеиновых кислот или их фрагменты, кодирующие пептидные последовательности вариабельной цепи или CDR, могут применяться для ппродуцирования измененных антител, например химерных или гуманизированных антител, или других генно-инженерных антител, при комбинировании функциональным образом со вторым иммуноглобулиновым партнером.
Измененные иммуноглобулиновые молекулы могут кодировать измененные антитела, которые включают генно-инженерные антитела, такие как химерные антитела и гуманизированные антитела. Желаемая область, кодирующая измененный иммуноглобулин, содержит CDR-кодирующие области, которые кодируют пептиды, обладающие антигенной специфичностью анти-MAG антитела, предпочтительно высокоаффинного антитела, встроенные в первого иммуноглобулинового партнера (человеческая каркасная или человеческая иммуноглобулиновая вариабельная область).
Предпочтительно первый иммуноглобулиновый партнер функционально связан со вторым иммуноглобулиновым партнером. Второй иммуноглобулиновый партнер определен выше, и может включать в себя последовательность, кодирующую интересующую область второго антитела, например Fc-область. Вторые иммуноглобулиновые партнеры могут также включать в себя последовательности, кодирующие другой иммуноглобулин, с которым константная область легкой или тяжелой цепи слита внутри рамки или посредством линкерной последовательности. Генно-инженерные антитела, направленные против функциональных фрагментов или аналогов MAG, могут быть разработаны, чтобы достичь улучшенного связывания.
Второй иммуноглобулиновый партнер может также находиться в ассоциации с эффекторными агентами, такими как определены выше, включающими небелковые молекулы-носители, с которыми второй иммуноглобулиновый партнер может быть функционально связан обычными способами.
Слияние или связь между вторыми иммуноглобулиновыми партнерами, например последовательностями антител, и эффекторным агентом может осуществляться любым подходящим способом, например посредством обычных ковалентных или ионных связей, слияний белков или гетеро-бифункциональных кросс-линкеров, например, карбодиимида, глутарового альдегида, и т.п. Такие способы известны из уровня техники и хорошо описаны в обычных руководствах по химии и биохимии.
Кроме того, обычные линкерные последовательности, которые просто обеспечивают желаемый объем пространства между вторым иммуноглобулиновым партнером и эффекторным агентом, также могут быть сконструированы в кодирующей области измененного иммуноглобулина. Конструирование таких линкеров хорошо известно специалистам в данной области техники. В других аспектах данного изобретения авторы изобретения предлагают ди-тела (бивалентные или биспецифичные), три-тела, тетра-тела и другие разновидности мультивалентных белковых scFV, имеющие один или более CDR, как описано выше, которые связываются с MAG и нейтрализуют его функцию.
В еще одном воплощении к антителу по данному изобретению может быть присоединен дополнительной агент. Например, методику технологии рекомбинантных ДНК можно применять для получения генно-инженерного антитела по изобретению, где Fc-фрагмент или СН2-СНЗ домен полноразмерной молекулы антитела заменяли ферментом или другой обнаруживаемой молекулой (т.е. полипептидной эффекторной молекулой или репортерной молекулой).
Второй иммуноглобулиновый партнер также может быть функциональным образом связан с неиммуноглобулиновым пептидом, белком или его фрагментом, гетерологичным CDR-содержащей последовательности, обладающей антигенной специфичностью анти-MAG антитела. Полученный в результате белок может проявлять как анти-MAG антигенную специфичность, так и характеристики неиммуноглобулина при экспрессии. Такая характеристика партнера слияния может представлять собой, например, функциональную характеристику, такую как еще один связывающий или рецепторный домен, или терапевтическую характеристику, если партнер слияния сам представляет собой терапевтический белок, или дополнительные антигенные характеристики.
Еще один желательный белок по данному изобретению может содержать полную молекулу антитела, имеющую полноразмерные тяжелые и легкие цепи, или какие-либо ее дискретные фрагменты, такие как Fab или F(ab')2 фрагменты, димер тяжелой цепи или любые минимально рекомбинантные ее фрагменты, такие как Fv или одноцепочечное антитело (SCA), или любую другую молекулу с такой же специфичностью, что и у выбранного донора mAb. Такой белок может быть использован в форме измененного антитела или может быть использован в неслитой форме.
Когда второй иммуноглобулиновый партнер происходит от антитела, отличного от донорного антитела, например, какого-либо изотипа или класса иммуноглобулиновых каркасных или константных областей, в результате получается генно-инженерное антитело. Генно-инженерные антитела могут содержать иммуноглобулиновые (Ig) константные области и вариабельные каркасные области из одного источника, например акцепторное антитело, и одну или более (предпочтительно все) CDR из донорного антитела. Кроме того, могут быть осуществлены изменения, например делеции, замещения или добавления каркасной области легкого и/или тяжелого вариабельного домена акцепторного mAb на уровне нуклеиновых кислот или аминокислот, или донорных областей CDR для сохранения антигенсвязывающую специфичности донорного антитела.
Такие генно-инженерные антитела разработаны для использования одной (или обеих) вариабельных тяжелых и/или легких цепей анти-MAG mAb или одной или более CDR тяжелой или легкой цепи. Генно-инженерные антитела могут быть нейтрализованы, как определено выше.
Такие генно-инженерные антитела могут включать в себя гуманизированное антитело, содержащее каркасные области выбранного человеческого иммуноглобулина или подтипа, или химерное антитело, содержащее человеческие константные области тяжелых и легких цепей, слитые с функциональными фрагментами анти-MAG антитела. Подходящее человеческое (или другого животного) акцепторное антитело может быть выбрано из стандартной базы данных, например базы данных КАВАТ®, базы данных Лос Аламоса и шведской базы данных белков, на основе гомологии с нуклеотидной и аминокислотной последовательностями донорного антитела. Человеческое антитело, характеризующееся гомологией с каркасными областями донорного антитела (на аминокислотной основе) может быть подходящим для получения константной области тяжелой цепи и/или вариабельной каркасной области тяжелой цепи для встраивания донорных CDR. Подходящее акцепторное антитело, способное предоставлять константные или вариабельные каркасные области легкой цепи, может быть выбрано аналогичным образом. Необходимо отметить, что не требуется, чтобы тяжелые и легкие цепи акцепторного антитела были получены из одного и того же акцепторного антитела.
Желательно, чтобы гетерологичные каркасные и константные области были выбраны из классов и изотипов человеческого иммуноглобулина, таких как IgG (подтипы 1-4), IgM, IgA и IgE. Однако акцепторное антитело не должно содержать только человеческие иммуноглобулиновые белковые последовательности. Например, может быть сконструирован ген, в котором последовательность ДНК, кодирующая часть цепи человеческого иммуноглобулина, слита с последовательностью ДНК, кодирующей неиммуноглобулиновую аминокислотную последовательность, такую как полипептидная эффекторная или репортерная молекула.
Предпочтительно в гуманизированном антителе вариабельные домены в человеческой как тяжелой, так и легкой цепях могут быть получены при помощи генной инженерии посредством замены одной или более CDR. Можно использовать все шесть CDR или различные комбинации менее чем шести CDR. Предпочтительно заменены все шесть CDR. Можно заменять CDR только в человеческой тяжелой цепи, используя в качестве легкой цепи немодифицированную легкую цепь из человеческого акцепторного антитела. Альтернативно совместимая легкая цепь может быть выбрана из другого человеческого антитела путем обращения к стандартным базам данных антител. Оставшаяся часть генно-инженерного антитела может происходить от любого подходящего акцепторного человеческого иммуноглобулина,
Таким образом, генно-инженерное гуманизированное антитело предпочтительно имеет структуру природного человеческого антитела или его фрагмента и обладает комбинацией свойств, требуемых для эффективного терапевтического использования.
Специалисту в данной области техники очевидно, что генно-инженерное антитело может быть дополнительно модифицировано путем изменений аминокислот в вариабельном домене, без обязательного влияния на специфичность и высокую аффинность донорного антитела (т.е. аналог). Предполагается, что аминокислоты тяжелой и легкой цепи могут быть заменены другими аминокислотами либо в вариабельных доменах каркасов или CDR, либо в обоих.
Кроме того, константная область может быть изменена для усиления или уменьшения выбранных свойств молекул по настоящему изобретению, например димеризации, связывания с Fc-рецепторами или способности связываться с комплементом и активировать его (смотри, например, Angal et al., Mol. Immunol. 30: 105-108 (1993), Xu et al., J. Biol. Chem. 269: 3469-3474 (1994), Winter et al., EP 307434-B).
Измененное антитело, которое представляет собой химерное антитело, отличается от гуманизированных антител, описанных выше, предоставлением полноразмерных вариабельных областей тяжелых и легких цепей нечеловеческого донорного антитела, включая каркасные области, в ассоциации с иммуноглобулиновыми константными областями обоих цепей из других видов, предпочтительно человека.
Предпочтительно вариабельные последовательности легкой и/или тяжелой цепи и CDR подходящих донорных mAb и кодирующие их последовательности нуклеиновых кислот используются в конструировании измененных антител, предпочтительно гуманизированных антител по данному изобретению следующим способом. Такие же или похожие способы также могут быть использованы для получения других воплощений данного изобретения.
Гибридому, продуцирующую выбранное донорное mAb, клонируют обычным образом, и ДНК его вариабельных областей тяжелых и легких цепей получают способами, известными специалистам в данной области техники, например способами, описанными в Sambrook et at., (Molecular Cloning (A Laboratory Manual). 2nd edition, Cold Spring Harbor Laboratory (1989)). Вариабельные области тяжелых и легких цепей, содержащие по меньшей мере CDR-кодирующие области и части каркасных областей вариабельного домена легкой и/или тяжелой цепи акцепторного mAb, требующиеся для сохранения связывающей специфичности донорного mAb, а также остальные производные от иммуноглобулина части цепи антитела, производные человеческого иммуноглобулина, получают, используя полинуклеотидные праймеры и обратную транскриптазу. CDR-кодирующие области идентифицируют, используя известную базу данных и путем сравнения с другими антителами.
Затем мышиное/человеческое химерное антитело может быть получено и проанализировано в отношении связывающей способности. Такое химерное антитело содержит полноразмерные области нечеловеческого донорного антитела VH и VL в ассоциации с константными областями человеческого Ig для обеих цепей.
Гомологичные каркасные области вариабельной области тяжелой цепи из человеческого антитела могут быть идентифицированы с использованием компьютерной базы данных, например КАВАТ®, и человеческое антитело, имеющее гомологию с донорным антителом, выбирают как акцепторное антитело. Аналогично может быть сконструирована подходящая вариабельная каркасная область легких цепей.
Гуманизированное антитело может происходить от химерного антитела или предпочтительно быть получено синтетически путем встраивания CDR-кодирующих областей донорного mAb из тяжелых и легких цепей соответственно в выбранный каркас тяжелых и легких цепей. Альтернативно гуманизированное антитело можно получить, используя стандартные методы мутагенеза. Таким образом, получающееся в результате гуманизированное антитело содержит человеческие каркасные области и CDR-кодирующие области донорного mAb. Затем может быть осуществлена манипуляция каркасными остатками. Получающееся в результате гуманизированное антитело может экспрессироваться в рекомбинантных клетках хозяевах, например клетках линия COS, CHO (яичников китайского хомячка) или клетках миеломы.
Обычный вектор экспрессии или рекомбинантную плазмиду получают посредством замены этих кодирующих последовательностей на антитело в функциональной ассоциации с обычными регуляторными контролирующими последовательностями, способными контролировать репликацию и экспрессию в клетках хозяевах, и/или секрецию из клеток хозяев. Регуляторные последовательности включают в себя промоторные последовательности, например промотор CMV (цитомегаловирусный), и сигнальные последовательности, которые могут происходить от других известных антител. Аналогично может быть получен второй вектор экспрессии, имеющий последовательность ДНК, которая кодирует комплементарную легкую или тяжелую цепь антитела. Предпочтительно этот второй вектор экспрессии идентичен первому за исключением того, что затрагивает кодирующие последовательности и селектируемые маркеры, таким чтобы гарантировать, насколько это возможно, что каждая полипептидная цепь функционально экспрессируется. Альтернативно кодирующие последовательности тяжелой и легкой цепи измененного антитела могут находиться на одном векторе.
Выбранная клетка-хозяин совместно трансфецируется обычными способами как первым, так и вторым векторами (или просто трансфецируется одним вектором) с созданием трансфецированной клетки-хозяина по данному изобретению, содержащей как рекомбинантные или синтетические легкие, так и тяжелые цепи. Трансфецированную клетку затем культивируют обычными способами с получением генно-инженерного антитела по данному изобретению. Гуманизированное антитело, которое включает в себя ассоциацию рекомбинантной тяжелой цепи и/или легкой цепи, отбирают из культуры с использованием подходящего анализа, такого как ELISA (твердофазный иммуноферментный анализ) или RIA (радиоиммунный анализ). Аналогичные стандарные способы могут быть использованы для конструирования других измененных антител и молекул.
Подходящие векторы для стадий клонирования и субклонирования, используемые в способах и конструировании композиций по данному изобретению, могут быть выбраны специалистом в данной области техники. Например, могут быть использованы обычные pUC серии клонирующих векторов. Один вектор, pUC19, имеется в продаже от поставщиков, таких как Amersham (Buckinghamshire, United Kingdom) или Pharmacia (Uppsala, Sweden). Кроме того, любой вектор, который способен легко реплицироваться, имеет множество сайтов клонирования и селектируемых генов (например устойчивости к антибиотикам), и легок для манипуляции, может быть использован для клонирования. Таким образом, выбор клонирующего вектора не является ограничивающим фактором для данного изобретения.
Аналогично векторы, используемые для экспрессии антител, могут быть выбраны специалистом в данной области техники из любого обычного вектора. Эти векторы также содержат выбранные регуляторные последовательности (такие как CMV промоторы), которые управляют репликацией и экспрессией гетерологичных последовательностей ДНК в выбранных клетках-хозяевах. Эти векторы содержат вышеописанные последовательности ДНК, которые кодируют антитело, или кодирующую область измененного иммуноглобулина. Кроме того, эти векторы могут включать в себя выбранные иммуноглобулиновые последовательности, модифицированные путем встраивания желательных сайтов рестрикции для легкой манипуляции.
Векторы экспрессии также могут характеризоваться генами, подходящими для усиленной экспрессии гетерологичных последовательностей ДНК, например геном дигидрофолатредуктазы млекопитающего (DHFR). Другие предпочтительные векторные последовательности включают поли-А-сигнальную последовательность, такую как последовательность бычьего гормона роста (BGH) и бетаглобиновая промоторная последовательность (бетаглопро). Векторы экспресии, полезные в данном изобретении, могут быть синтезированы способами, хорошо известными специалистам в данной области техники.
Компоненты таких векторов, например репликоны, селектируемые гены, энхансеры, промоторы, сигнальные последовательности и т.п., могут быть получены из торговых или природных источников или синтезированы известными способами, применяемыми в управлении экспрессией и/или секрецией продукта рекомбинантной ДНК в выбранном хозяине. Для этой задачи могут также быть выбраны другие подходящие векторы экспрессии, множество типов которых известно из уровня техники для экспрессии в млекопитающих, бактериях, насекомых, дрожжах и грибах.
Настоящее изобретение также включает в себя клеточную линию, трансфецированную рекомбинантной плазмидой, содержащей кодирующие последовательности антител или их измененных иммуноглобулиновых молекул. Клетки-хозяева, подходящие для клонирования и других манипуляций с этими клонирующими векторами, также являются обычными. Однако наиболее желательно использовать для репликации клонирующих векторов и других стадий конструирования измененных антител по данному изобретению клетки различных штаммов Е. coli.
Подходящие клетки-хозяева или клеточные линии для экспрессии антитела по данному изобретению предпочтительно представляют собой клетки млекопитающих, такие как NS0, Sp2/0, CHO, COS, клетки фибробластов (например 3Т3) и клетки миеломы, и более предпочтительно клетки CHO или миеломы. Можно использовать человеческие клетки, таким образом делая возможной модификацию молекулы с участием способов гликозилирования человека. Альтернативно можно использовать другие линии эукариотических клеток. Выбор подходящей клетки хозяина-млекопитающего и способов трансформации, культивирования, амплификации, скрининга и продуцирования и очистки продукта хорошо известны из уровня техники. Смотри, например, упомянутый выше Sambrook et al.
Бактериальные клетки могут оказаться полезными в качестве клеток-хозяев, подходящих для экспрессии рекомбинантных Fab по настоящему изобретению (смотри, например Pluckthun, A., Immunol. Rev. 130: 151-188 (1992)). Однако из-за тенденции белков, экспрессируемых в бактериальных клетках, находиться в несвернутой или неправильно свернутой форме или в негликозилированной форме, любой рекомбинантный Fab, продуцирующийся в бактериальной клетке, должен быть подвергнут скринингу на сохранение антигенсвязывающей способности. Если молекула, экспрессируемая бактериальной клеткой, продуцируется в правильно свернутой форме, эта бактериальная клетка будет являться желательным хозяином. Например различные штаммы Е. coli, используемые для экспрессии, хорошо известны в качестве клеток-хозяев в области биотехнологии. Различные штаммы В. subtilis, Streptomyces, других бацилл и т.п. также можно использовать в этом способе.
Когда это желательно, штаммы дрожжевых клеток, известные специалистам в данной области техники, также применимы в качестве клеток-хозяев, так же как клетки насекомых, например Drosophila и Lepidoptera, и вирусные системы экспрессии. Смотри, например Miller et al., Genetic Engineering. 8: 277-298, Plenum Press (1986) и приведенные в нем ссылки.
Общие способы, при помощи которых могут быть сконструированы векторы, способы трансфекции, требующиеся для получения клеток-хозяев по данному изобретению, и способы культивирования, необходимые для продуцирования измененного антитела по данному изобретению такой клеткой-хозяином, представляют собой традиционные способы. Также после продуцирования антитела по данному изобретению могут быть очищены от содержимого клеточной культуры в соответствии со стандартными способами данной области техники, включая осаждение сульфатом аммония, аффинные колонки, колоночная хроматография, гель-электрофорез и т.п. Такие способы входят в компетенцию специалистов в данной области техники и не ограничивают данное изобретение. Например, получение измененных антител описано в WO 99/58679 и WO 96/16990.
В еще одном способе экспрессии антител может использоваться экспрессия в трансгенном животном, как описано в патенте США №4873316. Это относится к системе экспрессии с использованием промотора казеина животного, который при трансгенном встраивании в млекопитающего дает возможность самке в ее молоке продуцировать желаемые рекомбинантные белки.
После экспрессии желательным способом антитело затем проверяют на in vitro активность, используя подходящий анализ. Для оценки количественного и качественного связывания антитела с MAG используют обычные в настоящее время форматы ELISA анализа. Кроме того, другие in vitro анализы также можно использовать для подтверждения нейтрализующей эффективности перед последующими клиническими исследованиями на людях, осуществляемыми для выяснения устойчивости антитела в организме вопреки обычным механизмам клиренса.
Терапевтические агенты по данному изобретению можно вводить в качестве профилактических или после повреждения, или при другой необходимости. Доза и продолжительность лечения связана с относительной продолжительностью нахождения молекул по настоящему изобретению в кровотоке человека и может быть скорректирована специалистом в данной области техники в зависимости от состояния, которое лечат, и общего состояния здоровья пациента.
Способ введения терапевтического агента по данному изобретению может представлять собой любой подходящий путь, который доставляет агента хозяину. Антагонисты и антитела и фармацевтические композиции по данному изобретению особенно пригодны для парентерального введения, т.е. подкожного, внутримышечного, внутривенного или интраназального.
Терапевтические агенты по данному изобретению могут быть приготовлены в виде фармацевтических композиций, содержащих эффективное количество антагониста или антитела по данному изобретению в качестве активного ингредиента в фармацевтически приемлемом носителе. В профилактическом агенте по данному изобретению предпочтительной является водная суспензия или раствор, содержащий генно-инженерное антитело, предпочтительно забуференный при физиологическом значении рН, в готовой для инъекции форме. Композиции для парентерального введения, как правило, содержат раствор антагониста или антитела по данному изобретению или их смесь, растворенную в фармацевтически приемлемом носителе, предпочтительно в водном носителе. Можно использовать множество водных носителей, например 0,9%-ный физиологический раствор, 0,3%-ный глицин и т.п. Эти растворы являются стерильными и, как правило, не содержат твердых частиц. Эти растворы можно стерилизовать обычными хорошо известными способами стерилизации (например фильтрацией). Эти композиции могут содержать фармацевтически приемлемые вспомогательные вещества, как, например, требующиеся для достижения состояний, близких физиологическим, такие как рН-регулирующие или буферные агенты агенты, и т.д. Концентрация антагониста или антитела по изобретению в таком фармацевтическом препарате может варьироваться широко, т.е. от менее приблизительно 0,5%, обычно равной или по меньшей мере приблизительно равной 1%, до 15 или 20% по массе, и будет выбрана главным образом на основании объемов жидкости, вязкостях и т.д., в соответствии с конкретным выбранным способом введения.
Таким образом, фармацевтическая композиция по изобретению для внутримышечной инъекции может быть приготовлена содержащей 1 мл стерильной забуференной воды и от приблизительно 1 нг до приблизительно 100 мг, например от приблизительно 50 нг до приблизительно 30 мг или более, предпочтительно от приблизительно 5 мг до приблизительно 25 мг антагониста или антитела по изобретению. Аналогично фармацевтическая композиция по изобретению для внутривенного вливания может быть приготовлена содержащей приблизительно 250 мл стерильного раствора Рингера и от приблизительно 1 до приблизительно 30, и предпочтительно от 5 мг до приблизительно 25 мг генно-инженерного антитела по изобретению. Современные способы изготовления парентерально вводимых композиций хорошо известны или очевидны специалистам в данной области техники и описаны более подробно, например, в Remington's Pharmaceutical Science, 15th ed., Mack Publishing Company, Easton, Pennsylvania.
Предпочтительно, чтобы терапевтический агент по данному изобретению в терапевтическом препарате был представлен в виде стандартных лекарственных форм. Подходящая терапевтически эффективная доза может быть легко определена специалистом в данной области техники. Для эффективного лечения инсульта и других неврологических заболеваний у человека следует вводить парентерально, предпочтительно внутривенно (в.в.) или внутримышечно (в.м.), разовую дозу антагониста или антитела по данному изобретению, составляющую до 700 мг включительно на 70 кг массы тела. Такую дозу можно при необходимости повторить в подходящие промежутки времени, выбранные в зависимости от целесообразности лечащим врачом.
Описанные здесь антитела могут быть лиофильно высушены для хранения и разведены в подходящем носителе перед использованием. Было показано, что этот способ эффективен для обычных иммуноглобулинов и могут быть применены известные из уровня техники методики лиофилизации и растворения.
В еще одном аспекте в данном изобретении предложена фармацевтическая композиция, содержащая анти-MAG антитело по настоящему изобретению или его функциональный фрагмент и фармацевтически приемлемый носитель, для лечения или профилактики инсульта и других неврологических заболеваний.
В еще одном аспекте в данном изобретении предложена фармацевтическая композиция, включающая в себя анти-MAG антитело по настоящему изобретению или его функциональный фрагмент и фармацевтически приемлемый носитель для ингибирования нейродегенерации и/или активизации функционального восстановления пациента-человека, страдающего инсультом или другим неврологическим заболеванием или имеющего риск их развития.
Следующие примеры иллюстрируют данное изобретение
Пример 1 - Анти-MAG антитело в модели инсульта
Материалы и способы
Анти-MAG моноклональное антитело
Анти-MAG моноклональное антитело представляет собой мышиное анти-MAG цыпленка антитело МАВ 1567, полученное от Chemicon. Это антитело имеет следующие характеристики:
Антиген: миелин-ассоциированный гликопротеин (человеческий, мышиный, крысиный, бычий, цыпленка, лягушки)
Изотип: IgG1
Нейтрализующая способность: смотри DeBellard et al. (1996) Mol. Cell. Neurosci. 7, 89-101; Tang et al. (1997) Mol. Cell. Neurosci. 9, 333-346; Torigoe K. and Lundborg G. (1997) Exp. Neurology 150, 254-262.
Контрольное mAb IgG1 было приобретено в R+D Systems.
Интрацеребральное вентрикулярное канюлирование (только для исследования 1)
Под галотановой анестезией устанавливали интрацеребральную вентрикулярную (и.ц.в.) канюлю в боковой левый желудочек головного мозга (координаты: 1,6 мм от срединной линии, 0,8 мм каудально от темени, 4,1 мм от поверхности черепа, граница разреза - 3,2 мм ниже нуля в соответствии с Paxinos and Watson, 1986). Всех крыс размещали по одной для того, чтобы предотвратить повреждение используемой или фиктивной канюли. Через 7 дней после операции правильное расположение канюли проверяли при помощи интенсивного питьевого ответа на ангиотензин II (100 нг, Simpson et al., 1978). Через девять суток животных подвергали ишемии мозга.
Преходящая очаговая ишемия мозга
Преходящую (90 мин) очаговую ишемию мозга индуцировали у самцов крыс Sprague Dawley массой от 300 до 350 г. На начальной стадии животных анестезировали смесью 5% галотана, 60% закиси азота и 30% кислорода, помещаемой на маску, и затем анестезию поддерживали при 1,5% галотана. Закупорку средней артерии большого мозга (МСАО) осуществляли, используя метод внутрипросветного перевязывания, описанный ранее (Zea Longa, et al., 1989). У животных в процессе хирургической процедуры поддерживали нормальную температуру, давали возможность придти в себя в течение 1 ч в инкубаторе, затем размещали по одному. В это исследование были включены только животные с неврологической оценкой 3 через 1 ч после закупорки (при оценке с использованием 5-балльной системы: 0 - отсутствует недостаточность; 1 - контралатеральный рефлекс; 2 - слабая судорога; 3 - кружение; 4 - неподвижность; 5 - смерть). Животных содержали в течение 1 недели, после чего животных умерщвляли путем транскардиальной перфузии 0,9%-ного физиологического раствора, затем 4%-ного параформальдегида в 100 мМ фосфатном буфере. Мозги затем фиксировали в 4%-ном параформальдегиде при 4°C в течение 48 ч, в течение которых их извлекали из черепов и разрезали на блоки толщиной 2 мм, используя матрицу для головного мозга крыс. Срезы толщиной 2 мм затем помещали в парафин, используя Shandon Citadel 1000 tissue processor (тканевый процессор), разрезали на срезы толщиной 6 мкм, используя микротом, и устанавливали на предметные стекла, покрытые поли-L-лизином. Срезы затем подвергали окрашиванию крезиловым фиолетовым быстрым (CFV).
Схема приема
Моноклональное анти-MAG антитело и мышиное контрольное антитело изотипа IgG1 диализовали против стерильного 0,9%-ного хлорида натрия в течение ночи и подходящим образом концентрировали.
Исследование 1: Животные получали 2,5 мкг анти-MAG mAb или 2,5 мкг мышиного IgG интрацеребровентрикулярно через 1, 24 и 72 ч после МСАО (5 мкл на дозу).
Исследование 2: Животные получали 200 мкг анти-MAG mAb или 200 мкг мышиного IgG внутривенно через 1 и 24 ч после МСАО.
Исследователь не имел информации о природе дозируемых растворов.
Неврологическая оценка
Перед индукцией мозговой ишемии крыс для исследования 1 тренировали ходить по брусу и в тесте с наклейками. Животных, не удовлетворяющих критериям в обоих тестах, исключали из дальнейшего исследования. После тренировки оставшихся животных разделяли в соответствии с характеристиками на две равные группы. В процессе неврологической оценки исследователи не имели информации относительно обрабатываемой группы животных.
Билатеральный тест с наклейками
Билатеральный тест с наклейками (Schallert et al., Pharmacology Biochemistry and Behaviour 16: 455-462, (1983)) использовали для оценки контралатеральной потери чувствительности/ипсилатерального нарушения равновесия. Это моделирует угасание тактильных ощущений, наблюдаемое у пациентов-людей, страдающих инсультом (Rose, et al., 1994). Этот тест был подробно описан ранее (Hunter, et al., Neuropharmacology 39: 806-816 (2000); Virley et al., Journal of Cerebral Blood Flow & Metabolism. 20: 563-582 (2000)). В кратком изложении, круглую бумажную наклейку плотно обертывали вокруг безволосой области передних лап с равным давлением в случайной последовательности ее расположения (левая, правая). Сеансы тренировки проводили в течение 6 суток перед МСАО, причем данные, полученные на 6 сутки, использовали в качестве базового значения перед операцией (Сутки 0). С животными проводили два испытания через 24 ч и 7 суток после МСАО, данные демонстрируют среднее значение по результатам двух испытаний, Латентность к контакту и удалению наклеек регистрировали и анализировали, используя логлинейный анализ (Сох, J. Royal Statistical Society В 34: 187-220 (1972)).
Хождение по брусу
Хождение по брусу использовали для оценки координации задних и передних конечностей как расстояние, пройденное по приподнятому 100 сантиметровому брусу (2,3 см в диаметре, 48 см над полом), как ранее было подробно описано (Virley et al., Journal of Cerebral Blood Flow & Metabolism. 20: 563-582 (2000)). Крыс тренировали переходить брус от начала до конца. Для тестирования с каждой крысой проводили 2 испытания через 24 ч и 7 суток после МСАО, данные представляют собой среднее значение из двух испытаний. Статистический анализ представляет собой ANOVA (дисперсионный анализ) с последующим t-тестом Стьюдента.
27-балльная неврологическая оценка (Исследование-1)
Это исследование состоит из серии тестов для оценки неврологического статуса, включающего в себя положение конечностей, визуальное касание передней конечностью, горизонтальное препятствие, контралатеральное кружение, наклонная плоскость, рефлекс выпрямления, контралатеральный рефлекс, подвижность и общее состояние, как было описано ранее (Hunter, et al., Neuropharmacoloqy 39: 806-816 (2000)) с дополнительными измерениями силы захвата (оценки 2 для хорошего захвата правой передней конечностью, 1 для слабого захвата). Общая оценка для нормального животного=27.
Для исследования 2 этот тест был дополнительно модифицирован: сила захвата - нормальные оценки 3, хорошая - 2, слабая - 1, очень слабая - 0; подвижность - нормальные оценки 4, превосходная - 3, очень хорошая - 2, хорошая - 1, плохая - 0; общее состояние - нормальные оценки 4, отличные - 3, очень хорошая - 2, хорошая - 1, плохая - 0; кружение - отсутствие - оценка 5, предпочтительно одностороннее - оценка 4, большой круг - 3, средний круг - 2, маленький круг - 1, кружение вокруг оси - 0. Общая оценка для нормального животного=32.
В обоих исследованиях животных тестировали через 1, 24, 48 ч и 7 суток после МСАО, оценки здоровых нормальных животных составляли 27 или 32 соответственно. Данные представлены в виде средних значений, статистический анализ представляет собой анализ ANOVA Крускил-Валлиса (Kruskil Wallis).
Оценка повреждения
Исследование 1 - Для каждого животного площади повреждения оценивали на срезах из трех предварительно определенных уровней головного мозга (0, -2,0 и -6,0 мм от темени соответственно). Неврологическое повреждение оценивали, используя окрашивание крезиловым фиолетовым быстрым, и площадь повреждения измеряли с использованием пакета визуализации Optimas 6.1. Данные выражены в виде средней площади (мм2) ± стандартная ошибка среднего (sem).
Исследование 2 - Для каждого животного оценивали площади повреждения на срезах из семи предварительно определенных уровней головного мозга (от +3 до -8 мм относительно темени). Повреждение нейронов оценивали, используя окрашивание крезиловым фиолетовым быстрым, и площадь повреждения оценивали, используя пакет визуализации Optimas 6.1. Данные выражены в виде средней площади (мм2) ± sem.
Результаты
Исследование 1 - Интрацеребровентикулярное (и.ц.в.) введение анти-MAG mAb
Неврологическая оценка
Через один час после МСАО животные в обеих обрабатываемых группах демонстрировали заметное ухудшение неврологической оценки (средняя оценка 12 в каждой группе). В этот момент не наблюдалось значительного различия между группами. Однако через 24 ч (р=0,02), 48 ч (р=0,005) и 7 суток (р=0,006) после МСАО животные, обработанные анти-MAG mAb (2,5 мкг, 1, 24 и 72 ч после МСАО), демонстрировали значительно лучшую общую неврологическую оценку по сравнению с животными, обработанными контрольным IgG. Средние значения неврологических оценок через 24, 48 ч и 7 суток после МСАО в группе, обработанной IgG1, составляли 15, 14 и 18 соответственно по сравнению с 19,5, 21,5 и 22 для животных, обработанных анти-MAG mAb. В дополнительных анализах индивидуального поведения, включающих общую оценку, это значительное улучшение было в основном отнесено к улучшенному показателю в следующих тестах: положение конечности (24 ч, р=0,045; 48 ч, р=0,016; 7 суток, р=0,008), сила захвата (24 ч, р=0,049, 48 ч, р=0,0495; 7 суток, р=0,243), подвижность (24 ч, р=0,199; 48 ч, р=0,012; 7 суток, р=0,067), горизонтальное препятствие (24 ч, р=0,065; 48 ч, р=0,005; 7 суток, р=0,016), наклонная плоскость (24 ч, р=0,006; 48 ч, р=0,006; 7 суток, р=0,169), визуальное касание передней конечностью (48 ч, р=0,049, 7 суток, р=0,049) и степень кружения (24 ч, р=0,417; 48 ч, р=0,034; 7 суток, р=0,183).
Хождение по брусу
Перед операцией всех животных тренировали пересекать брус (100 см). Через двадцать четыре часа после операции наблюдалось значительное ухудшение расстояния, пройденного по брусу животными, обработанными как анти-MAG (50±18 см), так и IgG1 (22±14 см), по сравнению со значениями до операции. Хотя и не существенно, животные, обработанные анти-MAG, демонстрировали значительное улучшение по сравнению с животными, обработанными IgG1, так как через 24 ч после МСАО они преодолевали вдвое большую дистанцию по сравнению с животными, обработанными IgG1. Однако через семь суток после операции, хотя обе группы продемонстрировали значительное улучшение по прошествии времени, показатели животных, обработанных IgG, оставались значительно худшими по сравнению с базовым значением (55±15 см; р=0,005). Однако в отличие от этого через 7 суток после МСАО показатели животных, обработанных анти-MAG mAb (2,5 мкг, через 1, 24 и 72 ч и.ц.в. после МСАО), существенно не отличались от базового значения (75±15 см; р=0,07). Эти данные демонстрируют, что обработка анти-MAG mAb усиливает восстановление выполнения этого задания хождения по брусу по сравнению с контролями, обработанными мышиным IgG1.
Наклейка
Перед операцией животные в каждой обрабатываемой группе быстро касались и удаляли наклейки с каждой передней конечности, перед обработкой не было значительного различия между группами (Таблица 1). Через двадцать четыре часа и 7 суток после МСАО латентность к касанию левой конечности в каждой обрабатываемой группе оставалась относительно неизменной, тогда как для правой конечности значительно увеличивалась. Однако не наблюдалось значительных различий между временем удаления у животных, обработанных анти-MAG и IgG1. Кроме того, через 24 ч после МСАО латентность к удалению с обоих - левой и правой передней конечностей - значительно увеличивалась в обеих обрабатываемых группах по сравнению с базовым значением, однако у животных, обработанных анти-MAG, латентность к удалению с левой конечности была значительно короче по сравнению с животными, обработанными IgG1 (p=0,03). Также наблюдалась тенденция к уменьшенной латентности к удалению с правой конечности у животных, обработанных анти-MAG, по сравнению с животными, обработанными IgG1 (p=0,08) (Таблица 1). На 7 сутки наблюдалась некоторая степень восстановления у животных, обработанных IgG1, выраженная в том, что латентность ко времени удаления для каждой передней конечности уменьшалось по сравнению с латентностью через 24 ч (Таблица 1). Эти данные свидетельствуют о том, что обработка крыс анти-MAG mAb ускоряет восстановление в этом тесте с наклейками после tMCAO.
Таблица 1 - Данные теста с наклейками
(*р=0,03 анти-MAG по сравнению с IgG1, используя логлинейный тест)
Измерения площади повреждения
Введение анти-MAG mAb и.ц.в. значительно уменьшало площадь повреждения в двух из трех исследованных уровней мозга по сравнению с животными, обработанными равным количеством мышиного IgG1 при оценке через 7 суток после МСАО (Таблица 2).
Таблица 2
(*р=0,02, $р=0,03, #р=0,06, анти-MAG по сравнению с IgG1, используя односторонний непарный t-тест Стьюдента)
Исследование 2 - Внутривенное (в.в.) введение
Неврологическая оценка
Через один час после МСАО животные в обеих группах демонстрировали заметное ухудшение неврологической оценки. В этот момент не наблюдалось значительного различия между группами, средние оценки через 24 ч после обработки анти-MAG mAb и IgG1 составляли 20 и 18 соответственно (р=0,5). Через сорок восемь часов после МСАО животные, обработанные анти-MAG mAb (200 мкг, в.в. через 1 и 24 ч после МСАО), демонстрировали значительное улучшение положения конечности (р=0,048) и силы захвата (р=0,033). Через семь суток после начала ишемии мозга животные, обработанные анти-MAG mAb, продолжали демонстрировать улучшение (положение конечности р=0,041; сила захвата р=0,048; подвижность р=0,05) и демонстрировали значительное улучшение общей неврологической оценки (средняя оценка 25) по сравнению с животными, обработанными мышиным IgG1 (средняя оценка 23, р=0,047).
Измерения площади повреждения
Анти-MAG антитело при в.в. введении после МСАО значительно уменьшало площадь повреждения в 5 из 7 предварительно определенных уровней мозга (от +3 до -8 мм относительно темени) по сравнению с изотипными контролями при оценке через 7 чуток после МСАО.
*p<0,05 - непарный односторонний t-тест Стьюдента
Заключения
Моноклональное анти-MAG антитело при введении как непосредственно в CSF (спинномозговую жидкость) или внутривенно после преходящей окклюзии средней мозговой артерии у крысы уменьшает площадь клеточной гибели и улучшает функциональное восстановление по сравнению с животными, обработанными контролем. Степень нейропротекции, наблюдаемая в этих исследованиях, свидетельствует о том, что это действие не может относиться к спрутингу аксонов, так как это не приводит в результате к сохранению нейронов. Улучшение функционального восстановления, наблюдаемое через 24 и 48 ч после МСАО, вероятно, отражает степень нейропротекции, обеспечиваемую этим антителом по сравнению с контрольными обработанными животными. Однако с течением времени состояние животных, по-видимому, дополнительно улучшается, что свидетельствует о том, что блокирующая MAG активность также может с течением времени усиливать функциональное восстановление.
Представленные здесь исследования являются доказательством того, что блокирование действий MAG обеспечивает как нейропротекцию, так и усиленное функциональное восстановление в модели инсульта у крыс и, следовательно, анти-MAG антитела являются потенциальными терапевтическими агентами для нейропротекции в острых состояниях и/или усиления функционального восстановления после инсульта. Низкие количества антитела, вводимого внутривенным путем, и получаемые в результате низкие уровни антитела в сыворотке крови, в свою очередь, должны свидетельствовать о чрезвычайно низких концентрациях антитела в мозге вследствие ограниченного проникновения антитела через гематоэнцефалический барьер. Неожиданно, однако, это все же привело в результате как к наблюдаемой нейропротекции, так и усиленному функциональному восстановлению. Анти-MAG антитела также могут быть потенциально использованы в лечении других неврологических расстройств, при которых очевидно разрушение клеток и/или нервных волокон, таких как повреждение спинного мозга, травма головного мозга, периферическая невропатия, болезнь Альцгеймера, лобно-височные деменции (тауопатии), болезнь Паркинсона, болезнь Гентингтона и рассеянный склероз. В следующих примерах CDR химерных и гуманизированных антител, описанных здесь, представляют собой CDR антитела Примера 1.
Пример 2 - Химерное антитело
Измененные антитела включают химерные антитела, которые содержат вариабельные области, происходящие от одних видов, связанные с константными областями из других видов. Примеры цепей мышино-человеческого химерного анти-MAG иммуноглобулина по изобретению представлены на Фиг.1, 2 и 3. Могут быть получены мышино-человеческие химеры с использованием константных областей человеческих IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM, IgD, а также химеры, в которых мышиные вариабельные области находятся в ассоциации с константными областями тяжелых или легких цепей видов, отличных от человека.
На Фиг.1 (Seq ID No. 27) представлена аминокислотная последовательность химерной иммуноглобулиновой тяжелой цепи, в которой вариабельная область мышиной анти-MAG тяжелой цепи ассоциирована с функциональной сигнальной последовательностью секреции иммуноглобулина и с измененной формой константной области человеческого IgG1, где Kabat остатки 248 и 250 изменены на аланин, чтобы блокировать эффекторные функции связывания с FcγRI и белком комплемента C1q (Duncan, A. R. and Winter, G. Localization of the C1q binding site on antibodies by surface scanning. Nature 332, 738-740, 1988. Duncan, A. R., Woolf, J. M., Partridge, L. J., Burton, D. R. and Winter, G. Localisation of the binding site for human FcRt on IgG. Nature 332, 563-564, 1988). Такие мутации, возможно, осуществляют для того, чтобы настроить свойства измененного антитела на достижение конкретного терапевтического эффекта - например связывания с антигеном и блокирования его функции без активации литических эффекторных механизмов.
На Фиг.2 (Seq ID No. 28) представлена аминокислотная последовательность легкой цепи химерного иммуноглобулина, в которой вариабельная область мышиной анти-MAG легкой цепи ассоциирована с функциональной сигнальной последовательностью секреции иммуноглобулина и с человеческой константной областью каппа.
Аналогично, анти-MAG вариабельные области могут быть ассоциированы с константными областями иммуноглобулина, которые лишены мутаций, блокирующих эффекторные функции. На Фиг.3 (Seq ID No. 29) представлена аминокислотная последовательность тяжелой цепи химерного иммуноглобулина, где вариабельная область тяжелой цепи мышиного анти-MAG антитела ассоциирована с функциональной сигнальной последовательностью секреции иммуноглобулина и с формой дикого типа константной области человеческого IgG1.
Согласно информации, представленной на Фиг.1-3, вставки кДНК, кодирующие эти химерные цепи, могут быть получены стандартными методами молекулярной биологии, хорошо известными специалистам в данной области техники. В кратком изложении, генетический код используется для идентификации нуклеотидных кодонов, кодирующих желательные аминокислоты, создавая виртуальную последовательность кДНК, кодирующую химерный белок. Если желательно, чтобы кДНК вставка экспрессировалась в конкретном организме, то могут быть выбраны имеющие особенные преимущества кодоны в соответствии с известными мнениями по использованию кодонов. Затем синтезируют желательную нуклеотидную последовательность посредством РСР (полимеразная цепная реакция) амплификации матрицы, содержащей перекрывающиеся синтетические олигонуклеотиды, которые при сближении представляют собой желательную последовательность. Полученный в результате продукт также может быть модифицирован посредством PCR или мутагенеза с присоединением сайтов рестрикции для облегчения клонирования в подходящую плазмиду для экспрессии или дополнительных манипуляций.
Пример 3 - Химерное антитело связывается с крысиным MAG в ELISA
Химерное анти-MAG антитело, содержащее CDR легкой и тяжелой цепей по данному изобретению, получали путем временной трансфекции СНО клеток. Для этого использовали реактив для трансфекции Transfast (Promega; E2431), и трансфекции осуществляли в соответствии с инструкциями производителей. В кратком изложении, приблизительно 106 СНО клеток вносили в каждую лунку 6-луночных культуральных планшетов. На следующие сутки ДНК вектора экспрессии млекопитающего, кодирующую соответствующую тяжелую или легкую цепь, смешивали в отношении 1:1 (5 мкг ДНК всего) в среде (Optimeml с Glutamax; Gibco #51985-026). Добавляли реактив для трансфекции Transfast и раствор переносили в лунки с конфлюэнтными слоями клеток. Через 1 ч при 37°C в инкубаторе для клеток смесь ДНК/Transfast покрывали 2 мл среды Optimam и оставляли в инкубаторе на 48-72 ч. Супернатанты собирали, очищали центрифугированием и пропускали через фильтры 0,2 мкм. Концентрацию антител в супернатанте СНО клеточной культуры определяли посредством ELISA и оцениваемая концентрация составляла 0,5 мкг/мл. Для связывания MAG использовали имеющиеся в продаже крысиный MAG-Fc. Благодаря слиянию с человеческим Fc, химерные антитела нельзя обнаружить, используя вторичные антитела против человеческого IgG. Вместо этого использовали специфичное антитело против человеческой легкой цепи каппа. На Фиг.4 показано, что это химерное антитело связывается с MAG даже в разведении 1/64. Неродственное гуманизированное антитело и культуральный супернатант ложно-трансфецированных клеток не порождали какого-либо сигнала в этом анализе.
Методика:
Микротитрационные планшеты ELISA (Nunc Maxisorp) покрывали 1 мкг/мл слитым белком - крысиный MAG-Fc (R & D systems; 538-MG) в PBS (фосфатном буферном растворе) при 4°C в течение ночи. Планшеты дважды промывали PBS и затем блокировали смесью PBS/BSA (бычий сывороточный альбумин) (1 мас.%) в течение 1 ч при комнатной температуре (RT). Культуральные супернатанты временно трансфецированных СНО клеток пропускали через фильтры 0,2 мкм и последовательно разводили в смеси PBS/BSA, начиная с неразбавленного супернатанта до разведения 1/64. Разведенные образцы оставляли при комнатной температуре на 1 ч. Планшеты затем трижды промывали смесью PBS/Tween 20 (0,1 об.%). Обнаруживающее антитело представляло собой конъюгат - козье антитело специфичное против легкой цепи каппа человека с пероксидазой (Sigma A-7164), разбавленный 1/2000 в смеси PBS/BSA. Обнаруживающее антитело инкубировали в течение 1 ч при комнатной температуре и планшеты промывали, как описано выше. Раствор субстрата добавляли (Sigma Fast OPD Р-9187) и инкубировали до момента обнаружения подходящего развития окраски и затем останавливали, используя 3 М H2SO4. Развитие окраски считывали при 490 нм.
Пример 4 - Гуманизированные антитела
Измененные антитела включают гуманизированные антитела, которые содержат гуманизированные вариабельные области, связанные с человеческими константными областями. Примеры цепей гуманизированных анти-MAG иммуноглобулиновых цепей по данному изобретению представлены на Фиг.5. Могут быть получены гуманизированные антитела с использованием константных областей человеческого IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM, IgD.
На Фиг.5 (Seq ID No. 30) представлен пример аминокислотной последовательности тяжелой цепи гуманизированного иммуноглобулина, в которой вариабельная область гуманизированной анти-MAG тяжелой цепи ассоциирована с функциональной сигнальной последовательностью для секреции иммуноглобулина, и с измененной формой константной области человеческого IgG1, где Kabat остатки 248 и 250 изменены на аланин для того, чтобы блокировать эффекторные функции связывания с FcγRI и белком комплемента C1q (Duncan, A. R. and Winter, G. Localization of the C1q binding site on antibodies by surface scanning. Nature 332, 738-740, 1988. Duncan, A. R., Woolf, J. М., Partridge, L. J., Burton, D. R. and Winter, G. Localisation of the binding site for human FcRt on IgG. Nature 332, 563-564, 1988). Такие мутации возможно получают для того, чтобы настроить свойства измененного антитела на достижение конкретного терапевтического эффекта - например связывания с антигеном и блокирования его функции без активации литических эффекторных механизмов.
На Фиг.5 (Seq ID No. 31) также представлен пример аминокислотной последовательности легкой цепи гуманизированного иммуноглобулина, где вариабельная область гуманизированной анти-MAG легкой цепи ассоциирована с функциональной сигнальной последовательностью секреции иммуноглобулина и с человеческой константной областью каппа.
Аналогично анти-MAG вариабельные области могут быть ассоциированы с константными областями иммуноглобулина, которые лишены мутаций, блокирующих эффекторные функции. На Фиг.5 (Seq ID No. 32) представлена аминокислотная последовательность тяжелой цепи гуманизированного иммуноглобулина, где вариабельная область анти-MAG тяжелой цепи ассоциирована с функциональной сигнальной последовательностью секреции иммуноглобулина и с константной областью формы дикого типа человеческого IgG1.
Согласно информации, представленной на Фиг.5, вставки кДНК, кодирующие эти гуманизированные цепи, могут быть получены стандартными методами молекулярной биологии, хорошо известными специалистам в данной области техники. В кратком изложении, генетический код используется для идентификации нуклеотидных кодонов, кодирующих желательные аминокислоты, создавая виртуальную последовательность кДНК, кодирующую белок. Если желательно, чтобы вставка кДНК экспрессировалась в конкретном организме, то могут быть выбраны кодоны, имеющие особенные преимущества, в соответствии с известными мнениями по использованию кодонов. Затем синтезируют желательную нуклеотидную последовательность посредством PCR амплификации матрицы, содержащей перекрывающиеся синтетические олигонуклеотиды, которые при сближении представляют собой желательную последовательность. Полученный в результате продукт также можно модифицировать посредством PCR или мутагенеза для присоединения сайтов рестрикции, чтобы облегчить клонирование в подходящую плазмиду для экспрессии или дополнительных манипуляций.
Пример 5 - Гуманизированные анти-MAG антитела связываются с крысиным и человеческим MAG в ELISA
1) Прямое связывание ELISA с крысиным MAG-Fc слитым белком нормализованных количеств культуральных супернатантов 9-ти гуманизированных комбинаций тяжелых и легких цепей
Гуманизированные анти-MAG антитела, содержащие CDR легких и тяжелых цепей по изобретению, получали посредством временной трансфекции СНО клеток. Для этого использовали реактив для трансфекции Transfast (Promega; E2431), и трансфекции осуществляли в соответствии с инструкциями производителей. В кратком изложении приблизительно 106 СНО клеток вносили в каждую лунку 6-луночных культуральных планшетов. На следующие сутки ДНК вектора экспрессии млекопитающего, кодирующую подходящую тяжелую или легкую цепь, смешивали в соотношении 1:1 (5 мкг ДНК всего) в среде (Optimeml с Glutamax; Gibco #51985-026). Добавляли реактив для трансфекции Transfast и раствор переносили в лунки с конфлюэнтными слоями клеток. Через 1 ч при 37°С в инкубаторе для клеток смесь ДНК/Т ransfast покрывали 2 мл среды Optimam и оставляли в икубаторе на 48-72 ч. Супернатанты собирали, очищали центрифугированием и пропускали через фильтры 0,2 мкм. 9 комбинаций тяжелых и легких вариабельных цепей получали из последовательностей, представленных в приведенной ниже таблице, и константные области тяжелой цепи IgG1 были функциональны по отношению к Sed ID.
Концентрацию антител определяли посредством ELISA, и количества супернатантов, используемых в анализе, нормализовали к исходной концентрации 250 или 500 нг/мл (в зависимости от концентрации культурального супернатанта). В качестве антигена использовали имеющийся в продаже крысиный MAG-Fc (R&D Systems; 538-MG). Благодаря слиянию этого антигена с человеческим Fc связанные химерные антитела нельзя было обнаружить, используя обычные вторичные антитела против человеческого IgG. Вместо этого использовали специфичное антитело против человеческой легкой цепи каппа. На Фиг.6 показано, что все 9 гуманизированные антитела, испытанные здесь, связывались с крысиным MAG с очень похожими кривыми связывания до приблизительно 4 нг/мл. Используемое для сравнения химерное антитело демонстрировало характеристики связывания, которые попадали в группу испытанных здесь гуманизированных антител. Хотя и небезусловно, это может свидетельствовать о том, что аффинности испытанных здесь гуманизированных антител оказывались очень близко к диапазону аффинности используемого здесь для сравнения негуманизированного химерного антитела.
Методика:
96-луночные планшеты Nunc Maxisorp покрывали на ночь при 4°С слитым белком - крысиный MAG-Fc (1 мкг/мл; R & D systems; 538-MG) в PBS. Планшеты дважды промывали PBS, содержащим Tween 20 (0,1 об.%; PBST), и блокировали PBS, содержащим BSA (1 мас./об.%) в течение 1 ч при комнатной температуре (RT). Различные количества культуральных супернатантов последовательно разводили в блокирующем буфере и добавляли к блокированным лункам, начиная с приблизительно 500 или 250 нг/мл. Концентрации антител в супернатантах были основаны на независимых анализах, оценивающих количество гуманизированного антитела, присутствующего в каждом культуральном супернатанте. Для сравнения также было включено химерное мышино-человеческое (негуманизированное) антитело. Образцы антител инкубировали в течение 1 ч при комнатной температуре и затем планшеты 3 раза промывали PBST. Добавляли вторичное антитело (конъюгат специфичного козьего антитела против человеческой легкой цепи с пероксидазой; Sigma A-7164), разбавленное 1/5000 в блокирующем буфере, и инкубировали в течение 1 ч при комнатной температуре. Лунки промывали три раза, как описано выше, и связывание обнаруживали посредством добавления субстрата (таблетки OPD (орто-фенилендиамина дигидрохлорида), растворенные в соответствии с указаниями; Sigma P-9187). Следили за развитием окраски и реакцию останавливали, используя 3М H2SO4. Развитие окраски считывали при длине волны 490 нм.
2) Прямое связывание ELISA с крысиным MAG-Fc слитым белком двух очищенных комбинаций тяжелой-легкой цепей гуманизированного анти-MAG антитела
Два гуманизированных антитела, состоящих из комбинаций вариабельных областей тяжелых и легких цепей BVh1/CVI1 и BVh3/CVI3 (Таблица, Фиг.5) и мутантной константной области IgG1, пример которых представлен в виде SEQ ID No: 30 (представляет собой BVh1/CVI1 мутантный IgG1, специалист в данной области техники может легко получить последовательность для BVh3/CVI3 эквивалента), получали посредством увеличенной в масштабе версии временной трансфекции, описанной в Примере 3, и очищали, используя аффинную хроматографию с белком А. Вещество очищенных антител диализовали против PBS и концентрацию определяли путем считывания OD280 (оптической плотности при длине волны 280 нм). Концентрации антител доводили до 5000 нг/мл и использовали в качестве последовательных разведении в ELISA связывании крысиного MMAG-Fc. На Фиг.7 показано, что очищенное вещество антител связывается с крысиным MAG-Fc и что обе комбинации вариабельных областей тяжелых и легких цепей были, испытанные здесь, очень похожи.
Способ:
96-луночные Nunc Maxisorp планшеты покрывали на ночь при 4°C слитым белком - крысиный MAG-Fc (2,5 мкг/мл; R & D systems; номер по каталогу 538-MG) в PBS. Планшеты дважды промывали PBS, содержащим Tween 20 (0,1% об.; PBST), и блокировали PBS, содержащим BSA (1 мас./об.%), в течение 1 ч при комнатной температуре (RT). Очищенное гуманизированное антитело доводили до исходной концентрации 5 мкг/мл в блокирующем буфере и затем последовательно разводили. Образцы антител инкубировали в течение 1 ч при комнатной температуре, и затем планшеты три раза промывали PBST. Добавляли вторичное антитело (конъюгат специфичного козьего антитела против человеческой легкой цепи и пероксидазы; Sigma A-7164), разбавленное 1/5000 в блокирующем буфере, и инкубировали в течение 1 ч при комнатной температуре. Лунки трижды промывали, как описано выше, и связывание обнаруживали добавлением субстрата (таблетки OPD, растворенные в соответствии с инструкциями; Sigma P-9187). Следили за развитием окраски, и реакцию останавливали, используя 3М H2SO4. Развитие окраски считывали при 490 нм.
Результаты:
Очищенные гуманизированные антитела, как не несущие, так и несущие мутации в каркасе, демонстрировали очень похожее связывание с крысиным MAG. Результаты представлены на Фиг.7.
3) Связывание с человеческим MAG, экспрессируемым на ОНО клетках, нормализованных количеств культурального супернатанта для двух гуманизированных комбинаций тяжелых и легких цепей
Гуманизированные вариабельные комбинации тяжелой и легкой цепей, аналогичные описанным в Примере 5.2, тестировали в виде очищенных супернатантов против человеческого MAG, экспрессируемого на поверхности СНО клеток. Количество культурального супернатанта, используемого для каждого антитела, нормализовали на основании на концентраций антител, определенных ELISA. Для этого 96-луночные планшеты (Nunc Maxisorp) покрывали на ночь при 4°С козьими антителами против человеческой IgG (гамма) цепи (Sigma I-3382; в бикарбонатном буфере рН 9,6; 2 мкг/мл). На следующие сутки планшеты дважды промывали промывочным буфером (PBST) и блокировали добавлением по меньшей мере 75 мкл блокирующего буфера (PBS, содержащего 1 мас./об.% BSA) в течение 1 ч при комнатной температуре. Раствор с образцами антител последовательно разводили в блокирующем буфере (первое разведение - неразведен или разведен вдвое) в двух парралелях. Стандарт Ab представлял собой очищенное гуманизированное IgG1 антитело, имеющее неродственную специфичность и известную концентрацию. Стандартный раствор также последовательно разводили на планшете, начиная с 500 нг/мл. Растворы антител инкубировали в течение 1 ч при комнатной температуре. Планшеты промывали три раза, как описано выше, и затем инкубировали с конъюгатом специфичного (свободного и связанного) козьего антитела против человеческой легкой (каппа) цепи и пероксидазы; Sigma А-7164), разбавленным 1/5000 в блокирующем буфере, в течение 1 ч при комнатной температуре. Планшеты снова промывали три раза, как описано выше, и инкубировали с раствором субстрата (таблетки OPD; Sigma P-9187) до развития сильной окраски. Развитие окраски останавливали добавлением 25 мкл 3 М H2SO4, и планшеты считывали при 490 нм.
На Фиг.8 показано, что оба испытанные здесь антитела распознают человеческий MAG и очень близки по своим связывающим характеристикам. СНО/- представляет собой отрицательный контроль СНО клеток, у которых не экспрессируется MAG.
Способ Eu-ELISA на основе клеток
96-луночные планшеты (Costar 3595) заполняли 100 мкл клеточной суспензии/лунку (смотри в приведенной ниже таблице рекомендуемое количество клеток для проведения анализа на 1, 2, 3 или 4 сутки).
Культуральную среду удаляли и планшеты блокировали DMEM (среда Игла в модификации Дулбекко) / F12 (Sigma D6421), содержащей FCS (фетальную телячью сыворотку) (10%), BSA (1%), NaN3 (1%, блокирующий буфер) в течение 1 часа при комнатной температуре. Затем блокирующий раствор удаляли, и добавляли образец (в блокирующем буфере 50 мкл/лунку). Образцы инкубировали при 4°С в течение 1 ч. Планшеты затем промывали три раза PBS, используя аппарат для промывки планшетов Skatron. После промывания клетки фиксировали 0,5%-ным параформальдегидом (разбавленным в PBS) в течение 20 минут при 4°С и снова промывали, как описано выше. Добавляли 50 мкл/лунку вторичного антитела, конъюгированного с европием, разбавленного в европиевом буфере (50 мМ Tris-основания, 150 мМ NaCl, 0,5% BSA, 0,1 г/л Tween 20, 7,86 мг/л DTPA (диэтилентриаминпентауксусной кислоты) при рН 7,3) и инкубировали в течение 1 ч при 4°С.
Планшеты промывали, как описано выше, и добавляли 200 мкл усиливающего раствора Delphia/лунку. Раствор инкубировали при комнатной температуре в течение 5-10 минут. Лунки считывали в течение 24 часов на аппарате Victor.
4) Конкурентный ELISA для связывания с крысиным MAG-Fc слитым белком двух очищенных гуманизированных антител и негуманизированного мышиного моноклонального антитела
96-луночные планшеты Nunc Maxisorp покрывали на ночь при 4°С крысиным MAG-Fc слитым белком (2,5 мкг/мл; R&D systems; 538-MG) в PBS. Планшеты дважды промывали PBS, содержащим Tween 20 (0,1 об.%; PBST), и блокировали PBS, содержащим BSA (1 мас./об.%), в течение 1 ч при комнатной температуре (RT). Очищенное гуманизированное антитело доводили до исходной концентрации 200 нг/мл и смешивали в равном объеме с конкурентными молекулами, приготовленными в блокирующем буфере, в интервале от 6000 до 0 нг/мл. Конкуренты представляли собой или парентеральное мышиное моноклональное антитело (анти-MAG) или неродственное мышиное моноклональное антитело (INN1) в тех же концентрациях (только BVh1/CVI1). Растворы антитело/конкурент инкубировали в течение 1 ч при комнатной температуре и затем планшеты промывали три раза PBST. Добавляли вторичное антитело (конъюгат специфичного козьего антитела против человеческой легкой цепи и пероксидазы; Sigma A-7164), разбавленное 1/5000 в блокирующем буфере, и инкубировали в течение 1 ч при комнатной температуре. Лунки трижды промывали, как описано выше, и связывание обнаруживали добавлением субстрата (таблетки OPD, растворенные в соответствии с инструкциями; Sigma P-9187). Развитие окраски измеряли при 490 нм.
Результаты:
С обоими препаратами очищенного антитела в равной степени конкурировало исходное мышиное моноклональное антитело, но не мышиное моноклональное антитело, которое обладало неродственной специфичностью - смотри Фиг.9. Это указывает на то, что исходное мышиное моноклональное антитело и гуманизированные антитела, испытываемые здесь, возможно, распознают один и тот же эпитоп и, возможно, обладают очень близкими аффинностями к крысиному MAG.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНЫЕ IL4-АНТИТЕЛА, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ, СВЯЗАННЫХ С ДЕЙСТВИЕМ IL4 | 1994 |
|
RU2162711C2 |
| АНТИТЕЛО К GD2-O-АЦЕТИЛИРОВАННОМУ ГАНГЛИОЗИДУ С ПРОАПОПТОЗНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2679715C1 |
| АНТИТЕЛА ПРОТИВ CD40 И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2796413C2 |
| АНТИТЕЛА К HER3 И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2560583C2 |
| ХИМЕРНЫЕ И ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ ИНТЕГРИНА α5β1, КОТОРЫЕ МОДУЛИРУЮТ АНГИОГЕНЕЗ | 2003 |
|
RU2346701C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-CD40-АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2407544C2 |
| Антитело против PD-1 и его применение | 2017 |
|
RU2739610C1 |
| АНТИТЕЛА К БЕЛКУ ПРОГРАММИРУЕМОЙ КЛЕТОЧНОЙ СМЕРТИ 1 | 2018 |
|
RU2812915C2 |
| АНТИТЕЛА ПРОТИВ ИНТЕРФЕРОНА-АЛЬФА | 2002 |
|
RU2314317C2 |
| АНТИТЕЛА К ErbB3 | 2011 |
|
RU2568051C2 |



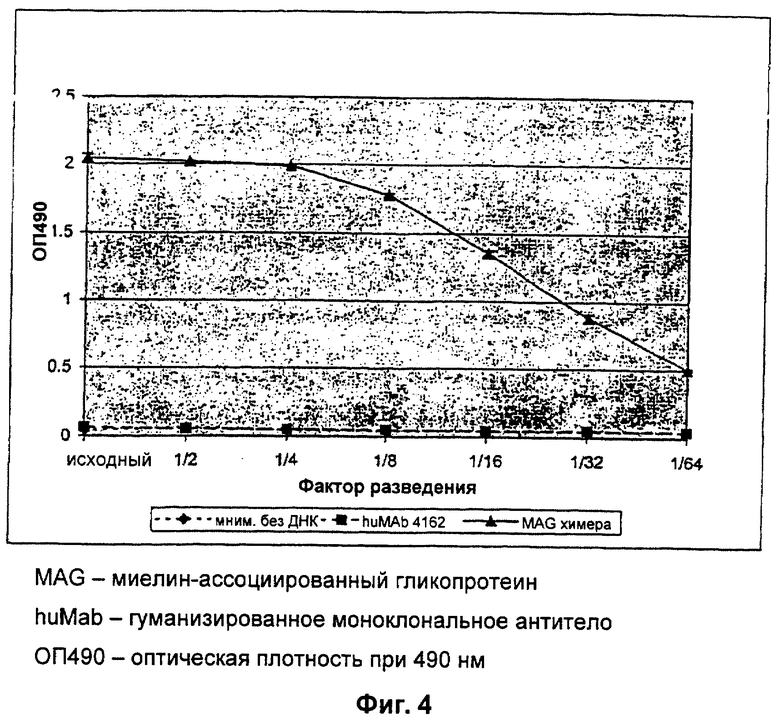

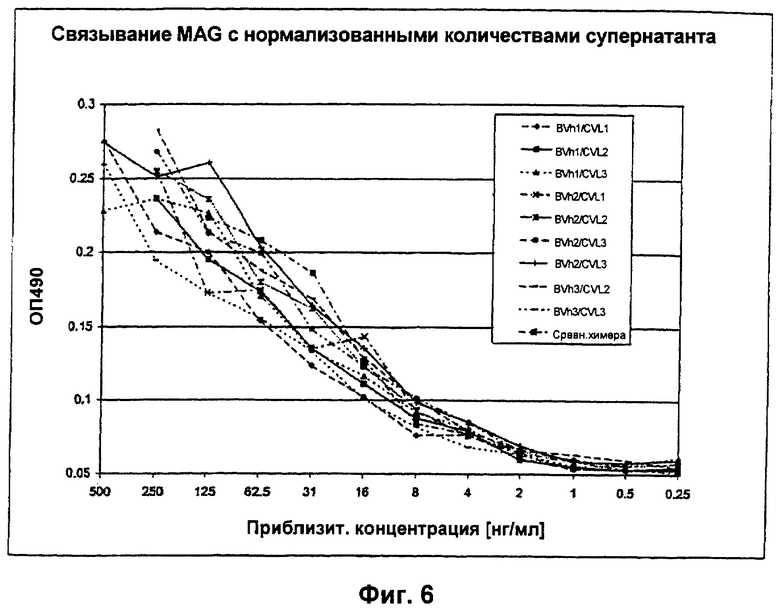
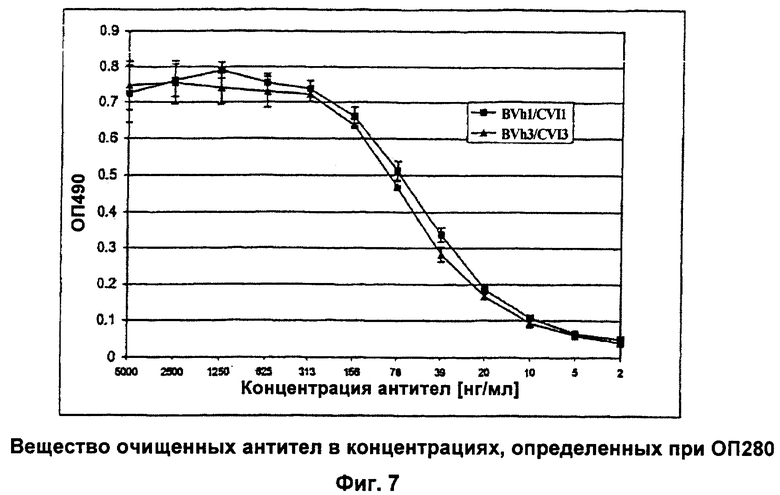

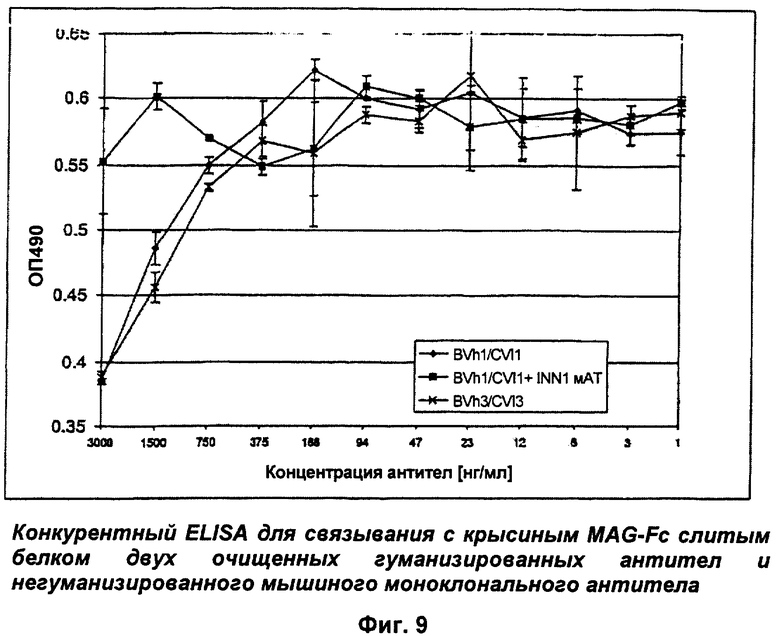
Настоящее изобретение относится к области медицины и касается антител против миелин-ассоциированного гликопротеина (MAG). Сущность изобретения включает гуманизированное антитело или его функциональный фрагмент, которые связываются с MAG (миелин-ассоциированным гликопротеином), а также фармацевтическую композицию, содержащую их, и к применению таких антител в лечении и/или профилактики неврологических заболеваний/расстройств, особенно инсульта. Преимущество изобретения заключается в усилении нейропротекции в острой фазе. 2 н. и 4 з.п. ф-лы, 9 ил.
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
Авторы
Даты
2007-07-27—Публикация
2003-08-05—Подача