ПЕРЕКРЕСТНАЯ ССЫЛКА
Данная заявка притязает на приоритет предварительной заявки на патент США №60/971161 с названием «Соединения, модулирующие внутриклеточный кальций», поданной 10 сентября 2007 г., полностью включенной сюда посредством ссылки.
OБЛАСТЬ ИЗОБРЕТЕНИЯ
Здесь описаны соединения, фармацевтические композиции и лекарственные средства, содержащие такие соединения, и способы применения таких соединений для модуляции активности депо-управляемых кальциевых каналов (SOC-каналов).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Кальций играет жизненно важную роль в функционировании и выживании клеток. Например, кальций является ключевым элементом при трансдукции сигналов внутрь и в пределах клеток. Инициация клеточных ответов на факторы роста, нейромедиаторы, гормоны и множество других сигнальных молекул происходит посредством кальций-зависимых процессов.
Практически все типы клеток некоторым образом зависят от генерирования цитоплазматических Са2+-сигналов для регуляции функционирования клеток или для запуска определенных ответов. Цитозольные Са2+-сигналы контролируют широкий спектр клеточных функций от короткосрочных ответов, таких как сокращение и секреция, до долгосрочной регуляции клеточного роста и пролиферации. Обычно эти сигналы включают какую-либо комбинацию высвобождения Са2+ из внутриклеточных депо, таких как эндоплазматический ретикулум (ER), и поступление Са2+ через плазматическую мембрану. В одном примере активация клетки начинается со связывания агониста с поверхностным мембранным рецептором, связанным с фосфолипазой С (PLC) посредством механизма, включающего G-белок. Активация PLC приводит к образованию инозит-1,4,5-трифосфата (IP3), который, в свою очередь, активирует рецептор IP3, вызывая высвобождение Са2+ из ER. Затем падение содержания Ca2+ в ER является сигналом для депо-управляемых кальциевых каналов (SOC-каналов) плазматической мембраны.
Депо-управляемый приток кальция (SOC-приток) является физиологическим клеточным процессом, контролирующим разнообразные функции, такие как, без ограничения, пополнение внутриклеточных депо Са2+ (Putney et al. Cell, 75, 199-201, 1993), активация действия ферментов (Fagan et al., J. Biol. Chem. 275:26530-26537, 2000), транскрипция генов (Lewis, Annu. Rev. Immunol. 19:497-521, 2001), пролиферация клеток (Nunez et al., J. Physiol. 571.1, 57-73, 2006) и высвобождение цитокинов (Winslow et al., Curr. Opin. Immunol. 15:299-307, 2003). В некоторых невозбудимых клетках, например клетках крови, иммунокомпетентных клетках, кроветворных клетках, Т-лимфоцитах и тучных клетках, SOC-приток происходит через кальциевые каналы, активируемые высвобождением кальция (CRAC-каналы), тип SOC-канала.
Данный механизм притока кальция был назван депо-управляемым входом кальция (SOCE). Белки молекул стромального взаимодействия (белки STIM) являются обязательным компонентом функционирования SOC-каналов, выполняя роль сенсоров для детекции уменьшения содержания кальция во внутренних депо и для активации SOC-каналов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Здесь описаны соединения формулы (I), (II), (IIA) или (IIБ), композиции, содержащие такие соединения, и способы их применения для модуляции внутриклеточного кальция. В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) модулируют внутриклеточный кальций путем ингибирования активности депо-управляемых кальциевых каналов. В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) модулируют внутриклеточный кальций, препятствуя активности комплексов активированных депо-управляемых кальциевых каналов. В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) ингибируют активацию депо-управляемых каналов. В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) ингибируют активацию кальциевых каналов, активируемых высвобождением кальция. В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) модулируют активность, модулируют взаимодействие, или модулируют уровень, или связывают, или взаимодействуют с по меньшей мере одним белком комплекса SOC-канала. В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) модулируют активность, модулируют взаимодействие, или модулируют уровень, или связывают, или взаимодействуют с по меньшей мере одним белком комплекса CRAC-канала. В одном аспекте соединение формулы (I), (II), (IIA) или (IIБ) является селективным ингибитором активности SOC-каналов. В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) является селективным ингибитором активности CRAC-каналов.
В одном аспекте здесь описано соединение формулы (I) или его фармацевтически приемлемая соль, фармацевтически приемлемый сольват или фармацевтически приемлемое пролекарство,
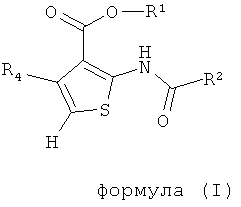
где R1 представляет собой водород, С1-С6 алкил, C1-С6 галогеноалкил или бензил;
R2 представляет собой арил, бензотиенил, бензофуранил или группу -СН2СН2-фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, С1-С6 алкила, С3-С6 циклоалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R8, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -CON(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, С1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, С1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила.
Для всех без исключения воплощений заместители могут быть выбраны из подгруппы перечисленных альтернатив. Например, в некоторых воплощениях R1 представляет собой водород или C1-С6 алкил. В других воплощениях R1 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, н-пентил или гексил. В других воплощениях R1 представляет собой Н, метил или этил. В некоторых воплощениях R1 представляет собой Н. В одном воплощении карбоксильная группировка тиофенового ядра заменена биоизостером карбоновой кислоты.
В некоторых воплощениях R2 представляет собой фенил, нафтил или бензотиенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, C1-С6 гетероалкила и C1-С6 галогеноалкила.
В некоторых воплощениях R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -N(R9)2, -CO2R9, -C(=O)R8. В некоторых воплощениях R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -OCF3, -ОМе, -OEt, -OiPr, метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, трет-бутила, фенила, -NH2, -N(Me)2, -CO2H, -CO2Me и - CO2Et.
В некоторых воплощениях R2 представляет собой фенил или бензотиенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, C1-С6 гетероалкила и C1-С6 галогеноалкила. В некоторых воплощениях R2 представляет собой фенил или бензотиенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -ОН, -CF3, -OCF3, -ОМе, метила, этила, изопропила и трет-бутила. В некоторых воплощениях R2 выбран из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 2,3-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 3-бромфенила; 4-бромфенила; 2-йодфенила; 3-йодфенила; 4-йодфенила; 2-метилфенила; 3-метилфенила; 4-метилфенила; 2,4-диметилфенила; 2,3-диметилфенила; 3,4-диметилфенила; 3,5-диметилфенила; и бензотиен-2-ила. В других воплощениях R2 выбран из фенила, 3-фторфенила; 4-фторфенила; 4-хлорфенила; 4-бромфенила; 4-йодфенила; 3-метилфенила; 3-метилфенила; и бензотиен-2-ила.
В некоторых воплощениях R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, C1-С6 фторалкила, C1-С6 гетероалкила и C1-С6 галогеноалкила. В других воплощениях R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -CF3, -ОН, -ОМе, -OCF3, метила и этила. В других воплощениях R4 выбран из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 2,3-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 3-бромфенила; 4-бромфенила; 2-йодфенила; 3-йодфенила; 4-йодфенила; 2-метилфенила; 3-метилфенила; 4-метилфенила; 2,4-диметилфенила; 2,3-диметилфенила; 3,4-диметилфенила; 3,5-диметилфенила; 2-трифторметилфенила; 3-трифторметилфенила; и 4-трифторметилфенила. В некоторых других воплощениях R4 выбран из фенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 4-бромфенила; 4-метилфенила; 3,4-диметилфенила; и 4-трифторметилфенила.
Здесь рассмотрена любая комбинация групп, описанных выше для различных переменных.
В одном аспекте соединение формулы (I) выбрано из:
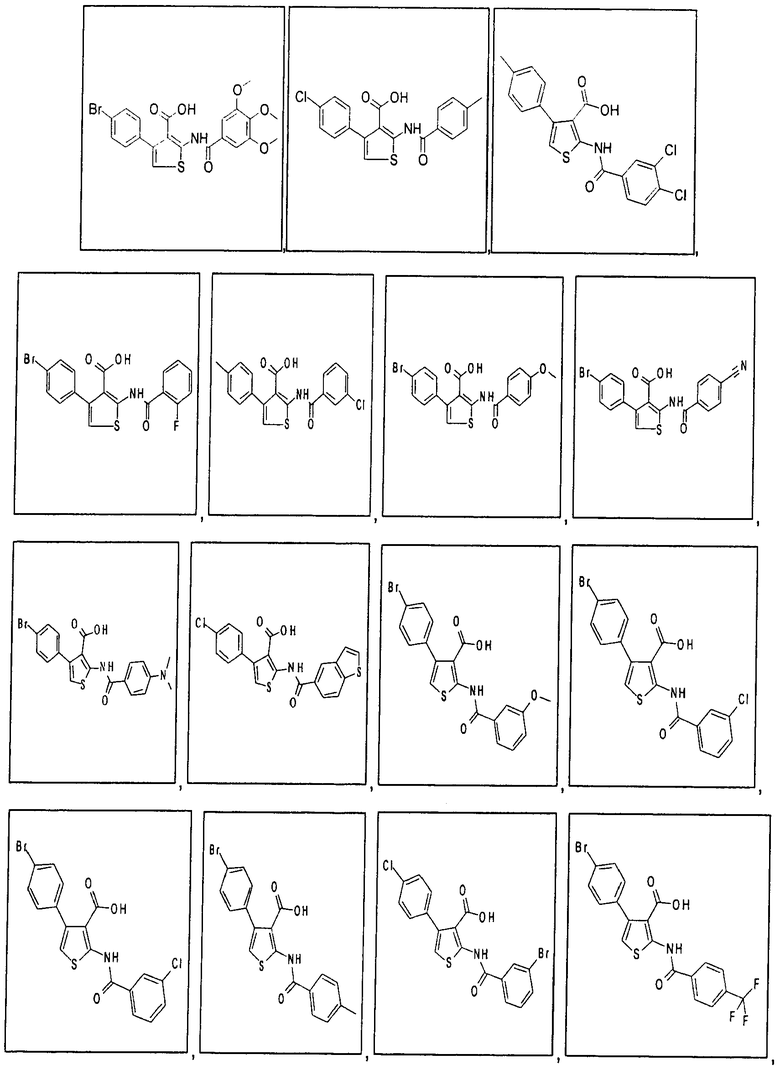
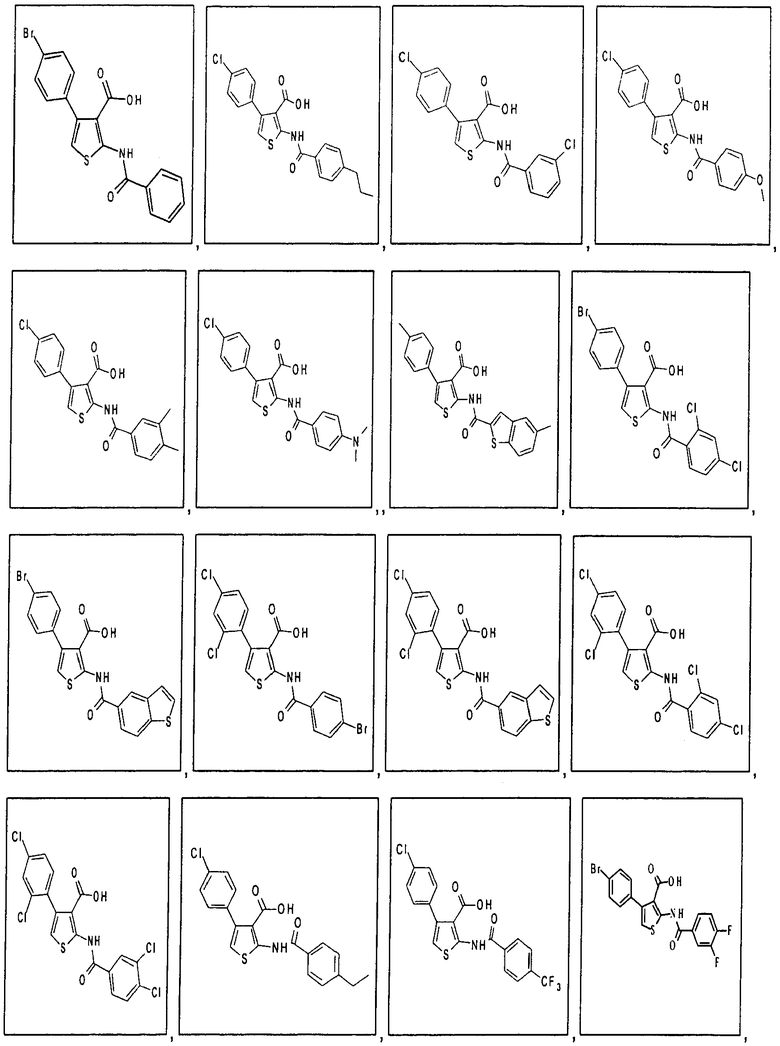
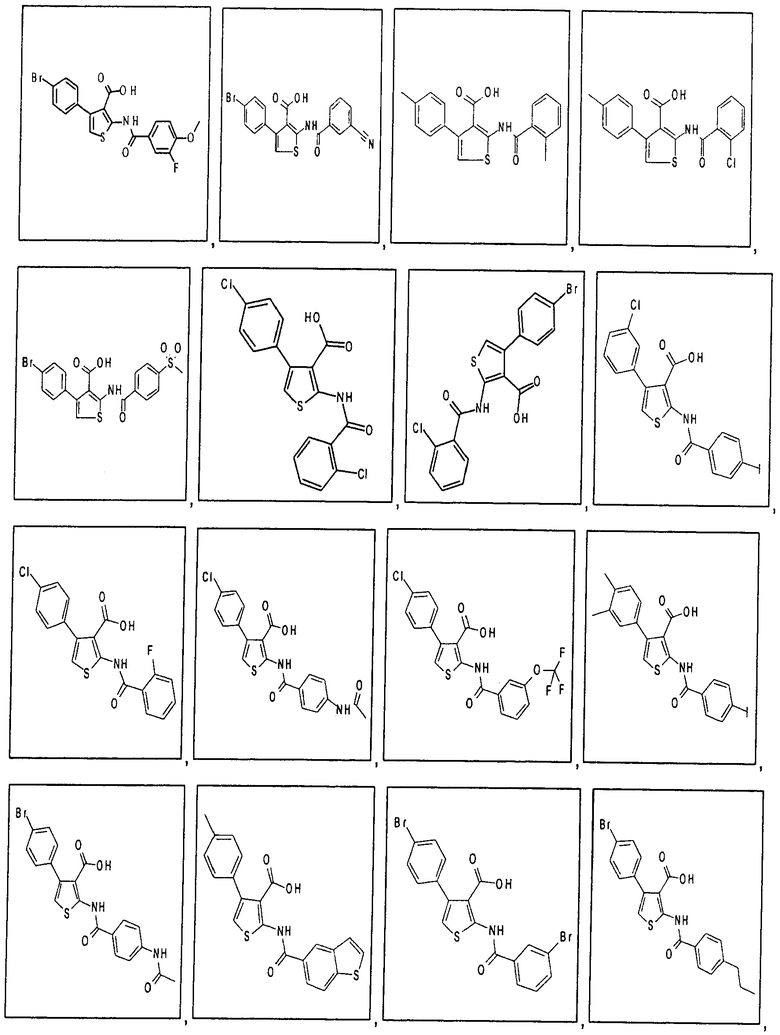
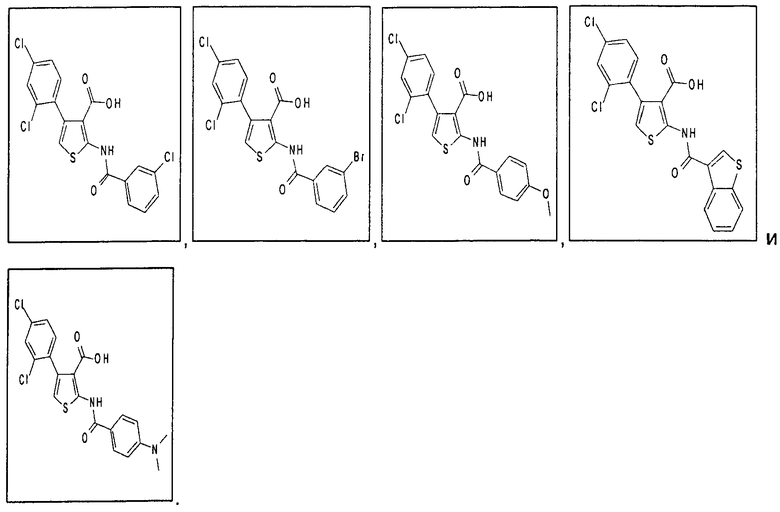
В одном аспекте здесь описан способ модуляции активности депо-управляемых кальциевых каналов (SOC-каналов), включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), (II), (IIA) или (IIБ) или его фармацевтически приемлемой солью, фармацевтически приемлемым сольватом или фармацевтически приемлемым пролекарством. В одном аспекте приведение в контакт происходит in vitro. В другом аспекте приведение в контакт происходит in vivo. В одном аспекте соединение формулы (I), (II), (IIА) или (IIБ) модулирует активность, модулирует взаимодействие, или модулирует уровень, или связывает, или взаимодействует с по меньшей мере одной частью комплекса депо-управляемого кальциевого канала, выбранного из семейства белков молекул стромального взаимодействия (STIM). В одном аспекте соединение формулы (I), (II), (IIА) или (IIБ) модулирует активность, модулирует взаимодействие, или модулирует уровень, или связывает, или взаимодействует с по меньшей мере одной частью STIM1 или STIM2. В одном аспекте модуляция активности депо-управляемых кальциевых каналов соединением формулы (I), (II), (IIA) или (IIБ) ингибирует депо-управляемый вход кальция (SOCE). В одном аспекте комплекс депо-управляемого кальциевого канала представляет собой комплекс кальциевого канала, активируемого высвобождением кальция (CRAC-канала). В одном аспекте модуляция активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), соединением формулы (I), (II), (IIA) или (IIБ) ингибирует электрофизиологический ток (ICRAC), непосредственно связанный с активированными CRAC-каналами.
В другом аспекте здесь описан способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I), (II), (IIA) или (IIБ) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства. В одном аспекте соединение формулы (I), (II), (IIA) или (IIБ) модулирует активность, модулирует взаимодействие, или модулирует уровень, или связывает, или взаимодействует с по меньшей мере одним компонентом комплекса кальциевого канала, активируемого высвобождением кальция (CRAC-канала), выбранного из семейства белков молекул стромального взаимодействия (STIM). В одном аспекте соединение формулы (I), (II), (IIA) или (IIБ) модулирует активность, модулирует взаимодействие, или модулирует уровень, или связывает, или взаимодействует с STIM1 или STIM2. В одном аспекте модуляция активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), соединением формулы (I), (II), (IIA) или (IIБ) ингибирует депо-управляемый вход кальция (SOCE). В одном аспекте модуляция активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), соединением формулы (I), (II), (IIA) или (IIБ) ингибирует электрофизиологический ток (ICRAC), непосредственно связанный с активированными CRAC-каналами. В одном аспекте соединение формулы (I), (II), (IIA) или (IIБ) ингибирует SOCE со средней ингибирующей концентрацией (IC50) менее 10 мкМ. В еще одном аспекте соединение формулы (I), (II), (IIA) или (IIБ) ингибирует электрофизиологический ток (ICRAC), непосредственно связанный с активированными CRAC-каналами, в концентрации менее 10 мкМ.
Также здесь описан способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение этому млекопитающему соединения формулы (I), (II), (IIA) или (IIБ) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства. В одном аспекте соединение формулы (I), (II), (IIA) или (IIБ) модулирует активность, модулирует взаимодействие, или связывает, или взаимодействует с белком млекопитающего STIM1 или белком млекопитающего STIM2. В одном аспекте заболевание, расстройство или состояние у млекопитающего выбрано из заболеваний/расстройств, включающих воспаление, гломерулонефрит, увеит, заболевания или расстройства печени, заболевания или расстройства почек, хроническое обструктивное заболевание легких, ревматоидный артрит, рассеянный склероз, воспалительное заболевание кишечника, васкулит, дерматит, остеоартрит, воспалительное заболевание мышц, аллергический ринит, вагинит, интерстициальный цистит, склеродермию, остеопороз, экзему, отторжение трансплантированного органа, псориаз, аллогенную или ксеногенную трансплантацию, отторжение трансплантата, реакцию «трансплантат против хозяина», красную волчанку, диабет I типа, фиброз легких, дерматомиозит, тиреоидит, тяжелую псевдопаралитическую миастению, аутоиммунную гемолитическую анемию, муковисцидоз, хронический рецидивирующий гепатит, первичный билиарный цирроз, аллергический конъюнктивит, гепатит и атопический дерматит, астму, синдром Шегрена, рак и другие пролиферативные заболевания и аутоиммунные заболевания или расстройства. В одном воплощении заболевание, расстройство или состояние представляет собой воспалительное заболевание кишечника. В другом воплощении воспалительное заболевание кишечника представляет собой неспецифический язвенный колит. В еще одном воплощении воспалительное заболевание кишечника представляет собой болезнь Крона. В одном воплощении заболевание, расстройство или состояние представляет собой псориаз. В одном воплощении заболевание, расстройство или состояние представляет собой рассеянный склероз. В одном воплощении заболевание, расстройство или состояние представляет собой ревматоидный артрит. В одном воплощении заболевание, расстройство или состояние представляет собой отторжение трансплантированного органа. В еще одном аспекте способ дополнительно включает введение млекопитающему второго терапевтического агента. В одном аспекте второй терапевтический агент выбран из иммунодепрессантов, глюкокортикоидов, нестероидных противовоспалительных лекарственных средств, специфичных ингибиторов циклооксигеназы-2 (Сох-2), лефлуномида, золото-тиоглюкозы, тиомалата золота, аурофина, сульфасалазина, гидроксихлорхинина, миноциклина, агентов против фактора некроза опухоли-α (TNF-α), абатацепта, анакинры, интерферона-β, интерферона-γ, интерлейкина-2, противоаллергических вакцин, антигистаминных агентов, антилейкотриеновых агентов, бета-агонистов, теофиллина и антихолинергических агентов. В другом аспекте второй терапевтический агент выбран из такролимуса, циклоспорина, рапамицина, метотрексата, циклофосфамида, азатиоприна, меркаптопурина, микофенолята или FTY720, преднизона, ацетата кортизона, преднизолона, метилпреднизолона, дексаметазона, бета-метазона, триамцинолона, беклометазона, ацетата флудрокортизона, ацетата дезоксикортикостерона, альдостерона, аспирина, салициловой кислоты, гентизиновой кислоты, салицилата холина-магния, салицилата холина, салицилата магния, салицилата натрия, дифлунизала, карпрофена, фенопрофена, фенопрофена кальция, флуоробипрофена (fluorobiprofen), ибупрофена, кетопрофена, набутона (nabutone), кеторолака, трометамина кеторолака, напроксена, оксапрозина, диклофенака, этодолака, индометацина, сулиндака, толметина, меклофенамата, меклофенамата натрия, мефенамовой кислоты, пироксикама, мелоксикама, целекоксиба, рофекоксиба, валдекоксиба, парекоксиба, эторикоксиба, люмиракоксиба, CS-502, JTE-522, L-745,337 и NS398, лефлуномида, золото-тиоглюкозы, тиомалата золота, аурофина, сульфасалазина, гидроксихлорхинина, миноциклина, инфликсимаба, этанерцепта, адалимумаба, абатацепта, анакинры, интерферона-β, интерферона-γ, интерлейкина-2, противоаллергических вакцин, антигистаминных агентов, антилейкотриеновых агентов, бета-агонистов, теофиллина и антихолинергических агентов.
Также здесь описан способ ингибирования связанной с депо-управляемым входом кальция (SOCE) активации ядерного фактора активированных Т-клеток (NFAT) у млекопитающего, включающий введение соединения формулы (I), (II), (IIA) или (IIБ) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства. В одном аспекте соединение формулы (I), (II), (IIA) или (IIБ) модулирует взаимодействие, или модулирует уровень, или связывает, или взаимодействует с белком млекопитающего STIM1 или белком млекопитающего STIM2.
Также здесь предложен способ снижения экспрессии цитокинов путем ингибирования связанной с депо-управляемым входом кальция активации NFAT у млекопитающего, включающий введение соединения формулы (I), (II), (IIA) или (IIБ) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства. В одном аспекте соединение формулы (I), (II), (IIA) или (IIБ) модулирует взаимодействие, или модулирует уровень, или связывает, или взаимодействует с белком млекопитающего STIM1 или белком млекопитающего STIM2. В одном аспекте цитокин выбран из интерлейкина-2 (IL-2), IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-15, IL-16, IL-17, IL-18, IL-1α, IL-1β, IL-1 RA, гранулоцитарного колониестимулирующего фактора (G-CSF), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), онкостатина М, эритропоэтина, лейкемического ингибирующего фактора (LIF), интерферонов, гамма-интерферона (γ-IFN), B7.1 (CD80), В7.2 (В70, CD86), фактора некроза опухоли-альфа (TNF-α), TNF-β, LT-β, лиганда CD40, Fas-лиганда, лиганда CD27, лиганда CD30, 4-1BBL, Trail и фактора, ингибирующего миграцию (MIF).
В одном аспекте здесь описано применение соединения формулы (I), (II), (IIA) или (IIБ) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства для изготовления лекарственного средства для модуляции активности депо-управляемых кальциевых каналов (SOC-каналов) у субъекта или для лечения заболевания или состояния у субъекта, при котором полезна модуляции активности депо-управляемых кальциевых каналов (SOC-каналов). В одном аспекте соединение формулы (I), (II), (IIA) или (IIБ) ингибирует депо-управляемый вход кальция (SOCE). В другом аспекте активность депо-управляемых кальциевых каналов представляет собой активность кальциевых каналов, активируемых высвобождением кальция.
Также здесь описан продукт, включающий упаковочный материал, соединение формулы (I), (II), (IIA) или (IIБ) или его композицию, или его фармацевтически приемлемую соль, фармацевтически приемлемое пролекарство или фармацевтически приемлемый сольват, которые эффективны для ингибирования активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), или для лечения, предотвращения или уменьшения интенсивности одного или более чем одного симптома заболевания или состояния, при котором полезно ингибирование активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), в упаковочном материале и этикетку, на которой указано, что соединение или его композицию, или его фармацевтически приемлемую соль, фармацевтически приемлемое пролекарство или фармацевтически приемлемый сольват используют для ингибирования активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), или для лечения, предотвращения или уменьшения интенсивности одного или более чем одного симптома заболевания или состояния, при котором полезно ингибирование активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов). В одном аспекте соединение формулы (I), (II), (IIA) или (IIБ) ингибирует депо-управляемый вход кальция (SOCE).
В одном аспекте здесь описано соединение формулы (IIA),
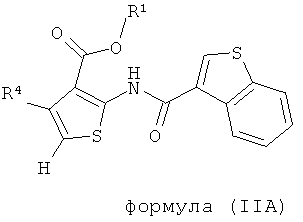
где R1 представляет собой водород, C1-С6 алкил, C1-С6 галогеноалкил или бензил;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, C1-С6 гетероалкила, С1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, C1-С6 алкила, С1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила.
В одном воплощении R1 представляет собой водород или C1-С6 алкил. В другом аспекте R1 представляет собой водород, метил, этил, н-пропил или изопропил. В одном воплощении карбоксильная группировка тиофенового ядра заменена биоизостером карбоновой кислоты.
В другом воплощении R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, С1-С6 алкила, C1-С6 фторалкила, С1-С6 гетероалкила и C1-С6 галогеноалкила.
В одном воплощении R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CF3, -ОН, -ОСН3, -OCF3, метила и этила.
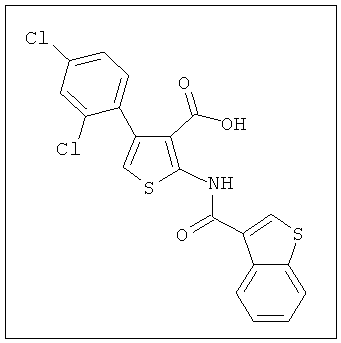
В другом воплощении соединение формулы (IIA) представляет собой
В одном аспекте здесь описано соединение формулы (IIБ),
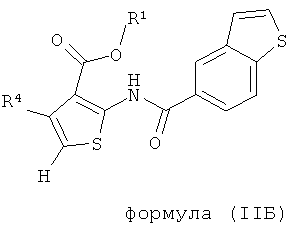
где R1 представляет собой водород, С1-С6 алкил, С1-С6галогеноалкил или бензил;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, С1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила.
В одном воплощении R1 представляет собой водород или C1-С6 алкил. В еще одном аспекте R1 представляет собой водород, метил, этил, н-пропил или изопропил. В одном воплощении карбоксильная группировка тиофенового ядра заменена биоизостером карбоновой кислоты.
В другом воплощении R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, С1-С6 алкила, С1-С6 фторалкила, C1-С6 гетероалкила и C1-С6 галогеноалкила.
В одном воплощении R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CF3, -ОН, -ОСН3, -OCF3, метила и этила.
В другом воплощении соединение формулы (IIБ) выбрано из:
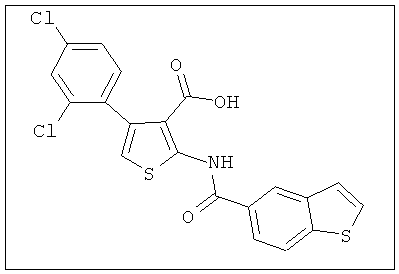 ,
, 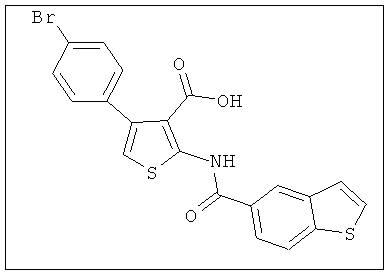 ,
, 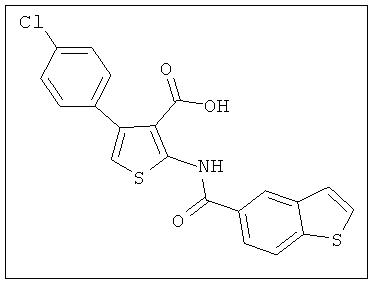 ,
, 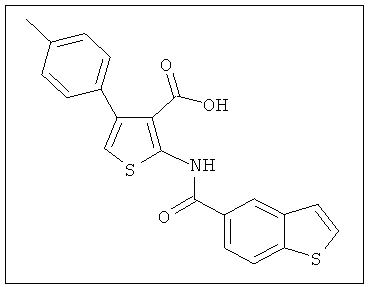 ,
,
Здесь рассмотрена любая комбинация групп, описанных выше для различных переменных.
В одном аспекте здесь описана фармацевтическая композиция, содержащая фармацевтически приемлемый разбавитель, эксципиент или связывающее вещество и соединение формулы (I), (II), (IIA) или (IIB) или его фармацевтически приемлемую соль, фармацевтически приемлемое пролекарство или фармацевтически приемлемый сольват.
В одном аспекте здесь предложена фармацевтическая композиция, содержащая эффективное количество соединения, предложенного здесь, и фармацевтически приемлемый эксципиент. В другом аспекте предложены композиции, дополнительно содержащие второй фармацевтически активный ингредиент.
В определенных воплощениях здесь предложена фармацевтическая композиция, содержащая: 1) физиологически приемлемый носитель, разбавитель и/или эксципиент; 2) одно или более чем одно соединение, описанное здесь.
В любом из указанных выше аспектов представлены другие воплощения, включающие отдельные введения эффективного количества соединения формулы (I), (II), (IIA) или (IIБ), включая другие воплощения, в которых: (1) соединение формулы (I), (II), (IIA) или (IIБ) вводят один раз; (2) соединение формулы (I), (II), (IIA) или (IIБ) вводят млекопитающему несколько раз на протяжении периода времени продолжительностью одни сутки; (3) непрерывно; или (4) постоянно.
В любом из указанных выше аспектов представлены другие воплощения, включающие несколько введений эффективного количества соединения формулы (I), (II), (IIA) или (IIБ), включая другие воплощения, в которых: (1) соединение формулы (I), (II), (IIA) или (IIБ) вводят в виде разовой дозы; (2) промежуток времени между несколькими введениями составляет каждые 6 часов; (3) соединение формулы (I), (II), (IIA) или (IIБ) вводят млекопитающему каждые 8 часов. В других или альтернативных воплощениях способ включает "отдых от лекарств" (drug holiday), когда введение соединения формулы (I), (II), (IIA) или (IIБ) временно прекращают или временно снижают вводимую дозу соединения формулы (I), (II), (IIA) или (IIБ); по окончании "отдыха от лекарств" введение соединения формулы (I), (II), (IIA) или (IIБ) возобновляют. Продолжительность "отдыха от лекарств" может варьировать от 2 суток до 1 года.
В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ), описанные здесь, вводят человеку. В некоторых воплощениях соединения формулы (I), (II), (IIA) или (IIБ), описанные здесь, вводят перорально.
Соединения, предложенные здесь, используют для модуляции внутриклеточного кальция. В одном аспекте соединения, предложенные здесь, модулируют активность SOC-каналов. В одном аспекте соединения, предложенные здесь, модулируют активность CRAC-каналов. В другом аспекте соединения, предложенные здесь, модулируют активность белков STIM. В другом аспекте соединения, предложенные здесь, модулируют активность белков Orai. В другом аспекте соединения, предложенные здесь, модулируют функциональные взаимодействия белков STIM с белками Orai. В другом аспекте соединения, предложенные здесь, уменьшают число функциональных SOC-каналов. В другом аспекте соединения, предложенные здесь, уменьшают число функциональных CRAC-каналов. В одном аспекте соединения, описанные здесь, являются блокаторами SOC-каналов. В одном аспекте соединения, описанные здесь, являются блокаторами CRAC-каналов.
В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) являются селективными ингибиторами SOCE. В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) являются селективными ингибиторами активности CRAC-каналов.
Другие задачи, признаки и преимущества соединений, композиций, способов и применений, описанных здесь, станут ясны из следующего подробного описания. Тем не менее, следует понимать, что в то время как в подробном описании и конкретных примерах описаны конкретные воплощения, они представлены лишь в качестве иллюстрации, поскольку различные изменения и модификации в рамках сущности и объема изобретения станут ясны специалистам в данной области техники из данного подробного описания.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1 показан метаболический путь ICRAC-каналов.
На Фиг.2 показано, что соединение 1 (2-(4-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновая кислота) ингибирует начальную кинетику ответа, связанного с CRAC-каналами, в клетках RBL-2H3 зависимым от концентрации образом.
На Фиг.3 показаны результаты обработки клеток RBL-2H3 соединением 1. Активацию CRAC-каналов и последующих эффекторов в клетках RBL-2H3 индуцировали тапсигаргином (ТС)/тетрадеканоилфорболацетатом (ТРА) и исследовали эффекты соединения 1 на дегрануляцию и высвобождение TNF-альфа. Соединение 1 ингибировало дегрануляцию с IC50 2,6 мкМ и ингибировало высвобождение TNF-альфа с IC50 3,3 мкМ.
На Фиг.4 показаны результаты анализа дегрануляции в клетках RBL-2H3. Индукции TG/TPA в течение 2 часов в сбалансированном солевом растворе Хенкса (HBSS) или HBSS+1% сыворотки предшествовала предварительная обработка соединением 1 в течение 10 минут. В отсутствие сыворотки соединение 1 ингибировало дегрануляцию с кажущейся IC50 менее приблизительно 0,3 мкМ, в то время как в присутствии сыворотки соединение 1 ингибировало дегрануляцию с IC50 приблизительно 1-3 мкМ.
На Фиг.5 показаны эффекты соединения 1 на SOCE, пролиферацию клеток и секрецию IL-2 в Т-клетках крысы. Соединение 1 ингибировало SOCE с IC50 приблизительно 2,4 мкМ, ингибировало пролиферацию клеток с IC50 приблизительно 4,3 мкМ и ингибировало секрецию IL-2 с IC50 приблизительно 2,5 мкМ.
На Фиг.6 показаны результаты ингибирования индуцированной конканавалином A (Con А) пролиферации эмбриональных Т-клеток человека соединением 1. Соединение 1 ингибировало индуцированную Con A пролиферацию эмбриональных Т-клеток человека с IC50 приблизительно 3,7 мкМ.
На Фиг.7 показаны результаты ингибирования высвобождения IL-2 в Т-клетках Jurkat соединением 1. Т-клетки Jurkat стимулировали фитогемагглютинином (РНА) и ТРА в присутствии соединения 1. Соединение 1 ингибировало высвобождение IL-2 в Т-клетках Jurkat с IC50 приблизительно 0,5 мкМ.
На Фиг.8 показан профиль селективности соединения 1. Соединение 1 является селективным ингибитором SOCE.
На Фиг.9 показана селективность соединения 1 в отношении SOC-каналов по сравнению с потенциал-зависимыми кальциевыми каналами, экспрессируемыми в человеческих клетках SH-SY5Y.
На Фиг.10 показаны аддитивные эффекты соединения 1 и циклоспорина А при ингибировании секреции IL-2 в Т-клетках Jurkat. Т-клетки Jurkat стимулировали с использованием РНА/TPA для индукции секреции IL-2.
На Фиг.11 показаны результаты перорального введения соединения 1 в крысиной модели коллаген-индуцированного артрита. В таком же анализе циклоспорин А, вводимый перорально, приводил к снижению массы печени на 9%, в то время как у крыс, которым вводили соединение 1, снижения массы печени не наблюдали.
На Фиг.12 показаны результаты перорального введения соединения 1 в мышиной модели гиперчувствительности замедленного типа (DTH).
На Фиг.13 показаны результаты обработки клеток НЕК293, сверхэкспрессирующих STIM1, соединением 1 и 2-аминоэтоксидифенилборатом (2-АРВ). Сверхэкспрессия STIM1 в клетках НЕК293 усиливает метаболический путь входа Ca2+, сходный с эндогенным SOCE (см. Примеры). Соединение 1 блокирует сигнал STIM1-зависимого входа Са2+ зависимым от концентрации образом, а 2-АРВ как усиливает этот сигнал (в низких концентрациях), так и ингибирует его (в высоких концентрациях).
На Фиг.14 показаны результаты ингибирования зависимого от рекомбинантного hOrai1/hSTIM1 входа Са2+ в стабильных клетках соединением 1 и соединением 2.
На Фиг.15 показано, что соединение 1 и соединение 2 ингибируют Monster ICRAC, экспрессируемый в клетках, стабильно сверхэкспрессирующих hOrai1/hSTIM1. Для сравнения также показаны эффекты некоторых соединений сравнения.
На Фиг.16 показано, что соединение 1 ингибирует рекомбинантные Cav 1.2 Са2+-каналы L-типа.
На Фиг.17 показана биодоступность и период полувыведения (T1/2) соединения 1 у крыс при пероральном введении.
На Фиг.18 показаны результаты позднего отторжения трансплантатов кожи у крыс Lewis, которым вводили соединение 1.
На Фиг.19 показаны результаты плазменных воздействий соединения 1 в течение 24 часов после перорального введения в дозе 10 или 50 мг/кг. Если не указано иное, каждая точка отражает среднее значение трех образцов.
На Фиг.20 показаны результаты ингибирования воспаления соединением 1 в крысиной модели неспецифического язвенного колита для воспалительного заболевания кишечника (IBD).
На Фиг.21 показана биодоступность и T1/2 соединения 2 (2-(3-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты) у крыс и эффект перорально вводимого соединения 2 в мышиной DTH-модели воспаления.
ПОДРОБНОЕ ОПИСАНИЕ
Клеточный кальциевый гомеостаз является результатом сложения регуляторных систем, вовлеченных в контроль уровней и перемещений внутриклеточного кальция. Клеточный кальциевый гомеостаз, по меньшей мере частично, обеспечивают связывание кальция и перемещение кальция внутрь клетки и из клетки через плазматическую мембрану и в пределах клетки перемещением кальция через мембраны внутриклеточных органелл, включая, например, эндоплазматический ретикулум, саркоплазматический ретикулум, митихондрии и органеллы эндоцитоза, включая эндосомы и лизосомы.
Перемещение кальция через клеточные мембраны осуществляют специализированные белки. Например, кальций из внеклеточного пространства может входить в клетку через различные кальциевые каналы и натриево-кальциевый антипортер, и его активно выводят из клетки кальциевые насосы и натриево-кальциевые антипортеры. Возможно также высвобождение кальция из внутренних депо через инозиттрифосфатные и рианодиновые рецепторы, и возможен его захват этими органеллами посредством кальциевых насосов.
Кальций может входить в клетку через любые из нескольких общих классов каналов, включая, без ограничения, потенциал-зависимые кальциевые каналы (VOC-каналы), депо-управляемые кальциевые каналы (SOC-каналы) и натриево-кальциевые антипортеры, действующие в режиме реверса. VOC-каналы активирует деполяризация мембраны, и они обнаружены в возбудимых клетках, таких как нервные и мышечные, и, большей частью, не обнаружены в невозбудимых клетках. В некоторых условиях Са2+ может входить в клетки через Na+-Ca2+-антипортеры, действующие в режиме реверса.
Эндоцитоз представляет другой процесс, посредством которого клетки могут захватывать кальций из внеклеточной среды через эндосомы. В дополнение, некоторые клетки, например, экзокринные клетки, могут высвобождать кальций посредством экзоцитоза.
Концентрация кальция в цитозоле подвержена устойчивой регуляции, при этом уровни покоя оценивают приблизительно в 0,1 мкМ в клетках млекопитающих, в то время как внеклеточная концентрация кальция обычно составляет приблизительно 2 мМ. Эта устойчивая регуляция способствует трансдукции сигналов внутрь и в пределах клеток посредством транзиторного тока кальция через плазматическую мембрану и мембраны внутриклеточных органелл. В клетках существует множество внутриклеточных кальциевых транспортных и буферных систем, способствующих формированию внутриклеточных кальциевых сигналов и поддержанию низкой концентрации кальция в цитоплазме в покое. В покоящихся клетках основными компонентами, вовлеченными в поддержание базальных уровней кальция, являются кальциевые насосы и каналы в эндоплазматическом ретикулуме и плазматической мембране. Нарушение уровней кальция в цитозоле в покое может влиять на передачу таких сигналов и давать начало дефектам ряда клеточных процессов. Например, пролиферация клеток включает длительную последовательность кальциевых сигналов. Другие клеточные процессы включая, без ограничения, секрецию, передачу сигналов и оплодотворение, включают кальциевую сигнализацию.
Поверхностные клеточные рецепторы, активирующие фосфолипазу С (PLC), образуют цитозольные Са2+-сигналы из внутри- и внеклеточных источников. Изначальное транзиторное повышение [Са2+]i (внутриклеточной концентрации кальция) является результатом высвобождения Са2+ из эндоплазматического ретикулума (ER), запускаемого продуктом PLC, инозит-1,4,5-трифосфатом (IP3), открывающим IP3-рецепторы в ER (Streb et al. Nature, 306, 67-69, 1983). Затем наступает следующая фаза длительного входа Са2+ через плазматическую мембрану посредством специализированных депо-управляемых кальциевых каналов (SOC-каналов) (в случае иммунокомпетентных клеток SOC-каналы представляют собой кальциевые каналы, активируемые высвобождением кальция (CRAC-каналы)) в плазматической мембране. Депо управляемый вход Са2+ (SOCE) представляет собой процесс, при котором опустошение депо Са2+ само по себе активирует Са2+-каналы в плазматической мембране, способствуя пополнению депо (Putney, Cell Calcium, 7, 1-12, 1986; Parekh et al., Physiol.Rev. 757-810; 2005). SOCE не просто обеспечивает Са2+ для пополнения депо, но может сам по себе генерировать длительные Са2+-сигналы, контролирующие такие важнейшие функции, как экспрессия генов, метаболизм клеток и экзоцитоз (Parekh and Putney, Physiol. Rev. 85, 757-810 (2005)).
В лимфоцитах и тучных клетках активация рецепторов антигенов или Fc-рецепторов вызывает высвобождение Са2+ из внутриклеточных депо, которое в свою очередь приводит к притоку Са2+ через CRAC-каналы в плазматической мембране. Последующее повышение внутриклеточного Са2+ активирует кальциневрин, фосфатазу, регулирующую транскрипционный фактор NFAT. В покоящихся клетках NFAT фосфорилирован и расположен в цитоплазме, но при дефосфорилировании кальциневрином NFAT перемещается в ядро и активирует различные генетические программы, в зависимости от условий стимуляции и типа клетки. В ответ на инфекции и при отторжении трансплантата NFAT действует совместно с транскрипционным фактором АР-1 (Fos-Jun) в ядре «эффекторных» Т-клеток, трансактивируя посредством этого гены цитокинов, гены, регулирующие пролиферацию Т-клеток, и другие гены, управляющие активным иммунным ответом (Rao et al., Annu Rev Immunol., 1997; 15:707-47). Наоборот, в Т-клетках, распознающих собственные антигены, NFAT активирован в отсутствие АР-1 и активирует транскрипционную программу, известную как «анергия», подавляющую аутоиммунные ответы (Macian et al., Transcriptional mechanisms underlying lymphocyte tolerance. Cell. 2002 Jun 14; 109(6):719-31). В подклассе Т-клеток, известном как регуляторные Т-клетки, подавляющем аутоиммунитет, опосредованный аутореактивными эффекторными Т-клетками, NFAT действует вместе с транскрипционным фактором FOXP3, активируя гены, обеспечивающие супрессорную функцию (Wu et al., Cell, 2006 Jul 28; 126(2):375-87; Rudensky AY, Gavin M, Zheng Y. Cell. 2006 Jul 28; 126(2):253-256).
Эндоплазматический ретикулум (ER) осуществляет множество процессов. ER играет роль как депо, так и стока агонист-чувствительного Са2+, в его просвете происходит фолдинг/процессинг белков. Здесь множество Са2+-зависимых белков-шаперонов обеспечивают правильный фолдинг новых синтезированных белков и их направление согласно предназначению. ER также вовлечен в транспорт везикул, высвобождение стрессорных сигналов, регуляцию метаболизма холестерина и апоптоз. Для многих из этих процессов необходим внутрипросветный Са2+, и нарушение фолдинга белков, стрессорные ответы ER и апоптоз можно вызвать истощением ER в отношении Са2+ в течение длительных периодов времени. Ввиду роли ER в качестве источника Са2+ ясно, что содержание Са2+ в ER должно уменьшаться после стимуляции. Тем не менее, для сохранения функциональной целостности ER жизненно важно, чтобы содержание Са2+ не уменьшалось до слишком низкого или сохранялось на низком уровне. Таким образом, восполнение ER Са2+ является центральным процессом для всех эукариотических клеток. Поскольку уменьшение содержания Са2+ в ER активирует депо-управляемые Са2+-каналы в плазматической мембране полагают, что основная функция этого метаболического пути входа Са2+ состоит в поддержании уровней Са2+ в ER, необходимых для правильного синтеза и фолдинга белков. Тем не менее, депо-управляемые Са2+-каналы обладают другими важными функциями.
Понимание депо-управляемого входа кальция было обеспечено электрофизиологическими исследованиями, в которых было установлено, что процесс опустошения депо активировал ток Са2+ в тучных клетках, называемый током Са2+, активируемым высвобождением Са2+, или ICRAC. ICRAC не является потенциал-активируемым, обладает внутренним выпрямлением и в высшей степени селективен в отношении Са2+. Его обнаруживают в нескольких типах клеток, главным образом, гемопоэтического происхождения. ICRAC не является единственным депо-управляемым током, и в настоящее время ясно, что депо-управляемый приток включает семейство Са2+-проницаемых каналов с различными свойствами в различных типах клеток. ICRAC был первым описанным депо-управляемым током Са2+ и остается популярной моделью для изучения депо-управляемого притока.
Депо-управляемые каналы могут быть активированы любым способом с опустошением депо; по-видимому, механизм опустошения депо не имеет значения, конечным результатом является активация депо-управляемого входа Са2+. Физиологически индукция опустошения депо происходит посредством повышения уровней IP3 или других Са2+-высвобождающих сигналов с последующим высвобождением Са2+ из депо. Однако существует несколько других способов опустошения депо. Эти способы включают следующее:
1) повышение IP3 в цитозоле (после стимуляции рецепторов или диализом цитозоля IP3 самим по себе или родственными соединениями, относящимися к тому же классу, такими как неметаболизируемый аналог Ins(2,4,5)Р3);
2) применение Са2+-ионофора иономицина для повышения проницаемости мембраны ER;
3) диализ цитоплазмы высокими концентрациями хелаторов Са2+ этиленгликольтетрауксусной кислоты (EGTA) или 1,2-бис-2-аминофеноксиэтан-N,N,N,N-тетрауксусной кислоты (ВАРТА), хелатирующими Са2+, поступающий из депо, предотвращая, таким образом, пополнение депо;
4) воздействие ингибиторами Са2+-аденозинтрифосфатазы (Са2+-АТФазы) саркоплазматического/эндоплазматического ретикулума (SERCA), такими как тапсигаргин, циклопиазоновая кислота и ди-трет-бутилгидрохинон, предотвращающими наполнение депо АТФазами Р-типа;
5) сенсибилизацию рецепторов IP3 к уровням InsP3 в покое такими агентами, как тимерозал; и
6) введение мембранопроницаемых Са2+-хелаторов металлов, таких как N,N,N,N-тетракис(2-пиридилметил)этилендиамин (TPEN), непосредственно в депо.
Посредством его массового действия TPEN снижает концентрацию свободного Са2+ в просвете, не изменяя общее содержание Са2+ в депо таким образом, что происходит образование сигнала, зависящего от истощения депо.
Эти способы опустошения депо не лишены возможных проблем. Ключевое свойство депо-управляемого входа Са2+ состоит в том, что каналы активирует уменьшение содержания Са2+ в депо, а не последующее повышение концентрации Са2+ в цитоплазме. Тем не менее, иономицин и блокаторы SERCA-насосов в большинстве случаев вызывают повышение концентрации Са2+ в цитоплазме, как следствие истощения депо, и такое повышение Са2+ может приводить к открытию Са2+-активируемых катионных каналов, проницаемых для Са2+. Один способ избегания таких проблем состоит в применении агентов в условиях, когда концентрацию Са2+ прочно сдерживают высокие концентрации хелатора Са2+, такого как EGTA или ВАРТА.
Депо-управляемый вход кальция
Сниженная концентрация кальция во внутриклеточных депо кальция, таких как эндоплазматический ретикулум, являющаяся результатом высвобождения из них кальция, обеспечивает сигнал для притока кальция из внеклеточной среды в клетку. Этот приток кальция, обеспечивающий длительное «плато» повышения концентрации кальция в цитозоле, в большинстве случаев не обусловлен потенциал-зависимыми каналами плазматической мембраны и не включает активацию кальциевых каналов кальцием. Этот механизм притока кальция называют емкостным входом кальция (ССЕ), входом кальция, активируемым высвобождением кальция, депо-управляемым входом кальция или входом кальция, активируемым истощением депо. Депо-управляемый вход кальция может быть записан как ионный ток с особыми свойствами. Этот ток называют ISOC (депо-управляемый ток) или ICRAC (ток, активируемый высвобождением кальция).
Электрофизиологический анализ депо-управляемых токов или токов, активируемых высвобождением кальция, выявляет особые биофизические свойства (см., например, Parekh and Penner (1997) Physiol. Rev. 77:901-930) этих токов. Например, ток может быть активирован истощением внутриклеточных депо кальция (например, нефизиологическими активаторами, такими как тапсигаргин, циклопиазоновая кислота (СРА), иономицин и ВАРТА, и физиологическими активаторами, такими как IP3) и может быть селективным для двухвалентных катионов, таких как кальций, по сравнению с одновалентными ионами в физиологических растворах или условиях, на него могут влиять изменения уровней кальция в цитозоле, и он может демонстрировать измененную селективность и проводимость при низких внеклеточных концентрациях двухвалентных катионов. Данный ток можно заблокировать или усилить посредством 2-АРВ (в зависимости от концентрации) и заблокировать посредством SKF96365 и Gd3+, и в большинстве случаев его можно описать как кальциевый ток, не являющийся строго потенциал-зависимым.
Исследованиями с фиксацией потенциала на тучных клетках и лейкемических Т-клетках Jurkat было установлено, что механизм CRAC-входа связан с ионным каналом с особыми биофизическими свойствами, включая высокую селективность в отношении Са2+ в сочетании с чрезвычайно низкой проводимостью. Более того, было показано, что CRAC-канал удовлетворяет строгим критериям депо-управляемости, то есть активации только снижением Са2+ в ER, а не цитозольным Са2+ или другими посредниками, образуемыми PLC (Prakriya et al., In Molecular and Cellular Insights into Ion Channel Biology (ed. Robert Maue) 121-140 (Elsevier Science, Amsterdam, 2004)).
Регуляция депо-управляемого входа кальция внутриклеточными депо кальция
Регуляция депо-управляемого входа кальция происходит посредством уровня кальция во внутриклеточном депо кальция. Внутриклеточные депо кальция могут быть охарактеризованы чувствительностью к агентам, которые могут являться физиологическими или фармакологическими, активирующим высвобождение кальция из депо или ингибирующим поступление кальция в депо. При описании внутриклеточных депо кальция были изучены различные клетки, и депо были охарактеризованы как чувствительные к различным агентам, включая без ограничения, IP3 и соединения, влияющие на рецептор IP3, тапсигаргин, иономицин и/или циклическую аденозиндифосфат-рибозу (АДФ-рибозу, cADPR) (см., например, Berridge (1993) Nature 361:315-325; Churchill and Louis (1999) Am. J. Physiol. 276:C426-C434; Dargie et al. (1990) Cell Regul. 1:279-290; Gerasimenko et al. (1996) Cell 84:473-480; Gromoda et al. (1995) FEBS Lett. 360:303-306; Guse et al. (1999) Nature 398:70-73).
Накопление кальция в органеллах-депо, эндоплазматическом и саркоплазматическом ретикулуме (SR; специализированном варианте эндоплазматического ретикулума в поперечно-полосатых мышцах), происходит посредством кальциевых АТФаз саркоплазматического-эндоплазматического ретикулума (SERCA), обычно называемых кальциевыми насосами. При передаче сигналов (то есть, при активации каналов эндоплазматического ретикулума для обеспечения высвобождения кальция из эндоплазматического ретикулума в цитоплазму) пополнение кальция в эндоплазматическом ретикулуме происходит посредством SERCA-насоса цитоплазматическим кальцием, поступившим в клетку из внеклеточной среды (Yu and Hinkle (2000) J. Biol. Chem. 275:23648-23653; Hofere et al. (1998) EMBO J. 17:1986-1995).
Каналы, высвобождающие кальций, ассоциированные с рецепторами IP3 и риадонина обеспечивают контролируемое высвобождение кальция из эндоплазматического и саркоплазматического ретикулума в цитоплазму, что приводит к транзиторным повышениям концентрации кальция в цитоплазме. К запуску высвобождения кальция, опосредованного рецепторами IP3, приводит IP3, образуемый при распаде фосфоинозитидов плазматической мембраны при действии фосфолипазы С, активируемой связыванием агониста с рецептором плазматической мембраны, связанным с G-белком. К запуску высвобождения кальция, опосредованного рецепторами риадонина, приводит повышение кальция в цитоплазме, и это называют кальций-индуцируемым высвобождением кальция (CICR). Также возможна регуляция активности риадониновых рецепторов (имеющих аффинность в отношении риадонина и кофеина) циклической АДФ-рибозой.
Таким образом, уровни кальция в депо и в цитоплазме изменчивы. Например, свободный кальций ER может снижаться от приблизительно 60-400 мкМ до приблизительно 1-50 мкМ при обработке клеток HeLa гистамином, агонистом связанных с PLC гистаминовых рецепторов (Miyawaki et al. (1997) Nature 388:882-887). Активация депо-управляемого входа кальция происходит при снижении концентрации свободного кальция во внутриклеточных депо. Таким образом, истощение кальция в депо, а также сопутствующее повышение концентрации кальция в цитозоле, могут регулировать депо-управляемый вход кальция в клетки.
Цитоплазматическое буферное действие в отношении кальция
Активация процессов передачи сигналов в клетках агонистами может приводить к резким повышениям проницаемости эндоплазматического ретикулума для кальция, например, посредством открытия каналов, связанных с рецепторами IP3, и плазматической мембраны посредством депо-управляемого входа кальция. Эти повышения проницаемости для кальция связаны с увеличением концентрации кальция в цитозоле, которое может быть разделено на два компонента: «пик» высвобождения кальция из эндоплазматического ретикулума при активации рецептора IP3 и фазу плато, представляющую собой длительное повышение уровней кальция, являющееся результатом входа кальция в цитоплазму из внеклеточной среды. При стимуляции внутриклеточная концентрация свободного кальция в покое, составляющая приблизительно 100 нМ, может в целом возрастать до более чем 1 мкМ. Клетка модулирует эти кальциевые сигналы эндогенными кальциевыми буферами, включая физиологическое буферное действие такими органеллами, как митохондрии, эндоплазматический ретикулум и комплекс Гольджи. Захват кальция митохондриями через унипортер во внутренней мембране обусловлен сильно отрицательным мембранным потенциалом митохондрии, и высвобождение накопленного кальция происходит медленно через натрий-зависимые и натрий-независимые антипортеры и, в некоторых случаях, поры, вызывающие переход мембраны митохондрии в состояние высокой проницаемости (permeability transition pore (PTP)). Таким образом, митохондрии могут действовать в качестве буферов кальция, захватывая кальций в течение периодов активации и медленно высвобождая его позже. Поступление кальция в эндоплазматический ретикулум регулируют АТФазы эндоплазматического и саркоплазматического ретикулума (SERCA). Поступление кальция в комплекс Гольджи опосредовано транспортной кальциевой АТФазой Р-типа (PMR1/ATP2C1). Кроме того, существуют доказательства выведения значительного количества кальция, высвобождаемого при активации рецепторов IP3, из клетки при действии кальциевой АТФазы плазматической мембраны. Например, кальциевые АТФазы плазматической мембраны обеспечивают основной механизм выведения кальция в человеческих Т-клетках и клетках Jurkat, хотя выведению кальция в человеческих Т-клетках также способствует натриево-кальциевый обмен. В органеллах, являющихся депо кальция, ионы кальция могут быть связаны со специализированными кальциевыми буферными белками, такими как, например, кальсеквестрины, кальретикулины и кальнексины. Кроме того, в цитозоле присутствуют кальциевые буферные белки, модулирующие кальциевые пики и способствующие перераспределению ионов кальция. Таким образом, белки и другие молекулы, участвующие в любом из этих и других механизмов, посредством которых могут быть снижены уровни кальция в цитозоле, являются белками, вовлеченными в, участвующими в и/или обеспечивающими цитоплазматическое буферное действие в отношении кальция. Таким образом, цитоплазматическое буферное действие в отношении кальция делает возможным длительный приток кальция через SOC-каналы. Значительные повышения цитоплазматического Са2+ или наполнение депо дезактивируют SOCE.
Последующие события, опосредованные входом кальция
В дополнение к внутриклеточным изменениям в кальциевых депо депо-управляемый вход кальция оказывает воздействие на множество событий, являющихся следствиями или дополнениями к депо-управляемым изменениям. Например, приток Са2+ приводит к активации большого числа кальмодулин-зависимых ферментов, включая сериновую фосфатазу кальциневрин. Активация кальциневрина повышением внутриклеточного кальция приводит к острым секреторным процессам, таким как дегрануляция тучных клеток. Активированные тучные клетки высвобождают предварительно образованные гранулы, содержащие гистамин, гепарин, TNF-α и ферменты, такие как β-гексозаминидаза. Для некоторых клеточных событий, таких как пролиферация В- и Т-клеток, необходима продолжительная кальциневриновая сигнализация, для которой необходимо продолжительное повышение внутриклеточного кальция. Кальциневрин регулирует несколько транскрипционных факторов, включая NFAT (ядерный фактор активированных Т-клеток), MEF2 и NFkB. Транскрипционные факторы NFAT играют важные роли во многих типах клеток, включая иммунокомпетентные клетки. В иммунокомпетентных клетках NFAT опосредует транскрипцию большого числа молекул, включая цитокины, хемокины и поверхностные клеточные рецепторы. Транскрипционные элементы NFAT были обнаружены в промоторах таких цитокинов, как IL-2, IL-3, IL-4, IL-5, IL-8, IL-13, а также фактора некроза опухоли-альфа (TNF-α), гранулоцитарного колониестимулирующего фактора (G-CSF) и гамма-интерферона (γ-IFN).
Активность белков NFAT регулирует степень их фосфорилирования, а ее, в свою очередь, регулируют как кальциневрин, так и NFAT-киназы. Активация кальциневрина повышением уровней внутриклеточного кальция приводит к дефосфорилированию NFAT и его поступлению в ядро. Рефосфорилирование NFAT маскирует последовательность ядерной локализации NFAT и предотвращает его поступление в ядро. Ввиду сильной зависимости его локализации и активности от опосредованного кальциневрином дефосфорилирования NFAT является чувствительным индикатором уровней внутриклеточного кальция.
Заболевания, расстройства или состояния
Клинические исследования демонстрируют, что CRAC-канал абсолютно необходим для активации генов, лежащих в основе Т-клеточного ответа на антиген. Продолжительный вход кальция необходим для активации лимфоцитов и адаптивного иммунного ответа. Вход кальция в лимфоциты происходит в первую очередь через CRAC-каналы. Повышение кальция происходит к активации NFAT и экспрессии цитокинов, необходимых для иммунного ответа. Ингибирование депо-управляемого входа кальция является эффективным способом предотвращения активации Т-клеток.
Ингибирование активности CRAC-каналов соединениями, описанными здесь, такими как соединения формулы (I), (IIA) и (IIВ), обеспечивает способ предоставления иммуносупрессивной терапии, как продемонстрировано устранением депо-управляемого входа кальция, отмеченного у пациентов с тяжелым комбинированным иммунодефицитом (SCID). Т-клетки, фибробласты и, в некоторых случаях, В-клетки от пациентов с Т-клеточным иммунодефицитом или SCID, у которых основным является дефект активации Т-клеток, демонстрируют выраженный дефект депо-управляемого входа кальция (Feske et al. (2001) Nature Immunol. 2:316-324; Paratiseti et al. (1994) J. Biol. Chem. 269:32327-32335; и Le Deist et al. (1995) Blood 85:1053-1062). У пациентов с SCID отсутствует адаптивный иммунный ответ, однако без какого-либо нарушения или токсичности в отношении основных органов. Фенотип пациентов с SCID показывает, что Ингибирование CRAC-каналов является эффективным способом иммуносупрессии.
Заболевания/расстройства, включающие воспаление, и заболевания/расстройства, связанные с иммунной системой
Заболевания или расстройства, которые можно лечить или предотвращать с применением соединений, композиций и способов, предложенных здесь, включают заболевания и расстройства, включающие воспаление и/или имеющие отношение к иммунной системе. Эти заболевания включают, без ограничения, астму, хроническое обструктивное заболевание легких, ревматоидный артрит, воспалительное заболевание кишечника, гломерулонефрит, воспалительные заболевания нервной системы, такие как рассеянный склероз, и расстройства иммунной системы.
Активация нейтрофилов (PMN) медиаторами воспаления отчасти обусловлена повышением концентрации кальция в цитозоле. В частности, полагают, что важную роль в активации PMN играет депо-управляемый приток кальция. Было показано, что травма повышает депо-управляемый приток кальция в PMN (Hauser et al. (2000) J. Trauma Injury Infection and Critical Care 48 (4):592-598), и что длительные повышения концентрации кальция в цитозоле ввиду усиленного депо-управляемого притока могут изменять ответ на стимулы в сочетании с хемотаксинами и вносить вклад в дисфункцию PMN после повреждения. Таким образом, модуляция концентрации цитозольного кальция в PMN через депо-управляемые кальциевые каналы может быть полезной в регуляции воспаления, опосредованного PMN, и сохранять функцию сердечно-сосудистой системы после травмы, шока или сепсиса (Hauser et al. (2001) J. Leukocyte Biology 69 (1):63-68).
Кальций играет важную роль в активации лимфоцитов. Активация лимфоцитов, например, антигенной стимуляцией приводит к быстрым повышениям концентраций свободного кальция внутри клетки и активации транскрипционных факторов, включая ядерный фактор активированных Т-клеток (NFAT), NF-кВ, JNK1, MEF2 и CREB. NFAT является ключевым транскрипционным регулятором гена IL-2 (и других цитокинов) (см., например, Lewis (2001) Annu. Rev. Immunol 19:497-521). Продолжительное повышение уровня внутриклеточного кальция необходимо для поддержания NFAT в транскрипционно активном состоянии и зависит от депо-управляемого входа кальция. Уменьшение или блокада депо-управляемого входа кальция в лимфоцитах блокирует кальций-зависимую активацию лимфоцитов. Таким образом, модуляция внутриклеточного кальция и, в частности, депо-управляемого входа кальция (например, снижение, устранение депо-управляемого входа кальция) в лимфоцитах может представлять собой способ лечения расстройств иммунной системы или расстройств, имеющих отношение к иммунной системе, включая, например, хронические заболевания/расстройства иммунной системы, острые заболевания/расстройства иммунной системы, аутоиммунные и иммунодефицитные заболевания/расстройства, заболевания/расстройства, включающие воспаление, отторжение трансплантированного органа и реакцию «трансплантат против хозяина», и измененные (например, гиперактивные) иммунные ответы. Например, лечение лечение аутоиммунного заболевания/расстройства может включать снижение, блокаду или устранение депо-управляемого входа кальция в лимфоцитах.
Примеры расстройств иммунной системы включают псориаз, ревматоидный артрит, васкулит, воспалительное заболевание кишечника, дерматит, остеоартрит, астму, воспалительное заболевание мышц, аллергический ринит, вагинит, интерстициальный цистит, склеродермию, остеопороз, экзему, аллогенную или ксеногенную трансплантацию (органа, костного мозга, стволовых клеток и других клеток и тканей), отторжение трансплантата, реакцию «трансплантат против хозяина», красную волчанку, воспалительное заболевание, диабет I типа, фиброз легких, дерматомиозит, синдром Шегрена, тиреоидит (например, тиреоидит Хашимото и аутоиммунный тиреоидит), тяжелую псевдопаралитическую миастению, аутоиммунную гемолитическую анемию, рассеянный склероз, муковисцидоз, хронический рецидивирующий гепатит, первичный билиарный цирроз, аллергический конъюнктивит и атопический дерматит.
Рак и другие пролиферативные заболевания
Соединения формулы (I), (II), (II), (IIA) и (IIБ), их композиции и способы, предложенные здесь, могут быть применены в связи с лечением злокачественных новообразований, включая, без ограничения, злокачественные новообразования лимфоретикулярного происхождения, рак желчного пузыря, рак молочной железы, рак ободочной кишки, рак эндометрия, рак головы и шеи, рак легкого, меланому, рак яичника, рак предстательной железы и рак прямой кишки. Депо-управляемый вход кальция может играть важную роль в пролиферации раковых клеток (Weiss et al. (2001) International Journal of Cancer 92 (6):877-882).
Ингибирование SOCE достаточно для предотвращения пролиферации опухолевых клеток. Производное пиразола, ВТР-2, непосредственный блокатор ICRAC, блокирует SOCE и пролиферацию в клетках Jurkat (Zitt et al., J. Biol. Chem., 279, 12427-12437, 2004) и клетках рака ободочной кишки. Было предложено, что для продолжительного SOCE необходим митохондриальный захват Са2+ (Nunez et al., J. Physiol. 571.1, 57-73, 2006) и что предотвращение митохондриального захвата Са2+ приводит к ингибированию SOCE (Hoth et al., P.N.A.S., 97, 10607-10612, 2000; Hoth et al., J. Cell. Biol. 137, 633-648, 1997; Glitsch et al., EMBO J., 21, 6744-6754, 2002). Стимуляция клеток Jurkat вызывает продолжительный SOCE и активацию Са2+-зависимой фосфатазы кальциневрина, дефосфорилирующей NFAT, стимулируя экспрессию интерлейкина-2 и пролиферацию. Соединения формулы (I), (II), (IIA) и (IIБ) ингибируют SOCE и могут быть применены в лечении рака или других пролиферативных заболеваний или состояний.
Заболевания и расстройства печени
Заболевания или расстройства, которые можно лечить или предотвращать с применением соединений формулы (I), (II), (IIA) или (IIБ), их композиций и способов, предложенных здесь, включают печеночные заболевания и расстройства или заболевания и расстройства печени. Эти заболевания или расстройства включают, без ограничения, повреждения печени, например, ввиду трансплантации, гепатита и цирроза.
Было показано значение депо-управляемого входа кальция при хроническом заболевании печени (Тао et al. (1999) J. Biol. Chem., 274(34):23761-23769), а также повреждении при трансплантации после холодной консервации - тепловой реоксигенации (Elimadi et al. (2001) Am J. Physiology, 281(3 Part 1):G809-G815).
Заболевания и расстройства почек
Заболевания или расстройства, которые можно лечить или предотвращать с применением способов, предложенных здесь, включают заболевания и расстройства почек или почечные заболевания и расстройства. Гиперплазия мезангиальных клеток часто является ключевым признаком таких заболеваний и расстройств. Такие заболевания и расстройства могут быть обусловлены иммунологическими или другими механизмами повреждения, включая IgA-нефропатию (IgAN), мембранозно-пролиферативный гломерулонефрит или волчаночный нефрит. Нарушения контроля репликации мезангиальных клеток также, по-видимому, играют ключевую роль в патогенезе прогрессирующей почечной недостаточности.
Обновление мезангиальных клеток в нормальной почке взрослого крайне незначительно, и интенсивность обновления составляет менее 1%. Важным признаком заболеваний клубочков/почек является мезангиальная гиперплазия ввиду повышенной интенсивности пролиферации или сниженной потери мезангиальных клеток. Результатом стимуляции пролиферации мезангиальных клеток без потери клеток, например, ввиду митогенной стимуляции может являться мезангиопролиферативный гломерулонефрит. Данные указывают на то, что регуляторы роста мезангиальных клеток, в частности факторы роста, могут действовать, регулируя депо-управляемые кальциевые каналы (Ма et al. (2001) J Am. Soc. of Nephrology, 12:(1) 47-53). Модуляторы депо-управляемого притока кальция могут быть полезны в лечении заболеваний клубочков ингибированием пролиферации мезангиальных клеток.
Депо-управляемые кальциевые каналы
Клинические исследования демонстрируют, что CRAC-канал, тип SOC-канала, абсолютно необходим для активации генов, лежащих в основе Т-клеточного ответа на антиген (Partiseti et al., J Biol. Chem., 269, 32327-32335, 1994; Feske et al., Curr. Biol. 15, 1235-1241, 2005). SOCE может вносить вклад непосредственно в повышение уровней Са2+ в цитозоле ([Са2+]i), как в Т-лимфоцитах, где CRAC-каналы генерируют продолжительные Са2+-сигналы, необходимые для управления экспрессией генов, лежащих в основе активации Т-клеток антигеном. Продолжительный вход кальция необходим для активации лимфоцитов и адаптивного иммунного ответа. Вход кальция в лимфоциты происходит главным образом через CRAC-каналы. Повышенные уровни кальция приводят к активации NFAT и экспрессии цитокинов, необходимых для иммунного ответа.
CRAC-канал имеет характерный отличительный биофизический признак, поддающуюся количественному определению зависимость от депо, и выполняет важнейшую функцию в Т-клетках. Исследования показали, что CRAC-каналы образованы двумя белками-компонентами, взаимодействующими с образованием CRAC-каналов. В сборке CRAC-канала участвуют два функциональных компонента, STIM1 и Orai1. STIM1 (молекула стромального взаимодействия 1) была идентифицирована как Са2+-сенсор в ER млекопитающих (Liou, J. et al. Curr. Biol. 15, 1235-1241 (2005); Roos, J. et al. J. Cell Biol. 169, 435-445 (2005); WO 20041078995; US 2007/0031814). Orai1/CRACM1 был идентифицирован как компонент CRAC-канала млекопитающих (Feske, S. et al. Nature 441, 179-185 (2006); Vig, M. et al. Science 312, 1220-1223 (2006); Zhang, S. L. et al. Proc. Natl Acad. Sci. USA 103, 9357-9362 (2006)).
STIM1 является Са2+-сенсором в депо Са2+ в ER, перемещающимся в ответ на истощение депо в отделы ER, близкие к плазматической мембране. Orai1 является субъединицей CRAC-канала, образующей поры в плазматической мембране. Было показано, что каждый из двух мембранных белков STIM1 и Orai1 необходим для активации CRAC-каналов.
Экспрессия как STIM1, так и Orai1 в эмбриональных клетках почки человека 293 (клетках НЕК293) приводит к восстановлению функциональных CRAC-каналов. Экспрессия Orai1 сама по себе значительно снижает депо-управляемый вход Ca2+ в клетках НЕК293 и Са2+-ток, активируемый высвобождением Ca2+ (ICRAC), в клетках базофильного лейкоза крысы. Тем не менее, при экспрессии одновременно с депо-сенсорным белком STIM1 Orai1 вызывает сильное увеличение SOCE, повышая скорость входа Са2+ до 103 раз. Этот вход является полностью депо-зависимым, поскольку та же коэкспрессия не вызывает измеримого депо-независимого входа Са2+. Блокатор депо-управляемых каналов, 2-аминоэтоксидифенилборат, полностью блокирует вход. Известно, что белки STIM опосредуют сенсорные функции в отношении депо Ca2+ и сближение мембраны эндоплазматического ретикулума и плазматической мембраны, не обладая собственными свойствами каналов. Orai1 является частью компонента канала плазматической мембраны, обеспечивающего вход Са2+. Подавление функции CRAC-каналов сверхэкспрессией Orai1 отражает необходимую стехиометрию STIM1 и Orai1 (Soboloff et al., J. Biol. Chem. Vol.281, no. 30, 20661-20665, 2006).
Белки молекул стромального взаимодействия (STIM)
При скрининге РНК-интерференцией (RNAi) в клетках S2 Drosophila с использованием тапсигаргин-активируемого входа Са2+ в качестве маркера депо-управляемых кальциевых каналов один ген, кодирующий белок молекулы стромального взаимодействия (Stim), приводил к существенно сниженному входу Ca2+ (Roos, J. et al. J. Cell Biol. 169, 435-445, 2005). Существуют также два гомолога Stim в клетках млекопитающих, STIM1 и STIM2, каждый из которых, по-видимому рассредоточен повсеместно (Williams et al., Biochem J. 2001 Aug 1; 357(Pt 3):673-85). STIM1 является Са2+-сенсором ER для депо-управляемого входа Са2+. STIM1 представляет собой мембранный белок I типа массой 77 кДа с несколькими предсказанными доменами белкового взаимодействия или сигнализации и расположен преимущественно в ER, но также в некоторой степени в плазматической мембране.
Нокдаун STIM1 посредством RNAi приводил к значительному снижению ICRAC в Т-клетках Jurkat и депо-управляемого входа Са2+ в эпителиальных клетках НЕК293 и клетках нейробластомы SH-SY5Y. Тем не менее, нокдаун близкородственного STIM2 не имел эффекта. Эти результаты указывают на важную роль STIM (Drosophila) и STIM1 (млекопитающие) в механизме активации депо-управляемых каналов. Маловероятно, чтобы STIM1 являлся депо-управляемым каналом сам по себе. У него нет каналоподобной последовательности, и сверхэкспрессия белка лишь незначительно усиливает вход Са2+. STIM1 расположен как на плазматической, так и на внутриклеточных мембранах, таких как ER (Manji et al., Biochim Biophys Acta. 2000 Aug 31; 1481 (1): 147-55. 2000). Последовательность белка говорит о том, что он пронизывает мембрану один раз, при этом его NH2-конец ориентирован в просвет ER или внеклеточное пространство. NH2-конец содержит домен типа EF-hand и функционирует как Са2+-сенсор в ER. Белок также содержит домены взаимодействия белок-белок, а именно домены спираль-спираль, в цитоплазме и стерильный мотив (SAM) в ER (или внеклеточном пространстве), оба из которых расположены вблизи предсказанного трансмембранного домена. STIM1 способен к олигомеризации, и, таким образом, белок в ER и плазматической мембране может взаимодействовать, связывая две молекулы (Roos, J. et al. J. Cell Biol. 169, 435-445 (2005)).
При флуоресценции полного внутреннего отражения (TIRF) и конфокальной микроскопии было выявлено, что STIM1 рассредоточен повсеместно в ER при полных депо Са2+, но при истощении депо происходит его перераспределение в отдельные точки вблизи плазматической мембраны. Несмотря на то что перераспределение STIM1 в соединительные области ER происходит медленно (Liou, J. et al. Curr. Biol. 15, 1235-1241 (2005); Zhang, S. L. et al. Nature 437, 902-905 (2005), оно опережает открытие CRAC-каналов на несколько секунд (Wu et al., J. Cell Biol. 174, 803-813 (2006)) и, таким образом, является достаточно быстрым, чтобы быть важной стадией активации CRAC-каналов.
Было предложено, что истощение депо вызывает встраивание STIM1 в плазматическую мембрану, где он может контролировать депо-управляемый вход кальция через CRAC-каналы (Zhang, S. L. et al. Nature 437, 902-905 (2005); Spassova, M. A. et al. Proc. Natl Acad. Sci. USA 103, 4040-4045 (2006)).
Решающее доказательство того, что STIM1 является Са2+-сенсором для SOCE, состоит в том, что мутация предсказанных Са2+-связывающих остатков структурного мотива EF hand, которая, как ожидают, снизит его аффинность в отношении Ca2+ и, таким образом, будет имитировать состояние истощения депо, вызывает спонтанное перераспределение STIM1 в определенные точки и запуск конститутивного притока Ca2+ через SOC-каналы, даже при заполненных депо (Spassova, M. A. et al. Proc. Natl Acad. Sci. USA 103, 4040-4045 (2006); Liou, J. et al. Curr. Biol. 15, 1235-1241 (2005)).
Белки Orai
Orai1 (также известный как CRACM1) является широко экспрессируемым белком плазматической мембраны массой 33 кДа с 4 трансмембранными доменами и без значимой гомологии последовательности с другими ионными каналами (Vig, M. et al. Science 312, 1220-1223 (2006); Zhang, S. L. et al. Proc. Natl Acad. Sci. USA 103, 9357-9362 (2006)).
В исследованиях Т-клеток от пациентов-людей с синдромом тяжелого комбинированного иммунодефицита (SCID), где активация Т-клеточных рецепторов или истощение депо не активирует вход Ca2+, было показано, что причиной этого является одна точковая мутация в Orai1 (Feske, S. et al. Nature 441, 179-185 (2006)).
Существуют другие гомологи Orai млекопитающих, например Orai2 и Orai3, тем не менее, их функция не ясна. Orai2 и Orai3 может демонстрировать активность SOC-каналов при сверхэкспрессии вместе с STIM1 в клетках НЕК (Mercer, J. С.et al. J. Biol. Chem. 281, 24979-24990 (2006)).
Доказательства того, что Orai1 является частью поры CRAC-канала были получены в исследованиях мутагенеза Orai1. Селективность CRAC-канала в отношении ионов Ca2+ была продемонстрирована мутациями либо Glu 106, либо Glu 190, которые ослабляли способность связывать Ca2+, блокируя проницаемость в отношении моновалентных катионов (аналогично механизмам, описанным для потенциал-зависимых Са2+-каналов) (Yeromin, A. V. et al. Nature 443, 226-229 (2006); Vig, M. et al. Curr. Biol. 16, 2073-2079 (2006); Prakriya, M. et al. Nature 443, 230-233 (2006)).
Нейтрализация заряда на паре аспарагинов в петле I-II (Asp 110 и Asp 112) уменьшает блокаду Gd3+ и блокаду выходящего тока внеклеточным Ca2+, указывая на то, что эти отрицательно заряженные сайты могут стимулировать накопление поливалентных катионов вблизи входа в пору.
Токи, наблюдаемые при сверхэкспрессии Orai1 очень напоминают ICRAC. и с учетом того факта, что Orai1 может образовывать мультимеры (Yeromin, A. V. et al. Nature 443, 226-229 (2006); Vig, M. et al. Curr. Biol. 16, 2073-2079 (2006); Prakriya, M. et al. Nature 443, 230-233 (2006)), вероятно, что нативный CRAC-канал представляет собой либо мультимер Orai1 самого по себе, либо в комбинации с близкородственными субъединицами Orai2 и/или Orai3.
Функциональные депо-управляемые кальциевые каналы
Описание SOC-каналов было в значительной степени получено посредством одного типа SOC-канала, CRAC-канала. Активность CRAC-каналов стимулирует снижение Са2+ в просвете ER, которое сочетается с открытием CRAC-каналов в плазматической мембране посредством действия STIM1 и Orai1. STIM1 детектирует истощение Ca2+, вызывая его накопление в переходном ER вблизи плазматической мембраны. В исследовании с основанной на TIRF Са2+-визуализацией для определения расположения открытых CRAC-каналов наблюдали, что повышения [Са2+]i локализованы там же, где и точки STIM1, прямо указывая, что открытие CRAC-каналов происходит лишь в непосредственной близости от этих мест (Luik, et al, J. Cell Biol. 174, 815-825 (2006)).
В клетках с одновременной экспрессией как STIM1, так и Orai1 истощение депо вызывает переход Orai1 самого по себе от рассредоточенного распределения к накоплению в плазматической мембране непосредственно напротив STIM1, позволяя STIM1 активировать канал (Luik, et al., J. Cell Biol. 174, 815-825 (2006); Xu, P. et al. Biochem. Biophys. Res. Commun. 350, 969-976 (2006)). Таким образом, CRAC-каналы образованы противопоставленными кластерами STIM1 в ER и Orai1 в плазматической мембране, разделенными узким промежутком цитозоля. Соединительный промежуток (приблизительно 10-25 нм) может быть достаточно небольшим для взаимодействий белок-белок. Это поддерживает факт возможности одновременной иммунопреципитации сверхэкспрессированных STIM1 и Orai1 (Yeromin, A. V. et al. Nature 443, 226-229 (2006); Vig, M. et al. Curr. Biol. 16, 2073-2079 (2006)).
Таким образом, STIM1 и Orai1 взаимодействуют либо непосредственно, либо как члены комплекса нескольких белков. Подтверждение этого наблюдали в одном исследовании, когда экспрессии цитозольной части STIM1 самой по себе было достаточно для активации CRAC-каналов (Huang, G. N. et al. Nature Cell Biol. 8, 1003-1010 (2006)), а эффекты удаления ERM/спираль-спираль и других С-концевых доменов наводят на мысль о значении в образовании кластеров STIM1 и активации SOC-каналов (Baba, Y. et al. Proc. Natl Acad. Sci. USA 103, 16704-16709 (2006)). На просветной стороне STIM1 при удалении Са2+ in vitro выделенная область EF-SAM образует димеры и мультимеры более высокого порядка, указывая на то, что олигомеризация STIM1 может являться ранней стадией депо-управляемой кальциевой активации (Stathopulos, et al., J. Biol. Chem. 281, 35855-35862 (2006)).
Соединения формулы (I), (II), (IIA) и (IIБ), описанные здесь, модулируют внутриклеточный кальций, как например ингибирование или снижение SOCE и/или ICRAC. Модуляция соединениями формулы (I), (II), (IIA) и (IIБ) может приводить к множеству эффектов, таким как, без ограничения, связывание с белком, взаимодействие с белком или модуляция взаимодействий, активностей, уровней или любого физического, структурного или другого свойства белка, вовлеченного в модуляцию внутриклеточного кальция (например, белка STIM и/или белка Orai).
Например, способы оценки связывания или взаимодействия исследуемого агента с белком, вовлеченным в модуляцию внутриклеточного кальция, включают ядерный магнитный резонанс (NMR), масс-спектроскопию, флуоресцентную спектроскопию, сцинтилляционные анализы сближения, анализы поверхностного плазменного резонанса и другие. Примеры способов оценки модуляции взаимодействий, активностей, уровней или любого физического, структурного или другого свойства белка, вовлеченного в модуляцию внутриклеточного кальция, включают, без ограничения, анализы резонансного переноса энергии флуоресценции (FRET-анализы) для оценки эффектов взаимодействия белков, NMR, рентгеновскую кристаллографию и круговой дихроизм для оценки эффектов на белковые взаимодействия и на физические и структурные свойства белка, и анализы активности, подходящие для оценки конкретной активности белка.
Мониторинг или оценка эффектов на внутриклеточный кальций
При мониторинге или оценке эффекта соединения формулы (I), (II), (IIA) или (IIБ) на внутриклеточный кальций в любом из способов скрининга/идентификации, описанных здесь или известных в данной области техники, может быть проведена прямая или непрямая оценка или измерение клеточного кальция (включая цитозольный кальций и кальций внутриклеточных органелл или компартментов) и/или перемещения его ионов внутрь, в пределах или из клетки, органеллы, депо кальция или их части (например, мембраны). Здесь описаны и/или в данной области техники известны множество способов оценки уровней кальция и перемещений или тока ионов. Конкретный применяемый способ и используемые условия могут зависеть от того, какой конкретно аспект внутриклеточного кальция мониторируют или оценивают. Например, как описано здесь, известны и могут быть использованы реагенты и условия для оценки именно депо-управляемого входа кальция, уровней кальция в цитозоле в покое, буферного действия в отношении кальция и уровней кальция во внутриклеточных органеллах и депо кальция, захвата кальция ими и его высвобождения из них. Эффект соединения формулы (I), (II), (IIA) или (IIБ) на внутриклеточный кальций можно мониторировать или оценивать с использованием, например, клетки, внутриклеточной органеллы или компартмента-депо кальция, мембраны (включая, например, участки разъединенной мембраны и липидный бислой) или свободной от клеток системы анализа (например, мембранной везикулы с нормальным расположением липидных слоев). В большинстве случаев некоторый аспект внутриклеточного кальция мониторируют или оценивают в присутствии исследуемого агента и сравнивают с контролем, например внутриклеточным кальцием в отсутствие исследуемого агента.
Способы модуляции внутриклеточного кальция
Модуляция внутриклеточного кальция может представлять собой любое изменение или коррекцию внутриклеточного кальция, включая, без ограничения, изменение концентрации или уровня кальция в цитоплазме и/или внутриклеточных органеллах-депо кальция, например, эндоплазматическом ретикулуме, изменение перемещения кальция внутрь, из и в пределах клетки или внутриклеточного депо кальция или органеллы, изменение расположения кальция в пределах клетки и изменение кинетики или других свойств токов кальция внутрь, из и в пределах клеток. В определенных воплощениях модуляция внутриклеточного кальция может включать изменение или коррекцию, например снижение или ингибирование, депо-управляемого входа кальция, буферного действия в отношении цитозольного кальция, перемещения кальция внутрь, из или в пределах внутриклеточного депо кальция или органеллы или уровней кальция в них, и/или базальных уровней кальция в цитозоле, или уровней кальция в цитозоле в покое. В некоторых воплощениях модуляция внутриклеточного кальция может включать изменение или коррекцию рецептор-опосредованного перемещения ионов (например, кальция), перемещения ионов (например, кальция), управляемого вторыми посредниками, притока кальция в клетку или его оттока из клетки и/или захвата ионов (например, кальция) в или их высвобождения из внутриклеточных компартментов, включая, например, эндосомы и лизосомы.
В одном аспекте соединения, описанные здесь, модулируют внутриклеточный кальций, как например, без ограничения, модуляция (например, снижение или ингибирование) активности SOC-каналов, такая как ингибирование активности CRAC-каналов (например, ингибирование ICRAC, ингибирование SOCE), в клетке иммунной системы (например, лимфоците, белой клетке крови, Т-клетке, В-клетке), фибробласте (или клетке, имеющей происхождение от фибробласта) или клетке эпидермиса, дермы или кожи (например, кератиноците). Стадия модуляции одного или более чем одного белка, вовлеченного в модуляцию внутриклеточного кальция (например, белка STIM и/или белка Orai), может включать, например, снижение уровня, экспрессии, активности, функции и/или молекулярных взаимодействий белка. Например, если клетка демонстрирует повышение уровней кальция или недостаток регуляции аспекта модуляции внутриклеточного кальция, например депо-управляемого входа кальция, то модуляция может включать снижение уровня экспрессии, активности или функции, или молекулярного взаимодействия белка, например белка STIM и/или белка Orai.
Способы лечения
Здесь предложен способ модуляции активности депо-управляемых кальциевых каналов (SOC-каналов), включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I) или его фармацевтически приемлемой солью, фармацевтически приемлемым сольватом или фармацевтически приемлемым пролекарством,

где R1 представляет собой водород, C1-С6 алкил, C1-С6 галогеноалкил или бензил;
R2 представляет собой арил, бензотиенил, бензофуранил или группу -СН2СН2-фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, С3-С6 циклоалкила, С1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, C2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R8, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -CON(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, С1-С6 гетероалкила, С1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, С1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила.
В одном воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где приведение в контакт происходит in vitro.
В одном воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где приведение в контакт происходит in vivo.
В еще одном воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где соединение формулы (I) модулирует активность, модулирует взаимодействие или модулирует уровень, или связывает, или взаимодействует с по меньшей мере одной частью комплекса депо-управляемого кальциевого канала, выбранного из семейства белков молекул стромального взаимодействия (STIM).
В другом воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где соединение формулы (I) модулирует активность, модулирует взаимодействие или модулирует уровень, или связывает, или взаимодействует с по меньшей мере одной частью STIM1 или STIM2.
В другом воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где модуляция активности депо-управляемых кальциевых каналов соединением формулы (I) ингибирует депо-управляемый вход кальция (SOCE).
В еще одном воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где комплекс депо-управляемого кальциевого канала представляет собой комплекс кальциевого канала, активируемого высвобождением кальция (CRAC-канала).
В другом воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где модуляция активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), соединением формулы (I) ингибирует электрофизиологический ток (ICRAC), непосредственно связанный с активированными CRAC-каналами.
В еще одном воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где R1 представляет собой водород или C1-С6 алкил.
В одном воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где R4 выбран из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 2,3-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 3-бромфенила; 4-бромфенила; 2-йодфенила; 3-йодфенила; 4-йодфенила; 2-метилфенила; 3-метилфенила; 4-метилфенила; 2,4-диметилфенила; 2,3-диметилфенила; 3,4-диметилфенила; 3,5-диметилфенила; 2-трифторметилфенила; 3-трифторметилфенила; и 4-трифторметилфенила.
В другом воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где R2 выбран из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 2,3-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 3-бромфенила; 4-бромфенила; 2-йодфенила; 3-йодфенила; 4-йодфенила; 2-метилфенила; 3-метилфенила; 4-метилфенила; 2,4-диметилфенила; 2,3-диметилфенила; 3,4-диметилфенила; 3,5-диметилфенила; и бензотиен-2-ила.
В еще одном воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где R2 представляет собой водород, метил, этил, н-пропил или изопропил.
В другом воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где R2 выбран из фенила, 3-фторфенила; 4-фторфенила; 4-хлорфенила; 4-бромфенила; 4-йодфенила; 3-метилфенила; 3-метилфенила; и бензотиен-2-ила.
В еще одном воплощении предложен способ модуляции активности депо-управляемых кальциевых каналов, включающий приведение в контакт комплекса депо-управляемого кальциевого канала (SOC-канала) или его части с соединением формулы (I), где R4 выбран из фенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 4-бромфенила; 4-метилфенила; 3,4-диметилфенила; и 4-трифторметилфенила.
Также здесь предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства,

где R1 представляет собой водород, C1-С6 алкил, C1-С6 галогеноалкил или бензил;
R2 представляет собой арил, бензотиенил, бензофуранил или группу -СН2СН2-фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, С3-С6 циклоалкила, С1-С6 гетероалкила, С1-С6 галогеноалкила, тетразолила, C2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R8, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила.
В одном воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где соединение формулы (I) модулирует активность, модулирует взаимодействие или модулирует уровень, или связывает, или взаимодействует с по меньшей мере одним компонентом комплекса кальциевого канала, активируемого высвобождением кальция (CRAC-канала), выбранного из семейства белков молекул стромального взаимодействия (STIM).
В другом воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где соединение формулы (I) модулирует активность, модулирует взаимодействие или модулирует уровень, или связывает, или взаимодействует с STIM1 или STIM2.
В еще одном воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где модуляция активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), соединением формулы (I) ингибирует депо-управляемый вход кальция (SOCE).
В другом воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где модуляция активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), соединением формулы (I) ингибирует электрофизиологический ток (ICRAC), непосредственно связанный с активированными CRAC-каналами.
В еще одном воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где соединение формулы (I) ингибирует SOCE с IC50 менее 10 мкМ.
В другом воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где соединение формулы (I) ингибирует электрофизиологический ток (ICRAC), непосредственно связанный с активированными CRAC-каналами, в концентрации менее 10 мкМ.
В еще одном воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, C1-С6 фторалкила, C1-С6 гетероалкила и C1-С6 галогеноалкила.
В другом воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R1 представляет собой водород или C1-С6 алкил.
В одном воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R2 представляет собой фенил или бензотиенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, C1-С6 гетероалкила и C1-С6 галогеноалкила.
В еще одном воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R1 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, м-пентил или гексил.
В одном воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R1 представляет собой Н, метил или этил.
В другом воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -CF3, -ОН, -ОМе, -OCF3, метила и этила.
В еще одном воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R2 представляет собой фенил или бензотиенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -ОН, -CF3, -OCF3, -ОМе, метила и этила.
В другом воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R4 выбран из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 2,3-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 3-бромфенила; 4-бромфенила; 2-йодфенила; 3-йодфенила; 4-йодфенила; 2-метилфенила; 3-метилфенила; 4-метилфенила; 2,4-диметилфенила; 2,3-диметилфенила; 3,4-диметилфенила; 3,5-диметилфенила; 2-трифторметилфенила; 3-трифторметилфенила; и 4-трифторметилфенила.
В другом воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R2 выбран из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 2,3-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 3-бромфенила; 4-бромфенила; 2-йодфенила; 3-йодфенила; 4-йодфенила; 2-метилфенила; 3-метилфенила; 4-метилфенила; 2,4-диметилфенила; 2,3-диметилфенила; 3,4-диметилфенила; 3,5-диметилфенила; и бензотиен-2-ила.
В еще одном воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R2 выбран из фенила, 3-фторфенила; 4-фторфенила; 4-хлорфенила; 4-бромфенила; 4-йодфенила; 3-метилфенила; 3-метилфенила; и бензотиен-2-ила.
В другом воплощении предложен способ модуляции активности кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов), у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R4 выбран из фенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 4-бромфенила; 4-метилфенила; 3,4-диметилфенила; и 4-трифторметилфенила.
В одном аспекте предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства,

где R1 представляет собой водород, C1-С6 алкил, C1-С6 галогеноалкил или бензил;
R2 представляет собой арил, бензотиенил, бензофуранил или группу -СН2СН2-фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, C2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R8, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -CON(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила.
В одном воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где соединение формулы (I) модулирует активность, модулирует взаимодействие или связывает, или взаимодействует с белком млекопитающего STIM1 или белком млекопитающего STIM2.
В другом воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где заболевание, расстройство или состояние у млекопитающего выбрано из заболеваний/расстройств, включающих воспаление, гломерулонефрит, увеит, заболевания или расстройства печени, заболевания или расстройства почек, хроническое обструктивное заболевание легких, ревматоидный артрит, псориаз, воспалительное заболевание кишечника, васкулит, дерматит, остеоартрит, воспалительное заболевание мышц, аллергический ринит, вагинит, интерстициальный цистит, склеродермию, остеопороз, экзему, отторжение трансплантированного органа, аллогенную или ксеногенную трансплантацию, отторжение трансплантата, реакцию «трансплантат против хозяина», красную волчанку, диабет I типа, фиброз легких, дерматомиозит, тиреоидит, тяжелую псевдопаралитическую миастению, аутоиммунную гемолитическую анемию, муковисцидоз, хронический рецидивирующий гепатит, первичный билиарный цирроз, аллергический конъюнктивит, гепатит и атопический дерматит, астму, рассеянный склероз, синдром Шегрена и аутоиммунные заболевания или расстройства.
В еще одном воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где заболевание, расстройство или состояние представляет собой ревматоидный артрит.
В другом воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где заболевание, расстройство или состояние представляет собой псориаз.
В одном воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где заболевание, расстройство или состояние представляет собой воспалительное заболевание кишечника.
В другом воплощении воспалительное заболевание кишечника представляет собой неспецифический язвенный колит.
В другом воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где заболевание, расстройство или состояние представляет собой отторжение трансплантированного органа.
В другом воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где заболевание, расстройство или состояние представляет собой рассеянный склероз.
В еще одном воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, дополнительно включающий введение млекопитающему второго терапевтического агента.
В другом воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где второй терапевтический агент выбран из иммунодепрессантов, глюкокортикоидов, нестероидных противовоспалительных лекарственных средств, специфичных ингибиторов Сох-2, лефлуномида, золото-тиоглюкозы, тиомалата золота, аурофина, сульфасалазина, гидроксихлорхинина, миноциклина, агентов против TNF-α, абатацепта, анакинры, интерферона-β, интерферона-γ, интерлейкина-2, противоаллергических вакцин, антигистаминных агентов, антилейкотриеновых агентов, бета-агонистов, теофиллина и антихолинергических агентов.
В еще одном воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где второй терапевтический агент выбран из такролимуса, циклоспорина, рапамицина, метотрексата, циклофосфамида, азатиоприна, меркаптопурина, микофенолята или FTY720, преднизона, ацетата кортизона, преднизолона, метилпреднизолона, дексаметазона, бетаметазона, триамцинолона, беклометазона, ацетата флудрокортизона, ацетата дезоксикортикостерона, альдостерона, аспирина, салициловой кислоты, гентизиновой кислоты, салицилата холина-магния, салицилата холина, салицилата холина-магния, салицилата холина, салицилата магния, салицилата натрия, дифлунизала, карпрофена, фенопрофена, фенопрофена кальция, флуоробипрофена, ибупрофена, кетопрофена, набутона (nabutone), кеторолака, трометамина кеторолака, напроксена, оксапрозина, диклофенака, этодолака, индометацина, сулиндака, толметина, меклофенамата, меклофенамата натрия, мефенамовой кислоты, пироксикама, мелоксикама, целекоксиба, рофекоксиба, валдекоксиба, парекоксиба, эторикоксиба, люмиракоксиба, CS-502, JTE-522, L-745,337 и NS398, лефлуномида, золото-тиоглюкозы, тиомалата золота, аурофина, сульфасалазина, гидроксихлорхинина, миноциклина, инфликсимаба, этанерцепта, адалимумаба, абатацепта, анакинры, интерферона-β, интерферона-γ, интерлейкина-2, противоаллергических вакцин, антигистаминных агентов, антилейкотриеновых агентов, бета-агонистов, теофиллина и антихолинергических агентов.
В другом воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R1 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, н-пентил или гексил.
В другом воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R1 представляет собой Н, метил или этил.
В одном воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -CF3, -ОН, -ОМе, -OCF3, метила и этила.
В еще одном воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R2 представляет собой фенил или бензотиенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -ОН, -CF3, -OCF3, -ОМе, метила и этила.
В одном воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R4 выбран из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 2,3-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 3-бромфенила; 4-бромфенила; 2-йодфенила; 3-йодфенила; 4-йодфенила; 2-метилфенила; 3-метилфенила; 4-метилфенила; 2,4-диметилфенила; 2,3-диметилфенила; 3,4-диметилфенила; 3,5-диметилфенила; 2-трифторметилфенила; 3-трифторметилфенила; и 4-трифторметилфенила.
В другом воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R2 выбран из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 2,3-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 3-бромфенила; 4-бромфенила; 2-йодфенила; 3-йодфенила; 4-йодфенила; 2-метилфенила; 3-метилфенила; 4-метилфенила; 2,4-диметилфенила; 2,3-диметилфенила; 3,4-диметилфенила; 3,5-диметилфенила; и бензотиен-2-ила.
В другом воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R2 выбран из фенила, 3- фторфенила; 4-фторфенила; 4-хлорфенила; 4-бромфенила; 4-йодфенила; 3-метилфенила; 3-метилфенила; и бензотиен-2-ила.
В еще одном воплощении предложен способ лечения заболевания, расстройства или состояния у млекопитающего, при котором полезно ингибирование активности депо-управляемых кальциевых каналов, включающий введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где R4 выбран из фенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 4-бромфенила; 4-метилфенила; 3,4-диметилфенила; и 4-трифторметилфенила.
Также здесь описан способ ингибирования связанной с депо-управляемым входом кальция (SOCE) активации ядерного фактора активированных Т-клеток (NFAT) у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства,

где R1 представляет собой водород, C1-С6 алкил, C1-С6 галогеноалкил или бензил;
R2 представляет собой арил, бензотиенил, бензофуранил или группу -СН2СН2-фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, С3-С6 циклоалкила, С1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, C2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R8, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -CON(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, C1-С6 алкила, С1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила.
В одном воплощении предложен способ ингибирования связанной с депо-управляемым входом кальция (SOCE) активации ядерного фактора активированных Т-клеток (NFAT) у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где соединение формулы (I) модулирует взаимодействие или модулирует уровень, или связывает, или взаимодействует с белком млекопитающего STIM1 или белком млекопитающего STIM2.
В другом аспекте предложен способ снижения экспрессии цитокинов путем ингибирования связанной с депо-управляемым входом кальция активации NFAT у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства,

где R1 представляет собой водород, C1-С6 алкил, C1-С6 галогеноалкил или бензил;
R2 представляет собой арил, бензотиенил, бензофуранил или группу -СН2СН2-фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, C2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R8, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -CON(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, С1-С6 фторалкила, С1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила.
В другом воплощении предложен способ снижения экспрессии цитокинов ингибированием связанной с депо-управляемым входом кальция активации NFAT у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где соединение формулы (I) модулирует взаимодействие или модулирует уровень, или связывает, или взаимодействует с белком млекопитающего STIM1 или белком млекопитающего STIM2.
В еще одном воплощении предложен способ снижения экспрессии цитокинов путем ингибирования связанной с депо-управляемым входом кальция активации NFAT у млекопитающего, включающий введение соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства, где цитокин выбран из IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-15, IL-16, IL-17, IL-18, IL-1α, IL-1β, IL-1 RA, гранулоцитарного колониестимулирующего фактора (G-CSF), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), онкостатина М, эритропоэтина, лейкемического ингибирующего фактора (LIF), интерферонов, гамма-интерферона (γ-IFN), В7.1 (CD80), В7.2 (В70, CD86), TNF-α, TNF-β, LT-β, лиганда CD40, Fas-лиганда, лиганда CD27, лиганда CD30, 4-1BBL, Trail и фактора, ингибирующего миграцию (MIF).
Соединения
Соединения, описанные здесь, модулируют внутриклеточный кальций и могут быть использованы в лечении заболеваний или состояний, где модуляция внеклеточного кальция имеет полезный эффект. В одном воплощении соединения, описанные здесь, модулируют депо-управляемый вход кальция. В одном воплощении соединения формулы (I), (II), (IIA) или (IIБ) прерывают сборку единиц SOCE. В другом воплощении соединения формулы (I), (II), (IIA) или (IIБ) изменяют функциональные взаимодействия белков, образующих комплексы депо-управляемых кальциевых каналов. В одном воплощении соединения формулы (I), (II), (IIA) или (IIБ) изменяют функциональные взаимодействия STIM1 и Orai1. В других воплощениях соединения формулы (I), (II), (IIA) или (IIБ) являются блокаторами пор SOC-каналов. В других воплощениях соединения формулы (I), (II), (IIA) или (IIБ) являются блокаторами пор CRAC-каналов.
В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) ингибируют электрофизиологический ток (Isoc), непосредственно связанный с активированными SOC-каналами. В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) ингибируют электрофизиологический ток (ICRAC), непосредственно связанный с активированными CRAC-каналами.
Заболевания и расстройства, при которых может быть полезной модуляция внутриклеточного кальция, включают, без ограничения, заболевание, связанное с иммунной системой (например, аутоиммунное заболевание), заболевание или расстройство, включающее воспаление (например, астму, хроническое обструктивное заболевание легких, ревматоидный артрит, воспалительное заболевание кишечника, гломерулонефрит, воспалительные заболевания нервной системы, рассеянный склероз и расстройства иммунной системы), рак и другие пролиферативные заболевания, заболевания почек и заболевания печени. В одном аспекте соединения, описанные здесь, могут быть использованы в качестве иммунодепрессантов для предотвращения отторжения трансплантата, отторжения при аллогенной или ксеногенной трансплантации (органа, костного мозга, стволовых клеток, других клеток и тканей), реакции «трансплантат против хозяина». Отторжения трансплантированного органа могут быть результатом трансплантаций тканей или органов. Реакция «трансплантат против хозяина» может быть результатом трансплантации костного мозга или стволовых клеток.
Соединения, описанные здесь, модулируют активность или модулируют взаимодействие, или связывают, или взаимодействуют с по меньшей мере одной частью белка в комплексе депо-управляемого кальциевого канала. В одном воплощении соединения, описанные здесь, модулируют активность или модулируют взаимодействие, или связывают, или взаимодействуют с по меньшей мере одной частью белка в комплексе кальциевого канала, активируемого высвобождением кальция. В одном аспекте соединения, описанные здесь, снижают уровень функциональных комплексов депо-управляемых кальциевых каналов. В одном аспекте соединения, описанные здесь, снижают уровень активированных комплексов депо-управляемых кальциевых каналов. В одном аспекте комплексы депо-управляемых кальциевых каналов представляют собой комплексы кальциевых каналов, активируемых высвобождением кальция.
Соединения, описанные здесь для лечения заболевания или расстройства, при введении субъекту с заболеванием или расстройством эффективно снижают, облегчают или устраняют симптом проявления заболевания или расстройства. Соединения, описанные здесь, можно также вводить субъекту, предрасположенному к заболеванию или расстройству, у которого еще нет проявления симптома заболевания или расстройства, и при этом они предотвращают или задерживают развитие симптомов. Агент может обладать такими эффектами сам по себе или в комбинации с другими агентами или может функционировать, усиливая терапевтический эффект другого агента.
Соединения, описанные здесь, их фармацевтически приемлемые соли, фармацевтически приемлемые пролекарства или фармацевтически приемлемые сольваты модулируют внутриклеточный кальций и могут быть использованы для лечения пациентов, у которых модуляция внеклеточного кальция обеспечивает полезный эффект.
В одном аспекте здесь описано соединение формулы (I) или его фармацевтически приемлемая соль, фармацевтически приемлемый сольват или фармацевтически приемлемое пролекарство,

где R1 представляет собой водород, С1-С6 алкил, C1-С6 галогеноалкил или бензил;
R2 представляет собой арил, бензотиенил, бензофуранил или группу -СН2СН2-фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R8, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -CON(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, C1-С6 гетероалкила, С1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила.
Для всех без исключения воплощений заместители могут быть выбраны из подгруппы перечисленных альтернатив. Например, в некоторых воплощениях R1 представляет собой водород или C1-С6 алкил. В других воплощениях R1 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил или гексил. В других воплощениях R1 представляет собой Н, метил или этил. В некоторых воплощениях R1 представляет собой Н. В одном воплощении карбоксильная группировка тиофенового ядра заменена биоизостером карбоновой кислоты.
В некоторых воплощениях R2 представляет собой фенил, нафтил или бензотиенил, где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, С1-С6 алкила, С1-С6 гетероалкила и C1-С6 галогеноалкила.
В некоторых воплощениях R2 возможно замещен 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, C1-С6 галогеноалкила, тетразолила, С1-С6 гетероциклоалкила, фенила, -N(R9)2, -CO2R9, -C(=O)R8. В некоторых воплощениях R2 возможно замещен 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -OCF3, -ОМе, -OEt, -OiPr, метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, трет-бутила, фенила, -NH2, -N(Me)2, -CO2H, -CO2Me и -CO2Et. В других воплощениях R2 возможно замещен 1 или 2 заместителями, выбранными из -NH(СО)СН3, пропила, -CF3, метила, этила, -SO2CH3, -CN или -ОСН3.
В некоторых воплощениях R2 представляет собой фенил или бензотиенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -ОН, -CF3, -OCF3, -OR8, C1-С6 алкила, C1-С6 гетероалкила и C1-С6 галогеноалкила. В некоторых воплощениях R2 представляет собой фенил или бензотиенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -ОН, -CF3, -OCF3, -ОМе, метила, этила, изопропила и трет-бутила. В некоторых воплощениях R2 выбран из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 2,3-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 3-бромфенила; 4-бромфенила; 2-йодфенила; 3-йодфенила; 4-йодфенила; 2-метилфенила; 3-метилфенила; 4-метилфенила; 2,4-диметилфенила; 2,3-диметилфенила; 3,4-диметилфенила; 3,5-диметилфенила; и бензотиен-2-ила. В других воплощениях R2 выбран из фенила, 3-фторфенила; 4-фторфенила; 4-хлорфенила; 4-бромфенила; 4-йодфенила; 3-метилфенила; 3-метилфенила; и бензотиен-2-ила.
В некоторых воплощениях R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, C1-С6 фторалкила, C1-С6 гетероалкила и С1-С6 галогеноалкила. В других воплощениях R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -CF3, -ОН, -ОМе, -OCF3, метила и этила. В других воплощениях R4 выбран из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 2,3-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 3-бромфенила; 4-бромфенила; 2-йодфенила; 3-йодфенила; 4-йодфенила; 2-метилфенила; 3-метилфенила; 4-метилфенила; 2,4-диметилфенила; 2,3-диметилфенила; 3,4-диметилфенила; 3,5-диметилфенила; 2-трифторметилфенила; 3-трифторметилфенила; и 4-трифторметилфенила. В некоторых других воплощениях R4 выбран из фенила; 4-фторфенила; 2-хлорфенила; 3-хлорфенила; 4-хлорфенила; 2,4-дихлорфенила; 3,4-дихлорфенила; 3,5-дихлорфенила; 2-бромфенила; 4-бромфенила; 4-метилфенила; 3,4-диметилфенила; и 4-трифторметилфенила.
В одном воплощении предложено соединение формулы (I), где R4 представляет собой 4-хлорфенил, R1 представляет собой водород, и R2 представляет собой группу СН2СН2-фенил. В другом воплощении предложено соединение формулы (I), где R4 представляет собой 3,4-дихлорфенил, R1 представляет собой водород, и R2 представляет собой группу СН2СН2-фенил. В другом воплощении предложено соединение формулы (I), где R4 представляет собой 3,5-дихлорфенил, R1 представляет собой водород, и R2 представляет собой группу СН2СН2-фенил.
Здесь рассмотрена любая комбинация групп, описанных выше для различных переменных.
В одном аспекте соединение формулы (I) выбрано из:
2-(4-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-фторбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-фторбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновой кислоты;
2-(4-фторбензамидо)-4-(2-бромфенил)тиофен-3-карбоновой кислоты;
2-(4-фторбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновой кислоты;
2-(4-фторбензамидо)-4-(2-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-фторбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-фторбензамидо)-4-(фенил)тиофен-3-карбоновой кислоты;
2-(4-фторбензамидо)-4-(4-метилфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
2-(4-йодбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(4-метилфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(3,5-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(2-бромфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(4-метилфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(2-бромфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(4-метилфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(4-фторфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(фенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(2-бромфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(4-метилфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(3-хлорфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(4-трифторметилфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(2-бромфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(3,4-диметилфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(4-метилфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(фенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(2-бромфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(4-фторфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновой кислоты;
метил-2-(4-хлорбензамидо)-4-(4-фторфенил)тиофен-3-карбоксилата;
этил-2-(4-хлорбензамидо)-4-(4-фторфенил)тиофен-3-карбоксилата;
2-(4-йодбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
4-(2,4-дихлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(3,4-дихлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(3,5-дихлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(3-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(2-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(2-хлор-4-фторбензамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3,4-дифторбензамидо)тиофен-3-карбоновой кислоты;
2-(2-хлор-4-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(2-фторбензамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-фтор-4-метоксибензамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(4-метилбензамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(4-цианобензамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(4-этилбензамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(4-(трифторметил)бензамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(2,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(4-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(2,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(3,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(4-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3-хлорфенил)пропанамидо)тиофен-3-карбоновой кислоты; и
4-(4-хлорфенил)-2-(3-(4-хлорфенил)пропанамидо)тиофен-3-карбоновой кислоты; или их фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства.
В одном аспекте соединение формулы (I) выбрано из:
2-(3-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-фторфенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-хлорфенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(2-хлор-4-фторбензамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3,4-дифторбензамидо)тиофен-3-карбоновой кислоты;
2-(2-хлор-4-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(2-фторбензамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-фтор-4-метоксибензамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(4-метилбензамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(4-цианобензамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(4-этилбензамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(4-(трифторметил)бензамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(2,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(4-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(2,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(3,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(4-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3-хлорфенил)пропанамидо)тиофен-3-карбоновой кислоты; и
4-(4-хлорфенил)-2-(3-(4-хлорфенил)пропанамидо)тиофен-3-карбоновой кислоты; или их фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства.
В еще одном аспекте соединение формулы (I) выбрано из:
2-(3-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3-хлорфенил)пропанамидо)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-йодбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты; или их фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства.
В другом аспекте предложено соединение формулы (I), выбранное из:
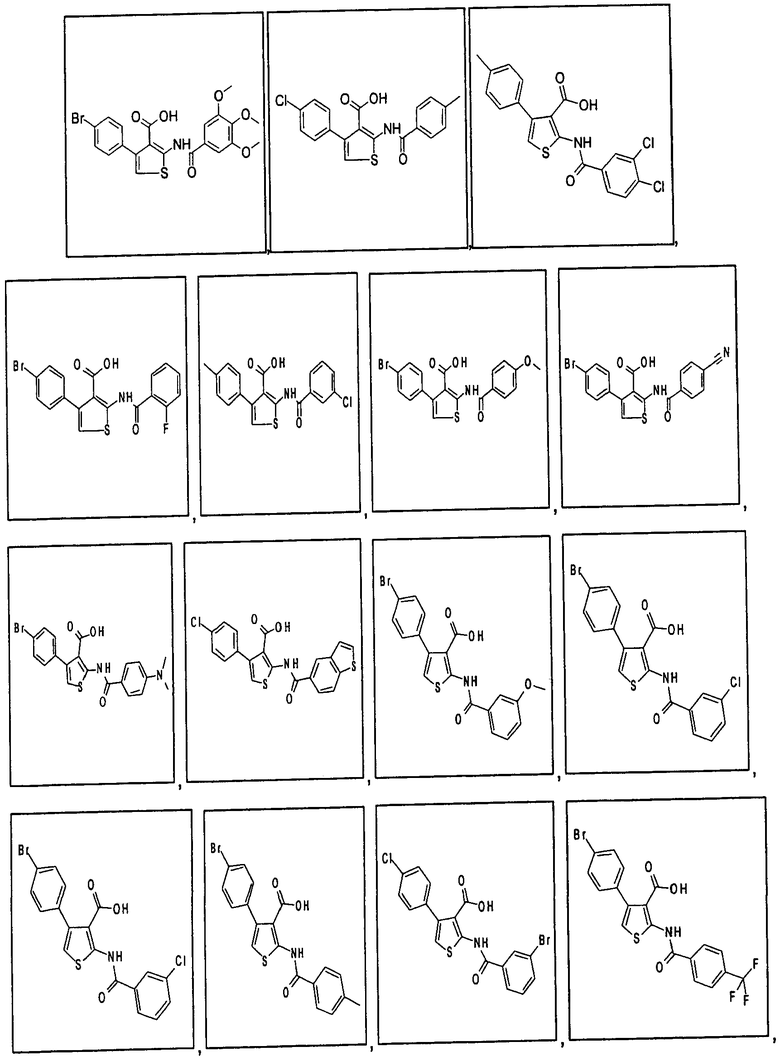
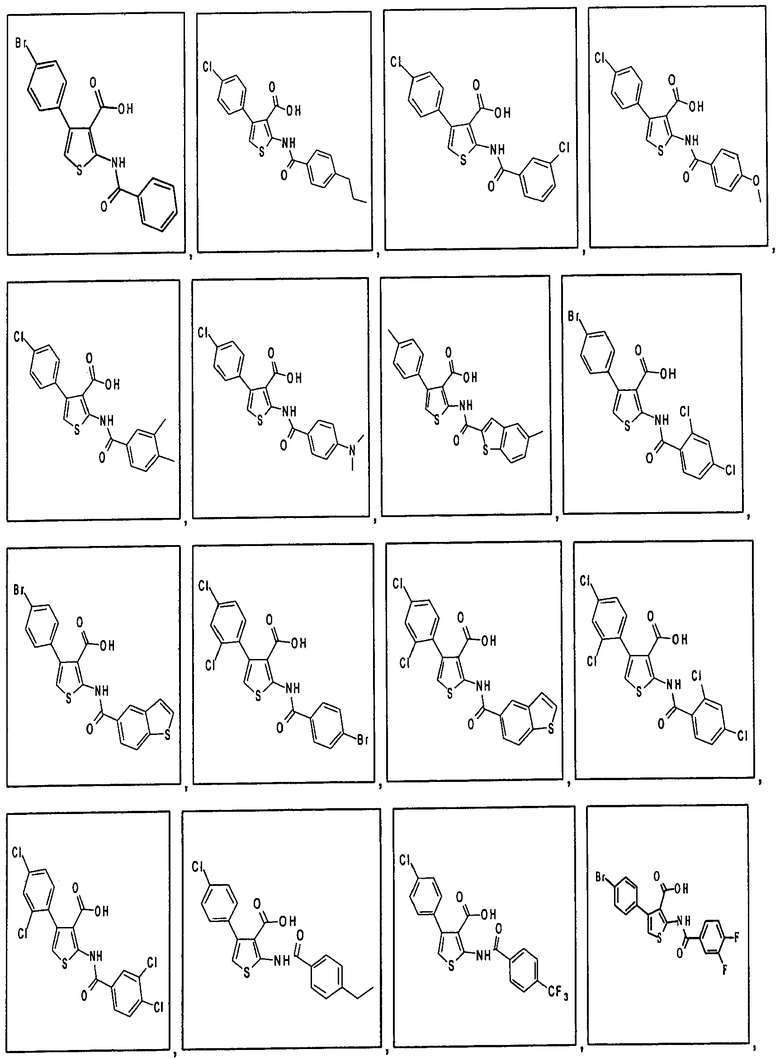
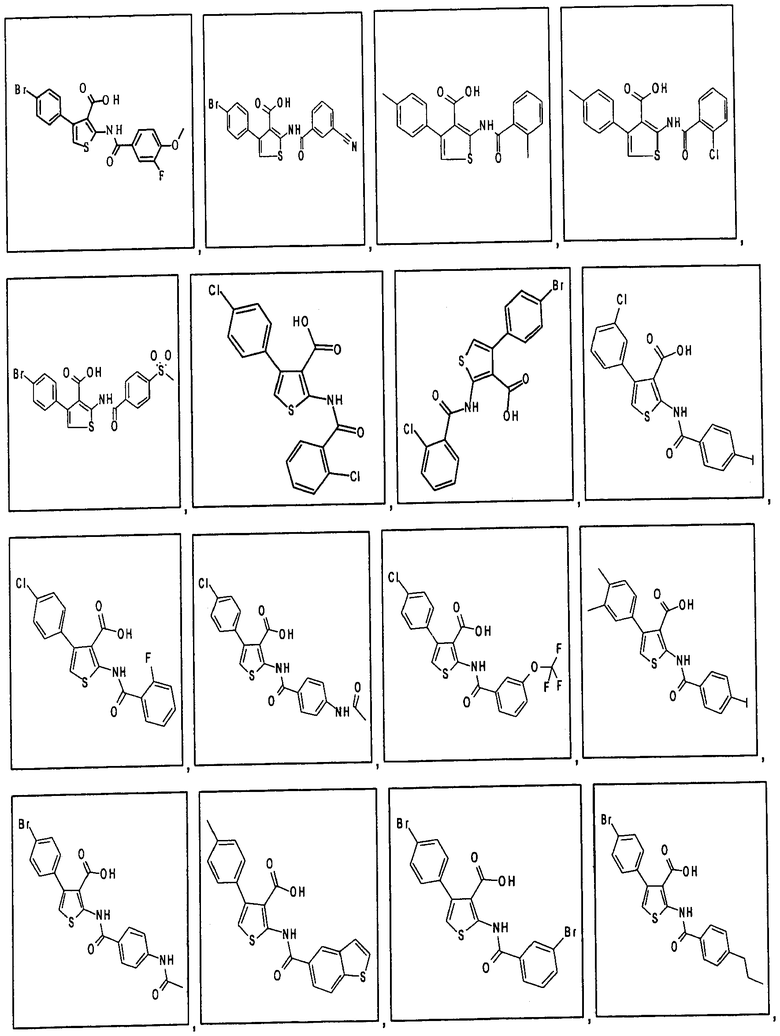
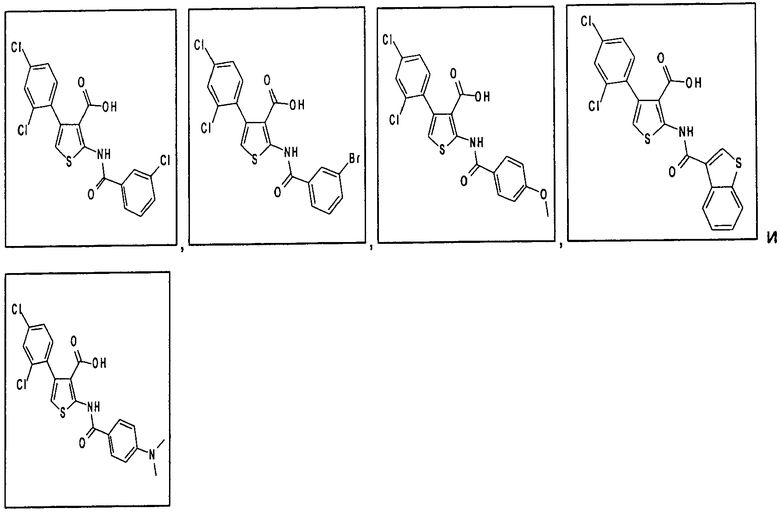
или их фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства.
В одном аспекте здесь описано соединение формулы (II),
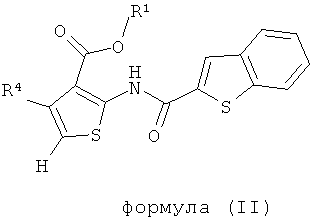
где R1 представляет собой водород, C1-С6 алкил, C1-С6 галогеноалкил или бензил;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
или его фармацевтически приемлемая соль, фармацевтически приемлемый сольват или фармацевтически приемлемое пролекарство.
Для всех без исключения воплощений заместители могут быть выбраны из подгруппы перечисленных альтернатив. Например, в некоторых воплощениях R1 представляет собой водород или C1-С6 алкил. В других воплощениях R1 представляет собой водород, метил, этил, н-пропил или изопропил. В других воплощениях R1 представляет собой трет-бутил. В других воплощениях R1 представляет собой водород. В одном воплощении карбоксильная группировка тиофенового ядра заменена биоизостером карбоновой кислоты.
В некоторых воплощениях R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, С1-С6 алкила, C1-С6 фторалкила, C1-С6 гетероалкила и C1-С6 галогеноалкила. В других воплощениях R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CF3, -ОН, -ОСН3, -OCF3, метила и этила.
Другие воплощения соединений, описанных здесь, включают, без ограничения, соединения в Таблице 1.
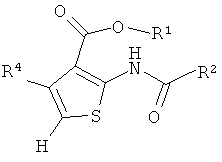
Соединения в Таблице 1 названы:
2-(4-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновая кислота;
2-(4-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновая кислота;
2-(4-фторбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновая кислота;
2-(4-фторбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновая кислота;
2-(4-фторбензамидо)-4-(2-бромфенил)тиофен-3-карбоновая кислота;
2-(4-фторбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновая кислота;
2-(4-фторбензамидо)-4-(2-хлорфенил)тиофен-3-карбоновая кислота;
2-(4-фторбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновая кислота;
2-(4-фторбензамидо)-4-(фенил)тиофен-3-карбоновая кислота;
2-(4-фторбензамидо)-4-(4-метилфенил)тиофен-3-карбоновая кислота;
2-(3-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(4-бромфенил)тиофен-3-карбоновая кислота;
2-(4-йодбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновая кислота;
2-(бензотиен-2-иламидо)-4-(4-бромфенил)тиофен-3-карбоновая кислота;
2-(3-метилбензамидо)-4-(4-бромфенил)тиофен-3-карбоновая кислота;
2-(4-бромбензамидо)-4-(4-метилфенил)тиофен-3-карбоновая кислота;
2-(4-бромбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновая кислота;
2-(4-бромбензамидо)-4-(4-бромфенил)тиофен-3-карбоновая кислота;
2-(4-бромбензамидо)-4-(3,5-дихлорфенил)тиофен-3-карбоновая кислота;
2-(4-бромбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновая кислота;
2-(4-бромбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновая кислота;
2-(4-бромбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновая кислота;
2-(4-бромбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновая кислота;
2-(4-бромбензамидо)-4-(2-бромфенил)тиофен-3-карбоновая кислота;
2-(3-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновая кислота;
2-(3-фторбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновая кислота;
2-(3-фторбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновая кислота;
2-(3-фторбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновая кислота;
2-(3-фторбензамидо)-4-(4-метилфенил)тиофен-3-карбоновая кислота;
2-(3-фторбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновая кислота;
2-(3-фторбензамидо)-4-(2-бромфенил)тиофен-3-карбоновая кислота;
2-(3-фторбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(4-метилфенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(4-фторфенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(фенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(2-бромфенил)тиофен-3-карбоновая кислота;
2-(4-хлорбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновая кислота;
2-(бензотиен-2-иламидо)-4-(4-хлорфенил)тиофен-3-карбоновая кислота;
2-(бензотиен-2-иламидо)-4-(4-метилфенил)тиофен-3-карбоновая кислота;
2-(бензотиен-2-иламидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновая кислота;
2-(бензотиен-2-иламидо)-4-(3-хлорфенил)тиофен-3-карбоновая кислота;
2-(бензотиен-2-иламидо)-4-(4-трифторметилфенил)тиофен-3-карбоновая кислота;
2-(бензотиен-2-иламидо)-4-(2-бромфенил)тиофен-3-карбоновая кислота;
2-(бензотиен-2-иламидо)-4-(3,4-диметилфенил)тиофен-3-карбоновая кислота;
2-(3-метилбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновая кислота;
2-(3-метилбензамидо)-4-(4-метилфенил)тиофен-3-карбоновая кислота;
2-(3-метилбензамидо)-4-(фенил)тиофен-3-карбоновая кислота;
2-(3-метилбензамидо)-4-(2-бромфенил)тиофен-3-карбоновая кислота;
2-(3-метилбензамидо)-4-(4-фторфенил)тиофен-3-карбоновая кислота;
2-(3-метилбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновая кислота;
2-(3-метилбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновая кислота;
2-(3-метилбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновая кислота;
2-(3-метилбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновая кислота;
метил-2-(4-хлорбензамидо)-4-(4-фторфенил)тиофен-3-карбоксилат;
этил-2-(4-хлорбензамидо)-4-(4-фторфенил)тиофен-3-карбоксилат;
2-(4-йодбензамидо)-4-(4-бромфенил)тиофен-3-карбоновая кислота;
4-(2,4-дихлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновая кислота;
4-(3,4-дихлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновая кислота;
4-(3,5-дихлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновая кислота;
4-(4-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновая кислота;
4-(3-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновая кислота;
4-(2-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновая кислота;
4-(4-бромфенил)-2-(2-хлор-4-фторбензамидо)тиофен-3-карбоновая кислота;
4-(4-бромфенил)-2-(3,4-дифторбензамидо)тиофен-3-карбоновая кислота;
2-(2-хлор-4-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновая кислота;
4-(4-бромфенил)-2-(2-фторбензамидо)тиофен-3-карбоновая кислота;
4-(4-бромфенил)-2-(3-фтор-4-метоксибензамидо)тиофен-3-карбоновая кислота;
4-(4-хлорфенил)-2-(4-метилбензамидо)тиофен-3-карбоновая кислота;
4-(4-бромфенил)-2-(4-цианобензамидо)тиофен-3-карбоновая кислота;
4-(4-хлорфенил)-2-(4-этилбензамидо)тиофен-3-карбоновая кислота;
4-(4-хлорфенил)-2-(4-(трифторметил)бензамидо)тиофен-3-карбоновая кислота;
4-(4-хлорфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновая кислота;
4-(4-бромфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновая кислота;
4-(4-хлорфенил)-2-(3-(2,4-дифторфенил)пропанамидо)тиофен-3-карбоновая кислота;
4-(4-бромфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновая кислота;
4-(4-бромфенил)-2-(3-(4-фторфенил)пропанамидо)тиофен-3-карбоновая кислота;
4-(4-хлорфенил)-2-(3-(3,4-дифторфенил)пропанамидо)тиофен-3-карбоновая кислота;
4-(4-бромфенил)-2-(3-(2,4-дифторфенил)пропанамидо)тиофен-3-карбоновая кислота;
4-(4-бромфенил)-2-(3-(3,4-дифторфенил)пропанамидо)тиофен-3-карбоновая кислота;
4-(4-хлорфенил)-2-(3-(4-фторфенил)пропанамидо)тиофен-3-карбоновая кислота;
4-(4-хлорфенил)-2-(3-(3-хлорфенил)пропанамидо)тиофен-3-карбоновая кислота; и
4-(4-хлорфенил)-2-(3-(4-хлорфенил)пропанамидо)тиофен-3-карбоновая кислота.
В одном аспекте здесь описано соединение формулы (II),

где R1 представляет собой водород, С1-С6 алкил, С1-С6 галогеноалкил или бензил;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, С1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из С1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
или его фармацевтически приемлемая соль, фармацевтически приемлемый сольват или фармацевтически приемлемое пролекарство.
Для всех без исключения воплощений заместители могут быть выбраны из подгруппы перечисленных альтернатив. Например, в некоторых воплощениях R1 представляет собой водород или С1-С6 алкил. В других воплощениях R1 представляет собой водород, метил, этил, н-пропил или изопропил. В других воплощениях R1 представляет собой водород. В одном воплощении карбоксильная группировка тиофенового ядра заменена биоизостером карбоновой кислоты.
В некоторых воплощениях R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, C1-С6 фторалкила, C1-С6 гетероалкила и C1-С6 галогеноалкила. В других воплощениях R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CF3, -ОН, -ОСН3, -OCF3, метила и этила.
В одном воплощении R1 представляет собой водород или C1-С6 алкил. В еще одном аспекте R1 представляет собой водород, метил, этил, н-пропил или изопропил.
В другом воплощении R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, С1-С6 алкила, C1-С6 фторалкила, C1-С6 гетероалкила и C1-С6 галогеноалкила.
В одном воплощении R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CF3, -ОН, -ОСН3, -OCF3, метила и этила.
В другом воплощении соединение формулы (IIA) представляет собой
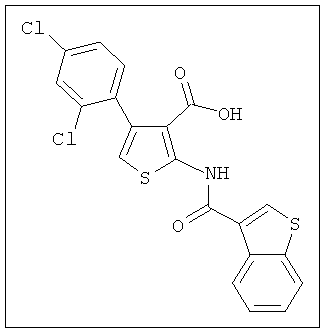 .
.
В одном аспекте здесь описано соединение формулы (IIБ),

где R1 представляет собой водород, С1-С6 алкил, C1-С6 галогеноалкил или бензил;
R4 представляет собой арил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO3, -CF3, -ОН, -OR8, -OCF3, C1-С6 алкила, С3-С6 циклоалкила, C1-С6 фторалкила, C1-С6 гетероалкила, C1-С6 галогеноалкила, тетразолила, С2-С6 гетероциклоалкила, фенила, -NHS(=O)2R8, -S(=O)2N(R9)2, -С(=O)CF3, -C(=O)NHS(=O)2R8, -S(=O)2NHC(=O)R9, -N(R9)2, -N(R9)C(=O)R8, -CO2R9, -C(=O)R8, -OC(=O)R8, -C(=O)N(R9)2, -SR8, -S(=O)R8 и -S(=O)2R8;
каждый R8 независимо выбран из C1-С6 алкила, C1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
каждый R9 независимо выбран из Н, C1-С6 алкила, С1-С6 галогеноалкила, С3-С8 циклоалкила, фенила и бензила;
или его фармацевтически приемлемая соль, фармацевтически приемлемый сольват или фармацевтически приемлемое пролекарство.
В одном воплощении R1 представляет собой водород или C1-С6 алкил. В еще одном аспекте R1 представляет собой водород, метил, этил, н-пропил или изопропил. В одном воплощении карбоксильная группировка тиофенового ядра заменена биоизостером карбоновой кислоты.
В другом воплощении R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CN, -NO2, -CF3, -ОН, -OR8, -OCF3, С1-С6 алкила, С1-С6 фторалкила, C1-С6 гетероалкила и C1-С6 галогеноалкила.
В одном воплощении R4 представляет собой фенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, -CF3, -ОН, -ОСН3, -OCF3, метила и этила.
В другом воплощении соединение формулы (IIБ) выбрано из:
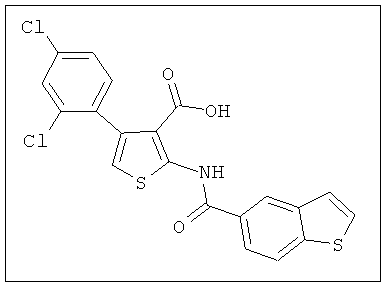 ,
, 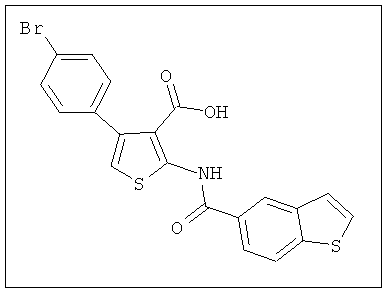 ,
, 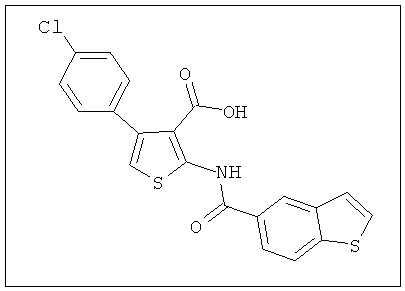 и
и  .
.
В данном описании группы и их заместители могут быть выбраны специалистом в данной области техники для обеспечения стабильных группировок и соединений.
Другие формы соединений
Соединения, описанные здесь, могут в некоторых случаях существовать в форме диастереомеров, энантиомеров или в других стереоизомерных формах. Соединения, представленные здесь, включают все диастереомерные, энантиомерные и эпимерные формы, а также их подходящие смеси. Разделение стереоизомеров может быть проведено хроматографией или образованием диастереомеров и разделением перекристаллизацией, или хроматографией, или любой их комбинацией. (Jean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates and Resolutions", John Wiley And Sons, Inc., 1981, включенная в данное описание посредством ссылки). Стереоизомеры могут также быть получены стереоселективным синтезом.
В некоторых ситуациях соединения могут существовать в форме таутомеров. Все таутомеры включены в описанные здесь формулы.
Способы и композиции, описанные здесь, включают применение аморфных форм, а также кристаллических форм (также известных как полиморфы). Соединения, описанные здесь, могут быть представлены в форме фармацевтически приемлемых солей. Активные метаболиты этих соединений, имеющие такой же тип активности, также включены в объем настоящего описания. В дополнение, соединения, описанные здесь, могут существовать в несольватированной, а также сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. Сольватированные формы представленных здесь соединений также рассматривают как раскрытые здесь.
В некоторых воплощениях соединения, описанные здесь, могут быть получены в форме пролекарств. «Пролекарство» относится к агенту, превращаемому в исходное лекарственное средство in vivo. Пролекарства часто полезны, поскольку в некоторых ситуациях они могут быть проще для введения, чем исходное лекарственное средство. Они могут, например, быть биодоступными при пероральном введении, в то время как исходное лекарственное средство не является биодоступным при пероральном введении. Пролекарство может также иметь улучшенную растворимость в фармацевтических композициях по сравнению с исходным лекарственным средством. Неограничивающим примером пролекарства может быть соединение, описанное здесь, вводимое в форме сложного эфира («пролекарства») для облегчения передачи через клеточную мембрану, где растворимость в воде вредна для подвижности, но который затем проходит метаболический гидролиз с образованием карбоновой кислоты, активного вещества, при его попадании в клетку, где растворимость в воде полезна. Другим примером пролекарства может являться короткий пептид (полиаминокислота), связанный с кислотной группой, при метаболизме которого происходит высвобождение активной группировки. В определенных воплощениях при введении in vivo пролекарство подвержено химическому превращению в биологически, фармацевтически или терапевтически активную форму соединения. В определенных воплощениях пролекарство подвержено ферментативному метаболизму в одну или более чем одну стадию или процесс с образованием биологически, фармацевтически или терапевтически активной формы соединения.
Для получения пролекарства фармацевтически активное соединение модифицируют таким образом, что активное соединение будет восстановлено при введении in vivo. Пролекарство может быть разработано для изменения метаболической стабильности или транспортных характеристик лекарственного средства, для маскировки побочных эффектов или токсичности, для улучшения вкуса и запаха лекарственного средства или для изменения других характеристик или свойств лекарственного средства. На основании знания фармакодинамических процессов и метаболизма лекарственных средств in vivo, специалисты в данной области техники, зная фармацевтически активное соединение, могут разработать пролекарства соединения (см., например, Nogrady (1985) Medicinal Chemistry A Biochemical Approach, Oxford University Press, New York, pages 388-392; Silverman (1992), The Organic Chemistry of Drag Design and Drag Action, Academic Press, Inc., San Diego, pages 352-401, Saulnier et al., (1994), Bioorganic and Medicinal Chemistry Letters, Vol.4, p.1985; Rooseboom et al., Pharmacological Reviews, 56:53-102, 2004; Miller et al., J. Med. Chem. Vol.46, no. 24, 5097-5116, 2003; Aesop Cho, "Recent Advances in Oral Prodrug Discovery", Annual Reports in Medicinal Chemistry, Vol.41, 395-407, 2006).
Пролекарственные формы описанных здесь соединений, где пролекарство подвержено метаболизму in vivo с образованием соединения формулы (I), (II), (IIA) или (IIБ), как изложено здесь, включены в объем формулы изобретения. В некоторых случаях некоторые из описанных здесь соединений могут представлять собой пролекарство для другого производного или активного соединения.
Пролекарства часто полезны, поскольку в некоторых ситуациях они могут быть проще для введения, чем исходное лекарственное средство. Они могут, например, быть биодоступными при пероральном введении, в то время как исходное лекарственное средство не является биодоступным при пероральном введении. Пролекарство может также иметь улучшенную растворимость в фармацевтических композициях по сравнению с исходным лекарственным средством. Пролекарства могут быть разработаны как обратимые производные лекарственных средств для применения в качестве модификаторов для усиления транспорта лекарственных средств в сайт-специфические ткани. В некоторых воплощениях разработка пролекарства увеличивает эффективную растворимость в воде. См., например, Fedorak et al., Am. J. Physiol, 269:G210-218 (1995); McLoed et al., Gastroenterol, 106:405-413 (1994); Hochhaus et al., Biomed. Chrom., 6:283-286 (1992); J. Larsen and H. Bundgaard, Int. J. Pharmaceutics, 37, 87 (1987); J. Larsen et al., Int. J. Pharmaceutics, 47, 103 (1988); Sinkula et al., J. Pharm. Sci., 64:181-210 (1975); Т. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems, Vol.14 of the A.C.S. Symposium Series; and Edward B. Roche, Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, все включены в данное описание).
Сайты на ароматической кольцевой части соединений, описанных здесь, могут быть чувствительны к различным метаболическим реакциям, таким образом, введение подходящих заместителей в ароматические кольцевые структуры, таких как, исключительно в качестве примера, галогены, может снижать, минимизировать или устранять этот метаболический путь.
Соединения, описанные здесь, могут быть мечены изотопами (например, радиоизотопом) или другими способами, включая, без ограничения, применение хромофоров или флуоресцентных группировок, биолюминесцентных меток, фотоактивных или хемилюминесцентных меток.
Соединения, описанные здесь, включают меченные изотопами соединения, идентичные соединениям, изложенным в различных формулах и структурах, представленных здесь, за исключением того факта, что один или более чем один атом заменен атомом, имеющим атомную массу или массовое число, отличающееся от атомной массы или массового числа, обычно обнаруживаемого в природе. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фтора и хлора, такие как, например, 2H, 3H, 13C, 14С, 15N, 18O, 17O, 35S, 18F, 36Cl соответственно. Определенные меченные изотопами соединения, описанные здесь, например, те, в которые включены такие радиоактивные изотопы, как 3H и 14С, полезны в анализах распределения лекарственных средств и/или субстратов в тканях. Кроме того, замена такими изотопами, как дейтерий, то есть 2H, может сделать возможными определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, такие как, например, увеличенный период полувыведения in vivo или сниженные требования в отношении доз.
В дополнительных или других воплощениях соединения, описанные здесь, подвержены метаболизму при введении в организм, нуждающийся в этом, для образования метаболита, используемого затем для оказания желаемого эффекта, включая желаемый терапевтический эффект.
Соединения, описанные здесь, могут быть получены и/или быть использованы в форме фармацевтически приемлемых солей. Типы фармацевтически приемлемых солей включают, без ограничения: (1) соли присоединения кислот, образованные взаимодействием соединения в форме свободного основания с фармацевтически приемлемой: неорганической кислотой, такой как, например, соляная кислота, бромоводородная кислота, серная кислота, фосфорная кислота, метафосфорная кислота и тому подобное; или органической кислотой, такой как, например, уксусная кислота, пропионовая кислота, капроевая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, трифторуксусная кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-метилбицикло-[2.2.2]окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 4,4'-метиленбис-(3-гидрокси-2-ен-1-карбоновая кислота), 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота, масляная кислота, фенилуксусная кислота, фенилмасляная кислота, вальпроевая кислота и тому подобное; (2) соли, образованные при замене кислого протона, присутствующего в исходном соединении, ионом металла, например ионом щелочного металла (например, лития, натрия, калия), ионом щелочноземельного металла (например, магния или кальция) или ионом алюминия. В некоторых случаях соединения, описанные здесь, могут образовывать координационные соединения с органическим основанием, таким как, без ограничения, этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин, дициклогексиламин, трис(гидроксиметил)метиламин. В других случаях соединения, описанные здесь, могут образовывать соли с аминокислотами, такими как, без ограничения, аргинин, лизин и тому подобное. Приемлемые неорганические основания, используемые для образования солей с соединениями, содержащими кислый протон, включают, без ограничения, гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия, гидроксид натрия и тому подобное.
Следует понимать, что ссылка на фармацевтически приемлемую соль, включает ее формы с присоединением растворителя или кристаллические формы, в частности сольваты или полиморфы. Сольваты содержат либо стехиометрические, либо нестехиометрические количества растворителя и могут быть образованы в процессе кристаллизации с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. Когда растворителем является вода, происходит образование гидратов, или, когда растворителем является спирт, происходит образование алкоголятов. Сольваты соединений, описанных здесь, могут легко быть получены или образованы в способах, описанных здесь. В дополнение, соединения, предложенные здесь, могут существовать в несольватированных, а также сольватированных формах. В большинстве случаев в целях соединений и способов, предложенных здесь, сольватированные формы рассматривают как эквивалентные несольватированным формам.
В некоторых воплощениях соединения, описанные здесь, такие как соединения формулы (I), (II), (IIA) и (IIБ), представлены в различных формах, включая, без ограничения, аморфные формы, измельченные формы и формы наночастиц. В дополнение, соединения, описанные здесь, включают кристаллические формы, также известные как полиморфы. Полиморфы включают различные конфигурации укладки кристаллов одного и того же элементного состава соединения. Полиморфы обычно имеют разные картины дифракции рентгеновских лучей, точки плавления, плотность, твердость, форму кристаллов, оптические свойства, стабильность и растворимость. Различные факторы, такие как растворитель для перекристаллизации, скорость кристаллизации и температура хранения, могут привести к доминированию одной кристаллической формы.
Скрининг и описание фармацевтически приемлемых солей, полиморфов и/или сольватов могут быть проведены с применением множества методик, включая, без ограничения, термический анализ, дифракцию рентгеновских лучей, спектроскопию, сорбцию пара и микроскопию. Способы термического анализа направлены на термохимическую деградацию и термофизические процессы, включая, без ограничения, полиморфные превращения, и такие способы применяют для анализа взаимосвязи различных полиморфных форм, для определения потери массы, для установления температуры стеклования или для исследований совместимости эксципиентов. Такие способы включают, без ограничения, дифференциальную сканирующую калориметрию (DSC), модулированную дифференциальную сканирующую калориметрию (MDCS), термогравиметрический анализ (TGA) и термогравиметрический анализ и инфракрасную спектроскопию (TG/IR). Способы дифракции рентгеновских лучей включают, без ограничения, дифрактометры на монокристалле и порошковые дифрактометры и источники синхротронного излучения. Различные используемые спектроскопические методики включают, без ограничения, спектроскопию комбинационного рассеяния света, инфракрасную спектроскопию на основе преобразования Фурье (FTIR), спектроскопию в видимой и ультрафиолетовой части спектра (UV-VIS-спектроскопию) и ядерный магнитный резонанс (NMR) (жидко- и твердотельный). Различные микроскопические методики включают, без ограничения, микроскопию в поляризованном свете, сканирующую электронную микроскопию (SEM) с энергорассеивающим рентгеновским анализом (EDX), сканирующую электронную микроскопию в режиме «естественной среды» с EDX (в газовой атмосфере или атмосфере водяного пара), инфракрасную микроскопию (IR-микроскопию) и микроскопию с комбинационным рассеянием.
В данном описании группы и их заместители могут быть выбраны специалистом в данной области техники для обеспечения стабильных группировок и соединений.
Синтез соединений
В некоторых воплощениях синтез соединений, описанных здесь, осуществляют с применением способов, описанных в химической литературе, с применением способов, описанных здесь, или их комбинацией. В дополнение, растворители, температуры и другие условия реакции, представленные здесь, могут быть изменены специалистами в данной области техники.
В других воплощениях исходные вещества и реагенты, используемые для синтеза соединений, описанных здесь, синтезируют или получают из коммерческих источников, таких как, без ограничения, Sigma Aldrich, FischerScientific (Fischer Chemicals) и AcrosOrganics.
В других воплощениях соединения, описанные здесь, и другие родственные соединения с другими заместителями синтезируют с применением методик и веществ, описанных здесь, а также известных в данной области техники, таких как описанные, например, в Fieser and Fieser's Reagents for Organic Synthesis, Volumes 1-17 (John Wiley and Sons, 1991); Rodd's Chemistry of Carbon Compounds, Volumes 1-5 and Supplemental (Elsevier Science Publishers, 1989); Organic Reactions, Volumes 1-40 (John Wiley and Sons, 1991), Larock's Comprehensive Organic Transformations (VCH Publishers Inc., 1989), March, advanced Organic Chemistry 4th Ed., (Wiley 1992); Carey and Sundberg, Advanced Organic Chemistry 4th Ed., Vols. A and (Plenum 2000, 2001), и Green and Wuts, Protective groups in Organic Synthesis 3rd Ed., (Wiley 1999) (все включены в данное описание посредством ссылки). Общие способы получения соединения, как раскрыто здесь, могут быть выведены из известных в данной области техники реакций, и реакции могут быть модифицированы с применением подходящих реагентов и условий, как будет ясно специалисту в данной области техники, для введения различных группировок, обнаруженных в формулах, как представлено здесь. В качестве руководства могут быть применены следующие способы синтеза.
Образование ковалентных связей посредством взаимодействия электрофила и нуклеофила
Соединения, описанные здесь, могут быть модифицированы с применением различных электрофилов и/или нуклеофилов для образования новых функциональных групп или заместителей. В Таблице 2, названной «Примеры ковалентных связей и их предшественников», перечислены неограничивающие примеры ковалентных связей и функциональных групп-предшественников, образующих ковалентные связи. Таблицу 2 можно использовать в качестве руководства по множеству имеющихся в распоряжении комбинаций электрофилов и нуклеофилов, обеспечивающих ковалентные связи. Функциональные группы-предшественники показаны как электрофильные группы и нуклеофильные группы.
Использование защитных групп
В описанных реакциях может быть необходимой защита реакционноспособных функциональных групп, например гидроксильных групп, аминогрупп, иминогрупп, тиогрупп или карбоксильных групп, где желательно их присутствие в конечном продукте, во избежание их нежелательного участия в реакциях. Защиту групп используют для того, чтобы заблокировать некоторые или все реакционноспособные группировки и предотвратить участие таких групп в химических реакциях до удаления защитной группы. Предпочтительно, чтобы каждую защитную группу можно было удалить отличным от других защитных групп способом. Защитные группы, отщепляемые в полностью несопоставимых условиях реакции, удовлетворяют требованию дифференциального удаления.
Защитные группы могут быть удалены кислотой, основанием, восстановительными условиями (такими как, например, гидрогенолиз) и/или окислительными условиями. Такие группы, как трифенилметил, диметокситрифенилметил, ацеталь и трет-бутилдиметилсилил, кислото-неустойчивы и могут быть использованы для защиты реакционноспособных карбоксильных и гидроксильных группировок в присутствии аминогрупп, защищенных карбобензоксигруппами (Cbz-группами), удаляемыми гидрогенолизом, и флуоренилметоксикарбонильными группами (Fmoc-группами), неустойчивыми к основаниям. Реакционноспособные группировки карбоновых кислот и гидроксильные группировки можно заблокировать группами, неустойчивыми к основаниям, такими как, без ограничения, метил, этил и ацетил, в присутствии аминов, заблокированных группами, неустойчивыми к кислотам, такими как трет-бутилкарбамат, или карбаматами, устойчивыми как к кислотам, так и к основаниям, но удаляемыми гидролизом.
Реакционноспособные группировки карбоновых кислот и гидроксильные группировки можно также заблокировать защитными группами, удаляемыми гидролизом, такими как бензильная группа, в то время как аминогруппы, способные присоединять водород от кислот, можно заблокировать группами, неустойчивыми к основаниям, такими как Fmoc-группа. Реакционноспособные группировки карбоновых кислот можно защитить превращением в простые сложноэфирные соединения, примеры которых приведены здесь, включая превращение в алкиловые сложные эфиры, или их можно заблокировать защитными группами, удаляемыми окислением, такими как 2,4-диметоксибензил, в то время как сосуществующие аминогруппы можно заблокировать неустойчивыми к фторидам силилкарбаматами.
Аллильные блокирующие группы применимы в присутствии защитных групп кислот и оснований, поскольку первые являются стабильными и могут быть впоследствии удалены металлическими или pi-кислотными катализаторами. Например, защита блокированной аллилом карбоновой кислоты может быть удалена Pd0-катализируемой реакцией в присутствии неустойчивых к кислотам трет-бутилкарбаматных или неустойчивых к основаниям ацетатных защитных групп аминов. Другой формой защитной группы является смола, к которой может быть присоединено соединение или промежуточный продукт. Поскольку остаток присоединен к смоле, функциональная группа заблокирована и не может взаимодействовать. При высвобождении из смолы функциональная группа доступна для взаимодействия.
Типичные блокирующие/защитные группы могут быть выбраны из:
Другие защитные группы и подробное описание методик, применимых для создания защитных групп, и их удаление описаны в Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons, New York, NY, 1999, и Kocienski, Protective Groups, Thieme Verlag, New York, NY, 1994, включенных в данное описание посредством ссылки).
Общий синтез
Получение соединений формулы (I), (II), (IIA) и (IIБ), описанных здесь, может быть осуществлено способами, известными в данной области техники, такими как описанные в Koebel et al., J. Med. Chem. 1975, vol 18, no 2, 192-194; Gewald, K.; Schinke, E.; Bottcher, H. Chem. Ber. 1966, 99, 94-100; Sabnis, R. W. Sulfur Rep. 1994, 16, 1-17; Sabnis, R. W. еt al., J. Heterocyclic Chem. 1999, 36, 333; Gemot A. Eller, Wolfgang Holzer Molecules 2006, 11, 371-376; Michael G. et al., J. Med. Chem.; 1999; 42(26) pp 5437 - 5447; все включены сюда посредством ссылки.
В одном воплощении соединения, описанные здесь, получают по последовательности, изображенной на Схеме А.
Схема А. Неограничивающий пример синтеза соединений формулы (I), (II), (IIA) или (IIБ)
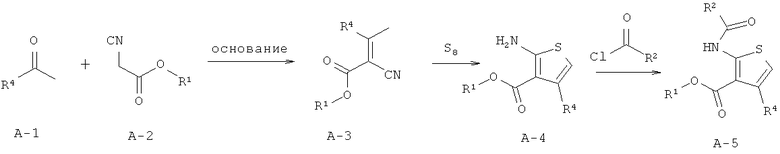
Конденсация Кновенагеля между кетонами структуры А-1 и цианоацетатами структуры А-2 приводит к образованию оснований Шиффа структуры А-3. Например, кетоны структуры А-1 подвергают взаимодействию с цианоацетатами структуры А-2 в присутствии амина, такого как, например, морфолин, в растворителе, таком как толуол, в условиях дегидратации, как например в присутствии 4 Å молекулярных сит, с образованием основания Шиффа структуры А-3. Основания Шиффа структуры А-3 подвергают взаимодействию в условиях реакции Гевальда (сера (S8), морфолин в растворителе, таком как этанол и толуол) с образованием тиофенов структуры А-4. Тиофены структуры А-4 затем подвергают взаимодействию с множеством хлорангидридов карбоновых кислот с получением соединений формулы (I). В другом воплощении тиофены структуры А-4 можно сочетать с карбоновыми кислотами в присутствии агента сочетания, такого как, например, дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIC), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDCI), N-гидроксибензотриазол (НОВТ), N-гидроксисукцинимид (HOSu), 4-нитрофенол, пентафторфенол, тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (TBTU), гексафторфосфат O-бензотриазол-N,N,N'N'-тетраметилурония (HBTU), гексафторфосфат бензотриазол-1-ил-окси-трис-(диметиламино)-фосфония (ВОР), гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония, гексафторфосфат бром-трис-пирролидинофосфония, тетрафторборат 2-(5-норборнен-2,3-дикарбоксимидо)-1,1,3,3-тетраметилурония (TNTU), тетрафторборат O-(N-сукцинимидил)-1,1,3,3-тетраметилурония (TSTU), гексафторфосфат тетраметилфторформамидиния и тому подобное, с получением соединений формулы (I).
В другом воплощении соединения формулы (I), (II), (IIA) и (IIБ) получают следующим способом, показанным на Схеме Б.
Схема Б. Неограничивающий пример синтеза соединений формулы (I), (II), (IIA) или (IIБ)
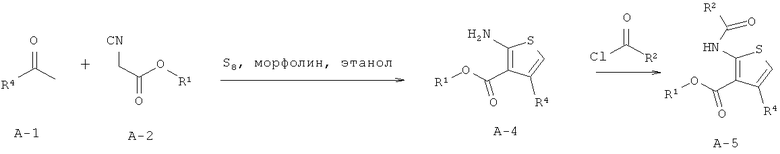
Кетоны структуры А-1, цианоацетаты структуры A-2, элементарную серу, морфолин и этанол смешивают друг с другом и перемешивают при комнатной температуре с образованием тиофенов структуры A-4. Тиофены структуры A-4 затем подвергают взаимодействию с активированными карбоновыми кислотами, такими как хлорангидриды, с образованием амидов структуры A-5. Гидролиз сложноэфирной функциональной группы амидов структуры A-5 приводит к получению соответствующих карбоновых кислот.
Схемы, представленные здесь, являются лишь иллюстрацией некоторых способов, которыми могут быть синтезированы соединения, описанные здесь, и в эти схемы могут быть внесены различные изменения, и они будут предложены специалисту в данной области техники со ссылкой на данное описание.
В данном описании группы и их заместители могут быть выбраны специалистом в данной области техники для обеспечения стабильных группировок и соединений.
Точная терминология
Если не определено иначе, все технические и научные термины, используемые здесь, имеют такое же значение, как их обычно понимает специалист в области техники, к которой относится заявленный объект изобретения. В случае, если используемые здесь термины имеют множество определений, основными являются определения этого раздела. Все патенты, патентные заявки, публикации и опубликованные нуклеотидные и аминокислотные последовательности (например, последовательности, доступные в GenBank или других базах данных), упомянутые здесь, включены посредством ссылки. Там, где сделана ссылка на URL или другой такой идентификатор или адрес, подразумевают, что такие идентификаторы могут изменяться, и конкретная информация в Интернете может появляться и исчезать, но эквивалентная информация может быть найдена при поиске в интернете. Ссылка на них является свидетельством доступности и публичного распространения такой информации.
Следует понимать, что предшествующее общее описание и последующее подробное описание являются лишь примером и объяснением и не ограничивают ни один из заявленных объектов изобретения. В данной заявке применение единственного числа включает применение множественного числа, если специально не указано иное. Необходимо отметить, что при использовании в данном описании и прилагаемой формуле изобретения формы единственного числа, указывающие на неопределенное количество, включают множественные референты, если контекстом ясно не продиктовано иное. В данной заявке применение «или» обозначает «и/или», если не указано иное. Кроме того, применение термина «включающий» или «включая», а также других форм, таких как «включать», «включает» и «включенный», не является ограничивающим.
Заголовки разделов, используемые здесь, приведены лишь в организационных целях, и их не следует толковать как ограничивающие описываемый объект изобретения.
Определение стандартных химических терминов может быть обнаружено в работах, на которые сделана ссылка, включая, без ограничения, Carey and Sundberg "ADVANCED ORGANIC CHEMISTRY 4TH ED." Vols. A (2000) and В (2001), Plenum Press, New York. Если не указано иное, применяют обычные способы масс-спектроскопии, ядерного магнитного резонанса, высокоэффективной жидкостной хроматографии (HPLC), химии белков, биохимии, методики рекомбинантных ДНК и фармакологические способы, известные специалистам в данной области техники.
Если не приведены специальные определения, описанные здесь лабораторные способы и методики аналитической химии, синтетической органической химии и медицинской и фармацевтической химии, и номенклатура, используемая в связи с ними, являются известными специалистам в данной области техники. Для химического синтеза, химических анализов, получения, изготовления и доставки фармацевтических средств и лечения пациентов могут быть использованы стандартные методики. Для рекомбинантных ДНК, синтеза олигонуклеотидов и культивирования и трансформации тканей могут быть использованы стандартные методики (например, электропорация, липофекция). Реакции и методики очистки могут быть проведены, например, с применением наборов описаний изготовителя, или как обычно проводят в данной области техники, или как описано здесь. Вышеизложенные методики и способы, могут в большинстве случаев быть проведены обычными способами, известными в данной области техники, и как описано в различных общих и более конкретных ссылках, перечисленных и обсуждаемых в настоящем описании.
Следует понимать, что способы и композиции, описанные здесь, не ограничены конкретными методиками, протоколами, клеточными линиями, конструкциями и реагентами, описанными здесь, и могут быть изменены сами по себе. Также следует понимать, что использованная здесь терминология приведена лишь с целью описания конкретных воплощений, и подразумевают, что она не ограничивает объем способов, соединений, композиций, описанных здесь.
При использовании здесь C1-Cx включает C1-C2, C1-С3… C1-Cx. C1-Cx относится к числу атомов углерода, составляющих обозначаемую группировку (за исключением возможных заместителей).
«Алкильная» группа относится к алифатической углеводородной группе. Алкильные группы могут включать или не включать ненасыщенные единицы. Алкильная группировка может представлять собой «насыщенную алкильную» группу, что означает, что она не содержит ненасыщенных единиц (то есть двойной углерод-углеродной связи или тройной углерод-углеродной связи). Алкильная группировка может также представлять собой «ненасыщенную алкильную» группировку, что означает, что она содержит по меньшей мере одну ненасыщенную единицу. Алкильная группировка, насыщенная или ненасыщенная, может представлять собой алкильную группировку с разветвленной цепью, с неразветвленной цепью или циклическую алкильную группировку.
«Алкильная» группа может иметь от 1 до 6 атомов углерода (при его появлении в любом месте здесь численный диапазон, как например от «1 до 6», относится к каждому целому числу в данном диапазоне; например, «от 1 до 6 атомов углерода» означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода и так далее до 6 атомов углерода включительно, тем не менее, настоящее определение также включает существование термина «алкил» без указания численного диапазона). Алкильная группа соединений, описанных здесь, может быть обозначена как «C1-С6 алкил» или сходными обозначениями. Исключительно в качестве примера, «C1-С6 алкил» указывает, что в алкильной цепи присутствуют от одного до шести атомов углерода, то есть алкильная цепь выбрана из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила, трет-бутила, н-пентила, изопентила, неопентила, гексила, пропен-3-ила (аллила), циклопропилметила, циклобутилметила, циклопентилметила, циклогексилметила. Алкильные группы могут быть замещенными или незамещенными. В зависимости от структуры алкильная группа может быть монорадикальной или дирадикальной (то есть алкиленовой группой).
Термин «алкокси» относится к группе «-O-алкил», где алкил представляет собой алкил, как определено здесь.
Термин «алкенил» относится к типу алкильной группы, где первые два атома алкильной группы образуют двойную связь, не являющуюся частью ароматической группы. То есть в начале алкенильной группы расположены атомы -C(R)=CR2, где R относится к остальным частям алкенильной группы, которые могут быть одинаковыми или различными. Неограничивающие примеры алкенильной группы включают -СН=СН2, -С(СН3)=СН2, -СН=СНСН3, -СН=С(СН3)2 и -С(СН3)=СНСН3. Алкенильная группировка может представлять собой алкильную группировку с разветвленной цепью, с неразветвленной цепью или циклическую алкенильную группировку (в таком случае она может также быть известна как «циклоалкенильная» группа). Алкенильные группы могут иметь от 2 до 6 атомов углерода. Алкенильные группы могут быть замещенными или незамещенными. В зависимости от структуры алкенильная группа может являться монорадикальной или дирадикальной (то есть алкениленовой группой).
Термин «алкинил» относится к типу алкильной группы, где первые два атома алкильной группы образуют тройную связь. То есть в начале алкинильной группы расположены атомы  где R относится к остальным частям алкинильной группы. Неограничивающие примеры алкинильной группы включают
где R относится к остальным частям алкинильной группы. Неограничивающие примеры алкинильной группы включают 
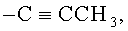
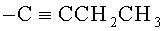 и
и 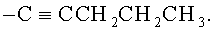 Часть «R» алкинильной группировки может быть разветвленной, неразветвленной или циклической. Алкинильная группа может иметь от 2 до 6 атомов углерода. Алкинильные группы могут быть замещенными или незамещенными. В зависимости от структуры алкинильная группа может являться монорадикальной или дирадикальной (то есть алкиниленовой группой).
Часть «R» алкинильной группировки может быть разветвленной, неразветвленной или циклической. Алкинильная группа может иметь от 2 до 6 атомов углерода. Алкинильные группы могут быть замещенными или незамещенными. В зависимости от структуры алкинильная группа может являться монорадикальной или дирадикальной (то есть алкиниленовой группой).
«Амино» относится к группе -NH2.
Термин «алкиламин» или «алкиламино» относится к группе -N(алкил)хНу, где алкил представляет собой алкил, как определено здесь, и х и у выбраны из группы х=1, у=1 и х=2, у=0. Когда х=2, алкильные группы, взятые вместе с атомом азота, к которому они присоединены, могут возможно образовывать циклическую кольцевую систему. «Диалкиламино» относится к группе -N(алкил)2, где алкил представляет собой алкил, как определено здесь.
Термин «ароматический» относится к плоскому кольцу, имеющему делокализованную π-электронную систему, содержащую 4n+2π-электронов, где n представляет собой целое число. Ароматические кольца могут быть образованы из пяти, шести, семи, восьми, девяти или более чем девяти атомов. Ароматические структуры могут возможно быть замещенными. Термин «ароматический» включает как арильные группы (например, фенил, нафталинил), так и гетероарильные группы (например, пиридинил, хинолинил).
При использовании здесь термин «арил» относится к ароматическому кольцу, в котором каждый из атомов, образующих кольцо, представляет собой атом углерода. Арильные кольца могут быть образованы пятью, шестью, семью, восьмью, девятью или более чем девятью атомами углерода. Арильные группы могут возможно быть замещенными. Арильные группы включают, без ограничения, фенил и нафталинил. В зависимости от структуры арильная группа может являться монорадикальной или дирадикальной (то есть ариленовой группой).
«Карбоксильный» относится к -CO2H. В некоторых воплощениях карбоксильные группировки могут быть заменены «биоизостером карбоновой кислоты», что относится к функциональной группе или группировке, демонстрирующей сходные с группировкой карбоновой кислоты физические и/или химические свойства. Биоизостер карбоновой кислоты имеет сходные с группировкой карбоновой кислоты биологические свойства. Соединение с группировкой карбоновой кислоты может иметь группировку карбоновой кислоты, замещенную на биоизостер карбоновой кислоты, и иметь сходные физические и/или биологические свойства при сравнении с соединением, содержащим карбоновую кислоту. Например, в одном воплощении биоизостер карбоновой кислоты будет ионизирован при физиологическом рН приблизительно в такой же степени, что и группа карбоновой кислоты. Примеры биоизостеров карбоновых кислот включают, без ограничения,
 ,
, 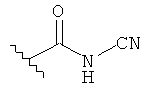 ,
, 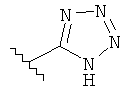 ,
, 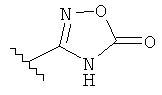 ,
, 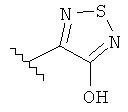 ,
, 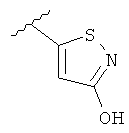 ,
, 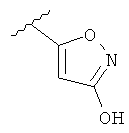 ,
, 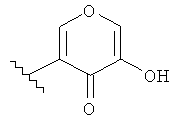 ,
,
и тому подобное.
Термин «циклоалкил» относится к моноциклическому или полициклическому неароматическому радикалу, где каждый из атомов, образующих кольцо (то есть атомов скелета), представляет собой атом углерода. Циклоалкилы могут быть насыщенными или частично ненасыщенными. Циклоалкилы могут быть конденсированы с ароматическим кольцом (в таком случае циклоалкил связан через атом углерода, не являющийся атомом ароматического кольца). Циклоалкильные группы включают группы, имеющие от 3 до 10 атомов в кольце. Иллюстративные примеры циклоалкильных групп включают, без ограничения, следующие группировки:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 
и тому подобное.
Термин «гетероарил» или, альтернативно, «гетероароматический», относится к арильной группе, содержащей в кольце один или более чем один гетероатом, выбранный из азота, кислорода и серы. Азотсодержащая «гетероароматическая» или «гетероарильная» группировка относится к ароматической группе, где по меньшей мере один из атомов скелета кольца представляет собой атом азота. Полициклические гетероарильные группы могут быть конденсированными или неконденсированными. Иллюстративные примеры гетероарильных групп включают следующие группировки:
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
, 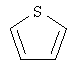 ,
, 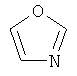 ,
, 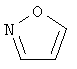 ,
, 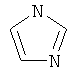 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 
и тому подобное.
«Гетероциклоалкильная» группа или «гетероалициклическая» группа относится к циклоалкильной группе, где по меньшей мере один атом скелета кольца представляет собой гетероатом, выбранный из азота, кислорода и серы. Радикалы могут быть конденсированы с арилом или гетероарилом. Иллюстративные примеры гетероциклоалкильных групп, также называемых неароматическими гетероциклами, включают;
 ,
, 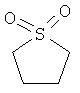 ,
, 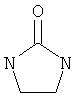 ,
,  ,
, 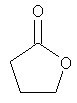 ,
, 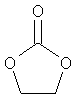 ,
, 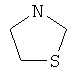 ,
,
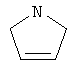 ,
, 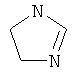 ,
, 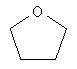 ,
, 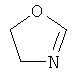 ,
, 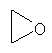 ,
, 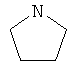 ,
, 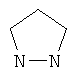 ,
,  ,
,  ,
, 
 ,
,  ,
,  ,
,  ,
,  ,
, 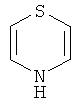 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,
и тому подобное. Термин гетероалициклический также включает все кольцевые формы углеводов, включая, без ограничения, моносахариды, дисахариды и олигосахариды. Если не указано иное, гетероциклоалкилы имеют в кольце от 2 до 10 атомов углерода. Понятно, что при указании числа атомов углерода в гетероциклоалкиле число атомов углерода в данном гетероциклоалкиле не равно общему числу атомов (включая гетероатомы), составляющих гетероциклоалкил (то есть атомов скелета кольца гетероциклоалкила).
Термин «галогено», или альтернативно «галоген», обозначает фторо, хлоро, бромо и йодо.
Термин «галогеноалкил» относится к алкильной группе, замещенной одним или более чем одним галогеном. Галогены могут быть одинаковыми, или они могут быть разными. Неограничивающие примеры галогеноалкилов включают -CH2Cl, -CF3, -CHF2, -CH2CF3, -CF3CF3, -CF(СН3)3 и тому подобное.
Термины «фторалкил» и «фторалкокси» включают алкильные и алкоксигруппы, соответственно, замещенные одним или более чем одним атомом фтора. Неограничивающие примеры фторалкилов включают -CF3, -CHF2, -CH2F, -CH2CF3, -CF2CF3, -CF2CF2CF3, -CF(СН3)3 и тому подобное. Неограничивающие примеры фторалкоксигрупп включают -OCF3, -OCHF2, -OCH2F, -OCH2CF3, -OCF2CF3, -OCF2CF2CF3, -OCF(СН3)2 и тому подобное.
Термин «гетероалкил» относится к алкильному радикалу, где один или более чем один атом скелета цепи выбран из атома, отличного от атома углерода, например, атома кислорода, азота, серы, фосфора, кремния или их комбинаций. Гетероатом (гетероатомы) могут быть расположены в любом внутреннем положении гетероалкильной группы. Примеры включают, без ограничения, -СН2-O-СН3, -СН2-СН2-O-СН3, -СН2-NH-СН3, -СН2-СН2-NH-СН3, -СН2-N(СН3)-СН3, -СН2-СН2-NH-СН3, -СН2-СН2-N(СН3)-СН3, -СН2-S-СН2-СН3, -СН2-СН2,-S(O)-СН3, -СН2-СН2-S(O)2-СН3, -CH2-NH-OCH3, -СН2-O-Si(СН3)3, -СН2-СН=N-ОСН3 и -СН=СН-N(СН3)-СН3. В дополнение до двух гетероатомов могут быть расположены последовательно, как например -СН2-NH-ОСН3 и -СН2-O-Si(СН3)3. За исключением числа гетероатомов, «гетероалкил» может иметь от 1 до 6 атомов углерода.
Термин «связь» или «одинарная связь» относится к химической связи между двумя атомами или двумя группировками, где атомы соединены связью и их рассматривают как часть более крупной субструктуры.
Термин «группировка» относится к определенному сегменту или функциональной группе молекулы. Химические группировки часто представляют собой распознаваемые химические группировки, включенные или присоединенные к молекуле.
При использовании здесь заместитель «R» при его появлении самого по себе и без численного обозначения относится к заместителю, выбранному из алкила, галогеноалкила, гетероалкила, алкенила, циклоалкила, арила, гетероарила (связанного через атом кольца) и гетероциклоалкила.
Термин «возможно замещенный» или «замещенный» обозначает, что соответствующая группа может быть замещенной одной или более чем одной дополнительной группой (группами), отдельно и независимо выбранными из алкила, циклоалкила, арила, гетероарила, гетероциклоалкила, -ОН, алкоксигруппы, арилоксигруппы, алкилтиогруппы, арилтиогруппы, алкилсульфоксидной группы, арилсульсроксидной группы, алкилсульфоновой группы, арилсульфоновой группы, -CN, галогеноа, ацила, ацилоксигруппы, -СО2Н, группы -CO2-алкил, нитрогруппы, галогеноалкила, фторалкила и аминогруппы, включая моно- и дизамещенные аминогруппы (например, -NN2, -NHR, -N(R)2), и их защищенных производных. В качестве примера возможные заместители могут представлять собой группы LsRs, где каждый Ls независимо выбран из связи, -O-, -С(=O)-, -S-, -S(=O)-, -S(=O)2-, -NH-, -NHC(O)-, -C(O)NH-, S(=O)2NH-, -NHS(=O)2, -OC(O)NH-, -NHC(O)O-, -(C1-алкил)- или -(С2-С6 алкенил)-; и каждый Rs независимо выбран из Н, (C1-С6 алкила), (С3-С8 циклоалкила), арила, гетероарила, гетероциклоалкила и C1-С6 гетероалкила. Защитные группы, способные образовывать защищенные производные указанных выше заместителей, представлены в таких источниках, как Greene and Wuts, приведенный выше.
Способы и композиции, описанные здесь, включают применение кристаллических форм (также известных как полиморфы) или фармацевтически приемлемых солей соединений, имеющих структуру формулы (I), (II), (IIA) или (IIБ), а также активных метаболитов этих соединений, имеющих такой же тип активности. В некоторых ситуациях соединения могут существовать в форме таутомеров. Все таутомеры включены в объем соединений, представленных здесь. В дополнение, соединения, описанные здесь, могут существовать в несольватированной, а также сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. Сольватированные формы представленных здесь соединений также рассматривают как раскрытые здесь.
Термины «набор и «продукт» используют как синонимы.
Термин «субъект» или «пациент» включает млекопитающих и животных, не являющихся млекопитающими. Примеры млекопитающих включают, без ограничения, любого члена класса Млекопитающие: людей, приматов, не являющихся людьми, таких как шимпанзе и другие виды человекообразных обезьян и обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы, свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки, и тому подобное. Примеры животных, не являющихся млекопитающими, включают, без ограничения, птиц, рыб и тому подобное. В одном воплощении способов и композиций, представленных здесь, млекопитающее представляет собой человека.
Термины «лечить» или «лечение» при использовании здесь включает облегчение, ослабление или уменьшение интенсивности симптомов заболевания или состояния, предотвращение дополнительных симптомов, улучшение или предотвращение причин, лежащих в основе симптомов, подавление заболевания или состояния, например прекращение развития заболевания или состояния, облегчение заболевания или состояния, индукцию регрессии заболевания или состояния, облегчение состояния, вызванного заболеванием или состоянием, или прекращение симптомов заболевания или состояния, профилактически и/или терапевтически.
При использовании здесь «белок-мишень» относится к белку или части белка, которые могут быть связаны соединением, описанным здесь, или могут взаимодействовать с соединением, описанным здесь, таким как соединение формулы (I), (II), (IIA) или (IIБ). В определенных воплощениях белок-мишень представляет собой белок STIM. В определенных воплощениях белок-мишень представляет собой белок Orai.
При использовании здесь «белок STIM» включает, без ограничения, STIM-1 млекопитающих, как например STIM-1 человека и грызуна (например, мыши), D-STIM Drosophila melanogaster, C-STIM С.elegans, STIM Anopheles gambiae и STIM-2 млекопитающих, как например STIM-2 человека и грызуна (например, мыши) (см. разделы [0211]-[0270] US 2007/0031814, а также Таблицу 3 US 2007/0031814, включенные сюда посредством ссылки). Как описано здесь, было установлено, что эти белки вовлечены в, участвуют в, и/или обеспечивают депо-управляемый вход кальция или его модуляцию, цитоплазматическое буферное действие в отношении кальция и/или модуляцию уровней кальция в, или перемещение кальция внутрь, в пределах или из внутриклеточных депо кальция (например, эндоплазматического ретикулума).
При использовании здесь «белок Orai» включает Orai1 (SEQ ID NO: 1, как описано в WO 07/081804), Orai2 (SEQ ID NO: 2, как описано в WO 07/081804) или Orai3 (SEQ ID NO: 3, как описано в WO 07/081804). Последовательность нуклеиновой кислоты Orai1 соответствует номеру доступа GenBank NM_032790, последовательность нуклеиновой кислоты Orai2 соответствует номеру доступа GenBank BC069270, и последовательность нуклеиновой кислоты Orai3 соответствует номеру доступа GenBank NM_152288. При использовании здесь Orai относится к одному или более чем одному гену Orai, например, Orai1, Orai2, Orai3 (см. Таблицу I WO 07/081804). Как описано здесь, было установлено, что эти белки вовлечены в, участвуют в, и/или обеспечивают депо-управляемый вход кальция или его модуляцию, цитоплазматическое буферное действие в отношении кальция и/или модуляцию уровней кальция в или перемещение кальция внутрь, в пределах или из внутриклеточных депо кальция (например, эндоплазматического ретикулума).
Термин «фрагмент» или «производное», относящийся к белку (например, STIM, Orai), обозначает белки или полипептиды, сохраняющие по существу такую же биологическую функцию или активность, что и нативный белок (белки), в по меньшей мере одном анализе. Например, фрагменты или производные соответствующего белка сохраняют по меньшей мере приблизительно 50% активности нативных белков, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 95% активности нативных белков, как определено, например, анализом притока кальция.
При использовании здесь, уменьшение интенсивности симптомов определенного заболевания, расстройства или состояния введением определенного соединения или фармацевтической композиции относится к любому уменьшению тяжести, задержке появления, замедлению прогрессирования или уменьшению продолжительности, постоянному или временному, длительному или транзиторному, которое может быть связано или ассоциировано с введением соединения или композиции.
При использовании здесь термин «модулировать» означает взаимодействовать с белком-мишенью либо непосредственно, либо косвенно, таким образом, что активность белка-мишени изменена, включая, исключительно в качестве примера, ингибирование активности мишени или ограничение или снижение активности мишени.
При использовании здесь термин «модулятор» относится к соединению, изменяющему активность мишени. Например, модулятор может вызывать повышение или снижение интенсивности определенной активности мишени по сравнению с интенсивностью активности в отсутствие модулятора. В определенных воплощениях модулятор является ингибитором, снижающим интенсивность одной или более чем одной активности мишени. В определенных воплощениях ингибитор полностью предотвращает одну или более чем одну активность мишени.
При использовании здесь «модуляция», относящаяся к внутриклеточному кальцию, относится к любому изменению или коррекции внутриклеточного кальция, включая, без ограничения, изменение концентрации кальция в цитоплазме и/или внутриклеточных органеллах-депо кальция, например эндоплазматическом ретикулуме, изменение кинетики токов кальция внутрь, из и в пределах клеток. В одном аспекте модуляция относится к снижению.
При использовании здесь термин «целевая активность» относится к биологической активности, которую можно модулировать модулятором. Определенные типичные целевые активности включают, без ограничения, аффинность связывания, трансдукцию сигналов, ферментативную активность, опухолевый рост, воспаление или процессы, связанные с воспалением, и уменьшение интенсивности одного или более чем одного симптома, связанного с заболеванием или состоянием.
Термины «ингибирует», «ингибирование» или «ингибитор» активности SOC-каналов или CRAC-каналов при использовании здесь относятся к ингибированию активности депо-управляемых кальциевых каналов или активности кальциевых каналов, активируемых высвобождением кальция.
Термин «приемлемый» в отношении препарата, композиции или ингредиента при использовании здесь обозначает не имеющий стойкого неблагоприятного эффекта на общее состояние здоровья субъекта, проходящего лечение.
«Фармацевтически приемлемый» при использовании здесь относится к веществу, такому как носитель или разбавитель, не устраняющему биологическую активность или свойства соединения, и являющемуся относительно нетоксичным, то есть вещество может быть введено индивиду, не вызывая нежелательных биологических эффектов или вредного взаимодействия с любым из компонентов композиции, содержащей указанное вещество.
Термин «фармацевтическая комбинация» при использовании здесь обозначает продукт, являющийся результатом смешения или комбинирования более чем одного активного ингредиента и включающий как фиксированные, так и нефиксированные комбинации активных ингредиентов. Термин «фиксированная комбинация» означает, что один активный ингредиент, например соединение формулы (I), (II), (IIA) или (IIБ), и сопутствующий агент вводят пациенту совместно в форме одного объекта или дозы. Термин «нефиксированная комбинация» означает, что один активный ингредиент, например соединение формулы (I), (II), (IIA) или (IIБ), и сопутствующий агент вводят пациенту в виде отдельных объектов, либо совместно, либо одновременно, либо последовательно без определенных ограничений по промежуткам времени, где такое введение обеспечивает эффективные уровни двух соединений в организме пациента. Последнее также применимо к смешанной терапии, например введению трех или более активных ингредиентов.
Термин «фармацевтическая композиция» относится к смеси соединения формулы (I), (II), (IIA) или (IIБ), описанного здесь, с другими химическими компонентами, такими как носители, стабилизаторы, разбавители, диспергирующие агенты, суспендирующие агенты, загустители и/или эксципиенты. Фармацевтическая композиция облегчает введение лекарственного средства в организм. В данной области техники существует множество методик введения соединения, включая, без ограничения, внутривенное, пероральное, аэрозольное, парентеральное, глазное, легочное и местное введение.
Термины «эффективное количество» или «терапевтически эффективное количество» при использовании здесь относятся к количеству вводимого агента или соединения, достаточному для облегчения, в некоторой степени, одного или более чем одного симптома заболевания или состояния, по поводу которого проводят лечение. Результатом может являться уменьшение и/или облегчение признаков, симптомов или причин заболевания или любое другое желаемое изменение биологической системы. Например, «эффективное количество» для терапевтических применений представляет собой количество композиции, содержащей соединение формулы (I), (II), (IIA) или (IIБ), описанное здесь, необходимое для обеспечения клинически значимого снижения симптомов заболевания. Подходящее «эффективное» количество в каждом отдельном случае может быть определено с применением таких методик, как исследование с увеличением дозы.
Термины «усиливать» или «усиление» при использовании здесь означают увеличение или продление желаемого эффекта, либо по силе, либо по продолжительности. Таким образом, в отношении усиления эффекта терапевтических агентов термин «усиление» относится к способности увеличивать или продлевать эффект других терапевтических агентов на систему, либо по силе, либо по продолжительности. «Усиливающее эффективное количество» при использовании здесь относится к количеству, адекватному для усиления эффекта другого терапевтического агента в желаемой системе.
Полагают, что термины «совместное введение» или тому подобное при использовании здесь включают введение выбранных терапевтических агентов одному пациенту, и подразумевают, что они включают схемы лечения, в которых агенты вводят одинаковыми или различными путями введения или в одно и то же или разное время.
Термин «носитель» при использовании здесь относится к относительно нетоксичным химическим соединениям или агентам, способствующим введению соединений в клетки или ткани.
Термин «разбавитель» относится к химическим соединениям, используемым для разведения рассматриваемого соединения перед доставкой. Разбавители могут также быть использованы для стабилизации соединений, поскольку они могут обеспечить более стабильную среду. В данной области техники в качестве разбавителей используют соли, растворенные в забуференных растворах (которые также могут обеспечить контроль или поддержание рН), включая, без ограничения, забуференный фосфатом физиологический раствор.
«Метаболит» соединения, раскрытого здесь, представляет собой производное этого соединения, образуемое при метаболизме соединения. Термин «активный метаболит» относится к биологически активному производному соединения, образуемому при метаболизме соединения. Термин «метаболизм» при использовании здесь относится к совокупности процессов (включая, без ограничения, реакции гидролиза и реакции, катализируемые ферментами), посредством которых организм изменяет определенное вещество. Таким образом, ферменты могут приводить к определенным структурным изменениям соединения. Например, цитохром Р450 катализирует множество окислительных и восстановительных реакций, в то время как уридиндифосфатглюкуронилтрансферазы кактализируют перенос активированной молекулы глюкуроновой кислоты на ароматические спирты, алифатические спирты, карбоновые кислоты, амины и свободные сульфгидрильные группы. Дополнительная информация о метаболизме может быть получена из The Pharmacological Basis of Therapeutics, 9th Edition, McGraw-Hill (1996). Метаболиты соединений, раскрытых здесь, могут быть идентифицированы либо введением соединений хозяину и анализом образцов ткани от хозяина, либо инкубацией соединений с клетками печени in vitro и анализом полученных соединений. Оба способа хорошо известны в данной области техники.
«Биодоступность» относится к проценту массы соединения, описанного здесь (например, соединения формулы (I), (II), (IIA) или (IIБ)), доставляемому в общий кровоток исследуемого животного или человека. Общее воздействие (AUC (0-∞)) лекарственного средства при внутривенном введении обычно определяют как 100% биодоступность (F%). «Биодоступность при пероральном введении» относится к степени, в которой соединение, описанное здесь, всасывается в общий кровоток при пероральном приеме фармацевтической композиции по сравнению с внутривенной инъекцией.
«Концентрация в плазме крови» относится к концентрации соединения формулы (I), (II), (IIA) или (IIБ), раскрытого здесь, в плазменном компоненте крови субъекта. Следует понимать, что концентрация описанных здесь соединений в плазме может существенно варьировать между субъектами ввиду вариабельности в отношении метаболизма и/или возможных взаимодействий с другими терапевтическими агентами. Согласно одному воплощению, раскрытому здесь, концентрация раскрытых здесь соединений в плазме крови может варьировать от субъекта к субъекту. Сходным образом, такие величины, как максимальная концентрация в плазме (Cmax) или время достижения максимальной концентрации в плазме (Tmax), или общая площадь под кривой зависимости концентрации в плазме от времени (AUC (0-∞)), могут варьировать от субъекта к субъекту. Ввиду этой вариабельности количество, необходимое, чтобы составить «терапевтически эффективное количество» соединения, может варьировать от субъекта к субъекту.
При использовании здесь «кальциевый гомеостаз» относится к поддержанию общего баланса внутриклеточных уровней и перемещений кальция, включая кальциевую сигнализацию, в пределах клетки.
При использовании здесь «внутриклеточный кальций» относится к кальцию, расположенному в клетке, без указания конкретного расположения в клетке. Наоборот, «цитозольный» или «цитоплазматический» в отношении кальция относится к кальцию, расположенному в цитоплазме клетки.
При использовании здесь эффект на внутриклеточный кальций представляет собой любое изменение любого аспекта внутриклеточного кальция, включая, без ограничения, изменение уровней и расположения внутриклеточного кальция и движения кальция внутрь из и в пределах клетки или внутриклеточного депо кальция, или органеллы. Например, эффект на внутриклеточный кальций может представлять собой изменение свойств, таких как, например, кинетика, чувствительности, скорость, амплитуда и электрофизиологические характеристики, кальциевого тока или перемещения, происходящего в клетке или ее части. Эффект на внутриклеточный кальций может представлять собой изменение любого процесса, модулирующего внутриклеточный кальций, депо-управляемый вход кальция, цитозольное буферное действие в отношении кальция, и уровней кальция в или перемещения кальция внутрь, из или в пределах внутриклеточного депо кальция. Любые из этих аспектов могут быть оценены множеством способов, включая, без ограничения, повышение уровней кальция или другого иона (в частности, катиона), перемещение кальция или другого иона (в частности, катиона), изменения уровней кальция или другого иона (в частности, катиона), кинетику токов кальция или другого иона (в частности, катиона) и/или транспорта кальция или другого иона (в частности, катиона) через мембрану. Изменение может представлять собой любое такое изменение, являющееся статистически значимым. Таким образом, например, если говорят, что внутриклеточный кальций в исследуемой клетке и контрольной клетке отличаются, такое различие может представлять собой статистически значимое различие.
При использовании здесь «вовлечен в» в отношении взаимоотношения белка и аспекта внутриклеточного кальция или регуляции внутриклеточного кальция означает, что при снижении, изменении или устранении экспрессии или активности белка в клетке происходит сопутствующее или ассоциированное снижение, изменение или устранение одного или более чем одного аспекта внутриклеточного кальция или регуляции внутриклеточного кальция. Такое изменение или снижение экспрессии или активности может происходить посредством изменения экспрессии гена, кодирующего белок, или изменения уровней белка. Таким образом, белок, вовлеченный в аспект внутриклеточного кальция, такой как, например, депо-управляемый вход кальция, может представлять собой белок, обеспечивающий или участвующий в аспекте внутриклеточного кальция или регуляции внутриклеточного кальция. Например, белок, обеспечивающий депо-управляемый вход кальция, может представлять собой белок STIM и/или белок Orai.
При использовании здесь белок, являющийся компонентом кальциевого канала, представляет собой белок, участвующий в многобелковом комплексе, образующем канал.
При использовании здесь «базальный» или «в покое» в отношении уровней кальция в цитозоле относится к концентрации кальция в цитоплазме клетки, такой как, например, нестимулированная клетка, которая не была подвержена воздействию условия, приводящего к перемещению кальция внутрь или из клетки или в пределах клетки. Базальный уровень кальция в цитозоле или уровень кальция в цитозоле в покое может представлять собой концентрацию свободного кальция (то есть кальция, не связанного с клеточным веществом, связывающим кальций) в цитоплазме клетки, такой как, например, нестимулированная клетка, которая не была подвержена воздействию условия, приводящего к перемещению кальция внутрь или из клетки.
При использовании здесь «перемещение» в отношении ионов, включая катионы, например, кальция, относится к перемещению или изменению расположения, такому как, например, ток ионов внутрь, из или в пределах клетки. Таким образом, перемещение ионов может представлять собой, например, перемещение ионов из внеклеточной среды в клетку, из клетки во внеклеточную среду, из внутриклеточной органеллы или сайта-депо в цитозоль, из цитозоля во внутриклеточную органеллу или сайт-депо, из одной внутриклеточной органеллы или сайта-депо в другую внутриклеточную органеллу или сайт-депо, из внеклеточной среды во внутриклеточную органеллу или сайт-депо, из внутриклеточной органеллы или сайта-депо во внеклеточную среду или из одного расположения в другое в пределах цитоплазмы клетки.
При использовании здесь «вход катионов» или «вход кальция» в клетку относится ко входу катионов, таких как кальций, во внутриклеточное расположение, такое как цитоплазма клетки, или в просвет внутриклеточной органеллы или сайта-депо. Таким образом, вход катионов может представлять собой, например, перемещение катионов в цитоплазму клетки из внеклеточной среды или из внутриклеточной органеллы, или сайта-депо, или перемещение катионов во внутриклеточную органеллу или сайт-депо из цитоплазмы или внеклеточной среды. Перемещение кальция в цитоплазму из внутриклеточной органеллы или сайта-депо также называют «высвобождением кальция» из органеллы или сайта-депо.
При использовании здесь «белок, модулирующий внутриклеточный кальций» относится к любому клеточному белку, вовлеченному в регуляцию, контроль и/или изменение внутриклеточного кальция. Например, такой белок может быть вовлечен в изменение или коррекцию внутриклеточного кальция несколькими способами, включая, без ограничения, посредством поддержания базальных уровней кальция в цитоплазме или уровней кальция в цитоплазме в покое или посредством участия в клеточном ответе на сигнал, передаваемый в клетку через механизм, включающий отклонение внутриклеточного кальция от базальных состояний или состояний покоя. В контексте «белка, модулирующего внутриклеточный кальций» «клеточный» белок представляет собой белок, связанный с клеткой, такой как, например, цитоплазматический белок, белок, связанный с плазматической мембраной, или белок внутриклеточной мембраны. Белки, модулирующие внутриклеточный кальций, включают, без ограничения, белки транспорта ионов, белки, связывающие кальций, и регуляторные белки, регулирующие белки транспорта ионов.
При использовании здесь «улучшение» относится к улучшению заболевания или состояния или по меньшей мере частичному облегчению симптомов, связанных с заболеванием или состоянием.
При использовании здесь «клеточный ответ» относится к любому клеточному ответу, приводящему к перемещению ионов внутрь и из клетки или в пределах клетки. Клеточный ответ может быть связан с любой клеточной активностью, зависящей, по меньшей мере частично, от ионов, таких как, например, кальций. Такие активности могут включать, например, клеточную активацию, экспрессию генов, эндоцитоз, экзоцитоз, миграцию клеток и гибель клетки посредством апоптоза.
При использовании здесь «иммунокомпетентные клетки» включают клетки иммунной системы, осуществляющие функцию или активность при иммунном ответе, такие как, без ограничения, Т-клетки, В-клетки, лимфоциты, макрофаги, дендритные клетки, нейтрофилы, эозинофилы, базофилы, тучные клетки, плазматические клетки, лейкоциты, антиген-представляющие клетки и естественные клетки-киллеры.
При использовании здесь «цитокин» относится к небольшим растворимым белкам, секретируемым клетками, способным изменять поведение или свойства секретирующей клетки или другой клетки. Цитокины связывают рецепторы цитокинов и стимулируют поведение или свойство клетки, например пролиферацию, гибель или дифференцировку клетки. Типичные цитокины включают, без ограничения, интерлейкины (например, интерлейкин-2 (IL-2), IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-15, IL-16, IL-17, IL-18, IL-1α, IL-1β и IL-1 RA), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), онкостатин М, эритропоэтин, лейкемический ингибирующий фактор (LIF), интерфероны, В7.1 (также известный как CD80), В7.2 (также известный как В70, CD86), члены семейства фактора некроза опухоли (TNF) (TNF-α, TNF-β, LT-β, лиганд CD40, Fas-лиганд, лиганд CD27, лиганд CD30, 4-1BBL, Trail) и фактор, ингибирующий миграцию (MIF).
«Депо-управляемый вход кальция» или «SOCE» относится к механизму координации высвобождения ионов кальция из внутриклеточных депо и притока ионов через плазматическую мембрану.
«Селективный ингибитор активности SOC-каналов» означает, что ингибитор селективен в отношении SOC-каналов и по существу не влияет на активность других типов ионных каналов.
«Селективный ингибитор активности CRAC-каналов» означает, что ингибитор селективен в отношении CRAC-каналов и по существу не влияет на активность других типов ионных каналов и/или других SOC-каналов.
Примеры фармацевтических композиций и способов введения
Фармацевтические композиции могут быть изготовлены обычным способом с применением одного или более чем одного физиологически приемлемого носителя, включая эксципиенты и вспомогательные вещества, способствующего обработке активных соединений с получением композиций, которые могут быть использованы фармацевтически. Подходящая композиция зависит от выбранного пути введения. Любые из хорошо известных методик, носителей и эксципиентов могут быть применены подходящим образом и как известно в данной области техники. Краткое описание фармацевтических композиций, описанных здесь, может быть обнаружено, например, в Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. and Lachman, L, Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; и Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins 1999), включенных в данное описание посредством ссылки.
Фармацевтическая композиция при использовании здесь относится к смеси соединения формулы (I), (II), (IIA) или (IIБ), описанного здесь, и других химических компонентов, таких как носители, стабилизаторы, разбавители, диспергирующие агенты, суспендирующие агенты, загустители и/или эксципиенты. Фармацевтическая композиция облегчает введение соединения в организм. При применении способов лечения и применений, предложных здесь, терапевтически эффективные количества соединений, описанных здесь, вводят в фармацевтической композиции млекопитающему, имеющему заболевание, расстройство или состояние, подлежащее лечению. В некоторых воплощениях млекопитающее представляет собой человека. Терапевтически эффективное количество может варьировать в зависимости от тяжести заболевания, возраста и относительного здоровья субъекта, активности используемого соединения и других факторов. Соединения формулы (I), (II), (IIA) или (IIБ) могут быть использованы сами по себе или в комбинации с одним или более чем одним терапевтическим агентом как компоненты смесей (как при комбинированной терапии).
Фармацевтические композиции, описанные здесь, могут быть введены субъекту несколькими путями введения, включая, без ограничения, пероральный, парентеральный (например, внутривенный, подкожный, внутримышечный), интраназальный, трансбуккальный, местный, ректальный или трансдермальный пути введения. Более того, фармацевтические композиции, описанные здесь, содержащие соединение формулы (I), (II), (IIA) или (IIБ), описанное здесь, могут быть изготовлены в виде любой подходящей лекарственной формы, включая, без ограничения, водные дисперсии для перорального введения, жидкости, гели, сиропы, эликсиры, взвеси, суспензии, аэрозоли, композиции с контролируемым высвобождением, быстрорастворимые композиции, шипучие композиции, лиофилизированные композиции, таблетки, порошки, пилюли, драже, капсулы, композиции с замедленным высвобождением, композиции с пролонгированным высвобождением, композиции с прерывистым высвобождением, композиции, состоящие из множества частиц, и смешанные композиции с немедленным высвобождением и контролируемым высвобождением.
Соединения и/или композиции можно вводить местным, а не системным способом, например инъекцией соединения непосредственно в орган или ткань, часто в депо-препарате или композиции с длительным высвобождением. Такие длительнодействующие композиции могут быть введены имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Кроме того, лекарственное средство можно вводить в системе направленной доставки лекарственного средства, например в липосоме, покрытой орган-специфичным антителом. Липосомы будут направлены на орган и селективно захвачены в нем. В дополнение, лекарственное средство может быть представлено в форме композиции с быстрым высвобождением, в форме композиции с пролонгированным высвобождением или в форме композиции с промежуточным высвобождением.
Фармацевтические композиции, содержащие соединение, описанное здесь, могут быть изготовлены обычным способом, таким как, исключительно в качестве примера, посредством обычных способов смешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульсификации, инкапсуляции, захвата или прессования.
Фармацевтические композиции будут содержать по меньшей мере одно соединение формулы (I), (II), (IIA) или (IIБ), описанное здесь, в качестве активного ингредиента в форме свободной кислоты или свободного основания, или в форме фармацевтически приемлемой соли. В дополнение, способы и фармацевтические композиции, описанные здесь, включают применение кристаллических форм (также известных как полиморфы), а также активных метаболитов этих соединений, имеющих такой же тип активности. В некоторых ситуациях соединения могут существовать в форме таутомеров. Все таутомеры включены в объем соединений, представленных здесь. В дополнение, соединения, описанные здесь, могут существовать в несольватированной, а также сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. Сольватированные формы представленных здесь соединений также рассматривают как раскрытые здесь.
В определенных воплощениях композиции, представленные здесь, могут также содержать один или более чем один консервант для подавления микробной активности. Подходящие консерванты включают четвертичные аммониевые соединения, такие как хлорид бензалкония, бромид цетилтриметиламмония и хлорид цетилпиридиния.
Фармацевтические композиции для перорального применения могут быть получены смешиванием одного или более чем одного твердого эксципиента с одним или более чем одним соединением, описанным здесь (например, соединением формулы (I), (II), (IIA) или (IIБ)), возможно, измельчением полученной смеси, и обработкой смеси гранул после добавления подходящих вспомогательных веществ, если желательно, с получением таблеток, пилюль или капсул. Подходящие эксципиенты включают, например, наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, микрокристаллическая целлюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза натрия; или другие, такие как поливинилпирролидон (PVP или повидон) или фосфат кальция. Если желательно, могут быть добавлены разрыхлители, такие как перекрестно сшитая кроскармеллоза натрия, поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия.
Ядра драже снабжают подходящими покрытиями. С этой целью могут быть использованы концентрированные растворы сахаров, которые могут возможно содержать аравийскую камедь, тальк, поливинилпирролидон, карбополовый гель, полиэтиленгликоль и/или диоксид титана, лаковые растворы и подходящие органические растворители или смеси растворителей. В покрытия для таблеток или драже могут быть добавлены красители или пигменты для идентификации или отличия различных комбинаций доз активных соединений.
Фармацевтические композиции, которые можно применять перорально, включают плотные (push-fit) капсулы, изготовленные из желатина, а также мягкие закрытые капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Плотные (push-fit) капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связывающими веществами, такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния, и, возможно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как нелетучие масла, вазелиновое масло или жидкие полиэтиленгликоли. Кроме того, возможно добавление стабилизаторов.
В некоторых воплощениях твердые лекарственные формы, раскрытые здесь, могут быть представлены в форме таблетки (включая суспензионную таблетку, быстрорастворимую таблетку, таблетку для разжевывания, быстрораспадающуюся таблетку, шипучую таблетку или таблетку в виде капсулы), пилюли, порошка (включая стерильный упакованный порошок, порошок для одноразового использования или шипучий порошок), капсулы (включая мягкие или твердые капсулы, например капсулы, изготовленные из желатина животного происхождения или гидроксиметилпропилцеллюлозы (НРМС) растительного происхождения, или «капсулы с покрытыми частицами» («sprinkle capsules»)), твердой дисперсии, твердого раствора, лекарственной формы, подверженной биологическому разрушению, композиций с контролируемым высвобождением, лекарственных форм с прерывистым высвобождением, лекарственных форм, состоящих из множества частиц, шариков, гранул или аэрозоля. В других воплощениях фармацевтическая композиция представлена в форме порошка. В других воплощениях фармацевтическая композиция представлена в форме таблетки, включая, без ограничения, быстрорастворимую таблетку. В дополнение, фармацевтические композиции описанных здесь соединений можно вводить в виде отдельной капсулы или в лекарственной форме, состоящей из множества капсул, В некоторых воплощениях фармацевтическую композицию вводят в виде двух или трех, или четырех капсул или таблеток.
В некоторых воплощениях твердые лекарственные формы, например таблетки, шипучие таблетки и капсулы, изготавливают смешиванием частиц соединения формулы (I), (II), (IIA) или (IIБ), описанного здесь, с одним или более чем одним фармацевтическим эксципиентом с образованием композиции в виде объемной смеси. Когда эти композиции в виде объемной смеси называют гомогенными, подразумевают, что частицы соединения формулы (I), (II), (IIA) или (IIБ), описанного здесь, равномерно распределены по композиции таким образом, что композиция может быть легко разделена на равноэффективные стандартные лекарственные формы, такие как таблетки, пилюли и капсулы. Отдельные стандартные дозы могут также включать пленочные покрытия, разрушающиеся при пероральном приеме или при контакте с разбавителем. Эти композиции могут быть изготовлены обычными фармакологическими методиками.
Твердые фармацевтические лекарственные формы, описанные здесь, могут содержать соединение формулы (I), (II), (IIА) или (IIБ), описанное здесь, и одну или более чем одну фармацевтически приемлемую добавку, такую как совместимый носитель, связывающий агент, наполнитель, суспендирующий агент, корригент, подсластитель, разрыхлитель, диспергирующий агент, поверхностно-активное вещество, смазывающее вещество, краситель, разбавитель, солюбилизатор, увлажняющий агент, пластификатор, стабилизатор, вещество, способствующее проникновению, смачивающий агент, пеногаситель, антиоксидант, консервант или одну или более чем одну их комбинацию. В других аспектах с применением стандартных способов покрытия, таких как описанные в Remington's Pharmaceutical Sciences, 20th Edition (2000), обеспечивают пленочное покрытие вокруг композиции соединения, описанного здесь. В одном воплощении некоторые или все частицы соединения, описанного здесь, имеют покрытие. В другом воплощении некоторые или все частицы соединения, описанного здесь, заключены в микрокапсулы. В еще одном воплощении частицы соединения, описанного здесь, не заключены в микрокапсулы и не имеют покрытия.
Подходящие носители для применения в твердых лекарственных формах, описанных здесь, включают, без ограничения, аравийскую камедь, желатин, коллоидный диоксид кремния, глицерофосфат кальция, лактат кальция, мальтодекстрин, глицерин, силикат магния, казеинат натрия, соевый лецитин, хлорид натрия, фосфат кальция, гидрофосфат калия, стеароиллактилат натрия, каррагенин, моноглицерид, диглицерид, прежелатинизированный крахмал, гидроксипропилметилцеллюлозу, ацетат-стеарат гидроксипропилметилцеллюлозы, сахарозу, микрокристаллическую целлюлозу, лактозу, маннит и тому подобное.
Подходящие наполнители для применения в твердых лекарственных формах, описанных здесь, включают, без ограничения, лактозу, карбонат кальция, фосфат кальция, гидрофосфат кальция, сульфат кальция, микрокристаллическую целлюлозу, целлюлозный порошок, декстрозу, декстраты, декстран, крахмалы, прежелатинизированный крахмал, гидроксипропилметилцеллюлозу (НРМС), фталат гидроксипропилметилцеллюлозы, ацетат-стеарат гидроксипропилметилцеллюлозы (HPMCAS), сахарозу, ксилит, лактит, маннит, сорбит, хлорид натрия, полиэтиленгликоль и тому подобное.
Для максимально возможного эффективного высвобождения соединения формулы (I), (II), (IIA) или (IIБ) из матрицы твердой лекарственной формы в композиции часто используют разрыхлители, особенно когда лекарственные формы прессуют со связывающим веществом. Разрыхлители способствуют разрушению матрицы лекарственной формы посредством набухания или капиллярного действия при абсорбции влаги в лекарственную форму. Подходящие разрыхлители для применения в твердых лекарственных формах, описанных здесь, включают, без ограничения, природный крахмал, такой как кукурузный крахмал или картофельный крахмал, прежелатинизированный крахмал, такой как National 1551 или Amijel®, или крахмалгликолят натрия, такой как Promogel® или Explotab®, целлюлозу, такую как продукт древесины, микрокристаллическую целлюлозу, например Avicel®, Avicel® PH101, Avicel® РН102, Avicel® PH105, Elcema® P100, Emcocel®, Vivacel®, Ming Tia® и Solka-Floc®, метилцеллюлозу, кроскармелозу или перекрестно сшитую целлюлозу, такую как перекрестно сшитая карбоксиметилцеллюлоза натрия (Ac-Di-Sol®), перекрестно сшитая карбоксиметилцеллюлоза, перекрестно сшитая кроскармелоза, перекрестно сшитый крахмал, такой как крахмалгликолят натрия, перекрестно сшитый полимер, такой как кросповидон, перекрестно сшитый поливинилпирролидон, альгинат, такой как альгиновая кислота или соль альгиновой кислоты, как например, альгинат натрия, глину, такую как Veegum® HV (силикат магния-алюминия), камедь, такую как агар, гуаровая камедь, плод рожкового дерева, Karaya, пектин или трагакантовая камедь, крахмалгликолят натрия, бентонит, природную губку, поверхностно-активное вещество, смолу, такую как катионообменная смола, мякоть цитрусов, лаурилсульфат натрия, лаурилсульфат натрия в комбинации с крахмалом и тому подобное.
Связывающие вещества придают композициям в виде твердой лекарственной формы для перорального введения когезионную способность: для композиции в форме капсулы, заполненной порошком, они способствуют образованию пробки, которой можно заполнить капсулы с твердой или мягкой оболочкой, и для композиции в форме таблетки они обеспечивают стабильность таблетки после прессования и способствуют обеспечению однородности смеси перед стадией прессования или заполнения. Вещества, подходящие для применения в качестве связывающих веществ в твердых лекарственных формах, описанных здесь, включают, без ограничения, карбоксиметилцеллюлозу, метилцеллюлозу (например, Methocel®), гидроксипропилметилцеллюлозу (например, Hypromellose USP Pharmacoat-603), ацетат-стеарат гидроксипропилметилцеллюлозы (Aqoate HS-LF and HS), гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу (например, Klucel®), этилцеллюлозу (например, Ethocel®) и микрокристаллическую целлюлозу (например, Avicel®), микрокристаллическую декстрозу, амилозу, силикат магния-алюминия, полисахаридные кислоты, бентониты, желатин, поливинилпирролидон/сополимер винилацетата, кросповидон, повидон, крахмал, прежелатинизированный крахмал, трагакант, декстрин, сахар, такой как сахароза (например, Dipac®), глюкозу, декстрозу, мелассы, маннит, сорбит, ксилит (например, Xylitab®), лактозу, природную или синтетическую камедь, такую как аравийская камедь, трагакантовая камедь, гхатти-камедь, растительный клей из шелухи isapol, крахмал, поливинилпирролидон (например, Povidone® CL, Kollidon® CL, Polyplasdone® XL-10 и Povidone® K-12), арабогалактан древесины лиственницы, Veegum®, полиэтиленгликоль, воски, альгинат натрия и тому подобное.
В большинстве случаев в композициях в форме желатиновых капсул, заполненных порошком, используют уровни связывающего вещества 20-70%. Уровень связующего вещества, используемый в композициях в форме таблеток, варьируется в зависимости от применения прямого прессования, влажного гранулирования, уплотнения валиком или использования других эксципиентов, таких как наполнители, которые сами по себе могут действовать как умеренно эффективные связывающие агенты. Специалисты в области изготовления лекарственных форм могут определить уровень связывающего вещества для композиций, но в композициях в форме таблеток обычно используют уровень связывающего вещества до 70%.
Подходящие смазывающие вещества или скользящие вещества для применения в твердых лекарственных формах, описанных здесь, включают, без ограничения, стеариновую кислоту, гидроксид кальция, тальк, кукурузный крахмал, стеарилфумарат натрия и соли щелочных и щелочно-земельных металлов, таких как алюминий, кальций, магний, цинк, стеариновую кислоту, стеараты натрия, стеарат магния, стеарат цинка, воски, Stearowet®, борную кислоту, бензоат натрия, ацетат натрия, хлорид натрия, лейцин, полиэтиленгликоль или метоксиполиэтиленгликоль, такой как Carbowax™, полиэтиленгликоль-400 (PEG 4000), PEG 5000, PEG 6000, пропиленгликоль, олеат натрия, глицерилбегенат, глицерилпальмитостеарат, глицерилбензоат, лаурилсульфат магния или натрия и тому подобное.
Подходящие разбавители для применения в твердых лекарственных формах, описанных здесь, включают, без ограничения, сахара (включая лактозу, сахарозу и декстрозу), полисахариды (включая декстраты и мальтодекстрин), полиолы (включая маннит, ксилит и сорбит), циклодекстрины и тому подобное.
Подходящие смачивающие агенты для применения в твердых лекарственных формах, описанных здесь, включают, например, олеиновую кислоту, глицерилмоностеарат, сорбитанмоноолеат, сорбиталмонолаурат, олеат триэтаноламина, моноэфир полиоксиэтиленсорбита и олеиновой кислоты, моноэфир полиоксиэтиленсорбита и лауриновой кислоты, четвертичные аммониевые соединения (например, Polyquat 10®), олеат натрия, лаурилсульфат натрия, стеарат магния, докузат натрия, триацетин, витамин Е, D-альфа-токоферилполиэтиленгликоль-1000-сукцинат (TPGS) и тому подобное.
Подходящие поверхностно-активные вещества для применения в твердых лекарственных формах, описанных здесь, включают, например, лаурилсульфат натрия, сорбитанмоноолеат, моноэфир полиоксиэтиленсорбита и олеиновой кислоты, полисорбаты, полоксомеры, желчные кислоты, глицерилмоностеарат, сополимеры этиленоксида и пропиленоксида, например, Pluronic® (BASF), и тому подобное.
Подходящие суспендирующие агенты для применения в твердых лекарственных формах, описанных здесь, включают, без ограничения, поливинилпирролидон, например поливинилпирролидон К12, поливинилпирролидон К17, поливинилпирролидон К25 или поливинилпирролидон К30, полиэтиленгликоль, например полиэтиленгликоль может иметь молекулярную массу от приблизительно 300 до приблизительно 6000 или от приблизительно 3350 до приблизительно 4000, или от приблизительно 5400 до приблизительно 7000, сополимер винилпирролидона/винилацетата (S630), карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, полисорбат-80, гидроксиэтилметилцеллюлозу, альгинат натрия, камеди, такие как, например, трагакантовая камедь и аравийская камедь, ксантаны, включая ксантановую камедь, сахара, целлюлозные полимеры, такие как, например, карбоксиметилцеллюлоза натрия, метилцеллюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, гидроксиэтилметилцеллюлоза, полисорбат-80, альгинат натрия, полиэтоксилированный сорбитанмонолаурат, полиэтоксилированный сорбитанмонолаурат, повидон и тому подобное.
Подходящие антиоксиданты для применения в твердых лекарственных формах, описанных здесь, включают, например, бутилированный гидрокситолуол (ВНТ), аскорбат натрия и токоферол.
Следует понимать, что добавки, используемые в твердых лекарственных формах, описанных здесь, в значительной степени совпадают. Таким образом, перечисленные выше добавки следует рассматривать исключительно как неограничивающие примеры типов добавок, которые могут быть включены в твердые лекарственные формы фармацевтических композиций, описанных здесь. Специалист в данной области техники может легко определить количество этих добавок в соответствии с конкретными желаемыми свойствами.
В других воплощениях один или более чем один слой фармацевтической композиции пластифицирован. В качестве пояснения, пластификатор в большинстве случаев представляет собой твердое вещество или жидкость с высокой точкой кипения. Подходящие пластификаторы могут быть добавлены в количестве от приблизительно 0,01% до приблизительно 50% по массе (масс./масс.) покрывающей композиции. Пластификаторы включают, без ограничения, диэтилфталат, эфиры лимонной кислоты, полиэтиленгликоль, глицерин, ацетилированные глицериды, триацетин, полипропиленгликоль, полиэтиленгликоль, триэтилцитрат, дибутилсебацинат, стеариновую кислоту, стеарол, стеарат и касторовое масло.
Прессованные таблетки представляют собой твердые лекарственные формы, изготовленные прессованием объемной смеси композиций, описанных выше. В различных воплощениях прессованные таблетки, разработанные для растворения в полости рта, будут включать один или более чем один корригент. В других воплощениях прессованные таблетки будут включать пленку, окружающую конечную прессованную таблетку. В некоторых воплощениях пленочное покрытие может обеспечить замедленное высвобождение соединения формулы (I), (II), (IIA) или (IIБ), описанного здесь, из композиции. В других воплощениях пленочное покрытие способствует приверженности пациента к лечению (например, покрытия Opadry® или сахарные покрытия). Пленочные покрытия, включая Opadry®, обычно составляют от приблизительно 1% до приблизительно 3% массы таблетки. В других воплощениях прессованные таблетки содержат один или более чем один эксципиент.
Капсула может быть изготовлена, например, помещением объемной смеси композиции соединения, описанного здесь, внутрь капсулы. В некоторых воплощениях композиции (неводные суспензии и растворы) помещены в мягкую желатиновую капсулу. В других воплощениях композиции помещены в стандартные желатиновые капсулы или нежелатиновые капсулы, как например капсулы, содержащие НРМС. В других воплощениях композиция помещена в капсулу с покрытыми частицами (sprinkle capsule), которую можно принять внутрь целиком или открыть и высыпать содержимое на пищу перед едой. В некоторых воплощениях терапевтическая доза разделена на несколько (например, две, три или четыре) капсулы. В некоторых воплощениях всю дозу композиции доставляют в форме капсулы.
В различных воплощениях частицы соединения формулы (I), (II), (IIA) или (IIБ), описанного здесь, и один или более чем один эксципиент подвергают сухому смешиванию и прессованию с образованием массы, такой как таблетка, имеющей достаточную твердость для обеспечения фармацевтической композиции, которая распадается за менее чем приблизительно 30 минут, менее чем приблизительно 35 минут, менее чем приблизительно 40 минут, менее чем приблизительно 45 минут, менее чем приблизительно 50 минут, менее чем приблизительно 55 минут или менее чем приблизительно 60 минут после перорального введения, высвобождая таким образом композицию в содержимое желудочно-кишечного тракта.
В другом аспекте лекарственные формы могут содержать композиции, заключенные в микрокапсулы. В некоторых воплощениях в веществе для заключения в микрокапсулы присутствует одно или более чем одно другое совместимое вещество. Типичные вещества включают, без ограничения, модификаторы рН, усилители разрушения, пеногасители, антиоксиданты, корригенты и вещества-носители, такие как связывающие вещества, суспендирующие агенты, разрыхлители, наполнители, поверхностно-активные вещества, солюбилизаторы, стабилизаторы, смазывающие вещества, смачивающие агенты и разбавители.
Вещества, применимые для заключения в микрокапсулы, описанные здесь, включают вещества, совместимые с соединениями, описанными здесь, эффективно изолирующие соединение от других несовместимых эксципиентов. Вещества, совместимые с соединениями формулы (I), (II), (IIA) или (IIБ), описанными здесь, представляют собой вещества, замедляющие высвобождение соединений формулы (I), (II), (IIA) или (IIБ) in vivo.
Типичные вещества для заключения в микрокапсулы, применимые для замедления высвобождения композиций, содержащих соединения, описанные здесь, включают, без ограничения, эфиры гидроксипропилцеллюлозы (НРС), такие как Klucel® или Nisso НРС, эфиры низкозамещенной гидроксипропилцеллюлозы (L-HPC), эфиры гидроксипропилметилцеллюлозы (НРМС), такие как Seppifilm-LC, Pharmacoat®, Metolose SR, Methocel®-E, Opadry YS, PrimaFlo, Benecel MP824 и Benecel MP843, полимеры метилцеллюлозы, такие как Methocel®-A, ацетат-стеарат гидроксипропилметилцеллюлозы Aqoat (HF-LS, HF-LG, HF-MS) и Metolose®, Ethylcelluloses (EC) и их смеси Е461, Ethocel®, Aqualon®-EC, Surelease®, поливиниловый спирт (PVA), такой как Opadry AMB, гидроксиэтилцеллюлозы, такие как Natrosol®, карбоксиметилцеллюлозы и соли карбоксиметилцеллюлоз (CMC), такие как Aqualon®-CMC, поливиниловый спирт и сополимеры полиэтиленгликоля, такие как Kollicoat IR®, моноглицериды (Myverol), триглицериды (KLX), полиэтиленгликоли, модифицированный пищевой крахмал, акриловые полимеры и смеси акриловых полимеров с эфирами целлюлозы, такие как Eudragit® EPO, Eudragit® L30D-55, Eudragit® FS 30D, Eudragit® L100-55, Eudragit® L100, Eudragit® S100, Eudragit® RD100, Eudragit® E100, Eudragit® L12.5, Eudragit® S12.5, Eudragit® NE30D и Eudragit® NE 40D, ацетат-фталат целлюлозы, плетки Sepifilm, как например смеси НРМС и стеариновой кислоты, циклодекстрины и смеси этих веществ.
В других воплощениях пластификаторы, такие как полиэтиленгликоли, например полиэтиленгликоль-300 (PEG 300), PEG 400, PEG 600, PEG 1450, PEG 3350 и PEG 800, стеариновая кислота, пропиленгликоль, олеиновая кислота и триацетин включены в вещество для заключения в микрокапсулы. В других воплощениях вещество для заключения в микрокапсулы, применимые для задержки высвобождения фармацевтических композиций, представляет собой вещество из фармакопеи Соединенных Штатов Америки (USP) или из Национального формуляра (NF). В других воплощениях вещество для заключения в микрокапсулы представляет собой Klucel. В других воплощениях вещество для заключения в микрокапсулы представляет собой метилцеллюлозу.
Заключенные в микрокапсулы соединения формулы (I), (II), (IIA) или (IIБ), описанные здесь, могут быть изготовлены способами, известными специалисту в данной области техники. Такие известные способы включают, например, способы распылительной сушки, способы с вращающимся диском и растворителем (spinning disk-solvent processes), способы расплавления, способы распылительного охлаждения, псевдоожиженный слой, электростатическое осаждение, прессование с центрифугированием, ротационное суспензионное распыление, полимеризацию на границе раздела фаз жидкость - газ или твердое тело - газ, прессование давлением, или баню распылительной экстракции растворителями (spraying solvent extraction bath). В дополнение к этим, также могут быть применены некоторые химические методики, например комплексная коацервация, выпаривание растворителя, несопоставимость полимеров, полимеризацию на границе раздела фаз в жидкой среде, полимеризацию in situ, высушивание в жидкой среде и десольватация в жидкой среде. Кроме того, также могут быть применены другие способы, такие как уплотнение валиком, прессование/сферонизация, коацервация или покрытие наночастицами.
В других воплощениях также изготавливают шипучие порошки согласно настоящему описанию. Шипучие соли были использованы для диспергирования лекарственных средств в воде перед пероральным введением. Шипучие соли представляют собой гранулы или крупнодисперсные порошки, содержащие лекарственный агент в сухой смеси, обычно состоящей из бикарбоната натрия, лимонной кислоты и/или винной кислоты. При растворении таких солей в воде происходит взаимодействие кислот и оснований с высвобождением газа диоксида углерода, что вызывает «шипение». Примеры шипучих солей включают, например, следующие ингредиенты: бикарбонат натрия или смесь бикарбоната натрия и карбоната натрия, лимонную кислоту и/или винную кислоту. Вместо комбинации бикарбоната натрия и лимонной и винной кислот может быть использована любая комбинация кислоты и основания, приводящая к высвобождению диоксида углерода, при условии, что ингредиенты являются подходящими для фармацевтического применения и приводят к рН приблизительно 6,0 или выше.
В других воплощениях композиции, описанные здесь, содержащие соединение, описанное здесь, представляют собой твердые дисперсии. Способы получения таких твердых дисперсий известны в данной области техники и включают, без ограничения, например, патенты США №№4343789, 5340591, 5456923, 5700485, 5723269 и публикацию патента США №2004/0013734. В других воплощениях композиции, описанные здесь, представляют собой твердые растворы. Такие растворы содержат вещество вместе с активным агентом и другими эксципиентами таким образом, что нагревание смеси приводит к растворению лекарственного средства, и полученную композицию затем охлаждают с получением твердой смеси, которая может затем быть обработана или непосредственно добавлена в капсулу, или прессована с получением таблетки. Способы получения таких твердых растворов известны в данной области техники и включают, без ограничения, например, патенты США №№4151273, 5281420 и 6083518.
Фармацевтические твердые лекарственные формы, включая композиции, описанные здесь, содержащие соединение формулы (I), (II), (IIA) или (IIБ), описанное здесь, могут затем быть обработаны для обеспечения контролируемого высвобождения соединения формулы (I), (II), (IIA) или (IIБ). Контролируемое высвобождение относится к высвобождению соединения формулы (I), (II), (IIA) или (IIБ), описанного здесь, содержащей его лекарственной формы в соответствии с желаемым профилем в течение продолжительного периода времени. Профили контролируемого высвобождения включают, например, профили длительного высвобождения, пролонгированного высвобождения, прерывистого высвобождения и отсроченного высвобождения. В отличие от композиций с немедленным высвобождением композиции с контролируемым высвобождением делают возможной доставку агента субъекту в течение продолжительного периода времени в соответствии с предопределенным профилем. Такие скорости высвобождения могут обеспечить терапевтически эффективные уровни агента в течение продолжительного периода времени и, посредством этого, обеспечить более длительный период фармакологического ответа, минимизируя, в то же время, побочные эффекты по сравнению с обычными лекарственными формами с быстрым высвобождением. Такие длительные периоды ответа обеспечивают многие преимущества, присущие таким композициям, недостижимые соответствующими короткодействующими препаратами с немедленным высвобождением.
В некоторых воплощениях твердые лекарственные формы, описанные здесь, могут быть изготовлены в виде лекарственных форм для перорального введения с отсроченным высвобождением, покрытых кишечнорастворимым покрытием, то есть в виде лекарственной формы фармацевтической композиции, как описано здесь, для перорального введения, в которой использовано кишечнорастворимое покрытие для осуществления высвобождения в тонкой кишке желудочно-кишечного тракта. Лекарственная форма с кишечнорастворимым покрытием может представлять собой прессованную или формованную, или выдавленную таблетку/форму (покрытую или непокрытую), содержащую гранулы, порошок, шарики, зерна или частицы активного ингредиента и/или других компонентов композиции, которые сами по себе имеют покрытие или не имеют покрытия. Лекарственная форма для перорального введения с кишечнорастворимым покрытием может также представлять собой капсулу (покрытую или непокрытую), содержащую пеллеты, зерна или гранулы твердого носителя или композиции, которые сами по себе имеют покрытие или не имеют покрытия.
При использовании здесь термин «замедленное высвобождение» относится к такой доставке, что высвобождение может быть осуществлено в некотором в большинстве случаев предсказуемом месте кишечника, дистальнее, чем оно могло бы быть осуществлено, в отсутствие изменений, приводящих к замедленному высвобождению. В некоторых воплощениях способом замедления высвобождения является покрытие. Любые покрытия следует наносить с достаточной толщиной, такой, что все покрытие не растворяется в жидкостях желудочно-кишечного тракта при рН ниже приблизительно 5, но при рН приблизительно 5 и выше. Покрытия могут быть изготовлены из приведенных ниже веществ.
Акриловые полимеры. Свойства акриловых полимеров (в первую очередь их растворимость в биологических жидкостях) могут варьироваться в зависимости от степени и типа замещения. Примеры замещенных акриловых полимеров включают сополимеры метакриловой кислоты и сополимеры метакрилата аммония. Доступны серии Eudragit E, L, S, RL, RS и NE (Rohm Pharma) как солюбилизированные в органическом растворителе, в виде водной дисперсии или сухих порошков. Серии Eudragit RL, NE и RS нерастворимы в желудочно-кишечном тракте, но проницаемы, и их используют, главным образом, для доставки в толстую кишку. Серия Eudragit E растворяется в желудке. Серии Eudragit L, L-30D и S нерастворимы в желудке и растворяются в кишечнике.
Производные целлюлозы. Примерами подходящих производных целлюлозы являются этилцеллюлоза, реакционные смеси частичных уксуснокислых эфиров целлюлозы и ангидрида фталевой кислоты. Свойства могут варьироваться в зависимости от степени и типа замещения. Ацетат-фталат целлюлозы (CAP) растворяется при рН>6. Aquateric (FMC) является водной системой и представляет собой высушенный распылительной сушкой САР-псевдолатекс с частицами <1 мкм. Другие компоненты Aquateric могут включать плюроники (pluronics), разновидности Tween и ацетилированные моноглицериды. Другие подходящие производные целлюлозы включают: ацетат-тримеллитат целлюлозы (Eastman); метилцеллюлозу (Pharmacoat, Methocel); фталат гидроксипропилметилцеллюлозы (НРМСР); сукцинат гидроксипропилметилцеллюлозы (HPMCS); и ацетат-сукцинат гидроксипропилметилцеллюлозы (например, AQOAT (Shin Etsu)). Свойства могут варьироваться в зависимости от степени и типа замещения. Например, НРМСР, такой как марки HP-50, HP-55, HP-55S, HP-55F, является подходящим. Свойства могут варьироваться в зависимости от степени и типа замещения. Например, подходящие марки ацетата-сукцината гидроксипропилметилцеллюлозы включают, без ограничения, AS-LG (LF), растворяющийся при рН 5, AS-MG (MF), растворяющийся при рН 5,5, и AS-HG (HF), растворяющийся при более высоком рН. Эти полимеры представлены в виде гранул или тонкоизмельченных порошков для водных дисперсий.
Фталат поливинилацетата (PVAP). PVAP растворяется при рН>5, и он значительно менее проницаем для водяного пара и желудочного сока.
В некоторых воплощениях покрытие может содержать и обычно содержит пластификатор и, возможно, другие эксципиенты для покрытия, такие как красители, тальк и/или стеарат магния, хорошо известные в данной области техники. Подходящие пластификаторы включают триэтилцитрат (Citroflex 2), триацетин (глицерилтриацетат), ацетилтриэтилцитират (Citroflec A2), Carbowax 400 (полиэтиленгликоль 400), диэтилфталат, трибутилцитрат, ацетилированные моноглицериды, глицерин, сложные эфиры жирных кислот, пропиленгликоль и дибутилфталат. В частности, анионные полимеры акриловой кислоты будут обычно содержать 10-25% по массе пластификатора, главным образом, дибутилфталата, полиэтиленгликоля, триэтилцитрата и триацетина. Для нанесения покрытий применяют обычные методики покрытия, такие как распылительное покрытие или нанесение оболочки. Толщина оболочки должна быть достаточной для обеспечения интактного состояния лекарственной формы для перорального введения до достижения желаемой области местной доставки в кишечнике.
Помимо пластификаторов в покрытия могут быть добавлены красители, вещества, уменьшающие клейкость, поверхностно-активные вещества, пеногасители, смазывающие вещества (например, карнаубский воск или PEG) для солюбилизации или диспергирования вещества покрытия, и для улучшения свойств покрытия и покрытого продукта.
В других воплощениях доставку композиций, описанных здесь, содержащих соединение формулы (I), (II), (IIA) или (IIБ), описанное здесь, осуществляют с применением лекарственной формы с прерывистым высвобождением. Лекарственная форма с прерывистым высвобождением может обеспечить один или более чем один импульс немедленного высвобождения в предопределенные моменты времени после контролируемого периода задержки или в определенных местах. Лекарственные формы с прерывистым высвобождением могут быть введены с применением множества композиций с прерывистым высвобождением, известных в данной области техники. Например, такие композиции включают, без ограничения, композиции описанные в патентах США №№5011692; 5017381; 5229135; 5840329; 4871549; 5260068; 5260069; 5508040; 5567441 и 5837284.
Многие типы систем с контролируемым высвобождением являются подходящими для применения с композициями, описанными здесь. Примеры таких систем доставки включают, например, системы на основе полимеров, таких как полимолочная и полигликолевая кислоты, полиангидриды и поликапролактон; пористые матрицы, системы, не основанные на полимерах, представляющие собой липиды, включая стерины, такие как холестерин, сложные эфиры холестерина и жирные кислоты, или нейтральные жиры, такие как моно-, ди- и триглицериды; гидрогелевые системы высвобождения; силиконовые системы; системы на основе пептидов; восковые покрытия, лекарственные формы, подверженные биологическому разрушению, прессованные таблетки с применением обычных связывающих веществ и тому подобное. См., например, Liberman et al., Pharmaceutical Dosage Forms, 2 Ed., Vol.1, pp.209-214 (1990); Singh et al., Encyclopedia of Pharmaceutical Technology, 2nd Ed., pp.751-753 (2002); патенты США №№4327725; 4624848; 4968509; 5461140; 5456923; 5516527; 5622721; 5686105; 5700410; 5977175; 6465014; и 6932983.
В некоторых воплощениях предложены фармацевтические композиции, содержащие частицы соединений, описанных здесь, например, соединений формулы (I), (II), (IIA) или (IIБ), и по меньшей мере один диспергирующий агент или суспендирующий агент, для перорального введения субъекту. Композиции могут представлять собой порошок и/или гранулы для суспензии, и при смешивании с водой получают по существу однородную суспензию.
Жидкие лекарственные формы композиций для перорального введения могут представлять собой водные суспензии, выбранные из группы, включающей, без ограничения, фармацевтически приемлемые водные дисперсии, эмульсии, растворы, эликсиры, гели и сиропы для перорального введения. См., например, Singh et al., Encyclopedia of Pharmaceutical Technology, 2nd Ed., pp.754-757 (2002).
Водные суспензии и дисперсии, описанные здесь, могут сохранять гомогенное состояние, как определено в фармакопее США (издание 2005 г., глава 905), по меньшей мере в течение 4 часов. Гомогенность следует определять способом отбора проб, соответствующим определению гомогенности всей композиции. В одном воплощении водную суспензию можно ресуспендировать с образованием гомогенной суспензии физическим перемешиванием продолжительностью менее 1 минуты. В другом воплощении водную суспензию можно ресуспендировать с образованием гомогенной суспензии физическим перемешиванием продолжительностью менее 45 секунд. В еще одном воплощении водную суспензию можно ресуспендировать с образованием гомогенной суспензии физическим перемешиванием продолжительностью менее 30 секунд. В еще одном воплощении перемешивание не является необходимым для поддержания гомогенной водной дисперсии.
Фармацевтические композиции, описанные здесь, могут включать подсластители, такие как, без ограничения, сироп аравийской камеди, ацесульфам К, алитам, анис, яблоко, аспартам, банан, фруктовое, молочное желе со взбитыми сливками, ягоды, черная смородина, баттерскотч, цитрат кальция, камфора, карамель, вишня, вишневый крем, шоколад, корица, жевательная резинка, цитрус, цитрусовый пунш, цитрусовый крем, сахарная вата, какао, кола, охлажденная вишня, охлажденный цитрус, цикламат, циламат (cyclamate), декстроза, эвкалипт, эвгенол, фруктоза, фруктовый пунш, имбирь, глицирретинат, сироп солодки (лакрицы), виноград, грейпфрут, мед, изомальт, лимон, лайм, лимонный крем, глицирризинат моноаммония (MagnaSweet®), мальтол, маннит, клен, алтей лекарственный, ментол, мятный крем, ягодная смесь, неогесперидин DC, неотам, апельсин, груша, персик, мята перечная, крем мяты перечной, Prosweet® Powder, малина, шипучий напиток из корнеплодов, ром, сахарин, сафрол, сорбит, мята курчавая, крем мяты курчавой, земляника, земляничный крем, посконник крапиволистный, сукралоза, сахароза, сахарин натрия, сахарин, аспартам, ацесульфам калия, маннит, талин, сукралоза, сорбит, швейцарский крем, тагатоза, мандарин, тауматин, засахаренные фрукты, ваниль, грецкий орех, арбуз, черешня, гаультерия, ксилит, или любую комбинацию этих корригентов, например анис-ментол, вишня-анис, корица-апельсин, вишня-корица, шоколад-мята, мед-лимон, лимон-лайм, лимон-мята, ментол-эвкалипт, апельсин-крем, ваниль-мята и их смеси.
В некоторых воплощениях фармацевтические композиции, описанные здесь, могут представлять собой самоэмульгирующиеся системы доставки лекарственных средств (SEDDS). Эмульсии представляют собой дисперсии одной несмешивающейся фазы в другой, обычно в форме капель. В большинстве случаев эмульсии получают интенсивным механическим диспергированием. SEDDS, в отличие от эмульсий или микроэмульсий, спонтанно образуют эмульсии при добавлении к избытку воды, без какого-либо внешнего механического диспергирования или перемешивания. Преимущество SEDDS состоит в том, что для распределения капель по раствору необходимо лишь мягкое перемешивание. В дополнение, вода или водная фаза может быть добавлена непосредственно перед введением, что обеспечивает стабильность нестабильного или гидрофобного активного ингредиента. Таким образом, SEDDS обеспечивает эффективную систему доставки для пероральной или парентеральной доставки гидрофобных активных ингредиентов. SEDDS может обеспечить улучшения биодоступности гидрофобных активных ингредиентов. Способы изготовления самоэмульгирующихся лекарственных форм известны в данной области техники и включают, без ограничения, например, патенты США №№5858401, 6667048 и 6960563.
Следует понимать, что перечисленные выше добавки, используемые в водных дисперсиях или суспензиях, описанных здесь, частично совпадают, поскольку разные специалисты в данной области техники часто по-разному классифицируют конкретную добавку, или эту добавку обычно используют для любой из нескольких различных функций. Таким образом, перечисленные выше добавки следует рассматривать исключительно как неограничивающие примеры типов добавок, которые могут быть включены в композиции, описанные здесь. Специалист в данной области техники может легко определить количество этих добавок в соответствии с конкретными желаемыми свойствами.
В данной области техники известны композиции для интраназального введения, и они описаны, например, в патентах США №№4476116, 5116817 и 6391452. Композиции, содержащие соединение, описанное здесь, изготавливаемые согласно этим и другим методикам, хорошо известным в данной области техники, изготавливают в форме растворов в физиологическом растворе с использованием бензилового спирта и других подходящих консервантов, фторуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных в данной области техники. См., например, Ansel, Н. С. et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, Sixth Ed. (1995). Предпочтительно эти композиции и препараты изготавливают с использованием подходящих нетоксичных фармацевтически приемлемых ингредиентов. Эти ингредиенты известны специалистам в области изготовления лекарственных форм для назального введения, и некоторые из них могут быть обнаружены в REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY, 21st edition, 2005, что является стандартной ссылкой в данной области техники. Выбор подходящих носителей в значительной степени зависит от природы желаемой назальной лекарственной формы, например, растворов, суспензий, мазей или гелей. Назальные лекарственные формы в большинстве случаев содержат значительное количество воды в дополнение к активному ингредиенту. Могут также присутствовать небольшие количества других ингредиентов, таких как корректоры рН, эмульгаторы или диспергирующие агенты, консерванты, поверхностно-активные вещества, желирующие агенты или буферные или другие стабилизирующие и солюбилизирующие агенты. Предпочтительно назальная лекарственная форма должна быть изотонична назальным секретам.
Для введения ингаляцией соединения, описанные здесь, могут быть представлены в форме аэрозоля, тумана или порошка. Доставку фармацевтических композиций, описанных здесь, подходящим образом осуществляют в форме получения распыленного аэрозоля из упаковок под давлением или небулайзера с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением единица дозы может быть определена клапаном для доставки отмеренного количества. Могут быть изготовлены капсулы и картриджи, такие как, только в качестве примера, желатиновые, для применения в ингаляторе или инсуффляторе, содержащие порошковую смесь соединения, описанного здесь, и подходящую основу порошка, такого как лактоза или крахмал.
Композиции для трансбуккального введения, содержащие соединения, описанные здесь, могут быть введены с применением множества композиций, известных в данной области техники. Например, такие композиции, включают, без ограничения, патенты США №№4229447, 4596795, 4755386 и 5739136. В дополнение, лекарственные формы для трансбуккального введения, описанные здесь, могут дополнительно содержать подверженный биологическому разрушению (гидролизуемый) полимерный носитель, который также способствует адгезии лекарственной формы к слизистой оболочке щеки. Лекарственную форму для трансбуккального введения изготавливают таким образом, чтобы она постепенно распадалась в течение предопределенного периода времени, при этом доставка соединения обеспечена в течение по существу всего указанного периода. Как будет ясно специалистам в данной области техники, трансбуккальная доставка лекарственных средств позволяет избежать недостатков, связанных с пероральным введением лекарственных средств, например, медленного всасывания, разрушения активного агента жидкостями, присутствующими в желудочно-кишечном тракте, и/или его инактивации при первом прохождении через печень. В отношении подверженного биологическому разрушению (гидролизуемого) полимерного носителя следует понимать, что может быть использован практически любой такой носитель, при условии, что это не вредит желаемому профилю высвобождения лекарственного средства и что носитель совместим с соединением формулы (I), (II), (IIA) или (IIБ), описанным здесь, и любыми другими компонентами, которые могут присутствовать в единице дозы для трансбуккального введения. В большинстве случаев полимерный носитель содержит гидрофильные (водорастворимые и набухающие в воде) полимеры, адгезирующие к влажной поверхности слизистой оболочки щеки. Примеры полимерных носителей, применимых здесь, включают полимеры и сополимеры акриловой кислоты, например, известные как «карбомеры» (одним таким полимером является Carbopol®, который может быть получен от B.F. Goodrich). В лекарственные формы для трансбуккального введения, описанные здесь, могут также быть включены другие компоненты, включая, без ограничения, разрыхлители, разбавители, связывающие вещества, смазывающие вещества, корригенты, красители, консерванты и тому подобное. Для трансбуккального или сублингвального введения композиции могут иметь форму таблеток, лепешек или гелей, изготовленных обычным способом.
Композиции для трансдермального введения, описанные здесь, могут быть введены с применением множества устройств, описанных в данной области техники. Например, такие устройства включают, без ограничения, патенты США №№3598122, 3598123, 3710795, 3731683, 3742951, 3814097, 3921636, 3972995, 3993072, 3993073, 3996934, 4031894, 4060084, 4069307, 4077407, 4201211, 4230105, 4292299, 4292303, 5336168, 5665378, 5837280, 5869090, 6923983, 6929801 и 6946144.
Лекарственные формы для трансдермального введения, описанные здесь, могут сдержать определенные фармацевтически приемлемые эксципиенты, обычные в данной области техники. В одном воплощении композиции для трансдермального введения, описанные здесь, включают по меньшей мере три компонента: (1) композицию соединения формулы (I), (II), (IIA) или (IIБ); (2) вещество, способствующее проникновению; и (3) водный адъювант. В дополнение, композиции для трансдермального введения, описанные здесь, могут включать дополнительные компоненты, такие как, без ограничения, желирующие агенты, основы кремов и мазей и тому подобное. В некоторых воплощениях композиция для трансдермального введения может дополнительно включать тканевую или нетканевую основу для усиления всасывания и предотвращения удаления композиции для трансдермального введения с кожи. В других воплощениях композиции для трансдермального введения, описанные здесь, способны поддерживать насыщенное или перенасыщенное состояние для стимуляции диффузии в кожу.
В композициях, подходящих для трансдермального введения соединений, описанных здесь, могут быть использованы устройства для трансдермальной доставки и пластыри для трансдермальной доставки, и эти композиции могут представлять собой липофильные эмульсии или забуференнные водные растворы, растворенные и/или диспергированные в полимере или связывающем веществе. Такие пластыри могут быть разработаны для непрерывной, прерывистой доставки фармацевтических агентов или доставки фармацевтических агентов по требованию. Более того, трансдермальная доставка соединений, описанных здесь, может быть осуществлена посредством ионофоретических пластырей и тому подобного. В дополнение, пластыри для трансдермального введения могут обеспечить контролируемое высвобождение соединения формулы (I), (II), (IIA) или (IIБ), описанного здесь. Скорость всасывания может быть уменьшена с применением скорость-контролирующих мембран или захватом соединения в полимерную матрицу или гель. Наоборот, для увеличения всасывания могут быть использованы усилители всасывания. Усилитель всасывания или носитель может содержать всасываемые фармацевтически приемлемые растворители для облегчения прохождения через кожу. Например, устройства для трансдермального введения представлены в форме повязки, содержащей основу, резервуар, содержащий соединение, возможно, с носителями, возможно, скорость-контролирующий барьер для доставки соединения в кожу хозяина с контролируемой предопределенной скоростью в течение продолжительного периода времени и средство прикрепления устройства к коже.
Композиции, подходящие для внутримышечной, подкожной или внутривенной инъекции могут содержать фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, и стерильные порошки для восстановления в стерильных растворах или дисперсиях для инъекций. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин, кремофор (cremophor) и тому подобное) их подходящие смеси, растительные масла (такие как оливковое масло) и органические сложные эфиры для инъекций, такие как этилолеат. Подходящую текучесть можно поддерживать, например, применением покрытия, такого как лецитин, поддержанием необходимого размера частиц в случае дисперсий и применением поверхностно-активных веществ. Композиции, подходящие для подкожной инъекции, могут также содержать такие добавки, как консерванты, смачивающие агенты, эмульгаторы и диспергирующие агенты. Предотвращение роста микроорганизмов можно обеспечить различными антибактериальными и противогрибковыми агентами, такими как парабены, хлорбутанол, фенол, сорбиновая кислота и тому подобное. Также может быть желательным включение изотонических агентов, таких как сахара, хлорид натрия и тому подобное. Пролонгированное всасывание лекарственной формы для инъекций может быть обусловлено применением агентов, замедляющих всасывание, таких как моностеарат алюминия и желатин.
Для внутривенных инъекций соединения, описанные здесь, могут быть приготовлены в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хенкса, раствор Рингера или физиологический раствор. Для введения через слизистые оболочки в композиции используют вещества, способствующие проникновению, подходящие для преодолеваемого барьера. В большинстве случаев такие вещества, способствующие проникновению, известны в данной области техники. Для других парентеральных инъекций подходящие композиции могут включать водные или неводные растворы, предпочтительно с физиологически совместимыми буферами или эксципиентами. Такие эксципиенты в большинстве случаев известны в данной области техники.
Парентеральные инъекции могут включать болюсную инъекцию или непрерывную инфузию. Композиции для инъекций могут быть представлены в стандартной лекарственной форме, например ампулах или контейнерах на несколько доз, с добавлением консерванта. Фармацевтическая композиция, описанная здесь, может быть представлена в форме, подходящей для парентеральной инъекции, в виде стерильных суспензий, растворов или эмульсий в масляных или водных наполнителях и может содержать агенты для изготовления лекарственных форм, такие как суспендирующие агенты, стабилизаторы и/или диспергирующие агенты. Фармацевтические композиции для парентерального введения включают водные растворы активных соединений в водорастворимой форме. В дополнение, суспензии активных соединений могут быть изготовлены в форме подходящих масляных суспензий для инъекций. Подходящие липофильные растворители или наполнители включают нелетучие масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат, или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, увеличивающие вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Возможно, суспензия может также содержать подходящие стабилизаторы или агенты, увеличивающие растворимость соединений для того, чтобы сделать возможным приготовление высококонцентрированных растворов. Альтернативно, активный ингредиент может быть представлен в форме порошка для разведения в подходящем наполнителе, например стерильной апирогенной воде, перед применением.
В определенных воплощениях могут быть использованы системы доставки фармацевтических соединений, такие как, например, липосомы и эмульсии. В определенных воплощениях композиции, предложенные здесь, могут также содержать мукоадгезивный полимер, выбранный из, например, карбоксиметилцеллюлозы, карбомера (полимера акриловой кислоты), поли(метилметакрилата), полиакриламида, поликарбофила, сополимера акриловой кислоты и бутилакрилата, альгината натрия и декстрана.
В некоторых воплощениях соединения, описанные здесь, могут быть введены местно и могут быть изготовлены в форме множества композиций для местного введения, таких как растворы, суспензии, лосьоны, гели, пасты, лекарственные шпатели, бальзамы, кремы или мази. Такие фармацевтические композиции могут содержать солюбилизаторы, стабилизаторы, агенты, увеличивающие тоничность, буферы и консерванты.
Соединения, описанные здесь, могут также быть изготовлены в форме композиций для ректального введения, таких как клизмы, гели для ректального введения, пены для ректального введения, аэрозоли для ректального введения, суппозитории, гелевые суппозитории или удерживающие клизмы, содержащие обычные суппозиторные основы, такие как масло какао или другие глицериды, а также синтетические полимеры, такие как поливинилпирролидон, PEG и тому подобное. В формах композиций в виде суппозиториев сначала происходит расплавление легкоплавкого воска, такого как, без ограничения, смесь глицеридов жирных кислот, возможно, в комбинации с маслом какао.
В большинстве случаев агент, такой как соединение формулы (I), (II), (IIA) или (IIБ), вводят в количестве, эффективном для улучшения заболевания или расстройства или предотвращения развития его симптомов (то есть терапевтически эффективном количестве). Таким образом, терапевтически эффективное количество может представлять собой количество, способное по меньшей мере частично предотвратить заболевание или расстройство или реверсировать его. Доза, необходимая для достижения эффективного количества, может варьироваться в зависимости от агента, композиции, заболевания или расстройства, и индивида, которому вводят агент.
Определение эффективных количеств может также включать анализы in vitro, в которых различные дозы агента вводят в клетки в культуре и определяют концентрацию агента, эффективную для улучшения некоторых или всех симптомов, для вычисления концентрации, необходимой in vivo. Эффективные количества могут также быть основаны на исследованиях на животных in vivo.
Агент может быть введен до, во время или после появления симптомов заболевания или расстройства. В некоторых воплощениях агент вводят субъекту с семейным анамнезом заболевания или расстройства, или имеющему фенотип, который может указывать на предрасположенность к заболеванию или расстройству, или имеющему генотип, из-за которого субъект предрасположен к заболеванию или расстройству.
Конкретная используемая система доставки может зависеть от ряда факторов, включая, например, предполагаемую мишень и путь введения, например местный или системный. Мишени для доставки могут представлять собой определенные клетки, являющиеся причиной заболевания или расстройства или способствующие заболеванию или расстройству, включая, например, клетки, имеющие измененный внутриклеточный кальций или нарушенную регуляцию кальция или нарушенный кальциевый гомеостаз, и клетки, не имеющие измененного внутриклеточного кальция, но которые могут иметь некоторое изменение, дефект или недостаточность, которые могут быть, по меньшей мере частично, компенсированы, нейтрализованы, подвержены обратному развитию или ослаблены изменением внутриклеточного кальция клетки. Конкретные клетки включают, например, иммунокомпетентные клетки (например, лимфоциты, Т-клетки, В-клетки, лейкоциты), фибробласты (или клетки, имеющие происхождение от фибробласта), клетки эпидермиса, клетки дермы или кожи (например, кератиноциты), клетки крови, клетки почки или почечные клетки (например, мезангиальные клетки), мышечные клетки (например, гладкомышечную клетку, такую как гладкомышечная клетка дыхательных путей (трахеи или бронхов)), экзокринные или секреторные клетки (например, клетки слюнных желез, включая клетки околоушной слюнной железы, клетки ацинусов и клетки поднижнечелюстной слюнной железы). Например, клетка-мишень может представлять собой резидентные или инфильтрирующие клетки легких или дыхательных путей, способствующие астме, резидентные или инфильтрирующие клетки нервной системы, способствующие неврологическому, нейродегенеративному или демиелинизирующему заболеванию или расстройству, резидентные или инфильтрирующие клетки, вовлеченные в отторжение трансплантата почки, трансплантированные клетки, активация которых приводит к реакции «трансплантат против хозяина», резидентные или инфильтрирующие клетки, вовлеченные в отторжение трансплантата почки, резидентные или инфильтрирующие клетки, активация которых способствует воспалению, например, при артрите, резидентные или инфильтрирующие клетки почки или мочевыводящей системы (например, мезангиальные клетки), вовлеченные в нейропатию и гломерулонефрит, и резидентные или инфильтрирующие клетки экзокринных желез (например, слюнных и слезных желез), вовлеченные в аутоиммунные расстройства (например, болезнь Шегрена). Введение агента может быть направлено на один или более чем один тип клеток или подгруппу типов клеток способами, известными специалистам в данной области техники. Например, агент может быть связан с антителом, лигандом рецептора клеточной поверхности или токсином или может быть заключен в частицу, селективно захватываемую клетками, например липосомы или вирус, в котором вирусный рецептор специфично связывает определенный тип клеток, или вирусную частицу без вирусной нуклеиновой кислоты, или может быть введен местно.
Примеры способов введения и схем лечения
Соединения, описанные здесь, могут быть использованы в композициях лекарственных средств для модуляции внутриклеточного кальция или для лечения заболеваний или состояний, при которых будет полезна, по меньшей мере отчасти, модуляция внутриклеточного кальция. В дополнение, способ лечения любых заболеваний или состояний, описанный здесь, у субъекта, нуждающегося в таком лечении, включает введение указанному субъекту фармацевтических композиций, содержащих по меньшей мере одно соединение, описанное здесь, или его фармацевтически приемлемую соль, фармацевтически приемлемое пролекарство или фармацевтически приемлемый сольват в терапевтически эффективных количествах.
Композиции, содержащие соединение (соединения), описанное здесь, могут быть введены для профилактического и/или терапевтического лечения. В терапевтических применениях композиции вводят пациенту, уже страдающему заболеванием или состоянием, в количестве, достаточном для лечения или по меньшей мере частичного подавления симптомов заболевания или состояния. Количества, эффективные для такого применения, будут зависеть от тяжести и течения заболевания или состояния, предшествующей терапии, состояния здоровья пациента, массы тела и ответа на лекарственные средства и мнения лечащего врача.
В профилактических применениях композиции, содержащие соединения, описанные здесь, вводят пациенту, восприимчивому к определенному заболеванию, расстройству или состоянию, или, в противном случае, пациенту с риском такого заболевания, расстройства или состояния. Такое количество определяют как «профилактически эффективное количество или дозу». В таких применениях точные количества также зависят от состояния здоровья пациента, массы тела и тому подобного. При применении у пациента эффективные количества для такого применения, будут зависеть от тяжести и течения заболевания, расстройства или состояния, предшествующей терапии, состояния здоровья пациента, массы тела и ответа на лекарственные средства и мнения лечащего врача.
В случае отсутствия улучшения состояния пациента по усмотрению врача возможно длительное применение соединений, то есть в течение длительного периода времени, включая применение на всем протяжении жизни пациента, для улучшения или, в противном случае, контроля или ограничения симптомов заболевания или состояния у пациента.
В случае улучшения состояния пациента по усмотрению врача возможен постоянный прием соединений; альтернативно, доза лекарственного средства может быть временно снижена или прием лекарственного средства может быть временно прекращен на определенный промежуток времени (то есть «отдых от лекарств»). Продолжительность "отдыха от лекарств" может варьироваться от 2 суток до 1 года, включая, исключительно в качестве примера, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 10 суток, 12 суток, 15 суток, 20 суток, 28 суток, 35 суток, 50 суток, 70 суток, 100 суток, 120 суток, 150 суток, 180 суток, 200 суток, 250 суток, 280 суток, 300 суток, 320 суток, 350 суток или 365 суток. Снижение дозы в течение "отдыха от лекарств" может составлять от приблизительно 10% до приблизительно 100%, включая, исключительно в качестве примера, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95% или приблизительно 100%.
При улучшении состояния здоровья пациента вводят поддерживающую дозу, если необходимо. Затем доза и частота введения, или и то, и другое, могут быть снижены как функция симптомов до уровня, при котором сохраняется улучшение заболевания, расстройства или состояния. Тем не менее, при рецидиве симптомов для пациента может быть необходимым периодическое лечение на долговременной основе.
Количество данного агента, которое будет соответствовать такому количеству, будет варьироваться в зависимости от конкретного соединения, заболевания или состояния и его тяжести, индивидуальных параметров (например, массы тела) субъекта или хозяина, нуждающегося в лечении, но, тем не менее, может быть определено способом, известным в данной области техники, в соответствии с конкретными обстоятельствами случая, включая, например, конкретный вводимый агент, путь введения, состояние, по поводу которого проводят лечение, и субъекта или хозяина, проходящего лечение. В большинстве случаев, тем не менее, дозы, применяемые для лечения взрослого человека, будут обычно составлять от приблизительно 0,02 до приблизительно 5000 мг в сутки, в некоторых воплощениях от приблизительно 1 до приблизительно 1500 мг в сутки. Желаемая доза может подходящим образом быть представлена в форме разовой дозы или в форме разделенных доз, вводимых одновременно (или в течение короткого периода времени) или с подходящими интервалами, например, в форме двух, трех, четырех или более доз в сутки.
Фармацевтическая композиция, описанная здесь, может быть представлена в стандартных лекарственных формах, подходящих для однократного введения определенных доз. В стандартной лекарственной форме композиция разделена на стандартные дозы, содержащие подходящие количества одного или более соединения. Стандартная доза может быть представлена в форме упаковки, содержащей дискретные количества композиции. Неограничивающие примеры представляют собой упакованные таблетки или капсулы и порошки во флаконах или ампулах. Композиции в виде водных суспензий могут быть упакованы в неподдающиеся повторной герметизации контейнеры на одну дозу. Альтернативно, могут быть использованы поддающиеся повторной герметизации контейнеры на несколько доз, в случае чего в композицию обычно включают консервант. Исключительно в качестве примера, композиции для парентеральной инъекции могут быть представлены в стандартной лекарственной форме, включая, без ограничения, ампулы или контейнеры на несколько доз с добавленным консервантом.
Описанные здесь суточные дозы, подходящие для соединений, описанных здесь, составляют от приблизительно 0,01 мг/кг до приблизительно 20 мг/кг. В одном воплощении суточные дозы составляют от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг. Указанная суточная доза у крупного млекопитающего, включая, без ограничения, людей, составляет от приблизительно 0,5 мг до приблизительно 1000 мг, и ее подходящим образом вводят в форме разовой дозы или в разделенных дозах, включая, без ограничения, до четырех раз в сутки или в форме с пролонгированным высвобождением. Подходящие стандартные лекарственные формы для перорального введения содержат от приблизительно 1 до приблизительно 500 мг активного ингредиента. В одном воплощении стандартная доза составляет приблизительно 1 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 400 мг или приблизительно 500 мг. Указанные выше диапазоны являются лишь приблизительными, поскольку число переменных в отношении индивидуальной схемы лечения велико, и значительные отклонения от этих рекомендуемых величин не являются необычными. Такие дозы могут быть изменены в зависимости от ряда переменных, включающих, без ограничения, активность используемого соединения, заболевание или состояние, по поводу которого проводят лечение, способ введения, требования отдельного субъекта, тяжесть заболевания или состояния, по поводу которого проводят лечение, и мнение практикующего врача.
Токсичность и терапевтическая эффективность таких схем лечения может быть определена стандартными фармацевтическими способами на клеточных культурах или экспериментальных животных, включая, без ограничения, определение средней смертельной дозы (LD50) (дозы, смертельной для 50% популяции) и средней эффективной дозы (ED50) (дозы, терапевтически эффективной у 50% популяции). Дозовое соотношение между токсическими и терапевтическими эффектами представляет собой терапевтический индекс и может быть выражено как соотношение между LD50 и ED50. Предпочтительны соединения, демонстрирующие высокие терапевтические индексы. Данные, полученные в анализах на клеточных культурах и исследованиях на животных, могут быть применены в определении диапазона доз для применения у человека. Доза таких соединений обычно входит в диапазон концентраций в циркулирующей крови, включающий ED50 с минимальной токсичностью. Доза может варьироваться в пределах этого диапазона в зависимости от используемой лекарственной формы и применяемого пути введения.
Комбинированное лечение
Соединения формулы (I), (II), (IIA) или (IIБ) и их композиции могут также быть применены в комбинации с другими хорошо известными терапевтическими агентами, выбранными по их терапевтическому значению для состояния, подлежащего лечению. В большинстве случаев нет необходимости вводить композиции, описанные здесь, и, в воплощениях, где применяют комбинированную терапию, другие агенты в одной и той же фармацевтической композиции, и, ввиду различных физических и химических свойств, может быть необходимым вводить их различными способами введения. Определение способа введения и целесообразности введения в одной и той же фармацевтической композиции, там, где это возможно входит в объем знаний квалифицированного практикующего врача. Первое введение может быть осуществлено согласно установленным протоколам, известным в данной области техники, и затем, на основании наблюдаемых эффектов, квалифицированный практикующий врач может изменить дозу, способы введения и время введения.
В некоторых случаях может быть подходящим вводить по меньшей мере одно соединение формулы (I), (II), (IIA) или (IIБ), описанное здесь, в комбинации с другим терапевтическим агентом. Исключительно в качестве примера, если одним из побочных эффектов, которые испытывает пациент при введении соединений, описанных здесь, таких как соединение формулы (I), (II), (IIA) или (IIБ), является тошнота, то может быть подходящим введение агента от тошноты в комбинации с первым терапевтическим агентом. Либо, исключительно в качестве примера, терапевтическая эффективность соединений, описанных здесь, может быть увеличена введением адъюванта (то есть сам по себе адъювант может иметь минимальный терапевтический полезный эффект, но в комбинации с другим терапевтическим агентом общий терапевтический полезный эффект для пациента увеличивается). Либо, исключительно в качестве примера, полезный эффект, оказываемый пациенту, может быть увеличен введением одного из соединений, описанных здесь, с другим терапевтическим агентом (что также включает схему лечения), также имеющим полезный терапевтический эффект. В любом случае, независимо от заболевания, расстройства или состояния, по поводу которого проводят лечение, общий полезный эффект, оказываемый на пациента, может просто представлять собой аддитивный эффект двух терапевтических агентов, или на пациента может быть оказан синергический полезный эффект.
Конкретный выбор используемых соединений будет зависеть от диагноза лечащих врачей и их мнения о состоянии пациента и подходящем протоколе лечения. Соединения можно вводить одновременно (например, одновременно, по существу одновременно или в рамках одного и того же протокола лечения) или последовательно, в зависимости от характера заболевания, расстройства или состояния, состояния пациента и фактического выбора используемых соединений. Определение порядка введения и числа повторных введений каждого терапевтического агента на протяжении протокола лечения входит в объем знаний квалифицированного врача после оценки заболевания, по поводу которого проводят лечение, и состояния пациента.
Терапевтически эффективные дозы могут варьироваться при применении лекарственных средств в лечебных комбинациях. Способы экспериментального определения терапевтически эффективных доз лекарственных средств и других агентов для применения в схемах комбинированного лечения описаны в литературе. Например, в литературе активно описывают применение регулярного дозированиия, то есть обеспечение более частого введения меньших доз для минимизации токсических побочных эффектов. Комбинационное лечение дополнительно включает периодические курсы лечения, начинающиеся и заканчивающиеся в разное время, способствующие лечению пациента.
Для комбинированного лечения, описанного здесь, дозы совместно вводимых соединений будут, конечно, варьироваться в зависимости от типа применяемого совместно вводимого лекарственного средства, от конкретного применяемого лекарственного средства, от заболевания или состояния, по поводу которого проводят лечение, и так далее. В дополнение, при совместном введении с одним или более чем одним биологически активным агентом соединение, предложенное здесь, может быть введено либо одновременно с биологически активным агентом (агентами), либо последовательно. При последовательном введении лечащий врач будет определять подходящую последовательность введения белка в комбинации с биологически активным агентом (агентами).
В любом случае несколько терапевтических агентов (один из которых представляет собой соединение формулы (I), (II), (IIA) или (IIБ), описанное здесь) могут быть введены в любом порядке или даже одновременно. При одновременном введении несколько терапевтических агентов могут быть представлены в одной единой форме или в нескольких формах (исключительно в качестве примера, либо в форме одной пилюли, либо в форме двух отдельных пилюль). Один из терапевтических агентов может быть введен в нескольких дозах, или оба могут быть введены в нескольких дозах. При неодновременном введении время между несколькими дозами может варьироваться от более чем нуля недель до менее чем четырех недель. В дополнение, комбинированные способы, композиции и препараты не следует ограничивать применением только двух агентов; также предполагают применение нескольких терапевтических комбинаций.
Ясно, что схема приема лекарственного средства для лечения, предотвращения или улучшения состояния (состояний), на облегчение которого направлен прием лекарственного средства, может быть изменена в соответствии с множеством факторов. Эти факторы включают расстройство или состояние, которым страдает субъект, а также возраст, массу тела, пол, питание и состояние здоровья субъекта. Таким образом, фактически применяемая схема приема лекарственного средства может варьироваться в широких пределах и, следовательно, может отличаться от схем приема лекарственных средств, изложенных здесь.
Фармацевтические агенты, составляющие комбинированную терапию, раскрытую здесь, могут представлять собой комбинированную лекарственную форму или быть представлены в отдельных лекарственных формах, предназначенных для по существу одновременного введения.
Фармацевтические агенты, составляющие комбинированную терапию, могут также быть введены последовательно с любым терапевтическим соединением, вводимым согласно схеме, требующей двухстадийного введения. Схема двухстадийного введения может требовать последовательного введения активных агентов или раздельного введения отдельных активных агентов. Период времени между несколькими стадиями введения может составлять от нескольких минут до нескольких часов, в зависимости от свойств каждого фармацевтического агента, таких как активность, растворимость, биодоступность, период полувыведения в плазме и кинетический профиль фармацевтического агента. Суточные вариации концентрации молекулы-мишени могут также определять оптимальный интервал между введениями.
В дополнение, соединения, описанные здесь, могут также быть применены в комбинации со способами, которые могут обеспечить пациенту аддитивный или синергический полезный эффект. Исключительно в качестве примера, ожидают, что в способах, описанных здесь, пациентам будет оказан терапевтический и/или профилактический полезный эффект, где фармацевтическую композицию соединения, раскрытого здесь, и/или комбинации с другими терапевтическими агентами сочетают с генетическим исследованием для определения того, является ли индивид носителем мутантного гена, для которого известна корреляция с определенными заболеваниями и расстройствами.
Соединения, описанные здесь, и комбинированное лечение могут быть применены до, в течение или после появления заболевания или состояния, и время введения композиции, содержащей соединение, может варьироваться. Таким образом, например, соединения могут быть применены в качестве профилактики, и их можно длительно вводить субъектам со склонностью к развитию состояний или заболеваний для предотвращения появления заболевания или состояния. Соединения и композиции могут быть введены субъекту при появлении симптомов или как можно раньше после появления симптомов. Введение соединений может быть начато в пределах первых 48 часов от момента появления симптомов, предпочтительно в пределах первых 48 часов от момента появления симптомов, более предпочтительно в пределах первых 6 часов от момента появления симптомов и наиболее предпочтительно в пределах первых 3 часов от момента появления симптомов. Первое введение может быть осуществлено любым осуществимым способом введения, таким как, например, внутривенная инъекция, болюсная инъекция, инфузия в течение от приблизительно 5 минут до приблизительно 5 часов, пилюля, капсула, пластырь для трансдермального введения, трансбуккальная доставка и тому подобное, или их комбинация. Соединение предпочтительно вводят как можно раньше после выявления или появления подозрения начала заболевания или состояния и в течение времени, необходимого для лечения заболевания, как например от 1 суток до приблизительно 3 месяцев. Продолжительность лечения может варьировать для каждого субъекта, и продолжительность может быть определена с применением известных критериев. Например, соединение или композицию, содержащую соединение, можно вводить в течение по меньшей мере 2 недель, предпочтительно от приблизительно 1 месяца до приблизительно 5 лет.
Ингибиторы SOCE
В одном аспекте соединения формулы (I), (II), (IIA) или (IIБ) могут быть введены или применены в сочетании с другими известными ингибиторами SOCE. В одном аспекте известные ингибиторы SOCE являются неселективными ингибиторами. В одном аспекте известные ингибиторы SOCE являются селективными ингибиторами.
Было описано множество ингибиторов SOCE. Известные ингибиторы SOCE включают:
а) катионы, включая катионы лантаноидов, такие как, например, Gd3+, La3+;
б) ингибиторы Р-450, включающие эконазол, миконазол, клотримазол, кетоконазол;
в) ингибиторы циклооксигеназы, включающие нифлумовую кислоту, флуфенамовую кислоту, тенидап;
г) ингибиторы липоксигеназы, включающие нордигидрогваяретовую кислоту, эйкозатетраеновую кислоту;
д) соединения, являющиеся блокаторами каналов, включающие SK&F 96365, SC38249, LU52396, L-651,582, тетрандрин, 2-аминоэтоксидифенилборат (2-АРВ);
е) соединения, ингибирующие SOCE, не действуя на SOC-каналы сами по себе, включающие U73122 (ингибитор фосфолипазы С), вортманнин (ингибитор фосфатидилинозитолкиназы).
Некоторые из этих известных ингибиторов SOCE обладают неспецифическими эффектами и/или несколькими механизмами действия, способствующими ингибированию SOCE, включающими блокаду поры SOC-канала (блокаторы каналов), ингибирование митохондриального синтеза аденозинтрифосфата (АТР), по-видимому, способствующего SOCE (Gamberucci et al., J Biol. Chem., 269, 23597-23602, 1994; Marriott et al., Am. J. Physiol., 269, C766-C774, 1995), изменения цитоплазматического рН (Muallem et al., Am. J. Physiol., 257, G917-G924, 1989), а также ингибирование активации SOC-каналов.
Иммунодепрессанты
В одном воплощении соединения формулы (I), (II), (IIA) или (IIБ) вводят как единственные агенты при иммуносупрессивной терапии для снижения, ингибирования или предотвращения активности иммунной системы. В клинической практике иммуносупрессивную терапию применяют для: предотвращения отторжения трансплантированных органов и тканей (например, костного мозга, сердца, почки, печени); лечения аутоиммунных заболеваний или заболеваний, наиболее вероятно, аутоиммунного происхождения (например, ревматоидного артрита, тяжелой псевдопаралитической миастении, системной красной волчанки, болезни Крона и неспецифического язвенного колита); и лечения некоторых других неаутоиммунных воспалительных заболеваний (например, длительного контроля аллергической астмы).
В некоторых воплощениях соединения формулы (I), (II), (IIA) или (IIБ) могут быть введены с другими иммунодепрессантами, выбранными из: ингибиторов кальциневрина (таких как, без ограничения, циклоспорин, такролимус); ингибиторов мишени рапамицина млекопитающих (mTOR) (таких как, без ограничения, сиролимус, эверолимус); антипролиферативных лекарственных средств (таких как, без ограничения, азатиоприн, микофеноловая кислота); кортикостероидов (таких как, без ограничения, преднизон, ацетат кортизона, преднизолон, метилпреднизолон, дексаметазон, бетаметазон, триамцинолон, беклометазон, ацетат флудрокортизона, ацетат дезоксикортикостерона, альдостерон, гидрокортизон); антител (таких как, без ограничения, моноклональные антитела против рецетора IL-2Rα (базиликсимаб, даклизумаб), поликлональные антитела против Т-клеток (антитимоцитарный глобулин (ATG), антилимфоцитарный глобулин (ALG))).
Другие иммунодепрессанты включают, без ограничения: глюкокортикоиды (альклометазон, альдостерон, амцинонид, беклометазон, бетаметазон, будесонид, циклесонид, клобетазол, клобетазон, клокортолон, клопреднол, кортизон, кортивазол, дефлазакорт, дезоксикортикостерон, десонид, дезоксиметазон, дезоксикортон, дексаметазон, дифлоразон, дифлукортолон, дифлупреднат, флуклоролон, флудрокортизон, флудроксикортид, флуметазон, флунизолид, ацетонид флуоцинолона, флуоцинонид, флуокортин, флуокортолон, фторметолон, флуперолон, флупредниден, флутиказон, формокортал, галцинонид, галометазон, гидрокортизон/кортизол, ацепонат гидрокортизона, бутепрат гидрокортизона, бутират гидрокортизона, лотепреднол, медризон, мепреднизон, метилпреднизолон, ацепонат метилпреднизолона, фуроат мометазона, параметазон, предникарбат, преднизон, преднизолон, преднилиден, римексолон, тиксокортол, тиамцинолон, улобетазол), циклофосфамид, нитрозомочевины, цисплатин, карбоплатин, оксалиплатин, метотрексат, азатиоприн, меркаптопурин, аналоги пиримидина, ингибиторы синтеза белка, метотрексат, азатиоприн, меркаптопурин, дактиномицин, антрациклины, митомицин С, блеомицин, митрамицин, Atgam(R), Thymoglobuline®, OKT3®, базициксимаб, даклизумаб, циклоспорин, такролимус, сиролимус, интерфероны (IFN-β, IFN-γ), опиоиды, TNF-связывающие белки (инфликсимаб, этанерцепт, адалимумаб, голимумаб), микофеноловую кислоту, микофенолят мофетила, FTY720, а также перечисленные в US 7060697.
Агенты для лечения аутоиммунных заболеваний, воспалительных
заболеваний
Там, где субъект страдает или имеет риск страдания аутоиммунным заболеванием, расстройством или состоянием или воспалительным заболеванием, расстройством или состоянием, соединение формулы (I), (II), (IIA) или (IIБ) может быть введено в любой комбинации с одним или более чем одним из следующих терапевтических агентов: иммунодепрессантов (например, такролимуса, циклоспорина, рапамицина, метотрексата, циклофосфамида, азатиоприна, меркаптопурина, микрофенолята или FTY720), глюкокортикоидов (например, преднизона, ацетата кортизона, преднизолона, метилпреднизолона, дексаметазона, бетаметазона, триамцинолона, беклометазона, ацетата флудрокортизона, ацетата дезоксикортикостерона, альдостерона), нестероидных противовоспалительных лекарственных средств (например, салицилатов, арилалкановых кислот, 2-арилпропионовых кислот, N-арилантраниловых кислот, оксикамов, коксибов или сульфонанилидов), специфичных ингибиторов циклооксигеназы-2 (Сох-2) (например, валдекоксиба, эторикоксиба, люмиракоксиба, целекоксиба или рофекоксиба), лефлуномида, золото-тиоглюкозы, золото-тиомалата, аурофина, сульфасалазина, гидроксихлорхинина, миноциклина, TNF-α-связывающих белков (например, инфликсимаба, этанерцепта или адалимумаба), абатацепта, анакинры, интерферона-β, интерферона-γ, интерлейкина-2, антилейкотриенов, теофиллина или антихолинергических агентов.
В одном воплощении соединения формулы (I), (II), (IIA) или (IIБ), описанные здесь, могут быть введены в комбинации с ингибиторами NFAT-кальциневринового пути. В одном воплощении ингибиторы NFAT-кальциневринового пути включают, без ограничения, циклоспосрин A (CsA) и такролимус (FK506).
В одном воплощении соединение формулы (I), (II), (IIA) или (IIБ) или композиции и лекарственные средства, содержащие соединение формулы (I), (II), (IIA) или (IIБ), могут быть введены пациенту в комбинации с противовоспалительным агентом, включая, без ограничения, нестероидные противовоспалительные лекарственные средства (NSAID) и кортикостероиды (глюкокортикоиды).
NSAID включают, без ограничения, аспирин, салициловую кислоту, гентизиновую кислоту, салицилат холина-магния, салицилат холина, салицилат холина-магния, салицилат холина, салицилат магния, салицилат натрия, дифлунизал, карпрофен, фенопрофен, фенопрофен кальция, флуоробипрофен, ибупрофен, кетопрофен, набутон (nabutone), кеторолак, трометамин кеторолака, напроксен, оксапрозин, диклофенак, этодолак, индометацин, сулиндак, толметина, меклофенамат, меклофенамат натрия, мефенамовую кислоту, пироксикам, мелоксикам, специфичные ингибиторы СОХ-2 (такие как, без ограничения, целекоксиб, рофекоксиб, валдекоксиб, парекоксиб, эторикоксиб, люмиракоксиб, CS-502, JTE-522, L-745,337 и NS398).
Здесь рассмотрены комбинации с NSAID, представляющими собой селективные ингибиторы СОХ-2. Такие соединения включают, без ограничения, раскрытые в патенте США №5474995; патенте США №5861419; патенте США №6001843; патенте США №6020343; патенте США №5409944; патенте США №5436265; патенте США №5536752; патенте США №5550142; патенте США №5604260; патенте США №5698584; патенте США №5710140; WO 94/15932; патенте США №5344991; патенте США №5134142; патенте США №5380738; патенте США №5393790; патенте США №5466823; патенте США №5633272; патенте США №5932598 и 6313138; все включены сюда посредством ссылки.
Соединения, описанные как селективные ингибиторы СОХ-2, и, следовательно, применимые в способах или фармацевтических композициях, описанных здесь, включают, без ограничения, целекоксиб, рофекоксиб, люмиракоксиб, эторикоксиб, валдекоксиб и парекоксиб, или их фармацевтически приемлемые соли.
Кортикостероиды включают, без ограничения: бетаметазон, преднизон, альклометазон, альдостерон, амцинонид, беклометазон, бетаметазон, будесонид, циклесонид, клобетазол, клобетазон, клокортолон, клопреднол, кортизон, клотривазол, дефлазакорт, дезоксикортикостерон, десонид, дезоксиметазон, дезоксикортон, дексаметазон, дифлоразон, дифлукортолон, дифлупреднат, флуклоролон, флудрокортизон, флудроксикортид, флуметазон, флунизолид, ацетонид флуоцинолона, флуоцинонид, флуокортин, флуокортолон, фторметолон, флуперолон, флупредниден, флутиказон, формокортал, галцинонид, галометазон, гидрокортизон/кортизол, ацепонат гидрокортизона, бутепрат гидрокортизона, бутират гидрокортизона, лотепреднол, медризон, мепреднизон, метилпреднизолон, ацепонат метилпреднизолона, фуроат мометазона, параметазон, предникарбат, преднизон/преднизолон, преднилиден, римексолон, тиксокортол, тиамцинолон и улобетазол.
Другие агенты, используемые как противовоспалительные лекарственные средства, включают раскрытые в публикации патента США 2005/0227929, включенной сюда посредством ссылки.
Некоторые имеющиеся в продаже противовоспалительные лекарственные средства включают, без ограничения, Arthrotec® (диклофенак и мизопростол), Asacol® (5-аминосалициловая кислота), Salofalk® (5-аминосалициловая кислота), Auralgan® (антипирин и бензокаин), Azulfidine® (сульфасалазин), Daypro® (оксапрозин), Lodine® (этодолак), Ponstan® (мефенаминовая кислота), Solumedrol® (метилпреднизолон), Вауег® (аспирин), Bufferin® (аспирин), Indocin® (индометацин), Vioxx® (рофекоксиб), Celebrex® (целекоксиб), Bextra® (вальдекоксиб), Arcoxia® (эторикоксиб), Prexige® (люмиракоксиб), Advil®, Motrin® (ибупрофен), Voltaren® (диклофенак), Orudis® (кетопрофен), Mobic® (мелоксикам), Relafen® (набуметон), Aleve®, Naprosyn® (напроксен), Feldene® (пироксикам).
В одном воплощении соединения формулы (I), (II), (IIА) или (IIБ) вводят в комбинации с антагонистами рецепторов лейкотриенов, включая, без ограничения, BAY u9773 (см. ЕР 00791576; опубликованную 27 августа 1997 г.), DUO-LT (Tsuji et al., Org. Biomol. Chem., 1, 3139-3141, 2003), зафирлукаст (Accolate®), монтелукаст (Singulair®), пранкуласт (Onon®) и их производные или аналоги.
Наборы/продукты
Также здесь описаны наборы и продукты для применения в терапевтических применениях, описанных здесь. Такие наборы могут включать носитель, упаковку или контейнер, разделенный на ячейки для одного или более чем одного контейнера, такого как флаконы, тубы и тому подобное, каждый из которых содержит один из отдельных элементов для применения в способе, описанном здесь. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы и пробирки. Контейнеры могут быть изготовлены из множества материалов, таких как стекло или пластик.
Продукты, предложенные здесь, включают упаковочные материалы. Упаковочные материалы для использования в фармацевтических упаковочных продуктах включают, например, патенты США №№5323907, 5052558 и 5033252. Примеры фармацевтических упаковочных материалов включают, без ограничения, блистерные упаковки, бутыли, тубы, ингаляторы, насосы, сумки, флаконы, контейнеры, шприцы, бутыли и любой упаковочный материал, подходящий для выбранной фармацевтической композиции и предполагаемого способа введения и лечения. Предполагают широкий спектр композиций соединений и композиций, предложенных здесь, а также множество способов лечения для любого заболевания, расстройства или состояния, при которых будет полезным ингибирование активности CRAC-каналов.
Например, контейнер (контейнеры) может содержать одно или более чем одно соединение, описанное здесь, возможно, в композиции или в комбинации с другим агентом, как раскрыто здесь. Контейнер (контейнеры), возможно, имеет стерильное входное отверстие (например, контейнер может представлять собой сумку или флакон с раствором для внутривенного введения с пробкой, прокалываемой иглой для подкожных инъекций). Такие наборы возможно содержат соединение с идентифицирующим описанием или этикеткой, или инструкциями, относящимися к его применению в способах, описанных здесь.
Набор будет обычно включать один или более чем один дополнительный контейнер, каждый из которых содержит один или более чем один из различных материалов (таких как реагенты, возможно, в концентрированной форме, и/или устройства), желательных с коммерческой точки зрения и с точки зрения пользователя, для применения соединения, описанного здесь. Неограничивающие примеры таких материалов включают, без ограничения, буферы, разбавители, фильтры, иглы, шприцы; носитель, упаковку, контейнер, флакон и/или этикетки пробирок с перечислением содержимого, и/или инструкции по применению, и листовки-вкладыши в упаковке с инструкциями по применению. Также обычно будет включен набор инструкций.
Этикетка может быть на контейнере или может быть связана с ним. Этикетка может быть на контейнере, когда буквы, цифры и другие символы, образующие этикетку, присоединены, выпрессованы или выгравированы на самом контейнере; этикетка может быть присоединена к контейнеру, когда она присутствует в резервуаре или носителе, в котором также находится контейнер, например, в виде листовки-вкладыша в упаковке. Этикетка может быть использована для краткого обозначения того, что содержимое следует использовать для конкретного терапевтического применения. На этикетке могут также быть кратко обозначены инструкции по применению содержимого, такого как в способах, описанных здесь.
В определенных воплощениях фармацевтические композиции могут быть представлены в упаковке или диспенсерном устройстве, которое может содержать одну или более чем одну стандартную лекарственную форму, содержащую соединение, предложенное здесь. Упаковка, например, может содержать металлическую или пластиковую фольгу, как например блистерная упаковка. Упаковка или диспенсерное устройство может быть снабжено инструкциями по введению. Упаковка или диспенсер могут также быть снабжены уведомлением, связанным с контейнером, в форме, предписанной правительственным учреждением, регулирующим изготовление, применение или продажу фармацевтических средств, при этом указанное уведомление отражает разрешение указанного учреждения на форму лекарственного средства для применения у людей или в ветеринарии. Такое уведомление, например, может представлять собой маркировку, одобренную Управлением по контролю за продуктами и лекарственными средствами США для лекарственных средств, отпускаемых по рецепту, или одобренный вкладыш для продукта. Также могут быть изготовлены композиции, содержащие соединение, предложенное здесь, изготовленное в совместимом фармацевтическом носителе, и они могут быть помещены в подходящий контейнер и снабжены этикеткой для лечения указанного состояния.
Анализы
Для оценки депо-управляемого входа кальция и кальциевой сигнализации в клетках могут быть применены несколько методик. Такие методики включают, без ограничения, электрофизиологию фиксации потенциала (измерение ионов кальция и других ионов по разные стороны от клеточных мембран, таких как плазматические мембраны), измерения электроемкости (позволяют отслеживать экзоцитоз на уровне отдельных клеток), визуализация кальция с использованием флуоресцентных красителей позволяет отслеживать паттерны перемещения кальция в пределах цитоплазмы, резонансный перенос энергии флуоресценции (FRET) позволяет оценивать взаимодействия белок - белок, и молекулярно-биологические способы позволяют манипулировать уровнями экспрессии интересующих белков.
Для исследования модуляции внутриклеточного кальция соединениями формулы (I), (II), (IIA) и (IIБ) может быть использован широкий спектр способов анализа. Такие анализы включают основанные на клетках анализы in vitro, a также модели на животных in vivo. Могут быть применены любые анализы, которыми выявляют, мониторируют или измеряют эффект на внутриклеточный кальций, включая события, опосредованные входом кальция. Такие анализы включают, без ограничения, анализы, которыми мониторируют, измеряют и/или выявляют уровни внутриклеточного кальция, модуляцию уровней кальция и перемещение кальция внутрь, из или в пределах клеток и внутриклеточных органелл. Анализы могут также включать мониторинг, измерение и/или выявление событий, опосредованных входом кальция, и молекул, вовлеченных в события, опосредованные входом кальция, таких как, без ограничения, молекулы трансдукции сигналов, транскрипционные факторы, секретируемые молекулы и другие молекулы, на которые влияют изменения кальциевого гомеостаза. Анализы включают, без ограничения, описанные здесь и описанные в публикации патента США №2007/0031814 и WO 07/081804, включенных сюда посредством ссылки.
Клетки и клеточные модели
Для in vitro исследования модуляции внутриклеточного кальция соединениями формулы (I), (II), (IIA) и (IIБ) доступен широкий спектр типов клеток для таких анализов. В определенном воплощении клетка представляет собой клетку, в которой происходит депо-управляемый вход кальция, или клетку, которой можно манипулировать таким образом, чтобы в ней происходил депо-управляемый вход кальция. В определенном воплощении клетка содержит один или более белки, вовлеченные в модуляцию внутриклеточного кальция (и, в частности, вовлеченные в, участвующие в и/или обеспечивающие депо-управляемый вход кальция, перемещение кальция внутрь, из или в пределах внутриклеточной органеллы или депо кальция, модуляцию уровней кальция во внутриклеточной органелле или депо кальция (например, эндоплазматическом ретикулуме) и/или буферное действие в отношении кальция), как например предложенные здесь. В определенных воплощениях, белок (белки) включает белки STIM (включая белок STIM1, STIM2, DSTIM и CSTIM) и/или белки Orai (Orai1, Orai2, Orai3). Клетка может экспрессировать белок (белки) эндогенно или экспрессировать белок (белки) рекомбинантно.
Клетки для применения в данных способах могут иметь происхождение от любого вида. В одном воплощении клетки могут представлять собой эукариотические клетки. В одном воплощении клетки могут представлять собой клетки дрожжей, насекомых (например, Drosophila или Anopheles) или млекопитающих. Клетки млекопитающих включают, без ограничения, клетки грызуна (например, мыши, крысы и хомяка), примата, обезьяны, собаки, быка, кролика и человека. В данных способах может быть использовано множество типов клеток, включая, например, нервные клетки, клетки нервной системы, головного мозга, иммунной системы, например Т-лимфоциты и В-клетки, эмбриональные клетки, клетки крови и гемапоэтические клетки, стромальные клетки, миелоидные клетки, лимфоидные клетки и множество опухолевых и раковых клеток. Конкретные клетки включают клетки Drosophila Schneider 2 или S2, эмбриональные клетки почки человека (НЕК293), клетки базофильного лейкоза крысы (RBL-2H3), клетки Jurkat, эпителиальные клетки, клетки рабдомиосаркомы, рабдоидные клетки, клетки ретинобластомы, клетки эпендимомы, клетки нейробластомы, клетки остеосаркомы, фибробласты, стромальные клетки костного мозга, клетки эритролейкоза и лимфобластные клетки. Другие клеточные линии включают НЕК 293 и 293Т, СНО (яичник китайского хомячка) (включая СНО-К1), LTK-, N2A, H6 и HGB. Многие такие клетки и клеточные линии доступны через депозитарии клеток, такие как, например, Американская коллекция типовых культур (American Type Culture Collection (ATCC, Manassas, Va.)). Эмбриональные клетки могут быть получены выделением из тканевых источников. Получение, поддержание и применение таких клеток и клеточных линий хорошо известно.
Могут быть использованы клетки известной клеточной линии, такие как клетки нейробластомы SH-SY5Y, клетки феохромоцитомы РС12, клетки нейробластомы SK-N-BE(2)C или SK-N-SH, клетки эпендимомы человека SK-N-МС, клетки SMS-KCNR, клетки нейробластомы человека LAN-5, клетки нейробластомы человека GI-CA-N, клетки нейробластомы человека GOTO, клетки нейробластомы мыши Neuro 2a (N2A) и/или клетки нейробластомы человека IMR 32, клетки хронического миелолейкоза (например, человеческие клетки К562), клетки промиелоцитарного лейкоза (например, клетки HL60) и клетки гистиоцитарной лимфомы (например, клетки U937), клетки лимфомы Беркитта (например, клетки СА46), В-клетки (например, NALM6), клетки острого лимфобластного лейкоза (например, клетки MOLT4), Т-клетки (например, клетки Jurkat) и ранние клетки T-ALL (например, клетки DU528).
Выбор клетки для использования в анализе in vitro для исследования модуляции внутриклеточного кальция соединениями формулы (I), (II), (IIA) и (IIБ) может включать несколько условий, включая, например, конкретный белок, используемый в способе, и конкретный аспект активности модуляции внутриклеточного кальция, мониторируемый или оцениваемый в способе.
В одном воплощении модуляцию внутриклеточного кальция соединением формулы (I), (II), (IIA) и (IIБ) исследуют мониторингом или оценкой эффекта на депо-управляемый вход кальция. Клетки, обычно используемые в таких способах, демонстрируют депо-управляемый вход кальция либо естественным образом, либо посредством манипуляции клетками. Клетки, эндогенно демонстрирующие депо-управляемый вход кальция, включают некоторые возбудимые клетки и большинство невозбудимых клеток и могут быть идентифицированы с применением способов, описанных здесь и/или известных в данной области техники.
В одном воплощении может быть желательным использовать клетку, включающую компоненты сигнализации и системы посредников, которые влияют на высвобождение кальция из внутриклеточных депо. Например, клетки, включающие компоненты систем рецептор-опосредованной активации фосфолипазы С (PLC), могут быть использованы для физиологической активации (посредством образования IP3) истощения депо для облегчения мониторинга депо-управляемого входа кальция. Рецептор-опосредованная активация PLC происходит посредством определенных связующих механизмов: активации PLC-β рецепторами, связанными с G-белками (GPCR) и активации PLC-γ тирозинкиназными рецепторами и нерецепторными тирозинкиназами. Таким образом, клетки, включающие систему рецептор-опосредованной активации PLC, можно мониторировать или оценивать на предмет депо-управляемого входа кальция при активации агонистом одного или более чем одного рецептора, о котором известно, что он участвует в данной системе. (См., например, Bouron (2000) FEBS Lett 470:269-272; Millar et al. (1995) J. Exp.Biol. 198:1843-1850; Yagodin et al. (1998) Cell Calcium 23:219-228; Yagodin et al. (1999) Cell Calcium 25:429-438; и Patterson et al. (2002) Cell 111:1-20).
Оценка внутриклеточного кальция после лечения соединением формулы (I), (II), (IIA) и (IIБ) может быть проведена при множестве условий. Условия могут быть выбраны для оценки эффекта исследуемого агента на определенный аспект внутриклеточного кальция. Например, известны и могут быть использованы реагенты и условия именно для оценки депо-управляемого входа кальция, уровней кальция в цитозоле в покое, буферного действия в отношении кальция и уровней кальция во внутриклеточных органеллах, захвата кальция ими и его высвобождения из них. Уровни кальция в цитозоле в покое, уровни кальция во внутриклеточных органеллах и перемещение катионов могут быть оценены с применением любого из способов, описанных здесь или известных в данной области техники. Такие способы оценки модуляции внутриклеточного кальция включают, без ограничения, кальций-чувствительные индикаторные измерения, такие как fluo-3, mag-fura 2 и ER-напрвленный экворин, измерения на основе меченого кальция (такого как 45Ca2+) и электрофизиологические измерения. Конкретные аспекты тока ионов, которые могут быть оценены включают, без ограничения, включая снижение (включая устранение) величины тока ионов, измененные биофизические свойства тока ионов и измененные чувствительности тока к активаторам или ингибиторам процессов кальциевого тока, таких как, например, депо-управляемый вход кальция. Также доступны реагенты и условия для применения в оценке именно рецептор-опосредованного перемещения кальция и перемещения кальция, управляемого вторыми посредниками.
Оценка депо-управляемого входа кальция
В одном аспекте соединения формулы (I), (II), (IIA) и (IIБ) добавляют к клеткам в условиях, допускающих депо-управляемый вход кальция, для оценки эффектов соединений формулы (I), (II), (IIA) и (IIБ) на депо-управляемый вход кальция. Такие условия описаны здесь и известны в данной области техники.
Например, в одном способе клетки могут быть обработаны для снижения уровней кальция во внутриклеточных депо и затем проанализированы на предмет признаков притока ионов (например, кальция) в ответ на это в присутствии соединения формулы (I), (II), (IIA) и (IIБ). Методики снижения уровней кальция во внутриклеточных депо и анализа клеток на предмет признаков притока ионов (например, кальция) известны в данной области техники и описаны здесь.
В других способах для выявления или мониторинга токов через депо-управляемые каналы (например, ISOC, ICRAC) в присутствии соединения формулы (I), (II), (IIA) и (IIБ) могут быть применен электрофизиологический анализ токов через участок плазматической мембраны, отделенной от клетки, или мембранной везикулы с нормальным расположением липидных слоев.
Оценка событий, опосредованных входом кальция
Известно несколько молекул, вовлеченных в регулируемые кальцием метаболические пути. Оценка молекул, вовлеченных в события, опосредованные входом кальция, может быть применена для мониторинга внутриклеточного кальция и может быть применена, например, в скрининговых анализах, описанных здесь, для мониторинга эффектов соединений формулы (I), (II), (IIA) и (IIБ). Примеры анализов включают, без ограничения, анализы, которыми выявляют, определяют присутствие, уровни, изменения уровней, образование, изменение (такое как фосфорилирование и дефосфорилирование), перемещения, деградации и активности молекул, вовлеченных в события, опосредованные входом кальция (см., например, Trevillyan et al. (2001) J. Biol. Chem. 276:48118-26). Анализы, описанные здесь, могут быть применены с клетками, которые были обработаны или контактировали с соединением формулы (I), (II), (IIA) и (IIБ), или экспрессирующими измененное количество исследуемой молекулы (такой как белок, вовлеченный в регуляцию кальция, включая белок STIM, белок Orai), или с контрольными клетками. Анализы можно также проводить с клетками, которые были стимулированы физиологическим или нефизиологическим активатором, или в нестимулированных клетках. Далее описаны репрезентативные анализы для молекул, вовлеченных в события, опосредованные входом кальция, и подразумевают, что это лишь примеры. В любом способе скрининга и/или модуляции, описанном здесь, могут также быть применены другие анализы для этих молекул и анализы для других молекул, вовлеченных в события, опосредованные входом кальция.
Высвобождение β-гексозаминидазы
В тучных клетках приток Са2+ приводит к дегрануляции и высвобождению медиаторов воспаления, таких как гепарин, гистамин и ферменты, такие как β-гексозаминидаза. Выявление и/или измерение высвобождения таких молекул может, таким образом, быть использовано для мониторинга внутриклеточного кальция. Например, среда от тучных клеток может быть собрана. Затем может быть добавлен подходящий субстрат для β-гексозаминидазы (например, п-нитрофенилацетилглюкозамид), и оптическая плотность полученной смеси может быть оценена для измерения относительного значения активности β-гексозаминидазы в образцах (Funaba et al. (2003) Cell Biol. International 27:879-85).
Кальций/кальмодулин-зависимая фосфатазная активность CaN
Фосфатаза кальциневрин (CaN) дефосфорилирует различные белки, влияя на их активность и локализацию. Активность CaN может быть оценена инкубацией очищенного CaN и субстрата CaN, например, радиоактивно меченного пептида, соответствующего последовательности субъединицы RII, зависимой от циклического аденозинмонофосфата (сАМР-зависимой) киназы, либо с соединением формулы (I), (II), (IIA) и (IIБ), либо без него (см., Trevillyan et al. (2001) J. Biol. Chem 276:48118-26). Уровень радиоактивно меченного пептида и/или количество высвобождаемого свободного неорганического фосфата могут быть измерены для оценки дефосфорилирующей активности CaN.
Транскрипционная активность NFAT
Транскрипционный фактор NFAT (ядерный фактор активированных Т-клеток) регулирует несколько генов в ответ на уровни внутриклеточного кальция. Например, белки NFAT регулируют транскрипцию генов цитокинов, вовлеченных в иммунный ответ. Промоторы от генов, регулируемых NFAT, и/или регуляторные области и элементы от этих генов могут быть использованы для мониторинга экспрессии, регулируемой NFAT, и, посредством этого, мониторинга внутриклеточного кальция. Могут быть конструированы слитые конструкции репортерного гена и промоторов, регулируемых NFAT, или элементов, регулируемых NFAT, функционально связанных с репортерным геном, таким как люцифераза, β-галактозидаза, зеленый флуоресцентный белок (GFP) или любой другой репортер, известный в данной области техники (см., например, опубликованную заявку на патент США №2002-0034728). Количество или активность репортерного белка является мерой активности NFAT.
Фосфорилирование NFAT
Регуляция активации NFAT происходит посредством, главным образом, его фосфорилирования, которое, в свою очередь, регулирует его субклеточную локализацию. В нестимулированных клетках NFAT представляет собой гиперфосфорилированный цитозольный белок. Повышение внутриклеточного Ca2+, индуцируемое множеством механизмов, повышает активность Са2+-кальмодулин-зависимой фосфатазы кальциневрина. Активированный кальциневрин дефосфорилирует несколько сериновых остатков в регуляторной области молекулы NFAT. Рефосфорилирование NFAT происходит в ответ на снижение уровней Са2+ или ингибирование CaN.
Состояние фосфорилирования NFAT можно мониторировать, например, экспрессией в клетках снабженного выявляемой меткой белка NFAT, такого как His6-меченый NFAT. Меченый NFAT может быть очищен из клеток с применением хроматографии с Ni2+ и подвержен электрофорезу в геле и окрашиванию или вестерн-блоттингу. Формы NFAT с большей степенью фосфорилирования можно отличить по их более медленному движению. Состояние фосфорилирования NFAT может быть использовано как мера активации NFAT (см., Trevillyan et al. (2001) J. Biol. Chem 276:48118-26).
Ядерная локализация NFAT
Локализацию NFAT между цитоплазмой и ядром регулирует состояние фосфорилирования NFAT. Фосфорилирование NFAT предотвращает ядерную локализацию, маскируя последовательность ядерной локализации. Ядерную локализацию NFAT можно мониторировать, например, экспрессией в клетках флуоресцентно меченного NFAT, например GFP-NFAT. Для мониторинга ядерной локализации меченого NFAT может быть применена конфокальная микроскопия (см., Trevillyan et al. (2001) J. Biol. Chem 276:48118-26).
Секреция цитокинов
Секрецию цитокинов, как например секрецию IL-2, можно мониторировать с применением анализа выявления белков. Например, может быть собран супернатант от иммунокомпетентных клеток. Твердофазный иммуноферментный анализ (ELISA) или другой подходящий формат с антителами к IL-2 может быть применен для выявления и/или измерения количества секретируемого IL-2 по сравнению с контрольными клетками. Секреция других цитокинов, например, TNF-α, может также быть определена в сходных анализах.
Экспрессия цитокинов
Экспрессия цитокинов, таких как, без ограничения, IL-2, в клетках может быть оценена либо прямыми, либо непрямыми способами. Например, в непрямых способах промотор IL-2 может быть функционально связан с репортерным геном, таким как люцифераза или β-галактозидаза, и репортерная конструкция может быть введена в клетки. Экспрессию репортерного гена можно мониторировать и сравнивать с экспрессией гена в контрольных клетках (см. Trevillyan et al. (2001) J. Biol. Chem 276:48118-26). Альтернативно, можно оценивать экспрессию мРНК или белка эндогенного или рекомбинантного IL-2.
Пролиферация Т-клеток
Такие цитокины, как IL-2, необходимы для пролиферации Т-клеток в ответ на митогенную или аллоантигенную стимуляцию, и, таким образом, изменения экспрессии или секреции цитокинов приводят к изменению пролиферации Т-клеток. Т-клетки могут быть индуцированы, как например конканавалином А или аллореактивными лимфоцитами, и пролиферация Т-клеток может быть измерена, например, подвергая клетки импульсу 3H-тимидина и измерением включения 3H-тимидина (см. Trevillyan et al. (2001) J. Biol. Chem 276:48118-26).
Модуляция (например, ингибирование или снижение) SOCE соединениями формулы (I), (II), (IIA) и (IIБ) может быть определена оценкой любого из следующих критериев:
а) присутствует прямое ингибирование повышенной [Ca2+]i, как измерено индикатором кальция;
б) присутствует прямое ингибирование ISOC или ICRAC, как измерено методом фиксации потенциала;
в) присутствует ингибирование последующих сигнальных функций, таких как активность кальциневрина, субклеточная локализация NFAT, фосфорилирование NFAT и/или продукция цитокинов, например IL-2; или
г) присутствуют изменения вызванной активацией пролиферации, дифференцировки клеток и/или сигнальных путей апоптоза.
Модели на животных
Модели на животных, которые могут быть использованы в воплощениях способов, дополнительно включают таких животных, как, без ограничения, животные, не являющиеся людьми, которые имеют, по меньшей мере в некоторых из их клеток, изменение или дефект, или аберрантное функционирование клеточного процесса, основанного или регулируемого внутриклеточным кальцием. Клеточные процессы, основанные или регулируемые внутриклеточным кальцием, включают, например, активацию клеток, экспрессию генов, миграцию клеток и апоптоз. Заболевания/расстройства, которые могут быть по меньшей мере частично компенсированы модуляцией внутриклеточного кальция, включают, без ограничения, аутоиммунные расстройства, включая ревматоидный артрит, воспалительное заболевание кишечника, синдром Шегрена (цитокины, ассоциированные с инвазией лимфоцитов в эпителиальные клетки слюнных желез, способны снижать мобилизацию кальция в клетках околоушной слюнной железы; также активация Т-клеток, включая активацию транскрипционных факторов, экспрессию генов цитокинов и пролиферацию клеток, зависит от длительного повышения уровня внутриклеточного кальция, обеспечиваемого депо-управляемым входом кальция), астму (депо-управляемый вход кальция может играть важную роль в опосредовании сокращения и пролиферации гладкомышечных клеток бронхов), гломерулонефрит и воспаление почечных клубочков (изменения внутриклеточного кальция, как например обусловленные депо-управляемым входом кальция, являются сигналом для адгезии моноцитов в совместной культуральной модели воспаления почечных клубочков).
Типы моделей на животных включают, без ограничения, животных, не являющихся людьми, таких как беспозвоночные и позвоночные, не являющиеся людьми, и млекопитающие, не являющиеся людьми, грызуны (например, мыши, крыса и хомяк), коровы, курицы, свиньи, козы, собаки, овцы, насекомые, Drosophila, нематоды, черви, С.elegans, обезьяны, гориллы и другие приматы.
Модели на животных включают трансгенных и нетрансгенных животных. Одним примером такой модели на животных, которая может быть использована в определенных воплощениях способов, является модель гиперреактивности дыхательных путей (AHR), характерного признака астмы, на грызунах. Эту модель можно получить, например, сенсибилизацией посредством иммунизации овальбумином с последующим воздействием аэрозолем овальбумина и провокацией холинергической стимуляцией (например, введением метахолина или ацетилхолина) (см., например, Xu et al. (2002) J. Appl. Physiol. 93:1833-1840; Humbles et al. (2002) Proc. Natl. Acad. Sci. 99:1479-1484). Гиперреактивность дыхательных путей (которая может быть оценена с применением способов, известных в данной области техники, например, с применением барометрической плетизмографии для записи кривых дыхательного давления и измерением легочных параметров, таких как проводимость легких и податливость легких) может быть оценена и сопоставлена у животных, получавших лечение и не получавших лечение соединением формулы (I), (II), (IIA) и (IIБ). Другим примером модели на животных, которая может быть использована в определенных воплощениях способов, является модель мезангиопролиферативного гломерулонефрита на грызунах, которая может быть получена, например, введением антитела против Thy1.1 (см., например, Jefferson and Johnson (1999) J. Nephrol. 12:297-307). Любое число параметров, указывающих на гломерулонефрит и почечную дисфункцию (например, пролиферация мезангиальных клеток, артериальное давление, выведение белка с мочой, клиренс креатинина, индекс гломерулосклероза и другие параметры) могут быть оценены и сопоставлены у животных, получавших лечение и не получавших лечение исследуемым агентом. Мышь с диабетом без ожирения (NOD), инбредная линия мышей, у которых спонтанно развивается аутоиммунный диабет, имеющий много сходных иммуногенетических признаков с сахарным диабетом 1 типа, является другим примером модели на животных, которая может быть использована в определенном воплощении способов. У этих мышей также манифестируют многие признаки аутоиммунной экзокринопатии (такой как синдром Шегрена), включающей снижение секреторной функции экзокринной ткани (см., например, Humphreys-Beher and Peck (1999) Arch. Oral Biol. 44 Suppl 1:S21-25 and Brayer et al. (2000) J. Rheumatol. 27:1896-1904). Признаки, относящиеся к синдрому Шегрена (например, лимфоцитарные инфильтраты в экзокринных железах (например, слюнных и слезных железах), присутствие дендритных клеток и макрофагов в поднижнечелюстных слюнных железах, отсутствие различий при измерении базальной и стимулированной секреции слезы слезными железами, скорости тока слюны и активность амилазы) могут быть оценены и сопоставлены у животных, получавших лечение и не получавших лечение соединением формулы (I), (II), (IIA) и (IIБ). В определенных воплощениях способов может также быть использована модель аутоиммунного заболевания на животных (например, на грызунах). Такие животные включают крысиные модели, доступные через National Institutes of Health (NIH) Autoimmune Rat Model Repository and Development Center (Bethesda, Md.; доступный на www.ors.od.nih.gov/dirs/vrp/ratcenter). Одна крысиная модель ревматоидного артрита (RA) и родственных хронических/воспалительных аутоиммунных заболеваний представляет собой модель коллаген-индуцированного артрита (CIA) (см., например, Griffiths and Remmers (2001) Immunol. Rev. 184:172-183). Типичные фенотипы аутоиммунного заболевания (например, измененные уровни иммунной реактивности в отношении собственных антигенов, хроническое воспаление экспрессирующих аутоантигены органов-мишеней и активация и участие инфильтрирующих мононуклеарных клеток и тканевых фибробластов в повреждении органа) могут быть оценены и сопоставлены у животных, получавших лечение и не получавших лечение соединением формулы (I), (II), (IIA) и (IIБ). В определенном воплощении способов может также быть использована модель невропатической или воспалительной боли на животных (например, на грызунах). Например, одна крысиная модель невропатической боли включает развитие тактильной аллодинии (слишком сильного ответа на безвредные в других обстоятельствах стимулы) после перевязки поясничных спинномозговых нервов (см., например, Chaplan et al. (1994) J. Neurosci. Methods 53:55-63 и Luo et al. (2001) J. Neurosci. 21:1868-1875). Тактильная аллодиния, один из характерных признаков невропатической боли, может быть оценена (например, оценкой порога отдергивания лапы в ответ на приложение давления) и сопоставлена у животных, получавших лечение и не получавших лечение соединением формулы (I), (II), (IIA) и (IIБ).
ПРИМЕРЫ
Данные примеры приведены исключительно в иллюстративных целях и без ограничения объема формулы изобретения, представленной здесь. Исходные вещества и реагенты, использованные для синтеза соединений, описанных здесь, могут быть синтезированы или могут быть приобретены из коммерческих источников, таких как, без ограничения, Sigma-Aldrich, Acros Organics, Fluka и Fischer Scientific.
Пример 1: 2-(4-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновая кислота (соединение 1)
Элементарную серу (10 ммоль), этилцианоацетат (10 ммоль) и п-бромацетофенон (10 ммоль), этанол (2 мл) и морфолин (2 мл) смешивают друг с другом и перемешивают при комнатной температуре в течение приблизительно 20 часов. Реакционную смесь вливают в 20 мл метиленхлорида и 25 мл соляного раствора. Слои разделяют и водный слой экстрагируют 2× 15 мл метиленхлорида. Органические слои объединяют, сушат над безводным сульфатом натрия, фильтруют и концентрируют досуха. Остаток очищают флеш-хроматографией с получением этил-2-амино-4-(4-бромфенил)-тиофен-3-карбоксилата. Этил-2-амино-4-(4-бромфенил)-тиофен-3-карбоксилат (5 ммоль) обрабатывают 4-фторбензоилхлоридом (5 ммоль) в THF (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 10 часов. Реакционную смесь разбавляют 1 н. NaOH (10 мл) и этилацетатом (15 мл). Слои разделяют и органический слой сушат безводным сульфатом натрия, фильтруют и концентрируют. Остаток очищают флеш-хроматографией с получением этил-2-(4-фторбензамидо)-4-(бромфенил)тиофен-3-карбоксилата. Этил-2-(фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоксилат гидролизуют при множестве условий (например, LiOH, вода или LiOH, H2O2, вода; или NaOH, вода) с получением 2-(4-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты.
Пример 2: 2-(4-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновая кислота (соединение 2)
Этилцианоацетат (5 ммоль) и п-хлорацетофенон (5 ммоль) растворяют в толуоле (5 мл). Добавляют морфолин (5 ммоль), затем добавляют активированные молекулярные сита (4 Å). Реакционную смесь перемешивают при 80°С в течение 12 часов. Реакционную смесь охлаждают до комнатной температуры, фильтруют и концентрируют. Остаток растворяют в толуоле (5 мл) и этаноле (5 мл) и добавляют серу (0,16 г; 5 ммоль). Реакционную смесь нагревают при 70°С в течение 12 часов при перемешивании. Реакционную смесь охлаждают до комнатной температуры, и выпаривают растворители. Остаток очищают посредством HPLC с получением этил-2-амино-4-(4-хлорфенил)-тиофен-3-карбоксилата. Этил-2-амино-4-(4-хлорфенил)-тиофен-3-карбоксилат (5 ммоль) обрабатывают 4-фторбензоилхлоридом (5 ммоль) в THF (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 10 часов. Реакционную смесь разбавляют 1 н. NaOH (10 мл) и этилацетатом (15 мл). Слои разделяют, органический слой сушат безводным сульфатом натрия, фильтруют и концентрируют. Остаток очищают флеш-хроматографией с получением этил-2-(4-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоксилата. Этил-2-(фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоксилат гидролизуют при множестве условий (например, LiOH, вода; LiOH, H2O2, вода; или NaOH, вода) с получением 2-(4-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты.
Следуя способам, описанным в Примере 1 и Примере 2, получают следующие соединения:
2-(4-фторбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(4-фторбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновую кислоту; 2-(4-фторбензамидо)-4-(2-бромфенил)тиофен-3-карбоновую кислоту; 2-(4-фторбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновую кислоту; 2-(4-фторбензамидо)-4-(2-хлорфенил)тиофен-3-карбоновую кислоту; 2-(4-фторбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(4-фторбензамидо)-4-(фенил)тиофен-3-карбоновую кислоту; 2-(4-фторбензамидо)-4-(4-метилфенил)тиофен-3-карбоновую кислоту; 2-(3-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(4-бромфенил)тиофен-3-карбоновую кислоту; 2-(4-йодбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(бензотиен-2-иламидо)-4-(4-бромфенил)тиофен-3-карбоновую кислоту; 2-(3-метилбензамидо)-4-(4-бромфенил)тиофен-3-карбоновую кислоту; 2-(4-бромбензамидо)-4-(4-метилфенил)тиофен-3-карбоновую кислоту; 2-(4-бромбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновую кислоту; 2-(4-бромбензамидо)-4-(4-бромфенил)тиофен-3-карбоновую кислоту; 2-(4-бромбензамидо)-4-(3,5-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(4-бромбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновую кислоту; 2-(4-бромбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновую кислоту; 2-(4-бромбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновую кислоту; 2-(4-бромбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(4-бромбензамидо)-4-(2-бромфенил)тиофен-3-карбоновую кислоту; 2-(3-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновую кислоту; 2-(3-фторбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(3-фторбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновую кислоту; 2-(3-фторбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновую кислоту; 2-(3-фторбензамидо)-4-(4-метилфенил)тиофен-3-карбоновую кислоту; 2-(3-фторбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(3-фторбензамидо)-4-(2-бромфенил)тиофен-3-карбоновую кислоту; 2-(3-фторбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(4-метилфенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(4-фторфенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(фенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(2-бромфенил)тиофен-3-карбоновую кислоту; 2-(4-хлорбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновую кислоту; 2-(бензотиен-2-иламидо)-4-(4-хлорфенил)тиофен-3-карбоновую кислоту; 2-(бензотиен-2-иламидо)-4-(4-метилфенил)тиофен-3-карбоновую кислоту; 2-(бензотиен-2-иламидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(бензотиен-2-иламидо)-4-(3-хлорфенил)тиофен-3-карбоновую кислоту; 2-(бензотиен-2-иламидо)-4-(4-трифторметилфенил)тиофен-3-карбоновую кислоту; 2-(бензотиен-2-иламидо)-4-(2-бромфенил)тиофен-3-карбоновую кислоту; 2-(бензотиен-2-иламидо)-4-(3,4-диметилфенил)тиофен-3-карбоновую кислоту; 2-(3-метилбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновую кислоту; 2-(3-метилбензамидо)-4-(4-метилфенил)тиофен-3-карбоновую кислоту; 2-(3-метилбензамидо)-4-(фенил)тиофен-3-карбоновую кислоту; 2-(3-метилбензамидо)-4-(2-бромфенил)тиофен-3-карбоновую кислоту; 2-(3-метилбензамидо)-4-(4-фторфенил)тиофен-3-карбоновую кислоту; 2-(3-метилбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновую кислоту; 2-(3-метилбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновую кислоту; 2-(3-метилбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновую кислоту; 2-(3-метилбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновую кислоту; метил-2-(4-хлорбензамидо)-4-(4-
фторфенил)тиофен-3-карбоксилат; этил-2-(4-хлорбензамидо)-4-(4-фторфенил)тиофен-3-карбоксилат; 2-(4-йодбензамидо)-4-(4-бромфенил)тиофен-3-карбоновую кислоту; 4-(2,4-дихлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновую кислоту; 4-(3,4-дихлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновую кислоту; 4-(3,5-дихлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновую кислоту; 4-(4-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновую кислоту; 4-(3-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновую кислоту; 4-(2-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновую кислоту; 4-(4-бромфенил)-2-(2-хлор-4-фторбензамидо)тиофен-3-карбоновую кислоту; 4-(4-бромфенил)-2-(3,4-дифторбензамидо)тиофен-3-карбоновую кислоту; 2-(2-хлор-4-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновую кислоту; 4-(4-бромфенил)-2-(2-фторбензамидо)тиофен-3-карбоновую кислоту; 4-(4-бромфенил)-2-(3-фтор-4-метоксибензамидо)тиофен-3-карбоновую кислоту; 4-(4-хлорфенил)-2-(4-метилбензамидо)тиофен-3-карбоновую кислоту; 4-(4-бромфенил)-2-(4-цианобензамидо)тиофен-3-карбоновую кислоту; 4-(4-хлорфенил)-2-(4-этилбензамидо)тиофен-3-карбоновую кислоту; 4-(4-хлорфенил)-2-(4-(трифторметил)бензамидо)тиофен-3-карбоновую кислоту; 4-(4-хлорфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновую кислоту; 4-(4-бромфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновую кислоту; 4-(4-хлорфенил)-
2-(3-(2,4-дифторфенил)пропанамидо)тиофен-3-карбоновую кислоту; 4-(4-бромфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновую кислоту; 4-(4-бромфенил)-2-(3-(4-фторфенил)пропанамидо)тиофен-3-карбоновую кислоту; 4-(4-хлорфенил)-2-(3-(3,4-дифторфенил)пропанамидо)тиофен-3-карбоновую кислоту; 4-(4-бромфенил)-2-(3-(2,4-дифторфенил)пропанамидо)тиофен-3-карбоновую кислоту; 4-(4-бромфенил)-2-(3-(3,4-дифторфенил)пропанамидо)тиофен-3-карбоновую кислоту; 4-(4-хлорфенил)-2-(3-(4-фторфенил)пропанамидо)тиофен-3-карбоновую кислоту; 4-(4-хлорфенил)-2-(3-(3-хлорфенил)пропанамидо)тиофен-3-карбоновую кислоту; и 4-(4-хлорфенил)-2-(3-(4-хлорфенил)пропанамидо)тиофен-3-карбоновую кислоту.
Биологические примеры
In vitro примеры
Пример 3: In vitro скрининг на агенты, модулирующие уровень внутриклеточного кальция
Для скрининга соединений, описанных здесь, таких как соединения формулы (I) и формулы (II), модулирующих внутриклеточный кальций, использовали анализы, основанные на флуоресценции.
А. Протокол анализа
В клетки RBL-2H3, высеянные на 384-луночные планшеты, в течение 45 минут нагружали FLUO-4-AM (конечная концентрация 2 мкМ) в HBSS. Клетки промывали и помещали в номинально свободный от Са2+ и Mg2+ раствор Хенкса. Через одну минуту добавляли исследуемый агент или наполнитель. После периода инкубации продолжительностью 15 минут добавляли 1 мкМ тапсигаргина (Tg) для ингибирования ER Са2+-насоса и разгрузки внутриклеточных депо Са2+. Через 15 минут после добавления Tg депо-управляемый вход кальция инициировали добавлением экзогенного Са2+ до конечной концентрации 1,8 мМ и за клетками наблюдали в течение еще 10-15 минут. Мониторинг уровней кальция проводили на всем протяжении анализа с использованием FLIPR384 (устройства для прочтения планшетов Molecular Devices с флуориметрической визуализацией для высокопроизводительного скрининга).
В альтернативном способе скринингового анализа через одну минуту после отмывки FLUO-4-AM, к клеткам SH-SY5Y добавляли 1 мкМ Tg. Через пятнадцать минут после добавления Tg добавляли исследуемое соединение или носитель, затем проводили еще одну инкубацию в течение 15 минут в буфере, свободном от Ca2+. Затем инициировали депо-управляемый вход кальция добавлением экзогенного Ca2+ до конечной концентрации 1,8 мМ и проводили мониторинг ответа на протяжении еще 10-15 минут.
Сходный способ скринингового анализа использовали с клетками НЕК293 и RBL-2H3.
Альтернативно, в способе скринингового анализа можно использовать экзогенный Ва2+ (конечная концентрация 10 мМ) вместо экзогенного Ca2+. В этом случае тапсигаргин-индуцированный депо-управляемый вход Ва2+ заменяет депо-управляемый вход Ca2+.
Б. Анализ данных
Данные по кинетике, полученные с использованием FLIPR384, анализировали и затем хранили в реляционной базе данных (ActivityBase; IDBS). Затем вычисляли десять количественных параметров, определяющих различные аспекты ответа депо-управляемого входа кальция. Эти параметры представляют собой следующие.
Среднее исходное значение: исходные показатели флуоресценции (относительные единицы флуоресценции, RFU), усредненные за 30 секунд до добавления Ca2+ для инициации депо-управляемого входа кальция.
Угловой коэффициент подъема: линейная регрессия повышения RFU со 2 по 30 секунду после добавления Ca2+.
Константа скорости повышения (Up К): константа скорости, полученная от ассоциации первого порядка RFU от 2 секунд до максимального ответа.
Пик: максимальная RFU (одна точка), достигнутая после добавления Ca2+.
Время до пика: время достижения пика RFU.
Пик/исходное: разность пика и средней исходной RFU.
Угловой коэффициент затухания: линейная регрессия уменьшения RFU от пика до конца периода измерения.
Константа скорости затухания (Decay К): константа скорости, полученная от затухания первого порядка RFU от пика до конца периода измерения.
Площадь под кривой (AUC): площадь под кривой от добавления Са2+ конца периода измерения.
Комбинации этих параметров использовали для описания соединений формулы (I). Соединения повторно исследовали в идентичных условиях для подтверждения их активности. Соединения с подтвержденной активностью затем анализировали на предмет зависимых от концентрации эффектов и затем соединения, демонстрирующие зависимые от концентрации эффекты, классифицировали как соединения, модулирующие внутриклеточный кальций.

Пример 4: Эффекты агентов, модулирующих внутриклеточный кальций, на дегрануляцию и высвобождение цитокинов в клетках RBL-2H3 in vitro
Для оценки дегрануляции и высвобождения цитокинов клетки RBL-2H3 высевали и стимулировали 20 нМ тапсигаргина/20 нМ тетрадеканоилфорболацетата (ТРА) в течение 20 часов в присутствии или в отсутствие соединения формулы (I) или формулы (II). Среду собирали и анализировали на высвобождение β-гексозаминидазы или на высвобождение медиатора воспаления цитокина TNF-α. Анализ фермента β-гексозаминидазы осуществляли путем добавления 200 мкл 1 мМ п-нитрофенилацетилглюкозамидного субстрата (Sigma #N9376) в 0,05 М цитрате Na (pH 4,5) к 50 мкл кондиционированной среды, инкубации в течение 60 минут при 37°С, с последующим добавлением 500 мкл 0,05 М карбоната Na, 0,05 М бикарбоната Na, pH 10,5, тщательного перемешивания и считывания оптической плотности при 405 нм в спектрофотометре для прочтения планшетов BioRad. Анализ высвобождения TNF-α проводили с использованием набора для ELISA Rat Tumor Necrosis Factor-α Ultrasensitive ELISA Kit от BioSource.
Результаты этих анализов показаны на Фиг.3 и 4.
Пример 5: Модуляция внутриклеточного кальция ингибитором SOCE в клетках, сверхэкспрессирующих STIM1
Депо-управляемый вход кальция чувствителен к ингибитору 2-аминоэтоксидифенилборату (2-АРВ). Для исследования того, является ли метаболический путь входа Са2+, активируемый сверхэкспрессией STIM1, фармакологически сходным с эндогенным SOCE, клетки HEK[STIM1] предварительно инкубировали с возрастающими дозами 2-АРВ и измеряли STIMI-зависимый вход Ca2+. Опосредованное тапсигаргином истощение депо как контрольных клеток HEK-Zeo, так и клеток HEK[STIM1], с последующим повторным добавлением экзогенного кальция приводило к ингибированию посредством 2-АРВ со сходными значениями IC50, составлявшими 11,8 мкМ и 10,5 мкМ, соответственно. Обработка клеток HEK[STIM1] 2-АРВ и исследование входа кальция в отсутствие Tg-зависимого истощения депо приводило к двухфазному эффекту 2-АРВ на вход кальция (Фиг.13). Вход кальция в данном случае индуцировали предварительной обработкой клеток в свободном от Ca2+ буфере и этот вход Ca2+ ингибировали со значением IC50, составлявшим 10,8 мкМ, сходным с IC50, о котором было сообщено для эндогенного SOCE в клетках НЕК293. Тем не менее, при более низких концентрациях 2-АРВ происходило потенцирование входа кальция. Способность как потенцировать, так и ингибировать вход кальция является свойством 2-АРВ, существование которого было показано ранее с использованием кальциевых каналов, активируемых высвобождением кальция (CRAC-каналов).
Использование соединения 1 вместо 2-АРВ приводило к зависимому от концентрации ингибированию STIM1-зависимого входа Ca2+ (см. Фиг.13).
Таким образом, сверхэкспрессия STIM1 в клетках НЕК293 придает CRAC-подобное свойство входу Ca2+ в клетках НЕК293, индуцируемому воздействием на клетки свободным от Ca2+ буфером без необходимости в истощении депо тапсигаргином. Соответственно, анализы для идентификации агентов, модулирующих внутриклеточный кальций, могут возможно быть проведены в клетках, сверхэкспрессирующих STIM1, без использования стандартных протоколов истощения внутриклеточного кальция.
Пример 6: Эффекты агентов, модулирующих внутриклеточный кальций, на секрецию IL-2 Т-клетками Jurkat in vitro
Для измерения секреции IL-2 Т-клетками Jurkat клетки высевали на 96-луночный планшет с плотностью 1,5×105 клеток на лунку. Клетки стимулировали 2,5 мкг/мл фитогемагглютинина (РНА) лектина + 80 нМ ТРА в течение 20 часов в присутствии или в отсутствие соединения формулы (I) или формулы (II). Среду затем собирали и анализировали на уровни IL-2 посредством ELISA (BioSource) согласно протоколам изготовителя.
Результаты анализа показаны на Фиг.7 и 10.
Пример 6А: Эффекты агентов на клонированные кальциевые каналы L-типа в клетках СНО in vitro
Приготавливали исходные растворы соединения А в диметилсульфоксиде (DMSO) и хранили их замороженными. Свежие концентрации соединения А приготавливали ежедневно разведением исходных растворов в подходящем забуференном HEPES физиологическом растворе. Препарат каждого исследуемого соединения обрабатывали ультразвуком при комнатной температуре в течение по меньшей мере 20 минут для облегчения растворения. В эмалированный 96-луночный планшет для соединений вносили подходящие количества исследуемого и контрольного растворов и помещали в лунку планшета PatchXpress®. Оценивали эффекты пяти концентраций. Приготавливали и замораживали партии исходных растворов положительных контролей. Свежую концентрацию положительного контроля приготавливали ежедневно разведением исходных растворов в HB-PS. Конечная концентрация DMSO составляла 0,3%.
Клетки содержали в инкубаторах для тканевых культур ChanTest SOP. Клетки СНО стабильно трансфицировали комплементарной ДНК (кДНК) подходящего ионного канала. Клетки культивировали в среде Ham's F-12, дополненной 10% фетальной бычьей сыворотки, 100 Ед/мл натриевой соли пенициллина G, 100 мкг/мл сульфата стрептомицина и подходящими антибиотиками для селекции. Клетки в культуральных чашках дважды промывали сбалансированным солевым раствором Хенкса, обрабатывали трипсином и ресуспендировали в культуральных средах перед исследованием. Пять концентраций каждого исследуемого соединения А наносили на интактные клетки с пятиминутными интервалами. Продолжительность воздействия каждым исследуемым соединением составляла приблизительно пять минут.
При приготовлении к сессии записи внутриклеточный раствор вносили во внутриклеточные компартменты плоского электрода. После установления конфигурации всей клетки мембранные токи записывали с применением двухканального амплификатора с фиксацией потенциалов в системе PatchXpress®. Достоверные записи целых клеток удовлетворяли следующим критериям: 1) мембранное сопротивление (Rm)≥МОм; 2) ток утечки ≤25% тока через каналы. Начало и стабильную блокаду hCav.1.2/β2/α2δ-каналов измеряли с использованием стимулирующего паттерна потенциала, состоящего из деполяризующего тестового импульса с интервалами продолжительностью 10 секунд от потенциала покоя, составлявшего -80 мВ. Концентрации исследуемых соединений наносили накопительным образом в порядке возрастания без отмывки между нанесениями. Измеряли максимальный ток во время стадии к 10 мВ. В конце каждого эксперимента добавляли насыщающую концентрацию нифедипина (10 мкМ) для блокады hCav1.2-тока. Данные хранили в компьютерной сети ChanTest для анализа. Стационарное состояние определяли как ограничивающую постоянную скорость изменения со временем. Стационарное состояние до и после нанесения исследуемого соединения использовали для вычисления процента тока, ингибированного при каждой концентрации.
In vivo примеры
Пример 7: Дозозависимые эффекты соединения 1, соединения 2, циклоспорина A (CSA) или рапамицина при гиперчувствительности замедленного типа (DTH) на подушечках лап мыши
Задача: определение дозозависимых эффектов исследуемого соединения на индуцированный метилированным бычьим сывороточным альбумином (mBSA) DTH-ответ в подушечках лап при введении в течение фазы сенсибилизации, а также фазы индукции.
Животные: 61 самец мышей Swiss Webster массой приблизительно 20-25 грамм в начале исследования.
Материалы: метилированный BSA (Sigma), полный адъювант Фрейнда (Difco) и добавочный Н37 RA M. tuberculosis (Difco).
Общий план исследования
Мышей анестезировали изофлураном и производили внутрикожные инъекции антигена в дозе 0,1 мл в основание хвоста (0 сутки (D0), 7 сутки (D07)). Антиген приготавливают, получая раствор с концентрацией 4 мг/мл в стерильной воде. Равные объемы антигена и полного адъюванта Фрейнда, к которым добавлены M. tuberculosis (MTB) в концентрации 4 мг/мл (воздействие ультразвуком в течение 5 минут после добавления MTB в масло), эмульгируют ручным перемешиванием до тех пор, пока шарик этого материала не будет сохранять свою форму при погружении в воду. Введение исследуемого соединения начинают на 0 сутки ежедневно (с интервалами продолжительностью 24 часа) и продолжают до суток 10, когда проводят провокацию.
На 10 сутки в подушечку правой задней лапы животных инъецируют 20 мкл 10 мг/мл mBSA. Пятерым несенсибилизированным самцам инъецируют mBSA в подушечки лап. Через двадцать четыре часа (на 11 сутки) правую и левую задние лапы рассекают у медиальной и латеральной лодыжек и взвешивают, и определяют разницу в массе, обусловленную инъекцией антигена.
Статистический анализ. Массы лап (среднее ± стандартная ошибка (SE)) для каждой группы анализировали на предмет различий с применением t-критерия Стьюдента или дисперсионного анализа (ANOVA) с последующей проверкой критерием Даннетта. Статистическая значимость составляла р≤0,05.
Протокол исследования DTH у мышей
Результаты для соединения 1 представлены на Фиг.12.
Результаты для соединения 2 представлены на Фиг.21.
Пример 7А: Фармакокинетические данные соединения 1 и соединения 2 у крыс
Биодоступность и фармакокинетические свойства соединения 1, вводимого перорально в наполнителе, представляющем собой 70% PEG400/30% H2O, в плазме крыс. Две группы введения: 1) группа внутривенного (в/в) введения в дозе 2 мг/кг; 2) группа перорального введения в дозе 10 мг/кг; самцы крыс Sprague-Dawley (3 крысы на группу) с массой приблизительно 250-300 грамм. Для каждой группы подбирают до 8 временных точек. Типичные временные точки представляют собой: перед введением, 15, 30 минут, 1, 2, 4, 8 и 24 часа. В каждой временной точке до 300 мкл цельной крови забирают через канюлю в яремной вене. Кровь забирают в микроцентрифужные пробирки с антикоагулянтом и центрифугируют при 5000 об/мин в микроцентрифуге в течение 5 минут перед переносом плазмы в чистую микроцентрифужную пробирку. Проводили биоаналитический анализ образцов плазмы.
Сходный способ применяли для получения фармакокинетических данных для соединения 2.
Результаты для соединения 1 представлены на Фиг.17.
Результаты для соединения 2 представлены на Фиг.21.
Пример 8: Эффект соединения 1 в крысиной модели коллаген-индуцированного артрита (CIA)
Задача: определение эффективности соединения 1, вводимого перорально ежедневно в ингибировании воспаления, деструкции хряща и резорбции кости при развитии у крыс артрита, индуцированного коллагеном II типа.
Животные: 44 самки крыс Lewis (Charles River#7246950), массой 125-150 г в начале исследования. 40 крысам инъецировали коллаген для получения 40 крыс с сильным ответом на 10, 11 сутки для 4 групп по 10 крыс. Четверо неиммунизированных животных использовали как отрицательный контроль.
Материалы: соединение 1 (натриевая соль), PEG400 в форме жидкости, коллаген II типа, неполный адъювант Фрейнда, уксусная кислота. Соединение 1 приготавливают в концентрации до 100 мг/мл в 70% PEG400/30% воды. Коллаген приготавливают, получая раствор с концентрацией 4 мг/мл в 0,01 н. уксусной кислоте. Равные объемы коллагена и неполного адъюванта Фрейнда эмульгируют ручным перемешиванием до тех пор, пока шарик этого материала не будет сохранять свою форму при погружении в воду.
Общий план исследования: животные (10 крыс на группу для артрита, 4 крысы на группу для нормального контроля).
Животных в группах 2-5 анестезируют изофлураном и производят инъекции коллагена (0 сутки (D0)); каждому животному вводят 300 мкл смеси в виде 3 инъекций под кожу спины. На 6 сутки (D6) животных вновь анестезируют и производят вторую инъекцию коллагена, как описано ранее.
Пероральное введение соединения 1 с интервалами продолжительностью 24 часа (ежедневно) начинают на 0 сутки с использованием вводимого объема растворов для перорального введения, составляющего 5 мл/кг. Крыс взвешивают на 0, 3, 6 и 9-17 сутки артрита и лодыжки измеряют штангенциркулем ежедневно, начиная с 9 суток. Конечные значения массы тела определяют на 17 сутки артрита. На 17 сутки всех животных анестезируют для конечного забора крови и затем умерщвляют. Затем задние лапы и колени удаляют, задние лапы взвешивают и затем (с коленями) помещают в формалин для обработки для микроскопии. Печень, селезенку и тимус, и почки также удаляют, освобождают от наружных тканей и взвешивают. Почки сохраняют в формалине для гистопатологического исследования.
Сбор образцов будет происходить в течение 1 суток и включать группы 2-5 с получением образцов от всех групп. Это приводит к тому, что обработка всех животных происходит одинаково, и это важно для клинических параметров и конечных значений массы печени.
Результаты исследования показаны на Фиг.11.
Пример 9: Эффекты соединения 1 на колит, индуцированный 2,4-динитробензолсульфоновой кислотой (DNBS), у крыс
Способ: Самцов крыс Wistar массой 200±20 г лишают пищи на 24 часа перед использованием. Дистальный колит индуцируют вливанием в ободочную кишку DNBS (2,4-динитробензолсульфоновой кислоты, 20 мг в 0,5 мл 30% этанола) с использованием катетера длиной 12 см с последующим осторожным введением воздуха (2 мл) через катетер для обеспечения сохранения раствора в ободочной кишке. Животных разделяют на группы по 5 животных в каждой. Исследуемое вещество и наполнитель вводят либо один раз в день, либо два раза в день, подходящим путем введения за 24 часа и за 1 час до вливания DNBS и затем в течение 6 последующих суток. Одной группе нормального контроля вводят только 0,9% NaCl без введения DNBS. Животных умерщвляют через 12 часов после последнего введения при введении два раза в сутки и через 24 часа после последнего введения при введении один раз в сутки и ободочную кишку удаляют и взвешивают. Во время эксперимента ежедневно проводят мониторинг массы тела, скрытой крови в кале и консистенции стула. Кроме того, при вскрытии брюшной полости перед удалением ободочной кишки отмечают спайки между ободочной кишкой и другими органами, а также наличие изъязвлений ободочной кишки после удаления и взвешивания массы каждой ободочной кишки (балльную оценку макроскопического повреждения записывают в соответствии с установленными шкалами). Также вычисляют отношение массы ободочной кишки к массе тела по формуле: масса ободочной кишки (г)/масса тела (BW) × 100. «Общее» увеличение отношения группы контроля наполнителем и группы DNBS относительно группы наполнителя используют как основу для сравнения отдельных групп введения и выражают как «уменьшение (%)» (процент снижения). 30% или большее (≥30%) снижение отношения массы ободочной кишки к массе тела по отношению к контрольной группе, которой вводили наполнитель, рассматривают как значимое.
В качестве стандартного исследуемого агента используют сульфасалазин. (Hogaboam CM, et al., An orally active non-selective endothelin receptor antagonist, bosentan, markedly reduces injury in a rat model of colitis. Eur J Pharmacol. 309: 261-269, 1996; Yue G, et al., The 21-aminosteroid tirilazid mesylate can ameliorate inflammatory bowel disease in rats. J Pharmacol Exp Ther. 276: 265-270, 1996.)
Результаты исследования показаны на Фиг.20.
Пример 10: Клиническое исследование безопасности и эффективности соединений формулы (I), (II), (IIA) или (IIБ) II фазы у пациентов с активным ревматоидным артритом
Целью данного исследования II фазы является изучение безопасности, переносимости, фармакокинетики (РК), фармакодинамики (PD) и эффективности однократных и повторных внутривенных инфузий соединений формулы (I), (II), (IIA) или (IIБ) у пациентов с активным ревматоидным артритом.
Пациенты: подходящими субъектами будут мужчины и женщины в возрасте от 18 до 75 лет.
Критерии
Критерии включения:
- все субъекты должны применять подходящую контрацепцию для обеспечения отсутствия беременностей в течение исследования и в течение по меньшей мере 12 недель после введения для мужчин и 32 недель после введения для женщин;
- индекс массы тела в диапазоне 18,5-35 кг/м2 включительно, в дополнение к массе в диапазоне 55-95 кг;
- субъект должен быть способен дать информированное согласие и способен следовать требованиям и расписанию исследования;
- субъект должен иметь диагноз ревматоидный артрит (RA) в соответствии с пересмотренными в 1987 г. критериями Американского колледжа ревматологии (American College of Rheumatology (ACR));
- субъект должен иметь показатель активности заболевания DAS28 более 4,2 при скрининге перед началом лечения;
- субъект должен иметь уровень С-реактивного белка (CRP) в сыворотке ≥0,5 мг/дл или уровень скорости оседания эритроцитов (ESR) 28 мм/ч при скрининге перед началом лечения;
- субъект не получал какой-либо биологической терапии в прошлом, включая биологические средства для лечения ревматоидного артрита;
- субъект должен иметь функциональные печеночные тесты, включая аланинаминотрансферазу (ALT) и аспартатаминотрансаминазу (AST), в пределах 1,5 значений верхней границы нормы (ULN) и щелочную фосфатазу (ALP) в пределах 3 значений ULN при скрининге; пациент также должен иметь общий билирубин в пределах ULN при скрининге;
- субъект должен получать метотрексат в течение по меньшей мере 3 месяцев и должен принимать стабильную дозу метотрексата (до 25 мг/неделю) в течение по меньшей мере 8 недель перед скринингом и быть готовым не менять эту дозу на всем протяжении исследования;
- если в дополнение к метотрексату субъект принимает сульфасалазин, он должен принимать стабильную дозу в течение по меньшей мере 4 недель перед скринингом и быть готовым не менять эту дозу на всем протяжении исследования;
- если в дополнение к метотрексату субъект принимает гидроксихлорохин или хлорохин, он должен принимать стабильную дозу в течение по меньшей мере 3 месяцев перед скринингом и быть готовым не менять эту дозу на всем протяжении исследования;
- субъекты, получающие другую пероральную противоревматическую терапию, которая может включать нестероидные противовоспалительные лекарственные средства (NSAID), ингибиторы циклооксигеназы-2 (СОХ-2), глюкокортикоиды для перорального введения, например преднизолон (приблизительно 10 мг/сутки), должны следовать стабильным схемам приема лекарственных средств в течение по меньшей мере 4 недель перед скринингом и быть готовыми не менять эту схему на всем протяжении исследования;
- субъекты, получающие глюкокортикоиды для внутримышечного введения, например метилпреднизолон (приблизительно 120 мг/месяц), должны следовать стабильной схеме приема лекарственного средства в течение по меньшей мере 3 месяцев перед скринингом и быть готовыми не менять эту схему на всем протяжении исследования;
- субъект должен принимать стабильную дозу фолатов в форме добавок (5 мг/неделю) на протяжении по меньшей мере 4 недель перед введением.
Критерии исключения:
- любое клинически значимое отклонение от нормы, идентифицированное во время скрининга при медицинской оценке, лабораторном обследовании (например, гаматологический параметр вне пределов нормы) или электрокардиографии (ЭКГ) (в 12 отведениях или по Холтеру);
- субъект имеет положительный результат на поверхностный антиген вируса гепатита В или антитела к вирусу гепатита С при скрининге;
- субъект имеет анамнез повышенных функциональных печеночных тестов (ALT, AST и ALP > 3 верхних границ нормы (ULN); общий билирубин > 1,5 ULN) один или более чем один раз за последние 6 месяцев;
- контакт или инфицирование Mycobacterium tuberculosis в прошлом;
- субъект имеет острую инфекцию;
- субъект имеет анамнез повторных, хронических или оппортунистических инфекций, которые, по мнению исследователя и/или медицинского монитора GSK, подвергают субъекта неприемлемому риску при его участии в исследовании;
- субъект имеет анамнез злокачественного новообразования, за исключением хирургически вылеченного базально-клеточного рака или женщин с вылеченным раком шейки матки (> 2 лет до исследования);
- субъект имеет анамнез инфекции, вызванной вирусом иммунодефицита человека (HIV), или другого иммунодефицитного заболевания;
- субъект, у которого расчетный клиренс креатинина составляет менее 50 мл/мин;
- субъект имеет значимые сердечные, легочные, метаболические, почечные, печеночные или желудочно-кишечные состояния, которые, по мнению исследователя и/или медицинского монитора GSK, подвергают субъекта неприемлемому риску при его участии в исследовании;
- субъект принимал циклоспорин, лефлуномид, циклофосфамид или азатиоприн в пределах 1 месяца до скрининга; субъекты, принимавшие циклоспорин, лефлуномид, циклофосфамид или азатиоприн в прошлом, должны выздороветь от всех связанных с лекарственным средством нежелательных явлений;
- субъект принимал соли золота или d-пенициламин в пределах 1 месяца перед скринингом; субъекты, принимавшие соли золота или d-пенициламин в прошлом, должны выздороветь от всех связанных с лекарственным средством нежелательных явлений;
- субъект получал глюкокортикоиды для внутрисуставного введения в пределах 1 месяца перед скринингом;
- недавний анамнез геморрагических расстройств, анемии, пептической язвы, рвоты кровью или желудочно-кишечного кровотечения;
- субъекты с анамнезом гематологического заболевания или приобретенных тромбоцитарных расстройств, включая вызванную лекарственными средствами тромбоцитопению, острую идиопатическую тромбоцитопению или болезнь фон Виллебранда;
- субъекты с известным риском внутричерепного кровотечения, включая хирургическое вмешательство на центральной нервной системе (CNS) в пределах последних 12 месяцев, артериальные сосудистые мальформации, закрытую травму головы в пределах 6 месяцев или любое другое событие, являющееся важным по мнению исследователя и/или медицинского монитора;
- субъект имеет гемоглобин (Hb) < 10 г/децилитр (дл) и число тромбоцитов < 150×109/литр (л);
- донорство крови в объеме более 500 мл в пределах периода продолжительностью 56 суток перед введением;
- нежелание субъектов мужского пола воздерживаться от половой жизни с женщиной во время беременности или лактации; или нежелание субъекта мужского пола использовать презерватив со спермицидом в дополнение применению его партнером женского пола другой формы контрацепции, такой как внутриматочное устройство (IUD), диафрагма со спермицидом, пероральные контрацептивы, прогестерон для инъекций, подкожные имплантаты левоноргестрела или перевязка маточных труб, если женщина может забеременеть в течение по меньшей мере 12 недель после лечения;
- нежелание субъекта женского пола, способного забеременеть, применять адекватную контрацепцию, как определено в разделе ограничений исследования; если необходимо, будет проведено подтверждение невозможности беременности у женщин (то есть постменопаузального или хирургического бесплодия, например перевязки труб или гистерэктомии, или двусторонней овариэктомии); постменопаузальный статус будут подтверждать по концентрациям фолликул-стимулирующего (FSH) гормона и эстрадиола сыворотки при скрининге; хирургическое бесплодие будут определять у женщин с документально подтвержденной гистерэктомией, перевязкой труб или двусторонней овариэктомией;
- субъект имеет анамнез злоупотребления наркотиками в пределах 12 месяцев перед скринингом;
- анамнез регулярного употребления алкоголя, превышающего среднее недельное потребление более 21 единицы или среднее суточное потребление более 3 единиц (мужчины), или среднее недельное потребление более 14 единиц, или среднее суточное потребление более 2 единиц (женщины); также будут исключены субъекты, потребляющие более 12 единиц алкоголя за период продолжительностью 24 часа; 1 единица эквивалентна половине пинты (220 мл) пива/светлого пива или 1 (25 мл) единице спирта или 1 стакану (125 мл) вина;
- положительный тест на беременность или лактация при скрининге;
- участие в исследовании с любым лекарственным средством, проходящим клиническое испытание, в пределах 3 месяцев или 5 периодов полувыведения (что бы ни было длительнее) ранее.
План исследования. Данное исследование представляет собой рандомизированное, двойное слепое, плацебо-контролируемое адаптивное исследование с подбором дозы для изучения безопасности, переносимости, фармакокинетики (РК), фармакодинамики (PD) и эффективности однократных и повторных внутривенных инфузий соединения формулы (I), (II), (IIA) или (IIБ) у пациентов с активным ревматоидным артритом. Исследование разделено на 2 части. Часть А является адаптивной фазой с подбором дозы, в которой будут получены данные о безопасности, переносимости, РК и PD однократных внутривенных инфузий. Часть Б является фазой повторных доз, в которой будут получены данные о безопасности, переносимости, РК и PD и эффективности повторных внутривенных инфузий выбранного уровня доз.
Первичные оцениваемые результаты:
- безопасность и переносимость после однократных возрастающих доз соединения формулы (I), (II), (IIA) или (IIБ) через 1 месяц и после 3 повторных доз соединения формулы (I), (II), (IIA) или (IIБ) через 3 месяца; клиническая эффективность (шкала DAS28) соединения формулы (I), (II), (IIA) или (IIБ) через 1 месяц.
Вторичные оцениваемые результаты:
- средневзвешенное значение DAS28 после однократных и повторных внутривенных доз;
- параметры РК соединения формулы (I), (II), (IIA) или (IIБ) в плазме после однократных и повторных внутривенных доз, включая концентрации свободного и связанного соединения формулы (I), (II), (IIA) или (IIБ) (в сыворотке), AUC(0-∞), Cmax, клиренс, объем распределения и норму накопления;
- критерии ответа DAS28 и EULAR после однократных и повторных внутривенных доз;
- ответ ACR20/ACR50/ACR70 после однократных и повторных внутривенных доз;
- число суставов с отеком при оценке 28 суставов;
- число напряженных/болезненных суставов при оценке 28 суставов;
- субъективная оценка боли;
- общая врачебная оценка состояния артрита;
- общая оценка состояния артрита пациентом;
- индекс функциональных нарушений (Health Assessment Questionnaire)
- С-реактивный белок (CRP)
- скорость оседания эритроцитов (ESR)
- общий индекс утомления;
- индекс нетрудоспособности HAQ;
- фармакодинамические биомаркеры после однократных и повторных внутривенных доз;
- характерные AUC50 и EC50 для изменений клинического результата в модели экспозиции в плазме, как оценено по сигмоидной Emax, и моделях непрямого ответа PK/PD;
- иммуногенность (человеческие антитела против соединения формулы (I), (II), (IIA) или (IIБ)).
Пример 11: Клиническое исследование безопасности и эффективности соединений формулы (I), (II), (IIA) или (IIБ) II фазы у пациентов с тяжелым рефракторным бляшечным псориазом
Целью данного исследования II фазы является изучение безопасности, эффективности и переносимости соединений формулы (I), (II), (IIA) или (IIБ) у пациентов с тяжелым рефракторным бляшечным псориазом.
Пациенты: подходящими субъектами будут мужчины и женщины возрастом от 18 до 75 лет.
Критерии
Критерии включения:
- пациент имеет тяжелый рефракторный бляшечный псориаз и у него была неэффективной по меньшей мере 1 системная терапия (в целях данного исследования псорален с ультрафиолетовым излучением типа А рассматривают как системную терапию);
- пациент имеет псориатическое поражение по меньшей мере 10% площади поверхности тела (BSA);
- пациент имеет оценку по шкале PSGA 4 или более;
- если пациент является женщиной, он имеет хирургическое бесплодие, или после менопаузы прошло 2 года, или, при возможности беременности, применяет в настоящее время приемлемый с медицинской точки зрения способ контрацепции и согласен продолжать применение этого способа на протяжении исследования (и в течение 30 суток после участия в исследовании); приемлемые способы контрацепции включают: воздержание, стероидные контрацептивы (для перорального, трансдермального, имплантационного или инъекционного введения) в сочетании с барьерным способом или внутриматочным устройством (IUD);
- пациент, если он является мужчиной, имеет хирургическое бесплодие или, если он способен к воспроизведению потомства, применяет в настоящее время одобренный способ предупреждения беременности и согласен продолжать применение этого способа на протяжении исследования (и в течение 60 суток после приема последней дозы соединения формулы (I), (II), (IIA) или (IIБ) ввиду возможных эффектов на сперматогенез);
- необходимо, чтобы пациент был согласен и способен соблюдать процедуры и ограничения исследования и согласен вернуться в клинику для оценки отдаленных результатов, как указано в данном протоколе.
Критерии исключения:
- пациент получал лечение системными противопсориатическими лекарственными средствами (конкретно, ретиноидами, метотрексатом, циклоспорином А, этанерцептом, эфализумабом, другими биологическими агентами или другими иммуномодуляторами) в пределах 4 недель или основанную на ультарфиолетовом излучении (UV-излучении) терапию в пределах 2 недель, или алифацепт в пределах 6 недель от запланированных 1 суток исследуемого лечения;
- пациент получал лечение мощными ингибиторами CYP3A4, включая циклоспорин, клотримазол, флюконазол, итраконазол, кетоконазол, вориконазол, эритромицин, кларитромицин и тролеандомицин, ингибиторы протеазы вируса иммунодефицита человека (HIV), или нефазодон, в пределах 1 недели (7 суток) от запланированных 1 суток исследуемого лечения;
- пациент в настоящее время получает варфарин;
- пациент имеет гиперчувствительность к соединению формулы (I), (II), (IIA) или (IIБ) или любому компоненту соединения формулы (I), (II), (IIA) или (IIБ);
- пациент имеет один или более чем один из следующих химических показателей сыворотки крови, как определено при скрининговом визите (визите 1):
- уровни билирубина, более чем в 2 раза превышающие верхнюю границу нормы (ULN);
- уровни ALT или AST, более чем в 2 раза превышающие ULN;
- уровни креатинина сыворотки, превышающие 2 мг/дл;
- в настоящее время пациенту необходимо лечение HIV ингибиторами протеазы;
- пациент получает лечение по поводу клинического диагноза язвы желудочно-кишечного тракта или имеет анамнез мелены или кровавой рвоты в пределах предшествующих 3 недель;
- пациент является женщиной в время беременности или лактации;
- пациент получал лечение лекарственным средством, проходящим клиническое испытание, в пределах 4 недель от запланированных 1 суток исследуемого лечения.
План исследования. Данное исследование представляет собой пробное, открытое, нерандомизированное исследование эффективности, безопасности и переносимости соединения формулы (I), (II), (IIA) или (IIБ) у пациентов с тяжелым рефракторным бляшечным псориазом с увеличением дозы.
Пример 12: Клиническое исследование безопасности и эффективности соединений формулы (I), (II), (IIA) или (IIБ) II фазы для профилактики острого отторжения после трансплантации почки
Стандартным иммуносупрессивным лечением после трансплантации почки является комбинация такролимуса, микофенолята мофетила и пренизолона. При применении этой схемы возможно снижение частоты острого отторжения трансплантата в первые шесть месяцев после трансплантации до приблизительно 20%. В настоящее время основной проблемой остается улучшение долгосрочных результатов предотвращением хронической нефропатии аллотрансплантата (CAN). Поскольку острое отторжение является серьезным прогностическим фактором CAN, дальнейшее снижение частоты острого отторжения может улучшить долгосрочную выживаемость трансплантата. Целью данного клинического исследования II фазы является изучение эффективности и безопасности соединения формулы (I), (II), (IIA) или (IIБ) для профилактики острого отторжения после трансплантации почки.
Пациенты: подходящими субъектами будут мужчины и женщины возрастом 18 лет и старше.
Критерии
Критерии включения:
- реципиенты трансплантата почки;
- подписанное, датированное и засвидетельствованное информированное согласие, одобренное Институтским наблюдательным советом (IRB).
Критерии исключения:
- беременность;
- живой HLA-идентичный донор;
- гемолитико-уремический синдром как исходное заболевание почки;
- фокальный сегментарный гломерулосклероз, произошедший с предыдущим трансплантатом почки;
- более двух неудачных предыдущих трансплантаций и/или вероятностная оценка риска (PRA) > 85%;
- сахарный диабет без текущего лечения инсулином;
- общее число лейкоцитов < 3000/мм3 или число тромбоцитов < 75000/мм3;
- активная инфекция, вызванная вирусом гепатита В, гепатита С или HIV;
- туберкулез в анамнезе.
План исследования. Данное исследование представляет собой рандомизированное, двойное слепое, плацебо-контролируемое интервенционное исследование эффективности и безопасности профилактического применения соединения формулы (I), (II), (IIA) или (IIБ). Одна группа будет получать однократную дозу соединения формулы (I), (II), (IIA) или (IIБ) внутривенно во время трансплантации, а другая группа получает инфузию плацебо.
Первичные результаты:
- определение частоты и тяжести подтвержденного биопсией острого отторжения в первые шесть месяцев после трансплантации.
Вторичные результаты:
- функция почек, как оценивают по клиренсу эндогенного креатинина через 6 месяцев;
- частота хронической нефропатии аллотрансплантата через 6 месяцев;
- кумулятивная частота инфекций и злокачественных новообразований через 6 месяцев;
- медицинские затраты в течение первых 6 месяцев после трансплантации;
- выживаемость пациентов и трансплантата.
Пример 13: Клиническое исследование безопасности и переносимости соединения формулы (I), (II), (IIA) или (IIБ) II фазы у пациентов с активным неспецифическим язвенным колитом (UC)
Целью данного исследования II фазы является изучение безопасности, переносимости схемы с соединением формулы (I), (II), (IIA) или (IIБ) у пациентов с активным неспецифическим язвенным колитом.
Пациенты: подходящими субъектами будут мужчины и женщины возрастом 18 лет и старше.
Критерии
Критерии включения:
- субъекты с активным UC при терапии 5-аминосалициловой кислотой (5-ASA) и также леченным 6-меркаптопурином (6-МР) и/или кортикостероидами, или которые ранее получали лечение азатиоприном (AZA), 6-МР или кортикостероидами и не были способны их переносить;
- оценка Мауо от 6 до 10 пунктов со среднетяжелым-тяжелым заболеванием при эндоскопии (показатель Мауо по меньшей мере 2), проведенной в пределах 14 суток от введения исследуемого лекарственного средства;
- субъекты, получающие следующие лекарственные средства, могут быть включены в исследование, если до введения исследуемого лекарственного средства прием лекарственных средств соответствовал следующим схемам, и во время исследования не ожидают никаких изменений:
• преднизолон ≤ 20 мг в сутки (или эквивалентно) (доза должна быть стабильной в течение по меньшей мере 3 недель перед введением исследуемого лекарственного средства);
• 5-ASA (доза должна быть стабильной в течение по меньшей мере 4 недель перед введением исследуемого лекарственного средства);
• AZA или 6-МР (доза должна быть стабильной в течение по меньшей мере 3 месяцев перед введением исследуемого лекарственного средства);
• стероиды или 5-ASA для ректального введения (должны быть стабильны в течение по меньшей мере 4 недель перед введением исследуемого лекарственного средства);
- субъекты, применяющие лекарственные средства для ректального введения должны иметь видимое поражение при ректороманоскопии на протяжении ≥ 20 см;
- лабораторные показатели при скрининге должны соответствовать определенным критериям:
• женщины должны быть в менопаузе (> 12 месяцев отсутствия менструаций) или иметь хирургическое бесплодие (например, в результате гистерэктомии или двусторонней овариэктомии), или должны применять эффективную контрацепцию (например, пероральные контрацептивы, внутриматочное устройство (IUD), двойной барьерный способ с использованием презерватива и спермицида) в течение по меньшей мере 4 недель перед введением исследуемого лекарственного средства, и должны быть согласны продолжать контрацепцию в течение их участия в исследовании; и
• ведущие активную половую жизнь субъекты мужского пола должны применять барьерный способ контрацепции на протяжении исследования.
Критерии исключения:
- терапия против фактора некроза опухоли (TNF) в пределах 8 недель перед введением исследуемого лекарственного средства;
- любая экспериментальная терапия за ≤ 4 недели перед введением исследуемого лекарственного средства;
- предыдущее лечение любым моноклональным антителом или слитым белком на основе иммуноглобулинов за ≤ 8 недель перед исследуемым лечением;
- наличие синдрома Кушинга;
- токсический мегаколон или фульминантное заболевание, при котором, вероятно, будет необходима колэктомия;
- противопоказание к колоноскопии или ректороманоскопии;
- первичный или вторичный иммунодефицит;
- аутоиммунное заболевание кроме UC, за исключением синдрома Шегрена или гипотиреоза;
- злокачественное заболевание в анамнезе, за исключением адекватно вылеченного базальноклеточного или плоскоклеточного рака кожи или рака шейки матки in situ;
- тяжелое психическое заболевание (субъекты со стабильной депрессией, получающие подходящее лечение, будут допущены в исследование);
- доказательства острой или хронической инфекции, подтвержденной:
- копрокультурой, положительной на патогенны и/или токсин Clostridium difficile;
- обнаружением при скрининговой рентгенографии грудной клетки, такими как легочный инфильтрат (инфильтраты) или аденопатия;
- лечение от туберкулеза, проводимое в настоящее время, клинические или рентгенографические доказательства активного туберкулеза (ТВ) или, для субъектов из Северной Америки, положительная реакция на сухой туберкулин, очищенный от белков среды (PPD), без предшествующей профилактики;
- Herpes zoster за ≤ 3 месяца перед введением исследуемого лекарственного средства;
- активные инфекционные заболевания, при которых необходимо внутривенное введение антибиотиков в пределах 4 недель от исследуемого лечения или пероральное введение антибиотиков в начале исследования;
- HIV или синдром приобретенного иммунодефицита (AIDS);
- положительные тесты на вирус гепатита В (HBV) или вирус гепатита С (HCV), указывающие на активную или хроническую инфекцию;
- клинически значимое заболевание сердца, при котором необходим прием лекарственных средств, нестабильная стенокардия, инфаркт миокарда в пределах 6 месяцев или застойная сердечная недостаточность;
- аритмия, при которой необходима активная терапия, за исключением клинически незначимых или незначительных нарушений проводимости;
- анамнез цереброваскулярного заболевания, при котором необходим прием лекарственных средств/лечение;
- терапия антикоагулянтами или установленное геморрагическое расстройство;
- судорожное расстройство, при котором необходима активная терапия;
- установленное злоупотребление алкоголем или наркотиками;
- беременность или кормление ребенка грудью;
- любое сопутствующее медицинское состояние, которое, по мнению ведущего исследователя, сделает исследуемое лекарственное средство опасным для субъекта или будет препятствовать интерпретации эффективности или безопасности лечения; или
- неспособность или нежелание вернуться на визиты для изучения отдаленных результатов и соблюдать протокол исследования.
Первичные оцениваемые результаты:
- изменение показателя Мауо на 57 сутки по сравнению со скринингом.
Вторичные оцениваемые результаты:
- частота ремиссии.
План исследования. Данное исследование представляет собой двойное слепое, плацебо-контролируемое, рандомизированное исследование безопасности и переносимости соединений формулы (I), (II), (IIA) или (IIБ) II фазы с несколькими дозами у пациентов с активным UC при внезапном обострении заболевания. Все субъекты будут иметь активное заболевание при приеме лекарственных средств, включающих 5-ASA, и либо принимать стабильные дозвы кортикостероидов и/или азатиоприна, или 6-меркаптопурина, либо они ранее принимали эти лекарственные средства и не были способны их переносить. Внезапное обострение заболевания определяют как показатель Мауо от 6 до 10 со среднетяжелой-тяжелой активностью заболевания при эндоскопии (значение по эндоскопической субшкале Мауо по меньшей мере 2) в пределах 2 недель перед введением исследуемого лекарственного средства. Дозы разрешенных для одновременного приема лекарственных средств (кортикостероидов, азатиоприна (AZA), 6-меркаптопурина (6-МР) и соединений, содержащих 5-аминосалицилаты (5-ASA)) не должны меняться на протяжении исследования. Субъекты будут рандомизированы для получения плацебо или соединения формулы (I), (II), (IIA) или (IIБ) внутривенно на 1, 15, 29 и 43 сутки. Все субъекты будут проходить наблюдение в клинике с регулярными интервалами до 85 суток для оценок безопасности, эффективности, фармакокинетики и/или фармакодинамики. Со всеми субъектами будут поддерживать контакт в течение 70 суток после последнего введения исследуемого лекарственного средства. Оценку безопасности будут проводить посредством измерений основных показателей состояния организма, клинических лабораторных тестов, физикальных осмотров, оценок иммуногенности, рентгенологического исследования грудной клетки, электрокардиограмм и по частоте и тяжести возникших после начала лечения нежелательных явлений. Первичную клиническую оценку активности будет определять изменение показателя Мауо на 57 сутки по сравнению со скринингом. Вторичные результаты включают определение частоты ремиссии по показателю Мауо на 57 сутки, оценку заживления слизистой оболочки и изменение показателя IBDQ по сравнению с исходным.
Пример 14: Клиническое исследование безопасности и эффективности соединений формулы (I), (II), (IIA) или (IIБ) II фазы у пациентов с рассеянным склерозом
Целью данного исследования II фазы является изучение безопасности, эффективности и переносимости соединения формулы (I), (II), (IIA) или (IIБ) у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом.
Пациенты: подходящими субъектами будут мужчины и женщины возрастом от 18 до 65 лет.
Критерии
Критерии включения:
- наличие точного диагноза рецидивирующе-ремиттирующего рассеянного склероза;
- наличие в анамнезе по меньшей мере 1 из следующего: а) как минимум 2 рецидивов рассеянного склероза (MS) за последние 2 года, но не в пределах 1-месячного периода перед скринингом; б) рецидива MS за последние 6 месяцев, но не в пределах 1-месячного периода перед скринингом.
Критерии исключения:
- наличие заболевания центральной нервной системы (CNS) (например, лимфомы CNS, системной красной волчанки);
- наличие значимого бульбарного поражения при MS или другие неврологические дефекты;
- наличие пролежней;
- иммуномодулирующая терапия в пределах 3 месяцев перед скринингом.
Первичные оцениваемые результаты:
- общее число новых Gd-положительных Т1-положительных очагов при магнитно-резонансной томографии (MRI) головы до 23 недели.
Вторичные оцениваемые результаты:
- общее число рецидивов MS до 23 недели; изменение показателя по Расширенной шкале утраты трудоспособности (Expanded Disability Status Scale (EDSS)) через 23 недели.
План исследования. Данное исследование представляет собой двойное слепое, плацебо-контролируемое, рандомизированное исследование нескольких подкожных инъекций соединения формулы (I), (II), (IIA) или (IIБ) II фазы с разными дозами у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом. Пациентам будут производить подкожные инъекции соединения формулы (I), (II), (IIA) или (IIБ) или плацебо на 0, 1, 2, 3, 7, 11, 15 и 19, или 100 неделе.
Фармацевтические композиции
Парентеральная композиция
Для получения парентеральной фармацевтической композиции, подходящей для инъекционного введения, 100 мг соединения формулы (I), (II), (IIA) или (IIБ) растворяют в DMSO и затем смешивают с 10 мл 0,9% стерильного физиологического раствора. Смесь включают в стандартную лекарственную форму, подходящую для инъекционного введения.
В другом воплощении для получения композиции для инъекций смешивают следующие ингредиенты.
Все из указанных выше ингредиентов, за исключением воды, смешивают и перемешивают и, если необходимо, незначительно подогревают. Затем добавляют достаточное количество воды.
Композиция для перорального введения
Для получения фармацевтической композиции для пероральной доставки 100 мг соединения формулы (I), (II), (IIA) или (IIБ) смешивают с 750 мг крахмала. Смесь включают в единицу дозирования для перорального введения, такую как твердая желатиновая капсула, подходящая для перорального введения.
В другом воплощении следующие ингредиенты тщательно смешивают и прессуют с получением таблеток с одной насечкой.
В еще одном воплощении следующие ингредиенты тщательно смешивают и вводят в твердую желатиновую капсулу.
В еще одном воплощении для получения раствора/суспензии для перорального введения смешивают следующие ингредиенты.
Композиция для сублингвального введения (твердая лепешка)
Для получения фармацевтической композиции для трансбуккальной доставки, такой как твердая лепешка, 100 мг соединения формулы (I), (II), (IIA) или (IIБ) смешивают с 420 мг сахарного порошка, смешанного с 1,6 мл светлого кукурузного сиропа, 2,4 мл дистиллированной воды и 0,42 мл экстракта мяты. Смесь осторожно перемешивают и заливают в форму для получения лепешки, подходящей для трансбуккального введения.
Композиция для ингаляционного введения
Для получения фармацевтической композиции для ингаляционной доставки 20 мг соединения формулы (I), (II), (IIA) или (IIБ) смешивают с 50 мг безводной лимонной кислоты и 100 мл 0,9% раствора хлорида натрия. Смесь включают в устройство для ингаляционной доставки, такое как небулайзер, подходящее для ингаляционного введения.
Композиция в форме геля для ректального введения
Для получения фармацевтической композиции для ректальной доставки 100 мг соединения формулы (I), (II), (IIA) или (IIБ) смешивают с 2,5 г метилцеллюлозы (1500 мПа), 100 мг метилпарабена, 5 г глицерина и 100 мл очищенной воды. Полученную гелевую смесь затем вводят в устройства для ректальной доставки, такие как спринцовки, подходящие для ректального введения.
Композиция в форме суппозитория
Суппозиторий общей массой 2,5 г получают смешиванием соединения формулы (I), (II), (IIA) или (IIБ) с Witepsol™ H-15 (триглицеридами насыщенной растительной жирной кислоты; Riches-Nelson, Inc., New York), и он имеет следующий состав.
Композиция в форме геля для местного применения
Для получения фармацевтической композиции в форме геля для местного применения 100 мг соединения формулы (I), (II), (IIA) или (IIБ) смешивают с 1,75 г гидроксипропилцеллюлозы, 10 мл пропиленгликоля, 10 мл изопропилмиристата и 100 мл очищенного спирта, USP. Полученную гелевую смесь затем включают в контейнеры, такие как тубы, подходящие для местного введения.
Композиция в форме раствора для глазного введения
Для получения фармацевтической композиции в форме раствора для глазного введения 100 мг соединения формулы (I), (II), (IIA) или (IIБ) смешивают с 0,9 г NaCl в 100 мл очищенной воды и фильтруют с использованием 0,2 мкм фильтра. Полученный изотонический раствор затем включают в устройства для глазной доставки, такие как контейнеры для глазных капель, подходящие для глазного введения.
Примеры и воплощения, описанные здесь, приведены исключительно в иллюстративных целях, и содержание описания и объем прилагаемой формулы изобретения включают различные модификации или изменения, предлагаемые специалистам в данной области техники.
| название | год | авторы | номер документа |
|---|---|---|---|
| КИСЛОРОДЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 3-ГЕТЕРОАРОИЛАМИНОПРОПИОНОВЫХ КИСЛОТ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2011 |
|
RU2561126C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСИЛМЕТИЛА | 2006 |
|
RU2451009C2 |
| ОКСАТИЕПИНО[6,5-B]ДИГИДРОПИРИДИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2000 |
|
RU2257388C2 |
| ПРОИЗВОДНЫЕ БЕНЗОХИНАЗОЛИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ КОСТНЫХ НАРУШЕНИЙ | 2006 |
|
RU2416602C2 |
| ПИРАЗОЛОПИРИДИНОВЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ НАДФН-ОКСИДАЗЫ | 2009 |
|
RU2538041C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 3-ТИАЗОЛОАМИНОПРОПИОНОВОЙ КИСЛОТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ | 2012 |
|
RU2617843C2 |
| АЦИЛИРОВАННЫЕ ИНДАНИЛАМИНЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2002 |
|
RU2339614C2 |
| 2,6-ЗАМЕЩЕННЫЕ-4-МОНОЗАМЕЩЕННЫЙ АМИНО-ПИРИМИДИНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРА ПРОСТАГЛАНДИНА D2 | 2005 |
|
RU2417990C2 |
| ИНГИБИТОРЫ КИНУРЕНИН-3-МОНООКСИГЕНАЗЫ | 2009 |
|
RU2523448C2 |
| ПРОИЗВОДНЫЕ ДИТИЕПИНО[6,5-B]ПИРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ ИНГИБИРОВАНИЯ И ЛЕЧЕНИЯ РАССТРОЙСТВ | 2000 |
|
RU2230746C2 |
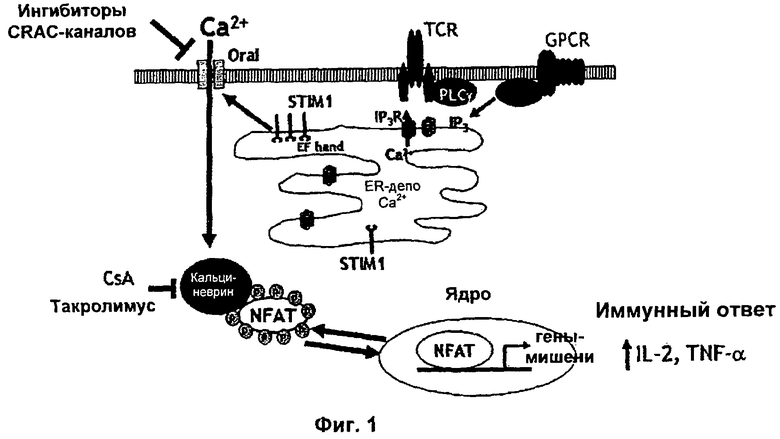
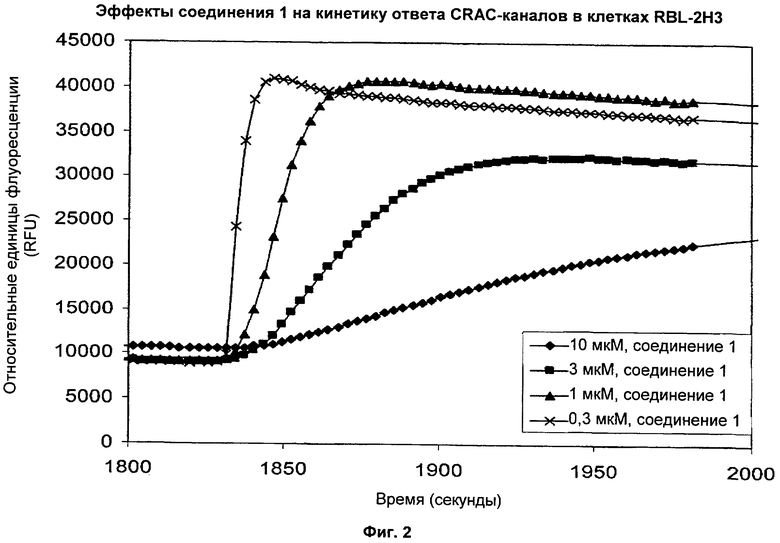
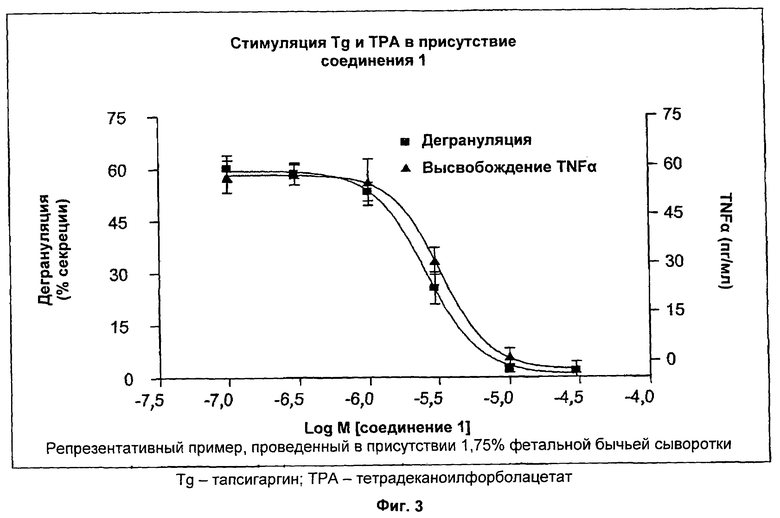
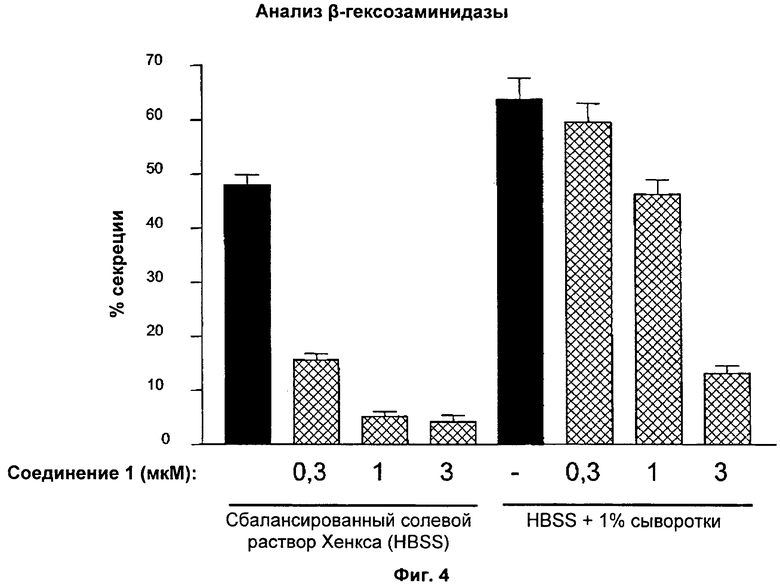
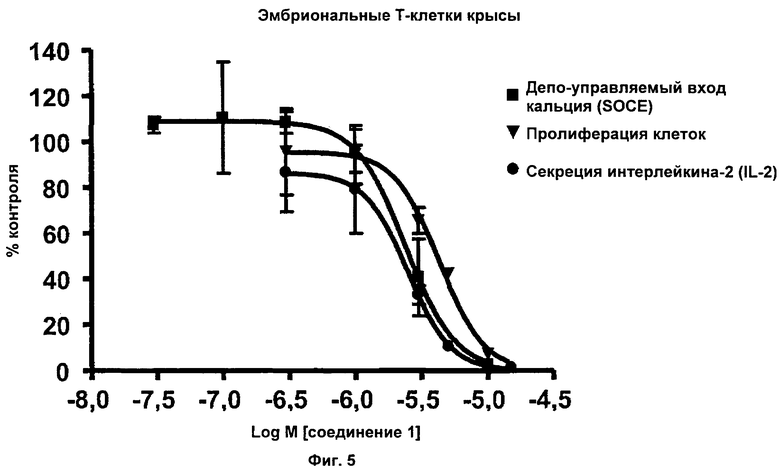
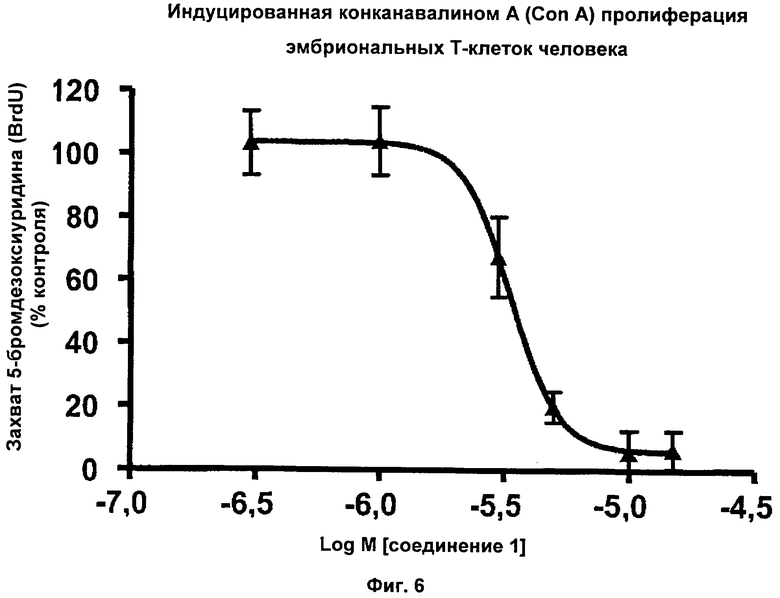
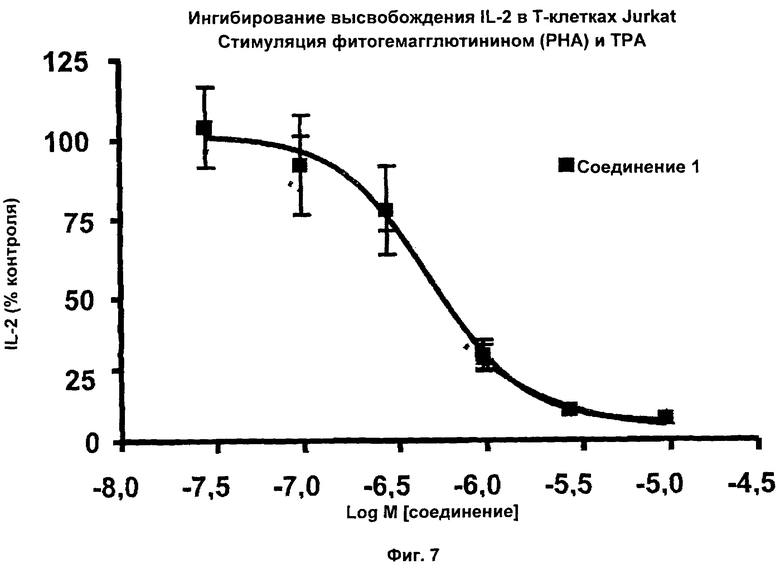
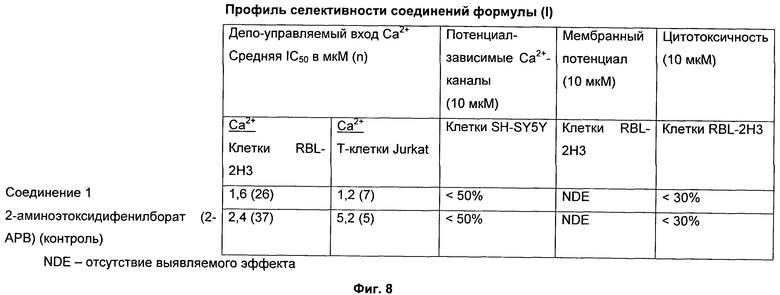
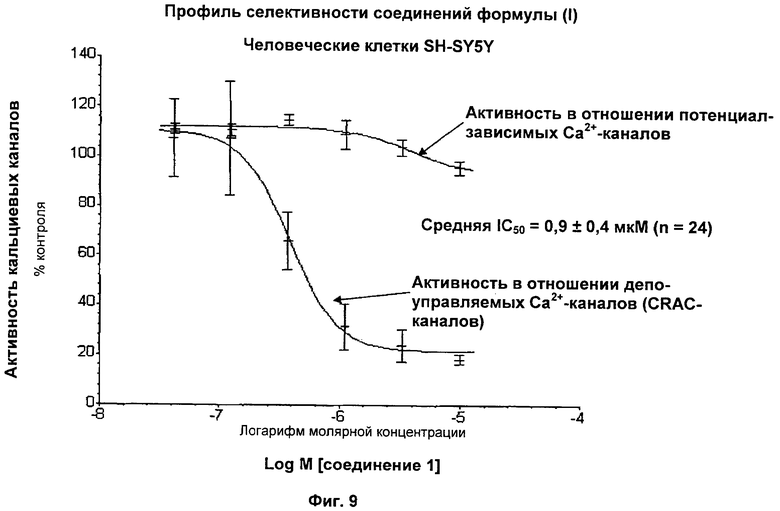
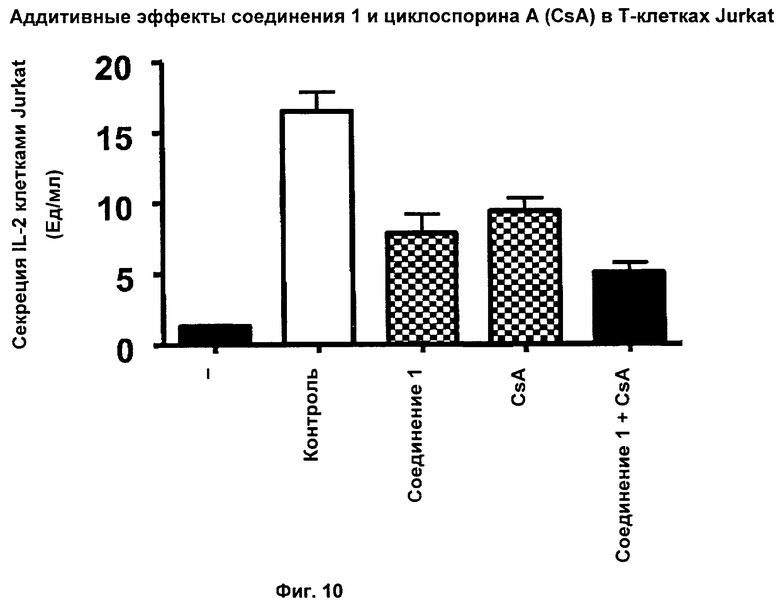
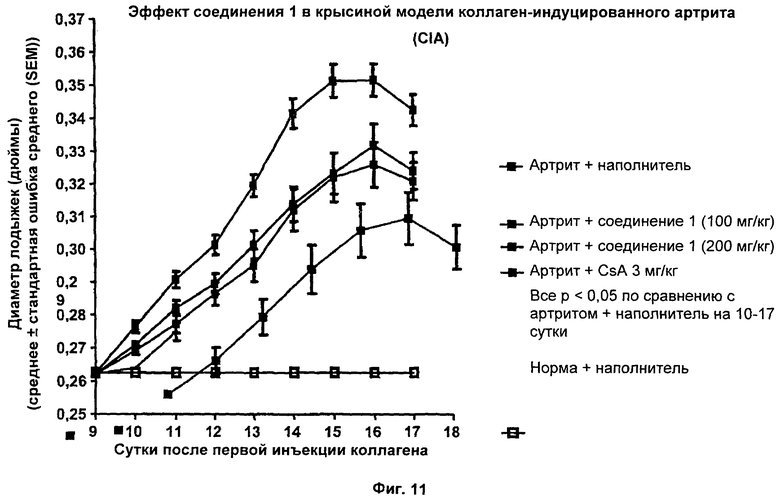
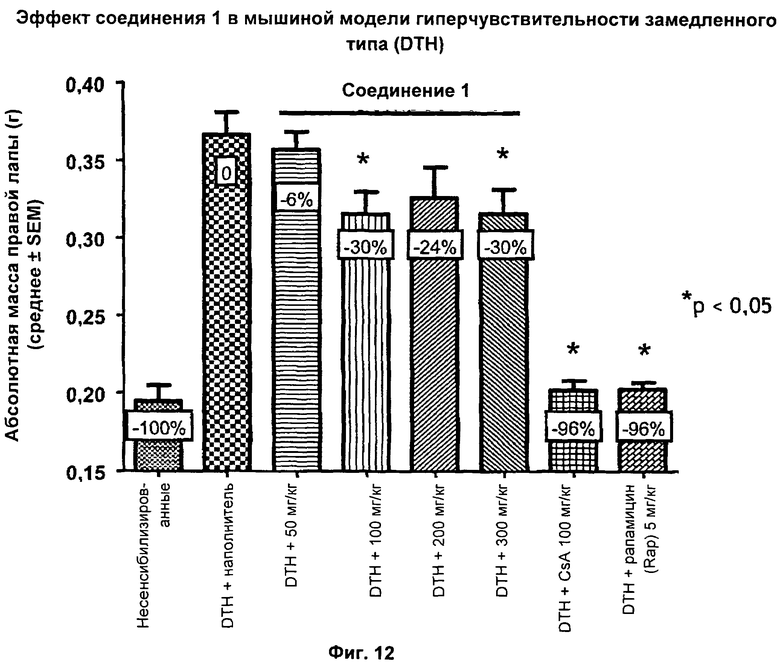
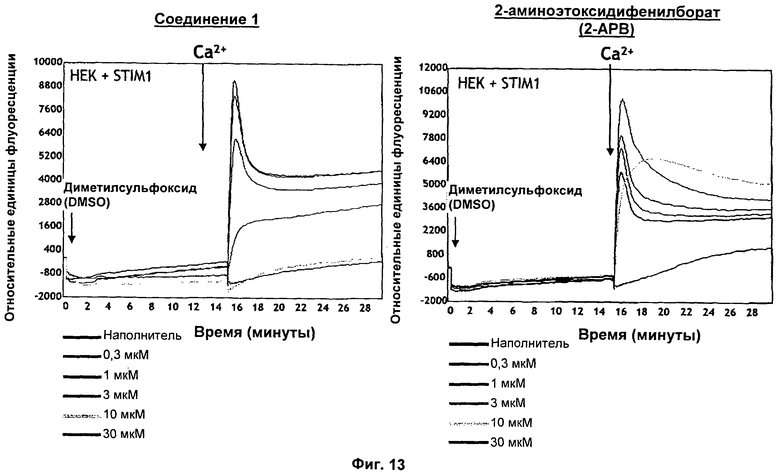
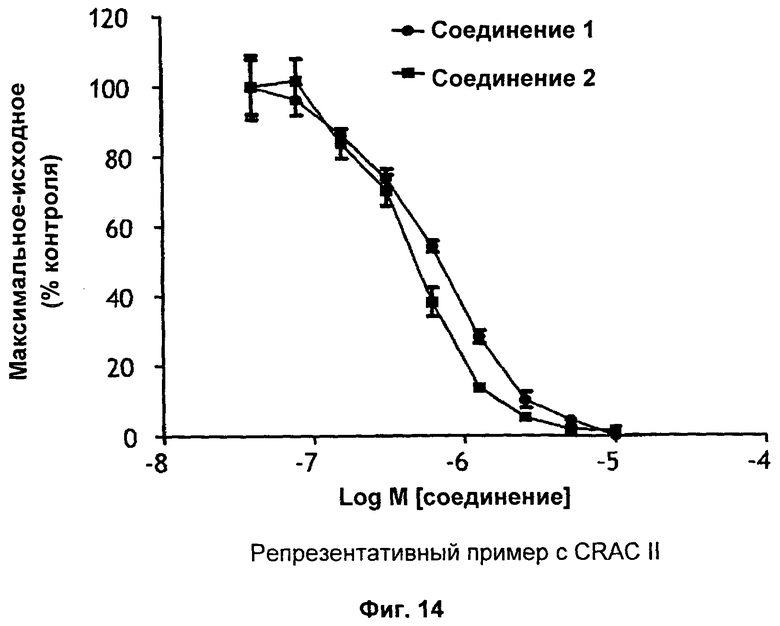
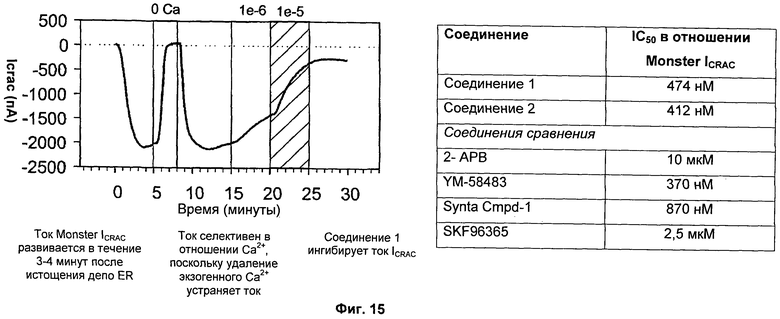

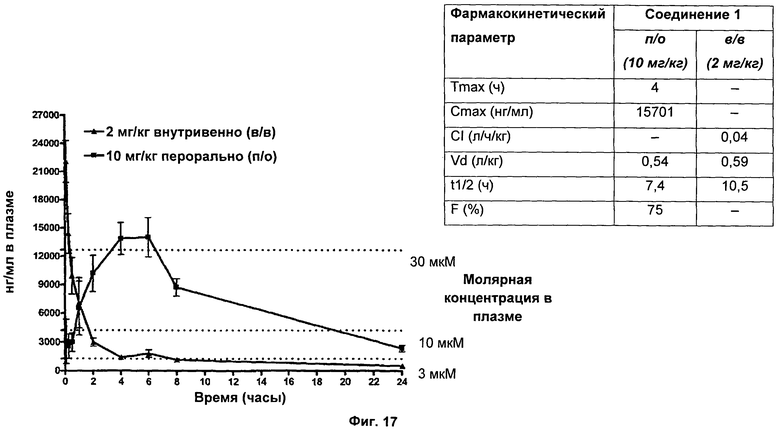
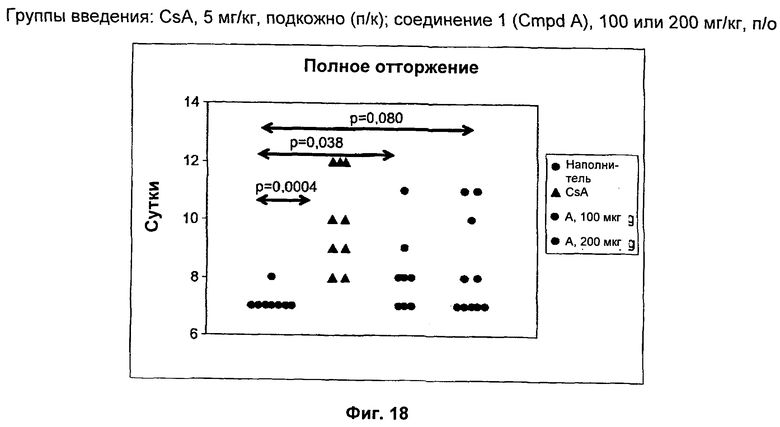
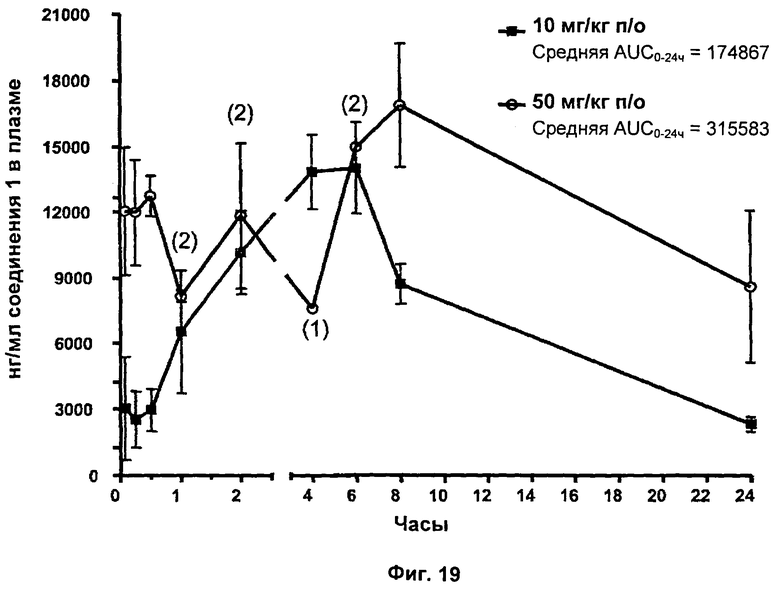
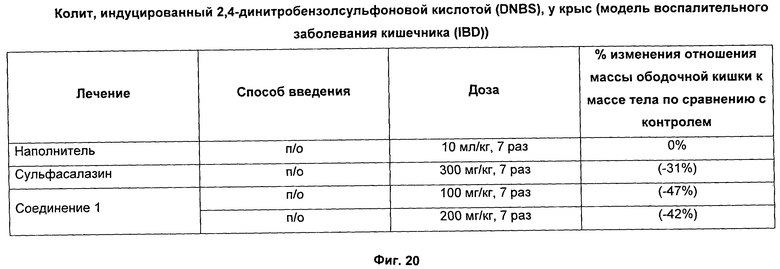
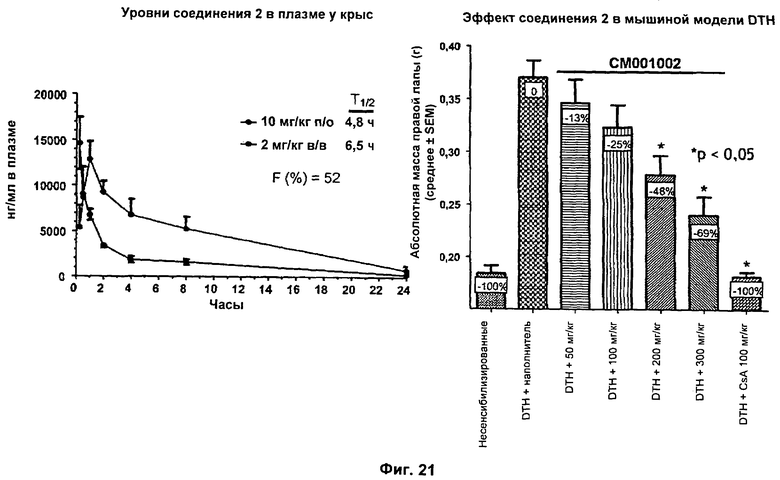
Изобретение относится к соединению формулы (I) или к его фармацевтически приемлемой соли:

где R1 представляет собой водород; R2 представляет собой фенил, бензотиенил, бензофуранил или группу -СН2СН2-фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Сl, Br, I, -CN, -NO2, -OR8, C1-С6алкила и -N(R9)2; R4 представляет собой фенил, замещенный 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CF3, -ОН, -OR8 и С1-С6алкила; каждый R8 независимо выбран из С1-С6алкила; и каждый R9 независимо выбран из Н и С1-С6алкила. Изобретение также относится к фармацевтической композиции для модуляции активности депо-управляемых кальциевых каналов (SOC-каналов), содержащей такие соединения. Технический результат - получены новые соединения и фармацевтические композиции на их основе, которые могут найти применение в медицине для лечения заболеваний или состояний, таких как ревматоидный артрит, псориаз, воспалительное заболевание кишечника, астму и рассеянный склероз. 4 н. и 8 з.п. ф-лы, 21 ил., 1 табл., 14 пр.
1. Соединение формулы (I) или его фармацевтически приемлемая соль:
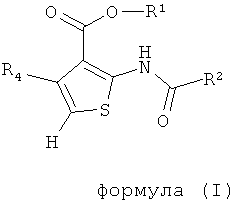
где R1 представляет собой водород;
R2 представляет собой фенил, бензотиенил, бензофуранил или группу -СН2СН2- фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -OR8, С1-С6алкила и -N(R9)2;
R4 представляет собой фенил, замещенный 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CF3, -ОН, -OR8 и С1-С6алкила;
каждый R8 независимо выбран из С1-С6алкила; и
каждый R9 независимо выбран из Н и С1-С6алкила.
2. Соединение по п.1, где R2 представляет собой бензотиенил, возможно замещенный 1 или 2 заместителями, выбранными из F, Cl, Br, I, СН3 и CN.
3. Соединение по п.2, где бензотиенил присоединен по положению 2.
4. Соединение по п.2, где бензотиенил присоединен по положению 5.
5. Соединение по п.1, где R4 представляет собой фенил и замещен 1 или 2 заместителями, выбранными из F, Cl, Br, I, ОН, СН3 и CF3.
6. Фармацевтическая композиция для модуляции активности депо-управляемых кальциевых каналов, содержащая соединение формулы (I) или его фармацевтически приемлемую соль:

где R1 представляет собой водород;
R2 представляет собой фенил, бензотиенил, бензофуранил или группу -СН2СН2-фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -OR8, С1-С6алкила или -N(R9)2;
R4 представляет собой фенил, замещенный 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CF3, -ОН, -OR8 и С1-С6алкила;
каждый R8 независимо выбран из С1-С6алкила; и
каждый R9 независимо выбран из Н и С1-С6алкила;
и фармацевтически приемлемый разбавитель, эксципиент или
связывающее вещество.
7. Соединение, выбранное из:
2-(4-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-фторбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-фторбензамидо)-4-(4-трифторметилфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(4-метилфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(4-бромфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(3,5-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(3-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-бромбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(3-фторбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(4-метилфенил)тиофен-3 -карбоновой кислоты;
2-(4-хлорбензамидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(4-фторфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(3,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(4-хлорбензамидо)-4-(3,4-диметилфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(4-метилфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(2,4-дихлорфенил)тиофен-3-карбоновой кислоты;
2-(бензотиен-2-иламидо)-4-(3-хлорфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(4-хлорфенил)тиофен-3-карбоновой кислоты;
2-(3-метилбензамидо)-4-(4-метилфенил)тиофен-3-карбоновой кислоты;
4-(2,4-дихлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3-хлорфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(3-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(2-хлорфенил)-2-(3-фенилпропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(2-хлор-4-фторбензамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3,4-дифторбензамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(2-фторбензамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(4-цианобензамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(3-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(2,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(4-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(3,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(2,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-бромфенил)-2-(3-(3,4-дифторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(4-фторфенил)пропанамидо)тиофен-3-карбоновой кислоты;
4-(4-хлорфенил)-2-(3-(4-хлорфенил)пропанамидо)тиофен-3-карбоновой кислоты;
или его фармацевтически приемлемая соль.
8. Способ лечения воспаления или заболевания, расстройства или состояния иммунной системы у млекопитающего, включающий введение этому млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли:

где R1 представляет собой водород;
R2 представляет собой фенил, бензотиенил, бензофуранил или группу -СН2СН2- фенил; где R2 возможно замещен 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CN, -NO2, -OR8, С1-С6алкила и -N(R9)2;
R4 представляет собой фенил, замещенный 1 или 2 заместителями, независимо выбранными из F, Cl, Br, I, -CF3, -ОН, -OR8 и С1-С6алкила;
каждый R8 независимо выбран из С1-С6алкила; и
каждый R9 независимо выбран из Н или С1-С6алкила.
9. Способ по п.8, где заболевание, расстройство или состояние у млекопитающего выбрано из заболеваний/расстройств, включающих ревматоидный артрит, псориаз, воспалительное заболевание кишечника, астму и рассеянный склероз.
10. Способ по п.9, где заболевание, расстройство или состояние представляет собой ревматоидный артрит.
11. Способ по п.9, где заболевание, расстройство или состояние представляет собой рассеянный склероз.
12. Способ по п.9, где заболевание, расстройство или состояние представляет собой воспалительное заболевание кишечника.
| ХАРИЗОМЕНОВА И.А | |||
| и др | |||
| Химия гетероциклических соединений, 1980, №1, с.45-46 | |||
| WO 9854116 А1, 03.12.1998 | |||
| 0 |
|
SU248131A1 | |
| Способ получения ациламинозамещенных 5-членных гетероциклических производных | 1976 |
|
SU655313A3 |
Авторы
Даты
2012-10-27—Публикация
2008-08-15—Подача