Изобретение относится к области микробиологии, касается нового штамма М 99/51 Trichoderma harzianum Rifai (ВКПМ F-1027) и может быть использовано для получения противоопухолевых препаратов.
Известно, что в составе компонентов высших базидиомицетов, таких как Fomitopsis officinalis, Ganoderma lucidum, Coriolus pubescens, содержатся препараты, оказывающие иммуномодулирующее действие [Богдаев А.Г., 2007. / Изучение индукции иммуномодулирующих эффектов масляными экстрактами плодовых тел базидиомицетов у мышей с привитой опухолью карциномы. / А.Г.Богдаев, А.В.Лавлинский, М.А.Наквасина. // Успехи медицинской микологии. Т.9, 2007. - С.148-150; Горшина Е.С. Биотехнологический препарат лекарственного гриба кориола опушенного. // Е.С.Горшина, М.М.Скворцова, В.Г.Высоцкий. / Современная микология России. Тезисы докладов I конгресса микологов России. - М.: Национальная академия микологии. - 2002в. - С.295; Mahajna et al. Mushroom extracts having anticancer activity // Pub. No.: US 2006/0045887 A1. Pub. Date: Mar. 2, 2006. - p.21].
Из полисахаридов гриба Trametes. versicolor был получен и хорошо изучен клинически препарат японской биотехнологической фирмы «SanKyo» «Крестин» (PSK). Препарат зарекомендовал себя как достаточно эффективный и, что особенно важно, малотоксичный онкостатик при поддерживающей терапии раковых заболеваний, снижающий также гематологическую супрессию, вызываемую другими противоопухолевыми лекарствами, а также как нервоуспокаивающее и болеутоляющее средство [Larosz, W.A. Effect of saponin from Midicado saliva extract on biological activity of Trametes versicolor // W.A.Larosz, E.Malarczyk, М.Larzysta / J. New Horizon of Bioscience in Forest products Field, 2003. - P. 213-220].
Исследованиями последних лет показано, что микромицеты рода Trichoderma также обладают иммуномодулирующими и противоопухолевыми свойствами. Рядом авторов были установлены некоторые группы активных веществ, таких как триходермамиды - модифицированные дипептиды, выделенные из морского штамма T. virens. Виридиофунгины, изолированные из Т. viride, оказывают цитотоксический эффект на опухолевые клетки. Триходеноны и циклопептановые производные, изолированные из культуры Т. harzianum, паразитирующей на Halichondria okadai, обладают цитотоксическим эффектом на линии опухолевых клеток [Reino, J.L. Secondary metabolites from species of the biocontrol agent Trichoderma / J.L.Reino, R.F.Guerriero, R.Hema'ndez-Gala', I.G.Collado // Phytochem Rev. - 2008. - V.7. - p.89-123].
В настоящее время мировой микробиологической промышленностью не освоено производство противоопухолевых биологических препаратов на основе активных штаммов микромицетов рода Trichoderma.
Техническим результатом изобретения является штамм М 99/51 (ВКПМ F-1027), обладающий противоопухолевой активностью.
Цель достигается использованием штамма М 99/51 (ВКПМ F-1027) для подавления роста опухолевых клеток. Особенностью штамма является уникальный биохимический состав. Штамм при глубинном и поверхностном культивировании выделяет в культуральную жидкость метаболиты, обладающие противоопухолевыми свойствами в отношении линий опухолевых клеток: НаСаТ - кератиноциты человека; ТНР-1 - макрофагоподобная линия клеток человека; А431 - линия эпидермоидной карциномы человека; Jurkаt-Т-клетки человека; К562 - линия клеток хронической миелоидной лейкемии; НЕК 293Т - клетки эмбриональной почки человека. Действующее начало активных соединений не является белком или пептидом, а относится к молекулам, не имеющих амидных связей.
Предлагается применение этого штамма в качестве биопродуцента для создания на его основе противоопухолевых препаратов.
Штамм получен как моноспоровый клон путем селекции на противоопухолевую активность из дикого штамма М-99/5 Trichoderma harzianum (ВКПМ F-888), выделенного из мульчи в Мининском лесхозе Красноярского края.
Штамм М-99/51 Trichoderma harzianum характеризуется следующими признаками:
Макроморфологические признаки:
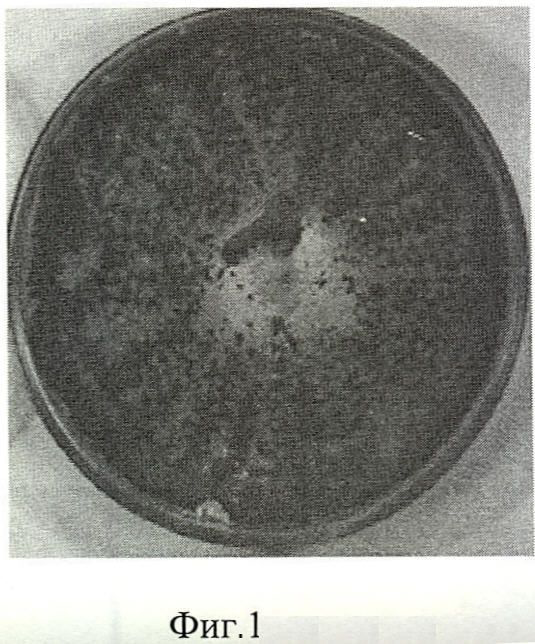
На диагностической среде (среда Чапека при 25°С) - рост очень быстрый, край колонии бахромчатый, мицелий ватообразный; Радиус колонии через 72 часа роста составляет 72-75 мм при температуре 22°С. Воздушный мицелий белого цвета, Цвет колоний от травяно-зеленого до зелено-малахитового. Пигмент в среду не выделяет (фиг.1).
Микроморфология:
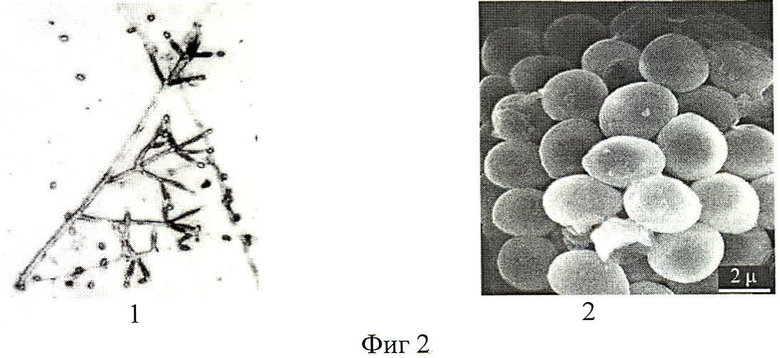
Конидиеносцы неокрашенные гладкие, прямые или слегка извилистые 4,0-8,0 µм в диаметре. Фиалиды собраны в группы по 2-5, с расширенной базальной частью и короткой узкой шейкой 5-7×3-5 µм, терминальные фиалиды более вытянутые до 12 µм в длину. Конидии яйцевидные, зеленого цвета, расположенные на гифах терминально или интеркалярно, размером 2,7-3,5×1,8-3,0 µм в диаметре (фиг.2). Образует хламидоспоры.
Другие среды, используемые для культивирования, - сусло-агар, овсяный агар.
Молекулярно-генетические признаки:
Штамм имеет следующую последовательность:
Степень сходства с коллекционными образцами согласно гомологии с другими штаммами (NCBI): №Z68189.1 Trichoderma harzianum штамм CBS 819.68 составляет 97,0%.
По заключению специалистов Красноярской краевой ветеринарной лаборатории данный штамм авирулентен, нетоксичен, нетоксигенен в отношении теплокровных организмов и не вызывает инфекционных заболеваний.
На фиг.1-8 представлены следующие иллюстрации:
Фиг.1. Морфология колоний штамма М-99/51 Trichoderma harzianum на сусло-агаре.
Фиг.2. Микроморфология мицелия, конидиеносцев и конидий штамма М 99/51 Trichoderma harzianum:
1. - Микроморфология конидиеносцев и мицелия;
2. - Морфология конидий (электронная микроскопия в растровом режиме).
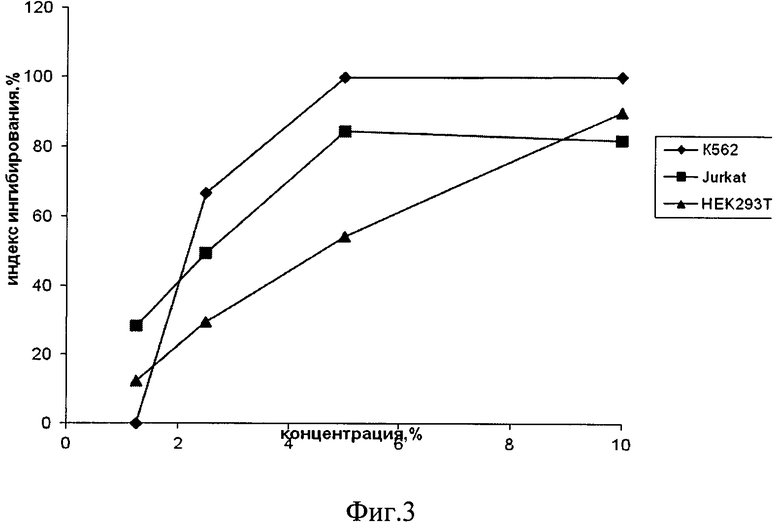
Фиг.3. Индекс ингибирования культуральной жидкостью штамма М 99/51 Trichoderma harzianum линий опухолевых клеток.
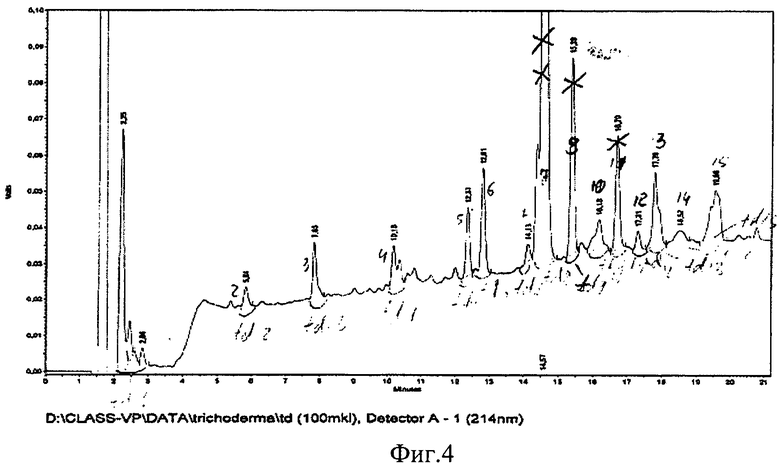
Фиг.4. Профиль элюции культуральной жидкости штамма Trichoderma harzianum M 99/51 на колонке с обращенной фазой, длина волны -214 нм.
Фиг 5. Оценка апоптоза линии клеток А431 при действии фракции F8 из культуральной жидкости штамма Trichoderma harzianum M99/51 (конфокальная микроскопия клеток, инкубирование 20 ч, увеличение х60).
Фиг.6. Индекс ингибирования клеток ТНР-1 и НЕК 293Т 72 ч 15 фракциями штамма Trichoderma harzianum M 99/51.
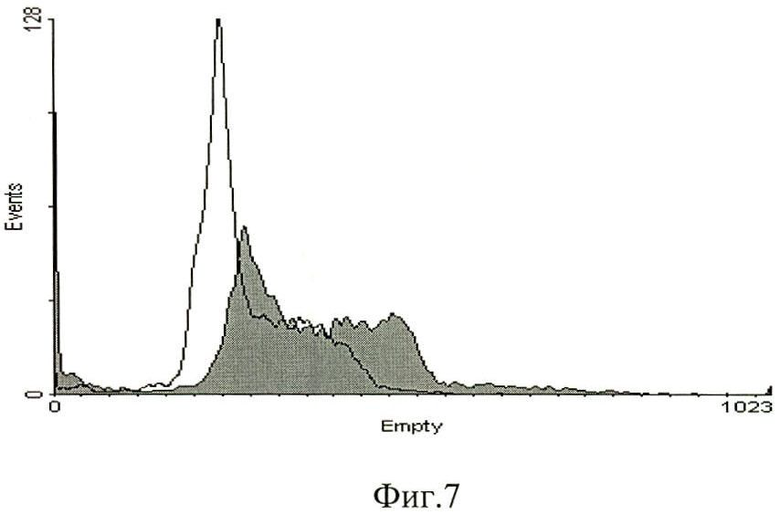
Фиг 7. Влияние фракции 8 культуральной жидкости штамма Trichoderma harzianum M 99/51 на цикл клеток К562. Белая область - контроль, серая - с добавлением фракции.
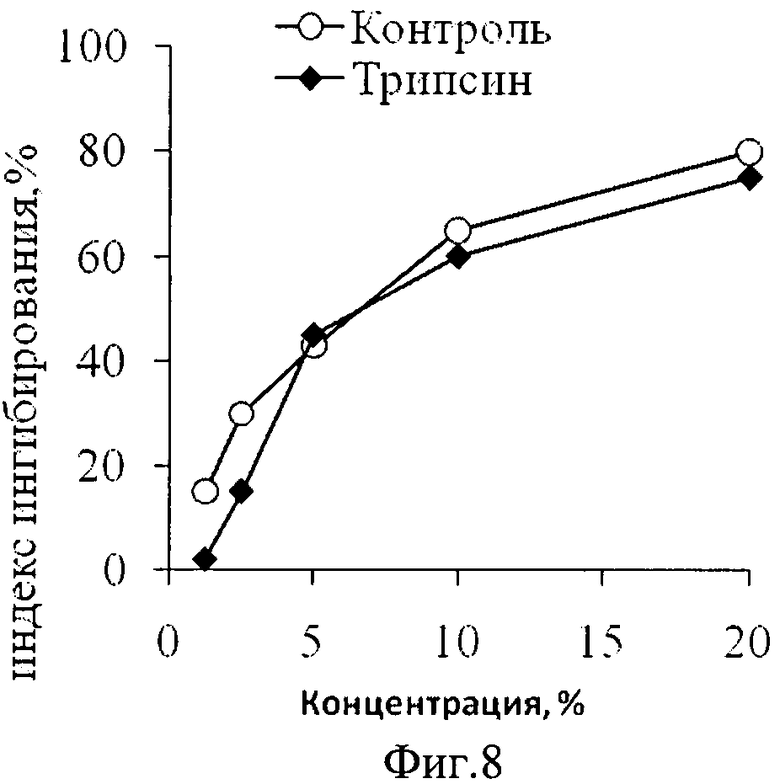
Фиг.8. Противоопухолевая активность фракции 8 культуральной жидкости штамма Trichoderma harzianum M 99/51 в отношении клеток К562 без обработки после обработки трипсином.
Пример 1. Глубинное культивирование штамма М 99/51 Trichoderma harzianum
Для исследования активности метаболитов грибов Trichoderma в отношении опухолевых клеток получают культуральную жидкость глубинным и смешанным жидкофазным культивированием на питательной среде Чапека следующего состава: сахароза - 30 г, нитрит натрия - 2 г, сульфат магния - 0,5 г, хлорид калия - 0,5 г, калий фосфорнокислый двузамещенный - 1,0 г.
Посев производят культурой штамма из расчета 1,5-2×106 конидий на 1 мл питательной среды. В качестве посевного материала используют культуру штамма, выращенную на скошенном сусло-агаре. Из пробирок делают смыв в колбы со стерильной водой, затем определяют титр спор в полученной суспензии микроскопическим способом в камере Горяева и методом пересчета на весь объем питательной среды используют необходимое количество суспензии для засева. Засев производят в колбы Эрленмейера объемом на 750 мл на 200 мл питательной среды.
Культивирование штамма проводят глубинным способом на качалке при 24-26°С в колбах объемом 750 мл в течение 5 и 10 суток, пока гриб не достигает стационарной фазы роста. Полученную культуральную жидкость центрифугируют и удаляют осадок, стерилизуют фильтрацией через фильтр с диаметром пор 0,22 мкм и тестируют на линиях опухолевых клеток.
Пример 2. Анализ цитотоксической активности метаболитов штамма М 99/51 Trichoderma harzianum
Для выявления противоопухолевой активности проводят анализ цитотоксичного и цитостатического эффектов in vitro с помощью МТТ теста. МТТ-тест используется для оценки цитотоксичности потенциально противоопухолевых соединений в эксперименте, который основан на способности дегидрогеназ живых клеток восстанавливать неокрашенные формы 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола (МТТ-реагента) до голубого кристаллического фармазана, растворимого в диметилсульфоксиде.
Для этого клетки различных клеточных линий вносят в плоскодонный 96-луночный планшет по 50 тыс. на лунку, в котором заранее титруют культуральную жидкость штамма М 99/51 Trichoderma harzianum. Планшеты инкубируют в CO2-инкубаторе 72 ч и на последние 4 часа добавляют 250 мкг/мл МТТ. По окончании инкубирования надосадочную жидкость убирают, а в лунки добавляют по 100 мкл диметилсульфоксида (Реахим, Москва) для растворения формазана. Планшеты анализируют на планшетном спектрофотометре (Titertek, UK), при длине волны 540 нм. Результаты обрабатывают с помощью пакета программ Excel (Microsoft). Действие препаратов оценивают по индексу ингибирования (ИИ), подсчитываемому по формуле: ИИ=[1-(ОПоп/ОПконт)]*100%, где ОПоп - оптическая плотность в опытных лунках, ОПконт - оптическая плотность в контрольных лунках.
Культуральная жидкость, полученная при глубинном культивировании штамма М 99/51 в течение 10 суток на среде Чапека, вызывает 100% гибель линий клеток К562, Jukat и НЕК 293Т (фиг.3).
Пример 3. Анализ проапоптотической активности метаболитов в культуральной жидкости штамма М 99/51 Trichoderma harzianum
Оценку проапоптотической активности культуральной жидкости штамма проводят с помощью окрашивания опытных клеток 10-N-нанонил-акридиновым оранжевым (НАО), который связывается с кардиолипином в митохондриях. Кардиолипин окисляется под действием апоптозных стимулов [Луценко Г.В. Цитометрический метод регистрации апоптоза с использованием флуорофора 10-N-нонил-акридинового оранжевого, Биологические мембраны, 2010, том 27, №5, С.430-439].
Для оценки апоптотического действия культуральной жидкости клетки А431 выращиют стерильно на предметных стеклах до конфлюэнтного монослоя. К монослою добавляют культуральную жидкость штамма в концентрации ЛД50 (50% летальная доза препарата, при которой наблюдается 50% подавление роста клеток) и инкубируют в течение 20 ч. Оценку апоптоза проводят окрашиванием клеток в течение 45 минут митохондриальными красителями Nonyl Acridine Orange (NAO), в соответствии с протоколом. Визуализацию клеток проводят с помощью окрашивания ядер красителем Hoechst33342 (Sigma). После окрашивания клетки фиксируют 2%-м раствором параформальдегида в течение 1 ч, затем трижды отмывают ФБ и полимеризуют на предметных стеклах с помощью смолы Mowiol 4.88 (Calbiochem, Германия). Детекцию проводят с помощью конфокальной микроскопии на микроскопе Эклипс Е2000 фирмы Никон (Япония).
В качестве контроля в оценке апоптотической активности культуральной жидкости используют противоопухолевый лекарственный препарат Актиномицин D.
В результате проведенных экспериментов по анализу цитотоксичности и проапоптотической активности установлено, что штамм проявляет значительную активность в отношении трех клеточных линий: А431 (фиг.5). При этом одним из механизмов действия является индукция апоптоза поздней стадии (20 ч).
Пример 4. Фракционирование метаболитов штамма М 99/51 Trichoderma harzianum методом высокоэффективной жидкостной хроматографии (ВЭЖХ).
Для более детального анализа действующего начала проводят фракционирование надосадочной жидкости методом ВЭЖХ. На фиг.4 приведен профиль элюции фракций в градиенте ацетонитрила. Полученные фракции лиофилизируют, растворяют в воде. Затем проводят анализ активности МТТ-тестом. Фракции, полученные из культурального фильтрата штамма М 99/51, тестируют на двух линиях опухолевых клеток ТНР-1 и НЕК 293Т. Результаты эксперимента представлены в виде гистограммы на фиг 6. Проанализировав результаты эксперимента, отмечают, что фракция F8 оказывает токсическое действие на две линии клеток ТНР-1 и НЕК 293Т и представляет интерес для выделения противоопухолевого соединения.
Пример 5. Анализ клеточного цикла активной фракции штамма М 99/51 Trichoderma harzianum
Анализ влияния фракции, полученной из культуральной жидкости штамма М 99/51 при культивировании штамма в течение 10 суток, на клеточный цикл проводят на суспензионных линиях клеток Jurkat и К562. Фракции добавляют к клеткам на 24 ч. По окончании инкубации клетки переводят в фосфатный буфер (ФБ), центрифугируют, а осадок фиксируют холодным 70%-м этанолом в течение 12 часов при минус 2°С. По окончании фиксирования клетки отмывают ФБ и окрашивают раствором йодистого пропидия (50 мкг/мл) в присутствии 10 мкг/мл РНКазы (Евроген, Москва) в течение 1 часа. После чего проводят анализ клеточного цикла на приборе FACScan (BD). При анализе выставляют регион по площади и ширине пика для выбора синглетных клеток (фиг.7). В результате сравнения двух гистограмм не выявили действия надосадка на клеточный цикл, что означает отсутствие активности ингибитора клеточного цикла.
Пример 6. Противоопухолевое действие культуральной среды и активной фракции штамма М 99/51 Trichoderma harzianum веществ пептидной природы
Для анализа роли пептидов и белков в противоопухолевом действии используют фракцию 8 культуральной жидкости штамма М 99/51 Trichoderma harzianum. Проводят гидролиз с помощью 0,05% трипсина в течение 16 ч. Цитотоксичность полученного гидролизата трипсина оценивают на линиях клеток НаСаТ b THP-1 с помощью МТТ-теста. Фракцию 8 культуральной жидкости после гидролиза вносят в культуру клеток в различных количествах. В качестве контроля используют исходную фракцию, которую выдерживают 16 часов без добавления трипсина. Анализ цитотоксичности при различных концентрациях фракции 8 культуральной жидкости гриба не показал изменения активности культуральной жидкости в результате гидролиза компонентов трипсином, что означает отсутствие пептидов в составе действующего начала изучаемого препарата (фиг.8).
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ МАКРОМИЦЕТА Trametes versicolor, ИСПОЛЬЗУЕМЫЙ В КАЧЕСТВЕ ПРОДУЦЕНТА ДЛЯ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ПРОТИВОПЛЕСНЕВЫХ ПРЕПАРАТОВ | 2013 |
|
RU2541770C1 |
| ШТАММ БАЗИДИОМИЦЕТА Fomitopsis Tyv-2006, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ | 2007 |
|
RU2360960C1 |
| ШТАММ Trichoderma citrinoviride Bissett - ПРОДУЦЕНТ АНТИБИОТИКОВ-ПЕПТАИБОЛОВ С АНТИГРИБНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2564577C1 |
| Штамм Emericellopsis alkalina Bilanenko & Georgieva - продуцент антибиотиков - пептаиболов с антигрибной и антибактериальной активностью | 2019 |
|
RU2704421C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУБСТАНЦИИ L-ЛИЗИН-АЛЬФА-ОКСИДАЗЫ | 2011 |
|
RU2471866C1 |
| Штамм Streptomyces hygroscopicus 18 - продуцент нафтохиноновых антибиотиков - астолидов А и В с противогрибковой и цитотоксической активностью и способ их получения | 2018 |
|
RU2681828C1 |
| Штамм базидиального гриба Inonotus obliquus - продуцент пигмента меланина, обладающего противовирусной и противоопухолевой активностью | 2019 |
|
RU2716590C1 |
| Штамм Trichoderma asperellum - продуцент гидролитических ферментов и пептидных метаболитов и его применение | 2015 |
|
RU2620971C1 |
| Штамм базидиального гриба Daedaleopsis confragosa, содержащий белки, проявляющие противоопухолевую и противовирусную активность | 2017 |
|
RU2663111C1 |
| БЕЛКОВОПЕПТИДНЫЙ ПРОТИВООПУХОЛЕВЫЙ КОМПОЗИТ, КЛЕТОЧНЫЙ ПРЕПАРАТ, АКТИВИРОВАННЫЙ ЭТИМ КОМПОЗИТОМ, И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2004 |
|
RU2283129C1 |

Изобретение относится к области микробиологии. Предложен штамм Trichoderma harzianum Rifai M 99/51, депонированный в ВКПМ под номером F-1027. Особенностью штамма является синтез активных противоопухолевых соединений непептидной природы, не имеющих амидных связей. Для штамма характерно продуцирование противоопухолевых соединений. Штамм обладает высокой цитотоксической активностью в отношении линий опухолевых клеток (НаСаТ-кератиноциты человека; ТНР-1 макрофагоподобная линия клеток человека; А431 - линия эпидермоидной карциномы человека; Jurkat - Т-клетки человека; К562 - линия клеток хронической миелоидной лейкемии; НЕК293Т - клетки эмбриональной почки человека) и может быть использован для получения противоопухолевых препаратов. Предлагается применение этого штамма в качестве продуцента для создания на его основе противоопухолевых препаратов. 8 ил., 6 пр.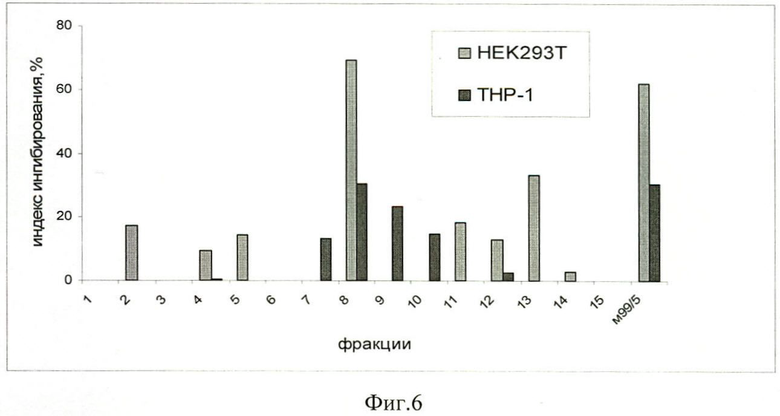
Штамм Trichoderma harzianum Rifai M 99/51 (ВКПМ F-1027), используемый для получения противоопухолевых препаратов.
| RU 2002108326 A, 10.01.2004 | |||
| RU 2010101054 A, 01.01.2011. |
Авторы
Даты
2012-10-27—Публикация
2011-10-04—Подача