Область техники, к которой относится изобретение
Изобретение относится к области микробиологии, химии природных соединений и медицины, а именно к продуценту биологически активным соединений, проявляющим антифунгальную и противоопухолевую активность и применимым в качестве лекарственного препарата в медицинской практике.
Предшествующий уровень техники Около 1,2 миллиарда человек по всему миру страдает от грибковых инфекций. Частота возникновения микозов в последние годы увеличилась из-за растущего количества пациентов с ослабленным иммунитетом, например больных СПИДом или требующих иммуносуппресивной терапии после пересадки органов, при аутоиммунных или раковых заболеваниях [Y.-L. Chang et al., New facets of antifungal therapy. Virulence 8 (2017) 222-236]. В современной клинической практике в основном используются антифунгальные агенты пяти основных классов: (1) азолы; (2) эхинокандины; (3) полиены; (4) аллиламины; (5) аналоги пиримидина [A.M. Fuentefria et al., Antifungals discovery: an insight into new strategies to combat antifungal resistance. Lett. Appl. Microbiol. (2017). doi: 10.1111/lam.12820]. Большая часть новых антифунгальных препаратов, внедряемых в клиническую практику, имеет синтетическую или полусинтетическую природу [D.J. Newman and G.M. Cragg, Natural products as sources of new drugs from 1981 to 2014. J. Nat. Prod. 79 (2016) 629-661]. Таким образом, современное состояние медицинской практики в области микозов требует новых препаратов, активных в отношении резистентных патогенных штаммов грибов, а также новых скаффолдов природного происхождения для разработки полусинтстических соединений.
У заявляемою антибиотика имеется ряд близких структурных аналогов, имеющих иной спектр активности. Наиболее близкими к заявленным являются вещества лангколид [S.E. Helaly et al., Langkolide, a 32-membered macrolactone antibiotic produced by Streplomyces sp. Acta 3062. J. Nat. Prod., 75 (2012) 1018-1024], деплелиды А и Б [Т. Takeuchi et al.. ATP Depletion assay led to the isolation of new 36-membered polyol macrolides deplelidcs A and В from Streptomyces sp. MM581-NF15. Org. Lett., 19 (2017) 4207-4210], а также соединения PM100117 и PM100118 [M. Perez et el., PM100117 and PM100118, new antitumor macrolides produced by a marine Streplomyces caniferus GUA-06-05-006A. J. Antibiot. 69 (2016) 388-394].
Раскрытие изобретения
Сущность изобретения заключается в получении нового штамма-продуцента, накапливающего в культуральной жидкости антибиотики астолиды А и В, структура которых ранее не описана. Способ выделения астолидов А и В заключается в экстракции активных соединений из культуральной жидкости с помощью бутанола с дальнейшим осаждением этилацетатом. Индивидуальные астолиды А и В выделяют методом ВЭЖХ. Выделенные новые антибиотики не проявляют активности в отношении грамположительных и грамогрицательных бактерий Staphylococcus aureus (АТСС 21027), Bacillus subtilis (АТСС 6633) и Escherichia coli (АТСС 25922). Астолиды А и В обладают ингибирующим действием в отношении коллекционных штаммов грибов Aspergillus niger АТСС 16404 и дрожжей Candida albicans АТСС 14053. а также в отношении клинических изолятов патогенных микроорганизмов С. albicans 219, A. niger 219 и С. tropicales 1402. резистентных к азолам. Кроме того для этих веществ показана цитотоксическая активность в отношении ряда опухолевых линий клеток человека.
Осуществление изобретения
Пример 1. Определение видовой принадлежности штамма 18 (ВКПМ Ас-2079) Streptomyces hygroscopicus
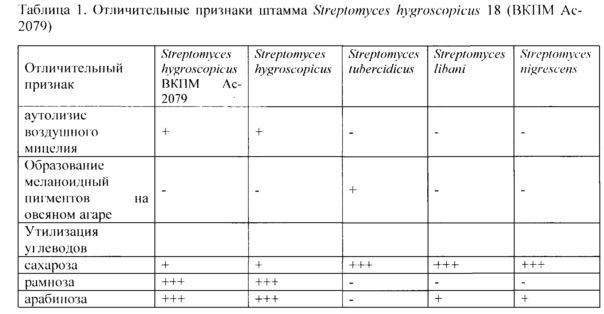
Макроморфологические признаки: штамм растет на всех средах с оптимумом роста при 25-27°C, на твердых питательных средах образует обильный воздушный и субстратный мицелий. Температурный оптимум роста на твердых и жидких средах составляет 25-27°C. Штамм спорулирует на всех указанных средах. Колонии обособленные, округлой формы, приподняты над агаром, шероховатые, диаметр колоний до 5 мм. Растворимый пигмент отсутствует.
Микроморфологические признаки:
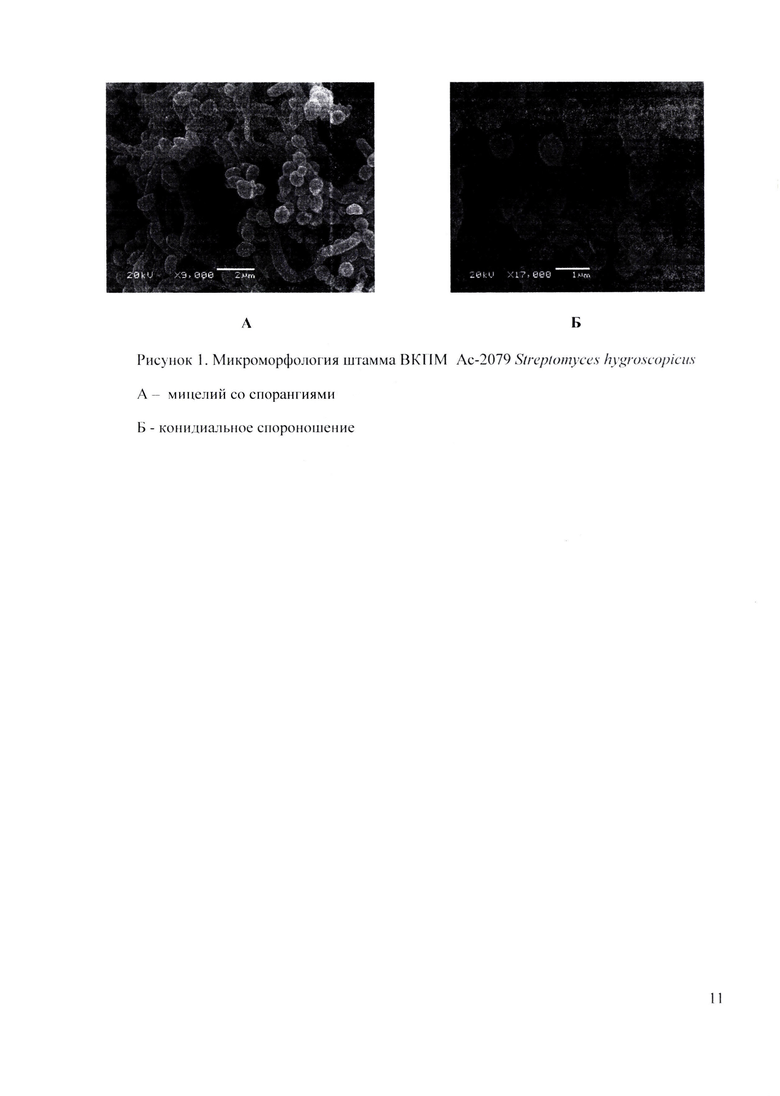
Культура грамположительная. Воздушный мицелий сильно разветвленный, на концах гиф имеются длинные спиралевидные цепочки неподвижных спор. Диаметр гиф воздушного мицелия 0,8-1,0 мкм. Зрелая цепочка спор состоит из 10 и более спор овальной формы (Рисунок 1).
Характерные особенности роста культуры на агаризованных питательных средах:
Органическая среда Гаузе 2: воздушный мицелий в логарифмической фазе роста имеет белый цвет, при переходе к стационарной фазе воздушный мицелий приобретает серый оттенок. Субстратный мицелий бежевого цвета. Колонии кожистые с неровными краями. Соево-глицериновая среда (состав в г/л: соевая мука - 15, глицерин - 30. NaCl - 3, СаСО3 - 3, агар - 20, рН 7,0): воздушный мицелий серого цвета, субстратный мицелий бежевою цвета. Колонии кожистые с неровными краями.
Овсяный агар (в г/л: овсяная мука - 20, агар - 20, рН 7,2): воздушный мицелий в центре колонии серого цвета, по краям - белого. Колонии кожистые с неровными краями. Для культуры, выращиваемой более 10 суток характерно увлажнение и автолиз воздушного мицелия, в результате цвет воздушного мицелия становится черным. Субстратный мицелий светло-серого цвета.
Минеральный агар Гаузе 1 (в г/л: крахмал - 20. K2НРO4 - 0,5, MgSO4×7H2O - 0,5, KNO3 -1,0, NaCl 0,5, FeSO4×7H2O - 0,01, агар - 20, рН 7,2-7,4): воздушный мицелий серый, со временем становится черным, в результате увлажнения и автолиза. Субстратный мицелий бежевого цвета.
Для культуры, выращиваемой на овсяном агаре и минеральном агаре Гаузе 1 свыше 10 суток, характерен лизис воздушного мицелия.
Физиолого-биохимические признаки:
Штамм S. hygroscopicus 18 способен утилизировать углеводы: глюкозу, сахарозу, рамнозу, галактозу, арабинозу. маннит.
Клеточная стенка содержит L-диаминопимелиповую кислоту и глицин. Основные фосфолипиды мембран: фосфатидилглицерин, фосфатидилинозит, фосфатидилсерии Характерной особенностью штамма S. hygroscopicus ВКПМ Ас-2079 и его отличием от близкородственных видов S. libani, S. nigrescens, S. iubercidicus является автолиз воздушного мицелия, наблюдаемый на овсяном агаре и минеральном агаре Гаузе 1 при длительном выращивании культуры. Окраска воздушного мицелия у единичных колоний на овсяном агаре (центр колоний серого, а по краям белого цвета) также характерна /для вида S. hygroscopicus. Отличительные признаки штамма S. hygroscopicus ВКПМ Ас-2079 от близкородственных видов приведены в табл. 1
Филогенетический анализ: Выделенная культура идентифицирована согласно фенотипическим и генотипическим признакам как S. hygroscopicus с использованием универсальной системы праймеров 27f, 341f-gcd, 785f, 1492r. Нуклеотидные последовательности гена 16S рРНК депонированы в GenBank NCBI с присвоением индивидуального номера доступа - MG832042.1
https://www.ncbi.nlm.nih.gov/nuccore/MG832042

Для получения антибиотиков штамм S. hygroscopicus ВКПМ Ас-2079 культивируют при 27°С в колбах Эрленмейера емкостью 750 мл в течение 5-7 дней при скорости качалки 220 об/мин на среде следующего состава (в г/л): соевая мука - 5. глицерин - 20, (NH4)2SO4 - 1.5, NaCl - 3, СаСO3 - 3, вода водопроводная - 1 л, рН 6.8.
Культивирование проводится при 27°С течение 5-6 дней при скорости качалки 220 об/мин.
Пример 2. Выделение астолидов из культуральной жидкости штамма Streplomyces hygroscopicus 18 (ВКПМ Ас-2079)
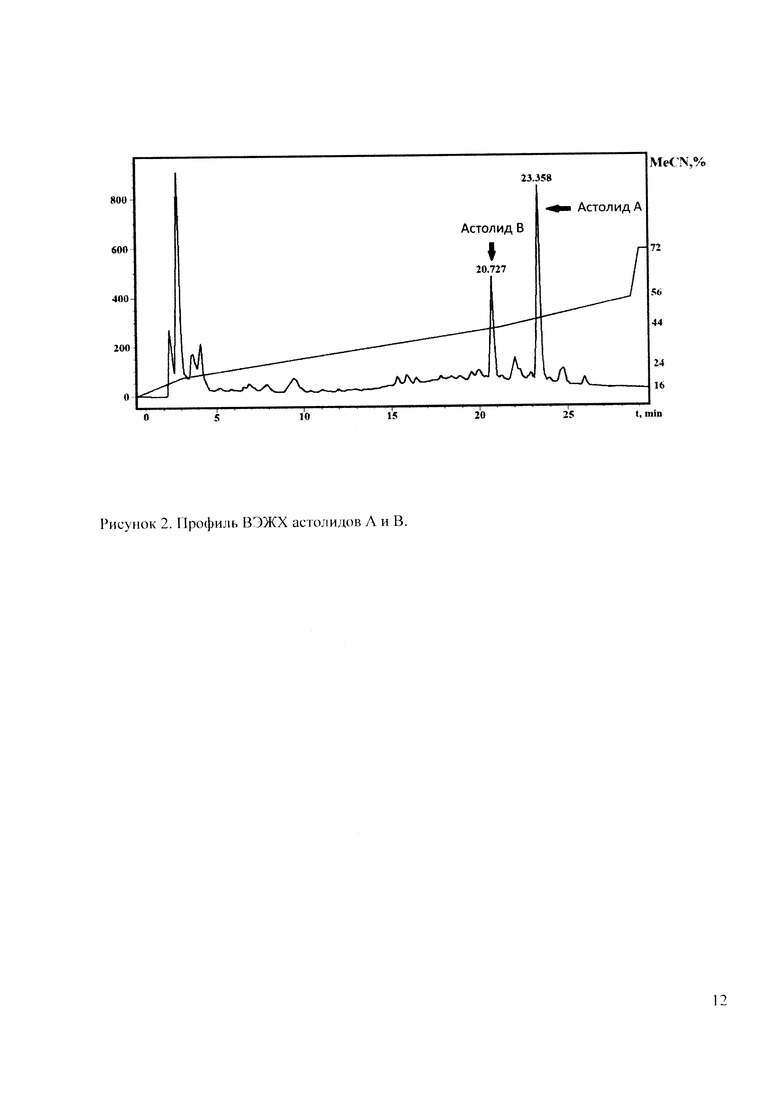
Культуральную жидкость центрифугируют и фильтруют, мицелий отбрасывают. Фильтрат культуральной жидкости экстрагируют бутанолом-1 (2×300 мл), органические вытяжки объединяют и упаривают досуха. Сухой экстракт растворяют в 100 мл этанола, затем добавляют 100 мл этилацетата и оставляют при 4°С на 12 ч, затем раствор фильтруют, осадок отбрасывают. Раствор упаривают досуха, затем растворяют в минимальном объеме спирта (7 мл). После добавления 150 мл этилацетата образуется осадок (0,24 г), содержащий астолиды А и В. Для дальнейший очистки сырец антибиотика подвергают фракционированию методом обращенно-фазовой высокоэффективной жидкостой хроматографии на колонке XBringe 4.6×250 м. 5 μм. 100 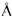 . с использованием линейного градиента ацетонитрила в воде 16→24% 2 мин, 24→44% 20 мин. 44→56% 8 мин, 56→72% 1 мин и изократического элюирования при 72% в течение 5 мин, скорость потока 0.9 мл/мин, детекция по поглощению при 254 нм. Собирают фракции с временами удерживания 20,7 мин и 23,4 мин (Рисунок 2). После лиофилизации собранных фракций получают астолид А в количестве 20-25 мг и астолид B в количестве 35-45 мг, оба вещества представляют собой аморфные твердые соединения.
. с использованием линейного градиента ацетонитрила в воде 16→24% 2 мин, 24→44% 20 мин. 44→56% 8 мин, 56→72% 1 мин и изократического элюирования при 72% в течение 5 мин, скорость потока 0.9 мл/мин, детекция по поглощению при 254 нм. Собирают фракции с временами удерживания 20,7 мин и 23,4 мин (Рисунок 2). После лиофилизации собранных фракций получают астолид А в количестве 20-25 мг и астолид B в количестве 35-45 мг, оба вещества представляют собой аморфные твердые соединения.
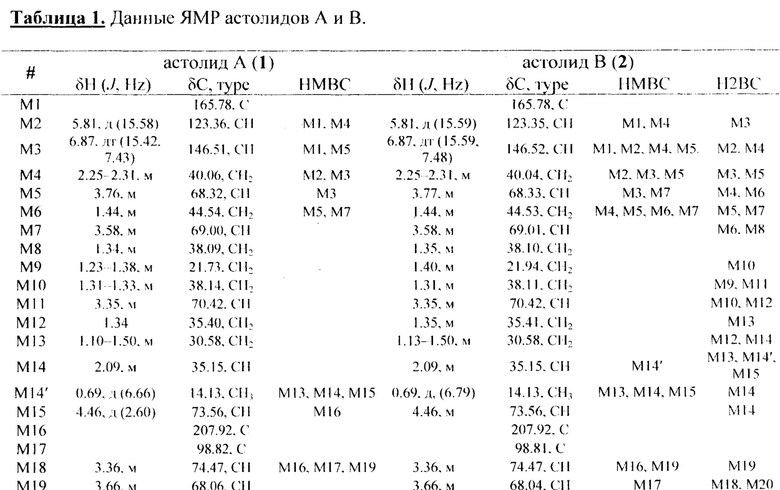
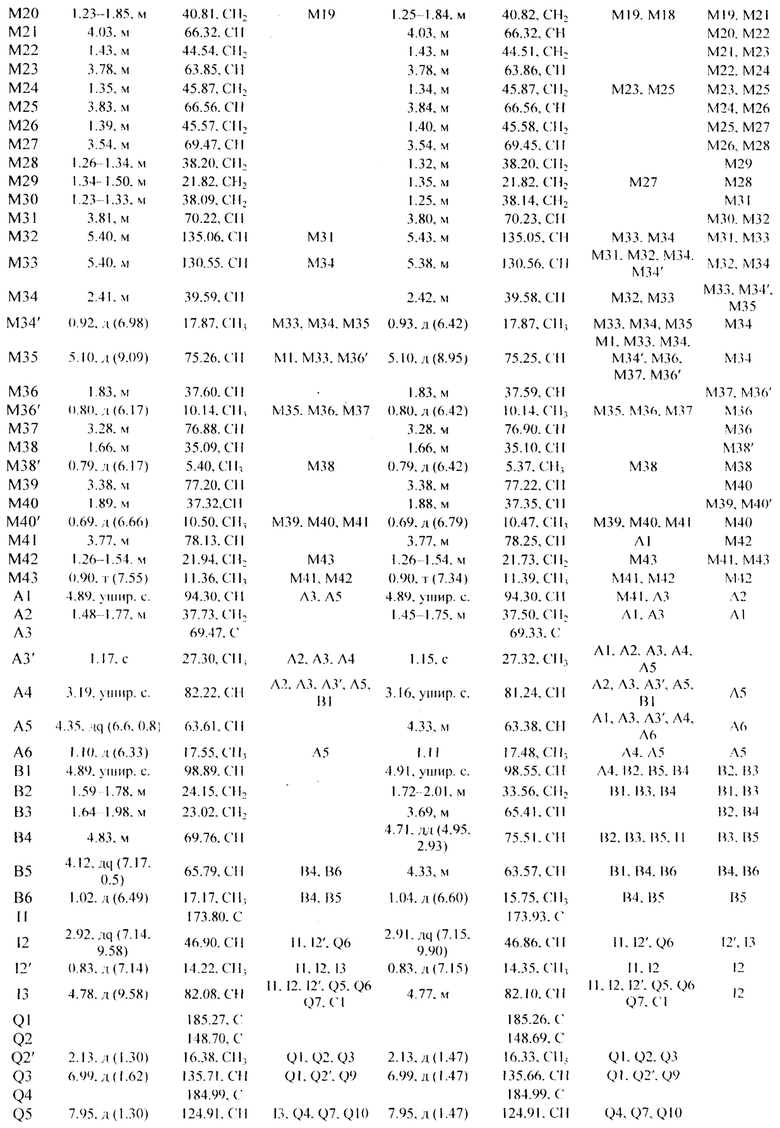
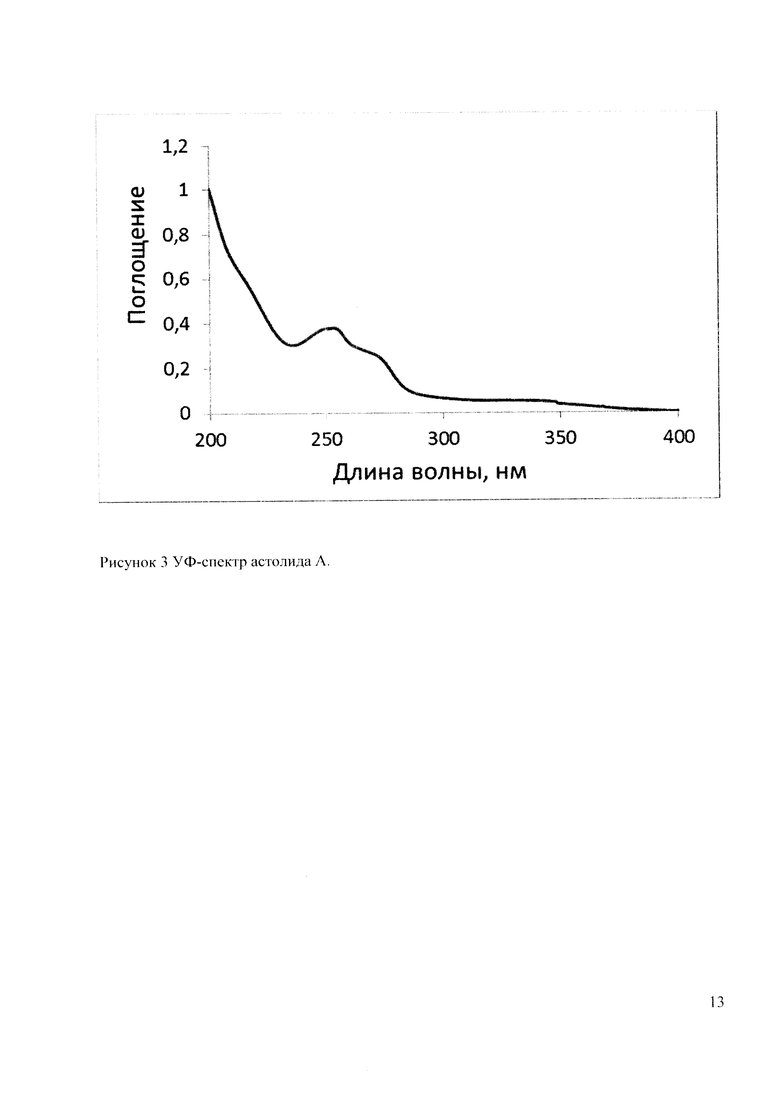
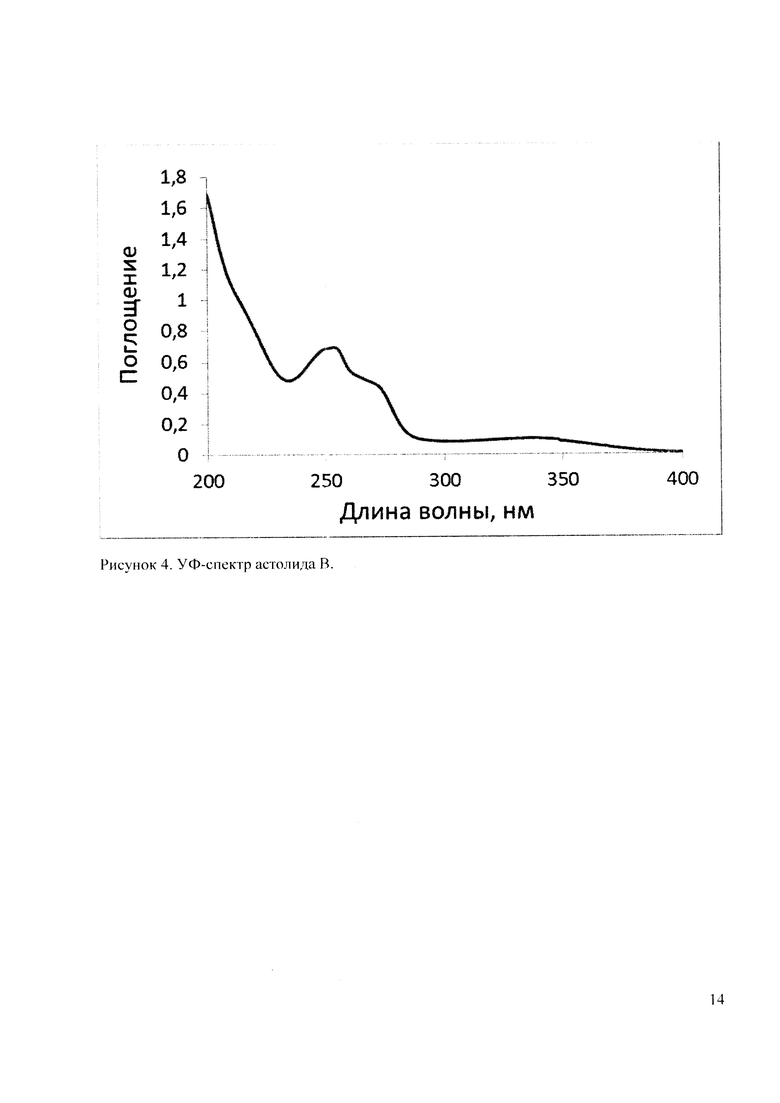
УФ-спектры астолидов А и В (Рисунок 3 и 4) очень близки и содержат максимумы поглощения с длинами волн λmax 254, 272 и 337 нм, характерными для 1,4-нафтохинонового фрагмента. Бруттснформулы астолидов А и В подтверждаются данными масс-спектромстрии высокого разрешения: астолид А (1) С82Н130О29 1601.8584 (расчетная масса M+Na 1601.8590); астолид В (2) С82Н130O30 1617.8533 (расчетная масса M+Na 1617.8539).
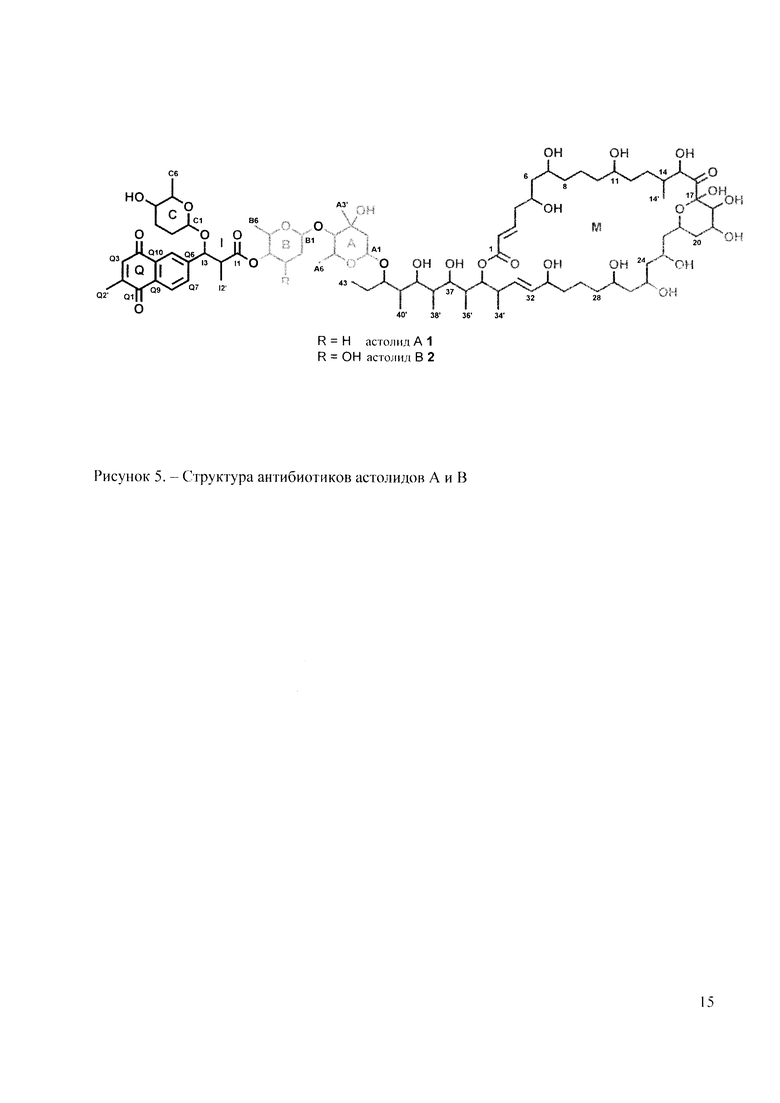
Сигналы в спектрах ЯМР 1Н и 13С представлены в Таблице 1. Структура соединений представлена на рисунке 5.

Пример 3. Определение фунгицидной активности Streptomyces hygroscopicus штамма 18 (ВКПМ Ас-2079) в отношении штаммов условно-патогенных и токсигенных мицелиальных и дрожжевых грибов
Тест-объектами берут коллекционные штаммы условно - патогенных мицелиальных и дрожжевых грибов Candida albicans АТСС 2091. С. tropicales INA 00763 и условно-патогенных микромицетов - A. oryzae 1К, A. niger 2К, A. fumigatus 4К, A.terreus 4К, A. fisheri 3К, A. flavus 7К и токсигенных грибов: P. brevicompactum VKM F-4481, P. chrysogenwn VKM F-4499, Fusarium 890, Fusarium 148. Контролем служат стандартные диски с амфотерицином В («НИИ Пастера», 40 мкг/мл). Величину диаметра зоны подавления роста тест-культур оценивают на 2-5 сутки.
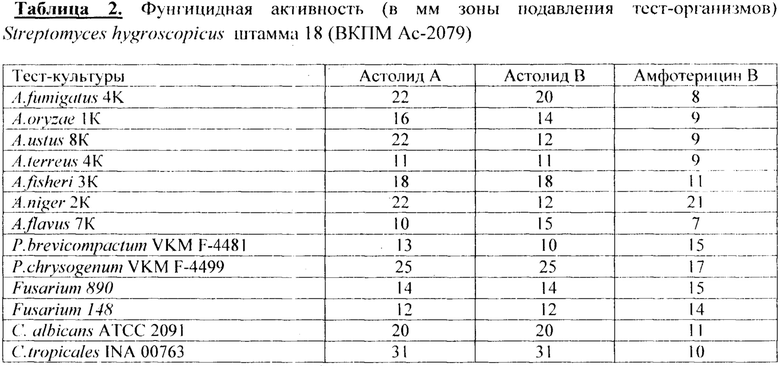
Ингибируетея рост всех условно-патогенных и токсигенных тест-культур мицелиальных грибов, но особенно эффективны астолиды А и В против A. fumigatus 4K, A. niger INA 00760, P. chrysogenwn VKM F-4499. Высокую активность проявляют в отношении дрожжей С. tropicales INA 00763.
Пример 4. Определение фунгицидной активности астолидов А и В в отношении клинических изолятов мицелиальных и дрожжевых грибов, резистентных к азолам.
В качестве тест-объектов используют клинические изоляты дрожжевых грибов, возбудителей инвазивных кандидозов с множественной резистентностью к применяемым антибиотикам - азолам: Candida albicans 1582м 2016 - возбудитель ка иди доза пищевода на фоне туберкулеза с легочным компонентом, туберкулезом селезенки и ВИЧ, С. tropicales 1402 - возбудитель кандидоза легких на фоне туберкулеза и ВИЧ. Также используют изоляты мицелиальных грибов - возбудителей вторичных инвазивных аспергиллезов у туберкулезных больных с множественной резистентностью к применяемым антибиотикам - азолам: Aspergillus fumigatus 163м 2016; Aspergillus flavus 905м 2016; Aspergillus terreus 1133м 2011; Aspergillus ochraceus 497м 2015; Aspergillus niger 219 2016. Для экспериментов по определению антимикробной активности тестируемых соединений готовят инокулюм тест-культур, для чего используют чистую суточную культуру грибов, выращенных на соответствующих плотных питательных средах при температуре 35°С. Далее в стерильном физиологическом растворе (0.85% NaCl) готовили взвесь микроорганизмов, доводя ее до определенной плотности. Плотность суспензий составляла 0.1-0.5 по стандарту МакФарланда.
Тестируемые вещества растворяют в ДМСО с начальной концентрацией 64 мкг/мл и готовят серии двукратных разведений от 16 мкг/мл до 0.25 мкг/мл в среде RPMI 1640. Эксперименты проводили в стерильных 96-луночных плоскодонных планшетах. В лунки каждого планшета вносят сначала по 100 мкл растворов серийных разведений тестируемых препаратов, а затем по 100 мкл раствора инокулята тест-культуры в среде RPMI 1640.
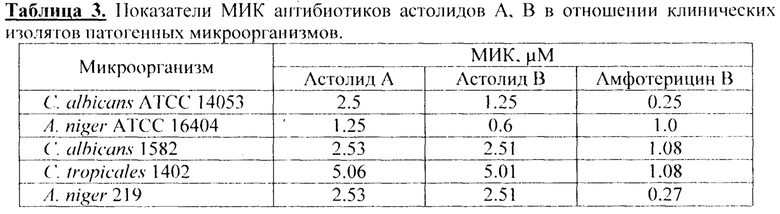
Соединения ингибируют рост патогенных клинических дрожжевых и плесневых грибов, минимальная подавляющая концентрация составляет от 0.27 до 5 мМоль. Наибольшую активность проявляют в отношении возбудителей вторичных инвазивных микозов у больных фиброзно-кавернозным туберкулезом легких: A. niger 219, С. albicans 1582 и С. tropicales 1402.
Пример 5 Определение цитотоксической активности астолидов А и В в отношении опухолевых клеток
Для экспериментов используют линии клеток человека: НСТ-116 (аденокарцинома толстой кишки человека), К-562 (хронический миелоидный лейкоз человека), К-562/4 (ее сублиния с экспрессией Р-гликопротеина), ПФЧ (посгнатальные фибробласты человека). HL60 (нромиелоцитарный лейкоз), U937 (монобластный лейкоз). Цитотоксическую активность оценивают с использованием колориметрического МТТ-теста, основанного на восстановлении бесцветной соли тетразолия (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид, МТТ) митохондриальными и цитоплазматическими дегидрогеназами живых метаболически активных клеток. Клетки культивируют в модифицированной по Дальбекко среде Игла (ДМЕМ) (ПанЭко. Россия) и RPMI 1640 с добавлением 5% эмбриональной телячьей сыворотки (США). 2 мМ L-глутамина, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина при 37°С, 5% СO2 в увлажненной атмосфере. В экспериментах использовали культуры в логарифмической фазе роста.
96-луночные планшеты засевают клетками, выдерживают 12 часов (ночь) для прикрепления, среда заменяется на свежую и в нее добавляют х500-кратные растворы тестируемых веществ. В качестве отрицательного контроля используют те же клетки и в той же посевной концентрации с добавлением в культуральную среду вместо испытуемых веществ такого же объема ростовой среды с DMSO. Определение оптической плотности растворов формазана проводят на спектрофотометре (модель 680 BIO-RAD, США) при длине волны в 540 нм. Статистическую обработку результатов проводят с помощью программы Excel. Измерения проводят на 4-е сутки инкубации без смены среды в планшетах.
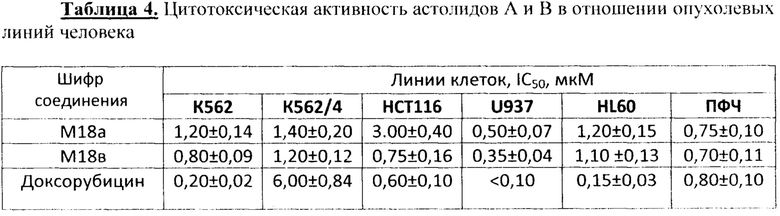
Астолиды А и В ингибируют рост опухолевых линий в концентрациях от 0,35 до 3 мкМ.
Промышленная применимость
Изобретение может быть использовано в медицине и ветеринарии, в качестве лекарственного средства, а также в научно-исследовательских лабораториях.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ Trichoderma citrinoviride Bissett - ПРОДУЦЕНТ АНТИБИОТИКОВ-ПЕПТАИБОЛОВ С АНТИГРИБНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2564577C1 |
| Штамм Emericellopsis alkalina Bilanenko & Georgieva - продуцент антибиотиков - пептаиболов с антигрибной и антибактериальной активностью | 2019 |
|
RU2704421C1 |
| СРЕДСТВО ДЛЯ ПОЛУЧЕНИЯ ПРОТИВОГРИБКОВОГО ПЕПТИДНОГО АНТИБИОТИКА, АКТИВНОГО В ОТНОШЕНИИ ВОЗБУДИТЕЛЕЙ ИНВАЗИВНЫХ МИКОЗОВ | 2020 |
|
RU2764304C1 |
| Штамм Trichoderma viride - продуцент соясапонина с противогрибной и ростстимулирующей активностью к растениям и дождевым червям | 2020 |
|
RU2750957C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОГРИБКОВОГО АНТИБИОТИКА ЭМЕРИЦИЛЛИПСИНА А | 2019 |
|
RU2710377C1 |
| Штамм актиномицета Streptomyces pratensis - продуцент антибиотиков, используемый для защиты овощных культур от мягкой гнили, вызываемой фитопатогенными бактериями Pectobacterium caratovorum | 2022 |
|
RU2798572C1 |
| Способ выделения и очистки нафтохиноновых противогрибковых антибиотиков астолидов А и В | 2019 |
|
RU2725187C1 |
| Штамм микромицета Penicillium crustosum ИНА 01369 ВКПМ F-1843 - продуцент антибиотиков, обладающий антимикробной активностью к фитопатогенным грибам рода Fusarium | 2023 |
|
RU2820703C1 |
| Штамм хитинолитического актиномицета Streptomyces baarnensis для защиты растений от фитопатогенных грибов и стимуляции роста растений | 2024 |
|
RU2839282C1 |
| Штамм бактерий Streptomyces hygroscopicus Ac-2158 для получения биопрепарата против возбудителей грибных болезней сои | 2022 |
|
RU2788200C1 |
Предложена группа изобретений, относящихся к биотехнологии - штамм Streptomyces hygroscopicus ВКПМ Ас-2079 - продуцент антибиотиков астолидов А и В и способ получения антибиотиков астолида А и астолида В с применением указанного штамма. Штамм Streptomyces hygroscopicus 18, обладающий антифунгальной активностью в отношении A. niger, C. albicans и C. tropicalis, депонирован в ВКПМ под регистрационным номером ВКПМ Ас-2079. Способ получения антибиотиков астолидов А и В предусматривает культивирование штамма Streptomyces hygroscopicus ВКПМ Ас-2079 на соевой питательной среде при температуре 27 0С в течение 5-6 дней. Полученную культуральную жидкость центрифугируют, фильтруют и проводят экстрагирование этанолом с последующим осаждением этилацетатом и выделением антибиотиков астолида А и астолида В методом высокоэффективной жидкостной хроматографии с использованием линейного градиента ацетонитрила в воде. Группа изобретений позволяет получить новые противогрибковые антибиотики астолиды А и В, обладающие антифунгальной активностью в отношении A. niger, C. albicans и C. tropicalis. 2 н.п. ф-лы, 5 ил., 5 табл., 5 пр.
1. Штамм Streptomyces hygroscopicus - продуцент нафтохиноновых антибиотиков, астолидов А и В, активных в отношении патогенных грибов и опухолевых клеток, с продуктивностью 25 и 45 мг/л, депонированный во Всероссийской коллекции промышленных микроорганизмов под номером ВКПМ Ас-2079.
2. Способ получения антибиотиков астолидов А и В, в котором штамм - продуцент по п. 1 культивируют в колбах Эрленмейера емкостью 750 мл, содержащих 150 мл жидкой соево-глицериновой питательной среды при скорости качалки 220 об/мин при 27°С в течение 5-6 дней, после чего активные соединения экстрагируют из культуральной жидкости с помощью бутанола с дальнейшим осаждением этилацетатом и выделением индивидуальных астолидов А и В методом ВЭЖХ.
| SOLEIMAN E | |||
| HELALY, ANDREAS KULIK et.al | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Способ изготовления масс из растительных и животных волокнистых материалов | 1923 |
|
SU3062A1 |
| ТЕЛЕФОННЫЙ АППАРАТ | 1923 |
|
SU1018A1 |
| ШТАММ АКТИНОМИЦЕТА STREPTOMYCES HYGROSCOPICUS SUBSP. ЦКМ В-4561, ОБЛАДАЮЩИЙ ФУНГИЦИДНЫМИ, БАКТЕРИЦИДНЫМИ И ИНСЕКТИЦИДНЫМИ СВОЙСТВАМИ | 2002 |
|
RU2243259C2 |
| RAUL GARSIA SALCEDO, CARLOS OLANO, et.al | |||
| Автоматический станок для прорезания шлицев в головках винтов | 1952 |
|
SU100117A2 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Штамм Amycolatopsis orientalis - продуцент антибиотика диметилванкомицина и способ получения антибиотика | 2016 |
|
RU2633511C1 |
| БИБИКОВА М.В., ГРАММАТИКОВА Н.Э | |||
| и др | |||
| Штамм Streptpomyces sp | |||
| - продуцент олигомицина SC-II (характеристика продуцента, биологические свойства антибиотика), Антибиотики и химиотерапия, 2012, 57, с | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ШТАММ STREPTOMYCES BAMBERGIENSIS - ПРОДУЦЕНТ МОЕНОМИЦИНА А | 1992 |
|
RU2013448C1 |
Авторы
Даты
2019-03-12—Публикация
2018-04-04—Подача