УРОВЕНЬ ТЕХНИКИ
Воспалительное заболевание кишечника включает хронические желудочно-кишечные расстройства, характеризующиеся инфильтрацией клеток воспаления в слизистую оболочку пищеварительного тракта. Среди этих заболеваний преобладающими являются два состояния - язвенный колит и болезнь Крона.
Язвенный колит развивается в толстом кишечнике (т.е. толстой кишке). Внутренняя оболочка пораженного кишечника становится воспаленной, и на ней образуются язвы.
Болезнь Крона в большинстве случаев поражает конечную часть тонкой кишки (т.е. конечную часть подвздошной кишки) и участки толстой кишки. Эта болезнь вызывает воспаление, проникающее в гораздо более глубокие слои стенки кишечника по сравнению с язвенным колитом.
Как язвенный колит, так и болезнь Крона связывают с нарушением регуляции провоспалительного цитокина, в том числе TNFα и IL-1β. См., например, McClane S.J. et al., Journal of Parenteral и Enteral Nutrition 23, 1999. Были разработаны терапевтические агенты, основанные на понижающей регуляции провоспалительного цитокина. Например, для лечения язвенного колита применяли 5-аминосалициловую кислоту, являющуюся ингибитором различных этапов передачи сигнала TNFα. См., например, Therapeutic Immunology Ed. Austen, K F., Blackwell Publishing, 2001, 159-167. Однако большинство терапевтических способов лечения воспалительного заболевания кишечника имеют ограниченную эффективность или значительные побочные эффекты.
В настоящее время по-прежнему существует потребность в разработке эффективных терапевтических агентов для лечения воспалительного заболевания кишечника.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на неожиданном обнаружении того факта, что экстракт Андрографиса метельчатого (Andrographis paniculata) проявляет эффективное лечебное действие по отношению к воспалительному заболеванию кишечника. Указанный экстракт содержит андрографолидные лактоны, полисахариды и флавоноиды; составляющие 10-22,01% (предпочтительно 13-17%), 18-28% (предпочтительно 20-25%) и 10-15% (предпочтительно 12-14%) от сухого веса экстракта соответственно. Андрографолидные лактоны включают андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид, составляющие 2-20% (предпочтительно 3-10%, более предпочтительно 6-10%), 0,01-6% (предпочтительно 0,01-2%, более предпочтительно 0,01-1%), 1-6% (предпочтительно 2-5%, более предпочтительно 2-4%) и 1-5% (предпочтительно 2-4%) от сухого веса экстракта соответственно.
Другой аспект настоящего изобретения относится к способу лечения воспалительного заболевания кишечника (в том числе болезни Крона и язвенного колита). Указанный способ включает введение субъекту, который в этом нуждается, эффективного количества вышеописанного экстракта.
Настоящее изобретение также включает фармацевтическую композицию, содержащую экстракт, описанный выше, и фармацевтически приемлемый носитель, а также применение такой композиции для лечения воспалительного заболевания кишечника и применение такой композиции для получения лекарственного препарата для лечения этого заболевания.
В приведенном ниже описании подробно обсуждаются несколько вариантов реализации настоящего изобретения. Другие признаки, задачи и преимущества настоящего изобретения станут очевидны из настоящего описания, а также формулы изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для получения экстракта согласно настоящему изобретению можно погрузить надземную часть Андрографиса метельчатого в 80-95% этанол, собрать этанольную фазу и затем удалить этанол. Конкретный пример приведен ниже. Полученный таким образом экстракт далее можно очистить с помощью тонкослойной хроматографии, колоночной флэш-хроматографии, высокоэффективной жидкостной хроматографии или любыми другими подходящими способами.
Настоящее изобретение включает способы лечения воспалительного заболевания кишечника путем введения субъекту, который в этом нуждается, эффективного количества экстракта согласно настоящему изобретению. Термин "эффективное количество" относится к количеству экстракта, которое необходимо для достижения одного из вышеописанных терапевтических эффектов у субъекта. Эффективные количества могут варьироваться, как известно специалистам в данной области техники, в зависимости от пути введения, применяемого наполнителя и возможности совместного применения с другими агентами. Предпочтительно эффективное количество составляет 1-100 мг/кг/день в расчете на сухой вес экстракта. Термин “лечение” относится к введению указанного экстракта субъекту, у которого имеется воспалительное заболевание кишечника, симптом этого заболевания или предрасположенность к этому заболеванию, с целью исцеления, излечения, облегчения, ослабления, изменения, устранения, смягчения, оказания положительного эффекта или воздействия на данное заболевание, симптомы данного заболевания или предрасположенность к данному заболеванию.
Для реализации одного из вышеописанных способов субъекту, который в этом нуждается, вводят перорально, ректально, парентерально, с помощью спрея для ингаляции или с помощью имплантируемого резервуара композицию, представляющую собой либо указанный выше экстракт в отдельности, либо смесь указанного экстракта и фармацевтически приемлемого носителя. В настоящем описании термин “парентеральный” включает методы подкожного, интрадермального, внутривенного, внутримышечного, внутрисуставного, внутриартериального, надчревного, внутриоболочечного, внутричерепного инъецирования или инфузии, или инъецирования или инфузии внутрь пораженных тканей.
Композиция для перорального применения может представлять собой любую подходящую для перорального применения лекарственную форму, в том числе, но не ограничиваясь ими, таблетки, капсулы, эмульсии и водные суспензии, дисперсии и растворы. Обычно применяемые носители для таблеток включают лактозу и кукурузный крахмал. В таблетки также обычно добавляют смазывающие вещества, такие как стеарат магния. Таблетки также могут быть покрыты оболочкой для целей доставки или косметических целей. В случае перорального введения в форме капсул применяемые разбавители включают лактозу и сухой кукурузный крахмал. При введении водных суспензий или эмульсий пероральным путем активный ингредиент может быть суспендирован или растворен в маслянистой фазе совместно с эмульгирующими или суспендирующими веществами. При необходимости можно добавить некоторые подсластители, ароматизаторы или красители.
Композиция для ректального применения может представлять собой любую лекарственную форму, подходящую для ректального введения, в том числе, но не ограничиваясь ими, крем, гель, эмульсию, суспензию, суппозиторий и таблетку. Одна из предпочтительных лекарственных форм представляет собой суппозиторий, форма и размер которого выполнены подходящими для введения в анальное отверстие в теле человека. Суппозиторий обычно размягчается, плавится или растворяется при температуре тела. Наполнители для суппозитория включают, но не ограничиваются ими, какао-масло, глицеринсодержащий желатин, гидрогенизированные растительные масла, смеси полиэтиленгликолей с различной молекулярной массой и эфиры, образованные жирными кислотами и полиэтиленгликолем.
Стерильную инъецируемую композицию (например, водную или масляную суспензию) можно приготовить согласно способам, известным в данной области техники, с применением подходящих диспергирующих или смачивающих веществ (таких как, например, Твин 80) и суспендирующих агентов. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном разбавителе или растворителе, подходящем для парентерального применения, например раствор в 1,3-бутандиоле. К подходящим носителям и растворителям, которые можно применять в настоящем изобретении, относятся маннитол, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды традиционно применяют стерильные нелетучие масла (например, синтетические моно- или диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, также можно применять при приготовлении инъецируемых препаратов, также как и натуральные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в виде соответствующих полиоксиэтилированных форм. Эти масляные растворы или суспензии могут также содержать разбавитель или диспергатор, представляющий собой длинноцепочечный спирт, или карбоксиметилцеллюлозу, или аналогичные диспергирующие вещества.
Композицию для ингаляции можно получить согласно способам, хорошо известным в области приготовления фармацевтических составов, и можно приготовить в виде растворов в физиологическом растворе с применением бензилового спирта или других подходящих консервантов, ускорителей всасывания, применяемых для повышения биодоступности, фторзамещенных углеводородов и/или других солюбилизирующих или диспергирующих веществ, известных в данной области техники.
Композицию для топического применения можно приготовить в виде масла, крема, лосьона, мази и т.п. Подходящие носители для композиции включают растительные или минеральные масла, медицинский вазелин (мягкий бесцветный парафин), жиры или масла с разветвленной цепью, животные жиры и высокомолекулярные спирты (более С12). Предпочтительными носителями являются носители, в которых активный ингредиент является растворимым. Эмульгаторы, стабилизаторы, смачивающие средства и антиоксиданты тоже могут быть введены в состав наряду с веществами, придающими окраску или аромат, если это необходимо. Кроме того, в этих составах для топического применения можно применять усилители трансдермального проникновения. Примеры таких усилителей можно найти в патентах США 3989816 и 4444762. Предпочтительно крема приготавливают из смеси минерального масла, самоэмульгируемого пчелиного воска и воды, в которую добавлен активный ингредиент, растворенный в небольшом количестве масла, таком как миндальное масло. Примером такого крема является крем, содержащий примерно 40 частей воды, примерно 20 частей пчелиного воска, примерно 40 частей минерального масла и примерно 1 часть миндального масла. Мази можно приготовить путем смешивания раствора активного ингредиента в растительном масле, таком как миндальное масло, с теплым мягким парафином и постепенного охлаждения смеси. Примером такой мази является мазь, содержащая примерно 30% миндального масла и примерно 70% мягкого бесцветного парафина по массе.
Носитель в фармацевтической композиции должен быть “приемлемым” в смысле совместимости с активным ингредиентом состава (и предпочтительно способным стабилизировать указанный активный ингредиент) и не должен оказывать отрицательного воздействия на субъекта, подвергаемого лечению. Например, солюбилизирующие вещества, такие как циклодекстрины (которые образуют характерные более растворимые комплексы с одним или более активными соединениями экстракта), можно применять в качестве фармацевтических наполнителей для доставки активных соединений. Примеры других носителей включают коллоидный диоксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и D&C Желтый №10.
Подходящий анализ in vitro можно применять для предварительной оценки эффективности вышеописанного экстракта в отношении ингибирования экспрессии TNFα или IL-1β. Можно также исследовать эффективность указанного экстракта при лечении воспалительного заболевания кишечника с помощью исследований in vivo. Например, экстракт можно ввести животному (например, подопытной мыши) или человеку с воспалительным заболеванием кишечника и затем оценить терапевтическое действие указанного экстракта. На основе полученных результатов можно также определить подходящий интервал дозирования и путь введения.
Без приведения дальнейших уточнений полагают, что приведенное выше описание надлежащим образом обеспечивает возможность реализации настоящего изобретения. Соответственно, следующие конкретные примеры следует рассматривать лишь в качестве иллюстративных и никоим образом не ограничивающих остальную часть изобретения. Содержание всех упоминаемых в настоящем описании публикаций, в том числе патентов, в полном объеме включено в настоящее описание посредством ссылки.
Пример 1: Получение экстракта Андрографиса метельчатого
Сухой порошок из листьев Андрографиса метельчатого (350 кг) погружали в 90% этанол (2100 кг). Смесь кипятили с обратным холодильником при 75-80°C в течение двух часов. Этанольную фазу собирали и твердый остаток снова подвергали экстракции. Этанольные растворы объединяли, фильтровали и концентрировали с получением влажной смеси с плотностью 1.00-1.10 г/мл.
Небольшое количество смеси высушивали и анализировали ее состав с помощью высокоэффективной жидкостной хроматографии и спектрофотомерии. Результат показал, что сухой экстракт содержал андрографолидные лактоны (14.8% в пересчете на сухой вес экстракта), полисахариды (24.6%) и флавоноиды (12.8%). Среди андрографолидных лактонов андрографолид составлял 9.2% в пересчете на сухой вес экстракта, 14-деоксиандрографолид <0.1%, 14-деокси-11,12-дегидроандрографолид 2.6% и неоандрографолид 3.0%. К влажной смеси добавляли декстрин (0.03 кг), после чего смесь высушивали распылением (на входе: 185-195°C; на выходе: 90-100°C). Полученный таким образом твердый экстракт подвергали размолу, просеивали и упаковывали с получением таблеток и капсул, как описано ниже.
Таблетки получали следующим образом. Крахмал (10 г) и сахар (10 г) смешивали с очищенной водой (80.0 г) и получали пасту. Отдельно экстракт (500.0 г), крахмал (140.0 г), микрокристаллическую целлюлозу (337.5 г) и пасту смешивали, гранулировали влажным способом и высушивали при 55°C. Высушенные гранулы (957.6 г) и стеарат магния (2.4 г) смешивали в течение 5 минут. Полученную смесь прессовали с получением таблеток (400 мг/таблетка, экв. 200 мг экстракта/таблетка). Таблетки покрывали пленкой с помощью пасты, полученной путем смешивания гипромеллозы (7.5 г), пропиленгликоля (1.6 г), диоксида титана (3.0 г), красочного лака Food Drug & Cosmetic (0.4 г) и очищенной воды (87.5 г) с получением требуемых таблеток, содержащих экстракт Андрографиса метельчатого.
Капсулы получали следующим образом. Смешивали указанный экстракт (340.0 г), предварительно высушенный крахмал (221.0 г), диоксид кремния (2.125 г) и микрокристаллическую целлюлозу (34.0 г). Этой смесью наполняли капсулы #0 с твердой оболочкой, применяя панель для заполнения капсул, и получали требуемые капсулы, содержащие экстракт Андрографиса метельчатого (351.25 мг смеси/капсула, экв. 200 мг экстракта/капсула).
Пример 2: Ингибирование экспрессии TNFα и IL-1β
Моноцитарные клетки периферической крови (РВМС) выделяли из свежей крови, применяя Ficoll-Paque Plus (Amersham Bioscience), согласно методике, предоставленной производителем. Клетки суспендировали в среде RPMI 1640, содержащей 10% FBS (телячью сыворотку крови) при концентрации 1×105 клеток/мл и высеивали в 96-луночный планшет. Каждую реакцию проводили в трех лунках.
10 мкл экстракта Андрографиса метельчатого в ДМСО добавляли в каждую лунку (конечные концентрации: 0.1, 0.3, 1, 3, 10 и 30 мкг/мл). Дексаметазон (конечная концентрация: 10 мкМ) применяли в качестве положительного контроля. 10 мкл среды применяли в качестве отрицательного контроля. Планшет инкубировали при 37°C в атмосфере 5% CO2 в течение 15 минут. Потом добавляли аликвоты 10 мкл 100 мкг/мл липополисахарида во все лунки, кроме лунок с отрицательным контролем, и планшет инкубировали при 37°C в атмосфере 5% CO2 в течение ночи.
Планшет подвергали центрифугированию со скоростью 1000 об/мин в течение 15 минут и собирали надосадочные жидкости. Концентрации TNFa и IL-1β измеряли с помощью набора TNFα ELISA (ферментный иммуносорбентный анализ) и набора IL1-β ELISA (Jingmei Bioengineer Technology).
Коэффициент ингибирования рассчитывали следующим образом:
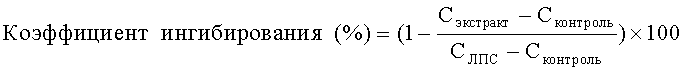
где Сэкстракт представляет собой концентрацию TNFα или IL-1β в клетках РВМС, обработанных экстрактом, а ЛПС, СЛПС представляет собой концентрацию TNFα или IL-1β в клетках РВМС, обработанных ЛПС и дексаметазоном, и Сконтроль представляет собой концентрацию TNFα или IL-1β в клетках РВМС, которые не обрабатывали ЛПС или экстрактом.
Пример 3: Лечение воспалительного заболевания кишечника в модели на мышах
Самцов мышей Balb/с (18-24 г, приобретены у Chinese Academy of Science animal center) анестезировали с помощью 1% пентобарбитала натрия путем введения 0.05 мг/10 г. Для индуцирования воспалительного заболевания кишечника каждой мыши (за исключением мышей из контрольной группы) через катетер медленно вводили 1.5 мг 2,4,6-тринитробензолсульфокислоты в 50% этаноле. Мыши из контрольной группы получали только 0.1 мл 50% этанола. Мышей подвергали лечению с помощью тестируемой пробы за 24 часа и за 2 часа до введения препарата, вызывающего воспалительное заболевание кишечника, и ежедневно в течение 5 дней после введения.
Массу тела каждой мыши контролировали каждый день перед и после введения 2,4,6-тринитробензолсульфокислоты. Мышей убивали через 24 часа после последнего введения тестируемых проб. Толстые кишки удаляли и взвешивали. Кроме того, рассчитывали отношение массы толстой кишки к массе тела и также контролировали сращение между толстой кишкой и другими органами.
Получали пробы тканей толстой кишки, расположенных точно на 2 см выше анального канала, фиксировали их в 10% фосфатном буферном растворе, заливали парафином, делали срезы и окрашивали гематоксилином/эозином. Степень воспаления на микроскопических поперечных срезах оценивают в баллах от 0 до 4 (0: нет признаков воспаления; 1: очень низкий уровень воспаления; 2: низкий уровень инфильтрации лейкоцитов; 3: высокий уровень инфильтрации лейкоцитов, высокая плотность сосудов и утолщенная стенка толстой кишки; и 4: трансмуральные инфильтрации, уменьшение содержания бокаловидных клеток, высокая плотность сосудов и утолщенная стенка толстой кишки).
Пример 4: Клиническое лечение язвенного колита
Для изучения эффективности экстракта Андрографиса метельчатого при лечении язвенного колита было проведено рандомизированное, с двойной маскировкой, активно контролируемое 8-недельное клиническое исследование в 5 различных учреждениях в Шанхае, Китай, в соответствии с рекомендациями Международной конференции по гармонизации и нормам надлежащей клинической практики (ICH-GCP). 120 пациентов с подтвержденным колоноскопией активным язвенным колитом на стадиях от слабой до умеренной были распределены на две группы (60 пациентов/группа). Одну группу лечили упомянутыми выше таблетками, содержащими экстракт Андрографиса метельчатого (3 раза в день, 2 таблетки за раз), а другую группу лечили 5-амино-2-гидроксибензойной кислотой, т.е. Etiasa (3 раза в день, 500 мг гранула каждый раз). Все другие лекарственные препараты были исключены. Терапевтическое действие оценивали раз в две недели, применяя шкалу, аналогичную неполной системе балльной оценки Мейо, и рассчитывали уменьшение клинических симптомов в баллах (≥50% уменьшение симптомов). Затем рассчитывали баллы за прошедшее время с применением стандартных неполных баллов Мейо (PMS), клинической реакции (улучшение ≥2 позиций или конечный балл, равный 0) и ремиссии (балл PMS ≤1 на 8 неделю). Результаты колоноскопии в начале и в конце лечения оценивали с помощью модифицированной шкалы Барона и биопсии, взятые во время колоноскопии, оценивали с гистологической точки зрения с применением шкалы 0-3.
Пациенты в двух группах имели сходные демографические показатели. В каждой группе средняя продолжительность заболевания варьировалась от 3.5 до 3.7 лет, и исходный средний PMS составлял 3.8. У 53 пациентов, принимавших участие в клиническом исследовании и подвергаемых лечению экстрактом, уменьшение клинических симптомов в баллах составляло 27% на 2 неделю и улучшалось до 56% к 8 неделе. 55 пациентов, принимавших участие в клиническом исследовании и подвергаемых лечению Etiasa, показывали аналогичное снижение. Уровень клинического ответа на 8 неделе составлял 58% у пациентов, подвергаемых лечению экстрактом, и 58% у пациентов, подвергаемых лечению Etiasa. Коэффициент ремиссии на 8 неделю составлял 43% у пациентов, подвергаемых лечению экстрактом, и 58% у пациентов, подвергаемых лечению Etiasa. Результаты определения PMS на начальной и 8 неделе в обеих группах являлись статистически значимыми (p<0.0002).
С эндоскопической точки зрения на 8 неделе 28% пациентов, подвергаемых лечению экстрактом, и 24% пациентов, подвергаемых лечению Etiasa, были в полной ремиссии (балл по шкале Барона 0); и у 47% пациентов, подвергаемых лечению экстрактом, и 42% пациентов, подвергаемых лечению Etiasa, баллы были понижены по меньшей мере на два уровня.
С гистологической точки зрения оценивали 19 пациентов из числа подвергаемых лечению экстрактом и 15 пациентов из числа подвергаемых лечению Etiasa. Для 10 из 19 пациентов, подвергаемых лечению экстрактом, наблюдалось уменьшение количества баллов, характеризующих воспаление, на 25-50% на 8 неделе, и такое же уменьшение демонстрировали 6 из 15 пациентов, подвергаемых лечению Etiasa. В группе, которую лечили экстрактом, у 12/15 пациентов, поступивших с повышенными уровнями C-реактивного белка, наблюдались нормальные уровни на 8 неделе по сравнению с 4/6 в группе, которую лечили Etiasa. Результаты в обеих группах являются статистически значимыми (p<0.0001).
Полученные результаты свидетельствовали, что экстракт был эффективным при лечении язвенного колита. Неожиданным образом эффективность экстракта была сопоставима или даже лучше, чем эффективность Etiasa.
ДРУГИЕ ВАРИАНТЫ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Было описано несколько вариантов реализации изобретения. Однако следует понимать, что возможные модификации изобретения также находятся в рамках настоящего изобретения. Соответственно, другие варианты реализации также находятся в рамках следующей формулы изобретения.
Детали одного или более вариантов реализации изобретения приведены на прилагаемых чертежах и в приведенном ниже описании. Другие признаки, задачи и преимущества настоящего изобретения станут очевидны из настоящего описания и чертежей, а также формулы изобретения.
Изобретение относится к фармацевтической промышленности, в частности к экстракту Андрографиса метельчатого (Andrographis paniculata) для лечения воспалительного заболевания кишечника. Экстракт Андрографиса метельчатого (Andrographis paniculata) для лечения воспалительного заболевания кишечника, содержащий андрографолидные лактоны, полисахариды и флавоноиды в определенном количестве. Фармацевтическая композиция для лечения воспалительного заболевания кишечника, содержащая экстракт Андрографиса метельчатого. Способ лечения воспалительного заболевания кишечника у субъекта. Вышеописанный экстракт Андрографиса метельчатого эффективен для лечения воспалительного заболевания кишечника. 3 н. и 26 з.п. ф-лы, 4 пр.
1. Экстракт Андрографиса метельчатого (Andrographis paniculata) для лечения воспалительного заболевания кишечника, содержащий андрографолидные лактоны, полисахариды и флавоноиды, причем указанные андрографолидные лактоны, полисахариды и флавоноиды составляют 10-22,01%, 18-28% и 10-15% от сухого веса экстракта соответственно, при этом указанные андрографолидные лактоны включают андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид, составляющие 2-20%, от 0,01 до <1%, 1-6% и 1-5% от сухого веса экстракта соответственно.
2. Экстракт по п.1, отличающийся тем, что указанные андрографолидные лактоны, полисахариды и флавоноиды составляют 13-17%, 20-25% и 12-14% от сухого веса экстракта соответственно.
3. Экстракт по п.1, отличающийся тем, что указанные андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 3-10%, от 0,01 до <1%, 2-5% и 2-4% от сухого веса экстракта соответственно.
4. Экстракт по п.3, отличающийся тем, что указанные андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 6-10%, от 0,01 до <1%, 2-4% и 2-4% от сухого веса экстракта соответственно.
5. Экстракт по п.2, отличающийся тем, что указанные андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 6-10%, от 0,01 до <1%, 2-5% и 2-4% от сухого веса экстракта соответственно.
6. Экстракт по п.5, отличающийся тем, что указанные андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 6-10%, от 0,01 до <1%, 2-4% и 2-4% от сухого веса экстракта соответственно.
7. Экстракт по п.1, отличающийся тем, что указанные полисахариды, флавоноиды, андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 24,6%, 12,8%, 9,2%, <0,1%, 2,6% и 3,0% от сухого веса экстракта соответственно.
8. Экстракт по п.1, где указанное воспалительное заболевание кишечника представляет собой болезнь Крона.
9. Экстракт по п.1, где указанное воспалительное заболевание кишечника представляет собой язвенный колит.
10. Экстракт по п.1, где указанное эффективное количество составляет 1-100 мг/кг/день в расчете на сухой вес экстракта.
11. Экстракт по п.1, где указанный экстракт предназначен для перорального введения субъекту.
12. Экстракт по п.1, где указанный экстракт предназначен для введения субъекту с помощью ректального суппозитория.
13. Фармацевтическая композиция для лечения воспалительного заболевания кишечника, содержащая:
экстракт Андрографиса метельчатого, содержащий андрографолидные лактоны, полисахариды и флавоноиды, при этом указанные андрографолидные лактоны, полисахариды и флавоноиды составляют 10-22,01%, 18-28% и 10-15% от сухого веса экстракта соответственно, и при этом указанные андрографолидные лактоны включают андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид, составляющие 2-20%, от 0,01 до <1%, 1-6% и 1-5% от сухого веса экстракта соответственно; и фармацевтически приемлемый носитель.
14. Фармацевтическая композиция по п.13, отличающаяся тем, что указанные андрографолидные лактоны, полисахариды и флавоноиды составляют 13-17%, 20-25% и 12-14% от сухого веса экстракта соответственно.
15. Фармацевтическая композиция по п.13, отличающаяся тем, что указанные андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 3-10%, от 0,01 до <1%, 2-5% и 2-4% от сухого веса экстракта соответственно.
16. Фармацевтическая композиция по п.13, отличающаяся тем, что указанные полисахариды, флаваноиды, андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 24,6%, 12,8%, 9,2%, <0,1%, 2,6% и 3,0% от сухого веса экстракта соответственно.
17. Способ лечения воспалительного заболевания кишечника у субъекта, который в этом нуждается, включающий введение указанному субъекту эффективного количества экстракта Андрографиса метельчатого, содержащего андрографолидные лактоны, полисахариды и флавоноиды, при этом указанные андрографолидные лактоны, полисахариды и флавоноиды составляют 10-22,01%, 18-28% и 10-15% от сухого веса экстракта соответственно, и при этом указанные андрографолидные лактоны включают андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид, составляющие 2-20%, от 0,01 до <1%, 1-6% и 1-5% от сухого веса экстракта соответственно.
18. Способ по п.17, отличающийся тем, что указанные андрографолидные лактоны, полисахариды и флавоноиды составляют 13-17%, 20-25% и 12-14% от сухого веса экстракта соответственно.
19. Способ по п.17, отличающийся тем, что указанные андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 3-10%, от 0,01 до <1%, 2-5% и 2-4% от сухого веса экстракта соответственно.
20. Способ по п.19, отличающийся тем, что указанные андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 6-10%, от 0,01 до <1%, 2-4% и 2-4% от сухого веса экстракта соответственно.
21. Способ по п.18, отличающийся тем, что указанные андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 6-10%, от 0,01 до <1%, 2-4% и 2-4% от сухого веса экстракта соответственно.
22. Способ по п.17, отличающийся тем, что указанные полисахариды, флаваноиды, андрографолид, 14-деоксиандрографолид, 14-деокси-11,12-дегидроандрографолид и неоандрографолид составляют 24,6%, 12,8%, 9,2%, <0,1%, 2,6% и 3,0% от сухого веса экстракта соответственно.
23. Способ по п.17, отличающийся тем, что указанное воспалительное заболевание кишечника представляет собой болезнь Крона.
24. Способ по п.17, отличающийся тем, что указанное воспалительное заболевание кишечника представляет собой язвенный колит.
25. Способ по п.17, отличающийся тем, что указанное эффективное количество составляет 1-100 мг/кг/день в расчете на сухой вес экстракта.
26. Способ по п.17, отличающийся тем, что указанный экстракт вводят субъекту перорально.
27. Способ по п.17, отличающийся тем, что указанный экстракт вводят субъекту с помощью ректального суппозитория.
28. Способ по п.17, отличающийся тем, что указанное воспалительное заболевание кишечника представляет собой болезнь Крона.
29. Способ по п.17, отличающийся тем, что указанное воспалительное заболевание кишечника представляет собой язвенный колит.
| US 2006246156 A1, 02.11.2006 | |||
| Y.Koteswara Rao et all | |||
| Flavonoids and andrographolides from Andrographis paniculata // Phytochemistry, August 2004, v.65, issue 16, p.2317-2321 | |||
| Junyaprasert VB et all | |||
| Inhibitory effect of Thai plant extracts on P-glycoprotein mediated efflux // Phytother Res., 2006 Jan, 20(1):79-81. |
Авторы
Даты
2012-12-10—Публикация
2008-10-31—Подача