Изобретение относится к новому классу 1,3-дикетонатных производных редкоземельных элементов, которые могут быть использованы в качестве активных слоев органических светоизлучающих диодов (OLED), оптико-электронных устройств, а также флуоресцентных меток и маркеров.
Ближайшими аналогами предложенных соединений РЗЭ можно считать известные комплексные соединения, включающие в качестве дикетонатного лиганда 4-ацилпиразолоны [1-2].
Получают данные известные соединения путем взаимодействия исходного 4-ацилпиразолона и нейтрального лиганда с солью редкоземельного элемента и гидроксидом щелочного металла в среде водного спирта с последующей кристаллизацией малорастворимого продукта. Например, для получения известного комплексного соединения европия с 1-фенил-3-метил-4-фенилацетилпиразононом [3] растворяют 3 ммоль пиразолона и 3 ммоль КОН в этаноле, после чего добавляют раствор 1 ммоль Eu(NO3)3*6H2O в 50% водном этаноле, выдерживают 2 часа при комнатной темпрературе и отделяют малорастворимый продукт путем фильтрования.
В данных известных соединениях дикетонный фрагмент является частью сопряженной системы пиразолона, что ограничивает возможность варьирования структуры с целью получения оптимальных люминесцентных (квантовый выход, интенсивность люминесценции) и технологически важных (термическая стабильность, пленкообразующая способность, растворимость и летучесть в вакууме) свойств.
Задачей, решаемой изобретением, является создание новых комплексных соединений РЗЭ, обладающих высокой интенсивностью люминесценции и заданными технологическими параметрами, такими как термическая стабильность, пленкообразующая способность, растворимость и летучесть в вакууме, что, в свою очередь, обеспечивает возможность их применения в оптико-электронных устройствах.
Для достижения поставленной задачи в качестве люминесцирующих комплексных соединений РЗЭ в настоящей заявке предложены комплексные соединения следующего строения:

где Ln - ион трехвалентного редкоземельного элемента, например Nd, Pr, Sm, Eu, Tb, Dy, Ho, Tm, Er, Yb; L1 - 1,3-дикетон, являющийся производным 1,3-дипиразолилпропандиона-1,3 общей формулы 2
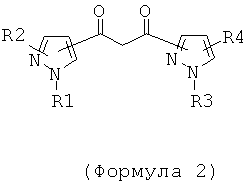
где R1, R3 - алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, R2, R4 - атом водорода, алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, атом галогена, CF3 или NO2-группа, причем сопряжение дикетонного фрагмента может осуществляться симметрично или несимметрично по положениям 3, 4 или 5 каждого пиразольного цикла. L2 - вспомогательный бидентатный N, Р или О-содержащий лиганд, например 1,10-фенантролин (Phen), 2,2-бипиридил (Bipy), трифенилфосфиноксид (ТРРО), три-н-октилфосфиноксид (ТОРО), диметиловый эфир диэтиленгликоля (Diglim).
В отличие от известных соединений РЗЭ, в соединениях общей формулы 1, дикетонный фрагмент не является частью сопряженной системы пиразола и может быть введен в любое возможное положение (а не только в С4) пиразольного цикла, что позволяет в широких пределах варьировать электронные и стерические свойства данного лиганда.
Авторам неизвестны примеры синтеза комплексных соединений редкоземельных элементов с 1-3-дикетонами ряда пиразола. Методом рентгеноструктурного анализа показана идентичность структуры свободного лиганда со структурой лиганда в составе комплексного соединения.
Введение в качестве дикетонной компоненты производных пиразола формулы 2 позволяет повысить интенсивность люминесценции комплексных соединений по сравнению с известными, а также варьировать в широких пределах такие практически значимые характеристики комплексов, как растворимость, пленкообразующая способность, термическая стабильность и летучесть в вакууме.
Синтез комплексных соединений общей формулы 1 осуществляют следующим образом: к раствору дикетона и вспомогательного бидентатного N, Р или О- содержащего лиганда, взятых в молярном соотношении 3:1 в этиловом спирте при повышенной температуре (предпочтительно 30-50°С), добавляют последовательно 1-3 М водный раствор гидроксида щелочного металла (предпочтительно NaOH), взятый в эквивалентном (по молям) количестве по отношению к дикетону, и водный раствор соли редкоземельного элемента, взятой в соотношении 1 моль РЗЭ на 3 моль дикетона, причем взаимодействие компонентов осуществляют при величине рН=6-6,5 в течение 12-24 часов при температуре 35-50°С в герметично закрытых контейнерах. Использование герметически закрытого контейнера является существенным, так как в этом случае не требуется восполнять потерю растворителя на испарение. Необходимый уровень рН устанавливают путем добавления разбавленной кислоты (предпочтительно уксусной) или раствора щелочи (предпочтительно NaOH, КОН или водного раствора аммиака) и контролируют с помощью рН-метра или универсальной индикаторной бумаги.
Для выделения конечных продуктов реакционную массу упаривают досуха, остаток экстрагируют хлорированным растворителем, например дихлорметаном, хлороформом или смесью этих растворителей с абсолютным этанолом, полученный раствор фильтруют и концентрируют. Комплексное соединение выделяют путем осаждения из полученного раствора посредством медленного добавления углеводородного растворителя, например пентана, гексана, гептана или бензола, в результате чего комплексное соединение осаждается в твердом виде.
Альтернативный путь выделения может заключаться в упаривании досуха сконцентрированного раствора комплексного соединения в хлорированном растворителе или его смеси с этанолом и перекристаллизации остатка из подходящего растворителя (этанола, метанола, ацетонитрила, хлороформа, дихлорметана или их смесей).
Указанный температурный режим является оптимальным для проведения данного синтеза и позволяет добиться полной конверсии исходных материалов в конечные продукты за указанный промежуток времени. При более высоких температурах или продолжительном (более 24 часов) времени взаимодействия реагентов происходит образование побочных продуктов. При низких температурах (менее 30°С) время реакции значительно удлиняется по сравнению с указанным и снижается полнота образования конечных продуктов.
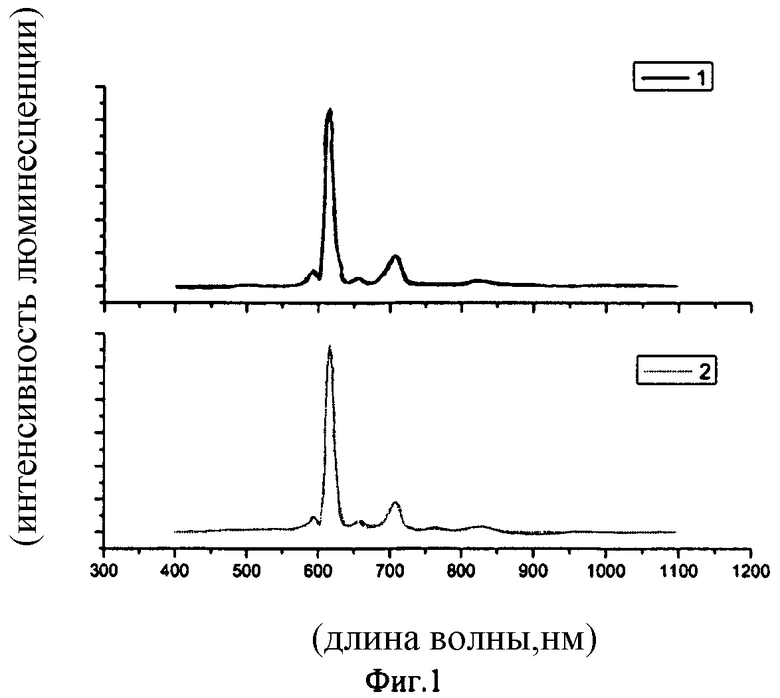
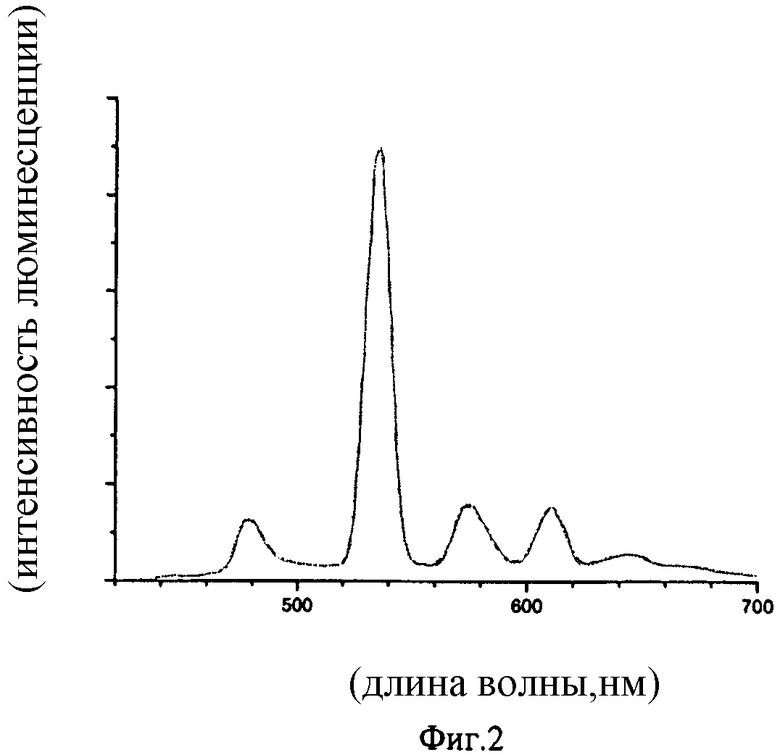
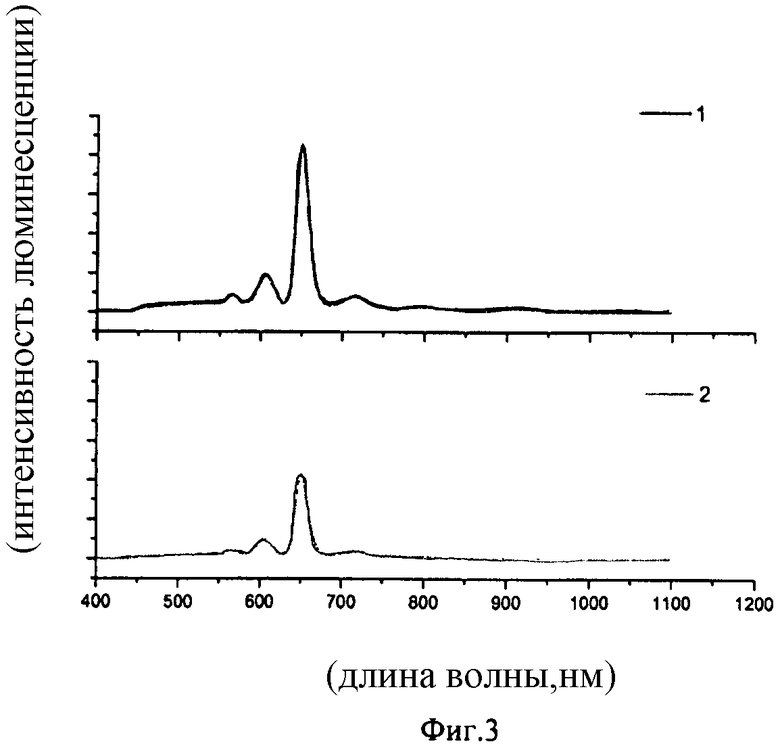
Спектральные данные, иллюстрирующие люминесцентные характеристики синтезированных соединений при фотовозбуждении представлены на фиг.1-3.
На фиг.1 изображены спектры люминесценции твердого образца (кривая 1) и термически нанесенной пленки (кривая 2) трис-(1,3-бис (1,3-диметил-1Н-пиразол-4-ил)-1,3-пропандионато)(1,10-фенантролин) европия (λ возб.=380 нм). Видно, что спектры люминесценции практически идентичны.
На фиг.2 приведен спектр люминесценции твердого образца трис-(1,3-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандионато)(1,10-фенантролин) тербия (λ возб.=380 нм).
Фиг.3 иллюстрирует идентичность спектров люминесценции твердого образца (кривая 1) и 1*10-2 М раствора в ацетонитриле (кривая 2) трис-(1,3-бис(1,3-диметил-1Н-пиразол-4-ил)-1,3-пропандионато)(1,10-фенантролин) самария (λ возб.=380 нм).
Пример 1.
Трис-(1,3-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандионато)(1,10-фенантролин) европий (III)
В 15 мл этанола при нагревании (30-50 С) растворяют 0.180 г (1 ммоль) фенантролина (Aldrich, США), 0.781 г (3 ммоль) 1,3-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандиона (полученного от компании Art-Chem GmbH, Германия) и добавляют 3 мл (3 ммоль) 1М водного раствора NaOH. Центрифугируют 5 минут при 5000 об/мин, раствор переносят стеклянный контейнер и добавляют по каплям раствор 0.338 г (1 ммоль) EuNO3)3*6H2O (99,9% Aldrich, США) в 5 мл воды при интенсивном перемешивании. Устанавливают рН=6,5 путем добавления нескольких капель уксусной кислоты, закрывают контейнер и выдерживают в термостате при +45°С 24 часа, после чего охлаждают до комнатной температуры. Затем растворитель полностью отгоняют в вакууме, к твердому остатку добавляют 30 мл дихлорметана и сливают с осадка. Органический раствор сушат безводным MgSO4 (около 0.5 г) и фильтруют через тонкий слой целита (Celite™, Aldrich). Прозрачный раствор упаривают до небольшого объема и осаждают пентаном. Кристаллы отфильтровывают, промывают на фильтре небольшим количеством пентана и сушат в вакууме. Выход - 0.52 г (46%). Найдено (%): С 54.43; Н 4.63; N 16.46. Вычислено для C51H53EuN14O6 (%): С 55.18; Н 4.81; N 17.67.
Люминесценцию образца измеряли на приборе Perkin-Elmer LS-45 в твердом виде в ампулах из кварцевого стекла диаметром 5 мм, в виде 1*10-3 М раствора в ацетонитриле к кварцевых кюветах с толщиной слоя 1 см и в виде термически осажденных в вакууме (10-6 Торр) на стеклянные подложки пленок.
Также пленки на стеклянных подложках были получены методом центрифугирования (spin-coating) с использованием в качестве связующего 2% раствор метилметакрилата в ТГФ, содержащий 0.1% комплекса или при использовании 2% раствора комплекса в хлороформе без добавления связующего.
Во всех случаях спектры люминесценции и возбуждения отличаются лишь относительно интенсивностью, λмах возб.=380 нм, длина волны в максимуме спектра люминесценции - 616 нм.
Пример 2.
Трис-(1,3-бис(1,3-диметил-1Н-пиразол-4-ил)-1,3-пропандионато)(1,10-фенантролин) тербий (III)
Получают аналогично предыдущему соединению из 0.453 г (1 ммоль) Tb(NO3)3*6H2O. Белый микрокристаллический порошок. Выход - 0.63 г (56%). Найдено (%): С 55.03; Н 4.94; N 17.89; Tb 14.32. Вычислено для C51H53N14O6Tb (%): С 54.84; Н 4.78; N 17.56; Tb 14.23.
Люминесценция в твердом состоянии и в растворе характеризуется следующими значениями: λмах возб.=380 нм, длина волны в максимуме спектра люминесценции - 550 нм.
Пример 3.
Трис-(13-бис(1,3-диметил-1H-пиразол-4-ил)-1,3-пропандионато)(1,10-фенантролин) самарий (III)
Получают аналогично Примеру 1 из 0.327 г (1 ммоль) Sm(ОАс)3*4Н2О. Белый микрокристаллический порошок. Выход - 0.58 г (52%). Найдено (%): С 55.31; Н 4.87; N 17.78. Вычислено для C51H53N14O6Sm (%): С 55.26; Н 4.82; N 17.69.
Люминесценция в твердом состоянии и в растворе характеризуется следующими значениями: λмах возб.=370 нм, длина волны в максимуме спектра люминесценции - 647 нм.
Нами впервые установлено, что синтезированные комплексы РЗЭ с пиразолсодержащими 1,3-дикетонами имеют выраженные интенсивные полосы люминесценции в видимой или ближней инфракрасной области спектра, причем вид спектров практически не отличается для соединения в твердой фазе, растворах и для пленки на стекле или другом прозрачном материале, полученные как методом центрифугирования, так и методом термического испарения в вакууме (10-6 Торр) при температуре 200-250°С.
Также было установлено, что соединения общей формулы 1 способны образовывать однородные оптически прозрачные пленки без добавления дополнительных пленкообразующих добавок при нанесении на прозрачную подложку методом центрифугирования из растворов в органических растворителях, например в хлороформе.
Эти результаты свидетельствуют о том, что при указанной выше температуре не происходит термического разложения комплексов или изменения их спектральных свойств, что открывает возможность использования этих комплексов в технологических процессах изготовления электролюминесцентных приборов на их основе.
Пример 4.
В соединении примера 1 замена одного пиразольного фрагмента на метальную группу (при использовании 1-(1,3-диметил-1H-пиразол-4-ил)-бутан-1,3диона в качестве исходного соединения) привела к уменьшению интенсивности люминесценции на длине волны 620 нм в двадцать раз. Таким образом показано, что изменение вида лиганда позволяет в широких пределах менять параметры люминесценции данных комплексных соединений.
Пример 5.
Трис-(1-(1-циклопентил)1H-пиразол-3-ил)-3-[1-фенил-3-(трифторметил)-1Н-пиразол-4-ил]-1,3-пропандионато)(2,2-бипиридил) европий (III)
Получают аналогично Примеру 1 из 0.338 г (1 ммоль) Eu(NO3)3*6H2O. Желтоватый микрокристаллический порошок. Выход - 0.78 г (37%). Найдено (%): С 56.53; Н 4.12; N 12.55; F 10.91. Вычислено для C73H62F9N14O6 (%): С 56.41; Н 4.02; N 12.62; F 11.00. В твердом виде λmax возб.=390 нм, длина волны в максимуме спектра люминесценции - 618 нм.
Пример 6.
Трис-(1-[4-хлоро-1-(2,2,2-трифторэтил)-1H-пиразол-3-ил-3-(3-циклопропил-1-этил-1H-пиразол-5-ил)-1,3-пропандионато)(трифенилфосфиноксид) тербий (III)
Получают аналогично Примеру 1 из 0.453 г (1 ммоль) Tb(NO3)3*6Н2О. Бежевый кристаллический порошок. Выход - 1.02 г (64%) Найдено (%): С 50.13; Н 3.97; N 10.77; F 10.91; Р 1.91. Вычислено для C66H60Cl3F9N12O7Tb (%): С 49.53; Н 3.78; N 10.50; F 10.68; Р 1.94. В твердом виде λмах возб.=395 нм, длина волны в максимуме спектра люминесценции - 551 нм.
Пример 7.
Трис-(1-(1-метил-4-нитро-1H-пиразол-3-ил)-3-(1-метил-3-фенил-1H-пиразол-5-ил)-1,3-пропандионато)(2,2-бипиридил) европий (III)
Получают аналогично Примеру 1 из 0.338 г (1 ммоль) Eu(NO3)3*6Н2О. Желтый микрокристаллический порошок. Выход - 0.35 г (26%). Найдено (%): С 54.09; Н 3.91; N 17.38; Вычислено для C61H50EuF9N17O12 (%): С 53.67; Н 3.69; N 17.44. В твердом виде λмах возб.=405 нм, длина волны в максимуме спектра люминесценции - 621 нм.
Пример 8.
Трис-(1-[1-метил-3-(5-метил-2-тиенил)-1H-пиразол-5-ил]-3-(1 -метил- 1H-пиразол-4-ил)-1,3-пропандионато)(1-метокси-2-(2-метоксиэтокси)этан) европий (III)
Получают аналогично Примеру 1 из 0.338 г (1 ммоль) Eu(NO3)3*6H2O. Белый микрокристаллический порошок. Выход - 0.39 г (31%). Найдено (%): С 51.11; Н 4.75; N 13.33. Вычислено для C54H59EuN12O9S3 (%): С 51.14; Н 4.69; N 13.25. В твердом виде λмах возб.=385 нм, длина волны в максимуме спектра люминесценции - 620 нм.
Пример 9.
Трис-(1-[3-(1,1,2,2,3,3,3-гептафторпропил)-1-метил-1H-пиразол-4-ил]-3-(1-метил-1H-пиразол-4-ил)-1,3-пропандионато)(три-н-октилфосфиноксид) тербий (III)
Получают аналогично Примеру 1 из 0.453 г (1 ммоль) Tb(NO3)3*6H2O. Белый микрокристаллический порошок. Выход - 0.76 г (44%). Найдено (%): С 45.81; Н 4.51; N 9.71; F 22.80; Р 1.79. Вычислено для C66H81F21N12O7PTb %): С 45.47; Н 4.68; N 9.64; F 22.89; Р 1.78. В твердом виде λmax возб.=380 нм, длина волны в максимуме спектра люминесценции - 553 нм.
Пример 10.
Трис-(1-[3,5-диметил-1-(2-тиенилметил)-1H-пиразо-4-ил]-3-(1-метил-1H-пиразол-4-ил)-1,3-пропандионато)(2,2-бипиридил) европий (III)
Получают аналогично Примеру 1 из 0.338 г (1 ммоль) Eu(НО3)3*6Н2О. Желтоватый микрокристаллический порошок. Выход - 0.48 г (36%). Найдено (%): С 55.07; Н 4.31; N 14.90. Вычислено для C61H59EuN14O6S3 (%): С 54.99; Н 4.49; N 14.72. В твердом виде λmax возб.=380 нм, длина волны в максимуме спектра люминесценции - 618 нм.
Источники информации
1. S.V.Eliseeva, J.-C.G. Bünzli. Chem. Soc. Rev. 2010. V.39. Р.189.
2. F.Marchetti, С.Pettinari, R.Pettinari. Coord. Chem. Rev. 2005. V.249. P.2909.
3. F.Marchetti, C.Pettinari, R.Pettinari, A.Drozdov, S.Troyanov, A.Voloshin, N.Shavaleev. J. Chem. Soc, Dalton Trans., 2002, 1409.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЮМИНЕСЦИРУЮЩИЕ КОМЛЕКСНЫЕ СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ С ПИРАЗОЛСОДЕРЖАЩИМИ ФТОРИРОВАННЫМИ 1,3-ДИКЕТОНАМИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2485163C1 |
| ЛЮМИНЕСЦИРУЮЩИЕ АНИОННЫЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ СО ФТОРИРОВАННЫМИ ПИРАЗОЛСОДЕРЖАЩИМИ 1,3-ДИКЕТОНАМИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2485162C1 |
| ЛЮМИНЕСЦИРУЮЩИЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ РЗЭ С ПИРАЗОЛСОДЕРЖАЩИМИ 1,3-ДИКЕТОНАМИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2469041C1 |
| Комплексные соединения редкоземельных металлов с органическими лигандами в качестве радиационно-стойких люминесцентных материалов | 2019 |
|
RU2720792C1 |
| ТРИСДИКЕТОНАТНЫЕ КОМПЛЕКСЫ ЛАНТАНИДОВ С ЛИГАНДАМИ ПИРИДИНОВОГО РЯДА В КАЧЕСТВЕ ЛЮМИНОФОРОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2463304C1 |
| Люминесцентный композитный материал на основе комплексов Eu(III) и способ его получения | 2019 |
|
RU2789111C2 |
| Разнолигандные фторзамещенные ароматические карбоксилаты лантанидов, проявляющие люминесцентные свойства, и органические светодиоды на их основе | 2017 |
|
RU2657496C1 |
| ТРИС[1-(4-(4-ПРОПИЛЦИКЛОГЕКСИЛ)ФЕНИЛ)ДЕКАН-1,3-ДИОНО]-[1,10-ФЕНАНТРОЛИН]ЕВРОПИЯ В КАЧЕСТВЕ ЛЮМИНЕСЦЕНТНОГО МАТЕРИАЛА | 2012 |
|
RU2499022C1 |
| СОЕДИНЕНИЕ ДИ(НИТРАТО)АЦЕТИЛАЦЕТОНАТОБИС (1,10-ФЕНАНТРОЛИН) ЛАНТАНОИД (III), ПРИГОДНОЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ЛЮМИНЕСЦЕНТНОЙ ДОБАВКИ В ЧЕРНИЛА, И ЧЕРНИЛА ДЛЯ СКРЫТОЙ МАРКИРОВКИ ЦЕННЫХ МАТЕРИАЛЬНЫХ ОБЪЕКТОВ | 2007 |
|
RU2373211C2 |
| Разнолигандные комплексные соединения тербия с фенантролином, интенсивность люминесценции которых зависит от температуры | 2014 |
|
RU2620117C2 |
Изобретение относится к комплексному соединению редкоземельных элементов общей формулы [Ln(L1)3L2] где Ln - ион трехвалентного редкоземельного элемента, например Nd, Pr, Sm, Eu, Tb, Dy, Ho, Tm, Er, Yb; L1 - дикетонатный лиганд, являющийся производным 1,3-дипиразолилпропандиона-1,3 общей формулы
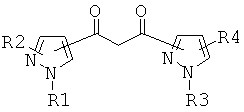
где R1, R3 - алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, R2, R4 - атом водорода, алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, атом галогена, CF3 или NO2-группа. При этом сопряжение дикетонного фрагмента может осуществляться симметрично или несимметрично по положениям 3, 4 или 5 каждого пиразольного цикла, L2 -вспомогательный бидентатный N, Р или О-содержащий лиганд, например 1,10-фенантролин (Phen), 2,2-бипиридил (Bipy), трифенилфосфиноксид (ТРРО), три-н-октилфосфиноксид (ТОРО), диметиловый эфир диэтиленгликоля (Diglim). Также предложен способ его получения. Изобретение позволяет получить новые комплексные соединения редкоземельных элементов, обладающие высокой интенсивностью люминесценции. 2 н.п. ф-лы, 3 ил., 10 пр.
1. Комплексное соединение редкоземельных элементов общей формулы
[Ln(L1)3L2],
где Ln - ион трехвалентного редкоземельного элемента, например Nd, Рr, Sm, Eu, Tb, Dy, Ho, Tm, Er, Yb;
L1 - дикетонатный лиганд, являющийся производным 1,3-дипиразолилпропандиона-1,3 общей формулы

где R1, R3 - алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель; R2, R4 - атом водорода, алкильный, фторалкильный, арильный, циклоалкильный или гетероциклический заместитель, атом галогена, CF3 или NO2 - группа, причем сопряжение дикетонного фрагмента может осуществляться симметрично или несимметрично по положениям 3, 4 или 5 каждого пиразольного цикла;
L2 - вспомогательный бидентатный N, Р или О-содержащий лиганд, например 1,10-фенантролин (Phen), 2,2-бипиридил (Bipy), трифенилфосфиноксид (ТРРО), три-н-октилфосфиноксид (ТОРО), диметиловый эфир диэтиленгликоля (Diglim).
2. Способ получения комплексного соединения редкоземельных элементов по п.1, включающий растворение дикетона и вспомогательного бидентатного N, Р или О-содержащего лиганда, взятых в молярном соотношении 3:1, в этиловом спирте при повышенной температуре (предпочтительно 30-50°С), добавление в полученный раствор 1-3 М водного раствора гидроксида щелочного металла, взятого в эквивалентном (по молям) количестве по отношению к дикетону, и последующее добавление в реакционную массу водного раствора соли редкоземельного элемента, взятой в соотношении 1 моль РЗЭ на 3 моля дикетона, причем взаимодействие компонентов осуществляют в водно-спиртовой среде при рН 6-6,5 в течение 12-24 ч при температуре 35-50°С в герметично закрытых контейнерах, выделение комплексного соединения редкоземельных элементов осуществляют упариванием досуха реакционной массы и последующей экстракцией остатка хлорированным растворителем, например дихлорметаном, хлороформом или смесью этих растворителей с абсолютным этанолом, полученный раствор фильтруют, упаривают и выделяют комплексное соединение редкоземельных элементов путем медленного добавления углеводородного растворителя, например пентана, гексана, гептана или бензола, в результате чего комплексное соединение осаждается в твердом виде.
| ELISEEVA S.V | |||
| et al | |||
| Lanthanide luminescence for functional materials and bio-sciences, Chem | |||
| Soc | |||
| Rev., 2010, v.39, p.189-227 | |||
| MARCHETTI F | |||
| et al | |||
| Acylpyrazolone ligands: Synthesis, structures, metal coordination chemistry and applications, Coordination Chemistry Reviews, 2005, v.249, p.2909-2945 | |||
| PETTINARI C | |||
| et al | |||
| Synthesis, structure and |
Авторы
Даты
2012-12-20—Публикация
2011-08-16—Подача