Область техники, к которой относится изобретение
Изобретение относится к новому соединению фенилуксусной кислоты или его соли и лекарственному средству, включающему его в качестве активного ингредиента. Конкретно, настоящее изобретение относится к новому соединению фенилуксусной кислоты формулы (I)
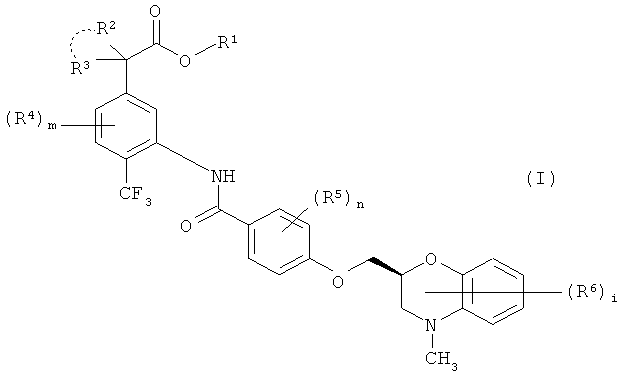
в которой все символы имеют значение, как описано ниже, его соли, N-окиси или сольвату, или пролекарству и к лекарственному средству, включающему вышеперечисленное в качестве активного ингредиента.
Уровень техники
Простагландин D2 (сокращенно PGD2) известен как метаболит, продуцируемый в каскаде арахидоновой кислоты, и считается одним из химических медиаторов, участвующим в аллергических заболеваниях, таких как аллергический ринит, бронхиальная астма и аллергический конъюнктивит. Известно, что PGD2 в основном продуцируется в тучных клетках и высвобождается из них и что высвобожденный PGD2 вызывает сокращение бронхов, усиление сосудистой проницаемости, расширение или сокращение кровеносных сосудов, усиление секреции слизи, ингибирование агрегации тромбоцитов и т.д. Показано также, что PGD2 индуцирует сокращение бронхов и закупорку носа in vivo, и продукция PGD2 увеличена при патологическом состоянии у пациентов, страдающих от системного мастоцитоза, аллергического ринита, бронхиальной астмы, атопического дерматита, крапивницы и т.д. (N. Engl. J. Med. 1980; 303: 1400-4, Am. Rev. Respir. Dis. 1983; 128: 597-602, J. Allergy Clin. Immunol. 1991; 88: 33-42, Arch. Otolaryngol. Head Neck Surg. 1987; 113: 179-83, J. Allergy Clin. Immunol. 1988; 82: 869-77, J. Immunol. 1991; 146: 671-6, J. Allergy Clin. Immunol. 1989; 83: 905-12, N. Eng. J. Med. 1986; 315: 800-4, Am. Rev. Respir. Dis. 1990; 142, 126-32, J. Allergy Clin. Immunol. 1991; 87: 540-8, J. Allergy Clin. Immunol 1986; 78: 458-61). Показано также, что PGD2 участвует в активности нервной системы, особенно во время сна, при секреции гормонов и боли. Дополнительно, показано также, что он участвует в агрегации тромбоцитов, метаболизме гликогена и регуляции внутриглазного давления и т.д.
В WO 2005/028455 (патентный документ 1 здесь и далее) описано, что соединение формулы (А) связывается с PD рецептором и ведет себя как его антагонист:
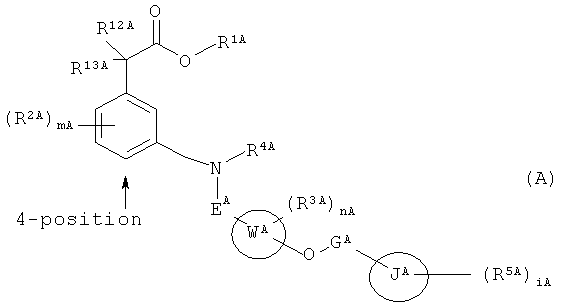
где
R1A представляет собой (1) атом водорода, (2) С1-4 алкильную группу и т.д.,
ЕA представляет собой -СО группу и т.д.,
R2A представляет собой (1) атом галогена, (2) С1-6 алкильную группу, (3) С 1-6 алкокси группу, (4) гидроксильную группу, (5) тригалометильную группу, (6), циано группу, (7) фенильную группу, (8) пиридильную группу, (9) нитрогруппу, (10) -NR6AR7A группу, (11) С1-4 алкильную группу, замещенную -OR8A группой, (12) окисленную С1-6 алкильную группу, (13) -SO2R11A группу, (14) -SOR11A группу или (15) -SR11A группу,
R3A представляет собой (1) атом галогена или (2) С1-6 алкильную группу и т.д.,
R6A и R7A независимо представляют собой атом водорода или С1-4 алкильную группу,
R8A представляет собой С1-4 алкильную, фенильную или пиридильную группу,
R4A представляет собой (1) атом водорода и т.д.,
R5A представляет собой (1) С1-6 алкил или (2) С1-10 алкокси и т.д.,
R11A представляет собой С1-6 алкильную группу или при необходимости замещенную фенильную группу,
Кольцо WA представляет собой С5-12 моноциклическое или бициклическое углеродное кольцо и т.д.,
GA представляет собой (1) С1-6 алкиленовую группу и т.д., имеющую 0-2 гетероатома, выбранные из группы, состоящей из атома азота, атома кислорода и атома серы.
Кольцо JA представляет собой С5-12 моноциклическое или бициклическое гетероциклическое кольцо и т.д.,
mА представляет собой 0 или целое число от 1 до 4,
nА представляет собой 0 или целое число от 1 до 4,
iA представляет собой 0 или целое число от 1 до 11,
R12A и R13A независимо представляют собой (1) при необходимости окисленную С1-4 алкильную группу, (2) атом галогена, (3) тригалометильную группу, (4) при необходимости защищенную гидроксильную группу, (5) при необходимости защищенную аминогруппу, (6) при необходимости замещенную фенильную группу, (7) при необходимости замещенную пиридильную группу или (8) атом водорода, или R12A и R13A вместе взятые представляют собой (1) оксо-группу, (2) С2-5 алкиленовую группу, в которой атом углерода при необходимости заменен атомом кислорода, атомом азота или атомом серы, где С2-5 алкиленовая группа при необходимости замещена или (3) при необходимости замещенную С 1-6 алкилиденовую группу (см. патентный документ 1).
В WO 03/078409 (патентный документ 2 здесь и далее) описано, что соединение формулы (В) связывается с PD рецептором и ведет себя как его антагонист:
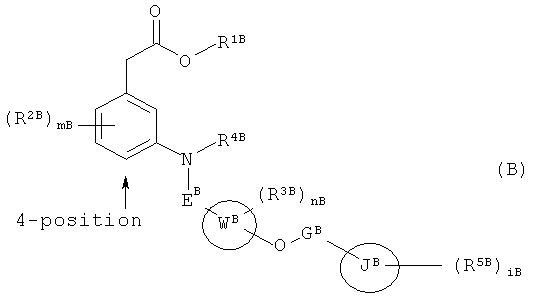
где R1B представляет собой (1) атом водорода, (2) С1-4 алкильную группу и и.д.,
ЕB представляет собой -С(=O)- группу и т.д.,
R2B представляет собой (1) атом галогена, (2) С1-6 алкильную группу, (3) С1-6 алкокси группу, (4) гидроксильную группу, (5) тригалометильную группу, (6), циано группу, (7) фенильную группу, (8) пиридильную группу, (9) нитрогруппу (10) -NR6BR7B группу или (11) С 1-4 алкильную группу, замещенную -OR8B группой,
R3B представляет собой (1) атом галогена или (2) С1-6 алкильную группу и т.д.,
R6B и R7B независимо представляют собой атом водорода или С1-4 алкильную группу,
R8B представляет собой С1-4 алкильную, фенильную или пиридильную группу,
R4B представляет собой (1) атом водорода и т.д.,
R5B представляет собой (1) С1-6 алкил или (2) С1-10 алкокси группу и т.д.
Кольцо WB представляет собой С5-12 моноциклическое или бициклическое углеродное кольцо и т.д.,
Gв представляет собой (1) С1-6 алкиленовую группу и т.д., содержащую 0-2 гетероатома, выбранные из группы, состоящей из атома азота, атома кислорода и атома серы,
кольцо JB представляет собой С5-12 моноциклическое или бициклическое гетероциклическое кольцо и т.д.,
mВ представляет собой 0 или целое число от 1 до 4,
nВ представляет собой 0 или целое число от 1 до 4,
iB представляет собой 0 или целое число от 1 до 11 (см. патентный документ 2).
Хотя в патентных документах 1 и 2 перечислены типы заместителей, представленных обозначениями R2A и R2B, нет описания наиболее предпочтительных положений замещения и нет описания эффектов или предположения относительно эффектов, связанных с типом и положением заместителя.
Дополнительно, в патентных документах 1 и 2 нет описания того, что фермент, участвующий в метаболизме лекарства, ингибируется путем введения конкретного заместителя в определенное положение соединения, представленного формулами (А) и (В), и поэтому, естественно, нет описания или предложения способов решения.
Дополнительно, в патентных документах 1 и 2 нет описания того, что в зависимости от комбинации типа заместителя и положения замещения соединения формул (А) и (В) могут обладать недостаточной избирательностью по отношению к другим рецепторам и поэтому, естественно, нет описания или предложения способов решения данной проблемы.
Раскрытие изобретения
Есть потребность в соединении, являющемся безопасным антагонистом DP рецептора, которое обладало бы значительной антагонистической активностью, не ингибировало бы фермент, участвующий в метаболизме лекарства, и обладало бы хорошей избирательностью по отношению к рецептору.
Так, если соединение ингибирует какой-либо фермент, участвующий в метаболизме лекарств, то имеется возможность взаимодействия лекарства с другим, сопутствующим лекарством, что может привести к серьезным побочным действиям, и это становится основной проблемой при применении соединения в качестве лекарственного средства.
Каскад арахидоновой кислоты включает различные типы простагландинов и есть много простагландиновых рецепторов, включая их подтипы, которые соответствуют каждому соединению и которые, соответственно, связаны с различными фармакологическими действиями. Поэтому для получения нового безопасного лекарственного средства, обладающего уменьшенными побочными действиями, важно также, чтобы лекарство обладало достаточной избирательностью по отношению к другим простагландиновым рецепторам.
Например, EP1 рецептор, ЕР2 рецептор, ЕР3 рецептор и ЕP4 рецептор известны как рецепторы подтипа ЕР, лигандом которых является простагландин Е.
Поскольку агонист ЕР2 рецептора обладает активностью релаксанта гладкой мускулатуры сосудов, есть опасение, что он вызывает понижение кровяного давления в качестве системного действия. Если агонист ЕР2 рецептора вызывает релаксацию гладкой мускулатуры местных сосудов, окружающих нос, то может случиться отек слизистой носа, связанный с понижением сосудистого сопротивления, в результате чего лечебное действие, направленное против симптомов аллергического ринита (закупорки носа и т.д.), которое ожидается от агониста DP рецептора, будет ослаблено. Дополнительно, действие по релаксации маточной мускулатуры, которым обладают агонисты ЕР2 рецептора, рассматривается как побочное действие с точки зрения предотвращения и/или лечения заболеваний, для которых предназначены соединения антагонисты DP рецепторов.
Таким образом, при разработке соединений антагонистов DP рецепторов исключительно важно, чтобы они обладали достаточной избирательностью относительно ЕР2 рецептора.
Авторы настоящего изобретения обнаружили, что метильная группа в 4-м положении соединения фенилуксусной кислоты, представленного формулами (А) и (В), улучшает сродство связывания с DP рецепторами значительно больше, чем наблюдается в случае незамещенных соединений. Однако стало ясным, что введение метильной группы усиливает также ингибирующее действие по отношению к CYP3A4, который является ферментом, участвующим в метаболизме лекарства.
Авторы настоящего изобретения обнаружили также, что введение хлора в положение 4 фенилуксусного соединения, представленного формулами (А) и (В), улучшает сродство связывания с DP рецепторами значительно больше, чем наблюдается в случае незамещенных соединений. Однако стало ясным, что присутствие в положении 4 фенилуксусного соединения атома водорода или хлора приводит к чрезвычайно высокому сродству связывания ЕР2 рецепторов. Введение хлора не оказывает действия на CYP3A4, однако, сильное сродство к ЕР2 рецептору представляет собой существенную проблему.
Авторы настоящего изобретения провели обширные исследования многих типов заместителей и положений замещения с целью решения вышеупомянутых проблем и неожиданно обнаружили, что соединение, имеющее основной скелет соединения, представленного формулами (А) и (В) per se, но несущее трифторметильную группу по положению 4 фенилуксусного звена, т.е. соединение формулы (I)
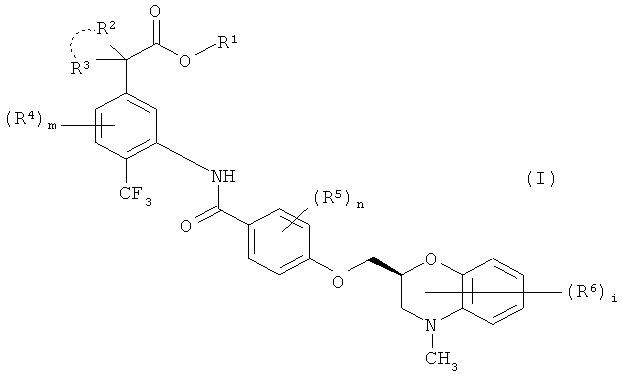
в которой все символы имеют значение, как описано ниже, не проявляет сильного ингибирования фермента, участвующего в метаболизме лекарства, в то же время проявляет неизмененную или улучшенную значительную антагонистическую активность по отношению к DP рецептору. Дополнительно, они обнаружили, что соединение обладает хорошей избирательностью по отношению к DP рецептору. Конкретно обнаружено, что соединение формулы (I), где R2 и R3, взятые вместе, представляют собой при необходимости окисленную С2-5 алкиленовую группу, конкретно -(СН2)2-, обладает гораздо большей избирательностью в отношении DP рецепторов.
Таким образом, настоящее изобретение относится (1) к соединению формулы (I)
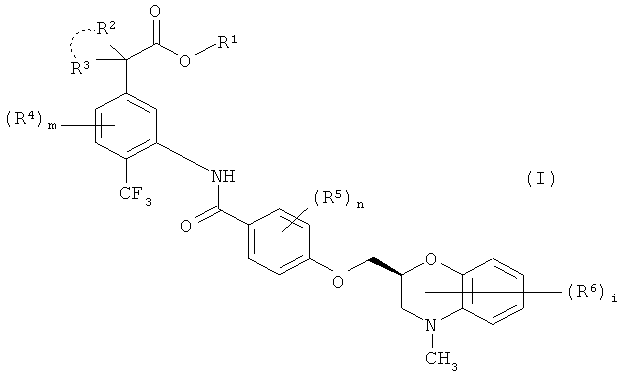
где
R1 представляет собой атом водорода или С1-4 алкильную группу,
R2 и R3 независимо представляют собой атом водорода, при необходимости окисленную С1-4 алкильную группу или при необходимости защищенную гидроксильную группу, при условии, что R2 и R3 не представляют собой при необходимости защищенную гидроксильную группу одновременно, или R2 и R3, взятые вместе, представляют собой при необходимости окисленную С2-5 алкиленовую группу,
каждый R4, R5 и R6 независимо представляет собой атом галогена, при необходимости окисленную С1-6 алкильную группу, при необходимости защищенную гидроксильную группу, тригалометильную группу, -SO2R7 группу, -SOR7 группу или -SR7 группу,
R7 представляет собой С 1-6 алкильную группу или при необходимости замещенную фенильную группу,

показывает, что заместитель выступает из плоскости листа,
m представляет собой 0 или целое число от 1 до 3,
n представляет собой 0 или целое число от 1 до 4 и
i представляет собой 0 или целое число от 1 до 7 при условии, что когда m равно 2 или более, R4 могут быть одинаковыми или разными, когда n равно 2 или более, R5 могут быть одинаковыми или разными, и когда i равно 2 или больше, R6 могут быть одинаковыми или разными,
его соль, N-оксид или сольват, или пролекарство;
(2) соединение по п.(1), в котором R2 и R3, взятые вместе, представляют собой С2-5 алкиленовую группу;
(3) соединение по п.(1), в котором R представляет собой гидроксильную группу и R3 представляет собой атом водорода или при необходимости окисленную С1-4 алкильную группу;
(4) соединение по п.(1), в котором R2 и R3 представляют собой атомы водорода;
(5) соединение, выбранное из группы, включающей следующие
(1) 1-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота,
(2) 1-(3-((2-этил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота,
(3) 1-(3-((2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота,
(4) (3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)уксусная кислота,
(5) (3-((2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)уксусная кислота,
(6) гидрокси-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)уксусная кислота и
(7) 2-гидрокси-2-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)пропионовая кислота,
их соль, N-оксид или сольват, или пролекарство;
(6) фармацевтическая композиция, включающая в качестве активного ингредиента соединение формулы (I) по п.(1), его соль, N-оксид или сольват, или пролекарство;
(7) фармацевтическая композиция по п.(6), которая представляет собой антагонист DP рецептора;
(8) фармацевтическая композиция по п.(6), которая представляет собой лекарство для профилактики и/или лечения заболеваний, опосредованных DP рецепторами;
(9) фармацевтическая композиция по п.(8), где заболевание, опосредованное DP рецепторами, представляет собой аллергическое заболевание, системный мастоцитоз, нарушения, сопровождающиеся системной активацией тучных клеток, анафилактический шок, бронхоспазм, крапивницу, экзему, прыщи, аллергический бронхиальный пульмонарный аспергиллоз, синусит, мигрень, полип носа, анафилактический васкулит, эозинофильный синдром, контактный дерматит, заболевания, сопровождающиеся зудом, заболевания, вызванные вторично в результате поведения, сопровождающего зуд, заболевания, сопровождающиеся покраснением, воспаление, хронические обструктивные болезни легких, ишемическое реперфузионное нарушение, цереброваскулярную катастрофу, аутоиммунное заболевание, травматическое повреждение мозга, гепатопатию, отторжение трансплантата, ревматоидный артрит, плеврит, остеоартрит, болезнь Крона, язвенный колит, синдром раздраженного кишечника, интерстициальный цистит, мышечную дистрофию, полимиозит, рак, лейкоз, вирусные инфекции, рассеянный склероз, нарушения сна или заболевания, связанные с агрегацией тромбоцитов;
(10) фармацевтическая композиция по п.(9), где аллергические заболевания представляют собой аллергический ринит, аллергический конъюнктивит, атопический дерматит, бронхиальную астму или пищевую аллергию;
(11) лекарственное средство, включающее комбинацию соединения формулы (I) по п.(1), его соли, N-оксида или сольвата, или пролекарства и одного или более лекарственного средства, выбранного из группы, состоящей из антигистаминного агента, супрессора высвобождения медиатора, ингибитора тромбоксансинтетазы, антагониста тромбоксанового А2 рецептора, антагониста лейкотриенового рецептора, ингибитора лейкотриенсинтазы, ингибитора цитокинов, стероидного агента, симпатомиметического агента, ингибитора фосфодиэстеразы IV, производного ксантина, антихолинэргического агента, состава с антителом анти-IgE, иммуносупрессивного агента, антагониста рецептора хемокинов, ингибитора молекулярной адгезии, другого антагониста простаноидного рецептора, нестероидного противовоспалительного агента и ингибитора синтазы оксида азота;
(12) способ профилактики и/или лечения заболеваний, опосредованных DP рецепторами, характеризующийся введением млекопитающему эффективной дозы соединения формулы (I) по п.(1), его соли, N-оксида или сольвата, или пролекарства;
(13) применение соединения формулы (I) по п.(1), его соли, N-оксида или сольвата, или пролекарства для получения лекарственного средства для профилактики и/или лечения заболеваний, опосредованных DP рецепторами, и
(14) соединение формулы (I-а),
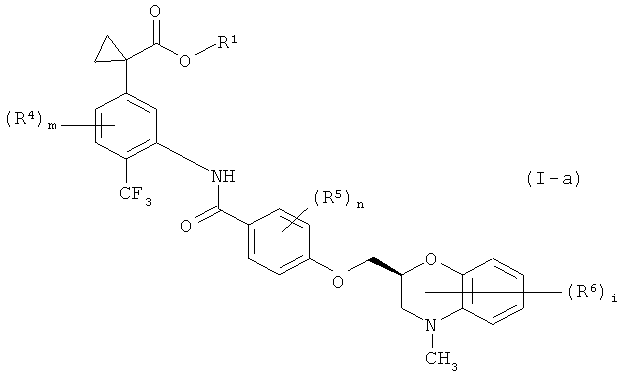
где
R1 представляет собой атом водорода или С1-4 алкильную группу,
каждый R4, R5 и R6 независимо представляет собой атом галогена, при необходимости окисленную С1-6 алкильную группу, при необходимости защищенную гидроксильную группу, тригалометильную группу, -SO2R7 группу, -SOR7 группу или -SR7 группу,
R7 представляет собой С1-6 алкильную группу или при необходимости замещенную фенильную группу,

показывает, что заместитель выступает из плоскости листа,
m представляет собой 0 или целое число от 1 до 3,
n представляет собой 0 или целое число от 1 до 4 и
i представляет собой 0 или целое число от 1 до 7 при условии, что когда m равно 2 или более, R4 могут быть одинаковыми или разными, когда n равно 2 или более, R5 могут быть одинаковыми или разными, и когда i равно 2 или больше, R6 могут быть одинаковыми или разными,
его соль, N-оксид или сольват, или пролекарство.
Эффект от изобретения
Поскольку соединение формулы (I) согласно настоящему изобретению связывается с DP рецептором и ведет себя как антагонист, оно полезно для профилактики и/или лечения заболеваний, опосредованных DP рецепторами. Дополнительно, поскольку соединение формулы (I) согласно настоящему изобретению не обладает сильным ингибиторным действием на фермент, участвующий в метаболизме лекарства, и обладает хорошей избирательностью по отношению к DP рецепторам, его можно применять в качестве безопасного лекарства.
Осуществление изобретения
В настоящем описании R1 представляет собой атом водорода или С 1-4 алкильную группу.
С1-4 алкильные группы, представленные R1, включают линейные и разветвленные алкильные группы, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил.
В настоящем описании R2 и R3 каждый независимо представляют собой атом водорода, при необходимости окисленную С1-4 алкильную группу или при необходимости защищенную гидроксильную группу, или R2 и R3, взятые вместе, представляют собой при необходимости окисленную С2-5 алкиленовую группу.
При необходимости окисленные С1-4 алкильные группы, представленные R2 или R3, включают С1-4 алкильную группу, при необходимости замещенную 1-3 гидроксильными группами и 1-3 оксо-группами. Заметим, что атом углерода, к которому присоединены несколько гидроксильных групп и/или оксо групп, ограничен терминальным атомом углерода. Конкретно, С1-4 линейные или разветвленные алкильные группы включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил, гидроксиметил, формил, карбокси, 2-гидроксиэтил, 2-оксоэтил, карбоксиметил, 1-гидроксиэтил, ацетил, 3-гидроксипропил, 3-оксопропил, 2-карбоксиэтил, 2-гидроксипропил, 2-оксопропил, 1-гидрокси-1-метилэтил, 4-гидроксибутил, 4-оксобутил, 3-карбоксипропил, 3-гидроксибутил, 3-оксобутил, 3-гидрокси-2-метилпропил, 2-метил-3-оксопропил, 2-карбоксипропил, 2-гидрокси-2-метилпропил, 3-гидрокси-1-метилпропил, 1-метил-3-оксопропил, 2-карбокси-1-метилэтил, 2-гидрокси-1-метилпропил, 1-метил-2-оксопропил, 1-гидрокси-1-метилпропил, 1-гидроксиметилпропил, 1-формилпропил, 1-карбоксипропил, 2-гидрокси-1,1-диметилэтил, 1,1-диметил-2-оксоэтил или 1-карбокси-1-метилэтил в качестве примеров.
При необходимости защищенные гидроксильные группы, представленные R2 или R3, включают гидроксильную группу или гидроксильную группу, защищенную защитной группой. Защитные группы для гидроксильной группы включают, например, алкильные группы, при необходимости имеющие заместитель (например, линейные или разветвленные С1-6 алкильные группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и т.д., С7-15 аралкильные группы, такие как бензил, фенетил, фенилпропил, нафтилметил, нафтилэтил и т.д.), карбоциклические группы, у которых может быть заместитель (например, при необходимости частично или полностью насыщенное С3-15 моноциклическое, бициклическое или трициклическое ненасыщенное углеродное кольцо, такое как циклопропан, циклобутан, циклопентан, циклогексан, бензол, толуол, ксилен, инден, индан или нафталин), гетероцикличекие группы, при необходимости имеющие заместитель (например, 3-15-членное моноциклическое, бициклическое или трициклическое ненасыщенное гетероциклическое кольцо, содержащее 1-5 гетероатомов, выбранных из атомов кислорода, азота и серы, например, пиррол, имидазол, триазол, тетразол, пиразол, пиридин, пиразин, пиримидин, фуран, тиофен, оксазол, изоксазол, тиазол, оксадиазол, оксазин, оксадиазин, тиадиазол, индол, бензофуран, бензотиофен, хинолин, изохинолин, бензоксазол, бензотиазол или бензимидазол, или при необходимости частично или полностью насыщенное 3-15-членное моноциклическое, бициклическое или трициклическое ненасыщенное гетероциклическое кольцо, содержащее 1-5 гетероатомов, выбранных из атомов кислорода, азота и серы, например, азиридин, азетидин, пирролидин, пиперидин, пиперазин, оксиран, оксетан, тетрагидрофуран, тетрагидропиран, морфолин, индолин или дигидробензофуран), алкилсульфонильные группы (например, С 1-4 алкилсульфонильная группа, например, метилсульфонил, этилсульфонил и т.д.), арилсульфонильные группы (например, С6-10 арилсульфонильная группа, например, фенилсульфонил), или ацильные группы (например, С1-6 алканоильная группа, например, формил, ацетил, пропаноил, пивалоил и, например, С6-10 арилкарбонильная группа, например, бензоил).
При необходимости окисленные С2-5 алкиленовые группы, представленные R2 и R3, взятыми вместе, включают С2-5 линейные или разветвленные алкиленовые группы, например этилен, пропилен, изопропилен, бутилен, изобутилен и пентилен, которые при необходимости замещены 1-3 гидроксильными группами и/или 1-3 оксо группами. Конкретно, -(СН2)2-, -(CH2)3-, -CH2CH(CН3)-, -(СH2)4-, -(СH2)2СH(СН3)-, -СН2СН(СН3)СН2-, -СН(СН2)СН(СН3)-, -СН2СН(СН3)2-, -(СН2)5-, -(СН2)3СН(СН3)-, -(СН2)2СН(СН3)СН2-, -СН2СН(ОН)-, -СН2-С(O)-, -СН2СН2СН(ОН)-, -СН2СН(ОН)СН2-, -СН2СН2С(O)-, -СН2С(O)СН2 - и т.д. являются примерами.
В настоящем описании R4 представляет собой атом галогена, при необходимости окисленную С1-6 алкильную группу, при необходимости защищенную гидроксильную группу, тригалометильную группу, -SO2R7 группу, -SOR7 группу или -SR7 группу.
Атом галогена, представленный R4, включает атом фтора, хлора, брома или йода.
При необходимости окисленные С 1-6 алкильные группы, представленные R4, включают С1-6 алкильные группы, при необходимости замещенные 1-3 гидроксильными группами и/или 1-3 оксо группами. Заметим, что атом углерода, к которому присоединены несколько гидроксильных групп и/или оксо групп, ограничен терминальным атомом углерода. Конкретно, С1-6 линейные или разветвленные алкильные группы включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил или изогексил, гидроксиметил, формил, карбокси, 2-гидроксиэтил, 2-оксоэтил, карбоксиметил, 1-гидроксиэтил, ацетил, 3-гидроксипропил, 3-оксопропил, 2-карбоксиэтил, 2-гидроксипропил, 2-оксопропил, 1-гидрокси-1-метилэтил, 4-гидроксибутил, 4-оксобутил, 3-карбоксипропил, 3-гидроксибутил, 3-оксобутил, 3-гидрокси-2-метилпропил, 2-метил-3-оксопропил, 2-карбоксипропил, 2-гидрокси-2-метилпропил, 3-гидрокси-1-метилпропил, 1-метил-3-оксопропил, 2-карбокси-1-метилэтил, 2-гидрокси-1-метилпропил, 1-метил-2-оксопропил, 1-гидрокси-1-метилпропил, 1-гидроксиметилпропил, 1-формилпропил, 1-карбоксипропил, 2-гидрокси-1,1-диметилэтил, 1,1-диметил-2-оксоэтил или 1-карбокси-1-метилэтил в качестве примеров.
При необходимости защищенная гидроксильная группа, представленная R4, и при необходимости защищенная гидроксильная группа, представленная R2 и R3, имеют одинаковое значение.
Тригалометильная группа, представленная R4, означает метальную группу, замещенную тремя атомами галогена, и включает трифторметил, трихлорметил и т.д.
R7 в -SO2R группе, -SOR7 группе или -SR7 группе, представленных R4, представляет С1-6 алкильную группу или при необходимости замещенную фенильную группу.
С1-6 алкильные группы, представленные R5, включают линейные или разветвленные алкильные группы, включающие метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил, пентил, изопентил, неопентил, гексил или изогексил.
При необходимости замещенные фенильные группы, представленные R7, включают, например, фенильную группу, толильную группу, ксилильную группу и т.д.
В настоящем описании R5 представляет собой атом галогена, при необходимости окисленную С1-6 алкильную группу, при необходимости защищенную гидроксильную группу, тригалометильную группу, -SO2R7 группу, -SOR7 группу или -SR7 группу.
Атом галогена, при необходимости окисленная С1-6 алкильная группа, при необходимости защищенная гидроксильная группа и тригалометильная группа, представленные R5, соответственно, имеют те же значения, как атом галогена, при необходимости окисленная С1-6 алкильная группа, при необходимости защищенная гидроксильная группа и тригалометильная группа, представленные R4.
R7 в -SO2R7 группе, -SOR7 группе или -SR7 группе, представленных R5, представляет собой С1-6 алкильную группу или при необходимости замещенную фенильную группу.
В настоящем описании R6 представляет собой атом галогена, при необходимости окисленную С1-6 алкильную группу, при необходимости защищенную гидроксильную группу, тригалометильную группу, -SO2R7 группу, -SOR7 группу или -SR7 группу.
Атом галогена, при необходимости окисленная С 1-6 алкильная группа, при необходимости защищенная гидроксильная группа и тригалометильная группа, представленные R6, соответственно, имеют те же значения, как атом галогена, при необходимости окисленная С 1-6 алкильная группа, при необходимости защищенная гидроксильная группа и тригалометильная группа, представленные R4.
R7 в -SO2R7 группе, -SOR7 группе или -SR7 группе, представленных R6, представляет собой С1-6 алкильную группу или при необходимости замещенную фенильную группу.
В настоящем описании m представляет собой 0 или целое число от 1 до 3 при условии, что когда m равно 2 или более, R4 могут быть одинаковыми или разными.
В настоящем описании n представляет собой 0 или целое число от 1 до 4 при условии, что когда n равно 2 или более, R5 могут быть одинаковыми или разными.
В настоящем описании i представляет собой 0 или целое число от 1 до 7 при условии, что когда i равно 2 или больше, R6 могут быть одинаковыми или разными.
В настоящем изобретении, если специально не оговорено, как понятно специалисту в данной области, символ

показывает, что заместитель расположен за планом листа (это α-положение), и символ

показывает, что заместитель расположен перед планом листа (это β-положение), и символ

показывает смешанное α-положение и β-положение.
В формуле (I) R1 предпочтительно представляет собой атом водорода.
В формуле (I) R2 и R3 предпочтительно представляют собой атом водорода, С1-4 алкильную группу или гидроксильную группу, более предпочтительно, атом водорода или гидроксильную группу.
В формуле (I) R2 и R3 вместе предпочтительно представляют собой С2-5 алкиленовую группу, более предпочтительно -(СН2)2-.
В группе
формулы (I) предпочтительно, что R2 и R3 вместе представляют собой С2-5 алкиленовую группу, R2 и R3 представляют собой комбинацию, где R2 представляет собой гидроксильную группу и R3 представляет собой атомы водорода или при необходимости окисленную С1-4 алкильную группу или
R2 и R3 вместе представляют собой атомы водорода и
более предпочтительно, R2 и R3 вместе представляют собой С2-5 алкиленовую группу или
R2 и R3 представляют собой комбинацию, где R2 представляет собой гидроксильную группу и R3 представляет собой атом водорода или С1-4 алкильную группу.
В формуле (I) R4 предпочтительно представляет собой атом галогена, С1-6 алкильную группу, гидроксильную группу, тригалометильную группу, -SO2R7 группу, -SOR7 группу или -SR7 группу, более предпочтительно атом галогена или С1-6 алкильную группу, наиболее предпочтительно атом хлора или метильную группу.
В формуле (I) R5 предпочтительно представляет собой атом галогена, С 1-6 алкильную группу, гидроксильную группу, тригалометильную группу, -SO2R7 группу, -SOR7 группу или -SR7 группу, более предпочтительно атом галогена или С1-6 алкильную группу, наиболее предпочтительно атом хлора, метильную группу, этильную группу или изопропильную группу.
В формуле (I) R6 предпочтительно представляет собой атом галогена, С1-6 алкильную группу, гидроксильную группу, тригалометильную группу, -SO2R7 группу, -SOR7 группу или -SR7 группу, более предпочтительно атом галогена или С1-6 алкильную группу, наиболее предпочтительно атом хлора или метильную группу.
В формуле (I) m предпочтительно равно 0 или 1, более предпочтительно 0.
В формуле (I) n предпочтительно равно 0 или целому числу от 1 до 2, более предпочтительно 2.
В формуле (I) i предпочтительно представляет собой 0 или целое число от 1 до 4, более предпочтительно 0 или целое число от 1 до 2, особенно предпочтительно 0.
Среди соединений формулы (I) соединения, представленные формулой (I-а)
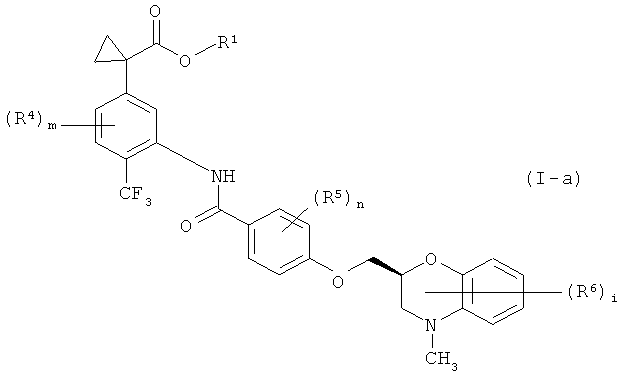
где все символы в формуле имеют такие же значения, как указано выше, соединение формулы (I-b)
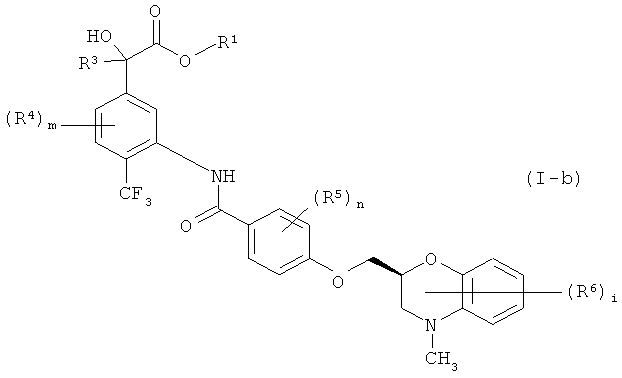
где все символы в формуле имеют такие же значения, как указано выше, соединение формулы (I-c)
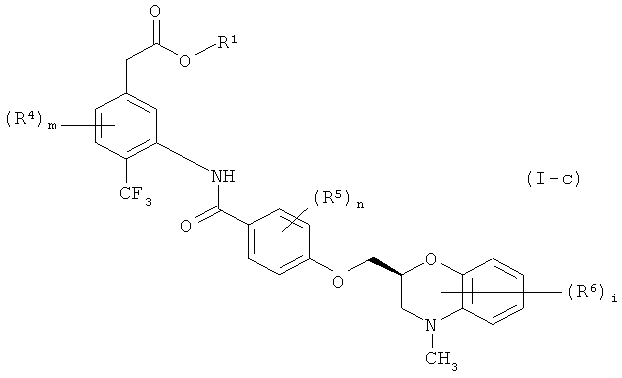
где все символы в формуле имеют такие же значения, как указано выше, соединение формулы (I-b), являются предпочтительными. Наиболее предпочтительно соединение формулы (I-а).
Среди соединений, представленных формулой (I), особенно предпочтительными являются следующие
(1) 1-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота,
(2) 1-(3-((2-этил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота,
(3) 1-(3-((2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота,
(4) (3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)уксусная кислота,
(5) (3-((2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)уксусная кислота,
(6) гидрокси-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2H-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)уксусная кислота и
(7) 2-гидрокси-2-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)пропионовая кислота.
В настоящем изобретении, если не оговорено особо, соединение включает все свои изомеры. Например, в настоящем изобретении группы алкил, алкенил, алкинил, алкокси, алкилтио, алкилен, алкенилен и алкинилен включают линейные и разветвленные типы структуры. Дополнительно, соединения включают все изомеры относительно двойных связей, колец и сопряженных колец (Е-, Z-, цис-, транс-изомеры), изомеры относительно присутствующих асимметричных атомов углерода (R-, S-изомеры, α-, β-конфигурации, энантиомеры, диастереомеры), оптически активные изомеры, обладающие оптическим вращением (D-, L-, d-, 1-изомеры), таутомеры, полярные изомеры согласно хроматографическому разделению (более полярный изомер, менее полярный изомер), равновесные соединения, ротамеры, их смеси в любом соотношении, рацемические смеси согласно настоящему изобретению.
В настоящем изобретении энантиомер соединения формулы (I), являющийся соединением формулы (I-Е),
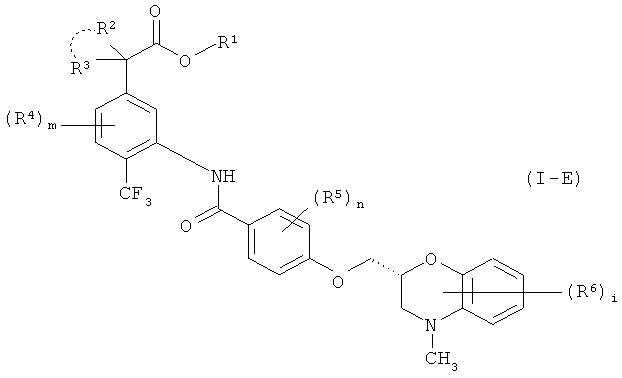
где все символы в формуле имеют такие же значения, как указано выше, может быть в смеси с соединением формулы (I), так что количество первого соединения меньше количества, оказывающего значительное влияние на эффект согласно настоящему изобретению.
Соединение формулы (I) можно переводить в его соль с помощью известных подходов. Соли включают соли щелочных металлов, щелочноземельных металлов, аммонийные соли, соли аминов и соли дополнительных кислот. Предпочтительными являются фармацевтически приемлемые соли.
Предпочтительно, соль является водорастворимой. Приемлемые соли включают соли щелочных металлов (калия, натрия и т.д.), соли щелочноземельных металлов (кальция, магния и т.д.), аммония, фармацевтически приемлемых органических аминов (тетраметиламмония, триэтиламина, метиламина, диметиламина, циклопентиламина, бензиламина, фенетиламина, пиперидина, моноэтаноламина, диэтаноламина, трис(гидроксиметил)аминометана, лизина, аргинина, N-метил-D-глюкамина и т.д.).
Кислотно-аддитивные соли, предпочтительно, являются водорастворимыми. Подходящие кислотно-аддитивные соли включают, например, соли неорганических кислот, такие как соли соляной, бромистоводородной, йодистоводородной кислот, сульфат, фосфат, нитрат и т.д. или соли органических кислот, такие как ацетат, лактат, тартрат, бензоат, цитрат, метансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат, изетионат, глюкуронат, глюконат и т.д.
Соединения согласно настоящему изобретению можно переводить в N-оксид с помощью любых известных способов. N-оксид является соединением, в котором атом азота соединения формулы (I) окислен.
Соединения формулы (I) и их соли можно переводить в сольваты.
Сольваты предпочтительно являются нетоксичными и водорастворимыми. Подходящие сольваты включают, например, водные сольваты или спиртовые сольваты (например, с этанолом и т.д.).
Пролекарство соединения формулы (I) означает соединение, которое превращается в соединение формулы (I) in vivo в ходе ферментативной реакции, под действием желудочной кислоты и т.п. Пролекарства соединения формулы (I) включают следующие варианты:
когда соединения формулы (I) имеют гидроксильную группу, те соединения, у которых гидроксильная группа ацилирована, алкилирована, фосфорилирована или борирована (например, соединение формулы (I), у которого гидроксильная группа ацетилирована, пальмитоилирована, пропаноилирована, пивалоилирована, сукцинилирована, фумарилирована, аланилирована или диметиламиноэтилкарбонилирована);
когда соединения формулы (I) имеют карбоксильную группу, те соединения, у которых карбоксильная группа этерифицирована или амидирована (например, соединения формулы (I), у которых карбоксильная группа образует этиловый эфир, изопропиловый эфир, фениловый эфир, карбоксиметиловый эфир, диметиламинометиловый эфир, пивалоилоксиметиловый эфир, этоксикарбонилоксиэтиловый эфир, фталидиловый эфир, (5-метил-2-оксо-1,3-диоксолен-4-ил)метиловый эфир, циклогексилоксикарбонилэтиловый эфир или метиламид) и
когда соединения формулы (I) имеют карбоксильную группу, те соединения, у которых карбоксильная группа заменена на гидроксиметильную группу.
Эти соединения можно получать известными per se способами.
Дополнительно, пролекарство соединения формулы (I) может быть его гидратированной или негидратированной формой.
Способ получения соединения согласно настоящему изобретению
Соединения формулы (I) согласно настоящему изобретению можно получать известными способами, такими как приведенные ниже способы, аналогичные им способы или способы, приведенные в примерах. Надо заметить, что в каждом способе получения, приведенном ниже, исходное соединение может быть в форме соли. Такие соли включают описанные выше в качестве фармацевтически приемлемых солей соединения формулы (I). Среди соединений формулы (I) соединения, у которых R1 представляет С1-4 алкильную группу, то есть соединения формулы (IA)
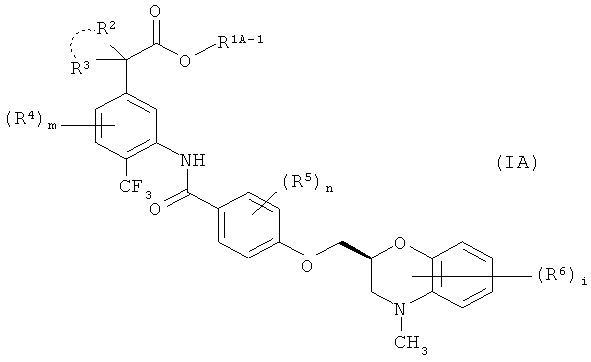
где R1A-1 представляет С1-4 алкильную группу и другие символы имеют такие же значения, как указано выше, можно получать по способу, приведенному ниже.
Соединения формулы (IA) можно получать, подвергая соединения формулы (II)
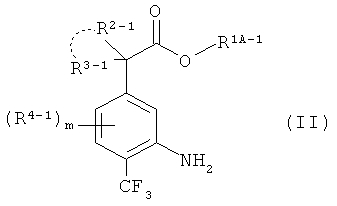
где R2-1, R3-1 и R4-1, соответственно, имеют те же значения, что R2, R3 и R4, в которых карбоксильная группа или гидроксильная группа в группе, представленной R2-1, R3-1 и R4-1, защищена при необходимости и другие символы имеют такие же значения, как выше,
и соединения формулы (III)
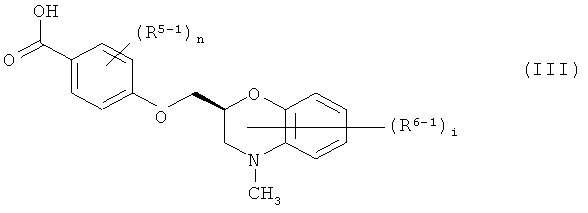
где R5-1 и R6-1, соответственно, имеют те же значения, как R5 и R6, в которых карбоксильная группа или гидроксильная группа в группе, представленной R5-1 и R6-1, защищена при необходимости и другие символы имеют те же значения, как выше, реакции амидирования с последующим снятием защиты при необходимости.
Реакции амидирования хорошо известны и включают, например,
(1) способ с применением галида кислоты,
(2) способ с применением смешанного ангидрида кислоты и
(3) способ с применением конденсирующего агента.
Эти способы конкретно описаны ниже.
(1) Способ с применением галида кислоты проводят, например, как описано ниже. Карбоксильная кислота реагирует с кислым галогенирующим агентом (оксалилхлоридом, тионилхлоридом и т.д.) в органическом растворителе (хлороформе, дихлорметане, диэтиловом эфире, тетрагидрофуране, диметилоксиэтане, ацетонитриле, этилацетате, толуоле и т.д.) или в отсутствие растворителя при температуре от -20°С до температуры возгонки и затем полученный галид кислоты реагирует с амином в присутствии или в отсутствие основания (пиридина, триэтиламина, диметиламина, диметиламинопиридина, диизопропилэтиламина, N-метилморфолина, 5-этил-2-метилпиридина (МЕР) и т.д.) в органическом растворителе (хлороформе, дихлорметане, диэтиловом эфире, тетрагидрофуране, ацетонитриле, этилацетате и т.д.) при температуре от 0°С до 40°С. Реакции предпочтительно проводят в атмосфере инертного газа (аргона, азота и т.д.) в безводных условиях. Дополнительно, полученный галид кислоты можно подвергать реакции с амином с применением щелочного водного раствора (водного раствора бикарбоната натрия или гидроокиси натрия и т.д.) в присутствии или в отсутствие межфазного катализатора (солей четвертичного аммония, таких как тетрабутиламмоний хлорид, триэтилбензиламмоний хлорид, три-н-октилметиламмоний хлорид, триметилдециламмоний хлорид, тетраметиламмоний бромид и т.д.) в органическом растворителе (диоксане, тетрагидрофуране, дихлорметане и т.д.) при температуре от 0°С до 40°С.
(2) Способ с применением смешанного ангидрида кислоты проводят, например, как описано ниже.
Карбоновая кислота реагирует с галидом кислоты (пивалоил хлоридом, тозил хлоридом, метил хлоридом и т.д.) или с производным кислоты (этилхлороформатом, изобутилхлороформатом и т.д.) в присутствии основания (пиридина, триэтиламина, диметиланилина, диметиламинопиридина, диизопропилэтиламина и т.д.) в органическом растворителе (хлороформе, дихлорметане, диэтиловом эфире, тетрагидрофуране и т.д.) или в отсутствие растворителя при температуре от 0°С до 40°С и затем полученный смешанный ангидрид кислоты реагирует с амином в органическом растворителе (хлороформе, дихлорметане, диэтиловом эфире, тетрагидрофуране и т.д.) при температуре от 0°С до 40°С. Реакции предпочтительно проводят в атмосфере инертного газа (аргона, азота и т.д.) в безводных условиях.
(3) Способ с применением конденсирующего агента проводят, например, как описано ниже.
Карбоновая кислота реагирует с амином в органическом растворителе (хлороформе, дихлорметане, диметилформамиде, диэтиловом эфире, тетрагидрофуране и т.д.) или в отсутствие растворителя при температуре от 0°С до 40°С в присутствии или в отсутствие основания (пиридина, триэтиламина, диметиланилина, диметиламинопиридина и т.д.) с применением конденсирующего агента (1,3-дициклогексилкарбодиимида (DCC), 1-этил-3-[3-(диметиламино)пропил]карбодиимида (EDC), 1,1'-карбонилдиимидазола (CDI), 2-хлор-1-метилпиридиниййодида, циклического ангидрида 1-пропилфосфоновой кислоты (циклического ангидрида 1-пропансульфоновой кислоты, РРА) и т.д.) с применением или без применения 1-гидроксибензтриазола (HOBt). Реакции предпочтительно проводят в атмосфере инертного газа (аргона, азота и т.д.) в безводных условиях.
Реакции снятия защиты с карбоксильной или гидроксильной групп хорошо известны и включают, например,
(1) щелочной гидролиз,
(2) реакцию снятия защиты в кислых условиях,
(3) реакцию снятия защиты путем гидрогенолиза,
(4) реакцию снятия защиты силильной группы,
(5) реакцию снятия защиты с применением металла и
(6) реакцию снятия защиты с применением комплекса металла.
Эти способы конкретно описаны ниже.
(1) Реакцию снятия защиты путем щелочного гидролиза проводят, например, путем применения гидроксида щелочного металла (гидроксида натрия, гидроксида калия, лития и т.д.), гидроксида щелочноземельного металла (гидроксида бария, гидроксида кальция и т.д.) или карбоната (карбоната натрия, карбоната калия и т.д.) или их раствора, или их смеси в органическом растворителе (метаноле, тетрагидрофуране, диоксане и т.д.) при температуре от 0°С до 80°С.
(2) Реакцию снятия защиты в кислых условиях поводят, например, в органической кислоте (уксусной кислоте, трифторуксусной кислоте, метансульфоновой кислоте, p-тозильной кислоте и т.д.) или в неорганической кислоте (соляной кислоте, серной кислоте и т.д.), или в их смеси (бромистоводородная кислота/уксусная кислота и т.д.) в органическом растворителе (дихлорметане, хлороформе, диоксане, этилацетате, анизоле и т.д.) в присутствии или в отсутствие 2,2,2-трифторэтанола при температуре от 0°С до 100°С.
(3) Реакцию снятия защиты путем гидрогенолиза проводят, например, в присутствии катализатора (палладий-углеродного, палладиевой черни, гидроокиси палладия на углероде, окиси платины, никеля Рэнея и т.д.) при обычном или повышенном давлении в атмосфере водорода или в присутствии формата аммония в растворителе (таком как эфиры (тетрагидрофуран, диоксан, диметоксиэтан, диэтиловый эфир и т.д.), спирты (метанол, этанол и т.д.), бензолы (бензол, толуол и т.д.), кетоны (ацетон, метилэтилкетон и т.д.), нитрилы (ацетонитрил и т.д.), амиды (диметилформамид и т.д.), вода, этилацетат, уксусная кислота или смесь растворителей, включающая два или более растворителя и т.д.) при температуре от 0°С до 200 С.
(4) Реакцию снятия защиты силильной группы проводят, например, с применением тетрабутиламмоний фторида в органическом растворителе, смешиваемом с водой, (тетрагидрофуран, ацетонитрил и т.д.) при температуре от 0°С до 40°С.
(5) Реакцию снятия защиты с применением металла проводят, например, в кислом растворителе (уксусной кислоте, буферном растворе с рН 4,2-7,2 или жидкой смеси этих растворов с органическим растворителем, таким как тетрагидрофуран) в присутствии порошка цинка с применением ультразвука при необходимости при температуре от 0°С до 40°С.
(6) Реакцию снятия защиты с применением комплекса металла проводят, например, с применением комплекса металла (тетракистрифенилфосфинпалладий (0), бис(трифенилфосфин)палладий (II) дихлорида, ацетата палладия (II), трис (трифенилфосфин)родий(1) хлорида и т.д.) в присутствии реагента-ловушки (гидрида трибутилолова, триэтилсилана, димедона, морфолина, диэтиламина, пирролидина и т.д.), органической кислоты (уксусной кислоты, муравьиной кислоты, 2-этилгексаноевой кислоты и т.д.), и/или солей органических кислот (2-этилгексаноата натрия, 2-этилгексаноата калия и т.д.) в присутствии или в отсутствие фосфинового агента (трифенилфосфина и т.д.) в органическом растворителе (дихлорметане, диметилформамиде, тетрагидрофуране, этилацетате, ацетонитриле, диоксане, этаноле и т.д.), воде или их смеси при температуре от 0°С до 40°С.
Реакцию снятия защиты можно проводить другими способами, отличными от вышеперечисленных, такими как способ, описанный в T.W.Green, Protective groups in Organic Synthesis, Wiley, New York, 1999.
Защитные группы для карбоксильной группы включают, например, метил, этил, аллил, t-бутил, трихлорэтил, бензил (Вn), фенацил, р-метоксибензил, тритил или 2-хлортритил или твердый носитель, к которому эти группы присоединены.
Защитные группы для гидроксильной группы включают, например, метил, тритил, метоксиметил (MOM), 1-этоксиэтил (ЕЕ), метоксиэтоксиэтил (MEM), 2-тетрагидропиранил (ТНР), триметилсилил (TMS), триэтилсилил (TES), t-бутилдиметилсилил (TBDMS), t-бутилдифенилсилил (TBDPS), ацетил (Ас), пивалоил, бензоил, бензил (Вп), р-метоксибензил, аллилоксикарбонил (Alloc), 2,2,2-трихлорэтоксикарбонил (Тгос) и т.д.
Защитные группы для карбоксильной группы или гидроксильной группы не ограничены конкретно вышеописанными группами, если их можно легко и избирательно удалить. Например, можно применять защитные группы, описанные в T.W.Green, Protective groups in Organic Synthesis, Wiley, New York, 1999.
Как хорошо понятно специалисту в данной области техники, целевое соединение согласно настоящему изобретению можно легко получить с применением реакции снятия защиты, аккуратно выбранной для данного объекта.
Среди соединений формулы (I) соединения, у которых R1 представляет атом
водорода, то есть соединение формулы (IB)
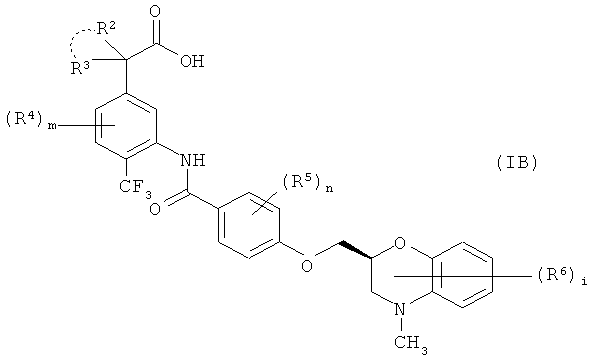
где все символы в формуле имеют те же значения, как указано выше, можно получить, подвергнув соединение формулы (IA) реакции снятия защиты с карбоксильной группы с последующей при необходимости реакцией снятия защиты с гидроксильной группы.
Реакцию снятия защиты с карбоксильной группы можно проводить по способам, описанным выше.
Как хорошо понятно специалисту в данной области техники, целевое соединение согласно настоящему изобретению можно легко получить с применением реакции снятия защиты, аккуратно выбранной для данного объекта.
Реакцию снятия защиты с гидроксильной группы можно проводить по способам, сходным с описанными выше.
Соединения формул (II) и (III) известны как таковые или легко получаются по известным способам.
Например, среди соединений формулы (II) соединения, в которых R2-1 и R3-1 вместе представляют С2-5 алкиленовую группу, то есть соединение формулы (II-1), и соединения, в которых R2-1 и R3-1 представляют собой атомы водорода, то есть соединение формулы (II-2) можно получать по способу, представленному на реакционной схеме 1, показанной ниже. На реакционной схеме 1 X1 и Х2, соответственно, независимо представляют атом водорода, j представляет целое число от 2 до 5, кольцо Е представляет С3-6-членное циклоалкановое кольцо и другие символы имеют такие же значения, как указано выше.
Реакционная схема 1
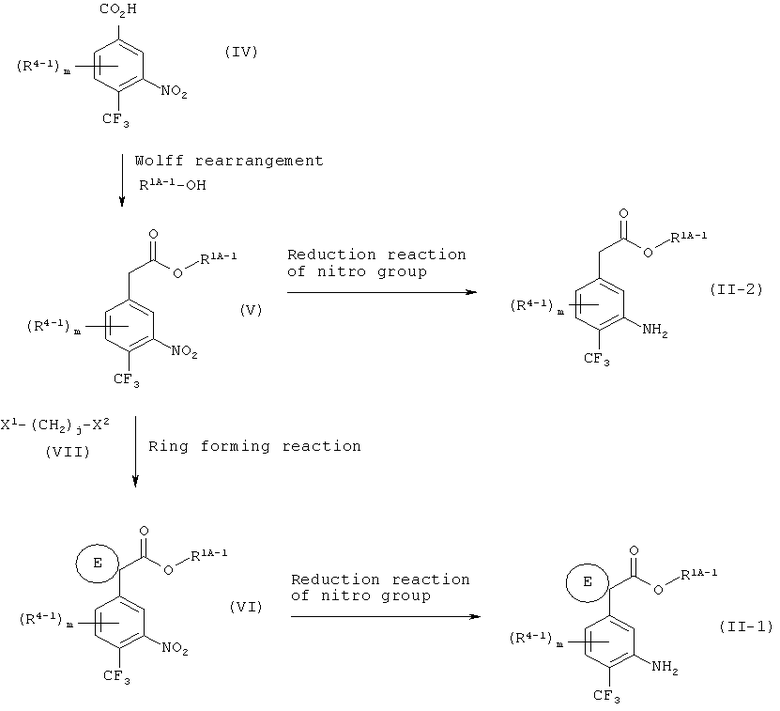
где: Wolff rearrangement - перегруппировка Вольфа;
Reduction reaction of nitro group - реакция восстановления нитрогруппы;
Ring forming reaction - реакция образования кольца.
Например, среди соединений формулы (III) соединения, у которых бензольное кольцо замещено R6-1, то есть соединение формулы (III-1) можно получить по способу, представленному на реакционной схеме 2 ниже. На реакционной схеме 2 k представляет собой 0 или целое число от 1 до 4, Ts представляет тозильную группу (р-толуолсульфонильную группу) и другие символы имеют такие же значения, как указано выше.
Реакционная схема 2
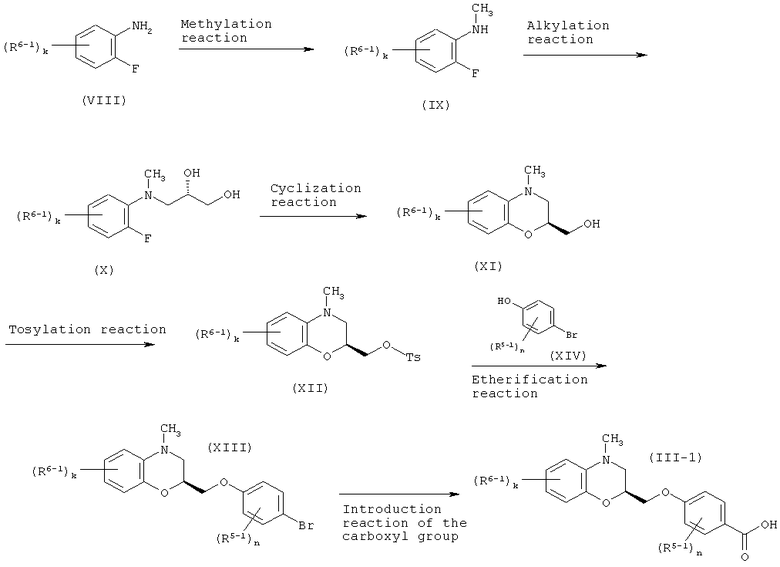
где: Methylation reaction - реакция метилирования;
Alkylation reaction - реакция алкилирования;
Cyclization reaction - реакция циклизации;
Tosylation reaction - реакция тозилирования;
Etherification reaction - реакция этерификации;
Introduction reaction of the carboxyl group - реакция введения карбоксильной группы.
Среди соединений формулы (IA) соединение, в котором R2 является гидроксильной группой, то есть соединение формулы (IA-1)
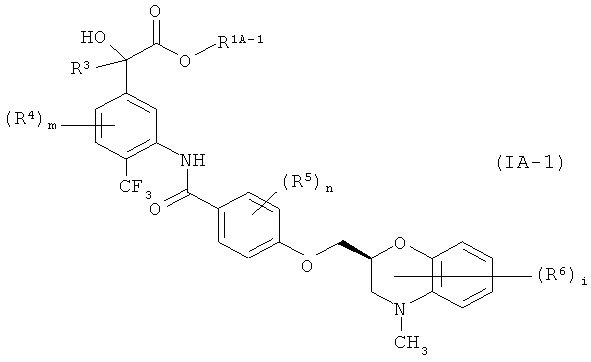
где все символы имеют те же значения, как указано выше, можно получить по способу, представленному на реакционной схеме 3 ниже. На реакционной схеме 3 все символы имеют те же значения, как указано выше.
Реакционная схема 3
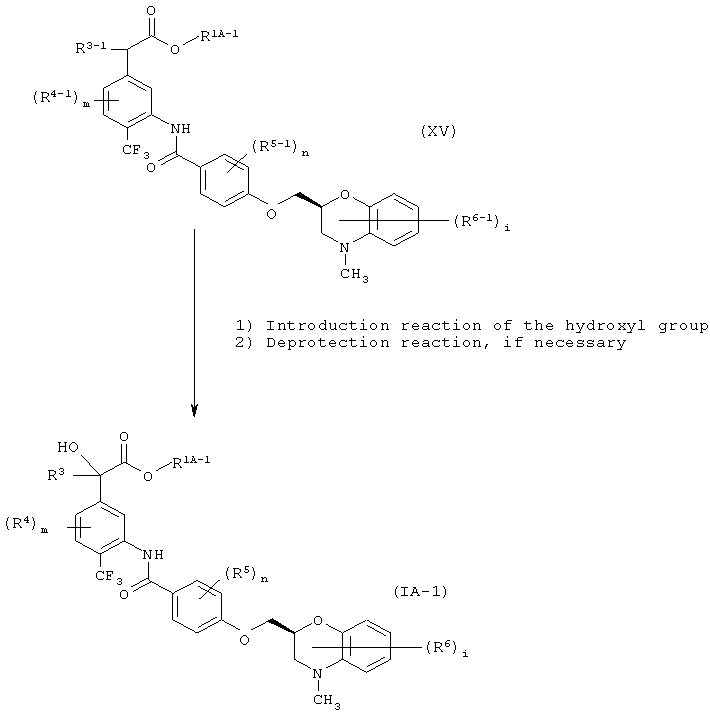
где: Introduction reaction of the hydroxyl group - реакция введения гидроксильной группы;
Deprotection reaction if necessary - реакция снятия защиты при необходимости.
Среди соединений формулы (IB) соединение, в котором R является гидроксильной группой, то есть соединение формулы (IB-1)
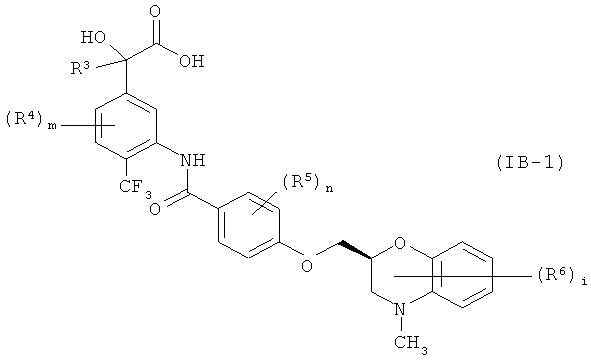
где все символы в формуле имеют те же значения, как указано выше, можно получить, подвергнув соединение формулы (IA-1) реакции снятия защиты с карбоксильной группы с последующей реакцией снятия защиты с гидроксильной группы при необходимости.
Реакцию снятия защиты с карбоксильной группы можно проводить по способам, описанным выше.
На реакционных схемах 1-3 соединения формул (IV), (VII), (VIII), (XIV) и (XV), применяемые в качестве исходных материалов, широко известны или могут быть легко получены с помощью комбинации хорошо известных приемов, например, способов, описанных в Comprehensive Organic Transformations: A Guide to Functional Group Preparations 2nd edition (R.C.Larock, J.Wiley and Sons Inc, 1999), или по способам, описанным в примерах.
Среди соединений формулы (I) настоящего изобретения те, которые не показаны выше, можно получить путем сочетания способов, описанных в примерах или хорошо известных способов, например, способов, описанных в Comprehensive Organic Transformations: A Guide to Functional Group Preparations 2nd edition (R.C.Larock, J.Wiley and Sons Inc. 1999).
В случае каждой реакции, описанной в настоящем изобретении, реакцию при нагревании можно проводить, как понятно специалисту в данной области техники, с помощью водяной бани, масляной бани или микроволнового излучения.
В случае каждой реакции, описанной в настоящем изобретении, можно при необходимости применять реагент на твердой подложке, то есть присоединенный к полимеру (например, полистиролу, полиакриламиду, полипропилену, полиэтиленгликолю и т.д.).
В случае каждой реакции, описанной в настоящем изобретении, продукт реакции можно очищать с помощью известных способов очистки, таких как перегонка при обычном или пониженном давлении, жидкостная хроматография с высоким разрешением с применением силикагеля или силиката магния, тонкослойная хроматография, ионообменные смолы, очищающие смолы или колоночная хроматография, промывка, или перекристаллизация. Очистку можно проводить после каждой реакции или после отдельных реакций.
Применение лекарственных средств
Поскольку соединение согласно настоящему изобретению, представленное формулой (I), связывается с DP рецепторами и действует как антагонист, оно представляется полезным для профилактики и/или лечения заболеваний, опосредованных DP рецепторами, таких как аллергические заболевания (например, аллергический ринит, аллергический конъюнктивит, атопический дерматит, бронхиальная астма или пищевая аллергия и т.д.), системный мастоцитоз, нарушения, сопровождающиеся системной активацией тучных клеток, анафилактический шок, бронхоспазм, крапивница, экзема, прыщи, аллергический бронхиальный пульмонарный аспергиллоз, синусит, мигрень, полип носа, анафилактический васкулит, эозинофильный синдром, контактный дерматит, заболевания, сопровождающиеся зудом (например, атопический дерматит, крапивница, аллергический конъюнктивит, аллергический ринит, контактный дерматит и т.д.), заболевания (например, катаракта, отслойка сетчатки, воспаления, инфекции и нарушения сна), вызванные вторично в результате поведения, сопровождающего зуд (например, расчесывание и биение (beating)), заболевания, сопровождающиеся покраснением, воспаление, хронические обструктивные болезни легких, ишемическое реперфузионное нарушение, цереброваскулярная катастрофа, аутоиммунное заболевание, травматическое повреждение мозга, гепатопатия, отторжение трансплантата, ревматоидный артрит, плеврит, остеоартрит, болезнь Крона, язвенный колит, синдром раздраженного кишечника, интерстициальный цистит, мышечная дистрофия, полимиозит, рак, лейкоз, вирусные инфекции (например, хронический гепатит С и т.д.) или рассеянный склероз. Дополнительно, поскольку рецептор вовлечен в нарушения сна или заболевания, связанные с агрегацией тромбоцитов, соединение также представляется полезным против соответствующих заболеваний.
Соединение формулы (I) сохраняет или проявляет повышенную значительную антагонистическую активность по отношению к DP рецепторам, при этом не оказывая сильного ингибирующего действия на фермент, участвующий в метаболизме лекарства, и обладают хорошей избирательностью по отношению к DP рецепторам. Дополнительно, у соединения формулы (I), в котором R2 и R3 вместе представляют С2-5 алкиленовую группу, или R2 представляет гидроксильную группу, эти эффекты значительные.
Особенно значительным является эффект, когда соединение формулы (I-а)
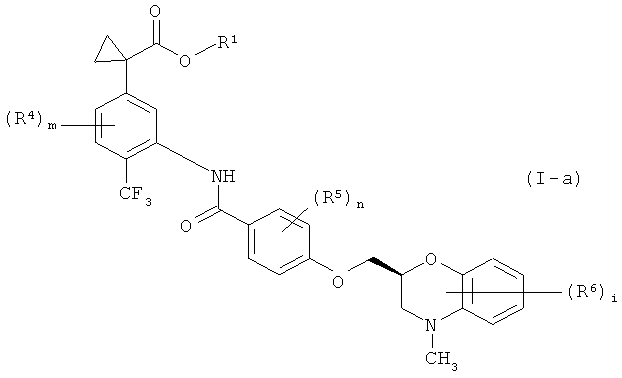
где все символы в формуле имеют те же значения, как указано выше, имеет группу -(СН2)2-, представленную R2 и R3 вместе.
Поскольку соединение формулы (I) настоящего изобретения не оказывает сильного ингибирующего действия на фермент, участвующий в метаболизме лекарства, такой как CYP3A4 или CYP2C9, соединение не проявляет фармацевтического взаимодействия с сопутствующим лекарством, оно может применяться в качестве безопасного лекарства, не вызывающего серьезных побочных эффектов.
Ингибирующая активность (значение IС50) соединения согласно настоящему изобретению по отношению к ферменту, участвующему в метаболизме лекарства, составляет предпочтительно 5 мкмоль/л (мкМ) или больше, более предпочтительно, 10 мкМ или больше, наиболее предпочтительно 30 мкМ или больше.
Каскад арахидоновой кислоты включает много типов простагландинов. Каждое соединение соответствует ряду простагландиновых рецепторов, включая их подтипы, которые, соответственно, связаны с различными фармакологическими эффектами. Поэтому для получения безопасного лекарства, обладающего уменьшенными побочными действиями, важно, чтобы лекарство было достаточно избирательным по отношению к другим простагландиновым рецепторам.
Поскольку соединение формулы (I) согласно настоящему изобретению обладает очень высокой избирательностью к DP рецепторам, фармакологические эффекты, опосредованные простагландиновыми рецепторами, отличными от DP рецепторов, такими как EP1 рецептор, ЕР2 рецептор, ЕР3 рецептор, ЕP4 рецептор, FP рецептор, IP рецептор или ТР рецептор и т.д., не появляются и поэтому соединение можно применять как безопасное лекарство, обладающее уменьшенными побочными действиями. Отметим, что действие на простагландиновые рецепторы, отличные от DP рецепторов, можно измерять, например, по способу, описанному в Biochim. Biophys. Acta, 1483, (2000), 285-293), и т.д., или по способу, описанному далее в биологическом примере 3.
Соединения формулы (I) согласно настоящему изобретению обладают свойствами высокой растворимости и абсорбции. Это наиболее востребованные физические, химические и фармакологические свойства (см. The Merck Manual of Diagnosis and Therapy (17th edition), Merck and Co), учитываемые при разработке лекарственного средства, и поэтому соединения согласно настоящему изобретению удовлетворяют условию, предъявляемому к превосходному лекарственному средству.
Токсичность
Соединение формулы (I) обладает очень низкой токсичностью (например, цитотоксичностью, гепатотоксичностью, нефротоксичностью, дыхательной токсичностью, токсическим действием на мозг и нейротоксичностью, гастроинтестинальной токсичностью, кардиоваскулярной токсичностью, гематологической и гематопоэтической токсичностью, иммунотоксичностью, токсичностью по отношению к костным и хрящевым тканям, кожной токсичностью, токсичностью по отношению к органам чувств, репротоксичностью и токсическим действием на половые органы, эндокринной токсичностью, тератогенезом, карциногенностью или мутагенностью) и является достаточно безопасным для фармацевтического применения.
Соединение формулы (I), его фармацевтически приемлемую соль или сольват можно вводить в качестве сопровождающего лекарства в комбинации с другими лекарственными средствами в целях
(1) дополнения и/или усиления превентивного и/или терапевтического действия терапевтического средства согласно настоящему изобретению,
(2) улучшения фармакокинетики и абсорбции терапевтического средства согласно настоящему изобретению и уменьшения дозировки и/или
(3) уменьшения побочного действия терапевтического средства согласно настоящему изобретению.
Лекарственное средство согласно настоящему изобретению в комбинации с другими лекарствами можно вводить в виде состава, включающего оба соединения, или можно вводить в виде отдельных составов. Введение в виде отдельных составов включает одновременное введение и введение, разделенное во времени. В случае раздельного во времени введения другие лекарства можно вводить после соединения согласно настоящему изобретению или лекарство согласно настоящему изобретению можно вводить после введения другого лекарства. Соответствующие способы введения могут быть одинаковыми или разными.
Вышеупомянутые другие лекарства могут быть низкомолекулярными соединениями или высокомолекулярными соединениями, такими как белки, полипептиды, полинуклеотиды (ДНК, РНК, ген), противосмысловой последовательностью, приманкой, антителом или вакциной и т.д. Дозу другого лекарства можно произвольно выбирать на основе дозы, применяемой в клинике. В составе смеси соотношение терапевтического средства согласно настоящему изобретению и других лекарств можно произвольно выбирать в соответствии с возрастом и массой тех, кому его вводят, способом введения, временем введения, заболеванием, симптомами, комбинацией и т.д. Например, можно применять 0,01-100 массовых частей других лекарств на 1 массовую часть терапевтического соединения согласно настоящему изобретению. Можно вводить комбинацию двух или более типов других лекарств в любом соотношении. Другие лекарства, применяемые с целью дополнения и/или усиления превентивного и/или терапевтического действия терапевтического средства согласно настоящему изобретению, включают на основе вышеописанного механизма не только уже известные лекарства, но также лекарства, которые будут открыты в будущем.
Заболевание, на которое направлено превентивное и/или терапевтическое действие сопровождающих/дополнительных лекарств, не ограничено конкретно, пока оно является заболеванием, при котором превентивное и/или терапевтическое действие лекарственного средства согласно настоящему изобретению дополняется и/или усиливается.
Другие лекарства, применяемые с целью дополнения и/или усиления превентивного и/или терапевтического действия соединений формулы (I) согласно настоящему изобретению против аллергического ринита, включают, например, антигистаминный агент, супрессор высвобождения медиатора, ингибитор тромбоксансинтетазы, антагонист тромбоксанового А2 рецептора, антагонист лейкотриенового рецептора, ингибитор лейкотриенсинтазы, ингибитор цитокинов, стероидный агент, симпатомиметический агент, ингибитор фосфодиэстеразы IV, производное ксантина, антихолинергический агент, состав с антителом анти-IgE, иммуносупрессивный агент, антагонист рецептора хемокинов, ингибитор молекулярной адгезии, другой антагонист простаноидного рецептора, нестероидное противовоспалительное средство и ингибитор синтазы оксида азота и т.д.
Другие лекарства с целью дополнения и/или усиления превентивного и/или терапевтического действия соединений формулы (I) согласно настоящему изобретению против аллергического конъюнктивита включают, например, антигистаминный агент, супрессор высвобождения медиатора, ингибитор тромбоксансинтетазы, антагонист тромбоксанового А2 рецептора, антагонист лейкотриенового рецептора, ингибитор лейкотриенсинтазы, ингибитор цитокинов, стероидный агент, симпатомиметический агент, ингибитор фосфодиэстеразы IV, производное ксантина, антихолинергический агент, состав с антителом анти-IgE, иммуносупрессивный агент, антагонист рецептора хемокинов, ингибитор молекулярной адгезии, другой антагонист простаноидного рецептора, нестероидное противовоспалительное средство и ингибитор синтазы окиси азота и т.д.
Антигистаминные агенты включают, например, кетотифен фумарат, мехитазин, азеластин гидрохлорид, оксатомин, терфенадин, эмедастин фумарат, эпинастин гидрохлорид, астемизол, эбастин, цетиризин гидрохлорид, бепотастин, фексофенадин, лоратадин, деслоратадин, олопатадин гидрохлорид, ТАК-427, ZCR-2060, NIP-530, мометазон фуроат, мизоластин, ВР-294, андоласт, ауранофин, акривастин и т.д.
Супрессоры медиатора высвобождения включают, например, траниласт, хромгликат натрия, амлексанокс, репиринаст, ибудиласт, тазаноласт, пемироласт калия и т.д.
Ингибиторы тромбоксансинтетазы включают, например, озагрель гидрохлорид или тродаст натрия и т.д.
Антагонисты А2 рецепторов тромбоксана включают, например, сератродаст, раматробан, домитробан гидрат кальция, КТ-962 и т.д.
Антагонисты А2 рецепторов лейкотриена включают, например, пранлукаст гидрат, монтелукаст, зафирлукаст, МСС-847, КСА-757, CS-615, YM-158, L-740515, СР-195494, LM-1484, RS-635, A-93178, S-36496, BIIL-284, ONO-4057 и т.д.
Ингибиторы лейкотриенсинтазы включают, например, зилейтон и т.д.
Ингибиторы цитокинов включают, например, суплатаст тозилат и т.д.
Стероидные агенты включают, например, для наружного применения хлорбетазол пропионат, дифлоразон диацетат, флуоцинодин, мометазон фуроат, бетаметазон дипропионат, бетаметазон бутират пропионат, бетаметазон валерат, дифлупреднат, будезонид, дифлукортолон валерат, амцинонид, гальцинонид, дексаметазон, дексаметазон пропионат, дексаметазон валерат, дексаметазон ацетат, гидрокортизон ацетат, гидрокортизон бутират, гидрокортизон бутират пропионат, депродон пропионат, преднизолон валерат ацетат, флуоцинолон ацетонид, беклометазон пропионат, триамцинолон ацетонид, флуметазон пивалат, аклометазон пропионат, клобетазон бутират, преднизолон, беклометазон пропионат, флудроксикортид и т.д.
Лекарства для приема внутрь и лекарства для инъекций включают кортизон ацетат, гидрокортизон, гидрокортизон фосфат натрия, гидрокортизон сукцинат натрия, флудрокортизон ацетат, преднизолон, преднизолон ацетат, преднизолон сукцинат натрия, преднизолонбутилацетат, преднизолонфосфат натрия, галопредон ацетат, метилпреднизолон, метилпреднизолон ацетат, метилпреднизолон сукцинат натрия, триамцинолон, триамцинолон ацетат, триамцинолон ацетонид, дексаметазон, дексаметазон ацетат, дексаметазон фосфат натрия, дексаметазон пальмитат, параметазон ацетат, бетаметазон и т.д.
Агенты для ингаляций включают беклометазон пропионат, флутиказон пропионат, будезонид, флунисолид, триамцинолон, ST-126P, циклезонид, дексаметазон паломитионат, мометазон фуранкарбонат, прастерон сульфонат, дефлазакорт, метилпреднизолон сулептанат, метилпреднизолон сукцинат натрия и т.д.
Симпатомиметические агенты включают, например, нафазолин нитрат, тетрагидрозолин гидрохлорид, оксиметазолин гидрохлорид, трамазолин гидрохлорид, псевдоэфедрин, сальбутамол, сальметерол, форметерол и т.д. Ингибиторы фосфодиэстеразы IV включают, например, теофиллин, циломиласт, рофлумиласт.
Производные ксантина включают, например, аминофиллин, теофиллин, доксофиллин, ципамфиллин, дипрофиллин.
Антихолинэргические агенты включают, например, ипратропий бромид, окситропий бромид, флутропий бромид, циметропий бромид, темиберин, тиотропий бромид, реватропат (UK-112166).
Составы с антителом анти-IgE включают, например, омализумаб. Иммуносупрессивные агенты включают, например, протопик, циклоспорин.
Нестероидные противовоспалительные лекарства включают, например, зазапирин, салицилат натрия, аспирин, соединения аспирина диалюмината, дифлунизал, индометацин, супрофен, уфенамат, диметилизопропилазулен, буфексамак, фелбинак, диклофенак, толметин натрия, клинорил, фенбуфен, набуметон, проглуметацин, индометацин фарнезил, ацеметацин, проглуметацин малеат, амфенак натрия, мофезолак, этодолак, ибупрофен, ибупрофен пиконол, напроксен, флурбипрофен, флурбипрофен аксетил, кетопрофен, фенопрофен кальция, тиапрофен, оксапрозин, пранопрофен, локсопрофен натрия, алюминопрофен, зальтопрофен, мефенамовая кислота, мефенамат алюминия, толфенамовая кислота, флоктафенин, кетофенилбутазон, оксифенилбутазон, пироксикам, ампироксикам, мазь Напагельна, эпиризол, тиарамид гидрохлорид, тинородин гидрохлорид, эморфазон, сулпирин, мигренин, салидон, Sedes G, Amipylo-N, Solbon, лекарства типа пиразолона против обычной простуды, ацетаминофен, фенацетин, диметокситиазин месилат, симетрид-содержащий агент, лекарства непиразалонового типа против обычной простуды.
Массовое соотношение соединения формулы (I) и других лекарственных средств в смеси не является конкретно ограниченным.
Два или более другие лекарственные средства можно произвольно вводить в комбинации.
Другие лекарственные средства с целью дополнения и/или усиления превентивного и/или терапевтического действия соединения формулы (I) включают на основе механизма, описанного выше, не только уже известные лекарства, но также лекарства, которые будут открыты в будущем.
С целью применения соединения формулы (I) или его нетоксических солей согласно настоящему изобретению или лекарства формулы (I) в комбинации с другими лекарствами для вышеописанных целей их обычно вводят орально или парентерально, локально или системно.
Доза может варьировать в зависимости от возраста, массы тела, симптомов, требуемого терапевтического действия, способа введения, продолжительности лечения и т.д. Обычно для взрослого человека вводят дозу от 1 мг до 1000 мг перорально от одного до нескольких раз в день или от 1 мг до 1000 мг парентерально (предпочтительно в виде назальных препаратов, глазных капель или мази) от одного до нескольких раз в день или путем продолжительного введения в вену от 1 часа до 24 часов в день.
Поскольку доза может меняться в зависимости от различных условий, как описано выше, при некоторых обстоятельствах адекватной может быть более низкая доза, чем описано выше, в то же время в отдельных случаях может требоваться доза, превышающая вышеприведенный интервал.
Для введения соединения формулы (I) или его нетоксических солей согласно настоящему изобретению или лекарства формулы (I) в комбинации с другими лекарствами в случае перорального введения обычно применяются в виде твердых композиций, жидких композиций или других композиций, в случае парентерального введения они применяются в форме состава для инъекций, продукта для наружного применения, суппозитория и т.д.
Твердые составы для перорального введения включают таблетки, пилюли, капсулы, порошки, гранулы и т.д.
Капсулы включают твердые капсулы и мягкие капсулы.
В таких твердых составах один или более активный компонент смешивают, по меньшей мере, с одним инертным наполнителем, например, лактозой, маннитом, глюкозой, гидроксипропилцеллюлозой, микрокристаллической целлюлозой, крахмалом, поливинилпирролодоном, алюминометасиликатом магния. Состав может содержать вспомогательные вещества, отличные от инертных наполнителей, например, лубрикант, такой как стеарат магния, дезинтегратор, такой как карбоксиметилцеллюлоза кальция, стабилизирующий агент, такой как лактоза, солюбилизирующий агент, такой как глутаминовая кислота или аспарагиновая кислота. При необходимости таблетка или пилюля может быть покрыта пленкой, сделанной из растворимых в желудке или кишечнике веществ, таких как белый сахар, желатин, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлозафталат, или могут быть покрыты двумя или более слоями. Дополнительно, капсулы, сделанные из абсорбируемых веществ, таких как желатин, также включены.
Жидкие составы для перорального введения включают фармацевтически приемлемые коллоидные растворы (opalizer), жидкие растворы, сироп, эликсир и т.д. В таких жидких составах одно или более активное вещество смешано с обычно применяемыми инертными растворителями (например, очищенной водой, этанолом). Составы могут содержать в дополнение к инертному растворителю вспомогательные вещества, такие как смачивающий агент или суспендирующий агент, подсластитель, ароматизатор, отдушку и консервант.
Другие составы для перорального введения включают спрей, содержащий одно или более активное вещество, который составлен по широко известному способу. Составы могут содержать стабилизирующий агент, например, однозамещенный сульфит натрия и буферный агент, предоставляющий изотоничность, и изотонический агент, например, хлористый натрий, цитрат натрия или лимонную кислоту. Способ получения спрея детально описан, например, в US 2868691 и US 3095355.
Составы для инъекций для парентерального введения согласно настоящему изобретению включают антибактериальные (стерильные) водные и/или неводные жидкие растворы, суспензии и эмульсии. Водные жидкие растворы и суспензии включают, например, дистиллированную воду для инъекций и обычный физиологический раствор. Неводные жидкие растворы и суспензии включают, например, пропиленгликоль, полиэтиленгликоль, растительные масла, например, оливковое масло, спирты, например, этанол, полисорбат 80® и т.д. Стерильные водные и неводные жидкие растворы, суспензии и эмульсии можно применять в виде смеси. Такие составы могут дополнительно содержать вспомогательные вещества, такие как консервант и смачивающий агент, эмульгатор, дезинтегрирующий агент, стабилизирующий агент (например, лактоза), солюбилизирующий агент (например, глутаминовая кислота, аспарагиновая кислота). Их стерилизуют путем фильтрации с применением фильтров, задерживающих бактерии, путем смешивания с бактерицидным агентом или путем облучения. Их можно также применять путем приготовления стерильного твердого состава, например, продукта лиофилизации, и перед употреблением растворять в стерильной или асептической дистиллированной воде для инъекций или в других растворителях.
Лекарственные формы в виде глазных капель для парентерального введения включают глазные капли, глазные капли типа суспензии, глазные капли типа эмульсии, глазные капли, которые растворяются непосредственно перед применением, и глазные мази.
Такие глазные капли можно производить по известным способам. Например, в случае глазных капель изотонический агент (хлористый натрий, концентрированный глицерин и т.д.), буферный агент (фосфат натрия, ацетат натрия и т.д.), поверхностно-активное вещество (полисорбат 80 (торговое название), полиоксилстеарат 40, полиоксиэтилен гидрированное касторовое масло и т.д.), стабилизатор (цитрат натрия, эдентат натрия и т.д.), антисептический агент (хлорид бензалкония, парабен и т.д.), и т.п. соответственно выбирают и готовят в зависимости от потребности. Их стерилизуют на последнем этапе или готовят с помощью стерильных операций.
Составы для ингаляций для парентерального введения включают аэрозольные препараты, порошки для ингаляций или жидкости для ингаляций. Жидкость для ингаляций может быть в такой форме, что ингредиенты растворяют в воде или другой подходящей среде непосредственно перед употреблением.
Эти составы для ингаляций получают по известным способам, например, для получения жидкостей для ингаляций антисептический агент (хлорид бензалкония, парабен и т.д.), краситель, буферное вещество (фосфат натрия, ацетат натрия и т.д.), изотонический агент (хлористый натрий, концентрированный глицерин и т.д.), загуститель (карбоксивиниловый полимер и т.д.), вещество для ускорения всасывания и т.д. соответственно подбирают и готовят в зависимости от потребности.
Для получения порошков для ингаляции лубрикант (стеариновую кислоту, ее соль и т.д.), связующее вещество (крахмал, декстрин и т.д.), наполнитель (лактозу, целлюлозу и т.д.), краситель, антисептическое вещество (хлорид бензалкония, парабен и т.д.), вещество, способствующее всасыванию, и т.д. соответственно подбирают и готовят в зависимости от потребности.
При введении жидкостей для ингаляции обычно применяют приспособление для получения спрея (атомайзер, небулайзер и т.д.) и для введения порошка для ингаляции обычно применяют приспособление для ингаляции порошкообразных лекарств.
Другие композиции для парентерального введения включают наружную аппликацию, крем, мазь, суппозиторий для интраректального введения и пессарий для внутривагинального введения и т.д., содержащие один или более активный ингредиент(ы), которые можно получать по известным способам.
Примеры
Следующие примеры и биологические примеры детально иллюстрируют настоящее изобретение, но не ограничивают области его притязаний.
Растворители в скобках обозначают растворители, применяемые для элюции и проведения реакций, и указанные соотношения растворителей для хроматографического разделения или ТСХ являются объемными. Растворители в скобках в случае описания параметров ЯМР обозначают растворители, применяемые при измерении.
Названия соединений в примерах получены с помощью программы ACD/Name (Version 6.00, Advanced Chemistry Development Inc).
Пример 1. Метил-(3-нитро-4-(трифторметил)фенил)ацетат
В атмосфере аргона 3-нитро-4-(трифторметил)бензойную кислоту (12 г) растворяют в 1,2-диметоксиэтане (120 мл). К реакционной смеси добавляют оксалилхлорид (10,4 мл) и безводный N,N-диметилформамид (одну каплю) и смесь перемешивают в течение 30 мин при 40°С. Реакционную смесь концентрируют с получением хлорида.
К раствору триметилсилилдиазометана в н-гексане (2,0 М, 29,8 мл) и раствору триэтиламина (16,6 мл) в тетрагидрофуране (60 мл) по каплям добавляют полученный ранее раствор хлорида в тетрагидрофуране (60 мл) и перемешивают в течение 1 часа при комнатной температуре. Реакционную смесь разводят этилацетатом, органический слой промывают водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Диазокетон получают путем удаления растворителя.
К раствору диазокетона (120 мл) и триэтиламина (7,5 мл) в этаноле добавляют ацетат серебра (5,0 г) при 60°С и перемешивают в течение 30 мин. После охлаждения реакционной смеси до комнатной температуры к ней добавляют этилацетат и воду и фильтруют через целит (торговое название). Органический слой, отделенный от фильтрата, промывают водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (8,6 г) с нижеприведенными физическими характеристиками получают путем очистки остатка, полученного после удаления растворителя, с помощью колоночной хроматографии на силикагеле (н-гексан:этилацетат, 4:1).
ТСХ: Rf 0,54 (н-гексан:этилацетат, 1:2).
1H-ЯМР: (CDCl3) δ 3,74, 3,77, 7,64, 7.78, 7,82.
Пример 2. Метил-1-(3-нитро-4-(трифторметил)фенил)циклопропанкарбоксилат
В атмосфере аргона соединение, полученное в примере 1 (8,4 г), и 1,2-дибромэтан (13,7 мл) растворяют в N-метилпирролидоне (150 мл). Добавляют 60% гидрид натрия (2,8 г) при охлаждении на льду и перемешивают в течение 1 часа при комнатной температуре. Реакционную смесь разводят водой и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (5,1 г) с нижеприведенными физическими характеристиками получают путем очистки остатка, полученного после удаления растворителя, с помощью колоночной хроматографии на силикагеле (н-гексан:этилацетат, 4:1).
ТСХ: Rf 0,56 (н-гексан:этилацетат, 1:2).
1Н-ЯМР: (CDCl3) δ 1,23, 1,78, 3,64, 7,68, 7,78, 7,88.
Пример 3. Метил-1-(3-амино-4-(трифторметил)фенил)циклопропанкарбоксилат
Водный раствор (22,5 мл-22,5 мл) соединения, полученного в примере 2 (5,1 г), и железо (3,9 г) в уксусной кислоте перемешивают при 60°С в течение 1 часа. Реакционную смесь разводят этилацетатом и фильтруют через целит (торговое название). Фильтрат промывают насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (3,9 г) с нижеприведенными физическими характеристиками получают путем перекристаллизации остатка, полученного после удаления растворителя, из смеси растворителей н-гексана и этилацетата.
ТСХ: Rf 0,55 (н-гексан:этилацетат:уксусная кислота, 1:2).
1Н-ЯМР: (CDCl3) δ 1,18, 1,59, 3,62, 4,13, 6,72, 6,75, 7,34.
Пример 4. (2-фторметил)метиламин
В атмосфере аргона муравьиную кислоту (6,1 мл) по каплям добавляют к уксусному ангидриду (15,5 мл) при 0°С, который перемешивают в течение 2 час при 50°С. После охлаждения до комнатной температуры реакционную смесь разводят тетрагидрофураном (THF, 10 мл). К полученному раствору добавляют раствор 2-фторанилина (5,56 г) в THF (20 мл) при комнатной температуре и смесь перемешивают в течение 1 часа при комнатной температуре. Реакционную смесь концентрируют. Полученный остаток затем растворяют в безводном THF (25 мл). В атмосфере аргона к раствору остатка в безводном THF (25 мл) добавляют комплекс борана с тетрагидрофураном (1 М раствор в THF, 125 мл) при 0°С и смесь перемешивают в течение 2 час при 50°С. После охлаждения реакционной смеси до комнатной температуры добавляют метанол (30 мл) и 4 н. раствор хлористого водорода в диоксане (10 мл) на ледяной бане и смесь перемешивают в течение 1 часа при 60 С. К концентрированной реакционной смеси добавляют 2 н. раствор гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Раствор фильтруют через целит (торговое название) и фильтрат концентрируют. К остатку добавляют смесь растворителей (гексан: этилацетат, 10:1) и фильтруют через силикагель. Названное соединение (6,45 г) с нижеприведенными физическими характеристиками получают путем концентрирования фильтрата.
Пример 5. (2S)-3-((2-фторфенил)(метил)амино)-1,2-пропандиол
В атмосфере аргона смесь соединения, полученного по примеру 4, (1,24 г), (R)-(+)-глицидол (1,11 г, Aldrich, 98% ее) и этанол (1 мл) перемешивают в течение 12 час при 50°С. Названное соединение с нижеприведенными физическими характеристиками получают путем концентрирования реакционной смеси. Полученное названное соединение применяют для следующей реакции без очистки.
ТСХ: Rf 0,40 (н-гексан:этилацетат, 1:1).
Пример 6. ((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метанол
К раствору соединения, полученного по примеру 5, в безводном диметилформамиде (DMF, 10 мл) добавляют t-бутоксид калия (1,68 г) на водяной бане и смесь перемешивают в течение 3 час при 80°С. Реакционную смесь добавляют к воде и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Раствор фильтруют через целит (торговое название) и фильтрат концентрируют. Названное соединение (1,55 г, 97,6% ее) с нижеприведенными физическими характеристиками получают путем очистки остатка с помощью колоночной хроматографии на силикагеле (гексан:этилацетат, 3:1).
ТСХ: Rf 0,35 (н-гексан:этилацетат, 2:1).
Оптическую чистоту названного соединения определяют с помощью жидкостной хроматографии высокого разрешения (HPLC). Колонка: CHIRALCEL OD (Daicel Chemical Industries, Ltd.) 0,46 см ⌀×25 см; скорость тока 1 мл/мин; растворитель гексан:2-пропанол 93:7; длина волны детекции 254 нм; время удержания 30,7 мин; температура 24°С.
Пример 7. ((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метил-4-метилбензолсульфонат
В атмосфере аргона к раствору соединения, полученного в примере 6 (3,06 г), в тетрагидрофуране (9 мл) добавляют триэтиламин (5 мл). К раствору добавляют раствор р-хлорида р-толуолсульфоновой кислоты (3,42 г) в тетрагидрофуране (9 мл) и N,N-диметиламинопиридин (209 мг) и смесь перемешивают в течение 4 час при комнатной температуре. После добавления воды реакционную смесь экстрагируют метил-t-бутиловым эфиром. Экстракт доводят до загустения путем добавления изопропилового спирта к остатку, полученному при концентрировании органического слоя. Названное соединение (5,12 г) с нижеприведенными физическими характеристиками получают путем промывки отфильтрованного твердого вещества изопропиловым спиртом и сушки.
ТСХ: Rf 0,81 (н-гексан:этилацетат, 1:1).
Пример 8. ((2S)-2-((4-бром-3,5-диметилфенокси)метил)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин
В атмосфере аргона к раствору 4-бром-3,5-диметилфенола (150 г) в безводном N,N-диметилацетамиде (1 л) последовательно добавляют карбонат калия (206 г) и соединение, полученное в примере 7 (249 г). Реакционную смесь перемешивают в течение 7 часов при 100°С. После охлаждения реакционной смеси до комнатной температуры к ней добавляют воду и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Остаток, полученный после удаления растворителя, оставляют кристаллизоваться из н-гексана. Названное соединение (244 г) с нижеприведенными физическими характеристиками получают путем фильтрации.
ТСХ: Rf 0,41 (н-гексан:этилацетат, 2:1).
1Н-ЯМР: (CDCl3) δ 2,31, 2,82, 3,14, 3,34, 4,13, 4,49-4,59, 6,53-6,63, 6,67-6,74, 6,74-6,83, 6,86.
Пример 9. 2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензойная кислота
В атмосфере аргона соединение, полученное в примере 8 (219 г), растворяют в безводном тетрагидрофуране (1,7 л) и перемешивают при -78°С. К раствору добавляют н-бутил литий (1,58 М раствор в н-гексане, 421 мл) и перемешивают в течение 1 часа. После продувания раствора углекислым газом раствор перемешивают в течение 2 часов при нагревании до 0°С. Остаток, полученный путем удаления растворителя, разводят 1 н. раствором гидроксида натрия, раствор промывают трет-бутилметиловым эфиром. К водной фазе добавляют 5 н. соляную кислоту при перемешивании для получения кристаллов. Названное соединение (183 г) с нижеприведенными физическими характеристиками получают путем фильтрации и сушки кристаллов.
TCX: Rf 0,25 (хлороформ:метанол, 9:1).
1Н-ЯМР: (СDСl3) δ 2,25, 2,82, 3,15, 3,34, 4,16, 4,47-4,62, 6,54-6,64, 6,67-6,84, 12,86.
Пример 10. 2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил хлорид
В атмосфере аргона соединение, полученное в примере 9 (0,97 г), растворяют в 1,2-диметоксиэтане (6 мл). К реакционной смеси добавляют оксалилхлорид (0,26 мл) и безводный N,N-диметилформамид (одну каплю) и перемешивают в течение 30 мин при 40°С. Реакционную смесь концентрируют для получения названного соединения.
Пример 11. Метил-1-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоксилат
К раствору соединения, полученного в примере 3 (1,0 г), в ацетонитриле (2,5 мл) и пиридине (1,2 мл) по каплям добавляют раствор соединения, полученного в примере 10, в ацетонитриле (2,5 мл) и перемешивают в течение ночи при 50°С. Реакционную смесь разводят этилацетатом и органический слой промывают 1 н. соляной кислотой, водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (0,50 г) с нижеприведенными физическими характеристиками получают путем очистки остатка, полученного после удаления растворителя, путем колоночной хроматографии на силикагеле (н-гексан:этилацетат, 4:1).
TCX: Rf 0,51 (н-гексан:этилацетат:уксусная кислота, 1:2).
1H-ЯМР: (CDCl3) δ 1,30, 1,68, 2,38, 2,92, 3,22, 3,39, 3,64, 4,10, 4,22, 4,62, 6,63, 6,82, 7,28, 7,50, 7,58, 8,38.
Пример 12. 1-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота
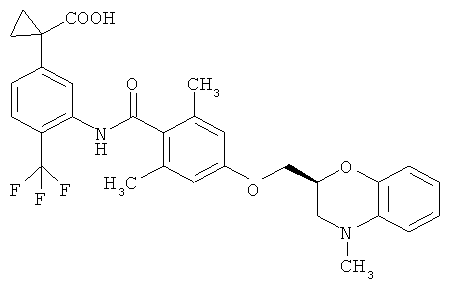
К смеси соединения, полученного в примере 11 (0,50 г), тетрагидрофурана (1 мл) и метанола (1 мл) добавляют 1 н. водный раствор гидроксида натрия (1 мл) и перемешивают в течение 2 часов при комнатной температуре. После нейтрализации реакционной смеси путем добавления 1 н. соляной кислоты (1 мл) к ней добавляют воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (0,41 г) согласно настоящему изобретению с нижеприведенными физическими характеристиками получают путем очистки остатка, полученного после удаления растворителя, путем колоночной хроматографии на силикагеле (метиленхлорид:этилацетат, 20:1).
ТСХ: Rf 0,63 (хлороформ: метанол, 10:1).
1Н-ЯМР: (CDCl3) δ 1,21, 1,52, 2,31, 2,83, 3,16, 3,37, 4,17, 4,55, 6,58, 6,75, 7,44, 7,68, 9,96, 12,54.
Пример 13. 4-бром-3-этилфенол
В атмосфере аргона к смеси 3-этилфенола (11,2 г), метиленхлорида (30 мл) и метанола (20 мл) добавляют тетра-н-бутиламмоний трибромид (24,9 г) и перемешивают в течение 1 часа при комнатной температуре. Реакционную смесь разводят этилацетатом и органический слой промывают 1 н. соляной кислотой, водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (11,2 г) с нижеприведенными физическими характеристиками получают путем удаления растворителя.
ТСХ: Rf 0,49 (н-гексан:этилацетат:уксусная кислота, 1:4).
1Н-ЯМР: (CDCl3) δ 1,22, 2,69, 4,92, 6,57, 6,74, 7,37.
Пример 14. (2S)-2-(4-бром-3-этилфенокси)метил-4-метил-3,4-дигидро-2Н-1,4-бензоксазин
В атмосфере аргона к смеси соединения, полученного в примере 13 (11,2 г), соединения, полученного в примере 7 (16,9 г), и N,N-диметилформамида (50 мл) добавляют хлористый цезий (18,2 г) и перемешивают в течение ночи при 70°С. Реакционную смесь разводят этилацетатом и органический слой промывают 1 н. соляной кислотой, водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (17,0 г) с нижеприведенными физическими характеристиками получают путем очистки остатка, полученного после удаления растворителя, путем колоночной хроматографии на силикагеле (н-гексан:этилацетат, 6:1).
ТСХ: Rf 0,49 (н-гексан:этилацетат:уксусная кислота, 1:6).
1Н-ЯМР: (СDСl3) δ 1,22, 2,69, 2,91, 3,23, 3,38, 4,09, 4,18, 4,61, 6,63, 6,82, 7,39.
Пример 15. 2-этил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензойная кислота
В атмосфере аргона к смеси соединения, полученного в примере 14 (17,0 г), и тетрагидрофурана (113 мл) добавляют раствор н-бутиллития в н-гексане (1,6 М, 32,3 мл) при -78°С и перемешивают в течение 1 часа. Через реакционную смесь продувают углекислый газ при -78°С и реакционную смесь перемешивают в течение 30 мин. Реакционную смесь разводят этилацетатом и органический слой промывают 1 н. соляной кислотой, водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (9,5 г) с нижеприведенными физическими характеристиками получают путем перекристаллизации остатка, полученного при удалении растворителя, из смеси н-гексана с этилацетатом.
ТСХ: Rf 0,63 (хлороформ:метанол, 10:1).
1Н-ЯМР: (DMSO-D6) δ 1,16, 2,81, 2,92, 3,17, 3,37, 4,22, 4,57, 6,59, 6,70, 6,85, 7,80.
Пример 16. Метил-1-(3-((2-этил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоксилат
Названное соединение (700 мг) с нижеприведенными физическими характеристиками получают по способу, сходному с описанным в примерах 10 и 11, с применением соединения, полученного в примере 15 (971 мг), и соединения, полученного в примере 2 (1000 мг).
ТСХ: Rf 0,47 (н-гексан:этилацетат:уксусная кислота, 1:2).
1Н-ЯМР: (СDСl3) δ 1,23, 1,64, 2,90, 3,24, 3,40, 3,63, 4,18, 4,24, 4,63, 6,68, 6,84, 7,23, 7,42, 7,58, 7,76, 8,37.
Пример 17. 1-(3-((2-этил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота
Соединение согласно настоящему изобретению (366 мг) с нижеприведенными физическими характеристиками получают из соединения, полученного в примере 16 (700 мг), по способу, сходному с описанным в примере 12.
ТСХ: Rf 0,63 (хлороформ:метанол, 1:10).
1Н-ЯМР: (CDCl3) δ 1,16, 1,17, 1,50, 2,77, 2,84, 3,18, 3,38, 4,23, 4,58, 6,60. 6.71, 6,92, 7,47, 7,69, 9,88, 12,56.
Пример 18. 2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензойная кислота
В атмосфере аргона соединение, полученное в примере 9 (100 г), растворяют в безводном тетрагидрофуране (1 л) и перемешивают при -20°С. К раствору добавляют метиллитий (3М раствор в диэтоксиметане, 255 мл). Реакционную смесь нагревают до 40°С и перемешивают в течение 1 часа и затем охлаждают до 0°С. К смеси по каплям добавляют йодистый метил (57 мл), затем нагревают ее до комнатной температуры и перемешивают в течение 30 мин. К смеси добавляют 2 н. водный раствор гидроксида натрия и растворитель удаляют с получением остатка. К остатку добавляют 5 н. соляную кислоту (270 мл) и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Остаток, полученный после удаления растворителя, перекристаллизуют из н-гексана. Названное соединение (80 г) с нижеприведенными физическими характеристиками получают путем фильтрации.
ТСХ: Rf 0,66 (хлороформ:метанол, 5:1).
1Н-ЯМР: (CDCl3) δ 1,13, 2,25, 2,57, 2,82, 3,15, 3,34, 4,16, 4,47-4,62, 6,52-6,64, 6,66-6,74, 6,74-6,83, 12,87.
Пример 19. 2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил хлорид
В атмосфере аргона соединение, полученное в примере 18 (79 г), растворяют в 1,2-диметоксиэтане (500 мл). К реакционной смеси добавляют безводный N,N-диметилформамид (3 капли) и оксалилхлорид (24 мл) и перемешивают при 40°С в течение часа. Реакционную смесь концентрируют для получения названного соединения.
Пример 20. Метил-1-(3-((2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоксилат
К раствору соединения, полученного в примере 3 (60 г), в ацетонитриле (400 мл) добавляют пиридин (94 мл) и затем раствор соединения, полученного в примере 19, в ацетонитриле (200 мл). Реакционную смесь перемешивают при 40°С в течение ночи. К реакционной смеси добавляют метанол (100 мл) и перемешивают в течение 30 мин. Смесь экстрагируют смесью растворителей этилацетата и н-гексана и органический слой промывают 1 н. соляной кислотой, насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором хлористого натрия. После сушки над безводным сульфатом магния названное соединение (87 г) с нижеприведенными физическими характеристиками получают путем очистки остатка, полученного после удаления растворителя, путем колоночной хроматографии на силикагеле (н-гексан:этилацетат, 3:1).
ТСХ: Rf 0,40 (н-гексан:этилацетат, 3:2).
1Н-ЯМР: (CDCl3) δ 1,26, 1,29-1,34, 1,66-1,73, 2,37, 2,70, 2,91, 3,26, 3,40, 3,67, 4,12, 4,25, 4,59-4,71, 6,63-6,75, 6,81-6,93, 7,25-7,31, 7,53, 7,58, 8,40.
Пример 21. 1-(3-((2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота
К смеси соединения, полученного в примере 20 (87 г), и метанола (870 мл) добавляют 1 н. водный раствор гидроксида натрия (150 мл) и перемешивают при 60°С в течение 6 час. Растворитель удаляют и остаток разводят водой. После промывки метил-трет-бутилметиловым эфиром раствор нейтрализуют путем добавления 5 н. соляной кислоты. Раствор экстрагируют этилацетатом и органический слой промывают водой и насыщенным раствором хлористого натрия и затем сушат над безводным сульфатом магния. Соединение согласно настоящему изобретению (79,6 г) с нижеприведенными физическими характеристиками получают путем перекристаллизации остатка, полученного после удаления растворителя, из смеси метанола с водой.
ТСХ: Rf 0,41 (хлороформ: метанол, 9:1).
1Н-ЯМР: (DMSO-d6) δ 1,13-1,25, 1,49-1,57, 2,33, 2,63, 2,84, 3,17, 3,37, 4,19, 4,51-4,62, 6,55-6,65, 6,68-6,86, 7,40-7,52, 7,69, 9,99, 12,59.
Пример 22. Метил(3-амино-4-(трифторметил)фенил)ацетат
Водный раствор (9 мл - 1 мл) соединения, полученного в примере 1 (1,9 г), и железо (1,6 г) в уксусной кислоте перемешивают при 70°С в течение 2 час. Реакционную смесь разводят этилацетатом и фильтруют через целит (торговое название). Фильтрат промывают насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (1,3 г) с нижеприведенными физическими характеристиками получают путем очистки остатка, полученного после удаления растворителя, путем колоночной хроматографии на силикагеле (н-гексан:этилацетат, 5:1).
ТСХ: Rf 0,44 (н-гексан:этилацетат:уксусная кислота, 1:1).
1Н-ЯМР: (СDСl3) δ 3,55, 3,70, 4,16, 6,69, 7,37.
Пример 23. Метил(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)ацетат
Соединение, полученное в примере 22 (0,57 г), растворяют в ацетонитриле (2,5 мл) и пиридине (0,37 мл), по каплям добавляют раствор соединения, полученного в примере 10 (0,75 г), в ацетонитриле (2,5 мл) и затем перемешивают в течение ночи при 50°С. Реакционную смесь разводят этилацетатом и органический слой промывают 1 н. соляной кислотой, водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (0,35 г) с нижеприведенными физическими характеристиками получают путем очистки остатка, полученного после удаления растворителя, путем колоночной хроматографии на силикагеле (н-гексан:этилацетат, 4:1).
ТСХ: Rf 0,54 (н-гексан:этилацетат:уксусная кислота, 1:1).
1Н-ЯМР: (CDCl3) δ 2,39, 2,91, 2,92, 3,24, 3,39, 3,77, 4,17, 4,22, 4,63, 6,68, 6,83, 7,21, 7,53, 7,60, 8,38.
Пример 24. (3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)уксусная кислота.
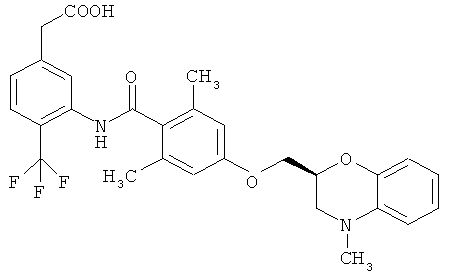
К смеси соединения, полученного в примере 23 (0,35 г), тетрагидрофурана (2 мл) и метанола (2 мл) добавляют 1 н. водный раствор гидроксида натрия (2 мл) и перемешивают в течение 2 часов при комнатной температуре. После нейтрализации реакционной смеси путем добавления 1 н. соляной кислоты (2 мл) добавляют воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Соединение согласно настоящему изобретению (0,28 г) с нижеприведенными физическими характеристиками получают путем перекристаллизации остатка, полученного после удаления растворителя, из смеси н-гексана с этилацетатом.
TCX: Rf 0,49 (хлороформ:метанол, 9:1).
1Н-ЯМР: (DMSO-D6) δ 2,31, 2,83, 3,16, 3,36, 3,74, 4,17, 4,56, 6,59, 6,75, 7,38, 7,46, 7,70, 9,96.
Пример 25. Метил(3-((2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)ацетат
Названное соединение (40 г) с нижеприведенными физическими характеристиками получают по способу, описанному в примерах 19 и 20, с применением соединения, полученного в примере 19 (39 г), и соединения, полученного в примере 22 (36 г).
TCX: Rf 0,64 (н-гексан:этилацетат:уксусная кислота, 1:2).
1Н-ЯМР: (СDСl3) δ 1,24, 2,38. 2,67, 2,92, 3.24, 3,41, 3,78, 4,12, 4,23, 4,62, 6,70, 6,83, 7,22, 7,54, 7,60, 8,38.
Пример 26. (3-((2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)уксусная кислота,

Названное соединение (31 г) с нижеприведенными физическими характеристиками получают по тому же способу, как в примере 21, с применением соединения, полученного в примере 25 (40 г).
TCX: Rf 0,39 (хлороформ:метанол, 9:1).
1Н-ЯМР: (DMSO-D6) δ 1,19, 2,33, 2,63, 2,83, 3,17, 3,75, 4,19, 4,56, 6,60, 6,75, 7,38, 7,45, 7,70, 9,98.
Пример 27. Метил гидрокси(3-((2,-6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)ацетат
В атмосфере аргона к смеси соединения, полученного в примере 23 (205 мг), и тетрагидрофурана (2 мл) добавляют раствор бис-(триметилсилил)амида натрия в тетрагидрофуране (1,0 М, 1,1 мл) при -78°С и перемешивают в течение часа при той же температуре. К реакционной смеси добавляют раствор (2S,8AR)-(-)-(камфорсульфонил)оксазиридина (250 мг) в тетрагидрофуране (2 мл) при -78°С и перемешивают при 0°С в течение 30 мин. Реакционную смесь разводят этилацетатом.
Органический слой промывают 1 н. соляной кислотой, водой и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Названное соединение (180 мг) с нижеприведенными физическими характеристиками получают путем очистки остатка, полученного после удаления растворителя, путем колоночной хроматографии на силикагеле (н-гексан:этилацетат, 1:1).
ТСХ: Rf 0,37 (н-гексан:этилацетат, 1:1).
1Н-ЯМР: (СDСl3) δ 2,39, 2.91, 3,23, 3,39, 3,61, 3,82, 4,11, 4,23. 4,62, 5,30, 6,63, 6,69, 6,82, 7,38, 7,56, 7,63, 8,55.
Пример 28. Гидрокси(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)уксусная кислота
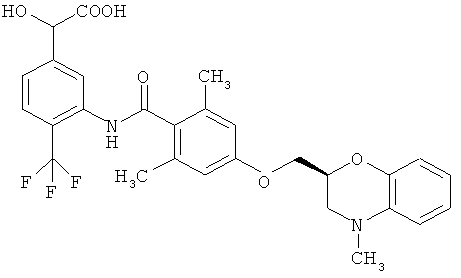
К смеси соединения, полученного в примере 27 (180 мг), тетрагидрофурана (2 мл) и метанола (2 мл) добавляют 1 н. водный раствор гидроксида натрия (2 мл) и перемешивают в течение 10 мин при комнатной температуре. Реакционную смесь нейтрализуют путем добавления 1 н. соляной кислоты (2 мл), добавляют к ней воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Соединение согласно настоящему изобретению (90 мг) с нижеприведенными физическими характеристиками получают путем удаления растворителя.
ТСХ: Rf 0,50 (хлороформ:метанол:вода, 40:20:1).
1Н-ЯМР: (DMSO-D6) δ 2,32, 2,83, 3,16, 3,36, 4,17, 4,55, 5,17, 6,58, 6,77, 7,52, 7,61, 7,75, 9.99.
Пример 29. Метил-2-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)пропионат
В атмосфере аргона к смеси соединения, полученного в примере 23 (330 мг), и тетрагидрофурана (3 мл) добавляют раствор диизопропиламида лития в смеси гептан-тетрагидрофуран-этилбензол (2,0 М, 0,67 мл) при -78°С и перемешивают при той же температуре в течение 2 часов. К реакционной смеси добавляют йодистый метил (259 мг) при -78°С и перемешивают при -20°С в течение 2 часов. Реакционную смесь разводят этилацетатом. Органический слой промывают 1 н. соляной кислотой, водой и насыщенным раствором хлористого натрия, затем сушат над безводным сульфатом магния. Названное соединение (170 мг) с нижеприведенными физическими характеристиками получают путем очистки остатка, полученного после удаления растворителя, путем колоночной хроматографии на силикагеле (н-гексан:этилацетат, 3:1).
ТСХ: Rf 0,52 (н-гексан:этилацетат:уксусная кислота, 1:2).
1Н-ЯМР: (СDСl3) δ 1,60, 2,39, 2,92, 3,24, 3,39, 3,62, 3,83, 4,13, 4,22, 4,62, 6,62, 6,70, 6,83, 7,22, 7,53, 7,59, 8,38.
Пример 30. Метил 2-гидрокси-2-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)пропионат
Названное соединение (600 мг) с нижеприведенными физическими характеристиками получают по тому же способу, как описано в примере 27, с применением соединения, полученного в примере 29 (800 мг).
ТСХ: Rf 0,47 (н-гексан:этилацетат:уксусная кислота, 1:1).
1Н-ЯМР: (CDCl3) δ 1,84, 2,38, 2,91, 3,25, 3,39, 3,86, 3,90, 4,13, 4,23, 4,63, 6,66, 6,71, 6,86, 7,51, 7,63, 8,64.
Пример 31. 2-гидрокси-2-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)пропионовая кислота

Названное соединение (380 мг) с нижеприведенными физическими характеристиками получают по способу, описанному в примере 28, с применением соединения, полученного в примере 30 (600 мг).
ТСХ: Rf 0,29 (хлороформ:метанол, 5:1).
1Н-ЯМР: (DMSO-D6) δ 1,63, 2,32, 2,83, 3,16, 3,38, 4,18, 4,57, 6,60, 6,77, 7,61, 7,71, 7,74. 9,99.
Нижеприведенные биологические примеры показывают, что соединения формулы (I) согласно настоящему изобретению обладают значительной антагонистической активностью по отношению к DP рецепторам, не проявляют сильного ингибирования ферментов, участвующих в метаболизме лекарства, и обладают высокой избирательностью относительно других DP рецепторов.
Биологический пример 1. Измерение антагонистической активности по отношению к DP рецепторам с применением человеческой плазмы, обогащенной тромбоцитами (PRP)
Кровь отбирают из локтевой вены здорового взрослого, давшего письменное согласие, основанное на информации, с применением шприца, заполненного 3,8% раствором цитрата натрия примерно на одну девятую предполагаемого объема. Собранную кровь подвергают разделению путем центрифугирования при 100 g при комнатной температуре в течение 15 мин для получения PRP в верхнем слое. К полученному PRP добавляют ЭДТА до конечной концентрации примерно 10 мМ. PRP подвергают разделению центрифугированием при 1500 g при комнатной температуре в течение 15 мин для получения супернатанта обедненной тромбоцитами плазмы (РРР). После суспендирования осадка тромбоцитов суспензию разводят РРР, так чтобы довести плотность тромбоцитов до 5,0×105 клеток/мкл. К полученной суспензии тромбоцитов добавляют 3-изобутил-1-метилксантин и антагонист простаноидного ЕР3 рецептора, так чтобы их конечные концентрации составляли 8 мМ и 1 мкМ, соответственно.
297 мкл полученной PRP помещают в каждую пробирку и затем инкубируют при 37°С в течение 5 мин. После добавления 1,5 мкл ДМСО или разных концентраций соединения согласно настоящему изобретению пробирки инкубируют 10 мин при 37°С. К суспензии добавляют 1,5 мкл ДМСО или PGD2 (конечная концентрация 3 мкМ) для инициации реакции. Через 15 мин инкубации при 37°С добавляют 300 мкМ охлажденной на льду 10% трихлоруксусной кислоты (ТХУ) для остановки реакции. Образцы, обработанные ТХУ, подвергают разделению путем центрифугирования при 15000 g в течение 3 мин при 4°С. Концентрацию цАМФ (сАМР) в полученном таким образом супернатанте измеряют с помощью ферментативного метода с применением системы сАМР EIA (Amersham pic). 300 мкл супернатанта, полученного, как описано выше, смешивают с 600 мкл раствора 0,5 М три-н-октиламина в хлороформе. После экстракции ТХУ в органический слой содержание цАМФ в водном слое образца измеряют по способу, приложенному к набору для измерения цАМФ.
Антагонистическая активность соединения согласно настоящему изобретению по отношению к DP рецепторам представлена в виде значений IC50 (концентрации соединения согласно настоящему изобретению, необходимой для ингибирования на 50% продукции цАМФ в отсутствие соединения согласно настоящему изобретению), рассчитанных из соотношения ингибирования относительно продукции цАМФ, увеличенной при стимуляции 3 мкМ PGD2.
Значения IC50 измерены для
(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)фенил)уксусной кислоты (сокращенно здесь и далее сравнительное соединение 1), которое является соединением, описанным в примере 13 (10) WO 2005/028455 (патентный документ 1),
(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-метилфенил)уксусной кислоты (сокращенно здесь и далее сравнительное соединение 2), которое является соединением, описанным в примере 13 (19) патентного документа 1,
(4-хлор-3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)фенил)уксусной кислоты (сокращенно здесь и далее сравнительное соединение 3), которое является соединением, описанным в примере 13 (2) патентного документа 1, и
1-(4-хлор-3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)фенил)циклопропанкарбоновой кислоты (сокращенно здесь и далее сравнительное соединение 4), которое является соединением, описанным в примере 38 патентного документа 1, по способу, описанному выше, и показано, что значения IC50 для сравнительных соединений 1, 3 и 4 составляют 0,021 мкМ, 0,004 мкМ и 0,0065 мкМ, соответственно.
Таким образом обнаружено, что соединение вышеупомянутой формулы (А), имеющее метильную группу (сравнительное соединение 2) или атом хлора (сравнительное соединение 4) в положении 4 фенилуксусной кислоты, обладает повышенной активностью связывания с DP рецептором по сравнению с незамещенным соединением (сравнительное соединение 1).
С другой стороны обнаружено, что соединение формулы (I) согласно настоящему изобретению обладает фармацевтически значимой антагонистической активностью по отношению к DP рецептору. Например, значения IC50 для соединений, описанных в примерах 12, 21 и 24, составляют 0,0071 мкМ, 0,0029 мкМ и 0,0089 мкМ, соответственно.
Биологический пример 2. Измерение ингибирующей активности по отношению к ферменту, участвующему в метаболизме лекарства (ингибирующее действие на человеческий CYP3A4)
Экспериментальный подход
Раствор тестируемого соединения с концентрацией, в 500 раз превышающей оцениваемую концентрацию в этаноле, или этанол разводят в 125 раз водой. К 50 мкл раствора тестируемого соединения или раствора этанола (контроль) добавляют субстрат CYP3A4 7-бензилоксихинолин (7-BQ), (40 мкМ), раствор хлористого магния (5 мМ) и 100 мкл 200 мМ калий-фосфатного буфера (рН 7,4), содержащего микросомальную систему экспрессии CYP3A4 (BD Gemest, 0,25 мг/мл), и инкубируют при 37°С в течение 10 мин, затем добавляют 50 мкл восстановленного никотинамидадениндинуклеотидфосфата (НАДФН, конечная концентрация 1 мМ) и инкубируют при 37°С в течение 30 мин. Сразу после добавления НАДФН и после инкубации измеряют интенсивность флуоресценции 7-гидроксихинолина, являющегося метаболитом субстрата (длина волны возбуждения 409 нм, длина волны испускания 530 нм). Степень ингибирования относительно контроля рассчитывают по нижеприведенному уравнению
Степень ингибирования (%)=[1-{(интенсивность флуоресценции в присутствии тестируемого соединения после инкубации - интенсивность флуоресценции в присутствии тестируемого соединения сразу после добавления НАДФН)/(интенсивность флуоресценции контроля после инкубации - интенсивность флуоресценции контроля сразу после добавления НАДФН)}]×100
IС50 рассчитывают по следующему уравнению
IС50 (мкМ)=(50-(DxA-CxB)/(D-C))/((B-A)/(D-C))
А - наибольшая степень ингибирования (%), которая меньше 50%.
В - наименьшая степень ингибирования (%), которая больше 50%.
С - концентрация (мкМ) тестируемого соединения, когда степень ингибирования равна А.
D - концентрация (мкМ) тестируемого соединения, когда степень ингибирования равна В.
Значения IС50, измеренные для сравнительных соединений 1, 2, 3 и 4 по вышеописанному способу, составляют 30 мкМ или более, меньше 3 мкМ, 19,7 мкМ и 30 мкМ или больше, соответственно.
Таким образом обнаружено, что соединения вышеупомянутой формулы (А), имеющие метильную группу в положении 4 фенилуксусной кислоты (сравнительное соединение 2), проявляют весьма сильное ингибирование CYP3A4, который является ферментом, участвующим в метаболизме лекарства, по сравнению с незамещенным соединением. Обнаружено также, что при помещении атома хлора в положение 4 фенилуксусной кислоты соединения вышеупомянутой формулы (А) соединение не оказывает действия на активность CYP3A4.
Измерение ингибирующего действия соединения формулы (I) согласно настоящему изобретению по вышеописанному способу показывает, что его ингибирующее действие на CYP3A4 не является сильным. Например, величины IC50 для соединений, описанных в примерах 12, 21 и 24, составляют 30 мкМ или выше, 30 мкМ или выше и 8,4 мкМ, соответственно.
Биологический пример 3. Эксперименты по связыванию рецептора с применением клеток, экспрессирующих рецепторы простаноидного подтипа
СНО клетки, экспрессирующие рецепторы простаноидного подтипа (человеческий ЕР2), получают по способу Sugimoto et al. (J.Biol.Chem. 267, 6463-6466 (1992)) для получения мембранного препарата.
Реакционный раствор (200 мкл), содержащий препарат мембранной фракции (0,5 мг/мл) и 3H-PGЕ2, инкубируют при комнатной температуре в течение 1 часа. Реакцию останавливают с помощью охлажденного на льду буфера (3 мл), связанный 3H-PGE2, задерживают на стеклянном фильтре (GF/B) путем фильтрации с отсосом при пониженном давлении и связанную радиоактивность измеряют с помощью жидкостного сцинтиллятора.
Значения Kd рассчитывают из графиков Скетчарда (Ann.N.Y.Acad.Sci. 51, 660 (1949)).
Неспецифическое связывание определяют по количеству метки, связанной в присутствии избыточного количества (10 мкМ) немеченого PGE2. Измерения ингибирования связывания 3H-PGE2 соединением согласно настоящему изобретению проводят путем добавления 3H-PGE2 (2,5 нМ) и соединения согласно настоящему изобретению в различных концентрациях. Заметим, что все реакции проводят в следующем буферном растворе.
Буферный раствор: фосфат калия (10 мМ, рН 6,0), ЭДТА (1 мМ), MgCl2 (10 мМ), NaCl (0,1 M).
Константу диссоциации (Ki (мкМ)) для каждого соединения рассчитывают по следующему уравнению.
Ki=IC50/(1+([C]/Kd)
IС50 - концентрация соединения согласно настоящему изобретению, необходимая для 50%-ного ингибирования специфического связывания 3H-PGE2,
С - концентрация 3H-PGE2,
Kd - константа диссоциации 3H-РGЕ2.
Значения Ki для сравнительных соединений 1, 3 и 4, измеренные по вышеописанному способу, составляют 0,0936 мкМ, 0,0168 мкМ и 0,0018 мкМ, соответственно.
Таким образом, показано, что когда соединения вышеупомянутой формулы (А) имеют атом водорода или хлора в положении 4 фенилуксусной кислоты, их сродство связывания с ЕР2 рецепторами является очень сильным.
С другой стороны, показано, что соединение вышеупомянутой формулы (I) не обладает сильным сродством связывания с ЕP2 рецепторами. Например, значения Ki для соединения, описанного в примере 12, составляет 0,142 мкМ.
Соединения, описанные в примере 12, являются соединениями формулы (А) из патентного документа 1, в которых
R2A представляет собой трифторметильную группу и замещены по положению 4 фенилуксусной кислоты, и
R12A и Rl3A, вместе взятые, представляют собой при необходимости окисленную С2-5 алкиленовую группу.
Сравнительное соединение 4 является соединением формулы (А) из патентного документа 1, в котором
R2A представляет собой атом хлора, и замещено по положению 4 фенилуксусной кислоты, и
R12A и R13A, вместе взятые, представляют собой при необходимости окисленную С2-5 алкиленовую группу.
Таким образом, вышеприведенные результаты показывают, что среди соединений формулы (А) только те соединения, в которых R2A представляет собой трифторметильную группу и замещены по положению 4 фенилуксусной кислоты, и R12A и R13A, вместе взятые, представляют собой при необходимости окисленную С2-5 алкиленовую группу, могут диссоциировать из комплекса с EP2 рецептором (обладают меньшим сродством связывания).
Пример состава 1
Следующие компоненты смешивают с помощью обычных способов и формуют для получения 10000 таблеток, где каждая содержит 10 мг активного ингредиента.
1-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота, 100 г;
карбоксиметилцеллюлоза кальция (дезинтегратор), 20 г;
стеарат магния (лубрикант), 10 г;
микрокристаллическая целлюлоза, 870 г.
Пример состава 2
После смешивания следующих компонентов по известным способам смесь фильтруют через фильтр для удаления пыли и помещают в ампулы порциями по 5 мл. Ампулы подвергают термической стерилизации путем автоклавирования с получением 10000 ампул, где каждая содержит 20 мг активного ингредиента.
1-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновая кислота, 200 г;
маннит, 20 г;
дистиллированная вода, 50 л.
Промышленное применение
Поскольку соединения формулы (I) согласно настоящему изобретению связываются с DP рецепторами и являются их антагонистами, считается, что соединения полезны для профилактики и/или лечения заболеваний, опосредованных DP рецепторами, какими являются аллергические заболевания, системный мастоцитоз, нарушения, сопровождающиеся системной активацией тучных клеток, анафилактический шок, бронхоспазм, крапивница, экзема, прыщи, аллергический бронхиальный пульмонарный аспергиллоз, синусит, мигрень, полип носа, анафилактический васкулит, эозинофильный синдром, контактный дерматит, заболевания, сопровождающиеся зудом, заболевания, вызванные вторично в результате поведения, сопровождающего зуд, воспаление, хронические обструктивные болезни легких, ишемическое реперфузионное нарушение, цереброваскулярная катастрофа, аутоиммунное заболевание, травматическое повреждение мозга, гепатопатия, отторжение трансплантата, ревматоидный артрит, плеврит, остеоартрит, болезнь Крона, язвенный колит, синдром раздраженного кишечника, интерстициальный цистит, мышечная дистрофия, полимиозит, рак, лейкоз, вирусные инфекции или рассеянный склероз. Дополнительно считается, что соединения имеют отношение к нарушениям сна или агрегации тромбоцитов и могут быть полезны против соответствующих заболеваний. Дополнительно, поскольку ингибирующее действие соединения формулы (I) согласно настоящему изобретению на ферменты, участвующие в метаболизме лекарства, не является сильным и соединения обладают высокой избирательностью по отношению к DP рецепторам, соединения могут применяться в качестве безопасных лекарств.
Изобретение относится к соединениям формулы (I-а), фармацевтически приемлемым солям, N-оксидам, сольватам и пролекарствам, и фармацевтической композиции на их основе. Соединения обладают свойствами антагониста DP рецептора и могут быть использованы для лечения заболеваний, опосредованных его активностью, такие как аллергический ринит, атопический дерматит, бронхиальная астма и пищевая аллергия. В общей формуле (I-а)
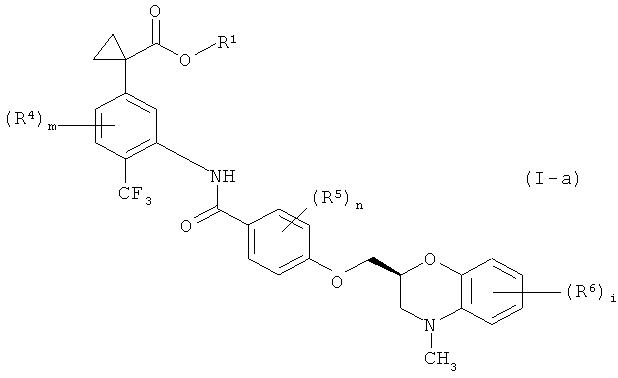
R1 представляет собой атом водорода или С 1-4 алкильную группу, каждый R4, R5 и R6 независимо представляет собой метил или этил,  показывает, что заместитель выступает из плоскости листа, m представляет собой О, n представляет собой целое число от 1 до 2 и i представляет собой 0, при условии, что когда n равно 2, R5 могут быть одинаковыми или разными. 3 н. и 3 з.п. ф-лы, 3 сх., 31 пр.
показывает, что заместитель выступает из плоскости листа, m представляет собой О, n представляет собой целое число от 1 до 2 и i представляет собой 0, при условии, что когда n равно 2, R5 могут быть одинаковыми или разными. 3 н. и 3 з.п. ф-лы, 3 сх., 31 пр.
1. Соединение формулы (I-a)
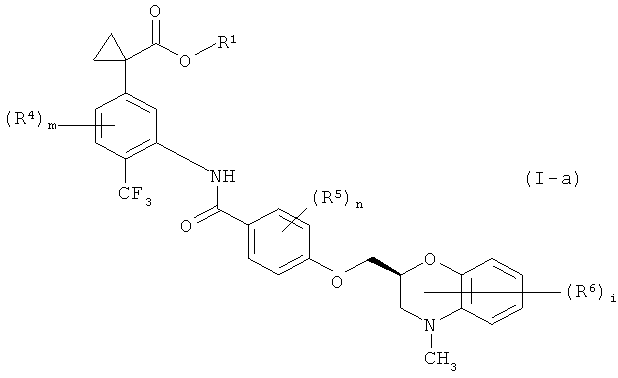
где R1 представляет собой атом водорода или С1-4 алкильную группу,
каждый R4, R5 и R6 независимо представляет собой метил или этил,
 показывает, что заместитель выступает из плоскости листа, m представляет собой О,
показывает, что заместитель выступает из плоскости листа, m представляет собой О,
n представляет собой целое число от 1 до 2 и
i представляет собой 0, при условии, что когда n равно 2, R5 могут быть одинаковыми или разными,
или его фармацевтически приемлемая соль, или N-оксид, или сольват, или пролекарство.
2. Соединение, выбранное из группы, состоящей из
(1) 1-(3-((2,6-диметил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновой кислоты,
(2) 1-(3-((2-этил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновой кислоты,
(3) 1-(3-((2-этил-6-метил-4-(((2S)-4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метокси)бензоил)амино)-4-(трифторметил)фенил)циклопропанкарбоновой кислоты,
или их фармацевтически приемлемой соли, или N-оксида, или сольвата, или пролекарства.
3. Фармацевтическая композиция, обладающая антагонистической активностью по отношению к DP рецептору, включающая в качестве активного ингредиента соединение формулы (I-а) по п.1, или соединение, выбранное из группы по п.2, или его фармацевтически приемлемую соль, или N-оксид, или сольват, или пролекарство.
4. Фармацевтическая композиция по п.3 для профилактики и/или лечения заболевания, опосредованного DP рецепторами.
5. Фармацевтическая композиция по п.4, где заболевание, опосредованное DP рецепторами, представляет собой аллергическое заболевание.
6. Фармацевтическая композиция по п.5, где аллергическое заболевание представляет собой аллергический ринит, аллергический конъюнктивит, атопический дерматит, бронхиальную астму или пищевую аллергию.
| Способ получения медицинских изделий из подвулканизованного натурального латекса | 1988 |
|
SU1666473A1 |
| ЕР 1486491 А1, 15.12.2004 | |||
| WO 200307840 А1, 25.09.2003 | |||
| Центробежнолитейная машина для отливки труб | 1979 |
|
SU869949A1 |
| ПРОИЗВОДНОЕ КАРБОНОВОЙ КИСЛОТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ АКТИВАЦИЕЙ DP-РЕЦЕПТОРА, ПРИМЕНЕНИЕ ПРОИЗВОДНОГО КАРБОНОВОЙ КИСЛОТЫ ДЛЯ ПРОИЗВОДСТВА ТАКОГО СРЕДСТВА, СПОСОБ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ АКТИВАЦИЕЙ DP-РЕЦЕПТОРОВ | 2003 |
|
RU2329256C2 |
Авторы
Даты
2012-12-27—Публикация
2008-08-11—Подача