Изобретение относится к ветеринарной медицине, в частности к получению препаратов, предназначенных для повышения неспецифической резистентности, профилактики и терапии нарушений обмена веществ у животных.
Известен способ получения препарата «Гемовит-меян», обладающего противоанемическим и ростостимулирующими свойствами (Авт. Ю.М.Бабич и др. Патент на изобретение РФ 2252020 от 05.02.2005 г.). Данный способ предусматривает смешивание минеральных компонентов (железа, марганца, цинка, меди, кобальта, селена, йода) с органическим лигандом - тринатриевой солью метионинянтарной кислоты. Недостатком этого способа является то, что полученный препарат применяется перорально, и всасывание его компонентов в желудочно-кишечном тракте животных невысокое.
Существует способ получения препарата «Асидивит», выпускаемого фирмой «Агроветзащита» (Наставление по применению препарата «Асидивит»). Этот препарат включает в свой состав антисептический стимулятор Дорогова фракция-2 (АСД Ф-2), янтарную кислоту, витамины А и Е. Препарат «Асидивит» применяют в виде внутримышечных инъекций. Однако ростостимулирующее действие данного препарата слабо выражено, так как он не оказывает стимулирующего влияния на азотистый обмен (обмен белков и аминокислот), в нем содержатся только два витамина - А и Е, нет минеральных компонентов.
В качестве прототипа выбран способ получения комплексного препарата «Янтарный биостимулятор» для повышения резистентности организма животных (Авт. А.Ф.Лебедев и др. Патент на изобретение РФ 2303979 от 23.05.2005), который предусматривает смешивание (мас.%) янтарной кислоты (1), тканевого препарата АСД Ф-2, новокаина (0,25) и дистиллированной воды (остальное) с добавлением pH полученной смеси до 6,9-7,0 путем добавления 10% раствора едкого натра и последующего автоклавирования в режиме 1,0-1,1 атм в течение 20-30 мин.
Недостатком способа-прототипа является то, что полученный препарат не оказывает выраженного стимулирующего действия на обмен веществ, в частности на обмен витаминов, минеральный и белково-аминокислотный обмены, а также не обладает антиоксидантными свойствами.
Технической задачей изобретения является разработка нового способа получения препарата, оказывающего комплексное стимулирующее влияние на неспецифическую резистентность организма, основные обмены веществ и обладающего антиоксидантными свойствами.
Решение технической задачи достигается тем, что с целью получения препарата для стимуляции неспецифической резистентности и обмена веществ у животных, смешивают янтарную кислоту, тканевый препарат АСДФ-2 (антисептический стимулятор Дорогова фракция-2), нуклеинат натрия и отходы биологической промышленности, полученные после культивирования перепелиных фибробластов на первичной культуральной среде, включающей синтетическую среду MEM (минимальная среда Игла), синтетическую среду 199 и сыворотку крови крупного рогатого скота, в следующем соотношении компонентов, г/л: янтарная кислота - 6-7; АСД Ф-2 - 30-35; нуклеинат натрия - 20-25; отходы биологической промышленности, полученные после культивирования перепелиных фибробластов, - до 1 л. При этом янтарную кислоту и нуклеинат натрия предварительно подвергают ультрафиолетовому облучению.
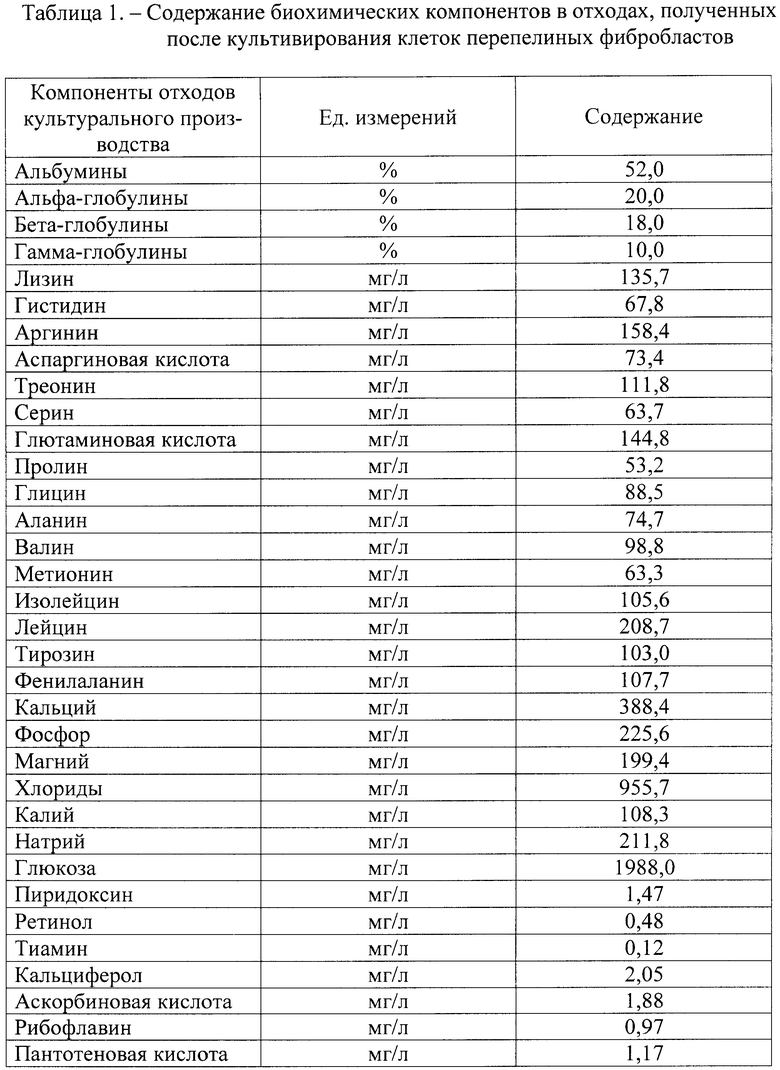
Включенные в состав препарата отходы биологической промышленности представляют собой субстрат, который получают после культивирования клеток, в частности перепелиных фибробластов, в технологических условиях биофабрик, например, Курской биофабрики. При культивировании клеток используется первичная культуральная среда, включающая синтетическую среду MEM (минимальная среда Игла), синтетическую среду 199 и сыворотку крови крупного рогатого скота. Данные среды содержат комплекс аминокислот, минеральных и витаминных компонентов в соотношениях, обеспечивающих оптимальный рост культуры клеток. После процесса культивирования в жидких отходах указанные вещества остаются практически в прежнем количестве и соотношениях. Помимо перечисленных выше компонентов, отходы культурального производства включают биологические продукты жизнедеятельности культивируемых клеток, которые выполняют роль естественных биостимуляторов.
Исследование биохимического состава отходов, полученных после культивирования клеток перепелиных фибробластов при производстве вакцины Марека в условиях Курской биофабрики показало, что отходы содержат комплекс биохимических компонентов, которые соответствуют компонентам первичной культуральной среды. При этом в процессе культивирования клетки продуцируют биохимические и биологически активные вещества, поступающие в окружающую среду, что повышает биологическую ценность отходов культурального производства.
Из данных, представленных в таблице 1, следует, что отходы биологического производства, полученные при культивировании перепелиных фибробластов, содержат большой спектр биохимических веществ. Это аминокислоты, в том числе незаменимые (аргинин, валин, лизин, треонин, гистидин, метионин, фенилаланин). Из минеральных компонентов в отходах содержатся кальций, фосфор, магний, калий, натрий, хлориды. Отходы включают в свой состав также углеводы, которые представлены глюкозой, и комплекс витаминов (ретинол, тиамин, кальциферол, рибофлавин, аскорбиновую и пантотеновую кислоты).
Отходы биологического производства, полученные при культивировании перепелиных фибробластов, ценны не только комплексом биохимических веществ, входящих в их состав, но и оптимальным соотношением этих веществ, что способствует их поступлению в организм после введения. Важной особенностью отходов культурального производства является наличие в них продуктов метаболизма культивируемых клеток, участвующих в регуляции ряда биохимических процессов.
Внешне отходы культурального производства представляют собой стерильную прозрачную жидкость розового цвета, без запаха.
Отходы биологического производства, полученные при культивировании перепелиных фибробластов, в дальнейших технологических процессах не используются и, например на Курской биофабрике, утилизируются.
Включение в состав препарата янтарной кислоты способствует усилению клеточного дыхания, усвоению кислорода клетками. Янтарная кислота является катализатором биоэнергетических процессов, обладает антиоксидантными свойствами, обезвреживает свободные радикалы, предотвращает разрушение эритроцитов, укрепляет иммунитет, участвует в нейтрализации токсинов, активизирует ряд важнейших ферментов.
Добавление в состав препарата нуклеината натрия значительно повышает его иммуностимулирующие свойства. Нуклеинат натрия индуцирует лейкоцитарную реакцию, стимулирует деятельность костного мозга, внутриклеточный метаболизм и нуклеиновый обмен. Он обладает активностью поликлонального иммуномодулятора, регулирует миграцию Т-лимфоцитов и процессы кооперации Т- и В-лимфоцитов, стимулирует фагоцитарную активность макрофагов и продукцию факторов неспецифической защиты организма, особенно при иммунодефицитах.
Включение в комплексный препарат антисептика-стимулятора Дорогова Ф-2 способствует повышению тканевых ферментов: транспортной Na+, K+ АТФ-азы, рибонуклеазы, щелочной фосфатазы и др., которые участвуют в активном транспорте ионов и питательных веществ через клеточные мембраны и в процессах фосфорилирования. Помимо этого стимулятор АСД Ф-2 улучшает трофику тканей, повышает уровень обменных процессов в здоровом организме и способствует восстановлению обмена до нормы при различных дистрофических состояниях.
Для получения 1 л препарата в стерильную стеклянную емкость последовательно вносят 6-7 г янтарной кислоты, 20-25 г нуклеината натрия, 30-35 мл АСД Ф-2 и доводят объем до 1 л добавлением отходов биологического производства, полученные при культивировании перепелиных фиброб-ластов. При этом для обеспечения стерильности порошкообразные янтарную кислоту и нуклеинат натрия предварительно подвергают ультрафиолетовому облучению, например, УФ-лампой ПРК-2, в течение 20-30 мин.
Выбранные количества янтарной кислоты, нуклеината натрия и АСД Ф-2, входящих в предлагаемый препарат, было определено опытным путем и обосновано тем, что данное соотношение компонентов обеспечивает синергетический эффект при внутримышечном введение препарата. При уменьшении нуклеината натрия (менее 20-25 г) снижается иммуностимулирующие свойства препарата, а уменьшение янтарной кислоты (менее 10-15 г) и АСД Ф-2 (менее 30-35 мл) сопровождается снижением ростостимулирующего действия препарата. Увеличение указанных компонентов выше верхних значений не оказывает существенных изменений свойств препарата.
Изготовленный препарат представляет собой прозрачную жидкость светло-желтого цвета, со слабым специфическим запахом и pH 6,8-7,0. Расфасовывают препарат во флаконы из темного стекла емкостью по 50 или 100 мл, которые закрывают резиновыми пробками и обкатывают алюминиевыми колпачками.
Общие свойства и стабильность препарата определяли согласно положений Государственной фармакопеи. Критериями служили такие параметры, как внешний вид, прозрачность, окраска, токсичность, отсутствие механических включений.
Сроки хранения препарата определяли методом «ускоренного старения», а также путем длительного хранения, для чего экспериментальные образцы были заложены на хранение при комнатной температуре и в холодильнике при 4-8°C. Каждые 3 месяца проводилась проверка препарата на бактериальную загрязненность с использованием сред Эндо и МПА.
Проверка показала, что при хранении исходные параметры препарата остаются без существующих изменений в течение 12 мес.
Исследование препарата на пирогенность проводили на 10 здоровых кроликах (5 самок, 5 самцов) с массой тела 2,4±0,11 кг. Все кролики находились в стереотипных условиях и получали одинаковый рацион.
Изготовленный препарат вводили кроликам в ушную вену в дозе 1 мл/кг. До и после введения препарата у кроликов измеряли температуру тела и брали кровь через 1, 3 и 6 часов. В крови определяли скорость оседания эритроцитов (СОЭ), гематокрит и содержание лейкоцитов общепринятыми методами (Клиническая лабораторная диагностика в ветеринарии. - М.: Агропромиздат, 1985).
Было установлено, что после введения препарата повышение суммарного показателя температуры тела у 10 подопытных кроликов находилось в пределах физиологических норм. При этом СОЭ колебалась в пределах 1,7-1,9 мм/час, а температура тела - 37,2-37,8°C.
Увеличение содержания лейкоцитов после введения препарата (7,11±0,38 - 7,54±0,40·109/л) по сравнению с фоновыми значениями (6,94±0,40 - 7,40±0,35·109/л) было недостоверным (Р>0,05). Проведенные исследования показали, что изготовленный препарат является апирогенным.
Местное действие препарата на слизистые оболочки определяли путем его однократного внесения в коньюктивальный мешок кроликов в количестве 1-2 капель. С этой целью оттягивали внутренний угол коньюктивального мешка и вносили препарат, а затем в течение 1 мин зажимали слезно-носовой канал и наблюдали за поведением кроликов. В первые 1-2 часа отмечалась слабая гиперемия коньюктивы, после чего она исчезала. Других изменений выявлено не было.
Острую токсичность изготовленного препарата определяли на 60 беспородных мышах, 30 морских свинках и 10 кроликах калифорнийской породы, которые содержались в условиях вивария и ветеринарной клиники Курской государственной сельскохозяйственной академии.
Препарат вводили внутримышечно, а также внутрижелудочно с использованием шприца с резиновой насадкой. После введения препарата за опытными животными наблюдали в течение 10 суток, отмечая время наступления токсикоза. Среднесмертельную дозу (LD50) рассчитывали по формуле Кербера, а ее среднюю ошибку - по формуле Гаддэма. В процессе эксперимента учитывали общее состояние животных, особенности их поведения, интенсивность и характер двигательной активности, тонус скелетной мускулатуры, реакцию на тактильные, звуковые и световые раздражители.
Исследования LD50 показали, что изготовленный препарат относится к малотоксичным соединениям.
Хроническую токсичность устанавливали на 20 белых мышах, 20 крысах и 10 кроликах. Препарат вводили подкожно в течение 30 дней с интервалом одни сутки в дозе, составляющей 1/3 дозы, испытанной в остром опыте. Длительное применение препарата не вызывало гибели животных и не сопровождалось клиническими изменениями за весь период наблюдений.
Анафилактогенностъ препарата исследовали на 20 морских свинках, которым в правую ушную раковину внутрикожно инъецировали по 0,1 мл изготовленного препарата. Контрольным свинкам вводили стерильный изотонический раствор натрия хлорида (физраствор). Через 12 дней в коньюктивальный мешок правого глаза закапывали по одной капле препарата. Одновременно свинкам субплантарно в правые лапки вводили по 0,1 мл препарата. При оценке реакции учитывали воспаление коньюктивы и наличие отека лап. После введение препарата у подопытных лабораторных животных не наблюдалось аллергической реакции, что свидетельствует об отсутствие в изготовленном препарате гетерогенного белка.
Влияние изготовленного препарата на иммунологический и биохимический статус изучали на разных видах животных.
Пример 1. Исследование влияния различных доз изготовленного препарата на общие гематологические показатели и биохимический статус было проведено на 30 белых беспородных крысах-самцах со средней живой массой 96-98 г, содержащихся в виварии Курской государственной сельскохозяйственной академии. Животные были разделены на три группы аналогов по 10 голов в каждой. Условия содержания, кормления и ухода за крысами всех групп были аналогичными.
Крысам 1 группы внутримышечно инъецировали изготовленный препарат в дозе 2,0 мл/кг, а крысам 2 группы - 3,0 мл/кг живой массы. Крысам 3 группы (контрольной) инъецировали стерильный изотонический раствор натрия хлорида из расчета 2,0 мл/кг живой массы. Вводили препараты подопытным животным один раз в день, трехкратно, через 24 часа.
Через 7 суток у крыс всех групп, после последнего введения препаратов, брали кровь, в которой определяли содержание эритроцитов, лейкоцитов, гемоглобина общепринятыми методами. Содержание общего белка определяли биуретовым методом, белковые фракции устанавливали с использованием электрофореза на пластинах из ацетата целлюлозы. Ферментативную активность аминотрансфераз (АЛТ, ACT) крови определяли с использованием наборов реактивов «Био-Ла-Тест» фирмы «Лахема». Содержание малонового диальдегида (МДА) устанавливали по реакции с тиобарбитуровой кислотой по методу Э.Н.Коробейниковой (1989). Через 30 дней после начала эксперимента у крыс всех групп определяли массу тела и среднесуточные привесы.
Наблюдения показали, что в период эксперимента общее состояние у всех подопытных животных было хорошее, поведение активное, реакции на внешние раздражители адекватные.
Результаты исследований крови представлены в таблице 2, из которой следует, что перед введением препаратов между изучаемыми показателями у животных всех групп не было существенных различий (Р>0,05) и они находились в пределах средних физиологических величин.
Через 7 дней после последнего введения препаратов у крыс 1 и 2 групп, по сравнению с контролем, наблюдалось достоверное увеличение (Р<0,05) в крови эритроцитов, общего белка, гамма-глобулинов. Показатели ферментативной активности аминотрансфераз (АЛТ, ACT) практически оставались на прежнем уровне, а показатели содержания МДА, наоборот, достоверно понизились.
При этом отмечено, что у крыс 2 группы в крови было больше эритроцитов, гемоглобина, общего белка, альбуминов и гамма-глобулинов, чем у крыс 1 группы. Однако выявленные различия были статистически недостоверными (Р>0,05).
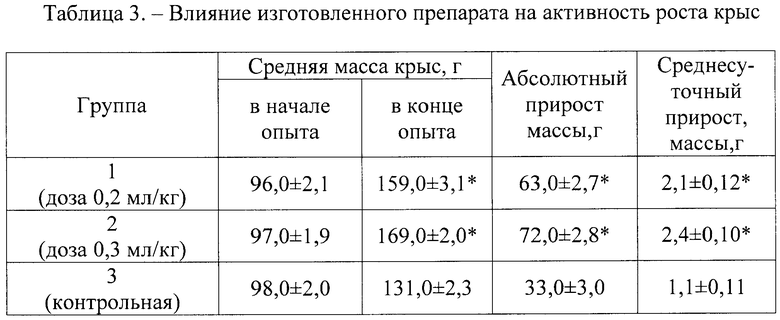
Определение массы тела у подопытных животных показало (табл.3), что через 30 дней после начала эксперимента у крыс 1 и 2 групп, по сравнению с контролем, она значительно увеличилась.
Полученные результаты проведенного эксперимента указывают на то, что применение изготовленного препарата в используемых дозах не оказывает отрицательного влияния на организм подопытных животных, препарат обладает ростостимулирующими свойствами, активизирует гемопоэз, обмен белков и защитные функции организма. При этом изготовленный препарат в испытуемых дозировках не вызывает изменений функциональной активности печени и обладает антиоксидантными свойствами, о чем свидетельствует содержание в крови подопытных животных АЛТ, ACT и МДА.
Пример 2. Влияние изготовленного препарата на обмен веществ и его ростостимулирующие свойства исследовали на цыплятах-бройлерах кросса «Росс-308», из которых по принципу аналогов в 7-суточном возрасте было сформировано три группы. Цыплятам 1 группы внутримышечно инъецировали 0,5 мл/кг изготовленного препарата трехкратно с интервалом 3 дня, 1 раз в день. Цыплятам 2 группы вводили 0,5 мл/кг препарата-прототипа по той же схеме, что и цыплятам 1 группы. Цыплята 3 группы являлись контрольными, им вводили изотонический раствор хлорида натрия. Птицы всех групп получали основной рацион, питательная и энергетическая ценность которого соответствовала нормам, рекомендованным ВНИТИП.
В период эксперимента учитывали общее клиническое состояние птицы, определяли живую массу и сохранность. В 40-суточном возрасте бройлеров убивали. Во время убоя проводили отбор крови и печени. В крови исследовали содержание эритроцитов, лейкоцитов, гемоглобина с использованием общепринятых методов. Биохимические компоненты крови определяли на анализаторе Stat Fax 1904 с соответствующими наборами реактивов. Содержание в печени каратиноидов и витаминов А, В2 и Е устанавливали методом жидкостной хроматографии на хроматографе Weters 2487. Идентификацию свободных аминокислот в печени проводили на аминокислотном анализаторе KLA-3B фирмы «Hitachi».
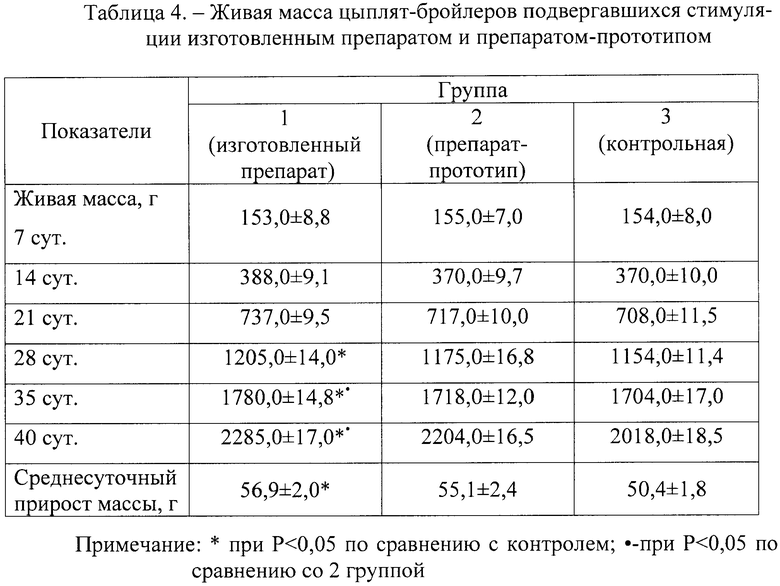
Результаты исследований показали, что прирост живой массы тела у цыплят 1 группы был выше по сравнению с цыплятами 2 и 3 группы (табл.4). При этом на 28, 35 и 40 сутки выявленные различия были статистически достоверными (Р<0,05).
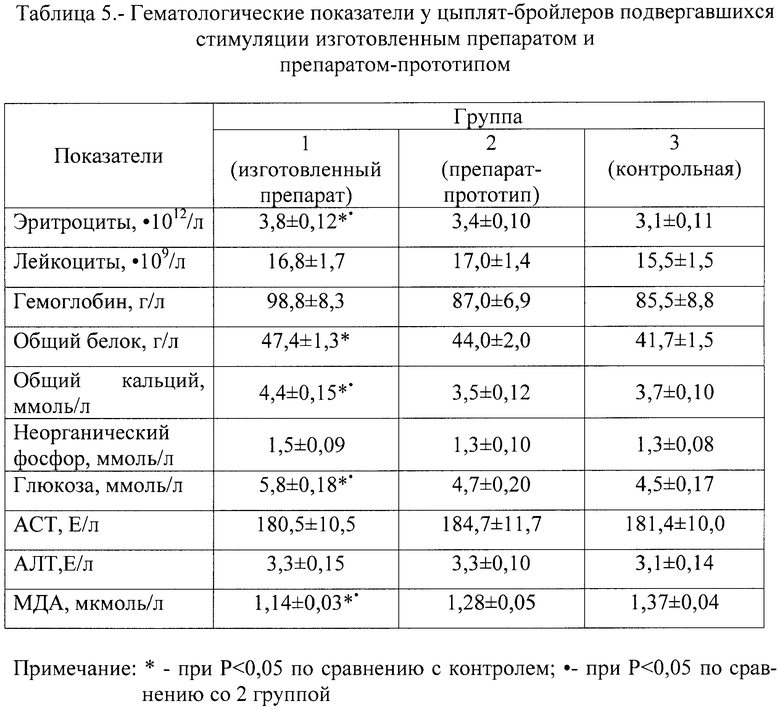
Как следует из таблицы 5, относительно высокое содержание в крови эритроцитов и гемоглобина у цыплят 1 группы свидетельствует о том, что изготовленный препарат оказывает стимулирующее влияние на эритропоэз, не изменяя стабильности кроветворения в целом.
Содержание общего белка, кальция и глюкозы в крови цыплят 1 группы также было достоверно выше (Р<0,05), чем у цыплят 2 и 3 группы. Можно предположить, что эти вещества поступают с введенным изготовленным препаратом, где они содержатся в оптимальных биологических соотношениях, что обеспечивает их быстрое проникновение в кровь. Однако не исключено, что изготовленный препарат оказывает общее стимулирующее влияние на метаболизм этих компонентов крови и они более активно всасываются в кишечнике из корма.
Относительно невысокая ферментативная активность аминотрансфераз крови (ACT, АЛТ) цыплят всех групп свидетельствует об отсутствии функциональных изменений в печени птицы после введения сравниваемых препаратов.
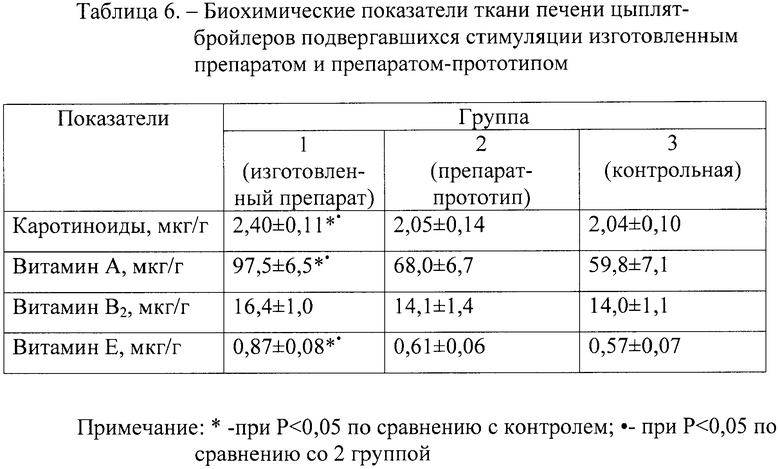
Биохимический анализ тканей печени у цыплят всех групп (табл.6) в 40-суточном возрасте позволил установить, что содержание каротиноидов, витамина А и Е в печени цыплят 1 группы было достоверно больше (Р<0,05) по сравнению с цыплятами 2 и 3 групп. Содержание витамина В2 в печени цыплят 1 группы также превышало его содержание у птицы 2 и 3 групп, однако, выявленные различия были статистически недостоверными (Р>0,05).
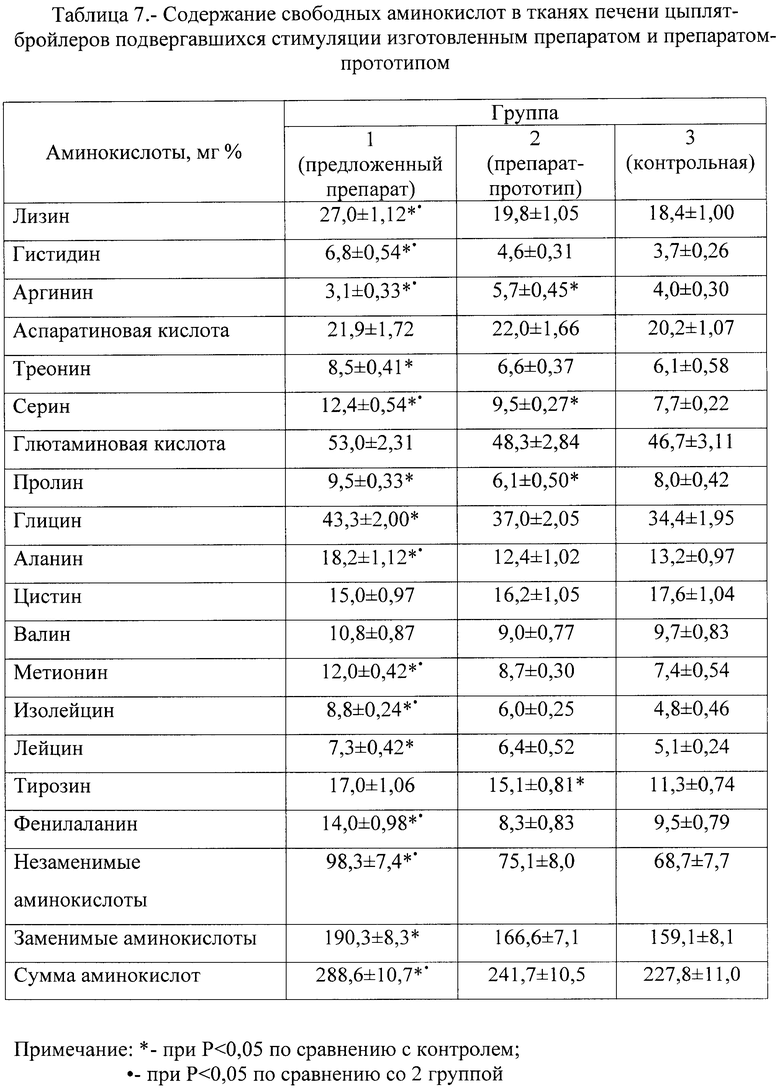
В тканях печени цыплят 1 группы отмечалось высокое суммарное содержание как заменимых, так и незаменимых аминокислот (табл.7). При этом содержание лизина, гистидина, серина, аланина, метионина, изолейцина и фенилаланина было достоверно (Р<0,05) больше, чем у цыплят 2 и 3 групп.
Таким образом, результаты данного эксперимента свидетельствуют о том, что изготовленный препарат оказывает стимулирующее влияние на основные обмены веществ в организме птицы, а также является «поставщиком» многих биохимических компонентов, участвующих в этих обменах.
Пример 3. В третьем эксперименте изучали иммуностимулирующие свойства изготовленного препарата. Исследования проводили на овцах романовской породы, которые содержались в условиях ветеринарной клиники Курской государственной сельскохозяйственной академии имени И.И.Иванова.
Было сформировано три группы. Овцам 1 группы внутримышечно иньецировали изготовленный препарат в дозе 3,0 мл/гол один раз в день трехкратно с интервалом 3 дня. Овцам 2 группы вводили препарат-прототип в дозе 3,0 мл/гол в той же последовательности, что и животным 1 группы. Овцы 3 группы являлись контрольными, им вводили 3,0 мл/гол стерильного изотонического раствора хлорида натрия. Содержание и кормление овец всех групп было одинаковым.
Перед введением препаратов, а также через 5 и 10 дней после последнего их ведения у всех подопытных животных брали кровь, в которой определяли содержание лейкоцитов на кондуктометрическом счетчике «Пикоскель - Р8-4». Бактерицидную активность сыворотки крови (БАСК) исследовали с использованием культуры Staphylococcus aureus. Лизоцимную активность сыворотки крови (ЛАСК) оценивали с применением суточной культуры Micrococcus lisodecticus. Фагоцитарную активность лейкоцитов (ФАЛ) определяли по реакции фагоцитоза с латексом. Содержание Т-лимфоцитов определяли по реакции розеткообразования лимфоцитов с эритроцитами барана, а В-лимфоцитов - с эритроцитами мыши. Уровень общих иммуноглобулинов устанавливали цинксульфатным методом.
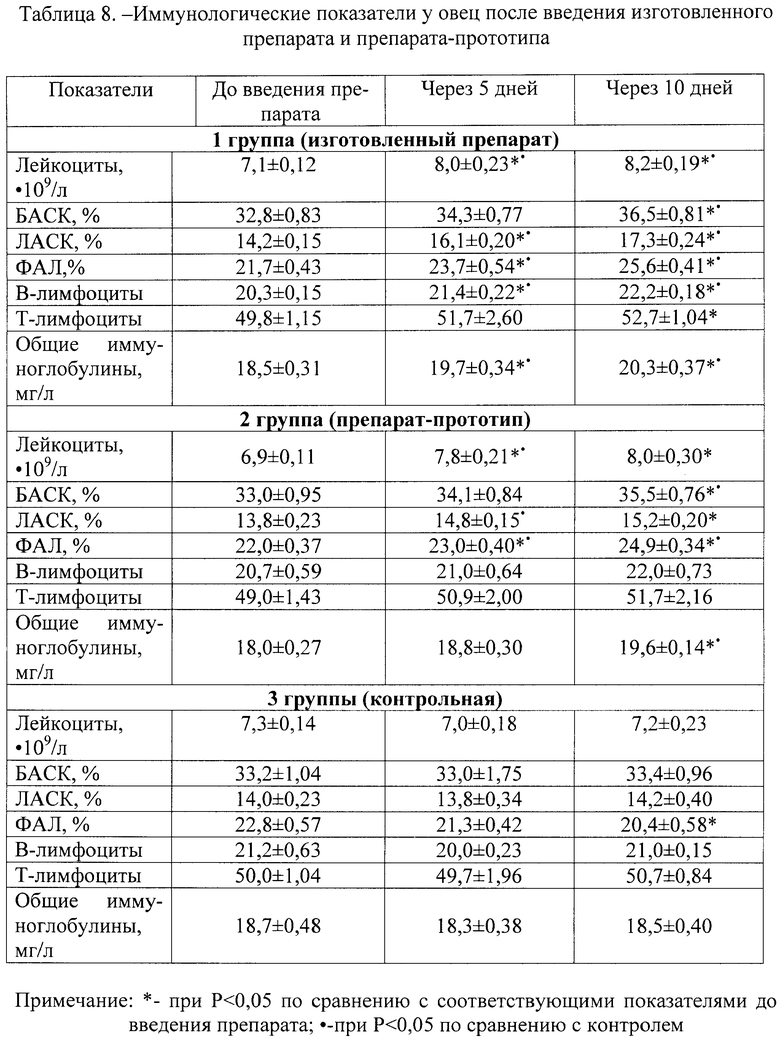
В ходе проведенных исследований было установлено, что изготовленный препарат обладает выраженным иммуностимулирующим действием, которое превосходило по многим параметрам препарат-прототип (табл.8). Так, в крови овец 1 группы содержание лейкоцитов, В-лимфоцитов и общих иммуноглобулинов было достоверно (Р<0,05) больше, а бактерицидная, лизоцимная и фагоцитарная активность крови выше, чем у овец 2 и 3 группы. Это связано с включением в состав изготовленного препарата иммуностимулятора нуклеоната натрия, а также с продуктами метаболизма культивируемых клеток, которые также обладают иммуностимулирующим действием.
Пример 4. Исследование влияния изготовленного препарата на обмен веществ у поросят - гипотрофиков проводили в условиях свиноводческой фермы учебно-опытного хозяйства Курской ГСХА. С этой целью было отобрано три группы поросят (по 10 голов в каждой) крупной белой породы, отстающих в росте и развитии. При этом клинических проявлений заболеваний у подопытных животных выявлено не было.
Поросятам 1 группы внутримышечно инъецировали изготовленный препарат в дозе 1,5 мл/кг один раз в день трехкратно с интервалом 3 дня. Поросятам 2 группы вводили препарат-прототип в дозе 1,5 мл/кг по той же схеме, что и животным первой группы. Поросята 3 группы являлись контрольными, им вводили изотонический раствор хлорида натрия в дозе 1,5 мл/гол.
У 5 поросят из каждой группы брали кровь до введения препарата и на 7 сутки после последнего введения препарата. В крови определяли СОЭ, гематокрит, содержание эритроцитов, лейкоцитов и гемоглобина общепринятыми методами. Биохимические компоненты крови исследовали с использованием наборов реактивов «Био-Ла-Тест» фирмы «Лахема» и «Клини-Тест».
Клиническое обследование подопытных поросят перед началом эксперимента показало, что аппетит у них был плохой, волосяной покров матовый и взъерошен, масса тела не соответствовала возрастному периоду. В крови поросят многие показатели приближались к нижним физиологическим границам (альбумины, гамма - глобулины, неорганический фосфор, общие липиды), а такие показатели, как эритроциты, гемоглобин, общий белок, общий кальций, глюкоза, были ниже физиологических норм.
Таким образом, общее клиническое исследование и гематологический анализ позволил выявить выраженное нарушение обменных процессов у включенных в эксперимент поросят.
Через 10-14 дней после проведенного курса стимуляции препаратами общее состояние поросят 1 и 2 группы значительно улучшилось. У большинства животных повысился аппетит, исчезла матовость и взъерошенность волосяного покрова, повысились среднесуточные привесы. Исследование крови на 7 день после последнего введения препаратов показало, что улучшение клинического состояния у поросят 1 и 2 групп происходило в связи с нормализацией у них биохимического статуса. Как следует из данных, представленных в таблице 9, у поросят нормализовалось большинство гематологических показателей. При этом у поросят, которым вводили изготовленный препарат, биохимический статус был более «физиологическим», чем у поросят, которым вводили препарат-прототип. Падежа животных среди 1 и 2 групп за период эксперимента не было.
У поросят 3 (контрольной группы) общее клиническое состояние оставалось на прежнем уровне. Аппетит у них был понижен, среднесуточные привесы были низкими. При этом у некоторых поросят проявились симптомы расстройства желудочно-кишечного тракта в виде диареи. За период эксперимента два поросенка из контрольной группы пали.
Таким образом, проведенные исследования на разных видах животных показали, что разработанный способ позволяет получить препарат, который оказывает выраженное стимулирующее действие на обмен веществ, обладает антиоксидантными свойствами и одновременно повышает естественную резистентность организма.
Предложенный способ получения биостимулирующего препарата не требует квалифицированного обеспечения, дорогостоящего и дефицитного оборудования. Компоненты, входящие в состав препарата, легкодоступные, имеют небольшую стоимость. Отходы биологической промышленности, используемые при изготовлении препарата, на биофабриках в дальнейшем технологическом процессе не применяются, например, на Курской биофабрике утилизируются. Все это позволяет использовать разработанный способ в условиях производственных отделов ветеринарных лабораторий.


| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ ДЛЯ СТИМУЛЯЦИИ ОБМЕНА ВЕЩЕСТВ И НЕСПЕЦИФИЧЕСКОЙ РЕЗИСТЕНТНОСТИ ЖИВОТНЫХ | 2011 |
|
RU2470648C1 |
| Способ повышения обмена веществ и неспецифической резистентности у сельскохозяйственных животных | 2021 |
|
RU2763842C1 |
| КОРМОВАЯ БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА ДЛЯ МОЛОДНЯКА СВИНЕЙ | 2011 |
|
RU2483567C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО ПРЕПАРАТА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НАРУШЕНИЙ ОБМЕНА ВЕЩЕСТВ, МИКРОЭЛЕМЕНТОЗОВ, ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА ЖИВОТНЫХ | 2007 |
|
RU2351323C2 |
| Способ улучшения обмена веществ у сельскохозяйственных животных с использованием микрокапсулированного интестевита | 2019 |
|
RU2719676C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО ПРЕПАРАТА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НАРУШЕНИЙ ОБМЕНА ВЕЩЕСТВ, МИКРОЭЛЕМЕНТОЗОВ, ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА ЖИВОТНЫХ | 2009 |
|
RU2404761C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО ПРЕПАРАТА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПАТОЛОГИЙ ОБМЕНА ВЕЩЕСТВ И НАРУШЕНИЙ ФУНКЦИЙ ИММУННОЙ СИСТЕМЫ ЖИВОТНЫХ | 2009 |
|
RU2395278C1 |
| Способ микрокапсуляции нуклеината натрия | 2019 |
|
RU2707558C1 |
| Состав для стимуляции неспецифической резистентности и обмена веществ у цыплят-бройлеров | 2016 |
|
RU2621999C1 |
| Способ получения биологически активного комплексного йодметаболического препарата для стимуляции эритропоэза, энергетического обмена, профилактики анемического синдрома, гипоксии, гипомикроэлементозов | 2020 |
|
RU2757367C1 |
Изобретение относится к ветеринарной медицине. Способ получения препарата для стимуляции неспецифической резистентности и обмена веществ у животных включает смешивание янтарной кислоты с тканевым препаратом АСД Ф-2 (антисептический стимулятор Дорогова фракция-2), нуклеинатом натрия и отходами биологической промышленности, полученных после культивировании перепелиных фибробластов на первичной культуральной среде, включающей синтетическую среду MEM (минимальная среда Игла), синтетическую среду 199 и сыворотку крови крупного рогатого скота, в следующем соотношении компонентов, г/л: янтарная кислота - 6-7, АСД Ф-2 - 30-35,нуклеинат натрия - 20-25, отходы биологической промышленности, полученные после культивирования перепелиных фибробластов, - до 1 л, причем янтарную кислоту и нуклеинат натрия предварительно подвергают ультрафиолетовому облучению. Изобретение обеспечивает получение препарата, который оказывает выраженное стимулирующее действие на обмен веществ, обладает антиоксидантными свойствами и повышает естественную резистентность организма животных. 9 табл., 4 пр.
Способ получения препарата для стимуляции неспецифической резистентности и обмена веществ у животных, включающий смешивание янтарной кислоты с тканевым препаратом АСД Ф-2 (антисептический стимулятор Дорогова фракция-2), отличающийся тем, что дополнительно вводят нуклеинат натрия и отходы биологической промышленности, полученные после культивировании перепелиных фибробластов на первичной культуральной среде, включающей синтетическую среду MEM (минимальная среда Игла), синтетическую среду 199 и сыворотку крови крупного рогатого скота в следующем соотношении компонентов, г/л:
при этом янтарную кислоту и нуклеинат натрия предварительно подвергают ультрафиолетовому облучению.
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА "ЯНТАРНЫЙ БИОСТИМУЛЯТОР" ДЛЯ ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА ЖИВОТНЫХ | 2005 |
|
RU2303979C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО ПРЕПАРАТА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НАРУШЕНИЙ ОБМЕНА ВЕЩЕСТВ, МИКРОЭЛЕМЕНТОЗОВ, ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА ЖИВОТНЫХ | 2009 |
|
RU2404761C1 |
| СПОСОБ СТИМУЛЯЦИИ НЕСПЕЦИФИЧЕСКОЙ РЕЗИСТЕНТНОСТИ ЖИВОТНЫХ | 2007 |
|
RU2339366C1 |
Авторы
Даты
2013-01-27—Публикация
2011-08-25—Подача