Предшествующий уровень техники
Широкий спектр противораковых химиотерапевтических агентов часто действует посредством ингибирования пролиферации в результате прерывания деления клетки или ингибирования апоптоза в относительно быстро делящихся клетках. Одной из стратегий для ингибирования клеточной пролиферации является применение химиотерапевтических агентов, представляющих собой нуклеотидные аналоги, таких как кладрибин, клофарабин, флударабин, меркаптопурин, пентостатин, тиогуанин, капецитабин, цитарабин, децитабин, фторурацил, флоксуридин, сапацитабин и гемцитабин. Эти соединения являются структурно подобными и типично действуют посредством по меньшей мере вмешательства в репликацию ДНК. Химиотерапевтические агенты, представляющие собой нуклеотидные аналоги, применяют для лечения, либо их исследуют для возможности лечения разнообразных видов рака, включая гематологические злокачественные опухоли, такие как лейкоз и лимфома, колоректальный рак, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичника, базально-клеточную карциному, рак мочевого пузыря, рак печени, рак простаты, рак желудка, рак почки, меланому, глиому, рак пищевода, рак шейки матки и миелодиспластические синдромы.
Лечение химиотерапевтическими агентами часто приводит в результате к развитию резистентности к одному или более чем одному химиотерапевтическому лекарственному средству посредством различных механизмов. Например, резистентность к гемцитабину при раке является широко распространенной проблемой. Большая доля пациентов в некоторый момент лечения прекращает получать гемцитабин, как одобрено при раке легкого, поджелудочной железы, мочевого пузыря, молочной железы и яичника и проходит исследование для лечения по меньшей мере рака печени и поджелудочной железы; и используется экспериментально для лечения лимфом и других видов рака. Хотя он эффективен в трети случаев, для которых это лекарственное средство одобрено, в большинстве ответ отсутствует, и даже в тех случаях, где ответ есть, в конечном счете, развивается резистентность.
Резистентность к гемцитабину является особенно проблематичной при раке поджелудочной железы, для которого нет других одобренных химиотерапевтических режимов. Несмотря на достижения в лечении многих типов рака, рак поджелудочной железы остается трудным для лечения при низкой долгосрочной выживаемости. По оценкам 2004 года распространенность этого заболевания в США составляет 31860 с ожидаемой смертью в 31270 случае. Одним из ограничений разработки новых лекарственных средств является отсутствие соответствующих доклинических моделей.
Всего примерно 5% пациентов с раком экзокринной части поджелудочной железы проживут 5 лет после обнаружения рака. Даже для пациентов с локальным заболеванием относительная доля 5-летнего выживания составляет примерно 20%. Для тех кто страдает регионарным заболеванием, относительная доля 5-летнего выживания составляет примерно 8%. Если присутствуют метастазы, относительная доля 5-летнего выживания составляет 2%. Хотя гемцитабин одобрен для лечения пациентов с раком поджелудочной железы, примерно 75-90% пациентов имеют минимальную пользу от этой терапии. Никаких обоснованных рекомендаций по лечению невозможно дать для пациентов с прогрессирующим раком поджелудочной железы после неудачи лечения первой линии гемцитабином.
За последние несколько лет в значительном числе клинических испытаний исследована активность новых агентов при раке поджелудочной железы отдельно или в комбинации с гемцитабином. Результаты этих исследований, в основном, отрицательны. Несмотря на данные по активности в исследованиях фазы II, ни агент сам по себе, ни комбинированная стратегия не были лучшими, чем один гемцитабин, в проведенных до сих пор исследованиях. Это применимо не только к общепринятым лекарственным средствам, но также к направленным агентам, таким как ингибиторы матриксных металлопротеиназ (ММР) и фарнезилтрансферазы (FTI).
Были проведены исследования для идентификации подходящих терапий для пациентов с раком поджелудочной железы, у которых была неудачной терапия гемцитабином, но результаты были смешанными. В одном исследовании лечение состояло из доцетаксела 65 мг/м2 и иринотекана 160 мг/м2, где тот и другой вводили раз в 21 сутки. Было зарегистрировано четырнадцать пациентов, после чего исследование было закрыто вследствие избыточной токсичности. Наиболее распространенные токсичности степени 3/4 включали нейтропению/лейкопению, тошноту и рвоту и диарею. Полностью половина пациентов получила только один цикл лечения при среднем сроке до неудачи лечения 36 суток. Никаких объективных ответов не наблюдали, хотя у трех пациентов заболевание было стабильным в течение по меньшей мере 6 циклов. Общее выживание для полной когорты составляло 134 суток при доле 6-месячного выживания 36%. В другом исследовании пациентов с раком поджелудочной железы, резистентным к гемцитабину, лечили S-I и цисплатином (CDDP) для определения доли ответа и токсичности. У пяти из семнадцати зарегистрированных пациентов (29,4%) получили частичный ответ, и 2 (11,8%) имели стабильное заболевание. Токсичности лечения были приемлемыми. Средний срок выживания составлял 10 месяцев (диапазон до 20 месяцев), где 63,7% и 31,9% пациентов жили до 6 и 12 месяцев соответственно.
Краткое изложение сущности изобретения
В одном аспекте в настоящем изобретении предложен способ применения дезинтегратора митоза/ингибитора биохимического пути polo-подобной киназы (Plk) в качестве лекарственного средства для лечения рака у субъектов, страдающих раком, поддающимся лечению химиотерапевтическим агентом, представляющим собой нуклеотидный аналог. Такие субъекты включают субъектов, страдающих видами рака, которые исходно поддавались лечению химиотерапевтическими агентами, представляющими собой нуклеотидные аналоги, у которых впоследствии химиотерапия потерпела неудачу вследствие развития резистентности к нуклеотидным химиотерапевтическим агентам (то есть развития резистентной опухоли). Способ применения включает препарат дезинтегратора митоза/ингибитора биохимического пути Plk в качестве лекарственного средства для введения субъекту, идентифицированному как страдающему типом рака, который поддается лечению химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, поддается лечению дезинтегратором митоза/ингибитором биохимического пути Plk. В некоторых воплощениях субъект имеет резистентность, либо у него развилась резистентность к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог. Этот способ дополнительно включает мониторинг субъекта в отношении снижения или стабилизации по меньшей мере одного признака или симптома рака, где лекарственное средство приводит в результате к снижению или стабилизации по меньшей мере одного признака или симптома рака. В одном воплощении дезинтегратор митоза/ингибитор биохимического пути Plk вводят совместно с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог. В одном аспекте способ применения включает реверсирование резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог.
В одном аспекте в настоящем изобретении предложен способ применения дезинтегратора митоза/ингибитора биохимического пути Plk для изготовления лекарственного средства для лечения рака у субъекта, страдающего раком, которому прежде вводили только химиотерапевтический агент, представляющий собой нуклеотидный аналог, где лекарственное средство приготовлено для совместного введения химиотерапевтического агента, представляющего собой нуклеотидный аналог, и субъект восприимчив к лечению комбинацией химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk. Этот способ дополнительно включает мониторинг субъекта в отношении снижения или стабилизации по меньшей мере одного признака или симптома рака. В одном аспекте способ включает предупреждение развития резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог.
В одном аспекте в настоящем изобретении предложен способ применения дезинтегратора митоза/ингибитора биохимического пути Plk для изготовления лекарственного средства для лечения рака у субъекта, восприимчивого к лечению рака с использованием химиотерапевтического агента, представляющего собой нуклеотидный аналог. Этот способ включает изготовление лекарственного средства, включающего дезинтегратор митоза/ингибитор биохимического пути Plk, для введения перед введением лекарственного средства, включающего химиотерапевтический агент, представляющий собой нуклеотидный аналог, возможно при продолжающемся введении дезинтегратора митоза/ингибитора биохимического пути Plk, и мониторинг субъекта в отношении снижения или стабилизации по меньшей мере одного признака или симптома рака. В одном аспекте способ применения этих лекарственных средств включает предупреждение у субъекта резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог.
В одном аспекте изобретение включает совместное введение химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk с получением синергетического эффекта этих соединений, так что эффект совместного введения этих соединений является большим, чем аддитивный эффект соединений, вводимых по отдельности. В одном аспекте изобретение включает изготовление синергетической композиции для применения в качестве лекарственного средства для лечения рака, включающей химиотерапевтический агент, представляющий собой нуклеотидный аналог, и дезинтегратор митоза/ингибитор биохимического пути Plk.
В одном аспекте изобретение включает схему введения химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk субъекту, страдающему раком, поддающимся лечению химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, и/или дезинтегратором митоза/ингибитором биохимического пути Plk. В одном воплощении эта схема включает введение одного химиотерапевтического агента, представляющего собой нуклеотидный аналог, с последующим совместным введением химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk. В одном воплощении эта схема включает введение дезинтегратора митоза/ингибитора биохимического пути Plk с последующим совместным введением дезинтегратора митоза/ингибитора биохимического пути Plk с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог. В одном воплощении эта схема включает совместное введение ингибитора Plk с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, возможно без предварительного отдельного введения любого из агентов. В одном аспекте изобретение возможно дополнительно включает введение дополнительных химиотерапевтических и/или фармацевтических агентов. В одном аспекте изобретение возможно дополнительно включает введение химиотерапевтического агента или дезинтегратора митоза/ингибитора биохимического пути Plk отдельно после совместного введения этих двух агентов.
В одном аспекте изобретение включает изготовление лекарственного средства, включающего дезинтегратор митоза/ингибитор биохимического пути Plk, для совместного введения с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, для лечения рака, резистентного к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у пациента, восприимчивого к лечению этим лекарственным средством.
В одном аспекте изобретение включает изготовление лекарственного средства, включающего дезинтегратор митоза/ингибитор биохимического пути Plk, для совместного введения с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, для предупреждения развития резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, при раке у пациента, восприимчивого к лечению этим лекарственным средством.
В одном аспекте изобретение включает изготовление лекарственного средства, включающего дезинтегратор митоза/ингибитор биохимического пути Plk, для совместного введения с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, для применения для реверсирования резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, при раке у пациента, ранее восприимчивого к лечению лекарственным средством, представляющим собой дезинтегратор митоза/ингибитор биохимического пути Plk.
В одном воплощении изобретение включает лекарственное средство для совместного введения дезинтегратора митоза/ингибитора биохимического пути Plk и химиотерапевтического агента, представляющего собой нуклеотидный аналог, которое представляет собой смесь, включающую дезинтегратор митоза/ингибитор биохимического пути Plk и химиотерапевтический агент, представляющий собой нуклеотидный аналог. В одном воплощении лекарственное средство для совместного введения дезинтегратора митоза/ингибитора биохимического пути Plk и химиотерапевтического агента, представляющего собой нуклеотидный аналог, включает препарат каждого из химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk в лекарственной форме, которая позволяет или облегчает введение обоих соединений субъекту. В некоторых воплощениях изобретения рак представляет собой рак, поддающийся лечению терапевтическим агентом, представляющим собой нуклеотидный аналог. В некоторых воплощениях изобретения рак представляет собой гематологическую злокачественную опухоль, такую как лейкоз или лимфома, колоректальный рак, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичника, базально-клеточную карциному, рак мочевого пузыря, рак печени, рак простаты, рак желудка, рак почки, меланому, глиому, рак пищевода, рак шейки матки и миелодиспластические синдромы.
В различных воплощениях дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой ингибитор Plk1. В различных воплощениях дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой ON-01910-Na или его производное. В воплощениях изобретения дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой ON-01910-Na. В различных воплощениях дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой терапевтическое средство на основе нуклеиновой кислоты. В различных воплощениях терапевтическое средство на основе нуклеиновой кислоты направлено на Plk1, конкретно Plk1 человека. В различных воплощениях терапевтическое средство на основе нуклеиновой кислоты представляет собой соединение миРНК (малая интерферирующая РНК).
В различных воплощениях изобретения химиотерапевтический агент, представляющий собой нуклеотидный аналог, представляет собой кладрибин, клофарабин, флударабин, меркаптопурин, пентостатин, тиогуанин, капецитабин, цитарабин, децитабин, фторурацил, флоксуридин, сапацитабин или гемцитабин. В различных воплощениях химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, является гемцитабин.
Краткое описание графических материалов
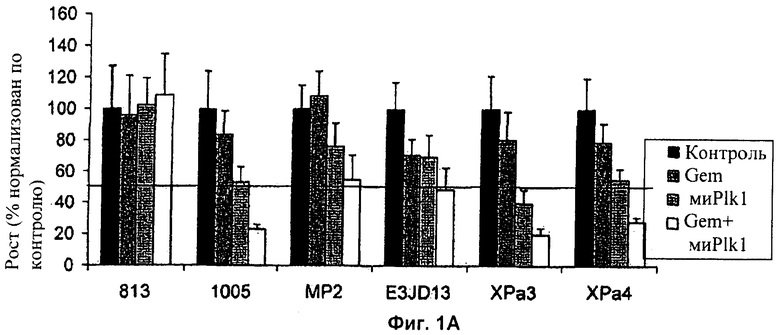
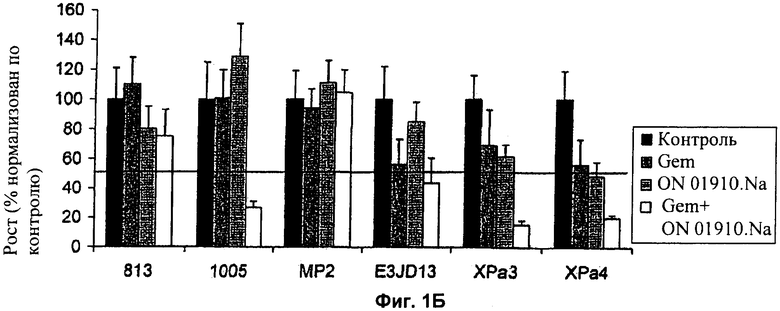
Фиг.1А и Б представляют собой графики, показывающие ингибирование роста шести клеточных линий, резистентных к гемцитабину, в ответ на обработку гемцитабином в присутствии или в отсутствие (А) миРНК-ингибитора и (Б) ON-01910-Na, низкомолекулярного ингибитора Plk1.
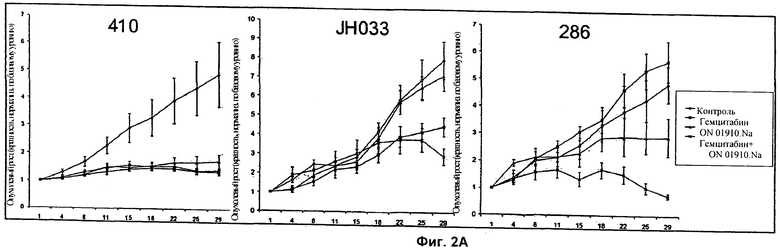
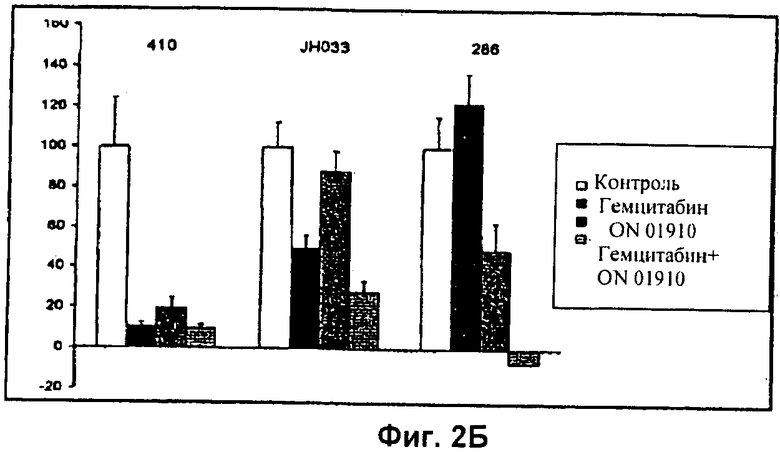
На Фиг.2 показаны результаты двух экспериментов in vivo у мышей с чувствительными и резистентными к гемцитабину опухолями. (А) показывает графики опухолевого роста трех экспериментов in vivo. Мышей, несущих опухоли, распределяли на 4 группы, которые обрабатывали носителем, гемцитабином, ON 01910-Na и комбинацией обоих агентов (при полных дозах). (Б) представляет собой столбиковую диаграмму А. Столбики ошибок представляют собой стандартное отклонение.
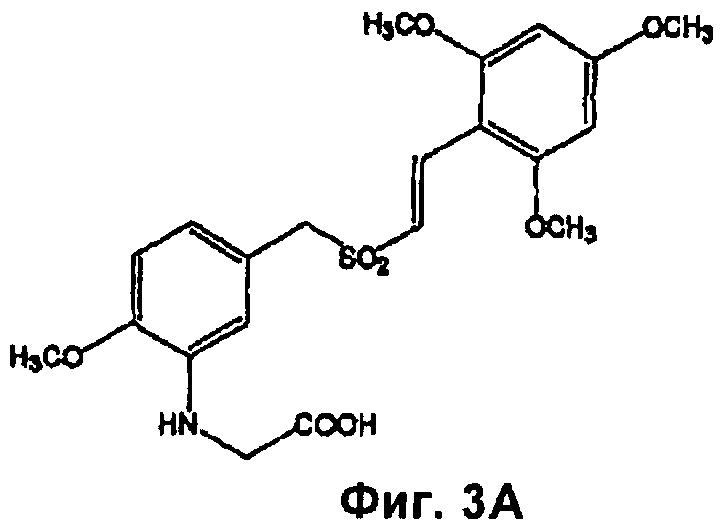
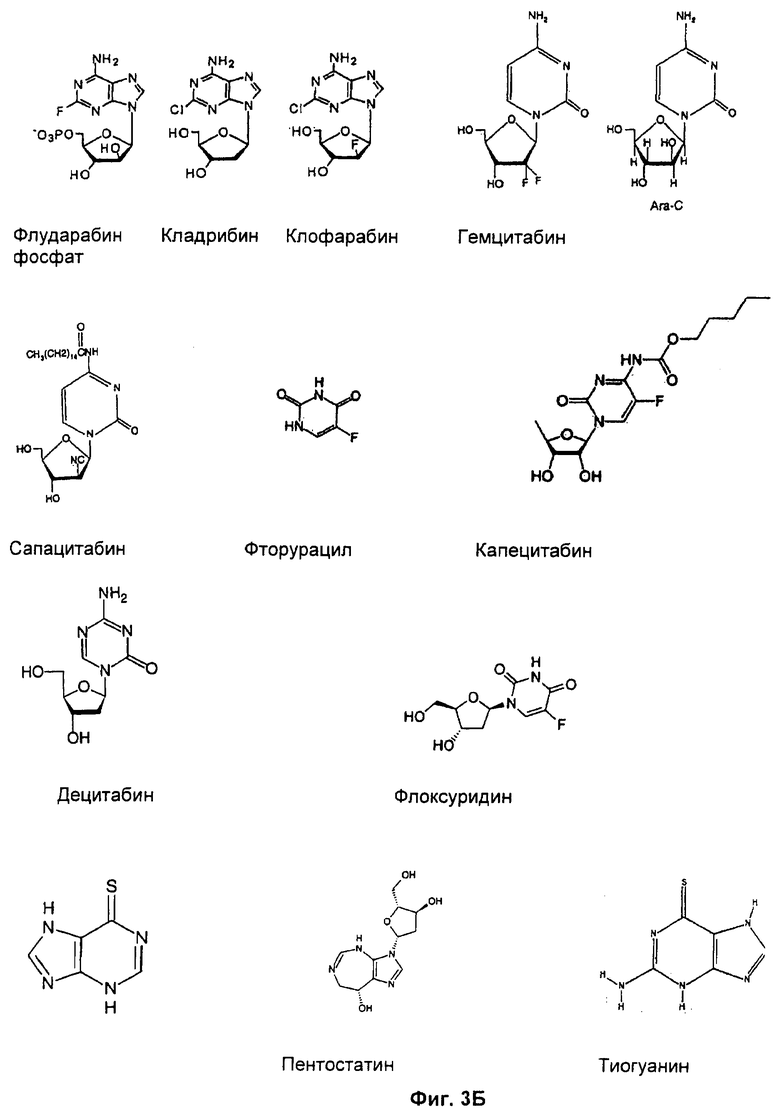
На Фиг.3 показаны структуры (A) ON01910 и (Б) химиотерапевтических агентов, представляющих собой нуклеотидные аналоги, кладрибин, клофарабин, флударабин, меркаптопурин, пентостатин, тиогуанин, капецитабин, цитарабин, децитабин, фторурацил, флоксуридин, сапацитабин или гемцитабин, как указано.
Подробное описание изобретения
Настоящее изобретение основано, по меньшей мере частично, на открытии того, что опухоли, чувствительные к гемцитабину, обладают сниженной экспрессией Plk1, и что гемцитабин-резистентные опухоли поддаются лечению дезинтеграторами митоза/ингибиторами биохимического пути Plk, включающими ON-01910-Na и соединение миРНК, направленной на Plk1 человека. Кроме того, ингибирование Plk1 в гемцитабин-резистентных опухолях придает чувствительность к гемцитабину прежде резистентной опухоли. Эта восприимчивость гемцитабин-резистентных опухолей к уничтожению ингибиторами Plk1 была определена с использованием гемцитабин-резистентных клеточных линий опухолей поджелудочной железы in vitro, гемцитабин-резистентных опухолей поджелудочной железы человека ех vivo и в модели ксенотрансплантатов мышей (то есть in vivo).
ON-01910-Na представляет собой малую молекулу, которая прерывает переход клеточного цикла G2/M и индуцирует задержку опухолевых клеток в митозе, характеризующуюся аномалиями веретена, приводящими к апоптозу. Этот эффект по меньшей мере частично связан с его активностью в качестве ингибитора Plk1. Как продемонстрировано в данной заявке, ON 01910 обладает активностью в моделях in vitro и in vivo гемцитабин-резистентного рака поджелудочной железы.
Термин "подлежащий лечению", "процесс лечения" или "лечение" включает снижение или ослабление по меньшей мере одного симптома, обусловленного или вызванного состоянием, расстройством или заболеванием, подлежащим лечению. Например, лечение может представлять собой уменьшение одного или нескольких симптомов расстройства или полное устранение этого расстройства. Лечение может включать объективный ответ ПО (полный ответ), 40 (частичный ответ) или СЗ (стабильное заболевание), как изложено в приведенной ниже таблице.
Ответ солидных опухолей на лечение может быть охарактеризован, например, с использованием критериев Всемирной организации здравоохранения (ВОЗ) или с использованием руководств по одномерному измерению группы Критериев Оценки Ответа при Солидных Опухолях (RECIST, Responsive Evaluation Criteria in Solid Tumors). Эти критерии изложены в приведенной ниже таблице.
См. также Park et al., Measuring response in solid tumors: Comparison of RECIST and WHO response criteria. Jpn. J. Clin. Oncolo. 33:533-537, 2003, включенный в данную заявку посредством ссылки. Одномерное измерение в критериях RECIST включает измерение только самого длинного диаметра всех целевых повреждений.
Термин "резистентная к лекарственному средству опухоль" или "резистентный к лекарственному средству рак" и тому подобное понимают как опухоль или рак, при котором критерии прогрессирующего заболевания (ПЗ) выполняются в присутствии или при введении лекарственного средства. В культуре резистентную клетку понимают как клетку, которая продолжает расти в присутствии лекарственного средства. Скорость роста составляет по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% относительно необработанной контрольной клетки в культуре. Резистентность к лекарственному средству может представлять собой резистентность к одному конкретному лекарственному средству или резистентность к многим лекарственным средствам, что распространено при опухолях, экспрессирующих ген множественной лекарственной устойчивости (MDR).
"Опухоль, поддающаяся лечению лекарственным средством", или "рак, поддающийся лечению лекарственным средством", и тому подобное понимают как опухоль или рак, при котором критерии ПО, ЧО или СЗ выполняются в присутствии или при введении лекарственного средства. В клеточной культуре чувствительная клетка представляет собой клетку, которая останавливает рост/деление или погибает в ответ на обработку лекарственным средством. Рак, поддающийся лечению, можно также понимать как тип рака, поддающийся лечению, например, тип рака, одобренный для лечения химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, или тип рака, при котором в исследовании была получена польза для лечения такого рака. Например, типы рака, поддающиеся лечению терапевтическим агентом, представляющим собой нуклеотидный аналог, включают, но не ограничены ими, гематологические злокачественные опухоли, такие как лейкоз и лимфома, колоректальный рак, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичника, базально-клеточную карциному, рак мочевого пузыря, рак печени, рак простаты, рак желудка, рак почки, меланому, глиому, рак пищевода, рак шейки матки и миелодиспластические синдромы.
Рак, поддающийся лечению лекарственным средством, может стать раком, резистентным к лекарственному средству, часто в ответ на лечение лекарственным средством.
Термин "субъект" включает млекопитающих, например людей, собак, коров, лошадей, свиней, овец, коз, кошек, мышей, кроликов, крыс и трансгенных животных, отличных от людей. В некоторых воплощениях субъект представляет собой человека, например человека, страдающего раком, имеющего риск заболевания раком или потенциально способного к заболеванию раком. Субъекта-человека могут называть пациентом.
Термин "рак" включает злокачественные заболевания, характеризующиеся нерегулируемым или неконтролируемым клеточным ростом, например, карциномы, саркомы, лейкозы и лимфомы. Рак включает солидные опухоли или несолидные опухоли. Рак включает рак любого органа, включая поджелудочную железу. Термин "рак" включает первичные злокачественные опухоли, например, опухоли, клетки которых не мигрировали в сайты организма субъекта, иные, чем сайт исходной опухоли, и вторичные злокачественные опухоли, например, возникшие в результате метастаза, миграции опухолевых клеток к вторичным сайтам, отличным от сайта исходной опухоли.
Выражение "терапевтически эффективное количество" соединения, как используют в данной заявке, представляет собой количество соединения, необходимое или достаточное для получения результата ПО, ЧО или СЗ при введении субъекту, как описано в данной заявке. Понятно, что терапевтически эффективное количество каждого химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk для применения в комбинации друг с другом может быть недостаточно для эффективности при отдельном применении. Соединения, которые обладают терапевтическим эффектом, можно называть лекарственными средствами или фармацевтическими агентами.
Выражение "синергетическая комбинация" включает комбинации терапевтических агентов, где терапевтический результат введения комбинации лекарственных средств выше, чем аддитивный эффект, который ожидался бы для комбинации этих лекарственных средств. Например, в клетках или опухолях, которые являются устойчивыми к гемцитабину (то есть лечение гемцитабином не индуцирует ПО, ЧО или СЗ, то есть не оказывает эффекта), введение комбинации гемцитабина и дезинтегратора митоза/ингибитора биохимического пути Plk обладает большим терапевтическим эффектом, чем введение одного дезинтегратора митоза/ингибитора биохимического пути Plk.
Выражение "совместное введение" в данной заявке понимают как введение субъекту двух или более чем двух лекарственных средств для лечения одного заболевания или состояния, такого как рак, так что два лекарственных средства присутствуют и/или обладают активностью у субъекта одновременно. Совместное введение понимают как препарат в виде смеси лекарственных средств, которые нужно вводить вместе, препарат или композицию лекарственных средств в специфичных носителях или в специфичных концентрациях для облегчения смешивания и/или последовательного введения. Лекарственные средства могут быть упакованы вместе в одном и том же флаконе или бутылочке; или в отдельных бутылочках или флаконах в одном контейнере (например, коробке). Лекарственные средства не обязательно готовить особым образом для введения вместе. Понятно, что различные типы лекарственных средств обладают различными фармакокинетическими и фармакодинамическими свойствами, так что режимы введения могут существенно варьировать. Поэтому одновременное введение не требуется. Совместное введение химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk не препятствует введению других химиотерапевтических агентов или других лекарственных средств. Примерные схемы для совместного введения представлены ниже.
Выражение "фармацевтически приемлемый носитель" известно в данной области техники и включает фармацевтически приемлемый материал, композицию или носитель, пригодный для введения соединений, используемых в способах, описанных в данной заявке, субъектам, например, млекопитающим. Носители включают жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, вовлеченный в перенос или транспортировку целевого агента из одного органа или части тела в другой орган или часть тела. Каждый носитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами композиции и безвредности для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и целлюлозы ацетат; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический физиологический раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы и другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях.
Соединения по изобретению
Предпочтительные соединения и способы по изобретению включают применение ингибитора Рlk1 ON-01910-Na ((E)-2,4,6-триметоксистирил-3-(карбоксиметиламино)-4-метоксибензилсульфона (Фиг.3А) и гемцитабина (4-амино-1-[3,3-дифтор-4-гидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил]-1Н-пиримидин-2-она), также известного как Gemzar® (Фиг.3Б).
Термин "дезинтегратор митоза/ингибитор биохимического пути Plk" и тому подобное, как используют в данной заявке, включает любую композицию, которая ингибирует киназную активность Plk (например, Plk1, Plk2, Plk3 или Plk4) или активность Plk в клетке, например, в результате снижения экспрессии Plk, либо ингибирует активность Plk непосредственно или посредством ингибирования компонента биохимического пути передачи сигнала Plk, в частности, Plk1; и обладает активностью в качестве дезинтегратора митоза. В предпочтительном воплощении ингибитор преимущественно ингибирует активность Plk по сравнению с активностью киназ, не представляющих собой Plk. Ингибитор Plk предпочтительно обладает активностью в 2 раза, в 5 раз, в 10 раз или в 20 раз выше при ингибировании киназы Plk по сравнению с ингибированием киназ, не представляющих собой Plk. Ингибитор Plk может быть специфичен для одной или более чем одной изоформы Plk. Альтернативно, активность ингибитора Plk можно измерить путем сравнения киназной активности Plk в присутствии и в отсутствие ингибитора. Ингибитор Plk ингибирует активность киназы Plk по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90% по сравнению с необработанным контролем.
Ингибиторы Plk могут ингибировать активность Plk в клетке посредством ингибирования экспрессии Plk в клетке, например, используя агент, представляющий собой антисмысловую РНК, направленную на Plk или миРНК, направленную на Plk соответствующего вида (например, Plk1 человека имеет №NM_005030 в GenBank, версия 3, обновлена 6 апреля 2008; Plk2 человека имеет №NM_006622 в GenBank, версия 2, обновлена 10 февраля 2008; Plk3 человека имеет №NM004073 в GenBank, версия 2, обновлена 11 февраля 2008; Plk4 человека имеет №Y13115 в GenBank, версия 1, обновлена 17 октября 2006; все номера GenBank включены в данную заявку посредством ссылки). Способ конструирования, синтеза, тестирования и введения антисмысловых олигонуклеотидов и соединений миРНК известны в данной области техники. Например, см. публикации патентов США №№20050107328 и 20070265438, обе из которых включены в данную заявку посредством ссылки.
Активность Plk1 в определенном количестве клеток или клеточного экстракта, обработанных соединением для снижения или ингибирования экспрессии Plk, сравнивают с таким же определенным количеством необработанных клеток или клеточного экстракта. Ингибирование можно измерить, используя любой стандартный анализ киназы, такой как раскрыт здесь или, например, в публикации РСТ WO 03/072062, включенной в данную заявку посредством ссылки. Дезинтеграторы митоза и ингибиторы Plk по изобретению также прерывают митоз, что можно легко наблюдать с помощью микроскопии, флуоресцентной сортировки клеток или другими способами.
Дезинтеграторы митоза предотвращают завершение правильного митоза, например, посредством прерывания распределения центросом, невозможностью цитокинеза, аномальных чисел хромосом и необратимых блоков в контрольных точках клеточного цикла. Дезинтеграторы митоза для применения в способе по изобретению предотвращают завершение митоза по меньшей мере в 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или большем числе клеток по сравнению с необработанным контролем.
В различных воплощениях изобретения дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой малую молекулу. Как используют в данной заявке, термин "малая молекула" относится к органическим соединениям, либо встречающимся в природе, либо искусственно созданным (например, путем химического синтеза), которые имеют относительно низкую молекулярную массу (например, менее чем примерно 7500, менее чем примерно 5000, менее чем примерно 1000 единиц молекулярной массы или менее чем примерно 500 единиц молекулярной массы), и которые не являются белками, полипептидами или нуклеиновыми кислотами. Типично малые молекулы имеют молекулярную массу менее чем примерно 1500 г/моль. Также малые молекулы типично имеют множественные углерод-углеродные связи. В одном воплощении малые молекулы не содержат исключительно пептидные (амидные) связи. В другом воплощении малые молекулы являются не олигомерными. Примерные низкомолекулярные соединения включают, но не ограничены ими, пептидомиметики, малые органические молекулы (например, Cane et al. 1998, Science 282:63; включено в данную заявку посредством ссылки) и библиотеки экстрактов натуральных продуктов. В другом воплощении эти соединения представляют собой малые органические непептидные соединения. В следующем воплощении малая молекула является не биосинтетической. Например, сама малая молекула предпочтительно не является продуктом транскрипции или трансляции.
В различных воплощениях изобретения дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой терапевтическое средство на основе нуклеиновой кислоты. Как используют в данной заявке, термин "терапевтическое средство на основе нуклеиновой кислоты" и тому подобное относится к любому соединению на основе нуклеиновой кислоты, которое содержит нуклеотиды и обладает желаемым эффектом на ген-мишень. Терапевтические средства на основе нуклеиновой кислоты могут быть одно-, дву- или многонитевыми и могут содержать модифицированные или немодифицированные нуклеотиды, либо отличные от нуклеотидов соединения, либо их различные смеси и комбинации. Примеры терапевтических средств на основе нуклеиновой кислоты по изобретению включают, но не ограничены ими, антисмысловые нуклеиновые кислоты, днРНК (двунитевая РНК), миРНК и ферментативные соединения нуклеиновых кислот.
Ингибиторы Plk1 могут включать любое из ряда производных ON-01910-Na, которое ингибирует активность Plk1, преимущественно то, которое специфично ингибирует активность Plk1. Например, ингибиторы Plk1 включают ON01910-Na и его производные, которые понимают как любое соединение формулы (I):
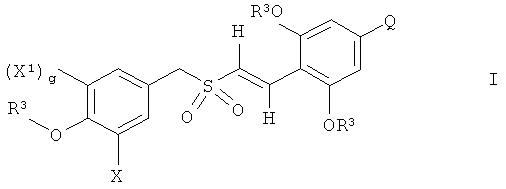
где X выбран из группы, состоящей из (i) и (ii) ниже:
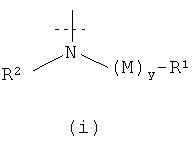
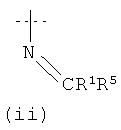
X1 выбран из группы, состоящей из (i), (ii) и (iii) ниже:
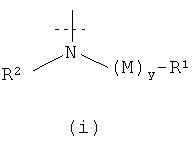
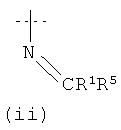
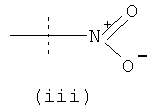
где X1 возможно защищен одной или более чем одной химической защитной группой;
g равно 0 или;
каждый M представляет собой двухвалентную соединительную группу, независимо выбранную из группы, состоящей из группы -(C1-C6-алкилен-, -(CH2)a-V-(CH2)b-, -(CH2)d-W-(CH2)e-и-Z-;
каждый у независимо выбран из группы, состоящей из 0 и 1;
каждый V независимо выбран из группы, состоящей из арилена, гетероарилена, -C(=O)-, -C(=S)-, -S(=O)-, -SO2-, -C(=O)O-; группы -C(=O)(C1-C6)перфторалкилен-, -C(=O)NR4-, -C(=S)NR4- и -SO2NR4-;
каждый W независимо выбран из группы, состоящей из -NR4-, -O- и -S-;
каждый a независимо выбран из группы, состоящей из 0, 1, 2 и 3;
каждый b независимо выбран из группы, состоящей из 0, 1, 2 и 3;
каждый d независимо выбран из группы, состоящей из 1, 2 и 3;
каждый e независимо выбран из группы, состоящей из 0, 1, 2 и 3;
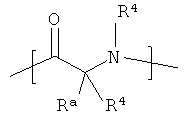
-Z - представляет собой
где абсолютной стереохимией -Z- является D или L или смесь D и L;
каждый Ra независимо выбран из группы, состоящей из -Р, -(C1-C6)алкила, -(CH2)3-NH-C(NH2)(=NH), -CH2C(=O)NH2, -СН2СOOH, -CH2SH, -(CH2)2C(=O)-NH2, (СН2)2СОOH, группы CH2-(2-имидазолил), -CH(CH3)-CH2-CH3, -СН2СН(СН3)2, -(CH2)4-NH2, -(CH2)2-S-CH3, фенила, СН2-фенила, -СН2-OH, -СН(OH)-СН3, групп -СН2-(3-индолил), -СН2-(4-гидроксифенил), -СН(СН3)2 и -СН2-СН3; и включает соединения, где Ra и R1 объединены с образованием 5-, 6- или 7-членного гетероциклического кольца;
каждый R1 независимо выбран из группы, состоящей из -H, незамещенного арила, замещенного арила, замещенного гетероцикла, незамещенного гетероцикла, -CO2R5 -C(=O)NR4 2, -CR4R6R7, -C(=NH)-NR4 2, -(C1-С6)перфторалкила, -CF2Cl, -P(=O)(OR4)2, -OP(=O)(OR4)2 и одновалентной пептидильной группировки с молекулярной массой менее 1000; при условии, что когда у равно 0, и R1 представляет собой -CO2R5, R5 не представляет собой -H;
каждый R2 независимо выбран из группы, состоящей из -H, -(C1-C6)алкила и арил(C1-C3)алкила, где -R2 и -(M)y-R1 могут быть, возможно, связаны ковалентно с образованием 5-, 6- или 7-членного замещенного или незамещенного гетероцикла;
каждый R3 независимо выбран из -(C1-C6)алкила;
каждый R4 независимо выбран из группы, состоящей из -H и -(C1-C6)алкила;
каждый R5 независимо выбран из группы, состоящей из -H, -(C1-C6)алкила и-(C1-C6)ацила;
каждый R6 независимо выбран из группы, состоящей из -H, -(C1-C6)алкила, -CO2R5, -C(=O)R7, -OR5, -OC(=O)(CH2)2CO2R5, -SR4, гуанидина, -NR4 2, -NR4 3 +, -N+(CH2CH2OR5)3, фенила, замещенного фенила, гетероцикла, замещенного гетероцикла и галогена;
каждый R7 независимо выбран из группы, состоящей из -Ra, галогена, -NR4 2 и гетероциклов, содержащих два атома азота; и
Q выбран из группы, состоящей из -H, -(C1-C6)алкокси, галогена, -(C1-C6)алкила и -NR4 2;
где заместители для замещенных арильных и замещенных гетероциклических групп, включающих или включенных в R1, R2, Ra, R и R7, независимо выбраны из группы, состоящей из галогена, -(C1-C6)алкила, -NO2, -C=N, -CO2R5, -C(=O)O(C1-C3)алкила, -OR5, группы -(C2-C6)алкилен-OH, фосфонато, -NR4 2, -МНС(=O)(C1-C6)алкила, сульфанила, -OC(=O)(C1-C3)алкила, группы -O(C2-C6)алкилен-N(C1-C6)алкил)2 и -CF3; при условии, что:
(1) когда R1 представляет собой одновалентную пептидильную группировку молекулярной массы менее 1000, и V представляет собой -C(=O)-, -C(=S)-, -S(=O)- или -SO2-, и b равно 0;
то указанная пептидильная группировка связана с M через амино-конец пептидильной группировки или через аминогруппу боковой цепи с образованием амида, тиоамида, сульфинамида или сульфонамида соответственно;
(2) когда R1 представляет собой одновалентную пептидильную группировку молекулярной массы менее 1000, и V представляет собой -C(=O)NR4 или -SO2NR4, и b равно 0,
то указанная пептидильная группировка связана с M через карбокси-конец пептидильной группировки или через карбоксильную группу боковой цепи с образованием имида или сульфонамида соответственно; и
(3) когда R1 представляет собой одновалентную пептидильную группировку молекулярной массы менее 1000, и W представляет собой -NR4-, -S- или -O-, и а равно 0,
то указанная пептидильная группировка связана с M через карбокси-конец пептидильной группировки или через карбоксильную группу боковой цепи с образованием карбоксамида, эфира карботиокислоты или эфира карбоновой кислоты соответственно;
или соль такого соединения.
Другие производные ON01910-Na, способы синтеза и активность соединений можно найти в публикации PCT WO 03/072062.
При использовании в данной заявке "химиотерапевтический агент, представляющий собой нуклеотидный аналог" представляет собой пуриновый аналог, такой как кладрибин, клофарабин, флударабин, меркаптопурин, пентостатин, тиогуанин, капецитабин, цитарабин, децитабин, фторурацил, флоксуридин, сапацитабин и гемцитабин. Такие соединения структурно подобны, как показано на фиг.3, и типично имеют атом азота, присоединенный к сахарной группе, и действуют по меньшей мере посредством прерывания синтеза ДНК. Такие соединения известны в данной области техники.
Дозировка и композиция
Соединения по изобретению можно вводить местно, энтерально или парентерально. Местное введение, например, включает, но не ограничено ими, накожное введение, посредством клизмы, глазных капель, ушных капель, интраназальное и вагинальное введение. Энтеральное введение включает введение, например, через рот (перорально), с помощью желудочной питательной трубки, дуоденальной питательной трубки или гастростомии, а также ректальное с помощью суппозитория или клизмы. Парентеральное введение включает, но не ограничено ими, внутривенное, внутриартериальное, внутримышечное, внутрисердечное, подкожное, внутрикостную инфузию (в костный мозг), внутрикожное, подоболочечное и внутрибрюшинное.
В предпочтительном воплощении соединения по изобретению вводят внутривенно.
Соединения, используемые в способах по настоящему изобретению, можно вводить перорально, используя любую фармацевтически приемлемую лекарственную форму, известную в данной области техники для такого введения. Соединение можно поставлять в твердых лекарственных формах, таких как сухие порошки, гранулы, таблетки или капсулы, или в жидких лекарственных формах, таких как сиропы или водные суспензии. Соединение можно вводить самостоятельно, но обычно его вводят с фармацевтическим носителем. Важным научным трудом в отношении лекарственных форм является Remington's Pharmaceutical Sciences, Mack Publishing.
Соединения, используемые в способах по настоящему изобретению, можно вводить в таких пероральных лекарственных формах, как таблетки, капсулы (каждая из которых включает препараты пролонгированного высвобождения или регулируемого по времени высвобождения), пилюли, порошки, гранулы, эликсиры, настойки, суспензии, сиропы и эмульсии. Подобным образом, их можно также вводить во внутривенной (болюсной или инфузионной), внутрибрюшинной, подкожной или внутримышечной форме, где все используемые лекарственные формы хорошо известны обычным специалистам в данной области техники.
Соединения, используемые в способах по настоящему изобретению, можно вводить с помощью любых средств, которые обеспечивают контакт соединения с сайтом действия соединения в организме хозяина, такого как человек или млекопитающее. Их можно вводить одни или с фармацевтическим носителем, выбранным на основании избранного пути введения и стандартной фармацевтической практики.
Схема дозировки для соединений, определенная настоящим изобретением, конечно, варьирует в зависимости от известных факторов, таких как фармакодинамические характеристики конкретного агента и его режим и путь введения; вид, возраст, пол, состояние здоровья, медицинское состояние и масса тела реципиента; природа и степень симптомов; вид сопутствующего лечения; частота лечения; путь введения, функционирование почек и печени пациента и желаемый эффект. Обычный врач или ветеринар может легко определить эффективное количество соединения для введения субъекту.
Соединения, используемые в способах по настоящему изобретению, можно вводить в интраназальной форме посредством местного применения соответствующих интраназальных носителей, или чрескожными путями, используя формы чрескожных пластырей, хорошо известные обычным специалистам в данной области техники.
В способах по настоящему изобретению соединения, описанные в данной заявке, можно вводить в смеси с подходящими фармацевтическими разбавителями, эксципиентами или носителями (все вместе называемые в данной заявке материалами-носителями), соответствующим образом выбранными в соответствии с предназначенной формой введения, то есть пероральными таблетками, капсулами, эликсирами, сиропами и тому подобным, и в соответствии с общепринятой фармацевтической практикой.
Например, для перорального введения в форме таблетки или капсулы активный компонент лекарственного средства можно объединять с пероральным, нетоксичным, фармацевтически приемлемым инертным носителем, таким как лактоза, крахмал, сахароза, глюкоза, метилцеллюлоза, стеарат магния, двузамещенный фосфат кальция, сульфат кальция, маннит, сорбит и тому подобное; для перорального введения в жидкой форме пероральные лекарственные ингредиенты можно объединять с пероральным, нетоксичным, фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и тому подобное. Кроме того, когда это желательно или необходимо, можно также включать в смесь подходящие связующие вещества, смазывающие агенты, разрыхлители и красители. Подходящие связующие вещества включают крахмал, желатин, натуральные сахара, такие как глюкоза или бета-лактоза, кукурузные подсластители, натуральные и синтетические смолы, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски и тому подобное. Смазывающие агенты, используемые в этих лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и тому подобное. Разрыхлители включают без ограничения крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и тому подобное.
Соединения, используемые в способах по настоящему изобретению, можно также вводить в форме систем липосомной доставки, таких как малые однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из ряда фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины.
Соединения, используемые в способах по настоящему изобретению, можно также сочетать с растворимыми полимерами в качестве направляющих носителей лекарственного средства. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный остатками пальмитоила. Более того, соединения, определенные настоящим изобретением, можно сочетать с классом биоразлагаемых полимеров, полезных при достижении контролируемого высвобождения лекарственного средства, например, полимером молочной кислоты, полимером гликолевой кислоты, сополимерами молочной и гликолевой кислоты, полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоацилатами и сшитыми или алифатическими блок-сополимерами гидрогелей.
Желатиновые капсулы могут содержать активный ингредиент и порошкообразные носители, такие как лактоза, крахмал, производные целлюлозы, стеарат магния, стеариновая кислота и тому подобное. Подобные разбавители можно использовать для получения прессованных таблеток. Как таблетки, так и капсулы можно готовить в виде препаратов пролонгированного высвобождения для получения непрерывного высвобождения лекарственного средства в течение периода в несколько часов. Прессованные таблетки могут быть покрыты сахаром или пленочным покрытием для маскировки какого-либо неблагоприятного вкуса и для защиты таблетки от воздействия атмосферы, либо энтеросолюбильным покрытием для избирательного разрушения в желудочно-кишечном тракте. Жидкие лекарственные формы для перорального введения могут содержать красители и корригенты для повышения приемлемости для пациента. Как правило, вода, подходящее масло, физиологический раствор, водная декстроза (глюкоза) и родственные сахарные растворы и гликоли, такие как пропиленгликоль или полиэтиленгликоли, являются подходящими носителями для парентеральных растворов.
Растворы для парентерального введения предпочтительно содержат водорастворимую соль активного ингредиента, подходящие стабилизирующие агенты и при необходимости буферные вещества. Антиоксиданты, такие как бисульфит натрия, сульфит натрия или аскорбиновая кислота, либо по отдельности, либо комбинированные, являются подходящими стабилизирующими агентами. Также используют лимонную кислоту или ее соли и натриевую соль ЭДТА. Кроме того, парентеральные растворы могут содержать консерванты, такие как бензалкония хлорид, метил- или пропилпарабен и хлорбутанол. Соединения, вводимые внутривенно, часто доставляют в нормальном физиологическом растворе.
Подходящие фармацевтические носители описаны в Remington's Pharmaceutical Sciences, Mack Publishing Company, стандартном справочнике в данной области техники. Включение в соответствующий носитель находится в пределах компетенции специалистов в данной области техники.
Дозировка химиотерапевтического агента, представляющего собой нуклеотидный аналог
Схемы дозировки химиотерапевтических агентов, представляющих собой нуклеотидные аналоги, известны в данной области техники и варьируют в зависимости от тяжести и типа рака, подлежащего лечению. Некоторые примеры химиотерапевтических схем приведены в таблице ниже. Все перечисленные ссылки включены в данную заявку посредством ссылки.
Схема
3-4 мг/м2/сутки, сутки 1-5 каждые 4 недели
Дозировка гемцитабина
Установлен ряд схем дозирования гемцитабина для лечения различных видов рака с использованием одного гемцитабина или в комбинации с другими агентами. Например, дозы в диапазоне от 10 мг/м2/неделя до 1200 мг/м2/неделя в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами использовали в исследованиях для лечения рака желчных путей. Частота и число доз на цикл варьировали (см., например, Pastorelli et al., Ann. Oncol.17: v\53-\57, 2006, включенную в данную заявку посредством ссылки). Диапазоны доз от 800 мг/м2/неделя до 1000 мг/м2/неделя вводили в исследованиях для лечения стадии IIIB или IV немелкоклеточного рака легкого (см., например, Rocha Lima et al., Ann. Oncol. 15:410-418, 2004, включенную в данную заявку посредством ссылки). Подобные дозировки вводили в исследованиях для лечения прогрессирующей переходно-клеточной карциномы уротелия, рецидивирующей ходжкинской лимфомы, рака поджелудочной железы и рака почки.
Примеры опубликованных схем дозировки показаны в приведенных ниже таблицах.
Введение единственного агента при прогрессирующем раке желчных путей воспроизведено частично из Pastorelli et al., 2006.
Комбинированная терапия доксетакселом (Dox) с гемцитабином (gem) при немелкоклеточном раке легкого, частично воспроизведено из Rocha Lima et al., 2004.
В способах по изобретению гемцитабин можно вводить в дозе от примерно 500 мг/м2/неделя до примерно 1500 мг/м2/неделя, предпочтительно от примерно 700 мг/м2/неделя до примерно 1300 мг/м2/неделя, предпочтительно от примерно 800 мг/м2/неделя до примерно 1200 мг/м2/неделя. Возможны более высокие и более низкие скорости дозирования. Дозу можно вводить в виде однократной дозы в неделю или можно делить на многократные дозы. Интенсивность дозы (время, за которое вводят дозу) может варьировать. Частота дозирования может составлять 1, 2, 3 или большее число раз на цикл. Цикл может составлять 1, 2, 3, 4, 5, 6, 7, 8 или большее число недель. Число циклов может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или большее число циклов, либо до достижения желаемого терапевтического результата, либо до ограничения дозирования побочными эффектами.
Дозировка ON01910
ON01910-Na исследован в клинических испытаниях с использованием различных дозировок и режимов введения. В одном исследовании диапазоны дозировки составили 160-8740 мг/неделя, где дозу делили на две дозы в неделю, вводимые в течение трех последовательных недель каждые четыре недели (2-часовая инфузия 2/неделя в течение 3 последовательных недель каждые 4 недели. Исследуемый диапазон дозы составлял 80 мг - 4370 мг. Доза для данного режима, рекомендованная для дальнейшего испытания, составляет 3120 мг). Принимая площадь поверхности тела примерно за 1,8 м2, доза составляет от примерно 90 мг/м2/неделя до примерно 4850 мг/м2/неделя.
В другом исследовании ON01910-Na вводили в виде 24-часовой инфузии в режиме недельной протяженности. Диапазон дозы составлял 250 мг/м2/неделя - 2750 мг/м2/неделя.
В другом исследовании ON01910-Na вводили в виде 72-часовой инфузии каждые 2 недели. Диапазон дозы составлял 50 мг/м2/сутки - 400 мг/м2/сутки (то есть от 75 мг/м2/неделя до 600 мг/м2/неделя).
Профиль безопасности ON01910-Na определяли в двух стандартных токсикологических исследованиях на животных, используя крыс и собак. У крыс однократные дозы 300 и 600 мг/м2 не давали токсичности, а 1200 мг/м2 обладала только легкой токсичностью (аногенитальное окрашивание). Когда дозу увеличивали до 3000 мг/м2, 9 из 11 животных погибали. При повторном дозировании на сутки 7 (1200 мг/м2) 2 из 13 крыс погибали за период дозирования. При повторном дозировании на 28 сутки с использованием групп из 12 самцов крыс и 12 самок крыс фиксированные суточные дозы 180 мг/м2 и 450 мг/м2 были переносимыми. Доза 900 мг/м2, даваемая дважды в неделю в течение 4 недель, была хорошо переносимой. У собак острые однократные дозы 2000 и 4000 мг/м2 вызывали желудочно-кишечные эффекты (диарею, метеоризм) с другими признаками дискомфорта во время дозирования (борьба, подача голосовых сигналов). При повторном внутривенном дозировании на сутки 7 доза 1000 мг/м2 ежесуточно хорошо переносилась собаками. При повторном внутривенном дозировании на сутки 28 ежесуточные внутривенные дозы 200 и 500 мг/м2 были хорошо переносимыми в течение 28 суток в группах, состоящих из трех самцов и трех самок собак породы бигль. Группа высокой дозы, начиная с 1000 мг/м2, не показывала признаков токсичности после 8 суток. На основании исследований с увеличением дозы самая высокая нетяжелая токсичная доза для данного режима дозировки была оценена как примерно 1500-2000 мг/м2 в течение 28 суток. Отдельная группа из 6 собак, обработанных в дозе 1000 мг/м2 дважды в неделю в течение 4 недель, хорошо переносила соединение без клинических проблем. В этих токсикологических исследованиях не было данных о какой-либо миелотоксичности, невропатии или кардиотоксичности. Результаты суммированы в приведенной ниже таблице (воспроизведено из Gumlreddy et al., Cancer Cell, 7:275-286, 2005, включенной в данную заявку посредством ссылки).
В способах по изобретению ON01910-Na и его производные можно вводить в дозе от примерно 50 мг/м2/неделя до примерно 5000 мг/м2/неделя или от примерно 90 мг/м2/неделя до примерно 4850 мг/м2/неделя. Возможны более высокие и более низкие уровни дозы. Дозу можно вводить в виде однократной дозы в неделю или можно делить ее на многократные дозы. Интенсивность дозы (время, за которое вводят дозу) можно варьировать. Частота дозирования может составлять 1, 2, 3 или большее число раз на цикл. Цикл может составлять 1, 2, 3, 4, 5, 6, 7, 8 или большее число недель. Число циклов может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или большее число циклов, либо до достижения желаемого терапевтического результата, либо до ограничения дозирования побочными эффектами.
Как показано выше в таблице от Rocha Lima, режимы и дозировки для введения гемцитабина в виде единственного агента или в комбинированном химиотерапевтическом режиме являются сходными. Любую из схем, представленных в таблице выше или в данной области техники для дозирования гемцитабина, можно комбинировать со схемами дозирования, изложенными выше для ON01910-Na или его производных. Понятно, что врач или другой практикующий специалист в области онкологии может варьировать схемы дозирования для соответствующих индивидуумов, и что возможны другие схемы дозирования.
Понятно, что конкретные дозировки и периоды введения модифицируют в зависимости от химиотерапевтических агентов в соответствии с нежелательными побочными эффектами (например, нейтропенией, инфекцией, тошнотой), которые обычно встречаются при введении химиотерапевтических агентов.
Приведенные здесь диапазоны понимают как условное обозначение для всех значений в пределах диапазона. Например, диапазон от 1 до 50 понимают как включающий любое число, комбинацию чисел или субдиапазон из группы, состоящей из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50.
Если конкретно не указано иное или не очевидно из контекста, как используют в данной заявке, термин "или" понимают как включающий.
Если конкретно не указано иное или не очевидно из контекста, как используют в данной заявке, термины единственного числа понимают как единственное или множественное.
Изложение перечня химических групп в любом определении переменной в данной заявке включает определения этой переменной как любой одной группы или комбинации перечисленных групп. Изложение воплощения для переменной или аспекта в данной заявке включает это воплощение в виде любого одного воплощения или в комбинации с любыми другими воплощениями или их частями.
Все ссылки, патенты, заявки на патенты и номера доступа, как дата подачи приоритетной заявки, на которые здесь ссылаются, в частности включены посредством ссылки.
Далее изобретение проиллюстрировано приведенными ниже примерами, которые не следует рассматривать как ограничивающие.
ПРИМЕРЫ
Материалы и методы
Анализ пролиферации in vitro
Гемцитабин-резистентные опухолевые клеточные линии поджелудочной железы человека 813, 1005, МР2 (имеющиеся в продаже от АТСС) и E3JD13, XPa3 и XPa4 (полученные от низких пассажей опухолей в Университете Джонса Хопкинса) выращивали в стандартных условиях культивирования в среде RPMI-1640 с 10% фетальной бычьей сывороткой и 1% пенициллин/стрептомицин.
миРНК Plk1 и реагент трансфекции (Dharmacon RNA technologies, Lafayette, СО) оптимизировали в 24-луночных планшетах для клеточных культур, где в каждую лунку добавляли 30000 клеток в 500 мкл культуральной среды и выращивали в течение ночи при 37°C. Каждый планшет содержал лунки для одной среды без антибиотика, лунки для 0,2%, 0,4% и 0,6% реагента трансфекции (РТ) до конечного объема среды без антибиотика для проверки токсичности и лунки для варьирующих количеств РТ и 100 нМ и 200 нМ концентраций миРНК в среде без антибиотика. Условия тестировали для 24 и 48 часов. Клетки собирали буфером RLT (Qiagen Valencia, CA). После оптимизации условий ингибирования Plk1 миРНК в шести клеточных линиях оптимальная концентрация РТ, миРНК и время составляли 0,4%, 200 нМ и 48 часов соответственно.
Суммарную РНК экстрагировали из осадков клеток (и опухолей), используя набор RNeasy™ Mini Kit (Qiagen, Valencia, СА). кДНК синтезировали, используя набор для синтеза iScript cDNA (Bio-Rad, Hercules, СА), следуя инструкциям изготовителя. Относительное количественное определение мРНК Plk1 и убиквитина С (UBC, используемый как ген домашнего хозяйства) было достигнуто с использованием системы обнаружения ПЦР в реальном времени iCycler iQ (Bio-Rad), используя зонды ABI Taqman (Foster City, CA). Эксперименты повторяли дважды, и образцы ставили в четырех повторах.
Лекарственную чувствительность in vitro к гемцитабину, ON 01910.Na и комбинации обоих лекарственных средств (все при концентрациях 1 мкМ в течение 72 часов) оценивали с помощью 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ; Sigma, St Louis, MO). Для исследований эффективности на основе МТТ после миРНК клетки высевали в 96-луночные планшеты, трансфицировали в течение 48 часов в вышеописанных условиях, а затем подвергали воздействию либо носителя, либо гемцитабина при концентрации 1 мкМ в течение 72 часов. Каждый эксперимент проводили в шести повторах для каждой концентрации лекарственного средства и проводили независимо по меньшей мере 3 раза.
Прямой ксенотрансплантат, полученный от рака поджелудочной железы
Резецированные аденокарциномы поджелудочной железы стандартно имплантируют бестимусным мышам в Медицинском Институте Джона Хопкинса в качестве способа получения обогащенных популяций опухолевых клеток в соответствии с протоколом, одобренным IRB (Международным реестром биологической безопасности), из остаточных раковых опухолей поджелудочной железы. Кратко, образцы опухоли от резекции Випла делили на кусочки по 2-3 мм3 в среде RPMI с антибиотиком. Отбирали кусочки ткани, не являющейся некротической, и погружали в Матригель. Под анестезией изофлураном опухоли имплантировали пяти-шести-недельным самкам бестимусных мышей (nu/nu), которых покупали у фирмы Harlan (Harlan Laboratories, Washington, DC).
Мышей, несущих опухоли, делили на четыре группы (n=8-10 опухолей на группу). Мышей обрабатывали гемцитабином 100 мг/кг, 2 раза/неделя в течение 4 недель или ON-01910.Na 250 мг/кг/сутки в течение 4 недель или их комбинацией. Размер опухоли определяли, используя циркуль, каждые четвертые сутки в ходе эксперимента.
На сутки 28 животных подвергали эвтаназии, и опухоли извлекали для анализа экспрессии Plk1 с помощью ОТ-ПЦР, используя стандартные протоколы. Уровни экспрессии Plk1 выражали относительно контроля, не обработанного лекарством.
Лекарственные средства
Гемцитабин (Eli Lilly, Indianapolis, IN) растворяли в физиологическом растворе. Лекарственное средство было свежеприготовленным, и его использовали в инъекционном объеме 0,2 мл/20 г массы тела.
ON-01910-Na растворяли в физиологическом растворе. Лекарственное средство было свежеприготовленным, и его использовали в инъекционном объеме 0,2 мл/20 г массы тела.
Относительное ингибирование опухолевого роста
Относительное ингибирование опухолевого роста (TGI) вычисляли как TGI=(Ti-T0/Ci-C0), где Ti и Ci представляют собой размер опухоли в обработанной и контрольной группе на сутки 28 соответственно; T0 и C0 представляют собой размер опухоли в обработанной и контрольной группе на сутки 1 соответственно. Эксперименты заканчивали на сутки 28. Авторы изобретения определяли ксенотрансплантат как чувствительный или резистентный к гемцитабину при TGI ни более ни менее -30% и TGI более -30%, соответственно, согласно критериям RECIST.
Пример 1 - Ингибирование Plk1 преодолевает резистентность к гемцитабину в опухолевых клеточных линиях поджелудочной железы
Шесть гемцитабин-резистентных клеточных линий выращивали в культуре и обрабатывали только гемцитабином, миРНК, направленной на Plk1, или их комбинацией в течение 24 часов. Клетки выращивали в течение трех дополнительных суток в среде. Определяли процент клеточного роста относительно контроля.
Подобным образом, те же клеточные линии выращивали в присутствии одного гемцитабина, одного ON-01910-Na или их комбинации в течение трех суток. Определяли процент клеточного роста относительно контроля.
Рост был ингибирован миРНК Plk1 в трех из шести клеточных линий (фиг.1А) и ON-01910-Na (фиг.1Б) в двух из шести клеточных линий относительно необработанного контроля. Обработка ингибитором Plk1 в комбинации с гемцитабином сильно ингибировала рост в большинстве клеточных линий. Комбинация ON-01910-Na и гемцитабина обладала по меньшей мере значительным аддитивным или синергическим эффектом при ингибировании клеточного роста в трех клеточных линиях, 1005, XPa3 и XPa4. Эти данные демонстрируют, что ингибитор Рlk1 может быть эффективен при уничтожении гемцитабин-резистентных клеток, и что ингибиторы Plk1 могут сенсибилизировать гемцитабин-резистентные клетки к уничтожению гемцитабином.
Пример 2 - Ингибирование Plk1 преодолевает резистентность к гемцитабину в опухолях поджелудочной железы in vivo
Опухоли поджелудочной железы имплантировали мышам, как подробно описано выше. Мышей обрабатывали только гемцитабином, только ON-01910-Na или их комбинацией, как указано. Размер опухоли измеряли через интервалы в четверо суток.
Три опухоли поджелудочной железы демонстрировали различные профили чувствительности к каждому из гемцитабина и ON-01910-Na (фиг.2А). Опухоль 41 была чувствительна к обработке как гемцитабином, так и ON-01910-Na по существу при отсутствии опухолевого роста независимо от обработки. Опухоль JH03 была чувствительна к обработке только гемцитабином, но не ON-01910-Na. Однако комбинация гемцитабина и ON-01910-Na была более эффективна, чем один гемцитабин, к концу эксперимента на сутки 28. Опухоль 28 была резистентной к гемцитабину, но чувствительной к ON-01910-Na. Примечательно, что комбинация гемцитабина и ON-01910-Na была значительно более эффективна, чем любое из этих соединений отдельно.
На сутки 28 опухоли собирали и анализировали на экспрессию Plk1 (фиг.2Б). Как показано, опухоль JH03, которая имела самую низкую экспрессию Plk1 после воздействия гемцитабина, была наиболее чувствительна к обработке гемцитабином.
Эти данные демонстрируют, что ON-01910-Na может индуцировать сенсибилизацию к гемцитабину в гемцитабин-резистентных опухолях поджелудочной железы.
Пример 3 - Лечение субъекта, страдающего раком, поддающимся лечению химиотерапевтическим агентом, представляющим собой нуклеотидный аналог
У субъекта диагностирован прогрессирующий рак желчных протоков, поддающийся лечению гемцитабином. Проводят операцию для уменьшения опухолевой массы. Начинают химиотерапию для уменьшения и лечения метастатического рака и какого-либо остаточного рака в первичном сайте. Гемцитабин вводят субъекту при 1000 мг/м2 на сутки 1, 8 и 15 каждые 4 недели в течение двух циклов. В начале третьего цикла ON01910 совместно вводят в виде 24-инфузии в режиме недельной продолжительности (сутки 1, 8, 15 и 23 четырехнедельного цикла). Доза ON01910 составляет 1000 мг/м2/неделя. Лекарственные средства вводят совместно в течение остальных циклов схемы химиотерапии. Проводят мониторинг субъекта в отношении прогрессирования или регрессии заболевания.
Пример 4 - Предупреждение развития резистентности к гемцитабину путем совместного введения миРНК, направленной на Plk1
У субъекта диагностирован рак поджелудочной железы. Соединение миРНК, направленной на Plk1, вводят субъекту одновременно с первой дозой химиотерапии гемцитабином в течение каждого цикла (например, на сутки 1 каждого четырехнедельного цикла). Терапевтические агенты миРНК являются длительно действующими соединениями, дающими возможность относительно редкого введения по сравнению с введением гемцитабина. Химиотерапию гемцитабином продолжают в течение желаемого числа циклов. Проводят мониторинг субъекта в отношении прогрессирования или регрессии заболевания.
Пример 5 - Предупреждение развития резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, с использованием ON01910
У субъекта диагностирован хронический лимфоцитарный лейкоз, рак, чувствительный к лечению флударабином, вводимым внутривенно в дозе 25 мг/м2 ежесуточно в течение 5 суток каждые 28-е сутки в течение вплоть до 12 циклов. За неделю до первого введения флударабина субъекту вводят ON01910 в дозе 100 мг/м2/сутки в виде 72-часовой инфузии (суммарная доза 300 мг/м2). Введение ON01910 в той же дозе каждую следующую неделю продолжают на протяжении курса химиотерапии флударабином. Проводят мониторинг субъекта на прогрессирование или регрессию заболевания.
Включение посредством ссылки
Содержание всех ссылок, патентов, находящихся на рассмотрении заявок на патент и опубликованных патентов, цитируемых во всей данной заявке, ясно включено посредством ссылки.
Эквиваленты
Специалистам в данной области техники должно быть известно, либо они могут установить, используя не более чем обычные эксперименты, многие эквиваленты конкретных воплощений изобретения, описанных здесь. Такие эквиваленты подразумевают как включенные в приведенную ниже формулу изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ РАКА, НЕСУЩЕГО МУТАЦИИ EGFR | 2007 |
|
RU2492864C2 |
| СПОСОБ ИНДУКЦИИ АПОПТОЗА КЛЕТОК ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ КОЛОРЕКТАЛЬНОГО РАКА И СРЕДСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2013 |
|
RU2551238C9 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2001 |
|
RU2284818C2 |
| СПОСОБ УМЕНЬШЕНИЯ МУЛЬТИЛЕКАРСТВЕННОЙ РЕЗИСТЕНТНОСТИ С ИСПОЛЬЗОВАНИЕМ ТРИПИРОФОСФАТА ИНОЗИТА | 2010 |
|
RU2563127C2 |
| Композиция для ингибирования роста и стимуляции апоптоза клеток колоректального рака | 2016 |
|
RU2644675C1 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2010 |
|
RU2587013C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2006 |
|
RU2429838C2 |
| СПОСОБЫ ЛЕЧЕНИЯ МЕТАСТАТИЧЕСКИХ ВИДОВ РАКА С ИСПОЛЬЗОВАНИЕМ РЕЦЕПТОРОВ-ЛОВУШЕК AXL | 2018 |
|
RU2785866C2 |
| СОХРАНЕНИЕ ИММУННОГО ОТВЕТА ВО ВРЕМЯ ХИМИОТЕРАПЕВТИЧЕСКИХ СХЕМ | 2017 |
|
RU2779478C2 |
| ЛЕЧЕНИЕ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2018 |
|
RU2792690C2 |
Предложены: фармацевтическая композиция, содержащая дезинтегратор митоза/ингибитор биохимического пути polo-подобной киназы (Plk), в частности, ON01910, ON01910-Na или ми-РНК, направленную на Plk1, и химиотерапевтический агент, представляющий собой нуклеотидный аналог, в эффективном количестве, а также приемлемый носитель, для использования в качестве лекарственного средства для предупреждения развития резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у субъекта, страдающего раком, или для использования в качестве лекарственного средства для лечения рака, резистентного к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у нуждающегося в этом пациента и применение по тому же назначению дезинтегратора митоза/ингибитор биохимического пути polo-подобной киназы (Plk), в частности, ON01910, ON01910-Na или ми-РНК, направленной на Plk1, и химиотерапевтического агента, представляющего собой нуклеотидный аналог. Показано достижение синергетического эффекта заявленным сочетанием и преодоление или предотвращение развития резистентности к химиотерапевтическому агенту. 2 н. и 13 з.п. ф-лы, 3 ил., 5 пр.
1. Фармацевтическая композиция, содержащая дезинтегратор митоза/ингибитор биохимического пути polo-подобной киназы (Plk), в частности ON01910, ON01910-Na или миРНК, направленную на Plk1, и химиотерапевтический агент, представляющий собой нуклеотидный аналог, в эффективном количестве, а также фармацевтически и физиологически приемлемый носитель, для использования в качестве лекарственного средства для предупреждения развития резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у субъекта, страдающего раком, или для использования в качестве лекарственного средства для лечения рака, резистентного к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у нуждающегося в этом пациента.
2. Фармацевтическая композиция по п.1, где химиотерапевтический агент, представляющий собой нуклеотидный аналог, выбран из группы, состоящей из кладрибина, клофарабина, флударабина, меркаптопурина, пентостатина, тиогуанина, капецитабина, цитарабина, децитабина, фторурацила, флоксуридина, сапацитабина и гемцитабина.
3. Фармацевтическая композиция по п.1, где химиотерапевтический агент, представляющий собой нуклеотидный аналог, представляет собой гемцитабин.
4. Фармацевтическая композиция по п.1, где рак выбран из группы, состоящей из лейкоза, лимфомы, колоректального рака, рака поджелудочной железы, рака легкого, рака молочной железы, рака яичника, базально-клеточной карциномы, рака мочевого пузыря, рака печени, рака простаты, рака желудка, рака почки, меланомы, глиомы, рака пищевода и рака шейки матки.
5. Фармацевтическая композиция по п.1, где рак представляет собой рак поджелудочной железы.
6. Фармацевтическая композиция по п.1, где лекарственное средство изготовлено для введения ON01910-Na или миРНК, направленной на Plk1, в дозе от примерно 50 мг/м2/неделя до примерно 5000 мг/м2/неделя.
7. Фармацевтическая композиция по п.2, где лекарственное средство изготовлено для введения гемцитабина в дозе от примерно 500 мг/м2/неделя до примерно 1500 мг/м2/неделя.
8. Фармацевтическая композиция по любому из пп.1-7 для введения субъекту после введения субъекту отдельно химиотерапевтического агента, представляющего собой нуклеотидный аналог.
9. Фармацевтическая композиция по любому из пп.1-7 для введения субъекту после введения субъекту отдельно дезинтегратора митоза/ингибитора биохимического пути Plk.
10. Фармацевтическая композиция по любому из пп.1-7 для введения субъекту перед введением субъекту отдельно химиотерапевтического агента, представляющего собой нуклеотидный аналог.
11. Фармацевтическая композиция по любому из пп.1-7 для введения субъекту перед введением субъекту отдельно дезинтегратора митоза/ингибитора биохимического пути Plk.
12. Применение дезинтегратора митоза/ингибитора биохимического пути polo-подобной киназы (Plk), в частности ON01910, ON01910-Na или миРНК, направленной на Plk1, и химиотерапевтического агента, представляющего собой нуклеотидный аналог, совместно для предупреждения развития резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у субъекта, страдающего раком, или для лечения рака, резистентного к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у нуждающегося в этом пациента.
13. Применение дезинтегратора митоза/ингибитора биохимического пути polo-подобной киназы (Plk) и химиотерапевтического агента, представляющего собой нуклеотидный аналог, по п.12, где дезинтегратор митоза/ингибитор биохимического пути polo-подобной киназы (PIk) вводят в дозе от примерно 50 мг/м2/неделя до примерно 5000 мг/м2/неделя.
14. Применение дезинтегратора митоза/ингибитора биохимического пути polo-подобной киназы (Plk) и химиотерапевтического агента, представляющего собой нуклеотидный аналог, по п.12, где химиотерапевтический агент, представляющий собой нуклеотидный аналог, представляет собой гемцитабин, который вводят в дозе от примерно 50 мг/м2/неделя до примерно 1500 мг/м2/неделя.
15. Применение дезинтегратора митоза/ингибитора биохимического пути polo-подобной киназы (Plk) и химиотерапевтического агента, представляющего собой нуклеотидный аналог, по любому из пп.12-14, где совместное введение проводят после предварительного введения субъекту отдельно химиотерапевтического агента, представляющего собой нуклеотидный аналог, и/или после предварительного введения субъекту отдельно дезинтегратора митоза/ингибитора биохимического пути polo-подобной киназы (Plk).
| GUMIREDDY К | |||
| et al | |||
| Зажим при разгонке зазоров железнодорожных рельсов | 1924 |
|
SU1910A1 |
| Cancer Cell | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Найдено из базы данных PubMedPMID: 15766665 | |||
| МИХАЙЛОВ И.Б | |||
| Настольная книга врача по клинической фармакологии | |||
| - СПб.: Фолиант, 2001, с.615-630, раздел | |||
Авторы
Даты
2013-02-27—Публикация
2008-04-17—Подача