УРОВЕНЬ ТЕХНИКИ
Гипогликемия встречается, когда уровень глюкозы в крови падает до слишком низкого значения, чтобы обеспечить достаточно энергии для жизнедеятельности организма. Для взрослых или детей в возрасте старше 10 лет гипогликемия является нетипичной за исключением побочных эффектов лечения диабета, но она также может быть результатом действия других лекарственных средств или заболеваний, результатом недостаточности гормонов или ферментов или результатом опухолей. Когда уровень глюкозы начинает падать, глюкагон, гормон, продуцируемый поджелудочной железой, посылает в печень сигнал разрушения гликогена и высвобождения глюкозы, что вызывает повышение уровня глюкозы в крови до нормального уровня. Однако для диабетиков эта реакция глюкагона на гипогликемию может быть нарушена, что затрудняет возвращение уровня глюкозы к нормальным значениям.
Гипогликемия представляет собой опасное для жизни событие, которое требует немедленного медицинского вмешательства. Введение глюкагона представляет собой проверенный способ лечения острой гипогликемии, и он может восстанавливать нормальный уровень глюкозы в считанные минуты после введения. При использовании глюкагона в случае неотложного медицинского лечения гипогликемии кристаллическую форму глюкагона растворяют с помощью кислого буфера для разведения и раствор инъецируют внутримышечно. Несмотря на то что это лечение является эффективным, методология является трудоемкой и опасной для того, кто уже находится в полубессознательном состоянии. Соответственно, существует потребность в аналоге глюкагона, который будет поддерживать биологические характеристики родительской молекулы, но будет достаточно растворимым и стабильным при соответствующих физиологических условиях, так что он может быть заранее приготовлен в форме раствора, готового для инъекции.
Кроме того, у диабетиков стараются поддерживать близкий к нормальному уровень глюкозы в крови для задержки или предотвращения микрососудистых осложнений. Достижение этой цели обычно требует применения интенсивной инсулиновой терапии. Стремясь достичь этой цели, медики столкнулись с существенным увеличением частоты и тяжести гипогликемии у обследованных пациентов-диабетиков. Соответственно, для лечения диабета необходима разработка улучшенных лекарственных средств и методологий, которые с меньшей вероятностью индуцируют гипогликемию, чем используемые в настоящее время инсулиновые терапии.
Как описано в настоящем документе, предлагаются высокоэффективные агонисты глюкагона, которые проявляют повышенную биофизическую стабильность и водорастворимость при физиологических значениях pH в фармацевтических композициях, подходящих для коммерческого использования. Нативный глюкагон не является ни растворимым, ни стабильным в диапазоне значений pH, соответствующих физиологическим значениям pH, и, таким образом, должен быть получен в виде сухого продукта, который требует восстановления и немедленного использования. Аналоги глюкагона, описанные в настоящем документе, обладают усиленными физическими свойствами, которые дают им преимущество для использования в текущих медицинских целях, где в настоящий момент применяется нативный гормон. Эти соединения могут использоваться в соответствии с одним вариантом осуществления для получения предварительно приготовленных растворов, готовых для инъекции с целью лечения гипогликемии. Альтернативно, агонисты глюкагона могут вводиться совместно с инсулином для забуферирования эффектов инсулина для обеспечения более стабильного поддержания уровня глюкозы в крови. Кроме того, ниже подробно описаны другие преимущества использования композиций, включающих модифицированные пептиды глюкагона, описанные в настоящем документе.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном варианте осуществления изобретения предлагаются пептиды глюкагона, которые сохраняют активность рецептора глюкагона и проявляют улучшенную растворимость по сравнению с нативным пептидом глюкагона (SEQ ID NO: 1). Нативный глюкагон проявляет слабую растворимость в водном растворе, особенно при физиологическом значении pH, с тенденцией к агрегации и осаждению с течением времени. Напротив, пептиды глюкагона по одному из вариантов осуществления изобретения проявляют, по меньшей мере, двухкратную, пятикратную или еще большую растворимость по сравнению с нативным глюкагоном при значении pH в интервале от 6 до 8, например при pH 7 через 24 часа при 25°C.
В одном варианте осуществления пептиды глюкагона сохраняют по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75% активности, 80% активности, 85% активности или 90% активности нативного глюкагона. В одном варианте осуществления пептиды глюкагона по настоящему изобретению обладают большей эффективностью, чем глюкагон. Любой из пептидов глюкагона по изобретению может дополнительно обладать улучшенной стабильностью и/или сниженной деградацией, например, с сохранением по меньшей мере 95% исходного пептида через 24 часа при 25°С.
В соответствии с одним вариантом осуществления предлагается пептид глюкагона, где пептид модифицирован с помощью аминокислотных замен и/или вставок, которые вводят заряженную аминокислоту в C-концевую область пептида и в одном варианте осуществления в положение, которое является C-концевым относительно положения 27 последовательности SEQ ID NO: 1. Необязательно, одна, две или три заряженные аминокислоты могут вводиться в C-концевую область и в одном варианте осуществления в C-концевую область относительно положения 27. В соответствии с одним вариантом осуществления нативную аминокислоту (аминокислоты) в положении 28 и/или 29 заменяют на заряженную аминокислоту и/или аминокислоты в количестве от одной до трех присоединяют к С-концу пептида. В иллюстративных вариантах осуществления одна, две или все заряженные аминокислоты являются отрицательно заряженными. С пептидом глюкагона могут быть произведены дополнительные модификации, например консервативные замены, которые обеспечат сохранение активности глюкагона.
Согласно одному иллюстративному варианту осуществления пептид глюкагона включает аминокислотную последовательность SEQ ID NO: 11 или ее аналог, которые содержат 1-3 дополнительных аминокислотных модификаций по отношению к нативному глюкагону или аналогу агониста глюкагона на его основе. SEQ ID NO: 11 представляет собой модифицированный пептид глюкагона, где остаток аспарагина в положении 28 нативного белка заменен на аспарагиновую кислоту. В другом иллюстративном варианте осуществления пептид глюкагона включает последовательность SEQ ID NO: 38, где остаток аспарагина в положении 28 нативного белка заменен на глутаминовую кислоту. Другие иллюстративные варианты осуществления включают пептиды глюкагона SEQ ID NO: 24, 25, 26, 33, 35, 36 и 37.
Растворимость любого из вышеуказанных соединений может быть дополнительно улучшена путем присоединения к пептиду гидрофильного компонента. В одном варианте осуществления гидрофильный компонент представляет собой цепь полиэтиленгликоля или другой водорастворимый полимер, который ковалентно связан с боковой цепью аминокислотного остатка в положении 16, 17, 21 или 24 указанного пептида глюкагона. Цепь полиэтиленгликоля согласно одному варианту осуществления имеет молекулярную массу, выбранную из диапазона от примерно 500 до примерно 40000 дальтон. Настоящее изобретение дополнительно охватывает фармацевтически приемлемые соли указанных агонистов глюкагона.
В других иллюстративных вариантах осуществления любое из вышеуказанных соединений может быть дополнительно модифицировано с изменением его фармацевтических свойств путем присоединения второго пептида к карбоксильному концу пептида глюкагона. В одном варианте осуществления пептид глюкагона ковалентно связан посредством пептидной связи со вторым пептидом, где второй пептид включает последовательность, выбранную из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22.
В других иллюстративных вариантах осуществления любое из вышеуказанных соединений может быть дополнительно модифицировано с улучшением стабильности путем модификации аминокислоты в положении 15 последовательности SEQ ID NO: 1 для уменьшения деградации пептида с течением времени, особенно в кислых или щелочных буферах.
Согласно одному варианту осуществления предлагается фармацевтическая композиция, включающая любой из новых пептидов глюкагона, описанных в настоящем документе, предпочтительно, с уровнем чистоты, соответствующим, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, и фармацевтически приемлемый разбавитель, носитель или вспомогательное вещество. Такие композиции могут содержать пептид глюкагона в концентрации, составляющей, по меньшей мере, 0,5 мг/мл, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл или выше. В одном варианте осуществления фармацевтические композиции включают водные растворы, которые стерильны и необязательно хранятся внутри различных контейнеров. В других вариантах осуществления фармацевтические композиции включают лиофилизованный порошок. Фармацевтические композиции могут быть дополнительно упакованы в виде части набора реагентов, который включает одноразовое устройство для введения композиции пациенту. На контейнерах или наборах реагентов могут быть маркировки, указывающие на хранение при температуре окружающей среды или при пониженной температуре.
Согласно одному варианту осуществления предлагается способ быстрого увеличения уровня глюкозы или способ лечения гипогликемии с применением предварительно приготовленного водного раствора. Способ включает стадию введения эффективного количества водного раствора, включающего новый модифицированный пептид глюкагона по настоящему изобретению. В другом варианте осуществления предлагается способ для индуцирования временного пареза кишечного тракта. Способ включает стадию введения одного или более пептидов глюкагона, описанных в настоящем документе, нуждающемуся в этом пациенту.
В еще в одном варианте осуществления предлагается способ снижения прибавления веса или способ индуцирования потери веса, который включает введение эффективного количества водного раствора, включающего пептид глюкагона по изобретению. В других вариантах осуществления предлагаются способы лечения диабета, включающие совместное введение инсулина и пептида глюкагона по изобретению.
Иллюстративные пептиды глюкагона выбраны из группы, состоящей из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 33, где аминокислота 29 пептида глюкагона связана со вторым пептидом посредством пептидной связи, и указанный второй пептид включает последовательность SEQ ID NO: 20, SEQ ID NO: 21 или SEQ ID NO: 22. В одном варианте осуществления пептид глюкагона является пэгилированным. В одном варианте осуществления способ включает стадию введения пептида, включающего последовательность SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26, где полиэтиленовая цепь ковалентно связана с аминокислотой в положении 21 или в положении 24.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой гистограмму, характеризующую стабильность Глюкагон-Cys21малеимидоПЭГ5K при 37°C, инкубированного в течение 24, 48, 72, 96, 144 и 166 часов соответственно.
На фиг. 2 представлены данные, полученные из HPLC-анализа Глюкагон-Cys21малеимидоПЭГ5K при pH 5, инкубированного при 37°C в течение 24, 72 или 144 часов соответственно.
На фиг. 3 представлены данные, демонстрирующие растворимость аналогов глюкагона (D28, E29, E30) по сравнению с нативным глюкагоном через 60 часов при 25°C при pH 2, 4, 5,5, 7 и 8 соответственно.
На фиг. 4 представлены данные, демонстрирующие растворимость аналогов глюкагона (E15D28, D28E29 и D28E30) по сравнению с нативным глюкагоном через 24 часа при 25°C, и затем через 24 часа при 4°C при pH 2, 4, 5,5 и 7 соответственно.
На фиг. 5 представлена максимальная растворимость аналогов глюкагона D28, D28E30 и E15,D28 через 24 часа, pH 7 при 4°C.
На фиг. 6 представлены данные, демонстрирующие опосредованную рецептором глюкагона индукцию cAMP с помощью аналогов глюкагона (K29 ▲, K30 ▼ и K29K30 ◆), по сравнению с нативным глюкагоном ■.
На фиг. 7 представлены данные, демонстрирующие опосредованную рецептором глюкагона индукцию cAMP с помощью аналогов глюкагона (D28 □, E29 ∆, E30 ∇, K30K31 ◇ и K30 ▼) по сравнению с нативным глюкагоном ■.
На фиг. 8 представлены данные, демонстрирующие опосредованную рецептором глюкагона индукцию cAMP с помощью аналогов глюкагона (D28 □, E28  и K29 ▲) по сравнению с нативным глюкагоном ■.
и K29 ▲) по сравнению с нативным глюкагоном ■.
На фиг. 9 представлены данные, демонстрирующие опосредованную рецептором глюкагона индукцию cAMP с помощью аналогов глюкагона (D28E29 +, D28E30 X, E15D28 * и E29 ∆) по сравнению с нативным глюкагоном ■.
На фиг. 10 представлены данные, демонстрирующие изменение концентрации глюкозы в сыворотке у собак бигль после внутримышечного введения глюкагона и аналогов глюкагона. Животным вводили дозу 0,005 мг/кг или глюкагона, или аналога глюкагона, включающего глюкагон с последовательностью SEQ ID NO: 31, связанной с карбокси-концевой областью глюкагона (глюкагон-CEX), или аналога глюкагона, включающего замену на аспарагиновую кислоту в положении аминокислоты 28 (глюкагон-Asp28) SEQ ID NO: 11.
ПОДРОБНОЕ ОПИСАНИЕ
ОПРЕДЕЛЕНИЯ
В описании и пунктах формулы изобретения используется следующая терминология согласно определениям, представленным ниже.
При использовании в настоящем документе в настоящем документе "фармацевтически приемлемый носитель" включает любой из стандартных фармацевтических носителей, таких как солевой раствор с фосфатным буфером, вода, эмульсии, такие как масло/вода или вода/масло, и различные типы увлажняющих агентов. Термин также охватывает любой из агентов, которые одобрены регулятивным органом Федерального Правительства США или приведены в Фармакопее США для использования у животных, включая людей.
При использовании в настоящем документе термин "фармацевтически приемлемая соль" обозначает соли соединений, которые сохраняют биологическую активность родительского соединения и которые не являются неприемлемыми биологически или иным образом. Многие из соединений, описанных в настоящем документе, способны образовывать кислоту и/или основание в присутствии амино- и/или карбоксильных групп или им подобных групп.
Фармацевтически приемлемые аддитивные соли основания могут быть получены из неорганических и органических оснований. Соли, полученные из неорганических оснований, включают, исключительно в качестве примера, соли натрия, калия, лития, аммония, кальция и магния. Соли, полученные из неорганических оснований, включают, но не ограничены ими, соли первичных, вторичных и третичных аминов.
Фармацевтически приемлемые аддитивные соли кислот могут быть получены из неорганических и органических кислот. Соли, полученные из неорганических кислот, включают хлороводородную кислоту, бромоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и им подобные. Соли, полученные из органических кислот, включают уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфокислоту, этансульфокислоту, p-толуолсульфокислоту, салициловую кислоту и им подобные.
При использовании в настоящем документе термин "лечение" включает профилактику определенного нарушения или состояния, или улучшение симптомов, ассоциированных с определенным нарушением или состоянием, и/или предотвращение или устранение указанных симптомов.
При использовании в настоящем документе "эффективное" количество или "терапевтически эффективное количество" пептида глюкагона обозначает нетоксичное, но достаточное количество пептида, обеспечивающего целевой эффект. Например, один целевой эффект мог бы представлять собой предотвращение или лечение гипогликемии с помощью измерений, например, увеличения уровня глюкозы в крови. Количество, которое является "эффективным", варьируется от субъекта к субъекту в зависимости от возраста и общего состояния индивидуума, способа введения и подобных факторов. Таким образом, не всегда возможно определить точное "эффективное количество". Однако подходящее "эффективное" количество в любом индивидуальном случае может быть определено специалистом в данной области с использованием обычной процедуры эксперимента.
Термин "парентеральный" обозначает введение не через алиментарный канал, а введение каким-то другим путем, таким как подкожный, внутримышечный, интраспинальный или внутривенный.
При использовании в настоящем документе термин "очищенный" и подобные термины относятся к выделению молекулы или соединения в форме, которая по существу не содержит примесей, обычно ассоциированных с молекулой или соединением в нативном или естественном окружении. При использовании в настоящем документе термин "очищенный" не требует абсолютной чистоты; предпочтительнее он подразумевается в качестве относительного определения. Термин "очищенный полипептид" используется в настоящем документе для описания полипептида, который был отделен от других соединений, включающих, но не ограниченных ими, молекулы нуклеиновой кислоты, липиды и углеводы.
Термин "выделенный" требует, чтобы материал, к которому он относится, был удален из его исходного окружения (например, естественного окружения, если он существует в природе). Например, природный полинуклеотид, присутствующий в живом животном, не является выделенным, но тот же полинуклеотид, отделенный от некоторой части или от всего сопутствующего ему в естественной системе материала, является выделенным.
При использовании в настоящем документе "пептид глюкагона" включает любой пептид, включающий или аминокислотную последовательность SEQ ID NO: 1, или любой аналог аминокислотной последовательности SEQ ID NO: 1, включающий аминокислотные замены, вставки или делеции или пост-трансляционные модификации (например, метилирование, ацилирование, убиквитинирование и им подобные) пептида, которые стимулируют активность рецептора глюкагона или рецептора GLP-I, измеренную с помощью продуцирования cAMP с использованием анализа, описанного в Примере 13.
Термин "агонист глюкагона" обозначает комплекс, включающий пептид глюкагона, который стимулирует активность рецептора глюкагона, измеренную с помощью продуцирования cAMP с использованием анализа, описанного в Примере 13.
При использовании в настоящем документе "аналог агониста глюкагона" представляет собой пептид глюкагона, включающий последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, или аналог такой последовательности, которая была модифицирована с включением одной или более консервативных аминокислотных замен в положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29.
При использовании в настоящем документе аминокислотная "модификация" обозначает замену, вставку или делецию аминокислоты и включает замену на любую из 20 аминокислот, обычно встречающихся в белках человека, а также нетипичных или неприродных аминокислот или их вставку. По всему содержанию заявки все ссылки на конкретное положение аминокислоты с помощью номера (например, положение 28) обозначают аминокислоту в этом положении у нативного глюкагона (SEQ ID NO: 1) или соответствующее положение аминокислоты в любых его аналогах. Например, ссылка в настоящем документе на "положение 28" будет обозначать соответствующее положение 27 для аналога глюкагона, в котором первая аминокислота в последовательности SEQ ID NO: 1 была делетирована. Подобным образом, ссылка в настоящем документе на "положение 28" будет обозначать соответствующее положение 29 для аналога глюкагона, в котором одна аминокислота была добавлена с N-конца последовательности SEQ ID NO: 1.
При использовании в настоящем документе аминокислотная "замена" обозначает замену одного аминокислотного остатка на другой аминокислотный остаток.
При использовании в настоящем документе термин "консервативная аминокислотная замена" определяется в настоящем документе как обмен в пределах одной из следующих пяти групп:
I. Небольшие алифатические, неполярные или незначительно полярные остатки:
Ala, Ser, Thr, Pro, GIy;
II. Полярные, отрицательно заряженные остатки и их амиды:
Asp, Asn, Glu, Gln, цистеиновая кислота и гомоцистеиновая кислота;
III. Полярные, положительно заряженные остатки:
His, Arg, Lys; Орнитин (Orn);
IV. Крупные, алифатические, неполярные остатки:
Met, Leu, Ile, Val, Cys, Норлейцин (Nle), гомоцистеин;
V. Крупные, ароматические остатки:
Phe, Tyr, Trp, ацетилфенилаланин
При использовании в настоящем документе общий термин "полиэтиленгликоль" или "ПЭГ" обозначает смеси конденсированных полимеров этиленоксида и воды в виде разветвленной и прямой цепи, характеризующихся общей формулой H(OCH2CH2)nOH, где n представляет собой, по меньшей мере, 9. В отсутствие любой дополнительной характеристики подразумевается, что термин включает полимеры этиленгликоля со средней общей молекулярной массой, выбранной из диапазона от 500 до 40000 дальтон. "Полиэтиленгликоль" или "ПЭГ" используется в комбинации с числовым индексом для указания его приблизительной средней молекулярной массы. Например, ПЭГ-5000 обозначает полиэтиленгликоль, имеющий общую молекулярную массу, составляющую в среднем примерно 5000.
При использовании в настоящем документе термин "пэгилированный" и подобные обозначает соединение, которое было модифицировано из его нативного состояния путем присоединения полимера полиэтиленгликоля к соединению. "Пэгилированный пептид глюкагона" представляет собой пептид глюкагона, который имеет цепь ПЭГ, ковалентно связанную с пептидом глюкагона.
При использовании в настоящем документе подразумевается, что общая ссылка на пептид охватывает пептиды, которые имеют мидифицированные амино- или карбокси-концевые области. Например, подразумевается, что аминокислотная цепь, включающая амидогруппу вместо концевой карбоновой кислоты, охватывается аминокислотной последовательностью, обозначающей стандартные аминокислоты. При использовании в настоящем документе "линкер" представляет собой связь, молекулу или группу молекул, которые связывают два отдельных компонента друг с другом. Линкеры могут обеспечивать оптимальное разделение двух компонентов или могут дополнительно обеспечивать лабильную связь, которая дает возможность двум компонентам быть отделенными друг от друга. Лабильные связи включают фото-отщепляемые группы, компоненты, отщепляемые кислотой, компоненты, отщепляемые основанием, и группы, отщепляемые ферментом.
При использовании в настоящем документе "димер" представляет собой комплекс, включающий две субъединицы, ковалентно связанные друг с другом посредством линкера. Термин димер, при использовании в отсутствие любого уточняющего определения охватывает одновременно гомодимеры и гетеродимеры. Гомодимер включает две идентичные субъединицы, тогда как гетеродимер включает две субъединицы, которые отличаются друг от друга, хотя, по существу, подобны друг другу.
При использовании в настоящем документе термин "pH-стабилизированный пептид глюкагона" обозначает аналог агониста глюкагона, который проявляет по сравнению с нативным глюкагоном повышенную стабильность и растворимость в водных буферах в самом широком интервале pH, которые используются в фармакологических целях.
При использовании в настоящем документе термин "заряженная аминокислота" обозначает аминокислоту, которая включает боковую цепь, которая отрицательно заряжена (т.е. депротонирована) или положительно заряжена (т.е. протонирована) в водном растворе при физиологическом значении pH. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту, глутаминовую кислоту, цистеиновую кислоту, гомоцистеиновую кислоту и гомоглутаминовую кислоту, тогда как положительно заряженные аминокислоты включают аргинин, лизин и гистидин. Заряженные аминокислоты включают заряженные аминокислоты из 20 аминокислот, широко встречающихся в белках человека, а также среди нетипичных или неприродных аминокислот.
При использовании в настоящем документе термин "кислая аминокислота" обозначает аминокислоту, которая включает второй кислый компонент, включающий, например, карбоновую кислоту или группу сульфоновой кислоты.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Авторы настоящего изобретения обнаружили, что нативный глюкагон может быть модифицирован путем введения заряда в его карбокси-концевую область для повышения растворимости пептида, но с сохранением у пептида свойств агониста. Повышенная растворимость позволяет получение и хранение растворов глюкагона при значениях pH, близких к нейтральному. Состав растворов глюкагона при относительно нейтральных значениях pH (например, pH со значением примерно 6-8) улучшает стабильность пептидов глюкагона в течение длительного срока. Соответственно, один вариант осуществления настоящего изобретения относится к агонисту глюкагона, который был модифицирован по отношению к пептиду дикого типа His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (SEQ ID NO: 1), для улучшения растворимости пептида в водных растворах, конкретно при значениях pH в интервале примерно от 5,5 примерно до 8, с сохранением при этом биологической активности нативного пептида. В одном варианте осуществления заряд вносят в пептид путем замены нативных незаряженных аминокислот на заряженные аминокислоты, выбранные из группы, состоящей из лизина, аргинина, гистидина, аспарагиновой кислоты и глутаминовой кислоты, или путем добавления заряженных аминокислот к амино- или карбокси-концу пептида. Неожиданно авторы изобретения обнаружили, что замена природной аминокислоты в положении 28 и/или 29 на заряженные аминокислоты и/или присоединение заряженных аминокислот в количестве от одной до двух к карбокси-концу пептида глюкагона повышает растворимость и стабильность пептидов глюкагона в водных растворах при соответствующих физиологических значениях pH (т.е., при значениях pH примерно 6,5-7,5), по меньшей мере, в 5 раз, вплоть до 30 раз.
Соответственно, пептиды глюкагона по одному варианту осуществления изобретения сохраняют активность глюкагона и проявляют растворимость, по меньшей мере, в 2 раза выше, в 5 раз, в 10 раз, в 15 раз, в 25 раз, в 30 раз или более по сравнению с нативным глюкагоном при данном значении pH в интервале между примерно 5,5 и 8, например при pH 7, по измерениям через 24 часа при 25ºC. Любой из пептидов глюкагона, описанных в настоящем документе, может дополнительно демонстрировать улучшенную стабильность при значениях pH в интервале 5,5-8, например сохранение, по меньшей мере, 75%, 80%, 90%, 95%, 96%, 97%, 98% или 99% исходного пептида через 24 часа при 25ºC. Пептиды глюкагона могут включать дополнительные модификации, которые изменяют его фармацевтические свойства, например увеличение эффективности, увеличение периода полужизни в кровотоке, увеличение срока хранения, уменьшение осаждения или агрегации и/или уменьшение деградации, например уменьшение случаев расщепления или химической модификации во время хранения.
В одном варианте осуществления пептид глюкагона с улучшенной растворимостью может быть получен, например, путем введения одной, двух, трех или более заряженных аминокислот в C-концевую область нативного глюкагона и в одном варианте осуществления в положение, являющееся С-концевым по отношению к положению 27. Такая заряженная аминокислота может быть введена, например, путем замены нативной аминокислоты на заряженную аминокислоту, например, в положениях 28 или 29, или, альтернативно, путем вставки заряженной аминокислоты, например, после положения 27, 28 или 29. В иллюстративных вариантах осуществления одна, две, три или все заряженные аминокислоты являются отрицательно заряженными. В других вариантах осуществления одна, две, три или все заряженные аминокислоты являются положительно заряженными. В определенных иллюстративных вариантах осуществления пептид глюкагона может включать любую одну или две из следующих модификаций: замену N28 на E; замену N28 на D; замену T29 на D; замену T29 на E; вставку E после положения 27, 28 или 29; вставку D после положения 27, 28 или 29. Например, E28E30, D28E30.
Дополнительные модификации могут быть произведены с пептидом глюкагона, которые могут дополнительно увеличивать растворимость и/или стабильность и/или активность глюкагона. Пептид глюкагона может альтернативно включать другие модификации, которые, по существу, не влияют на растворимость или стабильность и которые, по существу, не уменьшают активности глюкагона. В иллюстративных вариантах осуществления пептид глюкагона может включать аминокислотные модификации общим количеством от 1 до 2, до 3, до 4, до 5, до 6, до 7, до 8 до 9 или до 10 аминокислотных модификаций по отношению к последовательности нативного глюкагона.
Типичные модификации включают, но не ограничены ими: консервативные замены, например консервативные замены в одном или более из следующих положений: 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29;
модификацию, которая может уменьшать деградацию, т.е. модификацию аспарагиновой кислоты в положении 15, например, путем замены на глутаминовую кислоту, гомоглутаминовую кислоту, цистеиновую кислоту или гомоцистеиновую кислоту;
вставку гидрофильного компонента, такого как водорастворимый полимер полиэтиленгликоль, описанный в настоящем документе, например, в положение 16, 17, 20, 21, 24 или 29, которая может увеличивать растворимость и/или период полужизни;
модификацию аминокислоты в положении 27, например, путем замены на метионин, лейцин или норлейцин;
модификации в положении 1 или 2, как описано в настоящем документе;
C-концевые удлинения, как описано в настоящем документе;
гомодимеризацию или гетеродимеризацию, как описано в настоящем документе;
комбинации вышеуказанных модификаций.
Согласно одному варианту осуществления пептид нативного глюкагона с последовательностью SEQ ID NO: 1 модифицируют путем замены нативной аминокислоты в положении 28 и/или 29 на отрицательно заряженную аминокислоту (например, аспарагиновую кислоту или глутаминовую кислоту) и необязательно вставку отрицательно заряженной аминокислоты (например, аспарагиновой или глутаминовой кислоты) к карбоксильному концу пептида. В альтернативном варианте осуществления пептид нативного глюкагона с последовательностью SEQ ID NO: 1 модифицируют путем замены нативной аминокислоты в положении 29 на положительно заряженную аминокислоту (например, лизин, аргинин или гистидин) и необязательно путем присоединения одной или двух положительно заряженных аминокислот (например, лизина, аргинина или гистидина) к карбоксильному концу пептида. Согласно одному варианту осуществления предлагается аналог глюкагона, имеющий улучшенную растворимость и стабильность, где аналог включает аминокислотную последовательность SEQ ID NO: 34 с оговоркой, что, по меньшей мере, одну из аминокислот в положении 28 или 29 заменяют на кислую аминокислоту и/или вставляют дополнительную кислую аминокислоту к карбоксильному концу последовательности SEQ ID NO: 34. В одном варианте осуществления кислые аминокислоты независимо выбраны из группы, состоящей из Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты.
Согласно одному варианту осуществления предлагается агонист глюкагона, имеющий улучшенную растворимость и стабильность, где агонист включает аминокислотную последовательность SEQ ID NO: 33, где, по меньшей мере, одну из аминокислот в положениях 27, 28 или 29 заменяют на отличный от нативного аминокислотный остаток (т.e. по меньшей мере, один аминокислотный остаток, присутствующий в положении 27, 28 или 29 аналога, представляет собой кислую аминокислоту, отличную от аминокислоты, присутствующей в соответствующем положении в последовательности SEQ ID NO: 1). Согласно одному варианту осуществления предлагается агонист глюкагона, включающий последовательность SEQ ID NO: 33 с оговоркой, что когда аминокислота в положении 28 представляет собой аспарагин и аминокислота в положении 29 представляет собой треонин, то пептид дополнительно включает аминокислоты в количестве от одной до двух, независимо выбранные из группы, состоящей из Lys, Arg, His, Asp или Glu, вставленные к карбоксильному концу пептида глюкагона. Было опубликовано, что определенные положения пептида нативного глюкагона могут быть модифицированы при сохранении, по меньшей мере, некоторой части активности родительского пептида. Соответственно, заявители ожидают, что одна или более аминокислот, локализованных в положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27 или 29 пептида с последовательностью SEQ ID NO: 11, могут быть заменены на аминокислоту, отличную от той, что присутствует в пептиде нативного глюкагона, при сохранении повышенной эффективности, стабильности при физиологическом значении pH и биологической активности родительского пептида глюкагона. Например, согласно одному варианту осуществления остаток метионина, присутствующий в положении 27 нативного пептида, заменяют на лейцин или норлейцин для предотвращения окислительной деградации пептида.
В одном варианте осуществления предлагается аналог глюкагона с последовательностью SEQ ID NO: 33, где 1-6 аминокислот, выбранных из аминокислот с положениями 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 в аналоге, отличаются от соответствующей аминокислоты последовательности SEQ ID NO: 1. Согласно другому варианту осуществления предлагается аналог глюкагона с последовательностью SEQ ID NO: 33, где 1-3 аминокислоты, выбранные из аминокислот с положениями 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 в аналоге, отличаются от соответствующей аминокислоты последовательности SEQ ID NO: 1. В другом варианте осуществления предлагается аналог глюкагона с последовательностью SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 34, где 1-2 аминокислоты, выбранных из аминокислот с положениями 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 в аналоге, отличаются от соответствующей аминокислоты последовательности SEQ ID NO: 1, и в следующем варианте осуществления эти отличные аминокислоты в количестве от одной до двух характеризуют консервативные аминокислотные замены по отношению к аминокислоте, присутствующей в нативной последовательности (SEQ ID NO: 1). В одном варианте осуществления предлагается пептид глюкагона с последовательностью SEQ ID NO: 11 или SEQ ID NO: 13, где пептид глюкагона дополнительно включает одну, две или три аминокислотных замен в положениях, выбранных из положений 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27 или 29. В одном варианте осуществления замены в положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 27 или 29 являются консервативными аминокислотными заменами.
В одном варианте осуществления предлагается агонист глюкагона, включающий пептид аналога последовательности SEQ ID NO: 1, где аналог отличается от последовательности SEQ ID NO: 1 наличием аминокислоты, отличной от серина, в положении 2 и наличием кислой аминокислоты, заменяющей нативную аминокислоту в положении 28 или 29, или наличием кислой аминокислоты, вставленной к карбоксильному концу пептида с последовательностью SEQ ID NO: 1. В одном варианте осуществления кислая аминокислота представляет собой аспарагиновую кислоту или глутаминовую кислоту. В одном варианте осуществления предлагается аналог глюкагона последовательности SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 или SEQ ID NO: 32, где аналог отличается от родительской молекулы заменой в положении 2. Более конкретно, аминокислоту в положении 2 заменяют на аминокислоту, выбранную из группы, состоящей из d-серина, аланина, глицина, n-метилсерина и аминоизомасляной кислоты.
В другом варианте осуществления предлагается агонист глюкагона, включающий пептид аналога последовательности SEQ ID NO: 1, где аналог отличается от последовательности SEQ ID NO: 1 наличием аминокислоты, отличной от гистидина, в положении 1 и наличием кислой аминокислоты, заменяющей нативную аминокислоту в положении 28 или 29, или наличием кислой аминокислоты, вставленной к карбоксильному концу пептида с последовательностью SEQ ID NO: 1. В одном варианте осуществления кислая аминокислота представляет собой аспарагиновую кислоту или глутаминовую кислоту. В одном варианте осуществления предлагается аналог глюкагона последовательности SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 или SEQ ID NO: 32, где аналог отличается от родительской молекулы заменой в положении 1. Более конкретно, аминокислоту в положении 1 пептида аналога заменяют на аминокислоту, выбранную из группы, состоящей из d-гистидина, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина.
Согласно одному варианту осуществления модифицированный пептид глюкагона включает последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 32. В следующем варианте осуществления предлагается пептид глюкагона, включающий последовательность SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 или SEQ ID NO: 32, дополнительно включающую аминокислоты в количестве от одной до двух, вставленные в C-концевую область последовательности SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 или SEQ ID NO: 32, где дополнительные аминокислоты независимо выбраны из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты или гомоцистеиновой кислоты. В одном варианте осуществления дополнительные аминокислоты, вставленные к карбоксильному концу, выбраны из группы, состоящей из Lys, Arg, His, Asp или Glu, или в следующем варианте осуществления дополнительные аминокислоты представляют собой Asp или Glu.
В другом варианте осуществления пептид глюкагона включает последовательность SEQ ID NO: 7 или аналог агониста глюкагона на ее основе. В одном варианте осуществления пептид включает последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13. В другом варианте осуществления пептид включает последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 8, SEQ ID NO: 10 и SEQ ID NO: 11. В одном варианте осуществления пептид глюкагона включает последовательность SEQ ID NO: 8, SEQ ID NO: 10 и SEQ ID NO: 11, дополнительно включающие дополнительную аминокислоту, выбранную из группы, состоящей из Asp и Glu, вставленные в C-концевую область пептида глюкагона. В одном варианте осуществления пептид глюкагона включает последовательность SEQ ID NO: 11 или SEQ ID NO: 13, и в следующем варианте осуществления пептид глюкагона включает последовательность SEQ ID NO: 11. Согласно одному варианту осуществления предлагается агонист глюкагона, включающий модифицированный пептид глюкагона, выбранный из группы, состоящей из:
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Xaa-Xaa-Xaa-R (SEQ ID NO: 34),
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asp-Thr-R (SEQ ID NO: 11) и
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Xaa-Tyr-Leu-Glu-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asp-Thr-R (SEQ ID NO: 13),
где Xaa в положении 15 представляет собой Asp, Glu, цистеиновую кислоту, гомоглутаминовую кислоту или гомоцистеиновую кислоту, Xaa в положении 28 представляет собой Asn или кислую аминокислоту, и Xaa в положении 29 представляет собой Thr или кислую аминокислоту, и R представляет собой кислую аминокислоту, COOH или CONH2, с оговоркой, что остаток кислой аминокислоты присутствует в одном из следующих положений: 28, 29 или 30. В одном варианте осуществления R представляет собой COOH, и в другом варианте осуществления R представляет собой CONH2.
Настоящее изобретение также охватывает сшитые пептиды глюкагона, где второй пептид сшивают с C-концевой областью пептида глюкагона для повышения стабильности и растворимости пептида глюкагона. Более конкретно, сшитый пептид глюкагона может включать аналог агониста глюкагона, включающего пептид глюкагона NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Xaa-Xaa-Xaa-R (SEQ ID NO: 34), где R представляет собой кислую аминокислоту или связь и аминокислотную последовательность SEQ ID NO: 20 (GPSSGAPPPS), SEQ ID NO: 21 (KRNKNNIA) или SEQ ID NO: 22 (KRNR), связанные с карбокси-концевой аминокислотой пептида глюкагона. В одном варианте осуществления пептид глюкагона выбран из группы, состоящей из последовательностей SEQ ID NO: 33, SEQ ID NO: 7 или SEQ ID NO: 8, дополнительно включающих аминокислотную последовательность SEQ ID NO: 20 (GPSSGAPPPS), SEQ ID NO: 21 (KRNRNNIA) или SEQ ID NO: 22 (KRNR), связанную с карбокси-концевой аминокислотой пептида глюкагона. В одном варианте осуществления сшитый пептид глюкагона включает последовательности SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6 или аналог агониста глюкагона на их основе, дополнительно включающие аминокислотную последовательность SEQ ID NO: 20 (GPSSGAPPPS), SEQ ID NO: 21 (KRNRNNIA) или SEQ ID NO: 22 (KRNR), связанную с аминокислотой в положении 29 пептида глюкагона. Согласно одному варианту осуществления сшитый пептид дополнительно включает цепь ПЭГ, связанную с аминокислотой в положении 16, 17, 21 или 24, где молекулярная масса цепи ПЭГ выбрана из интервала 500-40000 дальтон. В одном варианте осуществления аминокислотная последовательность SEQ ID NO: 20 (GPSSGAPPPS), SEQ ID NO: 21 (KRNRNNIA) или SEQ ID NO: 22 (KRNR) связана с аминокислотой в положении 29 пептида глюкагона посредством пептидной связи. В одном варианте осуществления область пептида глюкагона сшитого пептида глюкагона включает последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 13. В одном варианте осуществления область пептида глюкагона сшитого пептида глюкагона включает последовательность SEQ ID NO: 11 или SEQ ID NO: 13, где цепь ПЭГ связана с аминокислотой в положении 21 или 24 соответственно.
В другом варианте осуществления последовательность пептида глюкагона сшитого пептида включает последовательность SEQ ID NO: 11, дополнительно включающую аминокислотную последовательность SEQ ID NO: 20 (GPSSGAPPPS), SEQ ID NO: 21 (KRNRNNIA) или SEQ ID NO: 22 (KRNR), связанные с аминокислотой в положении 29 пептида глюкагона. В одном варианте осуществления сшитый пептид глюкагона включает последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26. Типично, сшитые пептиды по настоящему изобретению содержат C-концевую аминокислоту со стандартной группой карбоновой кислоты. Однако аналоги таких последовательностей, где C-концевая аминокислота содержит амид, заменяющий карбоновую кислоту, также охвачены в виде воплощений. Согласно одному варианту осуществления сшитый пептид глюкагона включает аналог агониста глюкагона, выбранный из группы, состоящей из последовательностей SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 13, дополнительно включающих аминокислотную последовательность SEQ ID NO: 23 (GPSSGAPPPS-CONH2), связанную с аминокислотой в положении 29 пептида глюкагона.
Агонисты глюкагона по настоящему изобретению могут быть дополнительно модифицированы для улучшения растворимости и стабильности пептида в водных растворах при сохранении биологической активности пептида глюкагона. Согласно одному варианту осуществления ожидается, что введение гидрофильных групп в одно или более положений, выбранных из положений 16, 17, 20, 21, 24 и 29 пептида последовательности SEQ ID NO: 11, или аналога агониста глюкагона на ее основе, улучшает растворимость и стабильность аналога глюкагона при стабилизирующем значении pH. Более конкретно, в одном варианте осуществления пептид глюкагона последовательности SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 13, или SEQ ID NO: 32 модифицируют для включения одной или более гидрофильных групп, ковалентно связанных с боковыми цепями аминокислот, присутствующих в положениях 21 и 24 пептида глюкагона.
Согласно одному варианту осуществления пептид глюкагона последовательности SEQ ID NO: 11 модифицируют так, чтобы он содержал одну или более аминокислотных замен в положениях 16, 17, 20, 21, 24 и/или 29, где нативную аминокислоту заменяют на аминокислоту, имеющую боковую цепь, подходящую для перекрестного связывания с гидрофильными компонентами, включающими, например, ПЭГ. Нативный пептид может быть заменен на природную аминокислоту или синтетическую (неприродную) аминокислоту. Синтетические или неприродные аминокислоты обозначают аминокислоты, которые не встречаются в природе in vivo, но которые, тем не менее, могут быть введены в пептидные структуры, описанные в настоящем документе.
В одном варианте осуществления предлагается агонист глюкагона последовательности SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 13, где последовательность пептида нативного глюкагона была модифицирована так, чтобы он содержал природную или синтетическую аминокислоту, по меньшей мере, в одном из следующих положений: 16, 17, 21 и 24 нативной последовательности, где аминокислотная замена дополнительно включает гидрофильный компонент. В одном варианте осуществления замена осуществляется с аминокислотами в положении 21 или 24, и в следующем варианте осуществления гидрофильным компонентом является цепь ПЭГ. В одном варианте осуществления в пептиде глюкагона последовательности SEQ ID NO: 11 производят замену, по меньшей мере, на один остаток цистеина, где боковая цепь цистеинового остатка дополнительно модифицируется с помощью тиол-реакционноспособного реагента, включающего, например, малеимидо, винилсульфон, 2-пиридилтио, галогеналкил и галогенацил. Эти тиол-реакционноспособные реагенты могут содержать карбокси-, кето-, гидроксильные группы и группы простых эфиров, а также другие гидрофильные компоненты, такие как полиэтиленгликолевые единицы. В альтернативном варианте осуществления в пептиде нативного глюкагона производят замену с помощью лизина и боковую цепь заменяющего остатка лизина дополнительно модифицируют с использованием амино-реакционноспособных реагентов, таких как активные сложные эфиры (сукцинимидо-, ангидрид и т.д.) карбоновых кислот или альдегиды гидрофильных компонентов, таких как полиэтиленгликоль. В одном варианте осуществления пептид глюкагона выбран из группы, состоящей из последовательностей SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19.
Согласно одному варианту осуществления пэгилированный пептид глюкагона включает две или более цепей полиэтилена, ковалентно связанных с пептидом глюкагона, где общая молекулярная масса цепей глюкагона составляет примерно 1000-5000 дальтон. В одном варианте осуществления пэгилированный агонист глюкагона включает пептид последовательности SEQ ID NO: 6, где цепь ПЭГ ковалентно связана с аминокислотным остатком в положении 21 и в положении 24 и где объединенная молекулярная масса двух цепей ПЭГ составляет примерно 1000-5000 дальтон. В другом варианте осуществления пэгилированный агонист глюкагона включает пептид последовательности SEQ ID NO: 6, где цепь ПЭГ ковалентно связана с аминокислотным остатком в положении 21 и в положении 24 и где объединенная молекулярная масса двух цепей ПЭГ составляет примерно 5000-20000 дальтон.
Цепь полиэтиленгликоля может быть представлена в форме прямой цепи или может быть разветвлена. Согласно одному варианту осуществления цепь полиэтиленгликоля имеет значение средней молекулярной массы, выбранное из интервала примерно от 500 примерно до 40000 дальтон. В одном варианте осуществления цепь полиэтиленгликоля имеет значение молекулярной массы, выбранное из интервала примерно от 500 примерно до 5000 дальтон. В другом варианте осуществления цепь полиэтиленгликоля имеет значение молекулярной массы примерно от 20000 примерно до 40000 дальтон.
Как описано подробно в разделе Примеров, агонисты глюкагона по настоящему изобретению обладают повышенной биофизической стабильностью и водной растворимостью в растворах с физиологическим значением pH, сохраняя при этом или демонстрируя повышенную биоактивность по отношению к нативному пептиду. Соответственно, полагают, что агонисты глюкагона по настоящему изобретению являются подходящими для любого применения, которое ранее было описано для пептида нативного глюкагона. Таким образом, модифицированные пептиды глюкагона, описанные в настоящем документе, могут применяться для лечения гипогликемии, для увеличения уровня глюкозы в крови, для индуцирования временного пареза пищеварительного тракта, необходимой для радиологических применений, для уменьшения и поддержания веса тела, для применения в качестве дополнительной терапии вместе с инсулином или для лечения других метаболических заболеваний, которые развились в результате низкого уровня глюкагона в крови.
Один аспект настоящего описания относится к предварительно приготовленному водному раствору описанного настоящим агониста глюкагона для применения в лечении гипогликемии. Улучшенная стабильность и/или растворимость описанных в настоящем документе композиций, содержащих агонист, учитывает получение предварительно составленных водных растворов глюкагона для быстрого введения и лечения гипогликемии. Соответственно, в одном варианте осуществления предлагается раствор, включающий агонист глюкагона по настоящему изобретению, для введения пациенту, страдающему гипогликемией. В одном варианте осуществления предлагается раствор, включающий пэгилированный агонист глюкагона, как описано в настоящем документе, для введения пациенту, страдающему гипогликемией, где общая молекулярная масса цепей ПЭГ, связанных с пэгилированным агонистом глюкагона находится в интервале между примерно 500 и примерно 5000 дальтон. В одном варианте осуществления пэгилированный агонист глюкагона включает пептид, выбранный из группы, состоящей из последовательностей SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, и аналогов агониста глюкагона на их основе, где боковая цепь аминокислотного остатка в положении 16, 17, 21 или 24 указанного пептида глюкагона ковалентно связана с цепью полиэтиленгликоля. В одном варианте осуществления пэгилированный агонист глюкагона включает пептид последовательности SEQ ID NO: 16, где аминокислотный остаток в положении 21 пептида ковалентно связан с полиэтиленгликолем. В одном варианте осуществления пэгилированный агонист глюкагона включает пептид последовательности SEQ ID NO: 17, где аминокислотный остаток в положении 24 пептида ковалентно связан с полиэтиленгликолем.
Способ лечения гипогликемии согласно настоящему изобретению включает стадии введения пациенту описанных настоящим агонистов глюкагона с использованием любого стандартного пути введения, включающего парентеральное введение, такое как внутривенное, внутрибрюшинное, подкожное или внутримышечное, интратекальное, трансдермальное, ректальное, пероральное, назальное введение или введение с помощью ингаляции. В одном варианте осуществления композицию вводят подкожно или внутримышечно. В одном варианте осуществления композицию вводят парентерально, и композиция, содержащая глюкагон, предварительно упаковывается в шприц. Преимущественно стабильные в водном растворе аналоги глюкагона, описанные в настоящем документе, демонстрируют по отношению к нативному глюкагону повышенную стабильность в водных буферах с самым широким интервалом pH, которые используются для фарамкологических целей. Применение стабилизированных аналогов глюкагона, описанных в настоящем документе, учитывает получение и хранение растворов, содержащих агонист глюкагона, при физиологических значениях pH в течение продолжительных периодов времени.
Авторы настоящего изобретения обнаружили, что могут быть получены пэгилированные пептиды глюкагона, которые сохраняют биоактивность и специфичность родительского пептида. Однако увеличение длины цепи ПЭГ или присоединение множества цепей ПЭГ к пептиду, так что общая молекулярная масса связанного ПЭГ составляет более чем 5000 дальтон, начинает задерживать время действия модифицированного глюкагона. Согласно одному варианту осуществления предлагается пептид глюкагона последовательности SEQ ID NO: 11 или SEQ ID NO: 13, или аналог агониста глюкагона на их основе, где пептид включает одну или более цепей полиэтиленгликоля, где общая молекулярная масса связанного ПЭГ составляет более чем 5000 дальтон, и в одном варианте осуществления составляет более чем 10000 дальтон, но менее чем 40000 дальтон. Такие модифицированные пептиды глюкагона обладают временем запаздывания активности, но при этом не теряют биоактивность. Соответственно, такие соединения могут вводиться профилактически для продления эффекта от введенного пептида глюкагона.
Пептиды глюкагона, которые были модифицированы путем ковалентного связывания с цепью ПЭГ, имеющей молекулярную массу более чем 10000 дальтон, могут вводиться совместно с инсулином для буферирования действий инсулина и для помощи в поддержании стабильного уровня глюкозы в крови у диабетиков. Модифицированные пептиды глюкагона по настоящему описанию могут вводиться совместно с инсулином в виде одной композиции, могут вводиться одновременно в виде отдельных растворов, или, альтернативно, инсулин и модифицированный пептид глюкагона могут вводиться в различные моменты времени по отношению друг к другу. В одном варианте осуществления композиция, включающая инсулин и композиция, включающая модифицированный пептид глюкагона, вводятся с интервалом 12 часов относительно друг друга. Точное отношение модифицированного пептида глюкагона по отношению к вводимому инсулину будет зависеть частично от определения уровня глюкагона у пациента и может определяться с помощью обычных экспериментальных процедур.
Согласно одному варианту осуществления предлагается композиция, включающая инсулин и модифицированный пептид глюкагона, выбранный из группы, состоящей из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и аналогов агониста глюкагона на их основе, где модифицированный пептид глюкагона дополнительно включает цепь полиэтиленгликоля, ковалентно связанную с боковой цепью аминокислот в положении 16, 17, 21 или 24. В одном варианте осуществления композиция представляет собой водный раствор, включающий инсулин и аналог глюкагона. В вариантах осуществления где пептид глюкагона включает последовательность SEQ ID NO: 11 или SEQ ID NO: 13, пептид может дополнительно включать цепь полиэтиленгликоля, ковалентно связанную с боковой цепью аминокислот в положении 16, 17, 21 или 24. В одном варианте осуществления молекулярная масса цепи ПЭГ модифицированного пептида глюкагона составляет выше, чем 10000 дальтон. В одном варианте осуществления пэгилированный пептид глюкагона включает пептид, выбранный из группы, состоящей из последовательности SEQ ID NO: 11 и SEQ ID NO: 13, где боковая цепь аминокислотного остатка в положении 21 или 24 указанного пептида глюкагона ковалентно связана с цепью полиэтиленгликоля. В одном варианте осуществления цепь полиэтиленгликоля имеет молекулярную массу, составляющую примерно 10000-40000 дальтон.
Согласно одному варианту осуществления модифицированные пептиды глюкагона, описанные в настоящем документе, применяются для индуцирования временного пареза кишечного тракта. Этот способ имеет применение в целях радиологического анализа и включает стадию введения эффективного количества фармацевтической композиции, включающей пэгилированный пептид глюкагона, причем пептид глюкагона включает C-концевое удлинение или димер таких пептидов. В одном варианте осуществления пептид глюкагона включает последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13. В одном варианте осуществления пептид глюкагона дополнительно включает цепь ПЭГ с молекулярной массой, составляющей примерно 1000-40000 дальтон, ковалентно связанной с аминокислотным остатком в положении 21 или 24. В одном варианте осуществления пептид глюкагона выбран из группы, состоящей из последовательностей SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16 и SEQ ID NO: 17. В одном варианте осуществления цепь ПЭГ имеет молекулярную массу, составляющую примерно 500-5000 дальтон.
В следующем варианте осуществления композиция, применяемая для индуцирования временного пареза кишечного тракта, включает первый модифицированный пептид глюкагона и второй модифицированный пептид глюкагона, где первый модифицированный пептид включает последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 13, необязательно связанных с цепью ПЭГ с молекулярной массой, составляющей примерно 500-5000 дальтон, и второй пептид включает ковалентно связанную цепь ПЭГ с молекулярной массой, составляющей примерно 10000-40000 дальтон. В этом варианте осуществления цепь ПЭГ каждого пептида ковалентно связана с аминокислотным остатком или в положении 21 или в положении 24 соответствующего пептида и независимо друг от друга.
Было опубликовано, что оксинтомодулин, природный гидролизующий гормон, обнаруженный в тонкой кишке, вызывает потерю веса при введении крысам или людям (см. публикацию Diabetes 2005;54:2390-2395). Оксинтомодулин представляет собой пептид из 37 аминокислот, который содержит последовательность глюкагона из 29 аминокислот (т.е., SEQ ID NO: 1) с последующим карбокси-концевым удлинением на 8 аминокислот последовательности SEQ ID NO: 23 (KRNRNNIA).
Соответственно, авторы изобретения полагают, что биоактивность оксинтомодулина может сохраняться (т.е. подавление аппетита и индуцированная потеря веса/поддержание веса) при улучшении растворимости и стабильности соединения и улучшении фармакокинетики путем замены части оксинтомодулина в виде пептида глюкагона на модифицированные пептиды глюкагона, описанные в настоящем документе. Кроме того, авторы изобретения также полагают, что усеченная молекула оксинтомодулина, включающая пептид глюкагона по изобретению, с удаленными четырьмя концевыми аминокислотами оксинтомодулина также будет эффективной в подавлении аппетита и индуцировании потери веса/поддержания веса.
Соответственно, настоящее изобретение также охватывает модифицированные пептиды глюкагона по настоящему изобретению, которые содержат карбокси-концевое удлинение в виде последовательности SEQ ID NO: 21 (KRNRNNIA) или SEQ ID NO: 22. Согласно одному варианту осуществления для индуцирования потери веса или предотвращения прибавления веса индивидуумам вводят аналог агониста глюкагона последовательности SEQ ID NO: 33, дополнительно включающий аминокислотную последовательность SEQ ID NO: 21 (KRNRNNIA) или SEQ ID NO: 22, связанную с аминокислотой в положении 29 пептида глюкагона. Согласно одному варианту осуществления для индуцирования потери веса или предотвращения прибавления веса индивидуумам вводят аналог агониста глюкагона последовательности SEQ ID NO: 11 или SEQ ID NO: 13, дополнительно включающий аминокислотную последовательность SEQ ID NO: 21 (KRNRNNIA) или SEQ ID NO: 22, связанную с аминокислотой в положении 29 пептида глюкагона. В другом варианте осуществления способ снижения прибавления веса или способ индуцирования потери веса у индивидуума включает введение эффективного количества композиции, включающей агонист глюкагона, включающий пептид глюкагона, выбранный из группы, состоящей из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 5, где аминокислота в положении 29 пептида глюкагона связана со вторым пептидом посредством пептидной связи, и указанный второй пептид включает последовательность SEQ ID NO: 24 (KRNRNNIA) или SEQ ID NO: 25, и где цепь ПЭГ с молекулярной массой, составляющей примерно 1000-40000 дальтон, ковалентно связана с аминокислотным остатком в положении 21 и/или 24. В одном варианте осуществления сегмент пептида глюкагона в агонисте глюкагона выбран из группы, состоящей из последовательностей SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, где цепь ПЭГ с молекулярной массой, составляющей примерно 1000-40000 дальтон, ковалентно связана с аминокислотным остатком в положении 16, 17, 21 или 24.
Эксендин-4 представляет собой пептид, состоящий из 39 аминокислот. Он является мощным стимулятором рецептора, известного как GLP-I. Было опубликовано, что этот пептид также подавляет аппетит и индуцирует потерю веса. Заявители обнаружили, что при вставке к карбоксильному концу глюкагона концевой последовательности Эксендина-4 улучшается растворимость и стабильность глюкагона без нарушения биоактивности глюкагона. В одном варианте осуществления десять концевых аминоксилот Эксендина-4 (т.е., последовательность SEQ ID NO: 20 (GPSSGAPPPS)) связаны с карбокси-концевой областью пептида глюкагона по настоящему изобретению. Ожидается, что эти сшитые белки обладают фармакологической активностью для подавления аппетита и индуцирования потери веса/поддержания веса. В одном варианте осуществления концевая аминокислота удлинения с последовательностью SEQ ID NO: 20 включает амидную группу в месте карбокси-группы (т.е., SEQ ID NO: 23) и эта последовательность связана с карбокси-концевой областью пептида глюкагона по настоящему описанию.
В одном варианте осуществления способ снижения прибавления веса или способ индуцирования потери веса у индивидуума включает введение эффективного количества композиции, включающей пептид глюкагона последовательности SEQ ID NO: 33, где аминокислота в положении 29 пептида глюкагона связана со вторым пептидом посредством пептидной связи и указанный второй пептид включает последовательность SEQ ID NO: 20 (GPSSGAPPPS) или SEQ ID NO: 23. В одном варианте осуществления пептид глюкагона выбран из группы, состоящей из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, где аминокислота в положении 29 пептида глюкагона связана со вторым пептидом посредством пептидной связи и указанный второй пептид включает последовательность SEQ ID NO: 20 (GPSSGAPPPS) или SEQ ID NO: 23. В одном варианте осуществления пептид глюкагона в агонисте глюкагона выбран из группы, состоящей из последовательности SEQ ID NO: 11 и SEQ ID NO: 13. В одном варианте осуществления сегмент пептида глюкагона в сшитом пептиде выбран из группы, состоящей из последовательностей SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16 и SEQ ID NO: 17, где значение молекулярной массы цепи ПЭГ выбрано из интервала 500-40000 дальтон. Более конкретно в одном варианте осуществления пептид глюкагона в сшитом пептиде выбран из группы, состоящей из последовательности SEQ ID NO: 16 и SEQ ID NO: 17, где значение молекулярной массы цепи ПЭГ выбрано из интервала 1000-5000 дальтон.
В другом варианте осуществления композицию вводят пациенту для подавления аппетита, предотвращения прибавления веса и/или для индуцирования потери веса с помощью введения фармацевтической композиции, включающей первый пэгилированный пептид глюкагона и второй пэгилированный пептид глюкагона, где первый и второй пептид представляют собой сшитые пептиды, включающие C-концевое пептидное удлинение, включающее последовательность SEQ ID NO: 20 (GPSSGAPPPS) или SEQ ID NO: 23. Первый пэгилированный пептид гликогена включает ковалентно связанную цепь ПЭГ с молекулярной массой, составляющей примерно 500-10000 дальтон, и второй пэгилированный пептид гликогена включает ковалентно связанную цепь ПЭГ с молекулярной массой, составляющей примерно 10000-40000 дальтон.
Настоящее описание также охватывает мультимеры модифицированных пептидов глюкагона, описанных в настоящем документе. Два или более модифицированных пептидов глюкагона могут быть связаны вместе с использованием стандартных связывающих агентов и с использованием процедур, известных специалисту в данной области. Например, димеры могут быть образованы с помощью двух модифицированных пептидов глюкагона посредством использования бифункциональных тиольных кросслинкеров и бифункциональных амино-кросслинкеров, конкретно для пептидов глюкагона, у которых были заменены аминокислотные остатки на остатки цистеина, лизина, орнитина, гомоцистеина или ацетилфенилаланина (например, последовательность SEQ ID NO: 4 и SEQ ID NO: 5). Димер может представлять собой гомодимер или, альтернативно, гетеродимер. В одном варианте осуществления димер включает гомодимер сшитого пептида глюкагона, где область пептида глюкагона включает аналог агониста с последовательностью SEQ ID NO: 11 и аминокислотную последовательность SEQ ID NO: 20 (GPSSGAPPPS), SEQ ID NO: 21 (KRNRNNIA) или SEQ ID NO: 22 (KRNR), связанную с аминокислотой в положении 29 пептида глюкагона. В другом варианте осуществления димер включает гомодимер аналога агониста глюкагона с последовательностью SEQ ID NO: 11, где пептид глюкагона дополнительно включает цепь полиэтиленгликоля, ковалентно связанную с аминокислотой в положении 21 или 24 пептида глюкагона.
Согласно одному варианту осуществления предлагается димер, включающий первый пептид глюкагона, связанный со вторым пептидом глюкагона посредством линкера, где первый пептид глюкагона включает пептид, выбранный из группы, состоящей из последовательностей SEQ ID NO: 1, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10 и SEQ ID NO: 11, и второй пептид глюкагона включает последовательность SEQ ID NO: 33. Кроме того, что касается второго пептида глюкагона, когда аминокислота в положении 28 представляет собой аспарагин и аминокислота в положении 29 представляет собой треонин, то второй пептид глюкагона дополнительно включает аминокислоты в количестве от одной до двух (независимо выбранные из группы, состоящей из Lys, Arg, His, Asp или Glu), вставленные к карбоксильному концу второго пептида глюкагона, и фармацевтически приемлемые соли указанных полипептидов глюкагона.
Согласно другому варианту осуществления предлагается димер, включающий первый пептид глюкагона, связанный со вторым пептидом глюкагона посредством линкера, где указанный первый пептид глюкагона выбран из группы, состоящей из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, и второй пептид глюкагона независимо выбран из группы, состоящей из последовательности SEQ ID NO: 11 и SEQ ID NO: 13, и фармацевтически приемлемые соли указанных полипептидов глюкагона. В одном варианте осуществления первый пептид глюкагона выбран из группы, состоящей из последовательности SEQ ID NO: 7, и второй пептид глюкагона независимо выбран из группы, состоящей из последовательностей SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13. В одном варианте осуществления димер образуется с помощью двух пептидов, где каждый пептид включает аминокислотную последовательность SEQ ID NO: 11.
Согласно одному варианту осуществления предлагается фармацевтическая композиция, где композиция включает аналог агониста глюкагона по настоящему описанию или его фармацевтически приемлемые соли и фармацевтически приемлемый носитель. В одном варианте осуществления фармацевтическая композиция включает аналог аониста глюкагона с концентрацией 1 мг/мл и 10-50 mM Триэтиламин при pH 7-8,5. В одном варианте осуществления фармацевтическая композиция включает аналог агониста глюкагона с концентрацией 1 мг/мл и 20 мM Триэтиламин при pH 8,5.
Модифицированные пептиды глюкагона по настоящему изобретению могут предлагаться согласно одному варианту осуществления в виде части набора реагентов. В одном варианте осуществления предлагается набор реагентов для введения агониста глюкагона нуждающемуся в этом пациенту, где набор реагентов включает любой из пептидов глюкагона по изобретению в водном растворе. Типичные пептиды глюкагона для включения в такие наборы реагентов включают пептид глюкагона, выбранный из группы, состоящей из 1) пептида глюкагона, включающего последовательность SEQ ID NO: 7, SEQ ID NO: 10, SEQ ID NO:11 или SEQ ID NO: 13 или SEQ ID NO: 33; 2) сшитого пептида глюкагона, включающего аналог агониста глюкагона с последовательностью SEQ ID NO: 11 или SEQ ID NO: 13 или SEQ ID NO: 33, и аминокислотной последовательности SEQ ID NO: 20 (GPSSGAPPPS), SEQ ID NO: 21 (KRNRNNIA) или SEQ ID NO: 22 (KRNR), связанной с аминокислотой в положении 29 пептида глюкагона; 3) пэгилированного пептида глюкагона последовательности SEQ ID NO: 11 или SEQ ID NO: 13 или SEQ ID NO: 33, дополнительно включающего аминокислотную последовательность SEQ ID NO: 20 (GPSSGAPPPS), SEQ ID NO: 21 (KRNRNNIA) или SEQ ID NO: 22 (KRNR), связанную с аминокислотой в положении 29 пептида глюкагона, где цепь ПЭГ, ковалентно связанная с аминокислотой в положении 16, 17, 21 или 24, имеет молекулярную массу, составляющую примерно 500-40000 дальтон. В одном варианте осуществления предлагается набор реагентов с устройством для введения пациенту композиции, содержащей глюкагон, например игла шприца, шприц-ручка, безыгольный шприц или другой безыгольный инъектор. Набор реагентов может альтернативно или дополнительно включать один или более контейнеров из их разнообразия, например флаконы, пробирки, бутылочки, однокамерные или многокамерные предварительно заполненные шприцы, картриджи, инфузионные насосы (внешние или имплантируемые), безыгольные шприцы, предварительно заполненные шприцы-ручки и им подобные, необязательно содержащие пептид глюкагона. Предпочтительно наборы реагентов также будут включать инструкции по применению. Согласно одному варианту осуществления средство набора реагентов представляет собой средство аэрозольного дозирования, где композиция предварительно упакована внутри аэрозольного средства. В другом варианте осуществления набор реагентов включает шприц и иглу, и в одном варианте осуществления композиция, содержащая глюкагон, предварительно упакована внутри шприца. Соединения по настоящему изобретению могут быть получены с помощью стандартных методов синтеза, технологий рекомбинантной ДНК или любым другим методом получения пептидов и сшитых белков. Хотя определенные неприродные аминокислоты не могут быть экспрессированы с использованием стандартных технологий рекомбинантной ДНК, технологии их получения известны из уровня техники. Соединения по настоящему изобретению, которые охватывают не пептидные области, могут быть синтезированы с помощью стандартных реакций органической химии в дополнение к применяемым стандартным реакциям пептидной химии.
ПРИМЕРЫ
Общий протокол синтеза:
Аналоги глюкагона синтезировали с использованием HBTU-активированной с помощью "Fast Boc" одной конденсации с началом от 0,2 ммоль Boc-Thr(OBzl)Pam-смолы на модифицированном пептидном синтезаторе фирмы Applied Biosystem 430А. Boc-аминокислоты и HBTU получали от фирмы Midwest Biotech (Fishers, IN). Используемые защитные группы боковой цепи представляли собой: Arg(Tos), Asn(Xan), Asp(OcHex), Cys(pMeBzl), His(Bom), Lys(2Cl-Z), Ser(OBzl), Thr(OBzl), Tyr(2Br-Z) и Trp(CHO). Защитная группа боковой цепи на N-конце His представляла собой Boc.
Каждую полную пептидил-смолу обрабатывали раствором 20% пиперидина в диметилформамиде для удаления формильной группы из триптофана. Отщепления с помощью жидкого фтороводорода проводили в присутствии p-крезола и диметилсульфида. Отщепление проводили в течение 1 часа на ледяной бане с использованием HF-прибора (Penninsula Labs). После выпаривания HF осадок суспендировали в диэтиловом эфире и отфильтровывали твердые материалы. Каждый пептид экстрагировали в 30-70 мл водного раствора уксусной кислоты и разведенную аликвоту анализировали с помощью HPLC [Beckman System Gold, 0,46×5 см Zorbax C8, 1 мл/мин, 45C, 214 нм, буфер А=0,1%TFA, B=0,1% TFA/90% ацетонитрил, градиент от 10% до 80% B в течение 10 мин].
Очистку проводили на FPLC в колонке 2,2×25 см Kromasil Cl8, осуществляя мониторинг с помощью УФ при 214 нм и собирая фракции через 5 минут. Гомогенные фракции объединяли и лиофилизировали с получением продукта с чистотой >95%. Корректное значение молекулярной массы и чистоту подтверждали с использованием MALDI-масс-спектрального анализа.
Общий протокол пэгилирования: (Cys-малеимидо)
Типично, Cys-аналог глюкагона растворяли в фосфатно-солевом буферном растворе (5-10 мг/мл) и добавляли 0,01M этилендиаминтетрауксусной кислоты (10-15% от общего объема). Добавляли избыток (2-кратный) реагента малеимидо-метокси-ПЭГ (Nektar) и реакцию проводили с перемешиванием при комнатной температуре, осуществляя мониторинг прохождения реакции с помощью HPLC. Через 8-24 часа реакционную смесь подкисляли и наносили на препаративную колонку с обратной фазой для очистки с использованием градиента 0,1% TFA/ацетонитрил. Подходящие фракции объединяли и лиофилизировали с получением целевых пэгилированных аналогов.
ПРИМЕР 1
Синтез глюкагона Cys17(l-29) и подобных моно-Cys-аналогов.
0,2 ммоль Boc-Thr(OBzl)-Pam-смолы (SynChem Inc) помещали в реакционную камеру объемом 60 мл и следующую последовательность вводили и прогоняли на модифицированном пептидном синтезаторе фирмы Applied Biosystems 430A с использованием FastBoc HBTU-активированных одиночных конденсаций.
HSQGTFTSDYSKYLDSCRAQDFVQWLMNT (SEQ ID NO: 27)
Использовали следующие защитные группы для боковой цепи: Arg(Tos), Asp(OcHex), Asn(Xan), Cys(pMeBzl), Glu(OcHex), His(Boc), Lys(2Cl-Z), Ser(Bzl), Thr(Bzl), Trp(CHO), и Tyr(Br-Z). Полную пептидил-смолу обрабатывали с помощью 20% пиперидин/диметилформамида для удаления формильной защиты Trp, затем переносили в реакционную камеру для HF и сушили на вакууме. Добавляли 1 мл p-крезола и 0,5 мл диметилсульфида вместе с магнитной мешалкой. Камеру присоединяли к HF-прибору (Pennisula Labs), охлаждали на сухом льду/метаноловой бане, удаляли и конденсировали в ней приблизительно 10 мл жидкого фтороводорода. Реакцию проводили при перемешивании на ледяной бане в течение 1 часа, затем HF удаляли в вакууме. Осадок суспендировали в этиловом эфире; твердые материалы отфильтровывали, промывали с помощью эфира и пептид экстрагировали в 50 мл водного раствора уксусной кислоты. Осуществляли анализ HPLC [0,46×5 см Zorbax C8, 1 мл/мин, 45C, 214 нм, A буфер 0,1% TFA, B буфер 0,1% TFA/90% ACN, градиент=10%B-80%B в течение 10 мин] с небольшим образцом отщепляющего экстракта. Оставшийся экстракт загружали в 2,2×25см Kromasil C18 препаративную колонку с обращенной фазой и осуществляли ацетонитрильный градиент с использованием системы Pharmacia FPLC. 5-мин фракции собирали, осуществляя мониторинг с помощью УФ при 214 нм (2A). A=0,1% TFA, B=0,1% TFA/50% ацетонитрил. Градиент = 30%B-100%B в течение 450 мин.
Фракции, содержащие самый чистый продукт (48-52), объединяли, замораживали и лиофилизировали с получением 30,1 мг. HPLC-анализ продукта демонстрировал чистоту >90%, и MALDI-масс-спектральный анализ демонстрировал целевую массу, составляющую 3429,7. Глюкагон Cys21, Глюкагон Cys24 и Глюкагон Cys29 получали подобным образом.
ПРИМЕР 2
Синтез глюкагона-Cex и других удлиненных с C-конца аналогов.
285 мг (0,2 ммоль) метоксибензгидриламин-смолы (Midwest Biotech) помещали в реакционную камеру объемом 60 мл и следующую последовательность прогоняли на модифицированном пептидном синтезаторе фирмы Applied Biosystems 430A с использованием FastBoc HBTU-активированных одиночных конденсаций.
HSQGTFTSDYSKYLDSRRAQDFVQWLMNTGPSSGAPPPS (SEQ ID NO:28)
Использовали следующие защитные группы для боковой цепи: Arg(Tos), Asp(OcHex), Asn(Xan), Cys(pMeBzl), Glu(OcHex), His(Boc), Lys(2Cl-Z), Ser(Bzl), Thr(Bzl), Trp(CHO) и Tyr(Br-Z). Полную пептидил-смолу обрабатывали с помощью 20% пиперидин/диметилформамида для удаления формильной защиты Trp, затем переносили в реакционную камеру для HF и сушили на вакууме. Добавляли 1 мл p-крезола и 0,5 мл диметилсульфида вмсте с магнитной мешалкой. Камеру присоединяли к HF-прибору (Pennisula Labs), охлаждали на сухом льду/метаноловой бане, удаляли и конденсировали в ней приблизительно 10 мл жидкого фтороводорода. Реакцию проводили при перемешивании на ледяной бане в течение 1 часа, затем HF удаляли в вакууме. Осадок суспендировали в этиловом эфире; твердые материалы отфильтровывали, промывали с помощью эфира и пептид экстрагировали в 50 мл водного раствора уксусной кислоты. Осуществляли анализ HPLC [0,46×5 см Zorbax C8, 1 мл/мин, 45C, 214 нм, A буфер 0,1% TFA, B буфер 0,1% TFA/90% ACN, градиент=10%B-80%B в течение 10 мин] с небольшим образцом отщепляющего экстракта. Экстракт загружали в 2,2×25 см Kromasil C18 препаративную колонку с обратной фазой и осуществляли ацетонитрильный градиент для элюирования с использованием системы Pharmacia FPLC. 5-мин фракции собирали, осуществляя мониторинг с помощью УФ при 214 нм (2A). A=0,1% TFA, B=0,1% TFA/50% ацетонитрил. Градиент = 30%B-100%B в течение 450 мин. Фракции 58-65, содержащие самый чистый продукт (48-52), объединяли, замораживали и лиофилизировали с получением 198,1 мг.
HPLC-анализ продукта подтвердил чистоту выше чем 95%. MALDI-масс-спектральный анализ демонстрировал присутствие целевой теоретической массы, составляющей 4316,7 с продуктом в виде С-концевого амида. Оксинтомодулин и оксинтомодулин-KRNR получали подобно способу получения C-концевых карбоновых кислот начиная с загрузки подходящим образом PAM-смолы.
ПРИМЕР 3
Глюкагон Cys17 Mal-ПЭГ-5K
15,1 мг Глюкагона Cys17(l-29) и 27,3 мг метоксиполи(этиленгликоль)малеимида со средней молекулярной массой 5000 (mПЭГ-Mal-5000, Nektar Therapeutics) растворяли в 3,5 мл фосфатно-солевого буферного раствора (PBS) и добавляли 0,5 мл 0,01M этилендиаминтетрауксусной кислоты (EDTA). Реакцию проводили при перемешивании при комнатной температуре, осуществляя мониторинг прохождения реакции с помощью HPLC [0,46×5 см Zorbax C8, 1 мл/мин, 45C, 214 нм (0,5A), A=0,1% TFA, B=0,1% TFA/90% ACN, градиент=10%B-80%B в течение 10 мин].
Через 5 часов реакционную смесь загружали в 2,2×25 см Kromasil Cl 8 препаративную колонку с обращенной фазой. Градиент ацетонитрила проводили на Pharmacia FPLC, осуществляя мониторинг с помощью УФ-излучения при длине волны 214 нм и собирая 5-мин фракции. A=0,1% TFA, B=0,1% TFA/50% ацетонитрил, градиент 30%B-100%B в течение 450 мин. Фракции, соответствующие продукту, объединяли, замораживали и лиофилизировали с получением 25,9 мг.
Этот продукт анализировали на HPLC [0,46×5 см Zorbax C8, 1 мл/мин, 45C, 214 нм (0,5A), A=0,1% TFA, B=0,1% TFA/90% ACN, градиент=10%B-80%B в течение 10 мин], который показал чистоту приблизительно 90%. MALDI (ионизация лазерной десорбцией с использованием матрицы) масс-спектральный анализ показал широкий интервал масс (типичный для производных ПЭГ), составляющий 8700-9500. Этот факт показывает дополнение к массе исходного пептида глюкагона (3429), составляющее приблизительно 5000 а.м.е.
ПРИМЕР 4
Глюкагон Cys21 Mal-ПЭГ-5K
21,6 мг Глюкагона Cys21(l-29) и 24 мг mПЭГ-MAL-5000 (Nektar Therapeutics) растворяли в 3,5 мл фосфатно-солевом буферном растворе (PBS) и добавляли 0,5 мл 0,01M этилендиаминтетрауксусной кислоты (EDTA). Реакцию проводили при перемешивании при комнатной температуре. Через 2 часа добавляли другие 12,7 мг mПЭГ-MAL-5000. Через 8 часов реакционную смесь загружали в 2,2×25 см Vydac Cl8 препаративную колонку с обращенной фазой и проводили градиент ацетонитрила на Pharmacia FPLC при 4 мл/мин, осуществляя сбор 5-мин фракций. A=0,1% TFA, B=0,1% TFA/50% ACN. Градиент = 20%-80%B в течение 450 мин.
Фракции, соответствующие появлению продукта, объединяли, замораживали и лиофилизировали с получением 34 мг. Анализ проводили с помощью HPLC [0,46×5 см Zorbax C8, 1 мл/мин, 45C, 214 нм (0,5A), A=0,1% TFA, B=0,1% TFA/90% ACN, градиент = 10%B-80%B в течение 10 мин], который показал наличие гомогенного продукта, который отличался от исходного пептида глюкагона. MALDI (ионизация лазерной десорбцией с использованием матрицы) масс-спектральный анализ показал широкий интервал масс (типичный для производных ПЭГ), составляющий 8700-9700. Этот факт показывает дополнение к массе исходного пептида глюкагона (3470), составляющее приблизительно 5000 а.м.е.
ПРИМЕР 5
Глюкагон Cys24 Mal-ПЭГ-5K
20,1 мг Глюкагона C24(l-29) и 39,5 мг mПЭГ-Mal-5000 (Nektar Therapeutics) растворяли в 3,5 мл PBS при перемешивании и добавляли 0,5 мл 0,01M EDTA. Реакцию проводили при перемешивании при комнатной температуре в течение 7 часов, затем добавляли другие 40 мг mПЭГ-Mal-5000. Приблизительно через 15 часов реакционную смесь загружали в 2,2×25 см Vydac Cl8 препаративную колонку с обращенной фазой и проводили градиент ацетонитрила на Pharmacia FPLC. Собирали 5-мин фракции, осуществляя мониторинг с помощью УФ при 214 нм (2А). A буфер = 0,1% TFA, B буфер =0,1% TFA/50% ACN, градиент = 30%-100%B в течение 450 мин. Фракции, соответствующие продукту, объединяли, замораживали и лиофилизировали с получением 45,8 мг. MALDI-масс-спектральный анализ показал типичный для ПЭГ широкий сигнал с максимумом, составляющим 9175,2, который приблизительно на 5000 а.м.е. больше, чем у Глюкагона C24 (3457,8).
ПРИМЕР 6
Глюкагон Cys24 Mal-ПЭГ-20K
25,7 мг Глюкагона Cys24(l-29) и 40,7 мг mПЭГ-Mal-20K (Nektar Therapeutics) растворяли в 3,5 мл PBS при перемешивании при комнатной температуре и добавляли 0,5 мл 0,01M EDTA. Через 6 часов отношение исходного материала к продукту составило приблизительно 60:40, что было определено с помощью HPLC. Другие 25,1 мг mПЭГ-Mal-20K добавляли к реакционной смеси при перемешивании в течение еще 16 часов. Соотношение продуктов значительно не улучшилось, поэтому реакционную смесь загружали в 2,2×25 см Kromasil C18 препаративную колонку с обращенной фазой и очищали на Pharmacia FPLC с использованием градиента 30%B-100%B в течение 450 мин. A буфер = 0,1% TFA, B буфер = 0,1% TFA/50% ACN, поток = 4 мл/мин, и собирали 5-мин фракции, осуществляя мониторинг с помощью УФ при 214 нм (2A). Фракции, содержащие гомогенный продукт, объединяли, замораживали и лиофилизировали с получением 25,7 г. Чистота, определенная с помощью анализа HPLC, составила ~ 90%. MALDI-масс-спектральный анализ показал наличие широкого пика от 23000 до 27000, что приблизительно на 20000 a.м.е. больше, чем у исходного Глюкагона C24 (3457,8).
ПРИМЕР 7
Глюкагон Cys29 Mal-ПЭГ-5K
20 мг Глюкагона Cys29(1-29) и 24,7 мг mПЭГ-Mal-5000 (Nektar Therapeutics) растворяли в 3,5 мл PBS при перемешивании при комнатной температуре и добавляли 0,5 мл 0,01M EDTA. Через 4 часа добавляли другие 15,6 мг mПЭГ-Mal-5000 для стимулирования реакции к завершению. Через 8 часов реакционную смесь загружали в 2,2×25см Vydac Cl8 препаративную колонку с обращенной фазой и проводили градиент ацетонитрила на системе Pharmacia FPLC. Собирали 5-мин фракции, осуществляя мониторинг с помощью УФ при 214 нм (2А). A=0,1% TFA, B=0,1% TFA/50% ACN. Фракции 75-97 объединяли, замораживали и лиофилизировали с получением 40 мг продукта, отличного от извлеченного исходного материала на HPLC (фракции 58-63). Анализ продукта проводили с помощью HPLC [0,46×5 см Zorbax C8, 1 мл/мин, 45C, 214 нм (0,5A), A=0,1% TFA, B=0,1% TFA/90% ACN, градиент = 10%B-80%B в течение 10 мин], который показал чистоту больше чем 95%. MALDI-масс-спектральный анализ показал присутствие компонента ПЭГ с массой в интервале 8000-10000 (максимум при 9025,3), которая на 5540 a.м.е. больше, чем у стартового материала (3484,8).
ПРИМЕР 8
Глюкагон Cys24 (2-бутиролактон)
К 24,7 мг Глюкагона Cys24(l-29) добавляли 4 мл 0,05M бикарбоната аммония/50% ацетонитрила и 5,5 мкл раствора 2-бром-4-оксимасляная кислота-γ-лактон (100 мкл в 900 мкл ацетонитрила). Через 3 часа перемешивания при комнатной температуре в реакционную смесь добавляли другие 105 мкл раствора лактона, реакционную смесь перемешивали еще 15 часов. Реакционную смесь разводили до 10 мл с помощью 10% водного раствора уксусной кислоты и загружали в 2,2×25 см Kromasil C18 препаративную колонку с обращенной фазой. Градиент ацетонитрила (20%B-80%B в течение 450 мин) осуществляли на Pharmacia FPLC, собирая 5-мин фракции и осуществляя мониторинг с помощью УФ при 214 нм (2A). Поток = 4 мл/мин, A=0,1% TFA, B=0,1% TFA/50% ACN. Фракции 74-77 объединяли, замораживали и лиофилизировали с получением 7,5 мг. Анализ HPLC показал чистоту 95%, и MALDI-масс-спектральный анализ показал массу 3540,7 или на 84 массовых единицы больше, чем в стартовом материале. Этот результат согласуется с дополнением в виде одного компонента бутиролактона.

Точная масса =3538
Молекулярная формула = C155H226N42O50S2
ПРИМЕР 9
Глюкагон Cys24(S-карбоксиметил)
18,1 мг Глюкагона Cys24(l-29) растворяли в 9,4 мл 0,1M натрий фосфатного буфера (pH 9,2) и добавляли 0,6 мл раствора бромуксусной кислоты (1,3 мг/мл в ацетонитриле). Реакцию проводили при перемешивании при комнатной температуре и за прохождением реакции следили путем последующего анализа HPLC. Через 1 час добавляли еще 0,1 мл раствора бромуксусной кислоты. Реакционную смесь перемешивали еще 60 мин. Затем подкисляли с помощью водного раствора уксусной кислоты и загружали в 2,2×25 см Kromasil C18 препаративную колонку с обращенной фазой для очистки. Градиент ацетонитрила осуществляли на Pharmacia FPLC (поток = 4 мл/мин), собирая 5-мин фракции и осуществляя мониторинг с помощью УФ при 214 нм (2A). A=0,1% TFA, B=0,1% TFA/50% ACN. Фракции 26-29 объединяли, замораживали и лиофилизировали с получением нескольких мг продукта. Анализ HPLC подтвердил чистоту 90%, и MALDI-масс-спектральный анализ подтвердил массу целевого продукта, составляющую 3515.

Точная масса =3512
Молекулярная формула = C153H224N42O50S2
ПРИМЕР 10
Глюкагон Cys24 малеимидо,ПЭГ-3,4K-димер
16 мг Глюкагона Cys24 и 1,02 мг Mal-ПЭГ-Mal-3400, поли(этиленгликоль)-бис-малеимида со средней молекулярной массой 3400 (Nektar Therpeutics), растворяли в 3,5 мл фосфатно-солевого буферного раствора и 0,5 мл 0,01M EDTA и реакцию проводили при перемешивании при комнатной температуре. Через 16 часов добавляли еще 16 мг Глюкагона Cys24 и продолжали перемешивание. Приблизительно через 40 часов реакционную смесь загружали в Pharmcia PepRPC 16/10 колонку и проводили градиент ацетонитрила на Pharmacia FPLC, осуществляя сбор 2-мин фракций и осуществляя мониторинг с помощью УФ при 214 нм (2A). Поток=2 мл/мин, A=0,1% TFA, B=0,1% TFA/50% ACN. Фракции 69-74 объединяли, замораживали и лиофилизировали с получением 10,4 мг. Анализ HPLC показал чистоту 90%, и MALDI-масс-спектральный анализ показал присутствие компонента с массой в интервале 9500-11000, которая согласуется с массой целевого димера.
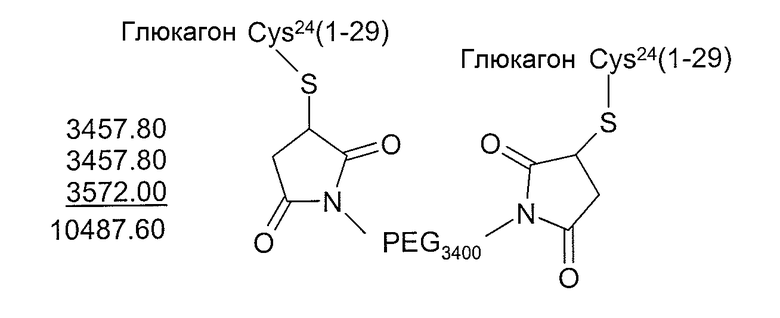
ПРИМЕР 11
Анализы растворимости глюкагона:
Раствор (l мг/мл или 3 мг/мл) глюкагона (или аналога) получали в 0,01N HCl. 100 мкл основного раствора разводили до 1 мл с помощью 0,01N HCl и определяли УФ-поглощение (276 нм). Значение pH оставшегося основного раствора доводили до pH 7 с использованием 200-250 мкл раствора 0,1M Na2HPO4 (pH 9,2). Раствор оставляли на ночь при 4ºC, затем центрифугировали. Затем растворяли 100 мкл супернатанта до 1 мл с помощью 0,01N HCl и определяли УФ-поглощение (в двух экземплярах). Исходное считывание поглощения компенсировалось увеличением объема, и для определения процента растворимости использовали следующий расчет:
(Конечное поглощение/исходное поглощение)×100 = процент растворимости
Результаты показаны в Таблице 1, где Глюкагон-Cex представляет собой дикий тип глюкагона (SEQ ID NO: 1) вместе с карбокси-концевой вставкой последовательности SEQ ID NO: 20, и Глюкагон-Cex R12 представляет собой последовательность SEQ ID NO:1, где Lys в положении 12 заменен на Arg и к карбоксильному концу вставлен пептид последовательности SEQ ID NO: 20.
Растворимость аналогов агонистов глюкагона, D28, E29, E30, E15D28, D28E30, D28E29, исследовали с использованием того же анализа, что используется для соединений, приведенных в Таблице 1. Данные (показанные на Фиг. 3 и 4) демонстрируют повышенную растворимость аналогов D28, E29, E30, E15D28, D28E30, D28E29 по отношению к нативному глюкагону при значениях pH 5,5 и 7. Данные, представленные на Фиг. 3, характеризуют растворимость, измеренную через 60 часов при 25ºC, тогда как данные, представленные на Фиг. 4, характеризуют растворимость, измеренную через 24 часа при 25ºC и затем через 24 часа при 4ºC. Фиг. 5 характеризует данные, касающиеся максимальной растворимости аналогов глюкагона D28, D28E30 и E15D28.
ПРИМЕР 12
Анализ связывания рецептора глюкагона
Аффинность пептидов к рецептору глюкагона измеряли с помощью конкурентного анализа связывания с использованием технологии сцинтилляционного анализа сближения. Последовательные 3-кратные разведения пептидов, произведенные в буфере для сцинтилляционного анализа сближения (0,05 M Tris-HCl, pH 7,5; 0,15 M NaCl, 0,1% масс./об. бычий сывороточный альбумин), смешивали в лунке 96-луночного белого/чистого планшета (Corning Inc., Acton, MA) с 0,05 нM (3-[125I]-иодотирозил) Tyr10-глюкагоном (Amersham Biosciences, Piscataway, NJ) с фрагментами плазматической мембраны, полученными из клеток, сверхэкспрессирующих рецептор глюкагона человека, в количестве 1-6 микрограмм на лунку, и 1 мг/на лунку гранул для сцинтилляционного анализа сближения с обработанным полиэтиленимином агглютинином типа А из зародышей пшеницы (Amersham Biosciences, Piscataway, NJ). После встряхивания в течение 5 минут при 800 об/мин на ротационном шейкере планшеты инкубировали 12 часов при комнатной температуре и затем считывали на жидкостном сцинтилляционном счетчике MicroBetal450 (Perkin-Elmer, Wellesley, MA). Неспецифически связанную радиоактивность (NSB) измеряли в лунках с концентрацией "холодного" нативного лиганда в 4 раза выше, чем наибольшая концентрация в тестируемых образцах и общую связанную радиоактивность детектировали в лунках в отсутствие конкурентного соединения. Процент специфичного связывания рассчитывали по следующей формуле: % Специфичного Связывания = ((Связанная радиоактивность-NSB)/(Общая связанная радиоактивность-NSB))×100. Значения IC50 определяли с использованием программного обеспечения Origin (OriginLab, Northampton, MA).
ПРИМЕР 13
Функциональный анализ - синтез cAMP
Способность аналогов глюкагона индуцировать cAMP измеряли с помощью репортерного анализа на основе люциферазы светляка. Клетки HEK293 ко-трансфецировали или рецептором глюкагона, или рецептором GLP-I и ген люциферазы, связанный с cAMP-респонсивным элементом, индуцировали с помощью удаления сыворотки путем культивирования в течение 16 часов в среде DMEM (Invitrogen, Carlsbad, CA), дополненной 0,25% бычьей ростовой сывороткой (HyClone, Logan, UT), и затем инкубировали с последовательными разведениями или глюкагона GLP-I, или новых аналогов глюкагона в течение 5 часов при 37ºC, 5% CO2 в 96-луночном планшете с покрытием в виде поли-D-Лизина "Biocoat" (BD Biosciences, San Jose, CA). По окончании инкубирования добавляли в каждую лунку 100 микролитров реагента LucLite, представляющего собой люминесцентный субстрат (Perkin-Elmer, Wellesley, MA). Планшеты быстро встряхивали, инкубировали 10 мин в темноте и измеряли испускание света на жидкостном сцинтилляционном счетчике MicroBeta-1450 (Perkin-Elmer, Wellesley, MA). Эффективные на 50% концентрации рассчитывали с использованием программного обеспечения Origin (OriginLab, Northampton, MA. Результаты показаны в Таблицах 2 и 3.
Данные для дополнительных аналогов глюкагона представлены на Фиг. 6-9 и в Таблице 4
ПРИМЕР 14
Анализ стабильности для Cys-малеимидо-ПЭГ-аналогов глюкагона
Каждый аналог глюкагона растворяли в воде или PBS и проводили исходный анализ HPLC. После приведения pH (4, 5, 6, 7), образцы инкубировали в течение определенного периода времени при 37ºC и повторяли анализ HPLC для определения целостности пептида. Определяли концентрацию определенного пептида, представляющего интерес, и рассчитывали процент оставшегося интактного материала по отношению к исходному анализу. Результаты для глюкагона Cys21-малеимидоПЭГ5K показаны на Фиг. 1 и 2.
ПРИМЕР 15
Изменения концентрации глюкозы в сыворотке у собак бигль после введения аналогов глюкагона
Собак семейства псовых/бигль весом 8-12 кг в возрасте 8-16 месяцев и с хорошим состоянием здоровья использовали для определения фармакокинетики и фармакодинамики действия глюкагона. Каждое животное не кормили в течение ночи и забирали кровь в следующие моменты времени после каждой дозы: 0 ч (перед дозой), через 5, 10, 20, 30, 45, 60, 90, 120, 240 минут после дозы. Шесть животных использовали для каждой группы дозирования и забирали приблизительно 1-2 мл цельной крови в каждый момент времени. Примерно 1 мл цельной крови добавляли к пробиркам K2 EDTA, содержащим подходящий объем Тразилола (апротинин) с получением в результате, по меньшей мере, 500 KIU/мл цельной крови. Приблизительно 500 мкл плазмы собирали после центрифугирования образцов в центрифуге с охлаждением при оборотах примерно 1500-3000g в течение 10-15 мин. Образцы переносили в пластиковые пробирки и замораживали для хранения при -70ºC или ниже. Оставшийся 1 мл цельной крови превращали в сыворотку путем помещения образца крови в пустую пробирку, давая возможность осесть при температуре окружающей среды в течение 15-20 мин, затем центрифугировали при 1500-3000g в течение 10-15 мин. в центрифуге с охлаждением. Образцы переносили в пластиковые пробирки и замораживали для хранения при -70ºC или ниже.
Глюкагон и аналоги растворяли в 0,01N HCl в концентрации 0,1667 мг/мл и вводили животным в дозах, составляющих 0,03 мл/кг.
Животным вводили внутримышечно дозу 0,005 мг/кг или глюкагона, или аналога глюкагона, включающего глюкагон вместе с последовательностью SEQ ID NO: 31, связанной с карбокси-концевой областью глюкагона (глюкагон-CEX), или аналог глюкагона, включающий замену в виде аспарагиновой кислоты в положении 28 (глюкагон-Asp28) SEQ ID NO: 11. Полученные в результате данные представлены на Фиг. 10.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛОГИ ГЛЮКАГОНА, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ РАСТВОРИМОСТЬЮ И СТАБИЛЬНОСТЬЮ В БУФЕРАХ С ФИЗИОЛОГИЧЕСКИМИ ЗНАЧЕНИЯМИ Ph | 2009 |
|
RU2560254C2 |
| ОСНОВАННЫЕ НА АМИДАХ ПРОЛЕКАРСТВА ПЕПТИДОВ ГЛЮКАГОНОВОГО НАДСЕМЕЙСТВА | 2009 |
|
RU2550696C2 |
| КОНЪЮГАТЫ ИНСУЛИН-ИНКРЕТИН | 2014 |
|
RU2678134C2 |
| ПЕПТИДЫ ГЛЮКАГОНОВОГО СУПЕРСЕМЕЙСТВА, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ОТНОСИТЕЛЬНО ЯДЕРНЫХ ГОРМОНАЛЬНЫХ РЕЦЕПТОРОВ | 2011 |
|
RU2604067C2 |
| ПЕПТИДНЫЕ ПРОЛЕКАРСТВА, ПРИНАДЛЕЖАЩИЕ К СУПЕРСЕМЕЙСТВУ АМИД-СОДЕРЖАЩИХ ГЛЮКАГОНОВ | 2011 |
|
RU2580317C2 |
| Конъюгат, содержащий оксинтомодулин и фрагмент иммуноглобулина, и его применение | 2012 |
|
RU2733544C2 |
| КОНЪЮГАТ, СОДЕРЖАЩИЙ ОКСИНТОМОДУЛИН И ФРАГМЕНТ ИММУНОГЛОБУЛИНА, И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2607365C2 |
| АНАЛОГИ ОКСИНТОМОДУЛИНА | 2009 |
|
RU2542362C2 |
| НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЛИТЕЛЬНО ДЕЙСТВУЮЩЕГО КОНЪЮГАТА ЛЕКАРСТВЕННОГО СРЕДСТВА ПОСРЕДСТВОМ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ | 2019 |
|
RU2805873C2 |
| ЛЕКАРСТВЕННЫЕ СРЕДСТВА, СВЯЗАННЫЕ С ДИПЕПТИДАМИ | 2009 |
|
RU2578591C2 |
















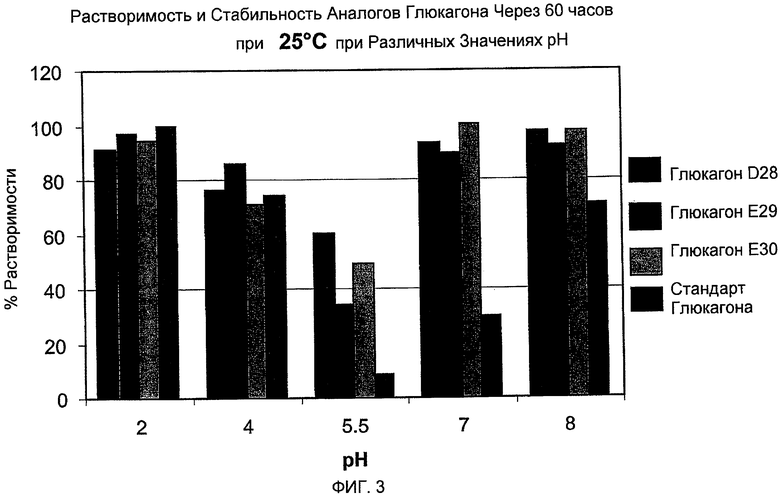
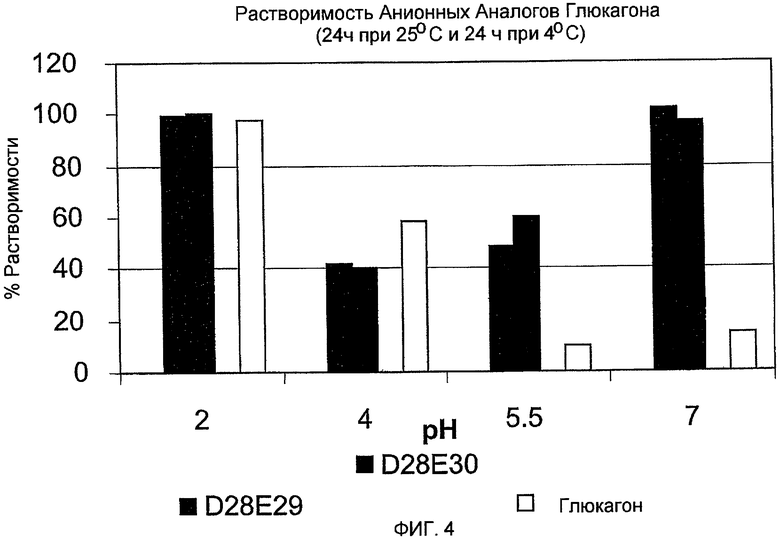
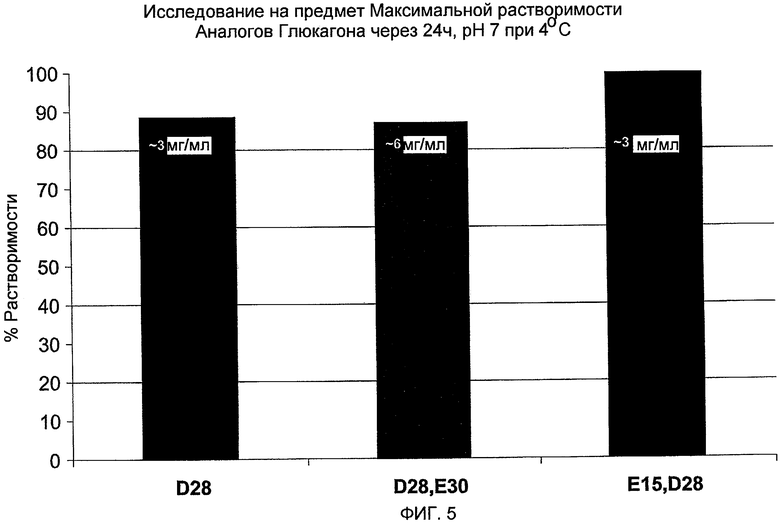
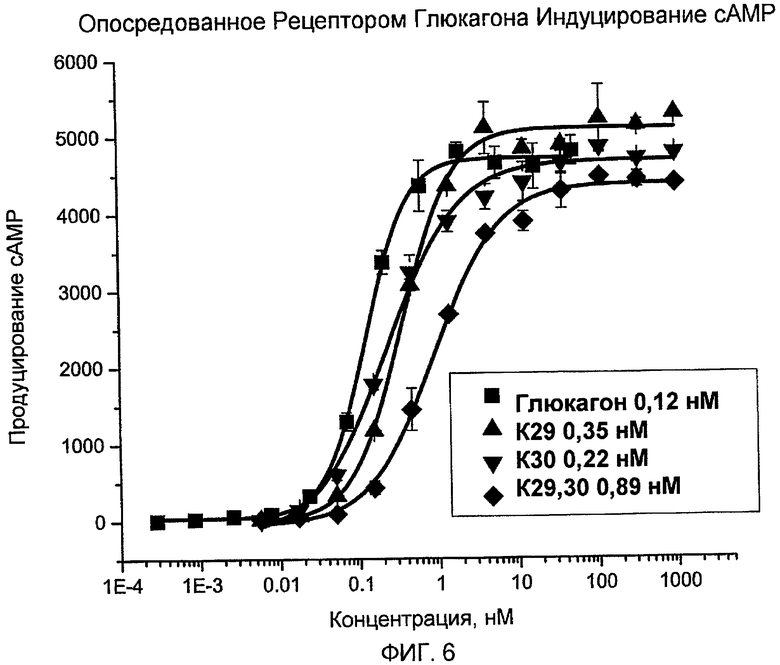
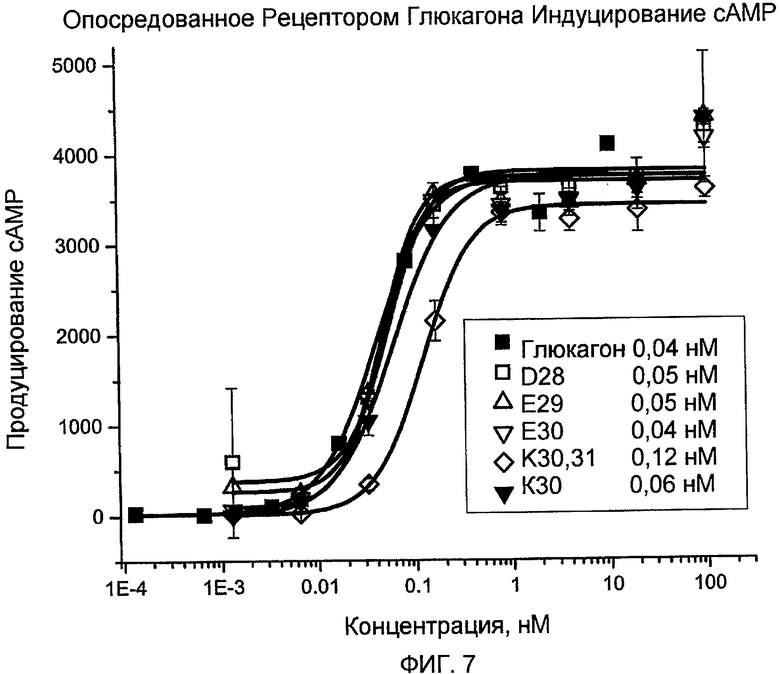
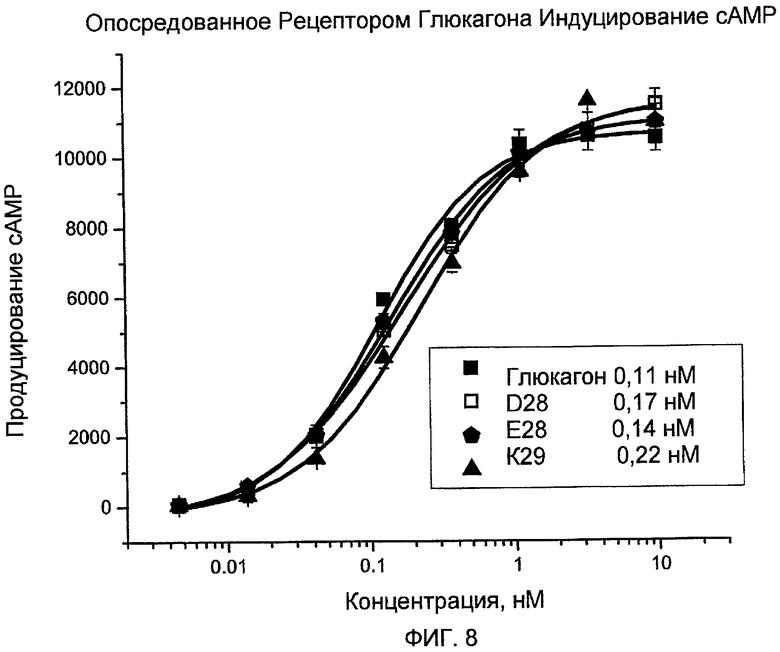
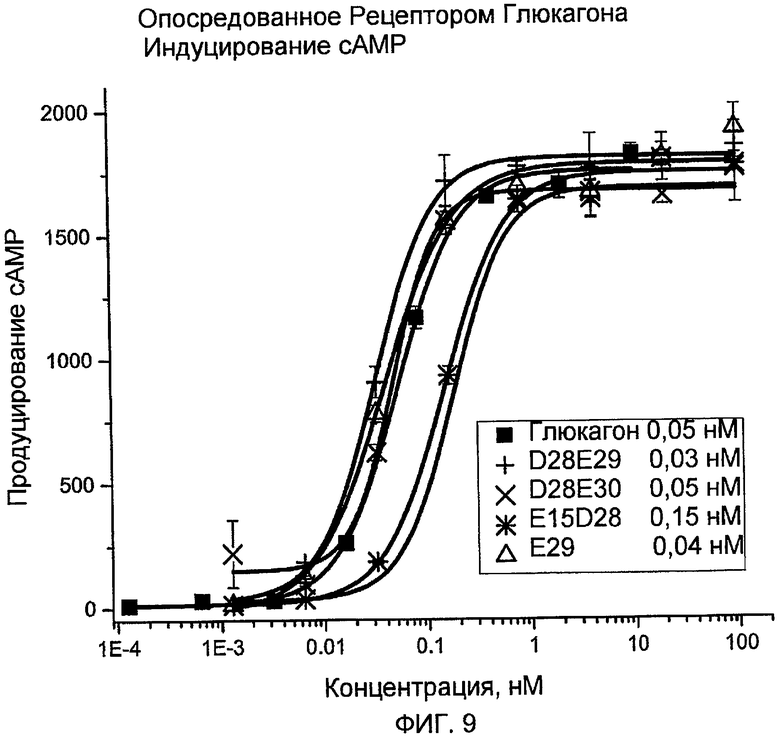

Изобретение относится к области биотехнологии, конкретно к получению аналогов глюкагона, и может быть использовано в медицине. Аминокислотная последовательность пептида включает отрицательно заряженную аминокислоту в положении 28 и отрицательно заряженную аминокислоту в положении 29 или 30 последовательности нативного глюкагона (SEQ ID NO: 1). Также аминокислотная последовательность может включать до 7 дополнительных аминокислотных модификаций по отношению к SEQ ID NO: 1, которые позволяют пептиду глюкагона сохранить активность глюкагона и улучшенную растворимость или стабильность. Полученный пептид используют для лечения гипогликемии и для временного пареза кишечного тракта. Изобретение позволяет получить пептид глюкагона с улучшенной растворимостью или стабильностью по отношению к нативному глюкагону. 7 н. и 8 з.п. ф-лы, 10 ил., 4 табл., 15 пр.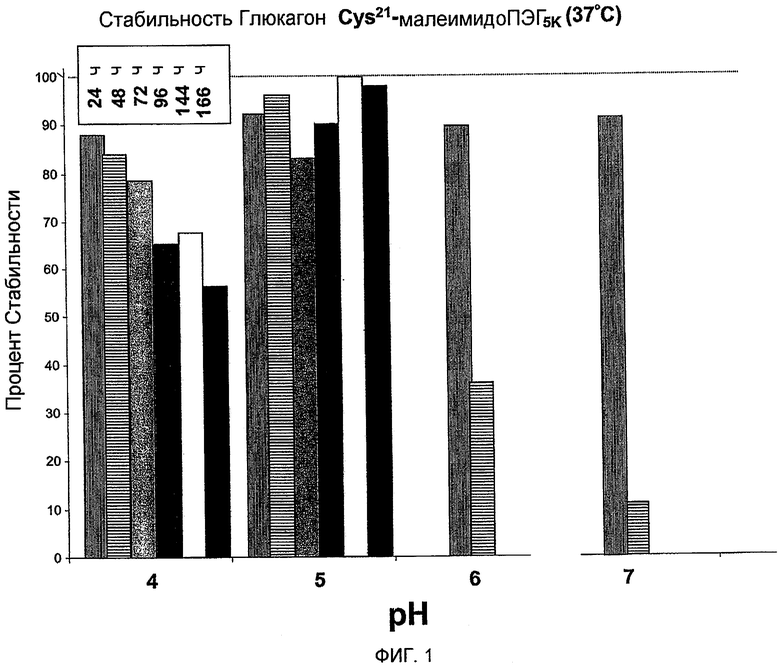
1. Пептид глюкагона с улучшенной растворимостью или стабильностью по отношению к нативному глюкагону (SEQ ID NO: 1), где аминокислотная последовательность пептида представляет собой SEQ ID NO: 1 с отрицательно заряженной аминокислотой в положении 28, отрицательно заряженной аминокислотой в положении 29 или 30 и до 7 дополнительных аминокислотных модификаций по отношению к SEQ ID NO: 1, которые позволяют пептиду глюкагона сохранить активность глюкагона и улучшенную растворимость или стабильность.
2. Пептид глюкагона по п.1, в котором отрицательно заряженные аминокислоты выбраны из группы, состоящей из Glu и Asp.
3. Пептид глюкагона по п.2, в котором (i) аминокислота в положении 28 представляет собой Asp, или (ii) аминокислота в положении 29 представляет собой Glu, или и то, и другое.
4. Пептид глюкагона по п.3, содержащий до 7 дополнительных аминокислотных модификаций в аминокислотах в положениях 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 и 24 по отношению к SEQ ID NO: 1.
5. Пептид глюкагона по п.1, содержащий до 7 дополнительных аминокислотных модификаций по отношению к SEQ ID NO: 1, выбранных из группы, состоящей из:
a. замены аминокислоты в положении 15 на Glu, гомо-Glu, цистеиновую кислоту, гомоцистеиновую кислоту;
b. гидрофильного компонента, ковалентно связанного с положением 16, 17, 20, 21, 24 или 29 указанного пептида глюкагона;
с. последовательности, выбранной из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, связанной с карбоксильным концом указанного пептида глюкагона;
d. аминокислоты в положении 2, выбранной из группы, состоящей из d-серина, аланина, глицина, n-метилсерина и аминоизомасляной кислоты;
или аминокислоты в положении 1, выбранной из группы, состоящей из d-гистидина, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина;
е. замены аминокислоты в положении 27 SEQ ID NO: 1 на Leu или Nle; или
f. их комбинации.
6. Пептид глюкагона с улучшенной растворимостью, включающий последовательность SEQ ID NO: 33 или аналог SEQ ID NO: 33, где указанный аналог отличается от SEQ ID NO: 33 аминокислотными заменами в количестве от одной до трех, причем указанные аминокислотные замены расположены в одном или более положениях, выбранных из положений 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 и 24 аналога, и позволяют пептиду глюкагона сохранить активность глюкагона и улучшенную растворимость при условии, что указанный пептид глюкагона включает кислую аминокислоту в положении 28 и дополнительную кислую аминокислоту в положении 29 или присоединенную к карбоксильному концу пептида.
7. Пептид глюкагона по п.1, где пептид глюкагона содержит любую из последовательностей SEQ ID NO: 7, 8, 11, 13, 32, 34 или 38 с отрицательно заряженной аминокислотой в положении 28, отрицательно заряженной аминокислотой в положении 29 или 30.
8. Пептид глюкагона по п.6, где указанный аналог отличается от SEQ ID NO: 33 аминокислотной заменой в положении 16, 17, 21 или 24 аналога с аминокислотой, ковалентно связанной с гидрофильным компонентом.
9. Пептид глюкагона по п.8, где указанный гидрофильный компонент представляет собой полиэтиленгликоль (ПЭГ).
10. Гомодимер, имеющий активность глюкагона, включающий два пептида глюкагона по пп.1, 4 или 6, связанных друг с другом посредством линкера.
11. Фармацевтическая композиция для лечения гипогликемии, включающая пептид глюкагона по пп.1, 4 или 6, или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
12. Набор реагентов для введения агониста глюкагона нуждающемуся в этом пациенту, причем указанный набор реагентов содержит пептид глюкагона по любому из пп.1-9 и устройство для введения указанной композиции пациенту.
13. Набор реагентов по п.12, где указанное устройство:
представляет собой дозирующее аэрозольное устройство, где композиция предварительно упакована внутри аэрозольного устройства; или
включает шприц и иглу, где композиция предварительно упакована внутри шприца.
14. Применение пептида глюкагона по пп.1, 4 или 6 для лечения гипогликемии.
15. Применение пептида глюкагона по пп.1, 4 или 6 для временного пареза кишечного тракта.
| UNSON C.G | |||
| et al | |||
| Identification of an essential serine residue in glucagon: implication for an active site triad // Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| USA | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| US 5665705 A1, 09.09.1997 | |||
| АНАЛОГИ ГПП-1 | 1999 |
|
RU2208015C2 |
Авторы
Даты
2013-03-10—Публикация
2008-01-03—Подача