Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается приоритет предварительной заявки на патент США No. 61/358188, поданной 24 июня, 2010, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Введение материала в электронной форме посредством ссылки
Электронная версия списка нуклеотидных/аминокислотных последовательностей, прилагаемая к описанию настоящей заявки вместе с распечатанным списком этих последовательностей, была создана 21 июня 2010 в виде одного файла размером 957 кb ACII (текст) под именем «Sequence_Listing_213134» и во всей своей полноте вводится в настоящее описание посредством ссылки.
Предшествующий уровень техники
Пептидные лекарственные средства представляют собой высокоэффективные препараты, которые обладают относительно кратковременным действием и имеют вариабельный терапевтический индекс. Настоящее изобретение относится к пептидным пролекарствам, где производное пролекарства было получено в целях замедления начала его действия и увеличения времени полужизни лекарственного средства. Замедленное начало действия лекарственного средства является преимущественным свойством, так как оно позволяет обеспечивать системное распределение пролекарства перед его активацией. В соответствии с этим, введение пролекарств позволяет избежать осложнений, вызываемых в период максимальной активности лекарственного средства после его введения, и повысить терапевтический индекс родительского лекарственного средства.
Распознавание рецептора и последующий процессинг пептидных и белковых агонистов являются главным путем разложения многих пептидных и белковых лекарственных средств. Таким образом, связывание пептидного лекарственного средства с его рецептором будет приводить к биологической стимуляции, а также к инициации последующей дезактивации пептида/белка, фармакологически индуцируемой посредством ферментативного разложения пептида или белка. В соответствии с настоящим изобретением, пролекарства с пролонгированным временем биологической полужизни пептида или белка могут быть получены с применением стратегии, направленной на ингибирование распознавания пролекарства соответствующим рецептором.
Описанные здесь пролекарства, в конечном счете, подвергаются химическому превращению в структуры, которые могут распознаваться рецептором, где скорость такого химического превращения определяет время начала и продолжительности биологического действия in vivo. Молекулярное конструирование, описанное в настоящей заявке, основано на внутримолекулярной химической реакции, которая не зависит от вспомогательных химических добавок или ферментов.
Пре-проглюкагон представляет собой полипептид-предшественник, состоящий из 158 аминокислот, который процессируется в различных тканях с образованием ряда различных пептидов, происходящих от проглюкагона, включая глюкагон (SEQ ID NO: 701), глюкагон-подобный пептид-1 (GLP-1; аминокислоты 7-36, представленные здесь последовательностями SEQ ID NO: 703 и SEQ ID NO: 704), глюкагон-подобный пептид-2 (GLP-2; SEQ ID NO: 708) и оксинтомодулин (OXM; SEQ ID NO: 706), которые обладают физиологическими функциями широкого ряда, включая гомеостаз глюкозы, секрецию инсулина, опорожнение желудка и увеличение объема тонкого кишечника, а также регуляцию потребление пищи.
Глюкагон представляет собой пептид, состоящий из 29 аминокислот, которые соответствуют аминокислотам 33-61 в последовательности пре-проглюкагона, а GLP-1 продуцируется как пептид, состоящий из 37 аминокислот, соответствующих аминокислотам 72-108 пре-проглюкагона. GLP-1 (7-36) в виде амида (SEQ ID NO: 704; C-конец представляет собой амид аргинина) или GLP-1 (7-37) в виде кислоты (SEQ ID NO: 703; C-конец представляет собой глицин) являются биологически активными формами GLP-1, которые обладают, по существу, эквивалентной активностью по отношению к рецептору GLP-1.
Глюкагон представляет собой жизненно необходимое лекарственное средство, которое используется в экстренной терапии для лечения гипогликемии в тяжелой форме. Сообщалось, что оксинтомодулин обладает фармакологической активностью, направленной на подавление аппетита и снижение массы тела. Клинические исследования агонистов рецептора GLP-1 или стабилизированных аналогов GLP-1 подтвердили, что такое семейство пептидов может оказаться эффективным для лечения диабета типа II. Кроме того, такое лечение, из-за его глюкозозависимого действия, является более безопасным, чем инсулиновая терапия, а поэтому устраняет какой-либо риск развития гипогликемии. Исследование взаимосвязи «структура - активность» показало, что N-концевой гистидин для каждого из этих пептидов (глюкагона, GLP-1 и оксинтомодулина) играет особенно важную роль во всех их функциях, и что N-концевые удлиненные формы значительно снижают биологическую активность.
Известно, что существуют другие пептиды, которые по своей структуре и активности напоминают глюкагон и GLP-1. Так, например, экзендин-4 представляет собой пептид, который присутствует в слюне ядозуба и, по своей структуре, напоминает GLP-1, и так же, как глюкагон и GLP-1, повышает уровень высвобождения инсулина.
Кроме того, полипептид, угнетающий секрецию желудочного сока, (GIP) также известен как глюкозозависимый инсулинотропный пептид и является членом семейства гормонов секретинов. GIP происходит от пробелка, состоящего из 153 аминокислот, кодируемых геном GIP и циркулирует в кровотоке как биологически активный пептид, состоящий из 42 аминокислот (SEQ ID NO: 707). Ген GIP экспрессируется в тонком кишечнике, а также в слюнных железах и является слабым ингибитором секреции желудочного сока. GIP, помимо его ингибирующего действия в желудке в присутствии глюкозы, повышает уровень высвобождения инсулина β-клетками панкреатических островков при введении в физиологических дозах. Очевидно, что GIP функционирует как кишечный фактор, который стимулирует высвобождение инсулина поджелудочной железы и может играть физиологически важную роль в поддержании гомеостаза глюкозы.
Остеокальцин (SEQ ID NO: 709) представляет собой неколлагеновый белок, обнаруживаемый в костях и в дентине. Этот белок секретируется остеобластами и, очевидно, играет определенную роль в минерализации и в гомеостазе ионов кальция. Сообщалось, что остеокальцин функционирует как гормон в организме, стимулирует высвобождение большего количества инсулина бета-клетками поджелудочной железы, и в то же самое время регулирует высвобождение гормона адипонектина жировыми клетками, что приводит к повышению чувствительности к инсулину.
Одним из недостатков терапевтического применения биологически активных пептидов, таких как остеокальцин, GIP, глюкагон, GLP-1 и оксинтомодулин является их очень короткое время полужизни (приблизительно две минуты для глюкагона и GLP-1) в плазме. В соответствии с этим, для осуществления соответствующей регуляции уровня глюкозы, нативные родственные глюкагону пептиды должны вводиться непрерывно в течение длительного периода времени. Короткое время полужизни родственных глюкагону пептидов и GLP-1 обусловлено их быстрым разложением дипептидил-пептидазой IV (DPP-IV), которая расщепляет эти пептиды между второй и третьей аминокислотами. Такое расщепление приводит не только к инактивации нативных пептидов, но, в случае глюкагона и GLP-1, их укороченные формы могут служить функциональными антагонистами их соответствующих рецепторов. В соответствии с этим, для реализации всего терапевтического потенциала механизмов действия этих лекарственных средств необходимо получить варианты GIP, глюкагона, GLP-1 и оксинтомодулина, а также родственных пептидов, которые обладали бы более продолжительным временем действия.
Описание сущности изобретения
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пролекарственному производному биологически активного полипептида, выбранного из группы, состоящей из глюкагона, экзендина-4, GLP-1, GLP-2, GIP, вазоактивного кишечного пептида (VIP), полипептида 27, активирующего аденилатциклазу гипофиза (PACAP-27), пептида, состоящего из гистидина-метионина (PHM), оксинтомодулина, секретина, остеокальцина, рилизинг-фактора гормона роста, а также аналогов, производных и конъюгатов вышеуказанных соединений. Производное пролекарства включает дипептидный элемент пролекарства, ковалентно связанный с активным центром биологически активного полипептида посредством амидной связи. В некоторых вариантах изобретения, дипептид ковалентно связан с биологически активным полипептидом в положении, которое нарушает способность биологически активного полипептида взаимодействовать с его соответствующим рецептором или кофактором. В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с амино-концом биологически активного пептида. Последующее удаление пептида в физиологических условиях и в отсутствии ферментативной активности будет приводить к полному восстановлению активности полипептида.
В некоторых своих вариантах, настоящее изобретение относится к пролекарству, имеющему общую структуру A-B-Q. В этом варианте, Q представляет собой биологически активный пептид, выбранный из группы пептидов, принадлежащих к суперсемейству глюкагонов, включая родственные глюкагону пептиды, остеокальцин, а также их аналоги, производные и конъюгаты, а A-B представляет собой дипептидное пролекарство, связанное с биологически активным пептидом посредством амидной связи. Более конкретно, в некоторых вариантах изобретения, A представляет собой аминокислоту или оксикислоту, а B представляет собой N-алкилированную аминокислоту, связанную с Q посредством амидной связи, образующейся между карбоксилом B (в A-B) и амином Q. Кроме того, в некоторых вариантах изобретения, A, B или аминокислота Q, к которой присоединена A-B, представляют собой некодируемую аминокислоту, а химическое отщепление A-B от Q, по меньшей мере примерно на 90%, происходит приблизительно за 1-720 часов в PBS в физиологических условиях. В другом варианте изобретения, химическое отщепление A-B от Q происходит по меньшей мере примерно на 50% приблизительно за 1 час или приблизительно за 1 неделю в PBS в физиологических условиях.
В некоторых вариантах изобретения, A и B выбирают так, чтобы они ингибировали ферментативное отщепление дипептида A-B от Q под действием ферментов, присутствующих в сыворотке млекопитающих. В некоторых вариантах изобретения, A и/или B выбирают так, чтобы полупериод отщепления A-B от Q в PBS в физиологических условиях не превышал более, чем в два раза полупериод отщепления и A-B от Q в растворе, содержащем протеазу DPP-IV (то есть, так, чтобы отщепление A-B от Q в присутствии протеазы DPP-IV и в физиологических условиях не происходило более, чем в 2 раза быстрее, чем в идентичных условиях в отсутствии фермента). В некоторых вариантах изобретения, A и/или B представляют собой аминокислоту в конфигурации стереоизомера D. В некоторых репрезентативных вариантах изобретения, A представляет собой аминокислоту в конфигурации стереоизомера D, а В представляет собой аминокислоту в конфигурации стереоизомера L. В некоторых репрезентативных вариантах изобретения, A представляет собой аминокислоту в конфигурации стереоизомера L, а В представляет собой аминокислоту в конфигурации стереоизомера D. В некоторых репрезентативных вариантах изобретения, A представляет собой аминокислоту в конфигурации стереоизомера D и В представляет собой аминокислоту в конфигурации стереоизомера D.
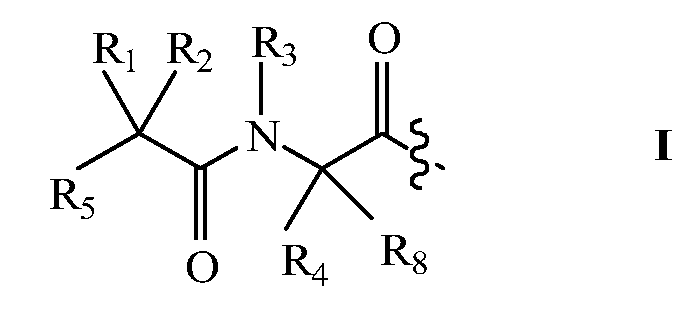
В некоторых вариантах изобретения, дипептидный элемент пролекарства (A-B) включает соединение, имеющее общую структуру формулы I:
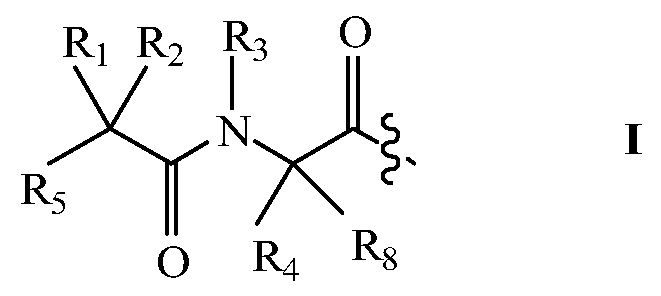
где R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)OH, (С1-С18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(W1)C1-C12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил или арил; или R4 и R8, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С18алкила, (С1-С18алкил)OH, (С1-С18алкил)NH2, (С1-С18алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, и (C1-C4алкил)(C3-C9гетероарил), или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, C1-C8алкил, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH.
Очевидно, что если W1 представляет собой N, то в физиологических условиях, атом азота связан с H.
В другом варианте изобретения, дипептидный элемент пролекарства (A-B) включает соединение, имеющее общую структуру формулы I:
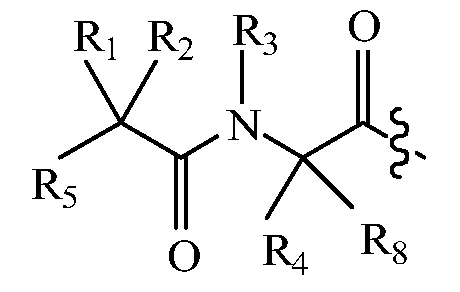
где R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)OH, (С1-С18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(W1)C1-C12алкил, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил или арил; или R4 и R8, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С18алкила, (С1-С18алкил)OH, (С1-С18алкил)NH2, (С1-С18алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, и (C1-C4алкил)(C3-C9гетероарил), или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, C1-C8алкил, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена.
Как описано выше, в некоторых своих аспектах, настоящее изобретение относится к пролекарству, имеющему общую структуру A-B-Q, где Q представляет собой пептид, принадлежащий к суперсемейству глюкагонов (например, родственный глюкагону пептид, рилизинг-фактор гормона роста (GHRH; SEQ ID NO: 719), вазоактивный кишечный пептид (VIP; SEQ ID NO: 720), полипептид 27, активирующий аденилат-циклазу гипофиза (PACAP-27; SEQ ID NO: 721), пептид, состоящий из гистидина-метионина (PHM; SEQ ID NO: 722), или секретин (SEQ ID NO: 723), и/или их аналоги, производные и конъюгаты). Пептиды, принадлежащие к суперсемейству глюкагонов, могут иметь общие структурные свойства, включая, но не ограничиваясь ими, гомологию в N-концевых аминокислотах и/или альфа-спиральную структуру в С-концевой части. Очевидно, что С-конец обычно связывается с рецептором, а N-конец обычно участвует в передаче сигнала рецептору. Несколько аминокислот в N-концевой части и в С-концевой части являются в высокой степени консервативными среди членов суперсемейства глюкагонов, например, His1, Gly4, Phe6, Phe22, Val23, Trp25 и Leu26, причем, аминокислоты в этих положениях являются идентичными по консервативным заменам или имеют сходные аминокислотные боковые цепи. В некоторых вариантах изобретения, Q представляет собой родственный глюкагону пептид, например, глюкагон (SEQ ID NO: 701), оксинтомодулин (SEQ ID NO: 706), экзендин-4 (SEQ ID NO: 718), глюкагон-подобный пептид-1 (GLP-1) (аминокислоты 7-37, представленные в SEQ ID №№: 703 и 707), глюкагон-подобный пептид-2 (GLP-2) (SEQ ID NO: 708), GIP (SEQ ID NO: 707) или их аналоги, производные и конъюгаты. В некоторых вариантах изобретения, Q представляет собой родственный глюкагону пептид, содержащий аминокислотную последовательность, которая по меньшей мере примерно на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична соответствующей последовательности нативного глюкагона, нативного оксинтомодулина, нативного экзендина-4, нативного (7-37)GLP-1, нативного GLP-2 или нативного GIP по всей длине нативного пептида (или во всех положениях, соответствующих глюкагону, см., например, фиг. 10). В других вариантах изобретения, пептид, принадлежащий к суперсемейству глюкагонов (Q), содержит аминокислотную последовательность нативного глюкагона, нативного экзендина-4, нативного (7-37)GLP-1, нативного GLP-2, нативного GHRH, нативного VIP, нативного PACAP-27, нативного PHM, нативного оксинтомодулина, нативного секретина или нативного GIP, имеющую до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных модификаций. В других вариантах изобретения, Q содержит аминокислотную последовательность, которая представляет собой химеру из двух или более нативных последовательностей пептида, родственного глюкагону. В некоторых вариантах изобретения, Q содержит аминокислотную последовательность, которая по меньшей мере примерно на 50% идентична последовательности нативного глюкагона (SEQ ID NO: 701), и которая сохраняет альфа-спиральную конформацию аминокислот, соответствующих аминокислотам 12-29 SEQ ID NO:701.
Q может быть любым известным пептидом, принадлежащим к суперсемейству глюкагонов, включая, например, любые родственные глюкагону пептиды, известные специалистам, некоторые из которых описаны в настоящей заявке как неограничивающие примеры. Различные аналоги GLP-1 известны специалистам и представляют собой родственный глюкагону пептид согласно изобретению, см., например, заявки WO 2008023050, WO 2007030519, WO 2005058954, WO 2003011892, WO 2007046834, WO 2006134340, WO 2006124529, WO 2004022004, WO 2003018516, WO 2007124461, каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки, и в которых представлены последовательности или формулы аналогов или производных GLP-1. В некоторых вариантах изобретения, Q представляет собой родственный глюкагону пептид, принадлежащий к классу 1, 2, 3, 4 или 5, как подробно описано в настоящей заявке. В любом из описанных здесь вариантов, Q представляет собой любую из последовательностей SEQ ID NN: 1-684, 701-742, 801-919, 1001-1262, 1301-1371, 1401-1518, 1701-1776 и 1801-1908.
Хотя дипептидное пролекарство, например, A-B, может быть связано с Q в любом положении, которое блокирует активность Q, однако, в описанных здесь вариантах представлены примеры положений, которые являются подходящими для связывания A-B. Если представленные здесь положения пронумерованы со ссылкой на положения в нативной последовательности глюкагона (SEQ ID NO: 701), то соответствующее положение в аналогах глюкагона или в других пептидах, принадлежащих к суперсемейству глюкагона, может быть определено путем выравнивания. См., например, фиг. 10, где проиллюстрировано выравнивание некоторых пептидов, принадлежащих к суперсемейству глюкагонов. Так, например, положение 24 в нативном глюкагоне соответствует положению 24 (7-37) GLP-1.
В некоторых вариантах изобретения, пептид, принадлежащий к суперсемейству глюкагонов, может содержать С-конец или C-концевую аминокислотную последовательность, включая, но не ограничиваясь ими, COOH, CONH2, GPSSGAPPPS (SEQ ID NO: 710), GPSSGAPPPS-CONH2 (SEQ ID NO: 711), карбокси-концевое удлинение оксинтомодулина, KRNRNNIA (SEQ ID NO: 714) или KGKKNDWKHNITQ (SEQ ID NO: 713). Кроме того, C-концевые аминокислотные последовательности для пептидов, принадлежащих к семейству глюкагонов, более подробно описаны ниже.
В других аспектах изобретения, Q содержит остеокальцин (SEQ ID NO: 709) или аминокислотную последовательность, которая по меньшей мере примерно на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична последовательности нативного остеокальцина по всей длине нативного пептида. Q может содержать аналог остеокальцина, в котором, по сравнению с нативным остеокальцином, имеются до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных модификаций. В других аспектах изобретения, Q содержит рилизинг-фактор гормона роста (GHRH) (SEQ ID NO: 719) или аминокислотную последовательность, которая по меньшей мере примерно на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична нативному GHRH по всей длине нативного пептида. Q может содержать аналог GHRH, в котором, по сравнению с нативным GHRH, имеется до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных модификаций. В некоторых вариантах изобретения, Q может представлять собой любой аналог остеокальцина или GHRH, известный специалистам.
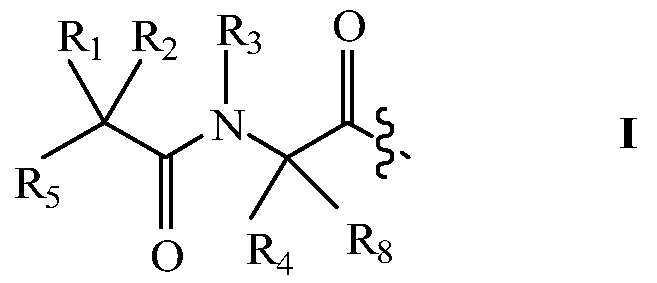
В других своих вариантах, настоящее изобретение относится к пролекарству, имеющему общую структуру A-B-Q, где Q представляет собой пептид, принадлежащий к суперсемейству глюкагонов, остеокальцин или их аналоги, производные или конъюгаты, а A-B имеет общую структуру:
 ,
,
где R1 и R8 независимо выбраны из группы, состоящей из H и С1-С8алкила;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C6-C10арил)R7, СН2(C5-C9гетероарил), или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С8алкила, (С1-С4алкил)OH, (С1-С4алкил)NH2, (С1-С4алкил)SH, (C3-C6)циклоалкила, или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH.
Если R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо, то R1 и R2 не являются H.
В других своих вариантах, настоящее изобретение относится к пролекарству, имеющему общую структуру A-B-Q, где Q представляет собой пептид, принадлежащий к суперсемейству глюкагонов, остеокальцин или их аналоги, производные или конъюгаты, а A-B имеет общую структуру:
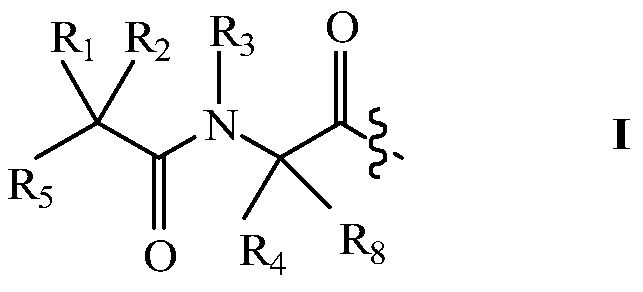
где R1 и R8 независимо представляют собой H или С1-С8алкил;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7 и СН2(C5-C9гетероарил), или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил;
R3 выбран из группы, состоящей из С1-С8алкила, (С1-С4алкил)OH, (С1-С4алкил)NH2, (С1-С4алкил)SH, (C3-C6)циклоалкила, или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, С1-С8алкил, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH, галогена, при условии, что если R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо, то R1 и R2 не являются H.
В других вариантах изобретения, Q представляет собой пептид, выбранный из группы, состоящей из рилизинг-фактора гормона роста (GHRH; SEQ ID NO: 719), вазоактивного кишечного пептида (VIP; SEQ ID NO: 720), полипептида 27, активирующего аденилат-циклазу гипофиза (PACAP-27; SEQ ID NO: 721), пептида, состоящего из гистидина-метионина (PHM; SEQ ID NO: 722), или секретина (SEQ ID NO: 723), глюкагона (SEQ ID NO: 701), экзендина-4 (SEQ ID NO: 718), глюкагон-подобного пептида-1 (GLP-1) (аминокислоты 7-37, представленные в SEQ ID №№: 703 и 704), глюкагон-подобного пептида-2 (GLP-2) (SEQ ID NO: 708), GIP (SEQ ID NO: 707) или их аналогов, производных и конъюгатов. В некоторых вариантах изобретения, Q представляет собой пептид, родственный глюкагону.
В другом своем варианте, настоящее изобретение относится к аналогу пролекарства, а именно, пептида, принадлежащего к суперсемейству глюкагонов или остеокальцина или их аналога, производного или конъюгата, где молекула пролекарства (A-B) ковалентно связана с Q в одном или нескольких внутренних аминокислотных остатках в последовательности Q, например, в положении Q, соответствующем положениям 12, 16, 17, 18, 20, 28, или 29 нативного глюкагона (SEQ ID NO: 701). Так, например, в некоторых вариантах изобретения, молекула пролекарства (A-B) связана прямо или посредством линкера, с замещенным Lys в положении 20 в Q. В таких вариантах изобретения, Q может содержать в положении 20 (по сравнению с нативной последовательностью глюкагона) замену, имеющую структуру:
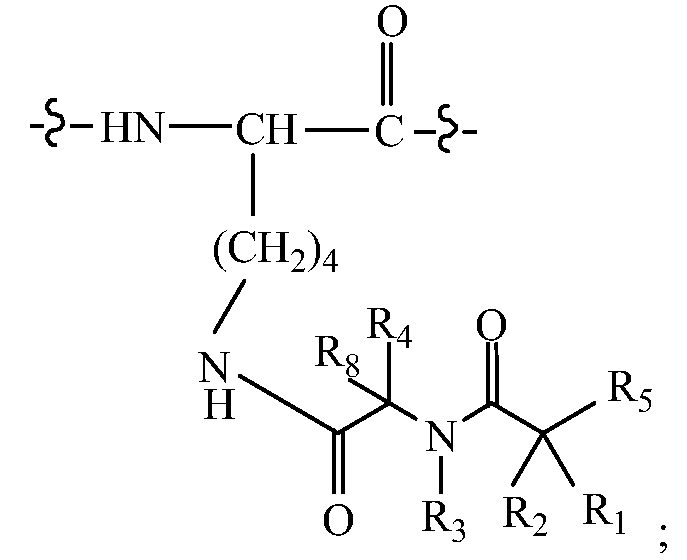
В других вариантах изобретения, молекула пролекарства (A-B) связана прямо или посредством линкера с замененным амино-Phe в положении 22. В таких вариантах изобретения, Q может содержать в положении 22 (по сравнению с нативной последовательностью глюкагона) замену, имеющую структуру:
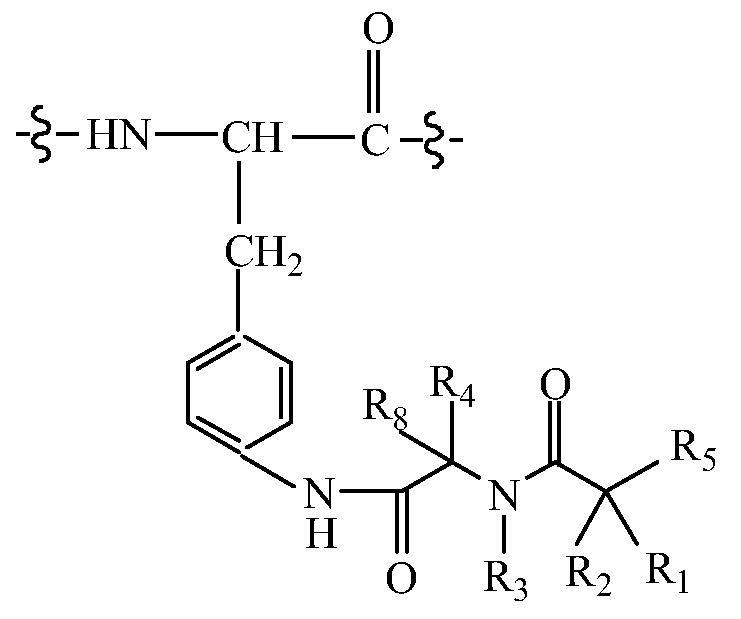
Альтернативно или дополнительно, молекула пролекарства (A-B) связана прямо или посредством линкера с амино-концом Q, где A-B имеет структуру:
 ,
,
где R1 и R8 независимо выбраны из группы, состоящей из H и С1-С8алкила;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C6-C10арил)R7, СН2(C5-C9гетероарил), или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С8алкила, (С1-С4алкил)OH, (С1-С4алкил)NH2, (С1-С4алкил)SH, (C3-C6)циклоалкила, или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH, при условии, что если каждый из R1 и R2 не является Н, то R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо.
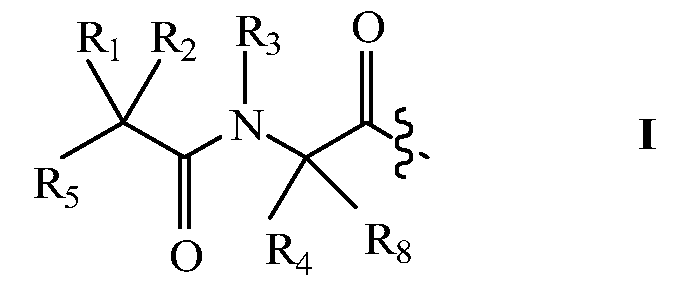
В других вариантах изобретения, молекула пролекарства (A-B) связана прямо или посредством линкера с амино-концом Q, где A-B имеет структуру:
 ,
,
где R1 и R8 независимо представляют собой H или С1-С8алкил;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7 и СН2(C3-C9гетероарил) или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил;
R3 выбран из группы, состоящей из С1-С8алкила, (С1-С4алкил)OH, (С1-С4алкил)NH2, (С1-С4алкил)SH, (C3-C6)циклоалкила, или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, С1-С8алкил, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH, галогена, при условии, что если оба R1 и R2 не являются Н, то R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо.
В некоторых вариантах изобретения, лишь одна молекула пролекарства связана с Q. Так, например, в таких вариантах изобретения, если молекула пролекарства (A-B) связана с Q у N-конца, то молекулы пролекарства (A-B) не связаны с внутренним аминокислотным остатком в последовательности Q, и наоборот. В некоторых вариантах изобретения, две или три молекулы пролекарства связаны с Q, например, у N-конца и в одном или нескольких внутренних сайтах.
Краткое описание графического материала
На фиг. 1 представлен график изменения массы тела у мышей с ожирением, вызванным кормлением (DIO), которым раз в неделю внутрибрюшинно инъецировали дозу 15 или 70 нмоль/кг аналога глюкагона. Мышей ежедневно взвешивали (N=8) после первой инъекции: только носителя ▼, пептида А, принадлежащего к суперсемейству глюкагонов («Пептида A») в дозе 15 нмоль/кг (▷) или 70 нмоль/кг (►), или производного пролекарства Пептида A, где дипептид связан с N-концом Пептида А посредством амидной связи, и где указанный дипептид представляет собой Aib-1 Pro0 (вводимый в дозе 15 нмоль/кг (O) или 70 нмоль/кг (●)),Aib-1 Pro0 (вводимый в дозе 70 нмоль/кг (◇)), Lys-1 Sar0 (вводимый в дозе 70 нмоль/кг (♦)), dAla-1 Pro0 (вводимый в дозе 70 нмоль/кг (◄)) или Ac-Aib-1 Pro-1 (вводимый в дозе 70 нмоль/кг (■)).
На фиг.2 представлен график изменения массы тела у мышей с ожирением, вызванным кормлением (DIO), которым раз в неделю внутрибрюшинно инъецировали дозы 0,5, 3, 15 или 70 нмоль/кг только носителя (♦), Пептида А (в дозе 0,5 ▲, 3 ►, 15 ▼ или 70 ◄ нмоль/кг/день) или Lys-1 Sar0 - Пептида А (в дозе 0,5 Δ, 3 ▷, 15 ▽ или 70 ◁ нмоль/кг/день).
На фиг. 3 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым сначала инъецировали пептид, родственный глюкагону, а затем раствор глюкозы. Мышам внутрибрюшинно инъецировали во время -60 минут либо только носитель (▲), либо дозу 15 или 70 нмоль/кг одного из следующих пептидов:
(A) Пептида А (в дозе 15 < или 70 ◄ нмоль/кг/день),
(B) Lys-1 Sar0 Пептида А (в дозе 15 ▷ или 70 ► нмоль/кг/ день), или
(C) dLys-1 Sar0 Пептида А (в дозе 15 □, или 70 ■ нмоль/кг/ день).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут. Уровни глюкозы в крови измеряли во время -60, 0, 15, 30, 60 и 120 минут.
На фиг. 4 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым сначала инъецировали пептид, родственный глюкагону, а затем раствор глюкозы. Мышам внутрибрюшинно инъецировали во время -15 минут либо только носитель (▼), либо дозу 2 нмоль/кг одного из следующих соединений:
(A) Lys-1 Sar0-Пептида А (■),
(B) Lys-1 (X), Sar0-Пептида А (▲), (X представляет собой 1K ПЭГ-цепь, связанную с боковой цепью Lys)
(C) Lys-1 (Y), Sar0 Пептида А, (♦), (Y представляет собой трет-бутилглицин, связанный с боковой цепью Lys)
(D) dLys-1 Sar0-Пептида А (►).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут. Уровни глюкозы в крови измеряли во время -15, 0, 15, 30, 60 и 120 минут.
На фиг. 5 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым сначала инъецировали пептид, родственный глюкагону, а затем раствор глюкозы. Мышам внутрибрюшинно инъецировали во время -15 минут либо только носитель (▼), либо дозу 20 нмоль/кг dLys-1 Sar0-Пептида А, (►), либо дозу 0,67 нмоль/кг одного из следующих соединений:
(A) Lys-1 Sar0-Пептида А (■),
(B) Lys-1 (X), Sar0-Пептида А (▲), (X представляет собой 1K ПЭГ-цепь, связанную с боковой цепью Lys)
(C) Lys-1 (Y), Sar0-Пептида А (♦), (Y представляет собой трет-бутилглицин, связанный с боковой цепью Lys).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут. Уровни глюкозы в крови измеряли во время -15, 0, 15, 30, 60, и 120 минут.
На фиг. 6 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым сначала инъецировали пептид, родственный глюкагону, а затем раствор глюкозы. Мышам внутрибрюшинно инъецировали во время -60 минут либо только носитель (▼), либо дозу 15 или 70 нмоль/кг одного из следующих соединений:
(A) Пептида А (в дозе 15 Δ или 70 ▲ нмоль/кг/день),
(B) dLys-1 Sar0-Пептида А (в дозе 15 □, или 70 ■ нмоль/кг/день), или
(C) Lys-1 Sar0-Пептида А (в дозе 15 ▷ или 70 ► нмоль/кг/день).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут и через 24 часа (см. фиг.7). Указанные уровни глюкозы в крови были измерены во время -60, 0, 15, 30, 60 и 120 минут до или после первого введения раствора глюкозы (то есть, начало отсчета 0 минут).
На фиг. 7 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым внутрибрюшинно, во время -60 минут, инъецировали либо только носитель (▼), либо дозу 15 или 70 нмоль/кг одного из следующих соединений:
(A) Пептида А (в дозе 15 Δ или 70 ▲ нмоль/кг/день),
(B) dLys-1 Sar0 Пептида А (в дозе 15 ◇ или 70 ▽ нмоль/кг/день), или
(C) Lys-1 Sar0 Пептида А (в дозе 15 ♦ или 70 ■ нмоль/кг/день).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут и через 24 часа. Указанные уровни глюкозы в крови были измерены через 0, 15, 30, 60 и 120 минут после второй инъекции раствора глюкозы, которую осуществляли через 24 часа.
На фиг. 8 представлены данные, указывающие на потерю массы у DIO-мышей (N=8), которым внутрибрюшинно инъецировали указанные соединения в дозе 15 или 70 нмоль/кг. Указанные массы тела измеряли через 7 дней после введения соединений.
На фиг. 9A-B представлены графики уровней глюкозы в крови (BG) (мг/дл) у DIO-мышей (n=8). Мышам внутрибрюшинно инъецировали только носитель или пептид-пролекарство за 24, 8, 4 или 1 час до введения провокационной дозы (указанной на фигуре) путем инъекции 25% глюкозы в физиологическом растворе в дозе 1,5 г/кг массы тела. Указанные уровни глюкозы в крови измеряли через 0, 15, 30, 60 и 120 минут после введения провокационной дозы раствора глюкозы. На фиг. 9A указаны уровни глюкозы в крови после введения Lys-1 Sar0-Пептида А (то есть, содержащего элемент пролекарство Lys-1 Sar0). На фиг. 9B указаны уровни глюкозы в крови после введения dLys-1 Sar0 Пептида А (то есть, содержащего элемент пролекарство D-Lys-1 Sar0).
На фиг. 10 проиллюстрировано выравнивание аминокислотных последовательностей различных пептидов, принадлежащих к суперсемейству глюкагонов, или их релевантных фрагментов. Представленными аминокислотными последовательностями являются последовательности GHRH (SEQ ID NO: 719), PHI (SEQ ID NO: 722), VIP (SEQ ID NO: 720), PACAP-27 (SEQ ID NO: 721), экзендина-4 (SEQ ID NO: 718), GLP-1 (SEQ ID NO: 703), глюкагона (SEQ ID NO: 701), оксинтомодулина (SEQ ID NO: 706), GIP (SEQ ID NO: 707), GLP-2 (SEQ ID NO: 708) и секретина (SEQ ID NO: 724).
На фиг. 11 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (девять групп, по восемь мышей в каждой), которым подкожно вводили одну дозу только носителя или 10 нмоль/кг одного из следующих соединений:
(A) Пептида С, принадлежащего к суперсемейству глюкагонов («Пептида C»),
(B) dK-Sar-Пептида C,
(C) Пептида В, принадлежащего к суперсемейству dK-Gly(N-гексил)глюкагонов («Пептида B»), или
(D) dK-F(N-Me)-Пептида C.
Мышам, возраст которых составлял 5,5 месяцев, приблизительно в течение 2 месяцев давали корм с высоким содержанием жира. Уровни глюкозы в крови измеряли через 0, 2, 4, 24 и 72 часа после инъекции.
На фиг. 12 представлен график изменения массы тела у DIO-мышей (девять групп, по восемь мышей в каждой), которым подкожно вводили одну дозу только носителя или 10 нмоль/кг одного из следующих соединений:
(A) Пептида С,
(B) dK-Sar-Пептида C,
(C) dK-Gly(N-гексил)-Пептида B, или
(D) dK-F(N-Me)-Пептида C.
Мышам, возраст которых составлял 5,5 месяцев, приблизительно в течение 2 месяцев давали корм с высоким содержанием жира. В течение 1-недельного исследования проводили мониторинг потребления пищи и жировой массы.
На фиг. 13A и 13B представлены графики рецептор-связывающей активности dK-Gly(N-гексил)-пептида B (Фиг. 13A) и dK-Sar-пептида C (Фиг. 13B) в 20% человеческой плазме, где указанную активность определяли с помощью люциферазного анализа на активность GLP-рецептора.
На фиг. 14 представлен график изменения массы тела у DIO-мышей (n=8), которым подкожно вводили одну дозу 3, 10 или 30 нмоль/кг только носителя или одного из следующих соединений:
(A) Пептида C,
(B) dLys-1 Sar0-Пептида C, или
(C) dLys-1-Gly(N-гексил)-Пептида B.
Массу тела определяли на дни 1, 3, 5 и 7 данного исследования. Мышам в возрасте 5 месяцев и с исходной средней массой тела 31,2 г, приблизительно в течение 5 месяцев давали стандартный корм для мышей.
На фиг. 15A-C представлены графики уровней глюкозы в крови (BG) (мг/дл) у DIO-мышей (n=8), которым подкожно вводили одну дозу 3, 10 или 30 нмоль/кг только носителя или одного из следующих соединений:
(A) Пептида C,
(B) dLys-1Sar0-Пептида C, или
(C) dLys-1-Gly(N-гексил)0-Пептида B.
Указанные уровни глюкозы в крови измеряли путем внутрибрюшинной инъекции на дни 1 (фиг. 15A), 3 (фиг. 15B) и 5 (фиг. 15C). Мышам в возрасте 5 месяцев приблизительно в течение 5 месяцев давали стандартный корм для мышей.
На фиг. 16A-C представлены графики рецептор-связывающей активности dK-Gly(N-гексил)-Пептида С (фиг. 16A), dLys-Sar-Пептида C (фиг. 16B) и dLys-Phe(N-метил)-Пептида C (фиг. 16C) в 20% человеческой плазме, где указанную активность определяли с помощью люциферазного анализа на активность GLP-рецептора.
На фиг. 17A-D представлены графики рецептор-связывающей активности Aib-Sar-Пептида D (фиг. 17A), dLys-Sar-Пептида D (фиг. 17B), dK-Gly(N-гексил)-Пептида D (фиг. 17C) и dLys-Phe(N-метил)-Пептида D (фиг. 17D) в 20% человеческой плазме, где указанную активность определяли с помощью люциферазного анализа на активность GLP-рецептора.
На фиг. 18 представлен график влияния одной подкожной дозы Пептида D и Aib-Sar-Пептида D в указанных концентрациях на уровне глюкозы в крови у мышей в течение 72 часов.
Подробное описание изобретения
Определения
В описании и в формуле изобретения используется терминология в соответствии с определениями, приведенными ниже.
Используемый здесь термин «пролекарство» определен как любое соединение, которое, до реализации его фармакологического действия, подвергается химической модификации.
Используемый здесь термин «аминокислота» охватывает любую молекулу, содержащую функциональные амино- и карбокси-группы, где аминогруппа и карбоксилатная группа связаны с одним и тем же атомом углерода (альфа-углерода). Альфа-углерод может иметь, но необязательно, один или два дополнительных органических заместителя. Аминокислота может быть обозначена трехбуквенным кодом, однобуквенным кодом или, в некоторых случаях, обозначена по названию ее боковой цепи. Так, например, неприродная аминокислота, содержащая циклогексановую группу, связанную с альфа-углеродом, называется «циклогексаном» или «циклогексилом». В целях настоящего изобретения, при обозначении аминокислоты без конкретного указания ее стереохимической структуры подразумевается, что такая аминокислота включает L- или D-форму или их рацемическую смесь. Однако, если аминокислота обозначается трехбуквенным кодом и имеет верхний индекс (то есть, Lys-1), то при таком обозначении подразумевается, что данная аминокислота имеет нативную L-форму, а D-форма обозначается строчной буквой «d», стоящей перед трехбуквенным кодом, имеющим надстрочный индекс (то есть, dLys-1).
Используемый здесь термин «оксикислота» означает аминокислоту, которая была модифицирована путем замены аминогруппы у альфа-углерода гидроксильной группой.
Используемый здесь термин «некодируемая аминокислота» включает любую из нижеследующих 20 аминокислот: Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, которая не имеет L-изомера.
«Дипептид» образуется в результате связывания α-аминокислоты или α-гидроксикислоты с другой аминокислотой посредством пептидной связи.
Используемый здесь термин «химическое расщепление», если отсутствует какое-либо дополнительное пояснение, охватывает неферментативную реакцию, приводящую к разрушению ковалентной химической связи.
Термин «биологически активный полипептид» означает полипептиды, обладающие биологическим действием in vitro и/или in vivo.
Используемый здесь термин «ацилированная» аминокислота означает аминокислоту, содержащую ацильную группу, которая не является нативной для данной природной аминокислоты, независимо от способа ее продуцирования. Репрезентативные способы продуцирования ацилированных аминокислот и ацилированных пептидов известны специалистам и включают ацилирование аминокислоты перед ее включением в пептид или пептидный синтез с последующим химическим ацилированием пептида. В некоторых вариантах изобретения, введение ацильной группы приводит к образованию пептида, обладающего одним или несколькими свойствами, такими как (i) увеличенное время полужизни в кровотоке, (ii) замедленное начало действия, (iii) продолжительное действие, (iv) повышенная резистентность к протеазам, таким как DPP-IV, и (v) повышенная активность по отношению к рецептору пептида, принадлежащего к суперсемейству глюкагонов, и/или пептида остеокальцина.
Используемый здесь термин «алкилированная» аминокислота означает аминокислоту, содержащую алкильную группу, которая не является нативной для данной природной аминокислоты, независимо от способа ее продуцирования. Репрезентативные методы продуцирования алкилированных аминокислот и алкилированных пептидов известны специалистам, и включают алкилирование аминокислоты перед ее включением в пептид или пептидный синтез с последующим химическим алкилированием пептида. Не ограничиваясь какой-либо конкретной теорией, можно лишь отметить, что алкилирование пептидов, очевидно, дает аналогичные, если не те же самые, эффекты, как и ацилирование пептидов, такие как, например, увеличенное время полужизни в кровотоке, замедленное начало действия, продолжительное действие, повышенная резистентность к протеазам, таким как DPP-IV, и повышенная активность по отношению к рецептору пептида, принадлежащего к суперсемейству глюкагонов, и/или к рецепторам пептида остеокальцина.
Используемый здесь термин «пептид» является общим термином и охватывает пептиды, которые имеют модифицированные амино- и карбокси-концы. Так, например, при обозначении аминокислотной последовательности стандартных аминокислот подразумеваются стандартные аминокислоты у N- и C-концов, а также соответствующая оксикислота у N-конца и/или соответствующая C-концевая аминокислота, модифицированная так, что она содержит амидную группу вместо концевой карбоксильной группы.
Используемый здесь термин «фармацевтически приемлемый носитель» включает любой стандартный фармацевтический носитель, такой как забуференный фосфатом физиологический раствор, вода, эмульсии, такие как эмульсия типа «масло в воде» или «вода в масле» и смачивающие агенты различных типов. Этот термин также охватывает любые агенты, разрешенные к применению Регуляторными органами Федерального правительства США или перечисленные в фармакопее США как агенты, которые могут быть использованы для их введения животным, включая человека.
Используемый здесь термин «фармацевтически приемлемая соль» означает соли соединений, которые сохраняют биологическую активность родительского соединения, и которые не оказывают каких-либо нежелательных биологических или других эффектов. Многие описанные здесь соединения способны образовывать соли кислот и/или оснований благодаря присутствию на них аминогрупп и/или карбоксильных групп или подобных групп.
Фармацевтически приемлемые основно-аддитивные соли могут быть получены из неорганических и органических оснований. Солями неорганических оснований являются, например, только соли натрия, калия, лития, аммония, кальция и магния. Солями органических оснований являются, но не ограничиваются ими, соли первичных, вторичных и третичных аминов.
Фармацевтически приемлемые кислотно-аддитивные соли могут быть получены из неорганических и органических кислот. Солями неорганических кислот являются соли хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, азотной кислоты, фосфорной кислоты и т.п. Солями органических кислот являются соли уксусной кислоты, пропионовой кислоты, гликолевой кислоты, пировиноградной кислоты, щавелевой кислоты, яблочной кислоты, малоновой кислоты, янтарной кислоты, малеиновой кислоты, фумаровой кислоты, винной кислоты, лимонной кислоты, бензойной кислоты, коричной кислоты, миндальной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, п-толуолсульфоновой кислоты, салициловой кислоты и т.п.
Используемый здесь термин «лечение» включает профилактику конкретного расстройства или состояния, или ослабление симптомов, ассоциированных с конкретным расстройством или состоянием, и/или предупреждение или устранение указанных симптомов. Так, например, используемый здесь термин «лечение диабета» в общих чертах означает поддержание близких к норме уровней глюкозы в крови, и может включать увеличение или снижение уровней глюкозы в крови в зависимости от конкретной ситуации.
Используемый здесь термин «эффективное количество» или «терапевтически эффективное количество» пролекарства означает нетоксическое, но достаточное количество пролекарства, необходимое для достижения желательного эффекта. Так, например, таким желательным эффектом может быть предупреждение или лечение гипергликемии. «Эффективное количество» варьируется для каждого конкретного индивидуума, в зависимости от возраста и общего состояния индивидуума, способа введения и т.п. Так, например, «эффективное количество» не всегда может быть точно определено. Однако, соответствующее «эффективное количество» для каждого конкретного индивидуума может быть определено средним специалистом в данной области путем рутинного экспериментирования.
Термин «парентеральный» относится к введению не через пищеварительный тракт, а некоторыми другими способами, такими как подкожное, внутримышечное, интраспинальное или внутривенное введение.
Используемый здесь термин «идентичность» означает сходство двух или более последовательностей. Идентичность измеряют путем деления числа идентичных остатков на общее число остатков и умножения полученного результата на 100 с получением процента. Таким образом, две копии абсолютно одинаковых последовательностей имеют 100% идентичность, а две последовательности, которые имеют аминокислотные делеции, добавления или замены по отношению друг к другу, имеют меньшую степень идентичности. Для специалиста в данной области очевидно, что для определения идентичности последовательностей могут быть использованы некоторые компьютерные программы, такие как программы, в которых применяются алгоритмы, такие как BLAST (Basic Local Alignment Search Tool, Altschul et al. (1993) J. Mol. Biol. 215:403-410).
Термин «пептид, родственный глюкагону» означает пептиды, которые обладают биологической активностью (как агонисты или антагонисты) по отношению к одному или нескольким рецепторам глюкагона, GLP-1, GLP-2 и GIP и имеют аминокислотную последовательность, которая по меньшей мере на 40% (например, на 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%) идентична последовательности по меньшей мере одного из таких соединений, как нативный глюкагон, нативный оксинтомодулин, нативный экзендин-4, нативный GLP-1, нативный GLP-2 или нативный GIP. Если это не оговорено особо, то любое указание на положение аминокислоты в пептиде, родственном глюкагону (например, положение связывания с молекулой пролекарства, молекулой конъюгата или с гидрофильным полимером, положение ацилирования или алкилирования) означает положение по отношению к нативной аминокислотной последовательности глюкагона (SEQ ID NO: 701).
Термин «пептид, принадлежащий к суперсемейству глюкагонов» означает группу пептидов, родственных по структуре своих N-концевых и C-концевых областей (см., например, Sherwood et al., Endocrine Reviews 21:619-670 (2000)). Членами этой группы являются все родственные глюкагону пептиды, а также рилизинг-фактор гормона роста (GHRH; SEQ ID NO: 719), вазоактивный кишечный пептид (VIP; SEQ ID NO: 720), полипептид 27, активирующий аденилат-циклазу гипофиза (PACAP-27; SEQ ID NO: 721), пептид, состоящий из гистидина-изолейцина (PHI), пептид, состоящий из гистидина-метионина (PHM; SEQ ID NO: 722) или секретин (SEQ ID NO: 723), и их аналоги, производные или конъюгаты, в которых имеются до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных модификаций по сравнению с нативным пептидом. Такие пептиды, предпочтительно, сохраняют способность взаимодействовать (являются агонистами или антагонистами) с рецепторами, принадлежащими к суперсемейству рецепторов глюкагона. Если это не оговорено особо, то любое указание на положение аминокислоты в пептиде, принадлежащем к суперсемейству глюкагонов (например, положение связывания с молекулой пролекарства, молекулой конъюгата или с гидрофильным полимером, положение ацилирования или алкилирования) означает положение по отношению к нативной аминокислотной последовательности глюкагона (SEQ ID NO: 701), см. фиг. 10, где проиллюстрировано выравнивание последовательностей соответствующих пептидов, принадлежащих к суперсемейству глюкагонов.
Термин «агонист GLP-1» означает соединение, которое стимулирует активность рецептора GLP-1, измеряемую по продуцированию cAMP с использованием анализа на экспериментальной in vitro модели, описанной в примере 13 Международной заявки No. WO 2007/056362, опубликованной 18 мая 2007, описание которой во всей своей полноте вводится в настоящую заявку посредством ссылки.
Используемый здесь термин «нативный GLP-1» является общим термином, который означает GLP-1(7-36) в форме амида (состоящего из последовательности SEQ ID NO: 704), GLP-1(7-37) в форме кислоты (состоящей из последовательности SEQ ID NO: 703) или смесь этих двух соединений. Используемый здесь общий термин «GLP-1», при отсутствии каких-либо дополнительный пояснений, означает нативный GLP-1.
Используемый здесь термин «пептид глюкагона» является общим термином, который означает природный пептид глюкагона SEQ ID NO: 701, а также его модифицированные производные, имеющие одну или несколько аминокислотных модификаций по сравнению с нативной последовательностью глюкагона, необязательно включая, но не ограничиваясь ими, замены в положениях аминокислот 1, 2, 5, 7, 8, 10, 12, 13, 14, 16, 17, 18, 24, 28 и 29. Вообще говоря, при всех указаниях конкретного положения аминокислоты (например, положения 28) подразумевается положение данной аминокислоты в нативном глюкагоне (SEQ ID NO: 701) или соответствующее положение данной аминокислоты в любых его аналогах. Так, например, «положение 28» должно означать соответствующее положение 27 в аналоге глюкагона, в котором первая аминокислота SEQ ID NO: 701 была делетирована. Аналогичным образом, «положение 28» должно означать соответствующее положение 29 в аналоге глюкагона, в котором одна аминокислота была присоединена перед N-концом SEQ ID NO: 701.
Используемый здесь термин «пептид GLP-1» является общим термином, который означает нативный GLP-1, а также его модифицированные производные, имеющие одну или несколько аминокислотных модификаций по сравнению с нативной последовательностью GLP-1.
Используемый здесь термин аминокислотная «модификация» означает замену, добавление или делецию аминокислоты и включает замену или добавление любой из 20 аминокислот, обычно встречающихся в человеческих белках, а также редких или неприродных аминокислот. Редкие аминокислоты поставляются коммерческими фирмами, включая Sigma-Aldrich (Milwaukee, WI), ChemPep Inc. (Miami, FL), и Genzyme Pharmaceuticals (Cambridge, MA). Редкие аминокислоты могут быть закуплены у коммерческих поставщиков, синтезированы de novo или химически модифицированы или дериватизированы из природных аминокислот. Аминокислотными модификациями являются: связывание аминокислоты с частью конъюгата, такой как гидрофильный полимер; ацилирование; алкилирование; и/или другая химическая дериватизация аминокислоты.
Используемый здесь термин «аминокислотная замена» означает замену одного аминокислотного остатка другим аминокислотным остатком.
Используемый здесь термин «консервативная аминокислотная замена» определен здесь как замена аминокислоты другой аминокислотой, принадлежащей к одной из нижеследующих пяти групп:
I. Небольшие алифатические остатки, неполярные остатки или остатки со слабой полярностью:
Ala, Ser, Thr, Pro, Gly;
II. Полярные, отрицательно заряженные остатки и их амиды:
Asp, Asn, Glu, Gln;
III. Полярные, положительно заряженные остатки:
His, Arg, Lys; орнитин (Orn)
IV. Крупные, алифатические, неполярные остатки:
Met, Leu, Ile, Val, Cys, норлейцин (Nle), гомоцистеин
V. Крупные, ароматические остатки:
Phe, Tyr, Trp, ацетилфенилаланин.
Используемый здесь термин «химера 2» означает пептид глюкагона, где нативная аминокислотная последовательность глюкагона (SEQ ID NO: 701) имеет следующие модификации: Gln в положении 17, Ala в положении 18, Lys в положении 20, Glu в положении 21, Ile в положении 23, Ala в положении 24 и С-концевой амид.
Используемый здесь общий термин «полиэтиленгликолевая цепь» или «ПЭГ-цепь» означает смеси конденсационных полимеров этиленоксида и воды в виде разветвленной или прямой цепи, представленной общей формулой H(OCH2CH2)kOH, где k равно по меньшей мере 9. Этот термин, при отсутствии каких-либо дополнительных пояснений, включает полимеры этиленгликоля со средней общей молекулярной массой, выбранной из масс в интервале 500-80000 дальтон. Термин «полиэтиленгликолевая цепь» или «ПЭГ-цепь», если он используется вместе с численным показателем, указывает на приблизительную среднюю молекулярную массу этой цепи. Так, например, ПЭГ-5000 (5k ПЭГ) означает полиэтиленгликолевую цепь, имеющую общую молекулярную массу, которая в среднем составляет примерно 5000 дальтон.
Используемый здесь термин «ПЭГилированный» и аналогичные термины относятся к соединению, природная структура которого была модифицирована путем присоединения к этому соединению полиэтиленгликолевой цепи. «ПЭГилированный полипептид» представляет собой полипептид, который имеет ПЭГ-цепь, ковалентно связанную с полипептидом.
Используемый здесь термин «линкер» означает связь, молекулу или группу молекул, которые связывают две отдельные молекулы друг с другом. Линкеры могут служить для обеспечения оптимального пространства для двух молекул, либо они могут также обеспечивать лабильную связь, которая позволяет отделять эти две молекулы друг от друга. Лабильными связями являются фоторасщепляемые группы; группы, которые отщепляются под действием кислоты; группы, которые отщепляются под действием основания, и группы, отщепляемые под действием ферментов.
Используемый здесь термин «димер» означает комплекс, содержащий две субъединицы, ковалентно связанные друг с другом посредством линкера. Термин «димер», употребляемый без какой-либо его качественной характеристики, охватывает гомодимеры и гетеродимеры. Гомодимер содержит две идентичных субъединицы, а гетеродимер содержит две субъединицы, которые отличаются друг от друга, хотя эти две субъединицы, в основном, аналогичны друг другу.
Используемый здесь термин «C1-Cnалкил», где n может быть равно 1-6, означает разветвленную или прямую алкильную группу, имеющую от 1 до указанного числа атомов углерода. Обычно, C1-C6алкильными группами являются, но не ограничиваются ими, метил, этил, н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и т.п.
Используемый здесь термины «C2-Cnалкенил», где n может быть равно 2-6, означает олефиновую ненасыщенную разветвленную или прямую группу, имеющую от 2 до указанного числа атомов углерода и по меньшей мере одну двойную связь. Примерами таких групп являются, но не ограничиваются ими: 1-пропенил, 2-пропенил(-CH2-CH=CH2), 1,3-бутадиенил(-CH=CHCH=CH2), 1-бутенил(-CH=CHCH2CH3), гексенил, пентенил и т.п.
Термин «C2-Cnалкинил», где n может быть равно 2-6, означает ненасыщенную разветвленную или прямую группу, имеющую от 2 до n атомов углерода и по меньшей мере одну тройную связь. Примерами таких групп являются, но не ограничиваются ими: 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 1-пентинил и т.п.
Используемый здесь термин «арил» означает моно- или бициклическую карбоциклическую систему, имеющую один или два ароматических кольца, включая, но не ограничиваясь ими, фенил, нафтил, тетрагидронафтил, инданил, инденил и т.п. Размер арильного кольца и присутствие заместителей или линкерных групп определяется по числу присутствующих атомов углерода. Так, например, термин «(C1-C3алкил)(C6-C10арил)» означает 6-10-членный арил, связанный с родительской молекулой посредством 1-3-членной алкильной цепи.
Используемый здесь термин «гетероарил» означает моно- или бициклическую систему, содержащую одно или два ароматических кольца и по меньшей мере один атом азота, кислорода или серы в ароматическом кольце. Размер гетероарильного кольца и присутствие заместителей или линкерных групп определяется по числу присутствующих атомов углерода. Так, например, термин «(C1-Cnалкил)(C5-C6гетероарил)» означает 5- или 6-членный гетероарил, связанный с родительской молекулой посредством 1 «n»-членной алкильной цепи.
Используемый здесь термин «гетероалкил» означает прямой или разветвленный углеводород, содержащий указанное число атомов углерода и по меньшей мере один гетероатом в остове данной структуры. Гетероатомами, подходящими для целей настоящего изобретения, являются, но не ограничиваются ими, N, S и O.
Используемый здесь термин «галоген» означает один или несколько членов группы, состоящей из фтора, хлора, брома и иода.
Используемый здесь термин «заряженная аминокислота» означает аминокислоту, содержащую боковую цепь, которая является отрицательно заряженной (то есть, депротонированной) или положительно заряженной (то есть, протонированной) в водном растворе при физиологическом рН. Так, например, отрицательно заряженными аминокислотами являются аспарагиновая кислота, глутаминовая кислота, цистеиновая кислота, гомоцистеиновая кислота и гомоглутаминовая кислота, а положительно заряженными аминокислотами являются аргинин, лизин и гистидин. Заряженными аминокислотами являются заряженные аминокислоты из числа 20 аминокислот, обычно встречающихся в человеческих белках, а также нетипичные или неприродные аминокислоты.
Используемый здесь термин «кислотная аминокислота» означает аминокислоту, которая содержит вторую кислотную молекулу (то есть, не являющуюся α-карбоксильной группой, которая присутствует во всех аминокислотах), включая, например, группу карбоновой кислоты или сульфоновой кислоты.
Используемый здесь термин «пациент», если отсутствуют какие-либо дополнительные пояснения, включает любое теплокровное позвоночное одомашненное животное (включая, например, но не ограничиваясь ими, крупный рогатый скот, лошадей, кошек, собак и других животных-компаньонов), млекопитающее и человек.
Варианты осуществления изобретения
В настоящей заявке описано приготовление пролекарств-производных биологически активных полипептидов, которые могут быть использованы для лечения заболевания, например, диабета и ожирения. Более конкретно, описанные здесь пролекарства приготавливают в целях увеличения времени полужизни родительского биологически активного пептида или белка, что способствует последующей активации пролекарства по механизму неферментативного расщепления. Идеальное пролекарство должно быть растворимым в воде в физиологических условиях (например, при рН 7,2 и при 37°C) и стабильным в форме порошка при длительном хранении. Оно должно быть иммунологически инертным и обладать низкой активностью по сравнению с родительскими лекарственным средством. В некоторых вариантах изобретения, пролекарство обладает активностью, которая составляет не более чем 10% от активности родительского лекарственного средства. В некоторых вариантах изобретения, пролекарство обладает активностью, которая составляет примерно менее чем 10%, примерно менее чем 5%, примерно 1%, или примерно менее чем 1% от активности родительского лекарственного средства. Кроме того, пролекарство, при его введении в организм, должно превращаться в активное лекарственное средство с количественным выходом в течение определенного периода времени. Как описано в настоящей заявке, авторами был разработан общий метод получения пролекарств известного биологически активного полипептида, выбранного из группы, состоящей из пептидов, принадлежащих к суперсемейству глюкагонов, включая пептиды, родственные глюкагону, а также остеокальцин и аналоги, производные и конъюгаты каждого из этих полипептидов, которые удовлетворяют всем этим требованиям.
Более конкретно, настоящее изобретение относится к химически обратимому пролекарству, содержащему последовательность пептида, принадлежащего к суперсемейству глюкагонов, включая, например, пептид, родственный глюкагону, или остеокальцин или его аналоги, производные или конъюгаты, модифицированные так, чтобы они содержали дипептидный элемент пролекарства, ковалентно связанный с пептидом посредством амидной связи. Ковалентное связывание дипептидного элемента пролекарства с активным центром пептида, принадлежащего к суперсемейству глюкагонов, приводит к ингибированию активности полипептида вплоть до расщепления дипептидного элемента пролекарства. В некоторых своих вариантах, настоящее изобретение относится к пролекарству, имеющему «полупериод неферментативной активации» (t½), составляющий примерно от 1 до 720 часов в физиологических условиях. Описанные здесь физиологические условия включают температуру примерно 35-40°C и pH примерно 7,0-7,4, а обычно рН 7,2-7,4, и температуру 36-38°C.
В основном, скорость расщепления, а поэтому и активация пролекарства зависит от структуры и стереохимии дипептидного элемента пролекарства. Описанные здесь пролекарства, в конечном счете, подвергаются химическому превращению в структуры, которые распознаются нативным рецептором лекарственного средства, где скорость такого химического превращения определяет время начала биологического действия in vivo и продолжительность такого действия. Конструирование молекул, описанное в настоящей заявке, основано на внутримолекулярной химической реакции, которая не зависит от дополнительных химических добавок или ферментов. Скорость превращения регулируется химической природой дипептидного заместителя и его расщепления в физиологических условиях. Поскольку физиологический рН и температура строго регулируется в точно определенном интервале, то скорость превращения пролекарства в лекарственное средство будет в высокой степени воспроизводимой у одного пациента и у различных пациентов.
Настоящее изобретение относится к описанным здесь пролекарствам, которые, благодаря их форме, имеют продолжительное время полужизни, составляющее по меньшей мере примерно 1 час, а в некоторых вариантах изобретения, оно составляет примерно более, чем 20 часов. В некоторых вариантах изобретения, время полужизни пролекарств составляет примерно 1, 6, 8, 12, 20, 24, 48 или 72 часа. В некоторых вариантах изобретения, время полужизни пролекарств составляет примерно 100 часов или более, включая время полужизни, составляющее примерно до 168, 336, 504, 672 или 720 часов, и эти пролекарства превращаются в активную форму в физиологических условиях посредством неферментативной реакции, индуцируемой природной химической нестабильностью. В некоторых вариантах изобретения, время t½ неферментативной активации пролекарства составляет 1-100 часов, а обычно 12-72 часа, например, 12-48 часов и 48-72 часа, а в некоторых вариантах изобретения, t½ составляет 24-48 часов как было измерено путем инкубирования пролекарства в забуференном фосфатом растворе (например, PBS) при 37°C и pH 7,2. В другом варианте изобретения, время t½ неферментативной активации пролекарства составляет примерно 1-6 часов, например, примерно 1 час, примерно 2 часа, примерно 3 часа, примерно 4 часа, примерно 5 часов или примерно 6 часов. В другом варианте изобретения, время t½ неферментативной активации пролекарства составляет 6-24 часа. Время полужизни различных пролекарств вычисляют по формуле t½=0,693/k, где «k» означает константу скорости первого порядка для разложения пролекарства. В некоторых вариантах изобретения, активация пролекарства происходит после расщепления дипептида, связанного амидной связью, с образованием дикетопиперазина или дикетоморфолина и высвобождением активного полипептидного лекарственного средства. Были идентифицированы конкретные дипептиды, состоящие из природных, некодируемых и/или синтетических аминокислот, которые облегчают внутримолекулярное разложение в физиологических условиях и высвобождение активных полипептидов.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пролекарству, состоящему из пептида, принадлежащего к суперсемейству глюкагонов, или остеокальцина или их аналогов, производных или конъюгатов, имеющих структуру A-B-Q. В этом варианте изобретения, Q представляет собой пептид, A представляет собой аминокислоту или гидроксикислоту, а В представляет собой N-алкилированную аминокислоту. В некоторых вариантах изобретения, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, родственный глюкагону. А и B, взятые вместе, представляют собой дипептидный элемент пролекарства, который связан с Q посредством образования амидной связи между A-B и амином Q. В некоторых вариантах изобретения, по меньшей мере одной из A, B, или аминокислотой Q, с которой связан A-B, является некодируемая аминокислота. Кроме того, в некоторых вариантах изобретения, дипептидный элемент пролекарства выбирают так, чтобы химическое отщепление A-B от Q по меньшей мере примерно на 90% происходило приблизительно за 1-720 часов в PBS в физиологических условиях. В другом варианте изобретения, аминокислоты дипептида выбирают так, чтобы полупериод отщепления A-B от Q в PBS в физиологических условиях не более чем в 2-5 раз превышал полупериод отщепления A-B от Q в растворе, содержащем протеазу DPP-IV (включая, например, человеческую сыворотку).
В соответствии с некоторыми вариантами изобретения, алифатическую аминогруппу Q (например, первичный амин), включая, например, N-концевой амин или аминогруппу аминокислотной боковой цепи, модифицируют путем ковалентного связывания с дипептидным элементом пролекарства посредством амидной связи. В некоторых вариантах изобретения, дипептидный элемент пролекарства присоединяют к аминогруппе боковой цепи аминокислоты, присутствующей в Q, либо непосредственно, либо посредством линкерной молекулы. В некоторых вариантах изобретения, линкерная молекула содержит ацильную группу или алкильную группу, несущую амин. В некоторых своих вариантах, настоящее изобретение относится к пептиду, принадлежащему к суперсемейству глюкагонов, например, к пептиду, родственному глюкагону, где указанные пептиды содержат ацильную группу или алкильную группу, ковалентно связанную с аминокислотой в положении 10 или 20 пептида, принадлежащего к суперсемейству глюкагонов, и где указанная ацильная группа или алкильная группа также содержит дипептидный элемент пролекарства, связанный с ацильной группой или алкильной группой посредством амидной связи. Так, например, в одном из вариантов изобретения рассматривается пролекарство, которое связано с аминогруппой Q либо непосредственно, либо посредством линкерной группы, где ацильная группа или алкильная группа связаны с пролекарством либо непосредственно, либо посредством линкерной группы.
В некоторых вариантах изобретения, дипептидный элемент пролекарства непосредственно связан с аминокислотной боковой цепью, где указанная аминокислота имеет общую структуру:
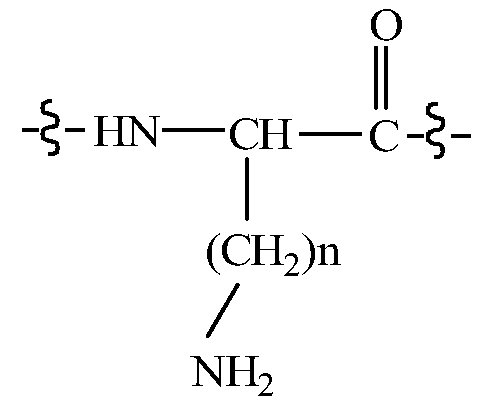
где n равно целому числу 1-4.
Альтернативно, дипептидный элемент пролекарства может быть связан с амино-заместителем, присутствующим на арильном кольце ароматической аминокислоты, включая, например, ароматическую аминокислоту, выбранную из группы, состоящей из амино-Phe, амино-нафтилаланина, амино-триптофана, амино-фенилглицина амино-гомо-Phe и амино-тирозина. В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с ароматической аминогруппой аминокислоты, имеющей общую структуру:

где m равно целому числу от 0 до 3. В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с 4-аминогруппой аминокислоты, имеющей общую структуру:
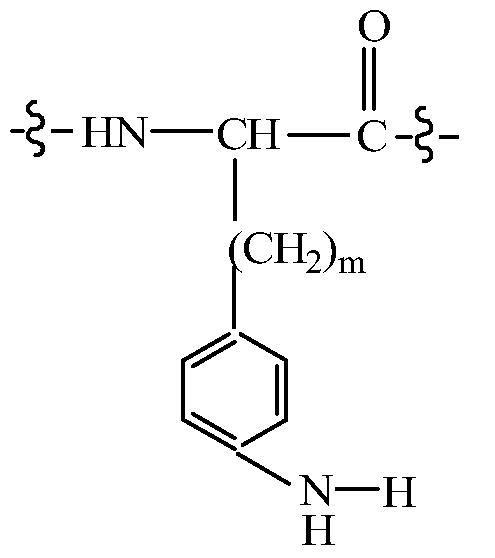
где m равно целому числу от 0 до 3. В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с аминогруппой боковой цепи лизина или ароматической аминогруппой 4-аминофенилаланина (вместо нативного фенилаланина или тирозинового остатка биологически активного пептида). В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с первичным амином, присутствующим на внутренней аминокислоте пептида, принадлежащего к суперсемейству глюкагонов, включая родственный глюкагону пептид, остеокальцин или их аналоги, производные или конъюгаты.
В некоторых вариантах изобретения, дипептидный элемент пролекарства имеет общую структуру A-B, где A представляет собой аминокислоту или гидроксикислоту, а B представляет собой N- алкилированную аминокислоту, связанную посредством амидной связи с первичной аминогруппой такого пептида, в результате чего образуется соответствующее пролекарство, состоящее из пептида. В некоторых вариантах изобретения, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, родственный глюкагону. В некоторых вариантах изобретения, A и B выбирают так, чтобы при связывании дипептида A-B с первичным амином такого пептида посредством амидной связи, химическое отщепление A-B от Q по меньшей мере примерно на 90% происходило приблизительно за 1-720 часов в PBS в физиологических условиях. В некоторых вариантах изобретения, A и/или B представляют собой аминокислоту в конфигурации стереоизомера D. В некоторых репрезентативных вариантах изобретения, A представляет собой аминокислоту в конфигурации стереоизомера D, а В представляет собой аминокислоту в конфигурации стереоизомера L. В некоторых репрезентативных вариантах изобретения, A представляет собой аминокислоту в конфигурации стереоизомера L, а В представляет собой аминокислоту в конфигурации стереоизомера D. В некоторых репрезентативных вариантах изобретения, A представляет собой аминокислоту в конфигурации стереоизомера D, и В представляет собой аминокислоту в конфигурации стереоизомера D.
В соответствии с некоторыми вариантами изобретения, дипептидный элемент пролекарства может быть дополнительно модифицирован так, чтобы он содержал гидрофильную группу. В некоторых вариантах изобретения, гидрофильной группой является полиэтиленгликолевая цепь. В соответствии с некоторыми вариантами изобретения, полиэтиленгликолевая цепь размером в 40k или выше ковалентно связана с боковой цепью аминокислоты A или B дипептидного элемента пролекарства. В другом варианте изобретения, указанный дипептидный элемент пролекарства дополнительно или альтернативно, может быть ацилирован или алкилирован жирной кислотой или желчной кислотой или их солью, например, жирной C4-C30-кислотой, жирной C8-C24-кислотой, холевой кислотой, C4-C30-алкилом, C8-C24-алкилом, или алкилом, содержащим стероидную молекулу желчной кислоты. Аминокислотой «A» дипептидного элемента пролекарства может быть, например, d-лизин, ковалентно связанный с ацильной или алкильной группой посредством аминогруппы его боковой цепи, или d-цистеин, ковалентно связанный с молекулой ПЭГ посредством сульфгидрильной группы его боковой цепи. Дипептидный элемент пролекарства может быть непосредственно связан с гидрофильной группой, ацильной группой или алкильной группой, либо он может быть связан с гидрофильной группой, ацильной группой или алкильной группой посредством спейсера, как описано в настоящей заявке. Альтернативно, дипептидный элемент пролекарства может быть связан с депо-белком, таким как декстран или крупная молекула ПЭГ (размером превышающим или равным 80000 дальтон), которая служит для секвестрации пролекарства на участке инъекции до тех пор, пока расщепление дипептида не будет приводить к высвобождению биологически активного пептида. Другие модификации дипептидных пролекарств описаны ниже в разделе, относящемся к пептидам, родственным глюкагону.
Дипептидный элемент пролекарства был сконструирован так, чтобы он расщеплялся после внутримолекулярной химической реакции, которая не зависит от других химических добавок или ферментов. Более конкретно, в некоторых вариантах изобретения, дипептидную структуру выбирают так, чтобы она была устойчивой к расщеплению пептидазами, присутствующими в сыворотке млекопитающих, включая, например, дипептидил-пептидазу IV (DPP-IV). В соответствии с некоторыми вариантами изобретения, скорость отщепления дипептидного элемента пролекарства от биологически активного пептида, в основном, не увеличивается (например, более чем в 2 раза) в том случае, когда реакцию проводят в физиологических условиях в присутствии сывороточных протеаз, по сравнению с реакцией, проводимой в отсутствии таких протеаз. Таким образом, полупериод отщепления A-B от биологически активного пептида в PBS в физиологических условиях не более чем в два, три, четыре или пять раз превышает полупериод отщепления A-B от биологически активного белка в растворе, содержащем протеазу DPP-IV. В некоторых вариантах изобретения, раствор, содержащий протеазу DPP-IV, представляет собой сыворотку, а более конкретно, сыворотку млекопитающего, включая человеческую сыворотку.
В соответствии с некоторыми вариантами изобретения, A или B дипептидного элемента пролекарства, или аминокислота пептида, принадлежащего к суперсемейству глюкагонов, с которым связаны A-B, представляют собой некодируемую аминокислоту. В некоторых вариантах изобретения, аминокислота «B» представляет собой N-алкилированную аминокислоту, но не пролин. В некоторых вариантах изобретения, N-алкилированная группа аминокислоты B представляет собой C1-C18алкил, а в некоторых вариантах изобретения, она представляет собой C1-C6алкил.
В соответствии с некоторыми вариантами изобретения, производное пролекарства, состоящее из пептида, принадлежащего к суперсемейству глюкагонов, и включающее описанный здесь дипептидный элемент пролекарства, может быть введено вместе с ингибитором протеазы, включая специфический ингибитор DPP-IV (например, Januvia®, Merck & Co, Inc), который служит в качестве средства, замедляющего активацию пролекарства. В этом варианте изобретения, аминокислоты элемента пролекарства выбирают так, чтобы дипептид представлял собой приемлемый субстрат для расщепления протеазой DPP-IV. В некоторых вариантах изобретения, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, родственный глюкагону. Ингибитор протеазы может быть введен в составе отдельно взятых композиций, либо пролекарство и ингибитор протеазы могут быть приготовлены в виде одной композиции. При введении в виде отдельных композиций, ингибитор протеазы обычно вводят через 1-5 часов, 1-2 часа, 30 минут или 10 минут после введения пролекарства. В некоторых вариантах изобретения, две отдельные композиции вводят непосредственно одну за другой.
В некоторых вариантах изобретения, дипептидный элемент пролекарства имеет общую структуру формулы I:
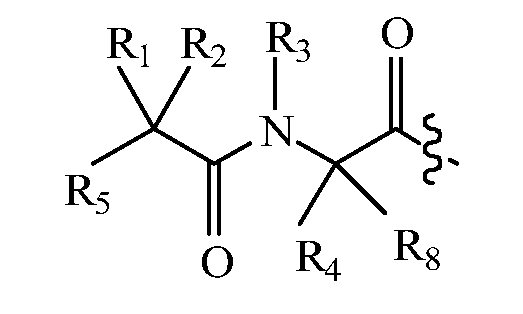
где R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)OH, (С1-С18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(А)(W1)C1-C12алкил, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил или арил; или R4 и R8, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С18алкила, (С1-С18алкил)OH, (С1-С18алкил)NH2, (С1-С18алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7 и (C1-C4алкил)(C3-C9гетероарил), или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, C1-C8алкил, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH.
Очевидно, что если W1 представляет собой N, то в физиологических условиях, атом азота связан с H.
В других вариантах изобретения, дипептидный элемент пролекарства имеет общую структуру формулы I:
 ,
,
где R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)OH, (С1-С18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(W1)C1-C12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил или арил; или R4 и R8, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С18алкила, (С1-С18алкил)OH, (С1-С18алкил)NH2, (С1-С18алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7 и (C1-C4алкил)(C3-C9гетероарил), или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, C1-C8алкил, или R6 и R1, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена.
В некоторых вариантах изобретения, R8 представляет собой H, а R5 представляет собой NHR6.
В некоторых вариантах изобретения, дипептидный элемент пролекарства имеет структуру формулы I, где
R1 и R8 независимо представляют собой H или С1-С8алкил;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, СН2(C3-C9гетероарил) или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил или арил;
R5 представляет собой NHR6; и
R6 представляет собой H или С1-С8алкил.
В других вариантах изобретения, дипептидный элемент пролекарства имеет структуру формулы I, где:
R1 и R8 независимо представляют собой H или С1-С8алкил;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7 и СН2(C3-C9гетероарил), или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил;
R3 представляет собой С1-С18алкил;
R5 представляет собой NHR6; и
R6 представляет собой H или С1-С8алкил; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена.
Время полужизни пролекарства, полученного в соответствии с настоящим изобретением, определяют по заместителям дипептидного элемента пролекарства, его расположению и аминокислоте, с которой он связан. Так, например, пролекарство может содержать пептид, принадлежащий к суперсемейству глюкагонов, где дипептидный элемент пролекарства связан посредством альфа-аминогруппы N-концевой аминокислоты белка, принадлежащего к суперсемейству глюкагонов. В этом варианте изобретения, пролекарства, имеющее t½, например, приблизительно 1 час, содержат дипептидный элемент пролекарства, имеющий структуру:
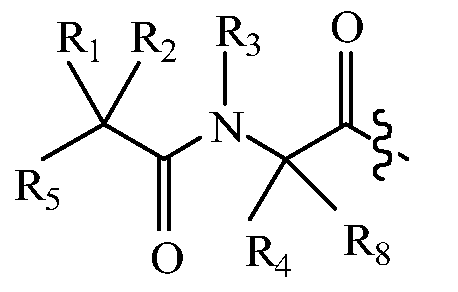 ,
,
где R1 и R2 независимо представляют собой С1-С18алкил или арил; или R1 и R2 связаны посредством (CH2)p, где p равно 2-9;
R3 представляет собой С1-С18алкил;
каждый из R4 и R8 представляют собой водород, и
R5 представляет собой амин.
В других вариантах изобретения, пролекарства, имеющие t½ например, приблизительно 1 час, содержат дипептидный элемент пролекарства, имеющий структуру:
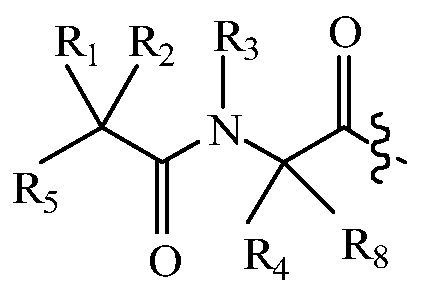 ,
,
где R1 и R2 независимо представляют собой С1-С18алкил или (C0-C4алкил)(C6-C10арил)R7, либо R1 и R2 связаны посредством (CH2)p, где p равно 2-9;
R3 представляет собой С1-С18алкил;
каждый из R4 и R8 представляет собой водород,
R5 представляет собой NH2; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена.
Кроме того, пролекарства, имеющие дипептидный элемент пролекарства связанный с N-концевой альфа-аминокислотой пептида, принадлежащего к суперсемейству глюкагонов, и имеющие t½, например, приблизительно от 6 до 24 часов, содержат дипептидный элемент пролекарства, имеющий структуру:
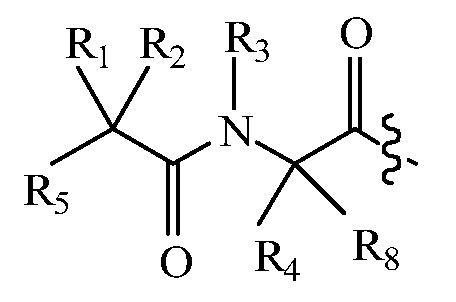 ,
,
где R1 и R2 независимо выбраны из группы, состоящей из водорода, С1-С18алкила и арила; или R1 и R2 связаны посредством (CH2)p, где p равно 2-9;
R3 представляет собой С1-С18алкил; либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-12-членное гетероциклическое кольцо;
R4 и R8 независимо выбраны из группы, состоящей из водорода, С1-С8алкила и арила; а R5 представляет собой амин;
при условии, что оба R1 и R2 не являются водородом, а один из R4 и R8 представляет собой водород.
В некоторых вариантах изобретения, пролекарства, имеющие дипептидный элемент пролекарства, связанный с N-концевой альфа-аминокислотой пептида, принадлежащего к суперсемейству глюкагонов, и имеющие t½, например, приблизительно от 12 до 72 часов, или в некоторых вариантах изобретения, от 12 до 48 часов, содержат дипептидный элемент пролекарства, имеющий структуру:
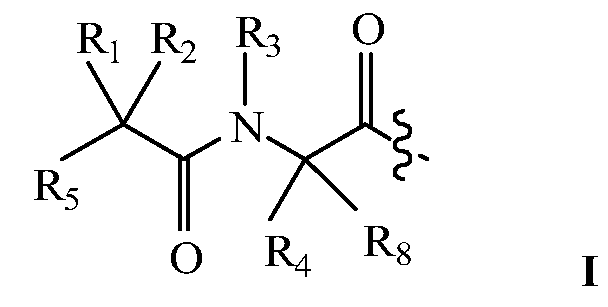 ,
,
где R1 и R2 независимо выбраны из группы, состоящей из водорода, С1-С18алкила, (С1-С18алкил)OH, (C1-C4алкил)NH2 и (C0-C4алкил)(C6-C10арил)R7, или R1 и R2 связаны посредством (CH2)p, где p равно 2-9;
R3 представляет собой С1-С18алкил; либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-12-членное гетероциклическое кольцо;
R4 и R8 независимо выбраны из группы, состоящей из водорода, С1-С8алкила и (C0-C4алкил)(C6-C10арил)R7;
R5 представляет собой NH2; и
R7 выбран из группы, состоящей из Н, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена,
при условии, что оба R1 и R2 не являются водородом, а по меньшей мере один из R4 и R8 представляет собой водород.
В некоторых вариантах изобретения, пролекарства, имеющие дипептидный элемент пролекарства связанный с N-концевой аминокислотой пептида, принадлежащего к суперсемейству глюкагонов, и имеющего t½, например, приблизительно от 12 до 72 часов, а в некоторых вариантах изобретения, от 12 до 48 часов, содержат дипептидный элемент пролекарства, имеющий структуру:
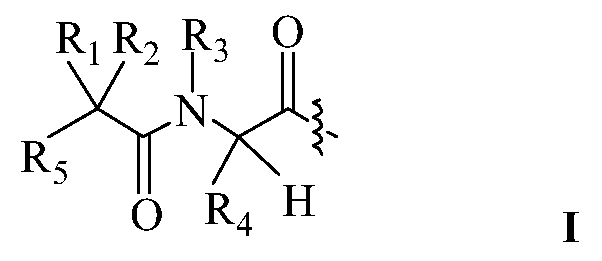
где:
R1 и R2 независимо выбраны из группы, состоящей из водорода, С1-С8алкила и (C1-C4алкил)NH2, или R1 и R2 связаны посредством (CH2)p, где p равно 2-9;
R3 представляет собой С1-С8алкил; либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-6-членное гетероциклическое кольцо;
R4 выбран из группы, состоящей из водорода и С1-С8алкила; и
R5 представляет собой NH2,
при условии, что оба R1 и R2 не являются водородом.
В других вариантах изобретения, пролекарства, имеющие дипептидный элемент пролекарства, связанный с N-концевой аминокислотой пептида, принадлежащего к суперсемейству глюкагонов, и имеющие t½, например, приблизительно от 12 до 72 часов, или в некоторых вариантах изобретения, от 12 до 48 часов, содержат дипептидный элемент пролекарства, имеющий структуру:
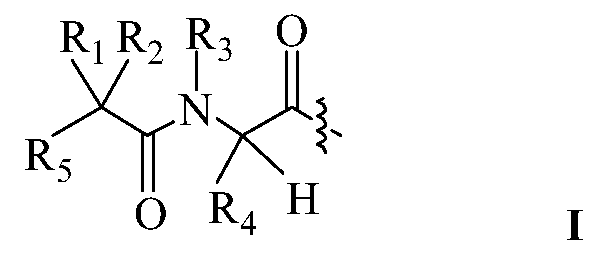 ,
,
где R1 и R2 независимо выбраны из группы, состоящей из водорода, С1-С8алкила и (C1-C4алкил)NH2;
R3 представляет собой С1-С8алкил;
R4 представляет собой водород; и
R5 представляет собой NH2,
при условии, что оба R1 и R2 не являются водородом.
В некоторых вариантах изобретения, пролекарства, имеющие дипептидный элемент пролекарства связанный с N-концевой аминокислотой пептида, принадлежащего к суперсемейству глюкагонов, и имеющие t½, например, приблизительно от 12 до 72 часов, или в некоторых вариантах изобретения, от 12 до 48 часов, содержат дипептидный элемент пролекарства, имеющий структуру:
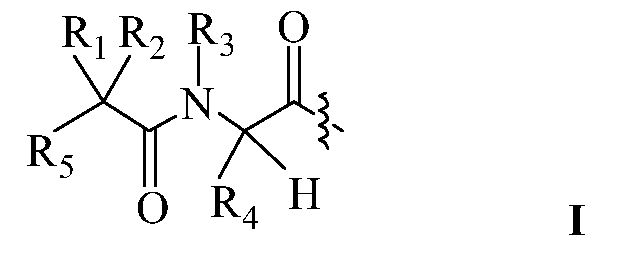 ,
,
где R1 и R2 независимо выбраны из группы, состоящей из водорода, С1-С8алкила и (C1-C4алкил)NH2, или R1 и R2 связаны посредством (CH2)p, где p равно 2-9;
R3 представляет собой С1-С8алкил;
R4 представляет собой (C0-C4алкил)(C6-C10арил)R7;
R5 представляет собой NH2,
R7 выбран из группы, состоящей из водорода, С1-С8алкила и (C0-C4алкил)OH,
при условии, что оба R1 и R2 не являются водородом.
В некоторых вариантах изобретения, пептид, принадлежащий к суперсемейству глюкагонов, представляет собой пептид, родственный глюкагону. В любом из этих вариантов, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид любой из последовательностей SEQ ID NO: 1-684, 701-731, 801-919, 1001-1262, 1301-1371, 1401-1518, 1701-1776 и 1801-1908.
Кроме того, настоящее изобретение относится к пролекарству, имеющему дипептидный элемент пролекарства, связанный с N-концевой альфа-аминокислотой пептида, принадлежащего к суперсемейству глюкагонов, и имеющему t½, например, приблизительно от 72 до 168 часов, где указанный дипептидный элемент пролекарства имеет структуру:
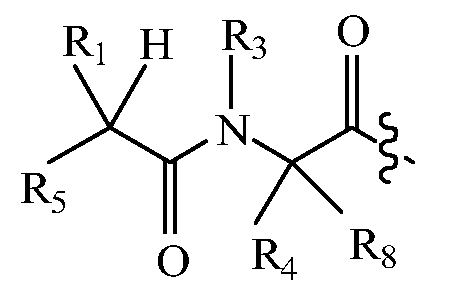 ,
,
где R1 выбран из группы, состоящей из водорода, С1-С8алкила и арила;
R3 представляет собой С1-С18алкил;
каждый из R4 и R8 представляет собой водород; и
R5 представляет собой амин или N-замещенный амин или гидроксил;
при условии, что если R1 представляет собой алкил или арил, то R1 и R5, взятые вместе с атомами, с которыми они связаны, образуют 4-11-членное гетероциклическое кольцо.
В некоторых вариантах изобретения, дипептидный элемент пролекарства имеет структуру:
 ,
,
где R1 выбран из группы, состоящей из водорода, С1-С8алкила и (C0-C4алкил)(C6-C10арил)R7;
R3 представляет собой С1-С18алкил;
каждый из R4 и R8 представляет собой водород;
R5 представляет собой NHR6 или ОН;
R6 представляет собой Н, С1-С8алкил, либо R6 и R1, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена;
при условии, что если R1 представляет собой алкил или (C0-C4алкил)(C6-C10арил)R7, то R1 и R5, взятые вместе с атомами, с которыми они связаны, образуют 4-11-членное гетероциклическое кольцо. В некоторых вариантах изобретения, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, родственный глюкагону.
В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с аминовой боковой цепью внутренней аминокислоты пептида, принадлежащего к суперсемейству глюкагонов. В этом варианте изобретения, пролекарства, имеющие t½, например, приблизительно 1 час, имеют структуру:
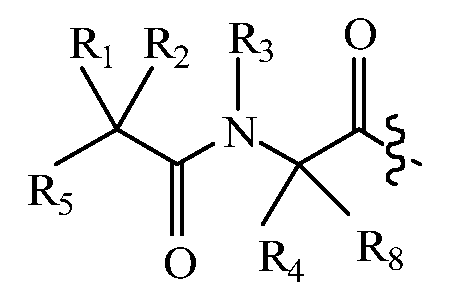 ,
,
где R1 и R2 независимо представляют собой С1-С8алкил или арил; или R1 и R2 связаны посредством (CH2)p, где p равно 2-9;
R3 представляет собой С1-С18алкил;
каждый из R4 и R8 представляет собой водород, а R5 представляет собой амин.
В некоторых вариантах изобретения, пролекарства, имеющие t½, например, приблизительно 1 час, имеют структуру:
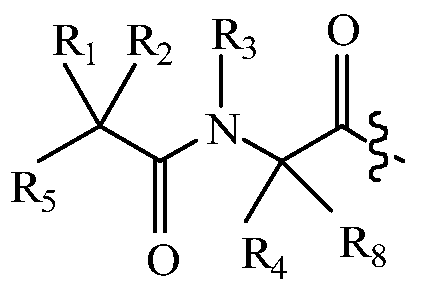 ,
,
где R1 и R2 независимо представляют собой С1-С8алкил или (C0-C4алкил)(C6-C10арил)R7; или R1 и R2 связаны посредством -(CH2)p-, где p равно 2-9;
R3 представляет собой С1-С18алкил;
каждый из R4 и R8 представляет собой водород;
R5 представляет собой NH2; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена.
Кроме того, пролекарства, имеют t½, например, приблизительно от 6 до 24 часов и содержат дипептидный элемент пролекарства, связанный с внутренней аминокислотной боковой цепью, где указанный дипептидный элемент пролекарства имеет структуру:
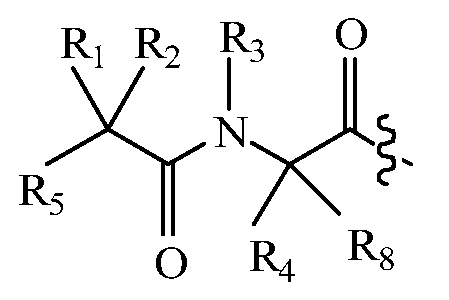 ,
,
где R1 и R2 независимо выбраны из группы, состоящей из водорода, С1-С18алкила или арила; или R1 и R2 связаны посредством -(CH2)p, где p равно 2-9;
R3 представляет собой С1-С18алкил, либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-12-гетероциклическое кольцо;
R4 и R8 независимо представляет собой С1-С18алкил или арил; и
R5 представляет собой амин или N-замещенный амин;
при условии, что оба R1 и R2 не являются водородом, а один из R4 и R8 представляет собой водород.
В некоторых вариантах изобретения, пролекарства, имеющие t½, например, приблизительно от 12 до 72 часов, а в некоторых вариантах изобретения, от 12 до 48 часов, и включающие дипептидный элемент пролекарства, связанный с внутренней аминокислотной боковой цепью, содержат дипептидный элемент пролекарства, имеющий структуру:
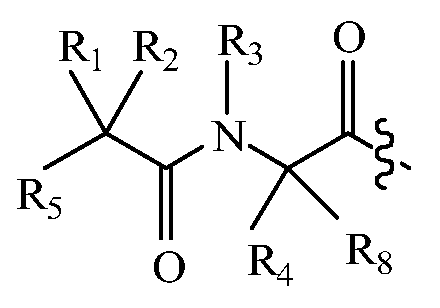 ,
,
где R1 и R2 независимо выбраны из группы, состоящей из водорода, С1-С18алкила и (C0-C4алкил)(C6-C10арил)R7, или R1 и R2 связаны посредством (CH2)p, где p равно 2-9;
R3 представляет собой С1-С18алкил; либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-12-членное гетероциклическое кольцо;
R4 и R8 независимо представляют собой водород, С1-С8алкил или (C0-C4алкил)(C6-C10арил)R7;
R5 представляет собой NHR6;
R6 представляет собой Н или С1-С8алкил, либо R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена;
при условии, что оба R1 и R2 не являются водородом, а по меньшей мере один из R4 и R8 представляет собой водород. В некоторых вариантах изобретения, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, родственный глюкагону.
Кроме того, настоящее изобретение относится к пролекарству, имеющему t½, например, приблизительно от 72 до 168 часов и содержащему дипептидный элемент пролекарства, связанный с внутренней аминокислотной боковой цепью пептида, принадлежащего к суперсемейству глюкагонов, где указанный дипептидный элемент пролекарства имеет структуру:
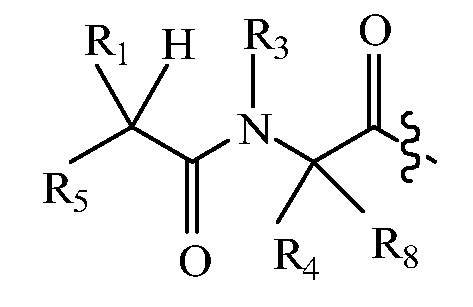 ,
,
где R1 и R2 независимо выбраны из группы, состоящей из водорода, С1-С18алкила и арила;
R3 представляет собой С1-С18алкил;
каждый из R4 и R8 представляет собой водород; и
R5 представляет собой амин или N-замещенный амин или гидроксил;
при условии, что если R1 и R2 независимо представляют собой алкил или арил, то R1 или R2 связаны с R5 посредством (CH2)p, где p равно 2-9.
В некоторых своих вариантах изобретения, настоящее изобретение относится к пролекарству, имеющему t½, например, приблизительно от 72 до 168 часов и содержащему дипептидный элемент пролекарства, связанный с внутренней аминокислотной боковой цепью пептида, принадлежащего к суперсемейству глюкагонов, где указанный дипептидный элемент пролекарства имеет структуру:
 ,
,
где R1 выбран из группы, состоящей из водорода, С1-С18алкила и (C0-C4алкил)(C6-C10арил)R7;
R3представляет собой С1-С18алкил;
каждый из R4 и R8 представляет собой водород;
R5 представляет собой NHR6 или ОН;
R6 представляет собой Н или С1-С8алкил, либо R6 и R1, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена;
при условии, что если R1 и R2 независимо представляют собой алкил или (C0-C4алкил)(C6-C10арил)R7, то R1 и R2 связаны с R5 посредством (CH2)p, где p равно 2-9. В некоторых вариантах изобретения, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, родственный глюкагону. В любом из этих вариантов, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, имеющий любую из последовательностей SEQ ID №№: 1-684, 701-731, 801-919, 1001-1262, 1301-1371, 1401-1518, 1701-1776 и 1801-1908.
В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с боковой цепью амина внутренней аминокислоты пептида, принадлежащего к суперсемейству глюкагонов, где указанная внутренняя аминокислота имеет структуру формулы II:
 ,
,
где n равно целому числу, выбранному из 1-4. В некоторых вариантах изобретения, n равно 3 или 4, а в некоторых вариантах изобретения, внутренней аминокислотой является лизин. В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с первичным амином на боковой цепи аминокислоты, находящейся в положениях 12, 16, 17, 18, 20, 28 или 29 пептида, принадлежащего к суперсемейству глюкагонов. В некоторых вариантах изобретения, аминокислота в положениях 12, 16, 17, 18, 20, 28 или 29 имеет структуру формулы II:
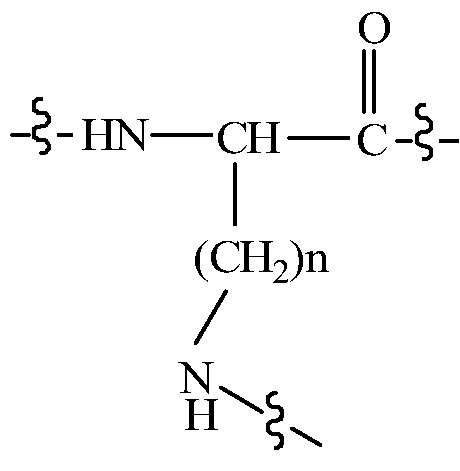
где n равно целому числу, выбранному из 1-4, а дипептидный элемент пролекарства связан с аминокислотной боковой цепью посредством амидной связи. В некоторых вариантах изобретения, n равно 4, а аминокислота находится в положении 20. В некоторых вариантах изобретения, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, родственный глюкагону.
В другом варианте изобретения, дипептидный элемент пролекарства связан с пептидом, принадлежащим к суперсемейству глюкагонов, посредством амина, присутствующего на арильной группе ароматической аминокислоты. В некоторых вариантах изобретения, ароматической аминокислотой является внутренняя аминокислота пептида, принадлежащего к суперсемейству глюкагонов, однако, указанной ароматической аминокислотой может быть также N-концевая аминокислота. В некоторых вариантах изобретения, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, родственный глюкагону. В некоторых вариантах изобретения, ароматическая аминокислота выбрана из группы, состоящей из амино-Phe, амино-нафтилаланина, амино-триптофана, амино-фенилглицина, амино-гомо-Phe и амино-тирозина. В некоторых вариантах изобретения, первичный амин, который образует амидную связь с дипептидным элементом пролекарства, находится на арильной группе в пара-положении. В некоторых вариантах изобретения, ароматический амин имеет структуру формулы III:
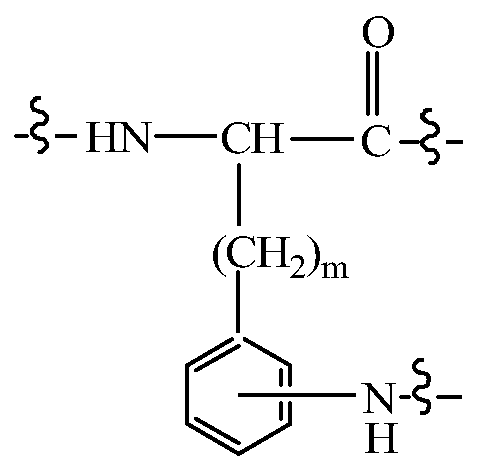 ,
,
где m равно целому числу от 1 до 3.
В тех вариантах изобретения, в которых дипептидный элемент пролекарства связан с пептидом, принадлежащим к суперсемейству глюкагонов, посредством амина, присутствующего на арильной группе ароматической аминокислоты, пролекарства, у которых t½, например, составляет приблизительно 1 час, имеют дипептидную структуру:
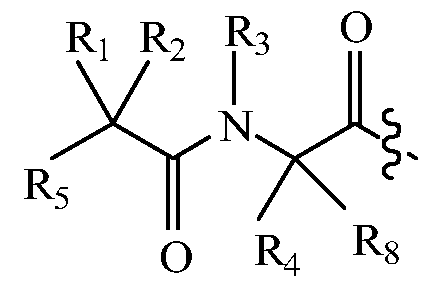 ,
,
где
R1 и R2 независимо представляют собой С1-С18алкил или арил;
R3 представляет собой С1-С18алкил, либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-12-гетероциклическое кольцо;
R4 и R8 независимо выбраны из группы, состоящей из водорода, С1-С18алкила и арила, а R5 представляет собой амин или гидроксил.
В некоторых вариантах изобретения, в которых дипептидный элемент пролекарства связан с пептидом, принадлежащим к суперсемейству глюкагонов, посредством амина, присутствующего на арильной группе ароматической аминокислоты, пролекарства, у которых t½, например, составляет приблизительно 1 час, имеют дипептидную структуру:
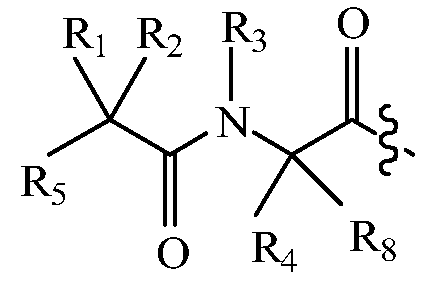 ,
,
где
R1 и R2 независимо представляют собой С1-С18алкил или (C0-C4алкил)(C6-C10арил)R7;
R3 представляет собой С1-С18алкил; либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-12-членное гетероциклическое кольцо;
R4 и R8 независимо выбраны из группы, состоящей из водорода, С1-С18алкила и (C0-C4алкил)(C6-C10арил)R7,
R5 представляет собой NH2 или ОН; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена. В некоторых вариантах изобретения, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, родственный глюкагону. Кроме того, настоящее изобретение относится к пролекарствам, содержащим дипептидный элемент пролекарства, связанный с ароматической аминокислотой, и имеющим t½, например, приблизительно от 6 до 24 часов, где указанный дипептид имеет структуру:
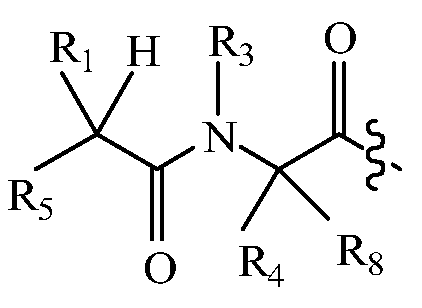 ,
,
где
R1 выбран из группы, состоящей из водорода, С1-С18алкила и арила, или R1 и R2 связаны посредством (CH2)p, где p равно 2-9;
R3 представляет собой С1-С18алкил; либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-6-членное гетероциклическое кольцо;
R4 и R8 независимо выбраны из группы, состоящей из водорода, С1-С18алкила и арила, а R5 представляет собой амин или N-замещенный амин.
В некоторых своих вариантах, настоящее изобретение относится к пролекарствам, имеющим дипептидный элемент пролекарства, связанный с ароматической аминокислотой, и имеющим t½, например, приблизительно от 6 до 24 часов, где указанный дипептид имеет структуру:
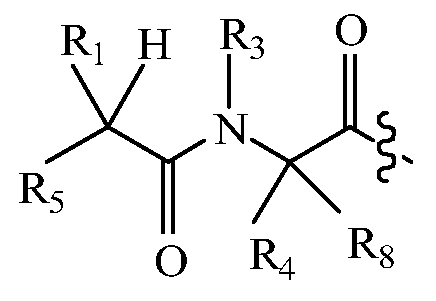 ,
,
где
R1 выбран из группы, состоящей из водорода, С1-С18алкила, (С1-С18алкил)OH, (C1-C4алкил)NH2 и (C0-C4алкил)(C6-C10арил)R7;
R3 представляет собой С1-С18алкил; либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-6-членное гетероциклическое кольцо;
R4 и R8 независимо выбраны из группы, состоящей из водорода, С1-С18алкила и (C0-C4алкил)(C6-C10арил)R7,
R5 представляет собой NHR6;
R6 представляет собой Н, С1-С8алкил, или R6 и R1, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена.
Кроме того, настоящее изобретение относится к пролекарствам, имеющим дипептидный элемент пролекарства, связанный посредством ароматической аминокислоты, и t½, составляющее, например, приблизительно от 72 до 168 часов, где указанный дипептид имеет структуру:
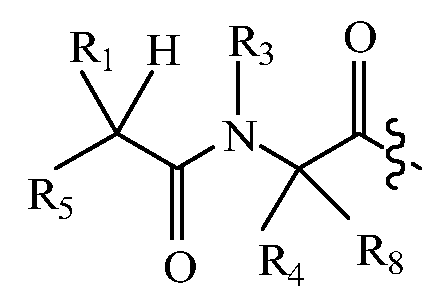 ,
,
где
R1 и R2 независимо выбраны из группы, состоящей из водорода, С1-С8алкила и арила;
R3 представляет собой С1-С18алкил; или R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-6-членное гетероциклическое кольцо;
каждый из R4 и R8 представляет собой водород; и
R5 выбран из группы, состоящей из амина, N-замещенного амина и гидроксила.
В некоторых своих вариантах, настоящее изобретение относится к пролекарствам, имеющим дипептидный элемент пролекарства, связанный посредством ароматической аминокислоты, и t½, составляющее, например, приблизительно от 72 до 168 часов, где указанный дипептид имеет структуру:
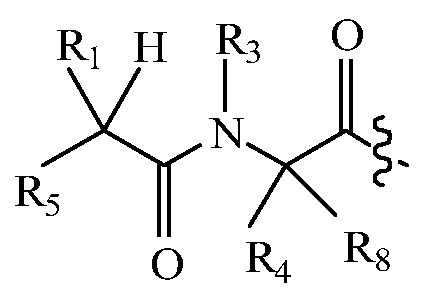 ,
,
где
R1 и R2 независимо выбраны из группы, состоящей из водорода, С1-С8алкила, (C0-C4алкил)COOH и (C0-C4алкил)(C6-C10арил)R7, или R1 и R5, взятые вместе с атомами, с которыми они связаны, образуют 4-11-членное гетероциклическое кольцо;
R3 представляет собой С1-С18алкил; либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 4-6-членное гетероциклическое кольцо;
R4 представляет собой водород, либо он образует 4-6-членное гетероциклическое кольцо с R3;
R8 представляет собой водород;
R5 представляет собой NHR6 или ОН;
R6 представляет собой Н или С1-С8алкил, либо R6 и R1, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена.
В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с ароматической аминокислотой посредством первичного амина, присутствующего в качестве арильного заместителя ароматической аминокислоты, где ароматическая аминокислота присутствует в положениях 10, 13, 22 или 25 пептида, принадлежащего к суперсемейству глюкагонов (в соответствии с нумерацией последовательности глюкагона, см., например, фиг. 10). В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с ароматической аминокислотой, локализованной в положении 22 пептида, принадлежащего к суперсемейству глюкагонов.
В соответствии с некоторыми вариантами изобретения, дипептидный элемент пролекарства связан с N-концевым амином пептида, принадлежащего к суперсемейству глюкагонов, включая, например, пептид, родственный глюкагону, или остеокальцин, а также их аналоги, производные и конъюгаты, где указанный дипептидный элемент пролекарства имеет структуру:
 ,
,
где
R1 выбран из группы, состоящей из H и С1-С18алкила;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C6-C10арил)R7, CH2(C5-C9гетероарил), либо R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С8алкила, (C3-C6)циклоалкила, либо R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, либо R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из Н и ОН. В некоторых вариантах изобретения R1 представляет собой Н или С1-С8алкил; R2 выбран из группы, состоящей из Н, С1-С6алкила, CH2OH, (C1-C4алкил)NH2, (C3-C6циклоалкил) и CH2(C6арил)R7, либо R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5-членное гетероциклическое кольцо; R3 представляет собой С1-С6алкил, а R4 выбран из группы, состоящей из Н, С1-С4алкила, (C3-C6)циклоалкила, (С1-С4алкил)OH, (С1-С4алкил)SH, и (C0-C4алкил)(C6-арил)R7, либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 5-членное гетероциклическое кольцо. В другом варианте изобретения R3 представляет собой CH3, R5 представляет собой NHR6, а в другом альтернативном варианте R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 5-членное гетероциклическое кольцо, а R5 представляет собой NHR6.
В соответствии с другим вариантом изобретения, дипептидный элемент пролекарства связан с N-концевым амином пептида, принадлежащего к суперсемейству глюкагонов, включая, например, пептид, родственный глюкагону, или остеокальцин, а также их аналоги, производные и конъюгаты, где указанный дипептидный элемент пролекарства имеет структуру:
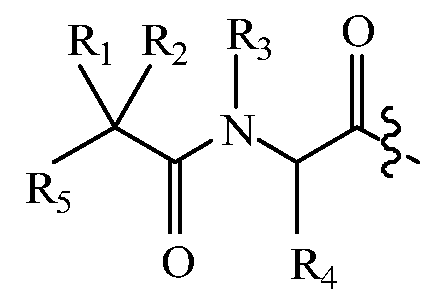 ,
,
где
R1 выбран из группы, состоящей из H и С1-С18алкила;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C6-C10арил)R7, CH2(C5-C9гетероарил), либо R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С8алкила, (C3-C6)циклоалкила, либо R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, либо R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, C1-C18алкила, C2-C18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)СООН, (C0-C4алкил)NH2, (C0-C4алкил)ОН и галогена. В некоторых вариантах изобретения R1 представляет собой Н или С1-С8алкил; R2 выбран из группы, состоящей из Н, С1-С6алкила, CH2OH, (C1-C4алкил)NH2, (C3-C6циклоалкил) и CH2(C6арил)R7, либо R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5-членное гетероциклическое кольцо; R3 представляет собой С1-С6алкил, а R4 выбран из группы, состоящей из Н, С1-С4алкила, (C3-C6)циклоалкила, (С1-С4алкил)OH, (С1-С4алкил)SH и (C0-C4алкил)(C6-арил)R7, либо R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 5-членное гетероциклическое кольцо. В другом варианте изобретения R3 представляет собой CH3, R5 представляет собой NHR6, а в другом альтернативном варианте R3 и R4, взятые вместе с атомами, с которыми они связаны, образуют 5-членное гетероциклическое кольцо, а R5 представляет собой NHR6.
В некоторых вариантах изобретения, Q представляет собой любую из SEQ ID NO: 1-684, 701-731, 801-919, 1001-1262, 1301-1371, 1401-1518, 1701-1776 и 1801-1908.
Пептиды, родственные глюкагону
В некоторых своих аспектах, настоящее изобретение относится к пептидам, родственным глюкагону (как части группы, обозначенной «Q»). Термин «пептид, родственный глюкагону» означает пептиды, обладающие биологической активностью (как агонисты или антагонисты) по отношению к любым одному или нескольким рецепторам глюкагона, GLP-1, GLP-2 и GIP, и содержащие аминокислотную последовательность, которая по меньшей мере на 40% (например, на 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%) идентична последовательности по меньшей мере одного из соединений, таких как нативный глюкагон, нативный оксинтомодулин, нативный экзендин-4, нативный GLP-1, нативный GLP-2 или нативный GIP. Следует отметить, что в настоящей заявке рассматриваются все возможные активные подгруппы пептида, родственного глюкагону, например, пептиды, обладающие биологической активностью (как агонисты или антагонисты) по отношению к любым одному или нескольким рецепторам глюкагонам, или GLP-1, или рецепторам GIP, вместе со всеми возможными подгруппами последовательностей, идентичных каждому из перечисленных здесь нативных пептидов, например, пептидов, содержащих аминокислотную последовательность, которая по меньшей мере на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична последовательности нативного глюкагона по всей его длине. В некоторых вариантах изобретения, пептидом, родственным глюкагону, являются пептид, обладающий агонистической активностью по отношению к рецептору глюкагона, агонистической активностью по отношению к рецептору GIP, агонистической активностью по отношению к рецептору глюкагона/рецептору GLP-1, антагонистической активностью по отношению к рецептору глюкагона или антагонистической активностью по отношению к рецептору глюкагона и агонистической активностью по отношению к рецептору GLP-1. В некоторых вариантах изобретения, пептид сохраняет альфа-спиральную конформацию у С-концевой половины молекулы. В некоторых вариантах изобретения, пептид сохраняет положения, участвующие во взаимодействии с рецептором или в передаче сигнала рецептору, например, положение 3 глюкагона или положения 7, 10, 12, 13, 15 или 17 (1-37)GLP-1. В соответствии с этим, пептидом, родственным глюкагону, может быть пептид класса 1, класса 2, класса 3, класса 4 и/или класса 5, каждый из которых подробно описан в настоящей заявке.
В соответствии с некоторыми вариантами изобретения, дипептидный элемент пролекарства может быть присоединен посредством амидной связи к любому из биологически активных соединений, ранее описанных в Международных заявках №№ PCT/US2008/08608 (поданной 3 января, 2008), PCT/US2008/053857 (поданной 13 февраля, 2008), PCT/US2009/47437 (поданной 16 июня, 2009), PCT/US2009/47438 (поданной 16 июня, 2009), PCT/US2009/47447 (поданной 16 июня, 2009), PCT/US2008/080973 (поданной 23 октября, 2008), и PCT/US2008/081333 (поданной 27 октября, 2008), описание которых точно вводится в настоящую заявку посредством ссылки. В некоторых репрезентативных вариантах изобретения, описанный здесь дипептидный элемент пролекарства может быть связан с биологически активными пептидами, описанными в PCT/US2008/08608, PCT/US2008/053857, PCT/US2009/47437, PCT/US2009/47438, PCT/US2009/47447, PCT/US2008/08097 и PCT/US2008/081333, либо посредством N-концевого амина или с аминогруппой боковой цепи лизина в положении 20, либо посредством ароматической аминогруппы 4-амино-фенилаланина вместо аминокислоты в положении 22 любого из описанных биологически активных пептидов. В некоторых репрезентативных вариантах изобретения, описанный здесь дипептидный элемент пролекарства связан посредством амидной связи с N-концевым амином биологически активного пептида, описанного в PCT/US2008/08608, PCT/US2008/053857, PCT/US2009/47437, PCT/US2009/47438, PCT/US2009/47447, PCT/US2008/08097 и PCT/US2008/081333. В некоторых вариантах изобретения, пептидом, принадлежащим к суперсемейству глюкагонов, является пептид, имеющий любую из SEQ ID NN: 1-684, 701-731, 801-919, 1001-1262, 1301-1371, 1401-1518, 1701-1776 и 1801-1908.
Модификации
Родственный глюкагону пептид может содержать аминокислотную последовательность нативного глюкагона (SEQ ID NO: 701) с модификациями. В репрезентативных вариантах изобретения, родственный глюкагону пептид может иметь всего 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных модификаций по сравнению с нативной последовательностью глюкагона, например, консервативных или неконсервативных замен. В некоторых аспектах изобретения, описанные здесь модификации и замены были внесены в конкретные положения родственного глюкагону пептида, где нумерация этих положений соответствует нумерации положений в последовательности глюкагона (SEQ ID NO: 701). В некоторых вариантах изобретения, 1, 2, 3, 4 или 5 неконсервативных замен были внесены в любое из положений 2, 5, 7, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29, а также в любое из этих положений были внесены до 5 дополнительных консервативных замен. В некоторых вариантах изобретения, 1, 2 или 3 аминокислотных модификации вводят в положения аминокислот 1-16, и 1, 2 или 3 аминокислотных модификации вводят в положения аминокислот 17-26. В некоторых вариантах изобретения, такие родственные глюкагону пептиды сохраняют по меньшей мере 22, 23, 24, 25, 26, 27 или 28 природных аминокислот в соответствующих положениях нативного глюкагона (например, они имеют 1-7, 1-5 или 1-3 модификаций по сравнению с природным глюкагоном).
Резистентность к DPP-IV
В некоторых вариантах изобретения, родственный глюкагону пептид содержит модификацию в положении 1 или 2, введенную для снижения чувствительности к расщеплению дипептидил-пептидазой IV. Более конкретно, в некоторых вариантах изобретения, аминокислота в положении 1 родственного глюкагону пептида (например, выбранного из пептидов, представленных на фиг. 10), заменена аминокислотой, выбранной из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Более конкретно, в некоторых вариантах изобретения, аминокислота в положении 2 родственного глюкагону пептида заменена аминокислотой, выбранной из группы, состоящей из D-серина, D-аланина, валина, глицина, N-метилсерина и аминоизомасляной кислоты. В некоторых вариантах изобретения, аминокислота в положении 2 родственного глюкагону пептида не является D-серин.
Гидрофильные группы
В некоторых вариантах изобретения, родственный глюкагону пептид (например, родственный глюкагону пептид класса 1, родственный глюкагону пептид класса 2, родственный глюкагону пептид класса 3, родственный глюкагону пептид класса 4, или родственный глюкагону пептид класса 5) присоединен к гидрофильной группе (ковалентно связан с этой группой). Гидрофильные группы могут быть присоединены к родственному глюкагону пептиду в любых условиях, подходящих для реакции взаимодействия белка с активированной полимерной молекулой. При этом могут быть применены любые методы, известные специалистам, включая ацилирование, восстановительное алкилирование, реакцию присоединения Михаэля, алкилирование посредством тиола или другие методы хемоселективного конъюгирования/лигирования, где указанные методы осуществляют посредством взаимодействия реакционноспособной группы на молекуле ПЭГ (например, альдегидной группы, аминогруппы, сложноэфирной группы, тиоловой группы, α-галогенацетильной группы, малеимидогруппы или гидразиногруппой) с реакционноспособной группой на соединении-мишени (например, с альдегидной группой, аминогруппой, сложноэфирной группой, тиоловой группой, α-галогенацетильной группой, малеимидогруппой или гидразиногруппой). Активирующими группами, которые могут быть использованы для связывания водорастворимых полимеров с одним или несколькими белками, являются, но не ограничиваются ими, сульфон, малеимид, сульфгидрил, тиол, трифлат, трезилат, азиридин, оксиран и 5-пиридил. В случае присоединения к пептиду посредством восстановительного алкилирования, выбранный полимер должен содержать один реакционноспособный альдегид, который может регулировать степень полимеризации. См., например, Kinstler et al., Adv. Drug. Delivery Rev. 54: 477-485 (2002); Roberts et al., Adv. Drug Delivery Rev. 54: 459-476 (2002); и Zalipsky et al., Adv. Drug Delivery Rev. 16: 157-182 (1995).
Что касается родственных глюкагону пептидов классов 1-3, то дополнительными активирующими группами, которые могут быть использованы для связывания водорастворимых полимеров с одним или несколькими белками, являются альфа-галогенированная ацильная группа (например, альфа-иодуксусная кислота, альфа-бромуксусная кислота, альфа-хлоруксусная кислота). В некоторых вариантах изобретения, в которых пептидом, родственным глюкагону, является родственный глюкагону пептид класса 1, класса 2 или класса 3, тиол-содержащую аминокислоту модифицируют малеимид-активированным ПЭГ путем проведения реакции присоединения Михаэля, в результате чего получают ПЭГилированный пептид, содержащий тиоэфирную связь, представленную ниже:
В других вариантах изобретения, тиол аминокислоты родственного глюкагону пептида класса 1, класса 2 или класса 3 модифицируют галогенацетил-активированным ПЭГ посредством реакции нуклеофильного замещения с получением ПЭГилированного пептида, содержащего тиоэфирную связь, представленную ниже:

Подходящими гидрофильными группами являются полиэтиленгликоль (ПЭГ), полипропиленгликоль, полиоксиэтилированные полиолы (например, ПОП), полиоксиэтилированный сорбит, полиоксиэтилированная глюкоза, полиоксиэтилированный глицерин (ПОГ), полиоксиалкилены, пропиональдегид полиэтиленгликоля, сополимеры этиленгликоля/пропиленгликоля, монометокси-полиэтиленгликоль, моно-(C1-C10)алкокси- или арилоксиполиэтиленгликоль, карбоксиметилцеллюлоза, полиацетали, поливиниловый спирт (ПВС), поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/ангидрида малеиновой кислоты, поли(бета-аминокислоты) (либо их гомополимеры, либо нестатистические сополимеры), поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры полипропиленгликоля (ППГ) и другие полиалкиленоксиды, сополимеры полипропиленоксида/этиленоксида, колоновые кислоты или другие полисахаридные полимеры, фиколл или декстран и их смеси. Декстраны представляют собой полисахаридные полимеры, состоящие из глюкозных субъединиц, связанных преимущественно α1-6-связями. Декстран существует в широких диапазонах молекулярных масс, например, приблизительно от 1 кД до 100 кД, или приблизительно от 5, 10, 15 или 20 кД до 20, 30, 40, 50, 60, 70, 80 или 90 кД.
В некоторых вариантах изобретения, гидрофильной группой является цепь полиэтиленгликоля (ПЭГ) или другой водорастворимый полимер, который ковалентно связан с боковой цепью аминокислотного остатка в одном или нескольких положениях 16, 17, 21, 24, 29, 40 указанного родственного глюкагону пептида, в пределах C-концевого удлинения или у C-концевой аминокислоты. В некоторых вариантах изобретения, нативная аминокислота в этом положении заменена аминокислотой, имеющей боковую цепь, подходящую для перекрестного связывания с гидрофильными группами, что облегчает связывание гидрофильной группы с пептидом. Репрезентативными аминокислотами являются Cys, Lys, Orn, гомо-Cys или ацетилфенилаланин (Ac-Phe). В других вариантах изобретения, аминокислота модифицирована так, что она содержит гидрофильную группу, присоединенную к пептиду у С-конца.
В соответствии с некоторыми вариантами изобретения, гидрофильная группа, например, полиэтиленгликолевая цепь имеет молекулярную массу, выбранную из группы, состоящей примерно из 500-40000 дальтон. В некоторых вариантах изобретения, полиэтиленгликолевая цепь имеет молекулярную массу, выбранную из группы, состоящей примерно из 500-5000 дальтон, или примерно 1000-5000 дальтон. В другом варианте изобретения, гидрофильная группа, например, полиэтиленгликолевая цепь имеет молекулярную массу примерно от 10000 до 20000 дальтон. В других репрезентативных вариантах, гидрофильная группа, например, полиэтиленгликолевая цепь имеет молекулярную массу примерно 20000-40000 дальтон.
Рассматриваются также гидрофильные полимеры с прямой или разветвленной цепью. Полученные препараты конъюгатов могут быть, в основном, монодисперсными или полидисперсными, и могут иметь примерно 0,5, 0,7, 1, 1,2, 1,5 или 2 полимерных группы на пептид.
Ацилирование
В некоторых вариантах изобретения, родственный глюкагону пептид (например, родственный глюкагону пептид класса 1, родственный глюкагону пептид класса 2, родственный глюкагону пептид класса 3, родственный глюкагону пептид класса 4 или родственный глюкагону пептид класса 5) модифицирован так, что он содержит ацильную группу. Так, например, родственным глюкагону пептидом может быть пептид класса 1, класса 2 или класса 3, и этот пептид может содержать ацильную группу, которая является ненативной по отношению к природной аминокислоте. Ацилирование может быть осуществлено в любом положении родственного глюкагону пептида, включая любое из положений 1-29, положение в С-концевом удлинении или у C-концевой аминокислоты, при условии, что активность, сообщаемая неацилированным пептидом, родственным глюкагону, будет сохраняться после ацилирования. Так, например, если неацилированный пептид обладает глюкагон-агонистической активностью, то ацилированный пептид сохраняет такую глюкагон-агонистическую активность. Кроме того, например, если неацилированный пептид обладает глюкагон-антагонистической активностью, то ацилированный пептид сохраняет такую глюкагон-антагонистическую активность. Например, если неацилированный пептид обладает GLP-1-агонистической активностью, то ацилированный пептид сохраняет такую GLP-1-агонистическую активность. Неограничивающими примерами являются ацилирование в положениях 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа). Что касается родственных глюкагону пептидов класса 1, класса 2 и класса 3, то ацилирование может быть осуществлено в любом из положений 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28, 29, 30, 37, 38, 39, 40, 41, 42 или 43 (в соответствии с нумерацией аминокислот глюкагона дикого типа). Ацильная группа может быть ковалентно связана непосредственно с аминокислотой родственного глюкагону пептида, либо она может быть связана с аминокислотой родственного глюкагону пептида посредством спейсера, где указанный спейсер расположен между аминокислотой родственного глюкагону пептида и ацильной группой. Родственные глюкагону пептиды могут быть ацилированы в том же самом положении аминокислоты, в котором присоединена гидрофильная группа, либо в другом положении. Неограничивающими примерами являются ацилирование в положении 10 (в соответствии с нумерацией аминокислот глюкагона дикого типа) и ПЭГилирование в одном или нескольких положениях в С-концевой части пептида глюкагона, например, в положениях 24, 28 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) в C-концевом удлинении или у C-конца (например, посредством присоединения C-концевого Cys).
В конкретном аспекте изобретения, родственный глюкагону пептид модифицируют посредством прямого ацилирования амина, гидроксила или тиола боковой цепи аминокислоты родственного глюкагону пептида так, чтобы он содержал ацильную группу. В некоторых вариантах изобретения, родственный глюкагону пептид подвергают прямому ацилированию посредством амина, гидроксила или тиола боковой цепи аминокислоты. В некоторых вариантах изобретения, ацилирование осуществляют в положениях 10, 20, 24 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа). В соответствии с этим, ацилированный пептид, родственный глюкагону, может содержать аминокислотную последовательность SEQ ID NO: 701, или модифицированную аминокислотную последовательность, имеющую одну или несколько описанных здесь аминокислотных модификаций, где по меньшей мере одна из аминокислот в положениях 10, 20, 24 и 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) модифицирована любой аминокислотой, содержащей амин, гидроксил или тиол боковой цепи. В некоторых конкретных вариантах изобретения, прямое ацилирование родственного глюкагону пептида осуществляют посредством амина, гидроксила или тиола боковой цепи аминокислоты в положении 10 (в соответствии с нумерацией аминокислот глюкагона дикого типа).
В некоторых вариантах изобретения, аминокислотой, содержащей амин боковой цепи, является аминокислота формулы I:
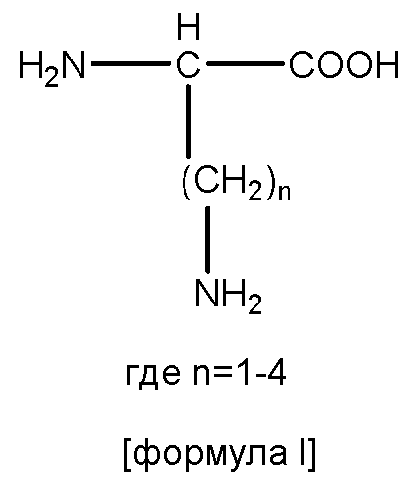
В некоторых репрезентативных вариантах изобретения, аминокислотой формулы I является аминокислота, где n равно 4 (Lys) или n равно 3 (Orn).
В других вариантах изобретения, аминокислотой, содержащей гидроксил боковой цепи, является аминокислота формулы II:

В некоторых репрезентативных вариантах изобретения, аминокислотой формулы II является аминокислота, где n равно 1 (Ser).
В других вариантах изобретения, аминокислотой, содержащей тиол боковой цепи, является аминокислота формулы III:
В некоторых репрезентативных вариантах изобретения, аминокислотой формулы III является аминокислота, где n равно 1 (Cys).
В других вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, аминокислота, содержащая амин, гидроксил или тиол боковой цепи, представляет собой дизамещенную аминокислоту, имеющую такую же структуру, как и аминокислоты формулы I, формулы II или формулы III, за исключением того, что атом водорода, связанный с альфа-углеродом аминокислоты формулы I, формулы II или формулы III, заменен второй боковой цепью.
В некоторых вариантах изобретения, ацилированный пептид, родственный глюкагону, содержит спейсер, расположенный между пептидом и ацильной группой. В некоторых вариантах изобретения, родственный глюкагону пептид ковалентно связан со спейсером, который, в свою очередь, ковалентно связан с ацильной группой. В некоторых репрезентативных вариантах изобретения, родственный глюкагону пептид модифицируют так, чтобы он содержал ацильную группу, где такую модификацию осуществляют посредством реакции ацилирования амина, гидроксила или тиола спейсера, где указанный спейсер присоединен к боковой цепи аминокислоты в положениях 10, 20, 24 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) или у C-концевой аминокислоты родственного глюкагону пептида. Аминокислотой, к которой присоединен спейсер, может быть любая аминокислота, содержащая группу, способную образовывать связь со спейсером. Так, например, подходящей является аминокислота, содержащая -NH2, -OH, или -COOH боковой цепи (например, Lys, Orn, Ser, Asp или Glu). Кроме того, что касается родственных глюкагону пептидов класса 1, класса 2 и класса 3, то подходящей является аминокислота (например, аминокислота, имеющая одно или два замещения в α-положении), содержащая -NH2, -OH или -COOH боковой цепи (например, Lys, Orn, Ser, Asp или Glu). В соответствии с этим, ацилированный родственный глюкагону пептид может содержать аминокислотную последовательность SEQ ID NO: 701 или ее модифицированную аминокислотную последовательность, имеющую одну или несколько описанных здесь аминокислотных модификаций, где по меньшей мере одна из аминокислот в положениях 10, 20, 24 и 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа), заменена любой аминокислотой, содержащей амин, гидроксил или карбоксилат боковой цепи.
В некоторых вариантах изобретения, спейсер представляет собой аминокислоту, содержащую амин, гидроксил или тиол боковой цепи, либо дипептид или трипептид, включающий аминокислоту, содержащую амин, гидроксил или тиол боковой цепи. В некоторых вариантах изобретения, аминокислотный спейсер не является γ-Glu. В некоторых вариантах изобретения, дипептидный спейсер не является γ-Glu-γ-Glu.
Если ацилирование происходит посредством аминогруппы аминокислоты спейсера, то такое ацилирование может происходить посредством альфа-амина аминокислоты или амина боковой цепи. В случае, если альфа-амин является ацилированным, то спейсерной аминокислотой может быть любая аминокислота. Так, например, спейсерной аминокислотой может быть гидрофобная аминокислота, например, Gly, Ala, Val, Leu, Ile, Trp, Met, Phe, Tyr. В некоторых вариантах изобретения, в которых пептидом, родственным глюкагону, является родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсерной аминокислотой может быть, например, гидрофобная аминокислота, например, Gly, Ala, Val, Leu, Ile, Trp, Met, Phe, Tyr, 6-аминогексановая кислота, 5-аминовалериановая кислота, 7-аминогептановая кислота, 8-аминооктановая кислота. Альтернативно, спейсерной аминокислотой может быть кислотный остаток, например, Asp и Glu. В случае если амин боковой цепи спейсерной аминокислоты является ацилированным, то спейсерной аминокислотой является аминокислота, содержащая амин боковой цепи, например, аминокислота формулы I (например, Lys или Orn). В этом случае, альфа-амин и амин боковой цепи спейсерной аминокислоты могут быть ацилированы, в результате чего пептид глюкагона становится диацилированным. Такие диацилированные молекулы являются вариантами настоящего изобретения.
Если ацилирование происходит посредством гидроксильной группы аминокислоты спейсера, то такой аминокислотой или одной из аминокислот дипептида или трипептида может быть аминокислота формулы II. В конкретном репрезентативном варианте, такой аминокислотой является Ser.
Если ацилирование происходит посредством тиоловой группы аминокислоты спейсера, то такой аминокислотой или одной из аминокислот дипептида или трипептида может быть аминокислота формулы III. В конкретном репрезентативном варианте, такой аминокислотой является Cys.
В некоторых вариантах изобретения, спейсер содержит гидрофильный бифункциональный спейсер. В конкретном варианте изобретения, спейсер содержит аминополи(алкилокси)карбоксилат. В соответствии с этим, спейсер может содержать, например, NH2(CH2CH2O)n(CH2)mCOOH, где m равно любому целому числу от 1 до 6, а n равно любому целому числу от 2 до 12, например, 8-амино-3,6-диоксаоктановую кислоту, которая поставляется фирмой Peptides International, Inc. (Louisville, KY).
В некоторых вариантах изобретения, относящихся только к родственным глюкагону пептидам класса 1, класса 2 и класса 3, спейсер содержит гидрофильный бифункциональный спейсер. В некоторых вариантах изобретения, гидрофильный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит две или более реакционноспособных групп, например, амин, гидроксильную группу, тиоловую группу и карбоксильную группу или любые их комбинации. В некоторых вариантах изобретения, гидрофильный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит гидроксильную группу и карбоксилат. В других вариантах изобретения, гидрофильный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит аминогруппу и карбоксилат. В других вариантах изобретения, гидрофильный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит тиоловую группу и карбоксилат.
В некоторых вариантах изобретения, в которых пептидом, родственным глюкагону, является родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсером является гидрофобный бифункциональный спейсер. Гидрофобные бифункциональные спейсеры известны специалистам. См., например, публикацию Bioconjugate Techniques, G. T. Hermanson (Academic Press, San Diego, CA, 1996), которая во всей своей полноте вводится в настоящее описание посредством ссылки. В некоторых вариантах изобретения, гидрофобный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит две или более реакционноспособных группы, например, амин, гидроксильную группу, тиоловую группу и карбоксильную группу или любые их комбинации. В некоторых вариантах изобретения, гидрофобный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит гидроксильную группу и карбоксилат. В других вариантах изобретения, гидрофобный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит аминогруппу и карбоксилат. В других вариантах изобретения, гидрофобный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит тиоловую группу и карбоксилат. Подходящие гидрофобные бифункциональные спейсеры, содержащие карбоксилат, гидроксильную группу или тиоловую группу, известны специалистам, и такими спейсерами являются, например, 8-гидроксиокатновая кислота и 8-меркаптооктановая кислота.
В некоторых вариантах изобретения, бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, не является дикарбоновой кислотой, содержащей неразветвленный метилен, состоящий из 1-7 атомов углерода, расположенных между карбоксилатными группами. В некоторых вариантах изобретения, бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, представляет собой дикарбоновую кислоту, содержащую неразветвленный метилен, состоящий из 1-7 атомов углерода, расположенных между карбоксилатными группами.
В конкретных вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсер (например, аминокислота, дипептид, трипептид, гидрофильный бифункциональный спейсер или гидрофобный бифункциональный спейсер) имеет длину в 3-10 атомов (например, 6-10 атомов (например, 6, 7, 8, 9 или 10 атомов). В более конкретных вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсер имеет длину примерно 3-10 атомов (например, 6-10 атомов), а ацильной группой является жирная C12-C18-ацильная группа, например, жирная C14-ацильная группа, жирная C16-ацильная группа, в результате чего общая длина спейсера и ацильной группы составляет 14-28 атомов, например, приблизительно 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 или 28 атомов. В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, длина спейсера и ацильной группы составляет 17-28 (например, 19-26, 19-21) атомов.
В соответствии с некоторыми вариантами изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, бифункциональный спейсер может представлять собой синтетическую или природную аминокислоту (включая, но не ограничиваясь ими, любую из описанных здесь аминокислот), содержащую аминокислотный остов длиной в 3-10 атомов (например, 6-аминогексановую кислоту, 5-аминовалериановую кислоту, 7-аминогептановую кислоту и 8-аминооктановую кислоту). Альтернативно, спейсером, присоединенным к родственному глюкагону пептиду класса 1, класса 2 или класса 3, может быть дипептидный или трипептидный спейсер, имеющий пептидный остов длиной 3-10 атомов (например, 6-10 атомов). Каждая аминокислота дипептидного или трипептидного спейсера, присоединенного к родственному глюкагону пептиду класса 1, класса 2 или класса 3, может быть идентична другой(им) аминокислоте(ам) дипептида или трипептида, либо она может отличаться от этой(их) аминокислоты (аминокислот), и такие аминокислоты могут быть независимо выбраны из группы, состоящей из природных и/или неприродных аминокислот, включая, например, любой из D- или L-изомеров природных аминокислот (Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp, Tyr), или любой из D- или L-изомеров неприродных аминокислот, выбранных из группы, состоящей из: β-аланина (β-Ala), N-α-метилаланина (Me-Ala), аминомасляной кислоты (Abu), γ-аминомасляной кислоты (γ-Abu), аминогексановой кислоты (ε-Ahx), аминоизомасляной кислоты (Aib), аминометилпирролкарбоновой кислоты, аминопиперидинкарбоновой кислоты, аминосерина (Ams), аминотетрагидропиран-4-карбоновой кислоты, аргинин-N-метокси-N-метиламида, β-аспарагиновой кислоты (β-Asp), азетидинкарбоновой кислоты, 3-(2-бензотиазолил)аланина, α-трет-бутилглицина, 2-амино-5-уреидо-н-валериановой кислоты (цитруллина, Cit), β-циклогексилаланина (Cha), ацетамидометилцистеина, диаминобутановой кислоты (Dab), диаминопропионовой кислоты (Dpr), дигидроксифенилаланина (DOPA), диметилтиазолидина (DMTA), γ-глутаминовой кислоты (γ-Glu), гомосерина (Hse), гидроксипролина (Hyp), N-метокси-N-метиламида изолейцина, метилизолейцина (MeIle), изонипекотиновой кислоты (Isn), метиллейцина (MeLeu), метиллизина, диметиллизина, триметиллизина, метанопролина, сульфоксида метионина (Met(O)), метионинсульфона (Met(О2)), норлейцина (Nle), метилнорлейцина (Me-Nle), норвалина (Nva), орнитина (Orn), пара-аминобензойной кислоты (PABA), пеницилламина (Pen), метилфенилаланина (MePhe), 4-хлорфенилаланина (Phe(4-Cl)), 4-фторфенилаланина (Phe(4-F)), 4-нитрофенилаланина (Phe(4-NO2)), 4-цианофенилаланина ((Phe(4-CN)), фенилглицина (Phg), пиперидинилаланина, пиперидинилглицина, 3,4-дегидропролина, пирролидинилаланина, саркозина (Sar), селеноцистеина (Sec), O-бензил-фосфосерина, 4-амино-3-гидрокси-6-метилгептановой кислоты (Sta), 4-амино-5-циклогексил-3-гидроксигептановой кислоты (ACHPA), 4-амино-3-гидрокси-5-фенилпентановой кислоты (AHPPA), l,2,3,4-тетрагидро-изохинолин-3-карбоновой кислоты (Tic), тетрагидропиранглицина, тиенилаланина (Thi), O-бензил-фосфотирозина, O-фосфотирозина, метокситирозина, этокситирозина, О-(бис-диметиламино-фосфоно)тирозина, тетрабутиламина сульфата тирозина, метилвалина (MeVal) и алкилированной 3-меркаптопропионовой кислоты.
В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсер имеет общий отрицательный заряд, например, он содержит одну или две отрицательно заряженных аминокислоты. В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, дипептид не является любым из дипептидов общей структуры A-B, где A выбран из группы, состоящей из Gly, Gln, Ala, Arg, Asp, Asn, Ile, Leu, Val, Phe и Pro, а B выбран из группы, состоящей из Lys, His, Trp. В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, дипептидный спейсер выбран из группы, состоящей из Ala-Ala, β-Ala-β-Ala, Leu-Leu, Pro-Pro, γ-аминомасляной кислоты-γ-аминомасляной кислоты и γ-Glu- γ-Glu.
В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, указанный родственный глюкагону пептид модифицирован так, что он содержит ацильную группу, введенную посредством ацилирования длинноцепочечного алкана родственным глюкагону пептидом. В конкретных аспектах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, длинноцепочечный алкан содержит амин, гидроксильную группу или тиоловую группу (например, октадециламин, тетрадеканол и гексадекантиол), которые реагируют с карбоксильной группой или активированной формой такой группы пептида, родственного глюкагону. Карбоксильная группа или ее активированная форма родственного глюкагону пептида класса 1, класса 2 или класса 3 может представлять собой часть боковой цепи аминокислоты (например, глутаминовой кислоты, аспарагиновой кислоты) родственного глюкагону пептида, либо она может представлять собой часть пептидного остова.
В некоторых вариантах изобретения, родственный глюкагону пептид класса 1, класса 2 или класса 3 модифицируют так, чтобы он содержал ацильную группу, введенную путем ацилирования длинноцепочечного алкана спейсером, который присоединен к пептиду глюкагона. В конкретных аспектах изобретения, длинноцепочечный алкан содержит амин, гидроксильную или тиоловую группу, которые реагируют с карбоксильной группой или активированной формой такой группы спейсера. Подходящие спейсеры, содержащие карбоксильную группу или ее активированную форму, описаны в настоящей заявке, и такими спейсерами являются, например, бифункциональные спейсеры, например, аминокислоты, дипептиды, трипептиды, гидрофильные бифункциональные спейсеры и гидрофобные бифункциональные спейсеры.
Используемый здесь термин «активированная форма карбоксильной группы» означает карбоксильную группу общей формулы R(C=О)X, где X представляет собой уходящую группу, а R представляет собой родственный глюкагону пептид или спейсер. Так, например, активированными формами карбоксильных групп могут быть, но не ограничиваются ими, ацилхлориды, ангидриды и сложные эфиры. В некоторых вариантах изобретения, активированной карбоксильной группой является сложный эфир с N-гидроксисукцинимидной (NHS) уходящей группой.
В тех аспектах изобретения, в которых длинноцепочечный алкан ацилирован родственным глюкагону пептидом класса 1, класса 2 или класса 3 или спейсером, длинноцепочечный алкан может иметь любой размер и может содержать углеродную цепь любой длины. Длинноцепочечный алкан может быть прямым или разветвленным. В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, длинноцепочечным алканом является C4-C30-алкан. Так, например, длинноцепочечным алканом может быть любой из таких алканов, как C4-алкан, C6-алкан, C8-алкан, C10-алкан, C12-алкан, C14-алкан, C16-алкан, C18-алкан, C20-алкан, C22-алкан, C24-алкан, C26-алкан, C28-алкан или C30-алкан. В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, длинноцепочечный алкан включает C8-C20-алкан, например, C14-алкан, C16-алкан или С18-алкан.
Кроме того, в некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, амин, гидроксильная группа или тиоловая группа родственного глюкагону пептида ацилированы холестериновой кислотой. В конкретном варианте изобретения, родственный глюкагону пептид класса 1, класса 2 или класса 3 связан с холестериновой кислотой посредством алкилированного дез-амино-Cys-спейсера, то есть, спейсера, представляющего собой алкилированную 3-меркаптопропионовую кислоту.
Подходящие методы ацилирования пептидов посредством аминов, гидроксилов и тиолов известны специалистам. См, например, Miller, Biochem Biophys Res Commun 218: 377-382 (1996); Shimohigashi and Stammer, Int J Pept Protein Res 19: 54-62 (1982); и Previero et al., Biochim Biophys Acta 263: 7-13 (1972) (методы ацилирования посредством гидроксила); и San and Silvius, J Pept Res 66: 169-180 (2005) (методы ацилирования посредством тиола); Bioconjugate Chem. "Chemical Modifications of Proteins: History and Applications" pages 1, 2-12 (1990); Hashimoto et al., Pharmacuetical Res. "Synthesis of Palmitoyl Derivatives of Insulin and their Biological Activity" Vol. 6, No: 2 pp.171-176 (1989).
Ацильная группа ацилированного пептида, родственного глюкагону, может иметь любой размер, например, углеродную цепь любой длины, и такая группа может быть прямой или разветвленной. В некоторых конкретных вариантах изобретения, ацильной группой является жирная C4-C30-кислота. Так, например, ацильной группой может быть любая из таких жирных кислот, как жирная C4-кислота, жирная C6-кислота, жирная C8-кислота, жирная C10-кислота, жирная C12-кислота, жирная C14-кислота, жирная C16-кислота, жирная C18-кислота, жирная C20-кислота, жирная C22-кислота, жирная C24-кислота, жирная C26-кислота, жирная C28-кислота или жирная C30-кислота. В некоторых вариантах изобретения, ацильной группой является жирная C8-С20-кислота, например, жирная C14-кислота или жирная C16-кислота.
В альтернативном варианте изобретения, ацильной группой является желчная кислота. Желчной кислотой может быть любая подходящая желчная кислота, включая, но не ограничиваясь ими, холевую кислоту, хенодезоксихолевую кислоту, дезоксихолевую кислоту, литохолевую кислоту, таурохолевую кислоту, гликохолевую кислоту и холестериновую кислоту.
Описанные здесь ацилированные пептиды, родственные глюкагону, могут быть дополнительно модифицированы так, чтобы они включали гидрофильную группу. В некоторых конкретных вариантах изобретения, гидрофильная группа может содержать полиэтиленгликолевую (ПЭГ) цепь. Введение гидрофильной группы может быть осуществлено любыми подходящими методами, такими как любой из описанных здесь методов. В соответствии с этим, ацилированный родственный глюкагону пептид может содержать SEQ ID NO: 701, включая любые описанные здесь модификации, в которых по меньшей мере одна из аминокислот в положениях 10, 20, 24 и 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) содержит ацильную группу, и по меньшей мере одна из аминокислот в положениях 16, 17, 21, 24 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа), в положении С-концевого удлинения или в положении С-концевой аминокислоты заменены на Cys, Lys, Orn, гомо-Cys или Ac-Phe, а боковая цепь аминокислоты ковалентно связана с гидрофильной группой (например, ПЭГ). В некоторых вариантах изобретения, ацильная группа присоединена в положении 10 (в соответствии с нумерацией аминокислот глюкагона дикого типа), необязательно, посредством спейсера, содержащего Cys, Lys, Orn, гомо-Cys или Ac-Phe, а гидрофильная группа введена в положение 24 остатка Cys.
Альтернативно, ацилированный родственный глюкагону пептид может содержать спейсер, где указанный спейсер был ацилирован и модифицирован так, чтобы он содержал гидрофильную группу. Неограничивающими примерами подходящих спейсеров являются спейсер, содержащий одну или несколько аминокислот, выбранных из группы, состоящей из Cys, Lys, Orn, гомо-Cys и Ac-Phe.
Алкилирование
В соответствии с некоторыми вариантами изобретения, родственный глюкагону пептид, например, родственный глюкагону пептид класса 1, родственный глюкагону пептид класса 2, родственный глюкагону пептид класса 3, родственный глюкагону пептид класса 4 или родственный глюкагону пептид класса 5 были модифицированы так, чтобы они содержали алкильную группу, связанную с родственным глюкагону пептидом посредством эфирной, тиоэфирной или аминовой связи в целях увеличения времени полужизни в кровотоке и/или замедления начала их действия и/или увеличения продолжительности их действия, и/или повышения резистентности к протеазам, таким как DPP-IV. В репрезентативных вариантах изобретения, в которых родственным глюкагону пептидом являются родственные глюкагону пептиды класса 1, класса 2 или класса 3, родственный глюкагону пептид содержит алкильную группу, которая не является нативной для природной аминокислоты.
Алкилирование может быть осуществлено в любом положении родственного глюкагону пептида, включая любое из положений 1-29, положение в С-концевом удлинении или С-концевое положение аминокислоты, при условии, что при этом, родственный глюкагону пептид будет сохранять агонистическую или антагонистическую активность по отношению к рецептору глюкагона, GLP-1 или другого родственного глюкагону пептида. В некоторых вариантах изобретения, если неалкилированный пептид обладает глюкагон-агонистической активностью, то алкилированный пептид сохраняет глюкагон-агонистическую активность. В других вариантах изобретения, если неалкилированный пептид обладает глюкагон-антагонистической активностью, то алкилированный пептид сохраняет глюкагон-антагонистическую активность. В некоторых вариантах изобретения, если неалкилированный пептид обладает GLP-1-агонистической активностью, то алкилированный пептид сохраняет GLP-1-агонистическую активность. Неограничивающими примерами является алкилирование в положениях 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа). Что касается родственных глюкагону пептидов класса 1, класса 2 и класса 3, то алкилирование может происходить в положениях 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28, 29, 30, 37, 38, 39, 40, 41, 42 или 43 (в соответствии с нумерацией аминокислот глюкагона дикого типа). Алкильная группа может быть ковалентно связана непосредственно с аминокислотой родственного глюкагону пептида, либо она может быть связана с аминокислотой родственного глюкагону пептида посредством спейсера, где указанный спейсер расположен между аминокислотой родственного глюкагону пептида и алкильной группой. Родственные глюкагону пептиды могут быть алкилированы в том же самом положении аминокислоты, в котором присоединена гидрофильная группа, либо в другом положении аминокислоты. Неограничивающими примерами являются алкилирование в положении 10 (в соответствии с нумерацией аминокислот глюкагона дикого типа) и ПЭГилирование в одном или нескольких положениях в С-концевой части родственного глюкагону пептида, например, в положениях 24, 28 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) в С-концевом удлинении или у C-конца (например, посредством присоединения C-концевого Cys).
В конкретном аспекте изобретения, родственный глюкагону пептид модифицируют так, чтобы он содержал алкильную группу, и такую модификацию осуществляют посредством прямого алкилирования амина, гидроксила или тиола боковой цепи аминокислоты родственного глюкагону пептида. В некоторых вариантах изобретения, родственный глюкагону пептид подвергают прямому алкилированию посредством амина, гидроксила или тиола боковой цепи аминокислоты. В некоторых вариантах изобретения, алкилирование осуществляют в положениях 10, 20, 24 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа). В соответствии с этим, алкилированный пептид, родственный глюкагону, может иметь аминокислотную последовательность SEQ ID NO: 701, или модифицированную аминокислотную последовательность, имеющую одну или несколько описанных здесь аминокислотных модификаций, где по меньшей мере одна из аминокислот в положениях 10, 20, 24 и 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) заменена любой аминокислотой, содержащей амин, гидроксил или тиол боковой цепи. В некоторых конкретных вариантах изобретения, прямое алкилирование родственного глюкагону пептида осуществляют посредством амина, гидроксила или тиола боковой цепи аминокислоты в положении 10 (в соответствии с нумерацией аминокислот глюкагона дикого типа).
В некоторых вариантах изобретения, аминокислотой, содержащей амин боковой цепи, является аминокислота формулы I. В некоторых репрезентативных вариантах изобретения, аминокислотой формулы I является аминокислота, где n равно 4 (Lys) или n равно 3 (Orn).
В других вариантах изобретения, аминокислотой, содержащей гидроксил боковой цепи, является аминокислота формулы II. В некоторых репрезентативных вариантах изобретения, аминокислотой формулы II является аминокислота, где n равно 1 (Ser).
В других вариантах изобретения, аминокислотой, содержащей тиол боковой цепи, является аминокислота формулы III. В некоторых репрезентативных вариантах изобретения, аминокислотой формулы III является аминокислота, где n равно 1 (Cys).
В других вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, аминокислота, содержащая амин, гидроксил или тиол боковой цепи, представляет собой дизамещенную аминокислоту, имеющую такую же структуру, как и аминокислоты формулы I, формулы II или формулы III, за исключением того, что атом водорода, связанный с альфа-углеродом аминокислоты формулы I, формулы II или формулы III, заменен второй боковой цепью.
В некоторых вариантах изобретения, алкилированный пептид, родственный глюкагону, содержит спейсер, расположенный между пептидом и алкильной группой. В некоторых вариантах изобретения, родственный глюкагону пептид ковалентно связан со спейсером, который, в свою очередь, ковалентно связан с алкильной группой. В некоторых репрезентативных вариантах изобретения, родственный глюкагону пептид модифицируют так, чтобы он содержал алкильную группу, посредством реакции алкилирования амина, гидроксила или тиола спейсера, где указанный спейсер присоединен к боковой цепи аминокислоты в положениях 10, 20, 24 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) родственного глюкагону пептида. Аминокислотой, к которой присоединен спейсер, может быть любая аминокислота, содержащая группу, способную образовывать связь со спейсером. Что касается родственных глюкагону пептидов класса 1, класса 2 и класса 3, то аминокислотой, к которой присоединен спейсер, может быть любая аминокислота (например, аминокислота, имеющая одно замещение в α-положении или α,α-дизамещенная аминокислота), содержащая группу, обеспечивающую связь со спейсером. Так, например, подходящей является аминокислота, содержащая -NH2, -OH или -COOH боковой цепи (например, Lys, Orn, Ser, Asp или Glu). В соответствии с этим, алкилированный родственный глюкагону пептид может содержать аминокислотную последовательность SEQ ID NO: 701 или ее модифицированную аминокислотную последовательность, имеющую одну или несколько описанных здесь аминокислотных модификаций, где по меньшей мере одна из аминокислот в положениях 10, 20, 24 и 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) заменена любой аминокислотой, содержащей амин, гидроксил или карбоксилат боковой цепи.
В некоторых вариантах изобретения, спейсер представляет собой аминокислоту, содержащую амин, гидроксил или тиол боковой цепи, либо дипептид или трипептид, включающий аминокислоту, содержащую амин, гидроксил или тиол боковой цепи. В некоторых вариантах изобретения, аминокислотный спейсер не является γ-Glu. В некоторых вариантах изобретения, дипептидный спейсер не является γ-Glu-γ-Glu.
Если алкилирование происходит посредством аминогруппы аминокислоты спейсера, то оно может быть осуществлено посредством альфа-амина аминокислоты или амина боковой цепи. В случае, если альфа-амин является алкилированным, то спейсерной аминокислотой может быть любая аминокислота. Так, например, спейсерной аминокислотой может быть гидрофобная аминокислота, например, Gly, Ala, Val, Leu, Ile, Trp, Met, Phe, Tyr. Альтернативно, спейсерной аминокислотой может быть кислотный остаток, например, Asp и Glu. В репрезентативных вариантах изобретения, в которых пептидом, родственным глюкагону, является родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсерной аминокислотой может быть гидрофобная аминокислота, например, Gly, Ala, Val, Leu, Ile, Trp, Met, Phe, Tyr, 6-аминогексановая кислота, 5-аминовалериановая кислота, 7-аминогептановая кислота, 8-аминооктановая кислота. Альтернативно, спейсерной аминокислотой, присоединенной к родственному глюкагону пептиду класса 1, класса 2 или класса 3, может быть кислотный остаток, например, Asp и Glu, при условии, что алкилирование будет происходить на альфа-амине кислотного остатка. В случае, если амин боковой цепи спейсерной аминокислоты является алкилированным, то спейсерной аминокислотой является аминокислота, содержащая амин боковой цепи, например, аминокислота формулы I (например, Lys или Orn). В этом случае, альфа-амин и амин боковой цепи спейсерной аминокислоты могут быть алкилированы, в результате чего пептид глюкагона становится диалкилированным. Такие диалкилированные молекулы являются вариантами настоящего изобретения.
Если алкилирование происходит посредством гидроксильной группы аминокислоты спейсера, то такой аминокислотой или одной из аминокислот спейсера может быть аминокислота формулы II. В конкретном репрезентативном варианте, такой аминокислотой является Ser.
Если алкилирование происходит посредством тиоловой группы аминокислоты спейсера, то такой аминокислотой или одной из аминокислот спейсера может быть аминокислота формулы III. В конкретном репрезентативном варианте, такой аминокислотой является Cys.
В некоторых вариантах изобретения, спейсер содержит гидрофильный бифункциональный спейсер. В конкретном варианте изобретения, спейсер содержит аминополи(алкилокси)карбоксилат. В соответствии с этим, спейсер может содержать, например, NH2(CH2CH2O)n(CH2)mCOOH, где m равно любому целому числу от 1 до 6, а n равно любому целому числу от 2 до 12, например, 8-амино-3,6-диоксаоктановую кислоту, которая поставляется фирмой Peptides International, Inc. (Louisville, KY).
В некоторых вариантах изобретения, родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсер содержит гидрофильный бифункциональный спейсер. В некоторых вариантах изобретения, гидрофильный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит две или более реакционноспособных группы, например, амин, гидроксильную группу, тиоловую группу и карбоксильную группу или любые их комбинации. В некоторых вариантах изобретения, гидрофильный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит гидроксильную группу и карбоксилат. В других вариантах изобретения, гидрофильный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит аминогруппу и карбоксилат. В других вариантах изобретения, гидрофильный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит тиоловую группу и карбоксилат.
В некоторых вариантах изобретения, спейсером, присоединенным к родственному глюкагону пептиду класса 1, класса 2 или класса 3, является гидрофобный бифункциональный спейсер. В некоторых вариантах изобретения, гидрофобный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит две или более реакционноспособных группы, например, амин, гидроксильную группу, тиоловую группу и карбоксильную группу или любые их комбинации. В некоторых вариантах изобретения, гидрофобный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит гидроксильную группу и карбоксилат. В других вариантах изобретения, гидрофобный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит аминогруппу и карбоксилат. В других вариантах изобретения, гидрофобный бифункциональный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, содержит тиоловую группу и карбоксилат. Подходящие гидрофобные бифункциональные спейсеры, содержащие карбоксилат, гидроксильную группу или тиоловую группу, известны специалистам, и такими спейсерами являются, например, 8-гидроксиокатновая кислота и 8-меркаптооктановая кислота.
В конкретных вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсер (например, аминокислота, дипептид, трипептид, гидрофильный бифункциональный спейсер или гидрофобный бифункциональный спейсер) имеет длину в 3-10 атомов (например, 6-10 атомов (например, 6, 7, 8, 9 или 10 атомов)). В более конкретных вариантах изобретения, спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, имеет длину примерно 3-10 атомов (например, 6-10 атомов), а алкильной группой является C12-C18-алкильная группа, например, C14-алкильная группа, C16-алкильная группа, в результате чего общая длина спейсера и алкильной группы составляет 14-28 атомов, например, приблизительно 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 или 28 атомов. В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, длина спейсера и алкила составляет 17-28 (например, 19-26, 19-21) атомов.
В соответствии с некоторыми вышеуказанными вариантами изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, бифункциональный спейсер может представлять собой синтетическую или неприродную аминокислоту, содержащую аминокислотный остов длиной в 3-10 атомов (например, 6-аминогексановую кислоту, 5-аминовалериановую кислоту, 7-аминогептановую кислоту и 8-аминооктановую кислоту). Альтернативно, спейсером, присоединенным к родственному глюкагону пептиду класса 1, класса 2 или класса 3, может быть дипептидный или трипептидный спейсер, имеющий пептидный остов длиной 3-10 атомов (например, 6-10 атомов). Дипептидный или трипептидный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, может состоять из природных и/или неприродных аминокислот, включая, например, любую из упомянутых здесь аминокислот. В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсер имеет общий отрицательный заряд, например, он содержит одну или две отрицательно заряженных аминокислоты. В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, дипептидный спейсер выбран из группы, состоящей из Ala-Ala, β-Ala-β-Ala, Leu-Leu, Pro-Pro, γ-аминомасляной кислоты-γ-аминомасляной кислоты и γ-Glu-γ-Glu. В некоторых вариантах изобретения, дипептидный спейсер не является γ-Glu-γ-Glu.
Подходящие методы алкилирования пептидов посредством аминов, гидроксилов и тиолов известны специалистам. Так, например, для образования эфирной связи между родственным глюкагону пептидом и алкильной группой может быть проведена реакция синтеза простого эфира Уильямсона. Кроме того, образование эфирной, тиоэфирной или аминовой связи может быть достигнуто посредством реакции нуклеофильного замещения пептида с алкилгалогенидом.
Алкильная группа алкилированного пептида, родственного глюкагону, может иметь любой размер, например, углеродную цепь любой длины, и такая группа может быть прямой или разветвленной. В некоторых вариантах изобретения, алкильной группой является C4-C30-алкил. Так, например, алкильной группой может быть любой из алкилов, таких как C4-алкил, C6-алкил, C8-алкил, C10-алкил, C12-алкил, C14-алкил, C16-алкил, C18-алкил, C20-алкил, C22-алкил, C24-алкил, C26-алкил, C28-алкил или C30-алкил. В некоторых вариантах изобретения, алкильной группой является C8-С20-алкил, например, C14-алкил или C16-алкил.
В некоторых конкретных вариантах изобретения, алкильная группа содержит стероидную часть желчной кислоты, например, холевой кислоты, хенодезоксихолевой кислоты, дезоксихолевой кислоты, литохолевой кислоты, таурохолевой кислоты, гликохолевой кислоты и холестериновой кислоты.
В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, указанный родственный глюкагону пептид модифицирован так, что он содержит алкильную группу, посредством реакции нуклеофильного замещения длинноцепочечного алкана с родственным глюкагону пептидом, где указанный родственный глюкагону пептид содержит уходящую группу, подходящую для проведения реакции нуклеофильного замещения. В конкретных аспектах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, нуклеофильная группа длинноцепочечного алкана содержит амин, гидроксильную группу или тиоловую группу (например, октадециламин, тетрадеканол и гексадекантиол). Уходящей группой родственного глюкагону пептида класса 1, класса 2 или класса 3 может быть часть боковой цепи аминокислоты или часть пептидного остова. Подходящими уходящими группами являются, например, N-гидроксисукцинимид, галогены и сложные эфиры сульфоновой кислоты.
В некоторых вариантах изобретения, родственный глюкагону пептид класса 1, класса 2 или класса 3 модифицирован так, что он содержит алкильную группу, посредством реакции нуклеофильного замещения длинноцепочечного алкана со спейсером, присоединенным к родственному глюкагону пептиду, где указанный спейсер содержит уходящую группу. В конкретных аспектах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, длинноцепочечный алкан содержит амин, гидроксильную группу или тиоловую группу. В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсером, содержащим уходящую группу, может быть любой из обсуждаемых здесь спейсеров, например, аминокислоты, дипептиды, трипептиды, гидрофильные бифункциональные спейсеры и гидрофобные бифункциональные спейсеры, которые дополнительно включают подходящую уходящую группу.
В тех аспектах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, и в которых длинноцепочечный алкан алкилирован родственным глюкагону пептидом или спейсером, длинноцепочечный алкан может иметь любой размер и может содержать углеродную цепь любой длины. Длинноцепочечный алкан может быть линейным или разветвленным. В некоторых аспектах изобретения, длинноцепочечным алканом является C4-C30-алкан. Так, например, длинноцепочечным алканом может быть любой из таких алканов, как C4-алкан, C6-алкан, C8-алкан, C10-алкан, C12-алкан, C14-алкан, C16-алкан, C18-алкан, C20-алкан, C22-алкан, C24-алкан, C26-алкан, C28-алкан или C30-алкан. В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, длинноцепочечный алкан содержит C8-C20-алкан, например, C14-алкан, C16-алкан или C18-алкан.
Кроме того, в некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, алкилирование может происходить между родственным глюкагону пептидом и холестериновой группой. Так, например, гидроксильная группа холестерина может заменять уходящую группу на длинноцепочечном алкане с образованием продукта «холестерин - пептид глюкагон».
Описанные здесь алкилированные пептиды, родственные глюкагону, могут быть дополнительно модифицированы так, чтобы они включали гидрофильную группу. В некоторых конкретных вариантах изобретения, гидрофильная группа может содержать полиэтиленгликолевую (ПЭГ) цепь. Введение гидрофильной группы может быть осуществлено любыми подходящими методами, такими как любой из описанных здесь методов. В соответствии с этим, ацилированный родственный глюкагону пептид может содержать SEQ ID NO: 701 или ее модифицированную аминокислотную последовательность, содержащую одну или несколько описанных здесь аминокислотных модификаций, в которых по меньшей мере одна из аминокислот в положениях 10, 20, 24 и 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) содержит алкильную группу, и по меньшей мере одна из аминокислот в положениях 16, 17, 21, 24 или 29, в положении С-концевого удлинения или в положении С-концевой аминокислоты заменены на Cys, Lys, Orn, гомо-Cys или Ac-Phe, а боковая цепь аминокислоты ковалентно связана с гидрофильной группой (например, ПЭГ). В некоторых вариантах изобретения, алкильная группа присоединена в положении 10 (в соответствии с нумерацией аминокислот глюкагона дикого типа), необязательно, посредством спейсера, содержащего Cys, Lys, Orn, гомо-Cys или Ac-Phe, а гидрофильная группа введена в положение 24 остатка Cys.
Альтернативно, алкилированный родственный глюкагону пептид может содержать спейсер, где указанный спейсер был алкилирован и модифицирован так, чтобы он содержал гидрофильную группу. Неограничивающими примерами подходящих спейсеров являются спейсер, содержащий одну или несколько аминокислот, выбранных из группы, состоящей из Cys, Lys, Orn, гомо-Cys и Ac-Phe.
Стабилизация альфа-спиральной структуры
В некоторых вариантах изобретения, для стабилизации трехмерной структуры карбокси-концевой части (например, аминокислот 12-29 (в соответствии с нумерацией аминокислот глюкагона дикого типа)) родственного глюкагону пептида, между двумя аминокислотными боковыми цепями создают внутримолекулярный мостик. Две аминокислотных боковых цепи могут быть связаны друг с другом посредством водородных связей, ионных взаимодействий, таких как образование солевых мостиков, или посредством ковалентных связей.
В некоторых вариантах изобретения, внутримолекулярный мостик образуется между двумя аминокислотами, которые находятся на расстоянии 3 аминокислот, например, аминокислот в положениях i и i+4, где i равно любому целому числу от 12 до 25 (например, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 и 25) в соответствии с нумерацией аминокислот глюкагона дикого типа. Более конкретно, боковые цепи аминокислотных пар 12 и 16, 16 и 20, 20 и 24 или 24 и 28 (аминокислотных пар, в которых i = 12, 16, 20 или 24) в соответствии с нумерацией аминокислот глюкагона дикого типа связаны друг с другом, и тем самым, стабилизируют альфа-спираль глюкагона. Альтернативно, i может быть равно 17.
В некоторых вариантах изобретения, где аминокислоты в положениях i и i+4 связаны внутримолекулярным мостиком, размер линкера составляет примерно 8 атомов или примерно 7-9 атомов.
В других вариантах изобретения, внутримолекулярный мостик образуется между двумя аминокислотами, которые находятся на расстоянии 2 аминокислот, например, аминокислот в положениях j и j+3, где j равно любому целому числу от 12 до 26 (например, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 и 26) в соответствии с нумерацией аминокислот глюкагона дикого типа. В некоторых конкретных вариантах изобретения, j равно 17.
В некоторых конкретных вариантах изобретения, где аминокислоты в положениях j и j+3 связаны внутримолекулярным мостиком, размер линкера составляет примерно 6 атомов или примерно 5-7 атомов.
В других вариантах изобретения, внутримолекулярный мостик образуется между двумя аминокислотами, которые находятся на расстоянии 6 аминокислот, например, аминокислот в положениях k и k+7, где k равно любому целому числу от 12 до 22 (например, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 и 22) в соответствии с нумерацией аминокислот глюкагона дикого типа. В некоторых конкретных вариантах изобретения, k=12, 13 или 17. В репрезентативном варианте изобретения, k равно 17.
Примерами аминокислотных пар, способных ковалентно связываться с образованием 6-атомного линкерного мостика, являются Orn и Asp, Glu и аминокислота формулы I, где n равно 2, и гомоглутаминовая кислота и аминокислота формулы I, где n равно 1, и где соединение формулы I представляет собой:
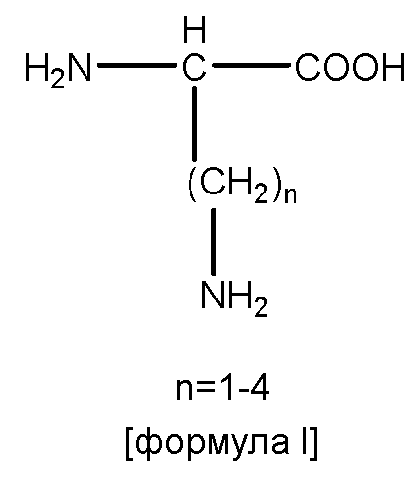
Примерами аминокислотных пар, обладающих способностью ковалентно связываться с образованием 7-атомного линкерного мостика, являются Orn-Glu (лактамовое кольцо); Lys-Asp (лактам); или гомоSer-гомоGlu (лактон). Примерами аминокислотных пар, которые могут образовывать 8-атомный линкер, являются Lys-Glu (лактам); гомоLys-Asp (лактам); Orn-гомоGlu (лактам); 4-аминоPhe-Asp (лактам) или Tyr-Asp (лактон). Примерами аминокислотных пар, которые могут образовывать 9-атомный линкер, являются гомоLys-Glu (лактам); Lys-гомоGlu (лактам); 4-аминоPhe-Glu (лактам); или Tyr-Glu (лактон). Любая из боковых цепей на этих аминокислотах может быть дополнительно замещена другими химическими группами, при условии, что это не будет приводить к разрушению трехмерной структуры альфа-спирали. Для среднего специалиста в данной области очевидно, что в целях создания стабилизирующей структуры аналогичного размера с нужным эффектом могут быть использованы альтернативные пары или альтернативные аминокислотные аналоги, включая химически модифицированные производные. Так, например, дисульфидный мостик между двумя гомоцистеинами имеет длину в 6 атомов и может быть дополнительно модифицирован для сообщения ему нужного эффекта. Даже в отсутствии ковалентной связи, аминокислотные пары, описанные выше, или аналогичные пары, известные среднему специалисту в данной области, могут также стабилизировать альфа-спираль посредством нековалентных связей, например, посредством образования солевых мостиков или водородных связей.
Размер лактамового кольца может варьироваться в зависимости от боковых цепей аминокислоты, а в некоторых вариантах изобретения, лактам образуется посредством связывания боковых цепей лизина с боковой цепью глутаминовой кислоты. Другими репрезентативными вариантами (в соответствии с нумерацией аминокислот глюкагона дикого типа) являются нижеследующие пары, которые связаны, но необязательно, лактамовыми мостиками, а именно: Glu в положении 12 с Lys в положении 16; нативный Lys в положении 12 с Glu в положении 16; Glu в положении 16 с Lys в положении 20; Lys в положении 16 с Glu в положении 20; Glu в положении 20 с Lys в положении 24; Lys в положении 20 с Glu в положении 24; Glu в положении 24 с Lys в положении 28; Lys в положении 24 с Glu в положении 28.
Альтернативно, порядок амидной связи в лактамовом кольце может быть обратным (например, лактамовое кольцо может быть образовано между боковыми цепями Lys12 и Glu16 или, альтернативно, между Glu12 и Lys16).
Внутримолекулярные мостики, не являющиеся лактамовым мостиком, могут быть использованы для стабилизации альфа-спирали родственных глюкагону пептидов. В некоторых вариантах изобретения, внутримолекулярным мостиком является гидрофобный мостик. В этом случае, внутримолекулярный мостик необязательно присутствует между боковыми цепями двух аминокислот, которые являются частью гидрофобной поверхности альфа-спирали родственного глюкагону пептида. Так, например, одной из аминокислот, связанных гидрофобным мостиком, может быть аминокислота в положении 10, 14 и 18 (в соответствии с нумерацией аминокислот глюкагона дикого типа).
В одном из конкретных аспектов, для перекрестного связывания одного или двух «витков» альфа-спирали родственного глюкагону пептида проводят реакцию метатезиса олефинов, осуществляемую с использованием полностью углеводородной системы перекрестного связывания. В этом случае, родственный глюкагону пептид может содержать α-метилированные аминокислоты, несущие олефиновые боковые цепи, имеющие различную длину и стереохимическую R- или S-конфигурацию в положениях i и i+4 или i+7. Так, например, олефиновая боковая цепь может содержать (CH2)n, где n равно любому целому числу от 1 до 6. В некоторых вариантах изобретения, при длине перекрестной связи в 8 атомов, n равно 3. Подходящие методы образования таких внутримолекулярных мостиков описаны в литературе. См, например, Schafmeister et al., J. Am. Chem. Soc. 122: 5891-5892 (2000) и Walensky et al., Science 305: 1466-1470 (2004). Альтернативно, пептид глюкагона может содержать остатки O-аллил-Ser, расположенные на смежных спиральных витках, которые образуют мостик в результате проведения катализируемой рутением реакции метатезиса с замыканием кольца. Такие методы перекрестного связывания описаны, например, Blackwell et al., Angew, Chem., Int. Ed. 37: 3281-3284 (1998).
В другом конкретном аспекте изобретения, для перекрестного связывания одного «витка» альфа-спирали используют неприродную аминокислоту тио-диаланин, лантионин, который широко применяется в качестве пептидомиметика цистина. Подходящие методы циклизации на основе лантионина известны специалистам. См., например, Matteucci et al., Tetrahedron Letters 45:1399-1401 (2004); Mayer et al., J. Peptide Res. 51:432-436 (1998); Polinsky et al., J. Med. Chem. 35: 4185-4194 (1992); Osapay et al., J. Med. Chem. 40: 2241-2251 (1997); Fukase et al., Bull. Chem. Soc. Jpn. 65: 2227-2240 (1992); Harpp et al., J. Org. Chem. 36: 73-80 (1971); Goodman and Shao, Pure Appl. Chem. 68: 1303-1308 (1996); и Osapay and Goodman, J. Chem. Soc. Chem. Commun. 1599-1600 (1993).
В некоторых вариантах изобретения, для стабилизации альфа-спирали пептида глюкагона используют α,ω-диаминоалкановые линкеры, например, 1,4-диаминопропан и 1,5-диаминопентан, расположенные между двумя остатками Glu в положениях i и i+7. Такие связи приводят к образованию мостика длиной в 9 атомов или более, в зависимости от длины диаминоалканового линкера. Подходящие методы получения пептидов, перекрестно связанных друг с другом посредством таких линкеров, описаны в литературе. См., например, Phelan et al., J. Am. Chem. Soc. 119: 455-460 (1997).
В другом варианте изобретения, для перекрестного связывания одного или двух витков альфа-спирали родственного глюкагону пептида используют дисульфидный мостик. Альтернативно, для стабилизации альфа-спирали родственного глюкагону пептида используют модифицированный дисульфидный мостик, в котором один или оба атома серы заменены метиленовой группой с последующей изостерической макроциклизацией. Подходящие методы модификации пептидов посредством образования дисульфидных мостиков или реакции циклизации с атомом серы, описаны, например, Jackson et al., J. Am. Chem. Soc. 113: 9391-9392 (1991) и Rudinger and Jost, Experientia 20: 570-571 (1964).
В другом варианте изобретения, альфа-спираль родственного глюкагону пептида стабилизируют посредством связывания атома металла с двумя остатками His или парой остатков His и Cys, расположенных в положениях i и i+4. Атомом металла может быть, например, Ru(III), Cu(II), Zn(II) или Cd(II). Такие методы стабилизации альфа-спирали посредством связывания с металлом известны специалистам. См., например, Andrews and Tabor, Tetrahedron 55:11711-11743 (1999); Ghadiri et al., J. Am. Chem. Soc. 112:1630-1632 (1990); и Ghadiri et al., J. Am. Chem. Soc. 119: 9063-9064 (1997).
Альфа-спираль родственного глюкагону пептида может быть альтернативно стабилизирована другими методами циклизации пептидов, описанными Davies, J. Peptide. Sci. 9:471-501 (2003). Альфа-спираль может быть стабилизирована посредством образования амидного мостика, тиоэфирного мостика, мостика из сложного тиоэфира, карбамидного мостика, карбаматного мостика, сульфонамидного мостика и т.п. Так, например, мостик из сложного тиоэфира может быть образован между С-концом и боковой цепью остатка Cys. Альтернативно, сложный тиоэфир может быть образован посредством боковых цепей аминокислот, имеющих тиол (Cys) и карбоновую кислоту (например, Asp, Glu). В другом методе, перекрестно-сшивающий агент, такой как дикарбоновая кислота, например, субериновая кислота (октандионовая кислота) и т.п., могут вводить связь между двумя функциональными группами аминокислотной боковой цепи, такими как свободная аминогруппа, гидроксильная группа, тиоловая группа и их комбинации.
В соответствии с некоторыми вариантами изобретения, альфа-спираль родственного глюкагону пептида стабилизируют путем введения гидрофобных аминокислот в положения i и i+4. Так, например, i может представлять собой Tyr, а i+4 может представлять собой Val или Leu; i может представлять собой Phe, а i+4 может представлять собой Cys или Met; I может представлять собой Cys, а i+4 может представлять собой Met; или i может представлять собой Phe, а i+4 может представлять собой Ile. Следует отметить, что в целях настоящего изобретения, вышеуказанные аминокислотные пары могут быть расположены в обратном порядке, например, указанная аминокислота в положении i может, альтернативно, присутствовать в положении i+4, а аминокислота в положении i+4 может присутствовать в положении i.
В соответствии с другими вариантами изобретения, в которых родственным глюкагону пептидом является пептид, обладающий глюкагон-агонистической активностью, GIP-агонистической активностью, глюкагон-антагонистической активностью и GLP-1-активностью, альфа-спираль стабилизируют посредством включения (путем замены или инсерции аминокислот) одной или нескольких альфа-спираль-стабилизирующих аминокислот в С-концевой части родственного глюкагону пептида (приблизительно аминокислот 12-29 в соответствии с нумерацией аминокислот глюкагона дикого типа). В конкретном варианте изобретения, альфа-спираль-стабилизирующей аминокислотой является α,α-дизамещенная аминокислота, включая, но не ограничиваясь ими, любую из таких аминокислот, как аминоизомасляная кислота (AIB), аминокислота, замещенная в двух положениях одинаковыми или различными группами, выбранными из метила, этила, пропила и н-бутила, или циклооктана или циклогептана (например, 1-аминоциклооктан-1-карбоновой кислоты). В некоторых вариантах изобретения, аминокислоты в одном, двух, трех, четырех или более положениях 16, 17, 18, 19, 20, 21, 24 или 29 родственного глюкагону пептида заменены α,α-дизамещенной аминокислотой. В конкретном варианте изобретения, аминокислоты в одном, двух, трех, четырех или во всех положениях 16, 20, 21 и 24 заменены AIB.
Конъюгаты
В настоящем описании также рассматриваются конъюгаты, в которых родственный глюкагону пептид (например, родственный глюкагону пептид класса 1, родственный глюкагону пептид класса 2, родственный глюкагону пептид класса 3, родственный глюкагону пептид класса 4 или родственный глюкагону пептид класса 5) связан, необязательно посредством ковалентной связи и, необязательно, посредством линкера, с другой частью конъюгата. Связывание может быть осуществлено посредством ковалентных химических связей, физических сил, таких как электростатические силы; водородных связей, ионных связей, ван-дер-ваальсовых связей, либо гидрофобных или гидрофильных взаимодействий. При этом могут быть использованы различные системы нековалентного связывания, включая биотин-авидин, лиганд/рецептор, фермент/субстрат, нуклеиновая кислота/белок, связывающийся с нуклеиновой кислотой, липид/белок, связывающийся с липидом, партнеры по связыванию с молекулой клеточной адгезии или любые партнеры по связыванию или их фрагменты, обладающие аффинностью по отношению друг к другу.
Родственный глюкагону пептид может быть связан с частями конъюгата посредством прямой ковалентной связи путем проведения реакции взаимодействия нужных аминокислотных остатков пептида с органическим дериватизирующим агентом, способным вступать в реакцию взаимодействия с выбранными боковыми цепями или с N- или C-концевыми остатками этих нужных аминокислот. Реакционноспособными группами на пептиде или на части конъюгата являются, например, альдегид, аминогруппа, сложный эфир, тиол, α-галогенацетил, малеимидогруппа или гидразиногруппа. Дериватизирующими агентами являются, например, малеимидобензоилсульфосукцинимидоэфир (конъюгированный посредством цистеиновых остатков), N-гидроксисукцинимид (конъюгированный посредством лизиновых остатков), глутаральдегид, ангидрид янтарной кислоты или другие агенты, известные специалистам. Альтернативно, части конъюгата могут быть связаны с пептидом посредством промежуточных носителей, таких как полисахаридные или полипептидные носители. Примерами полисахаридных носителей являются аминодекстран. Примерами подходящих полипептидных носителей являются полилизин, полиглутаминовая кислота, полиаспарагиновая кислота, их сополимеры и смешанные полимеры этих и других аминокислот, например, серинов, сообщающие загруженному носителю нужные свойства, такие как растворимость.
Цистеинильные остатки чаще всего подвергают реакции взаимодействия с α-галогенацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид, с получением карбоксиметиловых или карбоксиамидометиловых производных. Цистеиниловые остатки также дериватизируют посредством реакции взаимодействия с бромтрифторацетоном, альфа-бром-β-(5-имидазоил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, п-хлорбензоатом ртути, 2-хлор-ртуть-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом.
Гистидильные остатки дериватизируют посредством реакции взаимодействия с диэтилпирокарбонатом при pH 5,5-7,0, поскольку этот агент обладает относительной специфичностью к гистидиловой боковой цепи. Может быть также использован пара-бромфенацилбромид, при этом, реакцию, предпочтительно, осуществляют в 0,1 M какодилате натрия при pH 6,0.
Лизинильные и амино-концевые остатки подвергают реакции взаимодействия с ангидридами янтарной кислоты или другой карбоновой кислоты. Дериватизация этими агентами приводит к изменению заряда лизинильных остатков на противоположный. Другими подходящими реагентами для дериватизации альфа-амино-содержащих остатков являются сложные имидоэфиры, такие как метилпиколинимидат, фосфат пиридоксаля, пиридоксаль, хлорборогидрид, тринитробензолсульфоновая кислота, O-метилизомочевина, 2,4-пентандион и катализируемая трансаминазой реакция с глиоксилатом.
Аргинильные остатки модифицируют посредством реакции взаимодействия с одним или несколькими стандартными реагентами, такими как фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. При дериватизации аргининовых остатков необходимо, чтобы эта реакция была осуществлена в основных условиях, что обусловлено высоким pKa функциональной группы гуанидина. Кроме того, эти реагенты могут взаимодействовать с группами лизина, а также с эпсилон-аминогруппой аргинина.
Может быть осуществлена специфическая модификация тирозильных остатков, которая представляет особый интерес с точки зрения введения спектральных меток в тирозильные остатки посредством реакции взаимодействия с ароматическими соединениями диазония или тетранитрометаном. Для получения О-ацетилтирозильных молекул и 3-нитропроизводных чаще всего используют N-ацетилимидазол и тетранитрометан, соответственно.
Боковые карбоксильные группы (аспартильную или глутамильную) селективно модифицируют посредством реакции взаимодействия с карбодиимидами (R-N=C=N-R'), где R и R' представляют собой различные алкильные группы, такие как 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азоний-4,4-диметилпентил)карбодиимид. Кроме того, аспартильные и глутамильные остатки превращают в аспарагинильные и глутаминильные остатки посредством реакции взаимодействия с ионами аммония.
Другими модификациями являются гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных или треонильных остатков, метилирование альфа-аминогрупп лизиновых, аргининовых и гистидиновых боковых цепей (T. E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), дезамидирование аспарагина или глутамина, ацетилирование N-концевого амина и/или амидирование или эстерификация С-концевой группы карбоновой кислоты.
Ковалентная модификация другого типа включает химическое или ферментативное связывание гликозидов с пептидом. Сахар(а) может(могут) быть присоединен(ы) (a) к аргинину и гистидину, (b) к свободным гидроксильным группам, (c) к свободным сульфгидрильным группам, таким как сульфгидрильные группы цистеина, (d) к свободным гидроксильным группам, таким как гидроксильные группы серина, треонина или гидроксипролина, (e) к ароматическим остаткам, таким как остатки тирозина или триптофана, или (f) к амидной группе глутамина. Эти методы описаны в заявке WO87/05330, опубликованной 11 сентября 1987, и в публикации Aplin and Wriston, CRC Crit. Rev. Biochem., pp. 259-306 (1981).
Репрезентативными частями конъюгата, которые могут быть связаны с любым из описанных здесь родственных глюкагону пептидов, являются, но не ограничиваются ими, гетерологичный пептид или полипептид (включая, например, белок плазмы), нацеливающий агент, иммуноглобулин или его часть (например, вариабельная область, CDR или Fc-область), диагностическая метка, такая как радиоизотоп, флуорофор или ферментативная метка, полимер, включая водорастворимые полимеры или другие терапевтические или диагностические агенты. В некоторых своих вариантах, настоящее изобретение относится к конъюгату, содержащему родственный глюкагону пептид согласно изобретению и белок плазмы, где указанный белок плазмы выбран из группы, состоящей из альбумина, трансферина, фибриногена и глобулинов. В некоторых вариантах изобретения, белок плазмы, который является частью конъюгата, представляет собой альбумин или трансферин. В некоторых вариантах изобретения, линкер содержит цепь длиной примерно от 1 до 60 атомов или от 1 до 30 атомов или более, а также от 2 до 5 атомов, от 2 до 10 атомов, от 5 до 10 атомов или от 10 до 20 атомов. В некоторых вариантах изобретения, все атомы цепи представляют собой атомы углерода. В некоторых вариантах изобретения, атомы цепи в остове линкера выбраны из группы, состоящей из C, O, N и S. Атомы цепи и линкеры могут быть выбраны по их предполагаемой растворимости (гидрофильности), в результате чего может быть получен более растворимый конъюгат. В некоторых вариантах изобретения, линкер вводит функциональную группу, которую подвергают расщеплению ферментом или другим катализатором, или создают гидролитические условия, существующие в ткани- или в органе- или в клетке-мишени. В некоторых вариантах изобретения, линкер имеет длину, достаточную для снижения потенциала, создающего стерическое затруднение. Если линкер является ковалентной связью или пептидильной связью, а конъюгатом является полипептид, то весь конъюгат может представлять собой гибридный белок. Такие пептидильные линкеры могут иметь любую длину. Репрезентативные линкеры имеют длину примерно от 1 до 50, от 5 до 50, от 3 до 5, от 5 до 10, от 5 до 15 или от 10 до 30 аминокислот. Такие гибридные белки могут быть альтернативно получены методами рекомбинантных ДНК, известными среднему специалисту в данной области.
Как указывалось выше, в некоторых вариантах изобретения, родственные глюкагону пептиды являются конъюгированными, например, они присоединены к иммуноглобулину или к его части (например, к вариабельной области, CDR или Fc-области). Иммуноглобулинами известных типов (Ig) являются IgG, IgA, IgE, IgD или IgM. Fc-область представляет собой C-концевую область тяжелой цепи Ig, которая ответственна за связывание с Fc-рецепторами, обладающими активностью, такой как рециклинг (увеличивающий время полужизни), антителозависимая клеточно-опосредуемая цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC).
Так, например, в соответствии с некоторыми определениями, Fc-область тяжелой цепи человеческого IgG простирается от Cys226 до С-конца тяжелой цепи. «Шарнирная область» обычно простирается от Glu216 до Pro230 человеческого IgG1 (шарнирные области IgG других изотипов могут быть сопоставлены с последовательностью IgG1 путем их выравнивания и сравнения цистеинов, участвующих в образовании цистеиновых связей). Fc-область IgG включает два константных домена, CH2 и CH3. Домен CH2 Fc-области человеческого IgG обычно простирается от аминокислоты 231 до аминокислоты 341. Домен CH3 Fc-области человеческого IgG обычно простирается от аминокислоты 342 до аминокислоты 447. Положения аминокислот иммуноглобулинов или их фрагментов или областей указаны в соответствии с нумерацией по Кэбату (Kabat et al. 1991, Sequences of Proteins of Immunological Interest, U.S. Department of Public Health, Bethesda, Md.). В родственном варианте изобретения, Fc-область может содержать одну или несколько нативных или модифицированных константных областей тяжелой цепи иммуноглобулина, отличающихся от CH1, например, CH2- и CH3-области IgG и IgA, или CH3- и CH4-области IgE.
Подходящими частями конъюгата являются части последовательности иммуноглобулина, включающие FcRn-связывающий сайт. FcRn, рецептор «спасения», ответственен за рециклинг иммуноглобулинов и за их возвращение в кровоток. Область Fc-части IgG, которая связывается с FcRn-рецептором, была охарактеризована с помощью рентгеновского кристаллографического анализа (Burmeister et al. 1994, Nature 372:379). Основная область контакта Fc с FcRn расположена рядом с областью стыка CH2- и CH3-доменов. Все контакты Fc-FcRn осуществляются в одной тяжелой цепи Ig. Основными контактными сайтами являются аминокислотные остатки 248, 250-257, 272, 285, 288, 290-291, 308-311 и 314 CH2-домена и аминокислотные остатки 385-387, 428 и 433-436 CH3-домена.
Некоторыми частями конъюгата могут быть, а могут и не быть, сайт(ы) связывания с FcγR. FcγR ответственен за ADCC и CDC. Примерами положений в Fc-области, в которых осуществляется непосредственный контакт с FcγR, являются аминокислоты 234-239 (нижняя часть шарнирной области), аминокислоты 265-269 (петля B/C), аминокислоты 297-299 (петля C'/E) и аминокислоты 327-332 (петля F/G) (Sondermann et al., Nature 406: 267-273, 2000). Нижняя часть шарнирной области IgE также участвует в связывании с FcRI (Henry, et al., Biochemistry 36, 15568-15578, 1997). Остатки, участвующие в связывании с рецептором IgA, описаны в публикации Lewis et al., (J Immunol. 175:6694-701, 2005). Аминокислотные остатки, участвующие в связывании с рецептором IgE, описаны в публикации Sayers et al. (J Biol Chem. 279(34):35320-5, 2004).
Аминокислотные модификации могут быть внесены в Fc-область иммуноглобулина. Такие модифицированные Fc-области содержат по меньшей мере одну аминокислотную модификацию в CH3-домене Fc-области (остатки 342-447) и/или по меньшей мере одну аминокислотную модификацию в СН2-домене Fc-области (остатки 231-341). Очевидно, что мутациями, сообщающими повышенную аффинность по отношению к FcRn, являются T256A, T307A, E380A и N434A (Shields et al. 2001, J. Biol. Chem. 276:6591). Другие мутации могут снижать уровень связывания Fc-области с FcγRI, FcγRIIA, FcγRIIB и/или FcγRIIIA, но при этом, значительного снижения аффинности по отношению к FcRn не происходит. Так, например, замена остатка Asn в положении 297 Fc-области остатком Ala или другой аминокислотой приводит к удалению в высокой степени консервативного сайта N-гликозилирования и может приводить к снижению иммуногенности и одновременно к увеличению времени полужизни Fc-области, а также к снижению уровня связывания с FcγR (Routledge et al. 1995, Transplantation 60:847; Friend et al. 1999, Transplantation 68: 1632; Shields et al. 1995, J. Biol. Chem. 276:6591). В положениях 233-236 IgG1 были сделаны аминокислотные модификации, снижающие уровень связывания с FcγR (Ward and Ghetie 1995, Therapeutic Immunology 2:77 and Armour et al. 1999, Eur. J. Immunol. 29:2613). Некоторые репрезентативные аминокислотные замены описаны в патентах США № 7355008 и 7381408, каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
рПЭГ
В некоторых вариантах изобретения, конъюгат согласно изобретению содержит пептид, принадлежащий к суперсемейству глюкагонов, включая родственные глюкагону пептиды, остеокальцин, а также их аналоги, производные и конъюгаты, связанные со вспомогательным пептидом, обладающим способностью образовывать удлиненную конформацию, аналогичную конформации химического ПЭГ (например, рекомбинантную молекулу ПЭГ (рПЭГ)), такую как конформация, описанная в публикации Международной патентной заявки № WO2009/023270 и в публикации заявки на патент США № US2008/0286808. Молекула рПЭГ не является полиэтиленгликолем. В некоторых аспектах изобретения, молекулой рПЭГ является полипептид, содержащий одну или несколько аминокислот, таких как глицин, серин, глутаминовая кислота, аспарагиновая кислота, аланин или пролин. В некоторых аспектах изобретения, рПЭГ представляет собой гомополимер, например, поли-глицин, поли-серин, поли-глутаминовую кислоту, поли-аспарагиновую кислоту, поли-аланин или поли-пролин. В других вариантах изобретения, рПЭГ содержит повторы аминокислот двух типов, например, поли(Gly-Ser), поли(Gly-Glu), поли(Gly-Ala), поли(Gly-Asp), поли(Gly-Pro), поли(Ser-Glu) и т.п. В некоторых аспектах изобретения, рПЭГ содержит аминокислоты трех типов, например, поли(Gly-Ser-Glu). В конкретных аспектах изобретения, рПЭГ увеличивает время полужизни пептида, принадлежащего к суперсемейству глюкагонов, или остеокальцина. В некоторых аспектах изобретения, рПЭГ имеет суммарный положительный или суммарный отрицательный заряд. В некоторых аспектах изобретения, рПЭГ не имеет вторичной структуры. В некоторых вариантах изобретения, рПЭГ имеет длину, равную 10 аминокислотам или более, а в некоторых вариантах изобретения, он имеет длину примерно от 40 до 50 аминокислот. В некоторых аспектах изобретения, вспомогательный пептид присоединен к N- или C- концу пептида согласно изобретению посредством пептидной связи или сайта расщепления протеиназой, или встроен в петли пептида согласно изобретению. В некоторых аспектах изобретения, рПЭГ содержит аффинную метку или связан с ПЭГ, который имеет размер более 5 кДа. В некоторых вариантах изобретения, рПЭГ сообщает пептиду согласно изобретению повышенный гидродинамический радиус, увеличение время полужизни в сыворотке, повышенную резистентность к протеазе или повышенную растворимость, а в некоторых аспектах изобретения, пониженную иммуногенность.
Гибридные пептиды - C-концевое удлинение
В некоторых вариантах изобретения, родственный глюкагону пептид может содержать C-конец или C-концевую аминокислотную последовательность, включая, но не ограничиваясь ими: COOH, CONH2, GPSSGAPPPS (SEQ ID NO:710), GPSSGAPPPS-CONH2 (SEQ ID NO: 711), карбокси-концевое удлинение оксинтомодулина, KRNRNNIA (SEQ ID NO:714) или KGKKNDWKHNITQ (SEQ ID NO:713). Так, например, десять концевых аминокислот экзендина-4 (то есть, последовательность SEQ ID NO: 710 (GPSSGAPPPS)) присоединены к карбокси-концу родственного глюкагону пептида класса 1, родственного глюкагону пептида класса 2, родственного глюкагону пептида класса 3, родственного глюкагону пептида класса 4 или родственного глюкагону пептида класса 5 согласно изобретению.
Другим соединением, которое индуцирует снижение массы тела, является оксинтомодулин, природный пищеварительный гормон, присутствующий в тонком кишечнике (см. Diabetes 2005; 54:2390-2395). Оксинтомодулин представляет собой пептид, который состоит из 37 аминокислот (SEQ ID NO: 706) и содержит последовательность глюкагона из 29 аминокислот, за которыми следует карбокси-концевое удлинение из 8 аминокислот SEQ ID NO: 714 (KRNRNNIA). В соответствии с этим, в некоторых своих вариантах, настоящее изобретение относится к пролекарственным производным родственных глюкагону пептидов, которые также содержат карбокси-концевое удлинение, имеющее последовательность SEQ ID NO: 714 или удлинение из четырех аминокислот, имеющее последовательность KRNR.
Модификация глюкагона в положении 3
Описанные здесь родственные глюкагону пептиды класса 1-3 могут быть модифицированы в положении 3 (в соответствии с нумерацией аминокислот глюкагона дикого типа) в целях сохранения или повышения активности по отношению к рецептору глюкагона.
В некоторых вариантах изобретения, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, сохранение или повышение активности по отношению к рецептору глюкагона может быть достигнуто путем замены Gln в положении 3 глутаминовым аналогом. Так, например, родственный глюкагону пептид класса 1, класса 2 или класса 3, содержащий глутаминовый аналог в положении 3, может обладать активностью, которая составляет примерно 5%, примерно 10%, примерно 20%, примерно 50%, или примерно 85% или более от активности нативного глюкагона (SEQ ID NO: 701) по отношению к рецептору глюкагона. В некоторых вариантах изобретения, родственный глюкагону пептид класса 1, класса 2 или класса 3, содержащий глутаминовый аналог в положении 3, может обладать активностью, которая составляет примерно 20%, примерно 50%, примерно 75%, примерно 100%, примерно 200% или примерно 500% или более от активности соответствующего пептида глюкагона, имеющего такую же аминокислотную последовательность, как и пептид, содержащий глутаминовый аналог, за исключением замены аминокислоты в положении 3, по отношению к рецептору глюкагона. В некоторых вариантах изобретения, родственный глюкагону пептид класса 1, класса 2 или класса 3, содержащий глутаминовый аналог в положении 3, обладает повышенной активностью по отношению к рецептору глюкагона, и такая повышенная активность составляет не более, чем 1000%, 10000%, 100000% или 1000000% от активности нативного глюкагона или соответствующего родственного глюкагону пептида, имеющего такую же аминокислотную последовательность, как и пептид, содержащий глутаминовый аналог, за исключением замены аминокислоты в положении 3.
В некоторых вариантах изобретения, глутаминовый аналог представляет собой природную или неприродную аминокислоту, содержащую боковую цепь структуры I, II или III:
где: R1 представляет собой C0-3алкил или C0-3гетероалкил; R2 представляет собой NHR4 или C1-3алкил; R3 представляет собой C1-3алкил; R4 представляет собой H или C1-3алкил; X представляет собой NH, O или S; а Y представляет собой NHR4, SR3 или OR3. В некоторых вариантах изобретения, X представляет собой NH или Y представляет собой NHR4. В некоторых вариантах изобретения, R1 представляет собой C0-2алкил или C1гетероалкил. В некоторых вариантах изобретения, R2 представляет собой NHR4 или C1алкил. В некоторых вариантах изобретения, R4 представляет собой H или C1алкил. В своих репрезентативных вариантах, в которых родственным глюкагону пептидом является родственный глюкагону пептид класса 1, класса 2 или класса 3, настоящее изобретение относится к аминокислоте, содержащей боковую цепь структуры I, где R1 представляет собой CH2S, X представляет собой NH, а R2 представляет собой CH3 (ацетамидометилцистеин, C(Acm)); R1 представляет собой CH2, X представляет собой NH, а R2 представляет собой CH3 (ацетилдиаминобутановую кислоту, Dab(Ac)); R1 представляет собой C0алкил, X представляет собой NH, R2 представляет собой NHR4, а R4 представляет собой H (карбамоилдиаминопропановую кислоту, Dap(мочевину); или R1 представляет собой CH2CH2, X представляет собой NH, а R2 представляет собой CH3 (ацетилорнитин, Orn(Ac)). В своих репрезентативных вариантах, настоящее изобретение относится к аминокислоте, содержащей боковую цепь структуры II, где R1 представляет собой CH2, Y представляет собой NHR4, а R4 представляет собой CH3 (метилглутамин, Q(Me)). В своих репрезентативных вариантах, настоящее изобретение относится к аминокислоте, содержащей боковую цепь структуры III, где R1 представляет собой CH2, а R4 представляет собой H (сульфоксид метионина, M(O)). В конкретных вариантах изобретения, аминокислота в положении 3 заменена Dab(Ac).
Димеры
Что касается родственных глюкагону пептидов класса 1, класса 2 и класса 3, то такой родственный глюкагону пептид может быть частью димера, тримера или мультимера более высокого порядка, содержащего по меньшей мере два, три или более пептидов, связанных посредством линкера, где по меньшей мере один пептид или оба пептида представляют собой родственный глюкагону пептид. Димером может быть гомодимер или гетеродимер. В некоторых вариантах изобретения, линкер выбран из группы, состоящей из бифункционального тиолового перекрестно-связывающего линкера и бифункционального аминового перекрестно-связывающего линкера. В некоторых вариантах изобретения, линкером является ПЭГ, например, 5 кДа-ПЭГ, 20 кДа-ПЭГ. В некоторых вариантах изобретения, линкером является дисульфидная связь. Так, например, каждый мономер димера может содержать остаток Cys (например, концевой или внутренний Cys), а атом серы каждого остатка Cys участвует в образовании дисульфидной связи. В некоторых аспектах изобретения, мономеры соединены концевыми аминокислотами (например, N-концевыми или C-концевыми), внутренними аминокислотами или концевой аминокислотой по меньшей мере одного мономера и внутренней аминокислотой по меньшей мере одного другого мономера. В конкретных аспектах изобретения, мономеры не связаны друг с другом N-концевой аминокислотой. В некоторых аспектах изобретения, мономеры мультимера связаны друг с другом в ориентации «хвост к хвосту», в которой С-концевые аминокислоты каждого мономера связаны друг с другом. Часть конъюгата может быть ковалентно связана с любыми описанными здесь родственными глюкагону пептидами, включая димер, тример или мультимер более высокого порядка.
Методы получения родственных глюкагону пептидов
Описанные здесь родственные глюкагону пептиды (и пролекарства) могут быть получены стандартными методами синтеза, методами рекомбинантных ДНК или любыми другими методами получения пептидов и гибридных белков. Хотя некоторые неприродные аминокислоты не могут быть экспрессированы с применением стандартных методов рекомбинантных ДНК, однако, существуют методы их получения, которые известны специалистам. Соединения согласно изобретению, включающие непептидные части, могут быть синтезированы путем проведения, помимо стандартных реакций пептидного синтеза, стандартных реакций органического синтеза, если это возможно.
Классы родственных глюкагону пептидов более подробно описаны выше. В каждом разделе настоящей заявки, относящемся к родственным глюкагону пептидам классов 1, 2, 3, 4 и 5, описаны модификации, введенные в часть родственного глюкагону пептида (Q) пролекарственного соединения, подробно описанного выше. Таким образом, структурные элементы, описанные для класса родственных глюкагону пептидов, представляют собой структурные элементы Q, которые были затем модифицированы с получением пролекарственного соединения, описанного выше.
Родственные глюкагону пептиды класса 1
В некоторых вариантах изобретения, родственным глюкагону пептидом является родственный глюкагону пептид класса 1, описанный в настоящей заявке и в Международной патентной заявке No. PCT US2009/47437 (поданной 16 июня 2009), в Международной патентной заявке No. WO 2008/086086, опубликованной 17 июля 2008, и в предварительной заявке на патент США No. 61/090415, содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Биологические последовательности, упоминаемые в следующем разделе (SEQ ID NN: 801-915), относятся к родственным глюкагону пептидом класса 1, и соответствуют последовательностям SEQ ID NN: 1-115, описанным в Международной патентной заявке No. PCT US2009/47437.
Активность
Пептиды глюкагона класса 1 сохраняют активность по отношению к рецептору глюкагона, аналогичную активности нативного пептида глюкагона (SEQ ID NO: 801). Так, например, пептид глюкагона может сохранять по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85% или 90% от активности нативного глюкагона (как было вычислено по обратному отношению концентрации EC50 для пептида глюкагона к концентрации EC50 для глюкагона, измеренным, например, по уровню продуцирования cAMP с помощью анализа, который в общих чертах описан в примере 5). В некоторых вариантах изобретения, родственные глюкагону пептиды класса 1 обладают такой же активностью, как и глюкагон или еще большей активностью (или «эффективностью», этот термин используется здесь как синоним «активности»). В некоторых вариантах изобретения, описанные здесь пептиды глюкагона обладают активностью, которая составляет примерно не более, чем 100%, 1000%, 10000%, 100000% или 1000000% от активности нативного пептида глюкагона.
Любой из описанных здесь родственных глюкагону пептидов класса 1 может иметь EC50 по отношению к рецептору человеческого глюкагона, которая составляет 100 нМ, 75 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 5 нМ, 1 нМ или менее, как показал тест на индуцирование cAMP в клетках HEK293, сверхэкспрессирующих рецептор глюкагона, например, в анализе, описанном в примере 5. Обычно, ПЭГилированные пептиды имеют более высокую EC50 по сравнению с неПЭГилированным пептидом. Так, например, описанные родственные глюкагону пептиды класса 1, если они являются неПЭГилированными, могут обладать активностью по отношению к рецептору глюкагона, которая составляет по меньшей мере 20% (например, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, по меньшей мере 99%, 100%, 150%, 200%, 400%, 500% или более) от активности нативного глюкагона (SEQ ID NO: 801) по отношению к рецептору глюкагона. В некоторых вариантах изобретения, описанные здесь родственные глюкагону пептиды класса 1 имеют указанный % активности нативного глюкагона по отношению к рецептору глюкагона, если они не содержат гидрофильной группы, и имеют низкий % активности нативного глюкагона по отношению к рецептору глюкагона, если они содержат гидрофильную группу. Так, например, описанные здесь родственные глюкагону пептиды класса 1, если они являются ПЭГилированными, могут обладать активностью по отношению к рецептору глюкагона, которая составляет по меньшей мере 2% (например, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, или по меньшей мере 10%) от активности нативного глюкагона. В некоторых вариантах изобретения, описанные здесь родственные глюкагону пептиды класса 1 могут обладать любой из вышеуказанных активностей, которая составляет не более, чем 1000%, 10000%, 100000% или 1000000% от активности нативного глюкагона по отношению к рецептору глюкагона.
В некоторых вариантах изобретения, родственные глюкагону пептиды класса 1 обладают менее, чем примерно 5%, 4%, 3%, 2% или 1% от активности GLP-1 по отношению к рецептору GLP-1, и/или селективностью по отношению к рецептору глюкагона, которая примерно более, чем в 5 раз, 10 раз или 15 раз превышает селективность по отношению к рецептору GLP-1. Так, например, в некоторых вариантах изобретения, родственные глюкагону пептиды класса 1 обладают менее, чем 5% от активности нативного GLP-1 по отношению к рецептору GLP-1, и селективностью по отношению к рецептору глюкагона, которая более, чем в 5 раз превышает селективность по отношению к рецептору GLP-1.
Повышенная растворимость
Нативный глюкагон имеет плохую растворимость в водном растворе, а в частности, при физиологическом рН, и при этом, он имеет тенденцию к образованию агрегатов и к осаждению за определенный период времени. В противоположность этому, в некоторых вариантах изобретения, родственные глюкагону пептиды класса 1 обладают растворимостью, которая, например, через 24 часа при 25°C повышается по меньшей мере в 2 раза, в 5 раз или более по сравнению с растворимостью нативного глюкагона при рН 6-8, или 6-9, например, при рН 7.
В соответствии с этим, в некоторых вариантах изобретения, родственный глюкагону пептид класса 1, по сравнению с пептидом дикого типа, таким как His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (SEQ ID NO: 801), был модифицирован в целях повышения растворимости пептида в водных растворах, а в частности, при рН примерно от 5,5 до 8,0, но с сохранением биологической активности нативного пептида.
Так, например, растворимость любых описанных здесь родственных глюкагону пептидов класса 1 может быть еще больше увеличена путем присоединения гидрофильной группы к пептиду. Введение таких групп также приводит к увеличению продолжительности действия, например, как было измерено по увеличению времени полужизни в кровотоке. Гидрофильные группы также описаны в настоящей заявке.
Модификация заряженными остатками
В некоторых вариантах изобретения, растворимость улучшают путем сообщения заряда родственному глюкагону пептиду класса 1 посредством замены нативных незаряженных аминокислот заряженными аминокислотами, выбранными из группы, состоящей из лизина, аргинина, гистидина, аспарагиновой кислоты и глутаминовой кислоты, или посредством добавления заряженных аминокислот к амино- или к карбокси-концу пептида.
В соответствии с некоторыми вариантами изобретения, родственный глюкагону пептид класса 1 обладает повышенной растворимостью, что обусловлено тем, что указанный пептид был модифицирован путем аминокислотных замен и/или добавлений, которые вводят заряженную аминокислоту в С-концевую часть пептида, а в некоторых вариантах изобретения, в положение со стороны С-конца от положения 27 SEQ ID NO: 801. Одна, две или три заряженных аминокислоты могут быть введены, но необязательно, в С-концевую часть, а в некоторых вариантах изобретения, со стороны С-конца от положения 27. В соответствии с некоторыми вариантами изобретения, нативная(ые) аминокислот(ы) в положениях 28 и/или 29 заменена(ы) заряженной аминокислотой, и/или 1-3 заряженных аминокислоты добавлены к С-концу пептида, например, за положениями 27, 28 или 29. В репрезентативных вариантах изобретения, одна, две, три заряженных аминокислоты или все эти аминокислоты имеют отрицательный заряд. В других вариантах изобретения, одна, две, три заряженных аминокислоты или все эти аминокислоты имеют положительный заряд.
В конкретных репрезентативных вариантах изобретения, родственный глюкагону пептид класса 1 может содержать любую одну или две из нижеследующих модификаций: замену N28 на E; замену N28 на D; замену T29 на D; замену T29 на E; инсерцию E за положениями 27, 28 или 29; инсерцию D за положениями 27, 28 или 29. Такими заменами, например, являются замены D28E29, E28E29, E29E30, E28E30, D28E30.
В соответствии с одним из репрезентативных вариантов изобретения, родственный глюкагону пептид класса 1 содержит аминокислотную последовательность SEQ ID NO: 811, или ее аналог, которые содержат 1-3 дополнительных аминокислотных модификаций (описанных здесь для агонистов глюкагона) по сравнению с нативным глюкагоном или аналогом агониста глюкагона. Последовательность SEQ ID NO: 811 представляет собой модифицированный родственный глюкагону пептид класса 1, где аспарагиновый остаток в положении 28 нативного белка заменен аспарагиновой кислотой. В другом репрезентативном варианте изобретения, родственный глюкагону пептид класса 1 содержит аминокислотную последовательность SEQ ID NO: 838, где аспарагиновый остаток в положении 28 нативного белка был заменен глутаминовой кислотой. Другими репрезентативными вариантами являются родственные глюкагону пептиды класса 1, имеющие последовательности SEQ ID NN: 824, 825, 826, 833, 835, 836 и 837.
Замена природной аминокислоты в положении 28 и/или 29 зараженными аминокислотами и/или добавление одной или двух заряженных аминокислот у карбокси-конца родственного глюкагону пептида класса 1 приводит к повышению растворимости и стабильности пептидов глюкагона в водных растворах при физиологически приемлемых рН (то есть, при pH примерно 6,5-7,5) по меньшей мере в 5 раз и максимум в 30 раз. В соответствии с этим, в некоторых вариантах изобретения, пептиды глюкагона класса 1 сохраняют глюкагоновую активность и имеют растворимость, которая, через 24 часа при 25°C становится по меньшей мере в 2 раза, в 5 раз, в 10 раз, в 15 раз, в 25 раз, в 30 раз или выше, чем растворимость нативного глюкагона при данном рН, составляющем примерно 5,5-8, например, pH 7.
В родственный глюкагону пептид класса 1 могут быть введены дополнительные модификации, например, консервативные замены, описанные в настоящей заявке, что будет приводить к сохранению глюкагонной активности этих пептидов.
Повышенная стабильность
Любой из пептидов глюкагона класса 1 может иметь еще большую стабильность и/или меньшую способность к разложению, например, через 24 часа при 25°С, он может сохранять по меньшей мере 95% свойств исходного пептида. Любой из описанных здесь родственных глюкагону пептидов класса 1 может иметь еще большую стабильность при рН 5,5-8, например, через 24 часа при 25°С, он может сохранять по меньшей мере 75%, 80%, 90%, 95%, 96%, 97%, 98% или 99% свойств исходного пептида. В некоторых вариантах изобретения, родственные глюкагону пептиды класса 1 согласно изобретению обладают повышенной стабильностью, например, их концентрация может составлять по меньшей мере 75% (например, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, более, чем 95%, и до 100%) от концентрации пептида, при этом, менее, чем примерно 25% (например, менее, чем 20%, менее, чем 15%, менее, чем 10%, менее, чем 5%, 4%, 3%, 2%, 1%, и до 0%) разлагаемого пептида детектируется на 280 нм на детекторе ультрафиолетового (УФ) излучения примерно через 1 или более недель (например, примерно через 2 недели, примерно через 4 недели, примерно через 1 месяц, примерно через два месяца, примерно через три месяца, примерно через четыре месяца, примерно через шесть месяцев, примерно через восемь месяцев, примерно через десять месяцев, примерно через двенадцать месяцев) в растворе при температуре по меньшей мере 20°C (например, 21°C, 22°C, 23°C, 24°C, 25°C, 26°C, по меньшей мере 27,5°C, по меньшей мере 30°C, по меньшей мере 35°C, по меньшей мере 40°C, по меньшей мере 50°C), и менее, чем 100°C, менее, чем 85°C, менее, чем 75°C, или менее, чем 70°C. Родственные глюкагону пептиды класса 1 могут иметь дополнительные модификации, которые изменяют его фармацевтические свойства, например, повышают активность, увеличивают время полужизни в кровотоке, увеличивают срок хранения, снижают степень осаждения или агрегации и/или снижают степень разложения, например, снижают вероятность разложения или возникновения химических изменений после хранения.
В других репрезентативных вариантах изобретения, любой из вышеупомянутых родственных глюкагону пептидов класса 1 может быть дополнительно модифицирован в целях повышения стабильности посредством модификации аминокислоты в положении 15 SEQ ID NO: 801 для снижения степени разложения пептида за определенный период времени, а в частности, в кислотных или в основных буферах. В репрезентативных вариантах изобретения, Asp в положении 15 заменен на Glu, гомо-Glu, цистеиновую кислоту или гомоцистеиновую кислоту.
Альтернативно, любой из описанных здесь родственных глюкагону пептидов класса 1 может быть дополнительно модифицирован для повышения стабильности посредством замены аминокислоты в положении 16 SEQ ID NO: 801. В репрезентативных вариантах изобретения, относящихся к родственным глюкагону пептидам класса 1, в целях повышения их активности по отношению к рецептору глюкагона, Ser в положении 16 заменяют Thr или AIB, или любой из описанных здесь аминокислот. Такие модификации предотвращают расщепление пептидной связи между Asp15-Ser16.
В некоторых вариантах изобретения, любой из описанных здесь родственных глюкагону пептидов класса 1 может быть дополнительно модифицирован в целях снижения уровня расщепления в различных положениях аминокислот посредством модификации любой одной, двух, трех или всех четырех аминокислот в положениях 20, 21, 24 или 27. Репрезентативными вариантами являются замена Gln в положении 20 аминокислотами Ser, Thr, Ala или AIB, замена Asp в положении 21 аминокислотой Glu, замена Gln в положении 24 аминокислотой Ala или AIB, замена Met в положении 27 аминокислотой Leu или Nle. Удаление или замена метионина приводит к снижению уровня расщепления, обусловленного окислением метионина. Удаление или замена Gln или Asn приводит к снижению уровня расщепления, обусловленного дезамидированием Gln или Asn. Удаление или замена Asp приводит к снижению уровня расщепления, обусловленного дегидратацией Asp с образованием циклического сукцинимидного промежуточного соединения с последующей его изомеризацией в изоаспартат.
Повышенная активность
В соответствии с другим своим вариантом, настоящее изобретение относится к родственным глюкагону пептидам класса 1, которые обладают повышенной активностью по отношению к рецептору глюкагона, где указанные пептиды имеют аминокислотную модификацию в положении 16 нативного глюкагона (SEQ ID NO: 801). В неограничивающем примере, такая повышенная активность может быть достигнута путем замены природного серина в положении 16 глутаминовой кислотой или другой отрицательно заряженной аминокислотой, имеющей боковую цепь длиной в 4 атома, или альтернативно, любой одной из таких аминокислот, как глутамин, гомоглутаминовая кислота или гомоцистеиновая кислота, или заряженной аминокислотой, имеющей боковую цепь, содержащую по меньшей мере один гетероатом (например, N, O, S, P), и боковую цепь длиной примерно в 4 атома (или 3-5 атомов). Замена серина в положении 16 глутаминовой кислотой приводит к повышению активности по отношению к рецептору глюкагона по меньшей мере в 2 раза, 4 раза, 5 раз и до 10 раз или более. В некоторых вариантах изобретения, родственный глюкагону пептид класса 1 имеет селективность к рецептору глюкагона, которая, например, по меньшей мере в 5, 10 или 15 раз превышает селективность к рецепторам GLP-1.
Резистентность к DPP-IV
В некоторых вариантах изобретения, описанные здесь пептиды глюкагона класса 1 дополнительно модифицируют в положении 1 или 2 для снижения восприимчивости к расщеплению дипептидил-пептидазой IV. Более конкретно, в некоторых вариантах изобретения, родственный глюкагону пептид класса 1 в положении 1 и/или в положении 2 заменяют описанной(ыми) здесь аминокислотой(ами), резистентной(ыми) к DPP-IV. В некоторых вариантах изобретения, аминокислоту в положении 2 пептидного аналога заменяют аминоизомасляной кислотой. В некоторых вариантах изобретения, аминокислоту в положении 2 пептидного аналога заменяют аминокислотой, выбранной из группы, состоящей из D-серина, D-аланина, глицина, N-метилсерина и ε-аминомасляной кислоты. В другом варианте изобретения, аминокислоту в положении 2 родственного глюкагону пептида класса 1 заменяют аминокислотой, выбранной из группы, состоящей из D-серина, глицина и аминоизомасляной кислоты. В некоторых вариантах изобретения, аминокислота в положении 2 не является D-серином.
Снижение глюкагонной активности после модификации аминокислот в положении 1 и/или в положении 2 пептида глюкагона может быть устранено посредством стабилизации альфа-спиральной структуры в C-концевой части пептида глюкагона (аминокислоты примерно 12-29). Альфа-спиральная структура может быть стабилизирована, например, путем образования ковалентного или нековалентного внутримолекулярного мостика (например, лактамового мостика, расположенного между боковыми цепями аминокислот в положениях «i» и «i+4», где i равно целому числу от 12 до 25), замены аминокислот в положениях приблизительно 12-29 аминокислотой, стабилизирующей альфа-спираль (например, α,α-дизамещенной аминокислотой), и/или инсерции указанной аминокислоты в указанных положениях, как описано в настоящей заявке.
Модификации в положении 3
Активность по отношению к рецептору глюкагона может быть снижена путем модификации аминокислот в положении 3 (в соответствии с нумерацией аминокислот глюкагона дикого типа), например, замены природного глутамина в положении 3 кислотной, основной или гидрофобной аминокислотой. Так, например, замена в положении 3 глутаминовой кислотой, орнитином или норлейцином приводит к значительному снижению или устранению активности по отношению к рецептору глюкагона.
Сохранение или усиление активности по отношению к рецептору глюкагона может быть достигнуто путем замены Gln в положении 3 аналогом глутамина, описанным в настоящей заявке. Так, например, агонисты глюкагона могут содержать аминокислотную последовательность SEQ ID NO: 863, SEQ ID NO: 869, SEQ ID NO: 870, SEQ ID NO: 871, SEQ ID NO: 872, SEQ ID NO: 873 и SEQ ID NO: 874.
Повышение GLP-1 активности путем введения С-концевых амидов и сложных эфиров
Повышение активности по отношению к рецептору GLP-1 может быть достигнуто путем замены карбоксильной группы С-концевой аминокислоты нейтральной группой, такой как амид или сложный эфир. И наоборот, сохранение нативной карбоновой кислоты у С-конца пептида сообщает относительно более высокую селективность родственного глюкагону пептида класса 1 по отношению к рецептору глюкагона, чем к рецептору GLP-1 (например, приблизительно более, чем в 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 раз).
Другие модификации и комбинации
В родственный глюкагону пептид класса 1 могут быть введены дополнительные модификации, которые могут повышать растворимость и/или стабильность и/или глюкагоновую активность. Родственный глюкагону пептид класса 1 может альтернативно включать и другие модификации, которые не оказывают значительного влияния на растворимость или стабильность, и не приводят к значительному снижению глюкагоновую активности. В репрезентативных вариантах изобретения, родственный глюкагону пептид класса 1 может содержать вплоть до 11, 12, 13 или 14 аминокислотных модификаций по сравнению с нативной последовательностью глюкагона. Так, например, консервативные или неконсервативные замены, добавления или делеции могут быть сделаны в любом из положений, таких как положения 2, 5, 7, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29.
Репрезентативными модификациями родственного глюкагону пептида класса 1 являются, но не ограничиваются ими:
(a) неконсервативные замены, консервативные замены, добавления или делеции, по меньшей мере частично сохраняющие глюкагон-агонистическую активность, например, консервативные замены в одном или нескольких положениях, таких как положения 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29, замена Tyr в положении 10 аминокислотой Val или Phe, замена Lys в положении 12 аминокислотой Arg, замена в одном или нескольких положениях аминокислотой Ala;
(b) делеция аминокислот в положениях 29 и/или 28, и необязательно, в положении 27, по меньшей мере частично сохраняющая глюкагон-агонистическую активность;
(c) модификация аспарагиновой кислоты в положении 15, например, замена глутаминовой кислотой, гомоглутаминовой кислотой, цистеиновой кислотой или гомоцистеиновой кислотой, которая может приводить к снижению уровня разложения; или модификация серина в положении 16, например, путем его замены треонином, AIB, глутаминовой кислотой или другой отрицательно заряженной аминокислотой, имеющей боковую цепь длиной в 4 атома, или альтернативно, любой одной из таких аминокислот, как глутамин, гомоглутаминовая кислота или гомоцистеиновая кислота, где указанная замена аналогичным образом может приводить к снижению степени разложения, обусловленного расщеплением связи Asp15-Ser16;
(d) добавление гидрофильной группы, такой как описанный здесь водорастворимый полимер полиэтиленгликоль, например, в положениях 16, 17, 20, 21, 24, 29, 40 или у C-концевой аминокислоты, где указанное добавление может приводить к повышению растворимости и/или к увеличению времени полужизни;
(e) модификация метионина в положении 27, например, путем замены лейцином или норлейцином, в целях снижения степени окислительного разложения;
(f) модификация Gln в положении 20 или 24, например, путем замены аминокислотами Ser, Thr, Ala или AIB, в целях снижения степени разложения, обусловленного дезамидированием Gln;
(g) модификация Asp в положении 21, например, путем замены аминокислотой Glu, в целях снижения степени разложения, обусловленного дегидратацией Asp с образованием циклического сукцинимидного промежуточного соединения и его последующей изомеризацией в изоаспартат;
(h) описанные здесь модификации в положении 1 или 2, повышающие резистентность к расщеплению ферментом DPP-IV, необязательно в комбинации с внутримолекулярным мостиком, таким как лактамовый мостик, расположенный между положениями «i» и «i+4», где i равно целому числу от 12 до 25, например, 12, 16, 20, 24;
(i) ацилирование или алкилирование описанного здесь пептида глюкагона, которое может приводить к повышению активности по отношению к рецептору глюкагона и/или рецептору GLP-1, к увеличению времени полужизни в кровотоке и/или к увеличению продолжительности действия и/или замедлению начала действия, необязательно, в комбинации с добавлением гидрофильной группы, дополнительно или альтернативно, необязательно, в комбинации с модификацией, которая приводит к селективному снижению активности по отношению к пептиду GLP-1, например, модификацией Thr в положении 7, такой как замена Thr в положении 7 аминокислотой, не содержащей гидроксильной группы, например, Abu или Ile; делеция аминокислот со стороны C-конца по отношению к аминокислоте в положении 27 (например, делеция одной или обеих аминокислот в положениях 28 и 29, с получением пептида длиной в 27 или 28 аминокислот);
(j) C-концевые удлинения, описанные в настоящей заявке;
(k) гомодимеризация или гетеродимеризация, описанные в настоящей заявке; и
комбинации модификаций (a)-(k).
В некоторых вариантах изобретения, репрезентативными модификациями родственного глюкагону пептида класса 1 являются по меньшей мере одна аминокислотная модификация, выбранная из группы A, и одна или несколько аминокислотных модификаций, выбранных из группы B и/или группы C,
где модификация группы A представляет собой:
замену Asn в положении 28 заряженной аминокислотой;
замену Asn в положении 28 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты;
замену в положении 28 аминокислотами Asn, Asp или Glu;
замену в положении 28 аминокислотой Asp;
замену в положении 28 аминокислотой Glu;
замену Thr в положении 29 заряженной аминокислотой;
замену Thr в положении 29 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты;
замену в положении 29 аминокислотами Asp, Glu или Lys;
замену в положении 29 аминокислотой Glu;
инсерцию 1-3 заряженных аминокислот в положении, находящемся за положением 29;
инсерцию Glu или Lys за положением 29;
инсерцию Gly-Lys или Lys-Lys за положением 29;
или их комбинации;
модификация группы B представляет собой:
замену Asp в положении 15 аминокислотой Glu;
замену Ser в положении 16 аминокислотой Thr или AIB;
и где модификация группы C представляет собой:
замену His в положении 1 ненативной аминокислотой, которая снижает восприимчивость пептида глюкагона к расщеплению дипептидил-пептидазой IV (DPP-IV),
замену Ser в положении 2 ненативной аминокислотой, которая снижает восприимчивость пептида глюкагона к расщеплению дипептидил-пептидазой IV (DPP-IV),
замену Lys в положении 12 аминокислотой Arg;
замену Gln в положении 20 аминокислотами Ser, Thr, Ala или AIB;
замену Asp в положении 21 аминокислотой Glu;
замену Gln в положении 24 аминокислотами Ser, Thr, Ala или AIB;
замену Met в положении 27 аминокислотами Leu или Nle;
делецию аминокислот в положениях 27-29;
делецию аминокислот в положениях 28-29;
делецию аминокислоты в положении 29;
или их комбинации.
В репрезентативных вариантах изобретения, Lys в положении 12 заменен Arg. В других репрезентативных вариантах изобретения, аминокислоты в положениях 29 и/или 28, и, необязательно, в положении 27, делетированы.
В некоторых конкретных вариантах изобретения, пептид глюкагона содержит (a) аминокислотную модификацию в положении 1 и/или 2, которая сообщает резистентность к ферменту DPP-IV, например, замену DMIA в положении 1 или замену AIB в положении 2, (b) внутримолекулярный мостик в положениях 12-29, например, в положениях 16 и 20, или одну или несколько замен аминокислот в положениях 16, 20, 21 и 24 α,α-дизамещенной аминокислотой, необязательно (c) связанной с гидрофильной группой, такой как ПЭГ, например, посредством Cys в положении 24, 29 или в положении C-концевой аминокислоты, необязательно, (d) модификацию аминокислоты в положении 27, то есть, замену Met например, аминокислотой Nle, необязательно, (e) аминокислотные модификации в положениях 20, 21 и 24, снижающие степень разложения и, необязательно, (f) аминокислоты, связанные с SEQ ID NO: 820. Если пептид глюкагона связан с SEQ ID NO: 820, то в некоторых вариантах изобретения, аминокислотой в положении 29 является Thr или Gly. В других конкретных вариантах изобретения, пептид глюкагона содержит (a) Asp28Glu29, или Glu28Glu29 или Glu29Glu30, или Glu28Glu30 или Asp28Glu30, и необязательно (b) аминокислотную модификацию в положении 16, то есть, замену Ser, например, на Thr или AIB, и необязательно, (c) аминокислотную модификацию в положении 27, то есть, замену Met, например, на Nle, и необязательно, (d) аминокислотные модификации в положениях 20, 21 и 24, которые снижают степень разложения. В конкретном варианте изобретения, пептид глюкагона представляет собой T16, A20, E21, A24, Nle27, D28, E29.
В некоторых вариантах изобретения, родственный глюкагону пептид класса 1 содержит аминокислотную последовательность:
X1-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Z (SEQ ID NO: 839) с 1-3 аминокислотными модификациями,
где X1 и/или X2 представляет собой ненативную аминокислоту, которая снижает восприимчивость (или повышает резистентность) пептида глюкагона к расщеплению дипептидил-пептидазой IV (DPP-IV),
где Z выбран из группы, состоящей из -COOH (природного С-концевого карбоксилата), -Asn-COOH, Asn-Thr-COOH и Y-COOH, где Y представляет собой 1-2 аминокислоты, и
где внутримолекулярный мостик, связанный предпочтительно ковалентной связью, соединяет боковые цепи аминокислоты в положении i и аминокислоты в положении i+4, где i равно 12, 16, 20 или 24.
В некоторых вариантах изобретения, внутримолекулярным мостиком является лактамовый мостик. В некоторых вариантах изобретения, аминокислотами в положениях i и i+4 SEQ ID NO: 839 являются Lys и Glu, например, Glu16 и Lys20. В некоторых вариантах изобретения, X1 выбран из группы, состоящей из D-His, N-метил-His, альфа-метил-His, имидазолуксусной кислоты, дез-амино-His, гидроксил-His, ацетил-His, гомо-His и альфа,альфа-диметилимидазолуксусной кислоты (DMIA). В других вариантах изобретения, X2 выбран из группы, состоящей из D-Ser, D-Ala, Gly, N-метил-Ser, Val и альфа-аминоизомасляной кислоты (AIB). В некоторых вариантах изобретения, пептид глюкагона ковалентно связан с гидрофильной группой в любом из положений аминокислот 16, 17, 20, 21, 24, 29, 40, в области C-концевого удлинения или у C-концевой аминокислоты. В репрезентативных вариантах изобретения, эта гидрофильная группа ковалентно связана с остатками Lys, Cys, Orn, гомоцистеином или ацетилфенилаланином в любом из этих положений. Репрезентативными гидрофильными группами являются полиэтиленгликоль (ПЭГ), имеющий, например, молекулярную массу примерно от 1000 дальтон до 40000 дальтон, или примерно от 20000 дальтон до 40000 дальтон.
В других вариантах изобретения, родственный глюкагону пептид класса I содержит аминокислотную последовательность:
X1-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Z (SEQ ID NO: 839),
где X1 и/или X2 представляет собой ненативную аминокислоту, которая снижает восприимчивость (или повышает резистентность) пептида глюкагона к расщеплению дипептидил-пептидазой IV (DPP-IV),
где аминокислоты в одном, двух, трех, четырех или более положениях 16, 20, 21 и 24 пептида глюкагона заменены α,α-дизамещенной аминокислотой, и
где Z выбран из группы, состоящей из -COOH (природного C- концевого карбоксилата), -Asn-COOH, Asn-Thr-COOH и Y-COOH, где Y представляет собой 1-2 аминокислоты.
Другими репрезентативными аминокислотными модификациями вышеупомянутых родственных глюкагону пептидов класса 1 или его аналогов являются замена Thr в положении 7 аминокислотой, не имеющей гидроксильной группы, например, аминомасляной кислотой (Abu), Ile, необязательно, в комбинации с заменой или добавлением аминокислоты, содержащей боковую цепь, ковалентно связанную (например, посредством спейсера) с ацильной или алкильной группой, где указанная ацильная или алкильная группа является ненативной по отношению к природной аминокислоте; замена Lys в положении 12 аминокислотой Arg; замена Asp в положении 15 аминокислотой Glu; замена Ser в положении 16 аминокислотой Thr или AIB; замена Gln в положении 20 аминокислотой Ser, Thr, Ala или AIB; замена Asp в положении 21 аминокислотой Glu; замена Gln в положении 24 аминокислотой Ser, Thr, Ala или AIB; замена Met в положении 27 аминокислотой Leu или Nle; замена Asn в положении 28 заряженной аминокислотой; замена Asn в положении 28 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты; замена в положении 28 аминокислотой Asn, Asp или Glu; замена в положении 28 аминокислотой Asp; замена в положении 28 аминокислотой Glu; замена Thr в положении 29 заряженной аминокислотой; замена Thr в положении 29 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты; замена в положении 29 аминокислотой Asp, Glu, или Lys; замена в положении 29 аминокислотой Glu; инсерция 1-3 заряженных аминокислот за положением 29; инсерция Glu или Lys в положении 30 (то есть, за положением 29), необязательно с инсерцией Lys в положении 31; добавление SEQ ID NO: 820 к C-концу, где аминокислотой в положении 29 является, но необязательно, Thr или Gly; замена или добавление аминокислоты, ковалентно связанной с гидрофильной группой; или их комбинации.
Любая из вышеописанных модификаций, относящихся к агонистам глюкагона класса 1, которая приводит к повышению активности по отношению к рецептору глюкагона, сохранению частичной активности по отношению к рецептору глюкагона, повышению растворимости, повышению стабильности или снижению степени разложения, может быть введена в пептиды глюкагона класса 1 либо отдельно, либо в комбинации. Таким образом, могут быть получены родственные глюкагону пептиды класса 1, которые, через 24 часа при 25°С, сохраняют по меньшей мере 20% активности нативного глюкагона по отношению к рецептору глюкагона, являются растворимыми при концентрации по меньшей мере 1 мг/мл при pH 6-8 или 6-9 (например, pH 7), и сохраняют, но необязательно, по меньшей мере 95% активности исходного пептида (например, 5% или менее исходного пептида разлагались или расщеплялись). Альтернативно, могут быть получены пептиды глюкагона класса 1 с высокой активностью, которые, через 24 часа при 25°С, сохраняют по меньшей мере примерно 100%, 125%, 150%, 175%, 200%, 250%, 300%, 350%, 400%, 450%, 500%, 600%, 700%, 800%, 900% активности нативного глюкагона по отношению к рецептору глюкагона, или в 10 раз или более превышают такую активность, и необязательно, являются растворимыми при концентрации по меньшей мере 1 мг/мл при pH 6-8 или 6-9 (например, pH 7), и, необязательно, сохраняют по меньшей мере 95% активности исходного пептида (например, 5% или менее исходного пептида разлагаются или расщепляются). В некоторых вариантах изобретения, описанные здесь пептиды глюкагона класса 1 могут иметь по меньшей мере любую из вышеуказанных уровней активности по отношению к рецептору глюкагона, однако, она составляет не более, чем 10000%, 100000% или 1000000% активности нативного глюкагона по отношению к рецептору глюкагона.
Примеры вариантов родственных глюкагону пептидов класса 1
В соответствии с некоторыми вариантами изобретения, нативный пептид глюкагона SEQ ID NO: 801 модифицируют путем замены нативной аминокислоты в положении 28 и/или 29 отрицательно заряженной аминокислотой (например, аспарагиновой кислотой или глутаминовой кислотой) и, необязательно, добавления отрицательно заряженной аминокислоты (например, аспарагиновой кислоты или глутаминовой кислоты) к карбокси-концу пептида. В альтернативном варианте изобретения, нативный пептид глюкагона SEQ ID NO: 801 модифицируют путем замены нативной аминокислоты в положении 29 положительно заряженной аминокислотой (например, лизином, аргинином или гистидином), и, необязательно, добавления одной или двух положительно заряженных аминокислот (например, лизина, аргинина или гистидина) к карбокси-концу пептида. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к аналогу глюкагона, имеющему повышенную растворимость и стабильность, где указанный аналог содержит аминокислотную последовательность SEQ ID NO: 834, при условии, что по меньшей мере одна аминокислота в положении 28 или 29 заменена кислотной аминокислотой и/или дополнительная аминокислота добавлена к карбокси-концу SEQ ID NO: 834. В некоторых вариантах изобретения, кислотные аминокислоты независимо выбраны из группы, состоящей из Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к агонисту глюкагона, имеющему повышенную растворимость и стабильность, где указанный агонист содержит аминокислотную последовательность SEQ ID NO: 833, где по меньшей мере одна из аминокислот в положениях 27, 28 или 29 заменена ненативным аминокислотным остатком (то есть, по меньшей мере одна аминокислота, присутствующая в положениях 27, 28 или 29 данного аналога, представляет собой аминокислоту, отличающуюся от аминокислоты, присутствующей в соответствующем положении SEQ ID NO: 801). В соответствии с некоторыми своими вариантами, настоящее изобретение относится к агонисту глюкагона, содержащему SEQ ID NO: 833, при условии, что если аминокислотой в положении 28 является аспарагин, а аминокислотой в положении 29 является треонин, то такой пептид также содержит одну или две аминокислоты, независимо выбранные из группы, состоящей из Lys, Arg, His, Asp или Glu, добавленных к карбокси-концу пептида глюкагона.
Сообщалось, что некоторые положения нативного пептида глюкагона могут быть модифицированы, но при этом, они могут сохранять по меньшей мере некоторую активность родительского пептида. В соответствии с этим, авторами настоящего изобретения было высказано предположение, что одна или несколько аминокислот, расположенных в положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29 пептида SEQ ID NO: 811, могут быть заменены аминокислотой, отличающейся от аминокислоты, присутствующей в нативном пептиде глюкагона, но при этом, будет сохраняться повышенная активность, стабильность при физиологическом рН и биологическая активность родительского пептида глюкагона. Так, например, в соответствии с некоторыми вариантами изобретения, в целях предупреждения окислительного разложения пептида, метиониновый остаток, присутствующий в положении 27 нативного пептида, заменяют лейцином или норлейцином.
В некоторых своих вариантах, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 833, где 1-6 аминокислот, выбранных из положений 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 данного аналога, отличаются от соответствующих аминокислот SEQ ID NO: 801. В соответствии с другим своим вариантом, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 833, где 1-3 аминокислоты, выбранные из положений 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 данного аналога, отличаются от соответствующих аминокислот SEQ ID NO: 801. В другом своем варианте, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 807, SEQ ID NO: 808 или SEQ ID NO: 834, где 1 или 2 аминокислоты, выбранные из положений 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 данного аналога, отличаются от соответствующих аминокислот SEQ ID NO: 801, а в другом варианте, эти 1 или 2 отличающиеся аминокислоты представляют собой консервативные аминокислотные замены по сравнению с аминокислотами, присутствующими в нативной последовательности (SEQ ID NO: 801). В некоторых своих вариантах, настоящее изобретение относится к пептиду глюкагона SEQ ID NO: 811 или SEQ ID NO: 813, где указанный пептид глюкагона также содержит одну, две или три аминокислотных замены, выбранные из положений 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27 или 29. В некоторых вариантах изобретения, заменами в положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 27 или 29 являются консервативные аминокислотные замены.
В некоторых своих вариантах, настоящее изобретение относится к агонисту глюкагона, содержащему пептидный аналог SEQ ID NO: 801, где указанный аналог отличается от SEQ ID NO: 801 тем, что он имеет аминокислоту в положении 2, не являющуюся серином, а в положении 28 или 29, он имеет, вместо нативной аминокислоты, кислотную аминокислоту или кислотную аминокислоту, добавленную к карбокси-концу пептида SEQ ID NO: 801. В некоторых вариантах изобретения, кислотной аминокислотой является аспарагиновая кислота или глутаминовая кислота. В некоторых своих вариантах, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 809, SEQ ID NO: 812, SEQ ID NO: 813 или SEQ ID NO: 832, который отличается от родительской молекулы тем, что он имеет замену в положении 2. Более конкретно, аминокислота в положении 2 пептидного аналога заменена аминокислотой, выбранной из группы, состоящей из D-серина, аланина, D-аланина, глицина, N-метилсерина и аминоизомасляной кислоты.
В другом своем варианте, настоящее изобретение относится к агонисту глюкагона, содержащему пептидный аналог SEQ ID NO: 801, где указанный аналог отличается от SEQ ID NO: 801 тем, что он имеет аминокислоту в положении 1, не являющуюся гистидином, а в положении 28 или 29, он имеет, вместо нативной аминокислоты, кислотную аминокислоту или кислотную аминокислоту, добавленную к карбокси-концу пептида SEQ ID NO: 801. В некоторых вариантах изобретения, кислотной аминокислотой является аспарагиновая кислота или глутаминовая кислота. В некоторых своих вариантах, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 809, SEQ ID NO: 812, SEQ ID NO: 813 или SEQ ID NO: 832, который отличается от родительской молекулы тем, что он имеет замену в положении 1. Более конкретно, аминокислота в положении 2 пептидного аналога заменена аминокислотой, выбранной из группы, состоящей из DMIA, D-гистидина, дезаминогистидина, гидрокси-гистидина, ацетил-гистидина и гомогистидина.
В соответствии с некоторыми вариантами изобретения, модифицированный пептид глюкагона содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 809, SEQ ID NO: 812, SEQ ID NO: 813 и SEQ ID NO: 832. В другом своем варианте, настоящее изобретение относится к пептиду глюкагона, содержащему последовательность SEQ ID NO: 809, SEQ ID NO: 812, SEQ ID NO: 813 или SEQ ID NO: 832, которые также включают одну или две аминокислоты, добавленные к С-концу SEQ ID NO: 809, SEQ ID NO: 812, SEQ ID NO: 813 или SEQ ID NO: 832, где дополнительные аминокислоты независимо выбраны из группы, состоящей из Lys, Arg, His, Asp Glu, цистеиновой кислоты или гомоцистеиновой кислоты. В некоторых вариантах изобретения, дополнительные аминокислоты, добавленные к карбокси-концу, выбраны из группы, состоящей из Lys, Arg, His, Asp или Glu, или в другом варианте изобретения, дополнительными аминокислотами являются Asp или Glu.
В другом варианте изобретения, пептид глюкагона содержит последовательность SEQ ID NO: 7 или ее аналог агониста глюкагона. В некоторых вариантах изобретения, указанный пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 808, SEQ ID NO: 810, SEQ ID NO: 811, SEQ ID NO: 812 и SEQ ID NO: 813. В другом варианте изобретения, указанный пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 808, SEQ ID NO: 810 и SEQ ID NO: 811. В некоторых вариантах изобретения, указанный пептид глюкагона содержит последовательности SEQ ID NO: 808, SEQ ID NO: 810 и SEQ ID NO: 811, а также дополнительную аминокислоту, выбранную из группы, состоящей из Asp и Glu, добавленных к С-концу пептида глюкагона. В некоторых вариантах изобретения, пептид глюкагона содержит последовательность SEQ ID NO: 811 или SEQ ID NO: 813, а в другом варианте изобретения, пептид глюкагона содержит последовательность SEQ ID NO: 811.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к агонисту глюкагона, содержащему модифицированный пептид глюкагона, выбранный из группы, состоящей из:
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Xaa-Xaa-Xaa-R (SEQ ID NO: 834),
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asp-Thr-R (SEQ ID NO: 811) и
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Xaa-Tyr-Leu-Glu-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asp-Thr-R (SEQ ID NO: 813),
где Xaa в положении 15 представляет собой Asp, Glu, цистеиновую кислоту, гомоглутаминовую кислоту или гомоцистеиновую кислоту, Xaa в положении 28 представляет собой Asn или кислотную аминокислоту, Xaa в положении 29 представляет собой Thr или кислотную аминокислоту, а R представляет собой кислотную аминокислоту, COOH или CONH2, при условии, что остаток кислотной аминокислоты присутствует в одном из положений 28, 29 или 30. В некоторых вариантах изобретения, R представляет собой COOH, а в другом варианте изобретения, R представляет собой CONH2.
Настоящее изобретение также охватывает гибридные пептиды глюкагона, где второй пептид был присоединен к С-концу пептида глюкагона в целях повышения стабильности и растворимости пептида глюкагона. Более конкретно, гибридный пептид глюкагона может включать аналог агониста глюкагона, содержащий пептид глюкагона NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Xaa-Xaa-Xaa-R (SEQ ID NO: 834), где R представляет собой кислотную аминокислоту или связь и аминокислотную последовательность SEQ ID NO: 820 (GPSSGAPPPS), SEQ ID NO: 821 (KRNRNNIA) или SEQ ID NO: 822 (KRNR), связанные с карбокси-концевой аминокислотой пептида глюкагона. В некоторых вариантах изобретения, пептид глюкагона выбран из группы, состоящей из последовательностей SEQ ID NO: 833, SEQ ID NO: 807 или SEQ ID NO: 808, также содержащих аминокислотную последовательность SEQ ID NO: 820 (GPSSGAPPPS), SEQ ID NO: 821 (KRNRNNIA) или SEQ ID NO: 822 (KRNR), связанные с карбокси-концевой аминокислотой пептида глюкагона. В некоторых вариантах изобретения, гибридный пептид глюкагона содержит последовательности SEQ ID NO: 802, SEQ ID NO: 803, SEQ ID NO: 804, SEQ ID NO: 805 и SEQ ID NO: 806 или их аналог агониста глюкагона, а также аминокислотную последовательность SEQ ID NO: 820 (GPSSGAPPPS), SEQ ID NO: 821 (KRNRNNIA) или SEQ ID NO: 822 (KRNR), связанные с аминокислотой в положении 29 пептида глюкагона. В соответствии с некоторыми вариантами изобретения, гибридный пептид также содержит ПЭГ-цепь, связанную с аминокислотой в положении 16, 17, 21, 24, 29, в области C-концевого удлинения или у C-концевой аминокислоты, где указанная ПЭГ-цепь имеет размер 500-40000 дальтон. В некоторых вариантах изобретения, аминокислотная последовательность SEQ ID NO: 820 (GPSSGAPPPS), SEQ ID NO: 821 (KRNRNNIA) или SEQ ID NO: 822 (KRNR) связана с аминокислотой в положении 29 пептида глюкагона посредством пептидной связи. В некоторых вариантах изобретения, часть пептида глюкагона, входящая в состав гибридного пептида глюкагона, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 810, SEQ ID NO: 811 и SEQ ID NO: 813. В некоторых вариантах изобретения, часть пептида глюкагона, входящая в состав гибридного пептида глюкагона, содержит последовательность SEQ ID NO: 811 или SEQ ID NO: 813, где ПЭГ-цепь присоединена в положении 21, 24, 29, в области C-концевого удлинения или у С-концевой аминокислоты, соответственно.
В другом варианте изобретения, последовательность пептида глюкагона, входящая в состав гибридного пептида, содержит последовательность SEQ ID NO: 811, а также аминокислотную последовательность SEQ ID NO: 820 (GPSSGAPPPS), SEQ ID NO: 821 (KRNRNNIA) или SEQ ID NO: 822 (KRNR), связанные с аминокислотой в положении 29 пептида глюкагона. В некоторых вариантах изобретения, гибридный пептид глюкагона содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 824, SEQ ID NO: 825 и SEQ ID NO: 826. Обычно, гибридные пептиды согласно изобретению имеют С-концевую аминокислоту со стандартной карбоксильной группой. Однако, в качестве вариантов настоящего изобретения также рассматриваются аналоги этих последовательностей, в которых С-концевая аминокислота, вместо карбоксильной группы, содержит амид. В соответствии с некоторыми вариантами изобретения, гибридный пептид глюкагона содержит аналог агониста глюкагона, выбранный из группы, состоящей из SEQ ID NO: 810, SEQ ID NO: 811 и SEQ ID NO: 813, а также включающий аминокислотную последовательность SEQ ID NO: 823 (GPSSGAPPPS-CONH2), связанную с аминокислотой в положении 29 пептида глюкагона.
Агонисты глюкагона согласно изобретению могут быть также модифицированы для повышения растворимости и стабильности пептида в водных растворах и сохранения биологической активности пептида глюкагона. В некоторых вариантах изобретения было высказано предположение, что введение гидрофильных групп в одном или нескольких положениях, выбранных из положений 16, 17, 20, 21, 24 и 29 пептида SEQ ID NO: 811, или его аналога агониста глюкагона, будет приводить к повышению растворимости и стабильности аналога глюкагона при соответствующем рН. Более конкретно, в некоторых вариантах изобретения, пептид глюкагона SEQ ID NO: 810, SEQ ID NO: 811, SEQ ID NO: 813 или SEQ ID NO: 832 был модифицирован так, чтобы он содержал одну или несколько гидрофильных групп, ковалентно связанных с боковыми цепями аминокислот, присутствующих в положениях 21 и 24 пептида глюкагона.
В соответствии с некоторыми вариантами изобретения, пептид глюкагона SEQ ID NO: 811 был модифицирован так, чтобы он содержал одну или несколько аминокислотных замен в положениях 16, 17, 20, 21, 24 и/или 29, где нативная аминокислота была заменена аминокислотой, имеющей боковую цепь, подходящую для перекрестного связывания с гидрофильными группами, включая, например, ПЭГ. Нативный пептид может быть заменен природной аминокислотой или синтетической (неприродной) аминокислотой. Синтетические или неприродные аминокислоты представляют собой аминокислоты, которые не встречаются в природе in vivo, но которые, тем не менее, могут быть включены в описанные здесь пептидные структуры.
В некоторых своих вариантах, настоящее изобретение относится к агонисту глюкагона SEQ ID NO: 810, SEQ ID NO: 811 или SEQ ID NO: 813, где последовательность нативного пептида глюкагона была модифицирована так, чтобы она содержала природную или синтетическую аминокислоту по меньшей мере в одном из положений 16, 17, 21, 24, 29, в области С-концевого удлинения или в положении С-концевой аминокислоты нативной последовательности, где аминокислотная замена также содержит гидрофильную группу. В некоторых вариантах изобретения, замена присутствует в положении 21 или 24, а в другом варианте изобретения, гидрофильной группой является ПЭГ-цепь. В некоторых вариантах изобретения, пептид глюкагона SEQ ID NO: 811 заменен по меньшей мере одним цистеиновым остатком, где боковая цепь цистеинового остатка также модифицирована реагентом, взаимодействующим с тиолом, включая, например, малеимидо, винилсульфон, 2-пиридилтио, галогеналкил и галогенацил. Эти реагирующие с тиолом реагенты могут содержать карбокси-, кето-, гидроксильную и эфирную группы, а также другие гидрофильные группы, такое как полиэтиленгликолевые звенья. В альтернативном варианте изобретения, нативный пептид глюкагона заменен лизином, а боковая цепь замещающего лизинового остатка также модифицирована с использованием реагирующих с амином реагентов, таких как активные сложные эфиры (сукцинимидо, ангидрид и т.п.) карбоновых кислот или альдегиды гидрофильных групп, таких как полиэтиленгликоль. В некоторых вариантах изобретения, пептид глюкагона выбран из группы, состоящей из SEQ ID NO: 814, SEQ ID NO: 815, SEQ ID NO: 816, SEQ ID NO: 817, SEQ ID NO: 818 и SEQ ID NO: 819.
В соответствии с некоторыми вариантами изобретения, ПЭГилированный пептид глюкагона содержит две или более полиэтиленгликолевых цепи, ковалентно связанных с пептидом глюкагона, где общая молекулярная масса глюкагоновых цепей составляет примерно 1000-5000 дальтон. В некоторых вариантах изобретения, ПЭГилированный агонист глюкагона содержит пептид SEQ ID NO: 806, где ПЭГ-цепь ковалентно связана с аминокислотным остатком в положении 21 и в положении 24, и где общая молекулярная масса двух ПЭГ-цепей составляет примерно 1000-5000 дальтон. В другом варианте изобретения, ПЭГилированный агонист глюкагона содержит пептид SEQ ID NO: 806, где ПЭГ-цепь ковалентно связана с аминокислотным остатком в положении 21 и в положении 24, и где общая молекулярная масса двух ПЭГ-цепей составляет примерно 5000-20000 дальтон.
Полиэтиленгликолевая цепь может быть прямой или разветвленной. В соответствии с некоторыми вариантами изобретения, полиэтиленгликолевая цепь имеет среднюю молекулярную массу примерно 500-40000 дальтон. В некоторых вариантах изобретения, полиэтиленгликолевая цепь имеет молекулярную массу примерно 500-5000 дальтон. В другом варианте изобретения, полиэтиленгликолевая цепь имеет молекулярную массу примерно 20000-40000 дальтон.
Любой из описанных выше пептидов глюкагона может быть дополнительно модифицирован так, чтобы он включал ковалентный или нековалентный внутримолекулярный мостик или аминокислоту, стабилизирующую альфа-спираль, в С-концевой части пептида глюкагона (в положении аминокислот 12-29). В соответствии с некоторыми вариантами изобретения, пептид глюкагона содержит любую одну или несколько из обсуждаемых выше модификаций, а также аминокислотную замену в положениях 16, 20, 21 или 24 (или их комбинации), то есть, замену α,α-дизамещенной аминокислотой, например AIB. В соответствии с другим вариантом изобретения, пептид глюкагона содержит любую одну или несколько из обсуждаемых выше модификаций, а также внутримолекулярный мостик, например, лактам, присутствующий между боковыми цепями аминокислот в положениях 16 и 20 пептида глюкагона.
В соответствии с некоторыми вариантами изобретения, пептид глюкагона содержит аминокислотную последовательность SEQ ID NO: 877, где Xaa в положении 3 представляет собой аминокислоту, содержащую боковую цепь структуры I, II или III:
где:
R1 представляет собой C0-3алкил или C0-3гетероалкил; R2 представляет собой NHR4 или C1-3алкил; R3 представляет собой C1-3алкил; R4 представляет собой H или C1-3алкил; X представляет собой NH, O или S; а Y представляет собой NHR4, SR3 или OR3. В некоторых вариантах изобретения, X представляет собой NH или Y представляет собой NHR4. В некоторых вариантах изобретения, R1 представляет собой C0-2алкил или C1гетероалкил. В некоторых вариантах изобретения, R2 представляет собой NHR4 или C1алкил. В некоторых вариантах изобретения, R4 представляет собой H или C1алкил. В своих репрезентативных вариантах, настоящее изобретение относится к аминокислоте, содержащей боковую цепь структуры I, где R1 представляет собой CH2S, X представляет собой NH, а R2 представляет собой CH3 (ацетамидометилцистеин, C(Acm)); R1 представляет собой CH2, X представляет собой NH, а R2 представляет собой CH3 (ацетилдиаминобутановую кислоту, Dab(Ac)); R1 представляет собой C0алкил, X представляет собой NH, R2 представляет собой NHR4, а R4 представляет собой H (карбамоилдиаминопропановую кислоту, Dap(мочевину); или R1 представляет собой CH2CH2, X представляет собой NH, а R2 представляет собой CH3 (ацетилорнитин, Orn(Ac)). В своих репрезентативных вариантах, настоящее изобретение относится к аминокислоте, содержащей боковую цепь структуры II, где R1 представляет собой CH2, Y представляет собой NHR4, а R4 представляет собой CH3 (метилглутамин, Q(Me)). В своих репрезентативных вариантах, настоящее изобретение относится к аминокислоте, содержащей боковую цепь структуры III, где R1 представляет собой CH2, а R4 представляет собой H (сульфоксид метионина, M(O)). В конкретных вариантах изобретения, аминокислота в положении 3 заменена Dab(Ac). Так, например, агонисты глюкагона могут содержать аминокислотную последовательность SEQ ID NO: 863, SEQ ID NO: 869, SEQ ID NO: 871, SEQ ID NO: 872, SEQ ID NO: 873 и SEQ ID NO: 874.
В некоторых вариантах изобретения, пептидом глюкагона является аналог пептида глюкагона SEQ ID NO: 877. В конкретных аспектах изобретения, описанный здесь аналог содержит любую из аминокислотных модификаций, включая, но не ограничиваясь ими, замену Asn в положении 28 заряженной аминокислотой; замену Asn в положении 28 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты; замену в положении 28 аминокислотами Asn, Asp, или Glu; замену в положении 28 аминокислотой Asp; замену в положении 28 аминокислотой Glu; замену Thr в положении 29 заряженной аминокислотой; замену Thr в положении 29 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты; замену в положении 29 аминокислотами Asp, Glu или Lys; замену в положении 29 аминокислотой Glu; инсерцию 1-3 заряженных аминокислот за положением 29; инсерцию Glu или Lys за положением 29; инсерцию Gly-Lys или Lys-Lys за положением 29; и их комбинации.
В некоторых вариантах изобретения, аналог пептида глюкагона SEQ ID NO: 877 содержит α,α-дизамещенную аминокислоту, такую как AIB, в одном, двух, трех или во всех положениях 16, 20, 21 и 24.
В некоторых вариантах изобретения, аналог пептида глюкагона SEQ ID NO: 877 содержит одну или несколько из нижеследующих модификаций: замену His в положении 1 ненативной аминокислотой, которая снижает восприимчивость пептида глюкагона к расщеплению дипептидил-пептидазой IV (DPP-IV), замену Ser в положении 2 ненативной аминокислотой, которая снижает восприимчивость пептида глюкагона к расщеплению дипептидил-пептидазой IV (DPP-IV), замену Thr в положении 7 аминокислотой, не содержащей гидроксильной группы, например, Abu или Ile; замену Tyr в положении 10 аминокислотой Phe или Val; замену Lys в положении 12 аминокислотой Arg; замену Asp в положении 15 аминокислотой Glu, замену Ser в положении 16 аминокислотами Thr или AIB; замену Gln в положении 20 аминокислотами Ala или AIB; замену Asp в положении 21 аминокислотой Glu; замену Gln в положении 24 аминокислотами Ala или AIB; замену Met в положении 27 аминокислотами Leu или Nle; делецию аминокислот в положениях 27-29; делецию аминокислот в положениях 28-29; делецию аминокислоты в положении 29; добавление аминокислотной последовательности SEQ ID NO: 820 к C-концу, где аминокислотой в положении 29 является Thr или Gly, или их комбинацию.
В соответствии с конкретными вариантами изобретения, пептид глюкагона содержит любую из аминокислотных последовательностей SEQ ID NN: 862-867 и 869-874.
В некоторых вариантах изобретения, аналог пептида глюкагона, включающий SEQ ID NO: 877, содержит гидрофильную группу, например ПЭГ, ковалентно связанную с аминокислотой в любом из положений 16, 17, 20, 21, 24 и 29 или в положении C-концевой аминокислоты.
В некоторых вариантах изобретения, аналог пептида глюкагона, включающий SEQ ID NO: 877, содержит аминокислоту, имеющую боковую цепь, ковалентно связанную, но необязательно, посредством спейсера, с ацильной группой или алкильной группой, где указанная ацильная группа или алкильная группа является ненативной для данной природной аминокислоты. В некоторых вариантах изобретения, ацильной группой является ацильная группа жирной C4-C30-кислоты. В других вариантах изобретения, алкильной группой является C4-C30-алкил. В конкретных аспектах изобретения, ацильная группа или алкильная группа ковалентно связана с боковой цепью аминокислоты в положении 10. В некоторых вариантах изобретения, аминокислотой в положении 7 является Ile или Abu.
Агонист глюкагона может представлять собой пептид, содержащий аминокислотную последовательность любой из SEQ ID NN: 801-919, имеющую, но необязательно, 1, 2, 3, 4 или 5 дополнительных модификаций, которые обеспечивают сохранение активности агониста глюкагона. В некоторых вариантах изобретения, агонист глюкагона содержит аминокислоты любой из SEQ ID NN: 859-919.
Родственные глюкагону пептиды класса 2
В некоторых вариантах изобретения, родственным глюкагону пептидом является родственный глюкагону пептид класса 2, описанный в настоящей заявке и в Международной патентной заявке No. PCT US2009/47447 (поданной 16 июня, 2009), в предварительной заявке на патент США No. 61/090448 и в заявке на патент США No. 61/151349, содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Биологические последовательности, описанные в следующем разделе (SEQ ID NN: 1001-1262), относящемся к родственным глюкагону пептидам класса 2, соответствуют последовательностям SEQ ID NN: 1-262, представленным в Международной патентной заявке No. PCT US2009/47447.
Активность
Нативный глюкагон не активирует рецептор GIP, и обычно, его активность составляет примерно 1% от активности нативного GLP-1 по отношению к рецептору GLP-1. Модификации, введенные в описанную здесь последовательность нативного глюкагона, приводят к продуцированию родственных глюкагону пептидов класса 2, которые могут обладать сильной глюкагоновой активностью, эквивалентной активности нативного глюкагона (SEQ ID NO: 1001), или более высокой активностью; сильной GIP-активностью, эквивалентной активности нативного GIP (SEQ ID NO: 1004), или более высокой активностью, и/или сильной GLP-1-активностью, эквивалентной активности нативного GLP-1 или более высокой активностью. В соответствии с этим, родственным глюкагону пептидом класса 2 может быть один из таких пептидов, как двойной агонист глюкагона/GIP, тройной агонист глюкагона/GIP/GLP-1, двойной агонист GIP/GLP-1 или пептид глюкагона-агониста GIP, также описанные в настоящей заявке.
В некоторых вариантах изобретения, EC50 описанных здесь родственных глюкагону пептидов класса 2 в отношении активации рецептора GIP составляет примерно 100 нМ или менее, или примерно 75, 50, 25, 10, 8, 6, 5, 4, 3, 2 или 1 нМ или менее. В некоторых вариантах изобретения, EC50 описанных здесь родственных глюкагону пептидов класса 2 в отношении активации рецептора глюкагона составляет примерно 100 нМ или менее, или примерно 75, 50, 25, 10, 8, 6, 5, 4, 3, 2 или 1 нМ или менее. В некоторых вариантах изобретения, EC50 описанных здесь родственных глюкагону пептидов класса 2 в отношении активации рецептора GLP-1 составляет примерно 100 нМ или менее, или примерно 75, 50, 25, 10, 8, 6, 5, 4, 3, 2 или 1 нМ или менее. Активация рецептора может быть измерена с помощью анализов in vitro путем оценки уровня индуцирования cAMP в клетках HEK293, сверхэкспрессирующих данный рецептор, например, с помощью анализа клеток HEK293, ко-трансфецированных ДНК, кодирующей этот рецептор, и геном люциферазы, сцепленным с cAMP-отвечающим элементом, как описано в примере 5.
В некоторых вариантах изобретения, родственные глюкагону пептиды класса 2 имеют активность, которая по меньшей мере примерно на 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175% или 200% или более превышает активность нативного GIP (GIP-активность) по отношению к рецептору GIP. В некоторых вариантах изобретения, описанные здесь пептиды глюкагона обладают активностью по отношению к рецептору GIP, которая составляет не более, чем 1000%, 10000%, 100000% или 1000000% от активности нативного GIP. В некоторых вариантах изобретения, родственные глюкагону пептиды класса 2 имеют активность, которая по меньшей мере примерно на 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175%, 200%, 250%, 300%, 350%, 400%, 450% или 500% или более превышает активность нативного глюкагона (глюкагоновая активность) по отношению к рецептору глюкагона. В некоторых вариантах изобретения, описанные здесь пептиды глюкагона обладают активностью по отношению к рецептору глюкагона, которая составляет не более, чем 1000%, 10000%, 100000% или 1000000% активности нативного глюкагона. В некоторых вариантах изобретения, родственные глюкагону пептиды класса 2 имеют активность, которая по меньшей мере примерно на 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175% или 200% или более превышает активность нативного GLP-1 (GLP-1 -активность) по отношению к рецептору GLP-1. В некоторых вариантах изобретения, описанные здесь пептиды глюкагона обладают активностью по отношению к рецептору GLP-1, которая составляет не более, чем 1000%, 10000%, 100000% или 1000000% активности нативного GLP-1. Активность родственного глюкагону пептида класса 2 по отношению к рецептору по сравнению с нативным лигандом рецептора вычисляют как обратное отношение EC50 для родственного глюкагону пептида класса 2 к ЕС50 нативного лиганда.
В некоторых вариантах изобретения, родственные глюкагону пептиды класса 2 обладают активностью по отношению к рецептору глюкагона и к рецептору GIP («двойные агонисты глюкагона/GIP»). Эти родственные глюкагону пептиды класса 2, в отличие от нативного глюкагона, обладают специфичностью к рецептору глюкагона и к рецептору GIP. В некоторых вариантах изобретения, EC50 родственного глюкагону пептида класса 2 по отношению к рецептору GIP примерно менее, чем в 50 раз, 40 раз, 30 раз или в 20 раз отличается (является выше или ниже) от EC50 по отношению к рецептору глюкагона. В некоторых вариантах изобретения, GIP-активность родственного глюкагону пептида класса 2 примерно менее, чем в 500, 450, 400, 350, 300, 250, 200, 150, 100, 75, 50, 25, 20, 15, 10 или 5 раз отличается (является выше или ниже) от его глюкагоновой активности. В некоторых вариантах изобретения, отношение, равное концентрации EC50 родственного глюкагону пептида класса 2 по отношению к рецептору GIP, деленное на концентрацию EC50 родственного глюкагону пептида класса 2 по отношению к рецептору глюкагона, составляет менее, чем примерно 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах изобретения, отношение, равное концентрации EC50 по отношению к рецептору GIP, деленной на концентрацию EC50 по отношению к рецептору глюкагона, составляет примерно 1 или примерно менее, чем 1 (например, примерно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах изобретения, отношение GIP-активности родственного глюкагону пептида класса 2 к глюкагоновой активности родственного глюкагону пептида класса 2, составляет примерно менее, чем 500, 450, 400, 350, 300, 250, 200, 150, 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах изобретения, отношение активности по отношению к рецептору GIP, деленной на активность по отношению к рецептору глюкагона, составляет примерно 1 или примерно менее, чем 1 (например, примерно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах изобретения, GLP-1-активность в значительной степени снижается или ингибируется, например, посредством аминокислотной модификации в положении 7, то есть, делеции аминокислоты (аминокислот) со стороны С-конца по отношению к аминокислоте в положении 27 или 28 с образованием пептида, состоящего из 27 или 28 аминокислот, или их комбинации.
В другом аспекте изобретения, родственные глюкагону пептиды класса 2 обладают активностью по отношению к рецептору глюкагона, GIP и GLP-1 («тройные агонисты глюкагона/GIP/GLP-1»). Эти родственные глюкагону пептиды класса 2, в отличие от нативных глюкагонов обладают специфичностью к рецептору глюкагона, а также к рецептору GIP и к рецептору GLP-1. В некоторых вариантах изобретения, EC50 родственного глюкагону пептида класса 2 по отношению к рецептору GIP примерно менее, чем в 50 раз, в 40 раз, в 30 раз или в 20 раз отличается (является выше или ниже) от EC50 по отношению к рецептору глюкагона и GLP-1. В некоторых вариантах изобретения, GIP-активность родственного глюкагону пептида класса 2 примерно менее, чем в 500, 450, 400, 350, 300, 250, 200, 150, 100, 75, 50, 25, 20, 15, 10 или 5 раз отличается (является выше или ниже) от его глюкагоновой активности и GLP-1-активности. В некоторых вариантах изобретения, отношение, равное концентрации EC50 тройного агониста по отношению к рецептору GIP, деленной на концентрацию EC50 тройного агониста по отношению к рецептору GLP-1, составляет менее, чем примерно 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах настоящего изобретения, отношение, равное концентрации EC50 по отношению к рецептору GIP, деленной на концентрацию EC50 по отношению к рецептору GLP-1, составляет примерно 1 или примерно менее, чем 1 (например, примерно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах изобретения, отношение GIP-активности тройного агониста по сравнению с GLP-1-активностью тройного агониста, составляет примерно менее, чем 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах изобретения, отношение активности по отношению к рецептору GIP, деленной на активность по отношению к рецептору глюкагона, составляет примерно 1 или примерно менее, чем 1 (например, примерно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В родственных вариантах изобретения, отношение, равное концентрации EC50 тройного агониста по отношению к рецептору GIP, деленной на концентрацию EC50 тройного агониста по отношению к рецептору глюкагона, составляет примерно менее, чем 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах изобретения, отношение, равное концентрации EC50 по отношению к рецептору GIP, деленной на концентрацию EC50 по отношению к рецептору глюкагона, составляет примерно 1 или примерно менее, чем 1 (например, примерно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах изобретения, отношение GIP-активности тройного агониста к глюкагоновой активности тройного агониста составляет примерно менее, чем 500, 450, 400, 350, 300, 250, 200, 150, 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах изобретения, отношение активности к рецептору GIP, деленной на активность к рецептору глюкагона, составляет примерно 1 или примерно менее, чем 1 (например, примерно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах изобретения, отношение, равное концентрации EC50 тройного агониста по отношению к рецептору GLP-1, деленной на концентрацию EC50 тройного агониста по отношению к рецептору глюкагона, составляет примерно менее, чем 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах настоящего изобретения, указанное отношение концентрации EC50 по отношению к рецептору GLP-1, деленное на концентрацию EC50 по отношению к рецептору глюкагона, составляет примерно 1 или примерно менее, чем 1 (например, примерно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах настоящего изобретения, отношение GLP-1-активности тройного агониста к глюкагоновой активности тройного агониста составляет примерно менее, чем 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах изобретения, отношение, равное активности к рецептору GLP-1, деленной на активность к рецептору глюкагона, составляет примерно 1 или примерно менее, чем 1 (например, примерно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2).
В другом аспекте изобретения, родственные глюкагону пептиды класса 2 обладают активностью по отношению к рецепторам GLP-1 и GIP («двойные агонисты GIP/GLP-1»), но их глюкагоновая активность была в значительной степени снижена или ингибирована например, посредством аминокислотной модификации в положении 3. Так, например, замена в этом положении кислотной, основной или гидрофобной аминокислотой (глутаминовой кислотой, орнитином, норлейцином) приводит к снижению глюкагоновой активности. В некоторых вариантах изобретения, EC50 пептида глюкагона по отношению к рецептору GIP по меньшей мере в 50 раз, 40 раз, 30 раз или 20 раз отличается (является выше или ниже) от EC50 по отношению к рецептору GLP-1. В некоторых вариантах изобретения, GIP-активность родственного глюкагону пептида класса 2 примерно менее, чем в 25, 20, 15, 10 или 5 раз отличается (является выше или ниже) его GLP-1-активности. В некоторых вариантах изобретения, эти родственные глюкагону пептиды класса 2 обладают активностью, которая составляет примерно 10% или менее от активности нативного глюкагона по отношению к рецептору глюкагона, например, примерно 1-10% активностью, или примерно 0,1-10% активностью, или более, чем примерно 0,1% активностью, но менее, чем примерно 10% активностью. В некоторых вариантах изобретения, отношение, равное концентрации EC50 родственного глюкагону пептида класса 2 по отношению к рецептору GIP, деленной на концентрацию EC50 родственного глюкагону пептида класса 2 по отношению к рецептору GLP-1, составляет примерно менее, чем 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5, но не менее, чем 1. В некоторых вариантах изобретения, отношение GIP-активности родственного глюкагону пептида класса 2 к GLP-1-активности родственного глюкагону пептида класса 2 составляет примерно менее, чем 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5, но не менее, чем 1.
В другом аспекте изобретения, родственные глюкагону пептиды класса 2 обладают активностью по отношению к рецептору GIP, но при этом, глюкагоновая активность и GLP-1-активность были значительно снижены или ингибированы («пептиды глюкагона-агониста GIP»), например, посредством аминокислотных модификаций путем замены аминокислоты в положении 3 аминокислотой Glu и аминокислотой в положении 7 аминокислотой Ile. В некоторых вариантах изобретения, эти родственные глюкагону пептиды класса 2 обладают активностью, которая составляет 10% или менее от активности нативного глюкагона по отношению к рецептору глюкагона, например, 1-10%, или примерно 0,1-10%, или примерно более 0,1%, 0,5%, или 1%, но примерно менее, чем 1%, 5%, или 10%. В некоторых вариантах изобретения, эти родственные глюкагону пептиды класса 2 также обладают активностью, которая составляет примерно 10% или менее от активности нативного GLP-1 по отношению к рецептору GLP-1, например, примерно 1-10% или примерно 0,1-10%, или примерно более, чем 0,1%, 0,5%, или 1%, но примерно менее, чем 1%, 5% или 10%.
В некоторых вариантах изобретения, если родственный глюкагону пептид не является ПЭГилированным, то EC50 родственного глюкагону пептида класса 2 в отношении активации рецептора GIP составляет примерно 4, 2, 1 нМ или менее, либо его аналог обладает активностью, которая составляет по меньшей мере примерно 1%, 2%, 3%, 4% или 5% от активности нативного GIP по отношению к рецептору GIP. В родственных вариантах изобретения, EC50 неПЭГилированного родственного глюкагону пептида класса 2 в отношении активации рецептора GLP-1 составляет примерно 4, 2, 1 нМ или менее, либо составляет по меньшей мере примерно 1%, 2%, 3%, 4% или 5% от активности нативного GLP-1 по отношению к рецептору GLP-1. В других родственных вариантах изобретения, EC50 неПЭГилированного родственного глюкагону пептида класса 2 в отношении активации рецептора глюкагона составляет примерно 4, 2, 1 нМ или менее, либо она составляет по меньшей мере примерно 5%, 10%, 15% или 20% от активности нативного глюкагона по отношению к рецептору глюкагона. В некоторых вариантах изобретения, неПЭГилированный родственный глюкагону пептид класса 2 обладает активностью, которая составляет примерно менее, чем 1% от активности нативного глюкагона по отношению к рецептору глюкагона. В других вариантах изобретения, неПЭГилированный родственный глюкагону пептид класса 2 обладает активностью, которая составляет примерно менее, чем 10%, 5% или 1% от активности нативного GLP-1 по отношению к рецептору GLP-1.
В тех вариантах изобретения, в которых родственные глюкагону пептиды класса 2 связаны с гидрофильными группами, такими как ПЭГ, относительные EC50 для одного или более рецепторов могут быть выше, например, в 10 раз. Так, например, EC50 ПЭГилированного аналога в отношении активации рецептора GIP составляет примерно 10 нМ или менее, либо родственный глюкагону пептид класса 2 обладает активностью, которая составляет по меньшей мере примерно 0,1%, 0,2%, 0,3%, 0,4% или 0,5% от активности нативного GIP по отношению к рецептору GIP. В родственных вариантах изобретения, EC50 ПЭГилированного родственного глюкагону пептида класса 2 в отношении активации рецептора GLP-1 составляет примерно 10 нМ или менее, либо он составляет по меньшей мере примерно 0,1%, 0,2%, 0,3%, 0,4% или 0,5% от активности нативного GLP-1 по отношению к рецептору GLP-1. В других родственных вариантах изобретения, EC50 ПЭГилированного родственного глюкагону пептида класса 2 в отношении активации рецептора глюкагона составляет примерно 10 нМ или менее, либо по меньшей мере примерно 0,5%, 1%, 1,5% или 2% от активности нативного глюкагона по отношению к рецептору глюкагона. В некоторых вариантах изобретения, родственный глюкагону пептид класса 2 обладает активностью, которая составляет примерно менее, чем 1% от активности нативного глюкагона по отношению к рецептору глюкагона. В других вариантах изобретения, родственный глюкагону пептид класса 2 обладает активностью, которая составляет примерно менее, чем 10%, 5% или 1% от активности нативного GLP-1 по отношению к рецептору GLP-1.
Модификации
Модификации, описанные здесь для родственного глюкагону пептида класса 2, позволяют осуществлять манипуляции с глюкагоном (SEQ ID NO: 1001) в целях создания пептидов глюкагона, обладающих повышенной GIP-активностью, глюкагоновой активностью и/или GLP-1-активностью. Другие описанные здесь модификации родственного глюкагону пептида класса 2 позволяют продлить время полужизни, улучшают растворимость или повышают стабильность полученного пептида. Другие описанные здесь модификации родственного глюкагону пептида класса 2 не влияют на активность, либо эти модификации могут быть внесены так, чтобы они не подавляли нужную(ые) активность(и). Любые комбинации описанных родственных глюкагону пептидов класса 2, используемые в тех же самых целях (например, для повышения GIP-активности), могут быть введены отдельно или в комбинации. Любая одна из комбинаций или серия комбинаций родственного глюкагону пептида класса 2, которые приводят к улучшению свойств, могут быть введены отдельно или в комбинации, например, повышение GIP- и/или GLP-1-активности может быть объединено с увеличением времени полужизни. В родственных вариантах изобретения, 1, 2, 3, 4, 5, 6 или более аминокислотных модификаций могут представлять собой неконсервативные замены, добавления или делеции. В некоторых вариантах изобретения, 1, 2, 3, 4, 5, 6 или более аминокислотных модификаций могут представлять собой консервативные замены.
Модификации, которые влияют на GIP-активность
Повышение активности по отношению к рецептору GIP достигается посредством аминокислотной модификации в положении 1. Так, например, His в положении 1 заменен крупной ароматической аминокислотой, необязательно, Tyr, Phe, Trp, амино-Phe, нитро-Phe, хлор-Phe, сульфо-Phe, 4-пиридил-Ala, метил-Tyr или 3-амино-Tyr. Комбинация Tyr в положении 1 со стабилизацией альфа-спирали в области, соответствующей аминокислотам 12-29, сообщает родственному глюкагону пептиду класса 2 способность активировать рецептор GIP, а также рецептор GLP-1 и рецептор глюкагона. Альфа-спиральная структура может быть стабилизирована, например, посредством образования ковалентного или нековалентного внутримолекулярного мостика, или замены аминокислот, находящихся приблизительно в положениях 12-29, аминокислотой, стабилизирующей альфа-спираль (например, α,α-дизамещенной аминокислотой), и/или инсерции таких аминокислот.
Повышенная активность по отношению к рецептору GIP также достигается посредством аминокислотных модификаций в положениях 27 и/или 28, и, необязательно в положении 29. Так, например, Met в положении 27 заменяют крупной алифатической аминокислотой, необязательно, Leu; Asn в положении 28 заменяют небольшой алифатической аминокислотой, необязательно, Ala, а Thr в положении 29 заменяют небольшой алифатической аминокислотой, необязательно, Gly. Замена LAG в положениях 27-29 приводит к повышению GIP-активности по сравнению с активностью нативной последовательности MNT в этих положениях.
Повышение активности по отношению к рецептору GIP также достигается посредством аминокислотной модификации в положении 12. Так, например, аминокислоту в положении 12 заменяют крупной алифатической неполярной аминокислотой, необязательно, Ile.
Повышенная активность по отношению к рецептору GIP также достигается посредством аминокислотной модификации в положениях 17 и/или 18. Так, например, аминокислоту в положении 17 заменяют полярным остатком, необязательно, Gln, а аминокислоту в положении 18 заменяют небольшой алифатической аминокислотой, необязательно, Ala. Замена QA в положениях 17 и 18 приводит к повышению GIP-активности по сравнению с активностью нативной последовательности RR в этих положениях.
Повышение активности по отношению к рецептору GIP достигается посредством модификаций, которые приводят к образованию внутримолекулярного мостика между боковыми цепями аминокислоты в положениях 12-29. Так, например, внутримолекулярный мостик может образовываться посредством ковалентной связи между боковыми цепями двух аминокислот в положениях i и i+4 или между положениями j и j+3, или между положениями k и k+7. В репрезентативных вариантах изобретения, указанный мостик расположен между положениями 12 и 16, 16 и 20, 20 и 24, 24 и 28, или 17 и 20. В других вариантах изобретения, нековалентные связи, такие как солевые мостики, могут образовываться между положительно и отрицательно заряженными аминокислотами в этих положениях.
Любая из вышеописанных модификаций, которая приводит к повышению активности рецептора GIP, может быть введена отдельно или в комбинации. Комбинации модификаций, которые приводят к повышению активности рецептора GIP, в основном, дают более высокую GIP-активность, чем любая из таких модификаций, введенных отдельно.
Модификации, которые влияют на глюкагоновую активность
В некоторых вариантах изобретения, повышенная глюкагоновая активность достигается посредством аминокислотной модификации в положении 16 нативного глюкагона (SEQ ID NO: 1001). В неограничивающем примере, такая повышенная активность может достигаться посредством замены природного серина в положении 16 глутаминовой кислотой или другой отрицательно заряженной аминокислотой, имеющей боковую цепь длиной в 4 атома, или альтернативно, любой одной из таких аминокислот, как глутамин, гомоглутаминовая кислота или гомоцистеиновая кислота, или заряженной аминокислотой, имеющей боковую цепь, содержащую по меньшей мере один гетероатом (например, N, O, S, P), и боковую цепь длиной примерно в 4 атома (или 3-5 атомов). В некоторых вариантах изобретения, пептид глюкагона сохраняет свою природную селективность к рецептору глюкагона, но не к рецептору GLP-1.
Активность по отношению к рецептору глюкагона может быть снижена посредством аминокислотной модификации в положении 3, например, замены природного глутамина в положении 3 кислотной, основной или гидрофобной аминокислотой. Так, например, замена аминокислоты в положении 3 глутаминовой кислотой, орнитином или норлейцином, в основном, приводит к снижению или ингибированию активности по отношению к рецептору глюкагона.
Сохранение или повышение активности по отношению к рецептору глюкагона может быть достигнуто посредством замены Gln в положении 3 аналогом глутамина, описанным в настоящей заявке. Так, например, агонисты глюкагона могут содержать любую из аминокислотных последовательностей SEQ ID NN: 1243-1248, 1250, 1251 и 1253-1256.
Восстановление глюкагоновой активности, которая была снижена в результате аминокислотных модификаций в положениях 1 и 2, достигается посредством модификаций, которые стабилизируют альфа-спиральную структуру С-концевой части (аминокислоты 12-29) пептида глюкагона или его аналога. Так, например, внутримолекулярный мостик может образовываться посредством ковалентной связи между боковыми цепями двух аминокислот в положениях i и i+4 или между положениями j и j+3, или между положениями k и k+7. В других вариантах изобретения, нековалентные связи, такие как солевые мостики, могут образовываться между положительно и отрицательно заряженными аминокислотами в этих положениях. В других вариантах изобретения, одну или несколько α,α-дизамещенных аминокислот встраивают или вводят путем замены в эту С-концевую часть (аминокислоты 12-29) в положениях, которые обеспечивают сохранение нужной активности. Так, например, аминокислоты а одном, двух, трех или во всех положениях 16, 20, 21 или 24 заменяют α,α-дизамещенной аминокислотой, например, AIB.
Модификации, которые влияют на GLP-1-активность
Повышение активности по отношению к рецептору GLP-1 достигается путем замены карбоксильной группы C-концевой аминокислоты нейтральной группой, такой как амид или сложный эфир.
Повышение активности по отношению к рецептору GLP-1 может быть также достигнуто путем стабилизации альфа-спиральной структуры в C-концевой части глюкагона (примерно в положениях аминокислот 12-29), например, посредством образования внутримолекулярного мостика между боковыми цепями двух аминокислот или посредством замены аминокислот примерно в положениях аминокислот 12-29 аминокислотой, стабилизирующей альфа-спиральную структуру (например, α,α-дизамещенной аминокислотой) и/или инсерции этой аминокислоты, также описанной в настоящей заявке. В репрезентативных вариантах изобретения, боковые цепи аминокислотных пар в положениях 12 и 16, 13 и 17, 16 и 20, 17 и 21, 20 и 24 или 24 и 28 (аминокислотные пары, в которых i=12, 16, 20 или 24) связаны друг с другом и стабилизируют альфа-спираль глюкагона. В некоторых вариантах изобретения, указанный мостик или линкер имеет длину примерно в 8 (или примерно 7-9) атомов, в частности, когда этот мостик находится между положениями i и i+4. В некоторых вариантах изобретения, указанный мостик или линкер имеет длину примерно в 6 (или примерно 5-7) атомов, в частности, когда этот мостик находится между положениями j и j+3.
В некоторых вариантах изобретения, внутримолекулярные мостики образуются (a) в результате замены природного серина в положении 16 глутаминовой кислотой или другой отрицательно заряженной аминокислотой, имеющей боковую цепь длиной в 4 атома, или, альтернативно, любой одной из таких аминокислот, как глутамин, гомоглутаминовая кислота или гомоцистеиновая кислота, либо заряженной аминокислотой, имеющей боковую цепь, содержащую по меньшей мере один гетероатом (например, N, O, S, P) и боковую цепь длиной примерно в 4 атома (или 3-5 атомов), и (b) в результате замены природного глутамина в положении 20 другой гидрофильной аминокислотой, имеющей боковую цепь, которая представляет собой либо заряженную боковую цепь, либо боковую цепь, обладающую способностью к образованию водородной связи и имеющую длину по меньшей мере примерно в 5 (или примерно 4-6) атомов, например, лизином, цитруллином, аргинином или орнитином. Боковые цепи таких аминокислот в положениях 16 и 20 могут образовывать солевой мостик или способны ковалентно связываться. В некоторых вариантах изобретения, две аминокислоты связаны друг с другом с образованием лактамового кольца.
В некоторых вариантах изобретения, стабилизация альфа-спиральной структуры в С-концевой части пептида глюкагона может быть достигнута посредством образования внутримолекулярного мостика, не являющегося лактамовым мостиком. Так, например, подходящими методами ковалентного связывания являются любой один или несколько таких методов, как метатезис олефинов, циклизация на основе лантионина, образование дисульфидного мостика или модифицированного мостика, содержащего серу, применение α,ω-диаминоалкановых связей, образование мостиков, содержащих атом металла и другие методы циклизации пептидов, применяемые для стабилизации альфа-спирали.
В других вариантах изобретения, одну или несколько α,α-дизамещенных аминокислот включают или вводят путем замены в С-концевую часть (аминокислоты 12-29) в положения, которые ответственны за сохранение нужной активности. Так, например, аминокислоты в одном, двух, трех или во всех положениях 16, 20, 21 или 24 заменяют α,α-дизамещенной аминокислотой, например, AIB.
Повышение активности по отношению к рецептору GLP-1 достигается посредством аминокислотной модификации в положении 20 как описано в настоящей заявке.
Повышение активности по отношению к рецептору GLP-1 достигается путем добавления GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096) к С-концу. GLP-1-активность в таких аналогах может быть также повышена путем модификации аминокислоты в положениях 18, 28 или 29, или в положениях 18 и 29, как описано в настоящей заявке.
Дополнительное небольшое увеличение GLP-1-активности достигается путем модификации аминокислоты в положении 10 посредством введения крупного ароматического аминокислотного остатка, необязательно, Trp.
Снижение активности по отношению к рецептору GLP-1 достигается, например, путем модификации аминокислоты в положении 7 как описано в настоящей заявке.
Активность по отношению к рецептору GLP-1 может быть еще больше увеличена путем замены нативного аргинина аланином в положении 18.
Любая из вышеописанных модификаций, введенная в родственный глюкагону пептид класса 2 и приводящая к увеличению активности по отношению к рецептору GLP-1, может быть внесена отдельно или в комбинации с другими модификациями. Комбинации модификаций, которые приводят к повышению активности по отношению к рецептору GLP-1, и которые, в основном, еще больше повышают GLP-1-активность, чем любая из таких модификаций, введенных отдельно. Так, например, настоящее изобретение относится к пептидам глюкагона, которые содержат модификации в положении 16, в положении 20 и в C-концевой карбоксильной группе, необязательно посредством ковалентной связи между аминокислотами в положениях 16 и 20; к пептидам глюкагона, которые содержат модификации в положении 16 и в C-концевой карбоксильной группе; к пептидам глюкагона, которые содержат модификации в положениях 16 и 20, необязательно, посредством ковалентной связи между аминокислотами в положениях 16 и 20; и к пептидам глюкагона, которые содержат модификации в положении 20 и в C-концевой карбоксильной группе.
Модификации, повышающие резистентность к DPP-IV
Модификации в положении 1 и/или 2 могут повышать резистентность пептидов к расщеплению дипептидил-пептидазой IV (DPP IV). Так, например, аминокислоты в положении 1 и/или в положении 2 могут быть заменены аминокислотой, резистентной к DPP-IV, как описано в настоящей заявке. В некоторых вариантах изобретения, аминокислота в положении 2 заменена N-метилаланином.
Было обнаружено, что модификации в положении 2 (например, AIB в положении 2), а в некоторых случаях, модификации в положении 1 (например, DMIA в положении 1) могут снижать глюкагоновую активность, а иногда значительно; причем, неожиданно было обнаружено, что такая пониженная глюкагоновая активность может быть доведена до исходного уровня посредством стабилизации альфа-спиральной структуры в С-концевой части глюкагона (аминокислоты приблизительно 12-29), например, посредством образования ковалентной связи между боковыми цепями двух аминокислот, как описано в настоящей заявке. В некоторых вариантах изобретения, ковалентная связь присутствует между аминокислотами в положениях «i» и «i+4», или в положениях «j» и «j+3», например, между положениями 12 и 16, 16 и 20, 20 и 24, 24 и 28, или 17 и 20. В репрезентативных вариантах изобретения, такой ковалентной связью является лактамовый мостик, расположенный между глутаминовой кислотой в положении 16 и лизином в положении 20. В некоторых вариантах изобретения, такой ковалентной связью является внутримолекулярный мостик, но не лактамовый мостик, как описано в настоящей заявке.
Модификации, которые снижают степень разложения
В других репрезентативных вариантах изобретения, любой из родственных глюкагону пептидов класса 2 может быть дополнительно модифицирован для повышения стабильности посредством модификации аминокислоты в положении 15 и/или 16 SEQ ID NO: 1001 в целях снижения степени разложения пептида в течение определенного периода времени, в частности, в кислотных или основных буферах. Такие модификации снижают степень расщепления пептидной связи Asp15-Ser16. В репрезентативных вариантах изобретения, модификацией аминокислоты в положении 15 является делеция или замена Asp глутаминовой кислотой, гомоглутаминовой кислотой, цистеиновой кислотой или гомоцистеиновой кислотой. В других репрезентативных вариантах изобретения, модификацией аминокислоты в положении 16 является делеция или замена Ser на Thr или AIB. В других репрезентативных вариантах изобретения, Ser в положении 16 заменен глутаминовой кислотой или другой отрицательно заряженной аминокислотой, имеющей боковую цепь длиной в 4 атома, или альтернативно, любой одной из таких аминокислот, как глутамин, гомоглутаминовая кислота или гомоцистеиновая кислота.
В некоторых вариантах изобретения, метиониновый остаток в положении 27 нативного пептида модифицируют, например, путем делеции или замены. Такие модификации могут предотвращать окислительное разложение пептида. В некоторых вариантах изобретения, Met в положении 27 заменен лейцином, изолейцином или норлейцином. В некоторых конкретных вариантах изобретения, Met в положении 27 заменен лейцином или норлейцином.
В некоторых вариантах изобретения, Gln в положениях 20 и/или 24 модифицируют, например, путем делеции или замены. Такие модификации могут снижать степень разложения, обусловленного дезамидированием Gln. В некоторых вариантах изобретения, Gln в положениях 20 и/или 24 заменен Ser, Thr, Ala или AIB. В некоторых вариантах изобретения, Gln в положениях 20 и/или 24 заменен Lys, Arg, Orn или цитруллином.
В некоторых вариантах изобретения, Asp в положении 21 модифицируют, например, путем делеции или замены. Такие модификации могут снижать степень разложения, обусловленного дегидратацией Asp с образованием циклического сукцинимидного промежуточного соединения, с последующей его изомеризацией в изоаспартат. В некоторых вариантах изобретения, аминокислота в положении 21 заменена Glu, гомоглутаминовой кислотой или гомоцистеиновой кислотой. В некоторых конкретных вариантах изобретения, аминокислота в положении 21 заменена Glu.
Стабилизация альфа-спиральной структуры
Стабилизация альфа-спиральной структуры в C-концевой части родственного глюкагону пептида класса 2 (аминокислоты приблизительно 12-29) приводит к повышению GLP-1 и/или GIP-активности и к восстановлению глюкагоновой активности, которая была снижена в результате аминокислотных модификаций в положениях 1 и/или 2. Альфа-спиральная структура может быть стабилизирована, например, посредством образования ковалентного или нековалентного внутримолекулярного мостика, или замены аминокислот в положениях приблизительно 12-29 аминокислотой, стабилизирующей альфа-спираль (например, α,α-дизамещенной аминокислотой), и/или инсерции указанных аминокислот. Стабилизация альфа-спиральной структуры агониста GIP может быть осуществлена как описано в настоящей заявке.
Ацилирование и алкилирование
В соответствии с некоторыми вариантами изобретения, описанные здесь пептиды глюкагона модифицируют так, чтобы они содержали ацильную группу или алкильную группу, например, ацильную группу или алкильную группу, которая является ненативной для природной аминокислоты, описанной в настоящей заявке. Ацилирование или алкилирование может приводить к увеличению времени полужизни пептида глюкагона в кровотоке. Ацилирование или алкилирование может преимущественно замедлять начало действия и/или увеличивать продолжительность действия по отношению к рецепторам глюкагона и/или GLP-1 и/или повышать резистентность к протеазам, таким как DPP-IV, и/или повышать растворимость. Активность пептида глюкагона по отношению к рецепторам глюкагона и/или GLP-1 и/или GIP может быть сохранена после ацилирования. В некоторых вариантах изобретения, активность ацилированных пептидов глюкагона сравнима с активностью неацилированных вариантов пептидов глюкагона. Родственные глюкагону пептиды класса 2 могут быть ацилированы или алкилированы в том же самом положении аминокислоты, в котором была присоединена гидрофильная группа, или в другом положении аминокислоты, как описано в настоящей заявке.
В некоторых своих вариантах, настоящее изобретение относится к пептиду глюкагона, модифицированному так, чтобы он содержал ацильную группу или алкильную группу, ковалентно связанную с аминокислотой в положении 10 пептида глюкагона. Пептид глюкагона может также содержать спейсер, расположенный между аминокислотой в положении 10 пептида глюкагона и ацильной группой или алкильной группой. В некоторых вариантах изобретения, ацильной группой является жирная кислота или желчная кислота или их соль, например, жирная C4-C30-кислота, жирная C8-C24-кислота, холевая кислота, C4-C30-алкил, C8-C24- алкил, или алкил, содержащий стероидную группу желчной кислоты. Спейсером является любая часть, имеющая подходящие реакционноспособные группы для присоединения ацильной или алкильной групп. В репрезентативных вариантах изобретения, спейсер включает аминокислоту, дипептид, трипептид, гидрофильный бифункциональный спейсер или гидрофобный бифункциональный спейсер. В некоторых вариантах изобретения, спейсер выбран из группы, состоящей из Trp, Glu, Asp, Cys и спейсера, содержащего NH2(CH2CH2O)n(CH2)mCOOH, где m равно любому целому числу от 1 до 6, а n равно любому целому числу от 2 до 12. Такие ацилированные или алкилированные пептиды глюкагона могут также содержать гидрофильную группу, необязательно, полиэтиленгликоль. Любой из вышеуказанных пептидов глюкагона может содержать две ацильных группы или две алкильных группы или их комбинацию.
Конъюгаты и гибриды
Агонист GIP может быть присоединен, необязательно, посредством ковалентного присоединения, и необязательно, посредством линкера, к части конъюгата, описанного в настоящей заявке.
В других вариантах изобретения, вторым пептидом является XGPSSGAPPPS (SEQ ID NO: 1096), где X выбран из 20 наиболее распространенных аминокислот, например, глутаминовой кислоты, аспарагиновой аминокислоты или глицина. В некоторых вариантах изобретения, X представляет собой аминокислоту, например, Cys, которая также содержит гидрофильную группу, ковалентно связанную с боковой цепью этой аминокислоты. Такие C-концевые удлинения повышают растворимость и могут также повышать GIP- или GLP-1-активность. В некоторых вариантах изобретения, в которых пептид глюкагона также содержит карбокси-концевое удлинение, такая карбокси-концевая аминокислота в области удлинения заканчивается амидной группой или сложноэфирной группой, но не карбоксильной группой.
В некоторых вариантах изобретения, например, в пептиде глюкагона, содержащем С-концевое удлинение, треонин в положении 29 нативного пептида глюкагона заменен глицином. Так, например, пептид глюкагона, имеющий замену треонина глицином в положении 29 и содержащий C-концевое удлинение GPSSGAPPPS (SEQ ID NO: 1095), обладает активностью по отношению к рецептору GLP-1, которая в четыре раза превышает активность модифицированного нативного глюкагона, содержащего то же самое С-концевое удлинение. Такая замена T29G может быть использована в комбинации с другими описанными здесь модификациями в целях повышения аффинности пептидов глюкагона по отношению к рецептору GLP-1. Так, например, замена T29G может быть объединена с аминокислотными заменами S16E и N20K, необязательно, с образованием лактамового мостика между аминокислотами 16 и 20, и необязательно, с добавлением описанной здесь ПЭГ-цепи.
В некоторых вариантах изобретения, аминокислоту добавляют к C-концу, и такая дополнительная аминокислота выбрана из группы, состоящей из глутаминовой кислоты, аспарагиновой кислоты и глицина.
Модификации, повышающие растворимость
В другом варианте изобретения, растворимость любого из пептидов глюкагона может быть повышена посредством аминокислотных замен и/или добавлений, которые вводят заряженную аминокислоту в С-концевую часть пептида, предпочтительно, в положении со стороны С-конца по отношению к положению 27 SEQ ID NO: 1001. Одна, две или три заряженных аминокислоты могут быть введены, но необязательно, в С-концевую часть, а предпочтительно, со стороны С-конца по отношению к положению 27. В некоторых вариантах изобретения, нативную(ые) аминокислоту(ы) в положениях 28 и/или 29 заменяют одной или двумя заряженными аминокислотами, и/или в другом варианте изобретения, 1-3 заряженных аминокислоты также добавляют к С-концу пептида. В репрезентативных вариантах изобретения, одна две или все заряженные аминокислоты имеют отрицательный заряд. В некоторых вариантах изобретения, отрицательно заряженной аминокислотой (кислотной аминокислотой) является аспарагиновая кислота или глутаминовая кислота.
В пептид глюкагона могут быть введены дополнительные модификации, например, консервативные замены, позволяющие сохранять GIP-активность (и необязательно, GLP-1-активность и/или глюкагоновую активность).
Другие модификации
Любая из вышеописанных модификаций, введенная в пептид класса 2, которая приводит к повышению или снижению GIP-активности, к повышению или снижению активности по отношению к рецептору глюкагона, и к повышению активности по отношению к рецептору GLP-1, может быть включена отдельно или в комбинации с другими модификациями. Любая из вышеописанных модификаций, введенная в родственный глюкагону пептид класса 2, может быть также объединена с другими модификациями, которые сообщают другие нужные свойства, такие как повышенная растворимость и/или стабильность и/или увеличенная продолжительность действия, как описано в настоящей заявке для родственных глюкагону пептидов класса 2. Альтернативно, любая из вышеописанных модификаций, введенная в родственные глюкагону пептиды класса 2, может быть также объединена с другими модификациями, описанными здесь для родственных глюкагону пептидов класса 2, где указанные модификации не оказывают значительного влияния на растворимость, стабильность или активность. Репрезентативными модификациями являются, но не ограничиваются ими:
(A) Повышение растворимости, например, путем введения одной, двух, трех или более заряженных аминокислот в С-концевую часть нативного глюкагона, а предпочтительно, в положении со стороны С-конца по отношению к положению 27. Такая заряженная аминокислота может быть введена путем замены нативной аминокислоты заряженной аминокислотой, например, в положениях 28 или 29, или альтернативно, путем добавления заряженной аминокислоты, например, за положениями 27, 28 или 29. В репрезентативных вариантах изобретения, одна, две, три или все заряженные аминокислоты имеют отрицательный заряд. В других вариантах изобретения, одна, две, три или все заряженные аминокислоты имеют положительный заряд. Такие модификации, как было определено через 24 часа при 25°С, приводят к повышению растворимости, например, в 2 раза, в 5 раз, в 10 раз, в 15 раз, в 25 раз, в 30 раз или более по сравнению с растворимостью нативного глюкагона при pH 5,5-8, например, при pH 7;
(B) Повышение растворимости и увеличение продолжительности действия или времени полужизни в кровотоке путем добавления гидрофильной группы, такой как описанная здесь полиэтиленгликолевая цепь, например, в положениях 16, 17, 20, 21, 24 или 29, в C-концевом удлинении и в положении C-концевой аминокислоты пептида;
(C) Повышение растворимости и/или увеличение продолжительности действия или времени полужизни в кровотоке и/или замедление начала действия путем ацилирования или алкилирования пептида глюкагона, как описано в настоящей заявке;
(D) Увеличение продолжительности действия или времени полужизни в кровотоке посредством сообщения резистентности к расщеплению дипептидил-пептидазой IV (DPP IV) путем модификации аминокислоты в положении 1 или 2, как описано в настоящей заявке;
(E) Повышение стабильности посредством модификации Asp в положении 15, например, путем делеции или замены глутаминовой кислотой, гомоглутаминовой кислотой, цистеиновой кислотой или гомоцистеиновой кислотой. Такие модификации могут снижать степень разложения или расщепления при рН в пределах 5,5-8, например, позволяют сохранять целостность исходного пептида по меньшей мере на 75%, 80%, 90%, 95%, 96%, 97%, 98% или 99%, и до 100% через 24 часа при 25°C. Такие модификации снижают степень расщепления пептидной связи между Asp15-Ser16;
(F) Повышение стабильности посредством модификации Ser в положении 16, например, путем замены на Thr или AIB. Такие модификации также снижают степень расщепления пептидной связи между Asp15-Ser16;
(G) Повышение стабильности посредством модификации метионина в положении 27, например, путем замены лейцином или норлейцином. Такие модификации могут снижать степень окислительного разложения. Стабильность может быть также повышена посредством модификации Gln в положении 20 или 24, например, путем замены на Ser, Thr, Ala или AIB. Такие модификации могут снижать степень разложения, обусловленного дезамидированием Gln. Стабильность может быть повышена посредством модификации Asp в положении 21, например, путем замены на Glu. Такие модификации могут снижать степень разложения, обусловленного дегидратацией Asp с образованием циклического сукцинимидного промежуточного соединения с последующей его изомеризацией в изоаспартат;
(H) Неконсервативные или консервативные замены, добавления или делеции, которые не оказывают значительного влияния на активность, например, консервативные замены в одном или нескольких положениях 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29; замена в одном или нескольких из этих положений на Ala; делеция аминокислот в одном или нескольких положениях 27, 28 или 29; или делеция аминокислоты 29, необязательно, в комбинации с С-концевым амидом или сложным эфиром, введенными вместо С-концевой карбоксильной группы; замена Lys в положении 12 на Arg; замена Tyr в положении 10 на Val или Phe.
Сохранение активности после ПЭГилирования достигается путем добавления GPSSGAPPPS (SEQ ID NO: 1095) к С-концу.
Некоторые положения нативного пептида глюкагона могут быть модифицированы с сохранением по меньшей мере некоторой активности родительского пептида. В соответствии с этим, авторами настоящего изобретения было высказано предположение, что одна или несколько аминокислот в положениях 2, 5, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29 могут быть заменены аминокислотой, отличающейся от аминокислоты, присутствующей в нативном пептиде глюкагона, с сохранением активности по отношению к рецептору глюкагона.
В некоторых вариантах изобретения, аминокислоту в положении 18 заменяют аминокислотой, выбранной из группы, состоящей из Ala, Ser или Thr. В некоторых вариантах изобретения, аминокислоту в положении 20 заменяют Ser, Thr, Lys, Arg, Orn, цитруллином или AIB. В некоторых вариантах изобретения, аминокислоту в положении 21 заменяют Glu, гомоглутаминовой кислотой или гомоцистеиновой кислотой. В некоторых вариантах изобретения, пептид глюкагона содержит 1-10 аминокислотных модификаций, выбранных из модификаций в положениях 16, 17, 18, 20, 21, 23, 24, 27, 28 и 29. В репрезентативных вариантах изобретения, модификациями являются одна или несколько аминокислотных замен, выбранных из группы, состоящей из Gln17, Ala18, Glu21, Ile23, Ala24, Val27 и Gly29. В некоторых вариантах изобретения, 1 или 2 аминокислоты, выбранных из аминокислот в положениях 17-26, отличаются от аминокислот родительского пептида. В других вариантах изобретения, 1 или 2 аминокислоты, выбранных из аминокислот в положениях 17-22, отличаются от аминокислот родительского пептида. В других вариантах изобретения, модификациями являются Gln17, Ala18, Glu21, Ile23 и Ala24.
В некоторых вариантах изобретения, одну или несколько аминокислот добавляют к карбокси-концу пептида глюкагона. Аминокислоту обычно выбирают из 20 наиболее распространенных аминокислот, а в некоторых вариантах изобретения, аминокислота имеет амидную группу вместо карбоксильной кислоты нативной аминокислоты. В репрезентативных вариантах изобретения, добавленная аминокислота выбрана из группы, состоящей из глутаминовой кислоты, аспарагиновой кислоты и глицина.
Другими модификациями, которые не приводят к ингибированию активности, являются W10 или R20.
В некоторых вариантах изобретения, описанные здесь родственные глюкагону пептиды класса 2 модифицируют посредством усечения у C-конца на один или два аминокислотных остатка с сохранением активности и эффективности по отношению к рецепторам глюкагона, GLP-1 и/или GIP. В соответствии с этим, аминокислота в положениях 29 и/или 28 может быть делетирована.
Репрезентативные варианты
В соответствии с некоторыми вариантами изобретения, аналог глюкагона (SEQ ID NO: 1001), обладающий GIP-агонистической активностью, включает SEQ ID NO: 1001, имеющую (a) аминокислотную модификацию в положении 1, которая сообщает GIP-агонистическую активность, (b) модификацию, стабилизирующую альфа-спиральную структуру С-концевой части (аминокислоты 12-29) аналога, и (c) необязательно, 1-10 (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10) дополнительных аминокислотных модификаций. В некоторых вариантах изобретения, аналог обладает по меньшей мере примерно 1% активностью нативного GIP по отношению к рецептору GIP или любой другой активностью по отношению к описанному здесь рецептору GIP.
В некоторых вариантах изобретения, модификацией, которая стабилизирует альфа-спиральную структуру, является модификация, которая способствует образованию или введению внутримолекулярного мостика, включая, например, ковалентный внутримолекулярный мостик, такой как любой из описанных здесь мостиков. В некоторых вариантах изобретения, ковалентным внутримолекулярным мостиком является лактамовый мостик. Лактамовый мостик аналога этих вариантов может представлять собой лактамовый мостик, описанный в настоящей заявке. Описание лактамовых мостиков можно найти, например, в разделе «Стабилизация альфа-спиральной структуры». Так, например, лактамовым мостиком может быть мостик, расположенный между боковыми цепями аминокислот в положениях i и i+4 или между боковыми цепями аминокислот в положениях j и j+3, где i равно 12, 13, 16, 17, 20 или 24, а j равно 17. В некоторых вариантах изобретения, лактамовый мостик может присутствовать между аминокислотами в положениях 16 и 20, где одна из аминокислот в положениях 16 и 20 заменена Glu, а другая аминокислота в положениях 16 и 20 заменена Lys.
В альтернативных вариантах изобретения, модификацией, которая стабилизирует альфа-спиральную структуру, является введение одной, двух, трех или четырех α,α-дизамещенных аминокислот в положении(ях) 16, 20, 21 и 24 данного аналога. В некоторых вариантах изобретения, α,α-дизамещенной аминокислотой является AIB. В некоторых аспектах изобретения. α,α-дизамещенной аминокислотой (например, AIB) является аминокислота в положении 20, а аминокислота в положении 16 заменена положительно заряженной аминокислотой, такой как, например, описанная здесь аминокислота формулы IV. Аминокислотой формулы IV может быть гомоLys, Lys, Orn или 2,4-диаминомасляная кислота (Dab).
В конкретных аспектах настоящего изобретения, аминокислотной модификацией в положении 1 является замена His аминокислотой, не содержащей имидазоловой боковой цепи, например, крупной ароматической аминокислотой (например, Tyr).
В некоторых аспектах изобретения, аналог глюкагона включает аминокислотные модификации в одном, двух или во всех положениях 27, 28 и 29. Так, например, аминокислота Met в положении 27 может быть заменена крупной алифатической аминокислотой, необязательно, Leu, аминокислота Asn в положении 28 может быть заменена небольшой алифатической аминокислотой, необязательно, Ala, аминокислота Thr в положении 29 может быть заменена небольшой алифатической аминокислотой, необязательно, Gly, либо может быть осуществлена комбинация из двух или трех вышеуказанных замен. В конкретных вариантах изобретения, аналог глюкагона включает Leu в положении 27, Ala в положении 28 и Gly или Thr в положении 29.
В некоторых вариантах изобретения, аналог глюкагона содержит удлинение из 1-21 аминокислот со стороны C-конца по отношению к аминокислоте в положении 29. Удлинение может содержать, например, аминокислотную последовательность SEQ ID NO: 1095 или 1096. Дополнительно или альтернативно, аналог глюкагона может иметь удлинение, в котором 1-6 аминокислот представляют собой положительно заряженные аминокислоты. Положительно заряженными аминокислотами могут быть аминокислоты формулы IV, включая, но не ограничиваясь ими, Lys, гомоLys, Orn и Dab.
В некоторых вариантах изобретения, аналог глюкагона ацилируют или алкилируют как описано в настоящей заявке. Так, например, ацильная или алкильная группа может быть присоединена к аналогу глюкагона посредством спейсера или без спейсера в положениях 10 или 40 указанного аналога, как описано в настоящей заявке. Аналог может быть дополнительно или альтернативно модифицирован так, чтобы он содержал гидрофильную группу, также описанную в настоящей заявке. Кроме того, в некоторых вариантах изобретения, аналог содержит любую одну или комбинацию нижеследующих модификаций:
(a) замену Ser в положении 2 аминокислотами D-Ser, Ala, D-Ala, Gly, N-метил-Ser, AIB, Val или α-амино-N-масляной кислотой;
(b) замену Tyr в положении 10 аминокислотами Trp, Lys, Orn, Glu, Phe или Val:
(c) связывание ацильной группы с Lys в положении 10;
(d) замену Lys в положении 12 аминокислотами Arg или Ile;
(e) замену Ser в положении 16 аминокислотами Glu, Gln, гомоглутаминовой кислотой, гомоцистеиновой кислотой, Thr, Gly или AIB;
(f) замену Arg в положении 17 аминокислотой Gln;
(g) замену Arg в положении 18 аминокислотами Ala, Ser, Thr или Gly;
(h) замену Gln в положении 20 аминокислотами Ser, Thr, Ala, Lys, цитруллином, Arg, Orn или AIB;
(i) замену Asp в положении 21 аминокислотой Glu, гомоглутаминовой кислотой, гомоцистеиновой кислотой;
(j) замену Val в положении 23 аминокислотой Ile;
(k) замену Gln в положении 24 аминокислотами Asn, Ser, Thr, Ala или AIB; и
(l) консервативную замену в любом из положений 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 8 19 20, 21, 24, 27, 28 и 29.
В репрезентативных вариантах изобретения, аналог глюкагона (SEQ ID NO: 1001), обладающий GIP-агонистической активностью, имеет нижеследующие модификации:
(a) аминокислотную модификацию в положении 1, которая сообщает GIP-агонистическую активность,
(b) лактамовый мостик, расположенный между боковыми цепями аминокислот в положениях i и i+4 или между боковыми цепями аминокислот в положениях j и j+3, где i равно 12, 13, 16, 17, 20 или 24, а j равно 17,
(c) аминокислотные модификации в одном, двух или во всех положениях 27, 28 и 29, например, аминокислотные модификации в положении 27 и/или 28, и
(d) 1-9 или 1-6 дополнительных аминокислотных модификаций, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9 дополнительных аминокислотных модификаций, и
где EC50 аналога для активации рецептора GIP составляет примерно 10 нМ или менее.
Лактамовый мостик аналога этих вариантов может представлять собой лактамовый мостик, описанный в настоящей заявке. Описание лактамовых мостиков можно найти, например, в разделе «Стабилизация альфа-спиральной структуры». Так, например, лактамовым мостиком может быть мостик, расположенный между аминокислотами в положениях 16 и 20, где одна из аминокислот в положениях 16 и 20 заменена Glu, а другая аминокислота в положениях 16 и 20 заменена Lys.
В соответствии с этими вариантами изобретения, аналог может содержать, например, любую из аминокислотных последовательностей SEQ ID NN: 1005-1094.
В других репрезентативных вариантах изобретения, аналог глюкагона (SEQ ID NO: 1001), обладающий GIP-агонистической активностью, имеет нижеследующие модификации:
(a) аминокислотную модификацию в положении 1, которая сообщает GIP-агонистическую активность,
(b) замену одной, двух, трех или всех аминокислот в положениях 16, 20, 21 и 24 указанного аналога α,α-дизамещенной аминокислотой,
(c) аминокислотные модификации в одном, двух или во всех положениях 27, 28 и 29, например, аминокислотные модификации в положении 27 и/или 28, и
(d) 1-9 или 1-6 дополнительных аминокислотных модификаций, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9 дополнительных аминокислотных модификаций, и
где EC50 аналога для активации рецептора GIP составляет примерно 10 нМ или менее.
α,α-Дизамещенной аминокислотой аналога этих вариантов может быть любая α,α-дизамещенная аминокислота, включая, но не ограничиваясь ими, аминоизомасляную кислоту (AIB), аминокислоту, замещенную в двух положениях одной и той же или различными группами, выбранными из метила, этила, пропила и н-бутила, или циклооктаном или циклогептаном (например, 1-аминоциклооктан-1-карбоновой кислотой). В некоторых вариантах изобретения, α,α-дизамещенной аминокислотой является AIB. В некоторых вариантах изобретения, аминокислота в положении 20 заменена α,α-дизамещенной аминокислотой, например, AIB.
В соответствии с этими вариантами изобретения, аналог может содержать, например, любую из аминокислотных последовательностей SEQ ID NN: 1099-1141, 1144-1164, 1166-1169 и 1173-1178.
В других репрезентативных вариантах изобретения, аналог глюкагона (SEQ ID NO: 1001), обладающий GIP-агонистической активностью, имеет следующие модификации:
(a) аминокислотную модификацию в положении 1, которая сообщает GIP-агонистическую активность,
(b) замену аминокислоты Ser в положении 16 аминокислотой формулы IV:
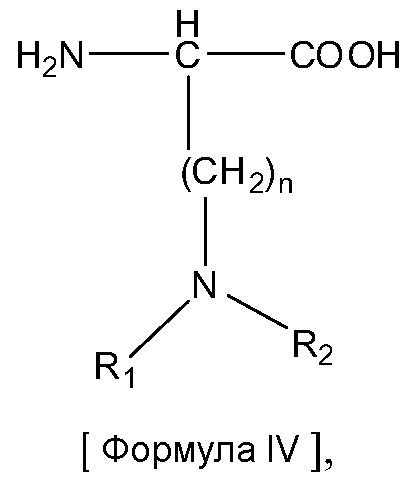
где n равно 1-16 или 1-10 или 1-7 или 1-6 или 2-6, каждый из R1 и R2 независимо выбран из группы, состоящей из H, С1-С18алкила, (С1-С18алкил)OH, (С1-С18алкил)NH2, (С1-С18алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7 и (C1-C4алкил)(C3-C9гетероарил), где R7 представляет собой H или OH, а боковая цепь аминокислоты формулы IV содержит свободную аминогруппу,
(c) замену аминокислоты Gln в положении 20 альфа,альфа-дизамещенной аминокислотой,
(d) аминокислотные модификации в одном, двух или во всех положениях 27, 28 и 29, например, аминокислотные модификации в положении 27 и/или 28, и
(е) 1-9 или 1-6 дополнительных аминокислотных модификаций, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9 дополнительных аминокислотных модификаций, и
где EC50 аналога для активации рецептора GIP составляет примерно 10 нМ или менее.
Аминокислотой формулы IV аналога этих вариантов может быть любая аминокислота, такая как, например, аминокислота формулы IV, где n равно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16. В некоторых вариантах изобретения, n равно 2, 3, 4, или 5, и в этом случае, аминокислотой является Dab, Orn, Lys или гомоLys, соответственно.
альфа,альфа-Дизамещенной аминокислотой аналога этих вариантов может быть любая альфа,альфа-дизамещенная аминокислота, включая, но не ограничиваясь ими, аминоизомасляную кислоту (AIB), аминокислоту, замещенную в двух положениях одной и той же или различными группами, выбранными из метила, этила, пропила и н-бутила, или циклооктаном или циклогептаном (например, 1-аминоциклооктан-1-карбоновой кислотой). В некоторых вариантах изобретения, альфа,альфа-дизамещенной аминокислотой является AIB.
В соответствии с этими вариантами изобретения, аналог может содержать, например, любую из аминокислотных последовательностей SEQ ID NN: 1099-1165.
В других репрезентативных вариантах изобретения, аналог глюкагона (SEQ ID NO: 1001), обладающий GIP-агонистической активностью, имеет следующие модификации:
(a) аминокислотную модификацию в положении 1, которая сообщает GIP-агонистическую активность, и
(b) удлинение примерно на 1-21 аминокислоту со стороны С-конца по отношению к аминокислоте в положении 29, где по меньшей мере одна из аминокислот такого удлинения является ацилированной или алкилированной,
где EC50 аналога для активации рецептора GIP составляет примерно 10 нМ или менее.
В некоторых вариантах изобретения, ацилированной или алкилированной аминокислотой является аминокислота формулы I, II или III. В более конкретных вариантах изобретения, аминокислотой формулы I является Dab, Orn, Lys или гомоLys. Кроме того, в некоторых вариантах изобретения, удлинение примерно на 1-21 аминокислоту содержит аминокислотную последовательность GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096), где X представляет собой любую аминокислоту, или GPSSGAPPPK (SEQ ID NO: 1170) или XGPSSGAPPPK (SEQ ID NO: 1171) или XGPSSGAPPPSK (SEQ ID NO: 1172), где X представляет собой Gly или небольшую алифатическую или неполярную или слабополярную аминокислоту. В некоторых вариантах изобретения, область примерно в 1-21 аминокислоту может содержать последовательность, включающую одну или несколько консервативных замен по сравнению с последовательностями SEQ ID NO: 1095, 1096, 1170, 1171 или 1172. В некоторых вариантах изобретения, ацилированная или алкилированная аминокислота находится в положениях 37, 38, 39, 40, 41, 42 или 43 аналога с удлинением у C-конца. В некоторых вариантах изобретения, ацилированная или алкилированная аминокислота находится в положении 40 аналога с удлинением у C-конца.
В некоторых вариантах изобретения, аналог, обладающий GIP-агонистической активностью, также имеет аминокислотные модификации в одном, двух или во всех положениях 27, 28 и 29, например, аминокислотные модификации в положениях 27 и/или 28.
В любом из вышеуказанных репрезентативных вариантов, аминокислотные модификации в положении 1, которые сообщают GIP-агонистическую активность, могут представлять собой замену His аминокислотой, не содержащей имидазоловой боковой цепи. Аминокислотной модификацией в положении 1 может быть, например, замена His крупной ароматической аминокислотой. В некоторых вариантах изобретения, крупной ароматической аминокислотой является любая из описанных здесь аминокислот, включая, например, Tyr.
Кроме того, в соответствии с вышеуказанными репрезентативными вариантами, аминокислотными модификациями в одном, двух или во всех положениях 27, 28 и 29 могут быть любая из описанных здесь модификаций в этих положениях. Так, например, Met в положении 27 может быть заменен крупной алифатической аминокислотой, необязательно, Leu; Asn в положении 28 может быть заменен небольшой алифатической аминокислотой, необязательно, Ala; и/или Thr в положении 29 может быть заменен небольшой алифатической аминокислотой, необязательно, Gly. Альтернативно, этот аналог может содержать такие аминокислотные модификации в положениях 27 и/или 28.
Аналог в соответствии с вышеуказанными репрезентативными вариантами может также содержать 1-9 или 1-6 других дополнительных аминокислотных модификаций, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9 дополнительных аминокислотных модификаций, таких как, например, любая из описанных здесь модификаций, которая приводит к повышению или снижению активности по отношению к любому из рецепторов GIP, GLP-1 и глюкагона, к повышению растворимости, к увеличению продолжительности действия или к увеличению времени полужизни в кровотоке, к замедлению начала действия или к повышению стабильности. Аналог может также содержать, например, аминокислотную модификацию в положении 12, необязательно, замену на Ile, и/или аминокислотные модификации в положениях 17 и 18, необязательно, замену на Q в положении 17 и на A в положении 18, и/или добавление GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096), или последовательности, содержащие одну или несколько консервативных замен по сравнению с SEQ ID NO: 1095 или 1096, со стороны C-конца. Аналог может включать одну или несколько из нижеследующих модификаций:
(i) замену Ser в положении 2 аминокислотами D-Ser, Ala, D-Ala, Gly, N-метил-Ser, AIB, Val или α-амино-N-масляной кислотой;
(ii) замену Tyr в положении 10 аминокислотами Trp, Lys, Orn, Glu, Phe или Val:
(iii) связывание ацильной группы с Lys в положении 10;
(iv) замену Lys в положении 12 аминокислотой Arg;
(v) замену Ser в положении 16 аминокислотами Glu, Gln, гомоглутаминовой кислотой, гомоцистеиновой кислотой, Thr, Gly или AIB;
(vi) замену Arg в положении 17 аминокислотой Gln;
(vii) замену Arg в положении 18 аминокислотами Ala, Ser, Thr или Gly;
(viii) замену Gln в положении 20 аминокислотами Ala, Ser, Thr, Lys, цитруллином, Arg, Orn или AIB;
(ix) замену Asp в положении 21 аминокислотой Glu, гомоглутаминовой кислотой, гомоцистеиновой кислотой;
(x) замену Val в положении 23 аминокислотой Ile;
(xi) замену Gln в положении 24 аминокислотами Asn, Ala, Ser, Thr или AIB; и
(xii) консервативную замену в любом из положений 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 18, 19, 20, 21, 24, 27, 28 и 29.
В некоторых вариантах изобретения, аналог содержит комбинацию модификаций (i)-(xii). Альтернативно или дополнительно, указанный аналог может содержать аминокислотную модификацию в положении 3 (например, замену аминокислоты Gln на Glu), где указанный аналог имеет менее, чем 1% активности глюкагона по отношению к рецептору глюкагона. Альтернативно или дополнительно, указанный аналог может содержать аминокислотную модификацию в положении 7 (например, замену аминокислоты Thr аминокислотой, не содержащей гидроксильной группы, например, Abu или Ile), где указанный аналог обладает активностью, которая составляет примерно менее, чем 10% активности GLP-1 по отношению к рецептору GLP-1.
В соответствии с репрезентативными вариантами изобретения, аналог может быть ковалентно связан с гидрофильной группой. В некоторых вариантах изобретения, аналог ковалентно связан с гидрофильной группой в любом из положений аминокислот 16, 17, 20, 21, 24, 29, 40, или у C-конца. В некоторых вариантах изобретения, аналог содержит C-концевое удлинение (например, аминокислотную последовательность SEQ ID NO: 1095) и добавление аминокислоты, содержащей гидрофильную группу, так, чтобы такая гидрофильная группа была ковалентно связана с аналогом в положении 40.
В некоторых вариантах изобретения, гидрофильная группа ковалентно связана с Lys, Cys, Orn, гомоцистеином или ацетилфенилаланином данного аналога. Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин могут представлять собой аминокислоты, которые являются нативными для последовательности глюкагона (SEQ ID NO: 1001) или которые могут служить в качестве замены нативной аминокислоты SEQ ID NO: 1001. В некоторых вариантах изобретения, в которых гидрофильная группа присоединена к Cys, связь с гидрофильной группой может содержать структуру:
В аналогах, содержащих гидрофильную группу, такой гидрофильной группой может быть любая из описанных здесь групп. Описание можно найти, например, в разделе «Связывание гидрофильных групп». В некоторых вариантах изобретения, гидрофильной группой является полиэтиленгликоль (ПЭГ). В некоторых вариантах изобретения, ПЭГ имеет молекулярную массу примерно 1000-40000 дальтон, например, примерно от 20000 дальтон до 40000 дальтон.
В соответствии с репрезентативными вариантами изобретения, аналог может содержать модифицированную аминокислоту, в которой боковая цепь ковалентно связана с ацильной или алкильной группой (например, с ацильной или алкильной группой, которая является ненативной для природной аминокислоты). Ацилированный или алкилированный аналог может представлять собой, соответственно, ацилированные или алкилированные пептиды, описанные в разделе «Ацилирование и алкилирование». В некоторых вариантах изобретения, ацильной группой является жирная C4-C30- ацильная группа, такая как, например, жирная C10-ацильная или алкильная группа, жирная C12-ацильная или алкильная группа, жирная С14-ацильная или алкильная группа, жирная C16-ацильная или алкильная группа, жирная C18-ацильная или алкильная группа, C20-ацильная или алкильная группа или C22-ацильная или алкильная группа. Ацильная или алкильная группа может быть ковалентно связана с любой аминокислотой аналога, включая, но не ограничиваясь ими, аминокислоту в положении 10 или 40, или C-концевую аминокислоту. В некоторых вариантах изобретения, аналог содержит C-концевое удлинение (например, аминокислотную последовательность SEQ ID NO: 1095) и добавление аминокислоты, содержащей ацильную или алкильную группу, при котором ацильная или алкильная группы ковалентно связаны с аналогом в положении 40. В некоторых вариантах изобретения, ацильная или алкильная группа ковалентно связана с боковой цепью аминокислоты формулы I, II, или III, например, с остатком Lys. Ацильная или алкильная группы могут быть ковалентно связаны с аминокислотой, которая является нативной для последовательности глюкагона (SEQ ID NO: 1001), либо они могут быть связаны с аминокислотой, которая была добавлена к последовательности SEQ ID NO: 1001 или к последовательности SEQ ID NO: 1001, за которой расположена SEQ ID NO: 1095 (у N- или C-конца), либо они могут быть связаны с аминокислотой, которая заменяет нативную аминокислоту, например, Tyr в положении 10 SEQ ID NO: 1001.
В вышеуказанных репрезентативных вариантах изобретения, в которых аналог содержит ацильную или алкильную группу, такой аналог может быть присоединен к ацильной или алкильной группе посредством спейсера, описанного в настоящей заявке. Спейсер может иметь длину, например, в 3-10 атомов, и таким спейсером может быть, например, аминокислота (например, 6-аминогексановая кислота или любая описанная здесь аминокислота), дипептид (например, Ala-Ala, βAla-βAla, Leu-Leu, Pro-Pro, γGlu-γGlu), трипептид или гидрофильный или гидрофобный бифункциональный спейсер. В некоторых аспектах изобретения, общая длина спейсера и ацильной или алкильной группы составляет примерно от 14 до 28 атомов. В некоторых вариантах изобретения, аминокислотный спейсер не является γ-Glu. В некоторых вариантах изобретения, дипептидный спейсер не является γ-Glu-γ-Glu.
В других репрезентативных вариантах изобретения, аналог глюкагона, обладающий GIP-агонистической активностью, содержит любую из аминокислотных последовательностей SEQ ID NN: 1227, 1228, 1229 или 1230, которая также включает нижеследующие модификации:
(a) необязательно, аминокислотную модификацию в положении 1, сообщающую GIP-агонистическую активность,
(b) удлинение примерно на 1-21 аминокислоту со стороны C-конца по отношению к аминокислоте в положении 29, где по меньшей мере одна из аминокислот такого удлинения является ацилированной или алкилированной, и
(d) до 6 дополнительных аминокислотных модификаций, где EC50 данного аналога для активации рецептора GIP составляет примерно 10 нМ или менее.
В некоторых аспектах изобретения, ацилированной или алкилированной аминокислотой является аминокислота формулы I, II или III. В более конкретных вариантах изобретения, аминокислотой формулы I является Dab, Orn, Lys или гомоLys. Кроме того, в некоторых вариантах изобретения, последовательность примерно из 1-21 аминокислоты содержит аминокислотную последовательность GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096), где X представляет собой любую аминокислоту, или GPSSGAPPPK (SEQ ID NO: 1170) или XGPSSGAPPPK (SEQ ID NO: 1171) или XGPSSGAPPPSK (SEQ ID NO: 1172), где X представляет собой Gly или небольшую алифатическую или неполярную или слабополярную аминокислоту. В некоторых вариантах изобретения, последовательность примерно из 1-21 аминокислоты может включать последовательности, содержащие одну или несколько консервативных замен по сравнению с последовательностями SEQ ID NO: 1095, 1096, 1170, 1171 или 1172. В некоторых вариантах изобретения, ацилированная или алкилированная аминокислота присутствует в положении 37, 38, 39, 40, 41, 42 или 43 аналога с С-концевым удлинением. В некоторых вариантах изобретения, ацилированная или алкилированная аминокислота присутствует в положении 40 аналога с C-концевым удлинением.
В любом из вышеуказанных репрезентативных вариантов изобретения, аминокислотой в положении 1, которая сообщает GIP-агонистическую активность, может быть аминокислота, не содержащая имидазоловой боковой цепи. Аминокислотой в положении 1 может быть, например, крупная ароматическая аминокислота. В некоторых вариантах изобретения, крупной ароматической аминокислотой является любая из описанных здесь аминокислот, включая, например, Tyr.
Аналог в соответствии с вышеуказанными репрезентативными вариантами изобретения может также содержать 1-6 дополнительных аминокислотных модификаций, таких как, например, любая из описанных здесь модификаций, которая повышает или снижает активность по отношению к любому из рецепторов GIP, GLP-1 и глюкагона, повышает растворимость, увеличивает продолжительность действия или увеличивает время полужизни в кровотоке, замедляет начало действия или повышает стабильность.
В некоторых аспектах изобретения, аналоги глюкагона, описанные в вышеуказанном репрезентативном варианте изобретения, содержат дополнительные аминокислотные модификации в одном, двух или во всех положениях 27, 28 и 29. Модификациями в этих положениях могут быть любые описанные здесь модификации в этих положениях. Так, например, по сравнению с последовательностями SEQ ID NO: 1227, 1228, 1229 или 1230, аминокислота в положении 27 может быть заменена крупной алифатической аминокислотой (например, Leu, Ile или норлейцином) или Met; аминокислота в положении 28 может быть заменена другой небольшой алифатической аминокислотой (например, Gly или Ala) или Asn, и/или аминокислота в положении 29 может быть заменена другой небольшой алифатической аминокислотой (например, Ala или Gly) или Thr. Альтернативно, аналог может содержать такие аминокислотные модификации в положении 27 и/или 28.
Аналог может также включать одну или несколько из нижеследующих дополнительных модификаций, где:
(i) аминокислотой в положении 2 является любая из аминокислот, таких как D-Ser, Ala, D-Ala, Gly, N-метил-Ser, AIB, Val или α-амино-N-масляная кислота;
(ii) аминокислотой в положении 10 является Tyr, Trp, Lys, Orn, Glu, Phe или Val;
(iii) ацильная группа связана с Lys в положении 10;
(iv) аминокислотой в положении 12 является Ile, Lys или Arg;
(v) аминокислотой в положении 16 является любая из аминокислот, таких как Ser, Glu, Gln, гомоглутаминовая кислота, гомоцистеиновая кислота, Thr, Gly или AIB;
(vi) аминокислотой в положении 17 является Gln или Arg;
(vii) аминокислотой в положении 18 является любая из аминокислот, таких как Ala, Arg, Ser, Thr или Gly;
(viii) аминокислотой в положении 20 является любая из аминокислот, таких как Ala, Ser, Thr, Lys, цитруллин, Arg, Orn, или AIB или другая альфа,альфа-дизамещенная аминокислота;
(ix) аминокислотой в положении 21 является любая из аминокислот, таких как Glu, Asp, гомоглутаминовая кислота, гомоцистеиновая кислота;
(x) аминокислотой в положении 23 является Val или Ile;
(xi) аминокислотой в положении 24 является любая из аминокислот, таких как Gln, Asn, Ala, Ser, Thr или AIB; и
(xii) одна или несколько консервативных замен присутствует в любом из положений 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 27, 28 и 29.
В некоторых вариантах изобретения, аналог содержит комбинацию модификаций (i)-(xii). Альтернативно или дополнительно, указанный аналог может содержать аминокислотную модификацию в положении 3 (например, замену аминокислоты Gln аминокислотой Glu), где указанный аналог обладает активностью, которая составляет менее, чем 1% активности глюкагона по отношению к рецептору глюкагона. Альтернативно или дополнительно, такой аналог может содержать аминокислотную модификацию в положении 7 (например, замену аминокислоты Thr аминокислотой, не содержащей гидроксильной группы, например, Abu или Ile), где указанный аналог обладает активностью, которая составляет примерно менее 10% активности GLP-1 по отношению к рецептору GLP-1.
В соответствии с репрезентативными вариантами изобретения, аналог может быть ковалентно связан с гидрофильной группой. В некоторых вариантах изобретения, указанный аналог ковалентно связан с гидрофильной группой в любом из положений аминокислот 16, 17, 20, 21, 24, 29, 40, или у C-конца. В некоторых вариантах изобретения, указанный аналог содержит гидрофильную группу, ковалентно связанную с ним в положении 24.
В некоторых вариантах изобретения, гидрофильная группа ковалентно связана с Lys, Cys, Orn, гомоцистеином или ацетилфенилаланином данного аналога. Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин могут представлять собой аминокислоты, которые являются нативными для последовательностей SEQ ID NO: 1001, 1227, 1228, 1229 или 1230, либо они могут представлять собой замененную аминокислоту. В некоторых вариантах изобретения, в которых гидрофильная группа присоединена к Cys, связь может содержать структуру:

В аналогах, содержащих гидрофильную группу, такой гидрофильной группой может быть любая из описанных здесь групп. Описание можно найти, например, в разделе «Связывание гидрофильных групп». В некоторых вариантах изобретения, гидрофильной группой является полиэтиленгликоль (ПЭГ). В некоторых вариантах изобретения, ПЭГ имеет молекулярную массу примерно 1000-40000 дальтон, например, примерно от 20000 дальтон до 40000 дальтон.
В соответствии с репрезентативными вариантами изобретения, аналог может содержать модифицированную аминокислоту в С-концевом удлинении, в котором боковая цепь ковалентно связана с ацильной или алкильной группой. Ацилированный или алкилированный аналог может представлять собой, соответственно, ацилированные или алкилированные пептиды, описанные в разделе «Ацилирование и алкилирование». В некоторых вариантах изобретения, ацильной группой является жирная C4-C30-ацильная группа, такая как, например, жирная C10-ацильная или алкильная группа, жирная C12-ацильная или алкильная группа, жирная С14-ацильная или алкильная группа, жирная ацильная или алкильная C16-группа, жирная C18-ацильная или алкильная группа, C20-ацильная или алкильная группа или C22-ацильная или алкильная группа. Ацильная или алкильная группа может быть ковалентно связана с любой аминокислотой аналога, включая, но не ограничиваясь ими, аминокислоту в положении 10 или 40, или C-концевую аминокислоту. В некоторых вариантах изобретения, ацильная или алкильная группа ковалентно связана с боковой цепью аминокислоты формулы I, II, или III, например, с остатком Lys. Ацильная или алкильная группы могут быть ковалентно связаны с аминокислотой, которая является нативной для последовательностей SEQ ID NO: 1001, 1227, 1228, 1229 или 1230, либо они могут быть связаны с замененной аминокислотой. Ацильная или алкильная группа ковалентно связана с аминокислотой, которая является нативной для SEQ ID NO: 1095, 1096, 1171 или 1172, либо она может быть связана с замененной аминокислотой.
В вышеуказанных репрезентативных вариантах изобретения, в которых аналог содержит ацильную или алкильную группу, такой аналог может быть присоединен к ацильной или алкильной группе посредством спейсера, описанного в настоящей заявке. Спейсер может иметь длину, например, в 3-10 атомов, и таким спейсером может быть, например, аминокислота (например, 6-аминогексановая кислота или любая описанная здесь аминокислота), дипептид (например, Ala-Ala, βAla-βAla, Leu-Leu, Pro-Pro, γGlu-γGlu), трипептид или гидрофильный или гидрофобный бифункциональный спейсер. В некоторых аспектах изобретения, общая длина спейсера и ацильной или алкильной группы составляет примерно от 14 до 28 атомов. В некоторых вариантах изобретения, аминокислотный спейсер не является γ-Glu. В некоторых вариантах изобретения, дипептидный спейсер не является γ-Glu-γ-Glu.
В некоторых более конкретных вариантах изобретения, аналог согласно изобретению содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NN: 1099-1141, 1144-1164, 1166, 1192-1207, 1209-1221 и 1223, или из группы, состоящей из SEQ ID NO:1167-1169, 1173-1178 и 1225.
Кроме того, конкретными примерами аналогов согласно изобретению являются, но не ограничиваются ими, любой из аналогов, представленных в таблицах 1-3.
В других репрезентативных вариантах изобретения, аналог глюкагона, обладающий GIP-агонистической активностью, содержит ацильную или алкильную группу (например, ацильную или алкильную группу, которая является ненативной для природной аминокислоты), где указанная ацильная или алкильная группы присоединены к спейсеру, где (i) спейсер связан с боковой цепью аминокислоты в положении 10 указанного аналога; или (ii) аналог содержит удлинение на 1-21 аминокислоту со стороны C-конца по отношению к аминокислоте в положении 29 и где спейсер связан с боковой цепью аминокислоты, соответствующей одной из аминокислот в положениях 37-43 в SEQ ID NO: 1001, где EC50 данного аналога для активации рецептора GIP составляет примерно 10 нМ или менее.
В таких вариантах изобретения, аналог может содержать аминокислотную последовательность SEQ ID NO: 1001, имеющую (i) модификацию в положении аминокислоты 1, которая сообщает GIP-агонистическую активность, (ii) аминокислотные модификации в одном, двух или во всех положениях 27, 28 и 29, (iii) по меньшей мере одну из модификаций, где:
(A) аналог содержит лактамовый мостик между боковыми цепями аминокислот в положениях i и i+4 или между боковыми цепями аминокислот в положениях j и j+3, где i равно 12, 13, 16, 17, 20 или 24, и где j равно 17;
(B) аминокислоты в одном, двух, трех или во всех положениях 16, 20, 21 и 24 данного аналога заменены α,α-дизамещенной аминокислотой; или
(C) аналог содержит (i) замену аминокислоты Ser в положении 16 аминокислотой формулы IV:
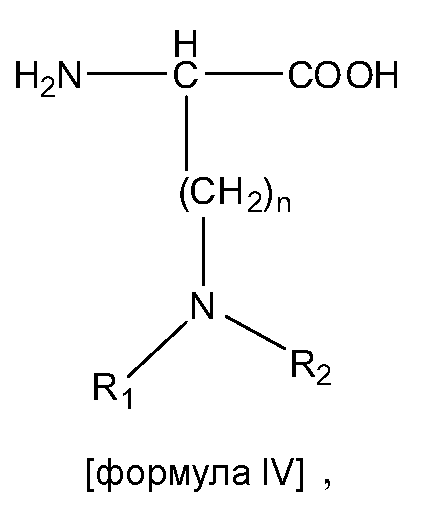
где n равно 1-7, каждый из R1 и R2 независимо выбран из группы, состоящей из H, C1-С18алкила, (C1-C18алкил)OH, (C1-C18алкил)NH2, (C1-С18алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7 и (C1-C4алкил)(C3-C9гетероарил), где R7 представляет собой H или OH, а боковая цепь аминокислоты формулы IV содержит свободную аминогруппу; и (ii) аминокислота Gln в положении 20 заменена альфа,альфа-дизамещенной аминокислотой, и
(iv) до 6 дополнительных аминокислотных модификаций.
Альфа,альфа-дизамещенной аминокислотой аналога этих вариантов может быть любая альфа,альфа-дизамещенная аминокислота, включая, но не ограничиваясь ими, аминоизомасляную кислоту (AIB), аминокислоту, замещенную в двух положениях одной и той же или различными группами, выбранными из метила, этила, пропила и н-бутила, или циклооктаном или циклогептаном (например, 1-аминоциклооктан-1-карбоновой кислотой). В некоторых вариантах изобретения, альфа,альфа-дизамещенной аминокислотой является AIB.
Аминокислотой формулы IV аналога этих вариантов изобретения может быть любая аминокислота, такая как, например, аминокислота формулы IV, где n равно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16. В некоторых вариантах изобретения, n равно 2, 3, 4, или 5, и в этом случае, указанной аминокислотой является Dab, Orn, Lys или гомоLys, соответственно.
В любом из вышеуказанных репрезентативных вариантов изобретения, аминокислотной модификацией в положении 1, которая сообщает GIP-агонистическую активность, может быть замена His аминокислотой, не содержащей имидазоловой боковой цепи. Аминокислотной модификацией в положении 1 может быть, например, замена His крупной ароматической аминокислотой. В некоторых вариантах изобретения, крупной ароматической аминокислотой является любая из описанных здесь аминокислот, включая, например, Tyr.
Кроме того, в соответствии с вышеуказанными репрезентативными вариантами изобретения, аминокислотными модификациями в одном, двух или во всех положениях 27, 28 и 29 могут быть любые описанные здесь модификации в этих положениях. Так, например, Met в положении 27 может быть заменен крупной алифатической аминокислотой, необязательно, Leu; Asn в положении 28 может быть заменен небольшой алифатической аминокислотой, необязательно, Ala, и/или Thr в положении 29 может быть заменен небольшой алифатической аминокислотой, необязательно, Gly. Альтернативно, аналог может содержать такие аминокислотные модификации в положении 27 и/или 28.
Аналог вышеуказанных репрезентативных вариантов изобретения может также содержать 1-9 или 1-6 других дополнительных аминокислотных модификаций, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9 других аминокислотных модификаций, таких как, например, любая из описанных здесь модификаций, которая приводит к повышению или снижению активности по отношению к любому из рецепторов GIP, GLP-1 и глюкагона, к повышению растворимости, к увеличению продолжительности действия или времени полужизни в кровотоке, к замедлению начала действия или к повышению стабильности. Аналог может также содержать, например, аминокислотную модификацию в положении 12, необязательно, замену на Ile, и/или аминокислотные модификации в положениях 17 и 18, необязательно, замену на Q в положении 17 и на A в положении 18, и/или добавление GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096), или последовательностей, содержащих одну или несколько консервативных замен по сравнению с SEQ ID NO: 1095 или 1096, к C-концу. Аналог может содержать одну или несколько из нижеследующих модификаций:
(i) замену Ser в положении 2 аминокислотами D-Ser, Ala, D-Ala, Gly, N-метил-Ser, AIB, Val или α-амино-N-масляной кислотой;
(ii) замену Tyr в положении 10 аминокислотами Trp, Lys, Orn, Glu, Phe или Val;
(iii) связь ацильной группы с Lys в положении 10;
(iv) замену Lys в положении 12 аминокислотой Arg;
(v) замену Ser в положении 16 аминокислотой Glu, аминокислотой Gln, гомоглутаминовой кислотой, гомоцистеиновой кислотой, Thr, Gly, Lys или AIB;
(vi) замену Arg в положении 17 аминокислотой Gln;
(vii) замену Arg в положении 18 аминокислотами Ala, Ser, Thr или Gly;
(viii) замену Gln в положении 20 аминокислотами Ala, Ser, Thr, Lys, цитруллином, Arg, Orn или AIB;
(ix) замену Asp в положении 21 аминокислотой Glu, гомоглутаминовой кислотой, гомоцистеиновой кислотой;
(x) замену Val в положении 23 аминокислотой Ile;
(xi) замену Gln в положении 24 аминокислотами Asn, Ala, Ser, Thr или AIB; и
(xii) консервативную замену в любом из положений 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 27, 28 и 29.
В некоторых вариантах изобретения, аналог содержит комбинацию модификаций (i)-(xii). Альтернативно или дополнительно, указанный аналог может содержать аминокислотную модификацию в положении 3 (например, замену аминокислоты Gln на Glu), где указанный аналог имеет менее, чем 1% активности глюкагона по отношению к рецептору глюкагона. Альтернативно или дополнительно, указанный аналог может содержать аминокислотную модификацию в положении 7 (например, замену аминокислоты Thr аминокислотой, не содержащей гидроксильной группы, например, Abu или Ile), делецию аминокислоты(аминокислот) со стороны С-конца по отношению к аминокислоте в положении 27 или 28, с получением пептида, состоящего из 27 или 28 аминокислот, или их комбинацию, где указанный аналог обладает активностью, которая составляет примерно менее, чем 10% активности GLP-1 по отношению к рецептору GLP-1.
В соответствии с репрезентативными вариантами изобретения, аналог может быть ковалентно связан с гидрофильной группой. В некоторых вариантах изобретения, аналог ковалентно связан с гидрофильной группой в любом из положений аминокислот 16, 17, 20, 21, 24, 29, 40, или у C-конца. В некоторых вариантах изобретения, аналог содержит C-концевое удлинение (например, аминокислотную последовательность SEQ ID NO: 1095) и добавление аминокислоты, содержащей гидрофильную группу, так, чтобы такая гидрофильная группа была ковалентно связана с аналогом в положении 40.
В некоторых вариантах изобретения, гидрофильная группа ковалентно связана с Lys, Cys, Orn, гомоцистеином или ацетилфенилаланином данного аналога. Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин могут представлять собой аминокислоты, которые являются нативными для последовательности глюкагона (SEQ ID NO: 1001) или которые могут служить в качестве замены нативной аминокислоты SEQ ID NO: 1001. В некоторых вариантах изобретения, в которых гидрофильная группа присоединена к Cys, связь с гидрофильной группой может содержать структуру:
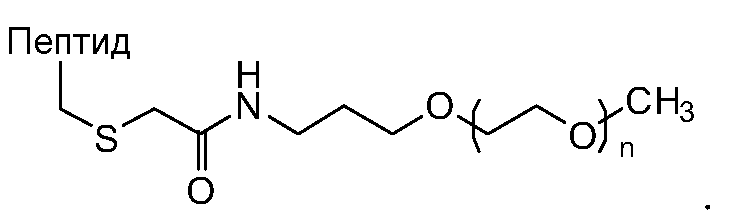
В аналогах, содержащих гидрофильную группу, такой гидрофильной группой может быть любая из описанных здесь групп. Описание можно найти, например, в разделе «Связывание гидрофильных групп». В некоторых вариантах изобретения, гидрофильной группой является полиэтиленгликоль (ПЭГ). В некоторых вариантах изобретения, ПЭГ имеет молекулярную массу примерно 1000-40000 дальтон, например, примерно от 20000 дальтон до 40000 дальтон.
В репрезентативных вариантах изобретения, в которых аналог содержит ацильную или алкильную группу, связанную с аналогом посредством спейсера, указанным спейсером может быть любой из описанных здесь спейсеров. Спейсер может иметь длину, например, в 3-10 атомов, и таким спейсером может быть, например, аминокислота (например, 6-аминогексановая кислота и любая из описанных здесь аминокислот), дипептид (например, Ala-Ala, βAla-βpAla, Leu-Leu, Pro-Pro, γGlu-γGlu), трипептид или гидрофильный или гидрофобный бифункциональный спейсер. В некоторых аспектах изобретения, общая длина спейсера и ацильной или алкильной групп составляет примерно от 14 до 28 атомов. В некоторых вариантах изобретения, аминокислотный спейсер не является γ-Glu. В некоторых вариантах изобретения, дипептидный спейсер не является γ-Glu-γ-Glu.
Ацильной или алкильной группой является любая описанная здесь ацильная или алкильная группа, такая как ацильная или алкильная группа, которая является ненативной для природной аминокислоты. В некоторых вариантах изобретения, ацильной или алкильной группой является жирная C4-C30-ацильная группа, такая как, например, жирная С10-ацильная или алкильная группа, жирная С12-ацильная или алкильная группа, жирная С14-ацильная или алкильная группа, жирная С16-ацильная или алкильная группа, жирная С18-ацильная или алкильная группа, жирная С20-ацильная или алкильная группа, С22-ацильная или алкильная группа или С4-С30-алкильная группа. В конкретных вариантах изобретения, ацильной группой является жирная C12-C18-ацильная группа (например, жирная C14- или C16-ацильная группа).
В некоторых вариантах изобретения, удлинение примерно на 1-21 аминокислоту со стороны C-конца по отношению к аминокислоте в положении 29 в указанном аналоге содержит аминокислотную последовательность GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096), где X представляет собой любую аминокислоту, или GPSSGAPPPK (SEQ ID NO: 1170) или XGPSSGAPPPK (SEQ ID NO: 1171) или XGPSSGAPPPSK (SEQ ID NO: 1172), где X представляет собой Gly или небольшую алифатическую или неполярную или слабополярную аминокислоту. В некоторых вариантах изобретения, последовательность примерно из 1-21 аминокислот может включать последовательности, содержащие одну или несколько консервативных замен по сравнению с SEQ ID NO: 1095, 1096, 1170, 1171 или 1172. В некоторых вариантах изобретения, ацилированная или алкилированная аминокислота находится в положениях 37, 38, 39, 40, 41, 42 или 43 аналога с С-концевым удлинением. В некоторых вариантах изобретения, ацилированная или алкилированная аминокислота находится в положении 40 аналога с C-концевым удлинением.
Агонистом GIP может быть пептид, содержащий любую из аминокислотных последовательностей, например, SEQ ID NN: 1005-1094, включающих, но необязательно, до 1, 2, 3, 4, или 5 дополнительных модификаций, сохраняющих GIP-агонистическую активность. В некоторых вариантах изобретения, агонист GIP содержит аминокислоты любой из SEQ ID NN: 1099-1262.
Родственные глюкагону пептиды класса 3
В некоторых вариантах изобретения, родственным глюкагону пептидом является родственный глюкагону пептид класса 3, описанный в настоящей заявке и в Международной патентной заявке No. PCT/US2009/47438 (поданной 16 июня, 2009), в публикации Международной патентной заявки No. WO 2008/101017, опубликованной 21 августа, 2008, в предварительной заявке на патент США No. 61/090412 и в заявке на патент США No. 61/177476, содержание которых во всей своей полноте вводится в описание настоящей заявки посредством ссылки.
Некоторые биологические последовательности, упомянутые в нижеследующем разделе (SEQ ID NN: 1-656), относящемся к родственным глюкагону пептидам класса 3, соответствуют SEQ ID NN: 1-656, описанным в Международной патентной заявке No. PCT/US2009/47438.
Активность
Родственным глюкагону пептидом класса 3 может быть пептид, обладающий повышенной активностью по отношению к рецептору глюкагона, а в соответствии с другими вариантами изобретения, он обладает повышенной биофизической стабильностью и/или растворимостью в воде. Кроме того, в некоторых вариантах изобретения, родственный глюкагону пептид класса 3, в отличие от нативного глюкагона, обладает специфичностью не только к рецептору глюкагона, но и к рецептору GLP-1, а поэтому, он является двойным агонистом этих двух рецепторов. Выбранные аминокислотные модификации, введенные в родственный глюкагону пептид класса 3, могут регулировать относительную активность пептида к рецептору GLP-1 и к рецептору глюкагона. Таким образом, родственным глюкагону пептидом класса 3 может быть двойной агонист глюкагона/GLP-1, который обладает более высокой активностью по отношению к рецептору глюкагона, чем к рецептору GLP-1; двойной агонист глюкагона/GLP-1, который обладает приблизительно эквивалентной активностью по отношению к обоим рецепторам, или двойной агонист глюкагона/GLP-1, который обладает более высокой активностью по отношению к рецептору GLP-1, чем к рецептору глюкагона. Двойной агонист, принадлежащий к последней категории, может быть сконструирован так, чтобы он обладал незначительной активностью по отношению к рецептору глюкагона, или вообще не обладал активностью по отношению к этому рецептору, но при этом сохранял свою способность активировать рецептор GLP-1 либо на том же уровне, как и нативный GLP-1, либо на более высоком уровне. Любой из этих двойных агонистов может также включать модификации, сообщающие повышенную биофизическую стабильность и/или растворимость в воде.
В родственный глюкагону пептид класса 3 могут быть внесены модификации для получения пептида глюкагона, который обладает по меньшей мере примерно от 1% (включая по меньшей мере примерно 1,5%, 2%, 5%, 7%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175%) до 200% или более активностью по отношению к рецептору GLP-1 по сравнению с нативным GLP-1 и по меньшей мере примерно от 1% (включая примерно 1,5%, 2%, 5%, 7%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175%, 200%, 250%, 300%, 350%, 400%, 450%) до 500% или более активностью по отношению к рецептору глюкагона по сравнению с нативным глюкагоном. Аминокислотной последовательностью нативного глюкагона является SEQ ID NO: 1, аминокислотной последовательностью GLP-1(7-36) в форме амида является SEQ ID NO: 52, а аминокислотной последовательностью GLP-1(7-37) в форме кислоты является SEQ ID NO: 50. В репрезентативных вариантах изобретения, родственный глюкагону пептид класса 3 может обладать по меньшей мере 10% активностью нативного глюкагона по отношению к рецептору глюкагона и по меньшей мере 50% активностью нативного GLP-1 по отношению к рецептору GLP-1, или по меньшей мере 40% активностью нативного глюкагона по отношению к рецептору глюкагона, и по меньшей мере 40% активностью нативного GLP-1 по отношению к рецептору GLP-1, или по меньшей мере 60% активностью нативного глюкагона по отношению к рецептору глюкагона и по меньшей мере 60% активностью нативного GLP-1 по отношению к рецептору GLP-1.
Селективность родственного глюкагону пептида класса 3 к рецептору глюкагона по сравнению с рецептором GLP-1 может быть выражена как отношение глюкагоновой активности/GLP-1-активности (активность данного пептида по отношению к рецептору глюкагона по сравнению с активностью нативного глюкагона, деленная на активность данного пептида по отношению к рецептору GLP-1 по сравнению с активностью с нативным GLP-1). Так, например, родственный глюкагону пептид класса 3, который обладает 60% активностью нативного глюкагона по отношению к рецептору глюкагона и 60% активностью нативного GLP-1 по отношению к рецептору GLP-1, имеет отношение глюкагоновой активности/GLP-1-активности, равное 1:1. Репрезентативными отношениями глюкагоновой активности/GLP-1-активности являются отношения приблизительно 1:1, 1,5:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1, или приблизительно 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2 или 1:1,5. Так, например, отношение глюкагоновой активности/GLP-1-активности, равное 10:1, означает, что специфичность к рецептору глюкагона в 10 раз превышает специфичность к рецептору GLP-1. Аналогичным образом, отношение GLP-1-активности/глюкагоновой активности, равное 10:1, означает, что специфичность к рецептору GLP-1 в 10 раз превышает специфичность к рецептору глюкагона.
В некоторых вариантах изобретения, родственные глюкагону пептиды класса 3 обладают примерно 10% или менее активностью нативного глюкагона по отношению к рецептору глюкагона, например, приблизительно 1-10% или приблизительно 0,1-10%, или более, чем приблизительно 0,1%, но менее, чем примерно 10%, и по меньшей мере 20% от активности GLP-1 по отношению к рецептору GLP-1. Так, например, описанные здесь репрезентативные родственные глюкагону пептиды класса 3 обладают примерно 0,5%, примерно 1% или примерно 7% активностью нативного глюкагона, и по меньшей мере 20% активностью GLP-1 по отношению к рецептору GLP-1.
Родственным глюкагону пептидом класса 3 может быть пептид глюкагона, обладающий повышенной или пониженной активностью по отношению к рецептору глюкагона или к рецептору GLP-1, или к обоим рецепторам. Родственным глюкагону пептидом класса 3 может быть пептид глюкагона с измененной специфичностью к рецептору глюкагона по сравнению с рецептором GLP-1.
Таким образом, настоящее изобретение относится к описанным здесь родственным глюкагону пептидам класса 3 с высокой активностью, которые также обладают улучшенной растворимостью и/или повышенной стабильностью. Репрезентативный родственный глюкагону пептид класса 3 с высокой активностью обладает по меньшей мере примерно 200% активностью нативного глюкагона по отношению к рецептору глюкагона, и необязательно, является растворимым при концентрации по меньшей мере 1 мг/мл при pH 6-8, 6-9 или 7-9 (например, pH 7), и, необязательно сохраняет по меньшей мере 95% активности исходного пептида (например, 5% или менее исходного пептида разлагается или расщепляется) через 24 часа при 25°C. В другом примере, репрезентативный родственный глюкагону пептид класса 3 обладает примерно более, чем 40% или примерно более, чем 60% активностью по отношению к рецепторам глюкагона и к рецепторам GLP-1 (в отношении примерно 1:3 и 3:1, или примерно 1:2 и 2:1), необязательно растворяется при концентрации по меньшей мере 1 мг/мл и при pH 6-8, 6-9 или 7-9 (например, pH 7), и необязательно сохраняет по меньшей мере 95% активность исходного пептида через 24 часа при 25°C. Другой репрезентативный родственный глюкагону пептид класса 3 обладает примерно 175% или более активностью нативного глюкагона по отношению к рецептору глюкагона и примерно 20% или менее активностью нативного GLP-1 по отношению к рецептору GLP-1, необязательно растворяется при концентрации по меньшей мере 1 мг/мл при рН 6-8 или 6-9 или 7-9 (например, при pH 7), и необязательно сохраняет по меньшей мере 95% активность исходного пептида через 24 часа при 25°C. Еще один репрезентативный родственный глюкагону пептид класса 3 обладает примерно 10% или менее активностью нативного глюкагона по отношению к рецептору глюкагона, и по меньшей мере примерно 20% активностью нативного GLP-1 по отношению к рецептору GLP-1, необязательно растворяется при концентрации по меньшей мере 1 мг/мл при pH 6-8, 6-9 или 7-9 (например, при pH 7), и необязательно сохраняет по меньшей мере 95% активность исходного пептида через 24 часа при 25°C. Другой репрезентативный родственный глюкагону пептид класса 3 обладает примерно 10% активностью или менее, но более, чем 0,1%, 0,5% или 1% активностью нативного глюкагона по отношению к рецептору глюкагона, и по меньшей мере примерно 50%, 60%, 70%, 80%, 90% или 100% или более, чем активностью нативного GLP-1 по отношению к рецептору GLP-1, необязательно растворяется при концентрации по меньшей мере 1 мг/мл при рН 6-8, 6-9 или 7-9 (например, pH 7), и необязательно сохраняет по меньшей мере 95% активность исходного пептида через 24 часа при 25°C. В некоторых вариантах изобретения, такие родственные глюкагону пептиды класса 3 сохраняют по меньшей мере 22, 23, 24, 25, 26, 27 или 28 природных аминокислот в положениях, соответствующих положениям в нативном глюкагоне (например, они имеют 1-7, 1-5 или 1-3 модификаций по сравнению с природным глюкагоном).
Модификации, влияющие на глюкагоновую активность
Повышение активности по отношению к рецептору глюкагона может быть достигнуто посредством аминокислотной модификации в положении 16 нативного глюкагона (SEQ ID NO: 1). В некоторых вариантах изобретения, родственным глюкагону пептидом класса 3 является агонист глюкагона, который, по сравнению с пептидом дикого типа His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (SEQ ID NO: 1) был модифицирован для повышения активности пептида по отношению к рецептору глюкагона. Природный серин в положении 16 нативного глюкагона (SEQ ID NO: 1) может быть заменен выбранными кислотными аминокислотами в целях повышения глюкагоновой активности, то есть, для придания ему способности стимулировать синтез cAMP в экспериментальном анализе на модели in vitro (см. пример 5). Более конкретно, такая замена будет приводить по меньшей мере к 2-кратному, 4-кратному, 5-кратному и 10-кратному повышению активности аналога по отношению к рецептору глюкагона. Такая замена также будет приводить по меньшей мере к 5-кратному, 10-кратному или 15-кратному повышению активности аналога по отношению к рецептору GLP-1, в отличие от нативного глюкагона, а специфичность к рецептору глюкагона будет аналогичной специфичности к рецептору GLP-1.
В неограничивающем примере, такое повышение активности может быть достигнуто путем замены природного серина в положении 16 глутаминовой кислотой или другой отрицательно заряженной аминокислотой, имеющей боковую цепь из 4 атомов, или, альтернативно, любой одной из таких аминокислот, как глутамин, гомоглутаминовая кислота или гомоцистеиновая кислота, или заряженной аминокислотой, имеющей боковую цепь, содержащую по меньшей мере один гетероатом (например, N, O, S, P) и боковую цепь длиной в 4 атома (или 3-5 атомов). В соответствии с некоторыми вариантами изобретения, сериновый остаток в положении 16 нативного глюкагона заменяют аминокислотой, выбранной из группы, состоящей из глутаминовой кислоты, глутамина, гомоглутаминовой кислоты, гомоцистеиновой кислоты, треонина или глицина. В соответствии с некоторыми вариантами изобретения, сериновый остаток в положении 16 нативного глюкагона заменяют аминокислотой, выбранной из группы, состоящей из глутаминовой кислоты, глутамина, гомоглутаминовой кислоты и гомоцистеиновой кислоты, а в некоторых вариантах изобретения, сериновый остаток заменяют глутаминовой кислотой.
В некоторых вариантах изобретения, родственный глюкагону пептид класса 3 с повышенной активностью содержит пептид SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7 или аналог агониста глюкагона SEQ ID NO: 5. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к родственному глюкагону пептиду класса 3, который обладает повышенной активностью по отношению к рецептору глюкагона по сравнению с глюкагоном дикого типа, где указанный пептид содержит последовательность SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 10, и где указанный пептид глюкагона сохраняет более высокую специфичность к рецептору глюкагона, чем к рецепторам GLP-1. В некоторых вариантах изобретения, родственный глюкагону пептид класса 3, обладающий более высокой специфичностью к рецептору глюкагона, содержит пептид SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10 или его аналог-агонист глюкагона, где карбокси-концевая амино-кислота сохраняет свою нативную карбоксильную группу. В соответствии с некоторыми вариантами изобретения, родственный глюкагону пептид класса 3 содержит последовательность NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-COOH (SEQ ID NO:10), где указанный пептид обладает активностью по отношению к рецептору глюкагона, которая приблизительно в 10 раз превышает активность нативного глюкагона, как было измерено в in vitro анализе на продуцирование cAMP, описанном в примере 5.
Активность по отношению к рецептору глюкагона может быть снижена, сохранена или повышена путем введения аминокислотной модификации в положение 3, например, замены природного глутамина в положении 3. В некоторых вариантах изобретения было показано, что замена аминокислоты в положении 3 кислотной, основной или гидрофобной аминокислотой (глутаминовой кислотой, орнитином, норлейцином) приводит к значительному снижению или ингибированию активности по отношению к рецептору глюкагона. Аналоги, в которых были сделаны замены, например, глутаминовой кислотой, орнитином или норлейцином, обладают примерно 10% активностью или менее от активности нативного глюкагона по отношению к рецептору глюкагона, например, примерно 1-10% активностью или примерно 0,1-10% активностью, или более, чем примерно 0,1% активностью, но менее чем примерно 10% активностью, и по меньшей мере 20% от активности GLP-1 по отношению к рецептору GLP-1. Так, например, описанные здесь репрезентативные аналоги обладают примерно 0,5% активностью, примерно 1% активностью или примерно 7% активностью нативного глюкагона, и по меньшей мере 20% активностью GLP-1 по отношению к рецептору GLP-1. В частности, любой из описанных здесь родственных глюкагону пептидов класса 3, включая аналоги глюкагона, аналоги агониста глюкагона, совместные агонисты глюкагона и двойные агонисты глюкагона/GLP-1, описанные в настоящей заявке, могут быть модифицированы так, чтобы они содержали модификацию в положении 3, например, замену Gln на Glu, с получением пептида с высокой специфичностью, например, со специфичностью к рецептору GLP-1, которая в 10 раз превышает специфичность к рецептору глюкагона.
В другом варианте изобретения, природный глутамин в положении 3 любого из пептидов глюкагона класса 3 может быть заменен аналогом глутамина без значительной потери активности по отношению к рецептору глюкагона, а в некоторых случаях, с повышением активности по отношению к рецептору глюкагона, как описано в настоящей заявке. В конкретных вариантах изобретения, аминокислота в положении 3 заменена аминокислотой Dab(Ac). Так, например, агонисты глюкагона могут содержать аминокислотные последовательности SEQ ID NO: 595, SEQ ID NO: 601 SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605 и SEQ ID NO: 606.
Было обнаружено, что модификации в положении 2 (например, AIB в положении 2), а в некоторых случаях, модификации в положении 1 могут снижать глюкагоновую активность. Такое снижение глюкагоновой активности может быть восстановлено до исходного уровня путем стабилизации альфа-спирали в C-концевой части глюкагона, например, описанными здесь методами, например, посредством образования ковалентной связи между боковыми цепями аминокислот в положениях «i» и «i+4», например, в положениях 12 и 16, 16 и 20, или 20 и 24. В некоторых вариантах изобретения, такой ковалентной связью является лактамовый мостик между глутаминовой кислотой в положении 16 и лизином в положении 20. В некоторых вариантах изобретения, такой ковалентной связью является внутримолекулярный мостик, а не лактамовый мостик. Так, например, подходящими методами образования ковалентной связи являются одна или несколько реакций, таких как метатезис олефинов, циклизация на основе лантионина, реакция образования дисульфидного мостика или модифицированного мостика, содержащего серу, реакция с использованием α,ω-диаминоалкановых связей, образование мостиков, содержащих атом металла, и другие методы циклизации пептидов.
Модификации, влияющие на GLP-1-активность
Повышенная активность по отношению к рецептору GLP-1 может быть достигнута путем замены карбоксильной группы C-концевой аминокислоты нейтральной группой, такой как амид или сложный эфир. В некоторых вариантах изобретения, эти родственные глюкагону пептиды класса 3 содержат последовательность SEQ ID NO: 20, где карбокси-концевая аминокислота имеет амидную группу вместо карбоксильной группы, присутствующей на нативной аминокислоте. Эти родственные глюкагону пептиды класса 3 обладают высокой активностью по отношению к рецепторам глюкагона и GLP-1, и таким образом, действуют как двойные агонисты обоих рецепторов. В соответствии с некоторыми вариантами изобретения, родственным глюкагону пептидом класса 3 является двойной агонист рецептора глюкагона и рецептора GLP-1, где указанный пептид содержит последовательность SEQ ID NO: 20, где аминокислотой в положении 28 является Asn или Lys, а аминокислотой в положении 29 является Thr-амид.
Повышенная активность по отношению к рецептору GLP-1 может быть достигнута путем модификаций, стабилизирующих альфа-спираль в С-концевой части глюкагона (например, в положениях остатков примерно 12-29).
В некоторых вариантах изобретения, такие модификации способствуют образованию внутримолекулярного мостика между боковыми цепями двух аминокислот, которые разделены тремя встроенными аминокислотами (то есть, аминокислотой в положении «i» и аминокислотой в положении «i+4», где i равно любому целому числу от 12 до 25), двумя встроенными аминокислотами, то есть, аминокислотой в положении «j» и аминокислотой в положении «j+3», где j равно любому целому числу от 12 до 27, или шестью встроенными аминокислотами, то есть, аминокислотой в положении «k» и аминокислотой в положении «k+7», где k равно любому целому числу от 12 до 22. В репрезентативных вариантах изобретения, мостик или линкер имеют длину примерно в 8 атомов (или примерно 7-9 атомов) и образуются между боковыми цепями аминокислот в положениях 12 и 16, в положениях 16 и 20, в положениях 20 и 24, или в положениях 24 и 28. Две аминокислотных боковых цепи могут быть связаны друг с другом посредством нековалентных связей, например, водородных связей, ионных взаимодействий, таких как образование солевых мостиков, или ковалентных связей.
В соответствии с некоторыми вариантами изобретения, родственный глюкагону пептид класса 3 обладает двойной агонистической активностью по отношению к рецептору глюкагона/GLP-1 и содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, 47, 48 и 49. В некоторых вариантах изобретения, боковые цепи ковалентно связаны друг с другом, а в некоторых вариантах изобретения, две аминокислоты связаны друг с другом с образованием лактамового кольца.
В соответствии с некоторыми вариантами изобретения, родственный глюкагону пептид класса 3 содержит последовательность SEQ ID NO: 45, где по меньшей мере одно лактамовое кольцо образуется между боковыми цепями аминокислотных пар, выбранных из группы, состоящей из аминокислотных пар 12 и 16, 16 и 20, 20 и 24 или 24 и 28. В некоторых вариантах изобретения, родственный глюкагону пептид класса 3 содержит аналог пептида глюкагона SEQ ID NO: 20, где указанный пептид содержит внутримолекулярный лактамовый мостик, образующийся между положениями аминокислот 12 и 16 или между положениями аминокислот 16 и 20. В некоторых вариантах изобретения, родственный глюкагону пептид класса 3 содержит последовательность SEQ ID NO: 20, где внутримолекулярный лактамовый мостик образуется между положениями аминокислот 12 и 16, между положениями аминокислот 16 и 20, или между положениями аминокислот 20 и 24, а аминокислотой в положении 29 является глицин, где последовательность SEQ ID NO: 29 связана с С-концевой аминокислотой SEQ ID NO: 20. В другом варианте изобретения, аминокислотой в положении 28 является аспарагиновая кислота.
В некоторых конкретных вариантах изобретения, стабилизация альфа-спиральной структуры в C-концевой части родственного глюкагону пептида класса 3 может быть достигнута посредством образования внутримолекулярного мостика, а не лактамового мостика. Так, например, для стабилизации альфа-спирали могут быть применены подходящие методы ковалентного связывания, включая любые одну или несколько реакций, таких как метатезис олефинов, циклизацию на основе лантионина, образование дисульфидного мостика или модифицированного мостика, содержащего серу, реакцию с использованием α,ω-диаминоалкановых связей, образование мостиков, содержащих атом металла, и другие методы циклизации пептидов.
Кроме того, повышенная активность по отношению к рецептору GLP-1 может быть достигнута путем стабилизации альфа-спиральной структуры в C-концевой части пептида глюкагона (в положениях аминокислот примерно 12-29) посредством соответствующего введения одной или нескольких α,α-дизамещенных аминокислот в положения, которые сохраняют нужную активность. Такие пептиды могут рассматриваться здесь как пептид, не содержащий внутримолекулярного мостика. В некоторых аспектах изобретения, стабилизация альфа-спирали достигается таким способом без введения внутримолекулярного мостика, такого как солевой мостик или ковалентная связь. В некоторых вариантах изобретения, аминокислоты в одном, двух, трех, четырех или более положениях, таких как положения 16, 17, 18, 19, 20, 21, 24 или 29 пептида глюкагона заменены α,α-дизамещенной аминокислотой. Так, например, замена в положении 16 родственного глюкагону пептида класса 3 аминоизомасляной кислотой (AIB), в отсутствии солевого мостика или лактама, приводит к повышению GLP-1-активности. В некоторых вариантах изобретения, аминокислоты в одном, двух, трех или более положениях 16, 20, 21 или 24 заменены AIB.
Повышенная активность по отношению к рецептору GLP-1 может быть достигнута путем аминокислотной модификации в положении 20. В некоторых вариантах изобретения, глутамин в положении 20 заменяют другой гидрофильной аминокислотой, имеющей боковую цепь, которая является заряженной или обладает способностью образовывать водородную связь, и имеет длину по меньшей мере примерно 5 атомов (или примерно 4-6 атомов), например, такими аминокислотами являются лизин, цитруллин, аргинин или орнитин.
Повышенная активность по отношению к рецептору GLP-1 была продемонстрирована у родственных глюкагону пептидов класса 3, содержащих С-концевое удлинение SEQ ID NO: 26. GLP-1-активность таких родственных глюкагону пептидов, содержащих SEQ ID NO: 26, может быть еще больше увеличена путем модификации аминокислоты в положении 18, 28 или 29, или в положении 18 и 29, как описано в настоящей заявке.
Несколько меньшее увеличение GLP-1-активности может быть достигнуто путем замены аминокислоты в положении 10 аминокислотой Trp.
Комбинации модификаций, повышающих активность по отношению к рецептору GLP-1, могут давать более высокую GLP-1-активность, чем любая из этих модификаций, введенных отдельно. Так, например, родственные глюкагону пептиды класса 3 могут содержать модификации в положении 16, в положении 20, и у C-концевой карбоксильной группы, необязательно, с ковалентной связью между аминокислотами в положениях 16 и 20; модификации в положении 16 и у С-концевой карбоксильной группы; модификации в положениях 16 и 20, необязательно, с ковалентной связью между аминокислотами в положениях 16 и 20; или модификации в положении 20 и у С-концевой карбоксильной группы; необязательно, при условии, что аминокислота в положении 12 не является Arg; или, необязательно, при условии, что аминокислота в положении 9 не является Glu.
Модификации, влияющие на растворимость
Присоединение гидрофильных групп
Родственные глюкагону пептиды класса 3 могут быть также модифицированы в целях повышения растворимости и стабильности пептидов в водных растворах при физиологическом pH и повышения биологической активности по сравнению с нативным глюкагоном. Обсуждаемые здесь гидрофильные группы могут быть присоединены к родственному глюкагону пептиду класса 3 как описано в настоящей заявке.
В соответствии с некоторыми вариантами изобретения предполагается, что введение гидрофильных групп в положениях 17, 21 и 24 родственного глюкагону пептида класса 3, содержащего SEQ ID NO: 9 или SEQ ID NO: 10, будет приводить к повышению растворимости и стабильности аналога глюкагона с высокой активностью в растворах, имеющих физиологический pH. Введение таких групп также будет приводить к увеличению продолжительности действия, как было определено по увеличению времени полужизни в кровотоке.
В некоторых вариантах изобретения, родственный глюкагону пептид класса 3 содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, где боковая цепь аминокислотного остатка в одном из положений 16, 17, 21 или 24 указанного родственного глюкагону пептида класса 3 также содержит полиэтиленгликолевую цепь, имеющую молекулярную массу примерно 500-40000 дальтон. В некоторых вариантах изобретения, полиэтиленгликолевая цепь имеет молекулярную массу примерно 500-5000 дальтон. В другом варианте изобретения, полиэтиленгликолевая цепь имеет молекулярную массу примерно 10000-20000 дальтон. В других репрезентативных вариантах изобретения, полиэтиленгликолевая цепь имеет молекулярную массу примерно 20000-40000 дальтон.
Подходящими гидрофильными группами являются любые водорастворимые полимеры, известные специалистам, включая описанные здесь гидрофильные группы, гомо- или сополимеры ПЭГ и монометил-замещенный полимер ПЭГ (мПЭГ). В соответствии с некоторыми вариантами изобретения, гидрофильная группа содержит полиэтиленовую (ПЭГ) цепь. Более конкретно, в некоторых вариантах изобретения, родственный глюкагону пептид класса 3 содержит последовательность SEQ ID NO: 6 или SEQ ID NO: 7, где ПЭГ-цепь ковалентно связана с боковыми цепями аминокислот, присутствующих в положениях 21 и 24 родственного глюкагону пептида класса 3, а карбокси-концевая аминокислота родственного глюкагону пептида класса 3 имеет карбоксильную группу. В соответствии с некоторыми вариантами изобретения, полиэтиленгликолевая цепь имеет среднюю молекулярную массу примерно 500-10000 дальтон.
В соответствии с некоторыми вариантами изобретения, ПЭГилированный родственный глюкагону пептид класса 3 содержит две или более полиэтиленгликолевых цепи, ковалентно связанных с родственным глюкагону пептидом класса 3, где общая молекулярная масса глюкагоновых цепей составляет примерно от 1000 до 5000 дальтон. В некоторых вариантах изобретения, ПЭГилированный агонист глюкагона содержит пептид, состоящий из SEQ ID NO: 5 или аналога агониста глюкагона SEQ ID NO: 5, где ПЭГ-цепь ковалентно связана с аминокислотным остатком в положении 21 и в положении 24, и где общая молекулярная масса двух ПЭГ-цепей составляет примерно 1000-5000 дальтон.
Заряженный С-конец
Растворимость родственного глюкагону пептида класса 3, содержащего SEQ ID NO: 20, может быть значительно повышена, например, путем введения одной, двух, трех или более заряженных аминокислот в С-концевую часть пептида глюкагона SEQ ID NO: 20, предпочтительно, в положении со стороны С-конца по отношению к положению 27. Такая заряженная аминокислота может быть введена путем замены нативной аминокислоты заряженной аминокислотой, например, в положениях 28 или 29, или альтернативно, путем добавления заряженной аминокислоты, например, за положениями 27, 28 или 29. В репрезентативных вариантах изобретения, одна, две, три или все заряженные аминокислоты являются отрицательно заряженными аминокислотами. В родственный глюкагону пептид класса 3 могут быть внесены дополнительные модификации, например, консервативные замены, в целях сохранения глюкагоновой активности. В некоторых своих вариантах, настоящее изобретение относится к аналогу родственного глюкагону пептида класса 3 SEQ ID NO:20, где указанный аналог отличается от последовательности SEQ ID NO: 20 тем, что он имеет 1 или 2 аминокислотных замены в положениях 17-26, а в некоторых вариантах изобретения, такой аналог отличается от пептида SEQ ID NO: 20 тем, что он имеет аминокислотную замену в положении 20.
Ацилирование/Алкилирование
В соответствии с некоторыми вариантами изобретения, пептид глюкагона модифицируют так, чтобы он содержал ацильную или алкильную группу, например, C4-C30-ацильную или алкильную группу. В некоторых аспектах изобретения, ацильная группа или алкильная группа не присутствуют на аминокислоте. В конкретных аспектах изобретения, ацильная или алкильная группа является ненативной для любой природной аминокислоты. Ацилирование или алкилирование может приводить к увеличению времени полужизни в кровотоке и/или к замедлению начала действия и/или к увеличению продолжительности действия и/или к повышению резистентности к протеазам, таким как DPP-IV. После ацилирования, активность родственных глюкагону пептидов класса 3 по отношению к рецептору глюкагона и рецептору GLP-1 сохраняется, а иногда даже значительно повышается. Кроме того, активность ацилированных аналогов сравнима с активностью неацилированных вариантов родственных глюкагону пептидов класса 3, а иногда, ацилированные аналоги обладают активностью, превышающей активность неацилированных вариантов.
В некоторых своих вариантах, настоящее изобретение относится к родственному глюкагону пептиду класса 3, модифицированному так, чтобы он содержал ацильную группу или алкильную группу, ковалентно связанную с аминокислотой в положении 10 пептида глюкагона. Пептид глюкагона может дополнительно содержать спейсер, расположенный между аминокислотой в положении 10 родственного пептиду глюкагона класса 3 и ацильной группой или алкильной группой. Любой из вышеуказанных родственных пептиду глюкагонов класса 3 может содержать две ацильных или две алкильных группы или их комбинацию.
В конкретном аспекте изобретения, ацилированный родственный глюкагону пептид класса 3 содержит любую из аминокислотных последовательностей SEQ ID NN: 534-544 и 546-549.
С-концевое усечение
В некоторых вариантах изобретения, описанные здесь родственные глюкагону пептиды класса 3 дополнительно модифицируют путем усечения или делеции одной или двух аминокислот у C-конца пептида глюкагона (то есть, в положении 29 и/или 28) так, чтобы это не влияло на активность и/или эффективность по отношению к рецепторам глюкагона и GLP-1. В соответствии с этим, родственный глюкагону пептид класса 3 может содержать аминокислоты 1-27 или 1-28 нативного пептида глюкагона (SEQ ID NO: 1), необязательно, с одной или несколькими описанными здесь модификациями.
В некоторых вариантах изобретения, усеченный родственный глюкагону пептид класса 3 содержит SEQ ID NO: 550 или SEQ ID NO: 551. В другом варианте изобретения, усеченный пептид-агонист глюкагона содержит SEQ ID NO: 552 или SEQ ID NO: 553.
С-концевое удлинение
В соответствии с некоторыми вариантами изобретения, описанные здесь родственные глюкагону пептиды класса 3 модифицируют путем присоединения второго пептида к карбокси-концу пептида глюкагона, например, SEQ ID NO: 26, SEQ ID NO: 27 или SEQ ID NO: 28. В некоторых вариантах изобретения, родственный глюкагону пептид класса 3, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68 и SEQ ID NO: 69, ковалентно связан посредством пептидной связи со вторым пептидом, где указанный второй пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. В другом варианте изобретения, в родственных глюкагону пептидах класса 3, которые содержат C-концевое удлинение, треонин в положении 29 нативного пептида глюкагона заменен глицином. Родственный глюкагону пептид класса 3, в котором треонин заменен глицином в положении 29, и который был модифицирован так, что он содержит карбокси-концевое удлинение SEQ ID NO: 26, обладает активностью по отношению к рецептору GLP-1, которая в четыре раза превышает активность нативного глюкагона по отношению к этому рецептору. Активность по отношению к рецептору GLP-1 может быть дополнительно увеличена путем замены нативного аргинина аланином в положении 18.
В соответствии с этим, родственный глюкагону пептид класса 3 может иметь карбокси-концевое удлинение SEQ ID NO: 27 (KRNRNNIA) или SEQ ID NO: 28. В соответствии с некоторыми вариантами изобретения, родственный глюкагону пептид класса 3, содержащий SEQ ID NO: 33 или SEQ ID NO: 20, также содержит аминокислотную последовательность SEQ ID NO: 27 (KRNRNNIA) или SEQ ID NO: 28, связанные с аминокислотой 29 пептида глюкагона. Более конкретно, родственный глюкагону пептид класса 3 содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15, а также аминокислотную последовательность SEQ ID NO: 27 (KRNRNNIA) или SEQ ID NO: 28, связанные с аминокислотой 29 пептида глюкагона. Более конкретно, пептид глюкагона содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 55 и SEQ ID NO: 56, а также аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPPS) или SEQ ID NO: 29, связанные с аминокислотой 29 родственного глюкагону пептида класса 3. В некоторых вариантах изобретения, родственный глюкагону пептид класса 3 содержит последовательность SEQ ID NO: 64.
Другие модификации
Любая из вышеописанных модификаций, которые были введены в родственные глюкагону пептиды класса 3, и которые приводят к повышению или снижению активности по отношению к рецептору глюкагона и к повышению активности по отношению к рецептору GLP-1, могут быть введены отдельно или в комбинации. Комбинации модификаций, повышающих активность по отношению к рецептору GLP-1, в основном, дают более высокую GLP-1-активность, чем любая из таких модификаций, введенных отдельно. Любая из вышеописанных модификаций, внесенных в родственные глюкагону пептиды класса 3, может быть также введена в комбинации с другими описанными здесь модификациями, в целях сообщения других нужных свойств, таких как повышенная растворимость и/или стабильность, и/или увеличенная продолжительность действия. Альтернативно, любая из вышеописанных модификаций, вводимых в родственные глюкагону пептиды класса 3, может быть также объединена с другими описанными здесь модификациями так, чтобы это, в основном, не влияло на растворимость, стабильность или активность. Репрезентативными модификациями являются, но не ограничиваются ими:
(A) Повышение стабильности, достигаемое, например, путем введения одной, двух, трех или более заряженных аминокислот в C-концевую часть нативного глюкагона, предпочтительно, в положении со стороны C-конца по отношению к положению 27. Такая заряженная аминокислота может быть введена путем замены нативной аминокислоты заряженной аминокислотой, например, в положениях 28 или 29, или альтернативно, путем добавления заряженной аминокислоты, например, за положениями 27, 28 или 29. В репрезентативных вариантах изобретения, одна, две, три или все заряженные аминокислоты являются отрицательно заряженными. В других вариантах изобретения, одна, две, три или все заряженные аминокислоты являются положительно заряженными. Такие модификации приводят к повышению растворимости, например, по меньшей мере в 2 раза, в 5 раз, в 10 раз, в 15 раз, в 25 раз, в 30 раз или более по сравнению с растворимостью нативного глюкагона при pH примерно 5,5-8, например, при pH 7, как было измерено через 24 часа при 25°C.
(B) Повышение растворимости и увеличение продолжительности действия или времени полужизни в кровотоке, достигаемое путем добавления гидрофильной группы, такой как полиэтиленгликолевая цепь, описанная в настоящей заявке, например, в положении 16, 17, 20, 21, 24 или 29, или у С-концевой аминокислоты пептида.
(C) Повышение стабильности, достигаемое путем модификации аспарагиновой кислоты в положении 15, например, путем делеции или замены глутаминовой кислотой, гомоглутаминовой кислотой, цистеиновой кислотой или гомоцистеиновой кислотой. Такие модификации могут снижать степень разложения или расщепления при pH в пределах 5,5-8, а особенно, в кислотных или основных буферах, и, например, сохраняют по меньшей мере 75%, 80%, 90%, 95%, 96%, 97%, 98% или 99% активности исходного пептида через 24 часа при 25°C.
(D) Повышение стабильности, достигаемое путем модификации метионина в положении в положении 27, например, путем замены лейцином или норлейцином. Такие модификации могут снижать степень окислительного разложения. Стабильность может быть также повышена путем модификации Gln в положении 20 или 24, например, путем замены аминокислотами Ser, Thr, Ala или AIB. Такие модификации могут снижать степень разложения, обусловленного дезамидированием Gln. Стабильность может быть повышена путем модификации Asp в положении 21, например, путем замены на Glu. Такие модификации могут снижать степень разложения, обусловленного дегидратацией Asp с образованием циклического сукцинимидного промежуточного соединения с последующей его изомеризацией в изоаспартат.
(E) Повышение резистентности к расщеплению дипептидил-пептидазой IV (DPP IV), достигаемое путем замены аминокислоты в положении 1 или 2 описанными здесь DPP-IV-резистентными аминокислотами и замены аминокислоты в положении 2 аминокислотой N-метилаланином.
(F) Консервативные или неконсервативные замены, добавления или делеции, которые не влияют на активность, например, консервативные замены в одном или нескольких положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29; делеции в одном или нескольких положениях 27, 28 или 29; или делеция аминокислоты 29, необязательно, в комбинации с C-концевым амидом или сложным эфиром вместо C-концевой карбоксильной группы.
(G) Добавление С-концевых удлинений, описанных в настоящей заявке.
(H) Увеличение времени полужизни в кровотоке и/или увеличение продолжительности действия и/или замедление начала действия, достигаемое, например, посредством описанного здесь ацилирования или алкилирования пептида глюкагона.
(I) Гомодимеризация или гетеродимеризация, описанные в настоящей заявке.
Другими модификациями являются замена His в положении 1 крупной ароматической аминокислотой (например, Tyr, Phe, Trp или амино-Phe); замена Ser в положении 2 на Ala; замена Tyr в положении 10 на Val или Phe; замена Lys в положении 12 на Arg; замена Asp в положении 15 на Glu; замена Ser в положении 16 на Thr или AIB.
Родственные глюкагону пептиды класса 3, которые обладают GLP-1-активностью и которые имеют неконсервативную замену His в положении 1 крупной ароматической аминокислотой (например, Tyr), могут сохранять GLP-1-активность, при условии, что альфа-спираль будет стабилизирована посредством внутримолекулярного мостика, такого как любой из описанных здесь мостиков.
Конъюгаты и гибриды
Родственный глюкагону пептид класса 3 может быть связан с частью конъюгата, необязательно, посредством ковалентной связи, и, необязательно, посредством линкера.
Родственный глюкагону пептид класса 3 может быть также частью гибридного пептида или белка, где второй пептид или полипептид был присоединен к концу, например, к карбокси-концу родственного глюкагону пептида класса 3.
Более конкретно, гибридный родственный глюкагону пептид класса 3 может содержать агонист глюкагона SEQ ID NO: 55, SEQ ID NO: 9 или SEQ ID NO: 10, а также аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPPS), SEQ ID NO: 27 (KRNRNNIA) или SEQ ID NO: 28 (KRNR), связанные с аминокислотой 29 пептида глюкагона. В некоторых вариантах изобретения, аминокислотная последовательность SEQ ID NO: 26 (GPSSGAPPPS), SEQ ID NO: 27 (KRNRNNIA) или SEQ ID NO: 28 (KRNR) связана с аминокислотой 29 родственного глюкагону пептида класса 3 посредством пептидной связи. Авторами настоящего изобретения было также обнаружено, что в гибридных родственных глюкагону пептидах класса 3, содержащих пептид экзендина-4 с С-концевым удлинением (например, SEQ ID NO: 26 или SEQ ID NO: 29), замена нативного треонинового остатка в положении 29 глицином приводит к резкому повышению активности по отношению к рецептору GLP-1. Такая аминокислотная замена может быть введена в родственные глюкагону пептиды класса 3 в комбинации с другими описанными здесь модификациями для повышения аффинности аналогов глюкагона по отношению к рецептору GLP-1. Так, например, замена T29G может быть объединена с аминокислотными заменами S16E и N20K, необязательно, с образованием лактамового мостика между аминокислотами 16 и 20, и, необязательно, с добавлением ПЭГ-цепи, описанной в настоящей заявке. В некоторых вариантах изобретения, родственный глюкагону пептид класса 3 содержит последовательность SEQ ID NO: 64. В некоторых вариантах изобретения, часть родственного глюкагону пептида класса 3, входящая в состав гибридного пептида глюкагона, выбрана из группы, состоящей из SEQ ID NO: 55, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5, где ПЭГ-цепь, если она присутствует в положениях 17, 21, 24, или у C-концевой аминокислоты, или в положениях 21 и 24, имеет молекулярную массу в пределах 500-40000 дальтон. Более конкретно, в некоторых вариантах изобретения, сегмент родственного глюкагону пептида класса 3 выбран из группы, состоящей из SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 63, где ПЭГ-цепь имеет молекулярную массу в пределах 500-5000 дальтон. В некоторых вариантах изобретения, родственным глюкагону пептидом класса 3 является гибридный пептид, содержащий последовательности SEQ ID NO: 55 и SEQ ID NO: 65, где пептид SEQ ID NO: 65 связан с карбокси-концом SEQ ID NO: 55.
В соответствии с некоторыми вариантами изобретения, дополнительная химическая модификация родственного глюкагону пептида класса 3 SEQ ID NO: 10 приводит к повышению активности по отношению к рецептору GLP-1 до того уровня, при котором отношение активности по отношению к рецепторам глюкагона и GLP-1 становится фактически эквивалентным. В соответствии с этим, в некоторых вариантах изобретения, родственный глюкагону пептид класса 3 содержит концевую аминокислоту, содержащую амидную группу вместо карбоксильной группы, присутствующей на нативной аминокислоте. Отношение активности родственного глюкагону пептида класса 3 по отношению к соответствующим рецепторам глюкагона и GLP-1 может быть скорректировано путем внесения дополнительных модификаций в родственный глюкагону пептид класса 3, с получением аналогов, обладающих примерно 40%-500% или более активностью нативного глюкагона по отношению к рецептору глюкагона, и примерно 20%-200% или более активностью нативного GLP-1 по отношению к рецептору GLP-1, например, активностью, которая в 50 раз, в 100 раз или более превышает активность нативного глюкагона по отношению к рецептору GLP-1. В некоторых вариантах изобретения, описанные здесь пептиды глюкагона обладают активностью, которая составляет примерно до 100%, 1000%, 10000%, 100000% или 1000000% от активности нативного глюкагона по отношению к рецептору глюкагона. В некоторых вариантах изобретения, описанные здесь пептиды глюкагона обладают активностью, которая составляет примерно до 100%, 1000%, 10000%, 100000% или 1000000% от активности нативного GLP-1 по отношению к рецептору GLP-1.
Репрезентативные варианты изобретения
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к аналогу глюкагона, содержащему последовательность SEQ ID NO: 55, где указанный аналог отличается от последовательности SEQ ID NO: 55 на 1-3 аминокислоты, выбранных из аминокислот в положениях 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21, 24, 27, 28 и 29, и где указанный пептид глюкагона обладает по меньшей мере 20% активностью нативного GLP-1 по отношению к рецептору GLP-1.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к двойному агонисту рецептора глюкагона/GLP-1, содержащему последовательность:
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Asp-Phe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 33), где Xaa в положении 15 выбрана из группы аминокислот, состоящей из Asp, Glu, цистеиновой кислоты, гомоглутаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 16 выбрана из группы аминокислот, состоящей из Ser, Glu, Gln, гомоглутаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 20 представляет собой Gln или Lys, Xaa в положении 24 представляет собой Gln или Glu, Xaa в положении 28 представляет собой Asn, Lys или кислотную аминокислоту, Xaa в положении 29 представляет собой Thr, Gly или кислотную аминокислоту, а R представляет собой COOH или CONH2, при условии, что если аминокислотой в положении 16 является серин, то аминокислотой в положении 20 является Lys, или альтернативно, если аминокислотой в положении 16 является серин, то аминокислотой в положении 24 является Glu, а аминокислотой в положении 20 или в положении 28 является Lys. В некоторых вариантах изобретения, двойной агонист рецептора глюкагона/GLP-1 содержит последовательность SEQ ID NO: 33, где аминокислотой в положении 28 является аспарагиновая кислота, а аминокислотой в положении 29 является глутаминовая кислота. В другом варианте изобретения, аминокислотой в положении 28 является нативный аспарагин, аминокислотой в положении 29 является глицин, а аминокислотная последовательность SEQ ID NO: 29 или SEQ ID NO: 65 ковалентно связана с карбокси-концом SEQ ID NO: 33.
В некоторых своих вариантах, настоящее изобретение относится к двойному агонисту, содержащему последовательность SEQ ID NO: 33, где дополнительная кислотная аминокислота добавлена к карбокси-концу пептида. В другом варианте изобретения, карбокси-концевая аминокислота аналога глюкагона имеет амид вместо карбоксильной группы природной аминокислоты. В некоторых вариантах изобретения, аналог глюкагона содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 и SEQ ID NO: 44.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к аналогу пептида глюкагона SEQ ID NO: 33, где указанный аналог отличается от SEQ ID NO: 33 на 1-3 аминокислоты, выбранных из аминокислот в положениях 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21 и 27, при условии, что если аминокислотой в положении 16 является серин, то аминокислотой в положении 20 является лизин или лактамовый мостик, образующийся между аминокислотой в положении 24 и аминокислотой в положении 20 или в положении 28. В соответствии с некоторыми вариантами изобретения, аналог отличается от SEQ ID NO: 33 на 1-3 аминокислоты, выбранных из аминокислот в положениях 1, 2, 3, 21 и 27. В некоторых вариантах изобретения, аналог пептида глюкагона SEQ ID NO: 33 отличается от этой последовательности 1-2 аминокислотами, или, в некоторых вариантах изобретения, одной аминокислотой в положениях 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21 и 27, при условии, что если аминокислотой в положении 16 является серин, то аминокислотой в положении 20 является лизин или лактамовый мостик, образующийся между аминокислотой в положении 24 и любой аминокислотой в положении 20 или в положении 28.
В соответствии с другим своим вариантом, настоящее изобретение относится к относительно селективному агонисту рецептора GLP-1, содержащему последовательность NH2-His-Ser-Xaa-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Asp-Phe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 53), где Xaa в положении 3 выбрана из группы аминокислот, состоящей из Glu, Orn или Nle, Xaa в положении 15 выбрана из группы аминокислот, состоящей из Asp, Glu, цистеиновой кислоты, гомоглутаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 16 выбрана из группы аминокислот, состоящей из Ser, Glu, Gln, гомоглутаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 20 представляет собой Gln или Lys, Xaa в положении 24 представляет собой Gln или Glu, Xaa в положении 28 представляет собой Asn, Lys или кислотную аминокислоту, Xaa в положении 29 представляет собой Thr, Gly или кислотную аминокислоту, а R представляет собой COOH, CONH2, SEQ ID NO: 26 или SEQ ID NO: 29, при условии, что если аминокислотой в положении 16 является серин, то аминокислотой в положении 20 является Lys, или альтернативно, если аминокислотой в положении 16 является серин, то аминокислотой в положении 24 является Glu, а аминокислотой в положении 20 или в положении 28 является Lys. В некоторых вариантах изобретения, аминокислотой в положении 3 является глутаминовая кислота. В некоторых вариантах изобретения, замененными кислотными аминокислотами в положении 28 и/или 29 является аспарагиновая кислота или глутаминовая кислота. В некоторых вариантах изобретения, пептид глюкагона, включая пептид, который является двойным агонистом, содержит последовательность SEQ ID NO: 33, которая также включает дополнительную кислотную аминокислоту, добавленную к карбокси-концу пептида. В другом варианте изобретения, карбокси-концевая аминокислота аналога глюкагона имеет амид вместо карбоксильной группы природной аминокислоты.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к двойному агонисту рецептора глюкагона/GLP-1, включающему модифицированный пептид глюкагона, выбранный из группы, состоящей из: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Asp-Phe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 34), где Xaa в положении 15 выбрана из группы аминокислот, состоящей из Asp, Glu, цистеиновой кислоты, гомоглутаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 16 выбрана из группы аминокислот, состоящей из Ser, Glu, Gln, гомоглутаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 20 представляет собой Gln или Lys, Xaa в положении 24 представляет собой Gln или Glu, а Xaa в положении 28 представляет собой Asn, Asp или Lys, R представляет собой COOH или CONH2, Xaa в положении 29 представляет собой Thr или Gly, а R представляет собой COOH, CONH2, SEQ ID NO: 26 или SEQ ID NO: 29, при условии, что аминокислотой в положении 16 является серин, аминокислотой в положении 20 является Lys, или альтернативно, если аминокислотой в положении 16 является серин, то аминокислотой в положении 24 является Glu, а аминокислотой в положении 20 или в положении 28 является Lys. В некоторых вариантах изобретения, R представляет собой CONH2, Xaa в положении 15 представляет собой Asp, Xaa в положении 16 выбрана из группы аминокислот, состоящей из Glu, Gln, гомоглутаминовой кислоты и гомоцистеиновой кислоты, каждая из Xaa в положениях 20 и 24 представляет собой Gln, Xaa в положении 28 представляет собой Asn или Asp, а Xaa в положении 29 представляет собой Thr. В некоторых вариантах изобретения, каждая из Xaa в положениях 15 и 16 представляет собой Glu, каждая из Xaa в положениях 20 и 24 представляет собой Gln, Xaa в положении 28 представляет собой Asn или Asp, Xaa в положении 29 представляет собой Thr, а R представляет собой CONH2.
Сообщалось, что некоторые положения нативного пептида глюкагона могут быть модифицированы с сохранением по меньшей мере некоторой активности родительского пептида. В соответствии с этим, авторами настоящего изобретения было высказано предположение, что одна или несколько аминокислот, расположенных в положениях 2, 5, 7, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29 пептида SEQ ID NO:11, могут быть заменены аминокислотой, отличающейся от аминокислоты, присутствующей в нативном пептиде глюкагона, но при этом, сохраняют активность по отношению к рецептору глюкагона. В некоторых вариантах изобретения, метиониновый остаток, присутствующий в положении 27 нативного пептида, заменяют лейцином или норлейцином в целях предупреждения окислительного разложения пептида. В другом варианте изобретения, аминокислота в положении 20 заменена Lys, Arg, Orn или цитруллином и/или аминокислота в положении 21 заменена Glu, гомоглутаминовой кислотой или гомоцистеиновой кислотой.
В некоторых своих вариантах, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 20, где 1-6 аминокислот, выбранных из аминокислот в положениях 1, 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21, 27, 28 или 29 данного аналога, отличаются от соответствующей аминокислоты SEQ ID NO: 1, при условии, что аминокислотой в положении 16 является серин, аминокислотой в положении 20 является Lys, или альтернативно, если аминокислотой в положении 16 является серин, то аминокислотой в положении 24 является Glu, а аминокислотой в положении 20 или в положении 28 является Lys. В соответствии с другим своим вариантом, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 20, где 1-3 аминокислот, выбранных из аминокислот в положениях 1, 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 20, 21, 27, 28 или 29 данного аналога, отличаются от соответствующей аминокислоты SEQ ID NO: 1. В другом своем варианте, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 11, где 1 или 2 аминокислоты, выбранных из аминокислот в положениях 1, 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 20 или 21 данного аналога, отличаются от соответствующей аминокислоты SEQ ID NO: 1, а в другом варианте изобретения, одна или две других аминокислоты, в отличие от аминокислоты, присутствующей в нативной последовательности глюкагона (SEQ ID NO: 1), представляют собой консервативные аминокислотные замены. В некоторых своих вариантах, настоящее изобретение относится к пептиду глюкагона SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, где указанный пептид глюкагона также содержит одну, две или три аминокислотных замены в положениях, выбранных из положений 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 20, 21, 27 или 29. В некоторых вариантах изобретения, заменами в положениях 2, 5, 7, 10, 11, 13, 14, 16, 17, 18, 19, 20, 21, 27 или 29 являются консервативные аминокислотные замены.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к двойному агонисту рецептора глюкагона /GLP-1, содержащему вариант последовательности SEQ ID NO 33, где 1-10 аминокислот, выбранных из аминокислот в положениях 16, 17, 18, 20, 21, 23, 24, 27, 28 и 29 данного варианта, соответственно, отличаются от соответствующей аминокислоты SEQ ID NO: 1. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к варианту последовательности SEQ ID NO 33, где указанный вариант отличается от SEQ ID NO: 33 одной или несколькими аминокислотными заменами, выбранными из группы, состоящей из Gln17, Ala18, Glu21, Ile23, Ala24, Val27 и Gly29. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к двойному агонисту рецептора глюкагона/GLP-1, содержащему варианты последовательности SEQ ID NO 33, где 1 или 2 аминокислоты, выбранных из аминокислот в положениях 17-26 данного варианта, отличаются от соответствующей аминокислоты SEQ ID NO: 1. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к варианту последовательности SEQ ID NO 33, где указанный вариант отличается от SEQ ID NO: 33 аминокислотной заменой, выбранной из группы, состоящей из Gln17, Ala18, Glu21, Ile23 и Ala24. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к варианту последовательности SEQ ID NO 33, где указанный вариант отличается от SEQ ID NO: 33 аминокислотной заменой в положении 18, где указанная замененная аминокислота выбрана из группы, состоящей из Ala, Ser, Thr и Gly. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к варианту SEQ ID NO 33, где указанный вариант отличается от SEQ ID NO: 33 аминокислотной заменой Ala в положении 18. Такие варианты охватывают последовательность SEQ ID NO: 55. В другом своем варианте, настоящее изобретение относится к двойному агонисту рецептора глюкагона/GLP-1, содержащему варианты последовательности SEQ ID NO 33, где 1-2 аминокислоты, выбранные из аминокислот в положениях 17-22 указанного варианта, отличаются от соответствующей аминокислоты SEQ ID NO: 1, а в другом своем варианте, настоящее изобретение относится к варианту SEQ ID NO 33, где указанный вариант отличается от SEQ ID NO: 33 одной или двумя аминокислотными заменами в положениях 20 и 21. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к двойному агонисту рецептора глюкагона/GLP-1, содержащему последовательность: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Xaa-Phe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 51), где Xaa в положении 15 представляет собой Asp, Glu, цистеиновую кислоту, гомоглутаминовую кислоту или гомоцистеиновую кислоту, Xaa в положении 16 представляет собой Ser, Glu, Gln, гомоглутаминовую кислоту или гомоцистеиновую кислоту, Xaa в положении 20 представляет собой Gln, Lys, Arg, Orn или цитруллин, где Xaa в положении 21 представляет собой Asp, Glu, гомоглутаминовую кислоту или гомоцистеиновую кислоту, Xaa в положении 24 представляет собой Gln или Glu, Xaa в положении 28 представляет собой Asn, Lys или кислотную аминокислоту, Xaa в положении 29 представляет собой Thr или кислотную аминокислоту, а R представляет собой COOH или CONH2. В некоторых вариантах изобретения, R представляет собой CONH2. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к двойному агонисту рецептора глюкагона/GLP-1, содержащему вариант SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 47, SEQ ID NO: 48 или SEQ ID NO: 49, где указанный вариант отличается от указанной последовательности аминокислотной заменой в положении 20. В некоторых вариантах изобретения, аминокислотная замена выбрана из группы, состоящей из замен аминокислот Lys, Arg, Orn или цитруллина в положении 20.
В некоторых своих вариантах, настоящее изобретение относится к агонисту глюкагона, содержащему аналог пептида SEQ ID NO: 34, где указанный аналог отличается от SEQ ID NO: 34 тем, что он имеет аминокислоту в положении 2, не являющуюся серином. В некоторых вариантах изобретения, сериновый остаток заменен аминоизомасляной кислотой, D-аланином, а в некоторых вариантах изобретения, сериновый остаток заменен аминоизомасляной кислотой. Такие модификации ингибируют расщепление дипептидилпептидазой IV, но не влияют на природную активность родительского соединения (например, сохраняют по меньшей мере 75, 80, 85, 90, 95% или более активности родительского соединения). В некоторых вариантах изобретения, растворимость аналога может быть увеличена, например, путем введения одной, двух, трех или более заряженных аминокислот в C-концевую часть нативного глюкагона, а предпочтительно, в положение со стороны С-конца по отношению к положению 27. В репрезентативных вариантах изобретения, одна, две, три или все заряженные аминокислоты являются отрицательно заряженными. В другом варианте изобретения, указанный аналог также имеет замену нативной аминокислоты в положении 28 или 29 кислотной аминокислотой, или кислотную аминокислоту, добавленную к карбокси-концу пептида SEQ ID NO: 34.
В некоторых вариантах изобретения, описанные здесь аналоги глюкагона дополнительно модифицируют в положении 1 или 2 для снижения чувствительности к расщеплению дипептидил-пептидазой IV. В некоторых своих вариантах, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, где указанный аналог отличается от родительской молекулы тем, что он имеет замену в положении 2 и обладает пониженной чувствительностью (то есть, резистентностью) к расщеплению дипептидил-пептидазой IV. Более конкретно, в некоторых вариантах изобретения, аминокислота в положении 2 пептидного аналога заменена аминокислотой, выбранной из группы, состоящей из D-серина, D-аланина, валина, амино-N-масляной кислоты, глицина, N-метилсерина и аминоизомасляной кислоты. В некоторых вариантах изобретения, аминокислота в положении 2 пептидного аналоги заменена аминокислотой, выбранной из группы, состоящей D-серина, D-аланина, глицина, N-метилсерина и аминоизомасляной кислоты. В другом варианте изобретения, аминокислота в положении 2 пептидного аналога заменена аминокислотой, выбранной из группы, состоящей из D-серина, глицина, N-метилсерина и аминоизомасляной кислоты. В некоторых вариантах изобретения, аминокислота в положении 2 не является D-серином. В некоторых вариантах изобретения, пептид глюкагона содержит последовательность SEQ ID NO: 21 или SEQ ID NO: 22.
В некоторых своих вариантах, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, где указанный аналог отличается от родительской молекулы тем, что он имеет замену в положении 1 и обладает пониженной чувствительностью (то есть, резистентностью) к расщеплению дипептидил-пептидазой IV. Более конкретно, аминокислота в положении 1 пептидного аналога заменена аминокислотой, выбранной из группы, состоящей из D-гистидина, альфа, альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. В другом своем варианте, настоящее изобретение относится к агонисту глюкагона, содержащему аналог пептида SEQ ID NO: 34, где указанный аналог отличается от SEQ ID NO: 34 тем, что он имеет аминокислоту в положении 1, не являющуюся гистидином. В некоторых вариантах изобретения, растворимость аналога может быть увеличена, например, путем введения одной, двух, трех или более заряженных аминокислот в C-концевую часть нативного глюкагона, а предпочтительно, в положение со стороны С-конца по отношению к положению 27. В репрезентативных вариантах изобретения, одна, две, три или все заряженные аминокислоты являются отрицательно заряженными. В другом варианте изобретения, указанный аналог также имеет замену нативной аминокислоты в положении 28 или 29 кислотной аминокислотой, или кислотную аминокислоту, добавленную к карбокси-концу пептида SEQ ID NO: 34. В некоторых вариантах изобретения, кислотной аминокислотой является аспарагиновая кислота или глутаминовая кислота.
В некоторых вариантах изобретения, двойной агонист рецептора глюкагона/GLP-1 содержит последовательность SEQ ID NO: 20, которая также включает дополнительное карбокси-концевое удлинение из одной аминокислоты или пептида, выбранного из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. В том варианте, в котором к карбокси-концу SEQ ID NO: 20 добавлена одна аминокислота, такая аминокислота обычно выбрана из 20 наиболее часто встречающихся аминокислот, а в некоторых вариантах изобретения, дополнительная карбокси-концевая аминокислота, вместо карбоксильной группы нативной аминокислоты, имеет амидную группу. В некоторых вариантах изобретения, дополнительная аминокислота выбрана из группы, состоящей из глутаминовой кислоты, аспарагиновой кислоты и глицина.
В своем альтернативном варианте, настоящее изобретение относится к двойному агонисту рецептора/GLP-1, где указанный пептид содержит по меньшей мере одно лактамовое кольцо, образованное между боковой цепью остатка глутаминовой кислоты и лизинового остатка, где указанный остаток глутаминовой кислоты и лизиновый остаток разделены тремя аминокислотами. В некоторых вариантах изобретения, карбокси-концевая аминокислота пептида глюкагона, несущего лактамовое кольцо, вместо карбоксильной группы нативной аминокислоты, имеет амидную группу. Более конкретно, в некоторых своих вариантах, настоящее изобретение относится к двойному агонисту глюкагона и GLP-1, содержащему модифицированный пептид глюкагона, выбранный из группы, состоящей из:
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 66)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Gln-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 67)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 68)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Lys-Xaa-R (SEQ ID NO: 69)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-Asn-Thr-R (SEQ ID NO: 16)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Lys-Thr-R (SEQ ID NO: 17)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-Lys-Thr-R (SEQ ID NO: 18)
где Xaa в положении 28 = Asp или Asn, Xaa в положении 29 представляет собой Thr или Gly, R выбран из группы, состоящей из COOH, CONH2, глутаминовой кислоты, аспарагиновой кислоты, глицина, SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, а лактамовый мостик образуется между Lys в положении 12 и Glu в положении 16 SEQ ID NO: 66, между Glu в положении 16 и Lys в положении 20 SEQ ID NO: 67, между Lys в положении 20 и Glu в положении 24 SEQ ID NO: 68, между Glu в положении 24 и Lys в положении 28 SEQ ID NO: 69, между Lys в положении 12 и Glu в положении 16 и между Lys в положении 20 и Glu в положении 24 SEQ ID NO: 16, между Lys в положении 12 и Glu в положении 16 и между Glu в положении 24 и Lys в положении 28 SEQ ID NO: 17 и между Glu в положении 16 и Lys в положении 20 и между Glu в положении 24 и Lys в положении 28 SEQ ID NO: 18. В некоторых вариантах изобретения, R выбран из группы, состоящей из COOH, CONH2, глутаминовой кислоты, аспарагиновой кислоты, глицина, аминокислотой в положении 28 является Asn, а аминокислотой в положении 29 является треонин. В некоторых вариантах изобретения, R представляет собой CONH2, аминокислотой в положении 28 является Asn, а аминокислотой в положении 29 является треонин. В другом варианте изобретения, R выбран из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 29 и SEQ ID NO: 65, а аминокислотой в положении 29 является глицин.
В другом варианте изобретения, двойной агонист рецептора глюкагона/GLP-1 выбран из группы, состоящей из SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, где указанный пептид также содержит дополнительное карбокси-концевое удлинение из одной аминокислоты или пептида, выбранного из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. В некоторых вариантах изобретения, концевое удлинение включает последовательность SEQ ID NO: 26, SEQ ID NO: 29 или SEQ ID NO: 65, а пептид глюкагона включает последовательность SEQ ID NO: 55. В другом варианте изобретения, двойной агонист рецептора глюкагона/GLP-1 включает последовательность SEQ ID NO: 33, где аминокислотой в положении 16 является глутаминовая кислота, аминокислотой в положении 20 является лизин, аминокислотой в положении 28 является аспарагин, а аминокислотная последовательность SEQ ID No: 26 или SEQ ID NO: 29 связана с карбокси-концом SEQ ID NO: 33.
В том варианте, в котором к карбокси-концу SEQ ID NO: 20 добавлена одна аминокислота, такая аминокислота обычно выбрана из 20 наиболее часто встречающихся аминокислот, а в некоторых вариантах изобретения, указанная аминокислота, вместо карбоксильной группы нативной аминокислоты, имеет амидную группу. В некоторых вариантах изобретения, дополнительная аминокислота выбрана из группы, состоящей из глутаминовой кислоты, аспарагиновой кислоты и глицина. В тех вариантах изобретения, в которых аналог агониста глюкагона также содержит карбокси-концевое удлинение, такая карбокси-концевая аминокислота в указанном удлинении, в некоторых вариантах изобретения, заканчивается амидной группой или сложноэфирной группой, а не карбоксильной группой.
В другом варианте изобретения, двойной агонист рецептора глюкагона/GLP-1 содержит последовательность: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Xaa-CONH2 (SEQ ID NO: 19), где Xaa в положении 30 представляет собой любую аминокислоту. В некоторых вариантах изобретения, Xaa выбрана из 20 наиболее часто встречающихся аминокислот, а в некоторых вариантах изобретения, указанной аминокислотой является глутаминовая кислота, аспарагиновая кислота или глицин. Растворимость этого пептида может быть дополнительно увеличена путем ковалентного связывания ПЭГ-цепи с боковой цепью аминокислоты в положениях 17, 21, 24 или 30 SEQ ID NO: 19. В другом варианте изобретения, указанный пептид содержит дополнительное карбокси-концевое удлинение пептида, выбранного из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. В соответствии с некоторыми вариантами изобретения, двойной агонист рецептора глюкагона/GLP-1 содержит последовательность SEQ ID NO: 30, SEQ ID NO: 31 и SEQ ID NO: 32.
Дополнительные сайт-специфические модификации, которые являются внутренними для последовательностей глюкагона SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 64, могут быть введены в целях создания набора агонистов глюкагона, обладающих GLP-1-агонистическими активностями различной степени. В соответствии с этим, пептиды, которые обладают фактически идентичной in vitro активностью по отношению к каждому из рецепторов, были получены и охарактеризованы. Аналогичным образом, были идентифицированы и охарактеризованы пептиды, обладающие в десять раз более высокой селективной активностью по отношению к каждому из двух рецепторов. Как указывалось выше, замена серинового остатка в положении 16 глутаминовой кислотой приводит к повышению активности нативного глюкагона по отношению к обоим рецепторам глюкагона и GLP-1, но при этом, приблизительно в десять раз более высокая специфичность этих пептидов к рецептору глюкагона остается почти неизменной. Кроме того, в результате замены нативного глутамина в положении 3 глутаминовой кислотой (SEQ ID NO: 22) получают аналог глюкагона, который обладает приблизительно в десять раз большей специфичностью к рецептору GLP-1.
Растворимость пептидов, которые являются двойными агонистами рецептора глюкагона/GLP-1, может быть еще выше в водных растворах при физиологическом рН, но при введении гидрофильных групп в положения 16, 17, 21 и 24 пептида или при добавлении одной модифицированной аминокислоты (то есть, аминокислоты, модифицированной так, чтобы она содержала гидрофильную группу) к карбокси-концу пептида, который является двойным агонистом рецептора глюкагона/GLP-1, сохраняется высокая биологическая активность по сравнению с активностью нативного глюкагона. В соответствии с некоторыми вариантами изобретения, гидрофильная группа содержит полиэтиленовую (ПЭГ) цепь. Более конкретно, в некоторых вариантах изобретения, пептид глюкагона содержит последовательность SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 или SEQ ID NO: 18, где ПЭГ-цепь ковалентно связана с боковой цепью аминокислот в положениях 16, 17, 21, 24, 29 или у C-концевой аминокислоты пептида глюкагона, при условии, что если пептид содержит SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, то полиэтиленгликолевая цепь будет ковалентно связана с аминокислотным остатком в положении 17, 21 или 24, а если пептид содержит SEQ ID NO: 14 или SEQ ID NO: 15, то полиэтиленгликолевая цепь будет ковалентно связана с аминокислотным остатком в положении 16, 17 или 21, и если пептид содержит SEQ ID NO: 16, SEQ ID NO: 17 или SEQ ID NO: 18, то полиэтиленгликолевая цепь будет ковалентно связана с аминокислотным остатком в положении 17 или 21.
В некоторых вариантах изобретения, пептид глюкагона содержит последовательность SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, где ПЭГ-цепь ковалентно связана с боковой цепью аминокислот в положении 17, 21, 24 или у C-концевой аминокислоты пептида глюкагона, а карбокси-концевая аминокислота пептида, вместо карбоксильной группы нативной аминокислоты, имеет амидную группу. В некоторых вариантах изобретения, пептид, который является двойным агонистом рецептора глюкагона/GLP-1, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, где ПЭГ-цепь ковалентно связана с боковой цепью аминокислоты в положении 17, 21 или 24 SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 19, или в положении 16, 17 или 21 SEQ ID NO: 14 и SEQ ID NO: 15 или в положении 17 или 21 SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18 пептида глюкагона. В другом варианте изобретения, пептид, который является двойным агонистом рецептора глюкагона/GLP-1, содержит последовательность SEQ ID NO: 11 или SEQ ID NO: 19, где ПЭГ-цепь ковалентно связана с боковой цепью аминокислот в положении 17, 21 или 24 или у С-концевой аминокислоты пептида глюкагона.
В соответствии с некоторыми вариантами изобретения и с учетом ограничений, описанных в предшествующих параграфах, пептид, который является двойным агонистом глюкагона, модифицируют так, чтобы он содержал одну или более аминокислотных замен в положениях 16, 17, 21, 24 или 29 или С-концевой аминокислоты, где нативная кислота заменена аминокислотой, имеющей боковую цепь, подходящую для перекрестного связывания с гидрофильными группами, включая, например, ПЭГ. Нативный пептид может быть заменен природной аминокислотой или синтетической (неприродной) аминокислотой. Синтетическими или неприродными аминокислотами являются аминокислоты, которые обычно не встречаются в природе in vivo, но которые, тем не менее, могут быть включены в описанные здесь пептидные структуры. Альтернативно, аминокислота, имеющая боковую цепь, подходящую для перекрестного связывания с гидрофильными группами, включая, например, ПЭГ, может быть добавлена к карбокси-концу любого из описанных здесь аналогов глюкагона. В соответствии с некоторыми вариантами изобретения, в пептиде, который является двойным агонистом рецептора глюкагона/GLP-1, в положении, выбранном из группы, состоящей из 16, 17, 21, 24 или 29, нативную аминокислоту заменяют аминокислотой, выбранной из группы, состоящей из лизина, цистеина, орнитина, гомоцистеина и ацетилфенилаланина, где замененная аминокислота также содержит ПЭГ-цепь, ковалентно связанную с боковой цепью аминокислоты. В некоторых вариантах изобретения, пептид глюкагона, выбранный из группы, состоящей из SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, дополнительно модифицируют так, чтобы ПЭГ-цепь была ковалентно связана с боковой цепью аминокислоты в положении 17 или 21 пептида глюкагона. В некоторых вариантах изобретения, ПЭГилированный двойной агонист рецептора глюкагона/GLP-1 также содержит последовательность SEQ ID NO: 26, SEQ ID NO: 27 или SEQ ID NO: 29.
В другом варианте изобретения, пептид глюкагона содержит последовательность SEQ ID NO: 55 или SEQ ID NO: 56, которая также включает С-концевое удлинение последовательностей SEQ ID NO: 26, SEQ ID NO: 29 или SEQ ID NO: 65, связанных с С-концевой аминокислотой SEQ ID NO: 55 или SEQ ID NO: 56, и, кроме того, он содержит, но необязательно, ПЭГ-цепь, ковалентно связанную с боковой цепью аминокислот в положении 17, 18, 21, 24 или 29 или у С-концевой аминокислоты пептида. В другом варианте изобретения, пептид глюкагона содержит последовательность SEQ ID NO: 55 или SEQ ID NO: 56, где ПЭГ-цепь ковалентно связана с боковой цепью аминокислот в положении 21 или 24 пептида глюкагона, и где указанный пептид также содержит С-концевое удлинение SEQ ID NO: 26 или SEQ ID NO: 29.
В другом варианте изобретения, пептид глюкагона содержит последовательность SEQ ID NO: 55 или SEQ ID NO: 33 или SEQ ID NO: 34, где дополнительная аминокислота добавлена к карбокси-концу SEQ ID NO: 33 или SEQ ID NO: 34, а ПЭГ-цепь ковалентно связана с боковой цепью добавленной аминокислоты. В другом варианте изобретения, ПЭГилированный аналог глюкагона также содержит С-концевое удлинение последовательностей SEQ ID NO: 26 или SEQ ID NO: 29, связанных с С-концевой аминокислотой SEQ ID NO: 33 или SEQ ID NO: 34. В другом варианте изобретения, пептид глюкагона содержит последовательность SEQ ID NO: 19, где ПЭГ-цепь ковалентно связана с боковой цепью аминокислоты в положении 30 пептида глюкагона, и где указанный пептид также содержит С-концевое удлинение последовательностей SEQ ID NO: 26 или SEQ ID NO: 29, связанных с С-концевой аминокислотой SEQ ID NO: 19.
Полиэтиленгликолевая цепь может быть прямой или разветвленной. В соответствии с некоторыми вариантами изобретения, полиэтиленгликолевая цепь имеет среднюю молекулярную массу в пределах примерно 500-10000 дальтон. В некоторых вариантах изобретения, полиэтиленгликолевая цепь имеет среднюю молекулярную массу в пределах примерно 1000-5000 дальтон. В альтернативном варианте изобретения, полиэтиленгликолевая цепь имеет среднюю молекулярную массу в пределах примерно 10000-20000 дальтон. В соответствии с некоторыми вариантами изобретения, ПЭГилированный пептид глюкагона содержит две или более полиэтиленгликолевых цепи, ковалентно связанных с пептидом глюкагона, где общая молекулярная масса глюкагоновых цепей составляет примерно 1000-5000 дальтон. В некоторых вариантах изобретения, ПЭГилированный агонист глюкагона содержит пептид, состоящий из SEQ ID NO: 5 или аналога агониста глюкагона SEQ ID NO: 5, где ПЭГ-цепь ковалентно связана с аминокислотным остатком в положении 21 и в положении 24, и где общая молекулярная масса двух ПЭГ-цепей составляет примерно 1000-5000 дальтон.
В некоторых репрезентативных вариантах изобретения, пептид глюкагона содержит аминокислотную последовательность SEQ ID NO: 1, имеющую до десяти аминокислотных модификаций и содержит аминокислоту в положении 10, которая является ацилированной или алкилированной. В некоторых вариантах изобретения, указанная аминокислота в положении 10 является ацилированной или алкилированной жирной C4-C30 кислотой. В некоторых аспектах изобретения, аминокислота в положении 10 включает ацильную группу или алкильную группу, которая является ненативной для природной аминокислоты.
В некоторых вариантах изобретения, пептид глюкагона, включающий аминокислоту в положении 10, которая является ацилированной или алкилированной, содержит стабилизированную альфа-спираль. В соответствии с этим, в некоторых аспектах изобретения, пептид глюкагона содержит описанную здесь ацильную или алкильную группу и внутримолекулярный мостик, например, ковалентный внутримолекулярный мостик (например, лактамовый мостик), расположенный между боковыми цепями аминокислоты в положении i и аминокислоты в положении i+4, где i равно 12, 16, 20 или 24. Альтернативно или дополнительно, пептид глюкагона содержит описанную здесь ацильную или алкильную группу, и одну, две, три или более аминокислот в положениях 16, 20, 21 и/или 24 пептида глюкагона, которые были заменены α,α-дизамещенной аминокислотой, например, AIB. В некоторых случаях, ненативный пептид глюкагона содержит Glu в положении 16 и Lys в положении 20, где лактамовый мостик связывает, но необязательно, Glu и Lys, и, необязательно, пептид глюкагона также содержит одну или несколько модификаций, выбранных из группы, состоящей из Gln в положении 17, Ala в положении 18, Glu в положении 21, Ile в положении 23 и Ala в положении 24.
Кроме того, в любом из этих вариантов, в которых пептид глюкагона содержит аминокислоту в положении 10, которая является ацилированной или алкилированной, указанный пептид глюкагона может также содержать С-концевой амид вместо С-концевого альфа-карбоксилата.
В некоторых вариантах изобретения, пептид глюкагона, содержащий описанную здесь ацильную или алкильную группу, также включает аминокислотную замену в положении 1, в положении 2, или в положениях 1 и 2, где указанная(ые) аминокислотная(ые) замена(ы) сообщает(ют) резистентность к протеазе DPP-IV. Так, например, His в положении 1 может быть заменен аминокислотой, выбранной из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Альтернативно или дополнительно, Ser в положении 2 может быть заменен аминокислотой, выбранной из группы, состоящей из D-серина, аланина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты. В некоторых вариантах изобретения, аминокислота в положении 2 не является D-серином.
Пептид глюкагона, содержащий аминокислоту в положении 10, которая является ацилированной или алкилированной, как описано в настоящей заявке, может содержать любую аминокислотную последовательность, которая, по существу, является родственной последовательности SEQ ID NO: 1. Так, например, пептид глюкагона содержит SEQ ID NO: 1, имеющую до 10 аминокислотных модификаций (например, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 модификаций). В некоторых вариантах изобретения, аминокислотная последовательность ацилированного или алкилированного пептида глюкагона более, чем на 25% идентична последовательности SEQ ID NO: 1 (например, более, чем на 30%, 35%, 40%, 50%, 60%, 70% 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или почти на 100% идентична SEQ ID NO: 1). В некоторых конкретных вариантах изобретения, пептидом глюкагона является пептид, который содержит SEQ ID NN: 55, где аминокислота в положении 10 является ацилированной или алкилированной, как описано в настоящей заявке. Пептидом глюкагона может быть любая из SEQ ID NN: 55, 55 с 1 или 2 аминокислотными модификациями, 2-4, 9-18, 20, 23-25, 33, 40-44, 53, 56, 61, 62, 64, 66-514 и 534.
Ацильной или алкильной группой этих вариантов может быть любая описанная здесь ацильная или алкильная группа. Так, например, ацильной группой может быть жирная C4-C30-(например, C8-C24-)ацильная группа, а алкильной группой может быть C4-C30- (например, C8-C24)-алкильная группа.
Аминокислотой, к которой присоединена ацильная или алкильная группа, может быть любая из описанных здесь аминокислот, например, аминокислота формулы I (например, Lys), формулы II и формулы III.
В некоторых вариантах изобретения, ацильная группа или алкильная группа непосредственно связана с аминокислотой в положении 10. В некоторых вариантах изобретения, ацильная или алкильная группа присоединена к аминокислоте в положении 10 посредством спейсера, например, спейсера длиной в 3-10 атомов, например, аминокислоты или дипептида. Спейсеры, подходящие для присоединения ацильной или алкильной группы, описаны в настоящей заявке.
В соответствии с некоторыми вариантами изобретения, родственным глюкагону пептидом класса 3 может быть аналог любого из вышеописанных родственных глюкагону пептидов класса 3, где указанный аналог обладает агонистической активностью по отношению к рецептору GIP. Уровень активности аналога по отношению к рецептору глюкагона, к рецептору GLP-1 и к рецептору GIP, а также эффективность по отношению к каждому из этих рецепторов и специфичность к каждому из этих рецепторов могут соответствовать уровню активности, эффективности и специфичности, описанным для рассматриваемых здесь родственных глюкагону пептидов класса 2. См. описание в подразделе «Родственный глюкагону пептид класса 2» раздела, озаглавленного «Активность».
В некоторых своих вариантах, настоящее изобретение относится к аналогу пептида глюкагона, обладающему агонистической активностью по отношению к рецептору GIP. В некоторых вариантах изобретения, такой аналог содержит аминокислотную последовательность SEQ ID NO: 1, имеющую по меньшей мере одну аминокислотную модификацию (необязательно, до 15 аминокислотных модификаций) и удлинение на 1-21 аминокислоту со стороны С-конца по отношению к аминокислоте в положении 29 данного аналога.
В некоторых аспектах изобретения, аналоги содержат по меньшей мере от одной и до 15 аминокислотных модификаций (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 аминокислотных модификаций, до 10 аминокислотных модификаций). В некоторых вариантах изобретения, аналоги содержат по меньшей от 1 до 10 аминокислотных модификаций и дополнительные консервативные аминокислотные модификации. Консервативные аминокислотные модификации описаны в настоящей заявке.
В некоторых аспектах изобретения, по меньшей мере одна аминокислотная модификация стабилизирует альфа-спиральную структуру в С-концевой части аналога. Модификации, стабилизирующие альфа-спиральную структуру, описаны в настоящей заявке. См., например, описание в разделе, озаглавленном «Стабилизация альфа-спирали/внутримолекулярные мостики». В некоторых аспектах изобретения, аналог содержит внутримолекулярный мостик (например, ковалентный внутримолекулярный мостик, нековалентный внутримолекулярный мостик) между боковыми цепями двух аминокислот данного аналога. В некоторых аспектах изобретения, внутримолекулярный мостик связывает боковые цепи аминокислот в положениях i и i+4, где i равно 12, 13, 16, 17, 20 или 24. В других аспектах изобретения, внутримолекулярный мостик соединяет боковые цепи аминокислот в положениях j и j+3, где j равно 17, или в положениях k и k+7, где k равно любому целому числу от 12 до 22. В некоторых вариантах изобретения, внутримолекулярным мостиком является ковалентный внутримолекулярный мостик, например, лактамовый мостик. В конкретных аспектах изобретения, лактамовый мостик соединяет боковые цепи аминокислот в положениях 16 и 20. В конкретных аспектах изобретения, одной из аминокислот в положениях 16 и 20 является положительно заряженная аминокислота, а другой аминокислотой является отрицательно заряженная аминокислота. Так, например, аналог может содержать лактамовый мостик, соединяющий боковые цепи Glu в положении 16 и Lys в положении 20. В других аспектах изобретения, отрицательно заряженная аминокислота и положительно заряженная аминокислота образуют солевой мостик. В этом случае, внутримолекулярный мостик представляет собой нековалентный внутримолекулярный мостик.
В конкретных аспектах изобретения, аминокислотной модификацией, которая стабилизирует альфа-спираль, является инсерция α,α-дизамещенной аминокислоты SEQ ID NO: 1 или замена такой α,α-дизамещенной аминокислотой. α,α-Дизамещенные аминокислоты, подходящие для стабилизации альфа-спирали, описаны в настоящей заявке, и такими аминокислотами являются, например, AIB. В некоторых аспектах изобретения, одна, две, три или более аминокислот в положениях 16, 20, 21 и 24 SEQ ID NO: 1 заменены α,α-дизамещенной аминокислотой, например, AIB. В конкретных вариантах изобретения, аминокислотой в положении 16 является AIB.
Аналог, обладающий агонистической активностью по отношению к рецептору GIP, может содержать дополнительные модификации, такие как любая из описанных здесь модификаций. Так, например, аминокислотные модификации могут приводить к повышению или снижению активности по отношению к рецептору GLP-1 или к рецептору глюкагона, или к обоим этим рецепторам. Аминокислотные модификации могут повышать стабильность пептида, например, повышать резистентность к расщеплению протеазой DPP-IV и стабилизировать связь между аминокислотами 15 и 16. Аминокислотные модификации могут повышать растворимость пептида и/или изменять время действия аналога по отношению к любому из рецепторов, таких как рецепторы GIP, глюкагона и GLP-1. Комбинация модификаций любого из этих типов может присутствовать в аналогах, обладающих агонистической активностью по отношению к рецептору GIP.
В соответствии с этим, в некоторых аспектах изобретения, аналог содержит аминокислотную последовательность SEQ ID NO: 1 с одной или несколькими заменами: Gln в положении 17, Ala в положении 18, Glu в положении 21, Ile в положении 23 и Ala или Cys в положении 24, или с консервативными аминокислотными заменами. В некоторых аспектах изобретения, аналог содержит С-концевой амид вместо С-концевого альфа-карбоксилата. В некоторых вариантах изобретения, аналог содержит аминокислотную замену в положении 1, в положении 2 или в положениях 1 и 2, где указанная(ые) замена(ы) сообщает(ют) резистентность к протеазе DPP-IV. Подходящие аминокислотные замены описаны в настоящей заявке. Так, например, в положении 1 присутствует DMIA, и/или в положении 2 присутствует d-Ser или AIB. В некоторых вариантах изобретения, аминокислота в положении 2 не является D-серином.
Дополнительно или альтернативно, аналог может содержать одну замену или комбинацию из таких замен, как: (a) замена Ser в положении 2 на Ala; (b) замена Gln в положении 3 на Glu или аналог глутамина; (c) замена Thr в положении 7 на Ile; (d) замена Tyr в положении 10 на Trp или на аминокислоту, содержащую ацильную или алкильную группу, которая не является нативной для природной аминокислоты; (e) замена Lys в положении 12 на Ile; (f) замена Asp в положении 15 на Glu; (g) замена Ser в положении 16 на Glu; (h) замена Gln в положении 20 на Ser, Thr, Ala, AIB; (i) замена Gln в положении 24 на Ser, Thr, Ala, AIB; (j) замена Met в положении 27 на Leu или Nle; (k) замена Asn в положении 29 на заряженную аминокислоту, необязательно, Asp или Glu; и (l) замена Thr в положении 29 на Gly или на заряженную аминокислоту, необязательно, Asp или Glu.
В некоторых аспектах изобретения, аналог не содержит аминокислотной модификации в положении 1, сообщающей GIP-агонистическую активность. В некоторых аспектах изобретения, аминокислота в положении 1 не является крупной ароматической аминокислотой, например, Tyr. В некоторых вариантах изобретения, аминокислотой в положении 1 является аминокислота, содержащая имидазоловое кольцо, например, His, аналоги His. В некоторых вариантах изобретения, аналог не является любым из соединений, описанных в заявке на патент США No. 61/151349. В некоторых аспектах изобретения, аналог содержит любую из аминокислотных последовательностей SEQ ID NN: 657-669.
Что касается аналогов, обладающих агонистической активностью по отношению к рецептору GIP, то такой аналог содержит удлинение на 1-21 аминокислоту (например, на 5-19, 7-15, 9-12 аминокислот). Удлинение данного аналога может содержать любую аминокислотную последовательность, при условии, что такое удлинение составляет 1-21 аминокислоту. В некоторых аспектах изобретения, удлинение составляет 7-15 аминокислот, а в других аспектах, такое удлинение составляет 9-12 аминокислот. В некоторых вариантах изобретения, удлинение содержит: (i) аминокислотную последовательность SEQ ID NO: 26 или 674, (ii) аминокислотную последовательность, которая имеет высокую степень идентичности (например, по меньшей мере 80%, 85%, 90%, 95%, 98%, 99%) аминокислотной последовательности SEQ ID NO: 26 или 674, или (iii) аминокислотную последовательность (i) или (ii) с одной или несколькими консервативными аминокислотными модификациями.
В некоторых вариантах изобретения, по меньшей мере одна из аминокислот указанного удлинения является ацилированной или алкилированной. Аминокислота, содержащая ацильную или алкильную группу, может быть локализована в любом положении удлинения аналога. В некоторых вариантах изобретения, ацилированная или алкилированная аминокислота в указанном удлинении локализована в положениях 37, 38, 39, 40, 41 или 42 (в соответствии с нумерацией последовательности SEQ ID NO: 1) данного аналога. В некоторых вариантах изобретения, ацилированная или алкилированная аминокислота локализована в положении 40 данного аналога.
В репрезентативных вариантах изобретения, ацильная или алкильная группа представляет собой ацильную или алкильную группу, которая является ненативной для природной аминокислоты. Так, например, ацильной или алкильной группой могут быть жирная C4-C30 (например, C12-C18)-ацильная группа или C4-C30 (например, C12-C18)алкил. Ацильная или алкильная группа могут представлять собой любую обсуждаемую здесь группу.
В некоторых вариантах изобретения, ацильная или алкильная группа непосредственно присоединена к аминокислоте, например, посредством боковой цепи аминокислоты. В других вариантах изобретения, ацильная или алкильная группа присоединена к аминокислоте посредством спейсера (например, аминокислоты, дипептида, трипептида, гидрофильного бифункционального спейсера, гидрофобного бифункционального спейсера). В некоторых аспектах изобретения, спейсер имеет длину в 3-10 атомов. В некоторых вариантах изобретения, аминокислотный спейсер не является γ-Glu. В некоторых вариантах изобретения, дипептидный спейсер не является γ-Glu-γ-Glu.
Кроме того, в репрезентативных вариантах изобретения, аминокислотой, к которой присоединена ацильная или алкильная группа, может быть любая из описанных здесь аминокислот, включая, например, аминокислоту формулы I, II или III. Аминокислотой, которая является ацилированной или алкилированной, может быть, например, Lys. Подходящие аминокислоты, содержащие ацильную или алкильную группу, а также подходящие ацильные группы и алкильные группы описаны в настоящей заявке. См., например, описание в разделе, озаглавленном «Ацилирование и алкилирование».
В других вариантах изобретения, 1-6 аминокислот (например, 1-2, 1-3, 1-4, 1-5 аминокислот) указанного удлинения представляют собой положительно заряженные аминокислоты, например, аминокислоты формулы IV, такие как, например, Lys. Используемый здесь термин «положительно заряженная аминокислота» означает любую природную или неприродную аминокислоту, имеющую положительный заряд на атоме ее боковой цепи при физиологическом pH. В некоторых аспектах изобретения, положительно заряженные аминокислоты присутствуют в любом из положений 37, 38, 39, 40, 41, 42 и 43. В конкретных вариантах изобретения, положительно заряженная аминокислота присутствует в положении 40.
В других случаях, описанное здесь удлинение является ацилированным или алкилированным и содержит 1-6 положительно заряженных аминокислот как описано в настоящей заявке.
В других вариантах изобретения, аналоги, которые обладают агонистической активностью по отношению к рецептору GIP, включают: (i) SEQ ID NO: 1 по меньшей мере с одной аминокислотной модификацией, (ii) удлинение на 1-21 аминокислоту (например, на 5-18, 7-15, 9-12 аминокислот) со стороны C-конца по отношению к аминокислоте в положении 29 данного аналога, и (iii) аминокислоту, содержащую ацильную или алкильную группу, которая является ненативной для природной аминокислоты, расположенной за пределами С-концевого удлинения (например, в любом из положений 1-29). В некоторых вариантах изобретения, указанный аналог содержит ацилированную или алкилированную аминокислоту в положении 10. В конкретных аспектах изобретения, ацильной или алкильной группой является жирная C4-C30-ацильная группа или C4-C30-алкильная группа. В некоторых вариантах изобретения, ацильная или алкильная группа присоединена посредством спейсера, например, аминокислоты, дипептида, трипептида, гидрофильного бифункционального спейсера, гидрофобного бифункционального спейсера. В некоторых аспектах изобретения, указанный аналог содержит аминокислотную модификацию, которая стабилизирует альфа-спираль, такую как солевой мостик, расположенный между Glu в положении 16 и Lys в положении 20, или альфа,альфа-дизамещенной аминокислотой в любом одном, двух, трех или более положениях 16, 20, 21 и 24. В конкретных аспектах изобретения, аналог дополнительно включает аминокислотные модификации, сообщающие резистентность к протеазе DPP-IV, например, DMIA в положении 1, AIB в положении 2. В настоящем изобретении рассматриваются аналоги, содержащие другие аминокислотные модификации.
В некоторых вариантах изобретения, аналоги, обладающие активностью по отношению к рецептору GIP, сохраняют по меньшей мере 0,1% (например, по меньшей мере 0,5%, 1%, 2%, 5%, 10%, 15% или 20%) активности нативного GIP по отношению к рецептору GIP. В некоторых вариантах изобретения, аналоги обладают более, чем 20% (например, более, чем 50%, более, чем 75%, более, чем 100%, более, чем 200%, более, чем 300%, более, чем 500%) активности нативного GIP по отношению к рецептору GIP. В некоторых вариантах изобретения, аналоги обладают обнаружимой агонистической активностью по отношению к одному из рецепторов GLP-1 и глюкагона или к обоим этим рецепторам. В некоторых аспектах изобретения, специфичность к этим рецепторам (к рецептору GIP и к рецептору GLP-1 и/или к рецептору глюкагона) увеличивается в 1000 раз. Так, например, специфичность к рецептору GLP-1 у аналогов, обладающих активностью по отношению к рецептору GIP, может менее, чем в 500 раз, в 100 раз, в 50 раз, в 25 раз, в 15 раз, в 10 раз превышать специфичность к рецептору GIP и/или к рецептору глюкагона.
В конкретных аспектах изобретения, аналог содержит структуры любой из SEQ ID NN: 657-669.
В соответствии с некоторыми вариантами изобретения, родственный глюкагону пептид класса 3 содержит аминокислотную последовательность нативного глюкагона (SEQ ID NO:1), имеющую следующие модификации: AIB в положении 2, Glu в положении 3, Lys в положении 10, Glu в положении 16, Gln в положении 17, Ala в положении 18, Lys в положении 20, Glu в положении 21, Ile в положении 23, Ala в положении 24; где Lys в положении 10 ацилирован жирной C14- или C16-кислотой, и где С-концевой карбоксилат заменен амидом. В конкретном варианте изобретения, этот родственный глюкагону пептид класса 3 присоединен посредством своей N-концевой аминокислоты к дипептиду D-Lys-саркозин.
В соответствии с некоторыми вариантами изобретения, родственный глюкагону пептид класса 3 содержит любую из аминокислотных последовательностей SEQ ID NN: 70-514, 517-534, или 554, по существу, состоит из такой последовательности или состоит из этой последовательности, которая содержит, но необязательно, до 1, 2, 3, 4 или 5 дополнительных модификаций, сохраняющих GLP-1-агонистическую активность и/или глюкагон-агонистическую активность. В некоторых вариантах изобретения, родственный глюкагону пептид класса 3 содержит любую из аминокислотных последовательностей SEQ ID NN: 562-684 и 1701-1776. В некоторых вариантах изобретения, родственный глюкагону пептид класса 3 содержит любую из аминокислотных последовательностей SEQ ID NN: 1801-1908.
Родственные глюкагону пептиды класса 4
В некоторых вариантах изобретения, родственным глюкагону пептидом является родственный глюкагону пептид класса 4 (см., например, Международную патентную заявку (PCT) No. PCT/US2008/080973, которая во всей своей полноте вводится в настоящее описание посредством ссылки).
Все биологические последовательности, упомянутые в следующем разделе (SEQ ID NN: 1301-1371), соответствуют последовательностям SEQ ID NN: 1-71, описанным в Международной патентной заявке No. PCT/US2008/080973.
Активность
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к родственным глюкагону пептидам класса 4 (далее называемым «пептидами класса 4»). В некоторых своих аспектах, настоящее изобретение относится к пептиду класса 4, обладающему глюкагон-антагонистической активностью. Антагонисты глюкагона могут быть использованы в любых случаях, когда необходимо подавление глюкагон-агонистической активности. Наиболее эффективное и очевидное применение антагонистов глюкагона для лечения диабета в целях снижения уровней глюкозы в крови было продемонстрировано на пре-клинических моделях гипергликемии. Антагонисты глюкагона могут быть дополнительно модифицированы в целях повышения биофизической стабильности и/или растворимости указанных соединений в воде, но с сохранением антагонистической активности родительского соединения. В некоторых аспектах изобретения, пептид класса 4 определен как чистый антагонист глюкагона.
Термин «антагонист глюкагона» означает соединение, которое подавляет активность глюкагона или предотвращает действие глюкагона. Так, например, антагонист глюкагона по меньшей мере на 60% (например, по меньшей мере на 70%), а предпочтительно, по меньшей мере на 80% ингибирует максимальную реакцию глюкагона с рецептором глюкагона. В некоторых вариантах изобретения, антагонист глюкагона по меньшей мере на 90% ингибирует максимальную реакцию глюкагона с рецептором глюкагона. В конкретном варианте изобретения, антагонист глюкагона по меньшей мере на 100% ингибирует максимальную реакцию глюкагона с рецептором глюкагона. Кроме того, антагонист глюкагона в концентрации примерно 1 мкМ обладает активностью, которая составляет примерно менее, чем 20% от максимальной агонистической активности глюкагона по отношению к рецептору глюкагона. В некоторых вариантах изобретения, антагонист глюкагона обладает активностью, которая составляет примерно менее, чем 10% от максимальной агонистической активности глюкагона по отношению к рецептору глюкагона. В конкретном варианте изобретения, антагонист глюкагона обладает активностью, которая составляет примерно менее, чем 5% от максимальной агонистической активности глюкагона по отношению к рецептору глюкагона. В другом конкретном варианте изобретения, антагонист глюкагона обладает активностью, которая составляет 0% от максимальной агонистической активности глюкагона по отношению к рецептору глюкагона.
«Чистый антагонист глюкагона» представляет собой антагонист глюкагона, который не индуцирует какую-либо детектируемую стимуляцию активности по отношению к рецептору глюкагона или GLP-1, как было измерено по уровню продуцирования cAMP с помощью экспериментального анализа на модели in vitro (см., например, PCT/US2008/080973). Так, например, чистый антагонист глюкагона обладает примерно менее, чем 5% (например, примерно менее, чем 4%, примерно менее, чем 3%, примерно менее, чем 2%, примерно менее, чем 1%, примерно 0%) от максимальной агонистической активности глюкагона по отношению к рецептору глюкагона и примерно менее, чем 5% (например, примерно менее, чем 4%, примерно менее, чем 3%, примерно менее, чем 2%, примерно менее, чем 1%, и примерно 0%) от максимальной агонистической активности GLP-1 по отношению к рецептору GLP-1.
В соответствии с этим, в некоторых своих аспектах, настоящее изобретение относится к пептидам класса 4, которые обладают чисто антагонистической активностью по отношению к глюкагону. В соответствии с некоторыми вариантами изобретения, антагонист глюкагона обладает активностью, которая снижает индуцируемое глюкагоном продуцирование cAMP, стимулирующего активность рецептора глюкагона, по меньшей мере максимум на 50% в случае, если рецептор глюкагона контактирует одновременно с 0,8 нМ глюкагона и антагониста глюкагона, как было измерено по продуцированию cAMP в анализе in vitro. В некоторых вариантах изобретения, антагонист глюкагона снижает индуцируемое глюкагоном продуцирование cAMP, стимулирующее активность рецептора глюкагона по меньшей мере максимум на 80%.
Очевидно, что пептиды класса 4 могут быть использованы в любых целях, которые были ранее описаны для антагонистов глюкагона. В соответствии с этим, описанные здесь пептиды класса 4 могут быть использованы для лечения гипергликемии или других нарушений метаболизма, вызываемых высокими уровнями глюкагона в крови или высокими уровнями глюкозы в крови. В соответствии с некоторыми вариантами изобретения, пациентом, подвергаемым лечению с использованием описанных здесь пептидов класса 4, является домашнее животное, а в другом варианте изобретения, такими пациентом является человек. Проведенные исследования позволяют предположить, что отсутствие ингибирования глюкагона у пациентов с диабетом играет определенную роль в развитии гипергликемии после приема пищи, частично вызываемой ускоренным гликогенолизом. Анализ на уровень глюкозы в крови, проводимый с помощью теста на пероральную толерантность к глюкозе (OGTT) и при наличии или в отсутствии индуцированного соматостатином ингибирования глюкагона, указывал на значительное повышение уровней глюкозы у индивидуумов с более высокими уровнями глюкагона. В соответствии с этим, пептиды класса 4 согласно изобретению могут быть использованы для лечения гипергликемии, а также предполагается, что они могут быть использованы для лечения диабета различных типов, включая сахарный диабет типа I, сахарный диабет типа II или диабет беременных, либо инсулинзависимый, либо инсулиннезависимый, и для снижения вероятности развития осложнений при диабете, включая нефропатию, ретинопатию и сосудистое заболевание.
В некоторых вариантах изобретения, десять концевых аминокислот экзендина-4 (то есть, последовательность SEQ ID NO: 1319 (GPSSGAPPPS)) связаны с карбокси-концом пептида класса 4. Предполагается, что эти гибридные белки обладают фармакологической активностью, направленной на снижение аппетита и стимуляцию снижения/сохранения массы тела. В соответствии с некоторыми вариантами изобретения, описанные здесь пептиды класса 4 могут быть также модифицированы так, чтобы они включали аминокислотную последовательность SEQ ID NO: 1319 (GPSSGAPPPS), связанную с аминокислотой 24 пептида класса 4 SEQ ID NO: 1342, и могут быть введены индивидуумам для стимуляции снижения или сохранения массы тела. Более конкретно, пептид класса 4 содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1302, SEQ ID NO: 1303, SEQ ID NO: 1304 SEQ ID NO: 1305, SEQ ID NO: 1306, SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1336, SEQ ID NO: 1339, SEQ ID NO: 1340 SEQ ID NO: 1341, SEQ ID NO: 1342, SEQ ID NO: 1343 и SEQ ID NO: 1344, а также аминокислотную последовательность SEQ ID NO: 1319 (GPSSGAPPPS), связанную с аминокислотой 24 пептида класса 4, и может быть использован для снижения аппетита и стимуляции снижения/сохранения массы тела. В некоторых вариантах изобретения, вводимый пептид класса 4 содержит последовательность SEQ ID NO: 1346 или SEQ ID NO: 1347.
Предполагается, что такие методы снижения аппетита или стимуляции снижения массы тела могут быть применены для снижения массы тела, предупреждения увеличения массы тела или для лечения ожирения различной этиологии, включая ожирение, вызываемое лекарственными средствами, а также для снижения вероятности развития осложнений, ассоциированных с ожирением, включая сосудистые заболевания (ишемическую болезнь сердца, инсульт, заболевание периферических сосудов, ишемическую реперфузию и т.п.), гипертензию, диабет типа II на ранней стадии, гиперлипидемию и скелетно-мышечные заболевания.
Пептиды класса 4 согласно изобретению могут быть введены отдельно или в комбинации с другими антидиабетическими средствами или средствами против ожирения. Антидиабетическими средствами, известными специалистам или находящимися на стадии разработки, являются инсулин, сульфонилмочевины, такие как толбутамид (Orinase), ацетогексамид (Dymelor), толазамид (Tolinase), хлорпропамид (Diabinese), глипизид (Glucotrol), глибурид (Diabeta, Micronase, Glynase), глимепирид (Amaryl), или гликлазид (Diamicron); меглитиниды, такие как репаглинид (Prandin) или натеглинид (Starlix); бигуаниды, такие как метформин (Glucophage) или фенформин; тиазолидиндионы, такие как розиглитазон (Avandia), пиоглитазон (Actos) или троглитазон (Rezulin), или другие ингибиторы PPARγ; ингибиторы альфа-глюкозидазы, которые ингибируют расщепление углеводов, такие как миглитол (Glyset), акарбоза (Precose/Glucobay); экзенатид (Byetta) или прамлинтид; ингибиторы дипептидил-пептидазы 4 (DPP-4), такие как вилдаглиптин или ситаглиптин; ингибиторы SGLT (натрийзависимого агента, ответственного за транспорт глюкозы 1); или ингибиторы ФБФазы (фруктозо-1,6-бисфосфатазы).
Средствами против ожирения, известными специалистам или находящимися на стадии разработки, являются средства, подавляющие аппетит, включая стимуляторы типа фенэтиламина, фентермин (необязательно вместе с фенфлурамином или дексфенфлурамином), диэтилпропион (Tenuate®), фендиметразин (Prelu-2®, Bontril®), бензфетамин (Didrex®), сибутрамин (Meridia®, Reductil®); римонабант (Acomplia®), другие антагонисты каннабиноидных рецепторов; оксинтомодулин; гидрохлорид флуоксетина (Prozac); Qnexa (топирамат и фентермин), Excalia (бупропион и зонизамид) или Contrave (бупропион и налтрексон); или ингибиторы липазы, аналогичные ксеникалу (Orlistat) или цетилистату (также известному как ATL-962), или GT 389-255.
Пептиды класса 4 согласно изобретению могут быть также введены пациентам, страдающим истощением, ассоциированным с катаболизмом. Было установлено, что больше половины пациентов с раком страдает ассоциированным с катаболизмом истощением, которое характеризуется самопроизвольной и прогрессирующей потерей массы тела, слабостью и низким уровнем жиров в организме и в мышцах. Этот синдром обычно наблюдается у пациентов со СПИД'ом, и может также наблюдаться при бактериальных и паразитарных инфекциях, при ревматоидном артрите и при хронических заболеваниях кишечника, печени, легких и сердца. Этот синдром обычно ассоциируется с анорексией и может проявляться как патологическое состояние, вызываемое старением или физическими травмами. Катаболическое истощение представляет собой симптом, который снижает качество жизни, ухудшает состояние здоровья и является основной причиной летального исхода. Авторами настоящей заявки было высказано предположение, что описанные здесь пептиды класса 4 могут быть введены пациентам для лечения катаболического истощения.
Фармацевтические композиции, содержащие описанные здесь пептиды класса 4, могут быть приготовлены с использованием стандартных фармацевтически приемлемых носителей и введены пациентам известными способами. В соответствии с этим, настоящее изобретение также охватывает фармацевтические композиции, содержащие один или несколько описанных здесь пептидов класса 4 в комбинации с фармацевтически приемлемым носителем. Фармацевтические композиции могут содержать пептиды класса 4 в качестве одного фармацевтически активного компонента, либо пептиды класса 4 могут быть объединены с одним или несколькими дополнительными активными агентами. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к композиции, содержащей пептид класса 4 согласно изобретению, и соединение, которое активирует рецептор GLP-1 (такое как GLP-1, аналог GLP-1, аналог экзендина-4 или его производное). В соответствии с некоторыми своими вариантами, настоящее изобретение относится к композиции, содержащей пептид класса 4 согласно изобретению, и инсулин или аналог инсулина. Альтернативно, может быть получена композиция для индуцирования снижения массы тела или предупреждения увеличения массы тела, где указанная композиция содержит последовательность SEQ ID NO: 1342, которая также включает аминокислотную последовательность SEQ ID NO: 1319 (GPSSGAPPPS), связанную с аминокислотой 24 SEQ ID NO: 1342, и пептид против ожирения. Подходящими пептидами против ожирения являются пептиды, описанные в патентах США 5691309, 6436435 или в заявке на патент США 20050176643, включая, но не ограничиваясь ими, GLP-1, GIP (полипептид, угнетающий секрецию желудочного сока), MP1, PYY, MC-4, лептин.
Структура пептидов класса 4
В некоторых своих вариантах, настоящее изобретение относится к родственным глюкагону пептидам класса 4, где природная аспарагиновая кислота в положении 9 (последовательности глюкагона SEQ ID NO: 1301) была заменена глутаминовой кислотой или производным на основе цистеиновой кислоты. Более конкретно, в некоторых аспектах изобретения, делеция первой аминокислоты (дез-His) и замена аспарагиновой кислоты в положении 9 глутаминовой кислотой приводят к образованию пептида класса 4. Родственные глюкагону пептиды класса 4, имеющие заместители сульфоновой кислоты в положении аминокислоты 9 глюкагона, действуют аналогично действию аминокислот с карбоксильной группой, однако, они имеют несколько существенных различий в своих физических свойствах, таких как растворимость. В случае замены изостерической глутаминовой кислоты в положении 9, обычно в положении дез-His, Glu9, гомоцистеиновой кислотой (hCysSO3), пептид класса 4 остается частично антагонистом и слабым агонистом.
В некоторых своих вариантах, настоящее изобретение относится к пептидам класса 4, в которых первые 2-5 аминокислот были удалены, а аминокислота в положении 9 (в соответствии с нумерацией последовательности SEQ ID NO: 1301) была заменена на hCys(SO3), гомоглутаминовой кислотой, β-гомоглутаминовой кислотой или алкилкарбоксилатным производным цистеина, имеющего структуру:
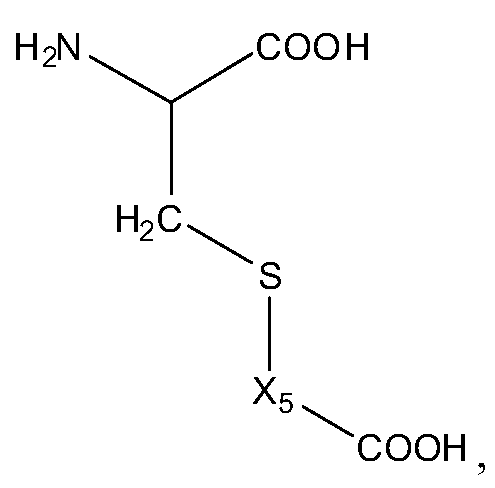
где X5 представляет собой C1-C4алкил, C2-C4алкенил или C2-C4алкинил, в результате чего было получено соединение, которое действует как антагонист гормонов, и представляет собой высокоспецифичное и высокоэффективное средство, не обладающее побочными агонистическими свойствами.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 4, который содержит модифицированный пептид глюкагона по сравнению с последовательностью дикого типа SEQ ID NO: 1301, полученный путем делеции 2-5 аминокислотных остатков у N-конца и замены остатка аспарагиновой кислоты в положении 9 нативного белка глутаминовой кислотой, гомоглутаминовой кислотой, β-гомоглутаминовой кислотой, сульфоновокислотным производным цистеина или алкилкарбоксилатным производным цистеина, имеющим структуру:
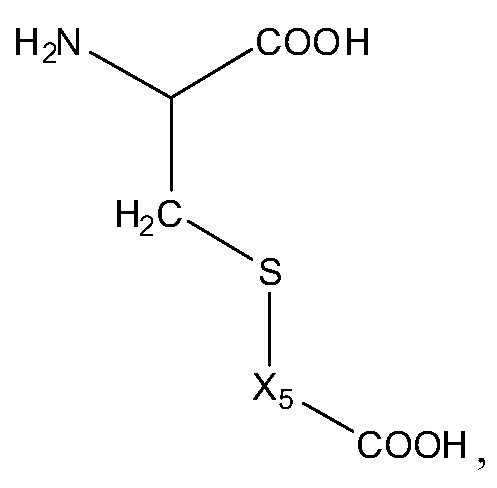
где X5 представляет собой C1-C4алкил, C2-C4алкенил или C2-C4алкинил.
В одном из конкретных вариантов изобретения, пептид класса 4, имеющий делецию 2-5 аминокислотных остатков у N-конца и замену Asp в положении 9 нативного глюкагона, дополнительно модифицируют путем внесения до трех аминокислотных модификаций. Так, например, пептид класса 4 может иметь одну, две или три консервативных аминокислотных модификаций. Альтернативно или дополнительно, пептид класса 4 может содержать одну или несколько аминокислотных модификаций, выбранных из группы, состоящей из:
A. замены одной или двух аминокислот в положениях 10, 20, и 24 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301), или у N- или C-концевой аминокислоты пептида класса 4 аминокислотой, ковалентно связанной с ацильной группой или алкильной группой посредством сложноэфирной, эфирной, тиоэфирной, амидной или алкиламиновой связи;
B. замены одной или двух аминокислот в положениях 16, 17, 20, 21 и 24 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301), или у N- или C-концевой аминокислоты пептида класса 4 аминокислотой, выбранной из группы, состоящей из Cys, Lys, орнитина, гомоцистеина и ацетилфенилаланина (Ac-Phe), где аминокислота указанной группы ковалентно связана с гидрофильной группой;
C. добавления аминокислоты, ковалентно связанной с гидрофильной группой, к N- или C-концу пептида класса 4;
D. замены Asp в положении 15 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301) цистеиновой кислотой, глутаминовой кислотой, гомоглутаминовой кислотой и гомоцистеиновой кислотой;
E. замены Ser в положении 16 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301) цистеиновой кислотой, глутаминовой кислотой, гомоглутаминовой кислотой и гомоцистеиновой кислотой;
F. замены AIB в одном или нескольких положениях 16, 20, 21 и 24 в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301;
G. делеции аминокислоты в положении 29 или аминокислот в положениях 28 и 29 в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301;
H. замены Asn в положении 28 или Thr в положении 29 или замены обеих этих аминокислот в указанных положениях (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301) заряженными аминокислотами; и/или добавления одной или двух заряженных аминокислот у С-конца SEQ ID NO: 1301;
I. замены Met в положении 27 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301) аминокислотами Leu или норлейцином;
J. добавления пептида, имеющего любую из аминокислотных последовательностей SEQ ID NN: 19-21 и 53 к C-концу SEQ ID NO: 1301; где аминокислотой в положении 29 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301) является Thr или Gly; и
K. замены C-концевого карбоксилата амидом или сложным эфиром.
В конкретном варианте изобретения, пептид класса 4 содержит аминокислотную модификацию A, B или C, описанную выше, или их комбинацию. В другом конкретном варианте изобретения, пептид класса 4, помимо аминокислотной(ых) модификации(й) A, B и/или C, также содержит любую из аминокислотных модификаций D-K, описанных выше, или их комбинацию.
В некоторых вариантах изобретения, пептид класса 4 содержит пептид глюкагона, где первые 5 аминокислот были удалены у N-конца, а оставшаяся N-концевая аминогруппа была заменена гидроксильной группой («аналог PLA6»), в результате чего был получен пептид SEQ ID NO: 1339. Заявителями было обнаружено, что замена фенилаланина фенилмолочной кислотой в аналогах пептида класса 4, в которых были делетированы первые 5 аминокислот и была сделана замена глутаминовой кислотой в положении 9 (по сравнению с нативным глюкагоном), приводит к еще большему повышению активности этих аналогов пептида класса 4.
В некоторых вариантах изобретения, пептид класса 4 SEQ ID NO: 1339 дополнительно модифицируют путем замены остатка аспарагиновой кислоты в положении 4 (в положении 9 нативного глюкагона) аминокислотой, имеющей общую структуру:
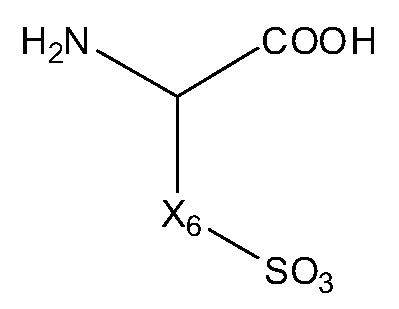
где X6 представляет собой C1-C3алкил, C2-C3алкен или C2-C3алкинил, а в некоторых вариантах изобретения, X6 представляет собой C1-C3алкил, а в другом варианте изобретения, X6 представляет собой C2алкил. В некоторых вариантах изобретения, пептид класса 4 содержит пептид глюкагона, где первые 5 аминокислот были удалены у N-конца, а остаток аспарагиновой кислоты в положении 4 (в положении 9 нативного глюкагона) был заменен цистеиновой кислотой или гомоцистеиновой кислотой. В некоторых вариантах изобретения, пептид класса 4 содержит пептид глюкагона, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1339, SEQ ID NO: 1307 и SEQ ID NO: 1308. В некоторых вариантах изобретения, пептид класса 4 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1308, где аминокислотой в положении 4 является гомоцистеиновая кислота.
В другом варианте изобретения, пептид класса 4 SEQ ID NO: 1339 был также модифицирован путем замены остатка аспарагиновой кислоты в положении 4 (в положении 9 нативного глюкагона) глутаминовой кислотой, гомоглутаминовой кислотой, β-гомоглутаминовой кислотой или алкилкарбоксилатным производным цистеина, имеющим структуру:
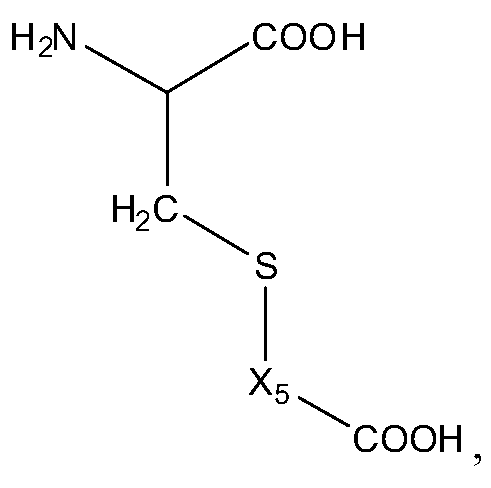
где X5 представляет собой C1-C4алкил, C2-C4алкенил или C2-C4алкинил. В конкретном варианте изобретения, X5 представляет собой C1 или C2алкил.
Однако, заявителями было обнаружено, что замена N-концевого фенилаланина на PLA в дез-1-5-аналоге глюкагона (то есть, в аналоге глюкагона, в котором были делетированы первые пять аминокислот), а также замена нативного остатка аспарагиновой кислоты в положении 4 (в положении 9 нативного глюкагона) не являются необходимыми для получения аналога, обладающего чисто антагонистическим действием. Этот результат является неожиданным, если учесть существовавшее ранее мнение, что для получения высокоаффинных и высокоэффективных антагонистов аналогов глюкагона (2-29) необходимо сделать замену нативного остатка аспарагиновой кислоты в положении 4. PLA-замена приводит к повышению относительной активности Asp9-аналога до уровня, сравнимого с уровнем активности Glu9- и hCys(SO3H)9-аналогов.
Замена фенилаланинового остатка другими аналогами фенилаланина, включая 3,4-2F-фенилаланин (3,4-2F-Phe), 2-нафтилаланин (2-Nal), N-ацилфенилаланин (Ac-Phe), альфа-метилгидрокоричную кислоту (MCA) и бензилмалоновую кислоту (BMA), не дает такого эффекта, как PLA-замена.
PLA-замена в других положениях, кроме положения 6 (в соответствии с нумерацией аминокислот нативного глюкагона), включая положения 4 и 5, показала, что PLA6-аналог является значительно более сильным антагонистом, чем аналоги глюкагона, имеющие небольшое удлинение у N-конца. Настоящее изобретение также включает аналоги, в которых N-концевая аминогруппа заменена ацилированными или алкилированными «O-концевыми» пептидами.
Кроме того, PLA6-замена не только повышает активность антагониста, но также играет важную роль в ПЭГилировании. PLA6-аналоги может быть селективно ПЭГилированы без восстановления глюкагон-агонистического действия. Было неожиданно обнаружено, что в отсутствии PLA-замены, ПЭГилирование аналога индуцирует глюкагон-агонистическое действие. Такого глюкагон-агонистического действия не наблюдается в ПЭГилированных PLA6-аналогах. Было исследовано несколько сайтов ПЭГилирования, включающих положения 3, 6 и 19 (положения 8, 11 и 19 нативного глюкагона) и N-концевой аминокислотный остаток. В некоторых вариантах изобретения, ПЭГилирование происходит в положении 19 (в положении 24 нативного глюкагона), поскольку этот сайт сообщает наиболее эффективное и селективное глюкагон-антагонистическое действие.
В некоторых вариантах изобретения, пептид класса 4 содержит общую структуру A-B-C, где A выбран из группы, состоящей из:
(i) фенилмолочной кислоты (PLA);
(ii) окси-производного PLA;
(iii) пептида из 2-6 аминокислот, в котором две смежных аминокислоты пептида связаны посредством сложноэфирной или простой эфирной связи;
B представляет собой аминокислоты i-26 SEQ ID NO: 1301, где i равно 3, 4, 5, 6 или 7, содержащие, но необязательно, одну или несколько аминокислотных модификаций, выбранных из группы, состоящей из:
(iv) замены Asp в положении 9 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301) на Glu, сульфоновокислотное производное Cys, гомоглутаминовую кислоту, β-гомоглутаминовую кислоту или алкилкарбоксилатное производное цистеина, имеющее структуру:
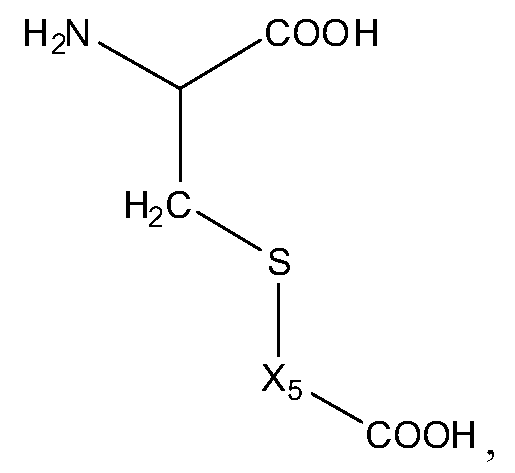
где X5 представляет собой C1-C4алкил, C2-C4алкенил или C2-C4алкинил;
(v) замены одной или двух аминокислот в положениях 10, 20 и 24 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301), аминокислотой, ковалентно связанной с ацильной группой или алкильной группой посредством сложноэфирной, эфирной, тиоэфирной, амидной или алкиламиновой связи;
(vi) замены одной или двух аминокислот в положениях 16, 17, 20, 21 и 24 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301), аминокислотой, выбранной из группы, состоящей из Cys, Lys, орнитина, гомоцистеина и ацетилфенилаланина (Ac-Phe), где аминокислота указанной группы ковалентно связана с гидрофильной группой;
(vii) замены Asp в положении 15 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301) цистеиновой кислотой, глутаминовой кислотой, гомоглутаминовой кислотой и гомоцистеиновой кислотой;
(viii) замены Ser в положении 16 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301) цистеиновой кислотой, глутаминовой кислотой, гомоглутаминовой кислотой и гомоцистеиновой кислотой;
(ix) замены аминокислотой AIB в одном или нескольких положениях 16, 20, 21 и 24 в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1301;
и C выбран из группы, состоящей из:
(х) X;
(xi) X-Y;
(xii) X-Y-Z; и
(xiii) X-Y-Z-R10,
где X представляет собой Met, Leu или Nle; Y представляет собой Asn или заряженную аминокислоту; Z представляет собой Thr, Gly, Cys, Lys, орнитин (Orn), гомоцистеин, ацетилфенилаланин (Ac-Phe) или заряженную аминокислоту; где R10 выбран из группы, состоящей из SEQ ID NN: 1319-1321 и 1353; и
(xiv) любой из групп (x)-(xiii), в которых C-концевой карбоксилат заменен амидом.
В конкретном аспекте изобретения, пептид класса 4 содержит окси-производное PLA. Используемый здесь термин «окси-производное PLA» означает соединение, имеющее модифицированную структуру PLA, в которой гидроксильная группа заменена O-R11, где R11 представляет собой химическую группу. В соответствии с этим, окси-производным PLA может быть, например, сложный эфир PLA или простой эфир PLA.
Методы получения окси-производных PLA известны специалистам. Так, например, если окси-производным является сложный эфир PLA, то такой сложный эфир может быть получен посредством реакции взаимодействия гидроксила PLA с карбонилом, несущим нуклеофил. Нуклеофилом может быть любой подходящий нуклеофил, включая, но не ограничиваясь ими, амин или гидроксил. В соответствии с этим, сложный эфир PLA может иметь структуру формулы IV:
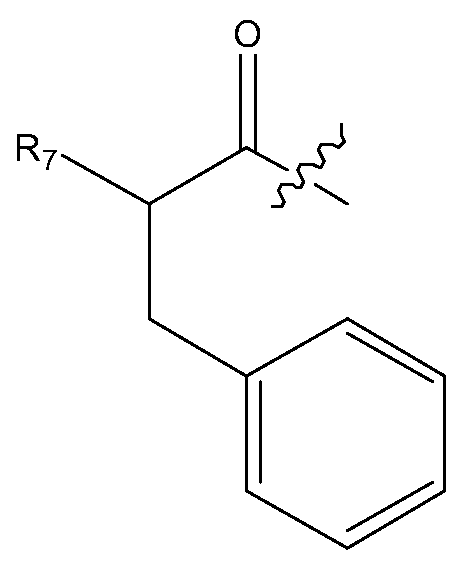
Формула IV
где R7 представляет собой сложный эфир, полученный посредством реакции взаимодействия гидроксила PLA с карбонилом, несущим нуклеофил.
Карбонилом, несущим нуклеофил (который реагирует с гидроксилом PLA с образованием сложного эфира), может быть, например, карбоновая кислота, производное карбоновой кислоты или активированный сложный эфир карбоновой кислоты. Производным карбоновой кислоты может быть, но не ограничивается ими, ацилхлорид, ангидрид кислоты, амид, сложный эфир или нитрил. Активированным сложным эфиром карбоновой кислоты может быть, например, N-гидроксисукцинимид (NHS), тозилат (Tos), карбодиимид или гексафторфосфат. В некоторых вариантах изобретения, карбодиимидом является 1,3-дициклогексилкарбодиимид (DCC), 1,1'-карбонилдимидазол (CDI), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) или 1,3-диизопропилкарбодиимид (DICD). В некоторых вариантах изобретения, гексафторфосфат выбран из группы, состоящей из гексафторфосфата бензотриазол-1-илокси-трис(диметиламино)фосфония (BOP), гексафторфосфата бензотриазол-1-ил-окситрипирролидинфосфония (PyBOP), гексафторфосфата 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) и гексафторфосфата o-бензотриазол-N,N,N',N'-тетраметилурония (HBTU).
Методы получения простых эфиров посредством реакции взаимодействия с гидроксильной группой (например, с гидроксилом PLA) также известны специалистом. Так, например, гидроксильная группа PLA может реагировать с галогенированным алкиловым спиртом или тозилированным алкиловым спиртом с образованием простой эфирной связи.
Вообще говоря, химической группой R11 является группа, которая не снижает активность пептида класса 4. В некоторых вариантах изобретения, такая химическая группа повышает активность, стабильность и/или растворимость пептида класса 4.
В конкретном варианте изобретения, химической группой, связанной с PLA посредством кислород-содержащей связи (например, сложноэфирной связи или простой эфирной связи), является полимер (например, полиалкиленгликоль), углевод, аминокислота, пептид или липид, например, жирная кислота или стероид.
В конкретном варианте изобретения, химической группой является аминокислота, представляющая собой, но необязательно, часть пептида, который согласно формуле IV является депсипептидом. В этой связи следует отметить, что PLA может присутствовать в положении, не являющемся положением N-концевого аминокислотного остатка пептида класса 4, то есть, в положении, в котором этот пептид класса 4 содержит одну или несколько (например, 1, 2, 3, 4, 5, 6 или более) аминокислот со стороны N-конца по отношению к остатку PLA. Так, например, пептид класса 4 может содержать PLA в положении n пептида класса 4, где n равно 2, 3, 4, 5 или 6.
Аминокислоты со стороны N-конца по отношению к остатку PLA могут быть синтетическими или природными. В конкретном варианте изобретения, аминокислоты, присутствующие со стороны N-конца по отношению к PLA, являются природными аминокислотами. В некоторых вариантах изобретения, аминокислоты, присутствующие со стороны N-конца по отношению к PLA, являются N-концевыми аминокислотами нативного глюкагона. Так, например, пептид класса 4 может содержать у N-конца любую аминокислотную последовательность SEQ ID NN: 1354-1358, где PLA связан с треонином посредством сложноэфирной связи:
SEQ ID NO 1354 His-Ser-Gln-Gly-Thr-PLA
SEQ ID NO 1355 Ser-Gln-Gly-Thr-PLA
SEQ ID NO 1356 Gln-Gly-Thr-PLA
SEQ ID NO 1357 Gly-Thr-PLA
SEQ ID NO 1358 Thr-PLA
В альтернативном варианте изобретения, одна или несколько N-концевых аминокислот могут быть заменены аминокислотой, отличающейся от аминокислоты нативного глюкагона. Так, например, если пептид класса 4 содержит PLA в качестве аминокислоты в положении 5 или 6, то аминокислота в положении 1 и/или в положении 2 может представлять собой аминокислоту, которая снижает чувствительность к расщеплению дипептидил-пептидазой IV. Более конкретно, в некоторых вариантах изобретения, аминокислотой в положении 1 пептида класса 4 является аминокислота, выбранная из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Более конкретно, в некоторых вариантах изобретения, аминокислотой в положении 2 пептида-антагониста является аминокислота, выбранная из группы, состоящей из D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (AIB). Кроме того, например, если пептид класса 4 содержит PLA в качестве аминокислоты в положении 4, 5 или 6, то аминокислотой в положении 3 пептида класса 4 может быть глутаминовая кислота, а в нативном глюкагоне, такой аминокислотой является нативный глутаминовый остаток. В репрезентативном варианте изобретения, пептид класса 4 содержит у своего N-конца любую из аминокислотных последовательностей SEQ ID NN: 1359-1361.
Что касается пептидов класса 4, содержащих соединение формулы IV, то полимером может быть любой полимер, при условии, что он может реагировать с гидроксильной группой PLA. Полимером может быть полимер, который по своей природе или обычно содержит карбонил, несущий нуклеофил. Альтернативно, таким полимером может быть полимер, который был дериватизирован так, чтобы он содержал карбонил, несущий карбонил. Указанным полимером может быть любой дериватизированный полимер, выбранный из: полиамидов, поликарбонатов, полиалкиленов и их производных, включая полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, полимеры сложных эфиров акриловой и метакриловой кислоты, включая полиметилметакрилат, полиэтилметакрилат, полибутилметакрилат, полиизобутилметакрилат, полигексилметакрилат, полиизодецилметакрилат, полилаурилметакрилат, полифенилметакрилат, полиметилакрилат, полиизопропилакрилат, полиизобутилакрилат, и полиоктадецилакрилат; поливиниловых полимеров, включая поливиниловые спирты, поливиниловые простые эфиры, поливиниловые сложные эфиры, поливинилгалогениды, поливинилацетат и поливинилпирролидон; полигликолидов, полисилоксанов, полиуретанов и их сополимеров; целлюлоз, включая алкилцеллюлозу, гидроксиалкилцеллюлозы, простые эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксибутилметилцеллюлозу, ацетат целлюлозы, пропионат целлюлозы, ацетат-бутират целлюлозы, ацетат-фталат целлюлозы, карбоксиэтилцеллюлозу, триацетат целлюлозы и натриевую соль сульфата целлюлозы; полипропилена, полиэтиленов, включая полиэтиленгликоль, полиэтиленоксид и полиэтилентерефталат, и полистирола.
Полимером может быть биологически разлагаемый полимер, включая синтетический биологически разлагаемый полимер (например, полимер молочной кислоты и гликолевой кислоты, полиангидриды, полиортоэфиры, полиуретаны, полибутановая кислота, поливалериановая кислота и сополимер лактида и капролактона) и природный биологически разлагаемый полимер (например, альгинат и другие полисахариды, включая декстран и целлюлозу, коллаген, их химические производные (замены, добавления химических групп, например, алкила, алкилена; продукты гидроксилирования, окисления и другие модификации, которые могут быть осуществлены рутинным способом), альбумин и другие гидрофильные белки (например, зеин и другие проламины и гидрофобные белки)), а также любой их сополимер или их смесь. Вообще говоря, эти вещества разлагаются либо посредством ферментативного гидролиза, либо под действием воды in vivo, посредством поверхностной эрозии или эрозии при растворении.
Полимером может быть биоадгезивный полимер, такой как биоэрозивный гидрогель, описанный в публикации H. S. Sawhney, C. P. Pathak и J. A. Hubbell in Macromolecules, 1993, 26, 581-587, которая вводится в настоящее описание посредством ссылки, полигиалуроновые кислоты, казеин, желатин, глютин, полиангидриды, полиакриловая кислота, альгинат, хитозан, полиметилметакрилат, полиэтилметакрилаты, полибутилметакрилаты, полиизобутилметакрилат, полигексилметакрилат, полиизодецилметакрилат, полилаурилметакрилат, полифенилметакрилат, полиметилакрилат, полиизопропилакрилат, полиизобутилакрилат и полиоктадецилакрилат.
В некоторых вариантах изобретения, полимером является водорастворимый полимер. Подходящие водорастворимые полимеры известны специалистам, и ими являются, например, поливинилпирролидон, гидроксипропилцеллюлоза (HPC; Klucel), гидроксипропилметилцеллюлоза (HPMC; Methocel), нитроцеллюлоза, гидроксипропилэтилцеллюлоза, гидроксипропилбутилцеллюлоза, гидроксипропилпентилцеллюлоза, метилцеллюлоза, этилцеллюлоза (Ethocel), гидроксиэтилцеллюлоза, различные алкилцеллюлозы и гидроксиалкилцеллюлозы, различные простые эфиры целлюлозы, ацетат целлюлозы, карбоксиметилцеллюлоза, натрий-содержащая карбоксиметилцеллюлоза, кальций-содержащая карбоксиметилцеллюлоза, сополимеры винилацетата/кротоновой кислоты, полигидроксиалкилметакрилат, гидроксиметилметакрилат, сополимеры метакриловой кислоты, полиметакриловая кислота, полиметилметакрилат, сополимеры ангидрида малеиновой кислоты/метилвинилового эфира, поливиниловый спирт, натрий- и кальций-содержащая полиакриловая кислота, полиакриловая кислота, кислотные карбоксиполимеры, карбоксиполиметилен, карбоксивиниловые полимеры, сополимер полиоксиэтилена-полиоксипропилена, сополимер полиметилвинилового эфира и ангидрида малеиновой кислоты, карбоксиметиламид, сополимер метакрилата калия и дивинилбензола, полиоксиэтиленгликоли, полиэтиленоксид и их производные, соли и комбинации.
В конкретном варианте изобретения, указанным полимером является полиалкиленгликоль, включая, например, полиэтиленгликоль (ПЭГ).
Углеводом может быть любой углевод, при условии, что он содержит или может быть получен так, чтобы он содержал карбонил с уходящей альфа-группой. Углеводом, например, может быть углевод, который был дериватизирован так, чтобы он содержал карбонил с уходящей альфа-группой. В соответствии с этим, углевод может представлять собой дериватизированную форму моносахарида (например, глюкозы, галактозы, фруктозы), дисахарида (например, сахарозы, лактозы, мальтозы), олигосахарида (например, раффинозы, стахиозы), полисахарида (крахмала, амилозы, амилопектина, целлюлозы, хитина, каллозы, ламинарина, ксилана, маннана, фукоидана, галактоманнана).
Что касается пептидов класса 4, содержащих соединение формулы IV, то липидом может быть любой липид, содержащий карбонил с уходящей альфа-группой. Липидом, например, может быть липид, который был дериватизирован так, чтобы он содержал карбонил. В соответствии с этим, липид может представлять собой производное жирной кислоты (например, жирной C4-C30-кислоты, эйкозаноида, простагландина, лейкотриена, тромбоксана, N-ацилэтаноламина), глицеролипида (например, моно-, ди-, три-замещенных глицеринов), глицерофосфолипида (например, фосфатидилхолина, фосфатидилинозита, фосфатидилэтаноламина, фосфатидилсерина), сфинголипида (например, сфингозина, церамида), стеролового липида (например, стироида, холестерина), пренолового липида, сахаролипида или поликетида, масла, воска, холестерина, стирола, растворимого в жирах витамина, моноглицерида, диглицерида, триглицерида, фосфолипида.
В некоторых вариантах изобретения, R7 имеет молекулярную массу примерно 100 кДа или менее, например, примерно 90 кДа или менее, примерно 80 кДа или менее, примерно 70 кДа или менее, примерно 60 кДа или менее, примерно 50 кДа или менее, примерно 40 кДа или менее. В соответствии с этим, R7 может иметь молекулярную массу примерно 35 кДа или менее, примерно 30 кДа или менее, примерно 25 кДа или менее, примерно 20 кДа или менее, примерно 15 кДа или менее, примерно 10 кДа или менее, примерно 5 кДа или менее, или примерно 1 кДа.
В альтернативном варианте изобретения, пептид класса 4 содержит в качестве группы A пептид, состоящий из 2-6 аминокислот, где две смежные аминокислоты указанного пептида связаны посредством сложной эфирной или простой эфирной связи. Сложная эфирная или простая эфирная связь может присутствовать, например, между аминокислотами 2 и 3, 3 и 4, 4 и 5 или 5 и 6. Пептид может быть также, но необязательно, модифицирован посредством ковалентной связи с другой химической группой, включая образование связи с полимером (например, гидрофильным полимером), алкилирование или ацилирование.
Что касается пептида класса 4, имеющего общую структуру A-B-C, то B представляет собой аминокислоты нативного глюкагона, например, i-26 SEQ ID NO: 1301, где i равно 3, 4, 5, 6 или 7, содержащие, но необязательно, одну или несколько аминокислотных модификаций. В конкретном варианте изобретения, B представляет собой аминокислоты 7-26 SEQ ID NO: 1301, которые могут быть также, но необязательно, модифицированы.
В некоторых вариантах изобретения, B может иметь до трех аминокислотных модификаций. Так, например, B, который представляет собой нативную аминокислотную последовательность SEQ ID NO: 1301, модифицируют посредством введения одной или нескольких консервативных аминокислотных модификаций.
В другом варианте изобретения, B содержит одну или несколько аминокислотных модификаций, выбранных из группы, состоящей из модификаций (iv)-(ix), описанных в настоящей заявке. В конкретном варианте изобретения, B содержит одну из аминокислотных модификаций (v) и (vi), или обе эти модификации. В другом конкретном варианте изобретения, B, помимо модификаций (v) и (vi), также содержит одну или комбинацию аминокислотных модификаций, выбранных из группы, состоящей из (iv), (vii), (viii) и (ix).
В другом конкретном варианте изобретения, пептид класса 4 содержит одну или несколько заряженных аминокислот у С-конца. Так, например, Y и/или Z могут представлять собой заряженную аминокислоту, например, Lys, Arg, His, Asp и Glu. В другом варианте изобретения, пептид класса 4 содержит одну или две заряженных аминокислоты (например, Lys, Arg, His, Asp и Glu) со стороны C-конца по отношению к Z. В конкретном аспекте изобретения, Z, за которым следует одна или две заряженных аминокислоты, не содержит R10.
В некоторых вариантах изобретения, пептид класса 4 содержит гидрофильную группу, ковалентно связанную с аминокислотным остатком пептида класса 4, как описано в настоящей заявке. Так, например, пептид класса 4 может содержать гидрофильную группу, ковалентно связанную с аминокислотой в положении 1, 16, 20, 21 или 24 в соответствии с нумерацией SEQ ID NO: 1301. В другом варианте изобретения, гидрофильная группа присоединена к С-концевой аминокислоте пептида класса 4, которая, в некоторых случаях, представляет собой 1-ю или 11-ю аминокислоту со стороны C-конца по отношению к Z. В другом варианте изобретения, гидрофильная группа присоединена к PLA, если A представляет собой PLA, PLA-Phe или PLA-Thr-Phe, где PLA модифицирована так, что она содержит гидрофильную группу. В другом варианте изобретения, аминокислота, содержащая гидрофильную группу, добавлена к N- или C-концу пептида класса 4. В другом варианте изобретения, пептид класса 4 содержит описанную здесь ацильную группу или алкильную группу. Так, например, ацилирование или алкилирование может происходить от боковой цепи аминокислоты в положении 10, 20 или 24, в соответствии с нумерацией SEQ ID NO: 1301. В альтернативном варианте изобретения, ацилирование или алкилирование может происходить от боковой цепи С-концевой аминокислоты пептида класса 4, которая, в некоторых случаях, представляет собой 1-ю или 11-ю аминокислоту со стороны C-конца по отношению к Z. В другом варианте изобретения, если A представляет собой PLA, PLA-Phe или PLA-Thr-Phe, то PLA модифицирована так, что она содержит ацильную или алкильную группу.
Репрезентативные варианты изобретения
Пептид класса 4 может содержать любые аминокислоты, как синтетические, так и природные, при условии, что по меньшей мере две смежных аминокислоты данного пептида связаны друг с другом посредством сложной эфирной или простой эфирной связи. В конкретном варианте изобретения, указанный пептид содержит аминокислоты нативного глюкагона. Так, например, указанный пептид может содержать j-6 нативного глюкагона (SEQ ID NO: 1301), где j равно 1, 2, 3, 4 или 5. Альтернативно, данный пептид может содержать аминокислотную последовательность у N-конца SEQ ID NO: 1301 с одной или несколькими аминокислотными модификациями. Аминокислотой в положении 1 и/или в положении 2 может быть аминокислота, которая снижает чувствительность к расщеплению дипептидил-пептидазой IV. Так, например, пептид класса 4 может содержать в положении 1 аминокислоту, выбранную из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Более конкретно, в некоторых вариантах изобретения, аминокислотой в положении 2 пептида-антагониста является аминокислота, выбранная из группы, состоящей из D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (AIB). Кроме того, например, аминокислотой в положении 3 пептида класса 4 может быть глутаминовая кислота, а в нативном глюкагоне, такой аминокислотой является нативный глутаминовый остаток. В соответствии с этим, пептид класса 4 может содержать аминокислотную последовательность:
Xaa1-Xaa2-Xaa3-Thr-Gly-Phe (SEQ ID NO: 1368);
Xaa2-Xaa3-Thr-Gly-Phe (SEQ ID NO: 1369); или
Xaa3-Thr-Gly-Phe (SEQ ID NO: 1370);
где Xaa1 выбрана из группы, состоящей из: His, D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина; Xaa2 выбрана из группы, состоящей из: Ser, D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (AIB); а Xaa3 представляет собой Gln или Glu.
Настоящее изобретение также охватывает варианты, в которых C-концевая аминокислота пептидов класса 4, вместо карбоксильной группы, присутствующей в нативной аминокислоте, имеет амидную группу.
В некоторых вариантах изобретения, в которых пептид класса 4 является ПЭГилированным, такой пептид класса 4 содержит укороченные пептиды глюкагона, в частности, 6-29, где «N-концевой» аминокислотой является PLA (фенилмолочная кислота). Такие производные глюкагона обладают уникальными свойствами. Такие производные являются более активными пептидами, чем пептиды, содержащие нативный N-концевой фенилаланин, и ингибируют любую глюкагон-агонистическую активность, вызываемую ПЭГилированием, что обычно не наблюдается в случае нативного фенилаланина. И наконец, хотя в современной литературе указывается, что замена нативной аспарагиновой кислоты в положении 9 необходима для достижения антагонистической активности, однако, заявителями было неожиданно обнаружено, что такая замена не требуется в аналогах PLA6-(6-29)глюкагона.
В некоторых вариантах изобретения, аминокислота пептида класса 4 заменена по меньшей мере одним цистеиновым остатком, где боковая цепь цистеинового остатка была дополнительно модифицирована реагентом, взаимодействующим с тиолом, включая, например, малеимидо, винилсульфон, 2-пиридилтио, галогеналкил и галогенацил. Эти реагирующие с тиолом реагенты могут содержать карбокси-, кето-, гидроксильную и эфирную группы, а также другие гидрофильные группы, такие как полиэтиленгликолевые звенья. В альтернативном варианте изобретения, аминокислота пептида класса 4 заменена лизином, а боковая цепь замещающего лизинового остатка также модифицирована с использованием реагирующих с амином реагентов, таких как активные сложные эфиры (сукцинимидо, ангидрид и т.п.) карбоновых кислот или альдегиды гидрофильных групп, таких как полиэтиленгликоль. В соответствии с некоторыми вариантами изобретения, лизиновый остаток, соответствующий положению 12 нативного пептида, заменен аргинином, а одна из аминокислот, соответствующих положению 1, 16, 17, 20, 21, 24 или 29 нативного пептида, заменена одним лизином, либо этот лизин добавлен к N- или C-концу пептида класса 4.
В другом варианте изобретения, метиониновый остаток, соответствующий положению 27 нативного пептида, заменяют лейцином или норлейцином для предупреждения окислительного разложения пептида.
В некоторых вариантах изобретения, описанные здесь пептиды класса 4 дополнительно модифицируют путем усечения или делеции одной или двух аминокислот у С-конца пептида глюкагона (то есть, усечения аминокислот в положении 29 или в положениях 28 и 29 нативного глюкагона) так, чтобы эти модификации не влияли на активность и/или эффективность по отношению к рецептору глюкагона. В соответствии с этим, описанный здесь пептид класса 4 может, по существу, состоять, либо он может состоять из аминокислот 1-27, 1-28, 2-27, 2-28, 3-27, 3-28, 4-27, 4-28, 5-27, 5-28, 6-27, или 6-28 нативного пептида глюкагона (SEQ ID NO: 1301) с одной или несколькими модификациями, сообщающими активность пептиду класса 4, как описано в настоящей заявке.
Описанные в настоящей заявке пептиды класса 4 также включают аминокислотные замены в положениях, которые, как известно, не играют решающей роли в функционировании пептида глюкагона. В некоторых вариантах изобретения, заменами являются консервативные аминокислотные замены в одном, двух или трех положениях, выбранных из группы, состоящей из 2, 5, 6, 7, 8, 9, 12, 13, 14, 15, 16, 19, 22, 23 или 24 последовательности SEQ ID NO: 1339. В некоторых вариантах изобретения, пептид класса 4 содержит производное пептида SEQ ID NO: 1342, где пептид глюкагона включает дополнительную аминокислотную замену, по сравнению с SEQ ID NO: 1342 в 1-3 положениях аминокислот, выбранных из положений 2, 5, 6, 8, 9, 12, 13 и 14. В некоторых вариантах изобретения, заменами в положениях 2, 5, 6, 8, 9, 12, 13 и 14 SEQ ID NO: 1342 являются консервативные аминокислотные замены. В некоторых вариантах изобретения, аминокислоты, соответствующие положениям 16, 17, 20, 21, 24 или 29 нативного пептида, а более конкретно, в положении 21 и/или 24, заменены цистеином или лизином, где ПЭГ-цепь ковалентно связана с замененным цистеиновым или лизиновым остатком.
В соответствии с некоторыми вариантами изобретения, модифицированный пептид класса 4 содержит две или более полиэтиленгликолевых цепи, ковалентно связанных с пептидом, где общая молекулярная масса цепей глюкагона составляет примерно от 1000 до 5000 дальтон. В некоторых вариантах изобретения, ПЭГилированный пептид класса 4 содержит пептид, выбранный из группы, состоящей из SEQ ID NO: 1312 и SEQ ID NO: 1322, где указанный пептид содержит полиэтиленгликолевую цепь, связанную с аминокислотой в положениях 11 и 19, а общая молекулярная масса двух ПЭГ-цепей составляет примерно 1000-5000 дальтон.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 4, содержащему модифицированный пептид глюкагона, выбранный из группы, состоящей из:
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Xaa-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1309),
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Xaa-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Xaa-Phe-Val-Gln-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1310),
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Xaa-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Xaa-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1311) и
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Xaa-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Xaa-Phe-Val-Xaa-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1312),
где Xaa в положении 4 представляет собой аспарагиновую кислоту, глутаминовую кислоту, цистеиновую кислоту или гомоцистеиновую кислоту; Xaa в положении 7 представляет собой Lys или Arg, Xaa в положении 10 представляет собой аспарагиновую кислоту, цистеиновую кислоту, глутаминовую кислоту, гомоглутаминовую кислоту и гомоцистеиновую кислоту; Xaa в положении 11 представляет собой Ser, Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин, Xaa в положении 16 представляет собой Asp, Lys, Cys, Orn, гомоцистеин и ацетилфенилаланин; а Xaa в положении 19 представляет собой Gln, Lys, Cys, Orn, гомоцистеин и ацетилфенилаланин; Xaa в положении 22 представляет собой Met, Leu или Nle, R1 представляет собой OH или NH2, а R2 представляет собой COOH или CONH2, где указанный пептид является ПЭГилированным в положении 11 для SEQ ID NO: 1309, в положении 16 для SEQ ID NO: 1310, в положении 19 для SEQ ID NO: 1311 и в положениях 16 и 19 для SEQ ID NO: 1312, при условии, что если Xaa в положении 4 представляет собой аспарагиновую кислоту, то R1 представляет собой OH. В соответствии с некоторыми вариантами изобретения, пептид содержит последовательность SEQ ID NO: 1309, SEQ ID NO: 1310 или SEQ ID NO: 1311, где R1 представляет собой OH, а R2 представляет собой CONH2. В некоторых вариантах изобретения, пептид содержит последовательность SEQ ID NO: 1309, SEQ ID NO: 1310 или SEQ ID NO: 1311, где R1 представляет собой OH, R2 представляет собой CONH2, а аминокислотой в положении 4 является аспарагиновая кислота, а в другом варианте изобретения, такие пептиды содержат карбокси-концевое удлинение, включающее последовательность SEQ ID NO: 1319.
В соответствии с некоторыми вариантами изобретения, пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1313, SEQ ID NO: 1314 и SEQ ID NO: 1316, где указанный пептид ПЭГилирован в положении 11 для SEQ ID NO: 1309 и SEQ ID NO: 1313, ПЭГилирован в положении 16 для SEQ ID NO: 1310, и ПЭГилирован в положении 19 для SEQ ID NO: 1310 и SEQ ID NO: 1314. В некоторых вариантах изобретения, агонист глюкагона содержит пептид SEQ ID NO: 1313 или SEQ ID NO: 1314. В некоторых вариантах изобретения, C-концевая аминокислота описанных здесь пептидов класса 4, вместо карбоксильной группы, присутствующей в нативной аминокислоте, имеет амидную группу. В соответствии с некоторыми вариантами изобретения, пептид класса 4 содержит последовательность SEQ ID NO: 1318.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 4, где белок плазмы был ковалентно связан с аминокислотной боковой цепью пептида в целях повышения растворимости, стабильности и/или фармакокинетических свойств пептида глюкагона. Так, например, сывороточный альбумин может быть ковалентно связан с описанными здесь пептидами класса 4. В некоторых вариантах изобретения, белок плазмы ковалентно связан с аминокислотой, соответствующей положениям 16, 17, 20, 21, 24 или 29 нативного пептида глюкагона. Более конкретно, в некоторых вариантах изобретения, белок плазмы связан с аминокислотой, соответствующей положению 16 или 24 нативного пептида глюкагона, где пептид класса 4 содержит последовательность SEQ ID NO: 1303, SEQ ID NO: 1304, SEQ ID NO: 1305, SEQ ID NO: 1306, SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1309, SEQ ID NO: 1311, SEQ ID NO: 1312, SEQ ID NO: 1322, SEQ ID NO: 1323, SEQ ID NO: 1324, SEQ ID NO: 1325, SEQ ID NO: 1326, SEQ ID NO: 1327, SEQ ID NO: 1328, SEQ ID NO: 1336 и SEQ ID NO: 1339. В некоторых вариантах изобретения, пептид класса 4 содержит пептид, выбранный из группы, состоящей из SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311 и SEQ ID NO: 1312.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 4, в котором прямая аминокислотная последовательность, представляющая собой Fc-часть молекулы иммуноглобулина, была ковалентно связана с аминокислотной боковой цепью описанного здесь пептида класса 4 в целях повышения растворимости, стабильности и/или фармакокинетических свойств пептида глюкагона. Так, например, аминокислотная последовательность, представляющая собой Fc-часть молекулы иммуноглобулина, может быть ковалентно связана в положении аминокислот 11, 12, 15, 16, 19, 21 или 24 пептида глюкагона SEQ ID NO: 1307, SEQ ID NO: 1339, или аналога глюкагона. В некоторых вариантах изобретения, Fc-пептид ковалентно связан с аминокислотами в положении 11 или 19 пептида класса 4 SEQ ID NO: 1306, SEQ ID NO: 1307, SEQ ID NO: 1308 или SEQ ID NO: 1336. Fc-часть обычно изолирована от IgG, но Fc-фрагмент пептида любого иммуноглобулина должен иметь эквивалентную функцию. В некоторых вариантах изобретения, пептид глюкагона выбран из группы, состоящей из SEQ ID NO: 1303, SEQ ID NO: 1304, SEQ ID NO: 1305, SEQ ID NO: 1307, SEQ ID NO: 1308 и SEQ ID NO: 1339, где Fc-часть связана с аминокислотой в соответствующем положении 16, 17, 20, 21, 24 или 29 нативного пептида глюкагона. В некоторых вариантах изобретения, пептид класса 4 содержит пептид глюкагона, выбранный из группы, состоящей из SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311 и SEQ ID NO: 1312, где Fc-пептид связан с боковой цепью аминокислоты, присутствующей в положении 11, 16 или 19 SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311, соответственно, и в обоих положениях 11 и 19 для SEQ ID NO: 1312.
В некоторых вариантах изобретения, пептид класса 4 содержит любую из аминокислотных последовательностей SEQ ID NN: 1362, 1364-1367 и 1371.
Модификации, вводимые для повышения растворимости
Пептиды класса 4 могут быть дополнительно модифицированы для улучшения растворимости пептида в водных растворах при физиологическом pH, а в некоторых аспектах изобретения, глюкагон-антагонистическая активность пептидов сохраняется. Введение гидрофильных групп в положениях, соответствующих положениям 1, 16, 17, 20, 21, 24 и 29 нативного пептида, или у его C-конца, может приводить к улучшению растворимости пептида класса 4 в растворах, имеющих физиологический pH, а в некоторых аспектах изобретения, антагонистическая активность родительских соединений сохраняется. Поэтому, в некоторых описанных здесь вариантах изобретения, описанные здесь пептиды класса 4 являются дополнительно модифицированными так, чтобы они содержали одну или несколько гидрофильных групп, ковалентно связанных с боковыми цепями аминокислот, соответствующих положениям аминокислот 1, 16, 17, 20, 21, 24 и 29 нативного пептида глюкагона или N- или C-концевой аминокислоты. В другом варианте изобретения, боковые цепи аминокислот, соответствующих положениям аминокислот 16 и 24 нативного пептида глюкагона, ковалентно связаны с гидрофильными группами, и в некоторых вариантах изобретения, такой гидрофильной группой является полиэтиленгликоль (ПЭГ).
Авторами настоящей заявки было также обнаружено, что нативный глюкагон может быть модифицирован путем сообщения заряда в его карбокси-конец для повышения растворимости пептида с сохранением агонистических свойств данного пептида. Такая повышенная растворимость позволяет получать и сохранять растворы глюкагона при pH, близком к нейтральному. Приготовление растворов глюкагона при относительно нейтральных pH (при pH примерно от 6,0 до 8,0) обеспечивает более длительную стабильность пептидов класса 4.
И в этом случае, авторами настоящего изобретения было высказано предположение, что описанные здесь пептиды класса 4 могут быть аналогичным образом модифицированы для повышения их растворимости в водных растворах при относительно нейтральном рН (например, при рН примерно 6,0-8,0) с сохранением антагонистических свойства родительского белка. В соответствии с этим, в некоторых своих вариантах, настоящее изобретение относится к пептиду класса 4 SEQ ID NO: 1339, в который были внесены дополнительные модификации по сравнению с нативными аминокислотами, присутствующими в положениях 6-29 глюкагона дикого типа (SEQ ID NO: 1301), а именно, сообщение указанному пептиду заряда путем замены нативных незаряженных аминокислот заряженными аминокислотами, или добавления заряженных аминокислот к карбокси-концу. В соответствии с некоторыми вариантами изобретения, 1-3 незаряженных нативных аминокислоты пептида класса 4 SEQ ID NO: 1339 заменены заряженной аминокислотой. В некоторых вариантах изобретения, заряженная аминокислота выбрана из группы, состоящей из лизина, аргинина, гистидина, аспарагиновой кислоты и глутаминовой кислоты. Более конкретно, авторами настоящего изобретения было обнаружено, что замена природной аминокислоты в соответствующем положении 28 и/или 29 по сравнению с нативным глюкагоном, заряженными аминокислотами и/или добавление одной или двух заряженных аминокислот к карбокси-концу пептида класса 4, будет приводить к повышению растворимости и стабильности пептидов класса 4 в водных растворах при физиологически приемлемых pH (то есть, при pH примерно 6,5-7,5). В соответствии с этим, предполагается, что такие модификации, внесенные в описанный здесь пептид класса 4, будут оказывать аналогичное влияние на растворимость в водных растворах, а в частности, при рН примерно от 5,5 до 8,0, и при этом, будет сохраняться биологическая активность родительского пептида.
В соответствии с некоторыми вариантами изобретения, пептид класса 4 SEQ ID NO: 1339 модифицирован путем замены нативной аминокислоты в соответствующем положении 28 и/или 29 по сравнению с нативным глюкагоном, отрицательно заряженной аминокислотой (например, аспарагиновой кислотой или глутаминовой кислотой) и, необязательно добавления отрицательно заряженной аминокислоты (например, аспарагиновой кислоты или глутаминовой кислоты) к карбокси-концу пептида. В альтернативном варианте изобретения, пептид класса 4 SEQ ID NO: 1339 модифицирован путем замены нативной аминокислоты в соответствующем положении 29 по сравнению с нативным глюкагоном, положительно заряженной аминокислотой (например, лизином, аргинином или гистидином) и, необязательно, добавления одной или двух положительно заряженных аминокислот (например, лизина, аргинина или гистидина) к карбокси-концу пептида. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 4, обладающему повышенной растворимостью и стабильностью, где указанный пептид содержит аминокислотную последовательность SEQ ID NO: 1341, при условии, что по меньшей мере одна из аминокислот в положении 23 или 24 SEQ ID NO: 1341 заменена кислотной аминокислотой и/или при условии, что к карбокси-концу SEQ ID NO: 1341 была добавлена дополнительная кислотная аминокислота. В некоторых вариантах изобретения, кислотные аминокислоты независимо выбраны из группы, состоящей из Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 4, обладающему повышенной растворимостью и стабильностью, где указанный антагонист содержит аминокислотную последовательность SEQ ID NO: 1341, SEQ ID NO: 1342, SEQ ID NO: 1343 или SEQ ID NO: 1344, где по меньшей мере одна из аминокислот в положениях 23 или 24 заменена ненативным аминокислотным остатком (то есть, по меньшей мере одна аминокислота, присутствующая в положении 23 или 24 данного аналога, представляет собой кислотную аминокислоту, отличающуюся от аминокислоты, присутствующей в соответствующем положении в SEQ ID NO: 1307). В соответствии с некоторыми своими вариантами, настоящее изобретение относится к агонисту глюкагона, содержащему последовательность SEQ ID NO: 1341 или 1342, при условии, что если аминокислотой в положении 23 является аспарагин, а аминокислотой в положении 24 является треонин, то такой пептид также содержит одну или две аминокислоты, независимо выбранные из группы, состоящей из Lys, Arg, His, Asp или Glu, добавленных к карбокси-концу пептида класса 4.
В другом варианте изобретения, растворимость пептида класса 4 SEQ ID NO: 1342 может быть улучшена путем ковалентного связывания гидрофильной группы с аминокислотным остатком в положении 11, 12, 15, 16, 19 или 24, причем, в некоторых вариантах изобретения, гидрофильная группа связана с аминокислотой в положении 11, 16 или 19, а в другом варианте изобретения, гидрофильная группа связана с аминокислотой в положении 19. В некоторых вариантах изобретения, гидрофильной группой является белок плазмы или Fc-часть иммуноглобулина, а в альтернативном варианте изобретения, гидрофильной группой является гидрофильная углеводородная цепь. В некоторых вариантах изобретения, гидрофильной группой является полиэтиленгликоль, имеющий молекулярную массу примерно 1000- 5000 дальтон. В другом варианте изобретения, гидрофильной группой является полиэтиленгликоль, имеющий молекулярную массу по меньшей мере примерно 20000 дальтон. В некоторых вариантах изобретения, модифицированный полиэтиленом пептид класса 4 содержит аминокислотную последовательность SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311, SEQ ID NO: 1312, SEQ ID NO: 1343, SEQ ID NO: 1344 или SEQ ID NO: 1345.
Модификации, вводимые для повышения стабильности
Последовательность Asp-Ser в положении 15-16 нативного глюкагона была идентифицирована как абсолютно нестабильный дипептид, который приводит к преждевременному химическому расщеплению нативного гормона в водных буферах. Так, например, при выдерживании в 0,01 н. HC1 при 37°C в течение 2 недель, более, чем 50% нативного глюкагона может расщепляться на фрагменты. Два высвобождающихся в результате расщепления пептида 1-15 и 16-29 теряют глюкагон-подобную биологическую активность, а поэтому создают проблемы при приготовлении водного препарата глюкагона и родственных ему аналогов. Как наблюдалось, селективная химическая замена Asp в положении 15 нативного пептида глюкагона аминокислотой Glu фактически устраняет химическое расщепление пептидной связи 15-16.
В соответствии с этим, было высказано предположение, что пептиды класса 4 согласно изобретению могут быть аналогичным образом модифицированы в целях снижения их восприимчивости к преждевременному химическому расщеплению в водных буферах. В соответствии с некоторыми вариантами изобретения, описанные здесь пептиды класса 4 могут быть также модифицированы для повышения их стабильности в водных растворах путем замены нативной аспарагиновой кислоты, расположенной в положении 15 нативного пептида глюкагона, аминокислотой, выбранной из группы, состоящей из цистеиновой кислоты, глутаминовой кислоты, гомоглутаминовой кислоты и гомоцистеиновой кислоты. В соответствии с некоторыми вариантами изобретения, остаток аспарагиновой кислоты в положении 10 пептида класса 4 SEQ ID NO: 1339 может быть заменен аминокислотой, выбранной из группы, состоящей из цистеиновой кислоты, глутаминовой кислоты, гомоглутаминовой кислоты и гомоцистеиновой кислоты, а в некоторых вариантах изобретения, нативная аспарагиновая кислота в положении 10 SEQ ID NO: 1339 заменена глутаминовой кислотой. В некоторых своих вариантах, настоящее изобретение относится к пептиду класса 4, обладающему повышенной стабильностью в водных растворах, где указанный антагонист содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1336, SEQ ID NO: 1340 и SEQ ID NO: 1342. В другом варианте изобретения, пептид класса 4 является амидированным.
В соответствии с некоторыми вариантами изобретения, повышенная стабильность, обусловленная пониженной степенью расщепления описанного здесь пептида класса 4, может быть также достигнута путем замены серина в положении 16 (в соответствии с нумерацией последовательности нативного глюкагона) глутаминовой кислотой, цистеиновой кислотой, гомоглутаминовой кислотой или гомоцистеиновой кислотой. В конкретном варианте изобретения, серин в положении 16 (в соответствии с нумерацией нативного глюкагона) заменен глутаминовой кислотой. В более конкретном аспекте изобретения, пептид класса 4, содержащий такую модификацию, включает С-концевой карбоксилат и не является амидированным.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 4, содержащему пептид глюкагона, выбранный из группы, состоящей из последовательностей SEQ ID NO: 1307, SEQ ID NO: 1336, SEQ ID NO: 1339, SEQ ID NO: 1340, SEQ ID NO: 1341, SEQ ID NO: 1342, SEQ ID NO: 1343 и SEQ ID NO: 1344, которые были дополнительно модифицированы посредством замен одной или нескольких дополнительных аминокислот в положениях, соответствующих положениям 11, 12, 15, 16, 19 и/или 24 нативного пептида глюкагона, где указанные аминокислотные замены включают замену аминокислотой, имеющей боковую цепь, подходящую для перекрестного связывания с гидрофильными группами, включая, например, ПЭГ. Такой пептид может быть заменен природной аминокислотой или синтетической (неприродной) аминокислотой. Термин «синтетические или неприродные аминокислоты» означает аминокислоты, которые обычно не встречаются в природе in vivo, но которые, тем не менее, могут быть включены в описанные здесь пептидные структуры. В некоторых своих вариантах, настоящее изобретение относится к пептиду класса 4, где указанный пептид содержит последовательности SEQ ID NO: 1307, SEQ ID NO: 1336, SEQ ID NO: 1339, SEQ ID NO: 1340, SEQ ID NO: 1341, SEQ ID NO: 1342, SEQ ID NO: 1343 и SEQ ID NO: 1344, и кроме того, содержит полиэтиленгликолевую цепь, связанную в соответствующем положении 21 или 24 нативного пептида глюкагона. В другом варианте изобретения, C-конец пептида класса 4 был модифицирован путем замены карбоксильной группы на амидную группу.
Гибридные белки и конъюгаты
Настоящее изобретение также охватывает гибридные пептиды. содержащие пептид класса 4, где второй пептид присоединен к С-концу пептида класса 4. Более конкретно, такой гибридный пептид может содержать пептид класса 4 SEQ ID NO: 1344, который также включает аминокислотную последовательность SEQ ID NO: 1319 (GPSSGAPPPS), SEQ ID NO: 1320 (Lys Arg Asn Arg Asn Asn Ile Ala) или SEQ ID NO: 1321 (Lys Arg Asn Arg), связанную с С-концевой аминокислотой пептида класса 4. В некоторых вариантах изобретения, аминокислотная последовательность SEQ ID NO: 1319 (GPSSGAPPPS) связана с аминокислотой 24 пептида класса 4 SEQ ID NO: 1342 посредством пептидной связи. В другом варианте изобретения, гибридный пептид содержит пептид класса 4 SEQ ID NO: 1307, SEQ ID NO: 1336, SEQ ID NO: 1339, SEQ ID NO: 1340, SEQ ID NO: 1341 или SEQ ID NO: 1343, который также включает аминокислотную последовательность SEQ ID NO: 1319 (GPSSGAPPPS), связанную с аминокислотой 24 пептида класса 4. В другом варианте изобретения, гибридный пептид содержит пептид класса 4 SEQ ID NO: 1307, SEQ ID NO: 1336, SEQ ID NO: 1337, SEQ ID NO: 1338, SEQ ID NO: 1339, SEQ ID NO: 1341 или SEQ ID NO: 1343, который также включает аминокислотную последовательность SEQ ID NO: 1320, SEQ ID NO: 1321 или SEQ ID NO: 1353, связанную с аминокислотой 24 пептида класса 4. В некоторых вариантах изобретения, гибридный пептид, содержащий пептид класса 4, включает последовательность, выбранную из группы, состоящей из SEQ ID NO: 1346 и SEQ ID NO 1347. В другом варианте изобретения, С-конец гибридного пептида был модифицирован путем замены карбоксильной группы на амидную группу.
В некоторых своих вариантах, настоящее изобретение относится к гибридному пептиду, содержащему пептид класса 4, где пептид класса 4, который является частью гибридного пептида, выбран из группы, состоящей из SEQ ID NO: 1303, SEQ ID NO: 1304, SEQ ID NO: 1305, SEQ ID NO: 1306, SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1309, SEQ ID NO: 1311, SEQ ID NO: 1312, SEQ ID NO: 1313, SEQ ID NO: 1314, SEQ ID NO: 1315, SEQ ID NO: 1310, SEQ ID NO: 1316, SEQ ID NO: 1317, SEQ ID NO: 1318 и SEQ ID NO: 1339, а последовательность SEQ ID NO: 1319 присоединена к карбокси-концу части, которая представляет собой пептид класса 4, и где ПЭГ-цепь, если она присутствует, имеет размер 500-40000 дальтон. Более конкретно, в некоторых вариантах изобретения, сегмент пептида класса 4 выбран из группы, состоящей из SEQ ID NO: 1313, SEQ ID NO: 1314, SEQ ID NO: 1315, SEQ ID NO: 1316, SEQ ID NO: 1346 и SEQ ID NO: 1347, где ПЭГ-цепь имеет размер примерно 500-5000 дальтон, а более конкретно, в некоторых вариантах изобретения, ПЭГ-цепь имеет размер примерно 1000 дальтон. В другом варианте изобретения, С-конец был модифицирован путем замены карбоксильной группы на амидную группу.
Пептид класса 4 может дополнительно содержать одну или две заряженных аминокислоты, добавленных к карбокси-концу. В некоторых вариантах изобретения, где одна или две заряженных аминокислоты были добавлены к карбокси-концу SEQ ID NO: 1344, аминокислоты представляют собой отрицательно заряженные аминокислоты, включая, например, глутаминовую и аспарагиновую кислоту. В некоторых вариантах изобретения, пептид класса 4 содержит последовательность SEQ ID NO: 1342, где по меньшей мере одно из соответствующих положений 27 и 28, по сравнению с положениями нативного пептида глюкагона, включает аминокислоту, выбранную из группы, состоящей из аспарагиновой кислоты и глутаминовой кислоты, и где SEQ ID NO: 1342 является модифицированной, но необязательно, и включает добавление одной или двух отрицательно заряженных аминокислот, добавленных к карбокси-концу. В некоторых вариантах изобретения, указанные отрицательно заряженные аминокислоты представляют собой глутаминовую кислоту или аспарагиновую кислоту.
Описанные здесь пептиды класса 4 могут быть объединены с другими активными агентами, включая, например, инсулин, в целях лечения заболеваний или состояний, характеризующихся избыточной глюкагоновой активностью. В некоторых вариантах изобретения, пептиды класса 4, которые были модифицированы путем ковалентного связывания с ПЭГ-цепью, имеющей молекулярную массу более, чем 10000 дальтон, могут быть введены в комбинации с инсулином для поддержания стабильных уровней глюкозы в крови у пациентов с диабетом. Пептиды класса 4 согласно изобретению могут быть введены вместе с инсулином в виде одной композиции, могут быть одновременно введены в виде отдельных растворов или, альтернативно, инсулин и пептид класса 4 могут быть введены в различные интервалы времени. В некоторых вариантах изобретения, композицию, содержащую инсулин, и композицию, содержащую пептид класса 4, вводят с интервалами в 12 часов. Точное соотношение пептида класса 4 и вводимого инсулина зависит частично от метода определения уровней глюкагона у пациента, и такое отношение может быть вычислено путем рутинного экспериментирования.
Димерные пептиды
Настоящее изобретение также охватывает мультимеры описанных здесь модифицированных пептидов класса 4. Два или более модифицированных пептидов класса 4 могут быть присоединены друг к другу посредством стандартных линкеров с применением методов, известных специалистам. Так, например, димеры могут быть образованы между двумя модифицированными пептидами класса 4 посредством бифункциональных тиоловых перекрестно-связывающих линкеров и бифункциональных аминовых перекрестно-связывающих линкеров, в частности, для пептидов класса 4, в которых были сделаны замены (например, в положениях 11, 16 или 19) цистеиновым остатком, лизиновым остатком, орнитиновым остатком, гомоцистеиновым остатком или ацетилфенилаланиновым остатком (например, SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311 и SEQ ID NO: 1312). Димером может быть гомодимер или, альтернативно, гетеродимер. В некоторых вариантах изобретения, димер образуется между двумя пептидами класса 4, независимо выбранными из группы, состоящей из SEQ ID NO: 1308, SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311, SEQ ID NO: 1312, SEQ ID NO: 1345, SEQ ID NO: 1346 или SEQ ID NO: 1347, где два пептида связаны друг с другом посредством линкера, присоединенного в положении 11 каждого пептида, в положении 16 каждого пептида или в положении 19 каждого пептида, или в любых их комбинациях. В некоторых вариантах изобретения, связью является дисульфидная связь между остатками Cys11-Cys11 или Cys19-Cys19 или Cys11-Cys19 соответствующих пептидов класса 4.
Аналогичным образом, димер может быть образован между двумя пептидами класса 4, независимо выбранными из группы, состоящей из SEQ ID NO: 1303, SEQ ID NO: 1304, SEQ ID NO: 1305, SEQ ID NO: 1306, SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311, SEQ ID NO: 1312, SEQ ID NO: 1336, SEQ ID NO: 1337, SEQ ID NO: 1338, SEQ ID NO: 1339 и SEQ ID NO: 1342, где связь между аминокислотами образуется в положениях, независимо выбранных из положений 16, 21 и 24, по сравнению с положениями нативного пептида глюкагона.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к димеру пептида класса 4, содержащему два пептида класса 4, каждый из которых содержит последовательность SEQ ID NO: 1346, где два антагониста связаны друг с другом дисульфидной связью посредством аминокислоты в положении 25. В другом своем варианте, настоящее изобретение относится к димеру пептида класса 4, содержащему два пептида класса 4, каждый из которых содержит последовательность SEQ ID NO: 1347, где два антагониста связаны друг с другом дисульфидной связью посредством аминокислоты в положении 35. В некоторых вариантах изобретения, димер образуется между пептидами класса 4, имеющими последовательности SEQ ID NO: 1346 и SEQ ID NO: 1347, где аминокислотой в положении 10 является глутаминовая кислота.
В некоторых вариантах изобретения, димер содержит гомодимер гибридного пептида, включающего пептид класса 4, выбранный из группы, состоящей из SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1336, SEQ ID NO: 1337, SEQ ID NO: 1340, SEQ ID NO: 1339, NO: 1340, SEQ ID NO: 1341, SEQ ID NO: 1342, и фармацевтически приемлемые соли указанных пептидов класса 4. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к димеру, включающему первый пептид класса 4, связанный со вторым пептидом класса 4 посредством линкера, где первый и второй пептиды димера независимо выбраны из группы, состоящей из SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1336, SEQ ID NO: 1337, SEQ ID NO: 1339, SEQ ID NO: 1340, SEQ ID NO: 1341 и SEQ ID NO: 1342, и фармацевтически приемлемых солей указанных полипептидов глюкагона. В другом варианте изобретения, первый и второй пептиды класса 4 димера независимо выбраны из группы, состоящей из SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1336 и SEQ ID NO: 1339.
В другом варианте изобретения, указанный димер включает гомодимер пептида класса 4, выбранного из группы, состоящей из SEQ ID NO: 1323, SEQ ID NO: 1324, SEQ ID NO: 1325, SEQ ID NO: 1326, SEQ ID NO: 1327, SEQ ID NO: 1328, SEQ ID NO: 1329, SEQ ID NO: 1330, SEQ ID NO: 1331. В другом своем варианте, настоящее изобретение относится к димеру пептида класса 4, где первый и второй пептиды димера содержат аминокислотную последовательность, независимо выбранную из группы, состоящей из SEQ ID NO: 1323, SEQ ID NO: 1324, SEQ ID NO: 1325, SEQ ID NO: 1326, SEQ ID NO: 1327 и SEQ ID NO: 1328. В другом варианте изобретения, указанный димер включает гомодимер пептида класса 4, выбранного из группы, состоящей из SEQ ID NO: 1309, SEQ ID NO: 1311 и SEQ ID NO: 1312, где указанный пептид также содержит полиэтиленгликолевую цепь, ковалентно связанную в положении 11 или 19 пептида глюкагона.
Родственный глюкагону пептид класса 4 может содержать любую из аминокислотных последовательностей SEQ ID NN: 1301-1371, которые имеют, но необязательно, до 1, 2, 3, 4, или 5 дополнительных модификаций, сохраняющих глюкагон-антагонистическую активность.
Родственные глюкагону пептиды класса 5
В некоторых вариантах изобретения, родственным глюкагону пептидом является родственный глюкагону пептид класса 5 (см., например, Международную патентную заявку (PCT) No. PCT/US2008/081333, которая во всей своей полноте вводится в настоящее описание посредством ссылки).
Все биологические последовательности, упомянутые в следующем разделе (SEQ ID NN: 1401-1518), соответствуют последовательностям SEQ ID NN: 1-118, описанным в Международной патентной заявке No. PCT/US2008/081333.
Активность
В некоторых аспектах изобретения, родственным глюкагону пептидом класса 5 (далее называемым «пептидом класса 5») может быть антагонист глюкагона/агонист GLP-1. Антагонисты глюкагона/агонисты GLP-1 могут быть использованы в любых случаях, когда желательно подавление глюкагон-агонистической активности с одновременной стимуляцией GLP-1-активности. Так, например, глюкагон-антагонистическая активность в комбинации со стимуляцией GLP-1 могут быть использованы для лечения диабета, где на пре-клинических моделях гипергликемии была продемонстрирована глюкагон-антагонистическая активность, направленная на снижение уровней глюкозы в крови, и где GLP-1-активность ассоциируется с продуцированием инсулина. Также известно, что соединения, обладающие GLP-1-активностью, могут быть использованы для лечения ожирения и предупреждения увеличения массы тела.
В некоторых аспектах изобретения, очевидно, что пептиды класса 5 могут быть использованы в любых целях, которые были ранее описаны для другого антагониста глюкагона/агонистов GLP-1. Было показано, что эти две активности, по отдельности, обладают в высокой степени предпочтительным действием, которое может быть применено в целях лечения метаболического синдрома, а в частности, диабета и ожирения. Глюкагон-антагонистическая активность может быть использована в любых случаях, когда желательно подавлять глюкагон-агонистическую активность. Присутствие агониста GLP-1 также подавляет эндогенную секрецию глюкагона поджелудочной железой и стимулирует синтез и секрецию инсулина. Эти два фармакологических эффекта обладают синергическим действием и нормализуют метаболические нарушения. В соответствии с этим, пептиды класса 5 могут быть использованы для лечения гипергликемии или других нарушений метаболизма, вызываемых высокими уровнями глюкагона в крови или высокими уровнями глюкозы в крови. В соответствии с некоторыми вариантами изобретения, пациентом, подвергаемым лечению с использованием антагонистов глюкагона/агонистов GLP-1, таких как описанные здесь пептиды класса 5, является домашнее животное, а в другом варианте изобретения, такими пациентом является человек. Проведенные исследования позволяют предположить, что отсутствие ингибирования глюкагона у пациентов с диабетом играет определенную роль в развитии гипергликемии после приема пищи, частично вызываемой ускоренным гликогенолизом. Анализ уровней глюкозы в крови, проводимый с помощью теста на пероральную толерантность к глюкозе (OGTT) и при наличии или в отсутствии индуцированного соматостатином ингибирования глюкагона, указывал на значительное повышение уровней глюкозы у индивидуумов с более высокими уровнями глюкагона. В соответствии с этим, антагонист глюкагона/агонисты GLP-1 или описанные здесь пептиды класса 5 могут быть использованы для лечения гипергликемии, а также предполагается, что они могут быть использованы для лечения диабета различных типов, включая сахарный диабет типа I, сахарный диабет типа II или диабет беременных, либо инсулинзависимый, либо инсулиннезависимый, и для снижения вероятности развития осложнений при диабете, включая нефропатию, ретинопатию и сосудистое заболевание.
Предполагается, что такие методы снижения аппетита или стимуляции снижения массы тела могут быть применены для снижения массы тела, предупреждения увеличения массы тела или для лечения ожирения различной этиологии, включая ожирение, вызываемое лекарственными средствами, а также для снижения вероятности возникновения осложнений, ассоциированных с ожирением, включая сосудистые заболевания (ишемическую болезнь сердца, инсульт, заболевание периферических сосудов, ишемическую реперфузию и т.п.), гипертензию, диабет типа II на ранней стадии, гиперлипидемию и скелетно-мышечные заболевания.
Фармацевтические композиции, содержащие пептиды класса 5, могут быть приготовлены с использованием стандартных фармацевтически приемлемых носителей и введены пациентам известными способами. В соответствии с этим, настоящее изобретение также охватывает фармацевтические композиции, содержащие один или несколько описанных здесь пептидов класса 5 в комбинации с фармацевтически приемлемым носителем. Фармацевтические композиции могут содержать пептиды класса 5 в качестве одного фармацевтически активного компонента, либо пептиды класса 5 могут быть объединены с одним или несколькими дополнительными активными агентами. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к композиции, содержащей пептид класса 5 и инсулин или аналог инсулина. Альтернативно, настоящее изобретение относится к композиции для индуцирования снижения массы тела или предупреждения увеличения массы тела, где указанная композиция содержит последовательность SEQ ID NO: 1415 или SEQ ID NO: 1451, которая также содержит аминокислотную последовательность SEQ ID NO: 1421 (GPSSGAPPPS) или SEQ ID NO: 1450, связанную с аминокислотой 24 SEQ ID NO: 1415 или SEQ ID NO: 1451, и пептид, подавляющий ожирение. Подходящими пептидами, подавляющими ожирение, являются пептиды, описанные в патентах США 5691309, 6436435 или в заявке на патент США 20050176643.
Структура пептида класса 5
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, содержащему пептид глюкагона, который был модифицирован путем делеции первых 1-5 аминокислотных остатков (например, первой аминокислоты, первых двух аминокислот, первых трех аминокислот, первых четырех аминокислот, первых пяти аминокислот) у N-конца, и стабилизации альфа-спиральной структуры в С-концевой части соединения (в положениях аминокислот примерно 12-29 в соответствии с нумерацией аминокислот глюкагона дикого типа, SEQ ID NO: 1401), например, посредством образования связи боковых цепей аминокислотных пар, выбранных из положений 12 и 16, 16 и 20, 20 и 24, и 24 и 28 (по сравнению с нативной последовательностью пептида глюкагона), и связанных друг с другом посредством водородных связей или ионных взаимодействий, таких как образование солевых мостиков, или посредством ковалентных связей. Альтернативно, стабилизация альфа-спирали в положениях остатков примерно 12-29 достигается путем введения одной или нескольких α,α-дизамещенных аминокислот в положениях, сохраняющих нужную активность. В некоторых вариантах изобретения, аминокислоты в одном, двух, трех, четырех или более положениях 16, 17, 18, 19, 20, 21, 24 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) пептида класса 5 или его аналога заменены α,α-дизамещенной аминокислотой. Так, например, замена в положении 16 (в соответствии с нумерацией аминокислот глюкагона дикого типа) пептида класса 5 или его аналога аминоизомасляной кислотой (AIB) приводит к стабилизации альфа-спирали в отсутствии солевого мостика или лактама. В некоторых вариантах изобретения, аминокислоты в одном, двух, трех, четырех или более положениях 16, 20, 21 или 24 (в соответствии с нумерацией аминокислот глюкагона дикого типа) заменены AIB.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, где указанный пептид обладает агонистической активностью, которая составляет по меньшей мере 80% от максимальной агонистической активности, достигаемой нативным GLP-1 по отношению к рецептору GLP-1, и глюкагон-антагонистической активностью, которая направлена на снижение индуцируемого глюкагоном продуцирования cAMP, которая стимулирует активность рецептора глюкагона, по меньшей мере максимум на 50%, как было измерено по продуцированию cAMP в анализе in vitro. В некоторых вариантах изобретения, пептид класса 5 обладает по меньшей мере 90% активностью нативного GLP-1 по отношению к рецептору GLP-1, и глюкагон-антагонистической активностью, которая направлена на снижение индуцируемого глюкагоном продуцирования cAMP, стимулирующего активность рецептора глюкагона, по меньшей мере максимум на 80%.
В соответствии с некоторыми вариантами изобретения, пептид класса 5 содержит производное пептида SEQ ID NO: 1402, где указанный пептид имеет дополнительные аминокислотные замены по сравнению с SEQ ID NO: 1402 в 1-3 положениях аминокислот, выбранных из положений 1, 2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 19, 22 и 24, и обладает по меньшей мере 90% активностью нативного GLP-1 по отношению к рецептору GLP-1, и глюкагон-антагонистической активностью, которая направлена на снижение индуцируемого глюкагоном продуцирования cAMP, стимулирующего активность рецептора глюкагона, по меньшей мере максимум на 80%.
В некоторых вариантах изобретения, альфа-спиральную структуру в С-концевой части пептида класса 5 (в положениях аминокислот примерно 12-29 в соответствии с нумерацией аминокислот глюкагона дикого типа) стабилизируют, например, путем образования ковалентного или нековалентного внутримолекулярного мостика, или замены аминокислот в положениях примерно 12-29 аминокислотой, стабилизирующей альфа-спираль (например, α,α-дизамещенной аминокислотой), и/или инсерции такой аминокислоты. В некоторых вариантах изобретения, аминокислоты в одном, двух, трех, четырех или более положениях 16, 17, 18, 19, 20, 21, 24 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа) пептида класса 5 или его аналога заменены α,α-дизамещенной аминокислотой, например, аминоизомасляной кислотой (AIB). Так, например, замена в положении 16 (в соответствии с нумерацией аминокислот глюкагона дикого типа) пептида класса 5 или его аналога аминоизомасляной кислотой (AIB) приводит к стабилизации альфа-спирали в отсутствии солевого мостика или лактама.
В некоторых вариантах изобретения, пептид класса 5 включает SEQ ID NO: 1415 или SEQ ID NO: 1451, а более конкретно, последовательность, выбранную из группы, состоящей из SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407, SEQ ID NO: 1408, SEQ ID NO: 1409, SEQ ID NO: 1416, SEQ ID NO: 1417, SEQ ID NO: 1418, SEQ ID NO: 1419, SEQ ID NO: 1422, SEQ ID NO: 1423, SEQ ID NO: 1424 и SEQ ID NO: 1425. В других вариантах изобретения, пептид класса 5 содержит производное пептида SEQ ID NO: 1415 или SEQ ID NO: 1451, где указанный пептид содержит дополнительную аминокислотную замену по сравнению с последовательностями SEQ ID NO: 1415 или SEQ ID NO: 1451 в 1-3 положениях аминокислот, выбранных из положений 1, 2, 5, 6, 8, 9, 12, 13 и 14. В некоторых вариантах изобретения, заменами в положениях 1, 2, 5, 6, 8, 9, 12, 13 и 14 являются консервативные аминокислотные замены. В некоторых вариантах изобретения, треонин в положении 24 SEQ ID NO: 1405 или SEQ ID NO: 1406 заменен глицином.
В соответствии с некоторыми вариантами изобретения, пептид класса 5 представляет собой другую пептидную модификацию, в которой, помимо делеции у N-конца, фенилаланин в положении 6 нативного пептида глюкагона был модифицирован, например, так, чтобы он содержал гидроксильную группу вместо N-концевой аминогруппы. В другом варианте изобретения, природная карбоксильная группа С-концевой аминокислоты заменена нейтральной группой, такой как амид или сложный эфир.
В соответствии с некоторыми вариантами изобретения были получены пептиды класса 5, где первые 3-5 аминокислот нативного глюкагона были делетированы, а аминокислота в положении 9, по сравнению с нативным пептидом глюкагона, была заменена аминокислотой, выбранной из группы, состоящей из глутаминовой кислоты, гомоглутаминовой кислоты, β-гомоглутаминовой кислоты, сульфоновокислотного производного цистеина или алкилкарбоксилатного производного цистеина, имеющего структуру:
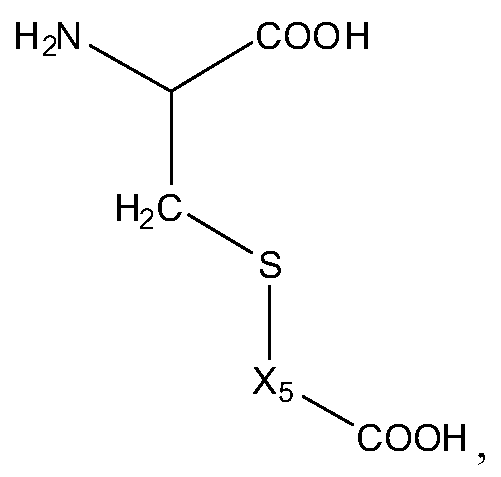
где X5 представляет собой C1-C4алкил, C2-C4алкенил или C2-C4алкинил, а альфа-спиральная структура в С-концевой части глюкагона (в положениях аминокислот примерно 12-29 в соответствии с нумерацией аминокислот глюкагона дикого типа) была стабилизирована, например, посредством лактамового мостика, образованного между боковыми цепями аминокислот 12 и 16 или аминокислот 16 и 20, по сравнению с нативным пептидом глюкагона. Примеры аминокислотных пар, обладающих способностью ковалентно связываться с образованием линкерного мостика из семи атомов, подробно описаны в настоящей заявке. В некоторых вариантах изобретения, сульфоновокислотным производным цистеина является цистеиновая кислота или гомоцистеиновая кислота.
В некоторых своих вариантах, настоящее изобретение относится к пептиду класса 5, содержащему аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408, где указанный пептид содержит лактамовое кольцо, образованное между боковыми цепями аминокислот в положениях 7 и 11 для SEQ ID NO: 1405, аминокислот 11 и 15 для SEQ ID NO: 1406, аминокислот в положениях 15 и 19 для SEQ ID NO: 1407 и аминокислот в положениях 19 и 24 для SEQ ID NO: 1408, где каждая из этих последовательностей также была модифицирована так, чтобы она содержала гидрофильную группу, ковалентно связанную с пептидом. Более конкретно, в некоторых вариантах изобретения, каждый пептид класса 5, содержащий лактам, был модифицирован посредством ковалентного связывания с полиэтиленгликолевой цепью. Так, например, что касается пептида класса 5, содержащего SEQ ID NO: 1405, то такой пептид был ПЭГилирован в положении, выбранном из группы, состоящей из 12, 15, 16, 19 и 24; что касается пептида класса 5, содержащего SEQ ID NO: 1406, то такой пептид был ПЭГилирован в положении, выбранном из группы, состоящей из 12, 16, 19 и 24; что касается пептида класса 5, содержащего SEQ ID NO: 1407, то такой пептид был ПЭГилирован в положении, выбранном из группы, состоящей из 11, 12, 16 и 24; что касается пептида класса 5, содержащего SEQ ID NO: 1408, то такой пептид был ПЭГилирован в положении, выбранном из группы, состоящей из 11, 12, 15 и 16. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, содержащему SEQ ID NO: 1447 или SEQ ID NO: 1448, где указанный пептид был ПЭГилирован в положении, выбранном из группы, состоящей из 12, 16, 19 и 24, по сравнению с последовательностью SEQ ID NO: 1447 или SEQ ID NO: 1448. В другом варианте изобретения, пептид SEQ ID NO: 1447 или SEQ ID NO: 1448 был дополнительно модифицирован путем добавления последовательности SEQ ID NO: 1421 к карбокси-концу указанного пептида.
Как подробно описано выше, в некоторых своих аспектах, настоящее изобретение относится к пептидам класса 5, в которых первые пять аминокислот нативного глюкагона были делетированы, аминогруппа N-концевой аминокислоты (фенилаланина) была заменена гидроксильной группой (то есть, первой аминокислотой является фенилмолочная кислота), а боковые цепи одной или нескольких аминокислотных пар, выбранных из аминокислот в положениях 12 и 16, 16 и 20, 20 и 24, и 24 и 28, связаны друг с другом, что обеспечивает стабилизацию альфа-спирали пептида класса 5.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, содержащему последовательность SEQ ID NO: 1402, которая была модифицирована путем замены серинового остатка в положении 11 SEQ ID NO: 1402 (в положении 16 в соответствии с нумерацией аминокислот нативного глюкагона) аминокислотой, выбранной из группы, состоящей из глутаминовой кислоты, глутамина, гомоглутаминовой кислоты, гомоцистеиновой кислоты, треонина или глицина. В соответствии с некоторыми вариантами изобретения, сериновый остаток в положении 11 SEQ ID NO: 1402 заменен аминокислотой, выбранной из группы, состоящей из глутаминовой кислоты, глутамина, гомоглутаминовой кислоты и гомоцистеиновой кислоты, а в некоторых вариантах изобретения, сериновый остаток заменен глутаминовой кислотой. В соответствии с некоторыми вариантами изобретения, пептид класса 5 содержит последовательность SEQ ID NO: 1438.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, в котором внутримолекулярный мостик расположен между двумя боковыми цепями аминокислот, что приводит к стабилизации трехмерной структуры карбокси-конца пептида SEQ ID NO: 1402. Более конкретно, боковые цепи одной или нескольких аминокислот, выбранных из аминокислотных пар 7 и 11, 11 и 15, 15 и 19, или 19 и 23 последовательности SEQ ID NO: 1402, связаны друг с другом, что приводит к стабилизации альфа-спирали в C-концевой части. Две боковые цепи могут быть связаны друг с другом посредством водородных связей, ионных взаимодействий (таких как образование солевых мостиков) или посредством ковалентных связей. В соответствии с некоторыми вариантами изобретения, линкер имеет длину в 7-9 атомов, а в некоторых вариантах изобретения, линкер имеет длину в 8 атомов. В некоторых вариантах изобретения, пептид класса 5 выбран из группы, состоящей из SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 и SEQ ID NO: 1408. В некоторых вариантах изобретения, С-концевая аминокислота пептида класса 5, вместо карбоксильной группы, присутствующей в нативной аминокислоте, имеет амидную группу.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, где указанный аналог содержит аминокислотную последовательность SEQ ID NO: 1409. В некоторых вариантах изобретения, трехмерную структуру карбокси-конца пептида SEQ ID NO: 1409 стабилизируют посредством образования ковалентных связей между боковыми цепями пептида. В некоторых вариантах изобретения, две боковые цепи аминокислот связаны друг с другом с образованием лактамового кольца. Размер лактамового кольца может варьироваться в зависимости от длины боковых цепей аминокислот, а в некоторых вариантах изобретения, лактам образуется посредством связывания боковых цепей аминокислоты лизина с боковой цепью глутаминовой кислоты. В некоторых вариантах изобретения, С-концевая аминокислота пептида класса 5, вместо карбоксильной группы, присутствующей в нативной аминокислоте, имеет амидную группу.
Порядок расположения амидной связи в лактамовом кольце может быть обратным (например, лактамовое кольцо может образовываться между боковыми цепями Lys12 и Glu16, или, альтернативно, между Glu12 и Lys16). В соответствии с некоторыми своими вариантами, настоящее изобретение относится к аналогу глюкагона SEQ ID NO: 1409, где по меньшей мере одно лактамовое кольцо образуется между боковыми цепями аминокислотной пары, выбранной из группы, состоящей из аминокислотных пар 7 и 11, 11 и 15, 15 и 19 или 19 и 23 SEQ ID NO: 1409. В некоторых своих вариантах, настоящее изобретение относится к пептиду класса 5, где указанный пептид содержит последовательность SEQ ID NO: 1410, которая дополнительно включает внутримолекулярный лактамовый мостик, образованный между положениями аминокислот 7 и 11, или между аминокислотами в положениях 11 и 15, или между аминокислотами в положениях 15 и 19 SEQ ID NO: 1410. В некоторых своих вариантах, настоящее изобретение относится к пептиду класса 5, содержащему последовательность SEQ ID NO: 1411, где указанная последовательность дополнительно содержит внутримолекулярный лактамовый мостик, образованный между положениями аминокислот 7 и 11, или между положениями аминокислот 11 и 15 SEQ ID NO: 1411. В некоторых вариантах изобретения, пептид класса 5 содержит последовательность SEQ ID NO: 1417.
Настоящее изобретение также относится к дополнительному пептиду класса 5, содержащему производные SEQ ID NO: 1405, где аспарагиновая кислота в положении 10 SEQ ID NO: 1405 (в положении 15 нативного глюкагона) была заменена глутаминовой кислотой, имеющей общую структуру:
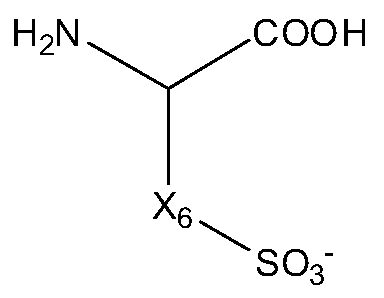
где X6 представляет собой C1-C3алкил, C2-C3алкен или C2-C3алкинил, в некоторых вариантах изобретения, X6 представляет собой C1-C3алкил, а в другом варианте изобретения, X6 представляет собой C2алкил. В некоторых своих вариантах, настоящее изобретение относится к производному пептида класса 5 SEQ ID NO: 1409, где аминокислота в положении 10 SEQ ID NO: 1409 (в положении 15 нативного глюкагона) заменена аминокислотой, выбранной из группы, состоящей из глутаминовой кислоты, цистеиновой кислоты, гомоцистеиновой кислоты и гомоглутаминовой кислоты. В другом варианте изобретения, аминокислота в положении 10 SEQ ID NO: 1409 заменена аминокислотой, выбранной из группы, состоящей из цистеиновой кислоты и гомоцистеиновой кислоты. В некоторых своих вариантах, настоящее изобретение относится к производному пептида класса 5 SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408, где аминокислота в положении 10 SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408 заменена аминокислотой, выбранной из группы, состоящей из глутаминовой кислоты, цистеиновой кислоты, гомоцистеиновой кислоты и гомоглутаминовой кислоты. В некоторых вариантах изобретения, С-концевая аминокислота пептида класса 5, вместо карбоксильной группы, присутствующей в нативной аминокислоте, имеет амидную группу.
В некоторых вариантах изобретения, аминокислота пептида класса 5 заменена по меньшей мере одним цистеиновым остатком, где боковая цепь цистеинового остатка была дополнительно модифицирована реагентом, взаимодействующим с тиолом, включая, например, малеимидо, винилсульфон, 2-пиридилтио, галогеналкил и галогенацил. Эти реагирующие с тиолом реагенты могут содержать карбокси-, кето-, гидроксильную и эфирную группы, а также другие гидрофильные группы, такие как полиэтиленгликолевые звенья. В альтернативном варианте изобретения, аминокислота пептида класса 5 заменена лизином, а боковая цепь замещающего лизинового остатка была дополнительно модифицирована с использованием реагирующих с амином реагентов, таких как активные сложные эфиры (сукцинимидо, ангидрид и т.п.) карбоновых кислот или альдегиды гидрофильных групп, таких как полиэтиленгликоль. В соответствии с некоторыми вариантами изобретения, лизиновый остаток, соответствующий положению 7 пептида SEQ ID NO: 1405, заменен аргинином, а одна из аминокислот, соответствующих положению 12, 15, 16, 19 и 24 последовательности SEQ ID NO: 1405, заменена одним лизином.
В другом варианте изобретения, метиониновый остаток, соответствующий положению 22 описанных здесь пептидов класса 5, был заменен лейцином или норлейцином для предупреждения окислительного разложения пептида.
Кроме того, в некоторых аспектах изобретения, пептиды класса 5 также включают аминокислотные замены в положениях, которые, как известно, не играют решающей роли в функционировании аналога глюкагона. В некоторых вариантах изобретения, заменами являются консервативные аминокислотные замены в одном, двух или трех положениях, выбранных из группы, состоящей из 2, 5, 6, 7, 8, 9, 12, 13, 14, 15, 16, 19, 22, 23 или 24. В некоторых вариантах изобретения, аминокислоты, соответствующие положениям 16, 17, 20, 21, 24 или 29 нативного пептида глюкагона, а более конкретно, положениям 21 и/или 24 нативного пептида глюкагона заменены цистеином или лизином, где ПЭГ-цепь ковалентно связана с замененным цистеиновым или лизиновым остатком.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, содержащему последовательность, состоящую из SEQ ID NO: 1409, которая была дополнительно модифицирована посредством замены одной или нескольких дополнительных аминокислот в положениях, соответствующих положениям 11, 12, 15, 16, 19 и/или 24 пептида (включая, например, замену цистеином), где указанная аминокислотная замена включают замену аминокислотой, имеющей боковую цепь, подходящую для перекрестного связывания с гидрофильными группами, включая, например, ПЭГ. Нативный глюкагон может быть заменен природной аминокислотой или синтетической (неприродной) аминокислотой. Термин «синтетические или неприродные аминокислоты» означает аминокислоты, которые обычно не встречаются в природе in vivo, но которые, тем не менее, могут быть включены в описанные здесь пептидные структуры. В некоторых своих вариантах, настоящее изобретение относится к пептиду класса 5, где указанный пептид содержит последовательность SEQ ID NO: 1409, и кроме того, содержит полиэтиленгликолевую цепь, связанную в положении 16 или 19 указанного пептида. В другом варианте изобретения, C-конец аналога глюкагона был модифицирован путем замены карбоксильной группы на амидную группу.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, содержащему аналог глюкагона, выбранный из группы, состоящей из:
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Lys-Tyr-Leu-Xaa-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1439)
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Xaa-Phe-Val-Gln-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1413),
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Xaa-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1414) и
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Xaa-Phe-Val-Xaa-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1412),
где Xaa в положении 4 представляет собой аспарагиновую кислоту, глутаминовую кислоту, цистеиновую кислоту или гомоцистеиновую кислоту; Xaa в положении 10 представляет собой Asp, Glu, цистеиновую кислоту, гомоглутаминовую кислоту и гомоцистеиновую кислоту, Xaa в положении 16 представляет собой Asp, Cys, Orn, гомоцистеин или ацетилфенилаланин; Xaa в положении 19 представляет собой Gln, Cys, Orn, гомоцистеин и ацетилфенилаланин; Xaa в положении 22 представляет собой Met, Leu или Nle, R1 представляет собой OH или NH2, а R2 представляет собой Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser (SEQ ID NO: 1421), Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser Xaa (SEQ ID NO: 1450; где Xaa представляет собой Cys, Orn, гомоцистеин или ацетилфенилаланин), COOH или CONH2, где указанный пептид ПЭГилирован, но необязательно, в положении 16 последовательности SEQ ID NO: 1413, в положении 19 последовательности SEQ ID NO: 1414 и в положениях 16 и 19 последовательности SEQ ID NO: 1412. В некоторых вариантах изобретения, Thr в положении 24 последовательности SEQ ID NN: 1412-1414 и 1439 заменен Gly. В соответствии с некоторыми вариантами изобретения, пептид содержит последовательность SEQ ID NO: 13 или SEQ ID NO: 1414, где R1 представляет собой OH. В соответствии с некоторыми вариантами изобретения, указанный пептид содержит последовательность SEQ ID NO: 1413 или SEQ ID NO: 1414, где R1 представляет собой OH, а R2 представляет собой CONH2. В соответствии с некоторыми вариантами изобретения, указанный пептид содержит последовательность SEQ ID NO: 1413 или SEQ ID NO: 1414, где R1 представляет собой OH, R2 представляет собой CONH2, а треонин в положении 24 заменен глицином.
В некоторых вариантах изобретения, пептид класса 5 был дополнительно модифицирован так, чтобы он содержал одну или несколько аминокислот нативного GLP-1, где указанную модификацию осуществляют путем замены нативного(ых) остатка(ов) глюкагона в соответствующих положениях аминокислоты. Так, например, пептид класса 5 может содержать одну или несколько аминокислотных замен в любом из положений 2, 3, 17, 18, 21, 23, и 24 (в соответствии с нумерацией аминокислот нативного глюкагона). В конкретном варианте изобретения, пептид класса 5 модифицируют путем введения одной или нескольких из нижеследующих аминокислотных замен, таких как: замена Ser2 на Ala, замена Gln3 на Glu, замена Arg17 на Gln, замена Arg в положении 18 на Ala, замена Asp в положении 21 на Glu, замена Val в положении 23 на Ile, и замена Gln в положении 24 на Ala (положения аминокислот соответствуют положениям аминокислот нативной последовательности глюкагона). В конкретном варианте изобретения, пептид класса 5 модифицируют путем замены Ser2 на Ala и Gln3 на Glu (в соответствии с нумерацией аминокислот нативного глюкагона). В другом конкретном варианте изобретения, пептид класса 5 модифицируют путем введения всех нижеследующих аминокислотных замен, а именно, замены Arg17 на Gln, замены Arg в положении 18 на Ala, замены Asp в положении 21 на Glu, замены Val в положении 23 на Ile, и замены Gln в положении 24 на Ala (нумерация аминокислот соответствует нумерации аминокислот нативного глюкагона). В другом конкретном варианте изобретения, пептид класса 5 модифицируют так, чтобы он содержал только Glu в положении 21 (в соответствии с нумерацией SEQ ID NO: 1401). В соответствии с этим, пептид класса 5 может содержать любую из аминокислотных последовательностей SEQ ID NN: 1460-1470, 1473-1478, 1480-1488, 1490-1496, 1503, 1504, 1506 и 1514-1518.
Настоящее изобретение также относится к пептиду класса 5 или к его конъюгату, содержащему (1) альфа-спираль, стабилизированную описанными здесь способами (например, посредством образования внутримолекулярного мостика или включения одной или нескольких альфа,альфа-дизамещенных аминокислот или кислотной аминокислоты в положении 16 (в соответствии с нумерацией SEQ ID NO: 1401), или их комбинацией); (2) C-концевой амид или сложный эфир вместо С-концевого карбоксилата и (3) общую структуру A-B-C:
где A выбран из группы, состоящей из:
(i) фенилмолочной кислоты (PLA);
(ii) окси-производного PLA;
(iii) пептида из 2-6 аминокислот, в котором две смежных аминокислоты связаны посредством сложноэфирной или эфирной связи;
где B представляет собой аминокислоты р-26 SEQ ID NO: 1401, где р равно 3, 4, 5, 6 или 7, содержащие, но необязательно, одну или несколько аминокислотных модификаций, включая, например, любую из модификаций, описанных для пептидов класса 5. Так, например, одна или несколько модификаций могут быть выбраны из группы, состоящей из:
(iv) замены Asp в положении 9 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1401) на Glu, сульфоновокислотное производное Cys, гомоглутаминовую кислоту, β-гомоглутаминовую кислоту или алкилкарбоксилатное производное цистеина, имеющее структуру:
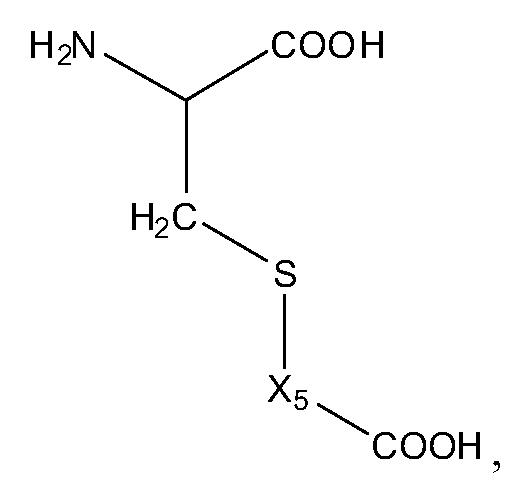
где X5 представляет собой C1-C4алкил, C2-C4алкенил или C2-C4алкинил;
(v) замены одной или двух аминокислот в положениях 10, 20, и 24 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1401) аминокислотой, ковалентно связанной с ацильной группой или алкильной группой посредством сложной эфирной, простой эфирной, тиоэфирной, амидной или алкиламиновой связи;
(vi) замены одной или двух аминокислот в положениях 16, 17, 20, 21 и 24 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1401) аминокислотой, выбранной из группы, состоящей из Cys, Lys, орнитина, гомоцистеина и ацетилфенилаланина (Ac-Phe), где аминокислота указанной группы ковалентно связана с гидрофильной группой;
(vii) замены Asp в положении 15 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1401) цистеиновой кислотой, глутаминовой кислотой, гомоглутаминовой кислотой и гомоцистеиновой кислотой;
(viii) замены Ser в положении 16 (в соответствии с нумерацией аминокислот в последовательности SEQ ID NO: 1401) цистеиновой кислотой, глутаминовой кислотой, гомоглутаминовой кислотой и гомоцистеиновой кислотой;
(ix) замены Arg в положении 17 на Gln, замены Arg в положении 18 на Ala, замены Asp в положении 21 на Glu, замены Val в положении 23 на Ile, и замены Gln в положении 24 на Ala (в соответствии с нумерацией аминокислот SEQ ID NO: 1401);
(x) замены Ser в положении 16 на Glu, замены Gln в положении 20 на Glu, или замены Gln в положении 24 на Glu (в соответствии с нумерацией аминокислот SEQ ID NO: 1401);
где C (в общей структуре A-B-C) выбран из группы, состоящей из:
(vii) X;
(viii) X-Y;
(ix) X-Y-Z;
(x) X-Y-Z-R10;
где X представляет собой Met, Leu или Nle; Y представляет собой Asn или заряженную аминокислоту; Z представляет собой Thr, Gly, Cys, Lys, орнитин (Orn), гомоцистеин, ацетилфенилаланин (Ac-Phe) или заряженную аминокислоту; где R10 выбран из группы, состоящей из SEQ ID NN: 1421, 1426, 1427 и 1450.
В конкретном аспекте изобретения, указанный пептид содержит окси-производное PLA. Используемый здесь термин «окси-производное PLA» означает соединение, имеющее модифицированную структуру PLA, в которой гидроксильная группа заменена O-R11, где R11 представляет собой химическую группу. В соответствии с этим, окси-производным PLA может быть, например, сложный эфир PLA или простой эфир PLA.
Методы получения окси-производных PLA известны специалистам. Так, например, если окси-производным является сложный эфир PLA, то такой сложный эфир может быть получен посредством реакции взаимодействия гидроксила PLA с карбонилом, несущим нуклеофил. Нуклеофилом может быть любой подходящий нуклеофил, включая, но не ограничиваясь ими, амин или гидроксил. В соответствии с этим, сложный эфир PLA может иметь структуру формулы IV:
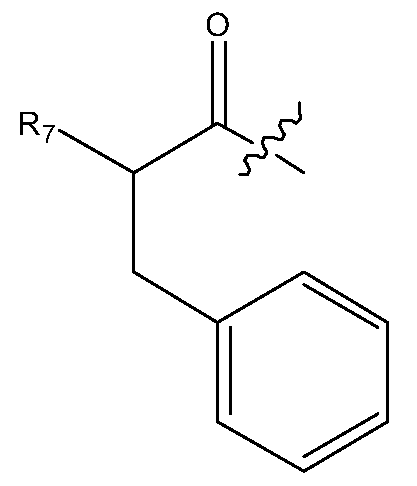
Формула IV
где R7 представляет собой сложный эфир, полученный посредством реакции взаимодействия гидроксила PLA с карбонилом, несущим нуклеофил.
Карбонилом, несущим нуклеофил (который реагирует с гидроксилом PLA с образованием сложного эфира), может быть, например, карбоновая кислота, производное карбоновой кислоты или активированный сложный эфир карбоновой кислоты. Производным карбоновой кислоты может быть, но не ограничивается ими, ацилхлорид, ангидрид кислоты, амид, сложный эфир или нитрил. Активированным сложным эфиром карбоновой кислоты может быть, например, N-гидроксисукцинимид (NHS), тозилат (Tos), карбодиимид или гексафторфосфат. В некоторых вариантах изобретения, карбодиимидом является 1,3-дициклогексилкарбодиимид (DCC), 1,1'-карбонилдимидазол (CDI), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) или 1,3-диизопропилкарбодиимид (DICD). В некоторых вариантах изобретения, гексафторфосфат выбран из группы, состоящей из гексафторфосфата бензотриазол-1-илокси-трис(диметиламино)фосфония (BOP), гексафторфосфата бензотриазол-1-ил-окситрипирролидинфосфония (PyBOP), гексафторфосфата 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) и гексафторфосфата o-бензотриазол-N,N,N',N'-тетраметилурония (HBTU).
Методы получения простых эфиров посредством реакции взаимодействия с гидроксильной группой (например, с гидроксилом PLA) также известны специалистом. Так, например, гидроксильная группа PLA может реагировать с галогенированным алкиловым спиртом или тозилированным алкиловым спиртом с образованием простой эфирной связи.
В конкретном варианте изобретения, химической группой, связанной с PLA посредством кислород-содержащей связи (например, сложной эфирной связи или простой эфирной связи), является полимер (например, полиалкиленгликоль), углевод, аминокислота, пептид или липид, например, жирная кислота или стероид.
В конкретном варианте изобретения, химической группой является аминокислота, представляющая собой, но необязательно, часть пептида, который согласно формуле IV является депсипептидом. В этой связи следует отметить, что PLA может присутствовать в положении, не являющемся положением N-концевого аминокислотного остатка указанного пептида, то есть, так, чтобы указанный пептид содержал одну или несколько (например, 1, 2, 3, 4, 5, 6 или более) аминокислот со стороны N-конца по отношению к остатку PLA. Так, например, указанный пептид может содержать PLA в положении n, где n равно 2, 3, 4, 5 или 6.
Аминокислоты со стороны N-конца по отношению к остатку PLA могут быть синтетическими или природными. В конкретном варианте изобретения, аминокислоты, присутствующие со стороны N-конца по отношению к PLA, являются природными аминокислотами. В некоторых вариантах изобретения, аминокислоты, присутствующие со стороны N-конца по отношению к PLA, являются N-концевыми аминокислотами нативного глюкагона. Так, например, указанный пептид может содержать у N-конца любую аминокислотную последовательность SEQ ID NN: 1452-1456, где PLA связан с треонином посредством сложноэфирной связи:
SEQ ID NO 1452 His-Ser-Gln-Gly-Thr-PLA
SEQ ID NO 1453 Ser-Gln-Gly-Thr-PLA
SEQ ID NO 1454 Gln-Gly-Thr-PLA
SEQ ID NO 1455 Gly-Thr-PLA
SEQ ID NO 1456 Thr-PLA
В альтернативном варианте изобретения, одна или несколько N-концевых аминокислот могут быть заменены аминокислотой, отличающейся от аминокислоты нативного глюкагона. Так, например, если указанный пептид содержит PLA в качестве аминокислоты в положении 5 или 6, то аминокислота в положении 1 и/или в положении 2 может представлять собой аминокислоту, которая снижает чувствительность к расщеплению дипептидил-пептидазой IV. Более конкретно, в некоторых вариантах изобретения, аминокислотой в положении 1 указанного пептида является аминокислота, выбранная из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Более конкретно, в некоторых вариантах изобретения, аминокислотой в положении 2 пептида-антагониста/пептида-агониста является аминокислота, выбранная из группы, состоящей из D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (AIB). Кроме того, например, если указанный пептид содержит PLA в качестве аминокислоты в положении 4, 5 или 6, то аминокислотой в положении 3 указанного пептида может быть глутаминовая кислота, а в нативном глюкагоне, такой аминокислотой является нативный глутаминовый остаток. В репрезентативном варианте изобретения, указанный пептид содержит у своего N-конца любую из аминокислотных последовательностей SEQ ID NN: 1457-1459.
Что касается пептидов, содержащих соединение формулы IV, то полимером может быть любой полимер, при условии, что он может реагировать с гидроксильной группой PLA. Полимером может быть полимер, который, по своей природе или в большинстве случаев, содержит карбонил, несущий нуклеофил. Альтернативно, таким полимером может быть полимер, который был дериватизирован так, чтобы он содержал карбонил, несущий карбонил. Указанным полимером может быть любой дериватизированный полимер, выбранный из: полиамидов, поликарбонатов, полиалкиленов и их производных, включая полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, полимеры сложных эфиров акриловой и метакриловой кислоты, включая полиметилметакрилат, полиэтилметакрилат, полибутилметакрилат, полиизобутилметакрилат, полигексилметакрилат, полиизодецилметакрилат, полилаурилметакрилат, полифенилметакрилат, полиметилакрилат, полиизопропилакрилат, полиизобутилакрилат и полиоктадецилакрилат; поливиниловых полимеров, включая поливиниловые спирты, поливиниловые простые эфиры, поливиниловые сложные эфиры, поливинилгалогениды, поливинилацетат и поливинилпирролидон; полигликолидов, полисилоксанов, полиуретанов и их сополимеров; целлюлоз, включая алкилцеллюлозу, гидроксиалкилцеллюлозы, простые эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксибутилметилцеллюлозу, ацетат целлюлозы, пропионат целлюлозы, ацетат-бутират целлюлозы, ацетат-фталат целлюлозы, карбоксиэтилцеллюлозу, триацетат целлюлозы и натриевую соль сульфата целлюлозы; полипропилена, полиэтиленов, включая полиэтиленгликоль, полиэтиленоксид и полиэтилентерефталат, и полистирола.
Полимером может быть биологически разлагаемый полимер, включая синтетический биологически разлагаемый полимер (например, полимеры молочной кислоты и гликолевой кислоты, полиангидриды, полиортоэфиры, полиуретаны, полибутановая кислота, поливалериановая кислота и сополимер лактида и капролактона)) и природный биологически разлагаемый полимер (например, альгинат и другие полисахариды, включая декстран и целлюлозу, коллаген, их химические производные (замены, добавления химических групп, например, алкила, алкилена; продукты гидроксилирования, окисления и другие модификации, которые могут быть осуществлены рутинным способом), альбумин и другие гидрофильные белки (например, зеин и другие проламины и гидрофобные белки)), а также любой их сополимер или их смесь. Вообще говоря, эти вещества разлагаются либо посредством ферментативного гидролиза, либо под действием воды in vivo, посредством поверхностной эрозии или эрозии при растворении.
Полимером может быть биоадгезивный полимер, такой как биоэрозивный гидрогель, описанный в публикации H. S. Sawhney, C. P. Pathak и J. A. Hubbell in Macromolecules, 1993, 26, 581-587, которая вводится в настоящее описание посредством ссылки; полигиалуроновые кислоты, казеин, желатин, глютин, полиангидриды, полиакриловая кислота, альгинат, хитозан, полиметилметакрилаты, полиэтилметакрилаты, полибутилметакрилаты, полиизобутилметакрилат, полигексилметакрилат, полиизодецилметакрилат, полилаурилметакрилат, полифенилметакрилат, полиметилакрилат, полиизопропилакрилат, полиизобутилакрилат и полиоктадецилакрилат.
В некоторых вариантах изобретения, полимером является водорастворимый полимер. Подходящие водорастворимые полимеры известны специалистам, и ими являются, например, поливинилпирролидон, гидроксипропилцеллюлоза (HPC; Klucel), гидроксипропилметилцеллюлоза (HPMC; Methocel), нитроцеллюлоза, гидроксипропилэтилцеллюлоза, гидроксипропилбутилцеллюлоза, гидроксипропилпентилцеллюлоза, метилцеллюлоза, этилцеллюлоза (Ethocel), гидроксиэтилцеллюлоза, различные алкилцеллюлозы и гидроксиалкилцеллюлозы, различные простые эфиры целлюлозы, ацетат целлюлозы, карбоксиметилцеллюлоза, натрий-содержащая карбоксиметилцеллюлоза, кальций-содержащая карбоксиметилцеллюлоза, сополимеры винилацетата/кротоновой кислоты, полигидроксиалкилметакрилат, гидроксиметилметакрилат, сополимеры метакриловой кислоты, полиметакриловая кислота, полиметилметакрилат, сополимеры ангидрида малеиновой кислоты/метилвинилового эфира, поливиниловый спирт, натрий- и кальций-содержащая полиакриловая кислота, полиакриловая кислота, кислотные карбоксиполимеры, карбоксиполиметилен, карбоксивиниловые полимеры, сополимер полиоксиэтилена-полиоксипропилена, сополимер полиметилвинилового эфира и ангидрида малеиновой кислоты, карбоксиметиламид, сополимер метакрилата калия и дивинилбензола, полиоксиэтиленгликоли, полиэтиленоксид и их производные, соли и комбинации.
В конкретном варианте изобретения, указанным полимером является полиалкиленгликоль, включая, например, полиэтиленгликоль (ПЭГ).
Углеводом может быть любой углевод, при условии, что он содержит или может быть получен так, чтобы он содержал карбонил с уходящей альфа-группой. Углеводом, например, может быть углевод, который был дериватизирован так, чтобы он содержал карбонил с уходящей альфа-группой. В соответствии с этим, углевод может представлять собой дериватизированную форму моносахарида (например, глюкозы, галактозы, фруктозы), дисахарида (например, сахарозы, лактозы, мальтозы), олигосахарида (например, раффинозы, стахиозы), полисахарида (крахмала, амилозы, амилопектина, целлюлозы, хитина, каллозы, ламинарина, ксилана, маннана, фукоидана, галактоманнана).
Липидом может быть липид, содержащий карбонил с уходящей альфа-группой. Липидом, например, может быть липид, который был дериватизирован так, чтобы он содержал карбонил. В соответствии с этим, липид может представлять собой производное жирной кислоты (например, жирной C4-C30-кислоты, эйкозаноида, простагландина, лейкотриена, тромбоксана, N-ацилэтаноламина), глицеролипида (например, моно-, ди-, три-замещенных глицеринов), глицерофосфолипида (например, фосфатидилхолина, фосфатидилинозита, фосфатидилэтаноламина, фосфатидилсерина), сфинголипида (например, сфингозина, церамида), стиролового липида (например, стероида, холестерина), пренолового липида, сахаролипида или поликетида, масла, воска, холестерина, стирола, растворимого в жирах витамина, моноглицерида, диглицерида, триглицерида, фосфолипида.
В некоторых вариантах изобретения, R7 имеет молекулярную массу примерно 100 кДа или менее, например, примерно 90 кДа или менее, примерно 80 кДа или менее, примерно 70 кДа или менее, примерно 60 кДа или менее, примерно 50 кДа или менее, примерно 40 кДа или менее. В соответствии с этим, R7 может иметь молекулярную массу примерно 35 кДа или менее, примерно 30 кДа или менее, примерно 25 кДа или менее, примерно 20 кДа или менее, примерно 15 кДа или менее, примерно 10 кДа или менее, примерно 5 кДа или менее, или примерно 1 кДа.
В альтернативном варианте изобретения, пептид, имеющий общую структуру А-В-С, содержит в качестве группы A пептид, состоящий из 2-6 аминокислот, где две смежные аминокислоты указанного пептида А связаны посредством сложной эфирной или простой эфирной связи. Сложная эфирная или простая эфирная связь может присутствовать, например, между аминокислотами 2 и 3, 3 и 4, 4 и 5 или 5 и 6. Пептид А может быть также, но необязательно, модифицирован посредством ковалентной связи с другой химической группой, включая образование связи с полимером (например, гидрофильным полимером), алкилирование или ацилирование.
В конкретном варианте изобретения, вышеописанный пептид класса 5, содержащий PLA, был модифицирован так, чтобы он содержал окси-производное PLA, такое как, например, сложный эфир PLA или простой эфир PLA. Так, например, пептид класса 5 может содержать любую из аминокислотных последовательностей SEQ ID NN: 1402, 1405-1420, 1422-1425, 1432-1436, 1438, 1439, 1445, 1446 и 1451, где PLA связан посредством сложной эфирной или простой эфирной связи с аминокислотой, пептидом, полимером, ацильной группой или алкильной группой. В настоящей заявке могут быть использованы любые из описанных здесь аминокислот, пептидов, полимеров, ацильных групп или алкильных групп. В том случае, если PLA связан с аминокислотой или пептидом посредством сложноэфирной связи, то пептид класса 5 может рассматриваться как депсипептид.
Кроме того, в другом конкретном варианте изобретения, вышеописанный пептид класса 5, не содержащий PLA, был модифицирован так, чтобы он содержал по меньшей мере одну сложную эфирную связь или простую эфирную связь между двумя смежными аминокислотами, находящимися со стороны N-конца по отношению к аминокислоте в положении 7 (в соответствии с нумерацией аминокислот нативного глюкагона). В конкретном варианте изобретения, пептид класса 5 содержит по меньшей мере одну сложноэфирную связь или эфирную связь между двумя смежными аминокислотами. В более конкретном варианте изобретения, пептид класса 5 содержит N-концевые 6 аминокислот SEQ ID NO: 1401, а две смежные аминокислоты этих шести N-концевых аминокислот связаны посредством сложной эфирной или простой эфирной связи.
Пептид A может содержать любые аминокислоты, как синтетические, так и природные, при условии, что по меньшей мере две смежных аминокислоты данного пептида связаны друг с другом посредством сложной эфирной или простой эфирной связи. В конкретном варианте изобретения, пептид А содержит аминокислоты нативного глюкагона. Аминокислотой в положении 1 и/или в положении 2 может быть аминокислота, которая снижает чувствительность к расщеплению дипептидил-пептидазой IV. Так, например, пептид А может содержать в положении 1 аминокислоту, выбранную из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Более конкретно, в некоторых вариантах изобретения, аминокислотой в положении 2 пептида А является аминокислота, выбранная из группы, состоящей из D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (AIB). Кроме того, например, аминокислотой в положении 3 пептида А может быть глутаминовая кислота, а в нативном глюкагоне, такой аминокислотой является нативный глутаминовый остаток. В соответствии с этим, пептид общей структуры А-В-С может содержать аминокислотную последовательность:
Xaa1-Xaa2-Xaa3-Thr-Gly-Phe (SEQ ID NO: 1507);
Xaa2-Xaa3-Thr-Gly-Phe (SEQ ID NO: 1508); или
Xaa3-Thr-Gly-Phe (SEQ ID NO: 1509);
где Xaa1 выбрана из группы, состоящей из: His, D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина; Xaa2 выбрана из группы, состоящей из: Ser, D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (AIB); а Xaa3 представляет собой Gln или Glu.
В некоторых вариантах изобретения, пептид B модифицирован путем введения до трех аминокислотных модификаций. Так, например, пептид В, который представляет собой нативную аминокислотную последовательность SEQ ID NO: 1401, модифицируют путем введения одной или нескольких консервативных аминокислотных замен.
В другом варианте изобретения, B включает одну или более аминокислотных модификаций, выбранных из группы, состоящей из описанных здесь модификаций (iv)-(x). В конкретном варианте изобретения, B включает одну или две аминокислотных модификации (v) и (vi). В другом конкретном варианте изобретения, B включает, помимо модификаций (v) и (vi), одну или комбинацию из аминокислотных модификаций, выбранных из группы, состоящей из (iv), (vii), (viii), (ix) и (x).
Как описано в настоящей заявке, пептид, содержащий общую структуру A-B-C, может включать одну или несколько заряженных аминокислот у С-конца, например, описанных здесь аминокислот Y и/или Z. Альтернативно или дополнительно, указанный пептид, содержащий общую структуру A-B-C, может также включать одну или две заряженных аминокислоты со стороны С-конца по отношению к Z, если C содержит X-Y-Z. Заряженными аминокислотами могут быть, например, одна из таких аминокислот, как Lys, Arg, His, Asp и Glu. В конкретном варианте изобретения, Y представляет собой Asp.
В некоторых вариантах изобретения, пептид, содержащий общую структуру A-B-C, включает гидрофильную группу, ковалентно связанную с аминокислотным остатком в положении 1, 16, 20, 21 или 24 (в соответствии с нумерацией аминокислот SEQ ID NO: 1401), или с N- или C-концевым остатком пептида, содержащего общую структуру A-B-C. В конкретном варианте изобретения, гидрофильная группа присоединена к остатку Cys пептида, содержащего общую структуру A-B-C. В соответствии с этим, аминокислота в положении 16, 21, 24 или 29 нативного глюкагона (SEQ ID NO: 1401) может быть заменена остатком Cys. Альтернативно, остаток Cys, содержащий гидрофильную группу, может быть добавлен к С-концу пептида, содержащего общую структуру A-B-C, в положение 30 или в положение 40, например, если пептид, содержащий общую структуру A-B-C, имеет С-концевое удлинение (в положениях, соответствующих нумерации аминокислот SEQ ID NO: 1401). Альтернативно, гидрофильная группа может быть присоединена к PLA пептида, содержащего общую структуру A-B-C, посредством гидроксильной группы PLA. Гидрофильной группой может быть любая из описанных здесь групп, включая, например, полиэтиленгликоль.
В конкретном аспекте изобретения, пептид, содержащий общую структуру A-B-C, включает альфа-спираль, стабилизированную посредством включения внутримолекулярного мостика. В некоторых вариантах изобретения, внутримолекулярным мостиком является лактамовый мостик. Лактамовый мостик может присутствовать между аминокислотами в положениях 9 и 12, между аминокислотами в положениях 12 и 16, между аминокислотами в положениях 16 и 20, между аминокислотами в положениях 20 и 24, или между аминокислотами в положениях 24 и 28 (в соответствии с нумерацией аминокислот SEQ ID NO: 1401). В конкретном варианте изобретения, аминокислоты в положениях 12 и 16 или в положениях 16 и 20 (в соответствии с нумерацией аминокислот SEQ ID NO: 1401) связаны друг с другом посредством лактамового мостика. В настоящей заявке рассматриваются и другие положения лактамового мостика.
Дополнительно или альтернативно, пептид, содержащий общую структуру A-B-C, может включать альфа,альфа-дизамещенную аминокислоту, например, в любом из положений 16, 20, 21 или 24 (в соответствии с нумерацией аминокислот SEQ ID NO: 1401). В некоторых вариантах изобретения, альфа,альфа-дизамещенной аминокислотой является AIB. В конкретном аспекте изобретения, AIB находится в положении 16 (в соответствии с нумерацией аминокислот SEQ ID NO: 1401).
Альтернативно или дополнительно, пептид, содержащий общую структуру A-B-C, может быть модифицирован так, чтобы он включал кислотную аминокислоту в положении 16 (в соответствии с нумерацией аминокислот SEQ ID NO: 1401), где указанная модификация повышает стабильность альфа-спирали. В некоторых вариантах изобретения, кислотной аминокислотой является аминокислота, содержащая сульфоновую кислоту в боковой цепи или карбоновую кислоту в боковой цепи. В более конкретном варианте изобретения, кислотная аминокислота выбрана из группы, состоящей из Glu, Asp, гомоглутаминовой кислоты, сульфоновокислотного производного Cys, цистеиновой кислоты, гомоцистеиновой кислоты, Asp и алкилированного производного Cys, имеющего структуру:
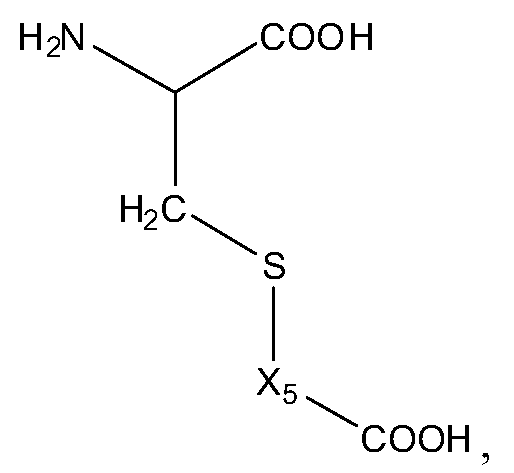
где X5 представляет собой C1-C4алкил, C2-C4алкенил или C2-C4алкинил.
В конкретном варианте изобретения, пептид класса 5 может содержать любую из аминокислотных последовательностей SEQ ID NN: 1460-1470, 1473-1478, 1480-1488, 1490-1496, 1503, 1504, 1506 и 1514-1518, или аминокислотную последовательность любого из пептидов 2-6, представленных в таблице 13, пептидов 1-8, представленных в таблице 14, и пептидов 2-6, 8 и 9, представленных в таблице 15.
Лактам, пептиды Cex-глюкагона (6-39) и антагонист глюкагона и GLP-1-агонистическая активность

Лактамовые пептиды глюкагона (1-29, 2-29, 4-29 и 6-29) и антагонист глюкагона и GLP-1-агонистическая активность
(PA = частичный антагонист)
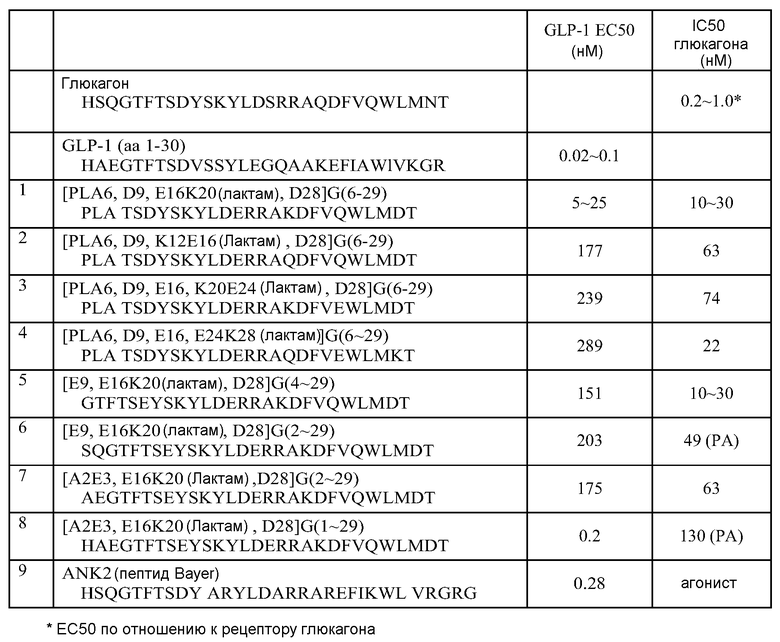
Таблица 15
Профили смешанного агониста/антагониста


В некоторых вариантах изобретения, пептид, содержащий общую структуру A-B-C, представляет собой пептид класса 5. В конкретном варианте изобретения, указанный пептид обладает агонистической активностью, которая составляет по меньшей мере примерно 50% от максимальной активности, достигаемой нативным GLP-1 по отношению к рецептору GLP-1, и по меньшей мере примерно на 50% ингибирует максимальную реакцию нативного глюкагона с рецептором глюкагона. В другом конкретном варианте изобретения, указанный пептид обладает агонистической активностью, которая составляет по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, или примерно 100% от максимальной агонистической активности, достигаемой нативным GLP-1 по отношению к рецептору GLP-1. Альтернативно или дополнительно, указанный пептид по меньшей мере примерно на 55%, по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 80%, по меньшей мере примерно на 90%, по меньшей мере примерно на 95% или примерно на 100% ингибирует максимальную реакцию нативного глюкагона с рецептором глюкагона.
В некоторых своих вариантах, настоящее изобретение относится к пептиду класса 5 или его конъюгату, которые включают:
(1) модификации, сообщающие глюкагон-антагонистическую активность, включая, но, не ограничиваясь ими:
(a) замену Phe в положении 6 на PLA (в соответствии с нумерацией аминокислот глюкагона дикого типа), необязательно, в комбинации с делецией 1-5 аминокислот у N-конца глюкагона дикого типа; или
(b) делецию 2-5 аминокислот у N-конца глюкагона дикого типа, необязательно, с заменой Asp в положении 9 глюкагона дикого типа глутаминовой кислотой, гомоглутаминовой кислотой или сульфоновокислотным производным цистеина (в соответствии с нумерацией аминокислот глюкагона дикого типа);
(2) модификации, сообщающие GLP-1-агонистическую активность, включая, но не ограничиваясь ими:
(a) инсерцию или замену α,α-дизамещенной аминокислоты в положениях аминокислот 12-29 глюкагона дикого типа, например, в одном, двух, трех, четырех или более положениях 16, 17, 18, 19, 20, 21, 24 или 29 (в соответствии с нумерацией аминокислот глюкагона дикого типа); или
(b) введение внутримолекулярного мостика в положениях аминокислот 12-29 глюкагона дикого типа, например, солевого мостика или лактамового мостика, или ковалентной связи другого типа; или
(c) замену аминокислоты в одном или нескольких положениях 2, 3, 17, 18, 21, 23 или 24 (в соответствии с нумерацией аминокислот нативного глюкагона) соответствующей аминокислотой GLP-1, например, замену Ser2 на Ala, замену Gln3 на Glu, замену Arg17 на Gln, замену Arg в положении 18 на Ala, замену Asp в положении 21 на Glu, замену Val в положении 23 на Ile, и/или замену Gln в положении 24 на Ala; или
(d) другие модификация, которые стабилизируют альфа-спиральную структуру приблизительно в положениях аминокислот 12-29 в соответствии с нумерацией аминокислот глюкагона дикого типа; и
(3) другие модификации, которые повышают GLP-1-агонистическую активность, например,
(a) введение C-концевого амида или сложного эфира вместо C-концевого карбоксилата; и необязательно,
(4) одну или несколько из нижеследующих модификаций:
(a) ковалентного присоединения к гидрофильной группе, такой как полиэтиленгликоль, например, у N-конца, или в положении 6, 16, 17, 20, 21, 24, 29, 40, или у C-концевой аминокислоты; и/или
(b) ацилирования или алкилирования; и необязательно,
(5) одну или несколько из нижеследующих дополнительных модификаций:
(a) ковалентного связывания аминокислот с N-концом, например, 1-5 аминокислот с N-концом, необязательно, посредством сложноэфирной связи с PLA в положении 6 (в соответствии с нумерацией аминокислот глюкагона дикого типа), необязательно, вместе с модификациями в положении 1 или 2, например, как описано в настоящей заявке, в целях повышения резистентности к расщеплению ферментом DPP-IV;
(b) делеции аминокислот в положениях 29 и/или 28, и, необязательно, в положении 27 (в соответствии с нумерацией аминокислот глюкагона дикого типа);
(c) ковалентного связывания аминокислот с C-концом;
(d) неконсервативных замен, консервативных замен, добавлений или делеций, сохраняющих нужную активность, например, консервативных замен в одном или нескольких положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29, замены Tyr в положении 10 на Val или Phe, замены Lys в положении 12 на Arg, замены в одном или нескольких этих положениях на Ala;
(e) модификации аспарагиновой кислоты в положении 15, например, путем замены глутаминовой кислотой, гомоглутаминовой кислотой, цистеиновой кислотой или гомоцистеиновой кислотой, где указанная модификация может снижать степень разложения; или модификации серина в положении 16, например, путем замены треонином, AIB, глутаминовой кислотой или другой отрицательно заряженной аминокислотой, имеющей боковую цепь длиной в 4 атома, или альтернативно, любой одной из таких аминокислот, как глутамин, гомоглутаминовая кислота или гомоцистеиновая кислота, где указанные замены аналогичным образом могут снижать степень разложения, обусловленного расщеплением связи Asp15-Ser16;
(f) модификации метионина в положении 27, например, путем замены лейцином или норлейцином в целях снижения степени окислительного разложения;
(g) модификации Gln в положении 20 или 24, например, путем замены аминокислотами Ala или AIB, в целях снижения степени расщепления, обусловленного дезамидированием Gln;
(h) модификации Asp в положении 21, например, путем замены аминокислотой Glu, в целях снижения степени разложения, обусловленного дегидратацией Asp с образованием циклического сукцинимидного промежуточного соединения с последующей его изомеризацией в изоаспартат;
j) гомодимеризации или гетеродимеризации, описанных в настоящей заявке, и
(k) комбинаций вышеописанных модификаций.
Следует отметить, что любая из модификаций одного и того же класса может быть объединена друг с другом и/или с модификациями другого класса. Так, например, модификации (1)(a) могут быть объединены с модификациями (2)(a) и (3); модификации (1)(a) могут быть объединены с модификациями (2)(b), например, с лактамовым мостиком или с солевым мостиком, и (3); модификации (1)(a) могут быть объединены с модификациями (2)(c) и (3); модификации (1)(b) могут быть объединены с модификациями (2)(a) и (3); модификации (1)(b) могут быть объединены с модификациями (2)(b), например, с лактамовым мостиком или с солевым мостиком и (3); модификации (1)(b) могут быть объединены с модификациями (2)(c) и (3); любая из вышеуказанных модификаций может быть объединена с модификациями (4)(a) и/или (4)(b); и любая из вышеуказанных модификаций может быть объединена с модификациями (5)(a)-(5)(k).
В репрезентативных вариантах изобретения, α,α-дизамещенная аминокислота AIB заменена в одном, двух, трех или во всех положениях 16, 20, 21 или 24 (в соответствии с нумерацией аминокислот глюкагона дикого типа).
В репрезентативных вариантах изобретения, внутримолекулярным мостиком является солевой мостик.
В других репрезентативных вариантах изобретения, внутримолекулярным мостиком является ковалентная связь, например, лактамовый мостик. В некоторых вариантах изобретения, лактамовый мостик присутствует между аминокислотами в положениях 9 и 12, между аминокислотами в положениях 12 и 16, между аминокислотами в положениях 16 и 20, между аминокислотами в положениях 20 и 24, или между аминокислотами в положениях 24 и 28 (в соответствии с нумерацией аминокислот SEQ ID NO: 1401). В репрезентативных вариантах изобретения, ацилирование или алкилирование осуществляют в положениях 6, 10, 20 или 24 или у N-конца или у C-конца (в соответствии с нумерацией аминокислот глюкагона дикого типа) SEQ ID NO: 1401.
В репрезентативных вариантах изобретения, модификациями являются:
(i) замена Asp в положении 15 (в соответствии с нумерацией аминокислот SEQ ID NO: 1401) цистеиновой кислотой, глутаминовой кислотой, гомоглутаминовой кислотой и гомоцистеиновой кислотой;
(ii) замена Ser в положении 16 (в соответствии с нумерацией аминокислот SEQ ID NO: 1401) цистеиновой кислотой, глутаминовой кислотой, гомоглутаминовой кислотой и гомоцистеиновой кислотой;
(iii) замена Asn в положении 28 заряженной аминокислотой;
(iv) замена Asn в положении 28 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты;
(v) замена в положении 28 аминокислотами Asn, Asp или Glu;
(vi) замена в положении 28 аминокислотой Asp;
(vii) замена в положении 28 аминокислотой Glu;
(viii) замена Thr в положении 29 заряженной аминокислотой;
(ix) замена Thr в положении 29 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты;
(x) замена в положении 29 аминокислотами Asp, Glu или Lys;
(xi) замена в положении 29 аминокислотой Glu;
(xii) инсерция 1-3 заряженных аминокислот за положением 29;
(xiii) инсерция Glu или Lys за положением 29;
(xiv) инсерция Gly-Lys или Lys-Lys за положением 29;
или их комбинации.
Любая из описанных выше модификаций, которая повышает агонистическую активность по отношению к рецептору GLP-1, антагонистическую активность по отношению к рецептору глюкагона, растворимость пептида и/или стабильность пептида, может быть введена отдельно или в комбинации с другими модификациями.
Модификация для повышения стабильности
В соответствии с некоторыми вариантами изобретения, описанные здесь пептиды класса 5 могут быть дополнительно модифицированы путем включения аминокислотной последовательности SEQ ID NO: 1421 (GPSSGAPPPS) или SEQ ID NO: 1450, связанной с карбокси-концевой аминокислотой (в положении 24) пептида класса 5, где указанные пептиды могут быть введены индивидуумам для стимуляции снижения массы тела или поддержания массы тела на соответствующем уровне. Более конкретно, пептид класса 5 включает последовательность, выбранную из группы, состоящей из SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407, SEQ ID NO: 1408, SEQ ID NO: 1409, SEQ ID NO: 1412, SEQ ID NO: 1413, SEQ ID NO: 1414, SEQ ID NO: 1416, SEQ ID NO: 1417, SEQ ID NO: 1418, SEQ ID NO: 1419, SEQ ID NO: 1422, SEQ ID NO: 1423, SEQ ID NO: 1424 и SEQ ID NO: 1425, а также аминокислотную последовательность SEQ ID NO: 1421 (GPSSGAPPPS) или SEQ ID NO: 1450, связанную с карбокси-концевой аминокислотой (в положении 24) указанного пептида или пептида класса 5, где указанный пептид может быть использован для снижения аппетита и стимуляции снижения массы тела/поддержания массы тела на соответствующем уровне. В некоторых вариантах изобретения, введенный пептид или пептид класса 5 содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1416, SEQ ID NO: 1417, SEQ ID NO: 1418 и SEQ ID NO: 1419, а также аминокислотную последовательность SEQ ID NO: 1421 (GPSSGAPPPS), связанную с карбокси-концевой аминокислотой (в положении 24) пептида класса 5. В некоторых вариантах изобретения, указанный способ включает введение пептида или пептида класса 5, содержащего последовательность SEQ ID NO: 1445 или SEQ ID NO: 1446.
В соответствии с этим было высказано предположение, что описанные здесь пептиды класса 5 могут быть аналогичным образом модифицированы для снижения их восприимчивости к преждевременному химическому расщеплению в водных буферах. В соответствии с некоторыми вариантами изобретения, описанные здесь пептиды класса 5 могут быть также модифицированы для повышения их стабильности в водных растворах путем замены нативной аспарагиновой кислоты, расположенной в положении 15 нативного глюкагона, аминокислотой, выбранной из группы, состоящей из цистеиновой кислоты, глутаминовой кислоты, гомоглутаминовой кислоты и гомоцистеиновой кислоты. В соответствии с некоторыми вариантами изобретения, остаток аспарагиновой кислоты в положении 10 пептида класса 5 SEQ ID NO: 1405, SEQ ID NO:1406, SEQ ID NO:1407 или SEQ ID NO:1408 может быть заменен аминокислотой, выбранной из группы, состоящей из цистеиновой кислоты, глутаминовой кислоты, гомоглутаминовой кислоты и гомоцистеиновой кислоты, а в некоторых вариантах изобретения, нативная аспарагиновая кислота в положении 10 SEQ ID NO: 1405, SEQ ID NO:1406, SEQ ID NO:1407 или SEQ ID NO:1408 заменена глутаминовой кислотой. В некоторых своих вариантах, настоящее изобретение относится к пептиду класса 5, обладающему повышенной стабильностью в водных растворах, где указанный антагонист содержит модифицированную последовательность SEQ ID NO:1409, где указанная модификация включает замену Asp в положении 10 SEQ ID NO:1409 аминокислотой Glu. В некоторых своих вариантах, настоящее изобретение относится к пептиду класса 5, содержащему последовательность, выбранную из группы, состоящей из SEQ ID NO: 1422, SEQ ID NO: 1423, SEQ ID NO:1424 и SEQ ID NO: 1425. В некоторых вариантах изобретения, пептид класса 5 является амидированным.
Последовательность Asp-Ser в положении 15 и 16 нативного глюкагона была идентифицирована как абсолютно нестабильный дипептид, приводящий к преждевременному химическому расщеплению нативного гормона в водных буферах. Так, например, при выдерживании в 0,01 н. HCl при 37°C в течение 2 недель, более, чем 50% нативного глюкагона может расщепляться на фрагменты. Два высвобождающихся в результате расщепления пептида 1-15 и 16-29 теряют глюкагон-подобную биологическую активность, и поэтому создают проблемы при приготовлении водного препарата глюкагона и родственных ему аналогов. Как наблюдалось, селективная химическая замена Asp в положении 15 нативного пептида глюкагона аминокислотой Glu фактически устраняет химическое расщепление пептидной связи 15-16.
В других репрезентативных вариантах изобретения, любое из вышеупомянутых соединений может быть дополнительно модифицировано в положениях аминокислот, соответствующих положениям 15 или 16 нативного глюкагона для повышения стабильности в целях снижения степени разложения пептида за определенный период времени, в частности, в кислотных или в основных буферах.
Модификация для повышения растворимости
Пептид класса 5 может быть дополнительно модифицирован в целях повышения растворимости пептида в водных растворах при физиологическом рН, а в некоторых аспектах изобретения, для сохранения глюкагон-антагонистической активности и GLP-1-агонистической активности. Введение гидрофильных групп в положениях, соответствующих положениям 12, 15, 16, 19 и 24 пептида SEQ ID NO: 1405, или в положениях 12, 16, 19 или 24 пептида SEQ ID NO: 1406 может приводить к повышению растворимости полученных пептидов в растворах, имеющих физиологический рН, с сохранением глюкагон-антагонистической активности и GLP-агонистической активности родительских соединений. Поэтому, в некоторых вариантах изобретения, описанный здесь пептид класса 5 дополнительно модифицируют так, чтобы он содержал одну или несколько гидрофильных групп, ковалентно связанных с боковыми цепями аминокислот, соответствующих положениям аминокислот 12, 15, 16, 19 и 24 пептида SEQ ID NO: 1405 или SEQ ID NO: 1406. В другом варианте изобретения, боковые цепи аминокислот, соответствующих положениям аминокислот 16 и 19 SEQ ID NO: 1405 или SEQ ID NO: 1406, ковалентно связаны с гидрофильными группами, а в некоторых вариантах изобретения, указанной гидрофильной группой является полиэтиленгликоль (ПЭГ).
Родственные глюкагону пептиды класса 5 могут быть модифицированы путем сообщения заряда у его карбокси-конца для повышения растворимости пептида с сохранением агонистических свойств данного пептида. Такая повышенная растворимость позволяет получать и сохранять растворы глюкагона при pH, близком к нейтральному. Приготовление растворов глюкагона при относительно нейтральных pH (при pH примерно от 6,0 до 8,0) обеспечивает более длительную стабильность пептидов класса 5.
Авторами настоящего изобретения было высказано предположение, что описанные здесь пептиды класса 5 могут быть аналогичным образом модифицированы для повышения их растворимости в водных растворах при относительно нейтральном рН (например, при рН примерно 6,0-8,0), а некоторых случаях, с сохранением глюкагон-антагонистической активности и GLP-1-активности. В соответствии с этим, в некоторых своих вариантах, настоящее изобретение относится к антагонисту глюкагона/GLP-1 SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408, в которые были внесены дополнительные модификации по сравнению с нативными аминокислотами, присутствующими в положениях 6-29 глюкагона дикого типа (SEQ ID NO: 1401), для сообщения указанному пептиду заряда путем замены нативных незаряженных аминокислот заряженными аминокислотами, или добавления заряженных аминокислот к карбокси-концу. В соответствии с некоторыми вариантами изобретения, описанные здесь 1-3 незаряженные нативные аминокислоты пептида класса 5 заменены заряженной аминокислотой. В некоторых вариантах изобретения, заряженная аминокислота выбрана из группы, состоящей из лизина, аргинина, гистидина, аспарагиновой кислоты и глутаминовой кислоты. Более конкретно, авторами настоящего изобретения было обнаружено, что замена природной аминокислоты, соответствующей положению 28 и/или 29 (по сравнению с нативным глюкагоном), заряженными аминокислотами и/или добавление одной или двух заряженных аминокислот к карбокси-концу пептида, будет приводить к повышению растворимости и стабильности пептида класса 5 в водных растворах при физиологически приемлемых pH (то есть, при pH примерно 6,5-7,5). В соответствии с этим, предполагается, что такие модификации, внесенные в описанный здесь пептид класса 5, будут оказывать аналогичное влияние на растворимость в водных растворах, а в частности, при рН примерно от 5,5 до 8,0, и при этом, будет сохраняться биологическая активность родительского пептида.
В соответствии с некоторыми вариантами изобретения, пептид класса 5 SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408 модифицирован путем замены нативной аминокислоты в соответствующем положении 23 и/или 24 этих последовательностей отрицательно заряженной аминокислотой (например, аспарагиновой кислотой или глутаминовой кислотой) и, необязательно, добавления отрицательно заряженной аминокислоты (например, аспарагиновой кислоты или глутаминовой кислоты) к карбокси-концу пептида. В альтернативном варианте изобретения, пептид класса 5, содержащий SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408, модифицирован путем замены нативной аминокислоты в положении 24 последовательностей SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408 положительно заряженной аминокислотой (например, лизином, аргинином или гистидином) и, необязательно, добавления одной или двух положительно заряженных аминокислот (например, лизина, аргинина или гистидина) к карбокси-концу пептида. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, обладающему повышенной растворимостью и стабильностью, где указанный аналог содержит аминокислотную последовательность SEQ ID NO: 1415 или SEQ ID NO: 1451, при условии, что по меньшей мере одна из аминокислот в положении 23 или 24 SEQ ID NO: 1415 или SEQ ID NO: 1451 заменена кислотной аминокислотой, и/или при условии, что к карбокси-концу SEQ ID NO: 1415 или SEQ ID NO: 1451 была добавлена дополнительная кислотная аминокислота. В некоторых вариантах изобретения, кислотные аминокислоты независимо выбраны из группы, состоящей из Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, обладающему повышенной растворимостью и стабильностью, где указанный антагонист содержит аминокислотную последовательность SEQ ID NO: 1416, SEQ ID NO: 1417, SEQ ID NO: 1418 или SEQ ID NO: 1419. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к агонисту глюкагона, содержащему последовательность SEQ ID NO: 1416 или SEQ ID NO: 1417. В некоторых вариантах изобретения, пептид класса 5 содержит последовательность SEQ ID NO: 1420.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пептиду класса 5, содержащему последовательность SEQ ID NO: 1415 или SEQ ID NO: 1451. В некоторых вариантах изобретения, в положении 4 SEQ ID NO: 1415 или SEQ ID NO: 1451 присутствует аспарагиновая кислота, глутаминовая кислота, гомоглутаминовая кислота, цистеиновая кислота или гомоцистеиновая кислота, в некоторых вариантах изобретения, в положении 4 присутствует аспарагиновая кислота, глутаминовая кислота, цистеиновая кислота или гомоцистеиновая кислота, в другом варианте изобретения, в положении 4 SEQ ID NO: 1415 или SEQ ID NO: 1451 присутствует аспарагиновая кислота или глутаминовая кислота, и в некоторых вариантах изобретения, в положении 4 SEQ ID NO: 1415 или SEQ ID NO: 1451 присутствует аспарагиновая кислота. В некоторых своих вариантах, настоящее изобретение относится к пептиду класса 5, содержащему последовательность SEQ ID NO: 1415 или SEQ ID NO: 1451, где в положении 4 SEQ ID NO: 1415 присутствует аспарагиновая кислота, а в положении 10 SEQ ID NO: 1415 присутствует глутаминовая кислота. В другом варианте изобретения, С-концевую аминокислоту SEQ ID NO: 1415 или SEQ ID NO: 1451 модифицируют путем замены нативной карбоксильной группы нейтральной группой, такой как амид или сложный эфир.
Гибриды пептида класса 5
В другом варианте изобретения, карбокси-концевая аминокислота описанного здесь пептида класса 5 ковалентно связана со вторым пептидом, содержащем последовательность, выбранную из группы, состоящей из SEQ ID NN: 1421, 1426, 1427 и 1450. Так, например, в некоторых вариантах изобретения, пептид класса 5 SEQ ID NO: 1415, SEQ ID NO: 1451, SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407, SEQ ID NO: 1408, SEQ ID NO: 1412, SEQ ID NO: 1413, SEQ ID NO: 1414, SEQ ID NO: 1416, SEQ ID NO: 1417, SEQ ID NO: 1418, SEQ ID NO: 1419, SEQ ID NO: 1422, SEQ ID NO: 1423, SEQ ID NO: 1424 и SEQ ID NO: 1425 ковалентно связан со вторым пептидом, содержащим последовательность, выбранную из группы, состоящей из SEQ ID NO: 1421 (GPSSGAPPPS), SEQ ID NO: 1426 (KRNRNNIA), SEQ ID NO: 1427 (KRNR) и SEQ ID NO: 1450 (GPSSGAPPPSX).
В некоторых своих вариантах, настоящее изобретение относится к димеру пептида класса 5, содержащему две последовательности, независимо выбранные из группы, состоящей из SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407, SEQ ID NO: 1408, SEQ ID NO: 1409, SEQ ID NO: 1422, SEQ ID NO: 1423, SEQ ID NO: 1424 и SEQ ID NO: 1425, которые также содержат аминокислотную последовательность SEQ ID NO: 1421 (GPSSGAPPPS), связанную с карбокси-концевой аминокислотой пептида класса 5.
В некоторых вариантах изобретения, пептид класса 5 дополнительно модифицируют путем усечения или делеции одной или двух аминокислот у C-конца пептида (то есть, усечения аминокислоты в положении 29 или в положениях 28 и 29 нативного глюкагона). При этом, предпочтительно, чтобы такое усечение не влияло на активность (например, глюкагон-антагонистическую активность/GLP-1-агонистическую активность) пептида класса 5.
Конъюгаты пептидов класса 5
Настоящее изобретение также относится к конъюгатам пептидов класса 5, где указанный пептид глюкагона связан, необязательно, посредством ковалентной связи и, необязательно, посредством линкера, с частью конъюгата.
В тех вариантах изобретения, в которых пептид класса 5 содержит полиэтиленгликолевую цепь, такая полиэтиленгликолевая цепь может быть прямой или разветвленной. В соответствии с некоторыми вариантами изобретения, полиэтиленгликолевая цепь имеет среднюю молекулярную массу примерно 500-10000 дальтон. В некоторых вариантах изобретения, полиэтиленгликолевая цепь имеет среднюю молекулярную массу примерно 1000-5000 дальтон. В некоторых вариантах изобретения, полиэтиленгликолевая цепь имеет среднюю молекулярную массу примерно 1000-5000 дальтон. В некоторых вариантах изобретения, полиэтиленгликолевая цепь имеет среднюю молекулярную массу примерно 1000-2000 дальтон. В некоторых вариантах изобретения, полиэтиленгликолевая цепь имеет среднюю молекулярную массу примерно 1000 дальтон.
В некоторых вариантах изобретения, ПЭГилированный пептид класса 5 содержит пептид, состоящий из SEQ ID NO: 1415 или SEQ ID NO:1451, где полиэтиленгликолевая цепь связана с аминокислотой, выбранной из аминокислот в положениях 11, 12, 15, 16, 19 и 24 SEQ ID NO: 1415 или SEQ ID NO: 1451, а молекулярная масса ПЭГ-цепи составляет примерно 1000-5000 дальтон. В некоторых вариантах изобретения, ПЭГилированный пептид класса 5 содержит пептид, состоящий из последовательности SEQ ID NO: 1415 или SEQ ID NO: 1451, где полиэтиленгликолевая цепь связана с аминокислотой в положении 16 или 19 SEQ ID NO: 1415 или SEQ ID NO: 1451, а молекулярная масса ПЭГ-цепи составляет примерно 1000-5000 дальтон. В другом варианте изобретения, модифицированный пептид класса 5 содержит две или более полиэтиленгликолевых цепи, ковалентно связанных с пептидом, где общая молекулярная масса глюкагоновых цепей составляет примерно 1000-5000 дальтон. В некоторых вариантах изобретения, пептид класса 5 включает последовательность SEQ ID NO: 1415 или SEQ ID NO: 1451, где полиэтиленгликолевая цепь связана с аминокислотой в положениях 16 и 19 SEQ ID NO: 1415 или SEQ ID NO: 1451, а общая молекулярная масса двух ПЭГ-цепей составляет примерно 1000-5000 дальтон.
Родственный глюкагону пептид класса 5 может содержать любую из аминокислотных последовательностей SEQ ID NN: 1401-1518, имеющую, но необязательно, до 1, 2, 3, 4 или 5 дополнительных модификаций, сохраняющих глюкагон-антагонистическую и GLP-1-агонистическую активность.
Влияние структуры дипептидного элемента пролекарства на скорость отщепления
Как описано выше, скорость отщепления дипептидного элемента пролекарства A-B от пептида, принадлежащего к суперсемейству глюкагонов, и тем самым, активация пролекарства зависит от структуры (включая N-алкилирование, число заместителей, длину или объем) и стереохимической структуры аминокислот дипептидного элемента пролекарства. Скорость отщепления дипептидного элемента пролекарства A-B от пептида, принадлежащего к суперсемейству глюкагонов также зависит от стерического затруднения, нуклеофильности и стабильности уходящей группы Q в процессе образования дикетопиперазина. Некоторые из этих структурных признаков описаны ниже в разделах «Категория I», «Категория II» и «Категория III», которые составляют часть настоящего изобретения. Из любой из этих категорий полностью исключаются пептидные последовательности, описанные в Международной заявке No. PCT/US2009/68745, поданной 18 декабря 2009 или в списке последовательностей этой заявки, и субкатегории: (1) дипептидных элементов пролекарства, (2) аминокислот А, и/или (3) аминокислот B, описанных в Международной заявке No. PCT/US2009/68745, поданной 18 декабря 2009, до той степени, в которой они полностью и/или частично перекрываются с частью любой из описанных здесь категорий, и только в той степени, которая необходима для сообщения новизны заявленному предмету изобретения.
Категория I: Состав аминокислот B дипептидного элемента пролекарства
В некоторых вариантах изобретения, время полужизни пролекарства, например, полупериод химического отщепления (t1/2) A-B от Q, который составляет по меньшей мере примерно от 1 часа до 1 недели в PBS, в физиологических условиях, зависит от присутствия и длины N-алкильного заместителя на аминокислоте B. Так, например, пролекарство, которое имеет более короткий N-алкильный заместитель на аминокислоте B (например, Gly(N-метил)), будет иметь более низкую скорость отщепления от A-B и более продолжительное время полужизни, чем пролекарство, которое имеет более длинный N-алкильный заместитель на аминокислоте B (например, Gly(N-гексил)).
В некоторых вариантах изобретения, время полужизни пролекарства зависит от степени замещения в бета-положении аминокислоты B дипептидного элемента пролекарства. Так, например, пролекарство, которое содержит аминокислоту B, дизамещенную в бета-положении (например, N-алкилированный изолейцин), имеет более низкую скорость отщепления от A-B, и более продолжительное время полужизни, чем пролекарство, которое имеет аминокислоту В, монозамещенную в бета-положении (например, N-алкилированный лейцин). Кроме того, пролекарство, которое имеет аминокислоту B, монозамещенную в бета-положении (например, N-алкилированный лейцин), имеет более низкую скорость отщепления от A-B, и более продолжительное время полужизни, чем пролекарство, которое содержит аминокислоту B, не имеющую заместителя в бета-положении (например, N-алкилированный аланин). Кроме того, пролекарство, которое содержит аминокислоту B, содержащую атом углерода в бета-положении (например, N-алкилированный аланин), имеет более низкую скорость отщепления от A-B и более продолжительное время полужизни, чем пролекарство, которое содержит глицин в качестве аминокислоты B.
В некоторых вариантах изобретения, время полужизни пролекарства зависит от объема боковой цепи аминокислоты В. Так, например, пролекарство, которое содержит более крупную боковую цепь на аминокислоте В (например, N-алкилированный фенилаланин), имеет более низкую скорость отщепления от A-B, и более продолжительное время полужизни, чем пролекарство, которое содержит менее крупную боковую цепь на аминокислоте В (например, N-алкилированный аланин).
Состав аминокислот В дипептидного элемента пролекарства может быть подразделен на нижеследующие субкатегории IA, IB и IC. Вообще говоря, дипептидные элементы пролекарства, относящиеся к субкатегории IA, отщепляются быстрее, а дипептидные элементы пролекарства, относящиеся к субкатегории IC, отщепляются более медленно.
Субкатегория IA: Аминокислотой В дипептидного элемента пролекарства является N-алкилированный глицин
В некоторых вариантах изобретения, указанное пролекарство содержит структуру:
A-B-Q;
где Q представляет собой пептид, принадлежащий к суперсемейству глюкагонов;
где A-B содержит структуру:
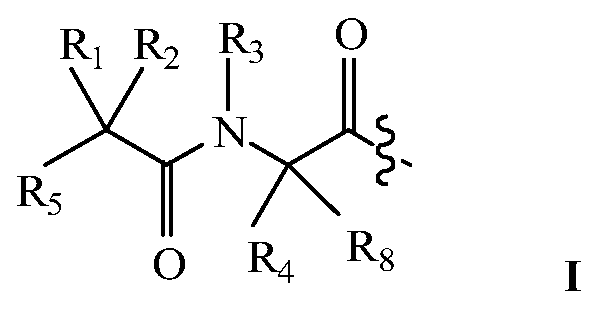
где
R1 и R2 независимо выбраны из группы, состоящей из H, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)OH, (С1-С18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(W1)C1-C12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил;
R3 представляет собой С1-С18алкил;
каждый из R4 и R8 представляет собой Н;
R5 представляет собой NHR6;
R6 представляет собой H или C1-C4алкил, или R5 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из Н, ОН, галогена, (C1-C7алкил), (C2-C7алкенил), OCF3, NO2, CN, NC, О(C1-C7алкил), CO2H, CO2(C1-C7алкил), NHR6, арила и гетероарила.
В некоторых вариантах изобретения, аминокислота B выбрана из группы, состоящей из глицин(N-метил), глицин(N-этил), глицин(N-пропил), глицин(N-бутил), глицин(N-пентил), глицин(N-гексил), глицин(N-гептил) и глицин(N-октил). Так, например, аминокислотой В может быть глицин(N-метил) или глицин(N-гексил).
В некоторых вариантах изобретения, если, например, оба R1 и R2 представляют собой водород, а R3 представляет собой C1-C4алкил, то A-B конъюгирован с алифатическим амином. В некоторых вариантах изобретения, если, например, оба R1 и R2 представляют собой водород, а R3 представляет собой C5-C8алкил, то A-B конъюгирован с алифатическим амином. В некоторых вариантах изобретения, если, например, по меньшей мере один из R1 или R2 не является водородом, а R3 представляет собой C1-C4алкил, то A-B конъюгирован с алифатическим амином. В некоторых вариантах изобретения, если, например, по меньшей мере один из R1 или R2 не является водородом, а R3 представляет собой C5-C8алкил, то A-B конъюгирован с алифатическим амином.
В некоторых вариантах изобретения, если оба R1 и R2 представляют собой водород, а R3 представляет собой метил, то A-B не конъюгирован с альфа-аминогруппой F7GLP-1(8-37).
Субкатегория IB: Аминокислота В дипептидного элемента пролекарства является незамещенной или монозамещенной в бета-положении
В некоторых вариантах изобретения, указанное пролекарство содержит структуру:
A-B-Q;
где Q представляет собой пептид, принадлежащий к суперсемейству глюкагонов;
где A-B содержит структуру:
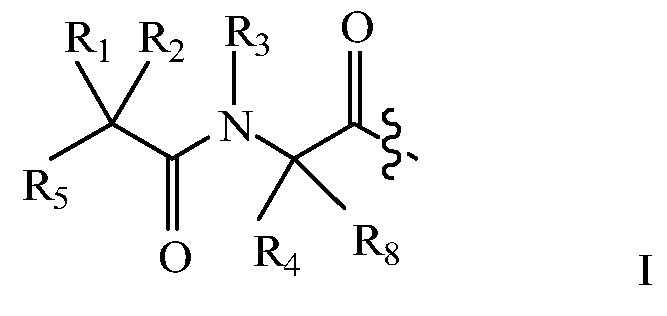
где
R1 и R2 независимо выбраны из группы, состоящей из H, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)OH, (С1-С18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(W1)C1-C12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил;
R3 представляет собой С1-С18алкил;
R4 выбран из группы, состоящей из CH3, CH2(С1-С10алкил), CH2(С2-С10алкенил), CH2(С0-С10алкил)ОН, CH2(С0-С10алкил)SH, CH2(C0-C3алкил)SCH3, CH2(C0-C3алкил)CONH2, CH2(C0-C3алкил)COOH, CH2(C0-C3алкил)NH2, CH2(C0-C3алкил)NHC(NH2 +)NH2, CH2(C0-C3алкил)(C3-C6циклоалкил), CH2(C0-C3алкил)(C2-C5гетероциклил), CH2(C0-C3алкил)(C6-C10арил)R7, CH2(C1-C3алкил)(C3-C9гетероарил) и CH2(C0-C12алкил(W1)C1-C12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R8 представляет собой Н;
R5 представляет собой NHR6; или R5 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R6 представляет собой H или C1-C4алкил; и
R7 выбран из группы, состоящей из Н, ОН, галогена, (C1-C7алкил), (C2-C7алкенил), OCF3, NO2, CN, NC, О(C1-C7алкил), CO2H, CO2(C1-C7алкил), NHR6, арила и гетероарила.
В некоторых вариантах изобретения, R4 выбран из группы, состоящей из CH3, CH2(С1-С4алкил), CH2(С1-С4)алкенила, CH2(С0-С4алкил)ОН, CH2(С0-С4алкил)SH, CH2(C0-C3алкил)SCH3, CH2(C0-C3алкил)CONH2, CH2(C0-C3алкил)COOH, CH2(C0-C4алкил)NH2 и CH2(C0-C3алкил)NHC(NH2 +)NH2.
Неограничивающими примерами аминокислот В в этих вариантах являются аланин(N-С1-С10алкил), лейцин(N-С1-С10алкил), метионин(N-С1-С10алкил), аспарагин(N-С1-С10алкил), глутаминовая кислота(N-С1-С10алкил), аспарагиновая кислота(N-С1-С10алкил), глутамин(N-С1-С10алкил), гистидин(N-С1-С10алкил), лизин(N-С1-С10алкил), аргинин(N-С1-С10алкил), серин(N-С1-С10алкил) и цистеин(N-С1-С10алкил).
В некоторых вариантах изобретения, аминокислота В выбрана из группы, состоящей из аланин(N-С1-С6алкил), лейцин(N-С1-С6алкил), метионин(N-С1-С6алкил), аспарагин(N-С1-С6алкил), глутаминовая кислота(N-С1-С6алкил), аспарагиновая кислота(N-С1-С6алкил), глутамин(N-С1-С6алкил), гистидин(N-С1-С6алкил), лизин(N-С1-С6алкил), аргинин(N-С1-С6алкил), серин(N-С1-С6алкил) и цистеин(N-С1-С6алкил).
Так, например, аминокислотой В может быть аланин(N-метил), лейцин(N-метил), метионин(N-метил), аспарагин(N-метил), глутаминовая кислота(N-метил), аспарагиновая кислота(N-метил), глутамин(N-метил), гистидин(N-метил), лизин(N-метил), аргинин(N-метил), серин(N-метил) и цистеин(N-метил).
В некоторых вариантах изобретения, R4 выбран из группы, состоящей из CH2(C0-C3алкил)(C3-C6циклоалкил), CH2(C0-C3алкил)(C2-C5гетероциклил), CH2(C0-C3алкил)(C6-C10арил)R7, CH2(C1-C3алкил)(C3-C9гетероарил) и CH2(C0-C12алкил(W1)C1-C12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, и где R7 выбран из группы, состоящей из H и OH.
Неограничивающими примерами аминокислот В в этих вариантах являются фенилаланин(N-С1-С10алкил), тирозин(N-С1-С10алкил) и триптофан(N-С1-С10алкил). В некоторых вариантах изобретения, аминокислота В выбрана из группы, состоящей из фенилаланин(N-С1-С6алкил), тирозин(N-С1-С6алкил) и триптофан(N-С1-С6алкил). Так, например, аминокислотой В может быть фенилаланин(N-метил), тирозин(N-метил) и триптофан(N-метил).
В некоторых вариантах изобретения, аминокислотой В является пролин. В некоторых вариантах изобретения, пролин исключен из субкатегории IB.
Субкатегория IC: Аминокислота В дипептидного элемента пролекарства является дизамещенной в бета-положении
В некоторых вариантах изобретения, указанное пролекарство содержит структуру:
A-B-Q;
где Q представляет собой пептид, принадлежащий к суперсемейству глюкагонов;
где A-B содержит структуру:

где
R1 и R2 независимо выбраны из группы, состоящей из H, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)OH, (С1-С18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(W1)C1-C12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил;
R3 представляет собой С1-С18алкил;
R4 независимо выбран из группы, состоящей из CH(С1-С8алкил)2, CH(С2-С8алкенил)2, CH(С1-С8алкил)(ОН), CH(С1-С8алкил)((С1-С8алкил)SH), CH(С1-С3алкил)(С1-С8алкил)(NH2);
R8 представляет собой Н;
R5 представляет собой NHR6; или R5 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R6 представляет собой H или C1-C4алкил; и
R7 выбран из группы, состоящей из Н, ОН, галогена, (C1-C7алкил), (C2-C7алкенил), OCF3, NO2, CN, NC, О(C1-C7алкил), CO2H, CO2(C1-C7алкил), NHR6, арила и гетероарила.
В некоторых вариантах изобретения, R4 представляет собой CH(С1-С8алкил)2 или CH(С1-С8алкил)(ОН). Неограничивающими примерами аминокислот В являются изолейцин(N-С1-С10алкил), валин(N-С1-С10алкил) и треонин(N-С1-С10алкил). В некоторых вариантах изобретения, аминокислота В выбрана из группы, состоящей из изолейцин(N-С1-С6алкил), валин(N-С1-С6алкил) и треонин(N-С1-С6алкил). Так, например, аминокислотой В может быть изолейцин(N-метил), валин(N-метил) и треонин(N-метил).
Категория II: Состав аминокислот А дипептидного элемента пролекарства
В некоторых вариантах изобретения, время полужизни пролекарства зависит от числа заместителей в альфа-положении аминокислоты А. Так, например, пролекарство, содержащее аминокислоту А, которая представляет собой α-монозамещенную аминокислоту (например, Ala), отщепляется более медленно и имеет более длительное время полужизни, чем пролекарство, содержащее аминокислоту А, которая представляет собой α,α-дизамещенную аминокислоту (например, Aib).
В некоторых вариантах изобретения, время полужизни пролекарства зависит от степени алкилирования у альфа-аминогруппы аминокислоты А. Вообще говоря, чем выше степень алкилирования, тем ниже скорость отщепления, и тем более продолжительным является время полужизни пролекарства. Так, например, дипептидный элемент пролекарства, имеющий N-алкилированный Ala, будет отщепляться медленнее и будет иметь более продолжительное время полужизни, чем указанный элемент, содержащий Ala.
Состав аминокислот А дипептидного элемента пролекарства может быть подразделен на нижеследующие субкатегории IIA и IIB. Вообще говоря, дипептидные элементы пролекарства, относящиеся к субкатегории IIA, отщепляются быстрее, чем дипептидные элементы пролекарства, относящиеся к субкатегории IIB.
Субкатегория IIA: Аминокислота А дипептидного элемента пролекарства является дизамещенной в альфа-положении
В некоторых вариантах изобретения, аминокислота А дипептидного элемента пролекарства является дизамещенной в альфа-положении. В этих вариантах изобретения, R1 и R2 в описанных структурах, относящихся к субкатегориям IA, IB и IC, независимо выбраны из группы, состоящей из С1-С10алкила, С2-С10алкенила, (С1-С10алкил)OH, (С1-С10алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(W1)C1-C12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, либо R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил; и где R7 выбран из группы, состоящей из Н и ОН.
Так, например, аминокислотой A может быть аминоизомасляная кислота (Aib).
Субкатегория IIB: Аминокислота А дипептидного элемента пролекарства является незамещенной или монозамещенной в альфа-положении
В некоторых вариантах изобретения, аминокислота А дипептидного элемента пролекарства является незамещенной или монозамещенной в альфа-положении. В этих вариантах изобретения, R1 в описанных структурах, относящихся к субкатегориям IA, IB и IC, представляет собой Н, а R2 в описанных структурах, относящихся к субкатегориям IA, IB и IC, выбран из группы, состоящей из H, С1-С10алкила, С2-С10алкенила, (С1-С10алкил)OH, (С1-С10алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(W1)C1-C12алкила, где R7 выбран из группы, состоящей из Н и ОН, и где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, либо R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил; либо R2 и R5 взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо.
В некоторых вариантах изобретения, аминокислота A дипептидного элемента пролекарства имеет «d«-стереохимическую структуру. Неограничивающими примерами аминокислот A в этих вариантах являются лизин, цистеин и аланин. Так, например, такими аминокислотами являются d-лизин, d-цистеин и d-аланин. В некоторых вариантах изобретения, d-стереохимическая структура может способствовать увеличению времени полужизни посредством снижения степени протеолитического расщепления пептида-пролекарства.
В некоторых вариантах изобретения, аминокислота A была подвергнута N-алкилированию группой, имеющей от 1 до 4 атомов углерода, и такими аминокислотами являются Ala(N-С1-С4алкил), Lys(N-С1-С4алкил) и Cys(N-С1-С4алкил). Так, например, аминокислотой А может быть Ala(N-метил), Lys(N-метил) и Cys(N-метил). N-алкилирование аминокислоты А приводит к снижению скорости отщепления дипептидного элемента пролекарства от Q и способствует увеличению времени полужизни.
Категория III: Конъюгирование сайта дипептидного элемента пролекарства (A-B) с пептидом, принадлежащим к суперсемейству глюкагонов (Q)
В некоторых вариантах изобретения, время полужизни пролекарства зависит от стерического затруднения, нуклеофильности и стабильности уходящей группы на Q в процессе образования дикетопиперазина. Чем ниже степень стерического затруднения уходящей группы, чем ниже нуклеофильность уходящей группы, или чем выше стабильность уходящей группы после отщепления, тем менее продолжительным является время полужизни пролекарства. Тип уходящей группы на Q может быть определен по типу связи между A-B и типу аминогруппы Q, как описано ниже для субкатегорий IIIA и IIIB. Вообще говоря, дипептидные элементы пролекарства, относящиеся к субкатегории IIIA, медленнее отщепляются от Q и имеют более длительное время полужизни, чем дипептидные элементы пролекарства, относящиеся к субкатегории IIIB.
Субкатегория IIIA: A-B, связанные с алифатической аминогруппой Q
В некоторых вариантах изобретения, часть A-B связана с Q посредством амидной связи между A-B и алифатической аминогруппой Q и образует пролекарство, которое имеет полупериод химического отщепления (t½) A-B от Q, составляющий по меньшей мере примерно от 1 часа до 1 недели в PBS в физиологических условиях, как описано выше.
В некоторых вариантах изобретения, часть A-B связана с Q посредством амидной связи между A-B и альфа-аминогруппой N-концевой аминокислоты Q. Так, например, дипептидный элемент пролекарства, имеющий аминокислоту В, принадлежащую к любой из субкатегорий IA, IB, и IC, и аминокислоту А, принадлежащую к любой из субкатегорий IIA и IIB, может быть присоединен к N-концевой аминокислоте Q с образованием пролекарства, которое имеет полупериод химического отщепления (t½) A-B от Q, составляющий по меньшей мере примерно от 1 часа до 1 недели в PBS в физиологических условиях.
В некоторых вариантах изобретения, часть A-B связана с Q посредством амидной связи между A-B и алифатической аминогруппой на боковой цепи аминокислоты Q. Так, например, дипептидный элемент пролекарства, имеющий аминокислоту В, принадлежащую к любой из субкатегорий IA, IB, и IC, и аминокислоту А, принадлежащую к любой из субкатегорий IIA и IIB, может быть присоединен к алифатической аминогруппе боковой цепи аминокислоты Q с образованием пролекарства, которое имеет полупериод химического отщепления (t½) A-B от Q, составляющий по меньшей мере примерно от 1 часа до 1 недели в PBS в физиологических условиях.
В некоторых вариантах изобретения, если часть A-B связана с Q посредством амидной связи между A-B и алифатической аминогруппой Q, то либо аминокислота A должна представлять собой α,α-дизамещенную аминокислоту (субкатегория IIA), либо аминокислота B должна быть N-алкилированной (любая из субкатегорий IA, IB или IC), либо то и другое. Так, например, если A представляет собой α-монозамещенную аминокислоту (например, Ala), то B не является N-алкилированной, а если часть A-B связана с Q посредством алифатической аминогруппы Q, то это не приведет к значительному отщеплению A-B.
В других вариантах изобретения, если часть A-B связана с альфа-аминогруппой F7GLP-1(8-37), то A-B не является Gly-Gly(N-Me).
В других необязательных вариантах изобретения, если часть A-B связана с Q посредством амидной связи между A-B и алифатической аминогруппой Q, и если A представляет собой аминокислоту, которая является незамещенной в альфа-положении (например, глицин), а B представляет собой аминокислоту, принадлежащую к субкатегории IA (N-алкилированный глицин), то N-алкильный заместитель аминокислоты B имеет длину по меньшей мере в пять атомов углерода (например, N-С5-С8алкил).
В других вариантах изобретения, если часть A-B связана с Q посредством амидной связи между A-B и алифатической аминогруппой Q, и если аминокислота A является незамещенной или монозамещенной в альфа-положении (субкатегория IIB), то аминокислота B не является пролином. В некоторых вариантах изобретения, если часть A-B связана с Q посредством амидной связи между A-B и алифатической аминогруппой Q, то A-B не является Gly-Pro. В некоторых вариантах изобретения, если аминокислотой B является пролин, то аминокислота А принадлежит к субкатегории IIA.
Субкатегория IIIB: A-B, связанные с ароматической аминогруппой Q
В некоторых вариантах изобретения, часть A-B связана с Q посредством амидной связи между A-B и ароматической аминогруппой боковой цепи аминокислоты Q и образует пролекарство, которое имеет полупериод химического отщепления (t½) A-B от Q, составляющий по меньшей мере примерно от 1 часа до 1 недели в PBS в физиологических условиях, как описано выше. Так, например, дипептидный элемент пролекарства, имеющий аминокислоту В, принадлежащую к любой из субкатегорий IA, IB и IC и аминокислоту A, принадлежащую к любой из субкатегорий IIA и IIB, может быть связан с ароматической аминогруппой боковой цепи аминокислоты Q и образует пролекарство, которое имеет полупериод химического отщепления (t½) A-B от Q, составляющий по меньшей мере примерно от 1 часа до 1 недели в PBS в физиологических условиях.
Любая из аминокислот B, определенная как аминокислота категории I, может быть объединена с любой из аминокислот А, определенных как аминокислота категории II, в результате чего может быть получен дипептидный элемент пролекарства. Этот дипептидный элемент пролекарства может быть присоединен в любом из положений, описанных в разделе «Категория III». Время полужизни указанного пролекарства может быть скорректировано с учетом:
(i) числа заместителей в альфа-положении аминокислоты А;
(ii) степени N-алкилирования аминокислот A и B;
(iii) числа заместителей в бета-положении аминокислоты В;
(iv) объема боковой цепи аминокислоты B; и
(v) стерического затруднения, нуклеофильности и стабильности уходящей группы на Q в процессе образования дикетопиперазина.
Модификация дипептидного элемента пролекарства A-B
Описанные выше дипептидные элементы пролекарства могут быть дополнительно модифицированы так, чтобы они содержали гидрофильную группу, ацильную группу или алкильную группу, описанные выше. В некоторых вариантах изобретения, дипептидный элемент пролекарства включает лизин, конъюгированный с ацильной группой или алкильной группой посредством аминогруппы боковой цепи. В некоторых вариантах изобретения, дипептидный элемент пролекарства включает цистеин, конъюгированный с гидрофильной группой (например, 40 кД ПЭГ) посредством сульфгидрильной группы боковой цепи. Гидрофильная группа, ацильная группа или алкильная группа могут быть непосредственно конъюгированы с дипептидным элементом пролекарства, либо они могут быть конъюгированы с указанным элементом посредством спейсера. В некоторых репрезентативных вариантах изобретения, гидрофильная группа, алкильная группа и/или ацильная группа конъюгированы с аминокислотой А указанного дипептидного элемента пролекарства.
В некоторых вариантах изобретения, нижеследующие дипептидные элементы пролекарства являются ПЭГилированными: dCys-Gly(N-гексил), dCys-Gly(N-метил) и dCys-Phe(N-метил). В некоторых вариантах изобретения, нижеследующие дипептидные элементы пролекарства включают ацильную группу: dLys-Gly(N-гексил), dLys-Gly(N-метил) и dLys-Phe(N-метил). В некоторых вариантах изобретения, нижеследующие дипептидные элементы пролекарства включают алкильную группу: dLys-Gly(N-гексил), dLys-Gly(N-метил) и dLys-Phe(N-метил).
Репрезентативные варианты осуществления изобретения
Дипептидный элемент пролекарства согласно изобретению может включать любую комбинацию аминокислот В категории I и аминокислот A категории II. Неограничивающими примерами аминокислот A, которые могут быть использованы в качестве аминокислоты А и аминокислоты В дипептидного элемента пролекарства, являются аминокислоты, перечисленные в нижеследующей таблице.
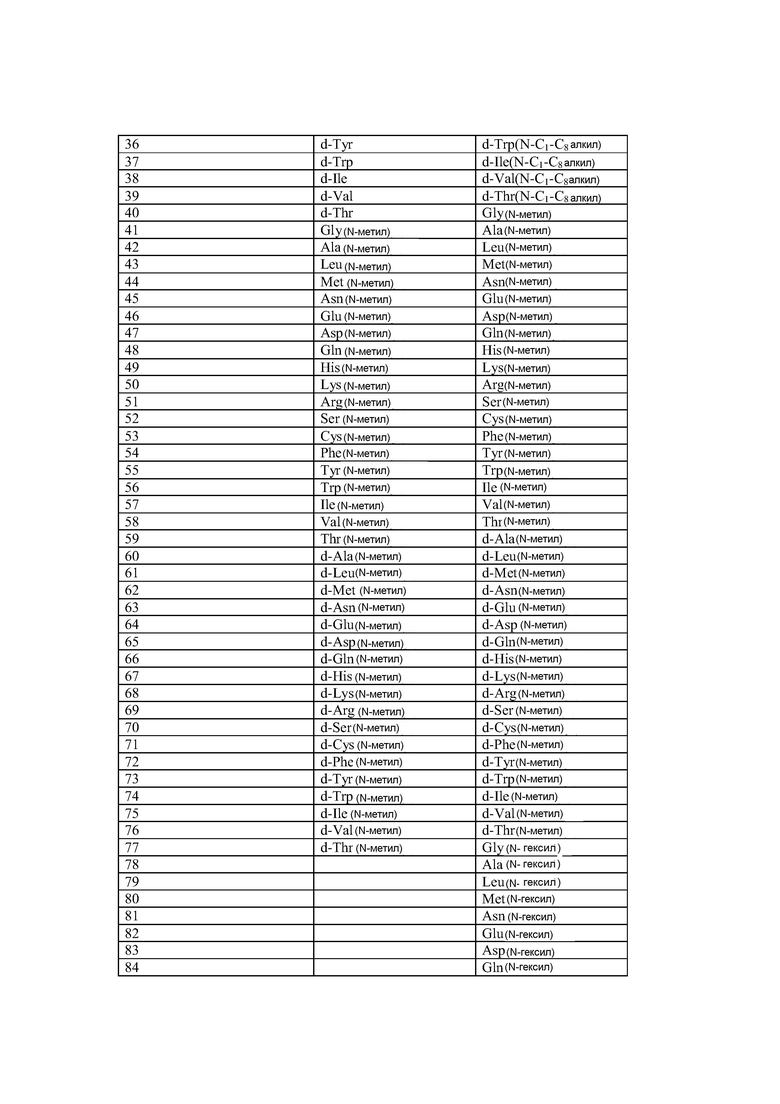
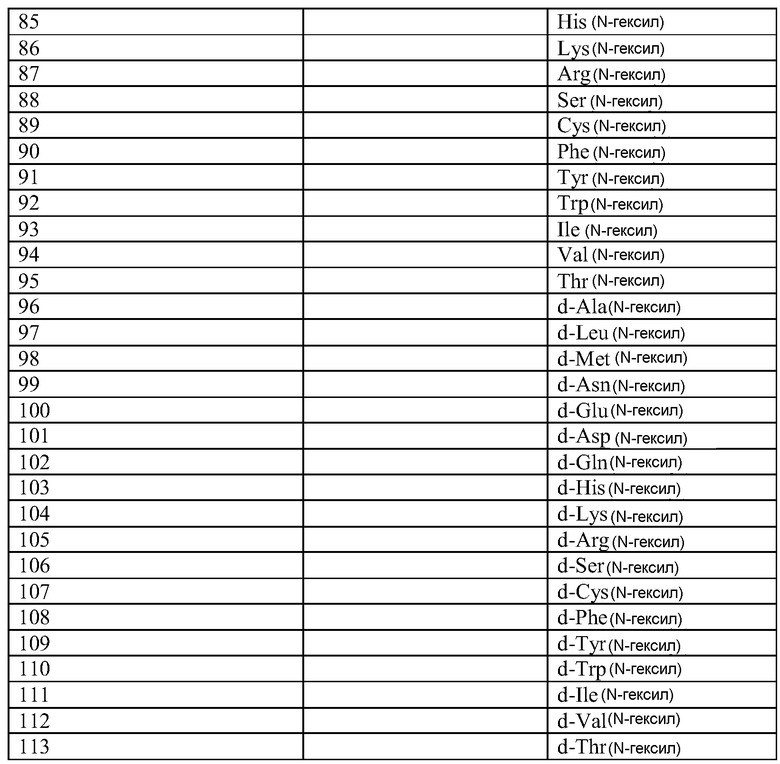
В некоторых вариантах изобретения, дипептидный элемент пролекарства включает комбинацию любой одной из аминокислот A1-A77 с любой одной из аминокислот B1-B113. Так, например, комбинациями аминокислот А и аминокислот В дипептидного элемента пролекарства могут быть: 
































Субкатегория IA: Аминокислотой В дипептидного элемента пролекарства является N-алкилированный глицин
В некоторых вариантах изобретения, аминокислотой В дипептидного элемента пролекарства является N-алкилированный глицин. Неограничивающие примеры дипептидных элементов пролекарства, имеющих N-алкилированный глицин в качестве аминокислоты B, представлены в нижеследующей таблице.
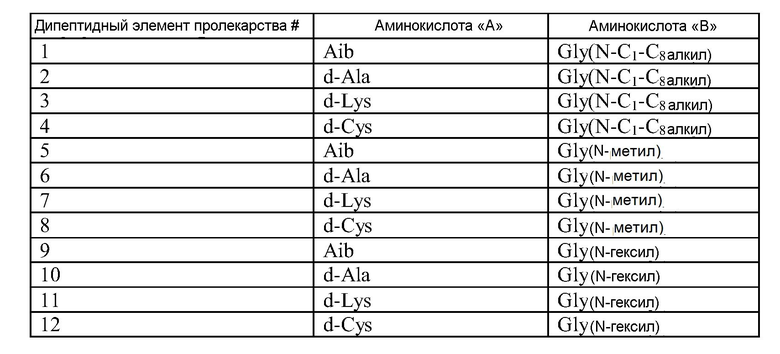
Субкатегория IB: Аминокислота В дипептидного элемента пролекарства является незамещенной или монозамещенной в бета-положении
В некоторых вариантах изобретения, аминокислота В дипептидного элемента пролекарства является незамещенной или монозамещенной в бета-положении и имеет относительно небольшую боковую цепь. Неограничивающие примеры дипептидных элементов пролекарства, имеющих аминокислоту В, которая является незамещенной или монозамещенной в бета-положении и имеет относительно небольшую боковую цепь, представлены в нижеследующей таблице.

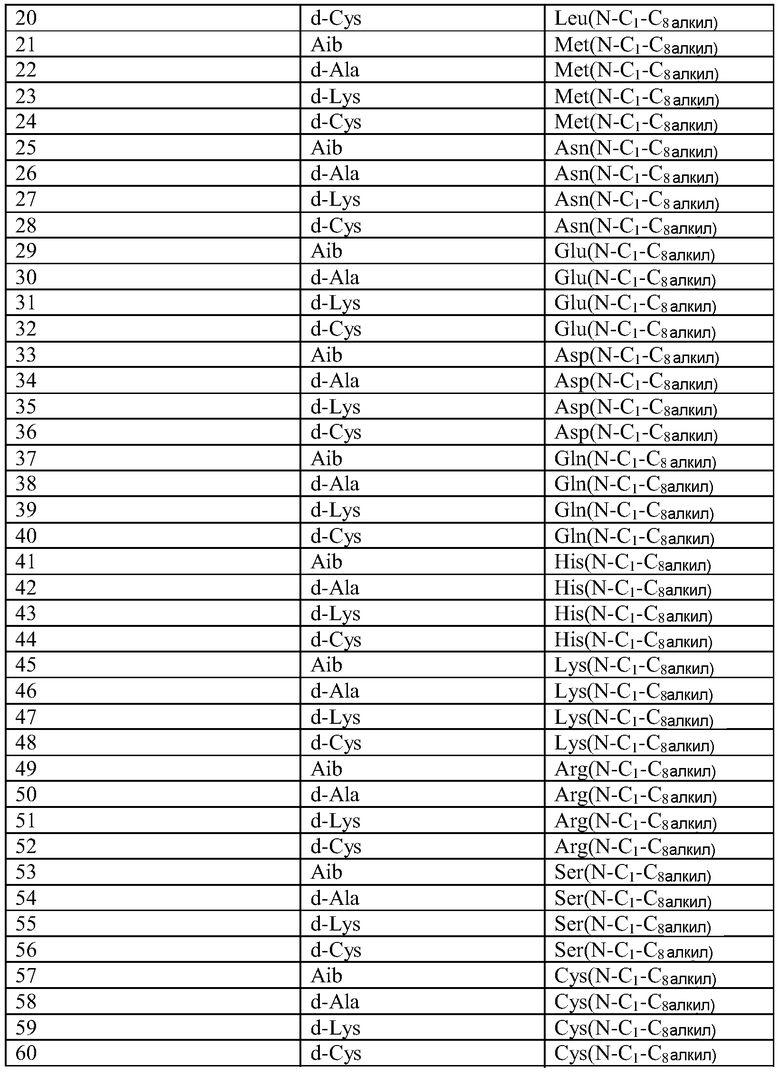
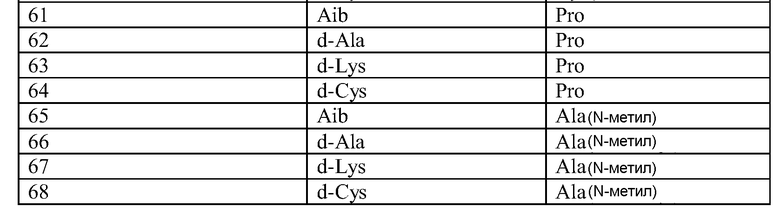
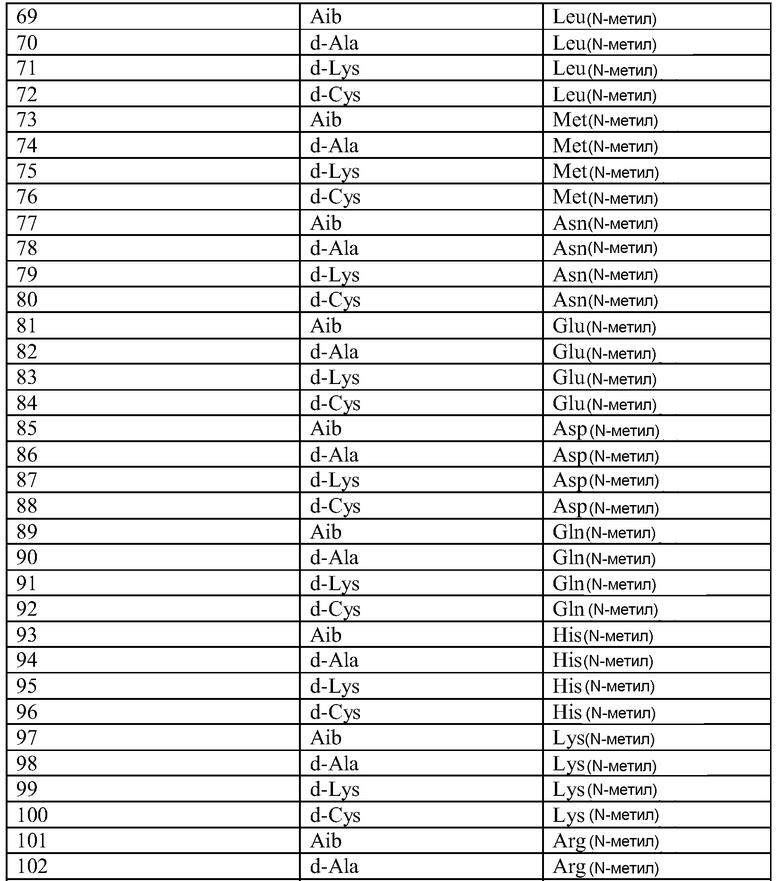

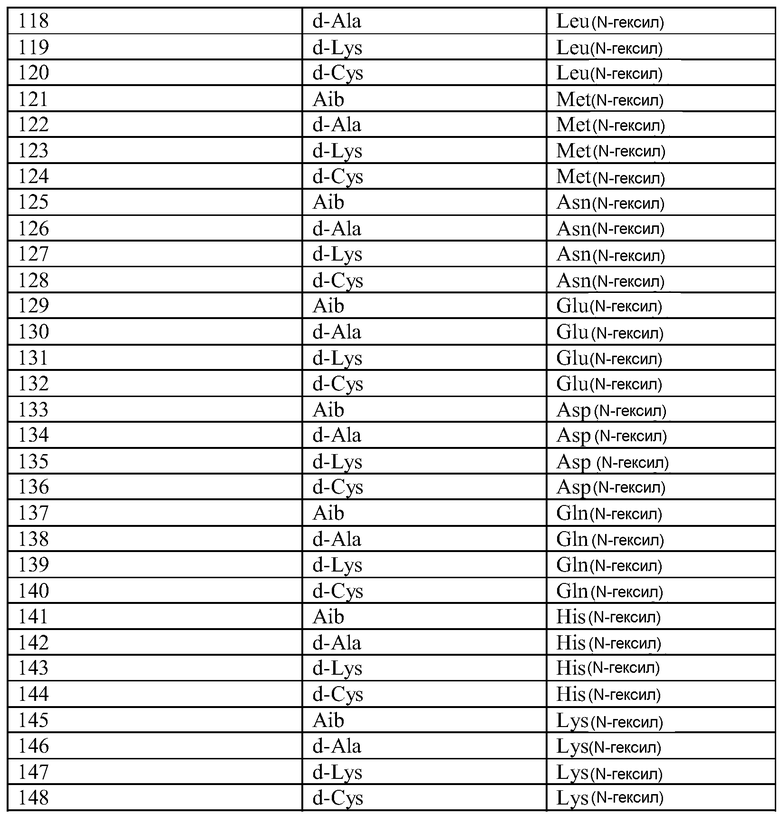
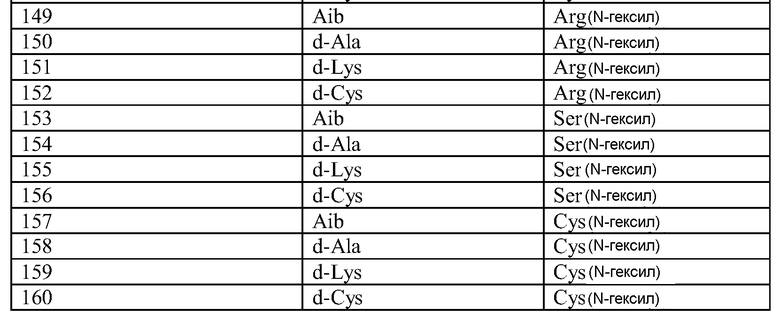
В некоторых вариантах изобретения, аминокислота В дипептидного элемента пролекарства является монозамещенной в бета-положении и имеет относительно крупную боковую цепь, как показано в нижеследующей таблице.

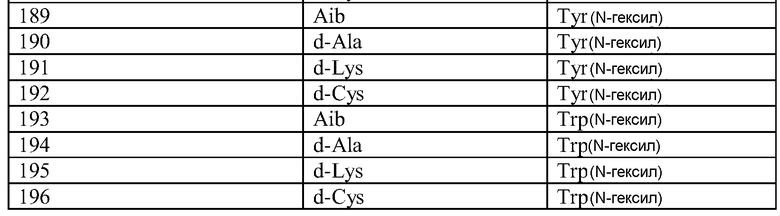
Субкатегория IC: Аминокислота В дипептидного элемента пролекарства является дизамещенной в бета-положении
В некоторых вариантах изобретения, аминокислота В дипептидного элемента пролекарства является дизамещенной в бета-положении. Неограничивающие примеры дипептидных элементов пролекарства, имеющих аминокислоту В, которая является дизамещенной в бета-положении, представлены в нижеследующей таблице.
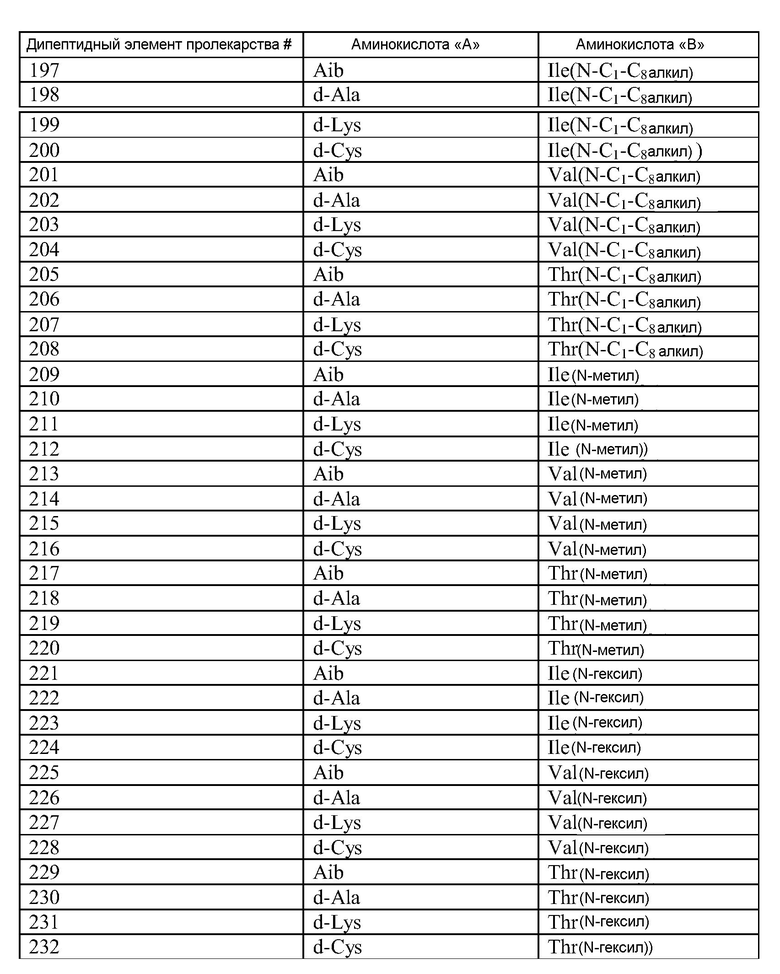
Пролекарства
Дипептидный элемент пролекарства конъюгирован с любым из нижеследующих родственных глюкагону пептидов в любом положении, которое влияет на активность родственного глюкагону пептида (например, с альфа-амином N-концевой аминокислоты, с алифатической аминогруппой на боковой цепи аминокислоты Q (например, боковой цепи лизина), с ароматической аминогруппой на боковой цепи аминокислоты Q (например, аминофенилаланина аминонафтилаланина, аминотриптофана, аминофенилглицина, аминогомофенилаланина). Репрезентативными положениями, в которых часть A-B связана с алифатической аминогруппой на боковой цепи аминокислоты Q, являются положения 12, 16, 17, 18, 20, 28 или 29 нативного глюкагона (SEQ ID NO: 701). Репрезентативными положениями, в которых часть A-B связана с ароматической аминогруппой на боковой цепи аминокислоты Q, являются положения 10, 13, 22 или 25 нативного глюкагона (SEQ ID NO: 701). В некоторых вариантах изобретения, дипептидный элемент пролекарства согласно изобретению конъюгирован с любой из последовательностей SEQ ID NN: 1-564, 566-570, 573-575, 577, 579-580, 585-612, 616, 618-632, 634-642, 647, 657-684, 701-732, 742-768, 801-878, 883-919, 1001-1262, 1301-1371, 1401-1518, 1701-1708, 1710, 1711, 1731-1734, 1738, 1740, 1741, 1745 и 1747-1776. Так, например, дипептидный элемент пролекарства может быть конъюгирован с любой одним из SEQ ID NN: 742-768.
В некоторых репрезентативных вариантах изобретения, Aib-Gly(N-гексил), dLys-Gly(N-гексил), dCys-Gly(N-гексил), dAla-Gly(N-гексил), Aib-Gly(N-метил), dLys-Gly(N-метил), dCys-Gly(N-метил), dAla-Gly(N-гексил), Aib-Phe(N-метил), dLys-Phe(N-метил), dCys-Phe(N-метил) или dAla-Phe(N-метил) конъюгирован с N-концевой альфа-аминогруппой любой из последовательностей SEQ ID NN: 742-745, 748-770, представленных SEQ ID NN: 769-794 и перечисленных в нижеследующей таблице.
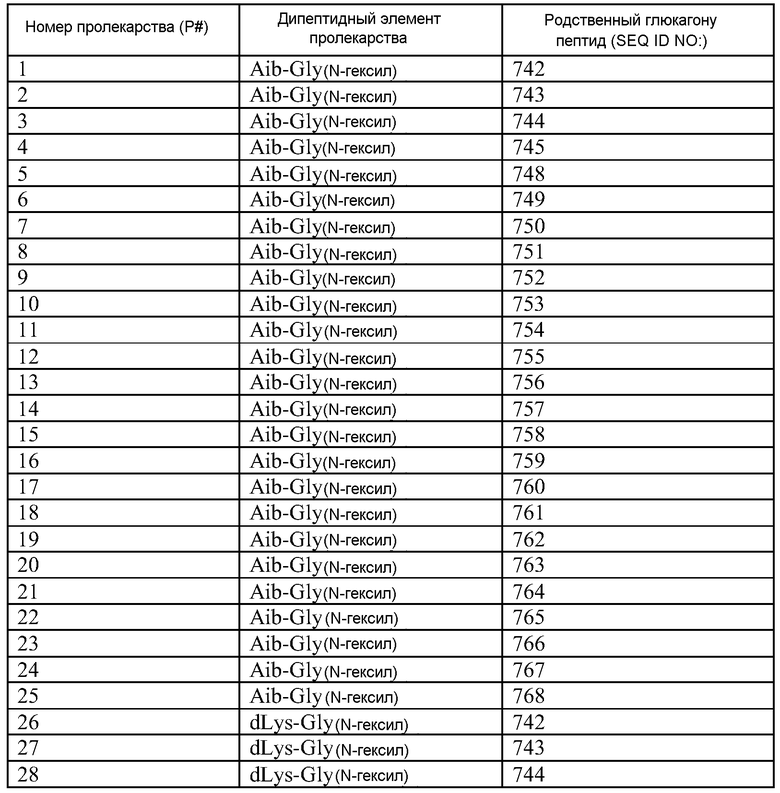

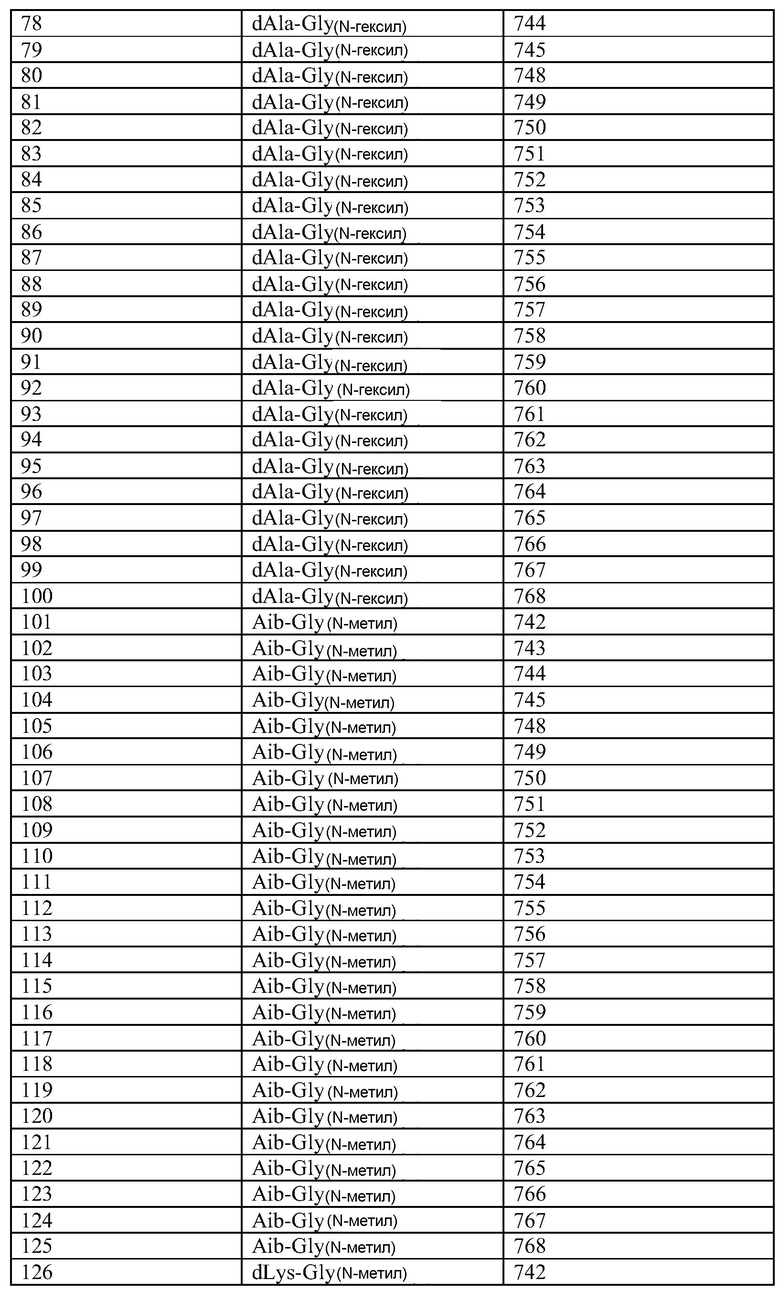
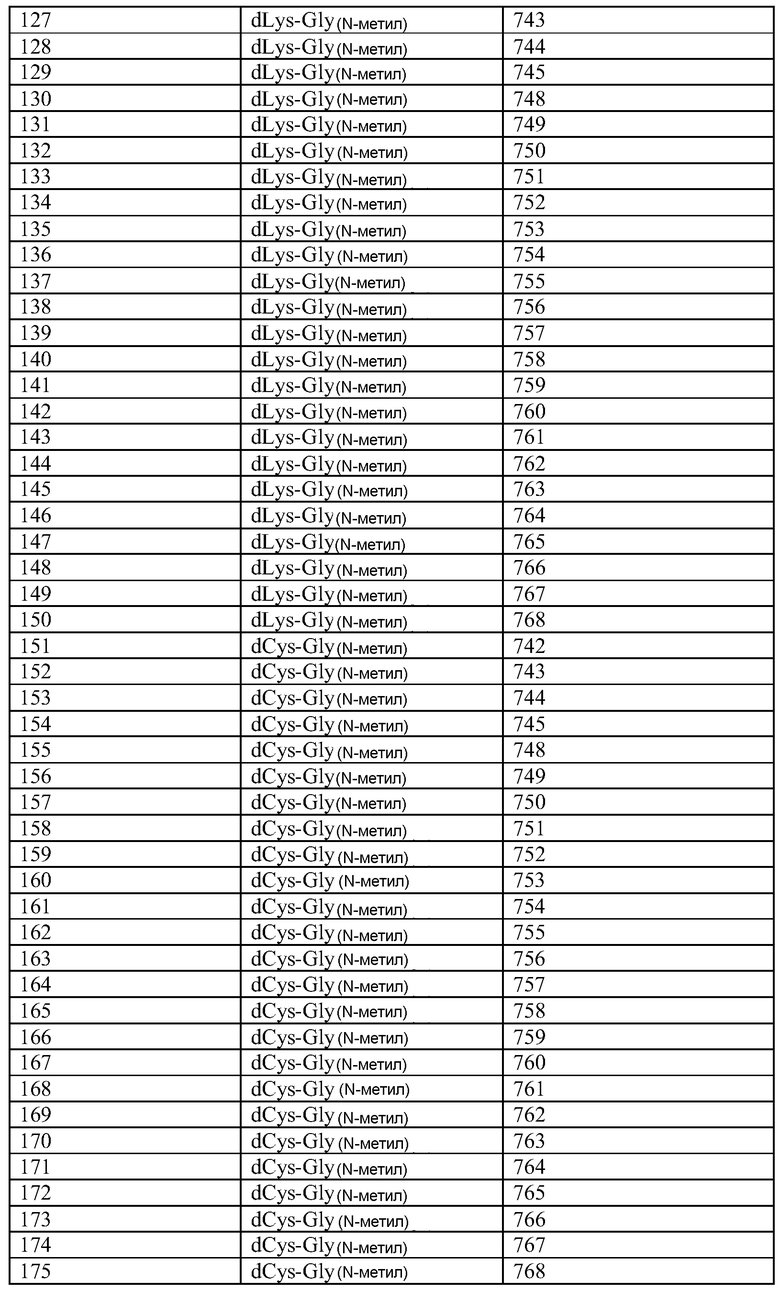
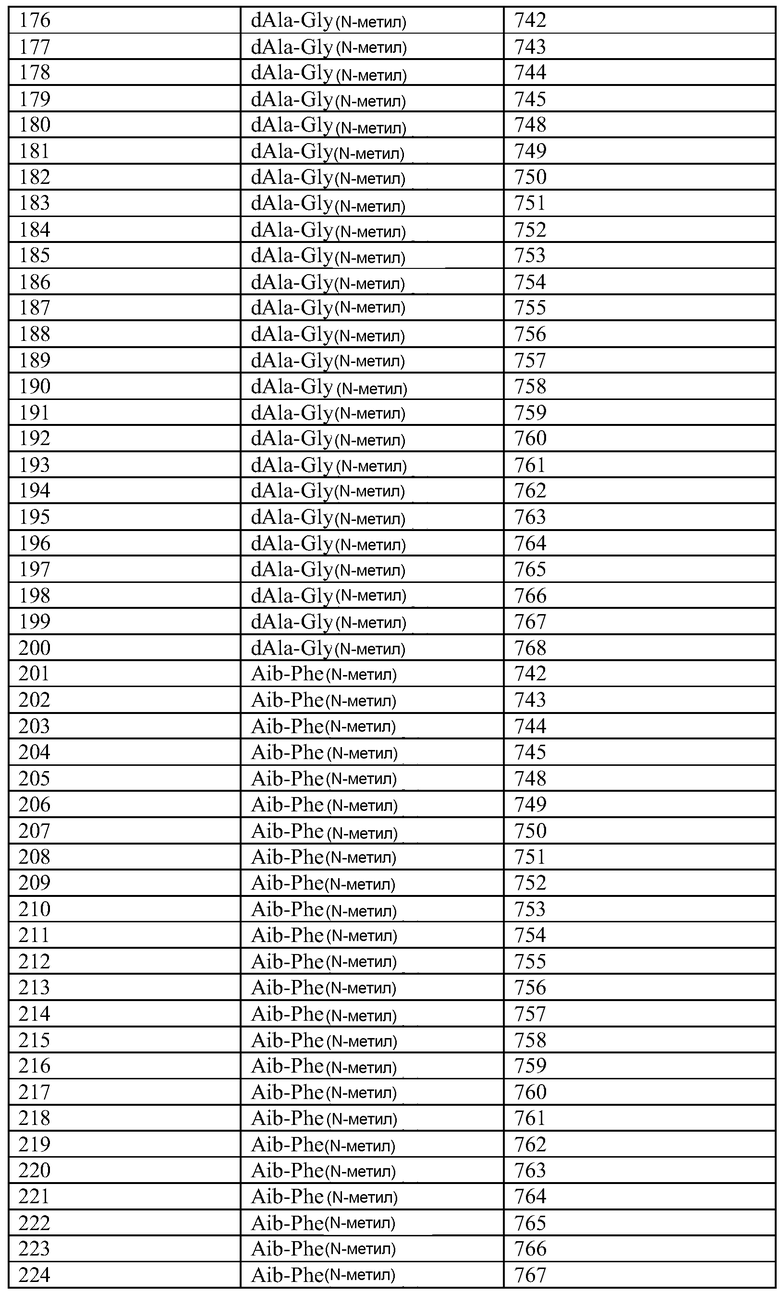
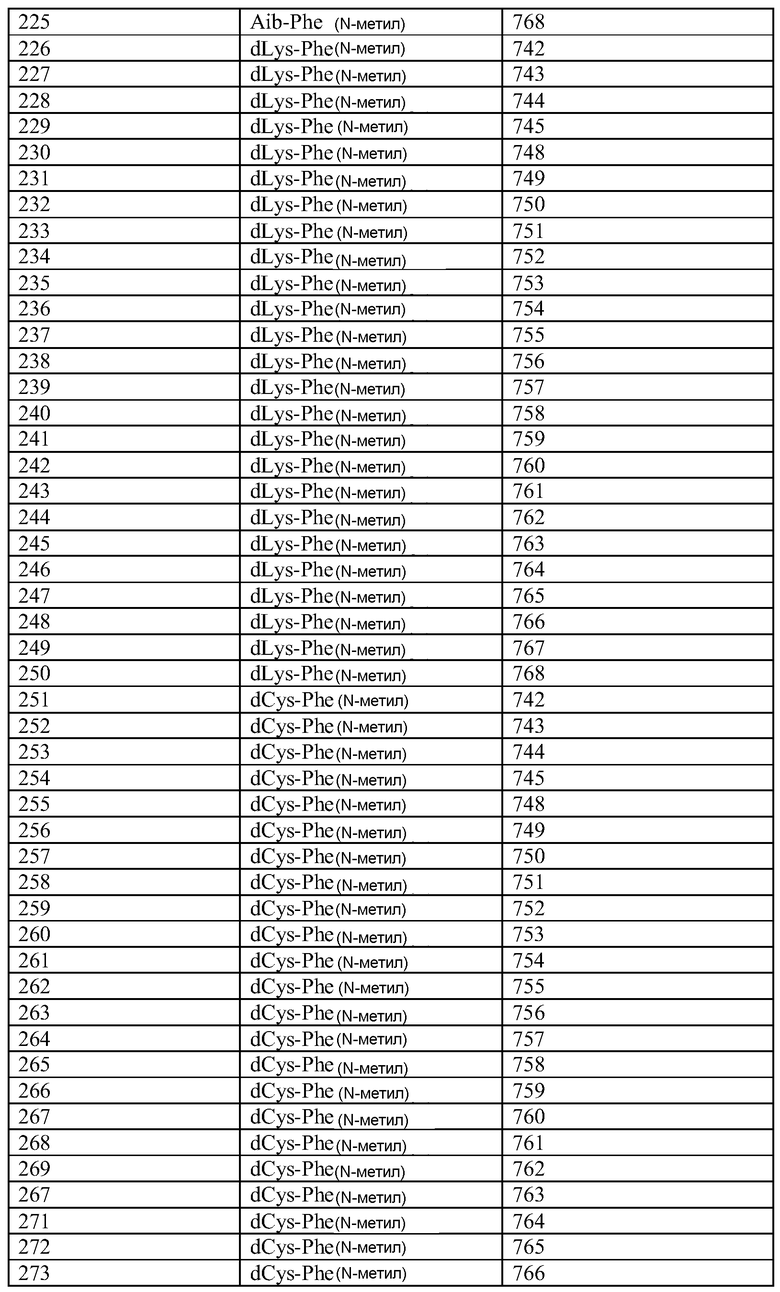
Способы применения
Пептиды, принадлежащие к суперсемейству глюкагонов
В общих чертах, пролекарства, содержащие пептид, принадлежащий к суперсемейству глюкагонов, или родственный глюкагону пептид, такой как пептид класса 1, 2, 3, 4 или 5, могут быть использованы в тех же целях, в которых используются пептиды, принадлежащие к суперсемейству глюкагонов и родственные глюкагону пептиды (подробное описание см., например, выше). Так, например, очевидно, что описанные биологически активные аналоги пептида-пролекарства могут быть использованы в тех же целях, в которых используется описанный ранее соответствующий родительский биологически активный пептид. В соответствии с этим, описанные здесь пролекарственные аналоги родственного глюкагону пептида могут быть использованы для лечения гипогликемии, гипергликемии, диабета или других метаболических расстройств, вызываемых высокими/низкими уровнями глюкагона в крови или высокими/низкими уровнями глюкозы в крови. В соответствии с некоторыми вариантами изобретения, пациентом, который может быть подвергнут лечению с использованием описанного здесь пролекарства, является домашнее животное, а в другом варианте изобретения, указанным пациентом, подвергаемым указанному лечению является человек.
В некоторых вариантах изобретения, пролекарства используют для снижения или подавления аппетита, уменьшения потребления пищи, снижения массы тела или поддержания массы тела на определенном уровне. Предполагается, что такие методы снижения аппетита или стимуляции снижения массы тела могут быть применены для снижения массы тела, предупреждения увеличения массы тела или лечения ожирения различной этиологии, включая ожирение, вызываемое лекарственными средствами, а также для снижения вероятности развития осложнений, ассоциированных с ожирением, включая сосудистые заболевания (ишемическую болезнь сердца, инсульт, заболевание периферических сосудов, ишемическую реперфузию и т.п.), гипертензию, диабет типа II на ранней стадии, гиперлипидемию и скелетно-мышечные заболевания.
В других вариантах изобретения, пролекарства используют в комбинации с парентерально вводимыми питательными веществами для лечения госпитализированных пациентов, не страдающих диабетом, например, пациентов, которым получают парентеральное питание или общее парентеральное питание. Неограничивающими примерами являются пациенты, подвергающиеся хирургической операции; пациенты, находящиеся в коме; пациенты с заболеваниями пищеварительного тракта; или пациенты с нарушением функции желудочно-кишечного тракта (например, вызываемым хирургическим вмешательством, блокадой или нарушением всасывающей способности, болезнью Крона, язвенным колитом, обструкцией желудочно-кишечного тракта; свищами в области желудочно-кишечного тракта, острым панкреатитом, ишемией кишечника, обширной хирургической операцией в области желудочно-кишечного тракта, некоторыми врожденными пороками желудочно-кишечного тракта, длительной диареей или синдромом укороченной тонкой кишки, вызываемым хирургической операцией), пациенты, находящиеся в шоковом состоянии, и пациенты, проходящие курс лечения, который часто требует парентерального введения углеводов вместе с различными комбинациями липидов, электролитов, микроэлементов, витаминов и аминокислот. Пролекарство на основе пептида, принадлежащего к суперсемейству глюкагонов, и питательный состав для парентерального введения могут быть введены одновременно, в различные периоды времени, в различной последовательности их введения, при условии, что пролекарство на основе пептида, принадлежащего к суперсемейству глюкагонов, будет давать нужный биологически эффект в тот период времени, в который усваивается данная парентеральная питательная композиция. Так, например, парентеральное питание может быть введено 1, 2 или 3 раза в день, а пролекарство на основе пептида, принадлежащего к суперсемейству глюкагонов, может быть введено через день, три раза в неделю, два раза в неделю, раз в неделю, через каждые 2 недели, через каждые 3 недели или раз в месяц.
Метаболический синдром, также известный как метаболический синдром X, синдром инсулинорезистентности или синдром Ривена, представляет собой расстройство, которым страдают свыше 50 миллионов американцев. Метаболический синдром обычно характеризуется совокупностью по меньшей мере трех или более нижеследующих факторов риска, таких как: (1) ожирение в области брюшины (избыток жировой ткани в брюшной полости и вокруг нее), (2) атерогенная дислипидемия (расстройства, ассоциированные с накоплением жира в крови, включая высокие уровни триглицеридов, низкие уровни холестерина ЛВП и высокие уровни холестерина ЛНП, которые усиливают рост бляшек на стенках артерий), (3) повышение кровяного давления, (4) инсулинорезистентность или непереносимость глюкозы, (5) протромбиновый статус (например, высокий уровень фибриногена или ингибитора активатора плазминогена-1 в крови) и (6) провоспалительное состояние (например, повышение уровня C-реактивного белка в крови). Другими факторами риска могут быть старение, гормональный дисбаланс и генетическая предрасположенность.
Метаболический синдром ассоциируется с повышенным риском развития ишемической болезни сердца и других расстройств, связанных с образованием сосудистых бляшек, таких как инсульт и заболевание периферических сосудов, называемое атеросклеротическим сердечно-сосудистым заболеванием (АССЗ). У пациентов с метаболическим синдромом может прогрессировать инсулинорезистентность на ранней стадии, переходящая в позднюю стадию диабета типа II с возрастающим риском АССЗ. Не претендуя на какую-либо конкретную теорию, авторы лишь отмечают, что взаимосвязь между инсулинорезистентностью, метаболическим синдромом и сосудистым заболеванием может одновременно запускать один или несколько механизмов патогенеза, включая нарушение инсулин-стимулированной вазодилатации; ассоциированное с инсулинорезистентностью снижение усвоения NO, обусловленное повышенным окислительным стрессом; и аномальные уровни гормонов, вырабатываемых адипоцитами, таких как адипонектин (Lteif и Mather, Can. J. Cardiol. 20 (suppl. B):66B-76B (2004)).
В соответствии с результатами, полученными в 2001 году Рабочей группой экспертов, проводивших клинические исследования в рамках Национальной Образовательной Программы по холестерину в целях создания рекомендаций по лечению взрослых (National Cholesterol Education Program) Adult Treatment Panel (ATP III), критериям метаболического синдрома удовлетворяет наличие у одного и того же индивидуума любого из трех нижеследующих признаков, таких как: (а) ожирение в области брюшины (окружность талии выше 102 см у мужчин и выше 88 см у женщин); (b) уровень триглицеридов в сыворотке (150 мг/дл или выше); (c) холестерин ЛВП (40 мг/дл или ниже у мужчин и 50 мг/дл или ниже у женщин); (d) кровяное давление (130/85 или более); и (e) уровень глюкозы в крови натощак (110 мг/дл или выше). Согласно данным Всемирной организации здравоохранения (ВОЗ), критерием наличия метаболического синдрома у индивидуума, имеющего высокие уровни инсулина в крови (повышенный уровень глюкозы в крови натощак или повышенный уровень глюкозы после одного приема пищи), является также наличие по меньшей мере двух из нижеследующих признаков, таких как: (a) ожирение в области брюшины (отношение окружности талии к окружности бедер выше 0,9, индекс массы тела по меньшей мере 30 кг/м2, или размер талии выше 37 дюймов); (b) панель показаний холестерина, указывающая на уровень триглицерида в крови по меньшей мере 150 мг/дл или холестерин ЛВП ниже 35 мг/дл; (c) кровяное давление 140/90 или выше или давление, установившееся на указанном уровне после проведения мер по его снижению (Mathur, Ruchi, "Metabolic Syndrome," ed. Shiel, Jr., William C, MedicineNet.com, May 11, 2009).
В соответствии с этим, если у индивидуума имеется любой из двух признаков или оба признака, удовлетворяющие критерию наличия метаболического синдрома, установленному в 2001 году Рабочей группой по лечению взрослых в рамках Национальной Образовательной Программы по холестерину или специалистами ВОЗ то считается, что данный индивидуум страдает метаболическим синдромом.
Не претендуя на какую-либо конкретную теорию, авторы лишь отмечают, что описанные здесь пептиды глюкагона могут быть использованы для лечения метаболического синдрома. В соответствии с этим, настоящее изобретение относится к способу предупреждения или лечения метаболического синдрома или устранения одного, двух, трех или более факторов риска развития метаболического синдрома у индивидуума, где указанный способ включает введение указанному индивидууму описанного здесь пептида глюкагона в количестве, которое является эффективным для предупреждения или лечения метаболического синдрома или устранения фактора риска развития такого синдрома.
Заболевание, называемое «жирная печень неалкогольного происхождения» (NAFLD), относится к широкому спектру заболеваний печени, начиная от простой формой «жирной печени» (стеатоза), до неалкогольного стеатогепатита (NASH) и до цирроза (необратимые, застарелые рубцы в печени). Все указанные стадии NAFLD имеют один общий признак, а именно накопление жира (жировая инфильтрация) в клетках печени (гепатоцитах). Простая форма заболевания «жирная печень» ассоциируется с аномальным накоплением жира определенного типа, триглицеридов, в клетках печени без воспаления или рубцевания. В случае NASH, накопление жира ассоциируется с воспалениями различной степени (гепатит) и рубцеванием (фиброз) печени. Воспалительные клетки могут разрушать клетки печени (гепатоцеллюлярный некроз). В терминах «стеатогепатит» и «стеатонекроз», steato означают инфильтрацию жира, гепатит означает воспаление печени, а некроз означает разрушение клеток печени. NASH может в конечном счете приводить к рубцеванию печени (фиброзу) с последующими необратимым застарелым рубцеванием (циррозом). Цирроз, который вызывается NASH, представляет собой последнюю и самую тяжелую стадию заболевания спектра NAFLD. (Mendler, Michel, "Fatty Liver: Nonalcoholic Fatty Liver Disease (NAFLD) and Nonalcoholic Steatohepatitis (NASH)," ed. Schoenfield, Leslie J., MedicineNet.com, August 29, 2005).
Алкогольное поражение печени или индуцированное алкоголем поражение печени включает три патологических отличительных признака болезни печени, ассоциированных с избыточным потреблением алкоголя или вызываемых избыточным потреблением алкоголя: жирная печень (стеатоз), хронический или острый гепатит и цирроз. Алкогольный гепатит может варьироваться от слабой формы гепатита с аномальными результатами лабораторных тестов, указывающих лишь на наличие заболевания, до тяжелой дисфункции печени, сопровождающейся осложнениями, такими как желтуха (пожелтение кожи, вызываемое длительным присутствием билирубина в крови), печеночная энцефалопатия (неврологическая дисфункция, вызываемая печеночной недостаточностью), асциты (накопление жидкости в брюшной полости), варикозное расширение вен пищевода, сопровождающееся кровоточивостью (варикозные вены в пищеводе), нарушение свертываемости крови и кома. Гистологически, характерными признаками алкогольного гепатита являются баллонирующая дегенерация гепатоцитов, воспаление, вызываемое нейтрофилами, а иногда тельцами Мэллори (аномальная агрегация промежуточных филаментных белков клеток). Анатомически, цирроз характеризуется образованием обширных узлов в печени в комбинации с фиброзом. (Worman, Howard J., "Alcoholic Liver Disease", Columbia University Medical Center website).
Не претендуя на какую-либо конкретную теорию, авторы лишь отмечают, что описанные здесь родственные глюкагону пептиды класса 2 и класса 3 могут быть использованы для лечения алкогольного поражения печени, NAFLD или любой его стадии, включая, например, стеатоз, стеатогепатит, гепатит, воспаление печени, NASH, цирроз или их осложнения. В соответствии с этим, настоящее изобретение относится к способу предупреждения или лечения алкогольного поражения печени, NAFLD или любой его стадии у индивидуума, где указанный способ включает введение индивидууму описанного здесь пептида глюкагона класса 2 или класса 3 в количестве, эффективном для предупреждения или лечения алкогольного поражения печени, NAFLD или любой его стадии. Такими способами лечения являются устранение одного, двух, трех или более нижеследующих признаков, таких как: содержание жира в печени, развитие или прогрессирование цирроза, развитие гепатоцеллюлярной карциномы, признаки воспаления, например, аномальные уровни печеночных ферментов (например, аспартат-аминотрансферазы AST и/или аланин-аминотрансферазы ALT или LDH), повышенный уровень ферритина в сыворотке, повышенный уровень билирубина в сыворотке и/или признаки фиброза, например, повышенные уровни TGF-бета. В предпочтительных вариантах изобретения, пептиды глюкагона класса 2 или класса 3 используют для лечения пациентов, у которых наблюдается прогрессирование простой формы заболевания «жирная печень» (стеатоз) и имеются признаки воспаления или гепатита. Указанные способы позволяют, например, снижать уровни AST и/или ALT.
Было показано, что GLP-1 и экзендин-4 обладают некоторым нейропротективным действием. Настоящее изобретение также относится к применению пептидов, принадлежащих к суперсемейству глюкагонов, для лечения нейродегенеративных заболеваний, включая, но не ограничиваются ими, болезнь Альцгеймера, болезнь Паркинсона, рассеянный склероз, амилотрофический боковой склероз, другие расстройства, ассоциированные с демиелинизацией, сенильную деменцию, подкорковую деменцию, артериосклеротическую деменцию, деменцию, ассоциированную со СПИД'ом или деменцию других типов; рак центральной нервной системы, травматическое поражение головного мозга, поражение спинного мозга, инсульт или ишемию головного мозга, васкулиты головного мозга, эпилепсию, болезнь Гентингтона, синдром Туретта, синдром Гийена-Барре, болезнь Вильсона, болезнь Пика, нейровоспалительные расстройства, энцефалит, энцефаломиелит, или менингит вирусного, грибкового или бактериального происхождения, или другие инфекционные заболевания центральной нервной системы, заболевания, вызываемые прионами, атаксию мозжечка, дегенерацию мозжечка, синдромы дегенерации спинного мозга и мозжечка, атаксию Фридриха, атаксию-телеангиэктазию, дисмиотрофию спинного мозга, прогрессирующий надъядерный паралич, дистонию, мышечные спазмы, тремор, пигментозный ретинит, дегенерацию черного и полосатого тела, митохондриальные энцефаломиопатии, нейронный восковидный липофусциноз, печеночные энцефалопатии, почечные энцефалопатии, метаболические энцефалопатии, энцефалопатии, вызываемые токсинами, и повреждение головного мозга, вызываемое облучением.
В соответствии с этим, настоящее изобретение относится к способу предупреждения или лечения нейродегенеративных заболеваний или устранения одного, двух, трех или более факторов риска развития таких заболеваний у индивидуума, где указанный способ включает введение указанному индивидууму описанного здесь пептида глюкагона в количестве, которое является эффективным для предупреждения или лечения нейродегенеративного заболевания или устранения фактора риска развития такого заболевания.
Способ лечения согласно изобретению включает стадии введения описанных здесь пролекарств пациенту любым стандартным способом введения, включая парентеральное введение, такое как внутривенное, внутрибрюшинное, подкожное или внутримышечное, интратекальное, чрескожное, ректальное, пероральное, интраназальное введение или введение путем ингаляции. В некоторых вариантах изобретения, композицию вводят подкожно или внутримышечно, необязательно, в виде депо-препарата или как часть композиции пролонгированного высвобождения.
Композиции и комбинации
Пролекарства согласно изобретению могут быть введены отдельно или в комбинации со вторым агентом, таким как антидиабетические средства и средства против ожирения. В некоторых вариантах изобретения, пролекарство вводят в комбинации со вторым пролекарством или членом суперсемейства глюкагонов, включая, например, родственный глюкагону пептид. В некоторых вариантах изобретения, пролекарство вводят в комбинации с антидиабетическим средством, включая, но не ограничиваясь ими, инсулин, сульфонилмочевины, такие как толбутамид (Orinase), ацетогексамид (Dymelor), толазамид (Tolinase), хлорпропамид (Diabinese), глипизид (Glucotrol), глибурид (Diabeta, Micronase, Glynase), глимепирид (Amaryl), или гликлазид (Diamicron); меглитиниды, такие как репаглинид (Prandin) или натеглинид (Starlix); бигуаниды, такие как метформин (Glucophage) или фенформин; тиазолидиндионы, такие как розиглитазон (Avandia), пиоглитазон (Actos) или троглитазон (Rezulin), или другие ингибиторы PPARγ; ингибиторы альфа-глюкозидазы, которые ингибируют расщепление углеводов, такие как миглитол (Glyset), акарбоза (Precose/Glucobay); экзенатид (Byetta) или прамлинтид; ингибиторы дипептидил-пептидазы 4 (DPP-4), такие как вилдаглиптин или ситаглиптин; ингибиторы SGLT (натрийзависимого агента, ответственного за транспорт глюкозы 1); или ингибиторы ФБФазы (фруктозо-1,6-бисфосфатазы).
Средствами против ожирения, известными специалистам или находящимися на стадии разработки, являются, но не ограничиваются ими, средства, подавляющие аппетит, включая стимуляторы типа фенэтиламина, фентермин (необязательно вместе с фенфлурамином или дексфенфлурамином), диэтилпропион (Tenuate®), фендиметразин (Prelu-2®, Bontril®), бензфетамин (Didrex®), сибутрамин (Meridia®, Reductil®); римонабант (Acomplia®), другие антагонисты каннабиноидных рецепторов; оксинтомодулин; гидрохлорид флуоксетина (Prozac); Qnexa (топирамат и фентермин), Excalia (бупропион и зонизамид) или Contrave (бупропион и налтрексон); или ингибиторы липазы, аналогичные ксеникалу (Orlistat) или цетилистату (также известному как ATL-962), или GT 389-255.
Пролекарства согласно изобретению могут быть также введены пациентам, страдающим катаболическим истощением. Было установлено, что половина пациентов с раком страдает ассоциированным с катаболизмом истощением, которое характеризуется самопроизвольной и прогрессирующей потерей массы тела, слабостью и низким уровнем жиров в организме и в мышцах. Этот синдром обычно наблюдается у пациентов со СПИД'ом, и может также наблюдаться при бактериальных и паразитарных инфекциях, при ревматоидном артрите и при хронических заболеваниях кишечника, печени, легких и сердца. Этот синдром обычно ассоциируется с анорексией и может проявляться как патологическое состояние, вызываемое старением или физическими травмами. Катаболическое истощение представляет собой симптом, который снижает качество жизни, ухудшает состояние здоровья и является главной причиной летального исхода.
Фармацевтические композиции, содержащие описанные здесь пролекарства, могут быть приготовлены с использованием стандартных фармацевтически приемлемых носителей и введены пациентам известными способами. В соответствии с этим, настоящее изобретение также охватывает фармацевтические композиции, содержащие один или несколько описанных здесь пролекарств или их фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым носителем. В некоторых вариантах изобретения, фармацевтическая композиция содержит пролекарство в концентрации 1 мг/мл при рН примерно 4,0-7,0 в фосфатно-буферной системе. Фармацевтические композиции могут содержать пролекарство в виде одного фармацевтически активного компонента, либо такие пролекарства могут быть объединены с одним или несколькими дополнительными активными агентами. В соответствии с некоторыми своими вариантами, настоящее изобретение относится к композиции, содержащей пролекарство согласно изобретению. Альтернативно, может быть получена композиция для индуцирования снижения массы тела или предупреждения увеличения массы тела, где указанная композиция содержит пролекарство и пептид против ожирения. Подходящими пептидами против ожирения являются пептиды, описанные в патентах США 5691309, 6436435 или в заявке на патент США 20050176643.
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к фармацевтической композиции, содержащей любое из описанных здесь новых пролекарств, предпочтительно, стерильных и, предпочтительно, имеющих чистоту по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, и фармацевтически приемлемый разбавитель, носитель или наполнитель. Такие композиции могут содержать описанное здесь производное пролекарства, включающее биологически активный пептид, где указанный активный пептид присутствует в концентрации, составляющей по меньшей 0,5 мг/мл, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 11 мг/мл, 12 мг/мл, 13 мг/мл, 14 мг/мл, 15 мг/мл, 16 мг/мл, 17 мг/мл, 18 мг/мл, 19 мг/мл, 20 мг/мл, 21 мг/мл, 22 мг/мл, 23 мг/мл, 24 мг/мл, 25 мг/мл или выше. Такие композиции могут содержать описанное здесь производное пролекарства, включающее биологически активный пептид класса 1, 2 или 3, где указанный активный пептид присутствует в концентрации, составляющей по меньшей концентрацию «А», где концентрация А составляет 0,001 мг/мл, 0,01 мг/мл, 0,1 мг/мл, 0,5 мг/мл, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 11 мг/мл, 12 мг/мл, 13 мг/мл, 14 мг/мл, 15 мг/мл, 16 мг/мл, 17 мг/мл, 18 мг/мл, 19 мг/мл, 20 мг/мл, 21 мг/мл, 22 мг/мл, 23 мг/мл, 24 мг/мл, 25 мг/мл или выше. В других вариантах изобретения, такие композиции могут содержать активный пептид класса 1, 2 или 3 в концентрации максимум «В», где В составляет 30 мг/мл, 25 мг/мл, 24 мг/мл, 23, мг/мл, 22 мг/мл, 21 мг/мл, 20 мг/мл, 19 мг/мл, 18 мг/мл, 17 мг/мл, 16 мг/мл, 15 мг/мл, 14 мг/мл, 13 мг/мл, 12 мг/мл, 11 мг/мл, 10 мг/мл, 9 мг/мл, 8 мг/мл, 7 мг/мл, 6 мг/мл, 5 мг/мл, 4 мг/мл, 3 мг/мл, 2 мг/мл, 1 мг/мл или 0,1 мг/мл. В некоторых вариантах изобретения, указанные композиции могут содержать родственный глюкагону пептид класса 1, 2 или 3 в концентрации A-B мг/мл, например, 0,001-30,0 мг/мл. В некоторых вариантах изобретения, фармацевтические композиции содержат водные растворы, которые являются стерилизованными, и которые могут храниться, но необязательно, в различных контейнерах. Соединения согласно изобретению могут быть использованы в соответствии с некоторыми вариантами изобретения для предварительного приготовления готовых растворов для инъекции. В других вариантах изобретения, фармацевтические композиции содержат лиофилизованный порошок. Фармацевтические композиции могут быть также упакованы как часть набора, включающего одноразовое устройство для введения композиции пациенту. Контейнеры или наборы могут быть помечены и положены на хранение при комнатной температуре или в холодильник.
При этом, предусматривается, что во всех описанных здесь терапевтических способах, в фармацевтических композициях, наборах и во всех аналогичных вариантах осуществления изобретения, пролекарственные соединения включают все фармацевтически приемлемые соли таких соединений.
В некоторых своих вариантах, настоящее изобретение относится в набору, снабженному устройством для введения пролекарственной композиции пациенту. Указанный набор может также включать ряд контейнеров, например, сосуды, пробирки, бутыли и т.п. Предпочтительно, такие наборы также включают инструкции по их применению. В соответствии с некоторыми вариантами изобретения, устройством, входящим в набор, является устройство для аэрозольного распыления, в которое была предварительно введена указанная композиция. В другом варианте изобретения, указанный набор содержит шприц и иглу, а в некоторых вариантах изобретения, пролекарственная композиция была предварительно введена в шприц.
Фармацевтические препараты родственных глюкагону пептидов класса 1, 2 и 3
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к фармацевтической композиции, где указанная композиция включает описанный здесь пептид глюкагона или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Фармацевтическая композиция может содержать любой фармацевтически приемлемый ингредиент, включая, например, подкисляющие агенты, добавки, адсорбенты, аэрозольные пропелленты, воздухоотталкивающие средства, подщелачивающие агенты, антиагломерирующие агенты, антикоагулянты, противомикробные консерванты, антиоксиданты, антисептики, основы, связующие вещества, забуферивающие агенты, хелатообразующие агенты, агенты для нанесения покрытий, окрашивающие агенты, обезвоживающие агенты, детергенты, разбавители, дезинфицирующие средства, дезинтеграторы, диспергирующие агенты, агенты, повышающие растворимость, красители, мягчители, эмульгаторы, стабилизаторы эмульсий, наполнители, пленкообразующие агенты, интенсификаторы вкуса и аромата, ароматизаторы, агенты, повышающие текучесть, гелеобразующие агенты, грануляторы, увлажнители, замасливатели, мукоадгезивы, основы для мазей, мази, маслянистые носители, органические основы, основы в форме пастилок, пигменты, пластификаторы, полирующие агенты, консерванты, секвестранты, агенты, усиливающие проницаемость через кожу, солюбилизирующие агенты, растворители, стабилизаторы, основы для суппозиториев, поверхностно-активные вещества, сурфактанты, суспендирующие агенты, подсластители, терапевтические средства, загустители, агенты, придающие тоничность, агенты, придающие токсичность, агенты, повышающие вязкость, агенты, поглощающие воду, смешивающиеся с водой сорастворители, мягчители воды или смачивающие агенты.
В некоторых вариантах изобретения, фармацевтическая композиция содержит любой компонент или комбинацию из таких компонентов, как: аравийская камедь, ацесульфам-калий, ацетилтрибутилцитрат, ацетилтриэтилцитрат, агар, альбумин, спирт, дегидратированный спирт, денатурированный спирт, разбавленный спирт, алейритовая кислота, альгиновая кислота, алифатические полиэфиры, окись алюминия, гидроксид алюминия, стеарат алюминия, амилопептин, α-амилоза, аскорбиновая кислота, аскорбилпальмитат, аспартам, бактериостатическая вода для инъекций, бентонит, бентонит-магма, хлорид бензалкония, хлорид бензэтония, бензойная кислота, бензиловый спирт, бензилбензоат, бромопол, бутилированный гидроксианизол, бутилированный гидрокситолуол, бутилпарабен, бутилпарабен-натрий, альгинат кальция, аскорбат кальция, карбонат кальция, цикламат кальция, двухосновный безводный фосфат кальция, двухосновный дегидрат-фосфат кальция, трехосновный фосфат кальция, пропионат кальция, силикат кальция, сорбат кальция, стеарат кальция, сульфат кальция, гемигидрат сульфата кальция, масло канолы, карбомер, диоксид углерода, кальций-содержащая карбоксиметилцеллюлоза, натрий-содержащая карбоксиметилцеллюлоза, β-каротин, каррагенан, касторовое масло, гидрогенизированное касторовое масло, катионный эмульгирующийся воск, ацетат целлюлозы, ацетат-фталат целлюлозы, этилцеллюлоза, микрокристаллическая целлюлоза, порошкообразная целлюлоза, кремний-содержащая микрокристаллическая целлюлоза, натрий-содержащая карбоксиметилцеллюлоза, цетостеариловый спирт, цетримид, цетиловый спирт, хлоргексидин, хлорбутанол, хлоркрезол, холестерин, ацетат хлоргексидина, глюконат хлоргексидина, гидрохлорид хлоргексидина, хлордифторэтан (HCFC), хлордифторметан, хлорфторуглерод (CFC), хлорфеноксиэтанол, хлорксиленол, твердый кукурузный сироп, безводная лимонная кислота, моногидрат лимонной кислоты, масло какао, окрашивающие агенты, кукурузное масло, масло из семян хлопчатника, крезол, м-крезол, o-крезол, п-крезол, натрий-содержащая кроскармелоза, кросповидон, цикламиновая кислота, циклодекстрины, декстраты, декстрин, декстроза, безводная декстроза, диазолидинилмочевина, дибутилфталат, дибутилсебакат, диэтаноламин, диэтилфталат, дифторэтан (HFC), диметил-β-циклодекстрин, соединения типа циклодекстрина, такие как Captisol®, диметиловый эфир, диметилфталат, дикалий-эдентат, динатрий-эдентат, дигидрофосфат натрия, докузат кальция, докузат калия, докузат натрия, додецилгаллат, бромид додецилтриметиламмония, диэдентат кальция-натрия, эдитиновая кислота, эглумин, этиловый спирт, этилцеллюлоза, этилгаллат, этиллаурат, этилмальтит, этилолеат, этилпарабен, этилпарабен-калий, этилпарабен-натрий, этилванилин, фруктоза, жидкая фруктоза, измельченная фруктоза, апирогенная фруктоза, порошкообразная фруктоза, фумаровая кислота, желатин, глюкоза, жидкая глюкоза, смеси глицеридов насыщенных растительных жирных кислот, глицерин, глицерилбегенат, глицерилмоноолеат, глицерилмоностеарат, самоэмульгирующийся глицерилмоностеарат, глицерилпальмитостеарат, глицин, гликоли, гликофурол, гуаровая камедь, гептофторпропан (HFC), бромид гексадецилтриметиламмония, сироп с высоким содержанием фруктозы, альбумин человеческой сыворотки, углеводороды (HC), разбавленная соляная кислота, гидрогенизированное растительное масло типа II, гидроксиэтилцеллюлоза, 2-гидроксиэтил-β-циклодекстрин, гидроксипропилцеллюлоза, слабозамещенная гидроксипропилцеллюлоза, 2-гидроксипропил-β-циклодекстрин, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы, имидомочевина, краситель индиго, краситель кармин, ионообменники, оксиды железа, изопропиловый спирт, изопропилмиристат, изопропилпальмитат, изотонический физиологический раствор, каолин, молочная кислота, лактит, лактоза, ланолин, ланолиновые спирты, безводный ланолин, лецитин, силикат магния-алюминия, карбонат магния, нормальный карбонат магния, безводный карбонат магния, гидроксид карбоната магния, лаурилсульфат магния, оксид магния, силикат магния, стеарат магния, трисиликат магния, безводный трисиликат магния, яблочная кислота, солод, мальтит, раствор мальтита, мальтодекстрин, мальтит, мальтоза, маннит, триглицериды со средней длиной цепи, меглумин, ментол, метилцеллюлоза, метилметакрилат, метилолеат, метилпарабен, метилпарабен-калий, метилпарабен-натрий, микрокристаллическая целлюлоза и натрий-содержащая карбоксиметилцеллюлоза, минеральное масло, летучее минеральное масло, минеральное масло и ланолиновые спирты, масло, оливковое масло, моноэтаноламин, монтмориллонит, октилгаллат, олеиновая кислота, пальмитиновая кислота, парафин, арахисовое масло, вазелин, вазелин и ланолиновые спирты, фармацевтически приемлемая глазурь, фенол, сжиженный фенол, феноксиэтанол, феноксипропанол, фенилэтиловый спирт, ацетат фенилртути, борат фенилртути, нитрат фенилртути, полакрилин, полакрилин-калий, полоксамер, полидекстроза, полиэтиленгликоль, полиэтиленоксид, полиакрилаты, блок-сополимеры полиэтилена-полиоксипропилена, полиметакрилаты, алкиловые эфиры полиоксиэтилена, производные полиоксиэтиленового касторового масла, полиоксиэтиленовые сложные эфиры сорбита и жирной кислоты, полиоксиэтиленстеараты, поливиниловый спирт, поливинилпирролидон, альгинат калия, бензоат калия, бикарбонат калия, бисульфит калия, хлорид калия, цитрат калия, безводный цитрат калия, гидрофосфат калия, метабисульфит калия, одноосновный фосфат калия, пропионат калия, сорбат калия, повидон, пропанол, пропионовая кислота, пропиленкарбонат, пропиленгликоль, альгинат пропиленгликоля, пропилгаллат, пропилпарабен, пропилпарабен-калий, пропилпарабен-натрий, сульфат протамина, рапсовое масло, раствор Рингера, сахарин, аммоний-содержащий сахарин, кальций-содержащий сахарин, натрий-содержащий сахарин, сафлоровое масло, сапонит, сывороточные белки, кунжутное масло, коллоидальная двуокись кремния, коллоидальный диоксид кремния, альгинат натрия, аскорбат натрия, бензоат натрия, бикарбонат натрия, бисульфит натрия, хлорид натрия, безводный цитрат натрия, дегидрат цитрата натрия, хлорид натрия, цикламат натрия, эдентат натрия, додецилсульфат натрия, лаурилсульфат натрия, метабисульфит натрия, фосфат натрия, двухосновный фосфат натрия, одноосновный фосфат натрия, фосфат натрия, трехосновный безводный пропионат натрия, пропионат натрия, сорбат натрия, натрий-содержащий гликолят крахмала, стеарилфумарат натрия, сульфит натрия, сорбиновая кислота, сложные эфиры сорбитана (сложные эфиры сорбитана и жирной кислоты), сорбит, 70% раствор сорбита, соевое масло, воск, полученный из спермацетов, крахмал, кукурузный крахмал, картофельный крахмал, крахмал, набухающий в холодной воде, стерилизованный кукурузный крахмал, стеариновая кислота, очищенная стеариновая кислота, стеариловый спирт, сахароза, сахара, спрессованный сахар, кондитерский сахар, гранулированный сахар, инвертированный сахар, сахар в таблетках (Sugartab), желтый краситель «солнечный закат» FCF, (синтетический пищевой краситель), синтетический парафин, тальк, винная кислота, тартразин, тетрафторэтан (HFC), необработанное масло какао, тимерозал, диоксид титана, альфа-токоферол, токоферилацетат, сукцинат альфа-токофериловой кислоты, бета-токоферол, дельта-токоферол, гамма-токоферол, трагакантовая камедь, триацетин, трибутилцитрат, триэтаноламин, триэтилцитрат, триметил-β-циклодекстрин, бромид триметилтетрадециламмония, буфер трис, тринатрийэдентат, ванилин, гидрогенизированное растительное масло типа I, вода, мягкая вода, жесткая вода, вода, не содержащая диоксида углерода, апирогенная вода, вода для инъекций, стерильная вода для ингаляций, стерильная вода для инъекций, стерильная вода для орошения, воски, анионный эмульгирующийся воск, воск карнаубы, катионный эмульгирующийся воск, воск на основе цетилового сложного эфира, микрокристаллический воск, неионный эмульгирующийся воск, воск для суппозиториев, белый воск, желтый воск, белое вазелиновое масло, жир, выделенный из шерсти, ксантановая камедь, ксилит, зеин, пропионат цинка, соли цинка, стеарат цинка или любой наполнитель, указанный в справочном руководстве Handbook of Pharmaceutical Excipients, Third Edition, A. H. Kibbe (Pharmaceutical Press, London, UK, 2000), содержание которого во всей своей полноте вводится в настоящее описание посредством ссылки. В руководстве Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980), содержание которого во всей своей полноте вводится в настоящее описание посредством ссылки, описаны различные компоненты, используемые в целях приготовления фармацевтически приемлемых композиций, и известные методы получения таких композиций. В фармацевтических композициях может быть использован любой стандартный агент, при условии, что он будет совместимым с данными фармацевтическими композициями. В указанные композиции могут быть также включены вспомогательные активные ингредиенты.
Описанные здесь фармацевтические препараты могут быть приготовлены так, чтобы они обладали кратковременным действием, быстрым действием, длительным действием или пролонгированным действием, как описано ниже. Могут быть также приготовлены фармацевтические композиции для немедленного высвобождения, для регулируемого высвобождения или для пролонгированного высвобождения. Композиции согласно изобретению могут также содержать, например, мицеллы или липосомы, либо они могут быть приготовлены в другой инкапсулированной форме, либо они могут быть введены в форме пролонгированного высвобождения, которая обеспечивает сохранность такой композиции в течение длительного периода времени и/или желаемый эффект доставки. Описанные фармацевтические композиции могут быть введены по любой схеме, включая, например, введение ежедневно (1 раз в день, 2 раза в день, 3 раза в день, 4 раза в день, 5 раз в день, 6 раз в день), каждые два дня, каждые три дня, каждые четыре дня, каждые пять дней, каждые шесть дней, каждую неделю, раз в две недели, раз в три недели, раз в месяц или раз в два месяца.
В некоторых вариантах изобретения, вышеописанный(ые) компонент(ы) может (могут) присутствовать в фармацевтической композиции в любой концентрации, такой как, например, по меньшей мере A, где А составляет 0,0001% масс/об, 0,001% масс/об, 0,01% масс/об, 0,1% масс/об, 1% масс/об, 2% масс/об, 5% масс/об, 10% масс/об, 20% масс/об, 30% масс/об, 40% масс/об, 50% масс/об, 60% масс/об, 70% масс/об, 80% масс/об или 90% масс/об. В некоторых вариантах изобретения, вышеописанный(ые) компонент(ы) может (могут) присутствовать в фармацевтической композиции в любой концентрации, такой как, например, максимум В, где В составляет 90% масс/об, 80% масс/об, 70% масс/об, 60% масс/об, 50% масс/об, 40% масс/об, 30% масс/об, 20% масс/об, 10% масс/об, 5% масс/об, 2% масс/об, 1% масс/об, 0,1% масс/об, 0,001% масс/об или 0,0001%. В некоторых вариантах изобретения, вышеописанный(ые) компонент(ы) может (могут) присутствовать в фармацевтической композиции в любом интервале концентраций, таком как, например, приблизительно от А до В. В некоторых вариантах изобретения, А составляет 0,0001%, а B составляет 90%.
Фармацевтические композиции могут быть приготовлены так, чтобы они имели физиологически совместимый рН. В некоторых вариантах изобретения, pH фармацевтической композиции может составлять по меньшей мере 5, по меньшей мере 5,5, по меньшей мере 6, по меньшей мере 6,5, по меньшей мере 7, по меньшей мере 7,5, по меньшей мере 8, по меньшей мере 8,5, по меньшей мере 9, по меньшей мере 9,5, по меньшей мере 10 или по меньшей мере 10,5 и до значения pH 11 включительно, в зависимости от способа приготовления и введения. В некоторых вариантах изобретения, фармацевтические композиции могут содержать забуферивающие агенты, подходящие для достижения физиологически совместимого рН. Забуферивающими агентами могут быть любые соединения, обладающие способностью к забуфериванию при нужном рН, такие как, например, фосфатные буферы (например, PBS), триэтаноламин, трис, бицин, TAPS, трицин, HEPES, TES, MOPS, PIPES, какодилат, MES и т.п. В некоторых вариантах изобретения, концентрация буфера составляет по меньшей мере 0,5 мМ, по меньшей мере 1 мМ, по меньшей мере 5 мМ, по меньшей мере 10 мМ, по меньшей мере 20 мМ, по меньшей мере 30 мМ, по меньшей мере 40 мМ, по меньшей мере 50 мМ, по меньшей мере 60 мМ, по меньшей мере 70 мМ, по меньшей мере 80 мМ, по меньшей мере 90 мМ, по меньшей мере 100 мМ, по меньшей мере 120 мМ, по меньшей мере 150 мМ или по меньшей мере 200 мМ. В некоторых вариантах изобретения, концентрация буфера составляет не более, чем 300 мМ (например, максимум 200 мМ, максимум 100 мМ, максимум 90 мМ, максимум 80 мМ, максимум 70 мМ, максимум 60 мМ, максимум 50 мМ, максимум 40 мМ, максимум 30 мМ, максимум 20 мМ, максимум 10 мМ, максимум 5 мМ, максимум 1 мМ).
Описанные здесь пролекарственные соединения могут быть получены стандартными методами синтеза, методами рекомбинантных ДНК или любыми другими методами получения пептидов и гибридных белков. Хотя некоторые неприродные аминокислоты не могут быть экспрессированы стандартными методами рекомбинантных ДНК, однако, методы их получения известны специалистам. Соединения согласно изобретению, которые включают непептидные части, могут быть синтезированы путем проведения, помимо стандартных химических реакций пептидного синтеза, также и стандартных химических реакций органического синтеза, если это возможно.
Примеры
Общий протокол ПЭГилирования: (Cys-малеимидо)
Обычно, родственный глюкагону пептид, содержащий Cys, растворяют в забуференном фосфатом физиологическом растворе (5-10 мг/мл) и добавляют 0,01 метилендиаминтетрауксусную кислоту (10-15% от общего объема). Затем добавляют избыток (2-кратный) малеимидо-метокси-ПЭГ-реагента (Dow), и реакционную смесь перемешивают при комнатной температуре, с одновременным мониторингом прохождения реакции с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Через 8-24 часа, реакционную смесь подкисляют и загружают на препаративную обращенно-фазовую колонку для очистки в градиенте 0,1% тетрафторуксусной кислоты (TFA)/ацетонитрила. Соответствующие фракции объединяют и лиофилизуют с получением нужных ПЭГилированных производных.
Пример 1
Определение полупериода отщепления дипептида (в PBS) на пептиде-модели
Гексапептид-модель (HSRGTF-NH2; SEQ ID NO:715) использовали в качестве модели для определения времени полужизни различных дипептидов, связанных с гексапептидом посредством амидной связи. Сборку гексапептида осуществляли на пептидном синтезаторе. Для подтверждения завершения синтеза и наличия удлиняемого N-конца, связанную с пептидом смолу отщепляли фтористоводородной кислотой (HF) и анализировали. Затем Boc-защищенный саркозин и лизин последовательно присоединяли к связанной с пептидом смоле и получали пептид А (дипептид + пептид-модель). Пептид А отщепляли под действием HF и очищали с помощью препаративной ВЭЖХ.
Препаративная очистка с помощью ВЭЖХ:
Очистку осуществляли с помощью ВЭЖХ-анализа на 1×25 см-колонке с адсорбентом Vydac C18 на основе двуокиси кремния (размер частиц 5 мкм, размер пор 300 Å). Было использовано следующее оборудование: насос Waters Associates модели 600, инжектор модели 717 и УФ-детектор модели 486. Все образцы анализировали на длине волны 230 нм. Растворитель А содержал 10% CH3CN/0,1% TFA в дистиллированной воде, а растворитель B содержал 0,1% TFA в CH3CN. В данном случае использовали линейный градиент (0→100% B, 2 часа). Скорость потока составляла 10 мл/мин, а размер фракции составлял 4 мл. Приблизительно из 150 мг неочищенного пептида обычно получали 30 мг чистого пептида (примерно с 20%-ным выходом).
Пептид A растворяли в концентрации 1 мг/мл в буфере, таком как забуференный фосфатом физиологический раствор (PBS) (pH 7,4). Затем раствор инкубировали при 37°C на водяной бане. Через различные периоды времени брали аналитические образцы (через 5 часов, 8 часов, 24 часа, 31 час, 47 часов), а затем их активность нейтрализовали равными объемами 0,1% TFA. Мониторинг реакции расщепления осуществляли с помощью ВЭЖХ. Затем проводили качественный мониторинг данных с помощью жидкостной хроматографии-масс-спектрометрии (ЖХ-МС), и полученные результаты количественно анализировали с помощью компьютерной программы HPLC Peak Simple Chromatography с получением данных времени удерживания и относительные площади пика для модифицированного пролекарства.
Анализ с помощью масс-спектрометрии
Масс-спектры получали на квадрупольном масс-спектрометре с электрораспылением Sciex API-III, снабженном стандартным источником ионов для ионизации электрораспылением (ESI). Были использованы следующие условия ионизации: ESI в моде положительного иона; напряжение при ионном распылении, 3,9 кВ; напряжение, подаваемое на отверстие, 60 В. В качестве ионизирующего газа и газа-носителя использовали азот со скоростью потока 0,9 л/мин. Масс-спектры регистрировали в диапазоне 600-1800 единиц Томпсона (Th) с шагом 0,5 Th и с временем задержки 2 мсек. Образец (приблизительно 1 мг/мл) растворяли в 50% водном ацетонитриле с 1% уксусной кислотой и вводили через подсоединенный шприц-насос со скоростью 5 мкл/мин.
Если пептиды анализировали в растворе PBS с помощью ESI-МС, то их сначала обессоливали с использованием насадки для твердофазной экстракции ZipTip, содержащей 0,6 мкл C4-смолы в соответствии с инструкциями производителя (Millipore Corporation, Billerica, MA, см. http://www.millipore.com/catalogue.nsf/docs/C5737).
Анализ с использованием ВЭЖХ
ВЭЖХ-анализ осуществляли с использованием хроматографической системы Beckman System Gold, снабженной УФ-детектором на 214 нм и колонкой с C8 Vydac размером 150 мм × 4,6 мм. Скорость потока составляла 1 мл/мин. Растворитель A содержал 0,1% TFA в дистиллированной воде, а растворитель B содержал 0,1% TFA в 90% CH3CN. При этом использовали линейный градиент (0%→30% B, 10 минут). Собранные данные анализировали с помощью компьютерной программы Peak Simple Chromatography.
Начальные скорости отщепления использовали для измерения константы скорости диссоциации соответствующих пролекарств. Концентрации пролекарства и лекарственного средства оценивали по площади их пиков, «а» и «b», соответственно, для каждого конкретного времени сбора (см. таблицу 1). Константы скорости диссоциации первого порядка для пролекарств определяли путем построения кривой зависимости логарифма концентрации пролекарства от времени. По наклону этой кривой определяли константу скорости «k». Затем вычисляли полупериод расщепления различных пролекарств по формуле: t½=0,693/k.
ВЭЖХ- и ЖХ-МС-данные для отщепления пептида A
(lys-sar-HSRGTF-NH2) в PBS
Полупериод расщепления различных пролекарств вычисляли по формуле t½=0,693/k, а полупериод отщепления комбинации lys-sar, определенное с использованием модели пептида HSRGTF-NH2 (SEQ ID NO: 715), составляло 14,0 ч.
Пример 2
Определение полупериода отщепления дипептида (в плазме) на пептидной D-модели
Другую гексапептид-модель (dHdTdRGdTdF-NH2; SEQ ID NO: 716) использовали в качестве модели для определения полупериода отщепления комбинации дипептидов в плазме. D-аминокислоты использовали для предупреждения другого ферментативного отщепления пептида-модели, за исключением расщепления пролекарства. Гексапептид синтезировали на автоматическом синтезаторе. Для подтверждения того, что соответствующий удлиненный N-конец может быть использован для модификации пролекарства, связанную с пептидом смолу отщепляли фтористоводородной кислотой (HF), и пептид анализировали для идентификации. Затем Boc-защищенный саркозин и лизин последовательно присоединяли к связанной с пептидом смоле. Пептид В (дипептид + пептидная d-модель) отщепляли под действием HF и очищали с помощью препаративной ВЭЖХ.
Препаративная очистка с помощью ВЭЖХ:
Очистку осуществляли с помощью ВЭЖХ-анализа на 1×25 см-колонке с адсорбентом Vydac C18 на основе двуокиси кремния (размер частиц 5 мкм, размер пор 300 Å). Было использовано следующее оборудование: насос Waters Associates модели 600, инжектор модели 717 и УФ-детектор модели 486. Все образцы анализировали на длине волны 230 нм. Растворитель А содержал 10% CH3CN/0,1% TFA в дистиллированной воде, а растворитель B содержал 0,1% TFA в CH3CN. В данном случае использовали линейный градиент (0→100% B, 2 часа). Скорость потока составляла 10 мл/мин, а размер фракции составлял 4 мл. Приблизительно из 150 мг неочищенного пептида обычно получали 30 мг чистого пептида (примерно с 20%-ным выходом).
Пептид В растворяли в концентрации 2 мг/мл в плазме (pH 7,4). Затем раствор инкубировали при 37°C на водяной бане. Через различные периоды времени брали аналитические образцы (через 5 часов, 11 часов, 24 часа, 32 часа, 48 часов). Образцы обрабатывали 10-кратным объемом 0,1% TFA/ACN и центрифугировали при 3000 об/мин. Супернатант собирали и разводили равным объемом 0,1% TFA/H2O. Мониторинг реакции отщепления осуществляли с помощью ВЭЖХ. Затем проводили качественный мониторинг данных с помощью ЖХ-МС, и полученные результаты количественно анализировали с помощью компьютерной программы HPLC Peak Simple Chromatography с получением данных о времени удерживания и относительной площади пика.
Анализ с помощью масс-спектрометрии
Масс-спектры получали на квадрупольном масс-спектрометре с электрораспылением Sciex API-III, снабженном стандартным источником ионов ESI. Были использованы следующие условия ионизации: ESI в моде положительного иона; напряжение при ионном распылении, 3,9 кВ; напряжение, подаваемое на отверстие, 60 В. В качестве ионизирующего газа и газа-носителя использовали азот со скоростью потока 0,9 л/мин. Масс-спектры регистрировали в диапазоне 600-1800 единиц Томпсона (Th) с шагом 0,5 Th и с временем задержки 2 мсек. Образец (приблизительно 1 мг/мл) растворяли в 50% водном ацетонитриле с 1% уксусной кислотой и вводили через подсоединенный шприц-насос со скоростью 5 мкл/мин.
Анализ с использованием ВЭЖХ
ВЭЖХ-анализ осуществляли с использованием хроматографической системы Beckman System Gold, снабженной УФ-детектором на 214 нм и колонкой с C8 Vydac размером 150 мм × 4,6 мм. Скорость потока составляла 1 мл/мин. Растворитель A содержал 0,1% TFA в дистиллированной воде, а растворитель B содержал 0,1% TFA в 90% CH3CN. При этом использовали линейный градиент (0%→30% B, 10 минут). Собранные данные анализировали с помощью компьютерной программы Peak Simple Chromatography.
Начальные скорости отщепления использовали для измерения константы скорости диссоциации соответствующих пролекарств. Концентрации пролекарства и лекарственного средства оценивали по площади их пиков, «а» и «b», соответственно, для каждого конкретного времени сбора (см. таблицу 2). Константы скорости диссоциации первого порядка для пролекарств определяли путем построения кривой зависимости логарифма концентрации пролекарства от времени. По наклону этой кривой определяли константу скорости «k». Затем вычисляли полупериод разложения различных пролекарств по формуле: t½=0,693/k.
ВЭЖХ- и ЖХ-МС-данные для отщепления пептида В (lys-sar-dHdTdRGdTdF-NH2) в плазме
Полупериод разложения различных пролекарств вычисляли по формуле t½=0,693/k. По этой формуле, время полужизни комбинации Lys-Sar в плазме, определенное с использованием пептидной D-модели dHdTdRGdTdF-NH2 (SEQ ID NO: 716), составляло 18,6 ч.
Пример 3
Полупериод отщепления различных дополнительных дипептидов, связанных с гексапептид-моделью (HSRGTF-NH2; SEQ ID NO: 715), определяли с применением методов, описанных в примере 1. Данные, полученные в этих экспериментах, представлены в таблицах 3 и 4.
Отщепление дипептидов A-B, связанных с боковой цепью N-концевого пара-амино-Phe, от гексапептидов-моделей в PBS
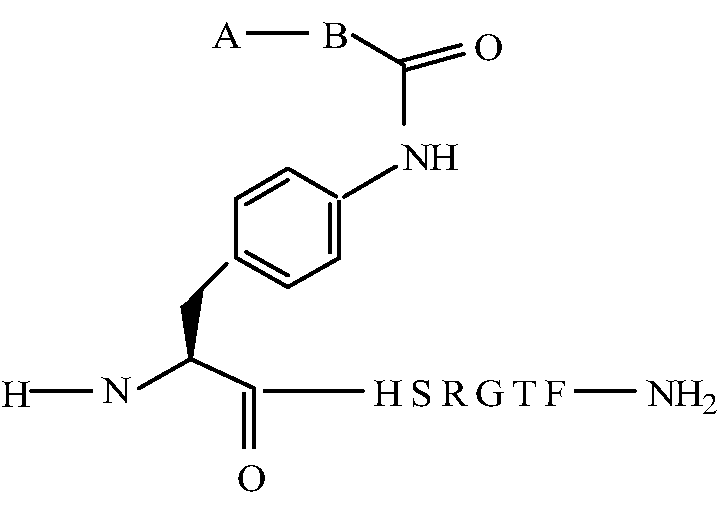
Отщепление дипептидов A-B, связанных с различными аминокислотами в положении 1 (X1), от гексапептида-модели (X1-S R G T F-NH2 (SEQ ID NO: 732)) в PBS
NH2-A-B-X1-S R G T F-NH2
Пример 4
Синтез аналогов глюкагона и GLP-1
Для оценки возможности получения биологически активного производного глюкагона и GLP-1 было синтезировано множество пептидных аналогов. Стандартная процедура их получения вкратце описана в настоящей заявке и подробно обсуждается ниже.
Материалы:
Смолу PAM (смола PAM представляет собой сополимер OCH2-фенилацетамидометил-полистирола-1% дивинилбензола) (100-180 меш, 1% полистирол, перекрестно связанный с DVB; загрузка = 0,7-1,0 ммоль/г), Boc-защищенные и Fmoc-защищенные аминокислоты закупали у Midwest Biotech. Другие реагенты, такие как α-гидрокси-кислоты (фенилмолочная кислота и гликолевая кислота), закупали у Aldrich. Твердофазный синтез пептидов, проводимый с использованием Boc-защищенных аминокислот, осуществляли на пептидном синтезаторе Applied Biosystem 430A. Синтез Fmoc-защищенных аминокислот осуществляли на пептидном синтезаторе Applied Biosystem Model 433. Синтез депсипептидов, осуществляемый вручную, проводили в реакционных сосудах из спеченного стекла аналогичными методами (Schnolzer, M., et al., (1992) Int J Pept Protein Res 40(3-4): 180-193).
Синтез пептидов (с использованием Boc-аминокислот/посредством HF-отщепления):
Синтез этих аналогов осуществляли на пептидном синтезаторе Applied Biosystem Model 430A. Синтетические пептиды конструировали путем последовательного добавления аминокислот, а активированные сложные эфиры каждой аминокислоты получали путем добавления 1,9 ммоль (3,8 мл 0,5 M раствора) 3-(диэтокси-фосфорилокси)-3H-бензо[d][l,2,3]триазин-4-она (DEPBT) в ДМФ в картридж, содержащий 2 ммоль Boc-защищенной аминокислоты. Аминокислоты растворяли путем барботирования газообразного азота через картридж. 1 мл N,N-диизопропилэтиламина добавляли в картридж для образования сложного эфира. Этот раствор переносили в реакционный сосуд, содержащий 0,2 ммоль C-концевого остатка, присоединенного к смоле PAM, несколько раз встряхивали и оставляли на 10 минут для связывания со смолой. После промывки для удаления непрореагировавших реагентов, N-концевую защитную Boc-группу удаляли путем обработки трифторуксусной кислотой (TFA) в течение 5 минут. Смолу промывали ДМФ и цикл повторяли нужное число раз до полной сборки цепи. По окончании синтеза (обычно 30 аминокислот), реакционный сосуд содержал приблизительно 1,2-1,5 г защищенной пептидил-PAM-смолы. Смолу много раз промывали диметилформамидом (ДМФ), обрабатывали трифторуксусной кислотой для удаления последней защитной трет-Boc-группы, и наконец, промывали еще несколько раз ДМФ, дихлорметаном (ДХМ), и сушили.
Пептидил-смолу обрабатывали безводной HF (подробное описание этого метода приводится далее в этом разделе), и обычно получали приблизительно 350 мг (примерно с 50% выходом) неочищенного пептида с удаленной защитной группой.
Синтез пептидов (с использованием Fmoc-аминокислот/посредством HF-отщепления):
Синтез по этой схеме осуществляли вручную с использованием нескольких аминокислот в выбранных сайтах. В данной работе, Fmoc-аминокислоты использовали только для синтеза пролекарств с внутренним серином, как части более широкой стратегии синтеза. При этом следует отметить, что хотя этот синтез осуществляли с применением Fmoc-химии, однако, обычно такие пептиды всегда синтезируют на смоле PAM, и в этом случае, для отщепления пептида от твердого носителя требуется HF-обработка. Выход таких пептидов является приблизительно таким же, как указывалось ранее для синтеза на Boc/PAM.
Этот синтез осуществляли, как описано в предыдущем разделе. По окончании стадии присоединения, пептидил-смолу обрабатывали 20% пиперидином для удаления N-концевой защитной Fmoc-группы. Затем проводили повторную промывку ДМФ, и этот цикл повторяли нужное число раз для каждой стадии присоединения. По окончании синтеза, пептидил-смолу сушили с использованием ДХМ, и пептид отщепляли от смолы под действием безводной HF.
Синтез депсипептидов (образование сложного эфира аминокислот)
В этом случае, пептидил-смола имела α-гидроксил-N-концевое удлинение вместо N-концевого амина, а ацилирование проводили у α-гидроксильной группы. Эти реакция занимает большее количество времени, чем образование амидной связи, поскольку гидроксильная группа является более слабым нуклеофилом, чем амин. Обычно, время такой реакции составляет 12 часов.
Сначала активированные сложные эфиры каждой аминокислоты получали путем добавления 1 ммоль (0,155 мл диизопропилкарбодиимида (DIC)) в картридж, содержащий раствор 2 ммоль Boc-защищенного аминокислотного остатка в 2 мл ДХМ. Этот картридж охлаждали до 10°C в течение 10 минут, а затем в него добавляли 0,9 ммоль (244 мг) диметиламинопиридина (DMAP) для ускорения образования сложного эфира. Эту смесь переносили в реакционный сосуд, содержащий пептидил-смолу, после чего синтезировали пептид. Содержимое реакционного сосуда перемешивали в течение 12 часов.
Пептидил-смолу сушили с использованием ДХМ и продолжали синтез нужного пептида. По окончании синтеза, пептидил-смолу сушили с использованием ДХМ, и наконец, обрабатывали безводной HF с получением нужного пептида.
Синтез N-концевого гидроксил-пептида (α-гидроксил-N-концевое удлинение)
В этой реакции, свободный амин пептидил-смолы взаимодействует с α-гидроксикислотой с образованием α-гидроксил-N-концевого удлинения. В соответствии с этим использовали две указанных α-гидрокси-кислоты, а именно, гликолевую кислоту (OH-глицин) и фенилмолочную кислоту (ОН-фенилаланин). Этот синтез также проводили вручную. Пептиды конструировали путем добавления α-гидрокси-кислоты, а активированные сложные эфиры α-гидрокси-кислоты получали путем добавления 0,9 ммоль DEPBT (270 мг) в картридж, содержащий раствор 1 ммоль Boc-защищенного остатка в 2 мл ДМФ. В картридж добавляли DIEA (N,N-диизопропилэтиламин, 0,5 мл) для ускорения образования сложного эфира. Эту смесь переносили в реакционный сосуд, содержащий пептидил-смолу, после чего синтезировали пептид. Время реакции составляло 6 часов.
Пептидил-смолу сушили с использованием ДХМ и продолжали синтез нужного пептида. По окончании синтеза, пептидил-смолу сушили с использованием ДХМ, и наконец, отщепляли путем обработки безводной HF с получением свободного пептида.
HF-обработка пептидил-смолы
Пептидил-смолу (30 мг - 200 мг) помещали в реакционный сосуд с фтористым водородом (HF) для отщепления. В этот сосуд добавляли 500 мкл п-крезола в качестве акцептора ионов карбония. Данный сосуд подсоединяли к HF-системе и помещали в смесь метанола/сухого льда. Затем из сосуда откачивали воздух с помощью вакуумного насоса, и реакционную смесь отгоняли с использованием 10 мл HF. Реакционную смесь пептидил-смолы и HF перемешивали в течение одного часа при 0°C, после чего создавали вакуум, а затем быстро откачивали HF (10-15 мин). Сосуд осторожно вынимали и заполняли приблизительно 35 мл эфира для осаждения пептида и для экстракции п-крезола и низкомолекулярных органических защитных групп, образовавшихся после HF-обработки. Смесь фильтровали через тефлоновый фильтр, и эту процедуру повторяли два раза для удаления избытка крезола. Полученный фильтрат отбрасывали. Осажденный пептид растворяли приблизительно в 20 мл 10% уксусной кислоты (водной). Фильтрат, содержащий нужный пептид, собирали и лиофилизовали.
Анализ с помощью масс-спектрометрии
Масс-спектры получали на квадрупольном масс-спектрометре с электрораспылением Sciex API-III, снабженном стандартным источником ионов для ESI. Были использованы следующие условия ионизации: ESI в моде положительного иона; напряжение при ионном распылении, 3,9 кВ; напряжение, подаваемое на отверстие, 60 В. В качестве ионизирующего газа и газа-носителя использовали азот со скоростью потока 0,9 л/мин. Масс-спектры регистрировали в диапазоне 600-1800 единиц Томпсона (Th) с шагом 0,5 Th и с временем задержки 2 мсек. Образец (примерно 1 мг/мл) растворяли в 50% водном ацетонитриле с 1% уксусной кислотой и вводили через подсоединенный шприц-насос со скоростью 5 мкл/мин.
Если пептиды анализировали в растворе PBS с помощью ESI-МС, то их сначала обессоливали с использованием насадки для твердофазной экстракции ZipTip, содержащей 0,6 мкл C4-смолы в соответствии с инструкциями производителя (Millipore Corporation, Billerica, MA, см. web-сайт Millipore http://www.millipore.com/catalogue.nsf/docs/C5737).
Анализ, проводимый с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ)
Полученные неочищенные пептиды подвергали предварительному анализу для приблизительной оценки их относительной скорости превращения в забуференном фосфатом физиологическом растворе (PBS) (pH, 7,2) с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) и MALDI-анализа. Образцы неочищенного пептида растворяли в PBS-буфере в концентрации 1 мг/мл. 1 мл полученного раствора хранили в 1,5-миллилитровом ВЭЖХ-сосуде, а затем этот сосуд герметично закрывали и инкубировали при 37°С. Затем, через различные интервалы времени брали 100 мкл-аликвоты, охлаждали до комнатной температуры и анализировали с помощью ВЭЖХ.
ВЭЖХ-анализы осуществляли с использованием хроматографической системы Beckman System Gold, снабженной УФ-детектором на 214 нм. ВЭЖХ-анализы осуществляли на колонке с C18 Vydac размером 150 мм × 4,6 мм. Скорость потока составляла 1 мл/мин. Растворитель A содержал 0,1% TFA в дистиллированной воде, а растворитель B содержал 0,1% TFA в 90% CH3CN. При этом, использовали линейный градиент (40%→70% B, 15 минут). Собранные данные анализировали с помощью компьютерной программы Peak Simple Chromatography.
Начальные скорости гидролиза использовали для измерения константы скорости диссоциации соответствующих пролекарств. Концентрации пролекарства и лекарственного средства оценивали по площади их пиков, соответственно. Константы скорости диссоциации первого порядка для пролекарств определяли путем построения кривой зависимости логарифма концентрации пролекарства от времени. По наклону этой кривой определяли константу скорости «k». Затем вычисляли полупериод разложения различных пролекарств по формуле: t½=0,693/k.
Препаративная очистка с помощью ВЭЖХ
После идентификация пролекарства, имеющего соответствующее t½, это пролекарство очищали. Очистку осуществляли с помощью ВЭЖХ-анализа на 1×25 см-колонке с адсорбентом Vydac C18 на основе двуокиси кремния (размер частиц 5 мкм, размер пор 300 Å). Было использовано следующее оборудование: насос Waters Associates модели 600, инжектор модели 717 и УФ-детектор модели 486. Все образцы анализировали на длине волны 214 нм. Растворитель А содержал 10% CH3CN/0,1% TFA в дистиллированной воде, а растворитель B содержал 0,1% TFA в CH3CN. В данном случае использовали линейный градиент (0→100% B, 2 часа). Скорость потока составляла 1,2 мл/мин, а размер фракции составлял 6 мл. Приблизительно из 350 мг неочищенного пептида обычно получали 80 мг чистого пептида (примерно с 23%-ным выходом).
Пример 5
Экспериментальная схема биоанализа: Анализ для детектирования cAMP, проводимый с использованием люциферазного гена-репортера
Способность каждого аналога глюкагона и GLP-1 или пролекарства индуцировать cAMP определяли с помощью анализа, проводимого с использованием гена-репортера люциферазы светляка. Уровни индуцируемого продуцирования cAMP прямо пропорциональны уровню связывания глюкагона или GLP-1 с их рецептором. В этом биоанализе использовали клетки HEK293, ко-трансфецированные рецептором глюкагона или GLP-1, соответственно, и ген люциферазы, сцепленный с cAMP-отвечающим элементом.
Эти клетки культивировали в течение 16 часов в бессывороточной минимальной поддерживающей среде Дульбекко (Invitrogen, Carlsbad, CA), в которую была добавлена 0,25% культуральная бычья сыворотка (HyClone, Logan, UT), а затем инкубировали с серийными разведениями аналогов GLP-1 или аналогов пролекарства в течение 5 часов при 37°С, 5% CO2 в 96 луночных планшетах «Biocoat», покрытых поли-D-лизином (BD Biosciences, San Jose, CA). По окончании инкубирования, в каждую лунку добавляли 100 мкл люминесцентного реагента-субстрата LucLite (Perkin Elmer, Wellesley, MA). Планшет быстро встряхивали, инкубировали в течение 10 минут в темноте, и интенсивность излучения на выходе измеряли в жидкостном сцинтилляционном счетчике MicroBeta-1450 (Perkin-Elmer, Wellesley, MA). Эффективные 50% концентрации (EC50) вычисляли с помощью программы Origin (OriginLab, Northampton, MA).
Пример 6
Биоактивность пролекарства на основе амид-содержащего родственного глюкагону пептида
I) GLP-1
Сборку пептида C24-GLP-1(7-36) (HAEGTFTSDVSSYLEGQAAKEFICWLVKGR; SEQ ID NO: 717) осуществляли на пептидном синтезаторе. Для подтверждения того, что соответствующий удлиненный N-конец может быть использован для модификации пролекарства, небольшой процент связанной с пептидом смолы отщепляли под действием HF и анализировали на точность синтеза. Синтезированный пептид имел массу 3329,8 дальтон. Активность связывания GLP-1 с его рецептором определяли с помощью люциферазного анализа на активность по отношению к рецептору GLP-1, как описано в примере 5.
II) Присоединение дипептидов к N-концу GLP
Дипептиды ковалентно присоединяли к N-концу глюкагона или GLP-1 для исследования различных тенденций прохождения реакции внутримолекулярной циклизации и отщепления посредством образования дикетопиперазина (DKP).
Биологически неактивные аналоги GLP-1 и глюкагона с присоединенным дипептидом превращали в активное пептидное лекарственное средство после расщепления амидной связи с образованием DKP. Аналогичное превращение может быть осуществлено с использованием либо саркозина (Sar), либо пролина в качестве аминокислоты «B» в дипептиде A-B аналогов GLP-1. Пролекарства, имеющие различные полупериоды разложения, оценивали посредством химической модификации заместителей у альфа-углерода первой (A) и второй (B) аминокислот дипептида формулы I. Так, например, дипептидный элемент пролекарства, содержащий пролин и аминоизомасляную кислоту (Aib), последовательно вводили в C24-GLP (SEQ ID NO: 717), в результате чего получали первый пептид, который был обозначен Aib-1-P0,C24GLP (7-36), где первой аминокислотой (аминокислотой «Xaa-1») данного пептида является аминоизомасляная кислота, а второй аминокислотой (аминокислотой «Xaa0») является пролин. Все упомянутые далее пептиды имеют такую же систематическую номенклатуру. Стереохимически, каждое синтезированное соединение представляет собой L-изомер, если это не оговорено особо, где аминокислоты обозначены трехбуквенными кодами, справа от которых стоит надстрочный индекс, указывающий на номер положения. Этот пептид был получен методом твердофазного синтеза, описанным выше. Синтез подтверждали с помощью ESI-МС-анализа (3479,9 Да).
III) ПЭГилирование GLP-пролекарства
ПЭГилирование представляет собой ценный метод защиты пептидов и снижения клиренса пептидов из почек. В соответствии с этим, для проведения последующих экспериментов, пролекарство Aib-1-P0,C24GLP(7-36) ПЭГилировали путем присоединения 40 кДа ПЭГ с функциональной малеимидо-группой к -SH-группе 24-Cys пролекарства Aib-1-P0,C24GLP(7-36) посредством реакции Михаэля. ПЭГилированный родственный глюкагону пептид был обозначен 40k ПЭГ-Aib-1-P0,C24GLP(7-36). Этот ПЭГилированный пептид очищали с помощью препаративной ВЭЖХ и подтверждали с помощью MALDI-TOF-МС (44000-46000, широкий пик).
IV) Активность GLP-1 в PES
Для оценки вероятности образования DKP и одновременной регенерации родительского лекарственного средства, пролекарство 40k ПЭГ-Aib-1-P0,C24GLP(7-36) инкубировали в буфере PBS при 37°С приблизительно в течение 10 дней. Образцы собирали в различные интервалы времени (30 часов, 54 часов, 168 часов, 240 часов). Для исследования восстановления активности GLP-1 после отщепления дипептидного пролекарства в результате образования DKP, все собранные образцы анализировали с помощью биоанализа. Более конкретно, активность связывания GLP-пролекарств с его рецептором определяли с помощью люциферазного анализа на активность по отношению к рецептору GLP, описанного в примере 5.
Данные биоанализа, полученные в различные периоды времени для 40k ПЭГ-Aib-1-P0,C24GLP(7-36) в PBS
V) Активность GLP-1 в плазме
Для оценки вероятности образования DKP и одновременной регенерации родительского лекарственного средства, dLys-1-Sar0,C24 GLP(7-36) инкубировали в плазме при 37°С приблизительно в течение 30 часов. Образцы собирали в различные интервалы времени (1 час, 12 часов, 30 часов). Для исследования восстановления активности после отщепления дипептида от GLP-1 в результате образования DKP, все собранные образцы анализировали с помощью биоанализа. Более конкретно, активность связывания GLP-пролекарств с его рецептором определяли с помощью люциферазного анализа на активность по отношению к рецептору GLP, описанного в примере 5.
Данные биоанализа, полученные в различные периоды времени для dLys-1-Sar0,C24 GLP(7-36) в плазме
Пример 7
In vivo эффекты пролекарств на основе пептида, принадлежащего к суперсемейству глюкагонов, у мышей
Мышам с ожирением, вызванным соответствующим кормлением (DIO), раз в неделю внутрибрюшинно инъецировали дозу пептида, принадлежащего к суперсемейству глюкагонов (SEQ ID NN: 1-684, 1701-1776, 1801-1908). Мышей ежедневно взвешивали (N=8) после первой инъекции: только носителя или пептида, принадлежащего к суперсемейству глюкагонов, в количестве примерно 0,5 нмоль/кг, 3 нмоль/кг, 10 нмоль/кг, 15 нмоль/кг или 70 нмоль/кг, или пролекарственного производного пептида, принадлежащего к суперсемейству глюкагонов, где дипептид связан с N-концом пептида, принадлежащего к суперсемейству глюкагонов, посредством амидной связи, и где указанным дипептидом является Aib-1Pro0, Aib-1dPro0, Lys-1Sar0, dAla-1Pro0, Ac-Aib-1Pro0, Lys-1(X)Sar0 (X представляет собой 1 K ПЭГ-цепь, связанную с боковой цепью Lys), Lys-1(Y)Sar0 (Y представляет собой трет-бутилглицин, связанный с боковой цепью Lys), dLys-1Sar0, dLys-1Gly(N-гексил)0, или dLys-1F(N-Me)0 (вводимые в количестве примерно 0,5 нмоль/кг, 3 нмоль/кг, 10 нмоль/кг, 15 нмоль/кг или 70 нмоль/кг). Физиологический раствор, содержащий 25% (об./об.) глюкозу, вводили в дозе 1,5 г/кг массы тела на время в 0 минут. Уровни глюкозы в крови измеряли при -60, 0, 15, 30, 60 и 120 минут. Массу тела, потребление корма, уровень глюкозы в крови и биохимический состав организма измеряли на дни 0 и 1.
Пример 8
Снижение массы тела у мышей, индуцированное введением аналогов глюкагона
Мышам с ожирением, вызванным соответствующим кормлением (DIO), раз в неделю внутрибрюшинно инъецировали дозу 15 или 70 нмоль/кг аналога глюкагона. Мышей ежедневно взвешивали (N=8) после первой инъекции: только носителя ▼, пептида А, принадлежащего к суперсемейству глюкагонов («Пептида A») в дозе 15 нмоль/кг (▷) или 70 нмоль/кг (►), или производного пролекарства Пептида A, где дипептид связан с N-концом Пептида А посредством амидной связи, и где указанный дипептид представляет собой Aib-1Pro0 (вводимый в дозе 15 нмоль/кг (O) или 70 нмоль/кг (●)), Aib-1 Pro0 (вводимый в дозе 70 нмоль/кг (◇)), Lys-1Sar0 (вводимый в дозе 70 нмоль/кг (♦)), dAla-1 Pro0 (вводимый в дозе 70 нмоль/кг (◄)) или Ac-Aib-1 Pro-1 (вводимый в дозе 70 нмоль/кг (■)). Результаты эксперимента представлены на фиг.1. Следует отметить, что соединение Ac-Aib-1Pro0Пептид А не способен отщепляться с образованием дикетопиперазина, но тем не менее, указанное соединение обнаруживает некоторый уровень активности, превышающей уровень активности, наблюдаемой в случае использования носителя. Это, вероятно, обусловлено низкой остаточной активностью пролекарства. Пептид А представляет собой ПЭГилированный аналог глюкагона, содержащий 7 замен по сравнению с нативным глюкагоном (SEQ ID NO: 701), C-концевой амид, и 40 кДа ПЭГ с функциональным малеимидом.
На фиг.2 представлен график изменения массы тела у мышей с ожирением, вызванным соответствующим кормлением (DIO), которым раз в неделю внутрибрюшинно инъецировали дозы 0,5, 3, 15 или 70 нмоль/кг только носителя (♦), Пептида А, (в дозе 0,5 ▲, 3 ►, 15 ▼ или 70 ◄ нмоль/кг/день) или Lys-1 Sar0 - Пептида А (в дозе 0,5Δ, 3 ▷, 15 ▽ или 70 ◁ нмоль/кг/день). Два эти лекарственных средства во всех дозах давали одинаковые эффекты, а поэтому польза от добавления дипептидного элемента пролекарства, была, как оказалось, минимальной. Это, вероятно, обусловлено ферментативным отщеплением дипептида и быстрой активацией введенного пролекарства.
Пример 9
Тест на толерантность к глюкозе, проводимый с использованием пролекарственных аналогов глюкагона
Мышам (N=8) с ожирением, вызванным соответствующим кормлением (DIO), внутрибрюшинно инъецировали дозу 15 или 70 нмоль/кг одного из нижеследующих пептидов:
(A) Пептида А (в дозе 15 ◁ или 70 ◄ нмоль/кг/день),
(B) Lys-1Sar0-Пептида А, (в дозе 15 ▷ или 70 ► нмоль/кг/ день), или
(C) dLys-1Sar0-Пептида А (в дозе 15 □, или 70 ■ нмоль/кг/ день).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут. Уровни глюкозы в крови измеряли во время -60, 0, 15, 30, 60 и 120 минут. На фиг.3 представлены данные этого эксперимента.
На фиг. 4 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым внутрибрюшинно вводили во время -15 минут либо только носитель (▼), либо дозу 2 нмоль/кг одного из следующих соединений:
(A) Lys-1Sar0-Пептида А (■),
(B) Lys-1(X),Sar0-Пептида А (▲), (X представляет собой 1K ПЭГ-цепь, связанную с боковой цепью Lys)
(C) Lys-1(Y),Sar0 Пептида А (♦), (Y представляет собой трет-бутилглицин, связанный с боковой цепью Lys)
(D) dLys-1Sar0-Пептида А, (►).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут. Уровни глюкозы в крови измеряли во время -15, 0, 15, 30, 60 и 120 минут.
На фиг. 5 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым сначала инъецировали пептид, родственный глюкагону, а затем раствор глюкозы. Мышам внутрибрюшинно инъецировали во время -15 минут либо только носитель (▼), либо дозу 20 нмоль/кг dLys-1 Sar0-Пептида А, (►), либо дозу 0,67 нмоль/кг одного из следующих соединений:
(A) Lys-1Sar0 Пептида А (■),
(B) Lys-1(X), Sar0 Пептида А (▲), (X представляет собой 1K ПЭГ-цепь, связанную с боковой цепью Lys)
(C) Lys-1(Y),Sar0 Пептида А (♦), (Y представляет собой трет-бутилглицин, связанный с боковой цепью Lys).
Данные, представленные на фиг. 3-5, показали, что Lys-1, Sar0-дипептид не действует таким же образом, как элемент пролекарства, если он связан с N-концом. Однако, модификация аминокислот указанного дипептида, а в частности, замена D-аминокислоты (dLys1) поддерживает соединение в неактивной форме (предположительно, посредством предотвращения ферментативного расщепления). Затем пролекарство активируют с учетом структуры и стереохимии дипептидного элемента пролекарства, а также его нуклеофильности. Как показано на фиг. 5, даже при гораздо более высокой дозе (в дозе 20 нмоль/кг по сравнению с дозой 0,67 нмоль/кг) dLys-1Sar0-пептид A обеспечивает эффективность пролекарства.
Пример 10
Мышам (N=8) с ожирением, вызванным соответствующим кормлением (DIO), внутрибрюшинно инъецировали дозу 15 или 70 нмоль/кг одного из нижеследующих соединений:
(A) Пептида А (в дозе 15 Δ или 70 ▲ нмоль/кг/день),
(B) dLys-1Sar0-Пептида А (в дозе 15 □ или 70 ■ нмоль/кг/день), или
(C) Lys-1Sar0-Пептида А (в дозе 15 ▷ или 70 ► нмоль/кг/день);
на время -60 минут. Во время 0 минут и через 24 часа внутрибрюшинно вводили 25% глюкозы в физиологическом растворе в дозе 1,5 г/кг массы тела. Уровни глюкозы в крови измеряли во время -60, 0, 15, 30, 60 и 120 минут. Массу тела, потребление корма, уровень глюкозы в крови и биохимический состав организма измеряли на дни 0 и 1, при этом, средняя масса тела мышей DIO (N=8 на группу), составляла 55 г. На фиг. 6 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым на время -60 минут внутрибрюшинно инъецировали только носитель (▼) или дозу 15 или 70 нмоль/кг одного из соединений, описанных выше.
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут и через 24 часа. Указанные уровни глюкозы в крови измеряли на время -60, 0, 15, 30, 60 и 120 минут после первого введения раствора глюкозы (то есть, время 0 минут).
На фиг. 7 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым внутрибрюшинно, на время -60 минут, инъецировали либо только носитель (▼), либо дозу 15 или 70 нмоль/кг одного из следующих соединений:
(A) Пептида А, (в дозе 15 Δ или 70 ▲ нмоль/кг/день),
(B) dLys-1Sar0-Пептида А, (в дозе 15 ◇ или 70 ▽ нмоль/кг/день), или
(C) Lys-1Sar0-Пептида А (в дозе 15 ♦ или 70 ■ нмоль/кг/день).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут и через 24 часа. Указанные уровни глюкозы в крови измеряли через 0, 15, 30, 60 и 120 минут после второй инъекции раствора глюкозы, которую осуществляли через 24 часа.
На фиг. 8 представлены данные, указывающие на потерю массы у DIO-мышей (N=8), которым внутрибрюшинно инъецировали указанные соединения в дозе 15 или 70 нмоль/кг. Указанные массы тела измеряли через 7 дней после введения соединений.
Пример 11
Мышам (N=8) с ожирением, вызванным соответствующим кормлением (DIO), внутрибрюшинно инъецировали только носитель или дозу 15 нмоль/кг пептида-пролекарства за 24, 8, 4 или 1 час до введения провокационной дозы путем инъекции 25% глюкозы физиологическом растворе в концентрации 1,5 г/кг массы тела. Указанные уровни глюкозы в крови измеряли через 0, 15, 30, 60 и 120 минут после введения провокационной дозы раствора глюкозы. Результаты данного исследования, проиллюстрированные на фиг. 9, показали, что введение Lys-1Sar0-Пептида А (фиг. 9А) и dLys-1Sar0-Пептида А (фиг. 9В), по сравнению с введением носителя, используемого в качестве контроля, приводило к снижению уровней глюкозы в крови. Сравнение результатов, полученных для двух пролекарств, указывало на различие в эффективности начального снижения уровня глюкозы в крови в различные периоды времени пребывания пролекарства в кровотоке. У мышей, которым вводили стереоизомер «d», начальное снижение уровня глюкозы в крови (то есть, на ранней стадии) было небольшим, если это пролекарство вводили за один час до введения провокационной дозы, и такое снижение было выше, если это пролекарство вводили задолго до введения провокационной дозы (например, самое большое начальное снижение наблюдалось через 8 и 24 часа после введения пролекарства). Это исследование подтвердило мнение, что пролекарства, содержащие стереоизомер «d», сохраняют свою неактивную форму в течение более длительного периода времени, чем пролекарства, содержащие стереоизомер «l».
Пример 12
Три пролекарства, содержащие пептид В, принадлежащий к суперсемейству глюкагонов («Пептид В»), и пептид С, принадлежащий к суперсемейству глюкагонов («Пептид С»), синтезировали в соответствии с нижеследующими условиями:
1) dK-Sar-Пептид C, где dK представляет собой D-изоформу Lys, Sar представляет собой саркозин, а Пептид C представляет собой аналог глюкагона, имеющий 8 замен по сравнению с нативным глюкагоном (SEQ ID NO: 701), C-концевой амид, и 40k Да ПЭГ с функциональной иодацетильной группой.
Сборку пептидной последовательности осуществляли методом твердофазного пептидного синтеза. После связывания и снятия защиты с последнего остатка His, связанную с пептидом смолу подвергали реакции взаимодействия с 5-кратным избытком Boc-саркозина, DEPBT и DIEA в ДМФ при комнатной температуре в течение 6 часов. Мониторинг прохождения реакции осуществляли с помощью нингидринового теста. После завершения связывания, смолу 3 раза промывали ДМФ и ДХМ, соответственно. Boc-защиту снимали с использованием TFA. Смолу промывали ДХМ, ДМФ и нейтрализовали DIEA. Затем, связанный со смолой пептид подвергали реакции взаимодействия с 5-кратным избытком Boc-dLys, DEPBT и DIEA при комнатной температуре в течение ночи. Затем смолу обрабатывали TFA для снятия Boc-защиты и промывали ДХМ, ДМФ. И наконец, смолу обрабатывали 20% пиперидином в ДМФ для удаления формильной группы на 25Trp и сушили в вакууме. В итоге, пептид расщепляли посредством реакции с HF при 4°C в течение 1 часа, и осаждали безводным этиловым эфиром. После фильтрации, пептид растворяли в 20% ацетонитриле (MeCN) в воде и лиофилизовали с получением порошка. Пептид очищали с помощью препаративной ВЭЖХ (C5-колонка; скорость потока 10 мл/мин; буфер A 10% MeCN и 0,1% TFA в воде; буфер B: 0,1% TFA в ACN; линейный градиент A-В%=0-40% (0-80 минут)). Соединение подтверждали с помощью ESI-MS (3612,8 дальтон).
Полученный пептид был ПЭГилирован путем присоединения 40 кДа ПЭГ с иодацетильной функциональной группой к тиоловой группе 24-Cys. Пептид растворяли в 4 M мочевины/50 нМ трис-буфера (pH 6,6) при 4°C в течение ночи. ПЭГилированный пептид очищали с помощью препаративной ВЭЖХ, и его идентичность подтверждали с помощью MALDI-TOF-MS (44000-46000, широкий пик).
2) dK-Gly(N-гексил)-Пептид B, где dK представляет собой D-изоформу Lys, Gly(N-гексил) представляет собой N-гексил-глицин, а Пептид В представляет собой аналог глюкагона, имеющий 8 замен по сравнению с нативным глюкагоном (SEQ ID NO: 701), C-концевой амид, и 40k Да ПЭГ с функциональной малеимидной группой.
Сборку пептидной последовательности осуществляли методом твердофазного пептидного синтеза. Связанную с пептидом смолу подвергали реакции взаимодействия с 5-кратным избытком бромуксусной кислоты, DIC и HOBT в ДМФ при комнатной температуре в течение 2 часов. Если результат нингидринового теста был отрицательным, то смолу три раза промывали ДМФ и ДХМ, соответственно. Затем смолу подвергали реакции взаимодействия с 10-кратным избытком н-гексиламина и DIEA в ДМФ при комнатной температуре в течение ночи. Затем, связанный со смолой пептид подвергали реакции взаимодействия с 5-кратным избытком Boc-dLys, DEPBT и DIEA при комнатной температуре в течение ночи. После этого, смолу три раза промывали ДМФ и ДХМ. Затем связанный со смолой пептид подвергали реакции взаимодействия с 5-кратным избытком Boc-dLys, DEPBT и DIEA при комнатной температуре в течение 24 часов. Смолу обрабатывали TFA для снятия Boc-защиты и промывали ДХМ и ДМФ. И наконец, смолу обрабатывали 20% пиперидином в ДМФ для удаления формильной группы на 25Trp и сушили в вакууме. В итоге, пептид расщепляли посредством реакции с HF при 4°C в течение 1 часа, и осаждали безводным этиловым эфиром. После фильтрации, пептид снова растворяли в 20% MeCN в воде и лиофилизовали с получением порошка. Пептид очищали с помощью препаративной ВЭЖХ (C5-колонка; скорость потока 10 мл/мин; буфер A: 10% MeCN и 0,1% TFA в воде; буфер B: 0,1% TFA в MeCN; линейный градиент A-В%=0-40% (0-80 минут)). Соединение подтверждали с помощью ESI-MS и было установлено, что оно имеет массу 3677,0 дальтон.
Полученный пептид был ПЭГилирован путем присоединения 40 кДа ПЭГ с малеимидной функциональной группой к тиоловой группе 24-Cys. Пептид растворяли в 4 M мочевины/50 нМ трис-буфера (pH 6,6) при 4°C в течение ночи. ПЭГилированный пептид очищали с помощью препаративной ВЭЖХ, и его идентичность подтверждали с помощью MALDI-TOF-MS (44000-46000, широкий пик).
3) dK-F(N-Me)-Пептид C, где dK представляет собой D-изоформу Lys, F(N-Me) представляет собой N-метил-Phe, а Пептид C представляет собой аналог глюкагона, имеющий 8 замен по сравнению с нативным глюкагоном (SEQ ID NO: 701), C-концевой амид, и 40k Да ПЭГ с функциональной иодацетильной группой. Сборку пептидной последовательности осуществляли методом твердофазного пептидного синтеза. Связанную с пептидом смолу подвергали реакции взаимодействия с 5-кратным избытком N-метилфенилаланина, DEPBT и DIEA в ДМФ при комнатной температуре в течение 6 часов. Если результат нингидринового теста был отрицательным, то смолу три раза промывали ДМФ и ДХМ, соответственно. Затем смолу подвергали реакции взаимодействия с TFA для снятия Вос-защиты, промывали ДМФ и ДХМ, и нейтрализовали DIEA. Затем, связанный со смолой пептид подвергали реакции взаимодействия с 5-кратным избытком Boc-dLys, DEPBT и DIEA при комнатной температуре в течение ночи. Затем смолу обрабатывали TFA для снятия Boc-защиты и промывали ДХМ и ДМФ. И наконец, смолу обрабатывали 20% пиперидином в ДМФ для удаления формильной группы на 25Trp и сушили в вакууме. В итоге, пептид расщепляли посредством реакции с HF при 4°C в течение 1 часа, и осаждали безводным этиловым эфиром. После фильтрации, пептид снова растворяли в 20% MeCN в воде и лиофилизовали с получением порошка. Пептид очищали с помощью препаративной ВЭЖХ в следующих условиях: C5-колонка; скорость потока 10 мл/мин; буфер A 10% MeCN и 0,1% TFA в воде; буфер B: 0,1% TFA в MeCN; линейный градиент A-В%=0-40% (0-80 минут); ПЭГ-инсулин или его аналоги собирали приблизительно при 33% В. Нужное соединение подтверждали с помощью ESI-MS и было установлено, что оно имеет массу 3701,0 дальтон.
Полученный пептид был ПЭГилирован путем присоединения 40 кДа ПЭГ с иодацетильной функциональной группой к тиоловой группе 24-Cys. Пептид растворяли в 4 M мочевины/50 нМ трис-буфера (pH 6,6) при 4°C в течение ночи. ПЭГилированный пептид очищали с помощью препаративной ВЭЖХ, и его идентичность подтверждали с помощью MALDI-TOF-MS (44000-46000, широкий пик).
Аналогичные методы могут быть применены для синтеза пролекарств, содержащих dLys-N-метил-глицин, dLys-N-гексил- глицин, и dLys-N-метил-фенилаланин, связанные с любой из последовательностей SEQ ID NN: 1-684, 701-731, 801-919, 1001-1262, 1301-1371, 1401-1518, 1701-1776 и 1801-1908.
Пример 13
Три пролекарства, описанные в примере 12, тестировали на их эффекты in vivo у мышей с ожирением, вызванным соответствующим кормлением (DIO) (штамм: C57B16). Девяти группам, каждая из которых состояла из восьми мышей (с начальной средней массой тела 44,5 г), подкожно инъецировали либо только носитель, либо 10 нмоль/кг пептида пролекарства примера 12, либо родительского пептида (не являющегося пролекарством и не содержащего дипептидной группы пролекарства). Мышам в возрасте 5,5 месяцев давали корм с высоким содержанием жира приблизительно в течение 2 месяцев. Уровни глюкозы в крови измеряли через 0, 2, 4, 24 и 72 часа после инъекции (фиг. 11). В течение одной недели после инъекции проводили мониторинг массы тела, которую измеряли на дни 0, 1, 3, 5 и 7, где день инъекции считался как день 0 (фиг. 12). Также проводили мониторинг потребления корма и жировой массы в течение 1-недельного исследования.
Масса тела мышей, которым вводили родительский пептид, dK-Sar-содержащее пролекарство или dK-Gly(N-гексил)-содержащее пролекарство, постоянно снижалась в течение всего периода исследования, в отличие от массы тела мышей, которым вводили носитель, используемый в качестве контроля. Как и ожидалось, родительский пептид вызывал самое большое снижение массы тела, что позволяет предположить, что пролекарства, вводимые в более высоких дозах, могут давать такие же эффекты, как и родительский пептид.
Изменение уровней глюкозы в крови (уровни на день 7 - день 0) было наибольшим при введении родительского пептида, хотя dK-Sar- и dK-Gly(N-гексил)-содержащие пролекарства также давали значительное снижения уровней глюкозы по сравнению с носителем, используемым в качестве контроля.
Пример 14
Скорость образования DKP модулировали путем замены боковой цепи и/или альфа-амина в аминокислоте «B» дипептидного пролекарства A-B. В таблице 7 указаны скорости образования DKP под действием dK-Sar-, dK-Gly(N-гексил)- и dK-F(N-Me)-пролекарств, описанных в примере 12.
Модуляция скорости образования DKP
Пример 15
Рецептор-связывающую активность нижеследующих пептидов и пролекарств в 20% человеческой плазме определяли в течение определенного периода времени с помощью люциферазного анализа на активность по отношению к рецептору GLP как описано в примере 5:
(A) GLP-1 (SEQ ID NO: 703),
(B) Пептид C,
(C) dLys-1Sar0-химерный Пептид С или
(D) dLys-1Gly(N-гексил)0-Пептид B.
Как показано в таблице 8, активности dLys-1Sar0- и dLys-1Gly(N-гексил)0-пролекарств постепенно повышались в течение определенного периода времени и через 48 часов соответствовали активности нативного GLP-1 (фиг. 13A и 13B).
Превращение пролекарства в активную лекарственную форму в зависимости от времени
Пример 16
Мышам, которые содержались в условиях голодания, и у которых было индуцировано ожирение путем соответствующего кормления (N=14, штамм: C57B16 дикого типа), каждую неделю подкожно инъецировали одну дозу 3, 10 или 30 нмоль/кг носителя или одного из нижеследующих соединений:
(А) Пептида C,
(В) dLys-1Sar0-Пептида С или
(С) dLys-1Gly(N-гексил)0-Пептида B.
Мышей, имеющих среднюю исходную массу тела 31,2 г, взвешивали на дни 1, 3, 5 и 7. Уровни глюкозы во внутрибрюшинных пробах крови измеряли на дни 1, 3 и 5. Мыши имели возраст приблизительно 5 месяцев и получали стандартный корм для мышей приблизительно в течение 5 месяцев.
Результаты исследования представлены на фиг. 14-15. На фиг. 14 представлен график изменения массы тела у DIO-мышей на дни 1, 3, 5 и 7. На фиг. 15 представлены графики уровней глюкозы в крови на день 1 (фиг. 15A), день 3 (фиг. 15B) и день 5 (фиг. 15C).
Пример 17
Рецептор-связывающую активность нижеследующих пептидов и пролекарств в 20% человеческой плазме определяли в течение определенного периода времени с помощью люциферазного анализа на активность по отношению к рецептору GLP-1 как описано в примере 5:
(A) GLP-1
(B) Пептид C,
(C) dLys-1Gly(N-гексил)0-Пептид С
(D) dLys-1Sar0-Пептид С
(Е) dLys-1Phe(N-метил)0-Пептид С.
Как показано в таблице 9, активности dLys-1Gly(N-гексил)0-, dLys-1Sar0- и dLys-1Phe(N-метил)0-пролекарств постепенно повышались с течением времени (фиг. 16А-С). Как показано также в таблице 9, время полужизни пролекарства может быть адаптировано путем изменения химической структуры второй аминокислоты дипептидного элемента пролекарства.
EC50 пролекарства и превращение пролекарства в активную лекарственную форму в зависимости от времени
Пример 18
Рецептор-связывающую активность нижеследующих пептидов и пролекарств в 20% человеческой плазме определяли в течение определенного периода времени с помощью анализа на активность по отношению к рецептору GLP-1 как описано в примере 5:
(A) GLP-1
(B) Пептид D,
(C) Aib-1Sar0-Пептид D
(D) dLys-1Sar0-Пептид D
(Е) dLys-1Gly(N-гексил)0-Пептид D
(F) dLys-1Phe(N-метил)0-Пептид D.
Как показано в таблице 10, активности Aib-1Sar0-, dLys-1Sar0-, dLys-1Gly(N-гексил)0- и dLys-1Phe(N-метил)0-пролекарств постепенно повышались с течением времени и зависели от структуры дипептидного элемента пролекарства (фиг. 17А-D). Пептид D, то есть, родственный глюкагону пептид класса 2, представляет собой аналог глюкагона, имеющий 3 замены по сравнению с нативным глюкагоном (SEQ ID NO: 701), С-концевое удлинение, С-концевой амид, ацильную группу и группу ПЭГ.
Превращение пролекарства в активную лекарственную форму в зависимости от времени
Пример 19
Генетически скрещенным мышам с диабетом/ожирением (N=8, штамм: самцы db/db (BKS.Cg-Dock7m+/+Leprdb/J)) подкожно инъецировали носитель или одну дозу 10, 30 или 100 нмоль/кг одного из нижеследующих соединений:
(A) Пептида D,
(B) Aib-Sar-Пептида D.
Уровни глюкозы во внутрибрюшинных пробах крови измеряли через 0, 4, 8, 24, 48 и 72 часа. Мыши имели возраст приблизительно 10-11 недель (33,4-45,6 г) и получали сертифицированный чистый корм для грызунов #5001. Животные в каждой группе имели свободный доступ к пище (ad libitum) во время исследования.
Результаты исследования представлены на фиг. 18. На фиг. 18 представлен график уровней глюкозы в крови у мышей в течение 72 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОСНОВАННЫЕ НА АМИДАХ ПРОЛЕКАРСТВА ПЕПТИДОВ ГЛЮКАГОНОВОГО НАДСЕМЕЙСТВА | 2009 |
|
RU2550696C2 |
| ПЕПТИДЫ ГЛЮКАГОНОВОГО СУПЕРСЕМЕЙСТВА, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ОТНОСИТЕЛЬНО ЯДЕРНЫХ ГОРМОНАЛЬНЫХ РЕЦЕПТОРОВ | 2011 |
|
RU2604067C2 |
| КОНЪЮГАТЫ ИНСУЛИН-ИНКРЕТИН | 2014 |
|
RU2678134C2 |
| ПРОЛЕКАРСТВА, СОДЕРЖАЩИЕ КОНЬЮГАТ ГИАЛУРОНОВОЙ КИСЛОТЫ, ЛИНКЕРА И ДВОЙНОГО АГОНИСТА GLP-1/ГЛЮКАГОНА | 2016 |
|
RU2719482C2 |
| ЛЕКАРСТВЕННЫЕ СРЕДСТВА, СВЯЗАННЫЕ С ДИПЕПТИДАМИ | 2009 |
|
RU2578591C2 |
| ПОЛИПЕПТИДЫ, СЕЛЕКТИВНЫЕ К РЕЦЕПТОРАМ ГЛЮКАГОНА, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2760007C2 |
| АНАЛОГИ ГЛЮКАГОНА, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ РАСТВОРИМОСТЬЮ И СТАБИЛЬНОСТЬЮ В БУФЕРАХ С ФИЗИОЛОГИЧЕСКИМИ ЗНАЧЕНИЯМИ Ph | 2009 |
|
RU2560254C2 |
| ПЕПТИДНЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ С ПОВЫШЕННОЙ ЭФФЕКТИВНОСТЬЮ ПРОТИВ ИНСУЛИНОРЕЗИСТЕНТНОСТИ | 2012 |
|
RU2602801C2 |
| ДВОЙНЫЕ АГОНИСТЫ GLP1/GIP ИЛИ ТРОЙНЫЕ АГОНИСТЫ GLP1/GIP/ГЛЮКАГОНА | 2013 |
|
RU2652783C2 |
| Терапевтическое применение глюкагона и включающей его комбинации | 2019 |
|
RU2838895C2 |







































































































































































































































































































































































































































































































































































































































































































































































































































































































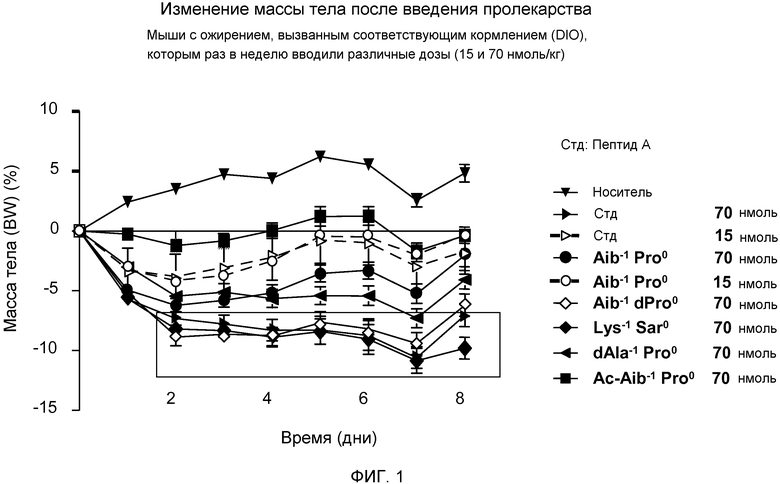
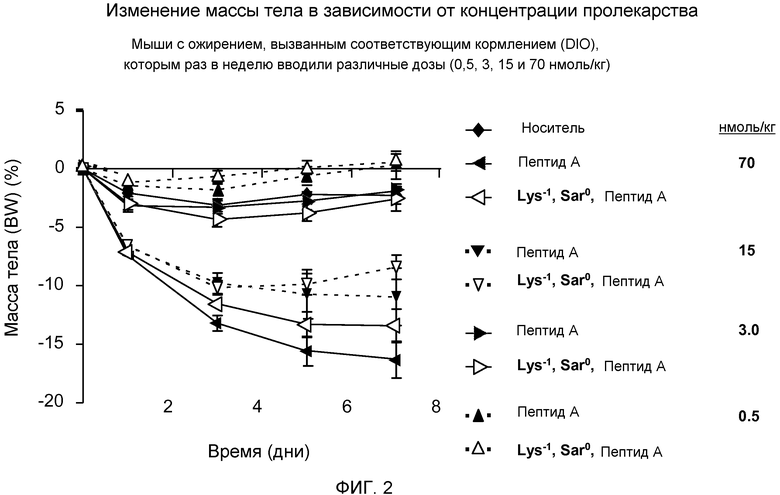

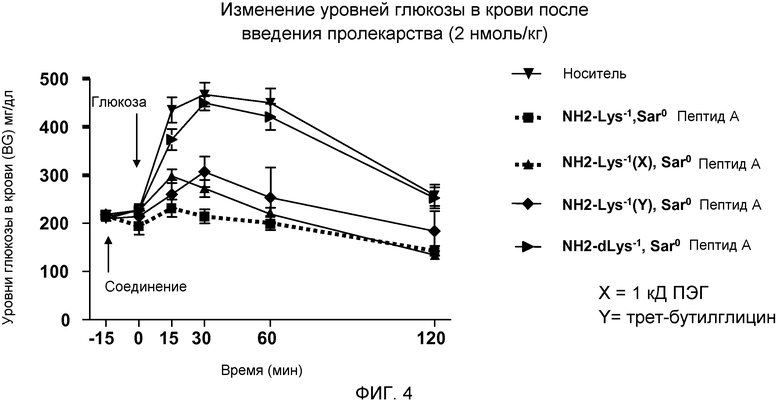
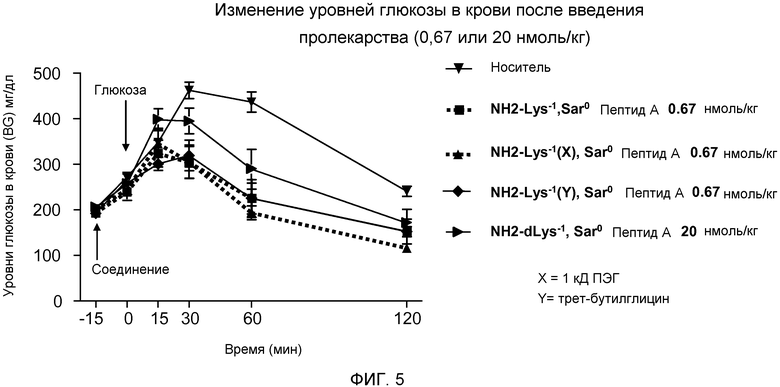
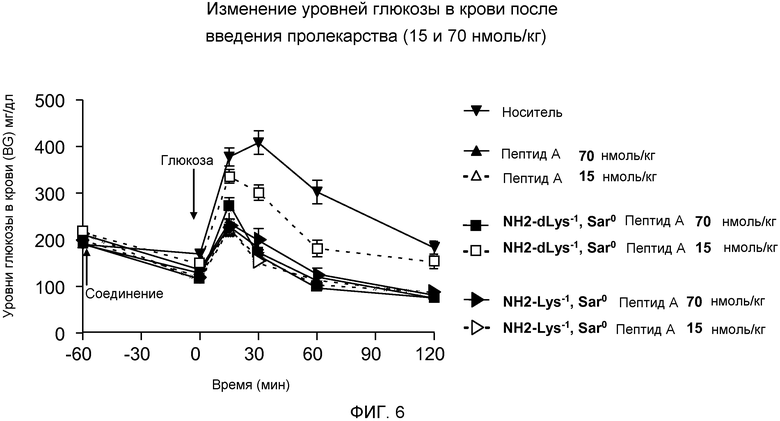
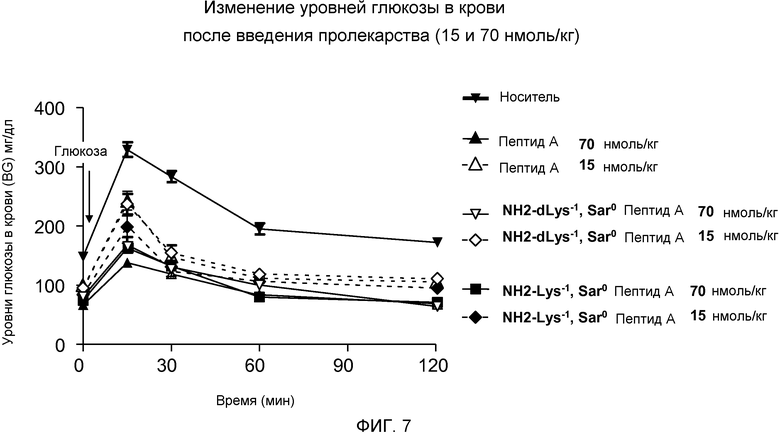
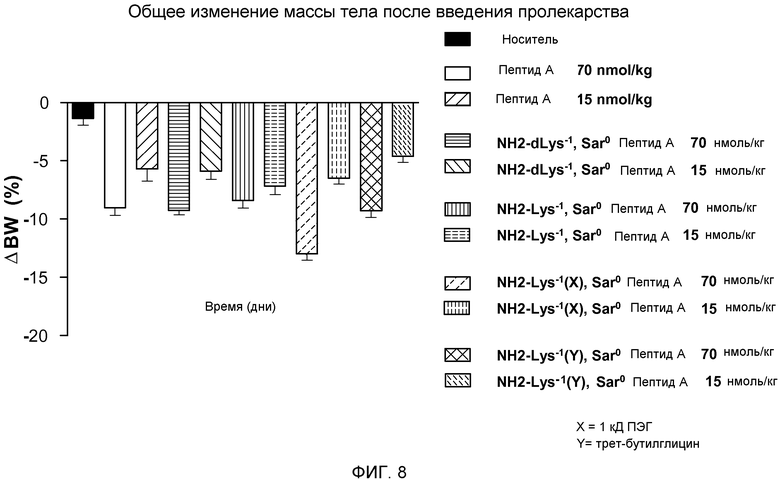
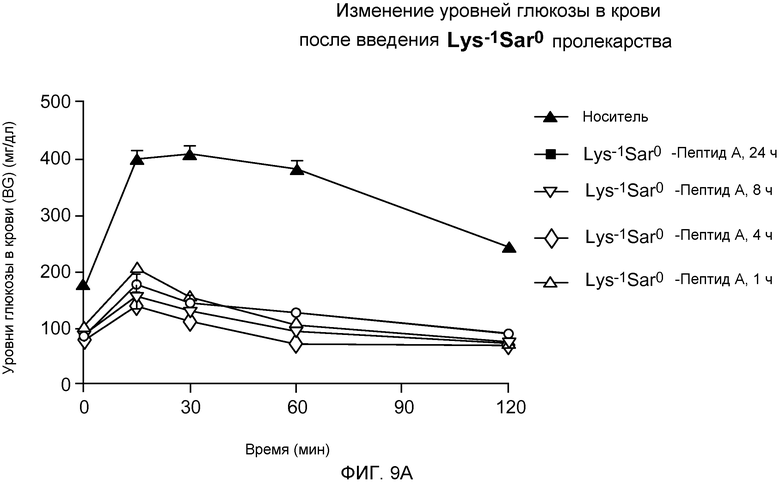
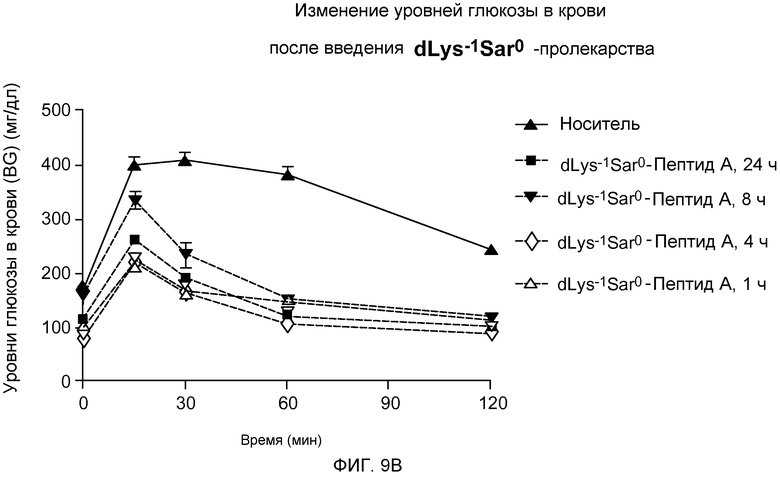

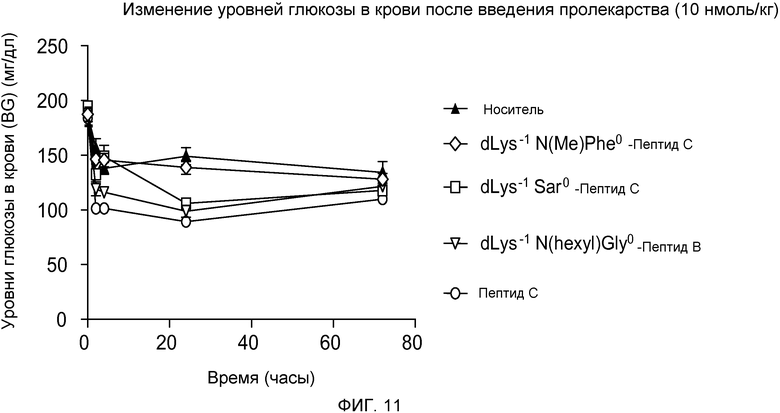
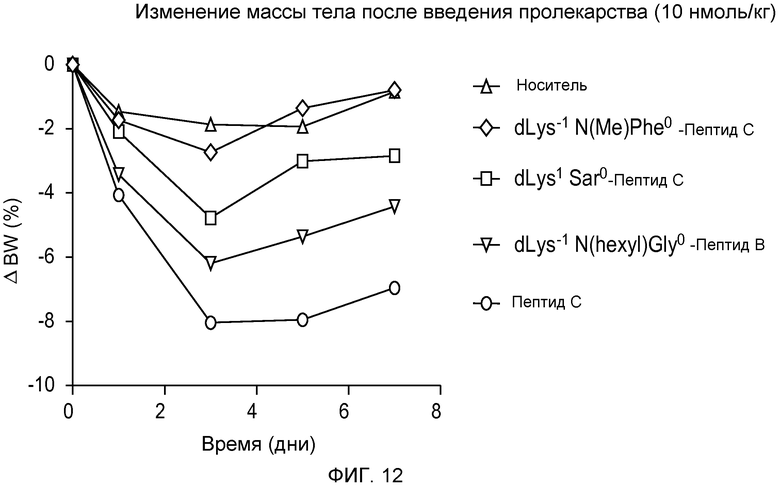
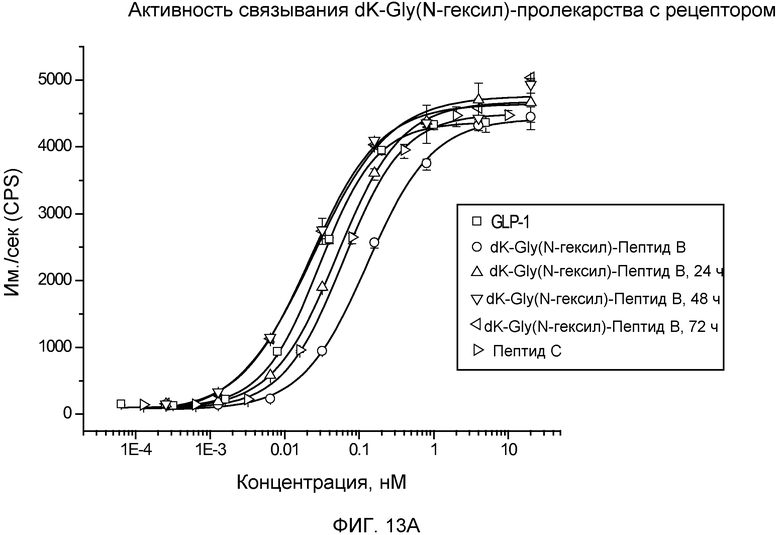


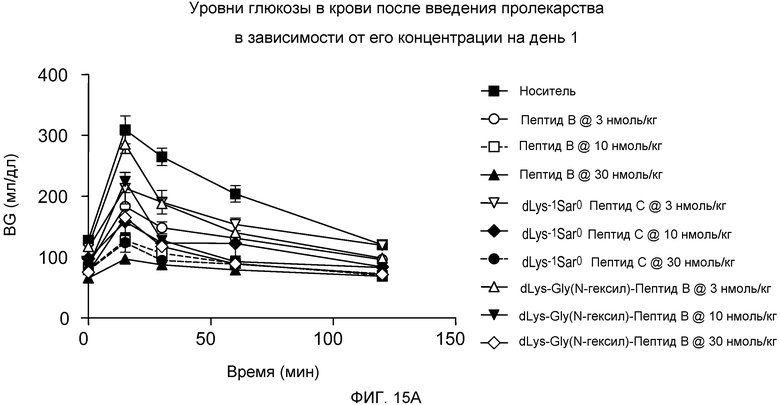
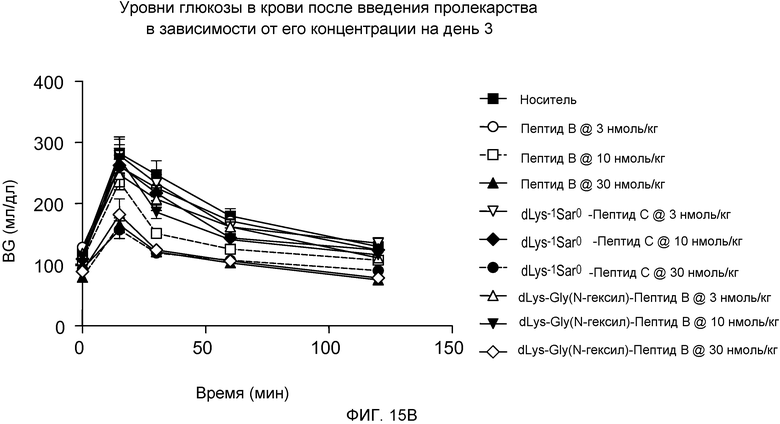
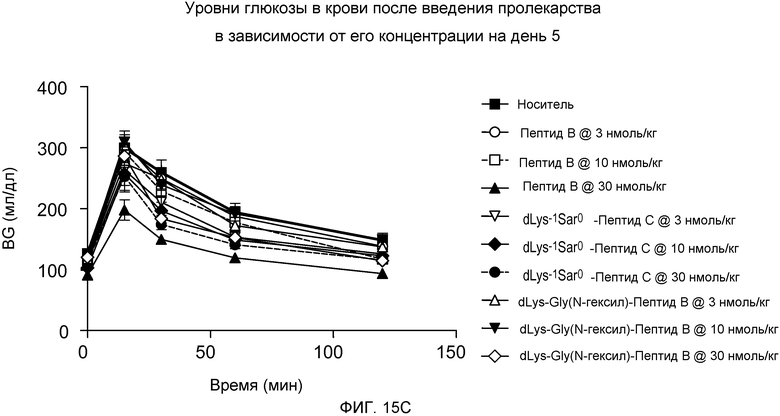
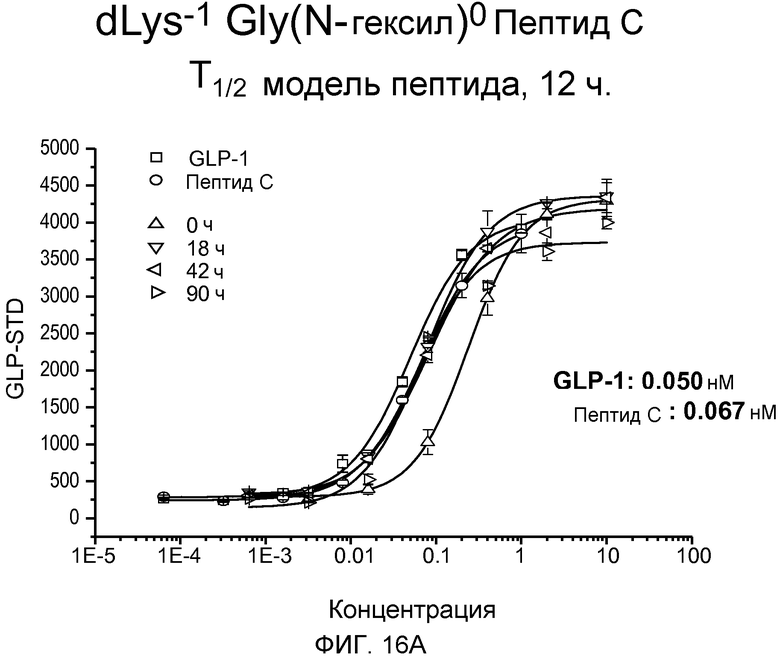
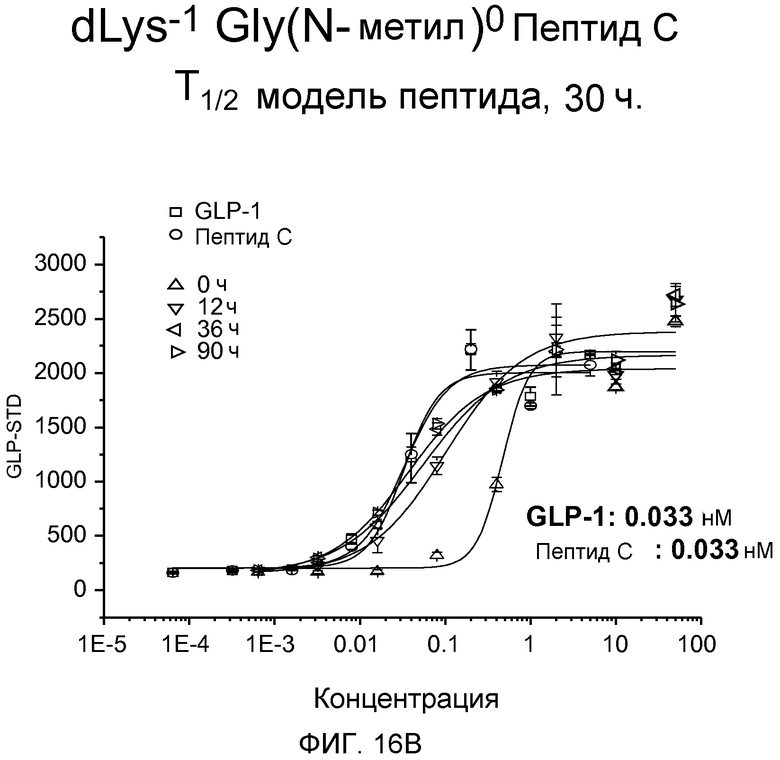
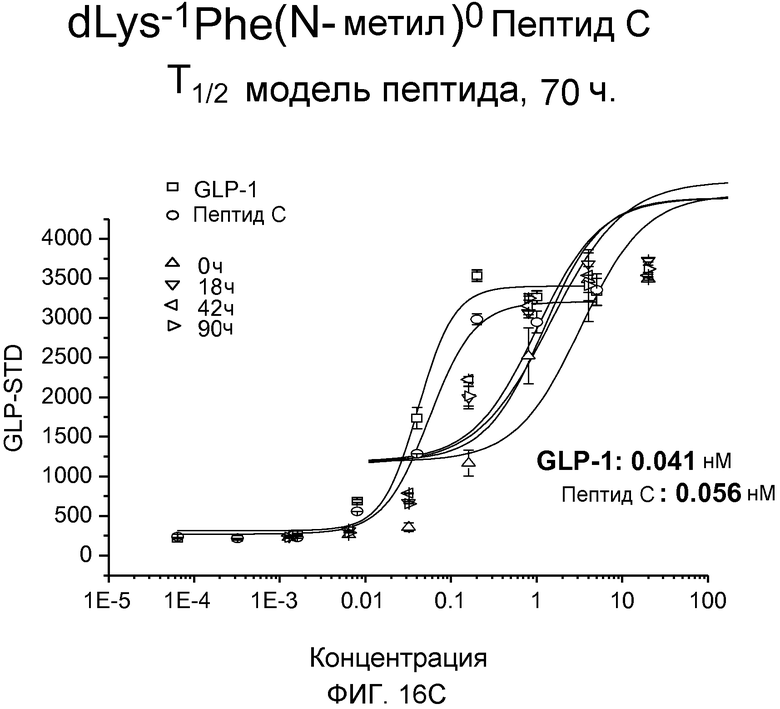
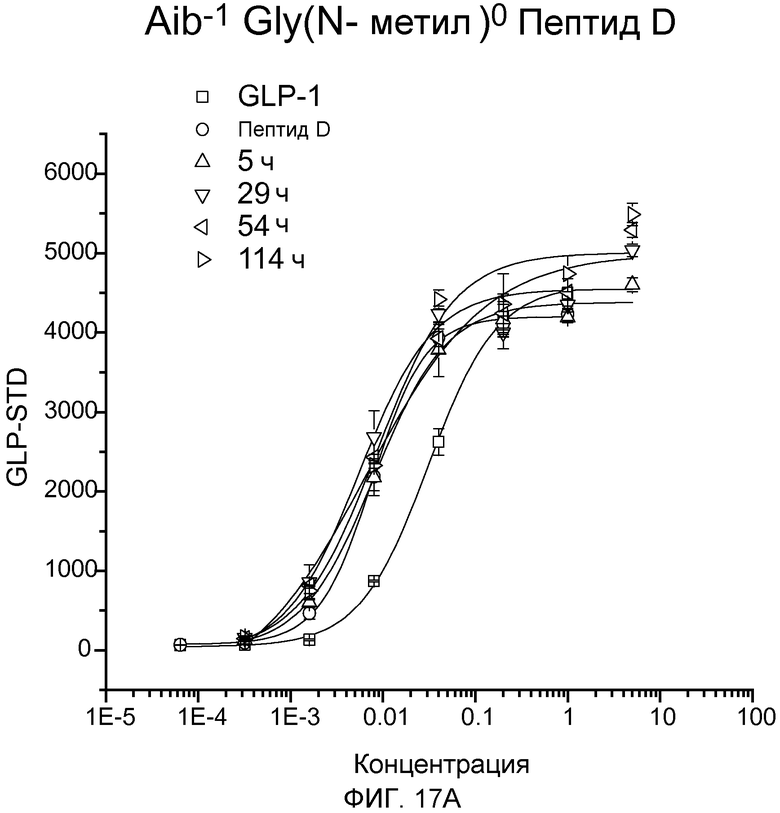
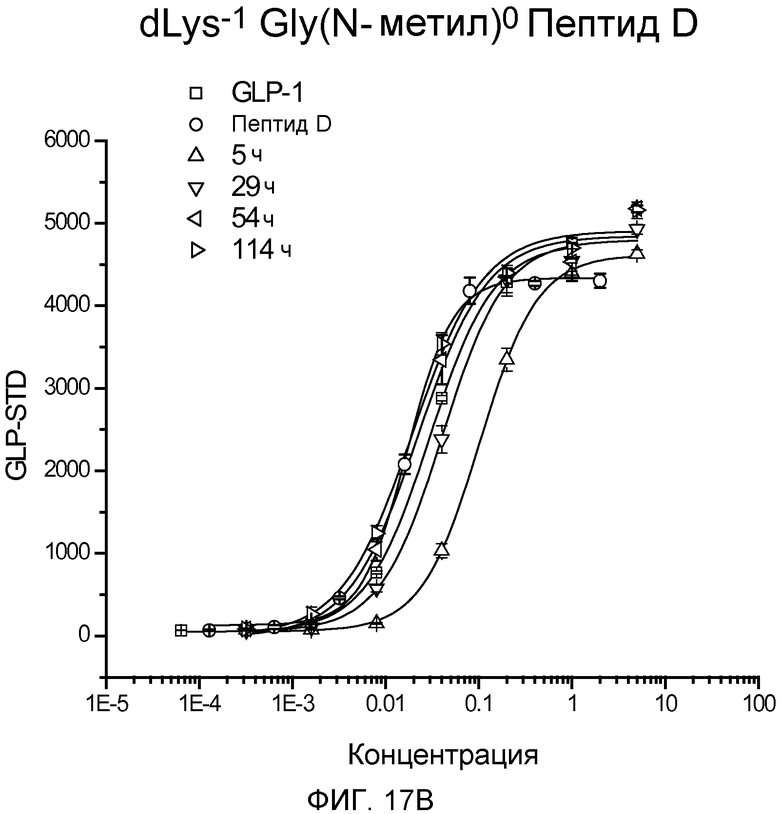
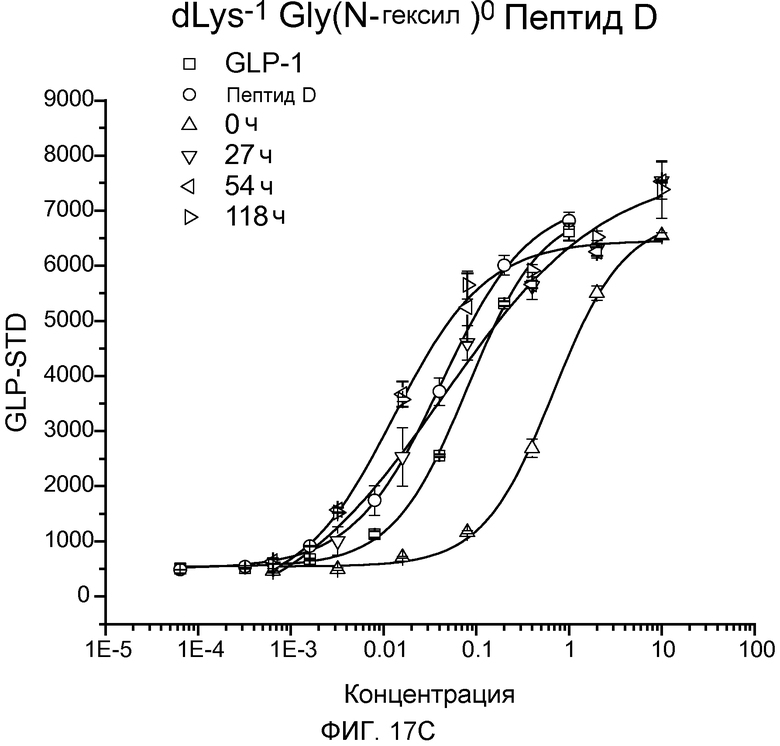
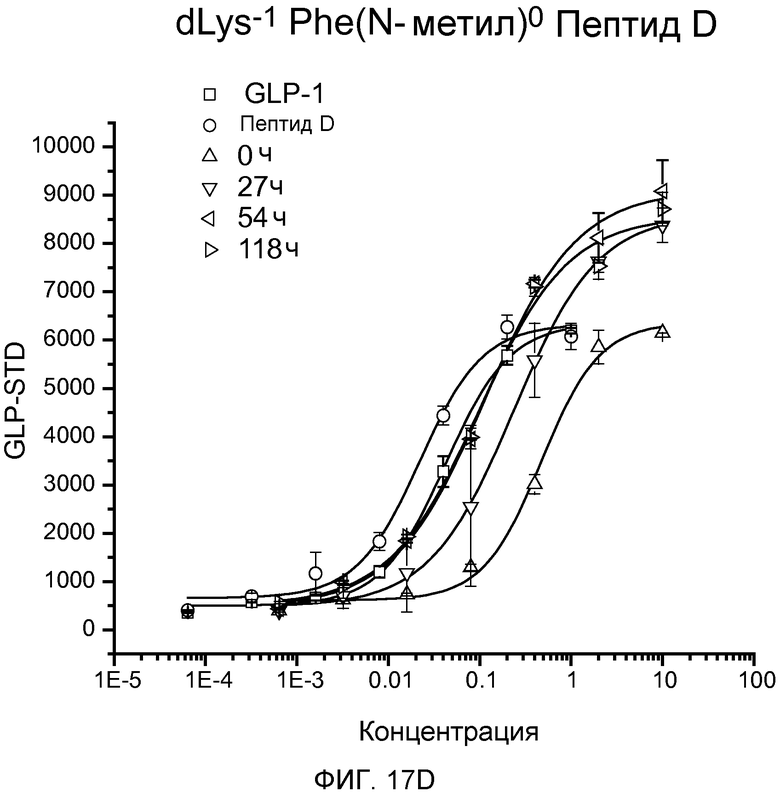
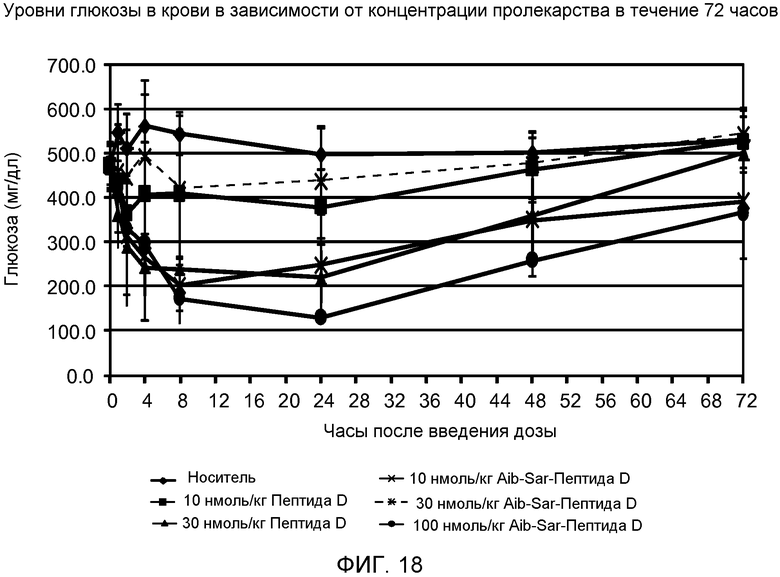
Изобретение относится к пролекарственным препаратам, состоящим из пептидов, принадлежащих к суперсемейству глюкагонов, где указанный пептид, принадлежащий к суперсемейству глюкагонов, был модифицирован путем присоединения дипептида к пептиду, принадлежащему к суперсемейству глюкагонов, посредством амидной связи. Описанные здесь пролекарства имеют длительное время полужизни и могут превращаться в активную форму в физиологических условиях посредством неферментативной реакции, инициированной химической нестабильностью. 15 з.п. ф-лы, 18 ил., 19 табл., 19 пр.
1. Пролекарство, содержащее структуру:
A-B-Q;
где Q представляет собой пептид, принадлежащий к суперсемейству глюкагонов,
где А-В содержит структуру:
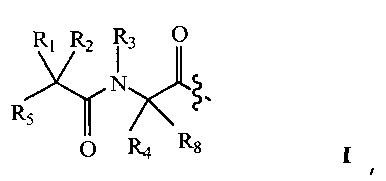
где
(I) R1 и R2 независимо выбраны из группы, состоящей из Н, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)ОН, (С1-С18алкил)SH, (С2-С3алкил)SCH3, (С1-С4алкил)CONH2, (С1-С4алкил)СООН, (С1-С4алкил)NH2, (С1-С4алкил)NHC(NH2 +)NH2, (С0-С4алкил)(С3-С6циклоалкил), (С0-С4алкил)(С2-С5гетероциклил), (С0-С4алкил)(С6-С10арил)R7, (C1-С4алкил)(С3-С9гетероарил) и C1-С12алкил(W1)С1-С12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и О, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют С3-С12циклоалкил;
R3 представляет собой этил, пропил, бутил, пентил, гептил или октил;
каждый из R4 и R8 представляет собой Н;
R5 представляет собой NHR6, либо R5 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R6 представляет собой Н или С1-С4алкил, и
R7 выбран из группы, состоящей из Н, ОН, галогена, (C1-С7алкил), (С2-С7алкенил), OCF3, NO2, CN, NC, О(С1-С7алкил), CO2H, CO2(С1-С7алкил), NHR6, арила и гетероарила;
где А-В связан с Q посредством амидной связи между А-В и алифатической аминогруппой Q;
где полупериод химического отщепления (t1/2) А-В от Q составляет по меньшей мере примерно от 1 часа до 1 недели в PBS в физиологических условиях;
при условии, что если А-В связан с альфа-аминогруппой на N-конце Q, и (i) оба R1 и R2 представляют собой Н, и (ii) R3 представляет собой метил, то Q не является F7GLP-1(8-37);
(II) R1 и R2 независимо выбраны из группы, состоящей из Н, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)ОН, (С1-С18алкил)SH, (С2-С3алкил)SCH3, (С1-С4алкил)CONH2, (С1-С4алкил)СООН, (С1-С4алкил)NH2, (С1-С4алкил)NHC(NH2 +)NH2, (С0-С4алкил)(С3-С6циклоалкил), (С0-С4алкил)(С2-С5гетероциклил), (С0-С4алкил)(С6-С10арил)R7, (C1-С4алкил)(С3-С9гетероарил) и С1-С12алкил(W1)С1-С12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и О, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют С3-С12циклоалкил;
R3 представляет собой С1-С18алкил;
R4 выбран из группы, состоящей из СН3, СН2(С1-С4алкил), СН2(C1-C4)алкенила, СН2(С0-С4алкил)ОН, СН2(С0-С4алкил)SH, СН2(С0-С3алкил)SCH3, СН2(С0-С3алкил)CONH2, СН2(С0-С3алкил)СООН, СН2(С0-С4алкил)NH2 и СН2(С0-С3алкил)NHC(NH2 +)NH2;
R8 представляет собой Н;
R5 представляет собой NHR6; или R5 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R6 представляет собой Н или С1-С4алкил, и
R7 выбран из группы, состоящей из Н, ОН, галогена, (С1-С7алкил), (С2-С7алкенил), OCF3, NO2, CN, NC, О(С1-С7алкил), CO2H, CO2(С1-С7алкил), NHR6, арила и гетероарила;
где А-В связан с Q посредством амидной связи между А-В и алифатической аминогруппой Q;
где полупериод химического отщепления (t1/2) А-В от Q составляет по меньшей мере примерно от 1 часа до 1 недели в PBS в физиологических условиях;
(III) R1 и R2 независимо выбраны из группы, состоящей из Н, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)ОН, (С1-С18алкил)SH, (С2-С3алкил)SCH3, (С1-С4алкил)CONH2, (С1-С4алкил)СООН, (С1-С4алкил)NH2, (С1-С4алкил)NHC(NH2 +)NH2, (С0-С4алкил)(С3-С6циклоалкил), (С0-С4алкил)(С2-С5гетероциклил), (С0-С4алкил)(С6-С10арил)R7, (C1-С4алкил)(С3-С9гетероарил) и С1-С12алкил(W1)С1-С12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и О, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют С3-С12циклоалкил;
R3 представляет собой С1-С18алкил;
R4 независимо выбран из группы, состоящей из СН(С1-С8алкил)2, СН(С2-С8алкенил)2, СН(С1-С8алкил)(ОН), СН(С1-С8алкил)((С1-С8алкил)SH) и СН(С1-С3алкил)(С1-С8алкил)(NH2);
R8 представляет собой Н;
R5 представляет собой NHR6; или R5 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R6 представляет собой Н или С1-С4алкил, и
R7 выбран из группы, состоящей из Н, ОН, галогена, (C1-С7алкил), (С2-С7алкенил), OCF3, NO2, CN, NC, О(С1-С7алкил), CO2H, CO2(С1-С7алкил), NHR6, арила и гетероарила;
где А-В связан с Q посредством амидной связи между А-В и алифатической аминогруппой Q;
где полупериод химического отщепления (t1/2) А-В от Q составляет по меньшей мере примерно от 1 часа до 1 недели в PBS в физиологических условиях;
(IV) R1 и R2 независимо выбраны из группы, состоящей из Н, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)ОН, (С1-С18алкил)SH, (С2-С3алкил)SCH3, (С1-С4алкил)CONH2, (С1-С4алкил)СООН, (С1-С4алкил)NH2, (С1-С4алкил)NHC(NH2 +)NH2, (С0-С4алкил)(С3-С6циклоалкил), (С0-С4алкил)(С2-С5гетероциклил), (С0-С4алкил)(С6-С10арил)R7, (C1-С4алкил)(С3-С9гетероарил) и С1-С12алкил(W1)С1-С12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и О, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют С3-С12циклоалкил;
R3, R4 и R8 и атомы, к которым они присоединены, образуют аминокислоту, выбранную из группы, состоящей из фенилаланин(N-С2-С10алкил), тирозин(N-C1-С10алкил), триптофан(N-C1-С10алкил), фенилаланин(N-С1-С6алкил), тирозин(N-С1-С6алкил), триптофан(N-C1-С6алкил), тирозин(N-метил) и триптофан(N-метил);
R5 представляет собой NHR6; или R5 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R6 представляет собой Н или С1-С4алкил; и
R7 выбран из группы, состоящей из Н, ОН, галогена, (С1-С7алкил), (С2-С7алкенил), OCF3, NO2, CN, NC, О(С1-С7алкил), CO2H, CO2(С1-С7алкил), NHR6, арила и гетероарила,
где А-В связан с Q посредством амидной связи между А-В и ароматической аминогруппой на боковой цепи аминокислоты Q;
где полупериод химического отщепления (t1/2) А-В от Q составляет по меньшей мере примерно от 1 часа до 1 недели в PBS в физиологических условиях;
(V) R1 и R2 независимо выбраны из группы, состоящей из Н, C1-С18алкила, С2-С18алкенила, (С1-С18алкил)ОН, (С1-С18алкил)SH, (С2-С3алкил)SCH3, (С1-С4алкил)CONH2, (С1-С4алкил)СООН, (С1-С4алкил)NH2, (С1-С4алкил)NHC(NH2 +)NH2, (С0-С4алкил)(С3-С6циклоалкил), (С0-С4алкил)(С2-С5гетероциклил), (С0-С4алкил)(С6-С10арил)R7, (С1-С4алкил)(С3-С9гетероарил) и С1-С12алкил(W1)С1-С12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и О, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют С3-С12циклоалкил;
R3 представляет собой С1-С18алкил;
R4 выбран из группы, состоящей из СН(С1-С8алкил)2, СН(С2-С8алкенил)2, СН(С1-С8алкил)(ОН), СН(С1-С8алкил)((С1-С8алкил)SH) и СН(С1-С3алкил)((С1-С8алкил)(NH2);
R8 представляет собой Н;
R5 представляет собой NHR6; или R5 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R6 представляет собой Н или С1-С4алкил; и
R7 выбран из группы, состоящей из Н, ОН, галогена, (C1-С7алкил), (С2-С7алкенил), OCF3, NO2, CN, NC, О(С1-С7алкил), CO2H, CO2(С1-С7алкил), NHR6, арила и гетероарила;
где А-В связан с Q посредством амидной связи между А-В и ароматической аминогруппой на боковой цепи аминокислоты Q;
где полупериод химического отщепления (t1/2) А-В от Q составляет по меньшей мере примерно от 1 часа до 1 недели в PBS в физиологических условиях.
2. Пролекарство по п. 1, где для структуры (II) В выбран из группы, состоящей из аланин(N-C1-С10алкил), лейцин(N-C1-С10алкил), аспарагин(N-C1-С10алкил), глутаминовая кислота(N-C1-С10алкил), аспарагиновая кислота(N-C1-С10алкил), глутамин(N-C1-С10алкил), лизин(N-C1-С10алкил), аргинин(N-C1-С10алкил), серин(N-С1-С10алкил), цистеин(N-C1-С10алкил), аланин(N-С1-С6алкил), лейцин(N-C1-С6алкил), аспарагин(N-С1-С6алкил), глутаминовая кислота(N-С1-С6алкил), аспарагиновая кислота(N-C1-С6алкил), глутамин(N-C1-С6алкил), лизин(N-C1-С6алкил), аргинин(N-C1-С6алкил), серин(N-C1-С6алкил), цистеин(N-C1-С6алкил), аланин(N-метил), лейцин(N-метил), аспарагин(N-метил), глутаминовая кислота(N-метил), аспарагиновая кислота(N-метил), глутамин(N-метил), лизин(N-метил), аргинин(N-метил), серин(N-метил) и цистеин(N-метил).
3. Пролекарство по п. 1, где для структуры (III) R4 представляет собой СН(С1-С8алкил)2 или СН(С1-С8алкил)ОН.
4. Пролекарство по п. 3, где В выбран из группы, состоящей из изолейцин(N-C1-С10алкил), валин(N-C1-С10алкил), треонин(N-C1-С10алкил), изолейцин(N-C1-С6алкил), валин(N-C1-С6алкил), треонин(N-C1-С6алкил), изолейцин(N-метил), валин(N-метил) и треонин(N-метил).
5. Пролекарство по п. 1, где алифатической аминогруппой является альфа-аминогруппа на N-концевой аминокислоте Q или алифатическая аминогруппа на боковой цепи Q.
6. Пролекарство по п. 1, где В выбран из группы, состоящей из аланин(N-C1-С10алкил), лейцин(N-C1-С10алкил), аспарагин(N-C1-С10алкил), глутаминовая кислота(N-C1-С10алкил), аспарагиновая кислота(N-C1-С10алкил), глутамин(N-C1-С10алкил), лизин(N-C1-С10алкил), аргинин(N-C1-С10алкил), серин(N-C1-С10алкил), цистеин(N-С1-С10алкил), аланин(N-С1-С6алкил), лейцин(N-C1-С6алкил), аспарагин(N-C1-С6алкил), глутаминовая кислота(N-C1-С6алкил), аспарагиновая кислота(N-С1-С6алкил), глутамин(N-C1-С6алкил), лизин(N-C1-С6алкил), аргинин(N-C1-С6алкил), серин(N-C1-С6алкил), цистеин(N-C1-С6алкил), аланин(N-метил), лейцин(N-метил), аспарагин(N-метил), глутаминовая кислота(N-метил), аспарагиновая кислота(N-метил), глутамин(N-метил), лизин(N-метил), аргинин(N-метил), серин(N-метил) и цистеин(N-метил).
7. Пролекарство по п. 1, где для структуры (VI) R4 представляет собой СН(С1-С8алкил)2 или СН(С1-С8алкил)(ОН).
8. Пролекарство по п. 7, где В выбран из группы, состоящей из изолейцин(N-C1-С10алкил), валин(N-C1-С10алкил) и треонин(N-C1-С10алкил), изолейцин(N-C1-С6алкил), валин(N-C1-С6алкил), треонин(N-C1-С6алкил), изолейцин(N-метил), валин(N-метил) и треонин(N-метил).
9. Пролекарство по п. 1, где R1 и R2 независимо выбраны из группы, состоящей из C1-С10алкила, С2-С10алкенила, (C1-С10алкил)ОН, (C1-С10алкил)SH, (С2-С3алкил)SCH3, (С1-С4алкил)CONH2, (С1-С4алкил)СООН, (С1-С4алкил)NH2, (С1-С4алкил)NHC(NH2 +)NH2, (C0-С4алкил)(С3-С6циклоалкил), (С0-С4алкил)(С2-С5гетероциклил), (С0-С4алкил)(С6-С10арил)R7, (С1-С4алкил)(С3-С9гетероарил) и С1-С12алкил(W1)С1-С12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и О, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют С3-С12циклоалкил; и где R7 выбран из группы, состоящей из Н и ОН.
10. Пролекарство по п. 9, где А представляет собой аминоизомасляную кислоту.
11. Пролекарство по п. 1, где R1 представляет собой Н, a R2 выбран из группы, состоящей из Н, С1-С10алкила, С2-С10алкенила, (C1-С10алкил)ОН, (C1-С10алкил)SH, (С2-С3алкил)SCH3, (C1-С4алкил)CONH2, (С1-С4алкил)СООН, (С1-С4алкил)NH2, (C1-С4алкил)NHC(NH2 +)NH2, (С0-С4алкил)(С3-С6циклоалкил), (С0-С4алкил)(С2-С5гетероциклил), (С0-С4алкил)(С6-С10арил)R7, (C1-С4алкил)(С3-С9гетероарил) и С1-С12алкил(W1) С1-С12алкила, где R7 выбран из группы, состоящей из Н и ОН, и где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и О, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют С3-С12циклоалкил; или R2 и R5, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо.
12. Пролекарство по п. 11, где А выбран из группы, состоящей из лизина, цистеина и аланина.
13. Пролекарство по п. 11, где А имеет d-стереохимическую структуру.
14. Пролекарство по п. 1, где Q выбран из группы, состоящей из SEQ ID NN: 1-564, 566-570, 573-575, 577, 579-580, 585-612, 616, 618-632, 634-642, 647, 657-684, 701-732, 742-768, 801-878, 883-919, 1001-1262, 1301-1371, 1401-1518, 1701-1708, 1710, 1711, 1731-1734, 1738, 1740, 1741, 1745 и 1747-1776.
15. Пролекарство по п. 1, дополнительно содержащее гидрофильную группу, ковалентно связанную с указанным пролекарством.
16. Пролекарство по п. 1, которое дополнительно содержит ацильную группу или алкильную группу, ковалентно связанную с указанным пролекарством.
| RU 2011129784 A, 27.01.2013 | |||
| WO 2009099763 A1, 13.08.2009 | |||
| WO 2009095479 A2, 06.08.2009. |
Авторы
Даты
2016-04-10—Публикация
2011-06-14—Подача