Изобретение относится к области медицины, в частности к способу получения фунгицидного материала, представляющего собой стабилизированную липосомальную форму сорбиновой кислоты для лечения грибковых заболеваний различной этиологии, а также для защиты продуктов питания от грибковых заражений.
Каждый год 30-40% пищевых продуктов и фуража в мире поражается микотоксинами грибов с соответствующим влиянием на здоровье человека и экономику. Наиболее распространенными микотоксинами являются aflatoxins, ochratoxins, trichothecenes, zearalenone, которые найдены в ряде продуктов, таких как сухой корм для животных, в злаках, кофе, сыре, фруктах, овощах и т.д. Эта проблема может быть в определенной мере решена при использовании таких ингибиторов роста грибов, как уксусная кислота, пропионовая кислота, сорбиновая кислота и их соли, а также при использовании фосфорорганических и хлорсодержащих пестицидов.
Органические кислоты, подобные сорбиновой кислоте, прекращают рост грибов и снижают возможность биосинтеза микотоксинов путем ингибирования биологических путей превращения (Gareis et al., 1984).
Особый интерес представляет сорбиновая кислота (СК). Она широко используется для улучшения вкуса, баланса рН различных продуктов, например, таких как свежая выпечка, слабоалкогольные напитки, сыры, рыба, фруктовые соки, свежие фрукты и овощи, томатные соки, маргарин, вино, колбасы, морепродукты, шоколадные сиропы.
Сорбиновая кислота (Е200) и ее соли, сорбат калия (Е202), сорбат натрия (Е201) и сорбат кальция (Е203) широко используются как средства против поражения грибками, а также, иногда, как антибактериальные средства (Sofos et al. 1985, Mahjoub and Bullerman 1986, Skrinjar et al. 1995).
В последние десятилетия особое внимание уделяется повышению эффективности лекарственных средств для медицины и ветеринарии путем разработки лекарственных систем, улучшающих их селективность, растворимость, биодеградацию и снижающих побочную токсичность. Наиболее известные из таких систем - липосомальные везикулы из фосфолипидов.
Липосомы являются хорошо известными носителями, и поэтому применение лекарственных средств в липосомальной форме было предметом исследований в течение достаточно продолжительного времени. Обзор введения в легкие лекарств, инкапсулированных в липосомах, при лечении астмы приведен в "Pulmonary delivery of liposomes" (H. Schreier в "Journal of Controlled Release", 24, 1993, p.209-223). В этом обзоре описаны физико-химические характеристики липосомных аэрозолей, а также их введение в дыхательные пути. Лекарства, которые вводились в легкие с помощью липосом, включают, например, противораковые агенты, пептиды, ферменты, противоастматические и антиаллергенные соединения, а также, как упоминалось выше, антибиотики. Состав липосомных аэрозолей или липосомных порошковых аэрозолей при использовании, например, ингалятора для сухих порошков, описан также Н. Schreier в "Formulation and in vitro performance of liposome powder aerosols" (S.T.P. Pharma Sciences 4, 1994, p.38-44).
К настоящему времени известно много препаратов, представляющих собой липосомальные формы лекарственных и биологически активных веществ.
Например, известен препарат (RU 2063770 А1), применяемый в виде ингаляций для лечения гнойно-воспалительных заболеваний легких и содержащий рифампицин в липосомальной форме с размером липосом 150-500 Å. Этот препарат содержит (на 1 флакон) 8 мг рифампицина, 80 мг гентамицина, 35 мг лецитина и 2,5 мг эктерицида. Известен также препарат (CN 1319395), содержащий 1-22% рифампина в липосомальной форме, 1-27% лецитина, 1-18% холестерола и 70-100% дистиллированной воды. Однако способы получения этих препаратов в указанных источниках информации не описано.
Известен способ получения липосомальной формы биологически активных веществ путем детергентного диализа (Грязнова Н.С. и др. Получение липосомальных препаратов различных биологически активных веществ методом детергентного проточного диализа. Журнал "Антибиотики и химиотерапия", 1992, т.37, 7, с.3-5), заключающийся в том, что готовят пленку из смеси яичного фосфатидилхолина, холестерина, стеариновой кислоты и токоферола, взятых в весовых соотношениях 250: 12,5: 5, полученную липидную пленку диспергируют в фосфатном буфере (рН 7,0), содержащем биологически активное вещество и детергент, а затем проводят детергентный диализ на приборе "Liposamate", получая одно- или двухслойные липосомы с диаметром от 35 до 75 нм. Недостатком этого способа является получение липосом с.малым содержанием активного вещества (0,1 мг/мл) и соответственно высокое соотношение вещество-липид. Кроме того, в препарате возможно наличие остаточных количеств детергента.
Наиболее близким решением к предлагаемому является способ получения липосомальной формы биологически активного вещества - рифампицина, изложенный в патенте RU 2223764 С1, когда готовят раствор рифампицина вместе с фосфолипидами в органическом растворителе. Затем растворитель удаляют до получения тонкой пленки, которую диспергируют в водной среде до получения суспензии мультиламелярных везикул с заключенным в них рифампицином. Полученную суспензию гомогенизируют при высоком давлении или продавливают через фильтр под давлением до получения липосом размером 0,1-0,5 мкм. В качестве фосфолипидов берут смесь, содержащую, мас.%: фосфатидилхолина 70-80, остальное - смесь любых других липидов яичного желтка, и/или сои, и/или крупного рогатого скота. Раствор рифампицина совместно с фосфолипидами готовят при соотношении рифампицин: фосфолипиды, равном 1:3-15. В качестве органического растворителя берут преимущественно этанол, в качестве водной среды берут изотонический стерильный раствор NaCl. Растворитель удаляют высушиванием в вакууме при 30-50°С. Гомогенизирование проводят при давлении 5,6×107-6,1×107 Па. Для фильтрации используют ядерный фильтр. Недостатком данного метода является то, что он не устраняет самого главного недостатка липосомальных форм биологически активных веществ - очень низкую стабильность, особенно при длительном хранении.
В предложенном способе технический результат заключается в увеличении стабильности модифицированных липосом при длительном хранении, за счет образования на их поверхности защитного слоя водорастворимого полимера, а также в увеличении антифунгальной активности липосомальной формы биологически активного вещества по сравнению с чистым низкомолекулярным биологически активным веществом, за счет пролонгированного и контролируемого выделения биологически активного вещества при гидролизе полимерного производного этого биологически активного вещества.
Указанный технический результат достигается тем, что в способе получения липосомальной формы биологически активного вещества, готовят раствор фосфолипидов фосфатидилхолина и холестерина мольного соотношения 1:0,1-10 с биологически активным веществом в органическом растворителе, удаляют органический растворитель до получения пленки, диспергируют пленку в водной среде до получения суспензии липидных везикул с включенным в них биологически активным веществом, гомогенизируют суспензию липидных везикул и отделяют липосомы размером не более 300 нм с включенным в них биологически активным веществом.
В качестве биологически активного вещества используют полимерный эфир сорбиновой кислоты (ПЭСК), с молекулярной массой 2000-50000 и коэффициентом полидисперсности 1,05-2,0, который содержит как минимум один фрагмент остатка сложного эфира сорбиновой кислоты и как минимум один фрагмент сополимера N-винилпирролидона и аллилглицидилового эфира. В свою очередь, сополимер N-винилпирролидона и аллилглицидилового эфира с молекулярной массой 2000-50000, состоит из звеньев N-винилпирролидона и аллилглицидилового эфира в мольном соотношении 1-10:1. Химическое строение используемого полимерного эфира сорбиновой кислоты представлено:
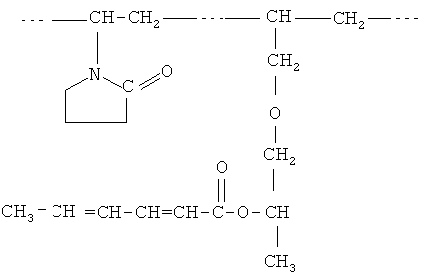
Раствор полимерного эфира сорбиновой кислоты совместно с фосфолипидами готовят при массовой доле полимерного эфира сорбиновой кислоты относительно смеси фосфолипидов, равной 0,5-20%.
В качестве органического растворителя используют этанол.
Органический растворитель удаляют отгонкой на роторном испарителе при пониженном давлении и температуре 30-60°С.
В качестве водной среды для диспергирования пленки используют буферный раствор с концентрацией 0,001-1 моль/л и рН равным 6-10.
Гомогенизацию проводят с помощью обработки ультразвуком с частотой 15-30 кГц в течение 180-300 секунд.
Отделение липосом проводят с помощью гельпроникающей хроматографии.
Сущность предлагаемого способа иллюстрируется следующими примерами конкретного осуществления.
Пример 1. В спиртовом растворе смеси фосфолипидов фосфатидилхолина и холестерина состава 2:1 (мольное соотношение) (5 г/100 мл этанола) растворили 0,025 г полимерного эфира сорбиновой кислоты (сополимера N-винилпирролидона и аллилглицидилового эфира в мольном соотношении 2:1, содержащего сорбиновую кислоту, химически связанную с эфирной группой аллилглицидилового эфира) (0,5 мас.%) с молекулярной массой 2500 и коэффициентом полидисперсности 1,2. Затем этанол отогнали на роторном испарителе Rotavapor (Buchi, Швейцария) при 55°С до получения тонкой пленки. Полученную пленку диспергировали в 0,07М фосфатном буфере (рН 6,7) в течение 2 часов до полного перехода высушенных веществ в водную фазу. На полученную однородную эмульсию воздействовали ультразвуком частоты 15 кГц в течение 240 секунд, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы размером не более 300 нм отделили от низкомолекулярных ингредиентов, используя гельпроникающую хроматографию - Sephadex G-25. Для дальнейших исследований с целью подтверждения технического результата полученному образцу липосом был присвоен шифр Лип-ПЭСК-0.5.
Пример 2. В спиртовом растворе смеси фосфолипидов фосфатидилхолина и холестерина состава 7:3 (мольное соотношение) (5 г/100 мл этанола) растворили 0,5 г полимерного эфира сорбиновой кислоты (сополимера N-винилпирролидона и аллилглицидилового эфира в мольном соотношении 1:1, содержащего сорбиновую кислоту, химически связанную с эфирной группой аллилглицидилового эфира) (10 мас.%) с молекулярной массой 10000 и коэффициентом полидисперсности 1,6. Затем этанол отогнали на роторном испарителе Rotavapor (Buchi, Швейцария) при 35°С до получения тонкой пленки. Полученную пленку диспергировали в 0,01 М боратном буфере (рН 9,2) в течение 2 часов до полного перехода высушенных веществ в водную фазу. На полученную однородную эмульсию воздействовали ультразвуком частоты 22 кГц в течение 180 секунд, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы размером не более 300 нм отделили от низкомолекулярных ингредиентов, используя гельпроникающую хроматографию - Sephadex G-25. Для дальнейших исследований с целью подтверждения технического результата полученному образцу липосом был присвоен шифр Лип-ПЭСК-10.
Пример 3. В спиртовом растворе смеси фосфолипидов фосфатидилхолина и холестерина состава 3:1 (мольное соотношение) (5 г/100 мл этанола) растворили 1 г полимерного эфира сорбиновой кислоты (сополимера N-винилпирролидона и аллилглицидилового эфира в мольном соотношении 1:1, содержащего сорбиновую кислоту, химически связанную с эфирной группой аллилглицидилового эфира) (20 мас.%) с молекулярной массой 40000 и коэффициентом полидисперсности 1,8. Затем этанол отогнали на роторном испарителе Rotavapor (Buchi, Швейцария) при 45°С до получения тонкой пленки. Полученную пленку диспергировали в 1М фосфатном буфере (рН 7,4) в течение 2 часов до полного перехода высушенных веществ в водную фазу. На полученную однородную эмульсию воздействовали ультразвуком частоты 30 кГц в течение 300 секунд, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы размером не более 300 нм отделили от низкомолекулярных ингредиентов, используя гельпроникающую хроматографию - Sephadex G-25. Для дальнейших исследований с целью подтверждения технического результата полученному образцу липосом был присвоен шифр Лип-ПЭСК-20.
Для подтверждения достижения технического результата, предусмотренного предложенным способом получения липосомальной формы биологически активного вещества (полимерного эфира сорбиновой кислоты), были изучены антифунгальная активность полученных липосом в сравнении с чистой сорбиновой кислотой, а также стабильность полученных образцов липосом при длительном хранении по сравнению с «чистыми» липосомами, не содержащими полимерный эфир сорбиновой кислоты.
Антифунгальную активность полученных образцов липосом определяли по отношению к культуре гриба Fusarium oxysporum методом «бумажный диск». Сущность этого метода заключается в нанесении на бумажный диск, помещенный на поверхность агаровой среды с тестируемым образцом гриба, исследуемого раствора фунгицида и наблюдении скорости радиального роста гриба в этих условиях.
Антифунгальную активность(АА) оценивали по формуле: АА(%)=100 - диаметр колонии образца/диаметр колонии стандарта ×100 %.
Эксперименты проводились при 25°С в течение 7 дней, рН среды 6.4. Каждое приведенное значение является средним арифметическим двух параллельных экспериментов. Для сравнения измерялась АА чистой сорбиновой кислоты в той же концентрации, что и в полученных образцах липосом.
В таблице 1 приведены данные, которые подтверждают, что антифунгальная активность липосом, модифицированных полимерным эфиром сорбиновой кислоты, выше, чем антифунгальная активность низкомолекулярной сорбиновой кислоты, при одинаковом содержании фунгицида в сравниваемых образцах.
Стабильность полученных образцов липосом при длительном хранении определяли, измеряя их средний размер в нм методом динамического светорассеяния. При этом стабильность липосом заключается в сохранении в течение долгого времени их среднего размера, измеренного сразу после получения образов липосом (отсутствие слипания, агрегации и разрушения липосом, сопровождающихся сильным увеличением размера липосом). Для сравнения использовали «чистые» липосомы такого же липидного состава, но не содержащие полимерного эфира сорбиновой кислоты.
В таблице 2 приведены данные, согласно которым после 12 месяцев хранения при температуре +25°С размеры полученных липосом, содержащих полимерный эфир сорбиновой кислоты не изменяются, тогда как образцы «чистых» липосом подвергаются сильной агрегации частиц с увеличением их среднего размера, что говорит о низкой стабильности таких «чистых» липосом. На основе полученных данных можно сделать вывод, что фунгицидный материал на основе липосом, модифицированных полимерным производным сорбиновой кислоты, стабилен при хранении как минимум в течение 1 года.
Таким образом, предлагаемый способ получения фунгицидного материала позволяет получить стабильные при хранении липосомы размером до 300 нм, содержащие полимерный эфир сорбиновой кислоты и вследствие этого обладающие противогрибковой активностью. Полученный таким способом фунгицидный материал обладает более высокой антифунгальной активностью по сравнению с низкомолекулярной сорбиновой кислотой и более высокой стабильностью по сравнению с немодифицированными «чистыми» липосомами. Кроме того, полученный по данному способу фунгицидный материал стабилен при длительном хранении даже при комнатной температуре.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФУНГИЦИДНЫЙ МАТЕРИАЛ ДЛЯ ПИЩЕВЫХ И СЕЛЬСКОХОЗЯЙСТВЕННЫХ ПРОДУКТОВ | 2010 |
|
RU2432741C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМАЛЬНОЙ ФОРМЫ РИФАМПИЦИНА | 2002 |
|
RU2223764C1 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНИТОЧУВСТВИТЕЛЬНЫХ ЛИПОСОМ | 2007 |
|
RU2357724C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМБИНИРОВАННОГО ЛИПОСОМАЛЬНОГО АНТИБАКТЕРИАЛЬНОГО ПРЕПАРАТА | 2008 |
|
RU2376012C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАПСУЛИРОВАННОЙ ФОРМЫ ПРОТИВОТУБЕРКУЛЕЗНЫХ ПРЕПАРАТОВ РИФАМИЦИНОВОГО РЯДА | 2009 |
|
RU2420287C1 |
| ФОСФОЛИПИДНАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2448731C2 |
| СПОСОБ ПОЛУЧЕНИЯ СИСТЕМЫ ДОСТАВКИ ВОДОНЕРАСТВОРИМЫХ И ПЛОХОРАСТВОРИМЫХ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ И ЛЕКАРСТВЕННАЯ ФОРМА НА ЕЕ ОСНОВЕ | 2006 |
|
RU2325151C2 |
| ЛИПОСОМАЛЬНОЕ СРЕДСТВО НА ОСНОВЕ УБИХИНОЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2605616C1 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2476216C1 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2514000C1 |
Изобретение относится к области медицины и фармацевтики, а именно к способу получения фунгицидного материала, представляющего собой стабилизированную липосомальную форму сорбиновой кислоты для лечения грибковых заболеваний различной этиологии, а также для защиты продуктов питания от грибковых заражений. В качестве биологически активного вещества используют полимерный эфир сорбиновой кислоты (ПЭСК) с молекулярной массой 2000-50000 и коэффициентом полидисперсности 1,05-2,0, который содержит как минимум один фрагмент остатка сложного эфира сорбиновой кислоты и как минимум один фрагмент сополимера N-винилпирролидона и аллилглицидилового эфира. Способ позволяет увеличить стабильность получаемых липосом при длительном хранении, а также увеличить антифунгальную активность липосомальной формы биологически активного вещества по сравнению с чистым низкомолекулярным биологически активным веществом. 7 з.п. ф-лы, 3 пр., 2 табл.
1. Способ получения липосомальной формы биологически активного вещества, включающий приготовление раствора фосфолипидов фосфатидилхолина и холестерина с биологически активным веществом в органическом растворителе, удаление органического растворителя до получения пленки, диспергирование пленки в водной среде до получения суспензии липидных везикул с включенным в них биологически активным веществом, гомогенизацию суспензии липидных везикул и отделение липосом размером не более 300 нм с включенным в них биологически активным веществом, отличающийся тем, что фосфолипиды фосфатидилхолин и холестерин смешиваются в мольном соотношении 1:0,1-10, а в качестве биологически активного вещества используют полимерный эфир сорбиновой кислоты с молекулярной массой 2000-50000 и коэффициентом полидисперсности 1,05-2,0, который содержит как минимум один фрагмент остатка сложного эфира сорбиновой кислоты и как минимум один фрагмент сополимера N-винилпирролидона и аллилглицидилового эфира с молекулярной массой 2000-50000.
2. Способ по п.1, отличающийся тем, что раствор полимерного эфира сорбиновой кислоты совместно с фосфолипидами готовят при массовом содержании полимерного эфира сорбиновой кислоты относительно фосфолипидов, равном 0,5-20 мас.%.
3. Способ по п.1, отличающийся тем, что в качестве органического растворителя используют этанол.
4. Способ по п.1, отличающийся тем, что органический растворитель удаляют отгонкой на роторном испарителе при пониженном давлении и температуре 30-60°С.
5. Способ по п.1, отличающийся тем, что в качестве водной среды для диспергирования пленки используют буферный раствор с концентрацией 0,001-1 моль/л и рН, равным 6-10.
6. Способ по п.1, отличающийся тем, что гомогенизацию проводят с помощью обработки ультразвуком с частотой 15-30 кГц в течение 180-300 с.
7. Способ по п.1, отличающийся тем, что отделение липосом проводят с помощью гельпроникающей хроматографии.
8. Способ по п.6, отличающийся тем, что сополимер N-винилпирролидона и аллилглицидилового эфира состоит из звеньев N-винилпирролидона и аллилглицидилового эфира в мольном соотношении 1-10:1.
| УСОВЕРШЕНСТВОВАННЫЙ ПРЕПАРАТ ДЛЯ МЕСТНОГО НЕИНВАЗИВНОГО ПРИМЕНЕНИЯ in vivo | 1998 |
|
RU2207844C2 |
| RU 2010110203 A, 27.09.2011 | |||
| Супрун О.В | |||
| Полимерные комплексы сорбиновой кислоты и их антифунгальное действие | |||
| Автореферат диссертации на соискание ученой степени кандидата химических наук | |||
| - М.: РХТУ им | |||
| Д.И | |||
| Менделеева, 2006, 19 с | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
Авторы
Даты
2013-03-20—Публикация
2011-12-22—Подача