Область техники, к которой относится изобретение
В настоящем изобретении описаны композиции для местного применения, которые содержат дезфторхинолоновое соединение.
Уровень техники
Несмотря на успехи антимикробной терапии в течение последних 20 лет, возрастает доля инфекций, вызываемых грамположительными организмами с множественной лекарственной устойчивостью, которые являются основными патогенами в первично неосложненных кожных инфекциях и инфекциях кожных структур (импетиго, фолликулит, фурункулез, акне, вторично инфицированные травматические повреждения, вторично инфицированные дерматозы и вторично инфицированные ожоги). Недавно описано повышение уровня внебольничных инфекций метициллиноустойчивого Staphylococcus aureus (MRSA) и возникновение плазмидной устойчивости к мупироцину также среди MRSA. Озеноксацин представляет собой новое нефторированное хинолоновое соединение, которое продемонстрировало высокий уровень активности в отношении грамположительных организмов, включая распространенные устойчивые к хинолону бактерии. Озеноксацин, вследствие своего двунаправленного механизма действия, активен в отношении ряда устойчивых мутантных штаммов. Таким образом озеноксацин является хорошим потенциальным антибактериальным препаратом для преодоления существующих в настоящее время механизмов устойчивости к антибиотикам вследствие своей высокой активности в отношении устойчивых грамположительных бактерий.
Озеноксацин активен в отношении большого числа патогенов, таких как Propionibacterium acnes, Staphylococcus aureus, метициллиночувствительный Staphylococcus aureus (MSSA), метициллиноустойчивый Staphylococcus aureus (MRSA), включая штаммы, устойчивые к ципрофлоксацину, метициллиночувствительный Staphylococcus epidermidis (MSSE), метициллиноустойчивый Staphylococcus epidermidis (MRSE), Streptococcus pyogenes, стрептококки группы G, пенициллиноустойчивый Streptococcus pneumoniae, положительный по β-лактамазе Haemophilus influenzae, нетипируемые штаммы Haemophilus influenzae, положительная по β-лактамазе Moraxella catarrhalis, Neisseria meningitides, Legionella pneumophila, Mycoplasma pneumoniae, Legionella pneumophila, Mycobacterium tuberculosis, Streptococcus agalactiae группы В, Neisseria gonorrhoeae, Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum, Helicobacter pylori, Bacteroides fragilis, Clostridium perfringens, Escherichia coli, хинолонустойчивая Escherichia coli, Salmonella spp., Shigella spp., ципрофлоксациночувствительный Pseudomonas aeruginosa, Clostridium difficile и Listeria monocytogenes.
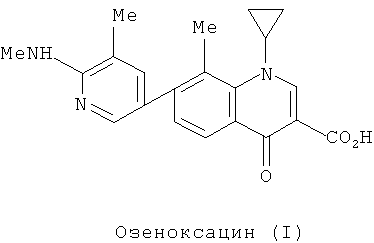
Озеноксацин (I) впервые описан в патенте US6335447 и патентах-аналогах. Его химическое название 1-циклопропил-8-метил-7-[5-метил-6-(метиламино)-3-пиридинил]-4-оксо-1,4-дигидро-3-хинолинкарбоновая кислота. Его химическая формула представляет собой:
Местное применение антимикробных препаратов представляет собой эффективный инструмент для лечения кожных инфекций и инфекций кожных структур, заболеваний, передаваемых половым путем, и инфекций половых путей, а также ряда системных инфекций, чувствительных к местному лечению. Местная антимикробная терапия обладает некоторыми потенциальными преимуществами по сравнению с системной терапией. Во-первых, она может избежать необязательного воздействия кишечной флоры, которое может приводить к селекции на устойчивость. Во-вторых, ожидают, что высокая местная концентрация лекарственного препарата при местном применении и незначительное системное всасывание должны подавлять множество форм мутационной устойчивости. В-третьих, менее вероятно, что местное применение по сравнению с системным лечением вызывает побочные эффекты. Соответственно, некоторые местные композиции, содержащие озеноксацин, описаны в области техники.
JP2002356426A раскрывает мази и гели для кожи. Мазь, содержащая озеноксацина 1 мас.%, N-метил-2-пирролидона 8 мас.%, пропиленгликоля 14,9 мас.%, олеиновой кислоты 0,9 мас.%, диизопропаноламина 2,3 мас.%, полиэтиленгликоля 400 20,2 мас.%, полиэтиленгликоля 4000 50,2 мас.% и воды 3,2 мас.%, описана в примере 2.
JP2003226643A раскрывает водные растворы, содержащие озеноксацин, циклодекстрин и компонент, придающий вязкость.
ЕР1731138А1 раскрывает жидкую дисперсию тонких частиц, содержащую озеноксацин, которая предназначена для применения при изготовлении фармацевтических композиций.
WO2007015453A1 раскрывает лосьоны, содержащие озеноксацин.
JP2007119456A раскрывает водные суспензии, содержащие наночастицы и растворимые гранулы озеноксацина, предназначенные для применения при изготовлении фармацевтических композиций. Преимущественно упоминают глазные растворы.
Комбинированное использование озеноксацина, ионов магния и гидроксипропил-β-циклодекстрина, в частности, для глазного применения, описано в статье Yamakawa, Т. et al., Journal of Controlled Release (2003), 86(1), 101-103.
Полутвердые композиции для местного применения представляют собой эффективные альтернативы жидким композициям, поскольку ими легче манипулировать и в результате они предпочтительны для пациентов. Однако, несмотря на большое разнообразие компонентов, присутствующих в полутвердых композициях, раскрытых в области техники, не имеется никаких количественных исследований их стабильности. Таким образом, существует потребность в испытанных стабильных полутвердых композициях для местного применения, содержащих озеноксацин в качестве активного ингредиента, для которых удостоверены микробиологическая и терапевтическая активность, поскольку показана устойчивая и длительная фармацевтическая стабильность.
Раскрытие изобретения
Соответственно, объект настоящего изобретения относится к фармацевтическим стабильным полутвердым композициям для местного применения, содержащим от 0,2 до 5 мас.% композиции озеноксацина и носитель, подходящий для изготовления мази или крема. Предпочтительно, когда количество озеноксацина составляет от 0,5 мас.% до 2 мас.%, и более предпочтительно составляет 1 мас.%. В настоящем изобретении все проценты выражают в массовых процентах, пока не определено иначе.
Согласно настоящему изобретению, предусматривают мазь, в которой подходящий носитель выбран из белого воска, бесцветного мягкого парафина и их смесей. Бесцветный мягкий парафин является предпочтительным.
Согласно настоящему изобретению, предусматривают крем, в котором подходящий носитель содержит смесь эмульгаторов, поверхностно-активных веществ, восков с низкой температурой плавления, диспергирующихся в воде компонентов и консервантов, не выделяющих формальдегид.
Соответственно, настоящее изобретение предусматривает крем, содержащий
a) 0,2÷5 мас.% озеноксацина и
b) подходящий носитель, содержащий:
b.1) 15÷25 мас.% одного или более эмульгаторов;
b.2) 10÷20 мас.% одного или более поверхностно-активных
веществ;
b.3) 5÷15 мас.% масляного компонента;
b.4) 1÷10 мас.% одного или более восков с низкой температурой плавления, выбранных из жирных кислот с 8-30 атомами углерода, жирных спиртов с 8-30 атомами углерода сложных эфиров жирных кислот с 8-30 атомами углерода, амидов жирных кислот с 8-30 атомами углерода, силиконовых восков и их смесей;
b.5) воду;
b.6) 10÷20 мас.% одного или более диспергирующихся в воде компонентов, выбранных из полиэтиленгликоля 400, гексиленгликоля, пропиленгликоля, эфира метилглюкозы и полипропиленгликоля 10, этоксидигликоля, полиэтиленгликоль 6 глицерида каприловой/каприновой кислоты, монобутилового эфира этиленгликоля, полиэтиленгликоль 8 глицеридов каприловой/каприновой кислоты, 3-метокси-3-метил-1-бутанола, диметилизосорбида и их смесей и
b.7) 0,01÷1 мас.% одного или более консервантов, не образующих формальдегид;
причем количество компонента b.5 представляет собой количество, дополняющее композицию до 100 мас.%, и все проценты являются мас.% и основаны на общей массе композиции.
Согласно одному из вариантов осуществления, настоящее изобретение предусматривает крем, в котором носитель содержит:
18÷22 мас.% компонента b.1;
13÷15 мас.% компонента b.2;
7÷9 мас.% компонента b.3;
3÷5 мас.% компонента b.4;
компонент b.5;
13÷17 мас.% компонента b.6;
0,05÷0,15 мас.% компонента b.7;
причем количество компонента b.5 представляет собой количество, дополняющее композицию до 100 мас.%.
Согласно следующему варианту осуществления, настоящее изобретение предусматривает крем, в котором носитель содержит:
20 мас.% компонента b.1;
14 мас.% компонента b.2;
8 мас.% компонента b.3;
4 мас.% компонента b.4;
компонент b.5;
15 мас.% компонента b.6;
0.1 мас.% компонента b.7;
причем количество компонента b.5 представляет собой количество, дополняющее композицию до 100 мас.%.
Согласно следующему варианту осуществления количество воды в носителе составляет 30÷45 мас.%.
В настоящем изобретении эмульгаторы выбраны из этиленгликольмоностеарата, сорбиттристеарата, смеси ПЭГ6 стеарата, гликольстеарата и ПЭГ32 стеарата, а также гидрированного лецитина и их смесей, предпочтительно, когда эмульгаторы представляют собой смесь ПЭГ6 стеарата, гликольстеарата и ПЭГ32 стеарата.
В настоящем изобретении поверхностно-активные вещества выбраны из сорбитолеатмоноолеин/пропиленгликоля, моно- и диглицеридов C8/C10 жирных кислот из кокосового масла, соевого лецитина, яичных фосфатидов, сложных эфиров моноглицеридов и лимонной кислоты, сложных эфиров моноглицеридов и молочной кислоты, сложных эфиров моноглицеридов и диацетилвинной кислоты, сложных эфиров моноглицеридов и янтарной кислоты, сложных эфиров сахарозы и жирных кислот, полигликолизированных глицеридов олеиновых кислот, полигликолизированных глицеридов линоленовой кислоты, сложных полиглицериновых эфиров жирных кислот, включая жирные кислоты как с длинной, так и со средней цепью и сложных полиглицериловых эфиров смешанных жирных кислот и их смесей. Предпочтительно, когда поверхностно-активные вещества представляют собой полигликолизированные глицериды олеиновых кислот.
В настоящем изобретении масляные компоненты выбраны из спиртов Гербе с основой из жирных спиртов, содержащих 8-10 атомов углерода, сложных эфиров С6-22 неразветвленных жирных кислот с неразветвленными или разветвленными С6-22 жирными спиртами, сложных эфиров разветвленных С6-13 карбоновых кислот с неразветвленными или разветвленными С6-22 жирными спиртами, сложных эфиров неразветвленных С6-22 жирных кислот с 2-этилгексанолом, сложных эфиров С3-38 алкилгидроксикарбоновых кислот с неразветвленными или разветвленными С6-22 жирными спиртами, сложных эфиров неразветвленных или разветвленных жирных кислот с полигидроспиртами или спиртами Гербе, триглицеридов на основе С6-10 жирных кислот, жидких смесей моно-, ди- и триглицеридов на основе С6-18 жирных кислот, сложных эфиров С6-22 жирных спиртов или спиртов Гербе с бензойной кислотой, сложных эфиров С2-12 дикарбоновых кислот с неразветвленными или разветвленными спиртами, содержащими 1-22 атома углерода, или полиолами, содержащими 2-10 атомов углерода и 2-6 гидроксильных групп, растительных масел, разветвленных первичных спиртов, замещенных циклогексанов, неразветвленных и разветвленных карбонатов С6-22 жирных спиртов, карбонатов Гербе на основе жирных спиртов, содержащих 8-10 атомов углерода, сложных эфиров бензойной кислоты с неразветвленными или разветвленными С6-22 спиртами, неразветвленными или разветвленными, симметричными или асимметричными диалкиловыми эфирами, содержащие 6-22 атома углерода на алкильную группу, открывающие цикл продукты сложных эфиров эпоксидированных жирных кислот с полиолами, силиконовых масел и алифатических или нафтеновых углеводов и их смесей. Предпочтительно, когда масляные компоненты представляют собой спирты Гербе на основе жирных спиртов, содержащих 8-10 атомов углерода, такие как 2-октилдодеканол (Eutanol® G РН).
Поскольку они являются первичными, разветвленными и имеют высокую молекулярную массу, спирты Гербе обладают низкой потенциальной возможностью вызывать раздражение, представляют собой жидкость до чрезвычайно низких температур и имеют низкую летучесть, эффективны в качестве пережиренных компонентов и являются хорошими смазывающими веществами.
В настоящем изобретении воска с низкой температурой плавления выбраны из жирных кислот из 8-30 атомов углерода, жирных спиртов из 8-30 атомов углерода, сложных эфиров жирных кислот из 8-30 атомов углерода, амидов жирных кислот из 8-30 атомов углерода, силиконовых восков и их смесей.
Предпочтительно, когда воска с низкой температурой плавления являются жирными спиртами из 8-30 атомов углерода. Более предпочтительно, когда из жирных спиртов выбирают стеариловый спирт.
Вследствие характеристик, обусловливающих консистенцию, стеариловый спирт действует как удобный регулятор вязкости.
В настоящем изобретении диспергирующиеся в воде компоненты выбраны из полиэтиленгликоля 400, гексиленгликоля, пропиленгликоля, эфира метилглюкозы и полипропиленгликоля 10, этоксидигликоля, полиэтиленгликоль 6 глицерида каприловой/каприновой кислоты, монобутилового эфира этиленгликоля, полиэтиленгликоль 8 глицеридов каприловой/каприновой кислоты, 3-метокси-3-метил-1-бутанола, диметилизосорбида и их смесей. Предпочтительно, когда диспергирующийся в воде компонент представляет собой пропиленгликоль.
В настоящем изобретении консерванты, не образующие формальдегид, выбраны из бензоата аммония, пропионата аммония, бензизотиазолинона, бензойной кислоты, бензотриазола, бензилового спирта, бензилпарабена, 5-бром-5-нитро-1,3-диоксана, 2-бром-2-нитропропан-1,3-диола, бутилбензоата, бутилпарабена, бензоата кальция, парабена кальция, пропионата кальция, салицилата кальция, сорбата кальция, хлоргексидиндиацетата, хлоргексидиндиглюконата, хлоргексидиндигидрохлорида, хлорацетамида, хлорбутанола, п-хлор-м-крезола, хлорофена, п-хлорфенола, хлорфенезина, хлортимола, хлороксенола, м-крезола, о-крезола, п-крезола, дегидроуксусной кислоты, дибромпропамидин диизетионата, диметилоксазолидина, дитиометилбензамида, домефена, этилферулата, этилпарабена, феруловой кислоты, глиоксаля, гексамидина, гексамидиндипарабена, гексамидинпарабена, 4-гидроксибензойной кислоты, гидроксиметилдиоксоазабициклооктана, йодопропинилбутиларбамата, изобутилпарабена, изодецилпарабена, изопропилкрезолов, изопропилпарабена, изопропилсорбата, лаурилдиэтилендиаминоглицина HCl, бензоата магния, пропионата магния, метил-хлоризотиазолинона, метилпарабена, октилизотиазолинона, бензоат пантенилэтилового эфира, фенетилового спирта, фенола, феноксиэтанола, феноксиэтилпарабена, феноксиизопропанола, фенилбензоата, фенилпарабена, о-фенилфенола, полиметоксибициклического оксазолидина, бензоата калия, бутилпарабена калия, этилпарабена калия, метилпарабена калия, парабена калия, феноксида калия, пропионата калия, пропилпарабена калия,сорбата калия, пропионовой кислоты, пропилбензоата, пропилпарабена, кватерниума-8 (метил- и стеарилдиметиламиноэтилметакрилат, кватернизированный (переведенный в четвертичную форму) диметилсульфатом), кватерниума-14 (этанаминий, N,N,N-триметил-2-[(2-метил-1-оксо-2-пропенил)окси]-, метилсульфат, гомополимер), кватерниума-15 (этанаминий, N,N,N-триметил-2-[(2-метил-1-оксо-2-пропенил)окси]-хлорид, полимер с 2-пропенамидом), бензоата натрия, бутилпарабена натрия, натрий п-хлор-м-крезола, дегидроацетата натрия, этилпарабена натрия, формиата натрия, гидроксиметансульфоната натрия, гидроксиметилглицината натрия, изобутилпарабена натрия, изопропилпарабена натрия, лаурилдиэтилендиаминглицината натрия, метилпарабена натрия, парабена натрия, фенилсульфоната натрия, феноксида натрия, о-фенилфената натрия, пропионата натрия, пропилпарабена натрия, сорбата натрия, сорбиновой кислоты, ТЕА-сорбата (триэтаноламинсорбата), тионтола (2,7-диметил-тиантрена), триклокарбана, триклозана и ундециленоил ПЭГ5 парабена (сложного эфира ундециленовой кислоты и ПЭГ5 парабена) и их смесей. Предпочтительно, когда консервант, не образующий формальдегид, представляет собой бензойную кислоту.
Другим объектом настоящего изобретения является применение композиций, соответствующих настоящему изобретению, при лечении или предупреждении (профилактике) кожных инфекций и инфекций кожных структур у человека или животного. Соответственно, настоящее изобретение предусматривает использование мазей и кремов, соответствующих настоящему изобретению, при лечении или профилактике кожных инфекций и инфекций кожных структур, причем неограничивающими примерами данных кожных инфекций и инфекций кожных структур являются импетиго, фолликулит, фурункулез, акне, вторично инфицированные травматические повреждения, вторично инфицированные дерматозы и вторично инфицированные ожоги, а также те кожные инфекции и инфекции кожных структур, которые вызывают метициллиночувствительный Staphylococcus aureus (MSSA), метициллиноустойчивый Staphylococcus aureus (MRSA), включая штаммы, устойчивые к ципрофлоксацину, метициллиночувствительный Staphylococcus epidermidis (MSSE), метициллиноустойчивый Staphylococcus epidermidis (MRSE), Streptococcus pyogenes и стрептококки группы G.
Другим объектом настоящего изобретения является применение новых композиций при лечении или предупреждении заболеваний, передаваемых половым путем, и инфекции половых путей у человека или животного. Соответственно, настоящее изобретение предусматривает применение мазей и кремов, соответствующих настоящему изобретению, при лечении или профилактике заболеваний, передаваемых половым путем, и инфекции половых путей, таких как вызываемые Streptococcus agalactiae группы В, Neisseria gonorrhoeae, Chlamydia trachomatis, Mycoplasma hominis и Ureaplasma urealyticum.
Другим объектом настоящего изобретения является применение новых композиций для борьбы с инфекциями носоглотки у бессимптомных назальных носителей у человека или животного. Соответственно, настоящее изобретение предусматривает применение мазей и кремов, соответствующих настоящему изобретению, для борьбы с инфекциями носоглотки у бессимптомных назальных носителей, причем инфекций, вызываемых метициллиночувствительным Staphylococcus aureus (MSSA), метициллиноустойчивым Staphylococcus aureus (MRSA), включая штаммы, устойчивые к ципрофлоксацину, пенициллиноустойчивым Streptococcus pneumoniae, положительным по β-лактамазе Haemophilus influenzae, нетипируемыми штаммами Haemophilus influenzae, положительной по β-лактамазе Moraxella catarrhalis, Neisseria meningitides, Legionella pneumophila, Mycoplasma pneumoniae, Legionella pneumophila и Mycobacterium tuberculosis.
Композиции, соответствующие настоящему изобретению, можно использовать путем непосредственного нанесения на пораженную или требующую защиты кожу или область половых органов. Кроме того, композиции можно использовать путем введения в полость носа, предпочтительно в носоглотку, в частности, переднюю часть носоглотки.
Кроме того, композиции, соответствующие настоящему изобретению, можно использовать для лечения кожных инфекций и инфекций кожных структур, заболеваний, передающихся половым путем, и инфекций половых путей, и для борьбы с инфекциями носоглотки у бессимптомных назальных носителей, когда данные инфекции устойчивы к обычным антибиотикам для местного применения, например, к мупироцину, фузидиевой кислоте, ретапамулину и хинолоновым соединениям, т.е. надифлоксацину.
Другим объектом настоящего изобретения является разработка новых способов лечения или предупреждения кожных инфекций и инфекций кожных структур у человека или животного, нуждающихся во введении композиций, соответствующих настоящему изобретению.
Другим объектом настоящего изобретения является разработка новых способов лечения или предупреждения заболеваний, передающихся половым путем, и инфекций половых путей у человека или животного, нуждающихся во введении композиций, соответствующих настоящему изобретению.
Другим объектом настоящего изобретения является разработка новых способов борьбы с инфекциями носоглотки у бессимптомных назальных носителей у человека или животного, нуждающихся во введении композиций, соответствующих настоящему изобретению.
Композиции, соответствующие изобретению, можно эффективно и безопасно использовать без клинически значимых дерматологических или системных вредных событий, поскольку всасывание кожей озеноксацина незначительно.
На протяжении описания и формулы изобретения слово "содержит" и варианты данного слова, например "содержащий", не предусматривают исключение других технических признаков, добавок, компонентов или стадий. Дополнительные объекты, преимущества и признаки изобретения будут очевидны компетентным специалистам в области техники на основании изучения описания или могут быть выяснены при практической реализации изобретения. Следующие примеры представлены в виде иллюстрации и не предназначены для ограничения настоящего изобретения.
Осуществление изобретения
Пример 1. Мазь, содержащая 1 мас.% озеноксацина
а) 100 г композиции
b) Изготовление
Бесцветный мягкий парафин (99 часть) растапливают до однородности при 70-75°С в реакторе соответствующего объема для изготовления партии, снабженном низкоскоростной мешалкой (якорная мешалка) и высокоскоростной мешалкой и системой нагревания и охлаждения. Парафин охлаждают до 50-55°С. Добавляют озеноксацин (1 часть) и диспергируют в парафине перемешиванием. Конечную дисперсию охлаждают до 25-30°С. Получают однородную бледно-желтую мазь с маслянистой основой. Конечную мазь упаковывают в алюминиевые тюбики объемом 20 мл при использовании автоматической системы.
c) Стабильность
Инертная природа носителя в виде жидкого парафина гарантирует, что мазь можно стабильно хранить в течение по меньшей мере 18 месяцев.
Пример 2. Крем, содержащий 1% озеноксацина
а) 100 г композиции
b) Изготовление
1. Пропиленгликоль (15 частей) и воду (37,9 частей) добавляют в реактор для полутвердых составов соответствующего объема.
2. Смесь нагревают при 70-75°С при низкоскоростном перемешивании.
3. Смесь Tefose® 63 (20 частей), Labrafil® М 1944 CS (14 частей), Lanette® 18 (4 частей) и бензойной кислоты (0,1 часть) расплавляют при 70-75°С в стеклянном/алюминиевом стакане соответствующего объема при низкоскоростном перемешивании.
4. Конечную смесь, полученную на стадии 3 (органическая фаза), добавляют в реактор с полутвердым составом. Смесь перемешивают при низкой скорости с помощью якорной мешалки и при высокой скорости с помощью высокоскоростного смесителя со сдвигом в течение 5 минут.
5. Смесь Eutanol® G РН (8 частей) и озеноксацина (1 часть) добавляют в стеклянный стакан соответствующего объема, снабженный соответствующей мешалкой. Смесь нагревают при 50-55°С при перемешивании.
6. Суспензию, полученную на стадии 5, добавляют к эмульсии, полученной на стадии 4, и перемешивают при низкой скорости с помощью якорной мешалки и при высокой скорости с помощью высокоскоростного смесителя со сдвигом в течение 20 минут.
7. Температуре полученного в результате крема дают опуститься до 25-30°С, прекращая нагревание. Проверяют однородность массы.
8. Конечный крем упаковывают в алюминиевые тюбики объемом 20 мл с крышкой из полиэтилена высокой плотности при использовании автоматической системы.
с) Стабильность
В таблицах 1-12 суммируют результаты исследований стабильности, проведенные с некоторыми опытными партиями.
Пример 3. Антибактериальная активность мази, содержащей 1 мас.% озеноксацина
а) Ход эксперимента
Антибактериальную активность оценивают на модели инфекции, состоящей из кожной раны, инфицированной Staphylococcus aureus (АТСС 6538), у мышей после местного нанесения мази, соответствующей Примеру 1.
Самцов мышей CD-1 (45 животных) массой тела 22-27 г в начале лечения помещают в стандартные лабораторные условия (температура 22±1°С и относительная влажность 65±10%; 12-часовое освещение (7:00-19:00/12 - часовой темновой цикл).
Для того чтобы инфицировать шовные нити, их погружают на 30 минут в суточный бульон S. aureus в концентрации 108 КОЕ (колониеобразующие единицы)/мл, предварительно подведенный в соответствии с данными спектрофотометрии.
Нити вынимают и оставляют сушиться на фильтровальной бумаге. Из каждой шовной нити вырезают два отрезка длиной 1 см, и каждый отрезок взбалтывают в пробирке с 1 мл 0,2 мас.% дрожжевого экстракта. Делают разведения данных бульонов и переносят в двух повторностях и параллельно на агар с дефицитом цистина-лактозы-электролитов (CLED) для определения концентрации на шовных нитях. Остаток шовной нити хранят в холодильнике до использования.
За день до начала эксперимента животных бреют и проводят удаление шерсти с использованием коммерческого крема-депилатория.
Мышей случайным образом распределяют по трем группам, состоящим из 15 животных. Группы кодируют, чтобы обеспечить лечение вслепую, согласно Таблице 13.
В день 1 в начале эксперимента животным проводят анестезию изофлураном. Инфекцию вызывают с помощью иглы с шелковой шовной нитью, предварительно инфицированной инокулюмом S. aureus в определенной концентрации. Делают прокол, чтобы только проколоть кожу на высоте плечевого пояса и с выходом ниже приблизительно на 1 см.
На каждом конце нити завязывают узлы, чтобы гарантировать, что она не сдвигается из подкожного положения. Затем делают внешний разрез скальпелем между двух узлов, не достигая мышечного слоя.
Различные лекарственные препараты применяют через один и восемь часов после инфекции. Лекарственные препараты наносят местно на пораженную область. Все нанесения препарата осуществляют массированием инфицированной области в течение не менее чем 30 секунд. Применение препаратов продолжают в течение еще четырех дней, и их наносят с 12-часовыми интервалами.
Наносимый объем составляет 0,1 мл/животное. В качестве плацебо получают носитель, используемый в составе тестируемого изделия, в виде мази. Виды лечения кодируют перед их применением.
Животных ежедневно взвешивают и отмечают любые клинические признаки, относящиеся к тесту.
В день 6 приблизительно через 16 часов после нанесения животных умерщвляют смещением шеи. Область кожи, приблизительно 1×2 см, которая включает рану, удаляют и взвешивают. Данный образец гомогенизируют в 5 мл физиологического раствора. Данный раствор (0,1 мл) и три последовательных разведения 1:10 исходного 5-мл раствора помещают параллельно на чашки с агаром CLED+50 мМ MgCl2. В группе, получающей мупироцин, 50 мМ MgCl2 заменяют 2 мас.% активированным углем. Для группы, получающей плацебо, используют агаровые чашки двух типов.
MgCl2 добавляют к агару CLED для того, чтобы он действовал как хелатор хинолонов, с целью подавления активности антибиотика на чашке, тогда как активированный уголь (2 мас.%) используют, чтобы избежать переноса мупироцина в образцах кожи животных, леченных 2 мас.% мупироциновой мазью. Гомогенизированные образцы хранят в холодильнике до проведения окончательных подсчетов в случае, когда расчеты необходимо повторить.
b) Результаты
Значения, полученные на агаре CLED+2 мас.% активированный уголь
В группе, получающей плацебо, при расчетах получают значения 6,53±0,218 (среднее ±SEM (стандартная ошибка)) для log (KOE/г кожи). Рост наблюдают на всех чашках.
В группе, леченной 2 мас.% мупироциновой мазью, значения Log(KOE/г кожи) составляют 4,92±0,236. Рост наблюдают на всех чашках. Наблюдают статистически достоверные разницы (проверка по критерию Стьюдента, р<0,01) между мупироцином и плацебо.
Показатель эффективности лечения для 2 мас.% мупироциновой мази составляет 24% по сравнению с группой, получающей плацебо.
Значения, полученные на агаре CLED+50 мМ MgCl2
В группе, получающей плацебо, при расчетах получают значения 6,32±0,264 (среднее ±SEM) для log(KOE/г кожи). Рост наблюдают на всех чашках.
В группе, леченной 1 мас.% озеноксациновой мазью, значения Log(KOE/г кожи) составляют 3,56±0,248. Рост наблюдают на 13 из 15 чашек. Наблюдают статистически достоверные разницы (проверка по критерию Стьюдента, р<0,01) между озеноксацином и плацебо.
Показатель эффективности лечения для 1 мас.% озеноксациновой мази составляет 44% по сравнению с группой, получающей плацебо.
с) Заключение
5-дневное применение мази, содержащей озеноксацин 1 мас.%, вызывает статистически достоверное и более сильное снижение бактериального роста на экспериментальной модели инфекции Staphylococcus aureus у мышей, чем получают при использовании мази, содержащей мупироцин 2 мас.%. Не наблюдают никаких вредных местных эффектов после применения препарата.
Пример 4. Антибактериальная активность крема, содержащего 1 мас.% озеноксацина
а) Ход эксперимента
Антибактериальную активность крема, соответствующего Примеру 2, оценивают аналогично способу, описанному в Примере 3а. Единственное различие относится к фармацевтическим формам, которые показаны в Таблице 14.
b) Результаты
Значения, полученные на агаре CLED+2 мас.% активированный уголь
В группе, получающей плацебо, при расчетах получают значения 6,80±0,145 (среднее±SEM) для log(KOE/г кожи). Рост наблюдают на всех чашках.
В группе, леченной 2 мас.% мупироциновой мазью, значения log(KOE/г кожи) составляют 5,01±0,218. Рост наблюдают на всех чашках. Наблюдают статистически достоверные разницы (проверка по критерию Стьюдента, р<0,01) между мупироцином и плацебо.
Показатель эффективности лечения для 2 мас.% мупироциновой мази составляет 26% по сравнению с группой, получающей плацебо.
Значения, полученные на агаре CLED+50 мМ MgCl2
В группе, получающей плацебо, при расчетах получают значения 6,67+0,171 (среднее±SEM) для log(KOE/г кожи). Рост наблюдают на всех чашках.
В группе, леченной 1 мас.% озеноксациновым кремом, значения Log(KOE/г кожи) составляют 3,10±0,154. Рост наблюдают на 13 из 15 чашек. Наблюдают статистически достоверные разницы (проверка по критерию Стьюдента, р<0,01) между озеноксацином и плацебо.
Показатель эффективности лечения для 1 мас.% озеноксацинового крема составляет 54% по сравнению с группой, получающей плацебо.
с) Заключение
5-дневное применение крема, содержащего озеноксацин 1%, вызывает статистически достоверное и более сильное снижение бактериального роста на экспериментальной модели инфекции Staphylococcus aureus у мышей, чем получают при использовании мази, содержащей мупироцин 2 мас.%. Не наблюдают никаких вредных местных эффектов после применения препарата.
Пример 5. Крем, содержащий 2 мас.% озеноксацина
100 г композиции
Способ изготовления такой, как описано в Примере 2. Результаты по стабильности аналогичны полученным для Примера 2.
Пример 6. Фаза I клинического испытания препарата 2 мас.% озеноксацинового крема.
Цели
Основной целью является оценка системного всасывания после неоднократного местного применения 2 мас.% озеноксацинового крема путем анализа фармакокинетических параметров, полученных на основании концентраций озеноксацина в плазме.
Дальнейшими целями является оценка безопасности и переносимости после неоднократного местного применения 2 мас.% озеноксацинового крема.
Методика
Проводят многодозное, двойное слепое, рандомизированное клиническое испытание под контролем плацебо с двухфакторным переходом. Включают 20 здоровых мужчин европеоидной расы - добровольных участников испытания в возрасте 18-60 лет. Доза введения составляет 0,5 г 2 мас.% озеноксацинового крема/90 см2. Каждому участнику испытания ежедневно 3 раза в день наносят 0,5 г 2 мас.% озеноксацинового крема в течение 6 дней и 1 раз наносят 0,5 г 2 мас.% озеноксацинового крема в день 7 или 3 раза в день наносят крем плацебо в течение 6 дней и 1 раз наносят крем плацебо в день 7, причем в каждый из периодов в соответствии с кодом рандомизации.
Образцы крови для измерений концентрации озеноксацина в плазме отбирают перед 1 и 2 нанесениями в день 1, перед 2 нанесение в день 2, перед 1 и 3 нанесением в день 3 и день 4, перед каждым нанесением в день 5 и день 6, перед нанесением в день 7 и через 0,5, 1, 2, 4, 8, 12, 24, 48 и 72 часа после нанесения в день 7.
Результаты
После неоднократного наружного нанесения 10 мг озеноксацина (2% крем) три раза в день в течение семи дней все концентрации озеноксацина в плазме также остаются ниже порога количественного определения. Таким образом, не наблюдают никакого системного всасывания.
После неоднократного наружного нанесения 2% озеноксацинового крема предварительные результаты показывают хороший профиль переносимости. Наиболее часто регистрируемые вредные события представляют собой зуд в области нанесения и эритему. Не описано никаких тяжелых вредных событий. Все вредные события классифицируют по интенсивности как слабые или умеренные.
Можно заключить, что 2 мас.% озеноксациновый крем хорошо переносится и кожное всасывание незначительно.
Варианты осуществления изобретения:
1. Фармацевтическая стабильная полутвердая композиция для местного применения, содержащая от 0,2 до 5 мас.% композиции озеноксацина и носитель, подходящий для изготовления мази или крема.
2. Композиция, соответствующая варианту осуществления 1 или 2, в которой количество озеноксацина составляет от 0,5 мас.% до 2 мас.%.
3. Композиция, соответствующая варианту осуществления 2, в которой количество озеноксацина составляет 1 мас.%.
4. Мазь, содержащая композицию, соответствующую любому из вариантов осуществления 1-3, содержащая 0,2+5 мас.% озеноксацина, в которой подходящий носитель выбран из белого воска, бесцветного мягкого парафина и их смесей.
5. Мазь, соответствующая варианту осуществления 4, в которой подходящий носитель представляет собой бесцветный мягкий парафин.
6. Крем, содержащий композицию, соответствующую любому из вариантов осуществления 1-3, в котором подходящий носитель содержит смесь эмульгаторов поверхностно-активных веществ, масляных компонентов, восков с низкой температурой плавления, воды, диспергирующихся в воде компонентов и не образующих формальдегид консервантов.
7. Крем, соответствующий варианту осуществления 6, в котором носитель включает в следующих пропорциях крема:
эмульгаторы, 15÷25 мас.%;
поверхностно-активные вещества, 10÷20 мас.%;
масляные компоненты, 5÷15 мас.%;
воска с низкой температурой плавления, 1÷10 мас.%;
воду, 30÷45 мас.%;
диспергирующиеся в воде компоненты, 10÷20 мас.% и
не образующие формальдегид консерванты, 0,01÷1 мас.%.
8. Крем по п.7, в котором носитель включает в следующих пропорциях крема:
эмульгаторы, 18÷22 мас.%;
поверхностно-активные вещества, 13÷15 мас.%;
масляные компоненты, 7÷9 мас.%;
воска с низкой температурой плавления, 3÷5 мас.%;
воду, 35÷40 мас.%;
диспергирующиеся в воде компоненты, 13÷17 мас.% и
не образующие формальдегид консерванты, 0,05÷0,15 мас.%.
9. Крем, соответствующий варианту осуществления 8, в котором носитель включает в следующих пропорциях крема:
эмульгаторы, 20 мас.%;
поверхностно-активные вещества, 14 мас.%;
масляные компоненты, 8 мас.%;
воска с низкой температурой плавления,
4 мас.%;
воду, 37,9 мас.%;
диспергирующиеся в воде компоненты, 15 мас.% и
не образующие формальдегид консерванты, 0,1 мас.%.
10. Крем, соответствующий любому из вариантов осуществления 6-9, в котором эмульгаторы выбраны из этиленгликольмоностеарата, сорбиттристеарата, смеси ПЭГ6 стеарата, гликольстеарата и ПЭГ32 стеарата, а также гидрированного лецитина и их смесей.
11. Крем, соответствующий варианту осуществления 10, в котором эмульгаторы представляют собой смесь ПЭГ6 стеарата, гликольстеарата и ПЭГ32 стеарата.
12. Крем, соответствующий любому из вариантов осуществления 6-11, в котором поверхностно-активные вещества выбраны из сорбитолеатмоноолеин/пропиленгликоля, моно- и диглицеридов С8/С10 жирных кислот из кокосового масла, соевого лецитина, яичных фосфатидов, сложных эфиров моноглицеридов и лимонной кислоты, сложных эфиров моноглицеридов и молочной кислоты, сложных эфиров моноглицеридов и диацетилвинной кислоты, сложных эфиров моноглицеридов и янтарной кислоты, сложных эфиров сахарозы и жирных кислот, полигликолизированных глицеридов олеиновых кислот, полигликолизированных глицеридов линоленовой кислоты, сложных полигицериновых эфиров жирных кислот, включая жирные кислоты как с длинной, так и со средней цепью, и сложных полиглицериловых эфиров смешанных жирных кислот и их смесей.
13. Крем, соответствующий варианту осуществления 12, в котором поверхностно-активные вещества представляют собой полигликолизированные глицериды олеиновых кислот.
14. Крем, соответствующий любому из вариантов осуществления 6-13, в котором масляные компоненты выбраны из спиртов Гербе с основой из жирных спиртов, содержащих 8-10 атомов углерода, сложных эфиров С6-22 неразветвленных жирных кислот с неразветвленными или разветвленными С6-22 жирными спиртами, сложных эфиров разветвленных С6-13 карбоновых кислот с неразветвленными или разветвленными С6-22 жирными спиртами, сложных эфиров неразветвленных С6-22 жирных кислот с 2-этилгексанолом, сложных эфиров С3-38 алкилгидроксикарбоновых кислот с неразветвленными или разветвленными С6-22 жирными спиртами, сложных эфиров неразветвленных или разветвленных жирных кислот с полигидроспиртами или спиртами Гербе, триглицеридов на основе С6-10 жирных кислот, жидких смесей моно-, ди- и триглицеридов на основе С6-18 жирных кислот, сложных эфиров С6-22 жирных спиртов или спиртов Гербе с бензойной кислотой, сложных эфиров С2-12 дикарбоновых кислот с неразветвленными или разветвленными спиртами, содержащими 1-22 атома углерода, или полиолами, содержащими 2-10 атомов углерода и 2-6 гидроксильных групп, растительных масел, разветвленных первичных спиртов, замещенных циклогексанов, неразветвленных и разветвленных карбонатов С6-22 жирных спиртов, карбонатов Гербе на основе жирных спиртов, содержащих 8-10 атомов углерода, сложных эфиров бензойной кислоты с неразветвленными или разветвленными С6-22 спиртами, неразветвленными или разветвленными, симметричными или асимметричными диалкиловыми эфирами, содержащими 6-22 атома углерода на алкильную группу, открывающие цикл продукты сложных эфиров эпоксидированных жирных кислот с полиолами, силиконовых масел и алифатических или нафтеновых углеводов и их смесей.
15. Крем, соответствующий варианту осуществления 14, в котором масляный компонент представляет собой спирт Гербе 2-октилдодеканол.
16. Крем, соответствующий любому из вариантов осуществления 6-15, в котором воска с низкой температурой плавления выбраны из жирных кислот из 8-30 атомов углерода, жирных спиртов из 8-30 атомов углерода, сложных эфиров жирных кислот из 8-30 атомов углерода, амидов жирных кислот из 8-30 атомов углерода, силиконовых восков и их смесей.
17. Крем, соответствующий варианту осуществления 16, в котором воска с низкой температурой плавления являются жирными спиртами из 8-30 атомов углерода.
18. Крем, соответствующий варианту осуществления 17, в котором стеариловый спирт выбран из жирных спиртов.
19. Крем, соответствующий любому из вариантов осуществления 6-18, в котором диспергирующиеся в воде компоненты выбраны из полиэтиленгликоля 400, гексиленгликоля, пропиленгликоля, эфира метилглюкозы и полипропиленгликоля 10, этоксидигликоля, полиэтиленгликоль 6 глицерида каприловой/каприновой кислоты, монобутилового эфира этиленгликоля, полиэтиленгликоль 8 глицеридов каприловой/каприновой кислоты, 3-метокси-3-метил-1-бутанола, диметилизосорбида и их смесей.
20. Крем, соответствующий варианту осуществления 19, в котором диспергирующийся в воде компонент представляет собой пропиленгликоль.
21. Крем, соответствующий любому из вариантов осуществления 6-20, в котором консерванты, не образующие формальдегид, выбраны из бензоата аммония, пропионата аммония, бензизотиазолинона, бензойной кислоты, бензотриазола, бензилового спирта, бензилпарабена, 5-бром-5-нитро-1,3-диоксана, 2-бром-2-нитропропан-1,3-диола, бутилбензоата, бутилпарабена, бензоата кальция, парабена кальция, пропионата кальция, салицилата кальция, сорбата кальция, хлоргексидиндиацетата, хлоргексидиндиглюконата, хлоргексидиндигидрохлорида, хлорацетамида, хлорбутанола, п-хлор-м-крезола, хлорофена, п-хлорфенола, хлорфенезина, хлортимола, хлороксенола, м-крезола, о-крезола, п-крезола, дегидроуксусной кислоты, дибромпропамидин диизетионата, диметилоксазолидина, дитиометилбензамида, домефена, этилферулата, этилпарабена, феруловой кислоты, глиоксаля, гексамидина, гексамидиндипарабена, гексамидинпарабена, 4-гидроксибензойной кислоты, гидроксиметилдиоксоазабициклооктана, йодопропинилбутиларбамата, изобутилпарабена, изодецилпарабена, изопропилкрезолов, изопропилпарабена, изопропилсорбата, лаурилдиэтилендиаминоглицина HCl, бензоата магния, пропионата магния, метил-хлоризотиазолинона, метилпарабена, октилизотиазолинона, бензоат пантенилэтилового эфира, фенетилового спирта, фенола, феноксиэтанола, феноксиэтилпарабена, феноксиизопропанола, фенилбензоата, фенилпарабена, о-фенилфенола, полиметоксибициклического оксазолидина, бензоата калия, бутилпарабена калия, этилпарабена калия, метилпарабена калия, парабена калия, феноксида калия, пропионата калия, пропилпарабена калия, сорбата калия, пропионовой кислоты, пропилбензоата, пропилпарабена, кватерниума-8 (метил- и стеарилдиметиламиноэтилметакрилат, кватернизированный (переведенный в четвертичную форму) диметилсульфатом), кватерниума-14 (этанаминий, N,N,N-триметил-2-[(2-метил-1-оксо-2-пропенил)окси]-, метилсульфат, гомополимер), кватерниума-15 (этанаминий, N,N,N-триметил-2-[(2-метил-1-оксо-2-пропенил)окси]-хлорид, полимер с 2-пропенамидом), бензоата натрия, бутилпарабена натрия, натрий п-хлор-м-крезола, дегидроацетата натрия, этилпарабена натрия, формиата натрия, гидроксиметансульфоната натрия, гидроксиметилглицината натрия, изобутилпарабена натрия, изопропилпарабена натрия, лаурилдиэтилендиаминглицината натрия, метилпарабена натрия, парабена натрия, фенилсульфоната натрия, феноксида натрия, о-фенилфената натрия, пропионата натрия, пропилпарабена натрия, сорбата натрия, сорбиновой кислоты, ТЕА-сорбата (триэтаноламинсорбата), тионтола (2,7-диметил-тиантрена), триклокарбана, триклозана и ундециленоил ПЭГ5 парабена (сложного эфира ундециленовой кислоты и ПЭГ5 парабена) и их смесей.
22. Крем, соответствующий варианту осуществления 21, в котором консервант, не образующий формальдегид, представляет собой бензойную кислоту.
23. Применение композиции, соответствующей любому из вариантов осуществления 1-3, при лечении или профилактике кожных инфекций и инфекций кожных структур у человека или животного.
24. Применение мази, соответствующей любому из вариантов осуществления 4 и 5, при лечении или профилактике кожных инфекций и инфекций кожных структур у человека или животного.
25. Применение крема, соответствующего любому из вариантов осуществления 6-22, при лечении или профилактике кожных инфекций и инфекций кожных структур у человека или животного.
26. Применение любого из вариантов осуществления 23-25, где кожные инфекции и инфекции кожных структур представляют собой импетиго, фолликулит, фурункулез, акне, вторично инфицированные травматические повреждения, вторично инфицированные дерматозы и вторично инфицированные ожоги, а также те кожные инфекции и инфекции кожных структур, которые вызывают метициллиночувствительный Staphylococcus aureus (MSSA), метициллиноустойчивый Staphylococcus aureus (MRSA), включая штаммы, устойчивые к ципрофлоксацину, метициллиночувствительный Staphylococcus epidermidis (MSSE), метициллиноустойчивый Staphylococcus epidermidis (MRSE), Streptococcus pyogenes и стрептококки группы G.
27. Применение композиции, соответствующей любому из вариантов осуществления 1-3, при лечении или профилактике заболеваний, передающихся половым путем, и инфекций половых путей у человека или животного.
28. Применение мази, соответствующей любому из вариантов осуществления 4 и 5, при лечении или профилактике заболеваний, передающихся половым путем, и инфекций половых путей у человека или животного.
29. Применение крема, соответствующего любому из вариантов осуществления 6-22, при лечении или профилактике заболеваний, передающихся половым путем, и инфекций половых путей у человека или животного.
30. Применение любого из вариантов осуществления 27-29, в которых заболевания, передающиеся половым путем, и инфекции половых путей вызывают Streptococcus agalactiae группы В, Neisseria gonorrhoeae, Chlamydia trachomatis, Mycoplasma hominis и Ureaplasma urealyticum.
31. Применение композиции, соответствующей любому из вариантов осуществления 1-3, для борьбы с инфекциями носоглотки у бессимптомных назальных носителей у человека или животного.
32. Применение мази, соответствующей любому из вариантов осуществления 4 и 5, для борьбы с инфекциями носоглотки у бессимптомных назальных носителей у человека или животного.
33. Применение крема, соответствующего любому из вариантов осуществления 6-22, для борьбы с инфекциями носоглотки у бессимптомных назальных носителей у человека или животного.
34. Применение любого из вариантов осуществления 31-33, в которых инфекции носоглотки вызывают метициллиночувствительный Staphylococcus aureus (MSSA), метициллиноустойчивый Staphylococcus aureus (MRSA), включая штаммы, устойчивые к ципрофлоксацину, пенициллиноустойчивый Streptococcus pneumoniae, положительный по β-лактамазе Haemophilus influenzae, нетипируемые штаммы Haemophilus influenzae, положительная по β-лактамазе Moraxella catarrhalis, Neisseria meningitides, Legionella pneumophila, Mycoplasma pneumoniae, Legionella pneumophila и Mycobacterium tuberculosis.
Изобретение относится к области медицины, конкретно к фармацевтической композиции для местного применения, обладающей противобактериальными свойствами. В изобретении представлены фармацевтические стабильные полутвердые композиции для местного применения, содержащие от 0,2 до 5 мас.% дезфторхинолонового соединения и носитель, подходящий для изготовления мази или крема. 14 н. и 10 з.п. ф-лы, 5 примеров, 14 табл.
1. Стабильная композиция в виде крема для местного применения, включающая 0,2÷5 мас.% озеноксацина и подходящий носитель, содержащий:
15÷25 мас.% по меньшей мере одного эмульгатора, выбранного из группы, включающей этиленгликоль моностеарата, сорбитан тристеарата, смеси ПЭГ6 стеарата, гликольстеарата и ПЭГ32 стеарата, гидрированный лецитин и их смеси;
10÷20 мас.% по меньшей мере одного поверхностно-активного вещества, выбранного из группы, включающей сорбитолеат моноолеина/пропиленгликоля, моно- и диглицериды C8/C10 жирных кислот из кокосового масла, соевый лецитин, яичные фосфатиды, сложные эфиры лимонной кислоты и моноглицеридов, сложные эфиры молочной кислоты и моноглицеридов, сложные эфиры диацетил винной кислоты и моноглицеридов, сложные эфиры янтарной кислоты и моноглицеридов, сложные эфиры сахарозы и жирных кислот, полигликолизированные глицериды олеиновой кислоты, полигликолизированные глицериды линоленовой кислоты, сложные полиглицериновые эфиры жирных кислот и сложные полиглицериловые эфиры смешанных жирных кислот и их смеси;
5÷15 мас.% масляного компонента, который представляет собой спирт Гербе (2-октилдодеканол);
1÷10 мас.% по меньшей мере одного воска с низкой температурой плавления, выбранного из группы, включающей жирные спирты с 8-30 атомами углерода и их смеси;
10÷20 мас.% по меньшей мере одного диспергирующегося в воде компонента, выбранного из группы, включающей ПЭГ400, гексиленгликоль, пропиленгликоль, эфир метилглюкозы и полипропиленгликоля 10, этоксидигликоль, ПЭГ6 глицериды каприловой/каприновой кислоты, монобутиловый эфир этиленгликоля, ПЭГ8 глицериды каприловой/каприновой кислоты, 3-метокси-3-метил-1-бутанол, диметилизосорбид и их смеси;
0,01÷1 мас.% по меньшей мере одного консерванта, не образующего формальдегид, и
воду, причем количество воды представляет собой количество, дополняющее композицию до 100 мас.%.
2. Композиция по п.1, в которой эмульгатор представляет собой смесь ПЭГ6 стеарата, гликольстеарата и ПЭГ32 стеарата.
3. Композиция по п.1 или 2, в которой поверхностно-активные вещества представляют собой полигликолизированные глицериды олеиновых кислот.
4. Композиция по п.1 или 2, в которой воск с низкой температурой плавления представляет собой стеариловый спирт.
5. Композиция по п.1 или 2, в которой диспергирующийся в воде компонент представляет собой пропиленгликоль.
6. Композиция по п.1 или 2, в которой не образующий формальдегид консервант представляет собой бензойную кислоту.
7. Композиция по п.1 или 2, в которой носитель содержит, мас.%:
8. Композиция по п.7, в которой носитель содержит, мас.%:
9. Применение композиции по любому из пп.1-8, в качестве лекарственного средства для лечения или предупреждения кожных инфекций и инфекций кожных структур, вызванных бактериями, у человека или животного.
10. Применение композиции по любому из пп.1-8, в качестве лекарственного средства для лечения или профилактики заболеваний, передающихся половым путем, и инфекций половых путей, вызванных бактериями, у человека или животного.
11. Применение композиции по любому из пп.1-8, в качестве лекарственного средства для лечения или профилактики инфекций носоглотки, вызванных бактериями, у человека или животного, которые являются бессимптомными назальными носителями.
12. Способ лечения или профилактики кожных инфекций и инфекций кожных структур, вызванных бактериями, включающий нанесение нуждающемуся в этом пациенту композиции по любому из пп.1-8.
13. Способ лечения или профилактики заболеваний, передающихся половым путем, и инфекций половых путей, вызванных бактериями, включающий нанесение нуждающемуся в этом пациенту композиции по любому из пп.1-8.
14. Способ лечения или профилактики инфекций носоглотки у бессимптомных назальных носителей, вызванных бактериями, включающий нанесение нуждающемуся в этом пациенту композиции по любому из пп.1-8.
15. Стабильная композиция в виде мази для местного применения, включающая 0,2÷5 мас.% озеноксацина и подходящий носитель, выбранный из группы, включающей белый воск, бесцветный мягкий парафин и их смеси.
16. Композиция по п.15, в которой носитель представляет собой бесцветный мягкий парафин.
17. Композиция по п.15 или 16, которая содержит 0,5÷2 мас.% озеноксацина.
18. Композиция по п.17, которая содержит 1 мас.% озеноксацина.
19. Применение композиции по любому из пп.15-18 в качестве лекарственного средства для лечения или профилактики кожных инфекций и инфекций кожных структур, вызванных бактериями.
20. Применение композиции по любому из пп.15-18 в качестве лекарственного средства для лечения или профилактики заболеваний, передающихся половым путем, и инфекций половых путей, вызванных бактериями.
21. Применение композиции по любому из пп.15-18 в качестве лекарственного средства для лечения или профилактики инфекций носоглотки, вызванных бактериями, у бессимптомных назальных носителей.
22. Способ лечения или профилактики кожных инфекций и инфекций кожных структур, вызванных бактериями, включающий введение нуждающемуся в этом пациенту композиции по любому из пп.15-18.
23. Способ лечения или профилактики заболеваний, передающихся половым путем, и инфекций половых путей, вызванных бактериями, включающий введение нуждающемуся в этом пациенту композиции по любому из пп.15-18.
24. Способ лечения или профилактики инфекций носоглотки у бессимптомных назальных носителей, вызванных бактериями, включающий введение нуждающемуся в этом пациенту композиции по любому из пп.15-18.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| ЕР 1941880 А1 01.08.2005 | |||
| C.TARRAGO et al | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| C.TARRAGO et al | |||
| PRECLINICAL IN VITRO AND IN VIVO ABSORPTION EVALUTION OF OZENOXACIN: A | |||
Авторы
Даты
2013-04-10—Публикация
2009-10-16—Подача