Область техники, к которой относится изобретение
Настоящее изобретение относится к способу и набору для обнаружения hMPV в образце, способу и набору, дополнительно позволяющим обнаруживать респираторные вирусы гриппа А, гриппа В, гриппа С, PIV 1, PIV 2, PIV 3, PIV 4A, 4В, аденовирус, hRSV А, hRSV В, коронавирус 229, эховирус 30, риновирус и hBoV.
Настоящее изобретение также относится к ряду последовательностей нуклеиновых кислот (нуклеотидных последовательностей), а также к их применению в качестве амплификационных праймеров для hMPV, присутствующего в тестируемом образце. Амплификация hMPV с помощью нуклеиновых кислот с последовательностями согласно настоящему изобретению совместима с определением генотипа hMPV, присутствующего в тестируемом образце.
Уровень техники
Инфекции дыхательных путей являются одной из основных причин смертности во всех возрастных группах, однако особенно среди маленьких детей, пожилых и пациентов с нарушенным иммунитетом. Основная часть этих инфекций обусловлена вирусами.
Недавние исследования позволяют предположить, что к наиболее распространенным вирусам, вызывающим инфекции дыхательных путей, следует добавить метапневмовирус человека (hMPV), пополнивший список вирусных патогенов дыхательных путей человека во всех возрастных группах (van den Hoogen et al., 2001 , Nat. Med. 7: 719-724; Peret et al., 2002, J. Infect. Dis. 185: 1660-1663; Boivin et al., 2002, J. Infect. Dis. 186: 1330-1334).
В качестве примера исследования можно привести результаты анализов, взятых у 1322 госпитализированных маленьких детей в возрасте моложе 2 лет в Испании за 5 лет, где вирус hMPV оказался наиболее распространенным после hRSV и риновируса (Garcia-Garcia et al., 2006, Pediatr. Pulmonol. 41 (9): 863-71). Смешанные инфекции являются частыми и клинически сходными с одиночными инфекциями и hRSV инфекциями. Дополнительные данные можно найти в Garcia-Garcia et al., 2006, Arch Dis Child. 91 (4): 290-5.
Недавно сделано предположение о более высокой вирулентности hMPV генотипа А по сравнению с генотипом В (Vicente et al., 2006, Clin Infect Dis. 42 (12): e11 1-3). Проанализирован клинический спектр из 69 случаев метапневмовирусной инфекции в педиатрии (55 случаев, вызванных генотипом А, и 14 случаев, вызванных генотипом В), и обнаружено, что диагноз пневмонии более распространен и индекс тяжести болезни (определяемый на основании необходимости госпитализации, уровня насыщения кислородом менее 90% и пребывания в блоке интенсивной терапии) выше у больных с инфекцией hMPV генотипа А. Различную наблюдаемую тяжесть болезни можно отнести на счет более высокой вирулентности hMPV генотипа A (hMPV-A) по сравнению с генотипом В (hMPV-B).
Попытки одновременного обнаружения hMPV и других вирусных агентов, воздействующих на дыхательные пути, уже описаны (WO 2005/038427 и WO 2006/070034 содержат показательные примеры). Исчерпывающий список респираторных вирусов включает вирусы гриппа А и В, человеческий респираторный синцитиальный вирус (hRSV) А и В, четыре серотипа вирусов парагриппа человека (PIV), аденовирусы, риновирусы, коронавирусы, вирус гриппа типа С, а также энтеровирусы. Дополнительно, область знания о вирусах, вызывающих инфекции нижних дыхательных путей, недавно пополнилась описанием нового члена, человеческого бокавируса (HBoV) (Allander et al., 2005, PNAS 102: 12891-12896).
Классическими амплификационными праймерами для hMPV являются L6 и L7, впервые описанные у Van den Hoogen et al., 2003, J. Infect. Dis. 188: 1571-1577. Другими примерами прототипов, где L6 и L7 применялись для амплификации hMPV, являются WO 2005/038427 и WO 2006/070034.
Конкретно, WO 2005/038427 предоставляет способ амплификации целевых последовательностей вирусов верхних дыхательных путей, где способ включает амплификацию с помощью ПЦР с применением нескольких пар ПЦР праймеров. В качестве праймеров для hMPV применяют праймеры L6 и L7.
Дополнительно, в WO 2006/070034 амплификацию респираторных вирусов, присутствующих в образце, можно проводить до гибридизации продуктов амплификации со специфичными к вирусам пробами. Праймерами, применяемыми для амплификации hMPV, опять являются L6 и L7.
Дополнительными патентными заявками прототипов, направленных на одновременное обнаружение респираторных вирусных патогенов, являются нижеследующие.
US 2007/092871, в которой описана микроматрица, включающая множество олигонуклеотидных проб-последовательностей для генетической идентификации патогенов верхних дыхательных путей. Что касается праймеров, раскрытых в заявке, в ней представлены только последовательности, соответствующие набору ПЦР праймеров для амплификации вируса гриппа А в образцах.
СА 2418004, в которой описан анализ для обнаружения в тестируемом образце нуклеиновых кислот клинически важных респираторных вирусных патогенов во множественном формате. Большая часть последовательностей амплификационных праймеров, приведенных в патентной заявке, уже описана другими, за исключением таковых для hMPV, которые впервые описаны в данной заявке. Однако эти последовательности, соответствующие амплификационным праймерам для hMPV, отличаются от таковых, описанных в настоящем изобретении.
WO 2005/005658, в которой описан способ обнаружения коронавируса, вызывающего тяжелый острый респираторный синдром (SARS-CoV), где способ основан на применении чипа, включающего подложку, на которой иммобилизованы олигонуклеотидные пробы. В дополнение к чипу патентная заявка раскрывает отдельные олигонуклеотидные праймеры для амплификации других респираторных вирусов, включая таковые для амплификации метапневмовируса человека. Однако ни один из амплификационных праймеров патентной заявки WO 2005/005658 не соответствует последовательностям, описанным в настоящей заявке.
WO 2004/057021, в которой раскрыты композиции и способы обнаружения респираторных вирусов путем применения специфических нуклеотидных последовательностей. Ни один из амплификационных праймеров для hMPV, раскрытых в WO 2004/057021, не соответствует таковым, раскрытым в изобретении, описанном здесь.
WO 2006/102695, в которой раскрыто применение полимеразной цепной реакции (ПЦР) в реальном времени для обнаружения организмов, вызывающих респираторные инфекции. В заявке приведены отдельные последовательности, соответствующие праймерам, а также якорным и сенсорным пробам. Касательно амплификационных праймеров, соответствующих hMPV, представленные последовательности отличаются от таковых настоящего изобретения.
WO 2004/096993, в которой представлены способы обнаружения метапневмовируса млекопитающих в образце, включающие контактирование образца с нуклеиновой кислотой пробы или еще контактирование образца с антителом, или альтернативно амплификация нуклеиновой кислоты MPV в образце. Относительно этого последнего способа обнаружения сказано в общем, что амплификационные праймеры могут специфически гибридизоваться с нуклеотидной последовательностью метапневмовируса человека без предоставления конкретных последовательностей праймеров.
Раскрытие изобретения
Проблема, которую надо решить в настоящем изобретении, представляет собой разработку способа, позволяющего альтернативное или даже более эффективное определение hMPV в тестируемом образце по сравнению со способами известных прототипов. Предпочтительно, способ должен быть совместим с последующим определением типа присутствующего hMPV и с обнаружением других респираторных вирусов, присутствующих в образце.
Решение проблемы, соответствующее первому аспекту настоящего изобретения, основано на одной или более нуклеотидной последовательности, включающей последовательность, выбранную из группы, включающей SEQ ID №1-6, комплементарные и эквивалентные им последовательности и их применение в качестве амплификационных праймеров при амплификации hMPV. «Эквиваленты» означают последовательности, которые могут отличаться от данной последовательности, например, по меньшей мере одной, предпочтительно, одной, двумя, тремя, четырьмя мутациями, включая замены, делеции и вставки. Другие эквиваленты могут быть праймерами, включающими альтернативные или модифицированные нуклеотиды вместо канонических нуклеотидов таким образом, что такая эквивалентная последовательность может действовать в качестве амплификационного праймера при амплификации hMPV. Нуклеиновые кислоты включают, например, ДНК, РНК и ПНК и любые другие формы или модификации.
Предпочтительно, нуклеотидные последовательности, включающие последовательности SEQ ID №1 и 2, и/или SEQ ID №3 и 4, и/или SEQ ID №5 и 6 или комплементарные и эквивалентные им последовательности, составляют пары амплификационных праймеров для hMPV. В более предпочтительном осуществлении нуклеотидные последовательности, состоящие из SEQ ID №1-6, комплементарные им или эквивалентные последовательности составляют амплификационные праймера для амплификации hMPV.
Другой аспект настоящего изобретения относится к способу обнаружения hMPV в тестируемом образце, включающему контактирование тестируемого образца с одной или более нуклеотидной последовательностью, включающей последовательность, выбранную из группы, включающей SEQ ID №1-6, комплементарные и эквивалентные им последовательности, и подвергание смеси реакции амплификации нуклеиновых кислот, где реакция амплификации предназначена для амплификации целевых последовательностей, присутствующих в образце.
Амплификация в тестируемых образцах с применением праймеров согласно настоящему изобретению приводит к более высокой чувствительности обнаружения hMPV, чем в описанных прототипах, как при электрофорезе в агарозном геле, так и в системах обнаружения, основанных на гибридизации со специфичными к целевой нуклеиновой кислоте (целеспецифичными) пробами.
На данном уровне техники проявляется большой интерес к способам обнаружения респираторных вирусов с помощью амплификации нуклеиновых кислот. Специалист в данной области техники, применяя способы, известные в данной области техники для получения амплификационных праймеров для hMPV, мог бы получить много последовательностей, эффективность которых была бы неизвестна и не могла бы быть проверена за разумное время и с помощью разумных ресурсов.
Способ согласно настоящему изобретению позволяет проводить более эффективное обнаружение hMPV в тестируемом образце, чем способы, известные в данной области техники. Так, амплификация с применением праймеров L6.2 и L7.2 согласно настоящему изобретению (SEQ ID №1 и 2, соответственно) позволяет обнаружить hMPV в образцах, тогда как амплификация с применением L6 и L7 известных прототипов (SEQ ID №7 и 8, соответственно) дает отрицательный результат.
Дополнительно, амплификация с применением праймеров SA, АА, SB и АВ (SEQ ID №3-6, соответственно) согласно настоящему изобретению с последующей гибридизацией со специфичными к последовательностям пробами, такими как пробы F249B, F256B или F256A (SEQ ID №11, 12 и 13, соответственно), дополняет детектирующую способность способа обнаружения, включающего амплификацию с применением праймеров L6 и L7, L6.2 и L7.2 с последующей гибридизацией с пробами HMNVA-S37 и HMNVB-S38 (SEQ ID №9 и 10, соответственно) вплоть до выявления почти 100% положительных по hMPV образцов.
Дополнительно, способ амплификации с применением праймеров L6.2 и L7.2 согласно настоящему изобретению в присутствии или в отсутствие праймеров L6 и L7 совместим с амплификацией в присутствии пар амплификационных праймеров для вируса гриппа А, вируса гриппа В, вируса гриппа С, PIV 1, PIV 2, PIV 3, PIV 4A, 4В, аденовируса, hRSV A, hRSV В, коронавируса 229, эховируса 30, риновируса и hBoV.
Преимуществом настоящего изобретения является то, что амплификация hMPV с помощью пар праймеров согласно изобретению совместима с определением генотипа hMPV путем гибридизации продуктов амплификации, предварительно превращенных в одноцепочечные олиго- или полинуклеотиды, с пробами согласно настоящему изобретению. Поэтому никакой гнездовой амплификации не требуется для определения генотипа.
Другой аспект настоящего изобретения соответствует набору для обнаружения и идентификации hMPV в тестируемом образце, где указанный набор включает одну или более смесь для амплификации нуклеиновых кислот, где по меньшей мере одна из амплификационных смесей содержит одну или более нуклеотидную последовательность, включающую последовательность, выбранную из группы, состоящей из SEQ ID №1-6, комплементарные и эквивалентные им последовательности.
В предпочтительном осуществлении набор согласно настоящему изобретению включает две или более смеси для амплификации:
- первую смесь, включающую первую и вторую нуклеотидные последовательности, состоящие из последовательностей SEQ ID №1 и 2, соответственно, или комплементарные и эквивалентные им последовательности в качестве пары амплификационных праймеров для hMPV;
- вторую смесь, включающую первую и вторую нуклеотидные последовательности, состоящие из последовательностей SEQ ID №3 и 4, соответственно, и/или третью и четвертую нуклеотидные последовательности, состоящие из последовательностей SEQ ID №5 и 6 соответственно, или комплементарные и эквивалентные им последовательности в качестве компонентов другой пары амплификационных праймеров для hMPV. Предпочтительно, вторая смесь включает нуклеотидные последовательности от первой до четвертой, представляющие собой последовательности SEQ ID №3-6 соответственно.
Первая смесь амплификационных праймеров может дополнительно включать праймеры L6 (SEQ ID №7) и L7 (SEQ ID №8).
Дополнительно, набор согласно настоящему изобретению может позволить обнаружение вируса гриппа А, вируса гриппа В, вируса гриппа С, PIV 1, PIV 2, PIV 3, PIV 4A, 4В, аденовируса, hRSV A, hRSV В, коронавируса 229, эховируса 30, риновируса и hBoV в тестируемом образце, где набор предпочтительно включает:
пары праймеров SEQ ID №14-24 для PIV 1, PIV 2, PIV 3, PIV 4A, 4В, hRSV А и коронавируса типа 229 в составе первой смеси для амплификации;
и пары праймеров SEQ ID №25-38 для вируса гриппа А, вируса гриппа В, вируса гриппа С, hRSV В, аденовируса, эховируса 30, риновируса и hBoV в составе второй амплификационной смеси.
В дополнение к амплификационным смесям набор может также включать:
1) сосуд с матрицей или набор сосудов с матрицами, где каждый сосуд включает микроматрицу, на которой представлены целеспецифичные пробы, и
2) реагенты для применения при визуализации гибридизации нуклеиновых кислот с пробами микроматрицы.
Дополнительный аспект настоящего изобретения соответствует применению вышеописанных способа и набора для обнаружения и идентификации в случае их присутствия в тестируемом образце одного или более вирусного агента, выбранного из группы, включающей hMPV, вирус гриппа А, вирус гриппа В, вирус гриппа С, PIV 1, PIV 2, PIV 3, PIV 4A, 4В, аденовирус, hRSV A, hRSV В, коронавирус 229, эховирус 30, риновирус и hBoV.
Дополнительные аспекты настоящего изобретения соответствуют (1) смеси для амплификации нуклеиновых кислот, включающей в качестве амплификационных праймеров нуклеиновые кислоты, включающие SEQ ID №1 и 2, и/или нуклеиновые кислоты, включающие SEQ ID №3 и 4, и/или нуклеиновые кислоты, включающие SEQ ID №5 и 6, или комплементарные и эквивалентные им последовательности. Предпочтительно, смесь включает в качестве амплификационных праймеров нуклеиновые кислоты от первой до четвертой, включающие SEQ ID №3-6 соответственно. Смесь может также включать пятую и шестую нуклеиновые кислоты, включающие SEQ ID №1 и 2 соответственно, но в предпочтительных осуществлениях пятая и шестая нуклеиновые кислоты не включены в состав той же смеси, что и нуклеиновые кислоты от первой до четвертой; (2) амплифицированные фрагменты, полученные с помощью пар праймеров SEQ ID №1 и 2, 3 и 4 и 5 и 6, и (3) способ получения последовательностей нуклеиновых кислот, включающих SEQ ID №1-6, комплементарные и эквивалентные им последовательности, где нуклеотидные последовательности могут быть мечеными. Предпочтительно, такая метка представляет собой биотин.
Краткое описание фигур
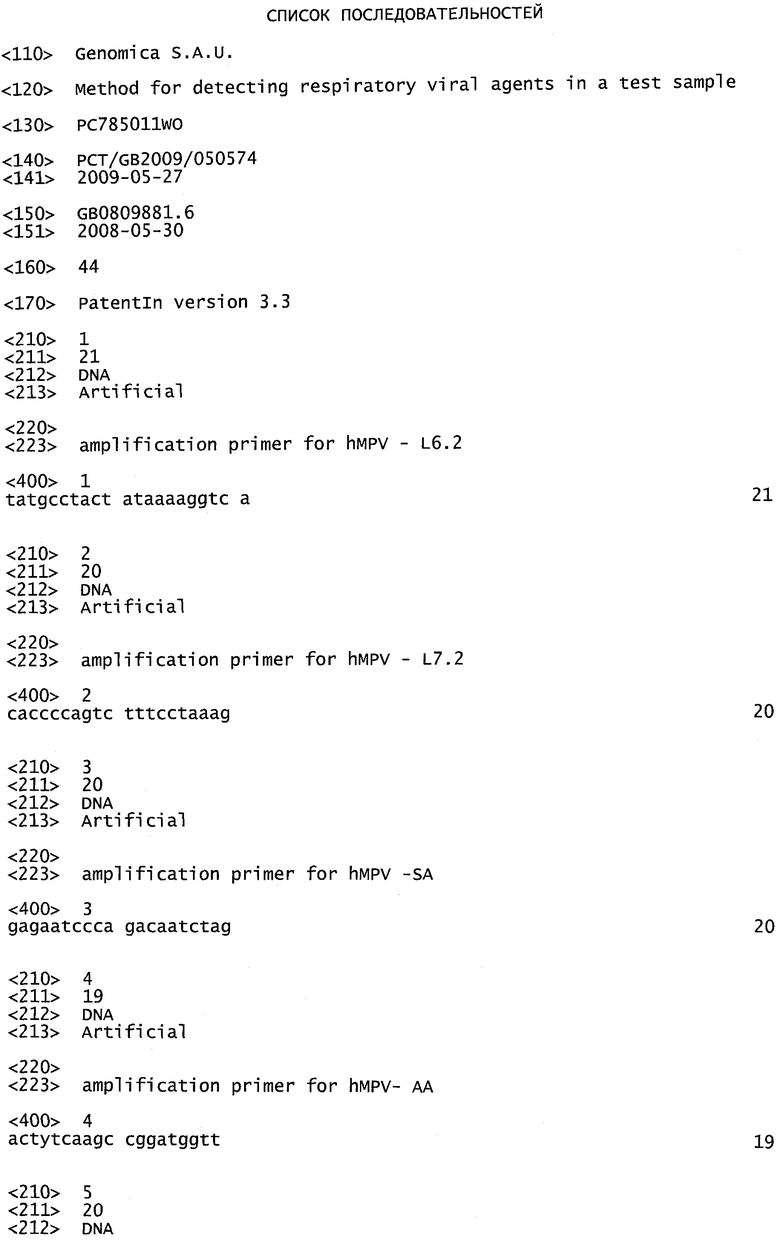
Фигура 1. Визуализация в агарозном геле продуктов амплификации, полученных с помощью реакции амплификации ПЦР в реальном времени с применением пары амплификационных праймеров L6 (SEQ ID №7) и L7 (SEQ ID №8) в отсутствие (дорожки 2-5) или в присутствии (дорожки 6-9) пары амплификационных праймеров L6.2 (SEQ ID №1) и L7.2 (SEQ ID №2).
Фигура 2. Результаты, полученные с помощью пробирок с матрицами, соответствующие образцу S7 (положительный по hMPV-A), подвергнутому амплификации согласно Multiplex 1 (панель А) и Multiplex 2 (панель В), и образцу S2 (положительному по hMPV-B), подвергнутому амплификации согласно Multiplex 1 (панель С) и Multiplex 2 (панель D).
Определения. Следующие термины имеют указанные значения в данной спецификации, если не оговорено другое значение.
Амплификационные праймеры - это нуклеиновые кислоты, которые связываются с одной или более целевой последовательностью, позволяя протекание ее амплификации.
Пробирка с матрицей - это индивидуальный сосуд с матрицей, который имеет форму и размер типичной лабораторной пробирки (например, эппендорфовской пробирки на 1,5 мл), содержащий микроматрицу, с которой можно проводить основанное на применении микроматрицы тестирование.
Сосуд с микроматрицей - это реакционный сосуд с плоским дном, содержащий микроматрицу. Молекулы проб микроматрицы могут быть нанесены на твердую подложку, причем эта твердая подложка может быть дном сосуда с микроматрицей, или другой твердой подложкой, прикрепленной ко дну сосуда с микроматрицей.
Эквивалент - это последовательность нуклеотидов, соответствующая таковой данной последовательности ДНК, где один или более нуклеотид является рибонуклеотидом или модифицированным нуклеотидом, таким как инозин, что не оказывает существенного влияния на характеристики гибридизации.
Внесение метки - это введение модифицированной группы в нуклеотидную последовательность.
Микроматрица - это молекулярные пробы, организованные на поверхности таким образом, что положение каждой пробы отдельно определено.
Реакции множественного (Multiplex) ПЦР и ПЦР в реальном времени - это реакции ПЦР и ПЦР в реальном времени, позволяющие амплифицировать две или более нуклеотидные последовательности, если таковые имеются.
Пробы - это нуклеиновые кислоты, способные специфически связывать целевую нуклеотидную последовательность. Сюда включены ДНК, РНК, ПНК и любые другие формы или модификации.
Чувствительность обнаружения - это минимальное количество копий, которое удается обнаружить. «Более высокая или улучшенная чувствительность» в данном контексте означает, что минимальное детектируемое количество копий уменьшено.
Полоска с сосудами - это ряд сосудов с матрицами, обычно из 8 штук, где каждый содержит микроматрицу, в которых можно проводить тестирование с помощью микроматриц.
Целевые последовательности - это последовательности, которые требуется обнаружить.
Специфичные для целевой нуклеиновой кислоты (целеспецифичные) пробы - это пробы, которые специфически гибридизуются с целевыми последовательностями, амплифицируемые с помощью реакции амплификации.
Осуществление изобретения
Настоящее изобретение относится к нуклеотидной последовательности, включающей последовательность, выбранную из группы, включающей SEQ ID №1-6 (таблица 1), комплементарные и эквивалентные им последовательности.
Нуклеотиды в последовательностях обозначены следующим образом: G означает гуанин, А - аденин, Т - тимин, С - цитозин, R означает G или A, Y означает Т или С, М означает А или С, К означает G или Т, S означает G или С, W означает А или Т, Н означает А или С, или Т, В означает G или Т, или С, V означает G или С, или A, D означает G или А, или Т и, наконец, N означает G или А, или Т, или С.
В предпочтительном осуществлении нуклеиновые кислоты согласно настоящему изобретению включают последовательности, выбранные из группы, включающей SEQ ID №1-6 из таблицы 1, комплементарные и эквивалентные им последовательности, дополнительно включающие 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 добавочных нуклеотидов на 5' или 3', или на обоих 5' и 3' концах. В другом предпочтительном осуществлении они состоят из последовательностей SEQ ID №1-6 из таблицы 1.
Нуклеотиды, как применяется в настоящем изобретении, могут представлять собой дезоксирибонуклеотиды, а также рибонуклеотиды, модифицированные нуклеотиды, такие как инозин, и нуклеотиды, содержащие модифицированные группы при том условии, что характеристики гибридизации не подвергаются существенному изменению. Такие вариации все включены в термин «эквиваленты». Предпочтительно, эквивалент включает один или более модифицированный нуклеотид. Альтернативно или дополнительно эквивалент включает один или более нуклеотид, не встречающийся в природе. В других осуществлениях эквивалент представляет собой РНК.
В предпочтительном осуществлении нуклеотидные последовательности согласно настоящему изобретению могут быть мечеными. В более предпочтительном осуществлении они мечены биотином.
Настоящее изобретение далее относится к применению одной или более нуклеотидной последовательности, как описано выше, в качестве амплификационного праймера при амплификации hMPV. В предпочтительном осуществлении настоящего изобретения нуклеотидные последовательности, включающие последовательности SEQ ID №1 и 2 и/или последовательности SEQ ID №3 и 4 и/или SEQ ID №5 и 6 или комплементарные и эквивалентные им последовательности, составляют пары амплификационных праймеров для hMPV. В другом предпочтительном осуществлении один или оба праймера каждой пары амплификационных праймеров являются мечеными.
Продукты амплификации из различных тестируемых образцов, полученные с применением пары амплификационных праймеров прототипа L6 и L7 (SEQ ID №7 и 8, соответственно, таблицы 1) в отсутствие или в присутствии пары амплификационных праймеров L6.2 и L7.2 (SEQ ID №1 и 2, соответственно, таблицы 1), сравнивают друг с другом в нижеприведенном примере 1. Визуализация продуктов амплификации производится путем электрофореза в агарозном геле. Как можно видеть на фигуре 1, амплификация с праймерами L6.2 и L7.2 приводит к обнаружения hMPV, присутствующего в образце, тогда как без них наличие hMPV не детектируется.
Один аспект настоящего изобретения относится к способу обнаружения hMPV в тестируемом образце, где способ включает контактирование тестируемого образца с одной или более нуклеотидной последовательностью, включающей последовательность, выбранную из группы, состоящей из SEQ ID №1-6, комплементарных и эквивалентных им последовательностей, и подвергание смеси реакции амплификации нуклеиновых кислот, где реакция амплификации направлена на амплификацию целевых последовательностей, присутствующих в образце.
Конкретное осуществление соответствует способу, в котором нуклеотидные последовательности, включающие последовательности SEQ ID №1 и 2 и/или последовательности SEQ ID №3 и 4, и/или SEQ ID №5 и 6, или комплементарные и эквивалентные им последовательности, составляют пары амплификационных праймеров для hMPV.
Амплификацию в ряде тестируемых образцов проводят со следующими наборами амплификационных праймеров:
- L6 и L7 в отсутствие L6.2 L7.2;
- L6 и L7 в присутствии L6.2 и L7.2 и
- SA, АА, SB и АВ (SEQ ID №3, 4, 5 и 6, соответственно).
Представительные примеры адекватных условий амплификации, соответствующих этому сравнительному исследованию, следует искать в примере 2.
Полученные таким путем продукты амплификации превращают в одноцепочечные олиго- или полинуклеотиды, за чем следует гибридизация со специфичными к целевой нуклеиновой кислоте пробами, соответствующими амплифицированным фрагментам, и визуализация результатов. Отдельные иллюстративные изображения приведены на фигуре 2. Чувствительность обнаружения при таком подходе обычно на порядок величин выше, чем в случае электрофореза в агарозном геле.
В таблице 2 приведены результаты, соответствующие ряду образцов, протестированных согласно экспериментальным условиям, описанным в примере 2.
Продукты амплификации, полученные с применением пар праймеров L6 и L7 как в отсутствие, так и в присутствии L6.2 и L7.2, подвергают денатурации и гибридизуют со вновь созданными пробами HMNVA-S37 и HMNVB-S38, которые служат для определения генотипов А и В hMPV соответственно.
Нуклеотиды в последовательностях обозначены следующим образом: G означает гуанин, А - аденин, Т - тимин, С - цитозин, R означает G или A, Y означает Т или С, М означает А или С, К означает G или Т, S означает G или С, W означает А или Т, Н означает А или С, или Т, В означает G или Т, или С, V означает G или С, или А, D означает G или А, или Т и, наконец, N означает G или А, или Т, или С.
Гибридизация продуктов амплификации с общей пробой известного для hMPV прототипа, такой как (TGGTGTGGGATATTAACAG), не дает другого результата.
Продукты амплификации, полученные с парами амплификационных праймеров SA/AA и SB/AB, денатурируют и гибридизуют со вновь созданными пробами:
Нуклеотиды в последовательностях обозначены следующим образом: G означает гуанин, А - аденин, Т - тимин, С - цитозин, R означает G или A, Y означает Т или С, М означает А или С, К означает G или Т, S означает G или С, W означает А или Т, Н означает А или С, или Т, В означает G или Т, или С, V означает G или С, или A, D означает G или А, или Т и, наконец, N означает G или А, или Т, или С.
Как видно из таблицы 2, способ согласно настоящему изобретению позволяет проводить более эффективное обнаружение hMPV, присутствующего в тестируемом образце, чем способы известных прототипов. Так, амплификация с праймерами L6.2 и L7.2 позволяет обнаружить hMPV в образцах, в которых амплификация с праймерами L6 и L7 дает отрицательный результат.
Дополнительно, амплификация с праймерами SA, АА, SB и АВ и гибридизация с пробами F249B, F256B и F256A дополняет способность праймеров L6.2 и L7.2 вплоть до выявления почти 100% положительных по hMPV образцов.
Другим преимуществом способа согласно настоящему изобретению по сравнению с существующими прототипами является то, что он позволяет различать типы А и В hMPV без секвенирования и/или анализа с применением рестриктаз. Дополнительно, амплификация hMPV совместима с присутствием амплификационных праймеров для обнаружения дополнительных респираторных вирусов гриппа А, гриппа В, гриппа С, PIV 1, PIV 2, PIV 3, PIV 4A, 4В, аденовируса, hRSV A, hRSV В, коронавируса 229, эховируса 30, риновируса и hBoV (см. пример 2 ниже в качестве представительного примера).
Поэтому в предпочтительном осуществлении способ согласно настоящему изобретению включает:
а) разделение тестируемого образца на два или более образца;
б) контактирование одного образца с первой смесью амплификационных праймеров, где указанная смесь содержит одну или две нуклеотидные последовательности, включающие последовательности SEQ ID №1 и 2 или комплементарные и эквивалентные им последовательности;
в) контактирование другого образца со второй смесью амплификационных праймеров, где указанная смесь содержит одну или две нуклеотидные последовательности, включающие последовательности SEQ ID №3 и 4 и/или одну или две нуклеотидные последовательности, включающие последовательности SEQ ID №5 и 6, или комплементарные и эквивалентные им последовательности;
г) подвергание разных рядов тестируемых образцов, смешанных с амплификационными праймерами, реакциям амплификации, направленным на амплификацию целевых последовательностей, присутствующих в образце.
В предпочтительном осуществлении настоящего изобретения первая смесь амплификационных праймеров дополнительно включает праймеры SEQ ID №7 и 8.
В другом предпочтительном осуществлении способ согласно настоящему изобретению дополнительно включает контактирование образца с одним или более амплификационным праймером для амплификации одного или более вирусного агента, выбранного из группы, включающей вирус гриппа А, вирус гриппа В, вирус гриппа С. С, PIV 1, PIV 2, PIV 3, PIV 4A, 4В, аденовирус, hRSV A, hRSV В, коронавирус 229, эховирус 30, риновирус и hBoV.
В наиболее предпочтительном осуществлении настоящего изобретения амплификационные праймеры, соответствующие вирусу гриппа А, вирусу гриппа В, вирусу гриппа С. С, PIV 1, PIV 2, PIV 3, PIV 4A, 4В, аденовирусу, hRSV A, hRSV В, коронавирусу 229, эховирусу 30, риновирусу и hBoV, следующие:
Нуклеотиды в последовательностях обозначены следующим образом: G означает гуанин, А - аденин, Т - тимин, С - цитозин, R означает G или A, Y означает Т или С, М означает А или С, К означает G или Т, S означает G или С, W означает А или Т, Н означает А или С, или Т, В означает G или Т, или С, V означает G или С, или A, D означает G или А, или Т и, наконец, N означает G или А, или Т, или С.
В предпочтительном осуществлении способ согласно настоящему изобретению включает:
а) разделение тестируемого образца на два или более образца;
б) контактирование одного образца с первой смесью амплификационных праймеров, где указанная смесь содержит нуклеотидные последовательности, включающие последовательности SEQ ID №1 и 2 или комплементарные и эквивалентные им последовательности и праймеры SEQ ID №7 и 8 в качестве амплификационных праймеров для hMPV, и пары амплификационных праймеров последовательностей SEQ ID №14-24 в качестве амплификационных праймеров для PIV 1, PIV 2, PIV 3, PIV 4A, 4В hRSV-A и коронавируса типа 229;
в) контактирование другого образца со второй смесью амплификационных праймеров, включающей нуклеотидные последовательности SEQ ID №3 и 4 и SEQ ID №5 и 6, или комплементарные и эквивалентные им последовательности в качестве амплификационных праймеров для hMPV, и пары амплификационных праймеров SEQ ID №25-38 в качестве амплификационных праймеров для вируса гриппа А, вируса гриппа В, вируса гриппа С, hRSV В, аденовируса, эховируса 30, риновируса и hBoV;
г) подвергание разных наборов тестируемых образцов, смешанных с амплификационными праймерами, реакциям амплификации, направленные на амплификацию целевых последовательностей, присутствующих в образце.
В предпочтительном осуществлении тестируемые образцы состоят из генетического материала, экстрагированного из оригинального образца. Экстракцию генетического материала можно проводить как с помощью автоматической, так и ручной техники экстракции, известной в данной области техники.
В наиболее предпочтительном осуществлении автоматическая система экстракции представляет собой NucliSENS easyMAG от BioMerieux (EP 1694813), в которой применяются магнитные частицы в сочетании с технологией BioMerieux's BOOM® для универсального выделения всех нуклеиновых кислот из широкого спектра образцов по объему и типу.
Специалист в данной области техники осведомлен о подходах и способах ручной обработки образцов с целью экстракции из них нуклеиновых кислот; можно применять любой соответствующий способ.
В конкретном примере нуклеиновые кислоты экстрагируют из 50 мкл тестируемого образца. После этапа экстракции осадок суспендируют в 20-25 мкл свободной от РНКазы воды.
В предпочтительном/конкретном осуществлении 5 мкл из 20-25 мкл, включающих генетический материал, экстрагированный из тестируемого образца, помещают в сосуд, содержащий реагенты для амплификации в конечном объеме 50 мкл.
Неотъемлемой проблемой множественных ПЦР является то, что присутствие нескольких праймеров в одной и той же реакции амплификации может приводить к взаимодействию между присутствующими праймерами, которое может препятствовать их гибридизации с соответствующими целевыми последовательностями и их амплификации. Это техническое препятствие было преодолено путем специфической комбинации амплификационных праймеров в смесях Multiplexes 1 и 2.
В предпочтительном осуществлении настоящего изобретения реакция амплификации представляет собой ПЦР в реальном времени.
В другом предпочтительном осуществлении один или более амплификационный праймер из каждой пары амплификационных праймеров является меченым, конкретно, с помощью биотина.
Альтернативно, метку вводят в продукт амплификации во время амплификации.
В предпочтительном осуществлении способ согласно настоящему изобретению дополнительно включает получение одноцепочечных олиго- или полинуклеотидов из любого продукта амплификации, что позволяет проводить гибридизацию таких одноцепочечных олиго- или полинуклеотидов с множеством (набором) целеспецифичных проб и обнаружение гибридизованных олиго- или полинуклеотидов. Более предпочтительно, одноцепочечные олиго- или полинуклеотиды получают путем денатурации любых присутствующих двухцепочечных олиго- или полинуклеотидов.
В предпочтительном осуществлении настоящего изобретения продукты ПЦР в реальном времени, полученные с применением амплификационных праймеров согласно настоящему изобретению, можно характеризовать с помощью технологии микроматриц. Технология микроматриц обеспечивает одновременное обнаружение большого количества молекулярных маркеров с диагностическими целями, при этом предоставляя контроли, необходимые для обеспечения надежности результатов.
В предпочтительном осуществлении настоящего изобретения метку можно вводить в продукт амплификации во время его амплификации, чтобы позволить его дальнейшее обнаружение; предпочтительно вводить метку, которая дает сигнал, который можно обнаружить колориметрическим способом. В наиболее предпочтительном осуществлении метка представляет собой биотин. Однако можно применять любой другой вид метки, известный в данной области техники (например, дигоксигенин). В отдельных осуществлениях можно также применять радиоактивные метки или флуорофоры. В предпочтительном осуществлении введение метки в продукт амплификации можно проводить путем добавления в смесь для амплификации модифицированных нуклеотидов, несущих метку (например, биотинилированных или дигоксигениновых производных дУТФ). В другом еще более предпочтительном осуществлении метка содержится в амплификационных праймерах.
В предпочтительном осуществлении настоящего изобретения продукт амплификации после предварительной денатурации гибридизуют с целеспецифичной пробой с целью минимизации проблемы, связанной с множественной ПЦР, которая часто приводит к получению продуктов неспецифической амплификации из-за присутствия нескольких праймеров.
В предпочтительном осуществлении денатурацию амплифицированной ДНК можно проводить путем нагревания. Можно также применять другие способы получения одноцепочечных ДНК после амплификации, например, химические способы.
В предпочтительном осуществлении настоящего изобретения одноцепочечную ДНК инкубируют с рядом целеспецифичных проб, содержащихся в микроматрице. В микроматрице представлена по меньшей мере одна проба, но более предпочтительно, более одной пробы со способностью к гибридизации с каждой целевой последовательностью. В отдельных осуществлениях изобретения одноцепочечнную ДНК можно также инкубировать с целеспецифичными пробами в растворе. Однако предпочтительно, чтобы пробы предоставлялись на твердой подложке.
В предпочтительном осуществлении настоящего изобретения пробы содержатся в микроматрице, которую можно поместить на покровное стекло или которая находится в реакционном сосуде, называемом далее сосудом с матрицей. Сосуды с матрицами могут быть представлены в разном формате, включая индивидуальные сосуды с матрицами, конкретно, пробирки с матрицами или наборы сосудов с матрицами, организованные в виде полоски или плоского планшета. Обычно планшеты состоят из рядов (полосок) сосудов с матрицами. Так, микроматрицы согласно настоящему изобретению могут содержаться в индивидуальном сосуде с матрицей. Альтернативно, две или более микроматрицы могут находиться в полоске из сосудов. В предпочтительном осуществлении полоска из сосудов содержит 8 сосудов. Дополнительно, три или более сосуда с матрицей могут быть организованы в набор полосок с сосудами. В другом предпочтительном осуществлении набор полосок с сосудами представляет собой планшет для микротитра (микротитр-планшет).
В предпочтительных осуществлениях молекулы проб микроматрицы могут быть нанесены на твердую подложку, причем эта твердая подложка может служить дном сосуда с матрицей, или на другую твердую подложку, которая может быть прикреплена ко дну сосуда с матрицей. Это означает, что поверхность микроматрицы может быть плоским дном сосуда с матрицей. Альтернативно, поверхность микроматрицы может быть твердой подложкой, прикрепленной ко дну сосуда с матрицей.
В одном осуществлении настоящего изобретения реакционный сосуд имеет типичный размер лабораторного реакционного сосуда. Типичные объемы заполнения находятся в интервале от 100 мкл до 2,5 мл, но могут быть также больше или меньше в отдельных осуществлениях. Особенно предпочтительным сосудом для матрицы является пробирка с матрицей, т.е. сосуд для матрицы с обычным объемом заполнения стандартной эппендорфовской пробирки до 1,5 мл. Дополнительными предпочтительными объемами заполнения являются объемы до 0,4 мл, до 0,5 мл, до 0,7 мл, до 1,0 мл или до 2,0 мл.
Благодаря наличию метки на амплифицированной ДНК, как только ее молекулы вступают во взаимодействие с молекулами пробы на поверхности микроматрицы, репортерный реагент связывается с меткой и дает видимые сигналы, которые можно обнаружить с помощью соответствующего приспособления. Взаимодействующие молекулы пробы и образца идентифицируют по расположению сигнала на поверхности микроматрицы. В конкретном случае, когда молекулы ДНК образца помечены биотином, репортерным реагентом может быть пероксидаза из хрена, ковалентно связанная со стрептавидином. Последний специфически связывается с биотином и пероксидаза запускает преципитацию субстратов, таких как тетраметилбензидин (ТМВ). Можно применять любую другую реакцию, которая приводит к преципитации на элементах микроматрицы и которую можно применять для обнаружения взаимодействия между целевыми молекулами и молекулами пробы согласно настоящему изобретению.
Настоящее изобретение дополнительно относится к набору для обнаружения и идентификации в тестируемом образце hMPV, где указанный набор включает одну или более смесь для амплификации нуклеиновых кислот, где по меньшей мере одна смесь для амплификации включает одну или более нуклеотидную последовательность, включающую последовательность, выбранную из группы, включающей SEQ ID №1-6, комплементарные и эквивалентные им последовательности.
В предпочтительном осуществлении набор согласно настоящему изобретению включает две или более смеси для амплификации:
- первую смесь, включающую первую и вторую нуклеотидные последовательности, включающие последовательности SEQ ID №1 и 2, соответственно, или комплементарные и эквивалентные им последовательности в качестве пары амплификационных праймеров для hMPV, и
- вторую смесь, включающую первую и вторую нуклеотидные последовательности, включающие последовательности SEQ ID №3 и 4, соответственно, и/или третью и четвертую нуклеотидные последовательности, включающие последовательности SEQ ID №5 и 6, соответственно, или комплементарные и эквивалентные им последовательности, в качестве компонентов других пар амплификационных праймеров для hMPV.
Первая смесь амплификационных праймеров может дополнительно включать праймеры L6 (SEQ ID №7) и L7 (SEQ ID №8).
Дополнительно, набор согласно настоящему изобретению может далее позволять обнаружение вируса гриппа А, вируса гриппа В, вируса гриппа С, PIV 1, PIV 2, PIV 3, PIV 4A, 4В, аденовируса, hRSV A, hRSV В, коронавируса 229, эховируса 30, риновируса и hBoV в тестируемом образце, где набор предпочтительно включает:
- пары праймеров SEQ ID №14-24 для PIV I, PIV 2, PIV 3, PIV 4A, 4В, hRSV А и коронавируса 229 в составе первой смеси для амплификации;
- пары праймеров SEQ ID №25-38 для вируса гриппа А, вируса гриппа В, вируса гриппа С, hRSV В, аденовируса, эховируса 30, риновируса и hBoV в составе второй амплификационной смеси.
В дополнение к амплификационным смесям набор может также включать:
1) сосуд с матрицей или набор сосудов с матрицами, где каждый сосуд включает микроматрицу, предоставляющую целеспецифичные пробы, и
2) реагенты для применения при визуализации гибридизации нуклеиновых кислот с пробами микроматрицы.
В предпочтительном осуществлении настоящего изобретения одна или более пробирка для амплификации дополнительно включает один или более внутренний контроль. В предпочтительном осуществлении протокол согласно настоящему изобретению включает внутренний контроль для этапа экстракции нуклеиновых кислот. В другом предпочтительном осуществлении протокол согласно настоящему изобретению включает внутренний контроль для этапа амплификации нуклеиновых кислот.
Предпочтительным внутренним контролем была бы ДНК плазмиды, которая может амплифицироваться с помощью пары амплификационных праймеров. В наиболее предпочтительном осуществлении настоящего изобретения одна или более из Multiplex пробирок включает ДНК для внутреннего контроля в виде плазмиды и праймеры RTS (GCTTGGGCGTGTCTCAAAATCT, SEQ ID NO 39) и RTA (GTCGCCACGGTTGATGAGAGCT, SEQ ID NO 40) для ее амплификации. Конкретно предпочтительные условия таковы:
В конечном объеме реакционной смеси 50 мкл.
Дополнительно особенно предпочтительные условия следующие:
В конечном объеме реакционной смеси 50 мкл.
Один или оба амплификационные праймеры RTS/ RTA могут быт мечеными.
Продукт амплификации, соответствующий ДНК внутреннего контроля, представляет собой фрагмент ДНК размером 885 пар оснований.
В конкретном осуществлении микроматрица включает пробы для специфического обнаружения внутреннего контроля, амплифицированного с применением амплификационных праймеров RTS и RTA. Конкретно, можно применять
Cl 1 5' (CAGCTGGCACGACAGGTTTCCCGACTGG, SEQ ID NO 41),
Cl 1 3' (TTGAAGTGGTGGCCTAACTACGG, SEQ ID NO 42) и
Cl 2 5' (CGTTCCACTGAGCGTCAGACCC, SEQ ID NO 43).
Дополнительно, предпочтительный внутренний контроль согласно настоящему изобретению может представлять собой фрагмент РНК, который можно было бы предпочтительно добавлять к тестируемому образцу перед экстракцией нуклеиновых кислот. Другой предпочтительный внутренний контроль может быть фрагментом РНК, который предпочтительно добавлять к нуклеиновой кислоте после ее экстракции из тестируемого образца. В более предпочтительном осуществлении фрагмент РНК может присутствовать в сосуде, содержащем реагенты для амплификации, перед инкубацией с нуклеиновыми кислотами, полученными из тестируемого образца.
В более предпочтительном осуществлении фрагмент РНК можно получать путем транскрипции плазмиды. В другом предпочтительном осуществлении фрагмент РНК мог быть получен путем химического синтеза.
Особенно предпочтительные целеспецифичные пробы, соответствующие продуктам амплификации hMPV согласно настоящему изобретению, включают последовательности, выбранные из группы, включающей SEQ ID №9-13, комплементарные и эквивалентные им последовательности. В наиболее предпочтительном осуществлении целеспецифичные пробы, соответствующие продуктам амплификации hMPV, включают последовательности SEQ ID №9-13.
Пробы согласно настоящему изобретению можно получать разными способами, например, путем химического синтеза (например, с помощью общепринятого фосфотриэфирного способа) или с помощью техник генной инженерии, например, путем молекулярного клонирования рекомбинантных плазмид, в которые вставлены соответствующие нуклеотидные последовательности, которые можно позднее получить путем обработки нуклеазами.
Специфичные пробы можно создавать с применением программы для сопоставления последовательностей нуклеиновых кислот (alignment) Oligo 6. Во всех случаях проводят анализ параметров Tm и соотношения G/C и избегают образования вторичных структур. Предпочтительными пробами согласно настоящему изобретению являются такие, у которых Tm одинаковы при концентрации соли, применяемой на этапе гибридизации. В предпочтительном осуществлении отбирают такие пробы, которые связываются с целевыми последовательностями в одинаковых условиях гибридизации. Специалисту в данной области техники известны другие способы конструкции специфичных проб.
В конкретном осуществлении настоящего изобретения пробы отбирают так, чтобы они не гибридизовались с геномной ДНК и не гибридизовались неспецифическим образом с амплифицированными фрагментами, соответствующими другим вирусам.
В предпочтительном осуществлении одна или более проба согласно настоящему изобретению находятся на твердой подложке.
В другом предпочтительном осуществлении две или более целеспецифичные пробы для одной и той же целевой последовательности находятся на твердой подложке с целью улучшения обнаружения искомых вирусных агентов.
Указанные пробы или смеси проб можно иммобилизовать в одном и том же положении на твердой подложке, предпочтительно, в двух разных положениях на твердой подложке и более предпочтительно в трех разных положениях на твердой подложке.
В предпочтительном осуществлении пробы согласно настоящему изобретению предоставляют на твердой подложке, находящейся внутри сосуда с матрицей.
В другом осуществлении пробы согласно настоящему изобретению предоставляют на твердой подложке, находящейся внутри сосудов полоски с матрицей.
В более предпочтительном осуществлении полоска сосудов с матрицей согласно настоящему изобретению включает 8 сосудов с матрицей.
В одном предпочтительном осуществлении твердая подложка представляет собой покровное стекло с покрытием.
В другом предпочтительном осуществлении твердая подложка представляет собой дно сосуда с матрицей, где сосуд с матрицей представляет собой индивидуальную пробирку с матрицей или компонент полоски из сосудов с матрицей или набора полосок сосудов, такого как микротитр-планшет.
В предпочтительном осуществлении взаимодействие между ДНК, амплифицированной с помощью пары праймеров согласно настоящему изобретению, и соответствующей пробой для ее обнаружения происходит в индивидуальном сосуде с матрицей, на полоске с сосудами или в наборе полосок с сосудами.
В предпочтительном осуществлении визуализация такого взаимодействия состоит из следующих этапов:
а) во-первых, получают изображение матрицы с помощью оптического приспособления,
б) затем изображение анализируют,
в) под конец представляется отчет, содержащий интерпретацию полученного результата.
Предпочтительно, изображение анализируют с помощью соответствующей программы.
Можно применять любой инструмент/приспособление, подходящее для этой работы.
Дополнительный аспект настоящего изобретения относится к применению вышеописанного способа и набора для обнаружения и идентификации в случае их присутствия в тестируемом образце одного или более вирусных агентов, выбранных из группы, включающей вирус гриппа А, вирус гриппа В, вирус гриппа С, PIV 1, PIV 2, PIV 3, PIV 4A, 4В, аденовирус, hRSV A, hRSV В, коронавирус 229, эховирус 30, риновирус и hBoV.
Как описано в примерах, представленных в настоящем изобретении, получено подтверждение того, что применение нуклеиновых кислот SEQ ID №1-6 в качестве амплификационных праймеров для амплификации hMPV позволяет получить лучшие данные в плане чувствительности обнаружения hMPV, чем в случае пары праймеров L6/L7 прототипа. Это соблюдается даже в присутствии амплификационных праймеров, соответствующих другим респираторным вирусам.
Другие аспекты настоящего изобретения соответствуют (1) смеси для амплификации нуклеиновых кислот, включающей в качестве амплификационных праймеров нуклеиновые кислоты, включающие SEQ ID №1 и 2 и/или нуклеиновые кислоты, включающие SEQ ID №3 и 4 и/или нуклеиновые кислоты, включающие SEQ ID №5 и 6 или комплементарные и эквивалентные им последовательности, (2) амплифицированные фрагменты, полученные с парами праймеров SEQ ID №1 и 2, 3 и 4 и 5 и 6, и (3) способ получения нуклеиновых кислот с последовательностями, включающими SEQ ID №1-6, комплементарные и эквивалентные им последовательности, где последовательности нуклеиновых кислот могут быть мечеными. Предпочтительно, метка представляет собой биотин.
Еще один аспект настоящего изобретения относится к пробам для обнаружения hMPV, включающим последовательности, выбранные из группы, включающей SEQ ID №9-13, комплементарные и эквивалентные им последовательности.
Сведения, подтверждающие возможность осуществления изобретения
Приведенные ниже примеры служат просто для иллюстрации изобретения и никоим образом не ограничивают области притязаний приложенной формулы изобретения.
Пример 1
Тестируемый образец из 200 мкл носоглоточного смыва подвергают автоматической экстракции с помощью системы NuchSENS easyMAG of BioMerieux с последующим ресуспендированием в 20 мкл очищенной от РНКазы воды.
5 мкл из общего объема 20 мкл помещают в два различных сосуда, где каждый содержит реагенты для амплификации в конечном объеме 50 мкл. Реагенты для амплификации включают амплификационные праймеры, известные в данной области техники, L6 и L7 (SEQ ID №7 и 8) в отсутствие (пробирка со знаком «-«) или в присутствии (пробирка со знаком «+») пары амплификационных праймеров L6.2 и L7.2 (SEQ ID №1 и 2, соответственно, по таблице 1).
Смесь для амплификации, соответствующая пробирке «+», следующая.
Приставка «В» означает «меченый биотином».
Смесь для амплификации, соответствующая пробирке «-», точно такая же, как в пробирке «+», за исключением того, что вместо амплификационных праймеров L6.2 и L7.2 добавлена очищенная от РНКазы вода.
Условия амплификации следующие.
Визуализация продуктов амплификации, соответствующих четырем различным тестируемым образцам, амплифицированным как в пробирке «-«, так и в пробирке «+», путем электрофореза в агарозном геле, приведена на фигуре 1.
Доказано, что описанные ранее экспериментальные условия одинаково эффективны для тестирования образцов, содержащих фарингальные выделения, носоглоточные выделения или бронхоальвеолярные смывы.
Пример 2
5 мкл из общего объема 20 мкл, полученного из тестируемых образцов S7 (положительный по hMPV-A) и S2 (положительный по hMPV-B) по способу, описанному в примере 1, добавляют к смесям реагентов Multiplex 1 или Multiplex 2 в конечном объеме 50 мкл.
Составы Multiplex 1 и 2 следующие.
Приставка «В» означает «меченый биотином».
Приставка «В» означает «меченый биотином».
Условия амплификации одинаковые для Multiplex 1 и 2.
Одноцепочечные олиго- и полинуклеотиды получают из соответствующих продуктов амплификации и оставляют их гибридизоваться с набором целеспецифичных проб, представленных на твердой подложке, заключенной в пробирке с матрицей.
Продукты амплификации, полученные с парой амплификационных праймеров L6 и L7 в отсутствие и в присутствии праймеров L6.2 и L7.2, денатурируют и гибридизуют со вновь созданными пробами HMNVA-S37 и HMNVB-S38 (SEQ ID №9 и 10, соответственно), которые служат, соответственно, для обнаружения генотипов А и В вируса hMPV.
Гибридизация вышеописанных продуктов амплификации с общей пробой для hMPV дает такой же результат.
Продукты амплификации, полученные с парами амплификационных праймеров SA/AA и SB/АВ, денатурируют и гибридизуют со вновь созданными пробами F249B, F256B и F256A (SEQ ID №11, 12 и 13,, соответственно), которые служат соответственно для обнаружения генотипов В, В и А вируса hMPV.
Представительные примеры изображений, соответствующих положительному по hMPV-A образцу (образец S7 в таблице 2) и положительному по hMPV-B образцу (образец S2 в таблице 2), приведены на фигуре 2. Условия амплификации, как показано для Multiplex 1 и 2, пробы для гибридизации представляют собой HMNVA-S37 и HMNVB-S38 в случае продуктов амплификации, полученных со смесью Multiplex 1, и F249B, F256B и F256A в случае продуктов амплификации, полученных со смесью Multiplex 2.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОРЫ ОЛИГОНУКЛЕОТИДОВ-ПРАЙМЕРОВ И ЗОНДОВ, БИОЛОГИЧЕСКИЙ МИКРОЧИП И ТЕСТ-СИСТЕМА ДЛЯ ИДЕНТИФИКАЦИИ И ТИПИРОВАНИЯ ВИРУСА ГРИППА А И В С ИХ ИСПОЛЬЗОВАНИЕМ | 2013 |
|
RU2538168C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ОБНАРУЖЕНИЯ И ИДЕНТИФИКАЦИИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ НУКЛЕИНОВЫХ КИСЛОТ В БИОЛОГИЧЕСКИХ ОБРАЗЦАХ | 2012 |
|
RU2595421C2 |
| АНАЛИЗ РЕСПИРАТОРНОЙ ИНФЕКЦИИ | 2012 |
|
RU2642304C2 |
| ПОВЫШЕНИЕ ВЫХОДА ВИРУСОПОДОБНЫХ ЧАСТИЦ В РАСТЕНИЯХ | 2012 |
|
RU2682752C2 |
| ПОЛИПЕПТИДЫ ИЗ NEISSERIA MENINGITIDIS | 2007 |
|
RU2450019C2 |
| Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации РНК JMTV методом ПЦР с гибридизационно-флуоресцентной детекцией | 2023 |
|
RU2818960C1 |
| ПОЛУЧЕНИЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ ВИРУСА ГРИППА В РАСТЕНИЯХ | 2014 |
|
RU2742607C1 |
| ПОЛУЧЕНИЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ ВИРУСА ГРИППА В РАСТЕНИЯХ | 2014 |
|
RU2705555C2 |
| СПОСОБ ДЕТЕКЦИИ ВИРУСА ГЕРПЕСА В ТЕСТИРУЕМОМ ОБРАЗЦЕ | 2009 |
|
RU2470999C2 |
| Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации РНК коронавируса человека 2019-nCoV методом ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени | 2020 |
|
RU2734300C1 |







Изобретение относится к области биотехнологии и вирусологии. Описаны способ и набор для обнаружения и идентификации метапневмовируса человека (hMPV) в тестируемых образцах, а также ряд последовательностей и их применение в качестве амплификационных праймеров для hMPV. Амплификация hMPV согласно настоящему изобретению совместима с обнаружением других вирусов, вызывающих респираторные инфекции, а также с проведением генотипирования hMPV, присутствующего в образце. После подвергания тестируемого образца амплификации с праймерами, специфичными для каждого вируса, из продуктов амплификации получают одноцепочечные ДНК и гибридизуют их со специфичными к соответствующим вирусам пробами. 5 н. и 1 з.п. ф-лы, 2 ил., 12 табл., 2 пр.
1. Способ обнаружения метапневмовируса человека (hMPV) в тестируемом образце, включающий
(a) разделение тестируемого образца на два и более образца,
(b) контакт первого образца с первой смесью амплификационных праймеров, причем указанная смесь включает первую и вторую нуклеотидные последовательности, включающие SEQ ID NO:3 и 4 соответственно и треть и четвертую нуклеотидные последовательности, включающие SEQ ID NO:5 и 6 соответственно, и/или комплементарные им последовательности или последовательности, отличающиеся от последовательностей SEQ ID NO:3, 4, 5 и 6 на одну мутацию;
(c) контакт второго образца со второй смесью амплификационных праймеров, причем указанная смесь включает первую и вторую нуклеотидные последовательности, включающие SEQ ID NO:1 и 2 соответтвенно, и третью и четвертую нуклеотидные последовательности, включающие SEQ ID NO:7 и 8 соответственно, и/или комплементарные им последовательности или последовательности, отличающиеся от последовательностей SEQ ID NO:1, 2, 7 и 8 на одну мутацию;
(d) осуществление реакций амплификации, направленных на амплификацию целевых последовательностей, присутствующих в образце, с различными наборами тестовых образцов, смешанных с амплификационными праймерами;
(e) получение одноцепочечных олиго- или полинуклеотидов из любого продукта амплификации, что позволяет проводить гибридизацию таких одноцепочечных олиго- или полинуклеотидов с большим числом (набором) целеспецифичных проб, где продукты амплификации, полученные из первой смеси амплификационных праймеров, гибридизуются с целеспецифичными пробами, содержащими одну или несколько проб, выбранных из группы, содержащей SEQ ID NO:11-13, комплементарные им последовательности и последовательности, которые отличаются от них на одну мутацию, а продукты амплификации, полученные с помощью второй смеси амплификационных праймеров, гибридизуются с целеспецифичными пробами, содержащими одну или несколько проб, выбранных из группы, содержащей SEQ ID NO:9 и 10, комплементарные им последовательности и последовательности, которые отличаются от них на одну мутацию; и
(f) обнаружение гибридизованных одноцепочечных олиго- или полинуклеотидов.
2. Способ по п.1, отличающийся тем, что одноцепочечные олиго- или полинуклеотиды получают путем денатурации любых присутствующих двухцепочечных олиго- или полинуклеотидов, находящихся в продуктах амплификации.
3. Набор для обнаружения и идентификации hMPV в тестируемом образце, включающий две и более смеси для амплификации,
первую смесь, включающую первую и вторую нуклеотидные последовательности, включающие SEQ ID NO:3 и 4 соответственно, и третью и четвертую нуклеотидные последовательности, включающие SEQ ID NO:5 и 6 соответственно, или комплементарные им последовательности и последовательности, отличающиеся от последовательностей SEQ ID NO:3, 4, 5 и 6 на одну мутацию, в качестве пары амплификационных праймеров для hMPV, и
вторую смесь, включающую первую и вторую нуклеотидные последовательности, включающие SEQ ID NO:1 и 2 соответственно, и третью и четвертую нуклеотидные последовательности, включающие SEQ ID NO:7 и 8 соответственно и/или комплементарные им последовательности и последовательности, отличающиеся от последовательностей SEQ ID NO:1, 2, 7 и 8 на одну мутацию, в качестве пары амплификационных праймеров для hMPV;
сосуд с матрицей или ряд сосудов с матрицей, где каждый включает микроматрицу, содержащую полиспецифические пробы, которые включает одну или более последовательностей, выбранных из группы, включающей SEQ ID NO:9-13, комплементарные им последовательности и последовательности, отличающиеся от них на одну мутацию, и которые предлагаются в качестве целеспецифичных проб для hMPV.
4. Пара праймеров для обнаружения hMPV, включающая первую и вторую нуклеотидные последовательности SEQ ID NO:3 и 4 соответственно.
5. Пара праймеров для обнаружения hMPV, включающая первую и вторую нуклеотидные последовательности SEQ ID NO:5 и 6 соответственно.
6. Пробы для обнаружения hMPV, включающие последовательности, выбранные из группы, включающей SEQ ID NO:9-13, комплементарные им последовательности и последовательности, отличающиеся от них на одну мутацию.
| US 20060014140 A1, 19.01.2006 | |||
| US 20060216700 A1, 28.09.2006 | |||
| US 20060228367 A1, 12.10.2006 | |||
| Трансмиссионный динамометр | 1927 |
|
SU6879A1 |
Авторы
Даты
2013-04-10—Публикация
2009-05-27—Подача