Ссылка на родственные заявки
По данной заявке испрашивается приоритет в соответствии с предварительной заявкой на патент США №60/894610, поданной 13 марта 2007 года.
Область изобретения
Способы, описанные в настоящем документе, касаются лечения рака мочевого пузыря. Более конкретно, описанные способы относятся к внутрипузырному введению апазиквона после трансуретральной резекции.
Уровень техники
Рак мочевого пузыря является седьмым среди самых распространенных во всем мире злокачественных опухолей. В 2006 году было приблизительно 280000 случаев рака мочевого пузыря в Европе и более 60000 новых случаев ожидалось в Соединенных Штатах. Самым распространенным типом рака мочевого пузыря (90%) является переходноклеточная карцинома (ПКК), которая происходит из уротелия, клеточного покрова уретральной системы (мочеточники, мочевой пузырь и уретра). Приблизительно 75% диагностируемого рака мочевого пузыря являются поверхностными на начальных этапах, что означает их нахождение около поверхности уротелия. Более конкретно, поверхностные опухоли состоят из папиллярных опухолей, которые ограничиваются слизистой оболочкой (Ta), папиллярными или сидячими опухолями, распространяющимися в собственную пластинку (ламина проприа) (T1), и карциному in situ (КИС). Все типы ограничиваются слизистой оболочкой или подслизистым слоем без инвазии в мышцы.
Поверхностный рак мочевого пузыря может подразделяться на прогностические классы риска согласно стадии, степени, размеру, количеству опухолевых поражений и структуре рецидива. Опухоли ранней стадии, низкой степени злокачественности (стадия Ta, степени G1-G2) имеют 30% частоту рецидивов в течение 2 лет и обычно не развиваются в стадию инвазии в мышцы, в то время как в случае других, крайних множественных высокорецидивных или крупных Т1 G3 опухолей, наблюдаются рецидивы с частотой 70-80% и развитие в стадию инвазии в мышцы с частотой 10-30%. Карцинома in situ (КИС) представляет самый высокий риск прогрессии опухоли.
Начальным лечением капиллярной ПКК, представлена в стадиях Ta и T1, обычно является полная трансуретральная резекция опухоли мочевого пузыря (ТУРОМП) (то есть хирургическое удаление всех видимых поражений), в то время как наличие КИС обычно указывает на другие дополнительные меры вследствие высокого риска развития. Например, пациентам с КИС часто проводят полезное лечение посредством внутрипузырного капельного вливания цитотоксического или иммунологического средства (обычно бациллы Кальметта-Герена (БКГ)). Лечение БКГ последовательно показало преимущество перед ТУРОМП отдельно в сроках безрецидивной выживаемости. Адъювантное лечение БКГ может также понизить частоту перехода заболевания в стадию инвазии.
Даже при том, что риск прогрессии заболевания в стадию инвазии низок в опухолях с низким риском, многократные случаи рецидива этого поверхностного рака мочевого пузыря часто требуют повторного вмешательства и вызывают значительные проблемы для пациента. Поэтому более эффективное лечение, которое уменьшает рецидив поверхностного рака мочевого пузыря, обеспечило бы важный успех в лечении этих опухолей.
Раскрытие изобретения
Настоящее изобретение направлено на способ лечения злокачественной опухоли, включающий введение пациенту, нуждающемуся в таком лечении, композиции, включающей терапевтически эффективное количество апазиквона (EO9) после трансуретральной резекции опухоли мочевого пузыря (ТУРОМП).
В одном варианте осуществления настоящее изобретение относится к способу лечения злокачественной опухоли, включающему стадию проведения ТУРОМП пациентам, нуждающимся в этом, за которой следует введение путем капельного внутрипузырного вливания терапевтической композиции, содержащей терапевтическое количество апазиквона. В одном аспекте терапевтическую композицию вводят в течение приблизительно 6 часов после ТУРОМП. В другом аспекте терапевтическую композицию вводят в течение приблизительно 5 часов после ТУРОМП. В другом аспекте терапевтическую композицию вводят в течение приблизительно 4 часов после ТУРОМП. В другом аспекте терапевтическую композицию вводят в течение приблизительно 3 часов после ТУРОМП. В другом аспекте терапевтическую композицию можно применять в единичной дозе. В другом аспекте терапевтическая композиция может быть перерастворенной и/или лиофилизированной до или после выполнения ТУРОМП пациентам, нуждающимся в этом.
В одном варианте осуществления настоящие способы применяют для лечения рака мочевого пузыря. В другом варианте осуществления настоящие способы применяют для лечения неинвазивного рака мочевого пузыря (ПРМП). В другом варианте осуществления настоящие способы применяют для лечения переходноклеточной карциномы мочевого пузыря. В другом варианте осуществления настоящие способы применяют для лечения злокачественной опухоли стадии Ta или T1 по классификации TNM и гистологической степени G1 или G2 перед ТУР.
В одном варианте осуществления способ лечения злокачественной опухоли может включать введение терапевтически эффективного количества от приблизительно 1 мг до приблизительно 8 мг на дозу апазиквона в перерастворенной лиофилизированной терапевтической композиции. В другом варианте осуществления способ лечения злокачественной опухоли может включать введение терапевтически эффективного количества, составляющего от приблизительно 2 мг до приблизительно 6 мг на дозу апазиквона, необязательно от приблизительно 10 мг до приблизительно 200 мг маннита, и необязательно от приблизительно 2 мг до приблизительно 300 мг бикарбоната натрия в терапевтической композиции. В другом варианте осуществления способ лечения злокачественной опухоли может включать применение терапевтической композиции, содержащей от приблизительно 0 мл до приблизительно 24 мл пропиленгликоля и от приблизительно 0 мг до приблизительно 10 мг ЭДТУК (этилендиаминтетрауксусной кислоты). Эти терапевтические композиции можно вводить пациенту, нуждающемуся в лечении злокачественной опухоли, после ТУРОМП. В другом варианте осуществления лиофилизированную перерастворенную терапевтическую композицию можно вводить путем однократного внутрипузырного капельного вливания.
В одном аспекте способ лечения злокачественной опухоли может включать введение перерастворенной лиофилизированной терапевтической композиции в объеме между приблизительно 2 мл и приблизительно 80 мл. В другом аспекте способ лечения злокачественной опухоли может включать введение перерастворенной лиофилизированной терапевтической композиции в объеме между приблизительно 30 мл и приблизительно 60 мл. В другом аспекте способ лечения злокачественной опухоли может включать введение перерастворенной лиофилизированной терапевтической композиции в объеме приблизительно 40 мл.
В одном варианте осуществления терапевтическую композицию, вводимую после ТУРОМП, можно получать с использованием разбавителей, имеющих от приблизительно 0% до приблизительно 60% об./об. пропиленгликоля, от приблизительно 0 мг/мл до приблизительно 5 мг/мл ЭДТУК, и от приблизительно 0 мг/мл до приблизительно 20 мг/мл бикарбоната натрия и воду. В другом варианте осуществления разбавители имеют от приблизительно 20% до приблизительно 40% об./об. пропиленгликоля, от приблизительно 0,01 мг/мл до приблизительно 1 мг/мл ЭДТУК, и от приблизительно 1 мг/мл до приблизительно 10 мг/мл бикарбоната натрия и воду. В другом варианте осуществления разбавители могут иметь приблизительно 30% об./об. пропиленгликоля, приблизительно 0,1 мг/мл ЭДТУК и приблизительно 5 мг/мл бикарбоната натрия и воду. В одном аспекте терапевтическую композицию можно применять путем внутрипузырного введения. В другом аспекте терапевтическая композиция может быть перерастворенной и/или лиофилизированной до или после проведения ТУРОМП пациентам, нуждающимся в этом. В другом аспекте терапевтическую композицию можно вводить однократным капельным вливанием, проводимым в пределах шести часов после ТУРОМП.
Подробное описание
Соединения индолохинона, как известно, пригодны в качестве цитостатических средств для лечения злокачественной опухоли у человека. См., например, патент США №5079257, включенный в настоящий документ в качестве ссылки в полном объеме, в отношении его указаний, связанных с синтезом, метаболизмом и терапевтической активностью индолохинонов. Кроме того, см., например, патент США №6894071, включенный в настоящий документ в качестве ссылки в полном объеме, в отношении его указаний, связанных с составами апазиквона.
В настоящем описании описано применение препаратов, содержащих биологически восстанавливающийся алкилирующий индолохинон с противоопухолевыми эффектами, таких как, но не ограничиваясь этим, апазиквон (EO9), после трансуретральной резекции опухоли мочевого пузыря (ТУРОМП) для лечения рака мочевого пузыря, неинвазивного рака мочевого пузыря, поверхностного рака мочевого пузыря (ПРМП), переходноклеточной карциномы мочевого пузыря, или рака стадии Та или Т1 по классификации TNM и/или гистологической степени G1 или G2.
Апазиквон (рекомендованный INN) также известен как EO9 или NSC-382459. Химически он представляет собой 5-(азиридин-1-ил)-3-(гидроксиметил)-2-[(1E)-3-гидроксипроп-1-енил]-1-метил-1H-индол-4,7-дион (INN) со структурной формулой:
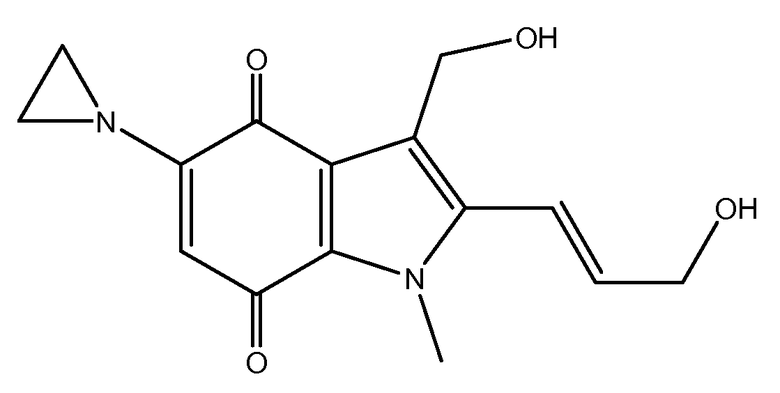
Апазиквон является полностью синтетическим биологически восстанавливающимся алкилирующим индолохиноном. Он является пролекарством, которое образует цитотоксическое соединение после ферментативной активации. Фермент DTD (DT-диафораза, также называемый NAD(P)H:хиноноксидоредуктаза-1 или NQO1) играет важную роль в активации апазиквона в аэробных условиях. Апазиквон также является цитотоксическим в гипоксических условиях, таких как в клетках с низкой активностью DTD. Полагают, что основной механизм активации апазиквона подобен механизму активации других индолохинонов, вовлекающему восстановление клеточными ферментами, которые переносят один или два электрона с образованием семихинона и гидрохинона, соответственно. Окисление семихинона в аэробных условиях приводит к окислительно-восстановительному циклу, который может вызывать гибель клетки посредством образования активных форм кислорода (АФК), приводящих к разрыву нити ДНК. Семихинон/гидрохинон может, особенно в гипоксических условиях, алкилировать и сшивать ДНК и другие макромолекулы, вызывая гибель клетки.
Редуктазы, экспрессируемые в опухолях, могут играть важную роль в селективности апазиквона. NQO1 (NAD(P)H:хиноноксидоредуктаза), двухэлектронный фермент редуктаза, может быть селективно нацелен на насыщенные кислородом клетки, в то время как одноэлектронные восстанавливающие ферменты, такие как цитохром P450-редуктаза, могут быть более эффективными в нацеливании на гипоксические клетки. Loadman et al., Br. J. Pharmacol., 137, 701-709, 2002.
Лиофилизированные препараты апазиквона имеют повышенную стабильность. Такие препараты могут включать наполнитель, такой как, но не ограничиваясь ими, мальтит, маннит, ксилит, сорбит, изомальтоза, олигофруктоза и полидекстроза. Лиофилизированный препарат апазиквона также может включать регулятор рН в количестве, достаточном для поддержания рН в области нейтрального диапазона. Регулятор рН может включать, но не ограничиваться ими, карбонат натрия, карбонат калия, гидроксид кальция, гидроксид натрия, гидроксид магния, гидроксид калия, бикарбонат натрия, оксид магния или оксид кальция.
Лиофилизированные препараты апазиквона, как описано в настоящем документе, можно перерастворять любым фармацевтически приемлемым разбавителем, чтобы приготовить фармацевтически приемлемый раствор для введения пациенту после ТУР. Фармацевтические разбавители, пригодные для перерастворения лиофилизированных препаратов по настоящему изобретению, могут включать, но не ограничиваться ими, разбавители, содержащие пропиленгликоль, бикарбонат натрия, ЭДТУК и/или воду. Предпочтительным путем введения дозы является внутрипузырное капельное вливание. Величина дозировки может изменяться вследствие нескольких факторов, включая, но не ограничиваясь ими, индивидуальные характеристики пациента, тип и/или стадию злокачественной опухоли или конкретный состав.
В предыдущих фазе I и фазе II клинических испытаний апазиквона для лечения злокачественной опухоли апазиквон вводили внутривенно. Лекарственное средство относительно хорошо переносилось 129 пациентами, которым проводили внутривенную инъекцию апазиквона. Ограничивающая дозу токсичность после внутривенного введения представляла собой протеинурию. Несмотря на сообщения о трех частичных ответах в испытаниях фазы I, в фазе II клинических испытаний при внутривенном введении лекарственного средства никаких ответов не наблюдали. Наиболее вероятное объяснение отсутствия ответа опухоли состоит в том, что апазиквон имеет время полужизни 0-19 минут в кровотоке, и поэтому при внутривенном введении его быстрое фармакокинетическое выведение эффективно препятствует доставке лекарственного средства к опухолям.
Фармакокинетические свойства апазиквона, которые делают его неблагоприятным для внутривенного введения, могут быть преимущественными при лечении поверхностных злокачественных опухолей, которые возникают в легкодоступном третьем компартменте, например, в мочевом пузыре, поскольку внутрипузырное введение позволяет обойти описанные проблемы внутривенной доставки лекарственного средства. Удержание лекарственного средства в пределах мочевого пузыря в течение одного часа может повысить проникновение лекарственного средства и доставку значительных количеств в опухоли, в то время как его всасывание в кровоток остается маловероятным. Однако даже если бы какое-нибудь лекарственное средство достигло системного кровотока, оно бы было быстро выведено, что минимизирует риск системной токсичности. Основываясь на указанных выше и последующих испытаниях, подтверждающих наличие как повышенных уровней DTD, так и областей гипоксии в поверхностном раке мочевого пузыря, апазиквон был изготовлен в качестве EOquin® для применения во внутрипузырном капельном вливании при лечении ПРМП.
Фармацевтические композиции, содержащие активный ингредиент по настоящему изобретению, пригодны для введения человеку или другим млекопитающим. Как правило, фармацевтические композиции являются стерильными и не содержат токсичных, канцерогенных или мутагенных соединений, которые при введении могут вызвать неблагоприятные реакции. Введение фармацевтической композиции можно проводить до, во время или после начала роста солидной опухоли.
"Активный ингредиент" относится к активной части композиции и может включать, но не ограничиваться этим, апазиквон. Терапевтическая композиция может содержать активные ингредиенты, как описано, или его физиологически приемлемую соль, производное, пролекарство или сольват. Активные ингредиенты можно вводить в качестве чистого соединения или в качестве фармацевтической композиции, содержащей одно или несколько веществ.
"Фармацевтическая композиция" или "терапевтическая композиция" включает композиции, в которых активные ингредиенты вводят в количестве, эффективном для достижения намеченной цели. Более конкретно, "терапевтически эффективное количество" или "терапевтическое количество" означает количество, эффективное для предотвращения развития, устранения, замедления прогрессии или уменьшения размера солидной опухоли. Специалист в данной области способен определить терапевтически эффективное количество, особенно с учетом подробного описания, представленного в настоящем документе.
"Терапевтически эффективная доза" или "терапевтически эффективный" относится к такому количеству активных ингредиентов, которое приводит к достижению желательного эффекта. Токсичность и терапевтическую эффективность таких активных ингредиентов можно определять стандартными фармацевтическими способами на клеточных культурах или экспериментальных животных, например, определение ЛД50 (доза, летальная для 50% популяции) и ЭД50 (доза, терапевтически эффективная для 50% популяции). Отношение между дозами для токсических и терапевтических эффектов является терапевтическим индексом, который выражается как отношение ЛД50 к ЭД50. Предпочтительным является высокий терапевтический индекс. Полученные данные можно использовать для получения диапазона дозировок для применения у человека. Дозировка активных ингредиентов предпочтительно находится в пределах диапазона концентраций в кровотоке, который включает ЭД50 при небольшом количестве токсичности или при отсутствии токсичности. Дозировка может варьировать в пределах этого диапазона в зависимости от используемой дозированной формы и применяемого способа введения.
Точный состав и дозировку может определить каждый конкретный врач с учетом состояния пациента и типа или стадии злокачественной опухоли.
Количество введенной фармацевтической композиции может зависеть от субъекта, подвергаемого лечению, от массы тела субъекта, тяжести заболевания, способа введения и суждения назначающего врача.
Активные ингредиенты можно вводить отдельно или в смеси с фармацевтическим носителем, выбранным с учетом намеченного пути введения и стандартной фармацевтической практики. Фармацевтические композиции для применения в соответствии с настоящим описанием, таким образом, можно изготавливать обычным образом с использованием одного или нескольких физиологически приемлемых носителей, включающих инертные эксципиенты и вспомогательные средства, которые облегчают переработку активных ингредиентов в препараты, которые можно использовать в фармацевтике.
Когда вводят терапевтически эффективное количество активных ингредиентов, композиция может иметь форму не содержащего пирогенов парентерально приемлемого водного раствора. Получение таких парентерально приемлемых растворов, имеющих соответствующие рН, изотоничность, стабильность и т.п., находится в пределах квалификации специалистов в данной области.
"Начало капельного вливания" является временем начала капельного вливания терапевтической композиции после ТУРОМП, в то время как "конец удерживания" является временем, когда происходит отток или опорожнение вводимой терапевтической композиции и другого содержимого мочевого пузыря, то есть время, в течение которого завершается удержание лекарственного средства в мочевом пузыре.
Для ветеринарного применения активные ингредиенты вводят в качестве подходящего приемлемого состава в соответствии с нормальной ветеринарной практикой. Ветеринар может легко определить режим дозирования, который является наиболее пригодным для конкретного животного.
Следующие примеры представлены как иллюстративные варианты осуществления настоящего изобретения. Однако настоящее описание не должно быть ограничено в любом случае примерами, изложенными ниже. Любой один или несколько признаков любого примера можно комбинировать с любым одним или несколькими признаками любого другого варианта осуществления или примера описанных в настоящем документе способов, не отступая от объема настоящего изобретения.
Испытание внутрипузырного капельного вливания апазиквона
Для испытаний, описанных в примерах 1 и 2, EOquin® перерастворяли в 20 мл разбавителя, и далее разбавляли водой для инъекции (20 мл) до общего объема вливаемой жидкости 40 мл. Ее капельно вливали в мочевой пузырь пациента через мочеточниковый катетер через две недели после трансуретральной резекции опухоли мочевого пузыря (ТУРОМП). Вливаемая жидкость сохранялась в мочевом пузыре в течение одного часа. Курс лечения состоял из шести вливаний через одну неделю каждая.
Пример 1
В первом испытании с использованием внутрипузырного введения, EOquin® вводили 12 пациентам с ПРМП стадии Та или Т1 по классификации TNM, гистологической степени G1 или G2. Все пациенты имели рецидивные множественные (от 2 до 10), поверхностные опухоли, из которых все, кроме одного "маркерного очага повреждения" диаметром 0,5-1 см, были иссечены трансуретральной резекцией (ТУРОМП) до испытания. Ответ опухоли определяли как полный ответ (ПО), отсутствие ответа (ОО) или прогрессирующее заболевание (ПЗ), подтверждаемые цистоскопией и гистологией (биопсия области начального маркерного очага поражения или полная резекция любого остаточного или нового очага повреждения) через четыре недели после последнего вливания. EOquin® вводили еженедельно в течение шести недель, начиная через две недели после ТУРОМП.
В части фазы 1 испытания шести пациентам вводили EOquin® в концентрациях, которые увеличивались еженедельно на 100% (0,0125 мг/мл; 0,025 мг/мл; 0,05 мг/мл; 0,1 мг/мл; 0,2 мг/мл; и 0,4 мг/мл и в этом определенном примере, 0,5, 1, 2, 4, 8 и 16 мг в 40 мл). После определения рекомендуемой дозы в этой группе с повышением дозы у пациентов, шести дополнительным пациентам вводили фиксированную еженедельную дозу 0,1 мг/мл (в этом конкретном примере, 4 мг EOquin® в 40 мл жидкости). Двое пациентов в группе с повышением дозы у пациентов испытывали связанные с EOquin локальные побочные эффекты после дозы 0,2 мг/мл и им вводили 0,1 мг/мл при шестом капельном вливании. Рекомендуемая доза составляла 0,1 мг/мл (4 мг в 40 мл вливаемой жидкости).
Эффективность. Ответ опухоли через четыре недели после последнего капельного вливания представлял собой 4/6 полных ответов (ПО) в группе с фиксированной дозой. Также было 4 ПО из 6 в группе с повышением дозы.
Безопасность. При повышении дозы у пациентов наблюдали мягкую или умеренную боль в мочевом пузыре и дизурию на всех уровнях дозы. Гематурию наблюдали только на уровнях дозы 0,2 мг/мл и 0,4 мг/мл. Другими сообщенными жалобами (по одному случаю каждой) были тошнота, изменение цвета языка и прилив крови на уровне в 0,0125 мг/мл и вазовагальные явления при 0,2 мг/мл. Практически все неблагоприятные эффекты были степени 1 или 2. При испытании не было никаких смертельных случаев.
Пример 2
Это испытание представляло собой многоцентровое нерандомизированное открытое испытание фазы II у пациентов с первичными или рецидивными множественными (2-10) очагами повреждения Ta или T1, G1 или G2 переходноклеточного ПРМП. Перед началом испытания пациентам была проведена ТУРОМП всех очагов повреждения, кроме одного (маркерного) очага повреждения диаметром 0,5-1 см.
Капельные вливания проводили еженедельно в течение шести недель. Ответ опухоли подтверждали биопсией или полной резекцией любой остаточной опухоли через две-четыре недели после последнего капельного вливания. Ответ опухоли оценивали как полный ответ (ПО), отсутствие ответа (ОО) или прогрессирующее заболевание (ПЗ).
Из 46 включенных в исследование пациентов 37 имели рецидивный ПРМП. Более 50% пациентов имели предшествующую ТУРОМП плюс внутрипузырную иммунотерапию и/или химиотерапию. Всего 17% перенесли ТУР-ОМП отдельно, и 17% не получали предшествующего лечения. При гистологическом исследовании у двух пациентов степень опухоли была переклассифицирована как G3.
Эффективность. Ответами опухолей были 31 ПО у 46 пациентов (67%). Не было никаких случаев "прогрессирующего заболевания", то есть прогрессирования степени T выше 1 во время оценки ответа, как определено в протоколе.
Безопасность. Лечение хорошо переносилось большинством пациентов, и имелось несколько системных (не связанных с мочевым пузырем) неблагоприятных эффектов, которые считали связанными с EOquin®.
При сравнении, активность внутрипузырного капельного вливания EOquin® является благоприятной относительно активности других цитотоксических или иммунологических средств, изученных в маркерных очагах повреждения поверхностного рака мочевого пузыря. Данные по безопасности в общей сложности у 58 пациентов в фазе I и фазе II испытания также сравнимы с данными по другим химиотерапевтическим средствам, в настоящее время используемым при внутрипузырном вливании. О системных побочных эффектах сообщали редко. Полную внутрипузырную дозу для капельного вливания 4 мг, соответствующую 20% или менее переносимой еженедельной внутривенной дозы (12 мг/м2, что эквивалентно суммарной дозе 20 мг у пациента с площадью поверхности тела 1,7 м2) вводили 111 пациентам. В фармакокинетическом исследовании, проведенном анализом ВЭЖХ в ходе первого (фаза I/II) испытания внутрипузырного введения, не было выявлено поддающихся детекции уровней апазиквона или его основного метаболита.
Пример 3
Традиционно адъювантное лечение капельным вливанием начинали через приблизительно 2 недели после ТУРОМП. Практика однократного капельного вливания, проведенного в пределах 6 часов (от времени проведения ТУРОМП до приблизительно 6 часов после ТУРОМП) после ТУРОМП, является более новой. "Немедленное" (в пределах 6 часов) внутрипузырное капельное вливание или внутрипузырное капельное вливание в день ТУРОМП цитотоксических средств применяли в Европе без сообщений о чрезмерной токсичности по сравнению с введением через 2 недели или более после ТУРОМП. Как показано в примерах 1 и 2, EOquin® в качестве единственного средства является безопасным и обычно хорошо переносится при дозе 0,1 мг/мл (здесь, 4 мг в 40 мл), вводимой еженедельно в течение 6 последовательных недель у пациентов, которым провели ТУРОМП, начиная приблизительно через 2 недели после ТУРОМП.
В этом испытании оценивали переносимость и безопасность применения EOquin® немедленно (т.е. в пределах приблизительно 6 часов) после ТУРОМП у пациентов с поверхностным раком мочевого пузыря. Уровни в плазме измеряли у пациентов в выбранных областях для оценки степени системного всасывания EOquin® после внутрипузырного капельного вливания немедленно (то есть в течение приблизительно 6 часов) после ТУРОМП.
Критерии включения пациентов включали: (1) переходноклеточный рак мочевого пузыря, клиническая стадия Та или Т1 по классификации TNM и гистологическая степень G1 или G2 перед трансуретральной резекцией; (2) абсолютное число нейтрофилов ≥1,5×109/л, тромбоциты ≥100×109/л, сывороточный креатинин и билирубин ≤1,5 × верхняя граница локальной нормы (ВГЛН), сывороточная GOT и GPT (AST/ALT) ≤3×ВГЛН; (3) отрицательные результаты теста на наличие беременности у женщин детородного возраста; (4) согласие всех пациентов использовать эффективный способ контрацепции; (5) общее состояние Eastern Cooperative Oncology Group (ECOG) 0-2 (шкала ECOG: 0: полностью активен, способен переносить все эффекты предболезни без ограничения; 1: ограничен в физически напряженной активности, но является амбулаторным пациентом, способным выполнять легкую или сидячую работу, например, легкую работу по дому, офисную работу; 2: амбулаторный пациент, способный к полному самостоятельному уходу, но неспособный выполнять любую активную работу, до и приблизительно более 50% часов бодрствования; 3: способен только к ограниченному самостоятельному уходу, прикованный к постели или стулу более 50% часов бодрствования; и 4: полностью нетрудоспособен, не может осуществлять самостоятельный уход, полностью прикован к постели или стулу; (6) возраст ≥18; и (7) пациент полностью проинформирован об исследовательской природе испытания; подписано письменное информированное согласие.
После ТУРОМП, убедившись в полном гемостазе и отсутствии разрыва мочевого пузыря, больным вводили 0,1 мг/мл (4 мг апазиквона в 40 мл вливаемой жидкости). EOquin® вводили внутрипузырно в пределах 6 часов после завершения ТУРОМП и удерживали в течение 1 часа. Трансуретральная резекция включала резекцию всех видимых опухолей, доходящих до собственной пластинки, и биопсию всех подозрительных мест. Материал после резекции и проведения биопсии, который содержал мышцу, подлежащую оценке на глубину опухоли, сохраняли согласно стандартным способам. Патологи исследовали опухоль на гистологическую степень и стадию опухоли. Результаты процедуры, включая размер и локализацию опухолей, включали в соответствующую CRF.
После ТУРОМП пациенты имели постоянный мочеточниковый катетер. Раствор лекарственного средства вводили в мочевой пузырь самотечным дренажем, или инъецировали медленно с использованием шприца с катетером, предварительно заполненного приготовленным лекарственным средством. Сразу после введения лекарственного средства катетер зажимали. Были предприняты меры, чтобы избежать вливания в мочевой пузырь воздушных пузырей.
EOquin® удерживали в мочевом пузыре в течение одного (1) часа. Во время удерживания и в течение 1 часа после дренажа (полное время 2 часа) проводили мониторинг пациентов в отношении развития местной и системной токсичности. По окончании времени удерживания мочевой пузырь дренировали в соответствующую емкость.
Показатели жизненно важных функций (кровяное давление, частота сердечных сокращений и частота дыхания) регистрировали до капельного вливания, через 30 минут после начала вливания и после завершения времени удерживания.
Фармакокинетические исследования выполняли в выбранных областях у пациентов, которые дали информированное согласие на забор крови для этих исследований. Соответствующий объем крови (обычно 1,5 мл) отбирали из канюли или катетера, собирали в гепаринизированные пробирки и немедленно помещали на лед. Режим отбора проб был следующим:
Образец 1: Перед началом капельного вливания EOquin®;
Образец 2: через 5 минут после начала вливания;
Образец 3: через 15 минут после начала вливания;
Образец 4: через 30 минут после начала вливания;
Образец 5: через 45 минут после начала вливания;
Образец 6: через 60 минут после начала вливания (соответствует времени дренирования EOquin® согласно протоколу).
Как можно скорее после сбора кровь центрифугировали при 4000 об./мин в течение 5 минут, и плазму переносили в 2 чистые пробирки для немедленного сохранения при от -70 до -80°C.
Первичный результат исследования определяли по двум главным оценкам: (1) наличие, тяжесть и частота неблагоприятных явлений/токсичностей в течение 2 недель после капельного вливания; и (2) для первых 10 пациентов с гистологией низкого риска (стадия Ta-T1, степень G1-G2), цистоскопическая оценка эпителия мочевого пузыря приблизительно через 3 месяца (±2 недели) после немедленного капельного вливания после ТУРОМП.
Пациентов первоначально включают в испытание, исходя из визуальной оценки исследователем стадии и степени опухоли. Клиническое исследование вероятной стадии опухоли и степени и адекватности резекции было подтверждено только позднее при гистопатологической экспертизе образца, полученного при резекции. В результате всем пациентам, включенным в исследование, проводили немедленное капельное вливание EOquin® после ТУРОМП.
Следующие меры были приняты между 6 и 12 сутками (начиная с дня ТУРОМП, и в дальнейшем называемыми "8 сутками"): (1) физикальное обследование (включая оценку общего состояния); (2) регистрация показателей жизненно важных функций (кровяное давление, пульс, температура), массы тела; (3) гематология: гемоглобин, количество тромбоцитов, WBC и лейкоцитарная формула; (4) химический анализ сыворотки: сывороточный креатинин, моча или BUN, натрий, калий, кальций, альбумин, SGOT/SGPT (AST/ALT) и сахар в крови; (5) анализ мочи: макроскопическое исследование, рН, удельный вес, глюкоза, белок, нитриты и кровь; микроскопическое исследование, показывающее WBC, RBC, цилиндры, другие; и (6) регистрация сопутствующих лекарственных средств и неблагоприятных явлений.
Следующие меры были приняты между 13 и 17 сутками (начиная со дня ТУРОМП, и в дальнейшем называемыми "15 сутками"): (1) физикальное обследование (включая оценку общего состояния); (2) регистрация показателей жизненно важных функций (кровяное давление, пульс, температура), массы тела; (3) гематология: гемоглобин, количество тромбоцитов, WBC и лейкоцитарная формула; (4) химический анализ сыворотки: сывороточный креатинин, моча или BUN, натрий, калий, кальций, альбумин, SGOT/SGPT (AST/ALT) и сахар в крови; (5) анализ мочи: макроскопическое исследование, рН, удельный вес, глюкоза, белок, нитриты и кровь; микроскопическое исследование, показывающее WBC, RBC, цилиндры, другие; и (6) регистрация сопутствующих лекарственных средств и неблагоприятных явлений.
В цистоскопии, запланированной через 3 месяца после ТУРОМП, исследователь оценивал состояние слизистой оболочки мочевого пузыря в дополнение к скринингу возможного рецидива опухоли. Регистрировали наблюдения ран, рубцов и других очагов повреждения мочевого пузыря. Биоптаты были взяты на усмотрение исследователя. Следующие измерения были также проведены в пределах ±2 недель от конца третьего месяца после ТУРОМП: (1) физикальное обследование; (2) регистрация показателей жизненно важных функций (кровяное давление, пульс, температура), массы тела; (3) гематология: гемоглобин, количество тромбоцитов, ЦИС и лейкоцитарная формула; (4) химический анализ сыворотки: сывороточный креатинин, моча или BUN, натрий, калий, кальций, альбумин, SGOT/SGPT (AST/ALT) и сахар в крови; (5) анализ мочи: макроскопическое исследование, рН, удельный вес, глюкоза, белок, нитриты и кровь; микроскопическое исследование, показывающее WBC, RBC, цилиндры, другие; (6) цитология мочи; (7) регистрация сопутствующих лекарств и неблагоприятных явлений (до цистоскопии); и (8) дополнительная цистоскопия, показывающая данные цистоскопии в CRF с цитологией мочи и фотографией, если доступно. Пациентов с неожиданными или патологическими данными при цистоскопии, проведенной в конце третьего месяца после ТУРОМП, наблюдали до тех пор, пока отклонение либо не разрешалось, либо не стабилизировалось.
В следующей таблице обобщенно представлены различные виды активности и показатели и моменты времени относительно ТУРОМП, в которых они были получены:
Исследование представляло собой многоцентровое исследование безопасности и переносимости еденичной дозы. 20 пациентам вводили дозу 4 мг апазиквона. Дозу вводили внутрь мочевого пузыря в течение 6 часов после ТУРОМП. Доза была безопасной и хорошо переносимой для большинства пациентов. Цистоскопия через три месяца после введения показала реэпителизацию в области резекции. Кроме того, фармакокинетические данные показывают отсутствие как апазиквона, так и метаболитов в образце плазмы после ТУРОМП и дренирования капельно влитого лекарственного средства. Неблагоприятные явления включали мочеполовые симптомы, включая дизурию, гематурию, задержку и учащение мочеиспускания, подобные замеченным после ТУРОМП. Ни о каких смертельных случаях не сообщалось.
Пример 4
В отличие от митомицина (MMC), EOquin® не раздражает кожу и не всасывается через слизистую оболочку мочевого пузыря при внутрипузырном введении (молекулярная масса 288). EOquin® ранее показал активность против поверхностного рака мочевого пузыря в предшествующих испытаниях. В следующем описанном испытании оценивали переносимость и безопасность EOquin®, а также его эффект на заживление хирургических ран и системное всасывание при внутрипузырном введении в качестве однократной дозы немедленно после ТУРОМП (трансуретральной резекции опухоли мочевого пузыря) у пациентов с поверхностным раком мочевого пузыря.
Исследование представляло собой многоцентровое открытое исследование безопасности. Пациентам (N=22) с ≤4 опухолями с максимальным диаметром 3,5 см, клиническая стадия Ta-T1 и степень G1-G2, вводили 4 мг EOquin® в 40 мл вливаемой жидкости в пределах 6 часов после ТУРОМП. EOquin® капельно вливали через постоянный катетер Фолея, который затем зажимали на один час. Через час мочевой пузырь дренировали, и катетер удаляли. У пациентов оценивали неблагоприятные явления во время удержания в течение одного часа и при посещениях для наблюдения в послеоперационные дни 8 и 15. Заживление ран оценивали цистоскопией, выполненной на 85 день после операции. Образцы плазмы для анализа уровня лекарственного средства были получены от шести пациентов в шесть моментов времени: перед вливанием и через 5, 15, 30, 45 и 60 минут после вливания. Образцы анализировали полностью проверенным способом с использованием высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией ВЭЖХ-МС (HPLC-MS/MS). Нижний предел количественной оценки (НПКО) для EOquin® составлял 5 мг/мл, а для его метаболита, EO5a, НПКО составил 10 нг/мл.
Было включено 23 пациента, и 20 пациентом проводили введение доз. Причинами для непроведения введения дозы были: обморок за день до ТУРОМП у одного пациента и отсутствие опухоли у двух пациентов. Вливание EOquin® и удерживание хорошо переносились всеми пациентами. О смертельных случаях или исключении не сообщалось. Сообщалось о четырех тяжелых неблагоприятных явлениях у пациентов: гематурия (×2), цистит и задержка мочи. Цистоскопия на 85 сутки показала реэпителизацию без признаков нарушения заживления раны. Далее, ни исходное лекарственное средство, ни его метаболит не были выявлены в образцах плазмы.
В общем, единственная внутрипузырная доза EOquin® была хорошо переносимой и безопасной при введении пациентам немедленно после ТУРОМП поверхностного (неинвазивного) рака мочевого пузыря. EOquin® не всасывался в кровоток из слизистой оболочки мочевого пузыря.
Различные усовершенствования и изменения вариантов осуществления могут быть сделаны и использованы без отклонения от объема и сущности настоящего изобретения, которое может быть применено на практике иначе, чем конкретно описано в настоящем документе. Вышеупомянутое описание предназначено для иллюстрации, но не для ограничения. Объем описанного в настоящем документе изобретения должен быть определен только формулой изобретения.
Термины и выражения, которые использованы в настоящем документе, используются как термины описания, а не для ограничения, и нет намерения использовать такие термины и выражения, как исключающие эквиваленты показанных и описанных признаков или их частей, и понятно, что различные изменения возможны в рамках настоящего изобретения. Кроме того, любой один или несколько признаков любого варианта осуществления описанных в настоящем документе способов могут быть комбинированы с любым одним или несколькими другими признаками любого другого варианта осуществления настоящего изобретения без отступления от объема настоящего изобретения.
Если нет иных указаний, все числа, выражающие количества ингредиентов, свойства, такие как молекулярный вес, условия реакции, и т.д., используемые в описании и формуле изобретения, следует понимать как модифицированные во всех случаях термином "приблизительно". Соответственно, если не указано иное, числовые параметры, изложенные в представленном описании и прилагаемой формуле изобретения, являются приближениями, и могут варьировать в зависимости от желательных свойств, которые стремились получить в настоящем изобретении. По меньшей мере, и не как попытка ограничить применение теории эквивалентов в отношении объема формулы изобретения, каждый числовой параметр следует рассматривать, по меньшей мере, с учетом количества указанных значащих цифр и с использованием обычных способов округления. Несмотря на то, что числовые интервалы и параметры, изложенные в широком объеме настоящего описания, являются приближениями, числовые величины, изложенные в конкретных примерах, указаны настолько точно, насколько возможно. Однако любые числовые величины по существу содержат определенные погрешности, обязательно следующие из стандартного отклонения, найденного в соответствующих тестовых измерениях.
Формы единственного числа и подобные значения, используемые в контексте описания описанных способов (особенно в контексте представленных ниже пунктов формулы изобретения), следует рассматривать как охватывающие как единственное, так и множественное число, если в настоящем документе не указано иное или если это ясно не противоречит контексту. Перечисление диапазонов значений в настоящем документе предназначено только для того, чтобы оно служило способом сокращения для указания каждого отдельного значения, попадающего в диапазон. Если в настоящем документе не указано иное, каждая отдельная величина включена в описание, как если бы она была индивидуально цитирована в настоящем документе. Все способы, описанные в настоящем документе, могут быть выполнены в любом подходящем порядке, если в настоящем документе нет иных указаний или если это явно не противоречит контексту. Использование любого и всех примеров или типичных формулировок (например, "такой как"), предоставленных в настоящем документе, предназначено только для того, чтобы лучше осветить изобретение и не налагает ограничение на объем настоящего изобретения, заявленного иначе. Никакую формулировку в описании не следует рассматривать как указание на какой-либо незаявленный элемент, существенный для практики настоящего изобретения.
Группирование альтернативных элементов или вариантов осуществления описанных в настоящем документе способов не следует рассматривать как ограничения. Каждый член группы может быть упомянут и заявлен отдельно или в любом сочетании с другими членами группы или другими элементами, встречающимися в настоящем документе. Ожидается, что один или более членов группы могут быть включены в группу или удалены из группы по причинам удобства и/или патентоспособности. Когда любое такое включение или устранение встречаются, описание, как подразумевают в настоящем документе, содержит измененную группу, таким образом, удовлетворяя письменному описанию всех групп Маркуша, используемых в прилагаемой формуле изобретения.
Определенные варианты осуществления согласно настоящему изобретению описаны в настоящем документе, включая лучший вариант осуществления, известный изобретателям, для того, чтобы выполнить описанные в настоящем документе способы. Безусловно, вариации этих вариантов осуществления будут очевидными для специалистов в данной области после прочтения представленного выше описания. Изобретатель ожидает, что специалисты будут использовать такие изменения соответствующим образом, и изобретатели намереваются применять описанные в настоящем документе способы на практике иначе, чем определенно описано в настоящем документе. Соответственно, это описание включает все изменения и эквиваленты объекта изобретения, изложенного в формуле изобретения, прилагаемой в настоящем документе, что разрешается действующим законом. Кроме того, любое сочетание описанных выше элементов во всех возможных вариациях охватывается способами, описанными в настоящем документе, если в настоящем документе нет иных указаний или если это явно не противоречит контексту.
Кроме того, многочисленные ссылки сделаны на патенты и печатные издания по всему описанию. Каждая упомянутая выше цитированная ссылка и печатные издания включены в настоящий документ в качестве ссылок в полном объеме.
В заключение, следует понимать, что варианты осуществления настоящего изобретения являются иллюстрациями принципов описанных в настоящем документе способов. Другие изменения, которые могут использоваться, находятся в пределах объема настоящего изобретения. Таким образом, в качестве примера, но не ограничения, альтернативные конфигурации настоящего раскрытия могут быть использованы в соответствии с представленными в настоящем документе указаниями. Соответственно, настоящее описание не ограничивается изобретением в точности, как показано и описано.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВНУТРИПУЗЫРНОЕ ВВЕДЕНИЕ АПАЗИКВОНА ПОСЛЕ ТРАНСУРЕТРАЛЬНОЙ РЕЗЕКЦИИ ПРИ ЛЕЧЕНИИ РАКА | 2012 |
|
RU2623142C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ РАКА МОЧЕВОГО ПУЗЫРЯ | 2008 |
|
RU2542449C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА МОЧЕВОГО ПУЗЫРЯ | 2014 |
|
RU2581946C2 |
| СПОСОБЫ ЛЕЧЕНИЯ МЕТАСТАЗА ОПУХОЛИ | 2018 |
|
RU2799546C2 |
| СПОСОБ КОМПЛЕКСНОГО ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ РЕЦИДИВОВ МЫШЕЧНО-НЕИНВАЗИВНЫХ ФОРМ РАКА МОЧЕВОГО ПУЗЫРЯ | 2013 |
|
RU2560314C2 |
| СПОСОБ ЛЕЧЕНИЯ ПОВЕРХНОСТНОГО РАКА МОЧЕВОГО ПУЗЫРЯ | 2007 |
|
RU2350338C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ МОЧЕВОГО ПУЗЫРЯ | 2009 |
|
RU2405601C1 |
| СПОСОБ ЛЕЧЕНИЯ ИНВАЗИВНОГО РАКА МОЧЕВОГО ПУЗЫРЯ | 2005 |
|
RU2276605C1 |
| СПОСОБ ЛЕЧЕНИЯ РАКА УРОТЕЛИЯ НИЖНИХ ПУТЕЙ | 2017 |
|
RU2764747C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ (ФДТ) ДЛЯ РАКА МОЧЕВОГО ПУЗЫРЯ | 2016 |
|
RU2745194C2 |
Группа изобретений относится к медицине и предназначена для лечения рака мочевого пузыря. Используют апазиквон, препарат вводится внутрипузырно в течение 6 часов после трансуретральной резекции. Группа изобретений позволяет достичь реэпителизации после ТУР у пациентов при отсутствии системных побочных явлений. 2 н. и 13 з.п.ф-лы, 4 пр., 1 табд.
1. Способ лечения злокачественной опухоли, включающий введение терапевтической композиции, содержащей терапевтическое количество апазиквона (EO9), в пределах приблизительно 6 ч после трансуретральной резекции опухоли мочевого пузыря (ТУРОМП).
2. Способ по п.1, в котором указанным введением является внутрипузырное капельное вливание.
3. Способ по п.1, в котором указанное введение проводят в пределах приблизительно 5 ч после ТУРОМП.
4. Способ по п.1, в котором указанное введение проводят в пределах приблизительно 4 ч после ТУРОМП.
5. Способ по п.1, в котором указанное введение проводят в пределах приблизительно 3 ч после ТУРОМП.
6. Способ по п.1, в котором указанной злокачественной опухолью является рак мочевого пузыря.
7. Способ по п.1, в котором указанной злокачественной опухолью является неинвазивный рак мочевого пузыря.
8. Способ по п.1, в котором указанной злокачественной опухолью является переходноклеточная карцинома мочевого пузыря.
9. Способ по п.1, в котором указанной злокачественной опухолью является стадия Та или Т1 по классификации TNM.
10. Способ по п.1, в котором указанной злокачественной опухолью является гистологическая степень G1 или G2.
11. Способ по п.1, в котором указанная терапевтическая композиция включает от приблизительно 1 мг до приблизительно 8 мг на дозу апазиквона.
12. Способ по п.1, в котором указанная терапевтическая композиция включает от приблизительно 2 мг до приблизительно 6 мг на дозу апазиквона.
13. Способ по п.1, в котором указанная терапевтическая композиция включает от приблизительно 3 мг до приблизительно 5 мг на дозу апазиквона.
14. Способ лечения злокачественной опухоли, включающий стадии:
(a) выполнение ТУР у пациентов, нуждающихся в этом;
(b) предоставление терапевтически эффективного количества перерастворенной лиофилизированной терапевтической композиции, включающей от приблизительно 1 мг до приблизительно 8 мг апазиквона на дозу указанной композиции; и
(c) введение посредством внутрипузырного капельного вливания указанной перерастворенной лиофилизированной терапевтической композиции после указанной ТУР.
15. Способ по п.14, в котором стадия (b) может быть выполнена до или после стадии (а).
| ИРРИГАЦИОННЫЙ РАСТВОР | 2000 |
|
RU2178305C1 |
| US 6894071, 17.05.2005 | |||
| VAN DER HEIJDEN et al, Phase II marker lesion study with intravesical instillation of apaziquone for superficial bladder cancer: toxicity and marker response | |||
| J Urol | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
Авторы
Даты
2013-04-27—Публикация
2008-03-13—Подача