Изобретение относится к биологически активной субстанции - белково-полипептидному комплексу (БПК), получаемому из эмбриональной нервной ткани копытных сельскохозяйственных животных, обладающей антигипоксическим, сосудистым и нейропротективным действием, стимулирующим физиологическую и репаративную регенерацию нервной ткани, для применения в производстве лекарственных препаратов при заболеваниях центральной и периферической нервной системы, гипоксических состояниях, в медицине катастроф, спортивной медицине, способу ее получения и фармкомпозиции на его основе.
Принятые сокращения и условные обозначения:
БПК- белково-полипептидный комплекс;
БПНК - белково-полипептидно-нуклеотидный комплекс;
I - ионная сила раствора;
Фармкомпозиция - фармацевтическая композиция.
В настоящее время, на фоне неуклонного роста заболеваний нервной системы сосудистого, травматического, токсического, инфекционного и аутоиммунного генеза, не существует препаратов группы прямых репарантов, специфичных для нервной ткани. Целью данного изобретения явилось создание биологически активной субстанции, обладающей антигипоксическим, тканеспецифическим протективным действием на нервную ткань, путем выделения БПК из нервной ткани эмбрионов копытных сельскохозяйственных животных.
Биологически активная субстанция представляет собой БПК с молекулярной массой входящих в него белково-полипептидных компонентов в пределах от 0,5 до 200 кДа, с содержанием среднемолекулярной фракции в пределах от 20 до 160 кДа не менее 70%, а фармкомпозиция - разбавлением полученного БПК фармацевтически приемлемым буфером с добавлением детергентов, солюбилизаторов, консервантов и равнозначной концентрации нуклеотидных компонентов в виде натриевой соли дезоксирибонуклеиновой кислоты с молекулярной массой входящих в него полинуклеотидов в пределах от 12 до 1000 кДа (12-660 пар оснований), с содержанием среднемолекулярной фракции в пределах от 20 до 500 кДа не менее 80%.
Белково-полипептидный комплекс получен путем ионообменной хроматографии фильтрата надосадочной фракции отцентрифугированного гомогената нервной ткани, в присутствии буферного раствора, детергентов, консервантов и солюбилизаторов из мозга эмбрионов копытных сельскохозяйственных животных сроком гестации от середины первой трети до середины последней трети беременности.
Нуклеотидная фракция БПНК фармкомпозиции получена методом щелочного гидролиза фугата гомогената ткани, оставшегося после получения белково-полипептидной фракции, с последующей очисткой и осаждением целевой фракции этанолом. Полученные фракции объединяются в равноценных концентрационных соотношениях, образуя БПНК с добавлением фармацевтически приемлемого буфера, детергентов, солюбилизаторов и консервантов.
Известен целый ряд биологически активных субстанций и препаратов пептидной, нуклеотидной природы из сырья животного происхождения, обладающих регенеративной и протективной активностью, которые используются для лечения заболеваний нервной системы.
Известен способ получения лечебного средства при заболеваниях, сопровождающихся нарушением функции центральной нервной системы [1], данный способ позволяет получать пептиды и белки с конечной концентрацией до 12 мг/мл и неустановленным разбросом молекулярных масс из эмбрионального мозга животных с помощью длительной (до 30 суток) экстракции и последующим ферментативным протеолизом с удалением образовывающегося осадка на всех этапах выделения. В данном способе полученные белки и полипептиды не охарактеризованы стандартными физико-химическими методами (масса, оптическая плотность, форез и т.д.) белков, а длительная экстракция и ферментативный протеолиз позволяют предполагать низкие цифры молекулярных масс полученных пептидов и достаточно высокий процент примесей в виде липопротеидов и пептидгликанов, что неуклонно ведет к повышению иммуногенности средства.
Известен способ лечения заболеваний центральной нервной системы [2], данный способ предполагает получение экстракта белков и нуклеиновых кислот из ткани мозга эмбрионов человека по стандартной методике с последующей их стерилизацией и лиофилизацией, используя смесь лиофилизата и донорского эмбрионального головного мозга. В данном способе полученные белки и полипептиды не охарактеризованы стандартными физико-химическими методами (масса, оптическая плотность, форез и т.д.), а изначальная лиофилизация ткани изменяет четвертичную и третичную структуру белковых и полипептидных компонентов, что неуклонно ведет к снижению биологической активности и специфичности фармакологического действия полученного экстракта, а также затрудняет его стандартизацию.
Известен способ изготовления биологически активных препаратов из эмбриональных тканей [3], данный способ позволяет получать смесь, не содержащую белков, из низкомолекулярных термостабильных веществ неопределенного состава молекулярной массой менее 10 кДа с содержанием пептидов 1-3 мг/мл и сухим остатком 14-20 мг/мл. Наличие низкомолекулярных термостабильных веществ неопределенного состава не позволяет применение данного препарата парентерально, а присутствие компонентов клеточных стенок и мембран клеточных структур определяет его высокую иммуногенность.
Известна группа изобретений «Лекарственные средства на основе зародыша и способ их получения» [4], данный способ предполагает измельчение и гомогенизацию мягких тканей эмбрионов животных в смеси с физиологическим раствором без четких физико-химических характеристик. Данный способ не позволяет стандартизировать полученную смесь, а отсутствие четких физико-химических характеристик получаемого продукта - применение данного препарата парентерально, из-за присутствия компонентов клеточных стенок и мембран клеточных структур, что определяет его высокую иммуногенность.
Известен способ изготовления биологически активных препаратов на основе эмбриональных тканей [5], который предусматривает гидролиз гомогената от 2 до 42 дней при температуре +4° - +45°С с дальнейшей термообработкой при температуре +60° - +120°С, отделением денатурированных веществ и выделением из гидролизата термостабильного целевого продукта со средней молекулярной массой менее 10 кДа неопределенного состава.
При данном способе изготовления получаемый целевой продукт содержит измененные, денатурированные продукты гидролиза белков и полипептидов с нарушенной четвертичной и третичной структурой, а также продукты распада многих активных молекул, что определяет его невысокую биологическую активность.
Известен способ получения биологически активного препарата из селезенки эмбрионов крупного рогатого скота и фармацевтическая композиция на его основе с иммуномодулирующей, антигипоксической и репаративной активностью [6], данный способ позволяет получить смесь низкомолекулярных пептидов, аминокислот, производных нуклеиновых кислот и других компонентов массой от 5 до 50 кДа из селезенки эмбрионов крупного рогатого скота методом солевой экстракции гомогената 0,9% раствором хлорида натрия с последующей последовательной ультрафильтрацией. В данном способе полученные белки, полипептиды и низкомолекулярные нуклеиновые кислоты не охарактеризованы стандартными физико-химическими методами (оптическая плотность, форез и т.д.), изначальная солевая экстракция физиологическим раствором не позволяет получить большой спектр активных соединений, а достаточно высокий процент примесей в виде липопротеидов и пептидгликанов, что неуклонно ведет к снижению биологической активности и специфичности фармакологического действия полученного препарата, повышению его иммуногенности, а также затрудняет его стандартизацию.
Известен способ получения лекарственного средства из ткани мозга эмбрионов животного и фармацевтическая композиция на его основе [7]. Данный способ позволяет получить смесь пептидов, аминокислот, производных нуклеиновых кислот и других компонентов из мозга эмбрионов животного, выдержанного после предварительного размораживания в течение 24 часов при температуре +10°С, методом двухэтапного экстрагирования гомогената 9% раствором сульфата калия, с последующей стабилизацией метиловым эфиром п-оксибензойной кислоты до концентрации 0,07% и последующей последовательной ультрафильтрацией для получения целевой фракции с молекулярными массами входящих в нее компонентов от 10 до 100 кДа. Длительный временной интервал после размораживания ткани продлевает посмортальный протеолиз, что негативно сказывается на качественном составе экстрагируемых компонентов и неуклонно ведет к потере тканеспецифической биологической активности, а достаточно высокий процент примесей в виде продуктов деградации ткани повышает иммуногенность лекарственного средства и затрудняет его стандартизацию.
Известен способ получения препарата [8], обладающего восстанавливающей активностью при нарушении функции головного мозга, который позволяет выделить из коры головного мозга убойных животных биологически активные полипептиды щелочной природы. Препарат получают путем обработки исходного сырья (ткань, содержащая серое вещество полушарий головного мозга) ацетоном при температуре от -10° до -4°С и соотношении ткани мозга и ацетона 1:5 в течение 18-30 ч, гомогенизации, экстрагирования гомогената 2-4%-ным раствором уксусной кислоты в течение 48-72 ч при рН=3,5-4,5 в присутствии хлористого цинка в концентрации 0,6-1,2 г/л и при соотношении гомогената и раствора уксусной кислоты 1:(8-4), центрифугирования, осаждения биологически активных веществ ацетоном при температуре от -3° до -5°С и соотношении супернатанта и ацетона 1:(7-5) и ионообменной хроматографии полученного осадка на катионите "Биокарб". В результате ионообменной хроматографии получают фракцию, содержащую щелочные полипептиды, которые обладают стимулирующим (или восстанавливающим при снижении активности мозга) действием на клетки коры головного мозга. Описанный способ не позволяет извлечь из коры головного мозга кислые и нейтральные полипептиды и получить биологически активные вещества, обладающие другим действием (например, противосудорожной активностью).
Известен способ получения биологически активных липофильной и гидрофильной фракций плаценты свиной [9, 10], данные способы позволяют получить смесь пептидов, аминокислот, оксикислот методом хлороформно-этанольной и водно-этанольной экстракции с солевым разделением фракций, а также использование хладоновых растворителей для получения липофильной фракции. Данный способ не позволяет получить тканеспецифические для нервной ткани белки и полипептиды, обладая системным действием, а наличие ростовых факторов без факторов дифференцировки и сигнальных тканевых молекул значительно повышает риск неопластических процессов, особенно при отсутствии полинуклиотидов, обладающих выраженным иммуномодулирующим эффектом. Получаемые фракции не имеют четких физико-химических характеристик, а сам способ хлороформно-этанольной и водно-этанольной экстракции и выделения позволяет получить только низкомолекулярные полипептиды и белки с измененной четвертичной и третичной структурой, что неизменно ведет к снижению специфической биологической активности.
Наиболее близким к заявленной группе изобретений по достигаемым результатам и некоторым эффектам биологической активности является известный способ получения биологически активного комплекса, обладающего нейрорегеративным и нейропротективным действием [11]. Данный способ позволяет получить смесь белков и полипептидов из головного мозга эмбрионов сельскохозяйственных животных, взятого на определенной стадии гестации (от начала средней трети до середины последней трети), методом анионообменной хроматографии, используя для нанесения на уравновешенную колонку предварительно отфильтрованный супернатант гомогената ткани с буферным раствором рН 7,2-8,4, целевые фракции получают, разделяя связавшиеся с носителем белки и полипептиды, используя в качестве подвижной фазы 0,05 М ТРИС-глициновый буфер, содержащий 0,1 мМ ЭДТА и 1М NaCl, повышая концентрацию ступенчатым градиентом с шагом 5%. Полученный вышеуказанным способом комплекс подвергают ультрафильтрации на мембране 5 кДа и обессоливают. Характеристику целевой белково-полипептидной фракции проверяют методами ультрафиолетовой спектрометрии, гель-хроматографии, денатурирующего электрофореза в полиакриламидном геле и аминокислотного анализа. Полученный вышеуказанным способом биологически активный комплекс имеет максимум поглощения ультрафиолетового спектра при длине волны 280±5 нм, массу входящих в него белков и полипептидов от 5 до 110 кДа.
Использование при получении данного комплекса на этапе анионообменной хроматографии в составе подвижной фазы 1М NaCl создает слишком высокую ионную силу подвижной фазы, равную 1 моль/л, а включение в состав ЭДТА и ТРИС еще больше ее увеличивает. В связи с этим полученная целевая фракция содержит большое количество кислых высокозаряженных белков и полипептидов, имеющих в клетках мозговой ткани преимущественно мембранную локализацию, в основном выполняющие структурные функции и только в незначительной степени регуляторные, не имеющие не только тканеспецифической, но и выраженной биологической активности. Дальнейшее ступенчатое повышение концентрации соли с шагом 5% еще больше увеличивает присутствие данных белков, увеличивая биологическую инертность смеси, тем самым снижая ее активность и повышая ее аллергенность.
Из уровня техники известны также следующие фармацевтические средства.
Известен иммуномодулятор «Деринат» компании «Техномедсервис» ЗАО ФП (Россия) [12], влияющий на клеточный и гуморальный иммунитет, стимулирующий репаративные процессы и гемопоэз (нормализует количество гранулоцитов, лимфоцитов, тромбоцитов), обладающий противовоспалительным и противоопухолевым действием, нормализующий состояние тканей при дистрофических изменениях сосудистого генеза, оказывающий слабо выраженное антикоагулянтное действие.
Известно средство для лечения геморрагического или ишемического инсультов «Церебролизин» фирмы «Ebewe» (Австрия) [13], который является продуктом обработки мозга интактных свиней.
Известно лечебное средство при заболеваниях, сопровождающихся нарушением функций центральной нервной системы - «Цереброкурин» фирмы ООО «НИР» (Украина) [14], который является продуктом обработки мозга эмбрионов животных.
Известен препарат полипептидной природы, получаемый путем экстракции из коры головного мозга крупного рогатого скота и свиней - «Кортексин» фирмы ООО «Герофарм» (Россия), [15], обладающий ноотропным, церебропротекторным, противосудорожным и антиоксидантным действием.
Известен препарат, повышающий устойчивость ткани головного мозга к интоксикации, гипоксии, гипогликемии, механической травме - «Церебролизат» фирмы «Микроген» НПО ФГУП (Иммунопрепарат) (Россия), [16], обладающий ноотропным действием, представляющий собой гидролизат головного мозга крупного рогатого скота.
Полинуклеотидный состав «Дерината» в виде натриевой соли дезоксирибонуклеиновой кислоты (дезоксирибонуклеат натрия) обозначает системное основное действие препарата как иммуномодулятора, влияющего на клеточный и гуморальный иммунитет. Препарат стимулирует репаративные процессы и гемопоэз (нормализует количество гранулоцитов, лимфоцитов, тромбоцитов), обладает противовоспалительным и противоопухолевым действием, нормализует состояние тканей при дистрофических изменениях сосудистого генеза, оказывает слабо выраженное антикоагулянтное действие. Стимуляция лейкопоэза при лейкопении, вызванной полихимиотерапией или лучевой терапией, наблюдается уже после однократной инъекции. Применение препарата в первые 24 ч после воздействия облучения ускоряет начало и темп восстановления стволовых клеток, а также миелоидного, лимфоидного и тромбоцитарного ростков кроветворения. Препарат активизирует противовирусный, противогрибковый и противомикробный иммунитет, повышает активность фагоцитов в отношении Chlamydiaceae, Staphylococcus aureus, Escherichia coli, Helicobacter pylori. Деринат существенно снижает чувствительность клеток к повреждающему действию цитотоксических препаратов и радиотерапии, что проявляется в снижении кардио- и миелотоксичности у онкологических больных и стабильности терапевтического эффекта при повторных курсах лечения. Препарат обладает неспецифическим репаративным и регенераторным действием. Недостатком известного препарата является низкая специфичность препарата в связи со слабым нейропротективным и регенеративным действием, в том числе и репаративным потенциалом для нервной ткани.
В состав "Церебролизина" входят аминокислоты (~85%), низкомолекулярные пептиды (~15%), микроэлементы, сырьем для получения которых служит мозг свиней. Нейропротективное и трофическое действие препарата осуществляется за счет специфических пептидов и аминокислот, молекулярной массы не выше 10000 Дальтон, из которых доминирующими и определяющими свойства препарата являются аланин, лейцин и лизин. Препарат предназначен для внутримышечного, внутривенного введения и обладает невысокой концентрацией биологически активных компонентов, поэтому вводится в организм больного в значительных дозах длительное время. Недостатком известного препарата является значительная продолжительность курса лечения, низкая активность и специфичность препарата в связи со слабым нейропротективным действием, обладая и крайне низким регенеративным, в том числе и репаративным потенциалом для нервной ткани.
В состав «Цереброкурина» входят водорастворимые пренатальные нейропептиды и продукты расщепления неактивных высокомолекулярных предшественников из гомогенизата мозга эмбрионов животных, который после разбавления физиологическим раствором подвергают взаимодействию с иммобилизованным протеолитическим ферментом, причем режим взаимодействия устанавливают, исходя из контрольной пробы получаемого средства, и полученный раствор выдерживают в течение 30 суток при температуре не выше +10°С. С помощью данной технологии достигается более высокая (по сравнению с Церебролизином) активность получаемого средства и значительно расширяется спектр его действия, за счет более высокой массы содержащихся пептидов и низкомолекулярных белков, оставшихся после протеолиза. Однако, несмотря на длительное формирование раствора до окончания процессов агрегации и протеолиза, данная технология не позволяет получить фракцию необходимой степени очистки для применении препарата внутривенно, что значительно затрудняет его биодоступность. Водная экстракция без буферизации раствора, детергентов, ингибиторов протеолиза и солюбилизантов на начальных этапах получения Цереброкурина, а также неопределенные сроки гестации эмбрионального мозга животных не позволяют обеспечить необходимую степень стандартизации, что допускает значительный разброс по составу полученных эволюционно закрепленных белково-пептидных концентрационных соотношений, снижая его тканеспецифическую нейрорегенеративную активность и стабильность фармакологического действия, ограничиваясь биологическим действием по типу обратной связи за счет сигнальной функции продуктов протеолиза ткани.
В состав «Кортексина» входит комплекс водорастворимых биологически активных щелочных, кислых и нейтральных полипептидов с мол.м. от 0,5 до 15 кДа и изоэлектрической точкой 3,5-9,5, получаемых из измельченной замороженной ткани головного мозга скота, путем экстракции раствором уксусной кислоты, содержащей хлористый цинк, отделения осадка, обработки надосадочной жидкости ацетоном, промывки образовавшегося осадка ацетоном, высушивании с последующей очисткой, стерилизации и лиофилизации целевого продукта. Препарат предназначен для внутримышечного введения и обладает невысокой концентрацией биологически активных низкомолекулярных компонентов, поэтому вводится в организм больного в значительных дозах длительное время. Несмотря на то, что препарат участвует в регуляции соотношений тормозных и возбуждающих аминокислот, концентрации серотонина и дофамина, оказывая ГАМК-позитивное влияние, снижает токсические эффекты нейротропных веществ, улучшает процессы обучения и памяти, ускоряет восстановление функций головного мозга после стрессорных воздействий, Кортексин имеет невысокую активность и специфичность в связи со слабым нейропротективным действием, обладая и низким регенеративным, в том числе незначительным репаративным потенциалом для нервной ткани, что требует значительной продолжительности курсового лечения.
В состав «Церебролизата» также входят водорастворимые полипептиды как результат гидролиза ткани головного мозга крупного рогатого скота, обладающие слабой ферментативной активностью, с молекулярной массой не более 15 кДа. Обозначенная в патенте вариация аминокислотного состава препарата допускает значительный разброс по составу полученных пептидных концентрационных соотношений, определяя низкую тканеспецифическую активность и стабильность фармакологического действия - со слабым нейрометаболическим и невыраженным ноотропным эффектом.
Задачей настоящего изобретения является создание биологически активной субстанции и фармкомпозиции на ее основе, с расширенными свойствам и высокой биологической активностью, обладающей тканеспецифическим репаративно-регенеративным действием на нервную ткань, и разработки способа ее получения, путем выделения биологически активного белково-полипептидного комплекса и полинуклеотидов для создания фармкомозиции из нервной ткани эмбрионов копытных сельскохозяйственных животных, которая решается за счет выбранной совокупности действий и режимов. Особенно важным оказалось определение оптимальных сроков гестации эмбриональной нервной ткани, подбора реагентов, их доз, режимов экстракции, буферизации и регуляции протеолитической активности, для сохранения эффективных концентрационных соотношений белков, полипептидов, закрепленных эволюционно и определяющих биологическую активность комплекса, обеспечивая репаративно-регенеративное тканеспецифическое действие, а также полинуклеотидов для получения фармкомпозиции.
Поставленная задача достигается заявленной группой изобретений при соблюдении всех условий получения БПК и фармкомпозиции.
В заявленную группу изобретений входит белково-полипептидный комплекс, способ его получения из эмбриональной нервной ткани копытных сельскохозяйственных животных на определенных сроках гестации и фармкомпозиция на основе этого белково-полипептидного комплекса.
Таким образом, поставленная задача достигается новым белково-полипептидным комплексом (БПК), обладающим антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервную систему, получаемый из эмбриональной нервной ткани сельскохозяйственных копытных животных сроком гестации от середины первой до середины последней трети беременности, включающий тканеспецифические отрицательно заряженные слабокислые, нейтральные белки и полипептиды, относящиеся к факторам роста, дифференцировки, сигнальным молекулам, определяющим его биологическую и фармакологическую активность, с молекулярными массами от 0,5 до 200 кДа, причем не менее 70% от общей массы белка имеет молекулярную массу в диапазоне от 20 до 160 кДа, имеющих характерный специфический набор полос при денатурирующем гель-электрофорезе («SDS-Page») в 5%-ном полиакриламидном геле по сравнению со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа и максимумом поглощения при длине волны 215±5 нм при снятии ультрафиолетового спектра в области длин волн от 200 до 500 нм.
Поставленная задача достигается также новым способом получения выше охарактеризованного белково-полипептидного комплекса, обладающего антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервную систему, заключающемся в том, что эмбриональную нервную ткань копытных сельскохозяйственных животных сроком гестации от середины первой трети до середины последней трети беременности поэтапно:
- гомогенизируют в буферном растворе, с одновременной экстракцией в присутствии обратимых ингибиторов протеолиза и неионных детергентов при рН не менее 5,2 и не выше 8,5 с последующим центрифугированием при значении g интервале 10000-28000 в течение 90-30 мин;
- полученный супернатант фильтруют;
- фильтрат подвергают анионообменной хроматографии на колонке с анионообменным носителем и разделяя связавшиеся с носителем белки и полипептиды, используя в качестве подвижной фазы буферный раствор, первоначально имеющий ионную силу (I) не выше 0,1 ммоль/л, повышая ее плавно или ступенчато с шагом 0,025 ммоль/л и начиная сбор целевых фракций с ионной силой элюента от 0,125 до 0,15 ммоль/л при рН от 5,2 до 8,5;
- полученные фракции объединяют и подвергают стерилизующей фильтрации.
ЭДТА выполняет одновременно две функции: ингибитора протеолиза и детергента.
С одной стороны, ЭДТА вступает в реакцию, захватывает ионы металлов, тем самым тормозит ферменты, разлагающие белки класса металлопротеинов, выступая в роли ингибиторов протеолиза. Кроме того, в качестве ингибиторов протеолиза можно использовать: гепарин (обратимый ингибитор); апротинин.
Другие виды ингибиторов протеолиза нежелательно использовать, поскольку они применяются в основном для исследований белков, т.к. достаточно токсичны.
С другой стороны, ЭДТА-растворы имеют высокую поверхностную активность, поэтому могут выступать в роли детергента.
Маннит выступает в роли солюбилизатора, препятствуя коагуляции белковых компонентов комплекса.
Общеизвестно, что маннит в пищевой промышленности используется как подсластитель, а также как добавка, препятствующая образованию комков в молочных и других продуктах.
Примером возможных других детергентов и солюбилизаторов являются полисорбаты (твин-80, твин-100).
Кроме того, детергентом является полисорбат-80, солюбилизатором является маннит, кармелоза, а ингибитором протеолиза являются гепарин, гордокс.
Еще одним изобретением заявленной группы является фармацевтическая композиция, обладающая антигипоксическим, иммуномодулирующим, тканеспецифическим репаративным действием на нервную ткань, выполненная в виде раствора, содержащего в качестве активного ингредиента биологически активный белково-полипептидный комплекс по п.1 формулы изобретения в концентрации 0,05-2,0 мг/мл, полученный способом по п.2 формулы изобретения, и полинуклеотидную фракцию в виде натриевой соли дезоксирибонуклеиновой кислоты, проявляющие комплексную с белково-полипептидной фракцией специфическую иммунорегулирующую активность в, по меньшей мере, равноценной концентрации с белково-полипептидным комплексом, и фармацевтически приемлемый разбавитель.
В качестве фармацевтически приемлемого разбавителя фармацевтическая композиция может содержать фармакопейный буферный раствор и, возможно, вспомогательные вещества, включающие высокомолекулярные соединения, стабилизаторы, консерванты и солюбилизаторы.
Фармацевтическая композиция содержит полинуклеотидную фракцию, желательно в виде средне- и низкомолекулярной фракции натриевой соли дезоксирибонуклеиновой кислоты - от 12 до 660 кДа (18-1000 пар оснований), имеющие максимальный УФ-спектр поглощения при длине волны 260±2 нм и минимальный - при 230±2 нм в области длин волн от 190 до 325 нм с отношением D260/280 от 1,6 до 2,0, наличием характерных специфических полос при электрофорезе в 1,8%-ном агарозном геле при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном молекулярных масс от 75 до 7000 пар оснований и синее окрашивание при постановке качественной реакции на рибозу, а также примесью белка, при определении его концентрации по Лоури, не выше 0,18%.
Указанная фармацевтическая композиция предназначена для фармацевтической и косметической промышленности, например для применения парентерально (внутрикожно, подкожно), интраназально или апликационно на слизистые оболочки и кожу.
Ниже приводится краткое описание способа получения комплекса, сам комплекс и фармкомпозиция на его основе.
Итак, белково-полипептидный комплекс получают следующим образом (некоторые операции описаны с указанием детализаций, которые не ограничивают способ):
- нервную ткань эмбрионов копытных сельскохозяйственных животных, сроком гестации от середины первой трети до середины последней трети беременности, размораживают;
- гомогенизируют в буферном растворе, с одновременной экстракцией в присутствии обратимых ингибиторов протеолиза и неионных детергентов при рН не менее 5,2 и не выше 8,5, в соотношениях не менее 1:0,5;
- гомогенат отделяют от балластных веществ фильтрованием через плотную ткань с последующим центрифугированием при значении g интервале 10000-28000 в течение 90-30 мин соответственно, объединяя полученный балластный тканевой материал после фильтрования через плотную ткань и фугат, для получения нуклеотидной фракции фармкомпозиции.
Получение белково-полипептидного комплекса:
- надосадочную жидкость фильтруют через мембранный фильтр с диаметром пор 0,45 мкм;
- фильтрат наносят на уравновешенную хроматографическую колонку с анионообменным носителем, например - Toyopearl DEAE-650M;
- разделение связавшихся с носителем белков производят плавным или ступенчатым градиентом ионной силы раствора, используя в качестве подвижной фазы буферный раствор, имеющий ионную силу не выше 0,1 ммоль/л, повышая ее с шагом 0,025 ммоль/л и начиная сбор целевых фракции с помощью буферного раствора с ионной силой от 0,125 до 0,15 ммоль/л, в интервале рН от 5,2 до 8,5;
- целевые фракции объединяют и подвергают ультрафильтрации на установке при противодавлении не более 8,0 кгс/см2 через материалы с задерживающей способностью выше 200 кДа, разводят буферным раствором, например 0,05М глицин-NaOH рН 7,4, до общей концентрации белка 1,0-2,0 мг/мл;
- полученный раствор подвергают стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,22 мкм и определяют суммарную концентрацию белков.
Все предварительные процессы и процессы получения белково-пептидной фракции желательно производить при температуре от +2° до +8°С.
Для идентификации полученного белково-полипептидного комплекса используют методы ультрафиолетовой спектрофотометрии, гель-хроматографии и электрофореза в полиакриламидном геле. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 215±5 нм (фиг.1). Молекулярную массу белков, входящих в препарат, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа (фиг.2). Значение изоэлектрической точки от 4,2 до 8,4. В состав препарата входят белки с молекулярной массой от 0,5 кДа до 200 кДа, из которых не менее 70% имеют молекулярную массу в диапазоне от 20 до 160 кДа.
Получение полинуклеотидной фракции для фармкомпозиции и самой фармкомпозиции:
- объединенный балластный тканевой материал и фугат, оставленный после центрифугирования отфильтрованного гомогената, с помощью миксера ресуспензируют в растворе, содержащем 2,5 мМ ЭДТА и 25 мМ цитрат натрия рН 7,0-8,0, в тех же режимах температур в соотношении не менее 1:1, выдерживая полученную массу в течение 30 минут;
- на этапе гидролиза к полученной массе добавляют 10 М NaOH из расчета конечной молярной концентрации щелочи не более 2 и, после размешивания, инкубируют в течение 16 часов при +48°С;
- охлажденную до +2°С смесь центрифугируют при ~32000 g и +4°С в течение 40 мин;
- перед переливанием супернатанта с поверхности надосадочной жидкости в центрифужных флаконах с помощью полосок фильтровальной бумаги снимают тонкую масляно-жировую пленку желтого цвета;
- в очищенный объединенный супернатант для повторного гидролиза добавляют 1/10 объема 10М NaOH и инкубируют 5 часов при +48°С;
- полученный дигидролизат охлаждают на ледяной бане (мокрый лед, 0°С), а затем при непрерывном перемешивании и под контролем рН-метра добавляют ледяную уксусную кислоту до показателя рН смеси не выше рН 5,4, наблюдая при этом выпадение белого обильного осадка денатурированных белков;
- смесь центрифугируют при ~32000 g и +4°С в течение 1 часа;
- к полученному супернатанту добавили 0,6 объема изопропанола;
- полученную смесь, после инкубации в течение 20 мин при комнатной температуре, центрифугируют при ~32000 g и +20°С в течение 1 часа, формируя осадок ДНК;
- осадок растворяют в 100 мл H2O и добавляют по 1/10 объема 3М ацетата натрия и 3 объема охлажденного до -20°С этанола и хорошо перемешивают;
- полученную суспензию центрифугируют при ~32000 g и +4°С в течение 1 часа;
- полученный осадок растворили в 50 мл H2O на магнитной мешалке;
- в конечном растворе после стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,22 мкм и определяют концентрацию полученной полинуклеотидной фракции.
Для идентификации полученной нуклеотидной фракции фармкомпозиции используют методы ультрафиолетовой спектрофотометрии и гель-электрофореза в 1,8% агарозном геле, а также качественные реакции на дезоксирибозу и натрий. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 190 до 325 нм: максимум поглощения отмечается при длине волны 260±2 нм, минимум поглощения - при 230±2 нм (фиг.3). Отношение D260/280 от 1,6 до 2,0. Молекулярную массу нуклеотидов, входящих во фракцию, определяют методом электрофореза в 1,8%-ном агарозном геле, при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном молекулярных масс от 75 до 7000 пар оснований: определяется наличие характерных специфических полос в интервале значений от 12 до 660 кДа (фиг.4). При качественной реакции на рибозу получают синее окрашивание при постановке качественной реакции на рибозу, а также примесью белка при определении его концентрации по Лоури не выше 18%.
Проводят идентификацию полученных белково-пептидного комплекса и нуклеотидной фракции, после чего для получения фармкомпозиции их объединяют как минимум в концентрационно равных соотношениях с расчетом конечной концентрации общего белка и полипептидов в полученном растворе в пределах 0,05-2,0 мг/мл при разбавлении фармацевтически приемлемым буферным раствором, например 50 мМ глицин-фосфатным, содержащим при необходимости вспомогательные вещества, например, с концентрациями 0,5% маннитола, 0,0005% полисорбата-80 и двузамещенного фосфорнокислого натрия до рН не ниже 5,2 и не выше 8,5. Проводят повторную идентификацию смеси и фильтрующую стерилизацию.
Идентификационную характеристику фармкомпозиции (БПНК) проводят методами ультрафиолетовой спектрофотометрии и электрофореза в 1,8% агарозном геле. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 260±2 нм, минимум поглощения - при длине волны 230±2 нм (фиг.5). При электрофорезе в 5%-ном полиакриламидном геле при окрашивании нитратом серебра определяется наличие характерных специфических полос белка и нуклеотидов (фиг.6), а при окрашивании реактивом Кумасси бриллиантовым голубым определяется наличие полос окрашивания, характерных только для белковой фракции (фиг.7).
Таким образом, при выделении БПК важно, чтобы:
- в качестве сырья использовалась эмбриональная нервная ткань копытных сельскохозяйственных животных со сроком гестации от конца первой трети до середины последней трети беременности;
- присутствие в буферном растворе детергентов и солюбилизаторов в достаточных концентрациях;
- на стадиях гомогенизации и анионообменной хроматографии рН буферных сред находился в диапазоне 5,2-8,5;
- при проведении анионообменной хроматографии ионная сила раствора (I) элюента при разделении связавшихся с носителем белков и полипептидов была не ниже 0,1 ммоль/л, а сбор целевых фракций производился элюентом, имеющим ионную силу раствора не выше 0,15 ммоль/л;
- в описываемом БПК содержание белка с молекулярными массами от 20 кДа до 160 кДа было не менее 70% от общего содержания белка;
- при индентификации заявленного БПК и проведении денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков отмечалось наличие характерных полос, подтверждающих и характеризующих спектр белково-полипептидных составляющих комплекса. При других параметрах получения состав белково-полипептидного компонента и концентрационные соотношения входящих в него компонентов будут иными.
Заявляемый биологически активный белково-полипептидный комплекс принципиально отличается от всех известных биологически активных субстанций, получаемых из сырья животного происхождения, по:
- сырьевой основе - используется нервная эмбриональная ткань сельскохозяйственных животных на определенной стадии гестации от середины первой трети до середины последней;
- методике получения - присутствие в экстрагирующем буферного раствора, детергентов и солюбилизантов и отсутствие денатурирующих и деградирующих соединений - спиртов, щелочей, кислот и ферментов, позволяет получить мембранные, межклеточные, цитоплазматические, ядерные белки и полипептиды с сохраненной третичной структурой;
- использованию в составе подвижной фазы миллимолярных концентраций катиона для создания умеренной ионной силы, позволяя тем самым получить большое количество специфических для нервной ткани слабо заряженных белков и полипептидов, выполняющих регуляторные, сигнальные и ферментативные функции, определяющие выраженную регенеративно-репаративную биологическую тканеспецифическую активность;
- качественному составу как определенной фракции тканевых (мембранных, клеточных, цитоплазматических, ядерных) гидрофильных, слабо заряженных отрицательных белков и полипептидов, с эволюционно закрепленным в онтогенезе концентрационным соотношением факторов роста, факторов дифференцировки и сигнальных молекул с молекулярной массой от 0,5 кДа до 200 кДа;
- идентификации и стандартизации полученной целевой фракции - наличие специфических, характерных для данного комплекса полос при электрофорезе в 5%-ном полиакриламидном геле (фиг.6), а также удаление с помощью мембранной фильтрации молекул выше 200 кДа;
- чистоте - полученный белково-полипептидный комплекс не содержит примесей в виде липидов, пептидгликанов, липополипротеидов, углеводов, полисахаридов и других соединений;
- способу применения - парентерально (внутрикожно, подкожно), на слизистые оболочки (интраназально, субконъюктивально) и кожу;
- безопасности применения (отсутствие токсических, мутагенных, канцерогенных и аллергизирующих свойств);
- биологической и фармакологической активности (репаративно-регенеративная) и ее специфичности (ткане- и органоспецифичная).
Изменение параметров гидролиза при получении полинуклеотидной фракции для фармацевтической композиции БПНК неизбежно приведут к изменению параметров фармкомпозиции за счет полинуклеотидных компонентов, однако при рекомендуемых концентрациях эти изменения незначительно скажутся на общей биологической активности фармкомпозиции в целом. При изменении природы сырьевого компонента для получения полинуклеотидной фракции (ткани животных, молоки промысловых рыб и т.д.), с сохранением методик получения, заявляемых концентрационных соотношений с белково-полипептидным комплексом и соответствие полученной фракции заявленным критериям, биологическая активность БПНК как фармкомпозиции значимо не меняется.
Заявленная фармкомпозиция в виде БПНК с фармацевтически приемлемым разбавителем позволяет повысить репаративно-регенераторный потенциал БПК за счет специфического действия средне- и низкомолекулярных полинуклеотидов по активизации гуморального и клеточного иммунитета в дозах не выше 0,1-10 мг, а также повысить стабильность раствора всей композиции и увеличить сроки его действия и хранения.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1. Способ получения БПК.
Получение белково-полипептидного комплекса из эмбриональной нервной ткани овец.
440 г эмбриональной нервной ткани ягнят сроком гестации 16-18 недель размораживают и гомогенизируют в 1200 мл 0,05М ТРИС-глициново-фосфатного буфера рН 8,0, содержащего 1 мМ ЭДТА и 0,1% маннит, в течение 5 минут при +4°С, гомогенат отделяют от балластных веществ фильтрованием через плотную ткань с последующим центрифугированием при значении g 10000 в течение 90 мин, отделяя фугат. Надосадочную жидкость фильтруют через мембранный фильтр с диаметром пор 0,45 мкм, фильтрат наносят на уравновешенную 4 объемами 0,05 М глициново-фосфатного буфера с рН 8,5 хроматографическую колонку объемом 200 мл с анионообменным носителем Toyopearl DEAE-650M, разделение связавшихся с носителем белков производят ступенчатым градиентом тем же буферным раствором, содержащим 0,05 М KCl (I=0,1 ммоль/л), повышая концентрацию соли с шагом 0,025 М (I=0,025 ммоль/л) и начиная сбор целевых фракции с концентрациями соли от 0,075 М (I=0,125 ммоль/л) до 0,1 М (I=0,15 ммоль/л), целевые фракции объединяют, подвергают ультрафильтрации на установке при противодавлении не более 8,0 кгс/см2 через материалы с задерживающей способностью выше 200 кДа и разводят 0,05 М раствором глицин-NaOH рН 8,5, полученный раствор подвергают стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,22 мкм и определяют суммарную концентрацию белков.
Все предварительные процессы и процессы получения белково-пептидной фракции производятся при температурах от +2° до +8°С.
Характеристика полученного белково-полипептидного комплекса:
- ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 215±5 нм (Фиг.1);
- молекулярную массу белков, входящих в препарат, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа, в состав фракции входят белки с молекулярной массой от 0,5 кДа до 200 кДа, из которых 76% имеют молекулярную массу в диапазоне от 20 до 160 кДа (Фиг.2);
- количественное определение белка методом Лоури (без предварительного осаждения) - 2,4 мг/мл;
- аминокислотный анализ (%): Asp - 10,82±2,8; Thr - 5,4±1,6; Sec - 5,2±1,8; Glu - 16,2±3,4; Pro - 7,045±2,5; Gly - 5,2±2,4; Ala - 5,4±1,8; Val - 7,08±2,9; Met - 2,65±1,4; He - 4,45±1,8; Leu - 9,4±2,6; Tyr - 4,02±1,2; Phe - 4,8±1,9; Orn - 0,48±0,2; Lys - 8,48±2,4; His - 2,8±0,9; Arg - 6,52±2,2.
Пример 2. Способ получения БПК.
Получение белково-полипептидного комплекса из эмбриональной нервной ткани свиней.
300 г эмбриональной нервной ткани поросят сроком гестации 16-18 недель размораживают и гомогенизируют в буферном растворе рН 5,2, содержащего 50 мМ Трис-малеата, 1 мМ (ЭДТА) и 0,1% маннита, в течение 5 минут при +2°С. Гомогенат отделяют от балластных веществ фильтрованием через плотную ткань с последующим центрифугированием при значении g 28000 в течение 30 мин соответственно, объединяя полученный балластный тканевой материал после фильтрования через плотную ткань и фугат для получения нуклеотидной фракции фармацевтической композиции. Супернатант фильтруют через мембранный фильтр с диаметром пор 0,45 мкм и наносят на уравновешенную 4 объемами малеатного буферного раствора рН 5,2 хроматографическую колонку объемом 250 мл с анионообменным носителем DEAE-Сефароза. Разделение связавшихся с носителем белков производят плавным повышением градиента ионной силы малеатного буферного раствора рН 5,2, содержащего 0,05 М NaCl (I=0,1 ммоль/л), начиная сбор целевой фракции с концентрации соли 0,075 М (I=0,125 ммоль/л) и заканчивая до 0,1 М (I=0,15 ммоль/л), целевую фракцию подвергают ультрафильтрации на установке при противодавлении не более 8,0 кгс/см2 через материалы с задерживающей способностью выше 200 кДа, обессоливают с помощью дилиза против 50 мМ раствора аспартата-NaOH рН 5,2. Раствор подвергают стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,22 мкм.
Для характеристики полученного белково-полипептидного комплекса используют методы ультрафиолетовой спектрофотометрии, гель-хроматографии, электрофореза в полиакриламидном геле и аминокислотного анализа. Ультрафиолетовый спектр раствора снимают в области длин волн от 200 до 500 нм - максимум поглощения отмечается при длине волны 215±5 нм (Фиг.8). Молекулярную массу белков и полипептидов, входящих в комплекс, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа (Фиг.9). В состав препарата входят белки с молекулярной массой от 0,5 кДа до 200 кДа, из которых 72% имеют молекулярную массу в диапазоне от 20 до 160 кДа. Количественное определение белка в полученном БПК методом Лоури (без предварительного осаждения) - 1,85 мг/мл.
Аминокислотный анализ полученного комплекса (%): Asp - 8,3±2,7; Thr - 6,9±2,1; Ser - 6,2±1,5; Glu - 12,9±4,7; Pro - 7,05±2,4; Gly - 8,2±2,1; Ala - 6,1±1,4; Val - 7,5±2,6; Met - 1,4±0,7; He - 4,9±1,2; Leu - 8,7±2,3; Tyr - 5,4±1,8; Phe - 5,5±2,1; Orn - 0,6±0,1; Lys - 8,6±2,8; His - 1,7±0,9; Arg - 7,1±2,8.
Пример 3. Способ получения фармкомпозиции.
а) получение полинуклеотидной фракции:
- объединенный балластный тканевой материал и осадок, оставленный после центрифугирования отфильтрованного гомогената весом 280 г, с помощью миксера ресуспензируют в растворе, содержащем 2,5 мМ ЭДТА и 25 мМ цитрат натрия рН 7,8, в тех же режимах температур в объемном соотношении 1:1,5 (650 мл) выдерживая полученную массу в течение 30 минут, к полученной массе добавляют 10 М NaOH из расчета конечной молярной концентрации щелочи не более 2 (158 мл) и, после размешивания, инкубируют в течение 16 часов при +48°С;
- охлажденную до +2°С смесь центрифугируют при ~32000 g и +4°С в течение 40 мин, удаляя перед переливанием супернатанта с поверхности надосадочной жидкости в центрифужных флаконах с помощью полосок фильтровальной бумаги тонкую масляно-жировую пленку желтого цвета;
- в очищенный объединенный супернатант для повторного гидролиза добавляем 1/10 объема 10 М NaOH (58 мл) и инкубируем 5 часов при +48°С;
- полученный дигидролизат охлаждают на ледяной бане (мокрый лед, 0°С), а затем при непрерывном перемешивании и под контролем рН-метра добавляют ледяную уксусную кислоту до показателя рН смеси не выше 5,4 (63 мл), наблюдая при этом выпадение белого обильного осадка денатурированных белков.
- смесь центрифугируют при ~32000 g и +4°С в течение 1 часа, к полученному супернатанту добавляют 0,6 объема изопропанола и, после инкубации в течение 20 мин при комнатной температуре, центрифугируют при ~32000 g и +20°С в течение 1 часа, формируя осадок ДНК;
- осадок растворяют в 100 мл Н2О и добавляют по 1/10 объема 3М ацетата натрия и 3 объема охлажденного до -20°С этанола и хорошо перемешивали;
- полученную суспензию центрифугируют при ~32000 g и +4°С в течение 1 часа, растворяя полученный в 50 мл H2O на магнитной мешалке. В конечном растворе после стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,22 мкм определяют концентрацию полученной полинуклеотидной фракции - 2,8 мг/мл.
Характеристика полученной нуклеотидной фракции:
- ультрафиолетовой спектр раствора снимали в области длин волн от 190 до 325 нм: максимум поглощения отмечался при длине волны 260±2 нм, минимум поглощения при 230±2 нм. Отношение D260/280 от 1,6 до 2,0 (Фиг.3);
- молекулярную массу нуклеотидов, входящих во фракцию, определяли методом денатурирующего «SDS-Page» электрофореза в 1,8%-ном агарозном геле, при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном пар оснований от 75 до 7000. Отмечается наличие характерных специфических полос в интервале значений молекулярной массы от 12 до 660 кДа (Фиг.4). При качественной реакции на рибозу получаем синее окрашивание. При определении концентрации белка по Лоури в выделенной нуклеотидной фракции она определена как 0,16 мг/мл (т.е. составляет ~0,15% от ДНК).
б) берут полученный по примеру 1 раствор БПК и объединяют с раствором полинуклеотидной фракции в виде натриевой соли дезоксирибонуклеиновой кислоты, полученной известным способом, представленным, например, в примере 3, с таким условием, чтобы конечная концентрация общего белка (определяется по методу Лоури) и концентрация полинуклеотидов (определяется спектофометрически) после разбавления 50 мМ глициново-фосфатным буферным раствором составляла 2 мг/мл. В полученный БПНК возможно добавление вспомогательных веществ: детергентов, солюбилизаторов и консервантов и высокомолекулярных соединений (с учетом конечной концентрации БПНК), в частности, до 0,5% маннитола, 0,0005% полисорбата-80, 0,03% нипагина и двузамещенного фосфорнокислого натрия до рН 8,5. Полученную фармкомпозицию подвергают стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,1 мкм, разливают в стерильные стеклянные флаконы и закупоривают.
Характеристика полученной фармкомпозиции с БПНК:
- идентификационную характеристику белково-полипептидно-нуклеотидного комплекса, после объединения в равных концентрациях полученных белковой и нуклеотидной фракций, проводят методами ультрафиолетовой спектрофотометрии и электрофореза в 1,8% агарозном геле, ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 260±2 нм, минимум поглощения - при длине волны 230±2 нм (Фиг.5). При электрофорезе в 5%-ном полиакриламидном геле при окрашивании нитратом серебра определяется наличие характерных специфических полос белка и нуклеотидов (Фиг.6), а при окрашивании реактивом Кумасси бриллиантовым голубым определяется наличие полос окрашивания, характерных только для белковой фракции (Фиг.7).
Пример 4. Способ получения фармкомпозиции.
а) получение полинуклеотидной фракции:
- объединенный балластный тканевой материал и фугат, оставленный после центрифугирования отфильтрованного гомогената весом 175 г, с помощью миксера ресуспензируют в растворе, содержащем 2,5 мМ ЭДТА и 25 мМ цитрат натрия рН 7,8, в тех же режимах температур в объемном соотношении 1:3 (425 мл) выдерживая полученную массу в течение 30 минут, к полученной массе добавляют 10М NaOH из расчета конечной молярной концентрации щелочи не более 2 (112 мл) и, после размешивания, инкубируют в течение 16 часов при +48°С;
- охлажденную до +2°С смесь центрифугируют при ~32000 g и +4°С в течение 40 мин, удаляя перед переливанием супернатанта с поверхности надосадочной жидкости в центрифужных флаконах с помощью полосок фильтровальной бумаги тонкую масляно-жировую пленку желтого цвета;
- в очищенный объединенный супернатант для повторного гидролиза добавляют 1/10 объема 10М NaOH (42 мл) и инкубировали 5 часов при +48°С;
- полученный дигидролизат охлаждают на ледяной бане (мокрый лед, 0°С), а затем при непрерывном перемешивании и под контролем рН-метра добавляют ледяную уксусную кислоту до показателя рН смеси не выше рН 5,4 (48 мл), наблюдая при этом выпадение белого обильного осадка денатурированных белков;
- смесь центрифугируют при ~32000 g и +4°С в течение 1 часа, к полученному супернатанту добавляя 0,6 объема изопропанола и, после инкубации в течение 20 мин при комнатной температуре, центрифугируют при ~32000 g и +20°С в течение 1 часа, формируя осадок ДНК.
- осадок растворяют в 100 мл H2O и добавляют по 1/10 объема 3М ацетата натрия и 3 объема охлажденного до -20°С этанола и хорошо перемешивают;
- полученную суспензию центрифугируют при -32000 g и +4°С в течение 1 часа, растворяя полученный в 50 мл H2O на магнитной мешалке. В конечном растворе после стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,22 мкм определяли концентрацию полученной полинуклеотидной фракции - 2,1 мг/мл.
Для характеристики полученной нуклеотидной фракции проводили ультрафиолетовую спектрофотометрию и гель-электрофорез в 1,8% агарозном геле, а также качественные реакции на дезоксирибозу и натрий. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 190 до 325 нм: максимум поглощения отмечается при длине волны 260±2 нм, минимум поглощения - при 230±2 нм (Фиг.10). Отношение D260/280 от 1,6 до 2,0. Молекулярную массу нуклеотидов, входящих во фракцию, определяют методом электрофореза в 1,8%-ном агарозном геле, при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном молекулярных масс от 70 до 7000 пар оснований: определяется наличие характерных специфических полос в интервале значений от 12 до 660 кДа (Фиг.11). При качественной реакции на рибозу получают синее окрашивание. При определении концентрации белка по Лоури в выделенной нуклеотидной фракции она определена как 0,12 мг/мл (т.е. составляет ~0,14% от ДНК).
б) берут полученный по примеру 2 раствор БПК и объединяют с раствором полинуклеотидной фракции в виде натриевой соли дезоксирибонуклеиновой кислоты, полученной известным способом, представленным, например, в примере 3, с таким условием, чтобы конечная концентрация общего белка (определяется по методу Лоури) и концентрация полинуклеотидов (определяется спектофометрически) после разбавления 50 мМ глициново-фосфатным буферным раствором составляла 0,05 мг/мл. В полученный БПНК возможно добавление вспомогательных веществ: детергентов, солюбилизаторов и консервантов и высокомолекулярных соединений (с учетом конечной концентрации БПНК), в частности, до 0,5% маннита, 0,0005% полисорбата-80, 0,005% бензалкония хлорида и однозамещенного фосфорнокислого натрия до рН 5,2. Полученную фармкомпозицию подвергают стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,1 мкм, разливают в стерильные стеклянные флаконы и закупоривают.
Характеристика полученной фармкомпозиции с условным обозначением содержащегося в ней образующегося комплекса БПНК:
- идентификационную характеристику белково-полипептидно-нуклеотидного комплекса, после объединения в равных концентрациях полученных белковой и нуклеотидной фракций, проводят методами ультрафиолетовой спектрофотометрии и электрофореза в 1,8% агарозном геле, ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 260±2 нм, минимум поглощения - при длине волны 230±2 нм (Фиг.12). При электрофорезе в 5%-ном полиакриламидном геле при окрашивании нитратом серебра определяется наличие характерных специфических полос белка и нуклеотидов (Фиг.13), а при окрашивании реактивом Кумасси бриллиантовым голубым определяется наличие полос окрашивания, характерных только для белковой фракции (Фиг.14).
Пример 5. Влияние БПНК на развитие эксплантатов головного мозга.
Эксперименты проведены на 52 фрагментах коры головного мозга и 40 фрагментах спинно-мозговых ганглиев 10-12-суточных эмбрионов цыпленка. Питательная среда для культивирования эксплантатов состояла из 35% раствора Игла, 25% фетальной сыворотки теленка, 35% раствора Хенкса, 5% куриного эмбрионального экстракта, в среду добавляли глюкозу (0,6%), инсулин (0,5 ед./мл), пенициллин (100 ед./мл), глютамин (2 мМ). Фрагменты коры головного мозга или спинно-мозговых ганглиев помещали в эту среду и культивировали на коллагеновой подложке в чашках Петри в термостате при температуре 36,7°С в течение 2 суток. В экспериментальную среду добавляли исследуемый БПНК и как положительный контроль - церебролизин и кортексин в концентрациях 0,5, 1, 2, 10, 20, 50, 100, 200, 400, 800, 1000 нг/мл. Критерием биологической активности служил индекс площади (ИП) - соотношение площади всего эксплантата вместе с зоной роста к исходящей площади фрагмента головного мозга. Достоверность различия сравниваемых средних значений ИП оценивали с помощью t-критерия Стьюдента. Значения ИП выражали в процентах, контрольное значение ИП принималось за 100%. Зону роста контрольных эксплантатов головного мозга составляли короткие нейриты, а также выселяющиеся клетки глии и фибробластоподобные клетки. При исследовании непосредственного влияния препаратов на фрагменты головного мозга были поставлены следующие серии опытов. В питательную среду эксплантатов коры головного мозга и спинномозговых ганглиев эмбрионов цыплят добавляли церебролизин и кортексин в различных концентрациях. На 3-и сутки культивирования с добавлением церебролизина при концентрации 100 нг/мл наблюдалось достоверное повышение ИП эксплантатов коры головного мозга на 24±3,5%, по сравнению с контрольными значениями ИП. Достоверных значений ИП эксплантатов коры при действии других концентраций церебролизина не наблюдалось. На 3-и сутки культивирования с добавлением кортексина при концентрации 50 нг/мл наблюдалось достоверное повышение ИП эксплантатов коры головного мозга на 32±4%, по сравнению с контрольными значениями ИП. Отмечалось достоверное повышение ИП эксплантантов коры головного мозга при концентрации кортексина 100 нг/мл на 28+3,5%, концентрации 200 нг/мл на 23+2%. Достоверные значений ИП эксплантатов коры при действии других концентраций кортексина не наблюдалось. Отчетливая стимуляция развития эксплантатов коры головного мозга выявилась при действии исследуемого БПНК в концентрации 20 нг/мл, когда ИП экспериментальных эксплантатов на 48±4,5% был достоверно выше, чем ИП контрольных эксплантатов и эксплантатов сравнения при действии кортексина и церебролизина. При добавлении церебролизина в среду для культивирования эксплантатов спинно-мозговых ганглиев достоверного увеличения ИП эксплантатов не отмечалось, в то время как при добавлении в среду кортексина наблюдалось увеличение ИП эксплантата на 22±3%. При добавлении исследуемого БПНК в среду для культивирования эксплантатов спинно-мозговых ганглиев наблюдалось увеличение ИП эксплантата на 36±3,5%. При исследовании эксплантатов коры головного мозга и спинномозговых ганглиев на более длительных сроках культивирования - 7 дней - выявились те же эффекты нейрит-стимулирующего действия в тех же концентрациях исследуемого комплекса. Таким образом, в отношении тканей головного мозга наблюдалось уменьшение порога эффективных концентраций для исследуемого БПНК по сравнению с церебролизином и кортексином. Так, увеличение зоны роста эксплантатов фрагментов коры головного мозга выявлялось при действии церебролизина только в концентрации 100 нг/мл, кортексина только в концентрациях 50 и 100 нг/мл, а при действии исследуемого БПНК - в концентрации 20, 10, 50 и 100 нг/мл соответственно. При этом интенсивность стимулирующего действия БПНК была достоверно выше, чем кортексина и церебролизина. На увеличение зоны роста эксплантатов спинномозговых ганглиев церебролизин достоверного действия не оказывал, кортексин достоверно увеличивал ИП на 24%, в то время как исследуемый белково-полипептидный комплекс способствовал увеличению ИП на 36%. Это свидетельствует о выраженном и направленном стимулирующем действии БПНК на нейроны различных отделов головного мозга.
Пример 6. Изучение токсичности фармкомпозиции БПНК [17].
Общетоксическое действие БПНК исследовали в режимах острой токсичности при однократном введении, а также подострой и хронической токсичности при длительном введении комплекса [17]. Исследование по изучению острой токсичности проведено на 72 белых беспородных мышах-самцах с массой тела 20-22 г. Животные были рандомизированно разделены на 6 равных групп. Комплекс вводили животным однократно внутримышечно в дозах 5 мг/кг, 10 мг/кг, 100 мг/кг, 200 мг/кг, 500 мг/кг в 0,5 мл стерильного 0,05 М глицин-NaOH раствора рН 7,5. Животным контрольной группы в том же объеме вводили стерильный 0,05 М глицин-NaOH раствор рН 7,5. Исследования по изучению подострой токсичности проведено на 95 белых беспородных крысах-самцах с массой тела 150-180 г. Ежедневно однократно животным подопытных групп вводили БПНК подкожно в течение 90 дней в дозах 1 мг/кг, 10 мг/кг, 50 мг/кг, 100 мг/кг в 0,5 мл стерильного 0,05 М глицин-NaOH раствора рН 7,5. Животным контрольной группы вводили в том же объеме стерильный 0,05 М глицин-NaOH раствор рН 7,5. До введения комплекса и на 30, 60 и 90 сутки после начала введения у животных исследовали морфологический состав и свойства периферической крови. При завершении эксперимента исследовали биохимические и коагулологические показатели крови.
Исследования по изучению хронической токсичности проводили в течение 6 месяцев на 112 морских свинках-самцах с массой тела 250-280 г. Животные подопытных групп получали ежедневно однократно подкожно БПНК в течение 6 мес в дозах 1 мг/кг, 10 мг/кг, 50 мг/кг, 100 мг/кг в 0,5 мл стерильного 0,05 М глицин-NaOH раствора рН 7,5. В контрольной группе животным вводили по аналогичной схеме стерильный 0,05 М глицин-NaOH раствор рН 7,5 в том же объеме. У животных в периферической крови общепринятыми методами определяли: количество эритроцитов, гемоглобина, ретикулоцитов, тромбоцитов, лейкоцитов, лейкоцитарную формулу, скорость оседания эритроцитов (СОЭ), резистентность эритроцитов. Наряду с этим определяли содержание в сыворотке крови общего белка по методу Лоури, калия и натрия методом плазменной спектрофотометрии. После завершения эксперимента проводили патоморфологическое исследование головного и спинного мозга, спинномозговых ганглиев, щитовидной железы, паращитовидных желез, надпочечников, семенников, гипофиза, сердца, легких, аорты, печени, почки, мочевого пузыря, поджелудочной железы, желудка, тонкой кишки, толстой кишки, тимуса, селезенки, лимфатических узлов, костного мозга. При изучении острой токсичности установлено, что однократное введение исследуемого комплекса животным в дозе, превышающей терапевтическую, рекомендованную для клинического применения, более чем в 1000 раз, не вызывает токсических реакций, что свидетельствует о большой терапевтической широте комплекса.
Изучение подострой и хронической токсичности комплекса свидетельствует об отсутствии побочных эффектов при его длительном применении в дозах, превышающих предполагаемую терапевтическую в 600 раз. При исследовании влияния комплекса на морфологический состав и биохимические показатели периферической крови морских свинок через 3 и 6 месяцев после начала его введения достоверного изменения показателей не выявлено.
При оценке общего состояния животных, морфологических и биохимических показателей периферической крови, морфологического состояния внутренних органов, состояния сердечно-сосудистой и дыхательной систем, функции печени и почек патологические изменения в организме не обнаружены. Следовательно, белково-полипептидный комплекс, полученный предлагаемым способом, при длительном введении животным не обладает токсическими свойствами, препятствующими дальнейшему его применению в качестве лекарственного средства, выполненного в виде лекарственной формы для парентерального введения.
Пример 7. Исследование субхронической токсичности фармкомпозиции при интраназальном введении половозрелым животным.
Исследования проводили на половозрелых кроликах-самках породы Шиншилла весом 2500 г [17]. Животные получены из питомника. Кроликов содержали в стандартных металлических клетках по 1 особи. Для кормления использовали брикетированный корм, свежие овощи. Доступ к воде и корму свободный. Освещение вивария искусственное. Температура воздуха +18 - +20°С [18]. В группе 5 животных, количество групп 3. Группы разделены следующим образом: 1 группа (терапевтическая доза) - фармкомпозиция 0,1 мг/мл 0,2 мл, вводимая ежедневно 1 раз в день; 2 группа - фармкомпозиция 0,1 мг/мл 0,2 мл, вводимая ежедневно 2 раза в день; 3 группа - интактные животные. Срок введения 1 месяц.
Токсичность оценивали согласно пунктам контрольного листа наблюдения: по выживаемости, общему виду, состоянию и поведению животных, изменению массы тела (взвешивание проводили в начале и в конце эксперимента). О местном раздражающем действии в ходе эксперимента судили по изменениям слизистых оболочек носа.
Экспериментальным животным до начала и в конце эксперимента исследовали морфологический состав периферической крови (количество эритроцитов, лейкоцитов, тромбоцитов, уровень гемоглобина), биохимические показатели (уровень белка, мочевины, креатина, глюкозы, общего холестерина и триглицеридов), активность некоторых ферментов сыворотки крови (аспартат- и аланинаминотрансферазы, щелочная фосфатаза, лактат дегидрогеназа). Для определения указанных показателей кровь брали из ушной вены в объеме 1,5-2,0 мл.
Подсчет форменных элементов крови производили на автоматическом счетчике крови «Пикоскель» (Венгрия). Уровень гемоглобина определяли гемиглобинцианидным методом. Уровень биохимических показателей определяли с помощью автоматизированной системы ФП-901, «Labsystems» Финляндия.
После окончания хронического эксперимента животных умерщвляли с помощью передозировки наркоза. Вскрытие животных производили сразу после их гибели по полной патологоанатомической схеме.
Морфометрическую оценку параметров органов животных проводили с помощью весов фирмы «Sartorius» (Германия) с последующим вычислением массы органов и их стандартных отклонений.
Для патоморфологических исследований образцы свежей ткани подвергали желатинированию и криостатированию с получением срезов толщиной до 5 мкм. Затем ткани фиксировали и окрашивали гематоксилин-эозином. Микроскопию проводили на микроскопе фирмы «Opton» (Германия).
Полученные экспериментальные данные сравнивали с контрольными и обсчитывали с помощью компьютерной статистической программы.
Результаты исследования
1. Визуальные наблюдения:
Выживаемость: Все подопытные животные перенесли введение фармкомпозиции в исследуемых дозах. Гибели не наблюдалось.
Поведение: повышенной или пониженной активности у подопытных животных сравнительно с контрольными группами не отмечено. Мышечный тонус у подопытных животных и контрольных не отличался повышенной возбудимостью. Замечено, что введение препарата не вызывает у животных чувство дискомфорта.
Внешний вид: все животные независимо от применяемой дозы были средней упитанности, истощением или ожирением не страдали. Шерстяной покров ровный и блестящий; выпадения или ломкости шерсти не выявлено. Помутнения роговицы, слезотечения или каких-либо патологических признаков не отмечено. Ушные раковины розового цвета без корок, не воспалены, подергиваний не замечено. Зубы обычного цвета у всех животных, поломок не наблюдалось.
Функции: дыхание у подопытных животных, как и у контрольных, было спокойное обычного ритма, незатрудненное; слюноотделение без патологии; частота, количество и цвет мочи был в пределах физиологической нормы; экскрет по цвету и оформленности не отличался от контроля.
2. Клинические исследования:
Динамика массы тела: во всех подопытных группах положительная, и достоверно не отличалась от интактного контроля.
Анализ крови: содержание гемоглобина, количество эритроцитов, лейкоцитов, тромбоцитов во всех группах в пределах физиологической нормы.
Биохимические исследования: глюкоза крови, активность аланиновой и аспарагиновой аминотрансфераз во всех группах в пределах нормы. Концентрация белка у кроликов, получавших фармкомпозицию 1 и 2 раза в день, статистически не различалась.
3. Патоморфологические данные:
Во всех исследуемых группах: во внутренних органах (печень, почки, легкие, сердце, селезенка, желудок, толстый и тонкий кишечник), железах внутренней секреции (щитовидная железа, тимус, надпочечники, поджелудочная железа), репродктивных органах (матка, яичники), лимфатических узлах, головном мозге, коже, слизистых носа и горла - патоморфологических изменений не выявлено.
Таким образом, проведены исследования субхронической токсичности назальной формы фармкомпозиции. При субхроническом исследовании спрея не было выявлено значимых изменений внутренних органов испытуемых животных, не обнаружено местнораздражающего действия. При изучении субхронической токсичности использовали клинические методы исследования, общепринятые методы исследования гематологических, биохимических показателей крови, а также гистологических исследований внутренних органов и слизистых носа.
Исследование субхронической токсичности фармкомпозиции на неполовозрелых кроликах при интраназальном введении.
Исследования проводили на 3-недельных крольчатах породы Шиншилла весом от 300 до 500 г. Нанесение препарата производили ежедневно 1 и 2 раза в день по 1 впрыску в течение 2 недель [17]. Животные получены из питомника. Кроликов содержали в стандартных металлических клетках по 1 особи. Для кормления использовали брикетированный корм, свежие овощи. Доступ к воде и корму свободный. Освещение вивария искусственное. Температура воздуха +18 - +20°С [18]. В группе 5 животных, количество групп 3. Группы разделены следующим образом: 1 группа (терапевтическая доза) - фармкомпозиция 0,1 мг/мл 0,2 мл, вводимая ежедневно 1 раз в день; 2 группа - фармкомпозиция 0,1 мг/мл 0,2 мл, вводимая ежедневно 2 раза в день; 3 группа - интактные животные. Срок введения 2 недели.
Токсичность оценивали согласно пунктам контрольного листа наблюдения: по выживаемости, общему виду, состоянию и поведению животных, изменению массы тела (взвешивание проводили в начале и в конце эксперимента). О местном раздражающем действии в ходе эксперимента судили по изменениям слизистых оболочек носа.
Экспериментальным животным до начала и в конце эксперимента исследовали морфологический состав периферической крови (количество эритроцитов, лейкоцитов, тромбоцитов, уровень гемоглобина), биохимические показатели (уровень белка, мочевины, креатина, глюкозы, общего холестерина и триглицеридов), активность некоторых ферментов сыворотки крови (аспартат- и аланинаминотрансферазы, щелочная фосфатаза, лактат дегидрогеназа). Для определения указанных показателей кровь брали из ушной вены в объеме 1,5-2,0 мл. Подсчет форменных элементов крови производили на автоматическом счетчике крови «Пикоскель» (Венгрия). Уровень гемоглобина определяли гемиглобинцианидным методом. Уровень биохимических показателей определяли с помощью автоматизированной системы ФП-901, «Labsystems» Финляндия.
После окончания хронического эксперимента животных умерщвляли с помощью передозировки наркоза. Вскрытие животных производили сразу после их гибели по полной патологоанатомической схеме.
Морфометрическую оценку параметров органов животных проводили с помощью весов фирмы «Sartorius» (Германия) с последующим вычислением массы органов и их стандартных отклонений.
Для патоморфологических исследований образцы свежей ткани подвергали желатинированию и криостатированию с получением срезов толщиной до 5 мкм. Затем ткани фиксировали и окрашивали гематоксилин-эозином. Микроскопию проводили на микроскопе фирмы «Opton» (Германия).
Полученные экспериментальные данные сравнивали с контрольными и обсчитывали с помощью компьютерной статистической программы.
Результаты исследования
Оценка раздражающего действия на слизистую оболочку носа.
Прижизненные биомикроскопические исследования
На протяжении всего срока наблюдения у животных сохранялось нормальное поведение, выделений из носовых ходов и образования корок не замечено. При использовании капель у кроликов возникал рефлекс чихания, который прекращался через 1-2 минуты. При закапывании капель как в терапевтической группе, так и в группе превышенной дозы у крольчат отмечалось механическое раздражающее действие, выразившееся в рефлексе чихания, подергивания носом, животные терли лапами нос.
Контрольная интактная группа. Слизистая оболочка бледно-розового цвета, без отеков и выделений. Во время наблюдение с отоларингологическим зеркалом изъянов на эпителии не обнаруживались. Слизистое отделяемое носа прозрачного водянистого вида. Рефлексы соответствовали физиологической норме.
При конфокальной микроскопии: эпителиальный слой имеет плотно упакованную структуру, четко дифференцированных клеток. Клетки связаны щелевыми контактами.
В группе терапевтической дозы слизистые носа оставались чистыми на протяжении всего срока наблюдения: слабо-розового цвета без выделений, отеков не наблюдалось. Сосуды слизистой оболочки не изменены. Состояние эпителия исследовали на щелевом освещение. Ни в одном случае патологических изменений не выявлено.
В группе ×10. Ни в одном случае патологических изменений слизистой не выявлено.
Клинические и биохимические исследования
Анализ крови: содержание гемоглобина, количество эритроцитов, лейкоцитов, тромбоцитов во всех группах в пределах физиологической нормы. Показатели, полученные в опытных группах, достоверно не отличались от контрольных групп интактных животных и препарата сравнения.
Биохимические исследования: глюкоза крови, активность аланиновой и аспарагиновой аминотрансфераз во всех группах в пределах номы.
Заключение. Проведены исследования токсичности в субхроническом эксперименте на неполовозрелых животных оригинальной фармкомпозиции.
Введение препарата интраназально как в терапевтической дозе, так и в десятикратно превышающих в течение 2 недель не вызывало изменений внутренних органов, не оказывало токсического действия на систему крови. Не оказывал местнораздражающего действия.
Пример 8. Изучение специфической активности БПК и БПНК [17].
Местнораздражающее действие. Проведенные исследования показали, что при подкожном, внутривенном и интраназальном введение субстанции биологически активного БПК не оказывает местнораздражающего действия. При быстром внутривенном введении возможны эффекты гипертермии. Не обнаружено местнораздражающего действия на слизистую носа и горла при интраназальном введении кроликам в течение 1 месяца.
Исследование иммуннотоксических и аллергизирующих свойств
Активная кожная анафилаксия
Опыт проводили на морских свинках в количестве по 10 голов в группе, всего 3 группы. Сенсибилизировали животных по схеме: первая инъекция подкожно, две последующие внутримышечно через день в область бедра. На 14 день на выстриженных участках спины морским свинкам вводили субстанцию БПК внутрикожно, в двукратных разведениях. Для контроля реактивности кожи вводили физиологический раствор тому же животному на другой выстриженный участок кожи. Контрольным животным вводили разрешающую инъекцию субстанции (равную сенсибилизирующей дозе). Затем животным вводили внутривенно по 0,5 мл 1% раствора синего Эванса. Через 30 минут животных умерщвляли эфиром и определяли размер синего пятна на внутренней стороне кожи в месте введения. Положительной считается реакция при размере пятна выше 6 мм, не более 3 мм в контроле. В трех случаях отмечена положительная реакция в группе животных, получавшей препарат в дозе, 10-кратно превышающей терапевтическую. Количество реакций свидетельствует о возможности индивидуальных реакций.
Реакция гиперчувствительности замедленного типа на мышах.
Опыты проводили на нелинейных мышах, массой 18-20 г, по 10 животных в группе. Общее количество животных в опыте - 30. Животных однократно сенсибилизировали внутрикожно в основании хвоста эмульсией БПК в НАФ (1:1). Доза введения составила 60 мкл. Контрольных животных сенсибилизировали эмульсией ПАФ с раствором Хенкса (1:1). Для выявления сенсибилизации через 5 суток мышам в подушечку задней лапы ввели 40 мкл раствора тест-препарата в растворе Хенкса. Через 24 часа после тестирования измеряли величину отека с помощью инженерного микрометра МК-0-25. При статистической обработке полученных результатов не обнаружена достоверная разница в толщине лапок опытных групп и контрольной (Р>0,05). Введение субстанции БПНК не вызывает реакции гиперчувствительности замедленного типа.
Исследование фагоцитарной активности перитонеальных макрофагов.
Постановку реакции проводили на белых крысах массой 180-200 г. Общее число животных в опыте 30, по 10 в каждой группе. Исследовали две дозы препарата БПК: терапевтическую и десятикратно ее превышающую, третья группа - контроль. Метод основан на определении оптической плотности лизирующего раствора после разрушения фагоцитов, поглотивших частицы нейтрального красного. Крыс, подвергнутых воздействию исследуемого препарата, забивали методом декапитации. Асептически внутрибрюшинно вводили 5 мл среды 199, содержащей 20% ЭТС (эмбриональная телячья сыворотка). После массажа брюшной полости среду отсасывали шприцем. Порции клеточной суспензии, полученные от всей группы животных, объединяли в общий пул. Концентрацию живых клеток доводили до 1,5×103 клеток/мл. Суспензию клеток стерильно разливали по 2 мл в пластиковые чашки Петри диаметром 40 мм. Чашки инкубировали 2 часа при 37°С. Надосадок, содержащий не прилипшие клетки, сливали, а фиксированный на пластике монослой дважды промывали средой 199. В слегка подсушенные чашки наливали раствор, содержащий нейтральный красный, и выдерживали при 37°С в течение 1 часа. Раствор сливали. Клетки промывали средой 199. В каждую чашку вносили по 3 мл лизирующего раствора. Клетки тщательно обрабатывали вращательным движением чашки. Раствор сливали в пробирки и на спектрофотометре при длине волны 540 нм измеряли оптическую плотность.
При введении субстанции БПНК фагоцитарная активность магрофагов не снижается. Статистически достоверных различий между показателями в опытных группах и контрольной нет.
Реакция дегрануляции тучных клеток
Постановку реакции проводили на крысах массой 180-200 г, самках.
Общее количество животных в опыте - 30. Раствор субстанции БПК вводили внутрибрюшинно в терапевтической дозе и десятикратно ее превышающей, контролем служила интактная группа. Для получения взвеси тучных клеток животных забивают декапитацией, в брюшную полость вводили буфер; после массажа передней брюшной стенки взвесь тучных клеток собирали в центрифужные пробирки. Препараты готовили на предметных стеклах, окрашенных 0,3% спиртовым раствором нейтрального красного. К 0,03 мл взвеси тучных клеток добавляли 0,03 мл сыворотки опытного животного и 0,03 мл исследуемого препарата в разведении 1:100. В контроле дегрануляция не превышала 5%. Препараты накрывали покровным стеклом, края которого герметизировали парафином. Затем инкубировали 15 минут в термостате при 37°С. Препараты микроскопировали под увеличением Х40, подсчитывая тучные клетки, подвергшиеся дегрануляции и нормальные, в сумме 100. Реакцию считали положительной, если степень дегрануляции превышала 20%.
Введение субстанции БПК в концентрации 0,01 мг/кг не вызывает дегрануляции тучных клеток, не отличается от контроля и превышает пороговое значение на 5%. Реакция в группе с введением в дозе десятикратного превышения терапевтической слабо положительная, однако эти значения не выходят за статистический процент ошибки.
Исследование на прионы. Пробы брали из 4-х флаконов. Реакцию проводили методом иммуноферментного анализа, на 96-луночном полистироловом планшете. Диагностическая тест-система - PrionScreen. Спектрофотометр Digiscan. Каждую пробу ставили в 4-х повторностях. Контроли: К-: 8 лунок, К+: 8 лунок. Полученные оптические плотности контролей и исследуемых образцов соответствовали условиям проведения реакции.
Результаты: инфекционные белки, прионы в исследуемой субстанции БПК не обнаружены.
Общее заключение. Проведены исследования токсичности в остром и субхроническом эксперименте оригинальной субстанции биологически активного БПК, а также изучение его местнораздражающего, иммунотоксического действия, аллергизирующих свойств и выявление наличия прионовых инфекций.
Острую токсичность фармкомпозиции БПНК изучали в эксперименте на мышах линии BALB/C. БПНК вводили тремя способами: подкожно, внутрибрюшинно, перорально и интраназально. Максимально возможная для введения мышам доза составляет 0,2 мл, что составило 10 мг/кг, интраназально вводили по 100 мкл 0,1% раствора в каждый носовой ход. Было выявлено, что в указанных дозах во всех способах введения препарат не вызывал гибели животных, симптомов острого отравления получено не было.
Исследования в субхроническом эксперименте проводили на половозрелых и отдельно на неполовозрелых крысах линии Wistar. Исследуемый препарат вводили подкожно в терапевтической дозе 0,01 мг/кг и десятикратно превышающей 0,1 мг/кг; внутривенно в дозе 0,0025 мг/кг и ×10 - 0,025 мг/кг. Интраназально, по 1 впрыску в каждый носовой ход, 2 раза в день, что составило 400 мкл 0,1% раствора - 0,016 мг/кг изучали на кроликах породы Шиншилла. При исследовании токсичности использовали общепринятые методы исследования гематологических, биохимических показателей крови, а также гистологических исследований внутренних органов.
Было получено, что введение фармкомпозиции БПНК различными способами как в терапевтической дозе, так и в десятикратно превышающих в течение 1 месяца не вызывало изменений внутренних органов, не оказывало токсического действия на систему крови. Не оказывал местнораздражающего действия при различных способах введения.
Исследование аллергизирующих свойств проводили на морских свинках при внутрикожных аппликациях. Было обнаружено, что фармкомпозиция БПНК не вызывала аллергических реакций в терапевтических дозах. Отмечено 2 случая повышенной чувствительности животных к препарату в дозе, в 10 раз превышающей терапевтическую. Исследование иммунотоксичности проведено на макрофагах крыс линии Вистар и не обнаружило данного эффекта.
Проведены исследования фармкомпозиции БПНК на наличие прионовых инфекций методом иммунноферментного анализа. БПНК оказался свободным от искомых возбудителей.
Пример 9. Мутагенность фармкомпозиции.
Для оценки мутагенных свойств заявляемой фармкомпозиции БПНК применили набор следующих тестов [19]:
- учет генных мутаций в тесте Эймса Salmonella /микросомы с использованием в качестве тест-объектов штаммов Salmonella typhimurium ТА 97, ТА 98 и ТА 100;
- учет микроядер в клетках костного мозга мышей.
Испытан образец белково-полипептидной фармкомпозиции, представляющий собой прозрачную жидкость, стерильно упакованную во флакон темного стекла в количестве 20 мл, содержащую субстанцию в концентрации 0,1 мг/мл.
Оценка мутагенных свойств белково-полипептидно-нуклеотидной фармкомпозиции в тесте Эймса.
Мутационный тест на Salmonella typhimurium является бактериальной тест-системой для учета генных мутаций к прототрофности по гистидину при действии химических соединений и (или) их метаболитов, индуцирующих мутации типа замены оснований или сдвига рамки считывания в геноме этого организма. Мутагены, индуцирующие замены пар оснований, - агенты, вызывающие мутации замены пар оснований в молекуле ДНК. Мутагены, индуцирующие мутации сдвига считывания генетического кода (фреймшифт мутации), - агенты, вызывающие добавление или нехватку одиночных или множественных пар оснований в молекуле ДНК.
Данный метод предназначен для выявления способности фармакологических веществ или их метаболитов индуцировать генные мутации у индикаторных штаммов Salmonella typhimurium. Бактерии обрабатываются тестируемым соединением с системой метаболической активации (СМ+) или без метаболической активации (СМ-). После инкубации в течение определенного периода времени подсчитывается количество ревертантных колоний у разных тестерных штаммов в сравнении с количеством спонтанных ревертантов в вариантах негативного контроля (необработанные культуры или культуры, обработанные растворителем). Если тестируемое соединение и (или) его метаболиты обладают мутагенной активностью, то они будут индуцировать обратные мутации от ауксотрофности к прототрофности по гистидину у гистидин-зависимых штаммов Salmonella typhimurium.
Для тестирования использовали набор индикаторных штаммов Salmonella typhimurium, позволяющий регистрировать мутации типа сдвига рамки считывания генетического кода (ТА 98 и ТА 97) и замены пар оснований (ТА 100). Штаммы получены из Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика.
Регламент работы с бактериальными культурами, проверка генотипов штаммов, правила их музейного хранения, необходимые для проведения экспериментов оборудование, посуда, реактивы и питательные среды и растворы, проведение работ по получению гомогената печени крыс и составление активирующей смеси, а также методы статистического анализа полученных результатов соответствовали стандартным, подробно описанным в соответствующей литературе.
Для метаболической активации использовали фракцию S9 печени самцов крыс Wistar, которым за 5 дней до забоя вводили индуктор микросомальных ферментов - совол (300 мг/кг, однократно, внутрибрюшинно). Для контроля активности системы метаболической активации использовали бромид этидия (10 мкг/чашку) на штамме ТА 98 при СМ+.
Фармкомпозиция БПНК в виде стерильного раствора с равным содержанием белка и нуклеотидов - 0,1 мг/мл, исследовали 1,0 и 0,3 мл исходного раствора на чашку и три 10-кратных разведения в физиологическом растворе (по 0,1 мл/ч). Тестируемые дозы субстанции составили 300; 100; 10; 1 и 0,1 мкг на чашку.
Эксперимент сопровождали положительными контролями, в качестве которых использовали вещества, индуцирующие мутации у соответствующих штаммов-тестеров при наличии или отсутствии условий активации. Для вариантов без активации использовали азид натрия в количестве 10 мкг на чашку для штамма ТА 100 при СМ-; 2,7-диамино-4,9-диокси-5,10-диоксо-4,5,9,10-тетрагидро-4,9-диазопирен (ДИАМ) - 10 мкг на чашку для штамма ТА 98 при СМ-; 9-аминоакридин (9АА) - 50 мкг/чашку для штамма ТА 97 при СМ-. Для контроля активности системы метаболической активации использовали этидиум бромид - 10 мкг на чашку на штамме ТА 98 при СМ+. В качестве негативного контроля использовали физиологический раствор (0,1 мл на чашку).
Селективный полуобогащенный агар (0,7%) в пробирках плавили в водяной бане при +100°С и помещали в термостатируемую водяную баню с температурой +45° - +46°С.
Сначала в пробирки с агаром вносили 0,1 мл образца в необходимых разведениях, затем - 0,1 мл суспензии бактерий и 0,5 мл микросомальной активирующей смеси (для варианта с метаболической активацией). Затем содержимое пробирки быстро перемешивали и выливали на слой нижнего минимального агара в чашки Петри. Продолжительность времени внесения микросомальной активирующей смеси и розлива полужидкого агара на чашку не превышала 10-15 секунд. Чашки оставляли при комнатной температуре на 30-40 минут и после полного застывания агара переносили в термостат при +37°С. Учет результатов проводили через 48 часов инкубации.
Параллельно в опыт включали варианты без системы метаболической активации (СМ-) и в присутствии системы метаболической активации (СМ+). В варианте СМ- может быть зарегистрировано действие прямых мутагенов, то есть препаратов, проявляющих мутагенный эффект за счет активности исходной структуры вещества. Действие же промутагенов, то есть соединений, эффект которых связан с образованием мутагенных метаболитов, может быть учтено при сравнении результатов, полученных при анализе данных испытаний вещества в вариантах СМ- и СМ+. В каждом контрольном и опытном вариантах использовали по 2 чашки. Мутагенный эффект считали значимым, если среднее количество колоний ревертантов на чашку в опытном варианте превышало таковое в контрольном варианте в 2 и более раз. Результаты эксперимента учитывали при наличии стандартного ответа во всех вариантах позитивного и негативного контроля. Количество колоний ревертантов в контроле с растворителем в вариантах СМ- и СМ+ было в пределах колебаний спонтанного уровня для данных штаммов. Ответ штаммов на стандартные мутагены был в пределах обычных уровней.
Исследованная фармкомпозиция БПНК во всех тестируемых концентрациях не показала мутагенного эффекта на штаммах ТА 100, ТА 98 и ТА 97 в вариантах без и в присутствии системы метаболической активации.
ЗАКЛЮЧЕНИЕ: фармкомпозиция БПНК не обладает способностью индуцировать генные мутации на тестерных штаммах Salmonella typhimurium во всем диапазоне испытанных концентраций.
Оценка мутагенных свойств БПНК фармкомпозиции микроядерным методом в клетках млекопитающих.
Цитогенетическая активность - способность вещества вызывать структурные и численные хромосомные нарушения в соматических и зародышевых клетках.
Микроядра - небольшие ДНК-содержащие образования, состоящие из ацентрических фрагментов хромосом или отставших на стадии анна-телофазы хромосом. На стадии телофазы эти фрагменты могут включаться в ядра дочерних клеток или образовывать одиночные или множественные микроядра в цитоплазме.
Цель исследования - выявление и количественная оценка цитогенетической (мутагенной) активности фармакологических средств в полихроматофильных эритроцитах (ПХЭ) костного мозга млекопитающих. Метод основан на микроскопической регистрации клеток с микроядрами.
Эксперименты проводили на самцах и самках мышей-гибридов F1 (CBAx C57BI6/J) двухмесячного возраста массой 18-20 г. В состав каждой группы входило по 6 особей. Животных содержали при 12-часовом световом режиме в условиях свободного доступа к воде и пище. Эксперименты на животных по оценке мутагенных свойств БПНК при однократном и пятикратном введении осуществляли в соответствии с официальными протоколами. Проведено 3 серии экспериментов с соответствующими контролями: терапевтическая доза испытана на самцах при однократном введении; субтоксическая доза испытана на самцах при однократном введении; терапевтическая доза испытана на самцах и самках при пятикратном введении. Учитывая, что возможным предполагаемым способом применения фармкомпозиции БПНК в клинике - внутривенный, подкожный и интраназальный, мышам в данном исследовании использовали внутрибрюшинное введение субстанции. Дозу БПНК для оценки мутагенной активности рассчитывали, исходя из наибольшей рекомендованной суточной терапевтической дозы (ТД) для человека. Рекомендовано внутривенное введение фармкомпозиции БПНК в количестве 2 мл при концентрации 0,1 мг/мл. При этом терапевтическая доза (ТД) для человека, в том числе для ребенка, может составить 0,05 мг/кг/сутки. Для расчета дозы в экспериментах на мышах рекомендуется использовать коэффициент пересчета, учитывающий соотношение площади поверхности тела и массы тела человека и мыши. В нашем исследовании он составил 8,33. Поэтому в качестве ТД для мышей использовали дозу, приблизительно равную 8,33 ТД для человека (0,42 мг/кг).
В качестве субтоксической использовали максимально возможную в условиях данного эксперимента дозу 10 мг/кг, поскольку вещество было предоставлено в концентрации 0,1 мг/мл, а общепринятое количество вещества, вводимое мышам, составляет 0,1 мл на 10 г веса. Соответственно в пересчете для человека максимальная испытанная доза составляет 1,7 мг/кг.
Было сформировано 7 групп животных: четыре опытных и три соответствующих контрольных. Субстанцию в дозе 0,1 мг/кг вводили пятикратно с интервалом 24 часа самцам и самкам. Забой во всех группах проводили через 6 часов после последнего введения белково-полипептидного комплекса.
В двух других опытных группах БПНК вводили однократно самцам в дозах 0,2 мг/кг и 0,5 мг/кг.
В качестве негативного контроля использовали растворитель - физраствор. Его вводили внутрибрюшинно самцам и самкам двух контрольных групп в те же сроки и в тех же объемах, что и животным опытных серий. В качестве позитивного контроля использовали циклофосфамид в дозе 20 мг/кг, растворенный ex tempore в физрастворе при однократном внутрибрюшинном введении за 24 часа до забоя.
Препараты клеток костного мозга для учета микроядер готовили общепринятым способом в соответствии с принятыми методическими рекомендациями [20]. Животных умерщвляли методом цервикальной дислокации через 6 часов после последнего введения препарата. Выделяли обе бедренные кости и очищали их от мышц. Для вымывания костного мозга использовали эмбриональную телячью сыворотку (НПП ПанЭ-КО). Костный мозг из обеих бедренных костей вымывали шприцем в микропробирку. Суспензию центрифугировали при 1000 об/мин, в течение 5 минут, супернатант удаляли, осадок осторожно ресуспендировали. Из капли суспензии готовили мазок, высушивали его на воздухе. Фиксировали метанолом 3 минуты. Окрашивали по методу Романовского-Гимза. Анализировали на зашифрованных препаратах по 2000 полихроматофильных эритроцитов от каждого животного. При подсчете 500 эритроцитов определяли соотношение полихроматофильных и нормохромных эритроцитов. Препараты расшифровывали по окончании анализа.
Критерием позитивного результата является воспроизводимое и статистически значимое увеличение числа полихроматофильных эритроцитов с микроядрами по крайней мере в одной из опытных групп по сравнению с контрольной. Полученный положительный результат свидетельствует, что вещество индуцирует хромосомные повреждения и/или нарушения митотического аппарата клеток у экспериментальных животных.
Статистическую обработку результатов по учету микроядер проводили путем сравнения опытных серий с контрольными по критерию Х2; межгрупповое сравнение доли полихроматофильных эритроцитов проводили с помощью критерия Манна-Уитни.
Результаты учета микроядер в полихроматофильных эритроцитах костного мозга мышей: во всех вариантах опыта фармкомпозиция БПНК не вызывала увеличения частоты клеток с микроядрами в костном мозге мышей при сравнении опытных и соответствующих контрольных серий. Циклофосфамид (позитивный контроль) при внутрибрюшинном введении самцам мышей в дозе 20 мг/кг вызывал повышение частоты клеток с микроядрами в 19,6 раза (62,1% против 3,16% в контроле, Р<0,001). Доля ПХЭ от общего числа эритроцитов костного мозга была приблизительно на одном уровне в группах опытных и контрольных серий, что свидетельствует об отсутствии токсического действия композиции в испытанных дозах на кроветворение. При действии позитивного контроля (циклофосфамида) отмечен сдвиг соотношения полихроматофильных и нормохромных эритроцитов в сторону последних (при сравнении с контролем Р<0,005).
Таким образом, мутагенная активность БПНК не выявлена в тесте на индукцию микроядер в полихроматофильных эритроцитах костного мозга мышей при условии однократного и пятикратного введения самцам и самкам внутрибрюшинно в дозе 0,42 мг/кг массы тела, что в пересчете соответствует суточной терапевтической дозе для человека. Мутагенная активность не выявлена также в условиях однократного введения белково-полипептидной фармкомпозиции самцам в максимально возможной дозе - 10 мг/кг. БПНК не проявил токсического действия по показателю «доля полихроматофильных эритроцитов».
Заключение по оценке мутагенных свойств БПНК.
БПНК не обладает мутагенной активностью в тесте Эймса Salmonella /микросомы и в тесте на индукцию микроядер в клетках костного мозга мышей в условиях экспериментов, проведенных в соответствии с Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ.
Пример 10. Действие биологически активной субстанции - БПК на цитокинетические параметры клеточной популяции.
Материалы и методы. Мышиные фибробласты 3Т3 культивировали на среде ДМЕМ (ПанЭко, Москва) с добавлением 584 мг/л глютамина, противогрибково-противомикробного препарата (Sigma, США) согласно инструкции производителя, и 10% по объему стандартизованной эмбриональной телячьей сыворотки (HyClone, США). Для проведения экспериментов клетки высаживали на 24-х луночные планшеты (Coming) в концентрации 3000 клеток на мл (на лунку). Для морфологических исследований в лунки планшета помещали покровные стекла диаметром 12 мм (Ted Pella, США) и высаживали клетки на них.
Внесение тестируемых веществ. По достижении клеточной культурой требуемой плотности заменяли среду культивирования на свежую того же состава (контроль), на ДМЕМ без сыворотки с добавлением 2 мг/мл БСА (Sigma) (отрицательный контроль), ДМЕМ без сыворотки с добавлением 10% по объему БПК (опыт 1) и ДМЕМ с добавлением 10% сыворотки и 10% БПНК (опыт 2).
Экспериментальные процедуры. Клетки анализировали через 8, 24 и 48 часов после внесения тестируемых реактивов. Состояние культуры in vivo анализировали и фотографировали клетки с помощью фазово-контрастного инвертированного микроскопа Axiovert 200M (Carl Zeiss, Германия), оснащенного объективом ЕС Plan-Nefluar 10x NA 0,5 и цифровой камерой ORCA II Erg-2 (Hamamatsu Photonics, Япония). Для определения количества клеток диссоциировали клеточный пласт смесью р-ра Версена (ПанЭко) и 0,025% р-ра трипсина (ПанЭко) в отношении 3:1. Полученную суспензию центрифугировали при 300 g, осадок ресуспендировали в растворе Хэнкса (ПанЭко) и считали в камере Горяева. Для анализа цитокинетических параметров популяции клетки, выращенные на покровных стеклах, фиксировали 1% глютаровым альдегидом на 0,1М фосфатном буфере при +4С, пермеабилизировали 0,5% р-ром Тритона Х-100 на PBS 10 минут, промывали дистиллированной водой и окрашивали гематоксилином Майера (90 секунд) (Sigma), обезвоживали и заключали в DePeX. После пермеабилизации также окрашивали клетки DAPI (0,1 мкг/мл) и заключали в Moviol. Полученные препараты изучали с помощью флуоресцентного микроскопа Axioskop II (Carl Zeiss), используя объективы Plan-Neofluar 40×NA 1,2 и 100×NA 1,3.
Результаты. Цитокинетические параметры популяций.
Контроль. 8 часов. Митотический индекс - 8%. Апоптоз и некроз - 0%.
24 часа. Митотический индекс - 11,9%. Апоптоз и некроз - 0%. Количество клеток в лунке - 265000.
48 часов. Митотический индекс - 9%. Апоптоз и некроз - 0%. Количество клеток в лунке - 780000.
БСА. 8 часов. Митотический индекс - 5%. Апоптоз и некроз - 0%.
24 часа. Митотический индекс - 5,5%. Апоптоз и некроз - 0%. Количество клеток в лунке - 167500.
48 часов. Митотический индекс - 3%. Апоптоз и некроз - 0%. Количество клеток в лунке - 625000.
БПНК.
8 часов. Митотический индекс - 6%. Апоптоз и некроз - 0%.
24 часа. Митотический индекс - 7,1%. Апоптоз и некроз - 0%. Количество клеток в лунке - 250000.
48 часов. Митотический индекс - 6%. Апоптоз и некроз - 0%. Количество клеток в лунке: посчитано 187000, реально ≈400000 (выброс).
Сыворотка + БПНК.
8 часов. Митотический индекс - 8%. Апоптоз и некроз - 0%.
24 часа. Митотический индекс - 4,5% (выброс). Апоптоз и некроз - 0%. Количество клеток в лунке - 317500.
48 часов. Митотический индекс - 9%. Апоптоз и некроз - 1%. Количество клеток в лунке - 680000.
Все экспериментальные линии демонстрируют прирост биомассы, не наблюдается цитотоксического действия ни в одном из случаев. В отрицательном контроле эффективность пролиферации минимальна, в присутствие БПНК наблюдается стимуляция пролиферации по сравнению с отрицательным контролем. Положительный контроль и среда с добавлением БПНК и сыворотки показывают одинаковый уровень пролиферации.
Клетки, инкубированные в присутствие с БПНК, формируют тонкие длинные отростки. Особенно хорошо заметно на первые сутки эксперимента. В присутствие сыворотки на фоне БПНК эффект сохраняется.
Выводы: 1) Биологически активная субстанция, состоящая из БПК, не является цитотоксичным препаратом.
2) Субстанция содержит ростовые факторы, однако не так эффективна в качестве стимулятора пролиферации, как эмбриональная сыворотка крови.
3) Субстанция вызывает изменение формы клеток с хорошо заметным формированием отростков.
Пример 11. Влияние БПНК на кровоснабжение мозга и выживаемость крыс в условиях его ишемического поражения.
Исследование проводили на крысах-самцах линии Вистар массой 180-250 г в условиях необратимой двусторонней окклюзии общих сонных артерий (см. Гусев Е.И., Скворцова В.И., 2001). Животных получали из питомника лабораторных животных ФИБХ РАН (г.Пущино) и подвергали карантину в течение 5 дней. Все ветеринарные манипуляции проводились в асептических условиях, позволяющие сохранить статус экспериментальных животных. Для содержания экспериментальных животных использовали стандартные условия [18]. У крыс под эфирным наркозом (эфир диэтиловый х/ч, ОАО «Медхимпром») в области шеи по средней линии делали небольшой разрез кожи длиной 8-10 мм, для обеспечения доступа к сонным артериям. Выделяли обе сонные артерии, отделяя блуждающий и симпатический нервы, проходящие вместе с артериями. Под сосуды подводили шелковые лигатуры (Silk bik 17×45 CM/M3/USP2/ Non needled/«Ethicon Johnson & Johnson», кат. № W203) и вместе с ассистентом производили одномоментную перевязку обеих сонных артерий тройным хирургическим узлом. Кожный разрез зашивали хирургическим шелком (Silk bik 100 см/M5/Sgle armed KP-3USP2/Non needled/«Ethicon Johnson & Johnson», кат. № W794), накладывая один или два хирургических кожных шва, с последующей обработкой раны 5% раствором настойки йода. Физиологический раствор или БПНК вводили внутрибрюшинно. Продолжительность всех манипуляций составляет 8-10 минут, затем животных помещают в клетку. Для исследования использовали три группы животных:
- группа 1 - контрольные животные после перевязки сонных артерий, получавшие физиологический раствор стерильным одноразовым инсулиновым шприцем 0,5 мл на крысу через 1 час и 0,5 мл на крысу через 5 часов после перевязки сонных артерий;
- группа 2 - ложнооперированные животные, у которых проводились те же манипуляции, что и у контрольных, только без перевязки сонных артерий, которым вводили физиологический раствор 0,5 мл на крысу через 1 час и 0,5 мл на крысу через 5 часов;
- группа 3 - животные после перевязки сонных артерий, которым вводили БПНК в дозе 0,5 мл 0,1% раствора (0,2 мг/кг) на крысу через 1 час и 0,5 мл на крысу через 5 часов;
- группа 4 - животные после перевязки сонных артерий, которым вводили БПНК в дозе 200 мкл 0,1% раствора на крысу интраназально непосредственно перед операцией, сразу после наркотизации, через 1 и 5 часов после операции.
Выживаемость животных отслеживали сразу после проведения процедуры перевязки и в течение первых суток, т.е. конечную выживаемость фиксировали через 24 часа. Биологическая активность препарата в виде защиты головного мозга в условиях неполной глобальной ишемии при одномоментной перевязке сонных артерий оценивалась следующим образом:
- выраженная - при выживании более 80% крыс;
- средневыраженная - при выживании 70-80% крыс;
- невыраженная - при выживании менее 70% крыс.
Статистическую обработку данных проводили с использованием точного критерия Фишера с учетом множественности сравнений.
Проведенные опыты показали, что в контрольных опытах после перевязки обеих сонных артерий в первый час погибает наибольшее количество животных, т.е. 11 из 24, а через сутки еще 4 животных, всего погибло 15 крыс из 24 (63%, табл.1). Среди ложнооперированных животных погибло 2 крысы сразу после операции (17%).
БПК при внутрибрюшинном введении крысам через 1 час и 5 часов по 0,2 мг/кг (0,5 мл 0,1% раствора) внутрибрюшинно вызывал гибель только двух животных, а 34 из 36 крыс выжило. Увеличение выживаемости животных по сравнению с контролем составляет 95%.
БПК при интраназальном введении крысам непосредственно перед операцией и через 1 и 5 часов после операции вызывал гибель шести животных, а 30 из 36 крыс выжило. Увеличение выживаемости животных по сравнению с контролем составляет 83%. Полученные данные представлены в таблице 1.
Таким образом, биологически активная субстанция, представляющая собой белково-полипептидно-нуклеотидный комплекс, оказывает статистически значимое увеличение выживаемости животных по сравнению с контролем в условиях неполной глобальной ишемии мозга, вызываемой одномоментной перевязки обеих сонных артерий, как при внутрибрюшинном, так и при интраназальном способах введения.
Пример 12. Изучение влияния фармакологической композиции БПНК на локальный мозговой кровоток в коре головного мозга наркотизированных крыс в условиях глобальной преходящей ишемии.
Опыты проводили на наркотизированных крысах-самцах линии Вистар массой 220-250 г при естественном дыхании. Крыс наркотизировали уретаном (фирма Sigma Aldrich Chemie GmbH, Germany) в дозе 1400 мг/кг внутрибрюшинно [21, 22, 23].
Методика. Состояние мозгового кровообращения у животных оценивали по регистрации локального мозгового кровотока в коре головного мозга крыс с помощью метода лазерной Допплеровской флоуметрии. Для регистрации локального мозгового кровотока в теменной области коры головного мозга крыс использовали флоуметр ALF-21 фирмы "Transonic System Inc." (США). Для этой цели игольчатый датчик флоуметра диаметром 0,8 мм устанавливали на теменной области коры большого мозга крысы с помощью микроманипулятора и коромысла. Одновременно регистрировали изменения артериального давления через предварительно введенный в бедренную артерию полиэтиленовый катетер. Запись показателей кровотока и артериального давления производили на полиграфе фирмы «BIOPAK» США и персональном компьютере. Фармакологическую композицию БПНК вводили в дозе 0,2 мг/кг (0,5 мл 0,1% раствора) через полиэтиленовый катетер в бедренную вену животных.
Модель глобальной преходящей ишемии широко используется для изучения как нарушений мозгового кровотока, так и изменений различных биохимических показателей функции мозга, происходящих после ишемического поражения. Глобальную преходящую ишемию у крыс вызывали 10-минутной окклюзией обеих общих сонных артерий с помощью специальных зажимов с одновременным снижением артериального давления до 40-50 мм рт.ст. путем забора артериальной крови из предварительно вставленного полиэтиленового катетера в бедренную артерию. Через 10 минут зажимы с сонных артерий снимают, а забранную ранее кровь вводили обратно животному.
Результаты исследования обрабатывали методом вариационной статистики с помощью дисперсионного анализа для повторных измерений и критерия множественных сравнений по Даннету с использованием программы Biostat.
Результаты исследования
Проведенные опыты показали, что в результате глобальной преходящей ишемии в коре головного мозга крыс наблюдается резкое снижение локального мозгового кровотока, которое в среднем составляет 6,1±1,0 усл.ед или 82±2,2% от исходного уровня. После снятия зажимов с сонных артерий и последующей реинфузии крови наблюдается резкое увеличение локального кровотока, которое постепенно снижается и через 30 минут после реперфузии составляет в среднем 25±2,8 усл.ед или 23±2,4% от исходного уровня (р<0,05).
Фармакологическая композиция БПНК, введенная через 30 минут после реперфузии внутривенно в дозе 0,2 мг/кг (0,5 мл 0,1% раствора), уже через 10 минут после введения в большинстве опытов вызывала увеличение локального мозгового кровотока в коре головного мозга крыс в среднем на 12±3,3% (в 7 из 10 опытов). Статистически значимое увеличение локального мозгового кровотока начинало проявляться на 50 минуте, которое составляло в среднем 39±9,2%, и продолжалось до 90 минуты наблюдения. 3десь следует отметить, что в контрольных опытах с введением физиологического раствора уровень локального мозгового кровотока практически не изменяется.
Параллельно изменениям мозгового кровотока проводили регистрацию артериального давления. Опыты показали, что через 10 минут после введения фармакологической субстанции крысам наблюдалось постепенное снижение уровня артериального давления, которое через 50 минут снижалось в среднем на 15±3,4% и оставалось пониженным до конца эксперимента.
Следует отметить, что в контрольных опытах с введением физиологического раствора также наблюдается небольшое снижение уровня артериального давления в среднем на 18%, поэтому можно сказать, что фармакологическая субстанция БПНК не оказывает существенного влияния на уровень артериального давления.
Заключение
Таким образом, в результате проведенного исследования показано, что фармакологическая композиция БПНК увеличивает выживаемость экспериментальных животных в условиях полной перевязки сонных артерий. Вместе с тем, фармакологическая субстанция увеличивает локальный мозговой кровоток в коре головного мозга крыс, сниженный после глобальной преходящей ишемии головного мозга, который к концу эксперимента по величине превосходит контрольный уровень, наблюдаемый до ишемии. Можно полагать, что повышение выживаемости животных при перевязке сонных артерий под влиянием фармакологической субстанции может быть обусловлено его способностью усиливать кровоснабжение коры головного мозга экспериментальных животных.
Пример 13. Больной Л,. 22 года. Диагноз - последствия детского церебрального паралича (спастический парез правой кисти с гипертонусом мышц сгибателей руки, двигательная гиподинамия). Фармкомпозиция БПНК назначалась курсовыми дозами подкожно по 1 мл 0,1% раствора 10 дней, с повтором курса через 7-10 дней по 3 курса 4 раза в год и интраназально по 2 впрыска в каждый носовой ход (400 мкл 0,1% раствора) однократно утром в течении 10 дней 4 курса в год. После лечения заявляемым препаратом в течение одного года в сочетании с физиотерапевтическими методами отмечалась выраженная положительная динамика в виде регресса спастического тонуса с нарастанием объема движений. Больной стал писать, чистить картофель и выполнять другие мелкие движения с высокой точностью. Начал плавать. Применение известных лекарственных средств в течение предыдущих 8 лет не дало положительных результатов.
На прилагаемых фиг.1 - фиг.14 представлены результаты испытаний и исследований комплекса по изобретению.
На фиг.1 приведен ультрафиолетовый спектр раствора белково-полипептидного комплекса в области длин волн от 200 до 500 нм с максимум поглощения при длине волны 215±5 нм, полученного по примеру 1.
На фиг.2 приведен денатурирующий электрофорез раствора белковой фракции, полученного по примеру 1. (2) в 5%-ном полиакриламидном геле при окрашивании реактивом Кумасси бриллиантовым голубым в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа (1).
На фиг.3 приведен ультрафиолетовый спектр нуклеотидной фракции фармкомпозиции, полученного по примеру 1, снимают в области длин волн от 190 до 325 нм: максимум поглощения отмечается при длине волны ~(260±2) нм, минимум поглощения при ~(230±2) нм.
На фиг.4 приведен электрофорез нуклеотидной фракции комплекса в 1,8%-ном агарозном геле, при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном молекулярных масс от 100 до 7000 пар оснований. Определяется наличие характерных специфических полос в интервале значений от 12 до 660 кДа.
На фиг.5 приведен ультрафиолетовый спектр раствора фармкомпозиции БПНК в области длин волн от 200 до 500 нм с максимумом поглощения при длине волны ~(260±2) нм и минимумом поглощения при ~(230±2) нм.
На фиг.6 приведен денатурирующий электрофорез фармкомпозиции БПНК по примеру 3. (2), в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков и диапазоном молекулярных масс от 1 кДа до 250 кДа (1) при окрашивании нитратом серебра. Определяется наличие характерных специфических полос белковой и нуклеотидной фракций.
На фиг.7 приведен денатурирующий электрофорез фармкомпозиции БПНК по примеру 3. (2), в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа при окрашивании реактивом Кумасси бриллиантовым голубым. Определяется наличие полос окрашивания, характерных для белковой фракции БПНК.
На фиг.8 приведен ультрафиолетовый спектр раствора белково-полипептидного комплекса, полученного по примеру 2. В области длин волн от 200 до 500 нм с максимум поглощения при длине волны 215±5 нм.
На фиг.9 приведен денатурирующий электрофорез белково-полипептидного комплекса, полученного по примеру 2. (2) в 5%-ном полиакриламидном геле при окрашивании реактивом Кумасси бриллиантовым голубым в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа (1).
На фиг.10 приведен ультрафиолетовый спектр нуклеотидной фракции фармкомпозиции по примеру 4, снимают в области длин волн от 190 до 325 нм: максимум поглощения отмечается при длине волны ~(260±2) нм, минимум поглощения - при ~(230±2) нм.
На фиг.11 приведен электрофорез нуклеотидной фракции фармкомпозиции по примеру 4, в 1,8%-ном агарозном геле, при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном молекулярных масс от 100 до 7000 пар оснований. Определяется наличие характерных специфических полос в интервале значений от 12 до 660 кДа.
На фиг.12 представлен ультрафиолетовый спектр раствора фармкомпозиции БПНК, полученной по примеру 4, в области длин волн от 200 до 500 нм с максимумом поглощения при длине волны ~(260±2) нм и минимумом поглощения при ~(230±2) нм;
На фиг.13 приведен денатурирующий электрофорез фармкомпозиции БПНК, полученной по примеру 4. (2), в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа (1) при окрашивании нитратом серебра. Определяется наличие характерных специфических полос белковой и нуклеотидной фракций.
На фиг.14 приведен денатурирующий электрофорез фармкомпозиции БПНК, полученной по примеру 4. (2), в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа при окрашивании реактивом Кумасси бриллиантовым голубым. Определяется наличие полос окрашивания, характерных для белковой фракции БПНК.
Изобретение позволяет создать биологически активную субстанцию, с расширенными свойствами и высокой биологической активностью, обладающую тканеспецифическим репаративно-регенеративным действием на нервную ткань, и разработать способ ее получения путем выделения биологически активного белково-полипептидного комплекса из мозга эмбрионов копытных сельскохозяйственных животных, которая решается за счет выбранной совокупности действий и режимов. Особенно важным оказалось определение оптимальных сроков гестации эмбрионального мозга, а также набора реагентов, их доз, режимов экстракции, буферизации для сохранения эффективных концентрационных соотношений белков, полипептидов и нуклеотидов закрепленных эволюционно и определяющих биологическую активность комплекса, обеспечивая репаративно-регенеративное тканеспецифическое действие.
Изобретение предназначено для использования в химико-фармацевтической промышленности и в медицине и касается биологически активной субстанции - белково-полипептидно-нуклеотидного комплекса, получаемого из эмбриональной ткани мозга копытных сельскохозяйственных животных, обладающей антигипоксическим, сосудистым и нейропротективным действием, стимулирующим физиологическую и репаративную регенерацию нервной ткани, для применения в производстве лекарственных препаратов при заболеваниях центральной и периферической нервной системы, гипоксических состояниях, в медицине катастроф, спортивной медицине, способу ее получения и фармкомпозицию на его основе.
Источники информации
1. Патент РФ №2128511 С1.
2. Патент РФ №2129427 С1.
3. Патент РФ №2132688 С1.
4. Заявка Франции №2413912
5. Патент РФ №2132688, МПК А61К 35/48.
6. Евразийский патент №004788 В1.
7. Евразийский патент №003301 В1.
8. Патент РФ N 1298979, кл. А61К 35/50, 1993 г.
9. Патент РФ №2237486 С1.
10. Патент UA 15241, МПК 6 А61К 35/50, Бюл. №4, 2000 г.
11. Международная заявка WO 2009/088314 А1, 2007 г.
12. «Деринат» компании «Техномедсервис» ЗАО ФП (Россия). (Информация опубликована Справочник «ВИДАЛЬ» Москва, «АстраФармСервис» 2010 г., Б-506).
13. «Церебролизин» фирмы «Ebewe» (Австрия) (информация опубликована в Справочнике ВИДАЛЬ-2007, за 2007 год, стр.В-1195).
14. «Цереброкурин» фирмы ООО «НИР» (Украина) заявка 97119997/14, патент (19) RU (11) 2128511.
15. «Кортексин» фирмы ООО «Герофарм» (Россия), патент (19) RU (11)2104702.
16. «Церебролизат» фирмы «Микроген» НПО ФГУП (Иммунопрепарат) (Россия), Патент N 010068.
17. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под общей редакцией чл.-кор. РАМН, проф. Р.У.Хабриева. - 2 изд., перераб. и доп. - М., ОАО Издательство «Медицина» - 2005, с.131-170. Патент РФ №2128511 (1999).
18. Программа по уходу и содержанию лабораторных животных НПП «Питомник лабораторных животных» ФИБХ РАН от ноября 2005 г.
19. Методические указания по оценке мутагенных свойств фармакологических веществ // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под общей редакцией чл.-кор. РАМН, проф. Р.У.Хабриева.- 2 изд., перераб. И доп. - М, ОАО Издательство «Медицина» - 2005., с.100-122.
20. Методические рекомендации «Оценка микроядерным методом мутагенной активности факторов окружающей среды в клетках разных органов млекопитающих» (М., 2001).
21. И.В.Силкина, Т.С.Ганьшина, С.Б.Серединин, Р.С.Мирзоян, Усилиние кровоснабжения ишемизированного мозга под влиянием афобазола, Ж. Эксперимен. и клин. Фармакология, 2004, т.67, №5, с.9-13.
22. Smith M.L, Bendek G., Dahlgen N. at all, Models for studing, long-term recovery following forebrain ischemia in the rat. A 2-vessell occlusion model // Neurol.Scan., 1984, v.69, p.385-400.
23. Ф Y.Wang-Fisher. Manual of Stroke Models in rats. CRC press, 2008, p.3-4.
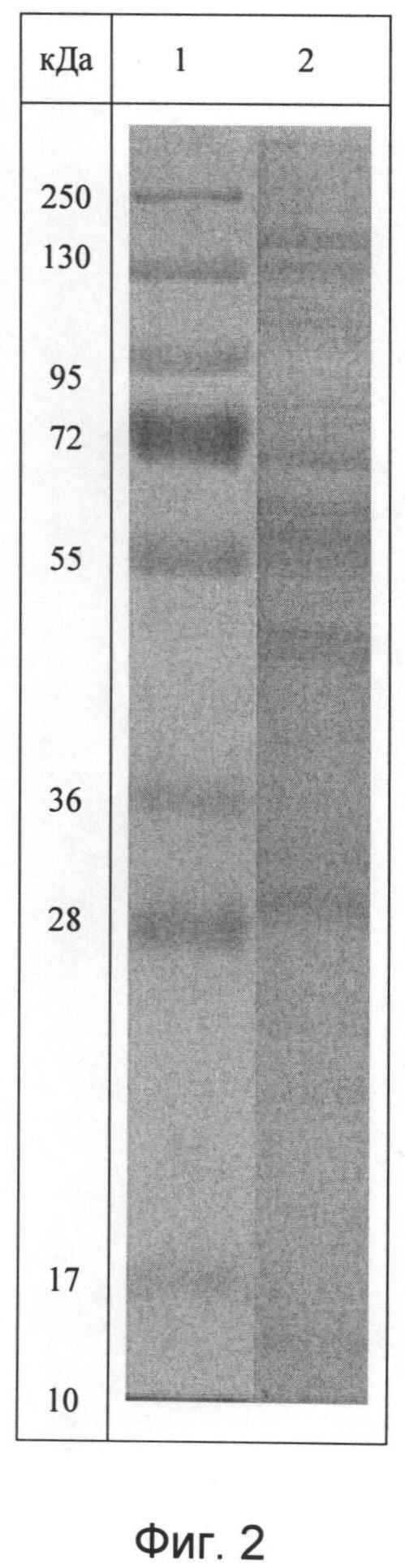
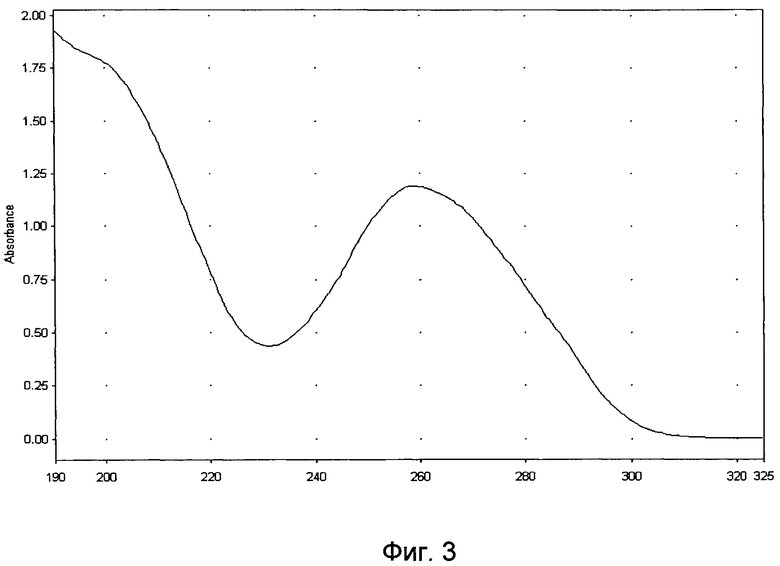
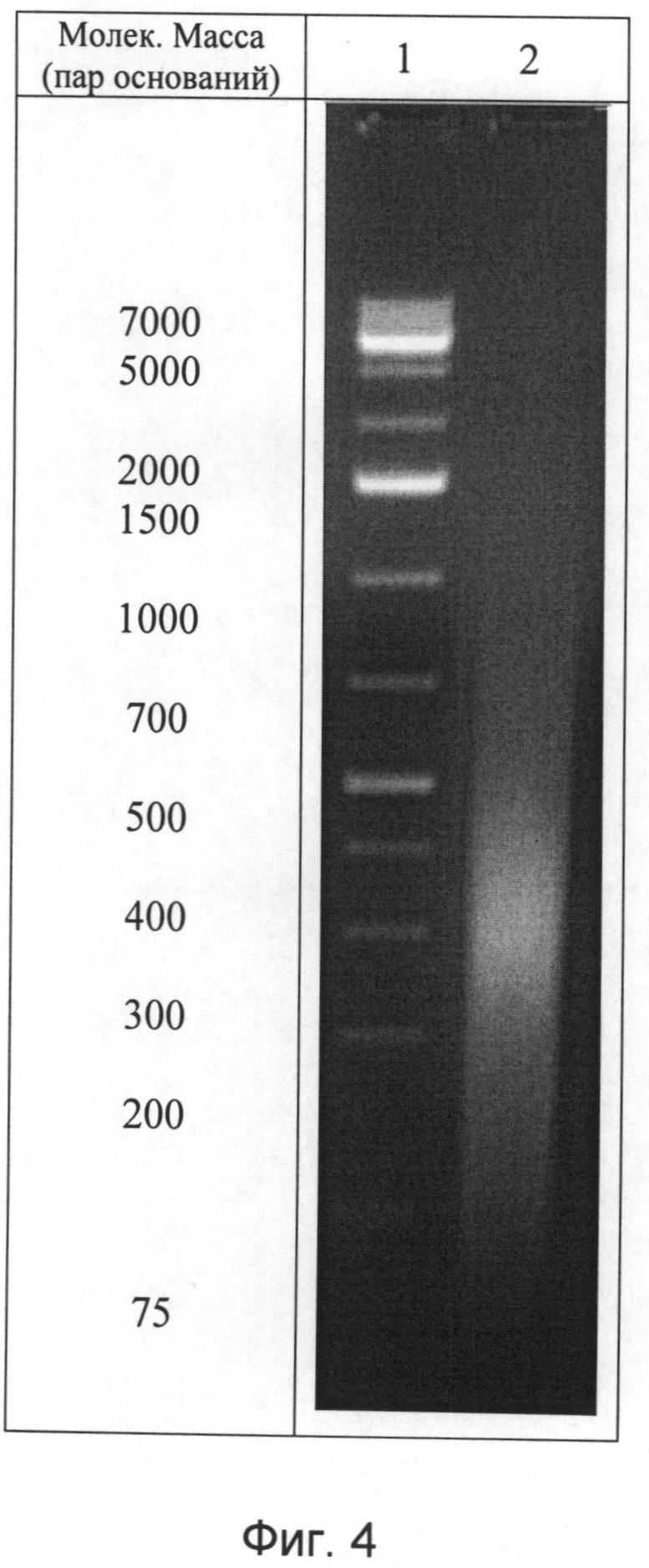
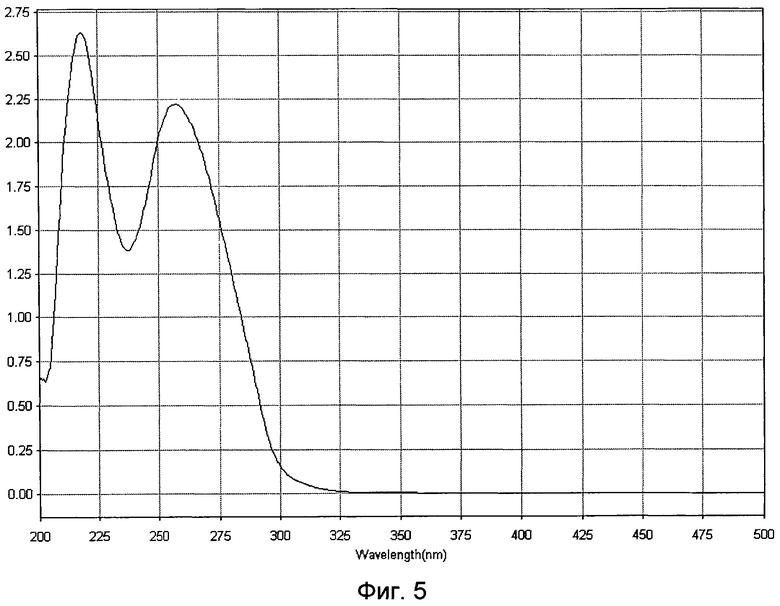
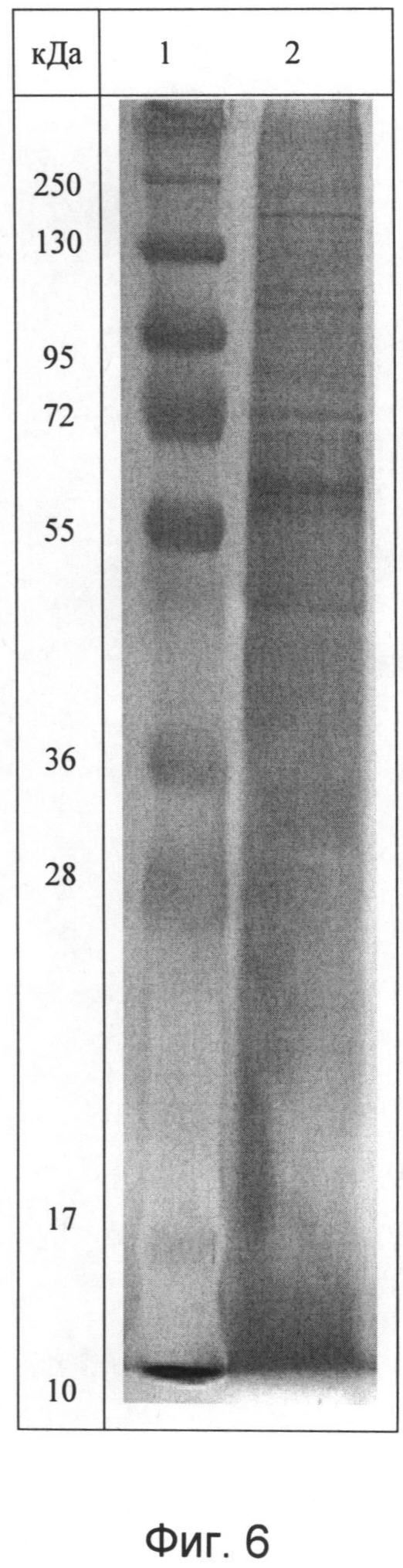
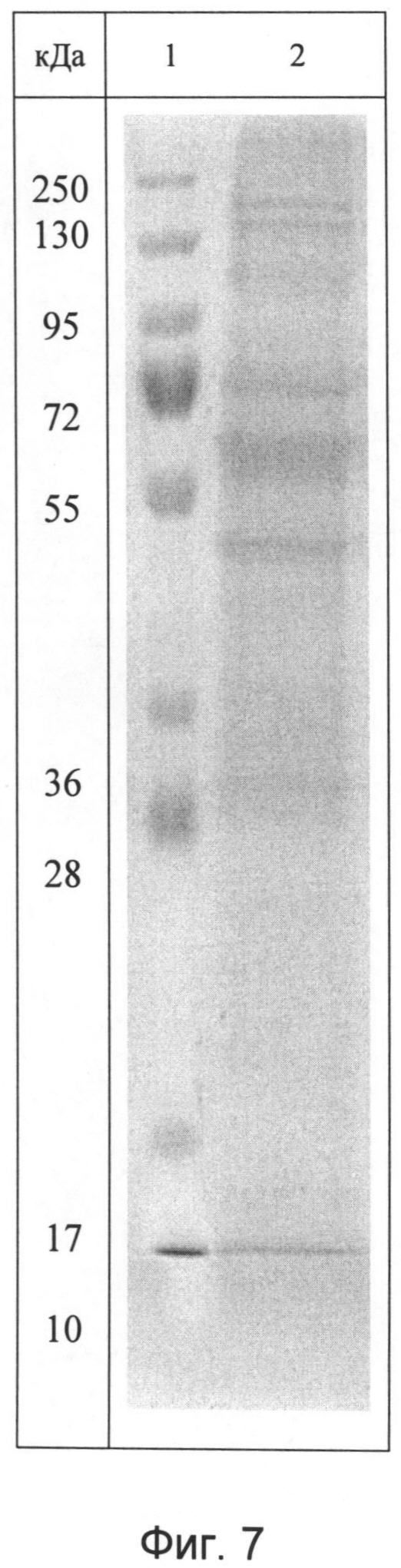

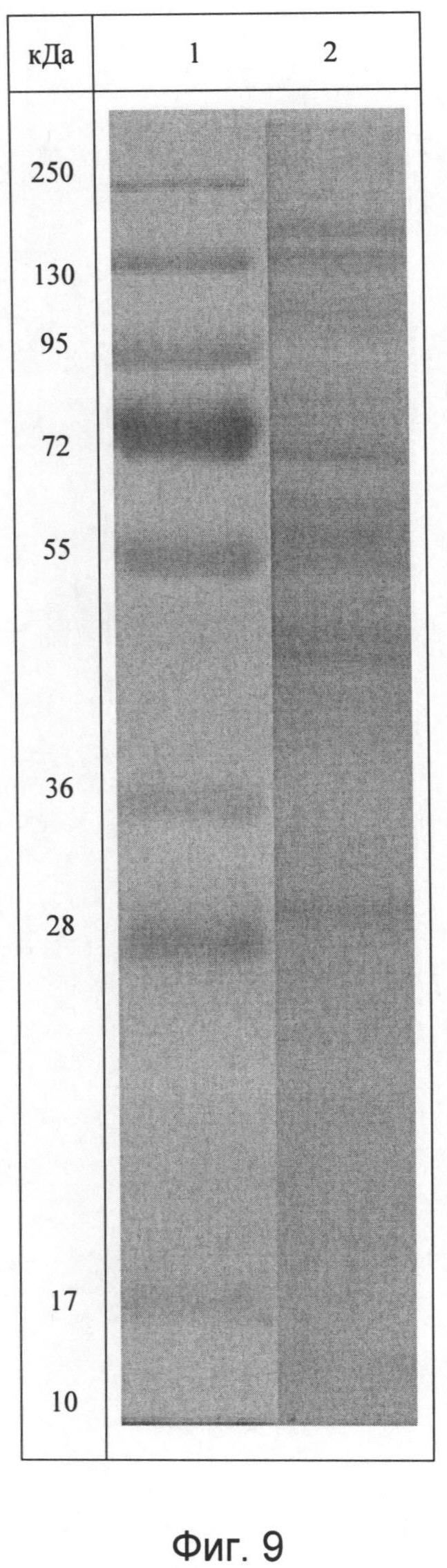
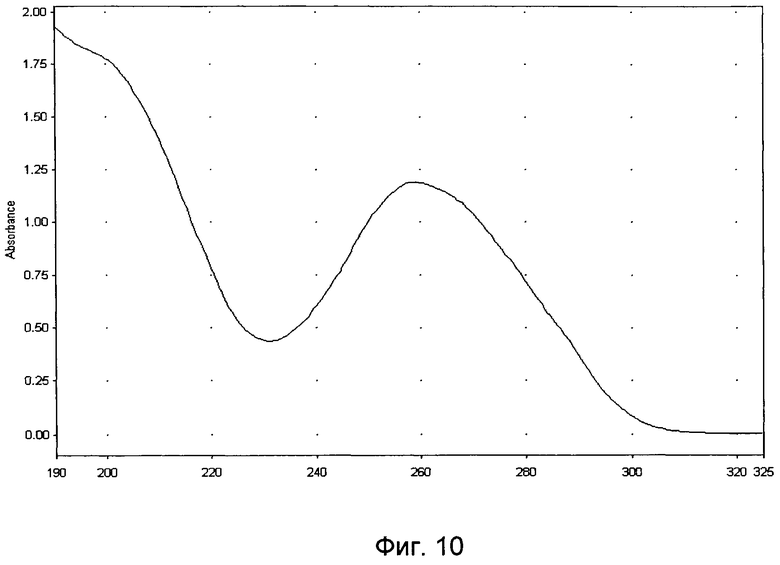
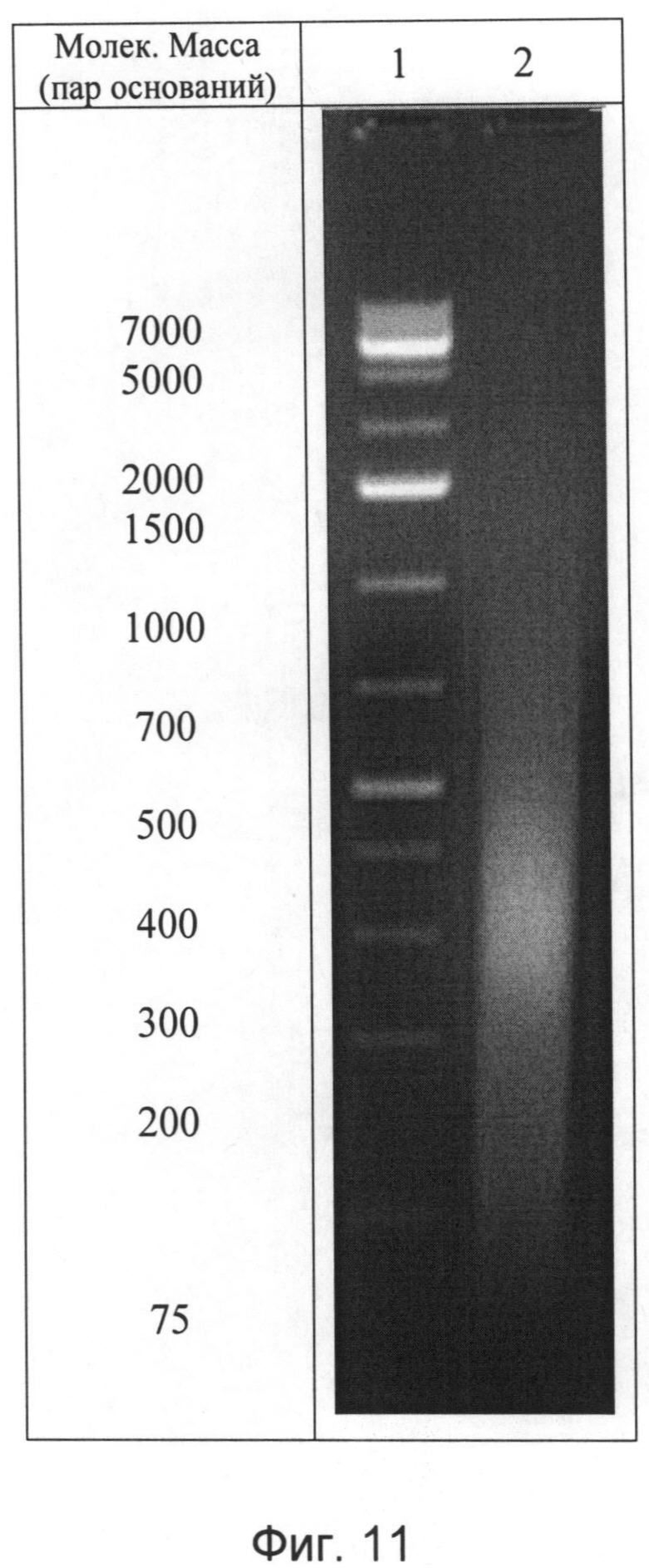
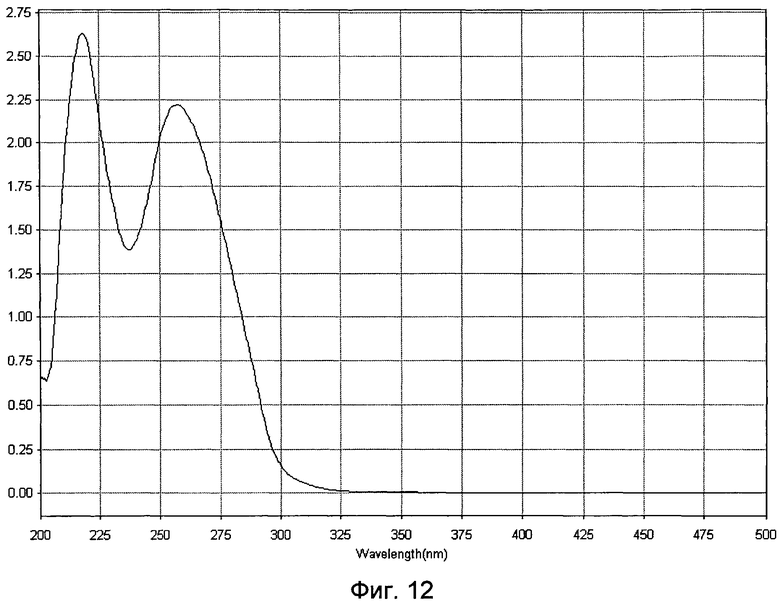

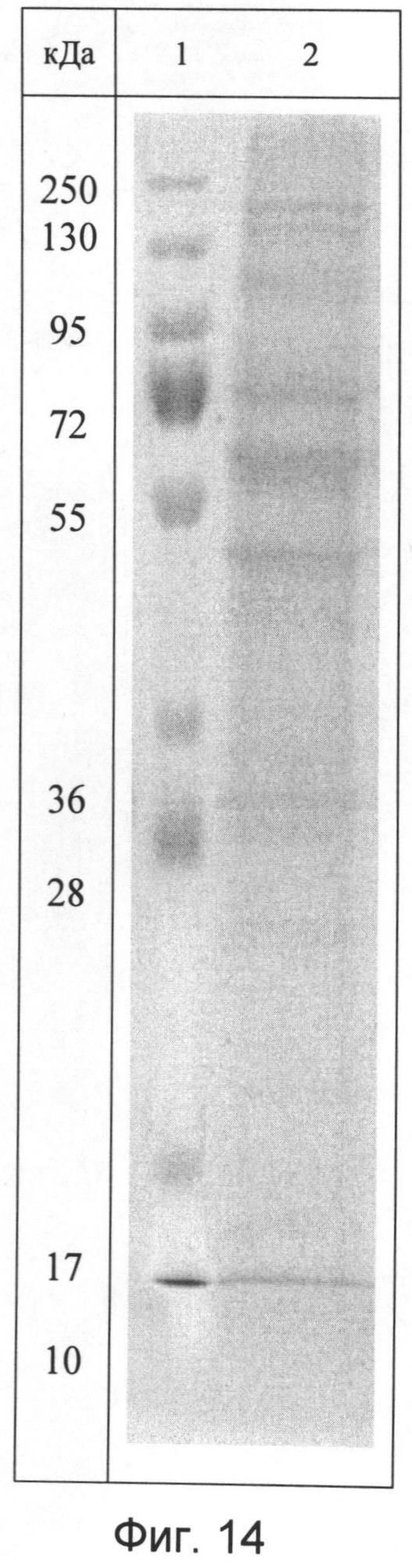
Группа изобретений относится к биотехнологии. Описан белково-полипептидный комплекс (БПК), обладающий антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервную систему, получаемый из экстрагированного гомогената нервной ткани эмбрионов копытных сельскохозяйственных животных сроком гестации от середины первой до середины последней трети беременности, способ его получения и фармкомпозиция на его основе. БПК включает тканеспецифические отрицательно заряженные слабокислые, нейтральные белки и полипептиды с молекулярными массами от 0,5 до 200 кДа, причем не менее 70% от общей массы белка имеет молекулярную массу в диапазоне от 20 до 160 кДа. БПК используют в качестве активного действующего компонента в фармацевтических композициях, предназначенных для получения лечебных средств. Изобретения позволяют получать препараты, обладающие высокой биологической активностью и предназначенные для лечения заболеваний центральной и периферической нервной системы, гипоксических состояний, а также используемые в спортивной медицине, медицине катастроф. 3 н. и 2 з.п. ф-лы, 14 ил., 1 табл., 13 пр.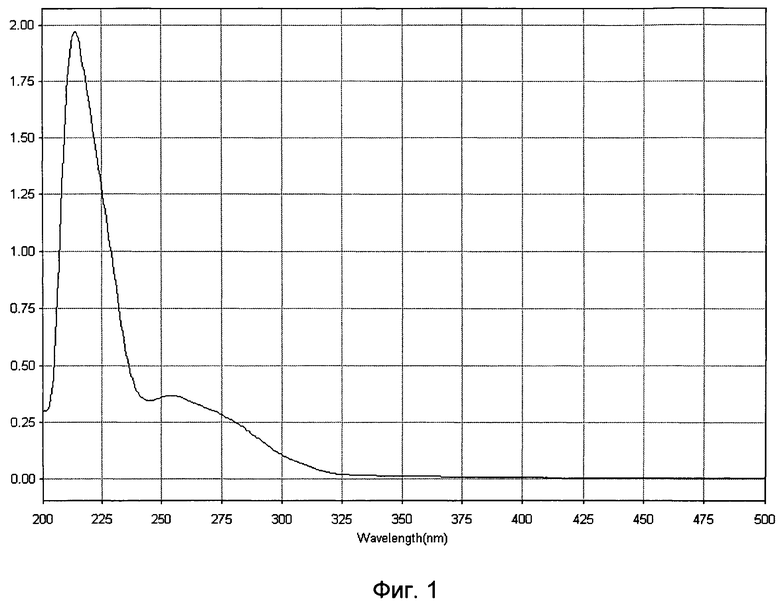
1. Способ получения белково-полипептидного комплекса (БПК), обладающего антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервные системы, заключающийся в том, что нервную ткань эмбрионов копытных сельскохозяйственных животных сроком гестации от середины первой трети до середины последней трети беременности поэтапно:
- гомогенизируют в буферном растворе с одновременной экстракцией в присутствии ингибиторов протеолиза, неионных детергентов и солюбилизаторов при рН не менее 5,2 и не выше 8,5 с последующим отделением балластного тканевого материала фильтрованием, центрифугированием при значении g 10000-28000 в течение, соответственно, 90-30 мин;
объединяют балластный тканевый материал и фугат после центрифугирования для выделения полинуклеотидных фракций;
- полученный супернатант фильтруют;
- фильтрат подвергают анионообменной хроматографии на колонке с анионообменным носителем и разделяют связавшиеся с носителем белки и полипептиды, используя в качестве подвижной фазы буферный раствор, первоначально имеющий ионную силу (I) не выше 0,1 ммоль/л, повышая ее плавно или ступенчато с шагом 0,025 ммоль/л и начиная сбор целевых фракций с ионной силой элюента от 0,125 до 0,15 ммоль/л при рН от 5,2 до 8,5;
- полученные фракции объединяют и подвергают стерилизующей фильтрации.
2. Белково-полипептидный комплекс (БПК), полученный способом по п.1, обладающий антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервные системы, получаемый из эмбриональной нервной ткани сельскохозяйственных копытных животных сроком гестации от середины первой до середины последней трети беременности, включающий тканеспецифические отрицательно заряженные слабо кислые, нейтральные белки и полипептиды, относящиеся к факторам роста, дифференцировки, сигнальным молекулам, определяющим его биологическую и фармакологическую активность, с молекулярными массами от 0,5 до 200 кДа, причем не менее 70% от общей массы белка имеет молекулярную массу от 20 до 160 кДа, имеющих характерный специфический набор полос при денатурирующем гель-электрофорезе («SDS-Page») в 5%-ном полиакриламидном геле по сравнению со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 до 250 кДа, значением изоэлектрической точки от 4,2 до 8,4 и максимумом поглощения при длине волны (215±5) нм при снятии ультрафиолетового спектра в области длин волн от 200 до 500 нм.
3. Фармацевтическая композиция, обладающая антигипоксическим, иммуномодулирующим, тканеспецифическим репаративным действием на нервную ткань, выполненная в виде раствора, содержащего в качестве активного ингредиента биологически активный белково-полипептидный комплекс по п.2 в концентрации 0,05-2,0 мг/мл, полученный способом по п.1, и средне- и низкомолекулярную полинуклеотидную фракцию в виде натриевой соли дезоксирибонуклеиновой кислоты, проявляющие комплексную с белково-полипептидной фракцией специфическую иммунорегулирующую активность в, по меньшей мере, равноценной концентрации с белково-полипептидным комплексом, и фармацевтически приемлемый разбавитель, причем средне- и низкомолекулярная полинуклеотидные фракции в виде натриевой соли дезоксирибонуклеиновой кислоты характеризуются молекулярной массой от 12 до 660 кДа (18-1000 пар оснований), имеющие максимальный УФ-спектр поглощения при длине волны (260±2) нм и минимальный - при (230±2) нм в области длин волн от 190 до 325 нм с отношением D260/280 от 1,6 до 2,0, наличием характерных специфических полос при электрофорезе в 1,8%-ном агарозном геле при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном молекулярных масс от 75 до 7000 пар оснований и синее окрашивание при постановке качественной реакции на рибозу, а также примесью белка, при определении его концентрации по Лоури не выше 0,18%.
4. Фармацевтическая композиция по п.3, отличающаяся тем, что в качестве фармацевтически приемлемого разбавителя содержит фармакопейный буферный раствор и, возможно, вспомогательные вещества, включающие высокомолекулярные соединения, стабилизаторы, консерванты и солюбилизаторы.
5. Фармацевтическая композиция по п.3, отличающаяся тем, что она предназначена для применения парентерально - внутрикожно или подкожно, интраназально или аппликационно на слизистые оболочки и кожу.
| WO 2009088314 A1, 16.07.2009 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЛЕЧЕБНОГО СРЕДСТВА ПРИ ЗАБОЛЕВАНИЯХ, СОПРОВОЖДАЮЩИХСЯ НАРУШЕНИЕМ ФУНКЦИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 1997 |
|
RU2128511C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗ ЖИВОТНОГО СЫРЬЯ КОМПЛЕКСА БИОЛОГИЧЕСКИ АКТИВНЫХ ПОЛИПЕПТИДОВ, НОРМАЛИЗУЮЩИХ ФУНКЦИИ ГОЛОВНОГО МОЗГА, ФАРМАКОЛОГИЧЕСКАЯ КОМПОЗИЦИЯ И ЕЕ ПРИМЕНЕНИЕ | 1996 |
|
RU2104702C1 |
| ШАБАНОВ П.Д | |||
| Фармакология лекарственных препаратов пептидной структуры | |||
| // Психофармакология биол | |||
| наркол | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2013-06-20—Публикация
2011-05-30—Подача