Изобретение относится к химико-фармацевтической промышленности и касается выделения биологически активных веществ из органов животных. Выделенный целевой продукт может использоваться в медицине как фармакологическое средство, способное нормализовывать функции головного мозга у субъекта, нуждающегося в этом (млекопитающее, например человек, домашние животные и скот, имеющие одно или более клиническое проявление нарушения функции головного мозга).
Известен способ получения препарата [1], обладающего восстанавливающей активностью при нарушении функции головного мозга, который позволяет выделить из коры головного мозга убойных животных биологически активные полипептиды щелочной природы.
Этот препарат получают путем обработки исходного сырья (ткань, содержащая серое вещество полушарий головного мозга) ацетоном при температуре от -10 до -4oC и соотношении ткани мозга и ацетона 1:5 в течение 18-30 ч, гомогенизации, экстрагирования гомогената 2-4%-ным раствором уксусной кислоты в течение 48-72 ч при pH=3,5-4,5 в присутствии хлористого цинка в концентрации 0,6-1,2 г/л и при соотношении гомогената и раствора уксусной кислоты 1: (8-4), центрифугирования, осаждения биологически активных веществ ацетоном при температуре от -3 до -5oC и соотношении супернатанта и ацетона 1:(7-5) и ионообменной хроматографии полученного осадка на катионите "Биокарб". В результате ионообменной хроматографии получают фракцию, содержащую щелочные полипептиды, которые обладают стимулирующим (или восстанавливающим при снижении активности мозга) действием на клетки коры головного мозга.
Однако описанный известный способ не позволяет извлечь из коры головного мозга кислые и нейтральные полипептиды и получить биологически активные вещества, обладающие другим действием (например, противосудорожной активностью).
Известно вещество [2], обладающее активностью предупреждать и улучшать расстройство функции головного мозга. Однако указанное вещество получают из альбумина, а не из ткани головного мозга, поэтому оно не содержит природных регуляторов нервных клеток и, следовательно, обладают узким спектром биологической активности, а именно нормализует функции головного мозга, нарушенные недостатком кислорода в крови.
Известно применение в терапии церебрального эндогенного фактора [3], который может быть получен экстракцией коры головного мозга с фильтрацией на фракции геля 10000-100 дальтон, хроматографической очисткой, представляющего собой пептид мол. м. 3500 дальтон с рК 5, что обуславливает его узкую биологическую активность, а именно серотонинергическую.
Задача, на решение которой направлено заявляемое изобретение, состоит в расширении видов и повышении биологической активности целевого продукта, полученного путем выделения из коры больших полушарий головного мозга животных комплекса, содержащего, помимо щелочных, биологически активные кислые и нейтральные полипептиды, а также в создании фармакологического средства, содержащего в качестве активного начала целевой продукт, полученный заявляемым способом, и оказывающего нормализующее действие на функции головного мозга субъекта, нуждающегося в этом.
Сущность заявляемого способа получения препарата состоит в том, что кору больших полушарий головного мозга убойных животных замораживают при t=- 40oC с последующим хранением при t от -20 до -22oC. Сырье подвергают гомогенизации, экстракции гомогената раствором уксусной кислоты при t = 10-15oC в течение 30-48 ч 2-4%-ным раствором уксусной кислоты при pH=3,2-3,8 в присутствии хлористого цинка в концентрации 0,6- 1,2 г/л при соотношении гомогената и раствора уксусной кислоты 1:(8-4). Для отделения нерастворимых компонентов проводят фильтрацию.
После фильтрации жидкую фазу обрабатывают ацетоном при t = от -3 до -5oC и при соотношении экстракта и ацетона 1:(7-5). При этом образуется осадок в виде белых хлопьев. Полученный осадок промывают ацетоном и высушивают под воздушной тягой.
Полученный после осаждения и высушивания порошок дополнительно экстрагируют водой при pH= 5,5-6,5 в течение часа при t = 18-22oC. Нерастворимые компоненты удаляют из экстракта путем центрифугирования. Полученный раствор препарата подвергают мембранной ультрафильтрации и лиофилизируют фильтрат.
Следует отметить, что в заявляемый способ в отличие от известного введены такие приемы выделения целевого продукта, как замораживание сырья, очистка экстракта с помощью фильтрации, дополнительная водная экстракция субстрата, которые в совокупности с изложенными выше приемами позволяют извлечь, помимо щелочных, биологически активные кислые и нейтральные полипептиды. Введение мембранной ультрафильтрции для удаления высокомолекулярных веществ с мол. м. более 15000 дальтон дает возможность провести очистку целевого продукта от балластных компонентов.
Целевой продукт представляет собой лиофилизированный порошок белого или белого с желтоватым оттенком цвета и содержит комплекс биологически активных полипептидов. При добавлении растворителя препарат умеренно растворим в воде, 0,9%-ном растворе NaCl, 0,25-0,5%-ном растворе новокаина. Раствор препарата прозрачен. Цвет раствора не превышает эталон 56 (ГФХ1, с. 194-197).
Отсутствие в препарате высокомолекулярных белковых компонентов подтверждает то, что при добавлении к 1%-ному раствору препарата 10%-ного раствора трихлоруксусной кислоты раствор препарата остается прозрачным.
Для более подробной характеристики препарата, полученного по заявляемому способу, проведено изучение его состава, основных физико-химических свойств, токсичности и специфической биологической активности.
Для определения в препарате пептидных связей к его раствору добавляют биуретовый реактив. Окрашивание раствора в фиолетовый цвет свидетельствует об имеющихся в препарате пептидных связях.
С целью определения в препарате полипептидов и их фракций использовали методы ультрафиолетовой спектрофотометрии, гель-хроматографии, изоэлектрического фокусирования и их модификации.
Ультрафиолетовый спектр раствора препарата в вводе снимали в области длин волн от 250 до 350 нм с максимумом поглощения при 270±5 нм.
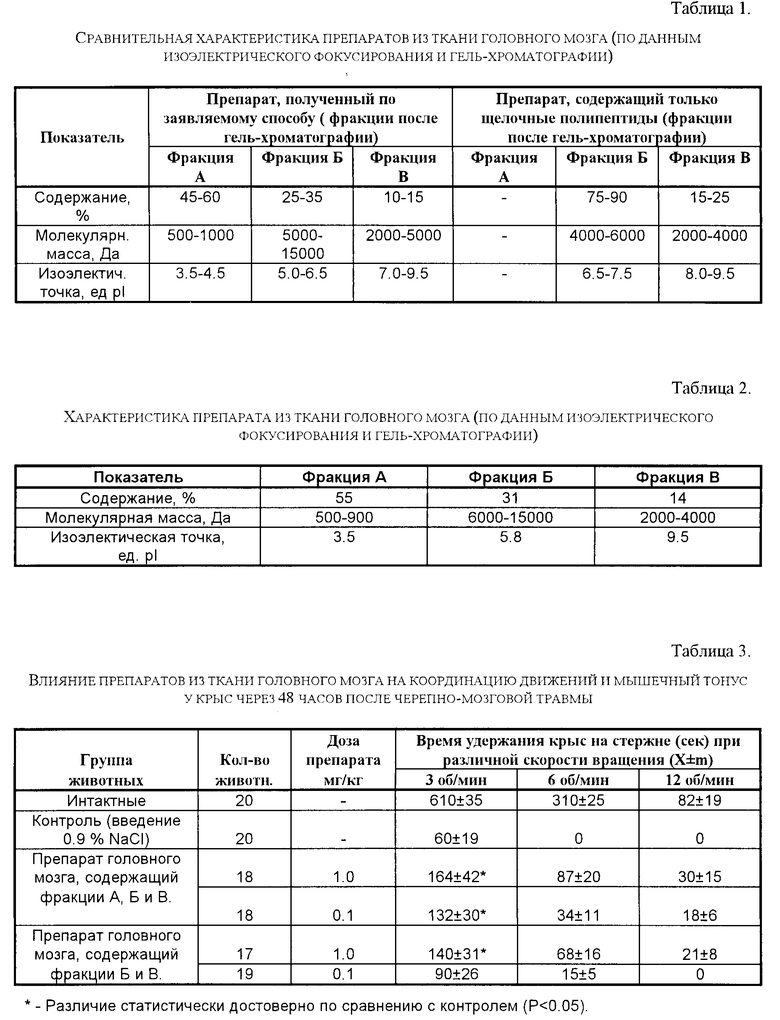
Методом изоэлектрического фокусирования показано, что в состав препарата, полученного заявляемым способом, входят полипептиды с изоэлектрической точкой pI 3,5-9,5, что существенно отличает его от препарата, получаемого известным способом и содержащим только щелочные полипептиды с pI 6,5-9,5.
Методом гель-хроматографии установлено, что препарат, полученный по заявляемому способу, может быть разделен на 3 фракции (А, Б и В), содержащие полипептиды с мол. м. от 500 до 15000 дальтон. В тех же условиях препарат, полученный известным способом и содержащий только щелочные полипептиды, может быть разделен на 2 фракции (Б и В) с мол. м. компонентов от 2000 до 6000 дальтон. В табл. 1 приведена сравнительная характеристика препаратов, полученных заявляемым способом и известным, по данным изоэлектрического фокусирования и гель-хроматографии.
Таким образом, по результатам изучения состава и основных физико-химических свойств установлено, что препарат, полученный по заявляемому способу, содержит в своем составе преимущественно (от 70 до 95%) кислые и нейтральные полипептиды с мол. м. от 500 до 15000 дальтон и pI 3,5-6,5, в то время как препарат, полученный известным способом [1], содержит в своем составе преимущественно щелочные полипептиды с мол. м. от 2000 до 6000 дальтон и рI 6,5-9,5.
Согласно изобретению фармакологическое средство для нормализации функций головного мозга содержит в качестве активного начала эффективное количество целевого продукта, полученного указанным способом и представляющего собой комплекс биологически активных полипептидов с мол. м. от 500 до 15000 дальтон и фармацевтически приемлемый компонент. При этом в качестве фармацевтически приемлемого компонента предлагается использовать, например, 0,9%-ный раствор NaCl.
Во время проведения сравнительных исследований in vivo на экспериментальных моделях были обнаружены новые терапевтические эффекты препарата, полученного заявляемым способом, такие как способность купировать судорожный синдром, восстанавливать нарушенную рефлекторную деятельность мозга, память и координацию движений.
Согласно изобретению способ нормализации функций головного мозга заключается в купировании судорожного синдрома, восстановлении нарушенной рефлекторной деятельности мозга, памяти и координации движений посредством введения субъекту, нуждающемуся в этом, терапевтически эффективного количества фармакологического средства, включающего в себя в качестве активного начала целевой продукт, полученный указанным способом и представляющий собой комплекс биологически активных полипептидов с мол. м. от 500 до 15000 дальтон и фармацевтически приемлемый носитель. Фармакологическое средство целесообразно применять в дозах от 0,1 до 1,0 мг на 1 кг массы тела в течение 10-40 дней в зависимости от характера течения и тяжести заболевания.
Изобретение иллюстрируется примерами конкретного выполнения способа получения из животного сырья комплекса биологически активных полипептидов (пример 1) и испытания биологической активности продукта, полученного заявляемым способом (примеры 2, 3), примерами результатов клинического изучения препарата, демонстрирующими его фармакологические свойства и подтверждающими возможность достижения лечебного эффекта (примеры 4,5), а также табл. 1-5.
Пример 1. Исходное количество головного мозга 1 кг. Ткань мозга очищают от сгустков крови, жировой клетчатки, промывают водой и замораживают при t = -40oC и хранят при t=-22oC. Сырье подвергают гомогенизации и проводят экстракцию 3%-ным раствором уксусной кислоты (pH=3,6),содержащей хлористый цинк в концентрации 1,2 г/л, при t=15oC в течение 48 ч, при массовом соотношении измельченной массы и раствора уксусной кислоты 1:6. Экстракт охлаждают до t= 5oC и отделяют осадок. Фильтрат обрабатывают ацетоном при t= -5oC и массовом соотношении супернатанта и ацетона 1:5. Полученный осадок промывают ацетоном при t=0oC и массовом соотношении 1:3, затем сушат при t=35oC в течение 4 ч. После чего порошок растворяют в 100 мл дистиллированной воды (pH=6,5) в течение 1 ч при t = 22oC, отделяют осадок. Фильтрат очищают от высокомолекулярных белков с молекулярной массой более 15000 Да методом ультрафильтрации на мембранах. В очищенный раствор объемом 40 мл добавляют наполнитель NaCl в количестве 360 мг. Стерилизуют и лиофилизируют фильтрат.
Целевой продукт представляет собой порошок (в количестве 760-800 мг) белого или белого с желтоватым оттенком цвета. Цвет 1%-ного раствора препарата не превышает эталон 56 (ГФХ1).
Тестирование на отсутствие высокомолекулярных белковых компонентов осуществляют путем добавления к 1%ному раствору препарата 10%-ного раствора трихлоруксусной кислоты. Прозрачность раствора свидетельствует об отсутствии высокомолекулярных белковых компонентов.
Для определения в препарате пептидных связей к 1 мл 1%-ного раствора препарата добавляют биуретовый реактив в количестве 4 мл. Окрашивание раствора в фиолетовый цвет свидетельствует об имеющихся в препарате полипептидных связях. Для приготовления биуретового реактива 0,75 г меди сульфата и 3,0 л натрия (калия) виннокислого растворяют в 250 мл. воды. К полученному раствору добавляют 150 мл 10%-ного раствора NaOH и 1 г калия иодида. Затем объем раствора доводят водой до 1000 мл.
Идентификацию препарата проводят с помощью ультрафиолетовой спектрофотометрии. Содержимое 5 флаконов (в одном флаконе вместимостью 5 мл содержится 10 мг биологически активного вещества) растворяют в мерной колбе вместимостью 100 мл и доводят объем раствора до водной метки. На спектрофотометре снимают УФ-спектр раствора препарата в воде, который дает максимум поглощения при 273 нм.
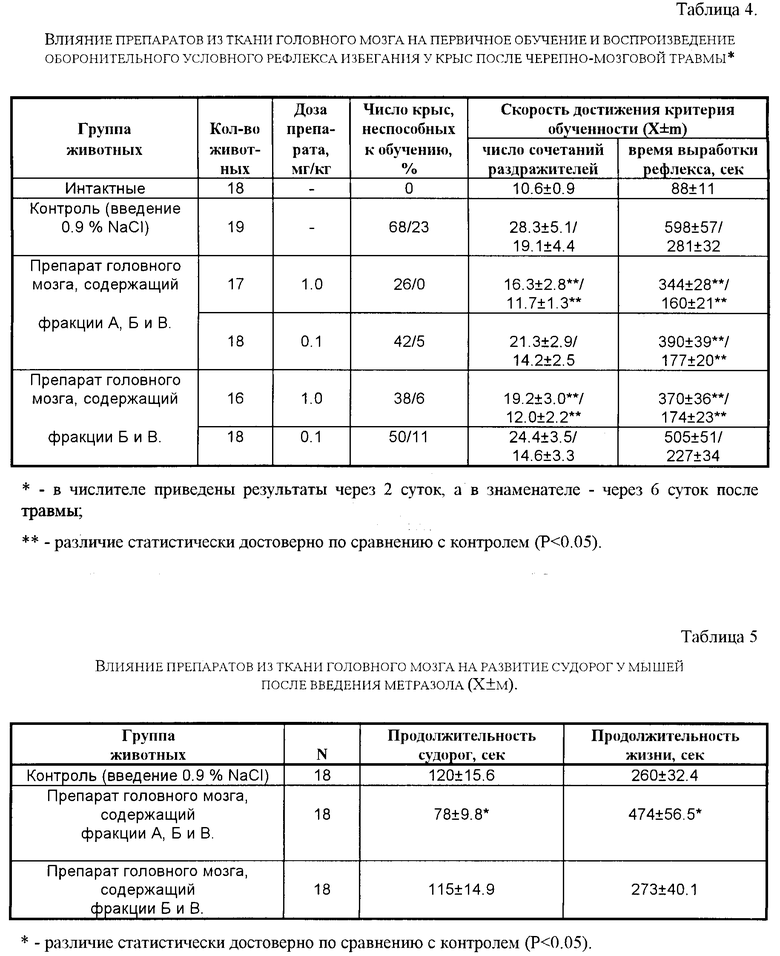
Для характеристики компонентов препарата, полученного заявляемым способом, по заряду и изоэлектрическим точкам (рI) проводят исследование методом изоэлектрического фокусирования. Для этого препарат растворяют в 8 М мочевине, содержащей 3% NP-40 и 10% бета-меркаптоэтанола и наносят в концентрации 50 мг/мл на пластину Ampholine PAG plate с диапазоном pH 3,5-9,5. Фракционирование препарата проводят на приборе "Multiphor" (LKB, Швеция) в течение 12 ч при напряжении 200 В и t=3oC. Далее гель окрашивают кумасси ярко-синим R-250 и денситометрируют при длине волны 600 нм. Исследование методом изоэлектрического фокусирования показывает, что в состав препарата, полученного заявляемым способом, входят полипептиды с pI от 3,5 до 9,5.
Молекулярную массу полипептидов, входящих в препарат, определяют методом гель-хроматографии на сефадексах G-25 и G-50 ("Pharmacia", Швеция). Для калибровки колонки 1,6 60 см используют Peptide Molecuar Weight Kit MS III ("Serva", Германия). Установлено, что препарат, полученный заявляемым способом, методом гель-хроматографии может быть разделен на 3 фракции, содержащие полипептиды с мол. м. от 500 до 15000 дальтон. Результаты изучения состава, физико-химических свойств препарата приведены в табл. 2.
Изучение возможного токсического влияния на организм препарата, полученного заявляемым способом, проводилось в соответствии с "Требованиями к доклиническому изучению обще- токсического действия новых фармакологических веществ", 1984 г (изданы Управлением по внедрению новых лекарственных препаратов и медицинской техники МЗ СССР).
Цель изучения состояла в определении переносимых токсических доз препарата, оценке степени и характера патологических изменений в различных органах и системах организма и выявлении зависимости токсических эффектов от дозы и длительности применения препарата.
Изучение "острой" токсичности препарата, полученного заявляемым способом, было проведено при однократном введении его животным по методу Кербера. Исследование выполнено на 96 мышах-самцах массой 20-22 г. Животные были разделены на 8 групп по 12 мышей в каждой. Препарат растворяли в стерильном 0,9%-ном растворе NaCl и вводили внутримышечно в дозах 700-1500 мг/кг. Наблюдение за животными вели в течение 14 суток. ЛД50 рассчитывали с помощью графика зависимости гибели животных от вводимой дозы препарата.
В результате проведенного исследования установлено, что ЛД50 для белых беспородных мышей при однократном введении препарата составляет 992±27,2 мг/кг. Необходимо отметить, что ДЛ50 препарата для мышей превышает предполагаемую однократную терапевтическую дозу (0,01-0,1 мг/кг) в среднем в 10000 раз.
"Хроническую" токсичность препарата, полученного заявляемым способом, изучали при повторном и длительном введении его крысам и кроликам. Животным ежедневно вводили внутримышечно препарат в дозе 1,0 мг/кг в течение 6 мес. Оценивали общее состояние животного, состав и свойства периферической крови, функции сердечно-сосудистой системы, печени, поджелудочной железы, почек и надпочечников. Часть животных подвергали патоморфологическому исследованию с целью оценки состояния различных отделов головного и спинного мозга, сердца, аорты, легких, печени, почек, органов эндокринной и иммунной систем.
При изучении "хронической" токсичности препарата, полученного заявляемым способом в дозе, которая в 10-100 раз превышала предполагаемую терапевтическую дозу, было установлено, что общее состояние животных, двигательная активность, а также основные функции изученных органов и систем находились в пределах физиологической нормы.
При патоморфологическом исследовании различных органов животных также не было обнаружено патологических изменений. Следовательно, препарат, полученный заявляемым способом, при длительном введении животным не обладает токсическими свойствами, препятствующими дальнейшему его применению в качестве лекарственного средства.
Для изучения биологической активности препарата, полученного заявляемым способом и известным, использовали экспериментальные модели, позволяющие оценить способность биологически активных веществ восстанавливать нарушенные функции головного мозга после черепно-мозговой травмы (пример 2) и нормализовывать его функции, в частности оказывать противосудорожное действие путем модуляции медиаторных систем нервных клеток (пример 3).
Пример 2. В первой модели у белых крыс вызывали тяжелую компрессионную черепно-мозговую травму с помощью падающего с определенной высоты на теменную область мозга свинцового груза. Для дальнейшей работы отбирали животных с симптомо-комплексом тяжелой черепно-мозговой травмы, который характеризовался судорогами длительностью 20-30 с и более, отсутствием корнеального рефлекса в течение 2-5 мин, нарушением ритма дыхания (типа Чейн-Стокса), ослаблением проприоцептивной чувствительности и другими признаками данной патологии. В течение последующих 4-6 недель у крыс с черепно-мозговой травмой наблюдали астенизацию, снижение двигательной активности, мышечного тонуса, нарушение координации, способности к обучению и воспроизведению информации и т. д. Контрольная группа животных получала инъекции 0.9%-ного раствора NaCl. Препараты, полученные заявляемым способом и известным, растворяли в 0.9%-ном растворе NaCl и вводили крысам подкожно через 1, 24, 72, 96 и 120 ч после травмы в дозах 0,1 и 1,0 мг/кг. Биологическую активность препаратов оценивали в тестах плавания с нагрузкой, открытого поля, вращающегося стержня и выработки оборонительного условного рефлекса в Y-образной камере.
Результаты изучения биологической активности препаратов из головного мозга приведены в табл. 3 и 4. Установлено, что тяжелая черепно-мозговая травма приводит к резкому нарушению у животных рефлекторной деятельности мозга, восприятия и переработки информации, памяти, поведенческих реакций, способности к обучению, координации движений и других функций. Это связано с повреждением и гибелью различных популяций нейронов в коре головного мозга. Восстановление функций головного мозга после черепно-мозговой травмы происходит медленно, а остаточные явления могут сохраняться в течение всей последующей жизни.
Выявлено отчетливое положительное влияние препарата, полученного заявляемым способом, на координацию движений и мышечный тонус животных через 48 ч после травмы. Время удержания крыс на стержне при скорости его вращения 3 об/мин достоверно превышало контрольные показатели, что наглядно представлено в табл. 3. Животные контрольной группы практически не могли удержаться на стержне при скорости его вращения 6 и 12 об/мин. В то же время крысы, которым вводили препараты, могли некоторое время удерживаться на стержне как при скорости его вращения 6 об/мин, так и 12 об/мин. Причем в данной экспериментальной модели эффективность препарата, полученного заявляемым способом, содержащего кислые и нейтральные полипептиды, превосходила действие препарата, полученного известным способом, содержащего только щелочные полипептиды, и проявлялось в дозе 0,1 мг/кг. Препарат, полученный известным способом, в этой же дозе был практически не активен.
Таким образом, введение препарата, полученного заявляемым способом из коры головного мозга, в раннем периоде после тяжелой черепно-мозговой травмы способствует восстановлению координации движений и мышечного тонуса у животных.
Результаты оценки способности крыс к обучению и скорости выработки у них оборонительного рефлекса после тяжелой черепно-мозговой травмы приведены в табл. 4.
Установлено, что после травмы значительно снижалась способность животных к обучению. При этом среди крыс, которым вводили препараты из коры головного мозга, число животных, отказывающихся от обучения, было значительно меньше, чем в контроле. У крыс, способных к обучению, после введения препаратов было выявлено достоверное уменьшение показателей количества сочетаний раздражителей до критерия обученности и времени выработки оборонительного рефлекса. Однако у крыс, получавших препарат, полученный заявляемым способом и содержащий кислые и нейтральные полипептиды, все показатели обучаемости были лучше, чем у животных, которым вводили препарат, полученный известным способом и содержащий только щелочные полипептиды.
Таким образом, применение препарата, полученного заявляемым способом, для восстановления функций головного мозга после черепно-мозговой травмы приводит к значительному улучшению способности животных к обучению и воспроизведению рефлекторного навыка, нормализации мышечного тонуса и координации движений. Ускоренное восстановление функций и поведенческих реакций в раннем посттравматическом периоде свидетельствует о том, что препарат активизирует репаративные процессы в головном мозге, что важно для сокращения сроков реабилитации организма и восстановления функций центральной нервной системы после тяжелой черепно-мозговой травмы. Следовательно, препарат может быть применен у пострадавших с целью снижения ранней посттравматической смертности, числа возможных осложнений, а также сокращения сроков лечения.
Пример 3. Оценку противосудорожной активности препарата, полученного заявляемым способом, проводили с использованием теста метразоловых судорог, который служит классической моделью для проверки активности противосудорожных средств. Для воспроизведения экспериментальной модели мышам вводят внутрибрюшинно метразол (син. коразол) в дозе 150 мг/кг. При этом у животных возникают тонико-клонические судороги, механизм развития которых связан с возбуждающим действием метразола на двигательные центры головного мозга. Оно опосредуется различными медиаторными системами мозга, в том числе зависимыми ГАМК. Поэтому антиметразоловое действие лекарственных препаратов свидетельствует о транквилизирующих свойствах и возможном вовлечении ГАМК-зависимых механизмов передачи сигналов.
Для изучения биологической активности препаратов, полученных заявляемым способом и известным, использовали 54 беспородных белых мыши массой 20-23 г. Первой группе животных (контрольной) вводили 0,9%-ный раствор NaCl. Второй группе животных вводили внутрибрюшинно препарат, полученный заявляемым способом, в дозе 1,0 мг/кг за 1 ч до введения метразола. Третьей группе животных вводили по аналогичной схеме препарат, полученный известным способом и содержащий только щелочные полипептиды. У мышей регистрировали суммарную продолжительность судорожных периодов и выживаемость. Результаты исследования приведены в табл. 5.
Как следует из таблицы, препарат, полученный заявляемым способом, обладает выраженным противосудорожным действием, вызывает укорочение клонической фазы судорожного припадка и достоверно защищает животных от гибели. Препарат, полученный известным способом и содержащий только щелочные полипептиды, практически не обладает противосудорожной активностью.
Следовательно, нормализующее действие препарата, полученного заявляемым способом, на двигательные нервные центры связано с присутствием в этом препарате кислых и нейтральных полипептидов, отличающихся по физико-химическим и биологическим свойствам от щелочных полипептидов.
Таким образом препарат, полученный заявляемым способом, не токсичен, обладает нормализующим действием в отношении функций головного мозга.
Выявленные в результате экспериментального доклинического исследования новые свойства препарата позволяют считать показанным его применение при ряде заболеваний головного мозга.
Приведенные ниже примеры клинического применения препарата подтверждают возможность его терапевтического применения с достижением лечебного эффекта.
Пример 4. Исследование эффективности препарата при последствиях черепно-мозговой травмы (далее ЧМТ), эпилепсии, вегетососудистой дистонии, мигренозной и невротической цефалгии.
Проведено первичное открытое сравнительное испытание препарата в рамках одной клиники при последствиях ЧМТ, эпилепсии, вегетососудистой дистонии, мигренозной и невротической цефалгии. Терапию исследуемым препаратом проводили курсами внутримышечных инъекций по 10 мг ежедневно в течение 10 дней.
Обследовано 96 больных с последствиями ЧМТ разной степени выраженности, 50 больных эпилепсией и 30 детей школьного возраста с явлениями вегетососудистой дистонии и головными болями мигренозного и невротического характера.
При последствиях ЧМТ препарат нормализовывал биоэлектрическую активность головного мозга, повышал концентрацию и устойчивость внимания, улучшал память и устранял явления церебральной астении. Значительный положительный клинический эффект препарата наблюдался в 76% случаев, в то время как традиционная терапия, проводимая в группе сравнения (церебролизин, амитриптилин, конвулекс, тавегил, верошпирон, стугерон) была эффективна лишь у 40% пациентов.
При эпилепсии препарат устранял патологические типы электроэнцефалограмм, пароксизмальную активность, повышал альфа-индекс, что приводило к значительному уменьшению частоты припадков, не купируемых ранее длительными приемами финлепсина и конвулекса.
При вегетососудистой дистонии, мигренозной и невротической цефалгии после курса лечения препаратом у пациентов наблюдалось уменьшение головных болей, улучшение эмоционального фона, памяти и внимания, устранялась судорожная готовность мозга.
Препарат не вызывал побочных эффектов, осложнений и лекарственной зависимости.
Исследование эффективности препарата при паралитических синдромах (детский церебральный паралич).
Проведено клиническое исследование эффективности препарата при детском церебральном параличе (ДЦП). В исследование было включено 89 детей, имеющих клиническое проявление одного из синдромов, характерных для ДЦП (диплегия, гемиплегия, тетрапарез, гиперкинетический и атонический синдромы).
Лечение препаратом проводили в виде трех последовательных курсов внутримышечных инъекций (10-100 мг/курс в зависимости от массы тела) с интервалом 1-3 мес. Наблюдались следующие клинические проявления позитивного терапевтического действия препарата: уменьшение проявлений двигательных расстройств (74% пациентов), улучшение умственного развития (65%) и купирование судорожного синдрома (41%). Клинические данные подтверждены ЭЭГ и свидетельствуют об эффективности препарата при детском церебральном параличе.
Источники информации:
1. Патент РФ N 1298979, кл. A 61 K 35/50, 1993 г.
2. Патент США N 4067963, кл. A 61 K 35/12, 1978.
3. Патент Франции N 2657784, кл. A 61 K 37/02, 1991.
Способ позволяет подучить комплекс биологически активных полипептидов, которые нормализуют функции головного мозга. Ткань головного мозга замораживают при -40oC, измельчают, экстрагируют раствором уксусной кислоты, содержащей хлористый цинк, 30-48 ч при 10-15oC обрабатывают ацетоном, после высушивания надосадка порошок растворяют в дистиллированной воде pH 5,5-6,5 при 18-22o, удаляют вещества с мол. м. более 15000 Да. Фармакологическое средство, содержащее в качестве активного начала выделенный целевой продукт в виде комплекса биологически активных полипептидов с мол. м. от 500 до 15000 Да и изоэлектрической точкой 3,5-9,5, предлагается использовать в медицинской практике для нормализации функций головного мозга. Способ нормализации функций головного мозга, проявляющийся в снятии синдрома противосудорожной активности и восстановлении нарушенной рефлекторной деятельности мозга, включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармакологического средства. 3 с. и 2 з.п. ф-лы, 5 табл.
| RU, патент 1298979, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| US, патент 4067963, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| FR, патент 2657784, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| FR, патент 2624019, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1998-02-20—Публикация
1996-10-16—Подача