Изобретение относится к медицине, а именно к клинической иммунологии и инфекционным болезням, и может быть использовано для лечения хронической часто рецидивирующей герпесвирусной инфекции.
Герпесвирусная инфекция является одной из важнейших медико-социальных проблем, что обусловлено ее широким распространением и чрезвычайно большим спектром клинических проявлений и осложнений. Герпесвирусную инфекцию вызывают вирусы простого герпеса I и II типа, а также вирус герпеса других разновидностей. По данным глобального обзора герпесвирусных исследований, инфицированность/заболеваемость герпесом из года в год нарастает. Многообразие клинических проявлений, особенности возбудителей, возможность их распространения практически всеми известными путями передачи позволили Европейскому региональному бюро ВОЗ отнести герпесвирусные инфекции в группу болезней, которые определяют будущее инфекционной патологии в текущем столетии [1, 2]. Важно отметить, что по данным современных эпидемиологических исследований регистрируется не только увеличение количества пациентов с герпетической инфекцией, но также более тяжелых форм течения заболевания с частыми обострениями [3].
В 85-90% случаев вирус находится под контролем иммунной системы. Однако у 10-15% людей при ослаблении иммунитета происходит клиническая манифестация заболевания, при этом частота рецидивов может варьировать от 1-2 до 12-20 раз в год. Как правило, герпесвирусная инфекция проявляется в виде высыпаний на слизистых оболочках тела (губы, нос, гениталии), повышения температуры тела, синдрома хронической усталости, общего депрессивного состояния. Клиническая картина длится от 5 дней до 2 недель, при этом человек находится в неработоспособном состоянии. В России ежегодно более 2,5 миллионов человек проходят курсы стационарного лечения в инфекционных, офтальмологических, неврологических, дерматологических отделениях.
Если герпес обостряется чаще 1 раза в 3 месяца, то это свидетельствует о хроническом, часто рецидивирующем характере течения заболевания, что является показанием для назначения адекватной этиопатогенетической и иммуномодулирующей терапии.
Как правило, для лечения хронической рецидивирующей герпесвирусной инфекции используют противовирусные препараты в сочетании с препаратами-индукторами интерферонов (патент RU 2373951 С1) или с препаратом рекомбинантного человеческого интерферона 2-альфа (патент RU 2391981 С2), а также с другими иммуномодуляторами, биостимуляторами, поливитаминами и препаратами местного действия. Наиболее широко применяются ацикловир, валтрекс, фамцикловир, алпизарин, рибамидил, метисазон (противовирусные препараты), а также иммуномодуляторы - ридостин, интерлок, тималин, ликопид, полиоксидоний, деринат, глутоксим, неовир, циклоферон, витамины группы В. Однако все вышеописанные препараты обладают неспецифическим действием и не способны индуцировать антиген-специфический иммунный ответ, направленный на элиминацию вируса. Клинический опыт применения ацикловира или его аналогов показывает, что противогерпетические средства могут купировать острые проявления, но не предотвращают повторного рецидивирования хронической герпетической инфекции, а в ряде случаев даже не снижают частоту рецидивов. Кроме того, отсутствуют четкие клинико-лабораторные критерии назначения и последовательности применения тех или иных комбинаций различных препаратов. При этом важно отметить, что к большинству современных противовирусных препаратов формируется резистентность, что также приводит к рецидивам заболевания и новому циклу терапии.
Известно, что ключевую роль в распознавании чужеродных (в том числе, вирусных) антигенов и презентации их эффекторным Т-клеткам играют дендритные клетки (ДК), способные инициировать антиген-специфический иммунный ответ [4]. ДК обладают уникальной способностью активировать как CD4, так и CD8 T-клетки. При этом стимулирующий эффект ДК в 10-100 раз превышает стимулирующее действие макрофагов и других антиген-презентирующих клеток в силу более высокого уровня экспрессии костимуляторных молекул, медленной внутриклеточной деградации антигена и длительной презентации антигенных пептидов на клеточной мембране. Кроме того, ДК являются единственными антиген-презентирующими клетками, которые способны активировать наивные Т-клетки [5].
Рядом исследований было показано, что хронические инфекционные заболевания вирусной природы четко ассоциируются со снижением количества и/или угнетением функциональной активности ДК, что рассматривается в качестве одного из возможных механизмов персистенции вируса в организме больного [6, 7].
Интерес к изучению ДК при вирусных заболеваниях связан не только с выяснением их патогенетической роли в хронизации/персистенции инфекции, но также с потенциальной возможностью использования ДК для разработки новых клеточных технологий лечения хронических и часто рецидивирующих вирусных инфекций [8, 9], поскольку именно ДК обладают уникальной способностью индуцировать антиген-специфический иммунный ответ.
Развитие новых подходов в создании и использовании лечебных ДК-вакцин стало возможным благодаря разработке методов генерации ДК в культуре in vitro. Согласно стандартным протоколам генерации ДК получают путем культивирования прилипающей фракции мононуклеарных клеток периферической крови (CD14+моноцитов) в присутствии гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) и интерлейкина-4 (ИЛ-4) [10]. Генерируемые таким образом незрелые дендритные клетки (ИЛ4-ДК) обладают высокой способностью к захвату антигена, но слабой стимуляторной активностью в отношении Т-клеток. Поэтому на второй стадии инициируется конечное созревание ДК. Для этого используют различные факторы: бактерии (живые или мертвые), бактериальные продукты (LPS), аналог вирусной РНК - полиинозиновая-цитидиловая кислота (поли-I:C), фрагменты двуцепочечной ДНК, провоспалительные медиаторы и их комбинации (ИЛ-1 - бетта, ФНО-альфа, ИЛ-6, простагландин-Е2, CD40-лиганд и др.). На стадии конечного созревания ДК могут быть пульсированы (нагружены) «целевым» антигеном, против которого должен быть индуцирован иммунный ответ. В качестве такого антигена могут выступать, например, лизаты опухолевых клеток или бактерий, а также иммуногенные пептиды опухолевых или вирусных антигенов (например, полученные в виде рекомбинантных продуктов). Зрелые ДК стабильно экспрессируют на своей поверхности молекулы главного комплекса гистосовместимости (МНС I и II класса) в комбинации с антигенными пептидами, а также отличаются от незрелых ДК повышенной экспрессией ко-стимуляторных (CD86) и адгезивных (CD54, CD58) молекул, способствующих более эффективному взаимодействию с Т-клетками [11].
Однако, использование для генерации дендритных клеток ГМ-КСФ в комбинации с ИЛ-4 не является наиболее оптимальным подходом, поскольку получаемые in vitro ИЛ4-ДК обладают низкой миграционной активностью и в условиях дефицита ростовых факторов могут подвергаться обратной трансформации в моноциты, и соответственно, могут быстро терять свои уникальные антиген-презентирующие свойства.
Поэтому был предложен альтернативный способ генерации ДК, при котором ИЛ-4 заменяется на интерферон-альфа (ИФН-альфа) [12]. Такой путь генерации ДК представляется более физиологичным, поскольку ИФН-б является ранним медиатором врожденного иммунитета и продуцируется в больших количествах в ответ на стимуляцию инфекционными антигенами и провоспалительными цитокинами. Кроме того, ИФНб-индуцированные ДК (ИФН-ДК) имеют ряд особенностей, которые принципиально отличают их от ИЛ4-ДК и позволяют существенно повысить эффективность их клинического использования. Так, ИФН-ДК генерируются быстрее по времени, характеризуются высокой способностью к захвату антигена, сохраняют стабильность в отсутствие цитокинов и ростовых факторов, имеют более высокую миграционную активность, более активно стимулируют CD8 Т-лимфоциты, индуцируют сбалансированный клеточный и гуморальный иммунный ответ, поскольку способны стимулировать как Th1-, так и Th2-лимфоциты [13, 14]. Учитывая также, что ИФН-ДК по некоторым данным обладают прямой цитотоксической активностью [15], применение данного типа ДК при хронических вирусных инфекциях представляется более перспективным.
Наиболее близким к заявленному изобретению является способ иммунотерапии вирусной инфекции, описанный в патенте US 2010143405 (А1), согласно которому с целью индукции клеточного иммунного ответа у больных хроническим вирусным гепатитом С (ХВГС) используют введение аутологичных дендритных клеток, генерированных и нагруженных (пульсированных) антигенами вируса гепатита С (HCV) в культуре in vitro. Способ направлен на лечение хронической вирусной инфекции, вызванной, в частности, вирусами гепатита С, гепатита В (HBV) и иммунодефицита человека (HIV). В соответствии с патентом (см. пример №4 способа-прототипа) ДК генерируют из моноцитов, выделенных из фракции мононуклеарных клеток (МНК) периферической крови больных ХВГС, в присутствии ГМ-КСФ (1000 МЕ/мл) и ИЛ-4 (800 МЕ/мл) в течение 4-5 сут. Полученные в результате незрелые ДК отмывают и ресуспендируют в свежей культуральной среде, содержащей ГМ-КСФ (1000 МЕ/мл) и ИЛ-4 (800 МЕ/мл). На этом этапе клетки пульсируют антигеном, который представляет собой синтетический липопептид - [Th]-K(Pam2CSS)-[CTL], который состоит из двух вирус-специфических эпитопов, распознающихся цитотоксическими CD8+лимфоцитами (CTL) и Т-хелперными клетками (Th) и соединенных между собой липидной конструкцией K(Pam2CSS), которая одновременно является лигандом для Toll-подобных рецепторов 2 типа (TLR-2). Данный антиген добавляют к незрелым ДК в конечной концентрации 20 нМ и инкубируют в течение 4 ч при 37°С во влажной атмосфере с 5% CO2. После чего, антиген-пульсированные ДК отмывают центрифугированием, ресуспендируют в свежей культуральной среде, содержащей ГМ-КСФ (1000 МЕ/мл) и ИЛ-4 (800 МЕ/мл), и культивируют в течение 2 сут. Поскольку используемая антигенная конструкция одновременно является лигандом для TLR-2, она способна индуцировать конечную дифференцировку ДК без добавления каких-либо дополнительных дозревающих стимулов. В результате генерируются зрелые ДК, нагруженные синтетическим липопептидом. Полученные клетки отмывают, ресуспендируют в физиологическом 0,9% растворе хлорида натрия с 10% человеческого сывороточного альбумина (ЧСА) и вводят внутрикожно в область живота (в дозе 10 млн клеток в 1 мл) и внутривенно, капельно в течение 30 мин (в дозе 10-50 млн в 100 мл). Если получено большее количество ДК, то оставшиеся клетки могут быть криоконсервированы (в дозе 20 млн/ампулу) и использованы при необходимости для повторных вакцинаций.
Однако способ-прототип имеет ряд существенных недостатков. Так, из описания патента не ясно, действительно ли данный подход позволяет индуцировать специфический иммунный ответ против вирусных антигенов (HCV). Если да, то какова выраженность и продолжительность иммунного ответа, и как это сказывается на клиническом течении хронической вирусной инфекции. Соответственно, не известно, будет ли эффективен данный способ при лечении герпесвирусной инфекции, которая отличается от других хронических вирусных инфекций, вызванных HCV, HBV и HIV, частыми обострениями (до 20 рецидивов в год), и что диктует необходимость не только индукции адекватного антиген-специфического иммунного ответа, но и поддержания/сохранения его на определенном уровне в течение длительного периода времени.
Предложенный авторами способ является технологически сложным и дорогостоящим. В частности, для выделения МНК из периферической крови и последующего получения из них моноцитов требуется проводить процедуры сепарации на оборудовании CliniMACS (Miltenyli Biotec) с использованием соответствующего одноразового расходного материала/реагентов (сетов) по программам Spectra MNC и CliniMACS Tubing Set/CliniMACS CD14. При этом, чтобы получить необходимое количество CD14+моноцитов, процедуры сепарации крови могут повторяться. Кроме того, в процессе генерации зрелых, антиген-пульсированных ДК требуется многократно обновлять культуральную среду с добавлением дорогостоящих рекомбинантных цитокинов ГМ-КСФ (1000 МЕ/мл) и ИЛ-4 (800 МЕ/мл). Также важно отметить, что процесс генерации ДК является продолжительным по времени (до 7 суток), что существенно повышает требования к лабораторному обеспечению стерильности культуральных работ.
Технологические сложности и экономические затраты способа-прототипа во многом обусловлены тем, что авторы предлагают использовать для лечения хронических вирусных инфекций ИЛ4-индуцированные ДК (ИЛ4-ДК). Кроме того, предлагается значительную часть полученных ИЛ4-ДК вводить внутривенно. Однако известно, что данный тип ДК отличается низкой миграционной активностью и в условиях дефицита ростовых факторов может подвергаться обратной трансформации в моноциты. Поэтому не является оптимальным не только протокол генерации ДК, но и введение их в системный кровоток, поскольку такие технологические приемы сопряжены с ослаблением антиген-презентирующей активности используемых ДК, что может негативно повлиять на эффективность индукции противовирусного иммунного ответа в процессе ДК-вакцинаций.
Кроме того, хорошо известно, что эффективность специфической иммунотерапии во многом зависит не только от иммуногенности вакцины, но и от одновременного использования неспецифической иммунотерапии с помощью различных адъювантов. Однако в способе-прототипе данный фундаментальный принцип проведения активной специфической иммунотерапии полностью игнорируется.
Задачей изобретения является создание более простого и экономичного способа иммунотерапии хронической часто рецидивирующей герпесвирусной инфекции, позволяющего уменьшить число обострений и выраженность их клинических проявлений.
Поставленная задача достигается путем использования генерированных из моноцитов периферической крови аутологичных ИФН-альфа индуцированных ДК, нагруженных рекомбинантным антигеном вируса герпеса в культуре in vitro, которые вводят больному подкожно 2 курсами в комбинации с препаратом рекомбинантного интерлейкина-2 в качестве адъюванта.
Технический результат состоит в эффективной индукции антиген-специфического иммунного ответа и поддержании его на адекватном уровне в течение длительного периода времени.
Заявленный способ осуществляется следующим образом.
Госпитализация больного осуществляется в период ремиссии (как минимум через 2 недели после последнего рецидива). Показанием для проведения специфической иммунотерапии является наличие хронической герпесвирусной инфекции, резистентной к противовирусным препаратам и с частотой обострения более 6 раз в год.
ДК генерируют из моноцитов периферической крови больного. Процедуру гемоэксфузии проводят в утренние часы. Для этого в стерильный флакон, содержащий раствор гепарина (10000 Ед), забирают 200 мл венозной крови больного, добавляют 40 мл раствора желатиноля и инкубируют 45 мин при 37°С. Собранную лейковзвесь собирают в отдельный флакон, центрифугируют при 1000 об/мин 20 мин. Содержащуюся в надосадке аутоплазму собирают для последующего использования. Осажденные клетки лейковзвеси однократно отмывают фосфат-забуференным физиологическим раствором (PBS), наслаивают на градиент плотности фиколла-верографина и центрифугируют в течение 20 мин при 3000 об/мин. Собранные из интерфазы мононуклеарные клетки (МНК) двукратно отмывают и ресуспендируют в культуральной среде RPMI-1640, дополненной 5% аутоплазмы, 5 мМ HEPES-буфера и гентамицином в дозе 80 Ед/мл. Затем, выделенные МНК в концентрации 3×106/мл инкубируют в течение 2 ч при 37°С в стерильных флаконах площадью 75 или 150 см2 (Falcon). Фракцию неприкрепившихся к пластику клеток удаляют. Для получения незрелых ДК к оставшимся во флаконе прикрепившимся клеткам моноцитарно-макрофагального ряда (80-90% CDH+моноцитов) добавляют полную культуральную среду, дополненную 1,5% аутоплазмы, 40 нг/мл ГМ-КСФ (Sigma-Aldrich) и 1000 Ед/мл ИФН-альфа (Роферон-А, Roche, Швейцария) и культивируют в течение 3 сут при 37° в CO2 - инкубаторе при 5% CO2. Конечное созревание незрелых ИФН-ДК проводят в течение дополнительных 24 ч в присутствии фармакопейного препарата полиоксидония (НПО ПетроваксФарм, Москва) в дозе 2 нг/мл. Полученные в результате зрелые ИФН-ДК нагружают (пульсируют) специфическим рекомбинантым антигеном вируса герпеса - HSV1gD (НПО «Диагностические системы», Нижний Новгород) в дозе 5 мкг/мл во время часовой инкубации при 37°С. Таким образом, общее время получения ИФН-ДК, нагруженных специфическим вирусным антигеном, составляет 4 суток. Затем ИФН-ДК криоконсервируют в растворе 10% DMSO и 90% альбумина в концентрации 6,0×106/мл и хранят при -80°С до последующего использования.
Специфическую иммунотерапию проводят в виде 2 курсов ДК-вакцинаций. Первый «индукторный» курс включает 4-6 подкожных инъекций (в верхнюю треть плеча) ИФН-ДК в дозе 5×106 клеток с 2-недельным интервалом. Через 3 мес после завершения первого курса проводят второй «поддерживающий» курс ДК-вакцинаций в виде 3-6 подкожных инъекций ИФН-ДК в дозе 5×106 клеток с кратностью 1 раз в месяц. Обязательным условием при проведении ДК-вакцинаций является использование в качестве адъюванта фармакопейного препарата рекомбинантного интерлейкина-2 человека (рИЛ-2, Ронколейкин®, ООО «Биотех», Санкт-Петербург), который также вводят подкожно в дозе 0,25 мг. Использование рИЛ-2 в качестве адъюванта может значительно усилить антиген-специфический Т-клеточный ответ при проведении ДК-вакцинаций за счет преодоления состояния анергии Т-клеток, предотвращения апоптоза Т-клеток, генерации Т-клеток-памяти, в том числе длительно живущих цитотоксических Т-лимфоцитов.
Для оценки эффективности индукции/поддержания антиген-специфического иммунного ответа у больных исследуют уровень пролиферативного ответа МНК на стимуляцию вакцинальным антигеном (HSV1gD) и митогеном (конканавалином А). Исследования проводят до начала терапии, после завершения 1-го и 2-го курса ДК-вакцинаций, а также через 6 мес после завершения лечения (в среднем через 15 мес после начала лечения). Для этого, из 10 мл гепаринизированной венозной крови больных выделяют МНК центрифугированием в градиенте плотности фиколла-верографина (как было описано ранее). МНК в концентрации 0,1×106/лунку культивируют при 37°С во влажной атмосфере с 5% CO2, в 96-луночных круглодонных планшетах для иммунологических исследований в полной культуральной среде, содержащей RPMI-1640, дополненной 0,3 мг/мл L-глютамина, 5 мМ HEPES-буфера, 80 мкг/мл гентамицина и 10% инактивированной сыворотки доноров AB(IY) группы. Для стимуляции клеток используют конкановалин А (КонА, Sigma) в дозе 15 мкг/мл и специфический рекомбинантый антиген вируса герпеса - HSV1gD в дозе 5 мкг/мл. Интенсивность пролиферации оценивают через 72 ч по включению в нуклеопротеидные фракции клеток 3H-тимидина, вносимого за 18 ч до окончания культивирования в дозе 1 мкг/мл. Подсчет радиоактивности производят в жидкостном сцинциляционном счетчике SL-30 (Intertechnic, Франция). Результаты представляют в виде среднего счета (имп/мин) из трех идентичных культур.
Заявляемый способ иммунотерапии был применен у 7 больных с орофациальной локализацией герпесвирусной инфекции. Длительность заболевания составила в среднем 18,3±1,3 года (от 15 до 25 лет), а количество обострений от 8 до 15 в год (за полгода до начала лечения отмечалось в среднем 6±0,5 рецидивов). Лечение проводили на фоне полной отмены противовирусных препаратов (вследствие их токсичности и/или малой эффективности) и каких-либо других иммуномодуляторов (индукторов интерферонов, препаратов рекомбинантного интерферона 2-альфа, ликопида, полиоксидония и т.д.). Проведение специфической иммунотерапии по разработанной схеме характеризовалось хорошей переносимостью, не вызывало местных и системных аллергических и/или воспалительных реакций.
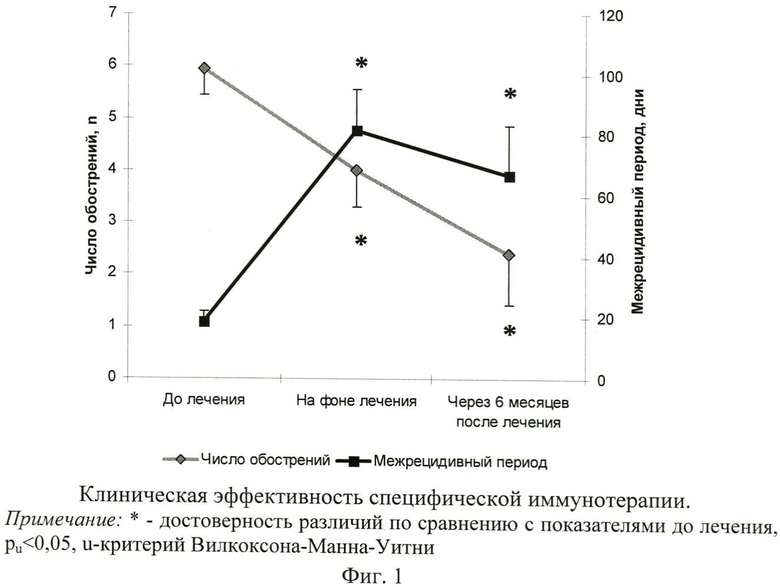
Заявляемый способ характеризовался выраженной клинической эффективностью (фиг.1). У больных регистрировалось достоверное уменьшение числа обострений: на фоне лечения количество рецидивов снизилось до 4,0±0,7 против 6±0,5 эпизодов до лечения (pu<0,05), а в течение 6 мес после окончания лечения - до 2,4±0,9 (pu<0,05). Соответственно, межрецидивный период на фоне терапии увеличился до 82±14 дней, а в период 6 мес наблюдения после терапии составил 67±16 дня, что было достоверно выше соответствующего показателя до лечения (18,7±3,2; pu<0,05). При этом у 3 пациентов в период 6-месячного наблюдения не было зарегистрировано ни одного обострения, а у 4-х, имевших рецидивы, обострения протекали в более легкой форме с меньшей площадью высыпаний и менее выраженной интоксикацией.
Исследование антиген-специфического и митоген-индуцированного пролиферативного ответа в культурах МНК больных показало, что исходно пациенты с герпесвирусной инфекцией характеризовались сниженным уровнем Кон-А стимулированной пролиферации (12314±1840 против 59240±3990 имп/мин у здоровых доноров, pu<0,05) и отсутствием реактивности на стимуляцию вирусным антигеном (табл.1).
После 1-го курса ДК-вакцинаций (через 3 мес от начала лечения) ИВАГ возрастал в среднем в 5 раз, что свидетельствовало о появлении антигенной реактивности МНК. Однако интенсивность митогенной реактивности Т-клеток оставалась низкой. По завершении 2-го курса ДК-вакцинаций (через 12 мес после начала лечения) интенсивность антиген-специфического ответа сохранялась на достаточно высоком уровне (ИВАГ 3,8±1,6 расч. ед.), при этом отмечалось 2-кратное усиление общей митогенной реактивности Т-клеток (pU<0,05). Через 6 мес после завершения лечения интенсивность антиген-специфического ответа у больных сохранялась на высоком уровне и соответствовала уровню ответа после первого «индукторного» курса ДК-вакцинаций. Кроме того отмечалось восстановление митогенной реактивности Т-клеток до уровня, сопоставимого со значениями здоровых доноров (59240±3990 имп/мин).
Примечание: данные представлены в виде M±SE пролиферативного ответа МНК больных герпесвирусной инфекцией в отсутствие и в присутствии АГ или КонА. В скобках - индекс влияния ИВАГ и ИВКОН-А - отношение стимулированного ответа к уровню спонтанной пролиферации, ∗ - достоверность различий по сравнению с показателями до лечения, pu<0,05, u-критерий Вилкоксона-Манна-Уитни.
Таким образом, проведение иммунотерапии по заявляемому способу сопровождалось индукцией антиген-специфического клеточного иммунного ответа, который поддерживался на адекватном уровне в течение как минимум 6 мес после завершения лечения. Кроме того, у больных происходила нормализация общей пролиферативной реактивности Т-клеток в ответ на митогенную стимуляцию.
Для лучшего понимания сущности заявленного изобретения, а также для подтверждения соответствия решения условию промышленной применимости, приводим примеры конкретной реализации, которыми оно исчерпаться не может.
Пример 1
Пациентка З., 24 г., ИБ №684, наблюдалась в отделении иммунологии клиники иммунопатологии НИИ КИ СО РАМН с 15 мая 2008 г. по 07 сентября 2009 г. При поступлении в отделение предъявляла жалобы на рецидивирующие пузырьковые высыпания на красной кайме губ с частотой 1 раз в месяц, повышение температуры тела до субфебрильных значений (37,2-37,3°С) преимущественно во второй половине дня, повышенную утомляемость, слабость, сниженную работоспособность.
По данным анамнеза, считает себя больной около 17 лет. Герпетические высыпания рецидивировали более 5 раз в год, для местного лечения использовались противовирусные препараты. В течение трех лет перед обращением частота рецидивов увеличилась до ежемесячных обострений и составила 12 раз/год. В то же время отмечалось постепенное усиление клинических проявлений в виде увеличения площади поражения, появления симптомов общей интоксикации, субфебрилитета как в период обострения, так и в межрецидивный период. Рецидивы провоцировались переохлаждением и/или острыми респираторными инфекциями. В лечении применяла системные и местные противовирусные препараты с кратковременным неполным эффектом.
Для генерации дендритных клеток 15.05.2008 была проведена гемоэксфузия периферической крови в объеме 200 мл. После 3-суточного культивирования прилипающей фракции мононуклеарных клеток в присутствии ГМ-КСФ (40 нг/мл) и ИФН-альфа (1000 Ед/мл) с последующим дозреванием в течение 24 ч в присутствии полиоксидония (2 нг/мл), полученные дендритные клетки нагружали («пульсировали») рекомбинантым антигеном вируса герпеса (HSV1gD в дозе 5 мкг/мл, 1 час при 37°С). Полученные антиген-специфические ИФН-ДК криоконсервировали при -80°С в растворе 10% DMSO и 90% альбумина аликвотами по 5×106 клеток для последующего использования. «Индукторный» курс ДК-вакцинаций состоял из 4 подкожных инъекций клеток с интервалом 11-14 дней (21.05.08; 02.06.08; 16.06.08 и 27.06.08). Дендритные клетки вводили подкожно в верхнюю треть плеча в 4 точки в количестве 1,25×106 ИФН-ДК в каждую точку. В качестве адъюванта использовали рекомбинантный интерлейкин-2 человека (Ронколейкин) в дозе 0,25 мг, подкожно. На фоне проводимого курса обострений не отмечалось.
«Поддерживающий» курс иммунотерапии был начат 10.09.2008 г. Была выполнена повторная гемоэксфузия венозной крови объемом 200 мл, и из фракции адгезивных клеток генерированы ИФН-ДК, нагруженные рекомбинантым антигеном вируса герпеса (как описано ранее). Было проведено пять ДК-вакцинаций с интервалом 2-4 недели (15.09.08; 13.10.08; 27.10.08; 10.11.08 и 24.11.08). Проведение специфической иммунотерапии характеризовалось хорошей переносимостью, не вызывало местных и системных аллергических или воспалительных реакций.
На фоне проведения «поддерживающего» курса иммунотерапии было отмечено два обострения лабиального герпеса (после 1-ой и 2-ой вакцинации), но при этом пациентка субъективно отмечала уменьшение площади поражения до 1-2 пузырьков, с быстрым самостоятельным регрессом. По данным катамнеза, первый рецидив после окончания специфической иммунотерапии отмечался в сентябре 2009 года, то есть через 9 мес после окончания лечения. При этом больная также отмечала значительно меньшую площадь герпетических высыпаний по сравнению с исходным уровнем.
С целью оценки эффективности индукции/поддержания антиген-специфического иммунного ответа у больной исследовали уровень пролиферативного ответа МНК на стимуляцию вакцинальным антигеном (HSV1gD, 5 мкг/мл) и митогеном (конканавалином А, 15 мкг/мл). До начала иммунотерапии (15.05.2008 г) регистрировалось: низкая митогенная реактивность Т-клеток (8326 имп/мин против 59240±3990 имп/мин у здоровых доноров) и отсутствие пролиферативного ответа на антиген (216 имп/мин; ИВАГ=1,1 расч. ед.). После первого и второго курса ДК-вакцинаций (10.09 и 01.12.2008 г, т.е. через 3 и 6 мес от начала лечения) было отмечено постепенное повышение уровня Кон-А-стимулированной пролиферации до 23651 и 27500 имп/мин, соответственно. Происходило также 1,5-2-кратное усиление антиген-специфического ответа (ИВАГ=1,5 и 2,0 расч. ед.). Через 6 мес после завершения поддерживающего курса (12.05.2009 г., т.е. через год от начала лечения) митогенная реактивность Т-клеток полностью восстановилась (46400 имп/мин), а интенсивность антиген-специфического ответа составляла 796 имп/мин (ИВАГ=4,4 расч. ед.).
Таким образом, активация антиген-специфического противовирусного иммунного ответа и восстановление функциональной реактивности Т-клеток, которые достигаются путем курсового лечения в виде подкожных вакцинаций аутологичных ИФН-альфа индуцированных ДК, нагруженных рекомбинантным антигеном вируса герпеса, в сочетании с препаратом рИЛ-2 в качестве адъюванта, позволяет уменьшить число обострений и выраженность их клинических проявлений у больных с хронической часто рецидивирующей герпесвирусной инфекцией.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИММУНОТЕРАПИИ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА С | 2016 |
|
RU2637631C2 |
| СПОСОБ ИММУНОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА | 2018 |
|
RU2686756C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ ГЕРПЕС-ВИРУСНОЙ ИНФЕКЦИЕЙ С ПОМОЩЬЮ АКТИВИРОВАННЫХ IN VITRO АУТОЛОГИЧНЫХ ЛИМФОЦИТОВ | 2022 |
|
RU2799141C2 |
| СПОСОБ ГЕНЕРАЦИИ АНТИГЕН-СПЕЦИФИЧЕСКИХ ЦИТОТОКСИЧЕСКИХ КЛЕТОК С АКТИВНОСТЬЮ ПРОТИВ КЛЕТОК, ИНФИЦИРОВАННЫХ ВИРУСОМ ГЕПАТИТА В | 2008 |
|
RU2366707C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ДИФФУЗНЫХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 2004 |
|
RU2283113C2 |
| СПОСОБ ГЕНЕРАЦИИ СПЕЦИФИЧЕСКОГО ИММУННОГО ОТВЕТА ПРОТИВ АНТИГЕНОВ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2011 |
|
RU2465324C1 |
| СПОСОБ ИММУНОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА | 2004 |
|
RU2262941C2 |
| Способ иммунотерапии рака молочной железы с помощью антиген-активированных дендритных клеток | 2016 |
|
RU2645464C1 |
| СПОСОБ ПОЛУЧЕНИЯ АУТОЛОГИЧНОЙ ВАКЦИНЫ ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2008 |
|
RU2372936C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2489169C2 |
Изобретение относится к медицине, а именно к клинической иммунологии и инфекционным болезням, и может быть использовано для лечения хронической часто рецидивирующей герпесвирусной инфекции. Для этого используют аутологичные ИФН-альфа индуцированные дендритные клетки, нагруженные рекомбинантным антигеном вируса герпеса, которые вводят больному подкожно 2 курсами в комбинации с препаратом рекомбинантного интерлейкина-2 в качестве адъюванта. Способ позволяет уменьшить число рецидивов и выраженность клинических проявлений герпесвирусной инфекции за счет индукции эффективного антиген-специфического клеточного иммунного ответа и поддержания его на адекватном уровне в течение длительного периода времени. 1 пр., 1 ил.
Способ иммунотерапии хронической вирусной инфекции, включающий введение больному аутологичных дендритных клеток, генерированных из моноцитов периферической крови и нагруженных вирусным антигеном в культуре in vitro, отличающийся тем, что дендритные клетки культивируют в присутствии интерферона-альфа, а в качестве антигена применяют рекомбинантный антиген вируса герпеса и используют полученные дендритные клетки 2 курсами посредством подкожных вакцинаций в сочетании с препаратом рекомбинантного интерлейкина-2 человека в качестве адъюванта для лечения часто рецидивирующей герпес-вирусной инфекции.
| СПОСОБ ИММУНОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА | 2004 |
|
RU2262941C2 |
| US 2010143405 А1, 10.06.2010 | |||
| US 2004022812 Al, 05.02.2004 | |||
| ЛЕПЛИНА Ю.О | |||
| и др | |||
| INFά-индуцированные дендритные клетки у больных множественной миеломой | |||
| Сибирский онкологический журнал, 2009, №6 (36), с.37-43 | |||
| KASSIM S | |||
| et al | |||
| Dendritic Cells are required for optimal activation of natural killer functions | |||
Авторы
Даты
2013-06-27—Публикация
2011-12-09—Подача