Изобретение относится к медицине, конкретно к иммунологии, и может быть использовано для получения активированных дендритных клеток, способных инициировать антиген-специфический иммунный ответ.
Предложенная доза гельминтного антигена Opisthorchis felineus является оптимальной для моделирования иммунного ответа на основе культуры дендритных клеток в ответ на инфекционный стимул с целью разработки подходов для терапии аллергических заболеваний на основе клеточных технологий.
Многочисленные факты свидетельствуют о способности гельминтных инфекций модифицировать иммунный ответ хозяина, что оказывает существенное влияние на риск развития и клиническое течение аллергии. Характер и степень этого модифицирующего влияния зависят от конкретных условий, в том числе генетических свойств индивидуумов. Существующие на сегодняшний день сведения об иммунных механизмах моделирования риска аллергических заболеваний у лиц с паразитарными заболеваниями недостаточны и требуют глубокого анализа их молекулярных основ. Изучение модифицирующего влияния гельминтных антигенов на формирование иммунного ответа у больных аллергическими заболеваниями особенно актуально для регионов с высокой распространенностью паразитарных инвазий [1].
Согласно иммуно-эпидемиологическому исследованию, осуществленному Л.М.Огородовой и соавт. в природных очагах описторхоза Томской области, у больных бронхиальной астмой на фоне хронического описторхоза регистрируется относительное снижение уровня патогенетически значимых провоспалительных цитокинов (ИЛ-4, ИЛ-5) и снижение уровней специфических IgE по сравнению с больными бронхиальной астмой без описторхоза [2]. Выявленные признаки снижения напряженности реакций гиперчувствительности немедленного типа на фоне описторхозной инвазии представляют значительный интерес в плане исследования молекулярных иммунных механизмов, контролирующих различные звенья патогенеза аллергии.
В настоящее время не существует эффективных методов профилактики аллергических заболеваний. Единственным патогенетическим методом лечения и ограничения расширения спектра причинно-значимых аллергенов у больных аллергическими заболеваниями является аллерген-специфическая иммунотерапия (АСИТ). Одним из основных недостатков этого метода является его специфичность только в отношении конкретных аллергенов, что затрудняет лечение больных с поливалентной сенсибилизацией. Побочные реакции при проведении АСИТ являются основной проблемой при использовании экстрактов аллергенов. Наиболее тяжелые нежелательные эффекты включают анафилаксию, вызванную IgE опосредованной дегрануляцией тучных клеток, приводящей к выбросу вазоактивных медиаторов и IgE опосредованному захвату антигенов дендритными клетками. Более усовершенствованным направлением АСИТ являются аллерген-специфические вакцины на основе дендритных клеток, создание которых находится на стадии клинических испытаний.
В связи с этим является актуальным изучение антигенных, иммуногенных и аллергенных свойств Opisthorchis felineus и исследование молекулярных и клеточных механизмов модификации реакций гиперчувствительности немедленного типа под влиянием антигена Opisthorchis felineus. Впервые проведенная активация (нагрузка) дендритных клеток с помощью гельминтного антигена Opisthorchis felineus позволит изучить иммунногенные, антигенные и аллергенные свойства возбудителя для разработки подходов к созданию антиаллергических вакцин на основе дендритных клеток.
В ряде научных центров ведутся исследования по созданию вакцин на основе дендритных клеток для иммунотерапии онкологических, инфекционных и аутоиммунных заболеваний. Изучается влияние дендритных клеток, активированных различными инфекционными антигенами на функциональные свойства клеток иммунной системы, и дальнейшее формирование иммунного ответа.
Возможность создания таких вакцин обусловлена тем, что дендритные клетки являются наиболее эффективными антиген-представляющими клетками, обладающими специфической способностью презентировать антигены наивным Т-клеткам и вызывать последующую дифференцировку иммунного ответа. Изолированные из периферической крови дендритные клетки после обработки in vitro выбранным антигеном становятся зрелыми и in vivo после их возврата в организм с помощью внутривенного введения могут инициировать иммунный ответ.
Значительное количество исследований зарубежных коллег посвящено изучению структурных и функциональных особенностей гельминтного антигена Shistosoma mansoni, а также его влияния на инициирование иммунного ответа дендритными клетками, полученными из периферической крови человека. Рядом авторов показано, что Shistosoma mansoni индуцирует провоспалительный фенотип дендритных клеток с последующей дифференцировкой Th2 пути иммунного ответа [8]. Антиген, выделенный из трематоды Fasciola hepatica, способен супрессировать созревание и дальнейшее функционирование дендритных клеток [7].
По данным научной литературы антиген М. tuberculosis изучен достаточно подробно, проанализированы фенотипические характеристики дендритных клеток, нагруженных данным антигеном, проведены работы по определению эффективности иммунного ответа на М. tuberculosis [5].
Известен способ получения стимулированных дендритных клеток для индукции иммунного ответа против туберкулеза человека. Способ основан на заборе у пациента незрелых дендритных клеток, их культивировании ex vivo для созревания и формирования аллостимуляторной активности. Клетки дополнительно собирают антигеном и вводят их тому же пациенту для формирования адаптивного иммунитета. При культивировании ех vivo незрелых дендритных клеток в культуральную среду вводят фрагментированную аллогенную двуцепочечную геномную ДНК с фрагментами, размером 200-6000 п.о. в количестве 5 мкг/мл среды [3].
Что касается гельминтной инвазии, вызванной описторхисами, то всего в мире ею поражено не менее 20 млн. человек. В России более 60% от всех зарегистрированных биогельминтозов приходится на долю описторхоза, вызванного трематодой семейства Opisthorhidae (Opisthorchis felineus). В Юго-Восточной Азии имеется родственный вид - Opisthorchis viverrini, а на Дальнем Востоке - Clonorchis sinensis [13]. На экспериментальных клеточных моделях in vitro достаточно изученными являются иммунологические аспекты и молекулярная биология инфекций, вызванных Opisthorchis viverrini и Clonorchis sinensis [6, 9].
Однако в доступной для анализа литературе не встречается ни одного исследования, в котором описан способ нагрузки дендритных клеток гельминтным антигеном, приготовленным из Opisthorchis felineus.
Наиболее близким к предлагаемому является способ получения зрелых дендритных клеток для индуцирования иммунного ответа. Известный способ позволяет получить зрелые дендритные клетки, экспрессирующие на своей поверхности CD1a, CD14low, CD83, CD86, IL-10low, CCR7 и IL-12p70 и имеющие стабильный фенотип низкого продуцирования IL-10. Для чего клетки-предшественники (моноциты) и незрелые дендритные клетки культивируют в присутствии факторов созревания и дифференцировки, таких как GM-CSF, IL-4 и TNF-a, при температуре от 31 до 37°С. Известный способ обладает ограниченной областью применения, так как полученные зрелые дендритные клетки используют для индуцирования иммунного ответа только против злокачественных образований и инфекционных болезней [4].
Новая техническая задача - разработка нового способа получения дендритных клеток активированных инфекционным антигеном Opisthorchis felineus.
Для решения поставленной задачи в способе нагрузки дендритных клеток антигеном инфекционного происхождения Opisthorchis felineus, включающем выделение фракции периферических мононуклеарных клеток (МНК) из венозной крови, процедуру выделения моноцитов из МНК, помещение выделенных моноцитов в полную питательную культуральную среду с цитокинами и ростовыми факторами, индукцию созревания дендритных клеток с использованием липополисахаридов E.coli, выделение моноцитов из МНК венозной крови проводят с использованием двойного градиента плотности перколла 47.5% SIP и 15% SIP соответственно, при охлаждении до +4°С, после чего выделенные моноциты помещают в полную питательную культуральную среду с добавлением 20 нг/мл ИЛ4 и 20 нг/мл ГМ-КСФ, при этом замену полной питательной культуральной среды с цитокинами и ростовыми факторами осуществляют на 3 стуки культивирования, дополнительно антиген инфекционного происхождения Opisthorchis felineus в дозе 40 мкг/мл добавляют на 4 сутки культивирования одновременно с липополисахаридом E.coli серотип 055:В5 в дозе 1 мкг/мл, после чего на 6 сутки культивирования дендритные клетки отмывают и анализируют методом проточной цитофлюориметрии.
Результатом разработанного способа является получение активированных дендритных клеток, способных инициировать антиген-специфический иммунный ответ.
Способ осуществляют следующим образом.
1) Выделение фракции периферических мононуклеарных клеток (МНК)
В стерильную пластиковую пробирку объемом 50 мл («Falcon», США) вносят периферическую венозную кровь, разбавленную в соотношении 1:4 с помощью бессывороточной среды RPMI-1640. На дно пробирки с кровью наслаивают 10 мл раствора фиколла плотностью 1,077 г/см3. Центрифугируют при 2000 об/мин на центрифуге «NF400R» (Турция) в течение 25 минут при комнатной температуре. Сбор клеток интерфазного кольца осуществляют с помощью пастеровской пластиковой трансфер-пипетки («Sigma-Aldrich», США). Собранные клетки переносят в стерильную пластиковую пробирку объемом 50 мл и дважды отмывают с помощью бессывороточной среды RPMI-1640, либо раствором Хэнкса («ПанЭко», Россия) при 2000 об/мин в течение 10 минут. После второй отмывки клетки ресуспендируют в полной среде RPMI-1640, содержащей эмбриональную телячью сыворотку (ЭТС) («Sigma-Aldrich», США).
2) Процедура выделения моноцитов из МНК венозной крови.
Выделение моноцитов из МНК крови проводят с использованием двойного градиента плотности перколла (1,131 г/см3, рН=8.5-9.5, «Sigma», США). До начала процедуры выделения моноцитов готовят раствор стандартного изотонического перколла (Standart Isotone Percoll) (SIP). Для этого к 1 мл 10-кратного забуференного фосфатного раствора (25 гр NaCl, 0.25 гр Na2HPO4 и 4.2 гр KH2PO4 доводят дистилированной водой до 400 мл, рН=7,2-7,4) добавляют 9 мл перколла с плотностью 1,131 г/см3. С использованием SIP и неполной среды RPMI готовят 2 градиента плотности перколла: 47.5% SIP (5226 мкл SIP смешивают с 5776 мкл RPMI из расчета на 2 пробы) и 15% SIP (к 750 мкл SIP добавляют 4250 мкл RPMI из расчета на 2 пробы).
Измеряют объем полученного после двукратной отмывки осадка МНК и добавляют RPMI в таком количестве, чтобы общий объем клеточной суспензии в пробе составил 1 мл. К полученному объему клеток добавляют 1,5 мл SIP. Далее суспензию переносят в стерильные пробирки объемом 15 мл. На поверхность клеточной суспензии медленно по стенке пробирки наслаивают 5 мл 47.5% SIP, а затем сверху также по стенке вносят 2 мл 15% SIP. Пробы центрифугируют в течение 45 мин при 3500 об/мин и при охлаждении до 4°С. После центрифугирования получают 2 кольца: верхнее кольцо является моноцитарным, в нижнем кольце находятся МНК, эритроциты осаждаются на дно пробирки. Моноцитарное кольцо собирают в отдельную стерильную пробирку пастеровской трансфер-пипеткой и дважды отмывают с помощью бессывороточной RPMI-1640 при 2000 об/мин в течение 10 минут.
Собранные моноциты используют для приготовления суспензии с концентрацией 5×105 клеток/мл. Суспензию готовят на основе среды RPMI-1640, содержащей 10% ЭТС, 50 мкМ β-меркаптоэтанола («Sigma-Aldrich», США), 2 мМ L-глутамина («Панэко», Россия), 50000 ед./литр пенициллина («Панэко», Россия), 50 г/л стрептомицина («Панэко», Россия), 11 мг/л пирувата натрия («Панэко», Россия).
3) Культивирование дендритных клеток из моноцитов
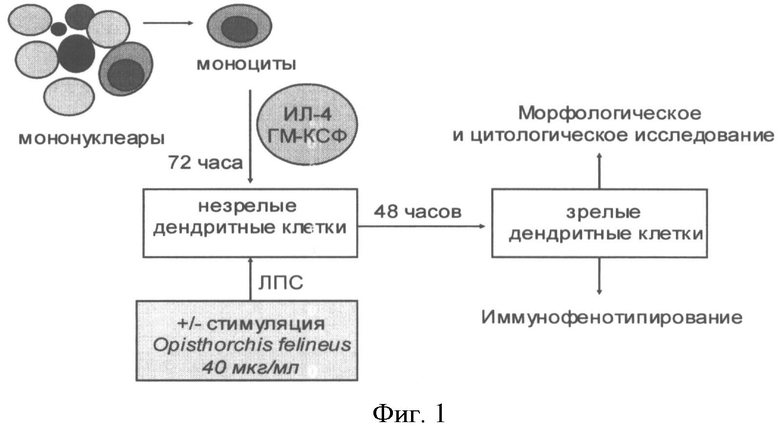
Выделенные моноциты с концентрацией 5×105 клеток/мл помещают в 24-луночные пластиковые культуральные планшеты («Nunclon», Дания) в объеме 1 мл на лунку. Клетки инкубируют в течение 1 часа в СО2 инкубаторе во влажной атмосфере 5% СО2 при +37°С. Далее из каждой лунки отбирают по 1 мл среды, взамен добавляя по 1 мл полной среды RPMI, содержащей ИЛ-4 («ProSpec», США; 20 нг/мл) и ГМ-КСФ («ProSpec», США; 20 нг/мл). Замену питательной среды с цитокинами на свежую проводят на 3 день культивирования. На 4 день индуцируют созревание дендритных клеток с использованием липополисахарида бактериального происхождения (L2880 - 055:В5, «Sigma-Aldrich», США). Стимуляцию дендритных клеток инфекционным антигеном Opisthorchis felineus проводят также на 4 день согласно схеме на Фиг.1. Рабочая доза антигена Opisthorchis felineus в культуральной лунке составляет 40 мкг/мл. На Фиг 2. приведена схема культивирования дендритных клеток из моноцитов периферической крови в условиях активации Opisthorchis felineus
Предложенная доза гельминтного антигена Opisthorchis felineus является оптимальной для моделирования иммунного ответа на основе культуры дендритных клеток в ответ на инфекционный стимул с целью разработки подходов для терапии аллергических заболеваний на основе клеточных технологий.
Перколл - сбалансированная среда для центрифугирования в градиенте плотности клеток и субклеточных структур. Центрифугирование приводит к гетерогенному распределению клеток и частиц разных размеров в среде. Концентрации градиентов плотности перколла (47,5% и 15%) для выделения моноцитов из МНК периферической крови подобраны авторами экспериментальным путем. Для выбора оптимальной плотности растворов SIP проводили измерение коэффициентов преломления приготовленных растворов на лабораторном рефрактометре по отношению к сахарозному градиенту. Экспериментальные работы с использованием концентрации SIP 47,5% и 34% соответственно приводили к меньшему выходу моноцитов после проведения центрифугирования, по сравнению с количеством клеток при заявленной плотности растворов SIP.
ЛПС - липополисахариды клеточной стенки бактерий E.coli (штамм L2880-055:В5) добавляются к антиген-активированным дендритным клетками для индукции созревания последних. Оптимальная для индукции созревания дендритных клеток доза ЛПС 1 мкг/мл подобрана авторами в эксперименте. Эта доза является достаточной по сравнению с использованием меньших концентраций ЛПС для стимулирования ДК в условиях активации антигеном Opisthorchis felineus и получения оптимального количества зрелых ДК.
Время культивации, концентрации используемых цитокинов, а также доза гельминтного антигена Opisthorchis felineus подобраны авторами экспериментально с целью получения максимального количества зрелых активированных дендритных клеток, способных вызвать антиген-специфический иммунный ответ. Культивирование моноцитов в течение 6 дней в полной питательной среде с цитокинами и ростовыми факторами приводило к получению зрелых ДК. При сокращении времени культивирования (4 дня) выход зрелых ДК снижался, большая часть клеток обладала свойствами незрелых ДК. Культивирование ДК более 6 дней приводило к появлению стареющих и нежизнеспособных клеток.
Добавление в культуральную питательную среду ИЛ4 и ГМ-КСФ в меньшей чем 20 нг/мл концентрации приводило к снижению дифференцировки моноцитов в ДК, и в целом, к получению меньшего количества ДК на 6 день культивирования. Подобранные дозы ИЛ4 и ГМ-КСФ являются достаточными для выращивания ДК. Использование больших доз ИЛ4 и ГМ-КСФ является нецелесообразным в связи с дороговизной этих реактивов.
Фенотип дендритных клеток подтвержден экспериментально методом проточной цитофлюориметрии на цитофлюориметре FacsCalibur (Becton Dickinson, США). Исследование экспрессии поверхностных кластеров детерминации дендритных клеток проведено при помощи соответствующих моноклональных антител. Определен уровень экспрессии CD209 (PerCP, «BD PharmingenTM», США), костимулирующей молекулы - CD86/B7-2 (FITC, «BD PharmingenTM», США); молекулы антигенного представления МНС I и II классов (HLA-DR, FITC, «BD Biosciences», США) и маркера терминальной дифференцировки дендритных клеток - CD83 (РЕ, «BD PharmingenTM», США). Анализ погибших клеток был проведен с использованием красителя для оценки жизнеспособности клеток 7-AAD (BD Bioscinces, США). Принцип действия 7-AAD заключается в окрашивании погибших клеток при проникновении только через поврежденную мембрану клетки и связывании с двухцепочечной ДНК.
Время культивации, концентрации используемых цитокинов, а также доза гельминтного антигена Opisthorchis felineus 40 мкг/мл подобраны авторами эмпирически в результате проведения ряда экспериментов с целью получения максимального количества зрелых активированных дендритных клеток, способных вызвать антиген-специфический иммунный ответ.
Способность Opisthorchis felineus модулировать иммунный ответ была проанализирована при совместном культивировании с дендритными клетками в течение 48 часов, являющимися ключевыми антиген-представляющими клетками, ответственными за генерацию и направленность иммунного ответа. Установление особенностей взаимодействия антигена Opisthorchis felineus и дендритных клеток по характеру изменения фенотипических характеристик дендритных клеток и их способности к созреванию необходимо для дальнейшего исследования поляризации иммунного ответа. Для культивирования в предлагаемом способе была подобрана и выбрана рабочая (конечная) доза гельминтного антигена Opisthorchis felineus - 40 мкг/мл, являющаяся оптимальной для моделирования иммунного ответа на основе дендритных клеток в ответ на инфекционный стимул.
Отличием предлагаемого способа является методический подход, включающий осуществление последовательных этапов выделения МНК и моноцитов с использованием градиента плотности фиколла (1,077 г/см3) и двойного ступенчатого градиента плотности перколла (1,131 г/см3) соответственно, позволяющих получить достаточное количество моноцитов для последующего культивирования дендритных клеток.
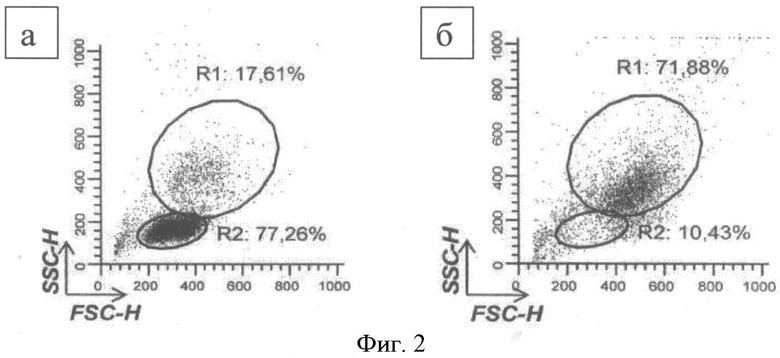
В результате выделения на градиенте плотности фиколла (1,077 г/см) была получена фракция МНК периферической крови, представленная лимфоцитами и моноцитами. Для начальной характеристики клеточных популяций использовали показатели бокового (side scatter, SSC) и переднего (forward scatter, FSC) светорассеивания, полученные с помощью проточной цитофлуориметрии.
Согласно результатам анализа по вышеперечисленным параметрам, моноциты составили порядка пятой части (14%-23%) от фракции МНК (Фиг.2а, область R1). Лимфоциты, характеризующиеся низкими сигналами SSC/FSC, представляли 70%-80% клеточной массы МНК (Фиг.2а, область R2). После разделения лимфоцитов и моноцитов с использованием двойного градиента плотности перколла (1,131 г/см3), клеточная фракция, собранная с раздела фаз, содержала 74,2±5,5% клеток, имеющих средние показатели SSC/FSC, характерные для моноцитов (Фиг.2б, область R1).
Пример на выполнение способа
Материалом для исследования служила венозная кровь здорового волонтера. В ходе выполнения центрифугирования с использованием градиента плотности фиколла (1,077 г/см3) и двойного ступенчатого градиента плотности перколла (1,131 г/см3) соответственно были получены моноциты периферической крови. Далее выделенные моноциты в концентрации 5×105 клеток/мл помещали в 24-луночные пластиковые культуральные планшеты и культивировали в полной среде RPMI, содержащей ИЛ-4 (20 нг/мл) и ГМ-КСФ (20 нг/мл) в CO2 инкубаторе во влажной атмосфере 5% CO2 при +37°С.
На 3 день культивирования проводили замену питательной среды с цитокинами. На 4 день индуцировали созревание ДК в присутствии ЛПС. Для получения антиген-активированных ДК на 4 день проводили стимуляцию инфекционным антигеном Opisthorchis felineus. Для фенотипической характеристики ДК исследовали уровень экспрессии CD209 (PerCP); костимулирующей молекулы - CD86/B7-2 (FITC); молекулы антигенного представления МНС I и II классов (HLA-DR, FITC) и маркера терминальной дифференцировки дендритных клеток - CD83 (РЕ) методом проточной цитофлюориметрии.
В рамках подбора дозы антигена использовали серийные разведения Opisthorchis felineus в трех рабочих концентрациях - 160, 40 и 10 мкг/мл, при этом конечная концентрация антигена в культуральной лунке составляла 40, 10 и 2.5 мкг/мл. Все выбранные концентрации антигена (40, 10, 2.5 мкг/мл) в присутствии ЛПС оказались достаточными для индукции созревания ДК, однако использование дозы антигена 40 мкг/мл приводило к наиболее выраженной экспрессии фенотипических маркеров на поверхности ДК. При этом клетки оставались жизнеспособными и обладали зрелым фенотипом. Анализ уровня жизнеспособности клеток проводили на основании измерения содержания ДНК с применением внутриядерного красителя 7AAD, уровень клеточного апотоза не превышал 15%. Экспрессия поверхностного маркера CD209 на полученных ДК составила 69%; выявлено 35% и 40% экспрессии маркера терминальной дифференцировки (CD83) и костимулирующей молекулы CD86 соответственно. Выраженность маркера HLA-DR оказалась наибольшей и составила 95% соответственно.
Приложение
Фиг 1. Способ нагрузки дендритных клеток инфекционным антигеном (схема)
Фиг.2. Распределение клеток в зависимости от сигналов бокового (SSC) и переднего светорассеивания (FSC)
Примечание:
а - популяции мононуклеарных клеток здоровых обследуемых (градиент фиколла 1,077 г/см3)
б - популяции мононуклеарных клеток здоровых обследуемых (двойной градиент перколла, 1,131 г/см3)
R1 - % моноцитов от мононуклеаров периферической крови
R2 - % лимфоцитов от мононуклеаров периферической крови
Список источников информации
1. Ильинских Е.Н. Актуальные вопросы изучения проблемы описторхоза в Сибири. / Е.Н.Ильинских // Бюллетень сибирской медицины. - 2002. - №1. - с.63-69.
2. Огородова Л. Сравнительная характеристика содержания IgE у детей с атоническими заболеваниями, протекающими на фоне персистирующих инфекций. / Л.М.Огородова, О.В.Козина, В.Ф.Раенко и др. // Аллергология. - 2005. - №1. - с.13-17.
3. Способ получения стимулированных дендритных клеток для индукции иммунного ответа против туберкулеза человека: пат. 2401664 Рос.Федерация: МПК: А61К А61Р C12N / Е.А.Алямкина; заявл. 03.08.2009; опубл. 20.10.2010, Электрон, дан. - Режим доступа: http://bankpatentov.ru/node/46175
4. Способ получения зрелых дендритных клеток для индуцирования иммунного ответа и применение полученных клеток: ЕР 200801385: МПК: C12N 5/00 А61К 39/00 А61Р 35/00 А61Р 31/12 / А. Киркин; заявитель и патентообладатель. - Дандрит Биотек А/С; заявл. 08.12.2005; опубл. 30.10.2008, Бюл. №3 http://www.eapo.org/rus/bulletin/ea201103/HTML/015266.html
5. Шевченко Ю.А. Влияние антиген-активированных дендритных клеток на функциональные свойства мононуклеарных клеток периферической крови больных туберкулезом: дис. … канд. биол. наук / Ю.А.Шевченко. - Новосибирск, 2008. - 108 с.
6. Cai X.Q. Sequences and gene organization of the mitochondrial genomes of the liver flukes Opisthorchis viverrini and Clonorchis sinensis (Trematoda). / X.Q.Cai, G.H.Liu, H.Q.Song et al. // Parasitol. Res. - 2011. - May 31. [Epub ahead of print].
7. Hamilton C.M. The Fasciola hepatica tegumental antigen suppresses dendritic cell maturation and function. / C.M.Hamilton, D.J.Dowling, C.E.Loscher, R.M.Morphew et al // Infect. Immun. - 2009. - Vol.77(6). - P.2488-2498.
8. Stijn C.M. Schistosoma mansoni worm glycolipids induce an inflammatory phenotype in human dendritic cells by cooperation of TLR4 and DC-SIGN. / C.M.Stijn, S.Meyer, М.van den Broek, S.C.Bruijns, et al // Mol. Immunol. - 2010. - Vol.47 (7-8). - P.1544-1552.
9. Wongratanacheewin, S. Immunology and molecular biology of Opisthorchis viverrni infection. / S.Wongratanacheewin, R.W.Sermswan, S.Sirisinha // Acta tropica. - 2003. - Vol.88. - P.195-207.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИММУНОТЕРАПИИ ХРОНИЧЕСКОЙ ЧАСТО РЕЦИДИВИРУЮЩЕЙ ГЕРПЕС-ВИРУСНОЙ ИНФЕКЦИИ | 2011 |
|
RU2485962C1 |
| СПОСОБ ГЕНЕРАЦИИ АНТИГЕН-СПЕЦИФИЧЕСКИХ ПРОТИВОТУБЕРКУЛЕЗНЫХ КЛЕТОК | 2008 |
|
RU2378373C2 |
| Способ иммунотерапии рака молочной железы с помощью антиген-активированных дендритных клеток | 2016 |
|
RU2645464C1 |
| СПОСОБ ПОЛУЧЕНИЯ СТИМУЛИРОВАННЫХ ДЕНДРИТНЫХ КЛЕТОК ДЛЯ ИНДУКЦИИ ИММУННОГО ОТВЕТА ПРОТИВ ТУБЕРКУЛЕЗА ЧЕЛОВЕКА | 2009 |
|
RU2401664C1 |
| СПОСОБ ГЕНЕРАЦИИ АНТИГЕН-СПЕЦИФИЧЕСКИХ ЦИТОТОКСИЧЕСКИХ КЛЕТОК С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2458985C1 |
| СПОСОБ ГЕНЕРАЦИИ АНТИГЕН-СПЕЦИФИЧЕСКИХ ЦИТОТОКСИЧЕСКИХ КЛЕТОК С АКТИВНОСТЬЮ ПРОТИВ КЛЕТОК РАКА ЯИЧНИКА | 2012 |
|
RU2508298C2 |
| АУТОЛОГИЧНАЯ ВАКЦИНА ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2008 |
|
RU2392946C2 |
| Способ получения зрелых антиген-активированных дендритных клеток с трансфекцией РНК опухолевых клеток рака молочной железы | 2016 |
|
RU2631792C2 |
| СПОСОБ ГЕНЕРАЦИИ ЦИТОТОКСИЧЕСКИХ КЛЕТОК С АКТИВНОСТЬЮ ПРОТИВ КЛЕТОК НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО | 2014 |
|
RU2577992C2 |
| СПОСОБ ИММУНОТЕРАПИИ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА С | 2016 |
|
RU2637631C2 |
Изобретение относится к иммунологии и биотехнологии. Предложен способ нагрузки дендритных клеток инфекционным антигеном Opisthorchis felineus. Выделяют моноциты из МНК венозной крови с использованием двойного градиента плотности перколла: 47.5% SIP и 15% SIP, соответственно, при охлаждении до +4°С. Моноциты помещают в полную питательную культуральную среду с добавлением 20 нг/мл ИЛ4 и 20 нг/мл ГМ-КСФ. Проводят замену полной питательной культуральной среды на 3 сутки культивирования. Добавляют на 4 сутки культивирования антиген инфекционного происхождения Opisthorchis felineus в дозе 40 мкг/мл и одновременно индуцируют созревание дендритных клеток липополисахаридом E.coli серотипа 055:В5 в дозе 1 мкг/мл. На 6 сутки культивирования дендритные клетки отмывают и анализируют. Использование способа обеспечивает получение зрелых, нагруженных антигеном дендритных клеток, с выраженностью маркера HLA DR 95%, что может найти применение в терапии аллергических заболеваний. 2 ил.
Способ нагрузки дендритных клеток антигеном инфекционного происхождения Opisthorchis felineus, включающий выделение фракции периферических мононуклеарных клеток (МНК) из венозной крови, процедуру выделения моноцитов из МНК, помещение выделенных моноцитов в полную питательную культуральную среду с цитокинами и ростовыми факторами, индукцию созревания дендритных клеток с использованием липополисахаридов E.coli, отличающийся тем, что выделение моноцитов из МНК венозной крови проводят с использованием двойного градиента плотности перколла 47,5% SIP и 15% SIP соответственно, при охлаждении до 4°С, после чего выделенные моноциты помещают в полную питательную культуральную среду с добавлением 20 нг/мл ИЛ4 и 20 нг/мл ГМ-КСФ, при этом замену полной питательной культуральной среды с цитокинами и ростовыми факторами осуществляют на 3 стуки культивирования, дополнительно антиген инфекционного происхождения Opisthorchis felineus в дозе 40 мкг/мл добавляют на 4 сутки культивирования одновременно с липополисахаридом E.coli серотип 055:В5 в дозе 1 мкг/мл, после чего на 6 сутки культивирования дендритные клетки отмывают и анализируют методом проточной цитофлюориметрии.
| ЕА 200801385 A1, 30.10.2008 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| US 2004253574 A1, 16.12.2004. | |||
Авторы
Даты
2013-06-27—Публикация
2011-12-29—Подача