УРОВЕНЬ ТЕХНИКИ
Биополимеры природного происхождения не всегда имеют структурные или функциональные характеристики, требуемые для биомедицинских вариантов применения. Тем не менее, полимерные биоматериалы используются в биомедицинских вариантах применения, включающих покрытия медицинского оборудования, искусственные имплантаты и устройства для доставки лекарственных средств. Полимерные сетчатые структуры могут быть сформированы, например, путем сшивания растворов водорастворимых полимеров с образованием нерастворимой в воде полимерной сетчатой структуры. Механические и структурные характеристики можно регулировать, модифицируя плотность сшивания, от которой зависит размер пор сетчатой структуры, содержание воды и механические свойства.
Полимеры, матрицы или гели являются предпочтительными для тканевой инженерии, поскольку их материалы могут инкапсулировать клетки. Некоторые полимеры или гели имеют высокое содержание воды, сравнимое с тканевым влагосодержанием, которое обеспечивает возможность транспорта питательных веществ и отходов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В частности, описание настоящего изобретения представляет композицию, содержащую, по меньшей мере, одно мономерное звено биологически совместимого полимера, функционализированного имидом для формирования тканевого адгезива, гидрогеля или того и другого.
В еще одном варианте осуществления, по меньшей мере, одно из мономерных звеньев биологически совместимого полимера сопряжено со второй функциональной группой, которая может представлять собой имид. Вторая функциональная группа, если не является имидом, может быть любой известной функциональной группой и может придавать полимеру направленность.
Мономер может быть функционализирован, по меньшей мере, двумя функциональными группами. В общем и целом, когда полимер содержит несколько видов функциональных групп, полимер может содержать в основном равномолярные количества различных функциональных групп, или же соотношения могут варьировать согласно выбранной структуре.
Далее, функционализированные биологически совместимые полимерные композиции могут содержать по меньшей мере второй биосовместимый полимер, который реагирует с первым имидированным биологическим полимером. Таким образом, второй полимер может содержать функциональные группы, реакционноспособные по отношению к имиду или еще одной функциональной группе в первом имидированном полимере. Функциональная группа во втором полимере может представлять собой, например, аминогруппу.
Композиции согласно описанию настоящего изобретения могут дополнительно содержать биологически активный агент, такой как питательное вещество, клетка, такая как кровяная клетка или хондроцит, или недифференцированная клетка, такая как стволовая клетка, такая как гематопоэтическая стволовая клетка или мезенхимальная стволовая клетка.
В некоторых вариантах осуществления описываемые композиции представляют собой гидрогели с адгезивными свойствами.
Настоящее изобретение представляет композицию, содержащую биологически совместимый первый полимер, функционализированный имидной группой, и, необязательно, мостиковую молекулу, такую как функционализированный второй полимер, для создания медицинского адгезива. В некоторых вариантах осуществления первый полимер содержит по меньшей мере 10 мономерных звеньев, по меньшей мере, 100 мономерных звеньев или, по меньшей мере, 1000 или более мономерных звеньев. Мостиковая молекула может содержать множество функциональных групп для обеспечения реакции по меньшей мере с двумя молекулами первого полимера.
В полимере не все мономеры должны быть функционализированы реакционноспособным фрагментом.
Первый полимер может быть реакционноспособным по отношению к поверхности структуры, такой как биологическая структура, такая как орган, ткань или клетка, такие как поверхность хряща или кости, или искусственная структура, такая как протез. Второй функциональный фрагмент в первом имидированном полимере, который может представлять собой имид, также может быть реакционноспособным по отношению к поверхности. Первый полимер может быть реакционноспособным по отношению к мостиковой молекуле. Реакции могут протекать любыми способами, которые обеспечивают уровень адгезии, такими, как формирование ковалентной связи, физическое сшивание, ионное связывание или другой молекулярный механизм, который фиксирует молекулы на поверхности, структуре или организме, реакционноспособных по отношению к таковым, и связывает их с мостиковой молекулой.
В некоторых вариантах осуществления многообразные полимеры реагируют между собой с образованием многослойной полимерной структуры с открытыми поверхностями, реакционноспособными по отношению к поверхности, такой как ткань, и к мостиковой молекуле. Мостиковая молекула также может представлять собой многослойную структуру.
Дополнительные признаки и преимущества настоящего изобретения представлены в нижеследующем Подробном Описании Изобретения и будут очевидными из такового.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1-20 изображают разнообразные имиды, которые могут быть использованы в качестве реактантов для дериватизации описываемых мономера или полимера.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение отчасти относится к способу пластики или устранения дефекта ткани или органа, такому как герметизация разреза или раны. Способ включает наложение на поверхность биологически совместимого полимера, содержащего имид. Необязательно, поверхность может быть сначала обработана для создания реакционноспособных функциональных групп, которые могут реагировать с описываемым первым имидированным полимером.
Представляющие интерес гели, сетчатые структуры, конструкционные носители (скаффолды), пленки и тому подобные, изготовленные из описываемой(-ых) композиции(-ций), содействуют интеграции и росту клетки, ткани и органа. Необязательное присутствие клеток, таких как стволовые клетки, усиливает интеграцию и рост клетки, ткани и органа.
Существенным для описываемого продукта является улучшенная интеграция с окружающей тканью для повышения стабильности и связывания с биологической поверхностью и для формирования новой ткани. Исследования in vitro подтвердили эффективность химического механизма реагирования с поверхностью и повышенную механическую прочность на поверхности раздела между материалом и клеткой/тканью/органом.
Настоящее изобретение разрешает проблему формирования волокнистой хрящевой ткани в хирургической практике. Настоящее изобретение применимо, например, на ранней стадии остеоартрита суставов путем применения повязок и гелей для профилактики энзиматического разложения синовиальной жидкости во время и после имплантации. Настоящее изобретение также обеспечивает возможность стимуляции костного мозга без нарушения целостности субхондральной кости. Описываемые соединение или соединения могут быть использованы, например, в глазу, в позвоночнике, в костно-мышечной системе, в местах, где находится хрящ, и так далее.
Настоящее изобретение представляет способ полимеризации in situ для формирования конструкционных носителей (скаффолдов) и тому подобных, которые могут быть сформированы с приданием желательной формы согласно дефекту, способствуют развитию ткани путем стимулирования восстановления нативных клеток, и потенциально могут быть имплантированы с помощью минимальной инвазивной инъекции.
Это описание изобретения направлено, по меньшей мере отчасти, на полимеры, матрицы и гели, и способы получения и применения матриц, полимеров и гелей. Один из таких названных полимеров содержит имид.
Например, данное описание представляет функционализированный биологически совместимый первый полимер, такой как гиалуронат, кератан-сульфат, хондроитин-сульфат и тому подобные, замещенные имидом. Например, см. патентные заявки WO 2006089119, WO 2004029137, WO 2006105161 и WO 2006036681, приведенные в настоящем описании для сведения, о разнообразных вариантах применения подобных, но не имеющих отношения к описываемым соединениям. В таковых не упоминаются никакие имиды, или же изложение явно не касается употребления имидов.
Биологическая поверхность относится к наружной, открытой в окружающую среду части биологического материала или организма, такого как микроб, вирус, клетка, ткань, орган и тому подобные, с которыми биологически совместимый полимер может взаимодействовать, реагировать и/или к которым прилипать.
Биологически совместимый полимер относится к полимеру, который функционализирован для того, чтобы служить в качестве композиции для нанесения на поверхность. Полимер представляет собой полимер природного происхождения, или который нетоксичен для реципиента. Полимер содержит по меньшей мере имид. Полимер может быть гомополимером, где все мономеры являются одинаковыми, или гетерополимером, содержащим два или более типов мономеров. Термины «биосовместимый полимер», «биосовместимая сшитая полимерная матрица» и «биосовместимость», будучи использованными в отношении данных полимеров, являются общепринятыми в технологии и рассматриваются как эквивалентные друг другу, включая биологически совместимый полимер. Например, биосовместимые полимеры содержат полимеры, которые как нетоксичны для реципиента (например, животного или человека), так и не разлагаются (если полимер разлагается) в такой степени, при которой в реципиенте образуются мономерные или олигомерные субъединицы или прочие побочные продукты в токсических концентрациях.
Понятия «активный агент» и «биологически активный агент» употребляются в настоящем описании взаимозаменяемо для обозначения химического или биологического соединения, которое создает желательный фармакологический и/или физиологический эффект, который может быть профилактическим или терапевтическим. Термины также охватывают фармацевтически приемлемые, фармакологически активные производные таковых активных агентов, конкретно упоминаемых в настоящем описании, содержащие, но не ограничивающиеся таковыми, соли, сложные эфиры, амиды, пролекарства, активные метаболиты, аналоги и тому подобные. Когда употребляются термины «активный агент», «фармакологически активный агент» и «лекарственное средство», то это должно пониматься так, что изобретение содержит активный агент как таковой, а также фармацевтически приемлемые, фармакологически активные соли, сложные эфиры, амиды, пролекарства, метаболиты, аналоги и т.д. Активный агент может быть биологическим организмом, таким как вирус или клетка, будь то встречающимся в природе или искусственно измененным, таким как трансформированный.
Понятия «биосовместимый полимер», «биосовместимая сшитая полимерная матрица» и «биосовместимость» являются общепринятыми в технологии. Например, биосовместимые полимеры содержат полимеры, которые не токсичны сами по себе для реципиента (например, животного или человека), не деградируют (если полимер разлагается) в такой степени, при каковой в реципиенте образуются мономерные или олигомерные субъединицы или прочие побочные продукты в токсических концентрациях. В некоторых вариантах осуществления настоящего изобретения биодеградация в общем включает разложение полимера в организме, например, на его мономерные структурные субъединицы, которые могут быть известны как практически нетоксичные. Однако промежуточные олигомерные продукты, образовавшиеся в результате такого разложения, могут иметь различные токсикологические характеристики, или биодеградация может содержать окисление или прочие биохимические реакции, которые формируют молекулы, иные, нежели мономерные структурные субъединицы полимера. Таким образом, в некоторых вариантах осуществления токсикология биоразложимого полимера, предполагаемого для применения in vivo, такого как имплантация или инъекция пациенту, может быть определена после одного или более анализов на токсичность. Нет необходимости в 100%-ной чистоте исследуемой композиции, чтобы считать ее биосовместимой; на самом деле, необходимо только, чтобы исследуемые композиции были биосовместимыми, как изложено выше. Так, исследуемая композиция может содержать полимеры, содержащие 99%, 98%, 97%, 96%, 95%, 90%, 85%, 80%, 75% или даже менее биосовместимых полимеров, например, включая описываемые в настоящем описании полимеры и прочие материалы и эксципиенты, и по-прежнему быть биосовместимой.
Чтобы определить, является ли полимер или другой материал биосовместимым, может быть необходимым проведение анализа на токсичность. Такие тестирования хорошо известны в уровне техники. Один пример такого анализа может быть выполнен на живых клетках, таких как HeLa, 293, СНО и тому подобных. Образец частично или полностью разлагают, как известно в уровне техники, с использованием, например, химического реагента или ферментного препарата. Аликвоту продуктов обработки образца помещают в культуральные планшеты с предварительно высеянными клетками. Образцы продуктов инкубируют с клетками. Результаты анализа могут быть нанесены на график в виде процентов (%) относительного роста в зависимости от концентрации деградированного образца.
В дополнение, мономеры, полимеры, полимерные матрицы и композиции согласно настоящему изобретению также могут быть оценены хорошо известными тестами in vivo, такими как подкожные имплантации крысам, для подтверждения того, что они не вызывают значительных уровней раздражения или воспаления в местах подкожной имплантации.
Понятие «биоразложимые» является общепризнанным в технологии и включает мономеры, полимеры, полимерные матрицы, гели, композиции и составы, такие как описываемые в настоящем описании, которые предполагаются деградирующими во время употребления, такого как in vivo. Биоразложимые полимеры и матрицы типично отличаются от биологически неразложимых полимеров тем, что первые могут разлагаться во время употребления. В некоторых вариантах осуществления такое употребление включает применение in vivo, такое как терапию in vivo, и в других определенных вариантах осуществления такое употребление включает применение in vitro. В общем деградация, относимая к биоразложимости, включает деградацию биоразложимого полимера на его составные структурные субъединицы, или расщепление полимера, например, в результате биохимического процесса, на более мелкие неполимерные субъединицы. В некоторых вариантах осуществления в общем могут быть идентифицированы два различных типа биодеградации. Например, один тип биодеградации может содержать расщепление связей (будь то ковалентных или каких-то иных) в каркасе полимера. В таком биоразложении типично образуются мономеры и олигомеры, и, даже более типично, такая биодеградация происходит путем расщепления связи, соединяющей одну или более структурных субъединиц в полимере. Напротив, еще один тип биодеградации может содержать расщепление связи (будь то ковалентной или какой-то иной), находящейся в боковой цепи, или такой, каковая связывает боковую цепь, функциональную группу и тому подобные с каркасом полимера. Например, терапевтический препарат, биологически активный агент или другое химическое вещество, присоединенные в качестве боковой цепи к каркасу полимера, могут быть высвобождены в результате биодеградации. В некоторых вариантах осуществления во время применения полимера могут иметь место один или другой или оба общих типа биоразложения. Как используется в настоящем описании, термин «биодеградация» охватывает оба общих типа биологического разложения.
Скорость деградации биоразложимого полимера часто зависит в некоторой степени от множества факторов, в том числе химической природы связи, ответственной за любое разложение, молекулярной массы, кристалличности, биостойкости и степени сшивания такого полимера, физических характеристик имплантата, формы и размеров, и способа и местоположения введения. Например, чем больше молекулярная масса, чем выше степень кристалличности и/или чем выше биостойкость, тем обычно медленнее биодеградация любого биоразложимого полимера. Термин «биоразложимый» предполагается содержащим материалы и процессы, также называемые как «биологически эродируемые».
В определенных вариантах осуществления скорость биодеградации такого полимера может быть охарактеризована присутствием ферментов, например, хондроитиназы. При таких обстоятельствах скорость биодеградации может зависеть не только от химической природы и физических характеристик полимерной матрицы, но и от природы любого такого фермента.
В определенных вариантах осуществления полимерные составы согласно настоящему изобретению биологически деградируют в течение периода, который является приемлемым в желательном варианте применения. В определенных вариантах осуществления, таких как терапия in vivo, такая деградация происходит в течение периода времени, обычно меньшего, чем примерно пять лет, один год, шесть месяцев, три месяца, один месяц, пятнадцать дней, пять дней, три дня или даже один день воздействия физиологического раствора с величиной рН между 6 и 8, имеющего температуру между около 25 и 37°С. В других вариантах осуществления полимер разлагается в течение периода между примерно одним часом и несколькими неделями, в зависимости от желательного варианта употребления. В некоторых вариантах осуществления полимер или полимерная матрица могут содержать детектируемое средство, которое высвобождается при деградации.
Понятие «сшитый» в настоящем описании относится к композиции, содержащей межмолекулярные сшивки и, необязательно, внутримолекулярные сшивки, возникающие, в общем, в результате формирования ковалентных связей. Ковалентное связывание двух сшиваемых компонентов может быть прямым, в каковом случае атом в одном компоненте непосредственно соединяется с атомом в другом компоненте, или может быть опосредованным, через группу-связку. Сшитый гель или полимерная матрица, в дополнение к ковалентным связям, могут также содержать межмолекулярные и/или внутримолекулярные нековалентные связи, такие как водородные связи и электростатические (ионные) связи.
Понятие «функционализированный» относится к модификации существующего молекулярного сегмента или группы для формирования или для введения новой реакционноспособной или более реакционноспособной группы (например, имидной группы), которая способна вступать в реакцию с еще одной функциональной группой (например, аминогруппой) с образованием ковалентной связи. Например, карбоксильные кислотные группы могут быть функционализированы реакцией с карбодиимидным и имидным реагентом при использовании известных методик для формирования новой реакционноспособной функциональной группы в виде имидной группы, при замещении атома водорода в гидроксильной группе карбоксильной функции.
Понятие «гель» относится к состоянию объекта между жидким и твердым, и в общем определяется как сшитая полимерная сетчатая структура, набухшая в жидкой среде. Типично гель представляет собой двухфазную коллоидальную дисперсию, содержащую как твердое вещество, так и жидкость, в которой количество твердого вещества превышает таковое, которое в двухфазной коллоидальной дисперсии называется как «золь». Как таковой, «гель» имеет некоторые свойства жидкости (то есть форма является упругой и деформируемой) и некоторые свойства твердого тела (то есть форма является достаточно дискретной, чтобы поддерживать трехмерную конфигурацию на двумерной поверхности).
Понятие «время желатинирования», также называемое в настоящем описании как «время гелеобразования», относится к времени, которое затрачивается на то, чтобы композиция стала нетекучей в условиях умеренного напряжения. В общем это проявляется как достижение физического состояния, в котором модуль упругости, G', становится равным или превышает модуль вязкости, G”, то есть коэффициент затухания механических колебаний (тангенс дельта) становится равным 1 (как может быть определено с использованием общеупотребительных реологических методов).
Гидрогель представляет собой набухающую в воде полимерную матрицу, которая может поглощать воду с образованием упругого геля, в котором «матрицы» представляют собой трехмерные сетчатые структуры из макромолекул, удерживаемых вместе ковалентными или нековалентными связками. При помещении в водную окружающую среду сухие гидрогели набухают в результате захватывания в них жидкости до уровня, допускаемого степенью сшивки.
Гидрогели состоят из гидрофильных полимеров, сшитых с образованием набухающей в воде, нерастворимой полимерной сетчатой структуры. Сшивание может быть инициировано многими физическими или химическими механизмами. Фотополимеризация представляет собой метод ковалентного сшивания полимерных цепей, в котором фотоинициатор и раствор полимера (называемый как раствор «предгеля») подвергаются облучению источником света, специфическим для фотоинициатора. При активации фотоинициатор реагирует с конкретными функциональными группами в полимерных цепях, сшивая их с образованием гидрогеля. Реакция протекает быстро (3-5 минут) и проходит при комнатной температуре и температуре тела. Фотоиндуцируемое желатинирование обеспечивает возможность пространственного и временного контроля формирования конструкционного носителя (скаффолда), позволяя корректирование формы после инъекции и во время желатинирования in vivo. Клетки и биоактивные факторы могут быть легко внедрены в гидрогелевый скаффолд простым смешением с раствором полимера перед фотожелатинированием.
Альтернативно, реактанты могут содержать комплиментарные реакционноспособные группы, такие как имидная и аминогруппа, которые производят сшивание без необходимости применения внешнего инициатора.
Описываемые гидрогели могут представлять собой частично взаимопроникающие сетчатые структуры, которые способствуют восстановлению клеток, ткани и органа, в то же время препятствуя образованию шрама. Описываемые гидрогели являются дериватизированными, чтобы содержать имид, реакционноспособный по отношению к поверхности и/или второму представляющему интерес полимеру. Описываемые гидрогели также конфигурированы так, чтобы иметь вязкость, которая будет позволять желатинированному гидрогелю оставаться закрепленным в или на клетке, ткани или органе, или на поверхности. Вязкость может контролироваться используемыми мономерами и полимерами, уровнем воды, захваченной гидрогелем, и введенными загустителями, такими как биополимеры, такие как белки, липиды, сахариды и тому подобные. Пример такого загустителя представляет гиалуроновая кислота или коллаген.
Термин «полимер» применяется для обозначения молекул, составленных повторяющимися мономерными звеньями, включая гомополимеры, блок-сополимеры, гетерополимеры, статистические сополимеры, привитые сополимеры и так далее. «Полимеры» также включают линейные полимеры, а также разветвленные полимеры, причем разветвленные полимеры включают высокоразветвленные, дендритные и звездчатые полимеры.
Мономер представляет базовое повторяющееся звено в полимере. Мономер сам по себе может быть мономером или может быть димером или олигомером по меньшей мере из двух различных мономеров, каждый димер или олигомер повторяется в полимере.
Инициатор полимеризации относится к любому веществу, которое может инициировать полимеризацию мономеров или макромеров, например, генерированием свободных радикалов. Инициатор полимеризации часто представляет собой окисляющий реагент. Примерные инициаторы полимеризации включают таковые, которые активируются при воздействии, например, электромагнитного излучения или теплоты.
Понятия «введенный», «инкапсулированный» и «захваченный» являются общепризнанными в технологии, когда речь идет о терапевтическом препарате, красителе или другом материале и полимерной композиции, такой как композиция согласно настоящему изобретению. В определенных вариантах осуществления эти термины включают введение, приготовление состава или иным образом внедрение такого препарата в композицию, которая обеспечивает возможность длительного высвобождения такого препарата в желательном варианте применения. Термины могут предполагать любой образ действий, которым терапевтический препарат или другой материал вводится в полимерную матрицу, включая, например, присоединение к мономеру такого полимера (взаимодействием с образованием ковалентной связи или иными типами связывания) и вовлечение такого мономера в полимеризацию для получения полимерного состава, распределенного по всей полимерной матрице, закрепленного на поверхности полимерной матрицы (ковалентным или иными типами связывания), инкапсулированного внутри полимерной матрицы и т.д. Термин «совместное введение» или «совместное инкапсулирование» относится к введению терапевтического препарата или другого материала и по меньшей мере одного иного терапевтического агента или иного материала в описываемую композицию.
Более конкретно, физическая форма, в которой любой терапевтический препарат или иной материал инкапсулируется в полимеры, может варьировать в зависимости от конкретного варианта исполнения. Например, терапевтический агент или другой материал может быть сначала инкапсулирован в микросфере и затем скомбинирован с полимером таким образом, что сохраняется по меньшей мере часть структуры микросфер. Альтернативно, терапевтический препарат или другой материал может быть совершенно несмешивающимся с полимером согласно изобретению, то есть диспергируется в виде мелких капелек, но не растворяется в полимере. В настоящем изобретении любая форма инкапсулирования или введения рассматривается в такой мере, насколько длительное высвобождение любого инкапсулированного терапевтического агента или иного материала определяет, достаточно ли приемлема форма инкапсулирования для любого конкретного употребления.
Понятие «лечение» или «терапия» является общепризнанным в технологии термином, который включает исцеление, а также уменьшение интенсивности по меньшей мере одного симптома любого состояния или заболевания. Лечение включает профилактику заболевания, расстройства или состояния против возникновения у животного, которое может быть предрасположено к заболеванию, расстройству и/или состоянию, но еще не было диагностировано как заболевшее; подавление болезни, расстройства или состояния, например, препятствованием его развитию; и облегчение течения болезни, расстройства или состояния, например, обеспечением любой степени регрессии заболевания, расстройства или состояния. Далее, лечение болезни или состояния включает снижение интенсивности по меньшей мере одного симптома конкретного заболевания или состояния, даже если обусловливающая таковые патофизиология не затрагивается, или же прочие симптомы остаются на прежнем уровне.
Понятие «фармацевтически приемлемые соли» является общепризнанным в технологии и включает относительно нетоксичные соли, образованные присоединением неорганических и органических кислот к композициям согласно настоящему изобретению, содержащим, без ограничения, терапевтические препараты, эксципиенты, прочие материалы и тому подобные. Примеры фармацевтически приемлемых солей включают производные минеральных кислот, таких как соляная кислота и серная кислота, и производные органических кислот, таких как этансульфоновая кислота, бензолсульфоновая кислота, пара-толуолсульфоновая кислота и тому подобные. Примеры пригодных неорганических оснований для формирования солей включают гидроксиды, карбонаты и бикарбонаты аммония, натрия, лития, калия, кальция, магния, алюминия, цинка и тому подобных. Соли могут быть также образованы с использованием пригодных органических оснований, включая такие, которые являются нетоксичными и сильными в достаточной мере, чтобы образовывать такие соли. В плане иллюстрации, класс таких органических оснований может содержать моно-, ди- и триалкиламины, такие как метиламин, диметиламин и триметиламин; моно-, ди- или тригидроксиалкиламины, такие как моно-, ди- и триэтаноламин; аминокислоты, такие как аргинин и лизин; гуанидин; N-метилглюкозамин; N-метилглюкамин; L-глутамин; N-метилпиперазин; морфолин; этилендиамин; N-бензилфенэтиламин; три(гидроксиметил)аминоэтан; и тому подобные, например, см. статью в J. Pharm. Sci., том 66: стр. 1-19 (1977).
Понятие «профилактическое или терапевтическое лечение» является общепризнанным в технологии и включает введение реципиенту одной или более описываемых композиций. Если таковая вводится до клинического обнаружения неблагоприятного состояния (например, заболевания или иного нежелательного состояния у животного-реципиента), то лечение является профилактическим, то есть оно защищает реципиента от развития нежелательного состояния, тогда как если она вводится после обнаружения неблагоприятного состояния, лечение является терапевтическим (то есть оно предназначено для уменьшения, ослабления или стабилизирования существующего неблагоприятного состояния или побочных эффектов такового).
Термин «алифатический» является общепризнанным в технологии и включает линейные, разветвленные и циклические алканы, алкены или алкины. В определенных вариантах осуществления алифатические группы в настоящем изобретении являются линейными или разветвленными и имеют от 1 до около 20 атомов углерода.
Термин «алкил» является общепризнанным в технологии и включает насыщенные алифатические группы, содержащие линейноцепочечные алкильные группы, разветвленные алкильные группы, циклоалкильные (алициклические) группы, алкилзамещенные циклоалкильные группы и циклоалкилзамещенные алкильные группы. В определенных вариантах осуществления алкил с линейной цепью или разветвленной цепью имеет около 30 или менее атомов углерода в своем каркасе (например, С1-С30 для линейной цепи, С3-С30 для разветвленной цепи), и, альтернативно, около 20 или менее атомов углерода. Подобным образом, циклоалкильные фрагменты имеют от около 3 до около 10 атомов углерода в своей циклической структуре, и альтернативно около 5, 6 или 7 атомов углерода в кольцевой структуре.
Более того, термин «алкил» (или «низший алкил») включает как «незамещенные алкильные группы», так и «замещенные алкильные группы», последние из которых относятся к алкильным фрагментам, имеющим заместители, замещающие атомы водорода у одного или более атомов углерода углеводородного скелета. Такие заместители могут содержать, например, галоген, гидроксил, карбонил (такой как карбоксил, алкоксикарбонил, формил или ацил), тиокарбонил (такой как сложный тиоэфир, тиоацетат или тиоформиат), алкоксил, фосфорил, фосфонат, фосфинат, аминогруппу, амидную группу, амидиновый фрагмент, иминогруппу, цианогруппу, нитрогруппу, азидную группу, сульфгидрильную группу, алкилтиогруппу, сульфат, сульфонат, сульфамоильный фрагмент, сульфонамидный фрагмент, сульфонил, гетероциклический фрагмент, арилалкил, или ароматический или гетероароматический фрагмент. Квалифицированным специалистам в этой области технологии будет понятно, что фрагменты, служащие заместителями в углеводородной цепи, сами могут быть замещенными, если это приемлемо. Например, заместители в замещенном алкиле могут содержать замещенные и незамещенные формы аминогруппы, азидную группу, иминогруппу, амидную группу, фосфорил (в том числе фосфонат и фосфинат), сульфонил (в том числе сульфат, сульфонамидогруппа, сульфамоил и сульфонат), и силильные группы, а также простые эфиры, алкилтиогруппы, карбонильные группы (в том числе кетоны, альдегиды, карбоксилаты и сложные эфиры), -CF3, -CN и тому подобные. Примерные замещенные алкилы описаны ниже. Циклоалкильные фрагменты могут быть далее замещены алкильными, алкенильными, алкоксильными фрагментами, алкилтиогруппами, аминоалкильными, карбонилзамещенными алкильными группами, -CF3, -CN и тому подобными.
Термин «аралкил» является общепризнанным в технологии и включает арильные группы (например, ароматическую или гетероароматическую группу).
Термины «алкенил» и «алкинил» являются общепризнанными в технологии и включают ненасыщенные алифатические группы, аналогичные по длине и возможной замещенности вышеописанным алкильным группам, но которые содержат по меньшей мере одну двойную или тройную связь, соответственно.
Термин «гетероатом» является общепризнанным в технологии, и в органической молекуле в общем включает атом любого элемента, отличного от углерода или водорода. Иллюстративные гетероатомы включают бор, азот, кислород, фосфор, серу и селен.
Термин «арил» является общепризнанным в технологии и включает 5-, 6- и 7-членные моноциклические ароматические группы, которые могут содержать от нуля до четырех гетероатомов, например, фрагменты бензола, пиррола, фурана, тиофена, имидазола, оксазола, тиазола, триазола, пиразола, пиридина, пиразина, пиридазина и пиримидина, и тому подобные. Таковые арильные группы, имеющие гетероатомы в циклической структуре, могут также называться как «арилгетероциклы» или «гетероароматические группы». Ароматический цикл может быть замещен в одном или более положениях кольца такими заместителями, каковые описаны выше, например, галогеном, азидной группой, алкильной, арилалкильной, алкенильной, алкинильной, циклоалкильной, гидроксильной, алкоксильной группой, аминогруппой, нитрогруппой, сульфгидрильной группой, иминогруппой, амидным, фосфонатным, фосфинатным фрагментом, карбонильной, карбоксильной, силильной группой, простым эфирным фрагментом, алкилтиогруппой, сульфонильной, сульфонамидной, кетоновой, альдегидной, сложноэфирной группой, гетероциклическим фрагментом, ароматическими или гетероароматическими фрагментами, -CF3, -CN или тому подобными. Термин «арил» также включает полициклические кольцевые системы, имеющие две или более циклических структур, в которых два или более атомов углерода являются общими для двух примыкающих друг к другу циклов (циклы называются «конденсированными циклами»), в которых по меньшей мере одно из колец является ароматическим, например, прочие циклические фрагменты могут представлять собой циклоалкильные, циклоалкенильные, циклоалкинильные, арильные и/или гетероциклические фрагменты, или циклы соединены нециклическими фрагментами.
Термины «орто-», «мета-» и «пара-» являются общепризнанными в технологии и применяются для 1,2-, 1,3- и 1,4-дизамещенных циклогексанов, соответственно. Например, наименования «1,2-диметилбензол» и «орто-диметилбензол» являются синонимами.
Термины «гетероцикл» и «гетероциклическая группа» являются общепризнанными в технологии и включают циклические структуры от 3- до 10-членных, такие как циклы от 3- до 7-членных, кольцевые структуры которых содержат от одного до четырех гетероатомов. Гетероциклы могут быть также полициклическими. Гетероциклические группы включают, например, фрагменты тиофена, тиантрена, фурана, пирана, изобензофурана, хромена, ксантена, феноксантина, пиррола, имидазола, пиразола, изотиазола, изоксазола, пиридина, пиразина, пиримидина, пиридазина, индолизина, изоиндола, индола, индазола, пурина, хинолизина, изохинолина, хинолина, фталазина, нафтиридина, хиноксалина, хиназолина, циннолина, птеридина, карбазола, карболина, фенантридина, акридина, фенантролина, феназина, фенарсазина, фенотиазина, фуразана, феноксазина, пирролидина, оксолана, тиолана, оксазола, пиперидина, пиперазина, морфолина, лактонов, лактамов, таких как азетидиноны и пирролидиноны, сультамы, сультоны и тому подобные. Гетероциклическое кольцо может быть замещено в одном или более положениях такими заместителями, каковые описаны выше, как, к примеру, галогеном, алкильной, арилалкильной, алкенильной, алкинильной, циклоалкильной, гидроксильной группой, аминогруппой, нитрогруппой, сульфгидрильной группой, иминогруппой, амидным, фосфонатным, фосфинатным фрагментом, карбонильной, карбоксильной, силильной группой, простым эфирным фрагментом, алкилтиогруппой, сульфонильной, кетонной, альдегидной, сложноэфирной группой, гетероциклическим фрагментом, ароматическим или гетероароматическим фрагментом, -CF3, -CN или тому подобными.
Термины «полициклический фрагмент» или «полициклическая группа» являются общепризнанными в технологии и включают структуры с двумя или более циклами (например, циклоалкильные, иклоалкенильные, циклоалкинильные, арильные и/или гетерильные фрагменты), в которых два или более атомов углерода являются совместными для двух примыкающих друг к другу колец, например, циклы являются «конденсированными циклами». Кольца, которые соединены через не соседствующие атомы, например, когда для обоих циклов общими являются три или более атомов, называются «мостиковыми» циклами. Каждое из колец полициклической системы может быть замещено такими заместителями, каковые описаны выше, как, к примеру, галогеном, алкильной, арилалкильной, алкенильной, алкинильной, циклоалкильной, гидроксильной группой, аминогруппой, нитрогруппой, сульфгидрильной группой, иминогруппой, амидным, фосфонатным, фосфинатным фрагментом, карбонильной, карбоксильной, силильной группой, простым эфирным фрагментом, алкилтиогруппой, сульфонильной, кетонной, альдегидной, сложноэфирной группой, гетероциклическим фрагментом, ароматическим или гетероароматическим фрагментом, -CF3, -CN или тому подобными.
Термин «карбоцикл» является общепризнанным в технологии и включает ароматический или неароматический цикл, в котором каждый атом кольца представляет собой углерод. Приведенные ниже общепризнанные в технологии термины имеют следующие значения: «нитрогруппа» означает -NO2; термин «галоген» обозначает -F, -Cl, -Br или -I; термин «сульфгидрил» означает -SH; термин «гидроксил» или «гидрокси-» означает -ОН; и термин «сульфонил» означает -SO2-.
Термины «амин» и «амино» являются общепризнанными в технологии и включают как незамещенные, так и замещенные амины. Первичный амин содержит два атома водорода, вторичный амин содержит один атом водорода и еще один заместитель, и в третичном амине оба атома водорода замещены. Заместители для одного или обоих атомов водорода могут представлять собой, например, алкил, алкенил, арил, циклоалкил, циклоалкенил, гетероцикл, полицикл и так далее. Если оба атома водорода замещены карбонильными группами, заключенный между карбонилами атом азота формирует имид.
Термин «алкиламин» включает аминогруппу, как определено выше, имеющую присоединенную к ней замещенную или незамещенную алкильную группу.
Термин «амидо» является общепризнанным в технологии как аминозамещенный карбонил.
Термин «алкилтио» является общепризнанным в технологии и включает алкильную группу, как определено выше, имеющую присоединенный к ней сернистый радикал. В определенных вариантах осуществления «алкилтиольный» фрагмент представлен одним из -S-алкильного, -S-алкенильного, -S-алкинильного фрагментов и так далее. Показательные примеры алкилтиогрупп включают метилтиогруппу, этилтиогруппу и тому подобные.
Термин «карбонил» является общепризнанным в технологии и включает структуру С=О. Карбонильные группы входят в состав сложных эфиров; карбоксильных групп; формиатов; тиокарбонильных групп; сложных тиоэфиров; тиокарбоновых кислот; тиоформиатов; кетонов и альдегидов.
Термины «алкоксил» и «алкокси» являются общепризнанными в технологии и включают алкильную группу, как определено выше, имеющую присоединенный к ней кислородсодержащий радикал. Показательные примеры алкоксильных групп включают метокси-, этокси-, пропокси-, трет-бутоксигруппы и тому подобные.
«Простой эфир» представляет собой два углеводородных фрагмента, ковалентно связанных атомом кислорода. Соответственно этому, заместитель в алкиле, который делает этот алкил простым эфиром, представляет собой алкоксильную группу или сходен с таковой, например, которая может быть представлена одной из -О-алкильной, -О-алкенильной, -О-алкинильной групп и так далее.
Термин «сульфонат» является общепризнанным в технологии и включает фрагмент, в котором атом серы несет два атома кислорода, соединенные с ним двойными связями, и атом кислорода, соединенный с ним ординарной связью.
Термин «сульфат» является общепризнанным в технологии и включает фрагмент, который напоминает сульфонат, но включает два атома кислорода, соединенных с ним ординарными связями.
Термины «сульфонамид», «сульфамоил», «сульфонил» и «сульфоксидо» являются общепризнанными в технологии, и каждый из них может содержать разнообразные группы R в качестве заместителей, как в настоящем описании описано.
Термины «фосфорамидит» и «фосфонамидит» являются общепризнанными в технологии.
Термин «селеноалкил» является общепризнанным в технологии и включает алкильную группу, имеющую присоединенную к ней замещенную селенсодержащую группу. Примерные «простые селеноэфиры», которые могут быть замещенными в алкильной группе, выбираются из одного из -Se-алкильного, -Se-алкенильного, -Se-алкинильного фрагментов и так далее.
Замещения могут быть произведены в алкенильных или алкинильных группах, чтобы сделать их, например, аминоалкенильными, аминоалкинильными, амидоалкенильными, амидоалкинильными, иминоалкенильными, иминоалкинильными, тиоалкенильными, тиоалкинильными, карбонилзамещенными алкенильными или алкинильными группами.
«Углеводород» является общепризнанным в технологии термином и включает все допустимые соединения, имеющие по меньшей мере один атом водорода и один атом углерода. Например, допустимые углеводороды включают ациклические и циклические, разветвленные и неразветвленные, карбоциклические и гетероциклические, ароматические и неароматические органические соединения, которые могут быть замещенными или незамещенными.
Выражение «защитная группа» является общепризнанным в технологии и включает временные заместители, которые защищают потенциально реакционноспособную функциональную группу от нежелательных химических превращений. Примеры таких защитных групп включают сложные эфиры для карбоновых кислот, простые силиловые эфиры для спиртов и ацетали и кетали для альдегидов и кетонов, соответственно. Область химии защитных групп была обобщена, например, в книге авторов Greene et al., Protective Groups in Organic Synthesis (Защитные Группы в Органическом Синтезе), 2-ое издание, изд-во Wiley, Нью-Йорк, (1991).
Определение каждого выражения, например, алкил, арил и т.д., когда таковой имеет место более чем один раз в любой структуре, предполагается независимым от его определения где бы то ни было в той же структуре, если не оговорено нечто иное в прямой форме или не подразумевается в контексте.
Термины «трифлил», «тозил», «мезил» и «нонафлил» являются общепризнанными в технологии и относятся к трифторметансульфонильной, пара-толуолсульфонильной, метансульфонильной и нонафторбутансульфонильной группам, соответственно. Термины «трифлат», «тозилат», «мезилат» и «нонафлат» являются общепризнанными в технологии и относятся к сложноэфирным функциональным группам, представляющим собой сложный эфир трифторметансульфоновой кислоты, сложный эфир пара-толуолсульфоновой кислоты, сложный эфир метансульфоновой кислоты и сложный эфир нонафторбутансульфоновой кислоты, и к молекулам, которые содержат названные группы, соответственно.
Аббревиатуры Me, Et, Ph, Tf, Nf, Ts и Ms являются общепризнанными в технологии и представляют метильную, этильную, фенильную, трифторметансульфонильную, нонафторбутансульфонильную, пара-толуолсульфонильную и метансульфонильную группы, соответственно. Более полный список сокращений, употребляемых химиками-органиками, имеющими обычную квалификацию в технологии, публикуется в первом номере каждого тома журнала Journal of Organic Chemistry; этот список типично представляет собой таблицу, озаглавленную “Standard List of Abbreviations” («Список стандартных сокращений»).
Определенные мономерные структурные субъединицы согласно настоящему изобретению могут существовать в конкретных геометрических или стереоизомерных формах. В дополнение, полимеры и другие композиции согласно настоящему изобретению могут быть также оптически активными. Настоящее изобретение рассматривает все такие соединения, содержащие цис-изомеры и транс-изомеры, R-энантиомеры и S-энантиомеры, диастереомеры, (d)-изомеры, (l)-изомеры, рацемические смеси таковых и прочие смеси таковых, как попадающие в пределы области изобретения. В заместителе, таком как алкильная группа, могут присутствовать дополнительные асимметрические атомы углерода. Все такие изомеры, а также смеси таковых предполагаются включенными в настоящее изобретение.
Если, например, желателен конкретный энантиомер соединения согласно настоящему изобретению, он может быть получен асимметрическим синтезом или путем образования производного с хиральным центром, где образованную смесь диастереомеров разделяют, и группу с хиральным центром отщепляют, чтобы получить желательные чистые энантиомеры. Альтернативно, если молекула содержит оснόвную функциональную группу, такую как аминогруппа, или кислотную функциональную группу, такую как карбоксил, диастереомерные соли получают с использованием подходящих оптически активных кислоты или основания, с последующим разделением полученных таким образом диастереомеров фракционной кристаллизацией или хроматографическими средствами, хорошо известными в технологии, и последующим выделением чистых энантиомеров.
Будет понятно, что понятие «замещение» или «замещенный чем-то» включает подразумеваемое условие, что такое замещение находится в соответствии с допустимой валентностью замещенного атома и заместителя, и что замещение приводит к стабильному соединению, например, которое не претерпевает самопроизвольного превращения, такого как перегруппировка, циклизация, элиминирование или другая реакция.
Термин «замещенный» также рассматривается как содержащий все допустимые заместители как производные органических соединений, таких как представляющий интерес реагент для формирования имидного фрагмента. В широком аспекте, допустимые заместители включают ациклические и циклические, разветвленные и неразветвленные, карбоциклические и гетероциклические, ароматические и неароматические заместители органических соединений. Иллюстративные примеры заместителей включают, например, таковые, описанные выше. Допустимые заместители могут быть одним или несколькими, и одинаковыми или различающимися для соответствующих органических соединений. Для целей настоящего изобретения гетероатомы, такие как азот, могут иметь водородные заместители и/или заместители, допустимые для описываемых в настоящем описании органических соединений, которые заполняют валентности гетероатомов. Настоящее изобретение не предполагается быть ограниченным любым путем в плане допустимых заместителей органических соединений.
Для целей настоящего изобретения химические элементы идентифицированы в соответствии с Периодической Таблицей Элементов, версией CAS (Система классификации в Chemical Abstracts Service), руководством Handbook of Chemistry and Physics, 67-ое издание, 1986-1987 гг.
Функциональная группа или фрагмент, которые могут быть использованы для замещения, являются таковыми, которые способны быть посредниками в формировании полимера или реакции с поверхностью или другой молекулой. Функциональные группы включают разнообразные радикалы и химические объекты, описываемые в настоящем описании, и включают алкенильные фрагменты, такие как акрилаты, метакрилаты, диметакрилаты, олигоакрилаты, олигометакрилаты, этакрилаты, итаконаты или акриламиды. Дополнительные функциональные группы включают альдегиды. Прочие функциональные группы могут содержать мономеры с этиленовой ненасыщенностью, содержащие, например, алкиловые сложные эфиры акриловой или метакриловой кислоты, такие как метилметакрилат, этилметакрилат, бутилметакрилат, этилакрилат, бутилакрилат, гексилакрилат, н-октилакрилат, лаурилметакрилат, 2-этилгексилметакрилат, нонилакрилат, бензилметакрилат, гидроксиалкиловые сложные эфиры тех же кислот, такие как 2-гидроксиэтилакрилат, 2-гидроксиэтилметакрилат и 2-гидроксипропилметакрилат, нитрил и амиды тех же кислот, такие как акрилонитрил, метакрилонитрил и метакриламид, винилацетат, винилпропионат, винилиденхлорид, винилхлорид и винилзамещенные ароматические соединения, такие как стирол, трет-бутилстирол и винилтолуол, диалкилмалеаты, диалкилитаконаты, диалкилметиленмалонаты, изопрен и бутадиен. Подходящие мономеры с этиленовой ненасыщенностью, содержащие карбоксильные кислотные группы, включают акриловые мономеры, такие как акриловая кислота, метакриловая кислота, этакриловая кислота, итаконовая кислота, малеиновая кислота, фумаровая кислота, моноалкилитаконат, в том числе монометилитаконат, моноэтилитаконат и монобутилитаконат, моноалкилмалеат, в том числе монометилмалеат, моноэтилмалеат и монобутилмалеат, цитраконовая кислота и стиролкарбоновая кислота. Подходящие мономеры с несколькими этиленовыми двойными связями включают бутадиен, изопрен, аллилметакрилат, диакрилаты алкандиолов, такие как диакрилат бутандиола и диакрилат гександиола, дивинилбензол и тому подобные.
В некоторых вариантах осуществления мономерное звено биологически совместимого полимера может быть функционализировано одним или более тиольными фрагментами, остатками карбоновых кислот или спиртовыми фрагментами, расположенными на мономере биополимера. Например, в случае хондроитин-сульфата карбонильная группа может быть дериватизирована имидной группой с использованием, к примеру, карбодиимидного реагента. Спиртовая группа может быть дериватизирована, например, с помощью реакции Мицунобу, см. статью авторов Procter et al., Tetrahedron Letters, том 47 (№ 29), стр. 5151-5154, 2006.
В некоторых вариантах осуществления настоящее описание изобретения направлено на композицию, содержащую, по меньшей мере, одно мономерное звено биологически совместимого полимера, такого как гиалуроновая кислота, гепарин-сульфат, кератан-сульфат и тому подобные, функционализированное имидом. Такие исходные молекулы представляют собой природные компоненты внеклеточного матрикса. Однако, в общем, в качестве полимера может быть использован любой биологически совместимый полимер, содержащий в себе по меньшей мере имид. Прочие подходящие полимеры включают таковые, которые встречаются в природе, такие как GAG (глюкозаминогликан), мукополисахарид, коллаген или протеогликановые компоненты, такие как гиалуроновая кислота, гепарин-сульфат, глюкозамины, дерматаны, кератаны, гепараны, гиалуронан, аггрекан и тому подобные.
В некоторых вариантах осуществления настоящее описание изобретения направлено на композицию, содержащую, по меньшей мере, одно мономерное звено сахарида или другого биосовместимого полимера или полимера, в котором мономеры имеют реакционноспособные точки, которые будут обеспечивать возможность по меньшей мере введения имида или прочих функциональных групп, такого как хондроитин-сульфат. Хондроитин-сульфат представляет собой природный компонент хряща и может быть полезным материалом скаффолда для регенерации. Хондроитин-сульфат включает структурные звенья глюкозаминогликанов, имеющих молекулярную массу 10-60 тысяч Дальтонов (кДа). Повторяющиеся структурные единицы, или мономерные звенья, хондроитин-сульфата состоят из дисахарида, β(1→4)связанного D-глюкуронил-β(1→3)-N-ацетил-D-галактозаминсульфата.
Имид согласно настоящему изобретению не ограничивается любым одним реактантом из таковых, ряд которых известен в технологии и применим в контексте настоящего изобретения, то есть для получения промежуточного производного, которое не претерпевает быстрого самопроизвольного разложения, но является стабильным в достаточной мере, чтобы прореагировать, например, с аминогруппой в желательной молекуле, в которой имид, будучи гидроксилированным и имеющим атом кислорода в качестве точки связывания, регенерируется в виде гидроксиимида и замещается функциональной группой в желательной молекуле. Примеры имидов приведены на Фигурах 1-20, например, сукцинимид.
Сшитые полимерные матрицы согласно настоящему изобретению могут содержать и формировать гидрогели. Содержание воды в гидрогеле может давать информацию о пористости структуры. Далее, содержание воды может быть фактором, который, обусловливает, например, выживание клеток, инкапсулированных внутри гидрогеля. Количество воды, которое гидрогель способен поглотить, может быть соотнесено с плотностью сшивки и/или размером пор. Например, процентное содержание имидных связок в функционализированном макромере, таком как хондроитин-сульфат или кератин-сульфат, может определять количество воды, которое может быть поглощено.
Композиции согласно настоящему изобретению могут содержать мономеры, макромеры, олигомеры, полимеры или смеси таковых. Полимерные композиции могут состоять исключительно из ковалентно сшиваемых полимеров, или полимеров, сшиваемых ионными взаимодействиями, или полимеров, сшиваемых в результате окислительно-восстановительных реакций, или полимеров, сшиваемых водородными связями, или любых комбинаций таковых. Реагенты должны быть в основном гидрофильными и биосовместимыми.
Пригодные гидрофильные полимеры, служащие в качестве первого и второго полимеров, включают синтетические полимеры, такие как полиэтиленгликоль, полиэтиленоксид, частично или полностью гидролизованный поливиниловый спирт, поливинилпирролидон, полиэтилоксазолин, блок-сополимеры полиэтиленоксида и полипропиленоксида (полоксамеры и мероксаполы), полоксамины, карбоксиметилцеллюлоза и гидроксиалкилированные целлюлозы, такие как гидроксиэтилцеллюлоза и метилгидроксипропилцеллюлоза, и природные полимеры, такие как полипептиды, полисахариды или углеводы, такие как FicollTM (синтетический сополимер сахарозы и эпихлоргидрина), полисахароза, гиалуроновая кислота, декстран, гепаран-сульфат, хондроитин-сульфат, гепарин, или альгинат, и белки, такие как желатин, коллаген, альбумин или овальбумин, или сополимеры или смеси таковых. Как используется в настоящем описании, термин «целлюлозы» включает целлюлозу и производные вышеописанных типов; «декстран» включает декстран и подобные производные такового.
Также применимы полисахариды или другие биологически совместимые полимеры, которые представляют собой очень вязкие жидкости или которые являются тиксотропными, и формируют гель по прошествии длительного времени в результате медленного развития структуры. Например, может быть использована гиалуроновая кислота, которая может формировать инъецируемый гель с консистенцией, подобной гелю для укладки волос. В особенности полезными являются модифицированные производные гиалуроновой кислоты. Как используется в настоящем описании, термин «модифицированные гиалуроновые кислоты» относится к химически модифицированным гиалуроновым кислотам. Модифицированные гиалуроновые кислоты могут быть спроектированы и синтезированы с предварительно подобранными химическими модификациями для регулирования скорости и степени сшивки и биодеградации. Например, могут быть спроектированы и синтезированы модифицированные гиалуроновые кислоты, которые этерифицированы относительно гидрофобной группой, такой как пропионовая кислота или фенилуксусная кислота, чтобы сделать полимер более гидрофобным и гелеобразующим, или которые привиты аминами для способствования электростатической самосборке. Тем самым могут быть синтезированы модифицированные гиалуроновые кислоты, которые являются инъецируемыми, то есть они могут быть текучими при напряжении, но сохраняют гелеобразную структуру, когда нагрузка отсутствует. Гиалуроновая кислота и гиалуроновые производные доступны на рынке от фирм Genzyme, Кембридж, Массачусетс, и Fidia, Италия.
Альтернативно, биологически совместимый полимер может быть введен в описываемую матрицу с образованием композита. Тем самым молекула, такая как гиалуроновая кислота или коллаген, может быть введена в описываемую матрицу. Может быть желательной реакционная способность такого введенного биополимера. Поэтому аминогруппы во введенном полимере могут быть реакционноспособными по отношению к компонентам описываемой матрицы, которая может давать композитную структуру с более высоким модулем. Альтернативно, для обеспечения преимущественных свойств полимера в композите без существенного влияния на модуль, таких как сохранение адгезивности к тканям, введенный полимер может быть функционализирован для снижения активности любых реакционноспособных функциональных групп в нем. Таким образом, например, аминогруппы в полимере, таком как коллаген, могут быть функционализированы, к примеру, введением алкильной группы, ацетильной группы и так далее, как излагается в настоящем описании, чтобы сделать полимер менее реакционноспособным по отношению к имидным группам.
Способы синтеза вышеописанных полимеров известны квалифицированным специалистам в этой области технологии, например, см. издание Concise Encyclopedia of Polymer Science and Polymeric Amines and Ammonium Salts, под редакцией E. Goethals (издательство Pergamon Press, Элмсфорд, Нью-Йорк, 1980). Многие полимеры, такие как полиакриловая кислота, имеются в продаже на рынке. Полимеры природного происхождения могут быть выделены из биологических источников, как известно в технологии, или имеются в продаже на рынке. Встречающиеся в природе и синтетические полимеры могут быть модифицированы с использованием химических реакций, технологически разработанных и описанных, например, в книге автора March “Advanced Organic Chemistry”, 4-ое издание, 1992, издательство Wiley-Interscience, Нью-Йорк.
Показательные варианты осуществления изобретения включают способ получения имидированного сахарида, мономерного или полимерного фрагмента, где способ может содержать применение, например, карбодиимидного промежуточного продукта, и имидного реактанта для образования дериватизированного имидом мономера. Примеры карбодиимидов включают N,N'-дициклогексилкарбодиимид (DCC), N,N'-диизопропилкарбодиимид (DIC) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC). В технологии известны другие способы имидирования молекулы.
Для модифицирования полимеров, которые могут затем подвергаться радикальной полимеризации, существуют разнообразные химические подходы. Например, для введения метакрилатных групп в один или более мономеров полимерной цепи могут быть использованы метакриловый ангидрид, метакрилоилхлорид и глицидилметакрилат. Глицидилметакрилат может быть применен, например, для повышения эффективности реакции. Далее, реагенты для модифицирования могут быть подобраны для оптимизации условий отсутствия цитотоксических побочных продуктов.
В некоторых вариантах осуществления количество каждой из функциональных групп на полимерный блок может составлять по меньшей мере один фрагмент примерно на 10 мономерных звеньев, по меньшей мере, около 2 фрагментов примерно на 10 мономерных звеньев, и вплоть до одной или более функциональных групп на мономер. Альтернативно, количество функциональных групп на полимерный блок может составлять по меньшей мере один фрагмент примерно на 12 мономерных звеньев, примерно на 14 мономерных звеньев или более. Например, может наличествовать, по меньшей мере, одна имидная группа на десять мономерных звеньев.
Более того, соотношение между каждым из имидов и другой функциональной группой может составлять 5:1, 9:2, 4:1, 7:2, 3:1, 5:2, 2:1, 3:2, 1:1, 2:3, 1:2, 2:5, 1:3, 2:7, 1:4, 2:9 или 1:5 вдоль всей длины полимера. Предпочтительно каждый из имидов и другая функциональная группа равномерно распределены вдоль длины полимера. Однако расположение функциональных групп может быть конфигурировано так, чтобы они размещались неслучайным образом или регулярно, например, будучи сконцентрированными в определенных местах полимерного каркаса для предполагаемого использования. Поэтому группы могут быть изолированными в различных положениях полимера. Если в стороне от имида есть две или более других функциональных групп, отношение каждой из функциональных групп к другой таковой может варьировать от единицы до любого другого отношения или отношений согласно выбранной структуре.
Представлена композиция, содержащая сшитую полимерную матрицу, в которой названная сшитая полимерная матрица включает по меньшей мере один имидированный биологически совместимый полимер. В некоторых вариантах осуществления названная сшитая полимерная матрица далее включает по меньшей мере два имидированных биосовместимых полимера. В других вариантах осуществления сшитая полимерная матрица далее включает второй биосовместимый полимер, содержащий одну или более функциональных групп, реакционноспособных по отношению к функциональным группам названного первого имидированного полимера, такие как аминогруппы, каковые находятся, например, в белке.
Вспомогательная молекула, которая может связывать описываемые имидированные биополимеры друг с другом, такая как аминосодержащий полимер, то есть мостиковая молекула, в общем представляет собой полимер, который содержит множество реакционноспособных мест, в котором названные реакционноспособные места являются такими, которые реагируют с точками, находящимися в описываемом имидированном биологически совместимом полимере. Мостиковая молекула предпочтительно является биосовместимой. Мостиковая молекула, как и имидированный биологически совместимый полимер, может быть биоразложимой. Мостиковая молекула может быть сконфигурирована в виде многослойной структуры, в которой внутренние слои могут быть одинаковыми или различающимися при условии, что поверхностные наружные слои наличествуют с открытой функциональной группой для реагирования с точками на имидированном полимере, который может представлять собой прилипающий к ткани полимер.
Пригодные полимеры для описываемых имидированного полимера и мостиковой молекулы включают биосовместимые мономеры с периодически повторяющимися структурными единицами, находящимися в сложных полифосфоэфирах, полилактидах, полигликолидах, поликапролактонах, полиангидридах, полиамидах, полиуретанах, сложных полиэфирамидах, полиортоэфирах, полидиоксанонах, полиацеталях, поликеталях, поликарбонатах, полиортокарбонатах, полифосфазенах, полигидроксибутиратах, полигидроксивалератах, полиалкиленоксалатах, полиалкиленсукцинатах, полималеиновых кислотах, полиаминокислотах, поливиниловом спирте, поливинилпирролидоне, полиэтиленгликоле, полигидроксицеллюлозе, хитине, хитозане, и сополимерах, тройных сополимерах или комбинациях или смесях вышеназванных материалов. Например, полимер может быть замещенным, чтобы содержать аминогруппы.
Прочие подходящие синтетические полимеры включают полимеры, содержащие аминогруппы, такие как химически синтезированные полипептиды. Такие полипептиды могут содержать полинуклеофильные полипептиды, которые были синтезированы для введения аминокислот, содержащих первичные аминогруппы, например, лизина, и/или аминокислот, содержащих тиольные группы (таких как цистеин). Далее, подходящие синтетические полимеры включают полиаминокислоты.
Другие соединения, которые могут содержать аминогруппы, включают белки, такие как альбумин. Альбумин может быть животного происхождения от млекопитающих, но могут быть также использованы прочие источники альбумина. Например, может быть использован бычий сывороточный альбумин (BSA). Альтернативно, альбумин может быть рекомбинантным альбумином, выделенным из клеток с экспрессированным геном рекомбинантного альбумина, при использовании известных в технологии методов. Главные фрагменты альбумина, содержащие по меньшей мере 100 остатков альбуминовой последовательности, будь то полученные частичным протеолизом или с помощью рекомбинантных средств, также могут быть использованы в качестве мостиковой молекулы вместо интактного альбумина. Альтернативно, применимые фрагменты могут содержать по меньшей мере 50 остатков, и более предпочтительно по меньшей мере 75 остатков альбуминовой последовательности. Наконец, могут быть также применены смеси различных форм альбумина (например, человеческого, бычьего, рекомбинантного, фрагментированного), и фракции плазмы, обогащенные альбумином. Альбумин может быть очищен непосредственно из тканей или клеток, с использованием методов, хорошо известных в технологии.
Будучи используемыми, инициаторы полимеризации включают электромеханическое излучение. Инициирование полимеризации может быть произведено путем облучения светом с длиной волны между около 200 до около 700 нм, или более около 320 нм или выше, или даже около 365 нм.
Примерами прочих инициаторов являются органические растворимые в растворителях инициаторы, такие как бензоилпероксид, азобисизобутиронитрил (AIBN), ди-трет-бутилпероксид и тому подобные, водорастворимые инициаторы, такие как персульфат аммония (APS), персульфат калия, персульфат натрия, тиосульфат натрия и тому подобные, окислительно-восстановительные инициаторы, которые представляют собой комбинации такого инициатора и тетраметилэтилена, соли двухвалентного железа (Fe2+), гидросульфит натрия или подобное восстановители и т.д.
Пригодные фотоинициаторы представляют собой такие, которые могут быть употреблены для инициирования полимеризации мономеров, имеющих минимальную цитотоксичность, генерированием свободных радикалов. В некоторых вариантах осуществления инициаторы могут действовать в пределах короткого периода времени, например, минут или секунд. Примерные красители для инициирования ультрафиолетовым (UV) или видимым светом включают этилэозин, 2,2-диметокси-2-фенилацетофенон, 2-метокси-2-фенилацетофенон, прочие производные ацетофенона и камфорхинон.
Другие фотоокисляемые и фотовосстанавливаемые красители, которые могут быть применены для инициирования полимеризации, включают акридиновые красители, например, продукт “Acriblarine”; тиазиновые красители, например, тионин; ксантиновые красители, например, бенгальский розовый; и феназиновые красители, например, метиленовый голубой. Таковые могут быть использованы с сокатализаторами, такими как амины, например, триэтаноламином; соединениями серы; гетероциклами, например, имидазолом; енолятами; металлоорганическими соединениями; и прочими соединениями, такими как N-фенилглицин. Другие инициаторы включают камфорхиноны и производные ацетофенона.
Могут быть также применены системы термического инициирования полимеризации. Такие системы, которые нестабильны при температуре 37°С и инициировали бы радикальную полимеризацию при физиологических температурах, включают, например, персульфат калия с тетраметилэтилендиамином или без такового; бензоилпероксид с триэтаноламином или без такового; и персульфат аммония с бисульфитом натрия.
Альтернативно, первый имидированный полимер может самопроизвольно реагировать с поверхностью, такой как ткань или протез. Первый имидированный полимер также может реагировать со вторым биосовместимым полимером. Два реактанта могут быть смешаны до нанесения, нанесены одновременно и так далее, как известно в технологии, для обеспечения полимеризации двух полимеров. При необходимости может быть применен инициатор, согласно избранному варианту применения.
Сшитые полимерные матрицы согласно настоящему изобретению могут формировать и могут содержать гидрогели. Содержание воды в гидрогеле может давать информацию о пористости структуры. Далее, содержание воды может быть фактором, который, обусловливает, например, выживание клеток, инкапсулированных внутри гидрогеля. Количество воды, которое гидрогель способен поглотить, может быть соотнесено с плотностью сшивки или размером пор. Например, процентное содержание метакрилатных групп в функционализированном полимере может влиять на количество воды, которое может быть поглощено.
Например, полиэтиленоксид-диакрилат (PEODA), несущий имид, может быть использован в полимерной системе для тканевой инженерии, и сшитые полимерные матрицы могут содержать совместно желатинированные CS-I (хондроитин-сульфат-имид) и полиэтиленоксид-диакрилат (PEODA).
Механические свойства сшитой полимерной матрицы, такой как скаффолд, также могут быть соотнесены с пористой структурой. Для употребления в тканевой инженерии могут быть желательными скаффолды с различными механическими характеристиками в зависимости от желательного клинического применения. Например, скаффолды для тканевой инженерии хряща в искусственном суставе должны выдерживать более высокие механические напряжения, чем система тканевой инженерии хряща в других местах тела. Таким образом, полимеры с механическими свойствами, которые легко регулируются, могут быть желательными и могут быть получены согласно избранному варианту применения.
Цитотоксичность системы биополимерного скаффолда может быть оценена с помощью любых пригодных клеток, таких как фибробласты, например, с использованием флуоресцентного анализа клеточного цикла живых и убитых клеток, и МТТ (бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолия), соединения, которое активно метаболизируется в клетке с изменением окраски с желтой на пурпурную, как излагается выше, и как известно в технологии.
В одном аспекте настоящего изобретения может быть приготовлена композиция, содержащая сшитую полимерную матрицу или гель, и один или больше биологически активных агентов. Биологически активный агент может широко варьировать в зависимости от предполагаемого назначения композиции. Термин «активный» является общепризнанным в технологии и относится к любому веществу, которое представляет собой биологически, физиологически или фармакологически активную субстанцию, которая действует локально или системно в субъекте. Примеры биологически активных агентов, которые могут быть названы как «лекарственные средства», описаны в хорошо известных литературных источниках, таких как Merck Index, The Physician's Desk Reference и The Pharmacological Basis of Therapeutics, и они включают, без ограничения, лекарственные препараты; витамины; минеральные добавки; субстанции, употребляемые для терапии, профилактики, диагностики, лечения или смягчения болезни или заболевания; субстанции, которые воздействуют на структуру или функцию тела; или пролекарства, которые становятся биологически активными или более активными после того, как они были помещены в физиологическое окружение. Могут быть использованы разнообразные формы биологически активного агента, которые способны высвобождаться из описываемой композиции, например, в соседнюю ткань или текучие среды при введении субъекту. В некоторых вариантах осуществления биологически активный агент может быть применен в сшитой полимерной матрице согласно настоящему изобретению, например, для способствования формированию хряща. В других вариантах осуществления биологически активный агент может быть использован в сшитой полимерной матрице согласно настоящему изобретению для лечения, улучшения, подавления или предотвращения заболевания или симптома, в сочетании, например, со способствованием формированию хряща.
Дальнейшие примеры биологически активных агентов включают, без ограничения, ферменты, антагонисты или агонисты рецепторов, гормоны, факторы роста, аутогенный костный мозг, антибиотики, антибактериальные препараты и антитела. Термин «биологически активный агент» также предполагается содержащим разнообразные типы клеток и генов, которые могут быть внедрены в композиции согласно изобретению.
В определенных вариантах осуществления описываемые композиции содержат биологически активный агент в количестве от около 1% до около 75% или более по весу от всей композиции, альтернативно около 2,5%, 5%, 10%, 20%, 30%, 40%, 50%, 60% или 70%.
Неограничивающие примеры биологически активных агентов включают следующее: средства, блокирующие адренэргические синапсы, анаболические препараты, андрогенные стероиды, антациды, антиастматические средства, антиаллергенные материалы, антихолестериновые и антилипидные препараты, антихолинэргики и симпатомиметики, антикоагулянты, антиконвульсанты, антидиарейные препараты, антиэметики, антигипертензивные средства, противоинфекционные средства, противовоспалительные препараты, такие как стероиды, нестероидные противовоспалительные средства, противомалярийные препараты, противоманиакальные препараты, противорвотные средства, антинеопластические агенты, препараты против ожирения, антипаркинсонические препараты, антипиретики и анальгетические препараты, антиспазматические агенты, противотромботические средства, препараты против урикемии, средства против стенокардии, антигистаминные препараты, противокашлевые средства, подавители аппетита, бензофенантридиновые алкалоиды, биологические агенты, кардиотонические средства, церебральные дилататоры, коронарные дилататоры, противоотечные средства, диуретики, диагностические препараты, эритропоэтические средства, эстрогены, отхаркивающие средства, желудочно-кишечные болеутоляющие средства, агенты, гипергликемические препараты, снотворные препараты, гипогликемические препараты, ионообменные смолы, слабительные средства, минеральные добавки, митотики, муколитические средства, факторы роста, нервно-мышечные лекарственные препараты, питательные вещества, периферические вазодилататоры, препараты, способствующие наступлению или сохранению беременности, простагландины, антидепрессанты, психотропные препараты, седативные средства, стимуляторы, тиреоидные и антитиреоидные препараты, транквилизаторы, маточные релаксанты, витамины, антигенные материалы и пролекарства.
Конкретные примеры применимых биологически активных агентов вышеуказанных категорий включают: (а) антинеопластики, такие как ингибиторы андрогенных рецепторов, антиметаболиты, цитотоксические препараты и иммуномодуляторы; (b) противокашлевые средства, такие как декстрометорфана гидробромид, носкапин, карбэтапентана цитрат и клофедианола гидрохлорид; (с) антигистаминные средства, такие как хлорфенирамин, фениндамина тартрат, пириламин, доксиламина сукцинат и фенилтолоксамина цитрат; (d) противоотечные средства, такие как гидрохлорид, гидрохлорид фенилпропаноламина, псевдоэфедрина гидрохлорид и эфедрин; (е) разнообразные алкалоиды, такие как кодеина фосфат, кодеина сульфат и морфин; (f) минеральные добавки, такие как хлорид калия, хлорид цинка, карбонат кальция, оксид магния и прочие соли щелочных металлов и щелочноземельных металлов; (g) ионообменные смолы, такие как N-ацетилпрокаинамид; (i) антипиретики и анальгетики, такие как ацетаминофен, аспирин и ибупрофен; подавители аппетита, такие как фенилпропаноламин или каффеин; (k) отхаркивающие средства, такие как гвайфенезин; (l) антациды, такие как гидроксид алюминия и гидроксид магния; биологические добавки, такие как пептиды, полипептиды, белки и аминокислоты, гормоны, интерфероны или цитокины, и прочие биоактивные пептидные соединения, такие как кальцитонин, ANF (атриальный натрийуретический пептид), ЕРО (эритропоэтин) и инсулин; (n) противоинфекционные препараты, такие как противогрибковые средства, противовирусные препараты, антисептики и антибиотики; и (m) десенсибилизирующие средства и антигенные материалы, такие как средства, применимые для вакцинаций.
Более конкретно, неограничивающие примеры применимых биологически активных агентов включают следующие терапевтические категории: анальгетики, такие как нестероидные противовоспалительные лекарственные средства, агонисты опиатных рецепторов и салицилаты; антигистаминные препараты, такие как Н1-блокаторы и Н2-блокаторы; противоинфекционные средства, такие как антигельминты, антианаэробные препараты, антибиотики, аминогликозидные антибиотики, противогрибковые антибиотики, цефалоспориновые антибиотики, макролидные антибиотики, антибиотики широкого спектра действия, пенициллиновые антибиотики, хинолоновые антибиотики, сульфонамидные антибиотики, тетрациклиновые антибиотики, антимикобактериальные препараты, противотуберкулезные антимикобактериальные препараты, антипротозойные препараты, антималярийные антипротозойные препараты, противовирусные средства, антиретровирусные препараты, агенты, убивающие чесоточных клещей и противоинфекционные препараты для лечения мочевых инфекций; антинеопластические агенты, такие как алкилирующие средства, алкилирующие средства на основе азотистого иприта, алкилирующие средства на основе нитрозомочевины, антиметаболиты, пуриновые аналоги антиметаболитов, пиримидиновые аналоги антиметаболитов, гормональные антинеопластические средства, природные антинеопластики, антибиотические природные антинеопластики и природные антинеопластики группы алкалоидов винка; средства против вегетативных нарушений, такие как антихолинергические препараты, противомускариновые антихолинергические препараты, алкалоиды спорыньи, парасимпатомиметики, парасимпатомиметические холинэргические агонисты, парасимпатомиметические холинэстеразные ингибиторы, симпатолитические средства, симпатолитические альфа-блокаторы, симпатолитики, симпатомиметики и симпатомиметические адренэргические агонисты; сердечно-сосудистые препараты, такие как средства против стенокардии, препараты против ишемической болезни сердца, антиангинальные средства группы блокаторов кальциевых каналов, нитратные антиангинальные средства, антиаритмические препараты, антиаритмические препараты группы сердечных гликозидов, антиаритмические препараты I класса, антиаритмические препараты II класса, антиаритмические препараты III класса, антиаритмические препараты IV класса, антигипертензивные средства, антигипертензивные α-блокаторы, антигипертензивные средства группы ингибитора ангиотензинпревращающего фермента (Акф-ингибитора), антигипертензивные L3-блокаторы, антигипертензивные средства группы блокаторов кальциевых каналов, адренэргические антигипертензивные средства центрального действия, диуретические антигипертензивные средства, антигипертензивные средства группы периферических вазодилататоров, антилипемические средства, антилипемические средства на основе веществ, усиливающих экскрецию желчной кислоты, антилипемические средства на основе ингибиторов редуктазы, инотропы, инотропы группы сердечных гликозидов и тромболитические средства; дерматологические препараты, такие как антигистаминные средства, противовоспалительные средства, кортикостероидные противовоспалительные средства, анестетики, антибактериальные препараты местного действия, антибактериальные препараты местного применения, противовирусные противоинфекционные препараты местного действия и антинеопластики местного действия; электролитические и почечные препараты, такие как подкисляющие средства, подщелачивающие средства, диуретики, диуретики группы ингибиторов карбоангидразы, петлевые диуретики, осмотические диуретики, аккумулирующие калий диуретики, тиазидные диуретики, электролитические заместители и средства, способствующие выведению мочевой кислоты; ферменты, такие как панкреатические ферменты и тромболитические ферменты; желудочно-кишечные препараты, такие как противодиарейные средства, антиэметики, желудочно-кишечные противовоспалительные средства, салицилатные желудочно-кишечные противовоспалительные средства, антацидные противоязвенные препараты, противоязвенные препараты группы ингибиторов протонного насоса в секреции кислоты желудочного сока, противоязвенные препараты, действующие на слизистую оболочку желудка, противоязвенные препараты группы Н2-блокаторов, холинолитические средства, средства, стимулирующие пищеварение, рвотные препараты, слабительные средства и размягчители стула, и прокинетические средства; анестетики общего действия, такие как ингаляционные анестетики, галогенированные ингаляционные анестетики, внутривенные анестетики, барбитуратные внутривенные анестетики, бензодиазепиновые внутривенные анестетики и внутривенные анестетики группы агонистов опиатных рецепторов; гематологические препараты, такие как противоанемические средства, гематопоэтические противоанемические средства, коагуляторные средства, антикоагулянты, гемостатические коагуляторные средства, коагуляторные средства группы ингибиторов агрегации тромбоцитов, коагуляторные средства на основе тромболитических ферментов и расширители объема плазмы; гормоны и модификаторы гормонов, такие как абортивные средства, адренальные средства, кортикостероидные адренальные препараты, андрогены, антиандрогены, антидиабетические препараты, антидиабетические препараты на основе сульфонилмочевины, антигипогликемические средства, оральные контрацептивы, прогестиновые контрацептивы, эстрогены, препараты, способствующие зачатию, средства, стимулирующие родовую деятельность, паратиреоидные средства, гормоны гипофиза, прогестины, антитиреоидные препараты, тиреоидные гормоны и токолитики; иммунобиологические препараты, такие как иммуноглобулины, иммуносуппрессоры, токсоиды и вакцины; местные анестетики, такие как амидные местные анестетики и сложноэфирные местные анестетики; средства против мышечно-скелетных болей, такие как противоподагрические противовоспалительные препараты, кортикостероидные противовоспалительные средства, противовоспалительные средства на основе соединений золота, иммуносуппрессорные противовоспалительные средства, нестероидные противовоспалительные лекарственные препараты, салицилатные противовоспалительные средства, релаксанты скелетной мускулатуры, релаксанты скелетной мускулатуры групп нейромышечных блокаторов и релаксанты скелетной мускулатуры групп обратимых нейромышечных блокаторов; неврологические препараты, такие как антиконвульсанты, барбитуратные антиконвульсанты, бензодиазепиновые антиконвульсанты, препараты против мигрени, антипаркинсонические препараты, средства против головокружения, агонисты опиатных рецепторов и антагонисты опиатных рецепторов; офтальмологические препараты, такие как средства против глаукомы, митотические агенты, мидриатики, мидриатики группы агонистов адренергических рецепторов, антимускариновые мидриатики, офтальмические анестетики, офтальмические противоинфекционные средства, офтальмические аминогликозидные противоинфекционные средства, офтальмические макролидные противоинфекционные средства, офтальмические хинолоновые противоинфекционные средства, офтальмические сульфонамидные противоинфекционные средства, офтальмические тетрациклиновые противоинфекционные средства, офтальмические противовоспалительные средства, офтальмические кортикостероидные противовоспалительные средства и офтальмические нестероидные противовоспалительные лекарственные препараты; психотропные препараты, такие как антидепрессанты, гетероциклические антидепрессанты, трициклические антидепрессанты на основе ингибиторов моноаминоксидазы и селективных ингибиторов обратного захвата серотонина, противоманиакальные препараты, нейролептические средства, фенотиазиновые нейролептические препараты, анксиолитики, седативные средства и снотворные препараты; барбитуратные седативные препараты и снотворные средства, бензодиазепиновые анксиолитики, седативные средства и снотворные препараты, и психостимуляторы; респираторные средства, такие как противокашлевые средства, бронходилататоры, бронходилататоры группы агонистов адренергических рецепторов, антимускариновые бронходилататоры, экспекторанты, муколитические препараты, респираторные противовоспалительные препараты и респираторные кортикостероидные противовоспалительные препараты; токсикологические средства, такие как антидоты, средства фиксации тяжелых металлов, препараты против злоупотребления алкоголем или наркотиками, сдерживающие средства против злоупотребления алкоголем или наркотиками и средства снятия абстиненции при злоупотреблении алкоголем или наркотиками; минералы; и витамины, такие как витамин А, витамин В, витамин С, витамин D, витамин Е и витамин К.
Другие классы биологически активных агентов из вышеназванных категорий включают: (1) анальгетические препараты в общем, такие как лидокаин, прочие «каиновые» анальгетики или производные таковых, и анальгетические нестероидные противовоспалительные лекарственные средства (NSAIDs), в том числе диклофенак, ибупрофен, кетопрофен и напроксен; (2) анальгетики группы агонистов опиатных рецепторов, такие как кодеин, фентанил, гидроморфон и морфин; (3) салицилатные анальгетики, такие как аспирин (ASA) (аспирин с энтеросолюбильным покрытием); (4) антигистаминные препараты группы Н1-блокаторов, такие как клемастин и терфенадин; (5) антигистаминные препараты группы Н2-блокаторов, такие как циметидин, фамотидин, низадин и ранитидин; (6) противоинфекционные средства, такие как мупироцин; (7) антианаэробные противоинфекционные препараты, такие как хлорамфеникол и клиндамицин; (8) противогрибковые антибиотические противоинфекционные препараты, такие как амфотерицин В, клотримазол, флуконазол и кетоконазол; (9) макролидные антибиотические противоинфекционные препараты, такие как ацитромицин и эритромицин; (10) антибиотические противоинфекционные препараты с широким спектром действия, такие как имипенем; пенициллиновые антибиотические противоинфекционные препараты, такие как нафциллин, оксациллин, пенициллин G и пенициллин V; (12) хинолоновые антибиотические противоинфекционные препараты, такие как ципрофлоксацин и норфлоксацин; (13) тетрациклиновые антибиотические противоинфекционные препараты, такие как доксициклин, миноциклин и тетрациклин; (14) противотуберкулезные антимикобактериальные противоинфекционные средства, такие как изониазид и рифампин; (15) антипротозойные противоинфекционные препараты, такие как атоваквон и дапсон; (16) противомалярийные антипротозойные противоинфекционные препараты, такие как хлороквин и пириметамин; (17) антиретровирусные противоинфекционные препараты, такие как ритонавир и зидовудин; (18) противовирусные противоинфекционные препараты, такие как ацикловир, ганцикловир, α-интерферон и римантадин; (19) алкилирующие антинеопластические средства, такие как карбоплатин и цисплатин; (20) алкилирующие антинеопластические средства на основе нитрозомочевины, такие как кармустин (BCNU); (21) антиметаболитические антинеопластические средства, такие как метотрексат; (22) пиримидиновые аналоги антинеопластических препаратов, такие как фторурацил (5-FU) и гемцитабин; (23) гормональные антинеопластические средства, такие как гозерелин, леупролид и тамоксифен; (24) природные антинеопластические средства, такие как альдеслейкин, интерлейкин-2, доцетаксел, этопозид, α-интерферон, паклитаксел, другие таксановые производные, и третиноин (ATRA); (25) антибиотические природные антинеопластические средства, такие как блеомицин, дактиномицин, даунорубицин, доксорубицин и митомицин; (26) природные антинеопластические средства группы алкалоидов винка, такие как винбластин и винкристин; (27) средства, воздействующие на вегетативную нервную систему, такие как никотин; (28) антихолинергические средства воздействия на вегетативную нервную систему, такие как бензтропин и тригексилфенидил; (29) антимускариновые антихолинергические средства воздействия на вегетативную нервную систему, такие как атропин и оксибутинин; (30) средства воздействия на вегетативную нервную систему на основе алкалоидов спорыньи, такие как бромокриптин; (31) парасимпатомиметики группы агонистов холинергических рецепторов, такие как пилокарпин; (32) парасимпатомиметики группы ингибиторов холинэстеразы, такие как пиридостигмин; (33) симпатолитики группы а-адреноблокаторов, такие как празозин; (34) симпатолитики группы D-блокаторов, такие как атенолол; (35) адренергические симпатолитики, такие как альбутерол и добутамин; (36) сердечно-сосудистые препараты, такие как аспирин (ASA) (аспирин с энтеросолюбильным покрытием); (37) антиангинальные средства группы D-блокаторов, такие как атенолол и пропранолол; (38) антиангинальные средства группы блокаторов кальциевых каналов, такие как нифедипин и верапамил; (39) нитратные антиангинальные средства, такие как изосорбида динитрат (ISDN); (40) антиаритмические средства группы сердечных гликозидов, такие как (41) антиаритмические средства I класса, такие как лидокаин, мексилетин, фенитоин, прокаинамид и хинидин; (42) антиаритмические средства класса, такие как атенолол, метопролол, пропранолол и тимолол; (43) антиаритмические средства класса, такие как амиодарон; (44) антиаритмические средства IV класса, такие как дилтиазем и верапамил; (45) антигипертензивные средства, такие как празозин; (46) антигипертензивные средства группы ингибитора ангиотензинпревращающего фермента (Акф-ингибитора), такие как каптоприл и эналаприл; (47) антигипертензивные средства, такие как атенолол, метопролол, надолол и пропанолол; (48) антигипертензивные средства групп блокаторов кальциевых каналов, такие как дилтиазем и нифедипин; (49) адренергические антигипертензивные средства центрального действия, такие как клонидин и метилдопа; (50) диуретические антигипертензивные средства, такие как амилорид, фуросемид, гидрохлоротиазид (HCTZ) и спиронолактон; (51) антигипертензивные средства группы периферических вазодилататоров, такие как миноксидил; (52) антилипемические средства, такие как гемфиброзил и пробукол; (53) антилипемические средства на основе веществ, усиливающих экскрецию желчной кислоты, такие как холестирамин; (54) антилипемические средства на основе ингибиторов редуктазы, такие как ловастазин и правастазин; (55) инотропы, такие как амринон, добутамин и допамин; (56) инотропы группы сердечных гликозидов, такие как (57) тромболитические средства, такие как альтеплаза (ТРА), анистреплаза, стрептокиназа и урокиназа; (58) дерматологические препараты, такие как колхицин, изотретиноин, метотрексат, миноксидил, третиноин (59) дерматологические кортикостероидные противовоспалительные средства, такие как бетаметазон и дексаметазон; (60) противогрибковые противоинфекционные препараты местного действия, такие как амфотерицин, клотримазол, миконазол и нистатин; (61) противовирусные противоинфекционные препараты местного действия, такие как ацикловир; (62) антинеопластики местного действия, такие как (63) электролитические и почечные препараты, такие как лактулоза; (64) петлевые диуретики, такие как фуросемид; (65) аккумулирующие калий диуретики, такие как триамтерен; (66) тиазидные диуретики, такие как гидрохлортиазид (HCTZ); (67) средства, способствующие выведению мочевой кислоты, такие как пробенецид; (68) ферменты, такие как (69) тромболитические ферменты, такие как альтеплаза, анистреплаза, стрептокиназа и урокиназа; (70) антиэметики, такие как прохлорперазин; (71) салицилатные желудочно-кишечные противовоспалительные средства, такие как сульфасалазин; (72) противоязвенные препараты группы ингибиторов протонного насоса в секреции кислоты желудочного сока, такие как омепразол; (73) противоязвенные препараты группы Н2-блокаторов, такие как циметидин, фамотидин, низатидин, ранитидин; (74) средства, стимулирующие пищеварение, такие как панкрелипаза; (75) прокинетические препараты, такие как эритромицин; (76) внутривенные анестетики группы агонистов опиатных рецепторов, такие как фентанил; (77) гематопоэтические противоанемические средства, такие как (G-CSF, гранулоцитарный колониестимулирующий фактор) и (GM-CSF, гранулоцитарно-макрофагальный колониестимулирующий фактор); (78) коагуляторные средства, такие как антигемофильные факторы 1-10 (AHF 1-10); (79) антикоагулянты, такие как варфарин; (80) коагуляторные средства на основе тромболитических ферментов, такие как альтеплаза, анистреплаза, стрептокиназа и урокиназа; (81) гормоны и модификаторы гормонов, такие как бромокриптин; (82) абортивные средства, такие как метотрексат; (83) антидиабетические препараты, такие как инсулин; (84) оральные контрацептивы, такие как эстроген и прогестин; (85) прогестиновые контрацептивы, такие как левоноргестрел и норгестрел; (86) эстрогены, такие как сопряженные эстрогены, диэтилстильбэстрол (DES), эстроген (эстрадиол, эстрон и эстропипат); (87) препараты, способствующие зачатию, такие как кломифен, человеческий хорионический гонадотропин (HCG) и менотропины; (88) паратиреоидные средства, такие как кальцитонин; (89) гипофизарные гормоны, такие как десмопрессин, гозерелин, окситоцин и вазопрессин (ADH); (90) прогестины, такие как медроксипрогестерон, норэтиндрон и прогестерон; (91) тиреоидные гормоны, такие как левотироксин; (92) иммунобиологические препараты, такие как интерферон бета-lb и интерферон гамма-lb; (93) иммуноглобулины, такие как иммуноглобулин IM, IMIG, IGIM и иммуноглобулин IVIG, IGIV; (94) амидные местные анестетики, как лидокаин; (95) сложноэфирные местные анестетики, такие как бензокаин и прокаин; (96) мышечно-скелетные кортикостероидные противовоспалительные средства, такие как беклометазон, бетаметазон, кортизон, дексаметазон, гидрокортизон и преднизон; (97) мышечно-скелетные иммуносуппрессорные противовоспалительные средства, такие как азатиоприн, циклофосфамид и метотрексат; (98) мышечно-скелетные нестероидные противовоспалительные лекарственные препараты, такие как диклофенак, ибупрофен, кетопрофен, кеторлак и напроксен; (99) релаксанты скелетной мускулатуры, такие как диазепам; (100) релаксанты скелетной мускулатуры группы обратимых нейромышечных блокаторов, такие как пиридостигмин; (101) неврологические препараты, такие как нимодипин, рилузол, такрин и тиклопидин; (102) антиконвульсанты, такие как карбамазепин, габапентин, ламотриджин, фенитоин и вальпроевая кислота; (103) барбитуратные антиконвульсанты, такие как фенобарбитал и примидон; (104) бензодиазепиновые антиконвульсанты, такие как клоназепам, диазепам и лоразепам; (105) антипаркинсонические препараты, такие как бромокриптин, леводопа, карбидопа и перголид; (106) средства против головокружения, такие как меклизин; (107) агонисты опиатных рецепторов, такие как кодеин, фентанил, гидроморфон, метадон и морфин; (108) антагонисты опиатных рецепторов, такие как налоксон; (109) средства против глаукомы, такие как тимолол; (110) митотические средства против глаукомы, такие как пилокарпин; (111) офтальмические аминогликозидные противоинфекционные средства, такие как гентамицин, неомицин и тобрамицин; (112) офтальмические хинолоновые противоинфекционные средства, такие как ципрофлоксацин, норфлоксацин и офлоксацин; (113) офтальмические кортикостероидные анти-агенты, такие как дексаметазон и преднизолон; (114) офтальмические нестероидные противовоспалительные лекарственные препараты, такие как диклофенак; (115) нейролептические средства, такие как клозапин, галоперидол и рисперидон; (116) бензодиазепиновые анксиолитики, седативные средства и снотворные препараты, такие как клоназепам, диазепам, лоразепам, оксазепам и празепам; (117) психостимуляторы, такие как метилфенидат и пемолин; (118) такие как кодеин; (119) бронходилататоры, такие как (120) бронходилататоры группы агонистов адренергических рецепторов, такие как альбутерол; (121) респираторные кортикостероидные противовоспалительные препараты, такие как дексаметазон; (122) антидоты, такие как флумазенил и налоксон; (123) средства фиксации тяжелых металлов, такие как пеницилламин; (124) сдерживающие средства против злоупотребления алкоголем или наркотиками, такие как дисульфирам, нальтрексон и никотин; (125) средства снятия абстиненции при злоупотреблении алкоголем или наркотиками, такие как бромокриптин; (126) минералы, такие как железо, кальций и магний; (127) производные витамина В, такие как цианокобаламин (витамин В12) и ниацин (витамин В3); (128) соединения витамина С, такие как аскорбиновая кислота; и (129) витамин D, такой как кальцитриол.
Далее, могут быть использованы рекомбинантные или выделенные из клеток белки, такие как: рекомбинантный бета-глюкан; концентрат бычьего иммуноглобулина; бычья супероксиддисмутаза; состав, содержащий фторурацил, эпинефрин и бычий коллаген; рекомбинантный гирудин (r-Hir), HIV-1 иммуноген; рекомбинантный гормон роста человека, рекомбинантный эритропоэтин (r-EPO); ген-активированный эритропоэтин (GA-EPO); рекомбинантный человеческий гемоглобин (r-Hb); рекомбинантный человеческий мекасермин (r-IGF-1); рекомбинантный β-интерферон; ленограстим (G-CSF); оланзапин; рекомбинантный тиреоидстимулирующий гормон (r-TSH); и топотекан.
Еще далее, могут быть также применены перечисленные ниже пептиды, белки и прочие крупные молекулы, такие как интерлейкины 1-18, включая мутанты и аналоги; интерфероны α, β, и которые могут быть полезными для регенерации хряща, гонадотропин-высвобождающий гормон (LHRH) и аналоги; гонадотропин-высвобождающий гормон, трансформирующий фактор роста (TGF); фактор роста фибробластов (FGF); фактор некроза опухоли α и β; фактор роста нервов (NGF); фактор, высвобождающий гормон роста (GHRF), эпидермальный фактор роста (EFG), остеогенные факторы, активированные соединительной тканью, фактор, гомологичный фактору роста фибробластов (FGFHF); фактор роста гепатоцитов (HGF); инсулин-подобный фактор роста (IGF); фактор-2 ингибирования инвазии (IIF-2); костные морфогенетические белки 1-7 (ВМР 1-7); соматостатин; тимозин-α-γ-глобулин; супероксиддисмутаза (SOD); и комплементарные факторы, и биологически активные аналоги, фрагменты и производные таких факторов, например, факторы роста.
Члены супергенного семейства трансформирующих факторов роста (TGF), которые представляют собой многофункциональные регуляторные белки, могут быть введены в полимерную матрицу согласно настоящему изобретению. Члены супергенного семейства трансформирующих факторов роста (TGF) включают трансформирующие факторы роста бета (например, TGF-β1, TGF-β2, TGF-β3); костные морфогенетические белки (например, ВМР-1, ВМР-2, ВМР-3, ВМР-4, ВМР-5, ВМР-6, ВМР-7, ВМР-8, ВМР-9); гепарин-связывающие факторы роста (например, фактор роста фибробластов (FGF), эпидермальный фактор роста (EFG), тромбоцитарный фактор роста (PDGF), инсулин-подобный фактор роста (IGF)), (например, Ингибин A, Ингибин B), факторы дифференциации роста (например, GDF-1); и Активины (например, Активин А, Активин В, Активин АВ). Факторы роста могут быть выделены из нативных, или природных источников, таких как клетки млекопитающих, или могут быть приготовлены синтетическим путем, таким как техника рекомбинантной ДНК, или с помощью разнообразных химических процессов. В дополнение, могут быть применены аналоги, фрагменты и производные этих факторов, при условии, что они проявляют по меньшей мере некоторую биологическую активность нативной молекулы. Например, аналоги могут быть получены экспрессией генов, измененных в результате сайт-специфического мутагенеза, или другими способами генной инженерии.
Могут быть использованы разнообразные формы биологически активных агентов. Таковые включают, без ограничения, такие формы, как незаряженные молекулы, молекулярные комплексы, соли, простые эфиры, сложные эфиры, амиды, пролекарственные формы и тому подобные, которые являются биологически активными, будучи имплантированными, инъецированными или иным образом помещенными в субъекте.
В определенных вариантах осуществления в описываемые композиции могут быть введены другие материалы в дополнение к одному или более биологически активным агентам. Например, в композиции согласно настоящему изобретению могут быть внедрены пластификаторы и стабилизаторы, известные в технологии. В определенных вариантах осуществления такие добавки, как пластификаторы и стабилизаторы, выбираются по их биосовместимости или по конечным физическим свойствам реагентов, загущения или желирования матрицы или застывшей или желированной матрицы.
Композиция согласно настоящему изобретению может далее содержать одну или более вспомогательных субстанций или тому подобных. Такие дополнительные материалы могут влиять на характеристики конечной композиции. Например, с полимерной композицией могут быть связаны такие наполнители, как бычий сывороточный альбумин (BSA) или мышиный сывороточный альбумин (MSA). В определенных вариантах осуществления количество наполнителя может варьировать от около 0,1 до около 50% или более по весу от композиции. Введение таких наполнителей может обусловливать скорость длительного высвобождения любой инкапсулированной субстанции. Прочие наполнители, известные квалифицированным специалистам в этой области технологии, такие как углеводы, сахара, крахмалы, сахариды, целлюлозы и полисахариды, включая и сахарозу, могут быть использованы в определенных вариантах осуществления в настоящем изобретении.
В композиции для корректирования величины рН могут быть введены буферные реагенты, кислоты и основания. Могут быть также включены средства для увеличения дистанции диффузии агентов, высвобождаемых из композиции.
Заряд, липофильность или гидрофильность описываемой композиции могут быть модифицированы путем применения добавки. Например, поверхностно-активные вещества могут быть применены для усиления смешиваемости плохо смешивающихся жидкостей. Примеры пригодных поверхностно-активных веществ включают декстран, полисорбаты и лаурилсульфат натрия. В общем поверхностно-активные вещества употребляются в низких концентрациях, обычно менее, чем около 5%.
Конкретный способ, используемый для получения описываемых в настоящем описании новых составов, не является критически важным для настоящего изобретения и может быть выбран из физиологического буфера (авторы Felgner et al., Патент США № 5589466 (1996)).
Терапевтические составы продукта могут быть приготовлены для хранения в виде лиофилизированных составов или водных растворов смешением продукта, имеющего желательную степень чистоты, с необязательными фармацевтически приемлемыми носителями, разбавителями, вспомогательными добавками или стабилизаторами, типично употребляемыми в технологии, то есть буферными реагентами, стабилизирующими средствами, консервантами, агентами для обеспечения изотоничности растворов, неионными детергентами, антиоксидантами и прочими разнообразными добавками, см. издание Remington's Pharmaceutical Sciences, 16-ое издание, под редакцией Osol (1980). Такие добавки в общем нетоксичны для реципиента в употребляемых дозировках и концентрациях, поэтому эксципиенты, разбавители, носители и так далее являются фармацевтически приемлемыми.
«Выделенный» или «очищенный» описываемый полимер в основном не содержит загрязняющих белков, происходящих из среды или ткани, из которых был получен полимер, или в основном свободен от химических прекурсоров или других химических соединений или реактантов в использованной среде или реакционной смеси, которая содержит химически синтезированные компоненты. Таким образом, выделенный и очищенный имидированный полимер в основном не содержит неимидированного полимерного материала и включает в своем составе менее чем около 30%, 25%, 20%, 10%, 5%, 4%, 3%, 2,5%, 2%, 1,5% или 1% или менее (по сухому весу) неимидированных биополимерных загрязнений.
Как используется в настоящем описании, термины «стабильность» и «стабильный» в контексте жидкого состава, содержащего описываемый биополимер, означают, что он устойчив к термической и химической агрегации, деградации или фрагментации при данных условиях изготовления, подготовки, транспортирования и хранения, таких как в течение одного месяца, в течение двух месяцев, в течение трех месяцев, в течение четырех месяцев, в течение пяти месяцев, в течение шести месяцев или более. «Стабильные» составы согласно изобретению остаются биологически активными в степени, равной или превышающей 80%, 85%, 90%, 95%, 98%, 99% или 99,5% при данных условиях изготовления, подготовки, транспортирования и хранения. Стабильность названного состава может быть оценена по степеням агрегации, деградации или фрагментации методами, известными квалифицированным специалистам в этой области технологии.
Термин «носитель» относится к разбавителю, вспомогательной добавке, эксципиенту или среде, с которыми вводится терапевтическое средство. Такие физиологические носители могут представлять собой стерильные жидкости, такие как вода или масла, включая таковые нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобные. Вода является пригодным носителем, когда фармацевтическую композицию вводят внутривенно. Солевые растворы и водные растворы декстрозы и глицерина также могут быть использованы в качестве жидких носителей, в частности для инъецируемых растворов. подходящие фармацевтические эксципиенты включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, высушенное снятое молоко, глицерин, пропиленгликоль, воду, этанол и тому подобные. Если желательно, композиция может также содержать небольшие количества смачивателей или эмульгаторов, или буферных реагентов для регулирования величины рН.
Композиции могут принимать форму растворов, суспензий, эмульсий, порошков, составов с длительным высвобождением, депо и тому подобных. Примеры пригодных носителей описаны в издании “Remington's Pharmaceutical Sciences”, Martin. Такие композиции будут содержать эффективное количество описываемого биополимера, предпочтительно в очищенном виде, вместе с подходящим количеством носителя, чтобы обеспечить форму надлежащего введения пациенту. Как известно в технологии, состав готовят для соответствия способу введения.
Буферные агенты помогают поддерживать значение рН в диапазоне, который приблизительно соответствует физиологическим условиям. Буферные средства предпочтительно присутствуют в концентрации, находящейся в диапазоне от около 2 мМ до около 50 мМ. подходящие буферные реагенты для применения в настоящем изобретении включают как органические, так и неорганические кислоты и соли таковых, такие как цитратные буферы (например, смесь мононатриевой соли лимонной кислоты и динатриевой соли лимонной кислоты, смесь лимонной кислоты и тринатриевой соли лимонной кислоты, смесь лимонной кислоты и мононатриевой соли лимонной кислоты, и т.д.), сукцинатные буферы (например, смесь янтарной кислоты и мононатриевой соли янтарной кислоты, смесь янтарной кислоты и гидроксида натрия, смесь янтарной кислоты и динатриевой соли янтарной кислоты, и т.д.), тартратные буферы (например, смесь винной кислоты и тартрата натрия, смесь винной кислоты и тартрата калия, смесь винной кислоты и гидроксида натрия, и т.д.), фумаратные буферы (например, смесь фумаровой кислоты и мононатриевой соли фумаровой кислоты, смесь фумаровой кислоты и динатриевой соли фумаровой кислоты, смесь мононатриевой соли фумаровой кислоты и динатриевой соли фумаровой кислоты, и т.д.), глюконатные буферы (например, смесь глюконовой кислоты и глюконата натрия, смесь глюконовой кислоты и гидроксида натрия, смесь глюконовой кислоты и глюконата калия, и т.д.), оксалатные буферы (например, смесь щавелевой кислоты и оксалата натрия, смесь щавелевой кислоты и гидроксида натрия, смесь щавелевой кислоты и оксалата калия, и т.д.), лактатные буферы (например, смесь молочной кислоты и лактата натрия, смесь молочной кислоты и гидроксида натрия, смесь молочной кислоты и лактата калия, и т.д.) и ацетатные буферы (например, смесь уксусной кислоты и ацетата натрия, смесь уксусной кислоты и гидроксида натрия, и т.д.). Могут быть использованы фосфатные буферы, карбонатные буферы, гистидиновые буферы, соли триметиламина, такие как Tris, HEPES и прочие такие известные буферы.
Для замедления роста микроорганизмов могут быть добавлены консерванты, и могут быть внесены в количествах, варьирующих от 0,2% до 1% (отношение весовых частей к объему). Консерванты, подходящие для использования в настоящем изобретении, включают фенол, бензиловый спирт, мета-крезол, хлорид октадецилдиметилбензиламмония, галогениды бензалкония (например, хлорид, бромид и иодид), хлорид гексаметония, алкилпарабены, такие как метил- или пропилпарабен, пирокатехин, резорцин, циклогексанол и 3-пентанол.
Средства для обеспечения изотоничности растворов присутствуют для поддержания физиологической изотоничности жидких композиций согласно настоящему изобретению и содержат многоатомные углеводные спирты, предпочтительно трехатомные или высшие углеводные спирты, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит. Многоатомные спирты могут присутствовать в количестве между около 0,1% до около 25%, по весу, предпочтительно от 1% до 5%, в расчете на относительные количества прочих ингредиентов.
Стабилизаторы относятся к обширной категории эксципиентов, которые могут варьировать по своей функциональности от наполнителя до добавки, которая солюбилизирует терапевтическое средство или помогает предотвратить денатурацию или прилипание к стенке контейнера. Типичные стабилизаторы могут представлять собой многоатомные углеводные спирты; аминокислоты, такие как аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т.д.; органические сахара или углеводные спирты, такие как лактоза, трегалоза, стахиоза, арабит, эритрит, маннит, сорбит, ксилит, рибитол, миоинозит, галактит, глицерин и тому подобные, включая циклитолы, такие как инозит; полиэтиленгликоль; полимеры аминокислот; серосодержащие восстановители, такие как мочевина, глутатион, липоевая кислота, тиогликолят натрия, тиоглицерин, α-монотиоглицерин и тиосульфат натрия; полипептиды с низкой молекулярной массой (то есть <10 остатков); белки, такие как человеческий сывороточный альбумин, бычий сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон, сахариды, моносахариды, такие как ксилоза, манноза, фруктоза или глюкоза; дисахариды, такие как лактоза, мальтоза и сахароза; трисахариды, такие как раффиноза; полисахариды, такие как декстран, и так далее. Стабилизаторы могут присутствовать в диапазоне от 0,1 до 10000 весовых частей на весовую часть биополимера.
Дополнительные разнообразные эксципиенты включают наполнители (например, крахмал), хелатирующие реагенты (например, этилендиаминтетрауксусная кислота (EDTA)), антиоксиданты (например, аскорбиновая кислота, метионин или витамин Е) и сорастворители.
Как используется в настоящем описании, термин «поверхностно-активное вещество» относится к органическим субстанциям, имеющим амфипатическую структуру, а именно, составлены группами с противоположными характеристиками растворимости, типично маслорастворимой углеводородной цепью и водорастворимой ионной группой. Поверхностно-активные вещества могут быть классифицированы, в зависимости от заряда поверхностно-активного фрагмента, на анионные, катионные и неионные поверхностно-активные вещества. Поверхностно-активные вещества часто употребляются в качестве смачивающих агентов, эмульгаторов, солюбилизаторов и диспергаторов для разнообразных фармацевтических композиций и составов биологических материалов.
Неионные поверхностно-активные вещества или детергенты (также известные как «смачивающие агенты») могут быть добавлены для способствования растворению терапевтического средства, а также для защиты терапевтического белка от обусловленной перемешиванием агрегации, каковые также позволяют составу подвергаться поверхностным сдвиговым напряжениям, не вызывая денатурации белка. Подходящие неионные поверхностно-активные вещества включают полисорбаты (20, 80 и т.д.), полиоксамеры (184, 188 и т.д.), полиолы Pluronic® и простые моноэфиры полиоксиэтиленсорбитана (TWEEN-20®, TWEEN-80® и т.д.). Неионные поверхностно-активные вещества могут содержаться в диапазоне от около 0,05 мг/мл до около 1,0 мг/мл, предпочтительно от около 0,07 мг/мл до около 0,2 мг/мл.
Как используется в настоящем описании, термин «неорганическая соль» относится к любому соединению, не содержащему углерода, которое получается в результате замещения части или всех кислотных атомов водорода или кислоты металлом или группой, действующей подобно металлу, и часто применяется как соединение для корректирования тоничности фармацевтических композиций и составов биологических материалов. Наиболее общеупотребительными неорганическими солями являются NaCl, KCl, NaH2PO4 и т.д.
Настоящее изобретение представляет жидкие составы биополимера, имеющие величину рН, варьирующую от около 5,0 до около 7,0, или от около 5,5 до около 6,5, или от около 5,8 до около 6,2, или около 6,0, или от около 6,0 до около 7,5, или от около 6,5 до около 7,0.
Настоящее изобретение охватывает составы, такие как жидкие составы, имеющие стабильность при температурах, имеющих место в коммерческих холодильниках и морозильных камерах, находящихся в кабинете врача или в лаборатории, таких как от около -20°С до около 5°С, причем названную стабильность оценивают, например, микроскопическим анализом, для целей хранения, такого как в течение около 60 дней, в течение около 120 дней, в течение около 180 дней, в течение около года, в течение около 2 лет или более. Жидкие составы согласно настоящему изобретению также проявляют стабильность, каковая оценивается, например, гранулометрическим анализом при комнатной температуре по меньшей мере за несколько часов, к примеру, за один час, два часа или около трех часов до употребления.
Примеры разбавителей включают забуференный фосфатным буфером солевой раствор, буфер для забуферивания против кислоты желудочного сока в мочевом пузыре, такой как цитратный буфер (рН 7,4), содержащий сахарозу, бикарбонатный буфер (рН 7,4) сам по себе или бикарбонатный буфер (рН 7,4), содержащий аскорбиновую кислоту, лактозу или аспартам. Примеры носителей включают белки, например, каковые находятся в снятом молоке, сахара, например, сахарозу, или поливинилпирролидон. Типично эти носители должны употребляться в концентрации около 0,1-90% (отношение весовых частей к объему), но предпочтительно в диапазоне 1-10% (отношение весовых частей к объему).
Составы, используемые для введения in vivo, должны быть стерильными. Это может быть обеспечено, например, фильтрованием через стерильные фильтровальные мембраны. Например, составы согласно настоящему изобретению могут быть стерилизованы путем фильтрации.
Биополимерная композиция будет составлена, дозирована и введена путем, соответствующим общепринятой медицинской практике. Определяющие факторы в этом контексте включают конкретное излечиваемое заболевание, конкретное излечиваемое млекопитающее, клиническое состояние индивидуального пациента, причину расстройства, место доставки средства, способ введения, расписание введения и прочие факторы, известные практикующим медицинским работникам. «Терапевтически эффективное количество» вводимого биополимера будет определяться такими соображениями и может представлять собой минимальное количество, необходимое для профилактики, улучшения или лечения рассматриваемого расстройства. Как применяемый в настоящем описании, термин «эффективное количество» эквивалентен выражению, имеющему отношение к терапевтическому уровню (например, профилактическое или терапевтическое средство), который достаточен для снижения серьезности и/или продолжительности болезни, ослабления одного или более симптомов таковой, предотвращения прогрессирования заболевания или обеспечения регрессии болезни, или который достаточен для достижения результата в предотвращении развития, рецидива, возникновения или прогрессирования заболевания или одного или более симптомов такового, или усиления или улучшения профилактического(-ких) и/или терапевтического(-ких) эффекта(-тов) еще одной терапии (например, еще одного терапевтического средства), применимого для лечения болезни. Например, описываемое лечение может повысить возможность использования сустава реципиентом исходя из первоначального состояния поврежденного или больного сустава, по меньшей мере на 5%, предпочтительно по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, или по меньшей мере на 100%. В еще одном варианте осуществления эффективное количество описываемого терапевтического или профилактического средства снимает симптомы заболевания, такие как симптомы артрита, по меньшей мере на 5%, предпочтительно по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, или по меньшей мере на 100%. Также используемым в настоящем описании как эквивалентным является термин «терапевтически эффективное количество».
При необходимости композиция также может содержать солюбилизатор и местный анестетик, такой как лидокаин или другой «каиновый» анестетик, для снятия боли в месте инъекции.
В общем, ингредиенты поставляются либо по отдельности, либо смешанными вместе в единой лекарственной форме, например, в виде сухого лиофилизированного порошка или безводного концентрата, в герметичном контейнере, таком как ампула или пакетик, с указанием количества активного средства. Когда композиция должна быть введена путем инфузии, она может быть распределена из инфузионной бутылки, содержащей стерильную воду фармацевтической чистоты или солевой раствор. Когда композицию вводят путем инъекции, ампулу со стерильной водой для инъекций или солевым раствором помещают, например, в комплект, чтобы ингредиенты могли смешаться до введения.
Представлено промышленное изделие, содержащее материалы, применимые для лечения вышеописанных заболеваний. Промышленное изделие включает контейнер и этикетку. Подходящие контейнеры включают, например, бутылки, микропробирки (виалки), шприцы и пробирки. Контейнеры могут быть сформированы из разнообразных материалов, таких как стекло или пластические материалы. Контейнер содержит композицию, которая эффективна для профилактики или лечения, например, раны или заболевания сустава, и может иметь стерильный входной канал (например, контейнер может представлять собой виалку, имеющую пробку, прокалываемую гиподермической иглой для инъекций). Этикетка, нанесенная на контейнер или связанная с таковым, показывает, что композиция применяется для лечения избранного состояния. Промышленное изделие может дополнительно содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как забуференный фосфатным буфером солевой раствор, раствор Рингера и раствор декстрозы. Оно может дополнительно содержать другие материалы, желательные из коммерческих или пользовательских соображений, в том числе буферы, разбавители, фильтры, иглы, шприцы и упаковочные вкладыши с инструкцией по применению.
Биологически активные агенты и прочие добавки могут быть введены в сшитую синтетическую полимерную композицию путем примешивания или добавлены к смеси реагентов. Альтернативно, агенты могут быть введены в сшитую полимерную матрицу путем связывания этих агентов с функциональными группами на описываемых полимерах. Такие композиции могут содержать связки, которые могут легко подвергаться биодеградации, например, в результате ферментативного расщепления, приводя к высвобождению активного агента или добавки в целевую ткань, где он будет проявлять свой желательный терапевтический эффект.
Простой способ введения биологически активных агентов, содержащих нуклеофильные группы в сшитой полимерной композиции, включает смешение активного агента с полиэлектрофильным компонентом до добавления полинуклеофильного компонента. Варьированием относительных молярных количеств различных компонентов реакционной композиции можно изменить суммарный заряд конечной сшитой полимерной композиции, чтобы приготовить матрицу для доставки заряженного соединения, такого как белок или ионизируемое лекарственное средство. Как таковая, доставка заряженных белков или лекарственных препаратов, которые обычно должны быстро диффундировать из нейтральной матрицы-носителя, может контролироваться.
Например, если применяется молярный избыток компонента, который является полинуклеофильным, полученная матрица может иметь положительный заряд сетчатой структуры и может быть использована для ионного связывания и доставки отрицательно заряженных соединений. Примеры отрицательно заряженных соединений, которые могут быть доставлены из этих матриц, включают разнообразные лекарственные препараты, клетки, белки и полисахариды.
Если используется молярный избыток компонента, который является полиэлектрофильным, полученная матрица имеет отрицательный заряд сетчатой структуры заряд и может быть использована для ионного связывания и доставки положительно заряженных соединений. Примеры положительно заряженных соединений, которые могут быть доставлены из этих матриц, включают разнообразные лекарственные препараты, клетки, белки и полисахариды.
Композиции сшитых полимерных матриц согласно настоящему изобретению могут быть также применены для доставки разнообразных типов живых клеток или генов к желательному месту введения для формирования новой ткани. Как используется в настоящем описании, термин «гены» предполагается охватывающим генетический материал из природных источников, синтетические нуклеиновые кислоты, ДНК, антисмысловую ДНК и РНК.
Например, мезенхимальные стволовые клетки могут быть доставлены с использованием полимерных матриц для продуцирования клеток того же типа, как ткань, в которую они доставлены. Мезенхимальные стволовые клетки могут быть недифференцированными и поэтому могут дифференцироваться с образованием разнообразных типов новых клеток благодаря присутствию активного агента или влияний (химических, физических и т.д.) окружающей конкретной ткани. Примеры мезенхимальных стволовых клеток включают остеобласты, хондроциты и фибробласты. Например, остеобласты могут быть доставлены к месту костного дефекта для создания новой кости; хондроциты могут быть доставлены к месту дефекта хряща для создания нового хряща; фибробласты могут быть доставлены для формирования коллагена всякий раз, когда требуется новая соединительная ткань; нейроэктодермальные клетки могут быть доставлены для формирования новой нервной ткани; эпителиальные клетки могут быть доставлены для формирования новых эпителиальных тканей, таких как печень, поджелудочная железа и т.д.
Клетки могут быть как аллогенными, так и ксеногенными по происхождению. Композиции могут быть использованы для доставки клеток объектов, которые являются генетически модифицированными.
В некоторых вариантах осуществления композиции согласно изобретению могут не подвергаться легкой деградации in vivo. Таким образом, клетки, захваченные внутри композиций сшитых полимерных матриц, будут изолированными от клеток реципиента и как таковые не будут провоцировать или будут задерживать иммунную реакцию хозяина.
Для захвата клеток или генов внутри сшитой полимерной матрицы клетки или гены могут быть, например, предварительно смешаны с реагентной композицией или, необязательно, со смесью до формирования сшитой полимерной матрицы, тем самым внедряя клетки или гены внутрь матрицы.
В общем способе эффективного лечения поверхности шарнирного сочленения или диска или сустава, в позвоночнике и так далее, внутри тела млекопитающего субъекта компоненты реакционной композиции вводятся в место, нуждающееся в лечении. Настоящее изобретение может быть приспособлено для включения надлежащего носителя для этой инъекции, имплантации, инфузии или доставки. Попав в рассматриваемое место тела, имидированный биологически совместимый полимер реагирует с поверхностью и становится связанным с таковой, например, с тканью или протезом. Таким образом, имидированный полимер является «биологически зафиксированным» на ткани реципиента и затем может реагировать с другими поверхностями или полимерами, такими как описываемая мостиковая молекула.
Альтернативно, полимерная матрица может быть сформирована полутвердой или в виде твердого объекта, пригодного для имплантации в анатомической области, или в форме пленки или сетки, которая может быть использована для покрытия сегмента области или поверхности. Разнообразные методы имплантации твердых объектов в соответствующие анатомические области скорее всего знакомы квалифицированному специалисту в этой области технологии.
В некоторых вариантах осуществления раскрытые в настоящем описании композиции могут быть размещены в хирургически созданном дефекте, который должен быть реконструирован, и должны быть оставлены в этом положении после того, как реконструкция была завершена. Настоящее изобретение может быть пригодным для использования в локальных реконструкциях тканей, реконструкциях лоскутов на ножке, уплотнении роговичных лоскутов или реконструкциях свободных пластических лоскутов.
В некоторых вариантах осуществления настоящее изобретение относится к наборам для сближения тканей или частей тканей, таких как для уплотнения или заживления.
Раскрытые в настоящем описании наборы будут содержать контейнер, служащий для описываемого имидированного полимера. Набор может содержать устройство доставки. Набор необязательно будет содержать контейнер, служащий для второго описываемого полимера. Могут быть включены инструкции по их применению.
Варианты применения таких наборов включают, например, терапевтическое употребление. Изобретение представляет наборы для применения в лечении болезни или состояния. Например, набор может содержать имидированный биологически совместимый полимер, такой как имидированный хондроитин-сульфат, и биосовместимый полимер или соединение, содержащие аминный фрагмент, такой как аминосодержащий полиэтиленгликоль.
В определенных вариантах осуществления описываемый полимер может быть сформирован с желательными структурами, такими как пленки, пены, скаффолды или прочие трехмерные структуры, представляющие интерес. При таких обстоятельствах в описываемую композицию могут быть включены прочие материалы, в дополнение к одному или более биологически активным агентам. Например, в композиции согласно настоящему изобретению могут быть введены известные в технологии пластификаторы и стабилизаторы. Компонентом набора может быть твердая структура. Так, описываемый имидированный биологически совместимый полимер может быть нанесен на биологическую поверхность в виде твердой структуры с обеспечением возможности реагировать с биологической поверхностью. Затем мостиковая молекула может быть приближена к зафиксированному биологически совместимому полимеру для взаимодействия с таковым.
В других вариантах осуществления биологически совместимый полимер используется без мостиковой молекулы. Таким образом, имидированный биологически совместимый полимер употребляется как адгезив. Полимер может быть нанесен в жидкой форме на рассматриваемую биологическую поверхность. Альтернативно, полимер может быть скомбинирован с инертной структурой, которая может обеспечить опору или служить в качестве носителя для полимера, такого как подложка для адгезивного бандажа, или со структурой или устройством, имеющими желательное назначение.
Описываемый имидированный полимер может быть приведен во взаимодействие с первой и второй тканью при возможности одновременно реагировать с таковыми. Имидные группы реагируют с функциональными группами ткани, такими как свободные аминогруппы лизиновых фрагментов белков.
В еще одном варианте осуществления имидный фрагмент или один из имидных фрагментов или другая функциональная группа являются реакционноспособными по отношению не только к ткани, но и к еще одной субстанции, используемой в организме, такой как протез, гидрогель, скаффолд, матрица и так далее. Таким образом, описываемый функционализированный полимер может быть использован для крепления этой субстанции к ткани или к конкретному месту в теле.
Раскрытые в настоящем описании композиции могут быть использованы в любом числе вариантов восстановления тканей, таких как, но не ограничивающихся таковыми, профилактика серомы и гематомы, присоединение кожного или мышечного лоскута, устранение или предотвращение эндоподтеканий, устранение расслоения аорты, восстановление объема легкого, восстановление нервной трубки, уплотнение роговичных разрезов, реплантация сетчатки и проведение микроваскулярного и нейрального анастомоза.
В одном варианте осуществления восстановление поврежденной ткани может быть проведено в пределах любого стандартного хирургического процесса, обеспечивающего возможность доступа для восстановления ткани, включая открытую хирургию и лапароскопическую технику. Как только поврежденная ткань становится доступной, композицию согласно изобретению помещают для контакта с поврежденной тканью вместе с любыми хирургическими повязкой или имплантатом, если необходимо. Будучи используемой для восстановления разорванной или отделенной ткани, такого как при соединении двух или более тканевых поверхностей, например, с последующим хирургическим вмешательством, композиция может быть нанесена на одну или более тканевых поверхностей, и затем поверхности приводятся в контакт друг с другом, и между таковыми возникает адгезия.
Будучи употребляемой для восстановления выпяченной ткани, хирургически приемлемая повязка может быть наложена на область ткани, окружающую выпяченную ткань, чтобы покрыть выпяченную область, тем самым укрепляя поврежденную ткань и устраняя дефект. Во время наложения повязки на окружающую ткань композиция согласно изобретению может быть нанесена либо на повязку на окружающей ткани, либо на повязку после того, как повязка была наложена на выпяченную ткань. Когда повязка и ткань будут приведены в контакт друг с другом, между таковыми может возникать адгезия.
Поверхности, которые нужно склеить, могут удерживаться вместе вручную, или с использованием других подходящих средств, таких как липкая лента, временный шов и так далее, пока реакция сшивки не пройдет до полного завершения. Сшивка типично протекает достаточно полно для адгезии в течение примерно от 5 до 60 секунд после смешения компонентов адгезивной композиции, если только не будет желательным замедленное отверждение. Однако время, требуемое для протекания полной сшивки, зависит от ряда факторов, в том числе от типа и молекулярной массы каждого реакционного компонента, степени функционализации и концентрации компонентов в сшиваемых композициях (например, более высокие концентрации имеют результатом более быстрое сшивание).
В одном варианте осуществления композиции согласно настоящему изобретению доставляются к месту введения с использованием устройства, которое позволяет компонентам поступать по отдельности, например, последовательно или одновременно. Такие системы доставки могут содержать многокамерное распылительное устройство.
Альтернативно, компоненты могут быть доставлены по отдельности с использованием любого типа управляемой экструзионной системы, или они могут быть доставлены вручную в форме отдельных паст, жидкостей или сухих порошков и смешаны друг с другом вручную на месте введения. Многие устройства, которые приспособлены для доставки многокомпонентных тканевых клеевых составов/гемостатических средств, хорошо известны в технологии и также могут быть использованы в практике настоящего изобретения.
Еще один путь доставки композиций согласно настоящему изобретению состоит в приготовлении реакционных компонентов в инактивированной форме в виде жидкости или порошка. Такие композиции могут быть затем активированы после нанесения в должное место на ткани или непосредственно перед этим, путем гидратации или применением, например, активатора. В одном варианте осуществления активатор представляет собой буферный раствор, имеющий такое значение рН, при котором он будет активировать композицию, будучи смешанным с таковой. Еще один путь доставки композиций заключается в приготовлении предварительно сформованных листов и нанесении листов как таковых на место введения. Квалифицированный специалист в этой области технологии может без труда определить надлежащую методику введения для употребления любой конкретной композиции, имеющей известную прочность геля и время гелеобразования
Описываемые в настоящем описании композиции могут быть использованы для терапевтических состояний, которые требуют нанесения покрытия или герметизирующего слоя для предотвращения утечки газов, жидкости или твердых субстанций. Метод предполагает нанесение реагента(-тов) на поврежденную ткань или орган для уплотнения 1) васкулярных и/или других тканей или органов для прекращения или сведения к минимуму кровотечения; 2) ткани в грудной клетке для прекращения или минимизации утечки воздуха; 3) желудочно-кишечного тракта или панкреатической ткани для прекращения или сведения к минимуму утечки фекальных масс или тканевого содержимого; 4) мочевого пузыря или мочеточников для прекращения или минимизации утечки мочи; 5) твердой мозговой оболочки для прекращения или сведения к минимуму утечки спинномозговой жидкости (CSF); и 6) кожи или серозной ткани для прекращения утечки серозной жидкости. Эти композиции могут быть также применены для склеивания друг с другом таких тканей, как мелкие сосуды, нервы или кожная ткань. Материал может быть использован 1) путем нанесения его на поверхность одной ткани, и затем вторая ткань может быть быстро прижата к первой ткани, или 2) приведением тканей в тесное соприкосновение и затем нанесением материала. В дополнение, композиции могут быть применены для заполнения полостей в мягких и твердых тканях, которые возникают в результате болезни или хирургического вмешательства.
Например, композиции полимерной матрицы согласно изобретению могут быть использованы для блокирования или заполнения разнообразных полостей и пор в теле млекопитающего субъекта. Композиции могут быть также применены в качестве биологических клеевых средств для уплотнения трещин или изломов внутри ткани или структуры (такой как сосуд), или стыков между соседними тканями или структурами, для предотвращения утечки крови или других биологических текучих сред.
Композиции могут быть также применены в качестве устройства заполнения крупных проемов для смещения органа в полости тела во время хирургических или радиационных процедур, например, для защиты кишок во время планового курса облучения тазовой области.
Композиции согласно изобретению могут быть также нанесены в виде покрытия на внутреннюю поверхность физиологического просвета, такого как кровеносный сосуд или фаллопиевы трубы, тем самым исполняя функцию уплотнения для предотвращения рестеноза просвета после терапевтического лечения, например, такого, как баллонная катетеризация для удаления отложений артериальных бляшек с внутренней поверхности кровеносного сосуда, или удаления шрамовой ткани или внутриматочной ткани из внутренности фаллопиевой трубы. Тонкий слой реакционной смеси предпочтительно наносят на внутреннюю поверхность сосуда (например, через катетер) немедленно после смешения первого и второго синтетических полимеров. Поскольку композиции согласно изобретению не претерпевают легкой деградации in vivo, возможный рестеноз вследствие деградации покрытия сводится к минимуму.
Композиции согласно изобретению могут быть также использованы для аугментации мягкой или твердой ткани внутри тела млекопитающего субъекта. Примеры вариантов применения для аугментации мягких тканей включают аугментацию сфинктера (например, уринального, анального, эзофагиального) и удаление морщин и шрамов. Примеры вариантов применения для аугментации твердых тканей включают восстановление и/или замещение костной и/или хрящевой ткани.
Теперь, когда изобретение в общем описано, оно будет более понятным с привлечением нижеследующих примеров, которые включены исключительно в целях иллюстрирования определенных аспектов и вариантов осуществления настоящего изобретения и не предполагают ограничения изобретения.
Пример 1
Получают донорские корнеосклеральные диски, непригодные для трансплантации. Роговицы сохраняются в стандартных условиях глазного банка в среде Optison-GS (фирмы Bausch & Lomb Surgical, Inc., Сан-Димас, Калифорния) при температуре 4°С. Процедуру выполняют не дольше, чем через 10 дней после смерти, как изложено в работе авторов Reyes et al., Invest. Ophthal. Vis. Sci., том 46 (№ 4), стр. 1247 (2005), которые сообщают о применении дериватизированного альдегидной группой хондроитин-сульфата с поливиниловым спиртом для уплотнения корнеальных разрезов. Однако токсичность этих реагентов не была определена.
Для выполнения кератэктомии с откидным лоскутом используют ручной микрокератом (LSK One; фирма Moria USA, Дойлстаун, Пенсильвания) сразу за пределами центрального отверстия глазной камеры способом, каковым получается крупный лоскут. Это отверстие подобно искусственному нерасширенному зрачку, который мог бы быть базисным пунктом в медицинском учреждении. Для всех роговиц употребляют головку толщиной 300 мкм. Как известно в технологии, для поддержания корнеосклеральных дисков применяют искусственную переднюю камеру (ALTK System; фирма Moria USA). Безредукторные направляющие на базовой пластине искусственной передней камеры предназначены для приспособления к головке микрокератома, чтобы ее проход вдоль роговицы поддерживался в одинаковых плоскости и направлении. Все диски с задней стромой, оболочкой Десцемета и слоем эндотелиевых клеток получены с использованием 6,25-миллиметрового ручного трепана.
Инфузию изотонического раствора хлорида натрия проводят перед тем, как корнеосклеральные диски помещены на базу передней камеры, для удаления остаточного воздуха как из инфузионной трубки, так и из-под роговицы. Бутылку с раствором поднимают на высоту 1,5 м над уровнем камеры для достижения надлежащего внутрикамерного давления (60-70 мм рт.ст.) перед проходом микрокератома. Роговицы центрируют согласно кольцевым направляющим в базе камеры. Механический эпителиальный соскоб выполняют с помощью 2,5-миллиметрового вертикального серповидного ножа со скругленным концом (Beaver, Becton Dickinson Surgical Systems, Франклин Лейкс, Нью-Джерси), во избежание поверхностных неровностей вследствие свободного эпителия, который может обусловить ошибки в пахиметрических и видеокератографических измерениях.
Искусственная передняя камера настроена на достижение максимального диаметра лоскута во всех случаях. Манипулирование предназначено для оставления как можно большей площади в стромальном ложе для выполнения трефинации и зашивания лоскута. Все хирургические операции выполняет один и тот же хирург во избежание вариабельности, характерной для различных хирургов, с использованием хирургического микроскопа (Ophthalmic 900S; фирма Moeller-Wedel, Гамбург, Германия).
Для имитации клинических условий на поверхность роговицы перед прохождением микрокератома наносят несколько капель гидрохлорида пропаракаина. Кератэктомию с частичным лоскутом проводят прохождением головки микрокератома с ее колеблющимся лезвием при относительно постоянной скорости вдоль пластины, останавливаясь как раз позади центрального отверстия камеры. Этот подход отличается от ранее опубликованной техники в попытке получить широкий откидной лоскут с относительно низкой вероятностью смещения лоскута, чтобы добавить больше стабильности лоскуту роговицы и сократить отверстие в роговице. Оставшуюся строму под откидным лоскутом отделяют с использованием 2-миллиметрового глазного шпателя Каллера (Sparta Surgical Corporation, Конкорд, Калифорния), чтобы оставить надлежащее пространство для выполнения центральной трефинации. Внутрикамерное давление возвращают к величине от 18 до 20 мм рт.ст. путем уменьшения высоты поднятия бутылки с раствором изотонического раствор хлорида натрия до 25 см над уровнем роговицы, и трепан центрируют согласно кератэктомии и «зрачковой» кромке, созданной искусственно центральным отверстием камеры. Для выполнения циркулярного разреза стромального ложа используют ручной трепан диаметром 6,25 мм. Лезвие трепана осторожно проворачивают до перфорации, и остальной циркулярный разрез завершают с помощью роговичных ножниц. Донорские диски укладывают в реципиентные ложа, оставляют незашитыми, и лоскут возвращают на место.
Эксперимент состоит из двух групп по четыре роговицы в каждой. В одной группе (Группа 1) лоскут фиксируют пятью узловыми швами (10/0-найлон, фирма Sharpoint Surgical Specialties Corporation, Ридинг, Пенсильвания). Техника выполнения шва одинаковая для всех роговиц для обеспечения единообразия.
Во второй группе (Группа 2) лоскут фиксируют с использованием тканевого адгезива, основанного на имидированном хондроитин-сульфате и аминосодержащем полиэтиленгликоле.
Мостиковый компонент, 10%-ный аминосодержащий полиэтиленгликоль, используют для перекрытия хондроитин-сульфат-имида (CS-I). Полиэтиленгликоль (PEG) намеренно подкрашивают в голубой цвет с помощью биосовместимого красителя (Cibacron Blue; фирма Sigma-Aldrich). Подкрашивание мостикового компонента позволяет непосредственно наблюдать полимеризованное клеевое средство относительно надреза и гарантирует, что клеевое средство не получило доступа в переднюю камеру.
Для нанесения хондроитин-сульфат-имида (CS) на края раны используют 2,5-миллиметровый вертикальный серповидный нож со скругленным концом (Beaver, BD Surgical Systems). Тонкий слой применяют для покрытия поверхности разреза и внутренних кромок раны. Затем с помощью второго серповидного ножа наносят тонкий слой мостикового компонента адгезива (аминосодержащий полиэтиленгликоль, PEG-амин) поверх первого слоя. Два компонента оставляют полимеризоваться в течение 30 секунд. Как только клеевое средство затвердевает, производят инфузию солевого раствора.
В обеих группах трансплантированный диск оставляют без зашивания или клеевого средства, так как он склонен оставаться на месте благодаря поверхностному натяжению после того, как внутрикамерное давление достигает величины 15-18 мм рт.ст.
После удаления эпителия инфузию изотонического раствора хлорида натрия прекращают и измеряют толщину роговицы с использованием ультразвукового пахиметра (Pach IV, фирма Accutome Inc., Малверн, Пенсильвания) в центре роговицы. Второе измерение проводят после создания откидного лоскута и отгибания его от стромального ложа. Затем рассчитывают толщину по центру лоскута.
Для анализа кривизны поверхности применяют коммерческий видеокератоскоп (фирма EyeSys Laboratories, Inc., Хьюстон, Техас). Ручной кератоскоп («диск Пласидо») располагают в вертикальном положении, и камеру центрируют соответственно контролю по монитору. Соблюдают осторожность в сохранении ориентации в предоперационной и послеоперационной регистрациях. Для каждой роговицы перед операцией и после операции проводят по три измерения.
Для оценки стабильности трансплантата постепенно повышают внутрикамерное давление. Отслеживают наличие утечки, и давление регистрируют с помощью цифрового манометра (Digimano 1000, фирма Netech Corp., Хиксвилл, Нью-Йорк).
Расчеты проводят с использованием программы StatsDirect, версия 1.9.0, для Windows (CamCode, Эшвилл, Англия). Описывают среднее значение, среднеквадратическое отклонение (SD), минимальное и максимальное значения.
Тканевое клеевое средство обеспечивает хорошее уплотнение и меньший астигматизм, чем другие сообщения о задней ламеллярной кератопластике с использованием микрокератома. Далее, отсутствие швов делает технику более простой и существенно сокращает расход времени.
Композиция согласно настоящему изобретению может быть использована для склеивания двух отдельных поверхностей, по меньшей мере одна из которых представляет собой биологическую поверхность. Так, настоящая композиция может быть использована для герметизации раны или отверстия путем смыкания открытых кромок вплотную друг к другу. Уплотнение может быть долговременным или может быть кратковременным, в зависимости от степени биоразложимости компонентов данного адгезива. Кратковременное уплотнение может обеспечивать время, достаточное для заживления или протекания естественного закрытия отверстия. Альтернативно, описываемый адгезив может быть применен для приклеивания небиологической, но биосовместимой поверхности к биологической поверхности. Такая небиологическая поверхность может иметь место, например, на протезе, медицинском устройстве и так далее.
Пример 2
Способ синтеза N-гидроксисукцинимидного производного хондроитин-сульфата (CS-NHS) с использованием карбодиимида был известен в технологии. Имидное производное значительно улучшает эффективность и биосовместимость. Также синтезировали аминопроизводное хондроитин-сульфата (CS-амин), чтобы оно действовало как донор аминогруппы. Например, хондроитин-сульфат (CS), сукцинимид и диимид в соотношении примерно 3:3:1, соответственно, могут быть введены в реакцию в небольшом объеме солевого раствора в течение короткого периода времени. Пригодное соотношение трех реагентов может составлять около 75:100:38, как вариант выбора методики.
В еще одном варианте осуществления хондроитин-сульфат (CS) (750 мг) растворяли в 6 мл забуференного фосфатным буфером солевого раствора (PBS). В 1,5 мл раствора PBS растворяли 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC, 1,572 г, 8,2 ммол). Готовили раствор 3,3 ммол N-гидроксисукцинимида (NHS) растворением 380 мг в 1,5 мл раствора PBS. Раствор N-гидроксисукцинимида (NHS) и карбодиимида (EDC) добавиляли к раствору хондроитин-сульфата (CS), смесь перемешивали вихревым взбалтыванием и оставляли реагировать в течение 10 минут при температуре 37°С. Реакционную смесь затем охлаждали в течение 30 минут при температуре -80°С, и осаждали этанолом. Раствор затем центрифугировали в течение 5 минут, и надосадочную жидкость удаляли и промывали.
Сшитые хондроитин-сульфатные (CS) сетчатые структуры синтезировали при разнообразных соотношениях “NHS:NH2”, как показано ниже в Таблице. Растворы полимера с концентрацией 10% (отношение весовых частей к объему) готовили при соотношениях CS-NHS к PEG-(NH2)6, составляющих 1:1, 1:2 и 2:1. Реактанты PEG-(NH2)6 и CS-NHS растворяли в среде DMEM с образованием трех различных концентраций: 13,3%, 10% и 6,67% (отношение весовых частей к объему). Реагент CS-NHS (50 мкл) добавляли в литейную форму, затем добавляли 50 мкл аминосодержащего полиэтиленгликоля (PEG-(NH2)6) и перемешивали. Через 10 минут сетчатые структуры извлекали из литейных форм и переносили в раствор PBS для измерений степени набухания.
Сшитые сетчатые структуры затем оценивали в отношении набухания и цитосовместимости (клетки, инкапсулированные в сетчатых структурах или культивированные рядом с таковыми). Характеристики набухания являются критически важными для вариантов применения в качестве глазного клеевого средства, поскольку избыточное набухание может раскрыть уплотненную рану или вызвать стигматизм. Сетчатые структуры были созданы с инкапсулированными клетками и без таковых. Потенциальная доставка клеток внутри адгезива применима для крупных ран роговицы, которые требуют формирования некоторой новой ткани в дополнение к уплотнению раны. Хондроитин-сульфатные (CS) сетчатые структуры были сравнимыми с полиэтиленгликолевыми (PEG) контрольными сетчатыми структурами во всех отчетах.
Фибробласты были инкапсулированы в сетчатой структуре из CS-PEG-амина при вариации соотношений, 1:1, 1:2 и 2:1. Контрольные PEG-сетчатые структуры были получены при концентрации 5%, 10% и 20% (отношение весовых частей к объему). Клетки были окрашены для анализа выживаемости с использованием имеющегося в продаже набора. Количество живых клеток во всех гелях было сравнимым, показывая, что гели на основе хондроитин-сульфат-имида (CS-I) были биосовместимыми.
В еще одном эксперименте реагенты CS-NHS и разветвленный полиэтиленгликоль (PEG) растворили в PBS, содержащем различные количества буфера HEPES, например, 10 мМ, 100 мМ, 500 мМ и 1000 мМ буфера HEPES. Реагенты перемешивали, пока происходило гелеобразование, до тех пор, когда взять пробу реагентов пипеткой становилось невозможно. Было отмечено, что кривая времени гелеобразования выходит на пологий участок при примерно 100 мМ буфера HEPES. С повышением концентрации буфера HEPES отмечалось слабое уменьшение объема геля, предположительно вследствие повышения степени сшивки при росте концентрации буфера HEPES. Модуль, или прочность геля, в общем также возрастал с увеличением концентрации буфера HEPES. При концентрации 500 мМ модуль в небольшой степени снижался, при большом стандартном отклонении.
Клетки из пульпозного ядра, фиброзного кольца, хондроциты, кератоциты, эндотелиальные клетки роговицы, эпителиальные клетки роговицы и мезенхимальные стволовые клетки были протестированы на цитотоксичность с разнообразными гелями согласно настоящему изобретению. Клетки также были инкапсулированы в разнообразных описываемых гелях. Мониторинг клеток проводили по меньшей мере в течение периода более 21 дня. В качестве контроля клетки были обработаны 5%-ным диакрилатом полиэтиленгликоля. Гели содержали хондроитин-сульфат (CS) и полиэтиленгликоль (PEG) при соотношениях CS:PEG 1:2, 1:1 и 2:1. Некоторые гели содержали гиалуроновую кислоту (НА) или глюкозамин (GlcN), в общем гель с соотношением CS:PEG 1:1 содержал равную часть гиалуроновой кислоты (НА) или глюкозамина (GlcN). При всех обстоятельствах выживаемость клеток поддерживалась в течение всего 21-дневного периода испытания. Эндотелиальные клетки роговицы на 8-ой день показали уровень пролиферации клеток, наблюдался антиапоптотический эффект.
В еще одной серии экспериментов к CS-PEG-гелям, приготовленным, как описано выше, добавили коллаген до конечной концентрации около 0,15% (отношение весовых частей к объему). Наблюдали увеличение модуля в 1,75±0,08 раза по сравнению с CS-PEG-гелями без коллагена. Было предположено, что коллаген действует как дисперсное включение в гелевой матрице и тем самым наделяет гель свойствами композита.
Первичные аминогруппы коллагена могут взаимодействовать с имидными группами CS-NHS в описываемом геле. Поэтому коллаген может сшиваться с гелевой матрицей ковалентным связыванием. Такое усиление сшивания может вести к снижению адгезионной способности геля вследствие уменьшения количества доступных имидных групп в CS-NHS. Один подход для предотвращения ковалентного связывания между коллагеном и гелевой матрицей состоит в применении функционализированного коллагена, такого как коллаген, в котором аминогруппа является замещенной, для сведения к минимуму реакционной способности аминогруппы. Например, аминогруппа может быть модифицирована введением ацетильной группы, алкильной группы и так далее, как излагается выше. Это должно приводить к гелю с повышенным модулем без ущерба адгезионной способности в отношении тканей.
Предполагаемые эквиваленты полимеров, полимерных матриц, субъединиц и прочих композиций, описанных в настоящем описании, включают такие материалы, которые иным образом соответствуют таковым, и которые имеют такие же общие свойства таковых, в которых произведены одна или более простых вариаций заместителей, которые не оказывают вредного влияния на эффективность такой молекулы или композиции в достижении ее предполагаемого назначения. В общем, соединения согласно настоящему изобретению могут быть получены способами, иллюстрированными в общих реакционных схемах, как, например, описано выше, или модификациями таковых, с использованием легкодоступных исходных материалов, реагентов и общеупотребительных синтетических методик. В этих реакциях также возможно применение вариантов, которые известны сами по себе, но в настоящем описании не упомянуты.
Все публикации и патенты, упомянутые в настоящем описании, тем самым включены ссылками во всей их полноте, как если бы каждая отдельная публикация или патент были специально и индивидуально указаны как включенные ссылкой.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕЛЕВЫЕ ПОЛИСАХАРИДНЫЕ КОМПОЗИЦИИ И СПОСОБЫ ДЛИТЕЛЬНОЙ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2008 |
|
RU2472487C2 |
| ИМПЛАНТИРУЕМЫЕ КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2739033C2 |
| КОМПОЗИЦИИ, СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРКАСА НА ОСНОВЕ ДОМЕНА ФИБРОНЕКТИНА ТИПА III | 2010 |
|
RU2562700C2 |
| СТИМУЛИРУЮЩАЯ АДГЕЗИЮ ВРЕМЕННАЯ МАСКА ДЛЯ ПОКРЫТЫХ ПОВЕРХНОСТЕЙ | 2009 |
|
RU2526885C2 |
| СПОСОБЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ СИНДРОМА ДАУНА | 2010 |
|
RU2549441C2 |
| ВИЗУАЛИЗИРУЮЩИЕ АГЕНТЫ ДЛЯ ФИБРОЗНЫХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2596495C2 |
| ПРИМЕНЕНИЕ СТРОМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ДЛЯ ЛЕЧЕНИЯ СВИЩЕЙ | 2006 |
|
RU2435846C2 |
| ПРИМЕНЕНИЕ СТРОМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ДЛЯ ЛЕЧЕНИЯ СВИЩЕЙ | 2011 |
|
RU2608641C2 |
| СОСТАВЫ БИОПРЕПАРАТОВ ДЛЯ ВНУТРИПУЗЫРНОЙ ИНСТИЛЛЯЦИИ | 2015 |
|
RU2720991C2 |
| СПОСОБ И ВЕЩЕСТВО ДЛЯ АКТИВИРУЕМОГО САЙТОМ КОМПЛЕКСООБРАЗОВАНИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ | 2010 |
|
RU2571924C2 |
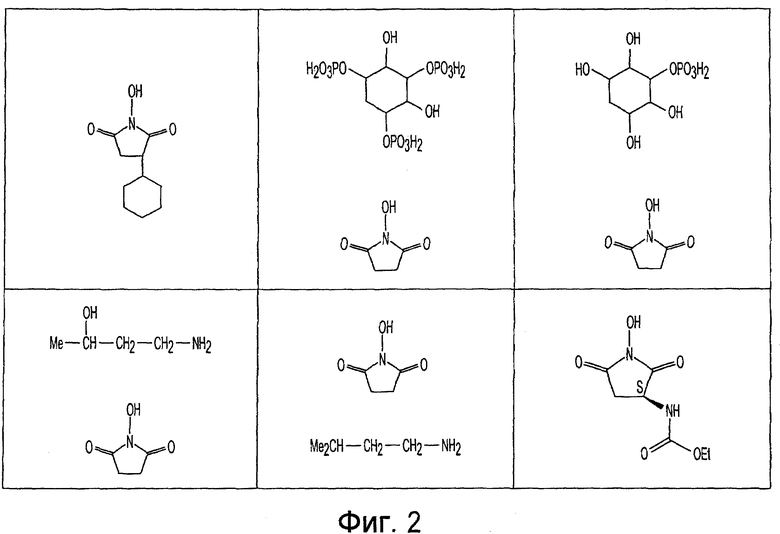
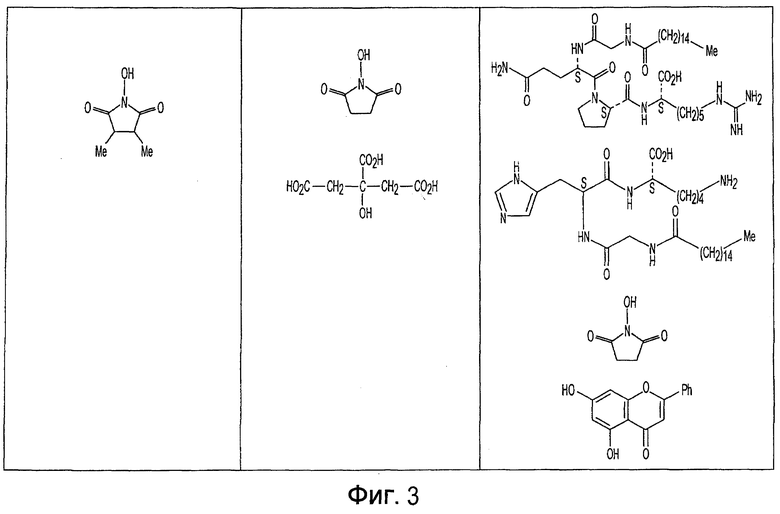
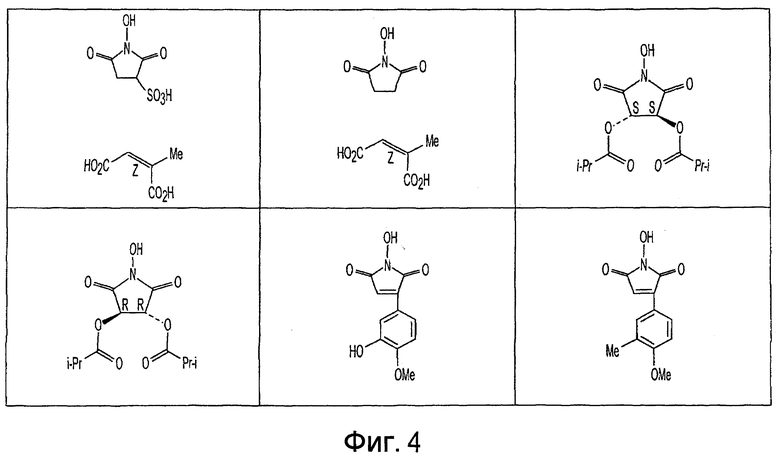
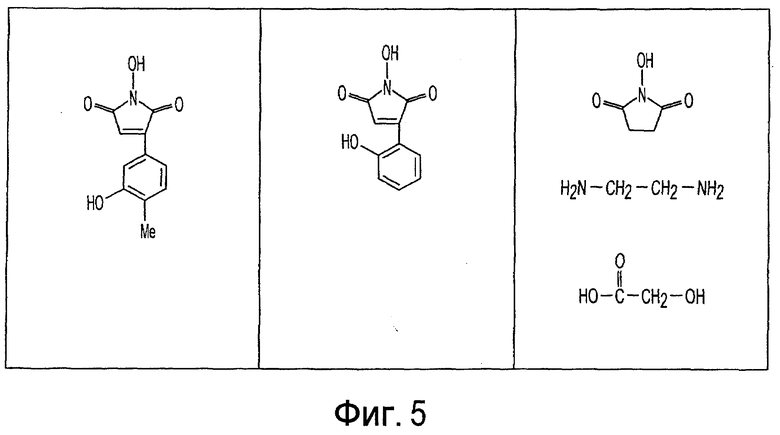
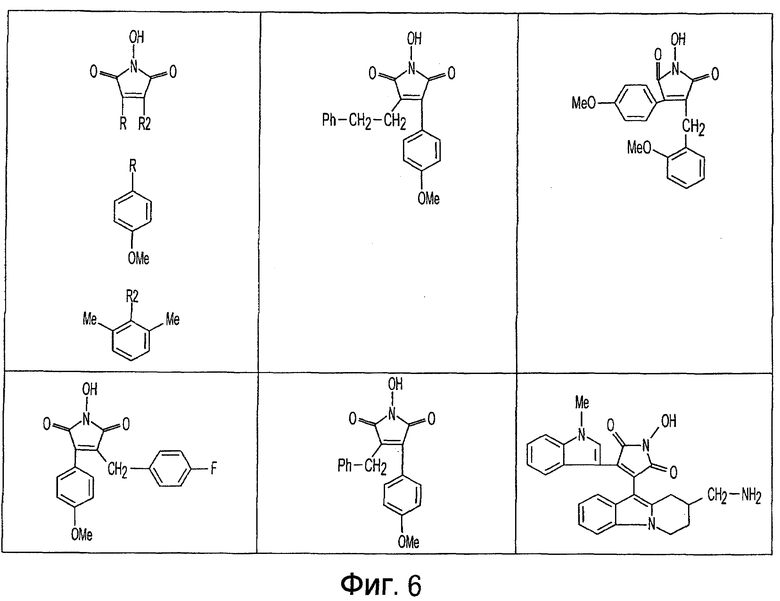
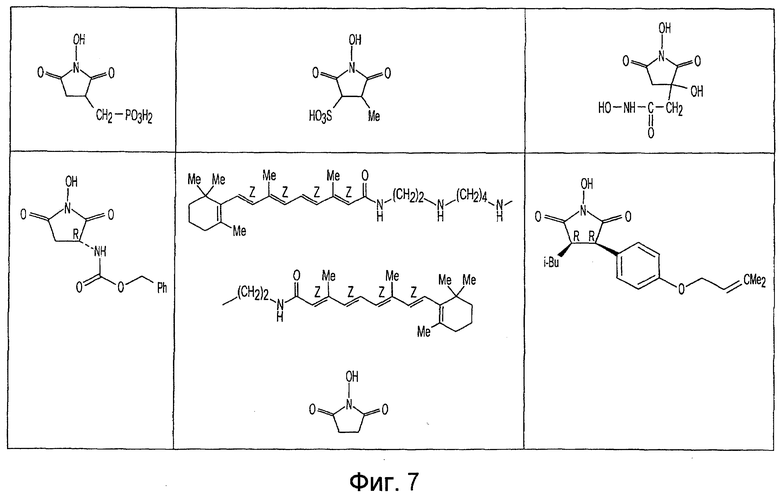
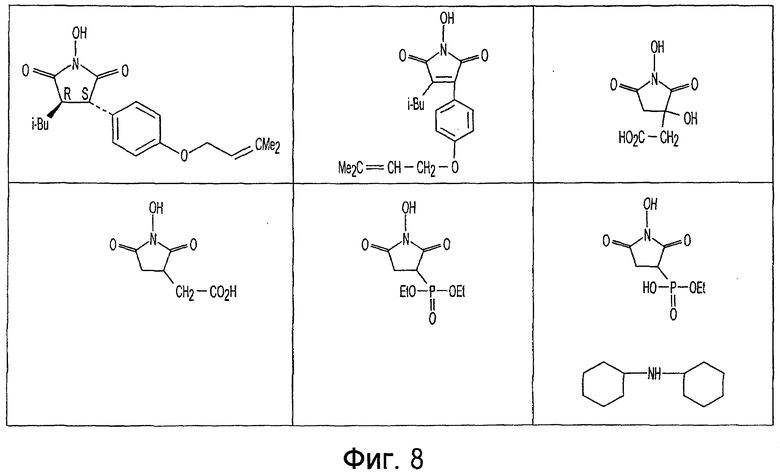
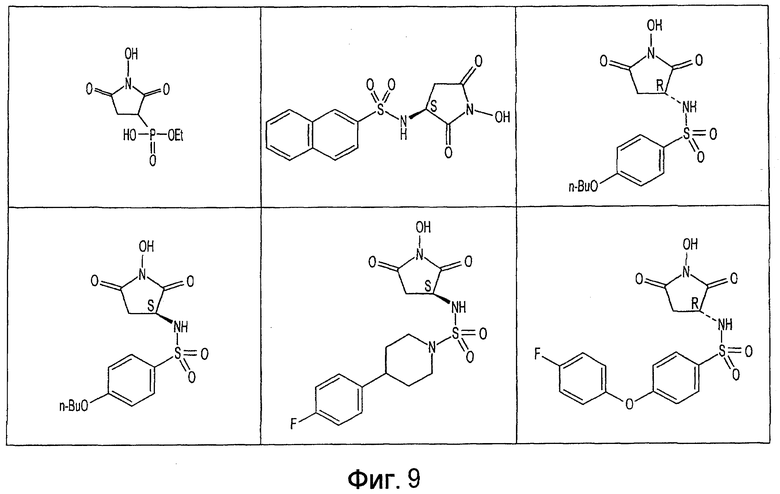
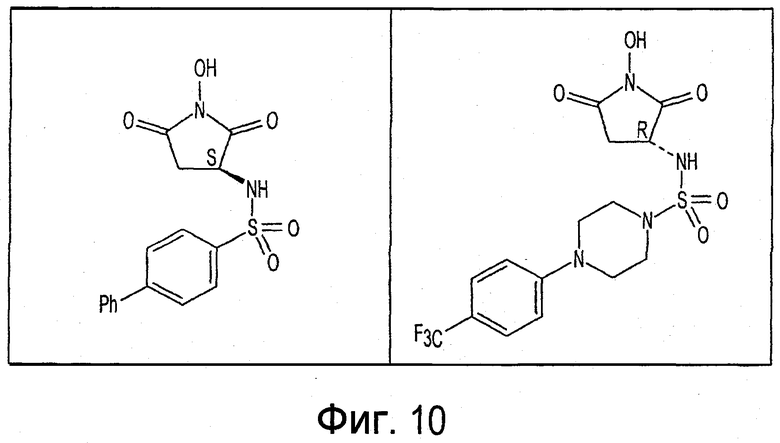
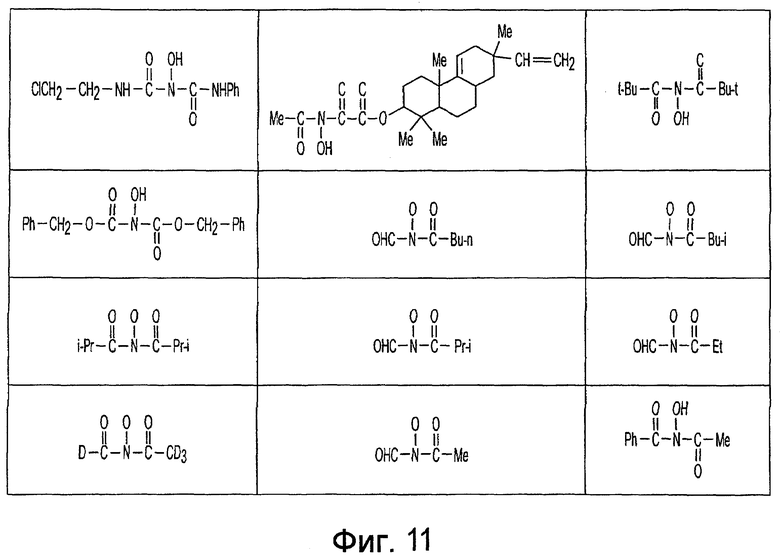

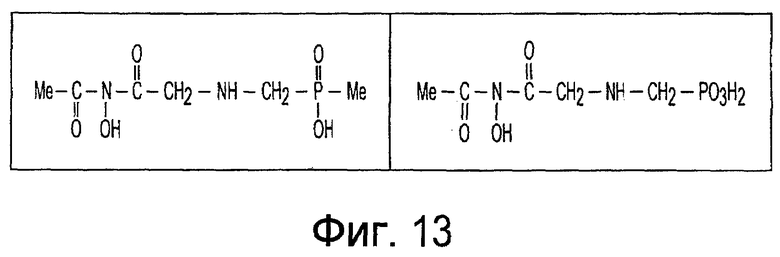
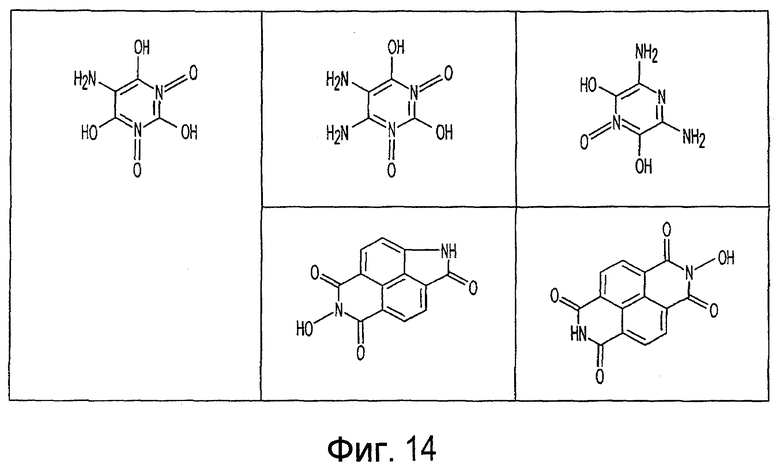
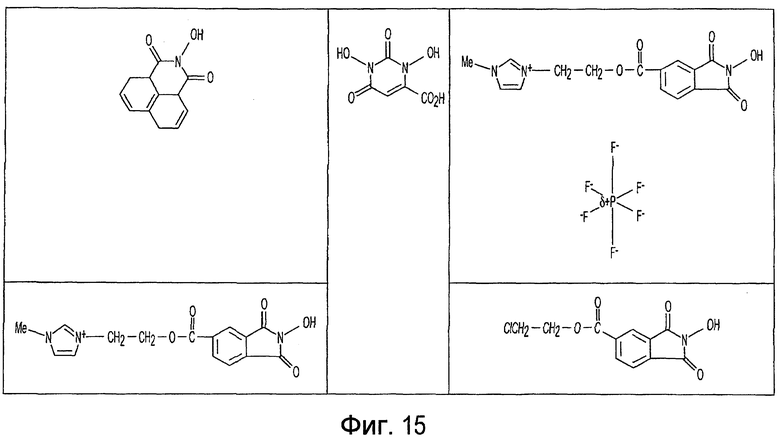
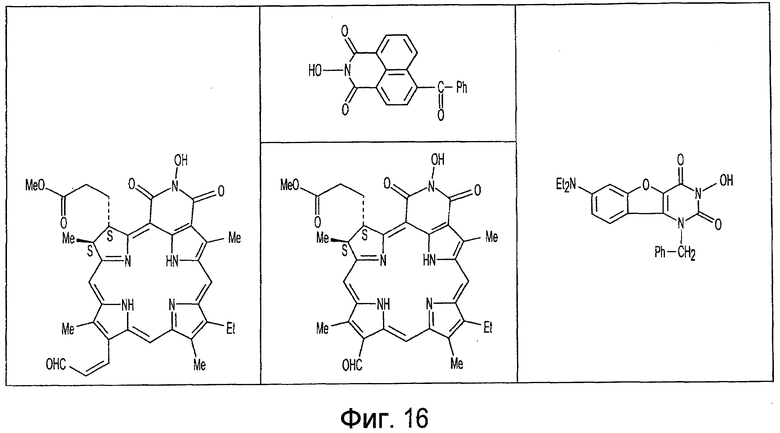
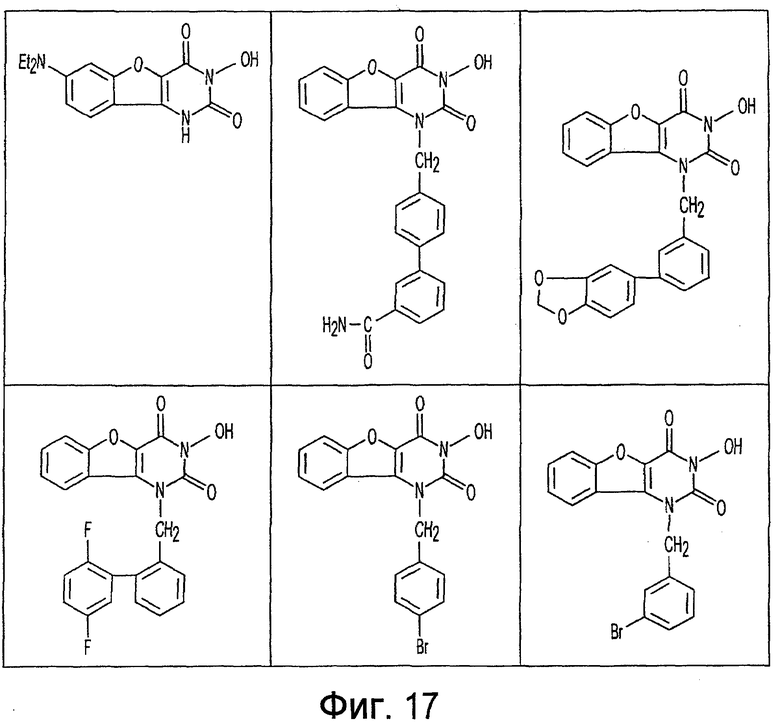
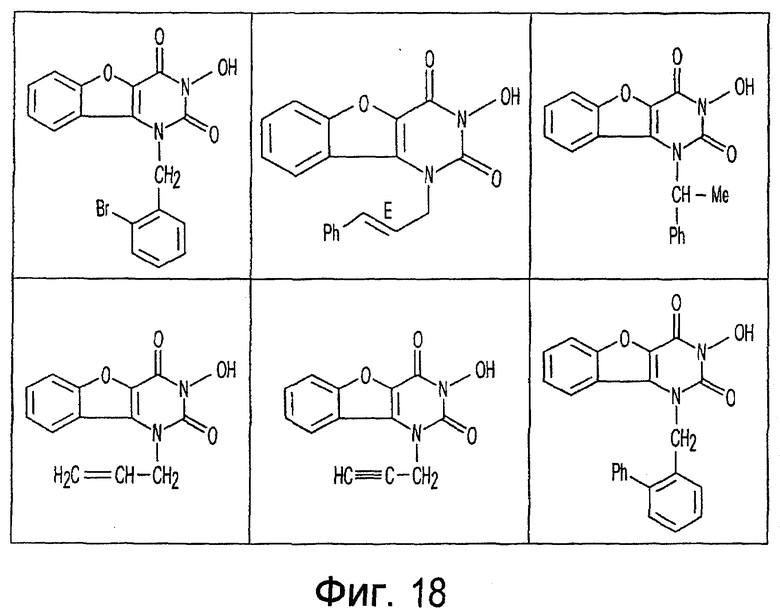
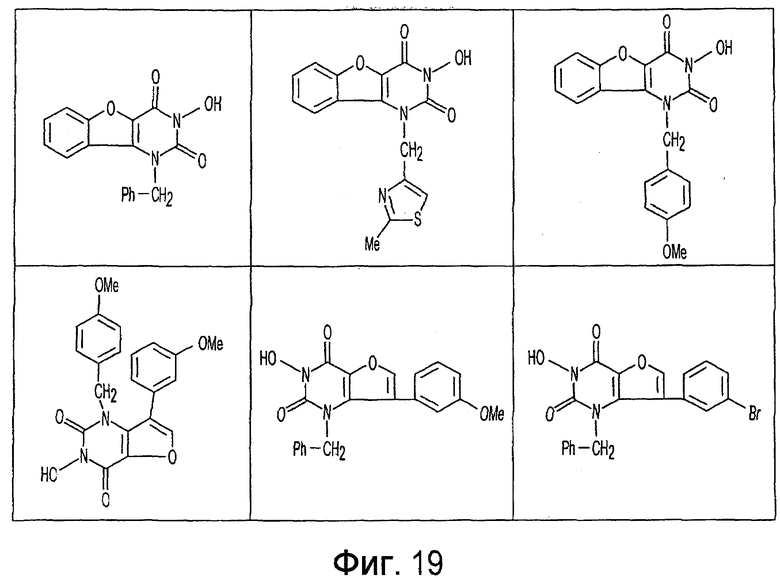
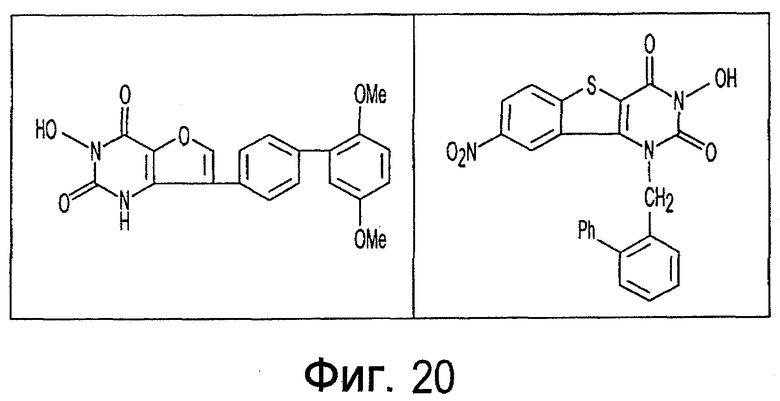
Изобретение относится к выделенному имидированному биологически совместимому полимеру, функционализированному имидной группой. Причем указанный полимер выбран из группы, состоящей из полиэтиленоксида, частично или полностью гидролизованного поливиниловым спиртом, поливинилпирролидона, полиэтилоксазолина, блок-сополимеров полипропиленоксида (полоксамеров и мероксаполов), сополимера полиэтиленоксида и полоксамина, карбоксиметилцеллюлозы и гидроксиалкилированной целлюлозы, полипептидов, полисахаридов, углеводов, полисахарозы, гиалуроновой кислоты, декстрана, гепарин-сульфата, кератан-сульфата, хондроитин-сульфата, гепарина, альгината, желатина, коллагена, альбумина, овальбумина, сложных полифосфоэфиров, полилактидов, полигликолидов, поликапролактонов, полиамидов, полиуретанов, сложных полиэфирамидов, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, полиортокарбонатов, полифосфазенов, полигидроксибутиратов, полигидроксивалератов, пблиалкиленоксалатов, полиалкиленсукцинатов, полималеиновых кислот, полиаминокислот, поливинилового спирта, поливинилпирролидона, полигидроксицеллюлозы, хитина, хитозана, и сополимеров, тройных сополимеров или комбинаций или смесей вышеназванных материалов. Также изобретение относится к композиции для тканевого адгезива, медицинскому устройству и фармацевтической композиции. Предложенное изобретение предоставляет дополнительно модифицированные или функционализированные имидированные полимеры. 4 н. и 5 з.п. ф-лы, 2 пр., 20 ил.
1. Выделенный имидированный биологически совместимый полимер, функционализированный имидной группой, причем указанный полимер выбран из группы, состоящей из полиэтиленоксида, частично или полностью гидролизованного поливиниловым спиртом, поливинилпирролидона, полиэтилоксазолина, блок-сополимеров полипропиленоксида (полоксамеров и мероксаполов), сополимера полиэтиленоксида и полоксамина, карбоксиметилцеллюлозы и гидроксиалкилированной целлюлозы, полипептидов, полисахаридов, углеводов, полисахарозы, гиалуроновой кислоты, декстрана, гепарин-сульфата, кератан-сульфата, хондроитин-сульфата, гепарина, альгината, желатина, коллагена, альбумина, овальбумина, сложных полифосфоэфиров, полилактидов, полигликолидов, поликапролактонов, полиамидов, полиуретанов, сложных полиэфирамидов, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, полиортокарбонатов, полифосфазенов, полигидроксибутиратов, полигидроксивалератов, полиалкиленоксалатов, полиалкиленсукцинатов, полималеиновых кислот, полиаминокислот, поливинилового спирта, поливинилпирролидона, полигидроксицеллюлозы, хитина, хитозана, и сополимеров, тройных сополимеров или комбинаций или смесей вышеназванных материалов.
2. Полимер по п. 1, в котором гидроксиалкилированная целлюлоза является гидроксиэтилцеллюлозой и/или метилгидроксипропилцеллюлозой.
3. Полимер по п. 1 или 2, который содержит, по меньшей мере, десять мономерных звеньев.
4. Полимер по п. 1, в котором названный имид содержит сукцинимид.
5. Композиция для тканевого адгезива, содержащая полимер по любому из пп. 1-4 и второй биологически совместимый полимер по п.1, реакционноспособный по отношению к первому полимеру.
6. Композиция по п. 5, в которой названный второй полимер содержит амин.
7. Медицинское устройство, содержащее небиологическую поверхность, покрытую композицией по п. 5 или 6.
8. Устройство по п. 7, содержащее протез.
9. Фармацевтическая композиция, пригодная для тканевого адгезива и/или гидрогеля, содержащая полимер по любому из пп. 1-4 и фармацевтически приемлемый носитель, эксципиент или разбавитель.
| US 2005208095 A1, 22.09.2005 | |||
| Застежка для чулочных подвязок | 1928 |
|
SU8220A1 |
| WO 2004029137 A2, 08.04.2004 | |||
| MOHAMED A ATTAWIA; KATHRYN E | |||
Авторы
Даты
2013-07-10—Публикация
2007-12-04—Подача