Изобретение относится к офтальмохирургии и хирургии челюстно-лицевой области и предназначено для пластики посттравматических дефектов и деформаций дна и стенок глазницы.
Посттравматические дефекты и деформации дна и стенок глазницы представляют собой одно из самых частых поражений при повреждениях костей верхней и средней зон лицевого скелета. Переломы костей, отделяющих глазницу от передней черепной ямки, височной и подвисочной ямок, верхнечелюстной пазухи и клеток решетчатого лабиринта, могут вызвать целый ряд функциональных и косметических расстройств. В зависимости от объема и степени костных разрушений основной клинической симптоматикой повреждения могут стать нарушение контуров и симметрии лица, диплопия, энофтальм, косоглазие, контрактура глазного яблока, слезотечение или дакриоцистит.
Основными этапами в комплексе лечебных мероприятий у больных с повреждениями костей лица, дна и стенок глазницы традиционно считаются остеотомия, репозиция и прочная фиксация костных фрагментов в правильном анатомическом положении. Однако при мелкооскольчатых переломах репозиция и фиксация костных фрагментов глазницы не являются завершающими этапами ее восстановления. Если не проводится пластика дна глазницы, то в отдаленном периоде формирующиеся рубцы приводят к вторичной деформации, развитию гипофтальма и энофтальма. У больных с посттравматическими деформациями скулоглазничной области из-за Рубцовых изменений и дефектов кости в области дна орбиты не представляется возможным добиться четкого анатомического соотношения между остеотомированными и репонированными фрагментами глазницы без проведения высокотехнологичной операции.
Одним из материалов, используемых при реконструкции глазницы, является аутотрансплантат (RU 94036817, RU 2283049, RU 2283049, RU 2330636, RU 2285471 и др.). Данный материал имеет существенные недостатки:
1) Необходимость нанесения дополнительной травмы пациенту при заготовке аутотрансплантата,
2) Возможность развития осложнений в донорской зоне (воспаление, невропатия, нарушение функции и т.д.),
3) Ограниченная возможность забора пластического материала (отказ пациента, противопоказания).
4) Непрогнозируемая резорбция аутокости.
Другим материалом, применяемым при реконструкции глазницы, является аллотрансплантат (заявка RU 2004106007). Недостатком данного материала является то, что применение аллотрансплантата (деминерализованная кость, брефокость и др.) требует согласие пациента на использование трупного материала и разрешение на его использование в медицине.
В последние годы в реконструктивной хирургии лица в качестве пластического материала используют металл или искусственный материал.
Чаще всего в качестве металла используют чистый титан или титановый сплав (RU 95108615, RU 95122139, RU 2299043, WO 2007142743, RU 2211010). Титан - химически инертный материал, но, как и любой металл, обладает достаточно высокой по сравнению с костной тканью человека теплопроводностью и электропроводностью. Известно, что металлические имплантаты вызывают гальвано-электрические тканевые реакции, приводящие к металлозу окружающих тканей и коррозии металла. На основании результатов использования металлических пластин установлено, что металлы вызывают резорбцию костной ткани.
Использование твердых искусственных материалов по патентам RU 2054912, RU 2283072 в реконструктивной челюстно-лицевой хирургии ограничено из-за сложности их моделирования и фиксации.
У керамических материалов (RU 2002113392, RU 2002113391) при накоплении дисперсных продуктов износа появляется негативная реакция окружающих тканей. Хрупкость керамики ограничивает сферу применения и вызывает резорбцию кости при прямом контакте.
Использование силиконовых трансплантатов (Бельченко В.А. «Черепно-лицевая хирургия: Руководство для врачей». - М.: ООО «Медицинское информационное агентство», 2006. Стр. 77.) в зоне орбиты имеет ограниченные показания, так как материал достаточно мягкий, что неприемлемо при пластике дна орбиты и требует создания поднадкостничного «кармана» или другого метода фиксации имплантата.
Оценивая результаты лечения больных с посттравматическими дефектами и деформациями глазницы с применением различных материалов, можно сделать вывод о необходимости дальнейшего поиска материала, используемого для пластики дна и стенок орбиты, обладающего минимальной реакцией со стороны окружающих тканей и относительно дешевого. А именно данный материал должен быть биосовместим, биостабилен (не подвергается процессу старения), прочен с одной стороны и моделируем - с другой, нетоксичен, с нулевой электропроводностью и низкой теплопроводностью, а также, не ограничивающий проведение диагностических и лечебных процедур (МРТ, физиотерапию и т.д.).
За прототип выбран известный твердый имплантат для пластики посттравматических дефектов и деформаций дна и стенок глазниц (патент RU 22111010 публ. 20.04.2003). Данный имплантат для реконструкции орбиты, содержит титановую перфорированную пластину, которая вполимеризована в гидрофильную полимерную композицию при следующем соотношении компонентов, мас.%: гидроксиэтилметакрилат 50-70, сшивающий агент 0,5-0,7, остальное - вода. Имплантат может дополнительно содержать биологически активные вещества, такие как антибиотики, антисептики, гемостатические средства, протеолитические ферменты, местные анестетики, антимикробные препараты в количестве 0,01-1%.
Недостатком прототипа является то, что в основе имплантата лежит металлическая пластина. После имплантации данного имплантата пациенту, в дальнейшем, возможны ограничения при выполнении электрофизиологических методов исследования (электроэнцефалография, реоэнцефалография), компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) и непереносимость СВЧ-излучения и других физиотерапевтических процедур. В ряде случаев пациент должен сменить профессию, особенно если она связана с пребыванием в зоне низких температур, так как происходит переохлаждение зоны имплантата. Гидрофильный материал, в который вполимеризована титановая пластина, при нахождении в жидкости набухает по всем направлениям, вследствие чего создается напряжение между титановой пластиной и гидрофильным полимером. Данное напряжение может привести к расхождению полимера и титановой пластины и уменьшению надежности их соединения. Гидрофильный материал, взаимодействуя в организме с лимфой и кровью, может быть потенциальным местом микробной контаминации и очагом бактериальных инфекций. Указанные недостатки, обусловленные материалом имплантата, несомненно, ухудшают качество жизни больного.
Задачей предлагаемого изобретения является уменьшение вероятности отторжения имплантата и снижения количества различных осложнений за счет повышения биосовместимых свойств материала.
Поставленная задача решается тем, что заявляемый имплантат для пластики посттравматических дефектов и деформаций дна и стенок глазницы в виде перфорированной твердой пластины сформирован путем фотоотверждения композиции, состоящей из следующих компонентов:
2,2-диметокси-фенилацетофенон следующего строения

2,4-дитретбутилортохинон следующего строения

олигоуретанметакрилат следующего строения
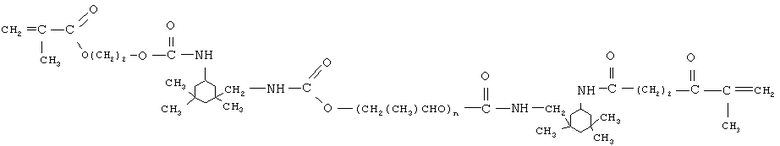
где n порядка 17,
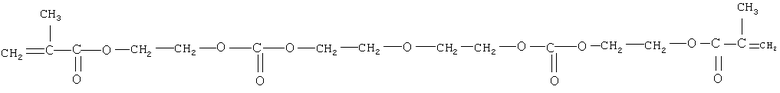
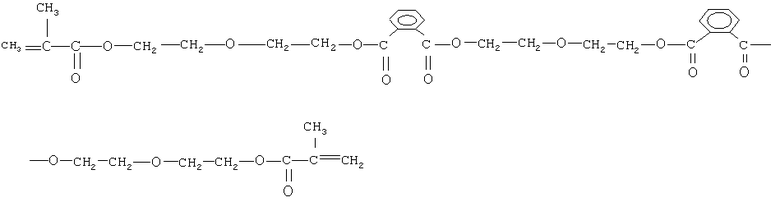
олигокарбонатметакрилат следующего строения
диметакрилатдиэтиленгликольфталат следующего строения

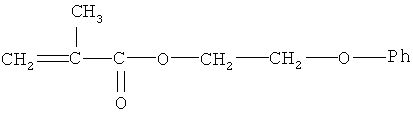
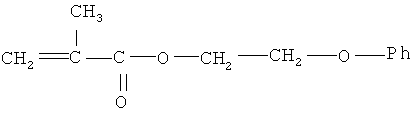
феноксиэтилметакрилат следующего строения
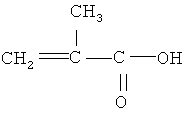
метакриловая кислота следующего строения

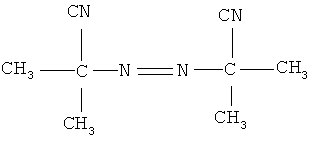
динитрилазоизомасляная кислота следующего строения
 ,
,
пигмент,
при этом вышеуказанные компоненты взяты в следующем соотношении, мас.%:
Пигмент обеспечивает непрозрачную окраску имплантата, что позволяет ему быть визуализируемым для хирурга во время операции. Выбранные параметры компонентов и их весовое соотношение обеспечивают оптимальные физико-механические свойства материала, которые позволяют моделировать имплантат при нагревании (температура стеклования 70-90°С) с сохранением приданной формы после остывания, обеспечивают высокие прочностные и биосовместимые свойства материала. Материал является гидрофобным, а температура стеклования материала много выше температуры тела человека, что гарантирует сохранение физико-механических свойств имплантата в теле человека, а именно материал остается прочным, при фиксации не прорезывается и не разрывается. Перед имплантацией пластину нагревают до необходимой температуры и изгибают так, чтобы она конгруэнтно повторяла форму глазницы в месте ее дефекта, перекрывала дефект и поддерживала глаз в правильном анатомическом положении.
Предлагаемое изобретение отвечает критерию изобретения «новизна», так как проведенные патентно-информационные исследования не выявили источников патентной и научно-технической литературы, порочащих новизну предлагаемого материала.
Предлагаемое изобретение отвечает критерию изобретения «изобретательский уровень», так как не обнаружено аналогичного материала того же назначения.
Известен материал по патенту RU 2253482, применяемый в области офтальмохирургии для изготовления оптически прозрачных твердых искусственных хрусталиков глаза, полученный путем фотоотверждения композиции, содержащей
олигокарбонатметакрилат строения
CH2=C(CH3)-C(O)O(CH2)2-O-C(O)-O-(CH2)2-O-(CH2)2-O-C(O)-O-(CH2)2-O-С(O)-С(СН3)=СН2,
2,2-диметокси-фенилацетофенон строения
С6Н5-С(O)-С(СН3)2-С6Н5,
2,4-дитретбутилортохинон строения
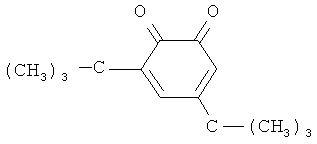
олигоуретанметакрилат строения с количеством оксипропиленовых групп n=30-35
CH2=C(CH3)-C(O)O(CH2)2-O-C(O)-NH-C6H5(CH3)-NH-C(O)-(-O-C(CH3)-CH2-)n-C(O)-NH-C6H5(CH3)-NH-C(O)-O-(CH2)2-O-C(O)-C(CH3)=CH2,
бензилметакрилат строения
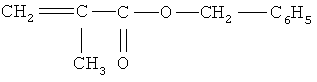
при этом вышеуказанные компоненты взяты в следующем соотношении, мас.%:
2,2-Диметокси-2-фенилацетофенон 0,1-0,7
2,4-Дитретбутилортохинон 0,001-0,006
Олигоуретанметакрилат 12-18
Бензилметакрилат 8-12
Олигокарбонатметакрилат - Остальное
Однако материал по патенту RU 2253482 не обладает достаточной прочностью, что ограничивает его моделирование и применение для замещения костных дефектов.
Заявляемый имплантат формируют следующим образом:
светочувствительную композицию полимеризуют путем экспонирования светом с длиной волны 320-380 нм фотополимеризующейся композиции указанного состава. Отличительной особенностью такого способа производства является то, что процесс формирования изделия исключает какое-либо механическое воздействие на формируемое изделие. Любое механическое воздействие на полимер, как известно, провоцирует образование свободных радикалов, которые впоследствии приводят к деструкции полимера и нежелательным токсическим реакциям. Указанный материал обладает повышенной устойчивостью в биологически активных средах, повышенной устойчивостью к окислительным процессам и процессам адсорбции белков на поверхности, предотвращающий образование грубой соединительно-тканной капсулы. Благодаря используемой фотохимической технологии, по данным ЭПР, свободные радикалы отсутствуют.
Данное изобретение поясняется следующими примерами:
Пример 1: В реакционную колбу, снабженную мешалкой, последовательно вводят компоненты в следующем соотношении, г:
Полученную смесь перемешивают при комнатной температуре до полного растворения 2,2-диметокси-2-фенилацетофенона и 2,4-дитретбутилортохинона. Имплантат изготавливают в стеклянных формах, состоящих из двух половинок, на одной из которых выполнен рисунок, например, из оксида железа с геометрическими размерами, точно соответствующими имплантату. На стеклянную половинку с рисунком прикрепляют ограничивающую рамку с заданной толщиной, равномерно распределяют композицию по внутреннему объему ограничивающей рамки и накрывают верхней стеклянной половинкой формы. Переносят собранную стеклянную форму в установку экспонирования, состоящую из источника УФ-света с длиной волны 320-380 нм и коллиматора, и проводят облучение в течение времени, необходимого для полного воспроизведения формы имплантата. После облучения форму разбирают, отделяя одну половинку формы от другой и удаляя ограничительную прокладку. Далее все операции выполняют с половинкой формы, на которой сформирован имплантат. Половинку формы с имплантатом помещают в установку проявления, состоящую из кюветы для проявителя объемом 200 мл, насоса, обеспечивающего циркуляцию проявителя, и форсунки, расположенной в крышке кюветы. Форму с имплантатом помещают в кювету, наливают проявитель - изопропиловый спирт, закрывают крышкой и включают насос. Во время проявления происходит удаление незаполимеризованной части фотоотверждаемого материала, который во время экспонирования находился под непрозрачными для УФ-света участками рисунка, выполненного на нижней половинке формы. После проявления имплантат высушивают в потоке теплого обеспыленного воздуха. Далее имплантат на половинке формы переносят в установку экспонирования, состоящую из источника УФ-света с длиной волны 320-380 нм и вакуумного насоса, обеспечивающего вакуум 10-1 мм рт.ст., и проводят стадию отжига, состоящую в дополнительном облучении имплантата. После дополнительного облучения трансплантат отделяют от формы. Получается имплантат с повышенной устойчивостью в биологически активных средах, повышенной устойчивостью к окислительным процессам и процессам адсорбции белков на поверхности, характеристики которого приведены в таблице 1.
Пример 2: В реакционную колбу, снабженную мешалкой, последовательно вводят компоненты в следующем соотношении, г:
Формируют имплантат, как в примере 1. Характеристики приведены в таблице 1.
Пример 3: В реакционную колбу, снабженную мешалкой, последовательно вводят компоненты в следующем соотношении, г:
Формируют имплантат, как в примере 1. Характеристики приведены в таблице 1.
Пример 4: В реакционную колбу, снабженную мешалкой, последовательно вводят компоненты в следующем соотношении, г:
Формируют имплантат, как в примере 1. Характеристики приведены в таблице 1.
Пример 5: В реакционную колбу, снабженную мешалкой, последовательно вводят компоненты в следующем соотношении, г:
Формируют имплантат, как в примере 1. Характеристики приведены в таблице 1.
Предлагаемый имплантат применен при лечении. Постоперационных осложнений не выявлено.
Клинические примеры:
Пример 1: Больной В., 37 лет, оперирован в отделении челюстно-лицевой хирургии по поводу перелома скулоорбитального комплекса и дна орбиты слева, двустороннего перелома нижней челюсти. Травму получил в быту 5 дней назад. (История болезни №62374).
При поступлении имелся отек и гематомы в левой скуловой области, левой орбиты и околонижнечелюстной области. При пальпации линий перелома определяется симптом «ступеньки» по нижнеглазничному краю и скулолобному шву, скулоальвеолярному гребню, болезненность при открывании рта. Имелась диплопия, онемение кожи подглазничной области. После предоперационной подготовки больной с использованием заявленного имплантата. Произведено обнажение линий перелома скуловой кости по скулолобному шву и нижнеглазничному краю через разрез кожи над линиями переломов. В зоне орбиты выполнен модифицированный трансконъюнктивальный разрез, затем проведена ревизия линий переломов и репозиция отломков скуловой кости и нижней стенки орбиты, освобождение ущемленных мышц глаза, и орбитальной клетчатки, затем остеосинтез титановыми мини-пластинами и винтами по скулолобному шву и нижнеглазничному краю. Следующим этапом являлось замещение имеющегося дефекта дна глазницы, путем укладывания на остатки костных стенок орбиты смоделированного предварительно в горячей воде заявляемого имплантата, затем его фиксация титановыми микровинтами и послойное ушивание раны. Проведена репозиция и остеосинтез перелома нижней челюсти в области восходящей ветви слева и тела справа титановыми мини-пластинами и винтами. Послеоперационный период протекал без осложнений, раны зажили первичным натяжением, диплопия устранена. Достигнут высокий косметический эффект. Глазное яблоко находится в правильном анатомическом положении. Больной выписан в удовлетворительном состоянии. При осмотре через 1, 3, 6 месяцев осложнений не выявлено.
| название | год | авторы | номер документа |
|---|---|---|---|
| МАТРИЦА ДЛЯ РЕГЕНЕРАЦИИ МЯГКИХ ТКАНЕЙ | 2013 |
|
RU2526182C1 |
| ЭЛАСТИЧНЫЙ ИСКУССТВЕННЫЙ ХРУСТАЛИК ГЛАЗА | 1998 |
|
RU2129880C1 |
| ЭЛАСТИЧНЫЙ ИСКУССТВЕННЫЙ ХРУСТАЛИК ГЛАЗА | 2000 |
|
RU2198661C2 |
| ЭЛАСТИЧНАЯ ИНТРАОКУЛЯРНАЯ ЛИНЗА С ГИДРОФИЛЬНЫМИ СВОЙСТВАМИ | 2004 |
|
RU2288494C2 |
| ИСКУССТВЕННЫЙ ХРУСТАЛИК ГЛАЗА | 2000 |
|
RU2172150C1 |
| МОНОЛИТНЫЙ ТВЕРДЫЙ ИСКУССТВЕННЫЙ ХРУСТАЛИК ГЛАЗА | 2003 |
|
RU2253482C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ЭЛАСТИЧНЫХ ИСКУССТВЕННЫХ ХРУСТАЛИКОВ ГЛАЗА | 2004 |
|
RU2275884C2 |
| МАТРИЦА ДЛЯ КЛЕТОЧНОЙ ТРАНСПЛАНТОЛОГИИ | 2011 |
|
RU2521194C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ЭЛАСТИЧНЫХ ИСКУССТВЕННЫХ ХРУСТАЛИКОВ ГЛАЗА | 2000 |
|
RU2198630C2 |
| ДРЕНАЖ ДЛЯ АНТИГЛАУКОМНЫХ ОПЕРАЦИЙ | 2006 |
|
RU2309781C1 |
Изобретение относится к медицине, конкретно к офтальмохирургии и хирургии челюстно-лицевой области, и предназначено для пластики посттравматических дефектов и деформаций дна и стенок глазницы. Описан имплантат в виде перфорированной твердой пластины, который сформирован путем фотоотверждения фотополимеризующейся композиции, при этом имплантат при нагревании (температура стеклования 70-90°С) сохраняет приданную форму после остывания, что обеспечивает высокие прочностные и биосовместимые свойства материала. Температура стеклования материала много выше температуры тела человека, что гарантирует сохранение физико-механических свойств имплантата в теле человека, а именно материал остается прочным, при фиксации не прорезывается и не разрывается. Перед имплантацией пластину нагревают до необходимой температуры и изгибают так, чтобы она конгруэнтно повторяла форму глазницы в месте ее дефекта, перекрывала дефект и поддерживала глаз в правильном анатомическом положении. Достигают уменьшения вероятности отторжения имплантата и снижения количества различных осложнений за счет повышения биосовместимых свойств материала. 1 табл., 5 пр.
Имплантат для пластики посттравматических дефектов и деформаций дна и стенок глазниц в виде перфорированной твердой пластины, отличающийся тем, что имплантат сформирован путем фотоотверждения композиции, содержащей
2,2-диметокси-фенилацетофенон следующего строения
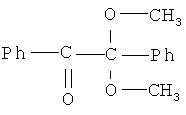
2,4-дитретбутилортохинон следующего строения

олигоуретанметакрилат следующего строения
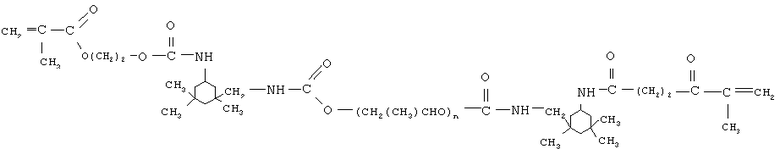
где n порядка 17,
олигокарбонатметакрилат следующего строения
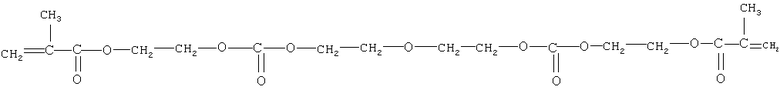
диметакрилатдиэтиленгликольфталат следующего строения
феноксиэтилметакрилат следующего строения
метакриловая кислота следующего строения
динитрилазоизомасляная кислота следующего строения

пигмент,
при этом вышеуказанные компоненты взяты в следующем соотношении, мас.%:
| RU 22111010 C2, 20.04.2003 | |||
| ЭЛАСТИЧНАЯ ИНТРАОКУЛЯРНАЯ ЛИНЗА С ГИДРОФИЛЬНЫМИ СВОЙСТВАМИ | 2004 |
|
RU2288494C2 |
| US 6277940 B1, 21.08.2001. | |||
Авторы
Даты
2013-07-20—Публикация
2011-12-21—Подача