Область техники, к которой относится изобретение
Настоящее изобретение относится к способу детекции раковых клеток или элементов раковых клеток в биологическом образце, где способ включает добавление панели агентов, которые связываются с двумя или более внеклеточными маркерами, и где, по меньшей мере, один агент является специфичным к раку. Детекцию осуществляют с помощью спектрометрического способа.
Уровень техники
Исследования прогностических факторов раковых заболеваний идентифицируют гистологический статус региональных лимфатических узлов как один из самых важных показателей выживаемости пациента. Концепция сигнального онкоузла, впервые введенная Raymond Cabanas (Cabanas et al., 1977), предполагает, что отток лимфы из первичной опухоли проходит через один конкретный региональный лимфатический узел - сигнальный онкоузел - а затем продолжается. Концепция сигнального онкоузла дает возможность для множества путей оттока из различных частей первичной опухоли, таким образом, пациент может иметь более одного сигнального онкоузла. Сигнальный онкоузел является уникальным для каждого индивидуума. Опухолевый статус этого узла отражает статус регионального лимфатического поля и имеет сильное воздействие на прогноз, как отмечается в обширных и продолжающихся исследованиях злокачественной меланомы и рака молочной железы.
Сообщается, что 5-летняя доля выживаемости достигает 89% для пациентов с диагнозом меланома, с сигнальным онкоузлом, отрицательным по метастазам опухолевых клеток. Для пациентов с диагнозом метастазированный сигнальный онкоузел, 5-летняя выживаемость снижается до 70% (Morton et al., 2003). Можно считать, что 11% умерших в группе с диагнозом «не содержащие метастазов сигнальные онкоузлы» фактически представляют собой случаи ложноотрицательного диагноза.
Благодаря убедительным доказательствам статуса сигнального онкоузла как прогностического фактора, биопсия сигнального онкоузла и возможная оценка присутствия или отсутствия метастатических опухолевых клеток стала рутинной процедурой для определения стадии заболевания во многих странах.
Диагноз для сигнального онкоузла также имеет влияние на стратегию лечения, выбираемую после диагностики сигнального онкоузла. Если статус сигнального онкоузла может быть быстро определен, это может также дать ценную информацию для принятия решения во время операции.
Сегодня рутинная процедура оценки сигнального лимфатического узла представляет собой послеоперационное гистопатологическое исследование зафиксированных в формалине погруженных в парафин срезов от нескольких уровней узла. Однако микрометастазы, расположенные между срезами, могут быть не замечены. Одна из дополнительных разработок представляет собой интраоперативное исследование сигнального онкоузла. В этом способе тонкие замороженные срезы (толщиной примерно 5 мкм) лимфатического узла окрашивают гематоксилином и эозином. Замороженные срезы исследуются затем патологоанатомом под микроскопом. Результат сообщают обратно в операционную, и может быть принято решение, например, о продолжении операции с иссечением лимфатического узла, если узел содержит опухолевые клетки. После операции образцы также иногда иммунногистохимически окрашивают маркерами, специфичными к исследуемому типу рака, которые облегчают детекцию микрометастазов. Примеры целевых маркеров представляют собой HMB-45 для злокачественной меланомы и цитокератин-20 для рака толстой кишки и молочной железы.
Эти рутинные процедуры детекции опухолевых клеток имеют различные недостатки. Они требуют продолжительного времени, уменьшают возможность получения важной информации во время операции на первичной опухоли. В самом плохом случае, они является также неточными, поскольку исследуется только малая доля (очень тонкие срезы) лимфатического узла и микрометастазы вне этих срезов неизбежно не будут детектироваться. Вероятность детекции метастазов с использованием рутинного скрининга замороженных срезов, окрашенных цитокератином-20, также зависит от размера метастазы. В конкретных исследованиях с сигнальными онкоузлами рака молочной железы (Weaver et al., 2006), вероятность появления необнаруженных метастазов ≤0,10 мм, как обнаружено, составляет 61%. Для метастазов ≤0,05 мм и ≤0,02 мм вероятность появления необнаруженных опухолевых клеток составляет 69% и 75%, соответственно. Способ также зависит от индивидуального опыта патологоанатома по детекции опухолевых клеток. Последняя общая проблема современного способа представляет собой нехватку специалистов в данной области в больничных лабораториях, что оказывает влияние на доступность и стоимость этих процедур.
Сообщают также об альтернативных методиках детекции, включая полимеразную цепную реакцию с обратной транскриптазой (RT-PCR) и с использованием проточной цитометрии. Методика RT-PCR является более чувствительной, чем гистопатологический способ, но требует также продолжительного времени, и способ, как обнаружено, дает ложноположительные результаты (Merrie et al., 1999; Noguchi et al., 1999). В дополнение к этому, мРНК является чувствительной к деградации, и эта особенность делает манипуляции с образцом и его транспортировку в рутинных клинических условиях сложными.
Проточно-цитометрические подходы, как сообщается, обладают более высокой чувствительностью, чем обычные методики (Leers et al., 2002). Пока что, способы, включающие проточную цитометрию как инструмент детекции опухолевых клеток в лимфатических узлах, основываются на окрашивании с помощью моноклональных антител против внутриклеточных маркеров, таких как цитокератин-20, белок, продуцируемый различными раковыми клетками (например, раковыми клетками молочной железы и толстой кишки), и ДНК.
Базирование на цитокератине-20 вносит риск ложноположительного диагноза, поскольку этот белок не экспрессируется исключительно опухолевыми клетками. Эксперименты показывают, что этот белок экспрессируется также в клетках, присутствующих в периферической крови здоровых субъектов. Соответственно, возникает необходимость в определении значения «точки разделения» между положительным и отрицательным диагнозом, которое неизбежно несет с собой риск ложного результата.
При использовании внутриклеточных маркеров, подобных цитокератину-20 или HMB-45, также требуется дополнительная стадия процедуры окрашивания антител. Клетки должны быть сделаны проницаемыми, например, с помощью сапонина, перед тем, как моноклональные антитела смогут достичь своих мишеней, что добавляет к процедуре, по меньшей мере, 30 минут.
Кроме того, паттерн экспрессии сильно отличается для различных опухолевых клеток и использование только одного маркера влечет за собой риск получения ложноотрицательных результатов.
Описание изобретения
Настоящее изобретение относится к способу детекции раковых клеток или элементов раковых клеток в биологическом образце, включающему добавление панели агентов, которые связываются с двумя или более внеклеточными маркерами, и где, по меньшей мере, один агент является специфичным к раку. Детекцию осуществляют с помощью спектрометрического способа. Настоящее изобретение, таким образом, охватывает одностадийный способ посредством использования панели агентов, которые добавляют к указанному биологическому образцу, что тем самым позволяет напрямую одновременно детектировать несколько маркеров, специфичных к раку, таким образом, исключая стадию иссечения сигнального онкоузла, окрашивания иссеченного образца и последующего осмотра опытным патологоанатомом. Как следствие, настоящее изобретение делает возможным значительно более быстрый, устойчивый, стандартизованный аналитический способ, основывающийся на не-субъективных физических характеристиках, с более высокой специфичностью, чувствительностью и воспроизводимостью.
Настоящее изобретение имеет различные применения. В первом диагностическом применении способ может использоваться для детекции опухолевых клеток в сигнальных онкоузлах, дренирующих узлах (metinel nodes) или других лимфатических узлах. Как обсуждается выше, детекция опухолевых клеток в сигнальных онкоузлах представляет собой широко используемую процедуру для определения стадии рака. Применение панели агентов, связывающихся с внеклеточными маркерами, которые идентифицируют определенный тип опухоли, позволяет детектировать опухолевые клетки с очень высокой чувствительностью и специфичностью. Подобный способ может применяться также и для детекции раковых клеток в других тканях.
Во втором диагностическом применении, настоящее изобретение может использоваться для определения типа первичной опухоли у пациентов с метастазами неизвестного происхождения. С помощью использования панели или панелей агентов, связывающихся с внеклеточными маркерами, которые являются специфичными к определенным типам рака и/или типам тканей, способ может давать разнообразные ключи при поиске местоположения первичной опухоли.
Еще в одном применении настоящего изобретения, способ может использоваться для мониторинга культуры клеток для клеточной терапии против рака (так называемой адоптивной иммунотерапии). Использование лимфоцитов сигнального онкоузла в адоптивной иммунотерапии вызывает необходимость в детекции раковых клеток в клеточной суспензии. В этом применении, панель агентов, связывающихся с внеклеточными маркерами, идентифицирующими тип рака, подлежащий лечению, может использоваться для определения того, что раковые клетки отсутствуют в культуре клеток, перед введением клеток обратно пациенту. Это применение может также использоваться для мониторинга пациентов во время лечения и может использоваться в качестве инструмента для оценки эффективности режима лечения, а также инструмента для принятия решений при выборе соответствующей терапии.
Применение настоящего изобретения для детекции опухолевых клеток может быть достигнуто посредством приготовления клеточной суспензии из различных типов тканей. На следующей стадии клеточная суспензия или образец из нее инкубируется вместе с панелью моноклональных антител, конъюгированных с флуорофором, связывающихся с маркерами, которые идентифицируют тип рака, который должен детектироваться. После инкубирования в течение некоторого времени и промывки, образец анализируют с использованием проточной цитометрии, и результаты анализов являются легкодоступными.
Как упоминалось, клеточная суспензия может быть приготовлена из различных источников, таких, например, как лимфатическая система, сигнальные онкоузлы, дренирующие узлы, другие лимфатические узлы, ткани опухолей, другие ткани, кровь и/или плазма.
Во втором диагностическом применении, для идентификации первичной опухоли, клеточную суспензию приготавливают либо из лимфатического узла дренирующего метастазы неизвестного происхождения, либо из биопсии метастазов. В зависимости от того, где именно в организме обнаруживают метастазы, несколько панелей конъюгированных с флуорофором моноклональных антител может быть использовано для идентификации конкретных типов первичных опухолей, которые часто дают метастазы в орган или ткань, где обнаруживают метастазы. Клеточную суспензию может оказаться необходимым разделить на несколько образцов, все они инкубируются с различным панелями антител, для скрининга типа опухоли, которая дает метастазы. Анализы с использованием проточной цитометрии возможны также и в этом применении настоящего изобретения.
Верификация отсутствия опухолевых клеток в культуре клеток для клеточной терапии против рака может достигаться с использованием способа, сходного с детекцией опухолевых клеток в лимфатических узлах. В этом применении настоящего изобретения клеточную суспензию приготавливают из образца культуры клеток. С использованием такого же типа панели моноклональных антител, как для применения при детекции опухолевых клеток, клеточная суспензия инкубируется, промывается и, наконец, анализируется с использованием проточной цитометрии.
Определения
Термин «агенты», как используется в настоящем документе, относится ко всем агентам, способным к связыванию или взаимодействию с внеклеточными маркерами, охватывая как уже известные агенты, такие, например, как коммерчески доступные моноклональные антитела, так и агенты, которые будут генерироваться. Примеры соответствующих агентов представляют собой моноклональные антитела, поликлональные антитела, фрагменты Fab, фрагменты (Fab')2, фрагменты Fv, пептиды, белки, молекулы ДНК, полисахариды или любое их сочетание.
Термин «панель агентов», как предполагается, означает панель, содержащую два или более агентов, так, например, как три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более агентов, девять или более или десять или более агентов. Количество выбранных агентов может зависеть от количества маркеров, которые должны подвергаться скринингу, и/или от возможностей оборудования, используемого в способе для количественного определения количества индивидуальных клеток, то есть от того, сколько агентов может оборудование детектировать одновременно. Количество агентов, специфичных к раку, в панели зависит от конкретного применения, однако присутствуют один или несколько агентов, специфичных к раку, так, например, как два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более агентов, девять или более или десять или более агентов. Предпочтительно используют гораздо больше специфичных агентов, так, например, как, по меньшей мере, 20, по меньшей мере, 30, по меньшей мере, 40, по меньшей мере, 50, по меньшей мере, 75 или, по меньшей мере, 100, в зависимости от доступности агентов, специфичных к раку. Специфичные к раку агенты в панели могут все быть специфичными к одному типу рака или могут иметь специфичность для различных типов рака.
Термин «антитела», как здесь используется, относится ко всем типам иммуноглобулинов, включая IgG, IgM, IgA, IgD, IgE и IgY. Антитела могут быть моноклональными или поликлональными и могут происходить от любых видов, включая (например) мышь, крысу, кролика, лошадь, курицу или человека, или могут представлять собой химерные антитела. Поликлональные антитела, используемые для осуществления настоящего изобретения, могут быть получены с помощью иммунизации соответствующих животных (например, кролика, козы, и тому подобное) с помощью антигена, сбора иммунной сыворотки от животного и выделения поликлональных антител из иммунной сыворотки в соответствии с известными процедурами.
Моноклональные антитела, используемые для осуществления настоящего изобретения, могут быть получены в линии клеток гибридом в соответствии с известными методиками.
«Фрагменты антитела», включенные в рамки настоящего изобретения, включают, например, Fab, F(ab')2 и фрагменты Fv, и соответствующие фрагменты, полученные из антител, отличных от IgG. Такие фрагменты могут быть получены с помощью известных методик.
Термин «внеклеточный маркер», как здесь используется, относится к маркерам, экспрессируемым на поверхности клеток.
Термин «тканеспецифичный внеклеточный маркер», как здесь используется, относится к маркеру, который экспрессируется на поверхности клетки, принадлежащей к определенному типу тканей, например, к ткани эпителиального или мезенхимального происхождения.
Термин «внеклеточный маркер, специфичный к раку» относится к маркеру, экспрессируемому на поверхности раковых клеток, в то время как термин «внеклеточный маркер, специфичный к типу рака» относится к маркеру, экспрессируемому на поверхности определенного типа раковых клеток, то есть на поверхности раковых клеток толстой кишки, раковых клеток молочной железы, и тому подобное. Термин «внеклеточный маркер, специфичный к субтипу рака» относится к маркеру, экспрессируемому на поверхности раковых клеток, где маркер является показательным для конкретных характеристик раковых клеток, таких как, например, агрессивность, метастатические свойства, инвазивность, способность к иммунносупрессии, чувствительность к химиотерапии, и присутствие антигенов опухоли, релевантных при иммунотерапии.
Термин «сигнальный лимфатический узел», как предполагается, означает первый лимфатический узел (узлы), который должен принимать отток лимфы от опухоли. Термин «дренирующий лимфатический узел» относится к первому лимфатическому узлу (узлам), который должен принимать отток лимфы от метастазов.
Термин «истинно положительный», как предполагается, означает исследуемый образец, правильно характеризуемый как положительный.
Термин «ложноположительный», как предполагается, означает исследуемый образец, ложно характеризуемый как положительный.
Термин «истинно отрицательный», как предполагается, означает исследуемый образец, правильно характеризуемый как отрицательный.
Термин «ложноотрицательный», как предполагается, означает исследуемый образец, ложно характеризуемый как отрицательный.
Термин «чувствительность», как предполагается, означает меру, которую вычисляют с использованием следующей формулы:
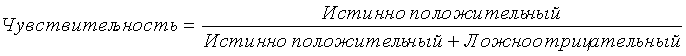
Термин «специфичность», как предполагается, означает, меру, которую вычисляют с использованием следующей формулы:
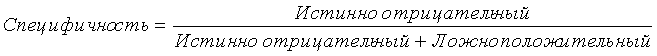
Термин «отрицательное предикативное значение (NPV)», как предполагается, означает меру, которую вычисляют с использованием следующей формулы:
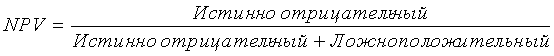
Термин «воспроизводимость», как предполагается, означает возможность независимого воспроизведения исследования с такими же результатами исследования, такую, например, как вариабельность для разных анализов и в пределах одного анализа, меньшую, чем 10%.
Термин «мечение агентов», как предполагается, означает конъюгирование агента с молекулой, детектируемой с помощью инструмента, такого, например, как ферменты, флуоресцентные молекулы, радиоактивные молекулы, биотин, олигонуклеотиды и/или полисахариды.
Термин «значение точки разделения», как предполагается, означает значение, которое считается значением, которое дает правильное различие между случаями положительных и отрицательных пациентов (по состоянию здоровья).
Панель агентов может использоваться для детекции раковых клеток, присутствующих в организме человека или животного, как, например, в крови или в тканях. Однако в конкретном варианте осуществления, применение относится к использованию панели агентов, связывающихся с внеклеточными маркерами, где, по меньшей мере, один из агентов является специфичным к раку, для детекции диссеминированных в ткани раковых клеток.
Даже, несмотря на то, что панель агентов может использоваться для детекции раковых клеток в любом месте в организме человека или животного, использование панели агентов будет в дальнейшем иллюстрироваться и обсуждаться более подробно для детекции раковых клеток в лимфатической системе, без ограничения настоящего изобретения каким-либо образом конкретным описанием.
Как рассмотрено выше, оценки присутствия или отсутствия опухолевых клеток в сигнальных или дренирующих лимфатических узлах являются очень важными для определения стадии рака, а также оказывают влияние на выбранную стратегию лечения. Если статус сигнального или дренирующего узла (узлов) может быть быстро определен, это может также давать ценную информацию для принятия решения во время операции. Соответственно, настоящее изобретение относится к способу детекции раковых клеток или элементов раковых клеток в биологическом образце, включающему добавление к указанному биологическому образцу панели агентов, которые связываются с двумя или более различными внеклеточными маркерами, где, по меньшей мере, один из агентов является специфичным к раку. Детекция раковых клеток или элементов клеток может осуществляться с помощью спектрометрического способа. Спектрометрический способ может быть, без ограничения, способным к детекции прямого рассеяния, бокового рассеяния и флюоресценции образца. Спектрометрический способ может представлять собой, без ограничения, проточный цитометр.
В предпочтительном варианте осуществления настоящего изобретения спектроскопический способ представляет собой проточную цитометрию.
Как рассмотрено выше, известные методики, доступные для детекции раковых клеток в сигнальных или дренирующих лимфатических узлах, имеют множество недостатков.
Преимущество: Более высокая чувствительность
В гистопатологических и иммуногистохимических способах, используемых сегодня для исследования лимфатических узлов, лимфатические узлы разрезают на тонкие замороженные срезы и окрашивают. Однако, поскольку исследуется только малая фракция лимфатического узла, микрометастазы вне выбранных срезов неизбежно не будут детектироваться. Также, даже если опухолевые клетки присутствуют в срезах, скрининг вручную с помощью гистопатологических и иммуногистохимических способов часто пропускает малые метастазы (≤ 0,10 мм) и индивидуальные раковые клетки (Weaver et al.)
В настоящем изобретении, клеточная суспензия из отдельных клеток сигнального или дренирующего узла (узлов) приготавливается после удаления сигнального или дренирующего лимфатического узла (узлов). Образцы клеточной суспензии инкубируют вместе с панелью агентов, нацеленных на внеклеточные маркеры, и большое количество клеток, такое, например, как 100000 клеток или более, анализируется затем с помощью способа, способного к количественному определению и пропорции индивидуальных клеток, экспрессирующих специфичные внеклеточные маркеры. Соответственно, посредством использования клеточной суспензии из одного или нескольких сигнальных или дренирующих лимфатических узлов получают рандомизированную популяцию клеток, репрезентативных для одного или нескольких цельных лимфатических узлов. Кроме того, анализы относительно большого количества клеток дают статистически надежное доказательство отсутствия или присутствия опухолевых клеток.
Соответственно, одно из преимуществ настоящего изобретения, обеспечиваемое по сравнению с известными методиками, представляет собой очень высокую чувствительность. То есть посредством использования панели агентов, как здесь обсуждается, раковые клетки могут детектироваться с чувствительностью 90% или более, такой, например, как 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более или 100%, что означает, что 90% или более, так, например, как 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более или 100% сигнальных или дренирующих узлов, содержащих раковые клетки, будут правильно диагностироваться как положительные.
Преимущество более высокой чувствительности с использованием настоящего изобретения возрастает по своему значению с уменьшением размеров метастазов. Поскольку настоящее изобретение анализирует большое количество индивидуальных клеток, вероятность детекции метастазов зависит только от общего количества опухолевых клеток, присутствующих в лимфатическом узле. Для обычных способов, вероятность детекции, как показано, зависит также от размеров метастазов. В качестве примера, чувствительность детекции с помощью антицитокератиновой иммунногистохимии, как обнаружено, составляет только 53% для сигнальных онкоузлов при раке молочной железы, изначально классифицируемых как отрицательные путем гистопатологического скрининга. Риск появления необнаруженных метастазов, как обнаружено, увеличивается с уменьшением их размеров. Вероятность появления необнаруженных метастазов ≤0,10 мм, как обнаружено, составляет 61%. Для метастазов ≤0,05 мм и ≤0,02 вероятность появления необнаруженных присутствующих опухолевых клеток составляет 69% и 75%, соответственно (Weaver et al.).
Общая чувствительность гистопатологии с гематоксилиновым и эозиновым окрашиванием составляет приблизительно 50%. Для скрининга с помощью гистопатологии, с последующей анти-цитокератиновой иммунногистохимией, общая чувствительность составляет приблизительно 80%. То есть настоящий способ дает гораздо более высокую чувствительность, чем используемые в настоящее время способы идентификации опухолевых клеток в образце лимфатического узла.
Преимущество: Более высокая специфичность
Другое преимущество настоящего изобретения заключается в том, что с помощью одновременного анализа нескольких маркеров получают более подробную информацию о приблизительно каждом образце, таким образом, понижая риск ложноположительных результатов, принимая во внимание индивидуальный разброс в экспрессии клеток. Способ также не основывается на детекции цитокератина-20, который, как обсуждалось ранее, не является специфичным к раку маркером, что дополнительно снижает риск ложноположительного диагноза.
То есть посредством использования панели агентов, как обсуждается здесь, раковые клетки могут быть детектированы со специфичностью 95% или более, такой, например, как 96% или более, 97% или более, 98% или более, или 99% или более или 100%, что подразумевает, что 95% или более, так, например, как 96% или более, 97% или более, 98% или более, или 99% или более или 100% сигнальных или дренирующих лимфатических узлов, не содержащих раковых клеток, будут правильно диагностированы как отрицательные.
Другой путь для выражения улучшения чувствительности и специфичности настоящего изобретения заключается в получении отрицательных предикативных значений, то есть, чтобы вероятность диагностирования сигнальных или дренирующих узлов, как не содержащих раковых клеток, была правильно диагностирована. Это значение отражает сочетание высокой чувствительности и специфичности. В то время как другие известные в настоящее время методики, используемые на данный момент, ставят специфичность выше чувствительности, настоящее изобретение позволяет поддерживать высокие уровни, как чувствительности, так и специфичности.
Соответственно, в настоящем изобретении является возможным объединение высокой чувствительности и специфичности, то есть раковые клетки могут быть детектированы с очень высоким отрицательным предикативным значением.
Соответственно, настоящее изобретение относится к использованию, в котором раковые клетки могут быть детектированы с отрицательным предикативным значением 90% или более, таким, например, как 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более или 100%, что означает, что если образец идентифицируется как отрицательный относительно раковых клеток с помощью способа, обсуждаемого здесь, вероятность того, что образец действительно является отрицательным, составляет 90% или более, так, например, как 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более или даже 100%.
Высокое отрицательное предикативное значение является благоприятным для способа, как здесь обсуждается, поскольку для пациента риск удаления какой-либо здоровой ткани во время операции сильно уменьшается.
Преимущество: Более высокая воспроизводимость
Другое преимущество настоящего изобретения заключается в том, что его легко осуществлять с высокой воспроизводимостью. Таким образом, вариабельность для разных анализов и в пределах одного анализа меньше, чем 10%, так, например, как меньше, чем 9%, меньше, чем 8%, меньше чем 7%, меньше, чем 6%, меньше, чем 5%, меньше, чем 4%, меньше, чем 3%, меньше, чем 2%, или меньше, чем 1%. Соответственно, процедура может быть стандартизована и осуществлена широким диапазоном профессионалов, таких, например, как клинические биохимики и клинические лабораторные исследователи. Для сравнения, используемые в настоящее время гистопатологические способы требуют присутствия опытного патологоанатома, что также приводит к гораздо более субъективной оценке образцов, поскольку может иметься вариабельность до 30-35% между наблюдениями двух различных патологоанатомов.
Преимущество: Более высокая скорость
Другое преимущество настоящего изобретения заключается в том, что анализы присутствия или отсутствия раковых клеток в образце человека или животного могут осуществляться за очень короткое время. Это особенно важно, если способ используют для интраоперативного диагноза метастазов и микрометастаза лимфатического узла, что позволяет получать диагноз, например, во время операции на первичной опухоли.
Соответственно, в настоящем изобретении раковые клетки могут быть детектированы в пределах 25 минут или меньше, так, например, как в пределах 20 минут или меньше, в пределах 15 минут или меньше, в пределах 10 минут или меньше.
Для сравнения, известная методика иммуногистохимического окрашивания, которая широко используется, требует нескольких часов для завершения.
Окрашивание клеток посредством использования внутриклеточного маркера цитокератина-20 имеет тот недостаток, что клетки должны быть пермеабилизованы с помощью сапонина, чтобы дать возможность для поступления агентов в клетки, тем самым добавляя время к процедуре. Среднее время для осуществления анализов с использованием цитокератина-20 составляет примерно 45 минут. Соответственно, посредством использования агентов, связывающихся с внеклеточными маркерами, время анализов значительно уменьшается.
Обычные гистопатологические анализы замороженных срезов тканей могут сделать возможным быстрый диагноз в пределах, может быть, 20 минут, но чувствительность такого способа для детекции, например, микрометастаз, является гораздо более низкой, чем чувствительность панели, обсуждаемой здесь, поскольку исследуют только малую фракцию лимфатического узла, и оценка образцов являются субъективной, как обсуждается выше. Эксперименты, также осуществляемые с использованием RT-PCR для диагностики метастазов в лимфатическом узле, приводят к получению высокой чувствительности, однако то количество времени, которое обычно требуется для их осуществления, делает такие анализы совершено непригодными для интраоперативного принятия решения. По сравнению с этим, использование панели в соответствии с настоящим изобретением дает очень высокую чувствительность и специфичность, в сочетании с коротким временем анализа.
Как рассмотрено выше, панели агентов для использования в настоящем изобретении могут иметь сильно варьирующийся состав в зависимости от конкретного применения. Впоследствии будут приведены примеры конкретных применений и составов панелей для лучшего описания настоящего изобретения. Однако они не должны рассматриваться как ограничивающие настоящее изобретение каким-либо образом.
Применение панелей и выбор агентов
Детекция раковых клеток с помощью их фенотипических свойств может следовать двум различным «стратегиям». Первая стратегия заключается в поиске маркеров, которые изменяют уровень экспрессии, когда клетка становится злокачественной. С помощью данных, показывающих, что определенный тип рака часто экспрессирует определенный маркер, в то время как нормальная клетка, происходящая от той же ткани, не делает этого, можно предположить, что клетка является злокачественной. В этом случае, маркер может быть назван «специфичным к раку» или «специфичным к типу рака».
Вторая стратегия представляет собой поиск эктопических клеток, то есть поиск маркеров, которые, как правило, не должны экспрессироваться в тканях, где собирают анализируемые клетки. С помощью таких данных, что определенный маркер, как правило, экспрессируется в одном типе тканей и не экспрессируется в ткани, где собирают клетки, опять же можно предположить, что клетка является злокачественной. В этом случае, ищут «маркеры, специфичные к ткани».
Однако детекция раковых клеток по их фенотипу не является простой задачей. Раковые клетки происходят от нормальных, «здоровых», клеток, и, разумеется, многие поверхностные маркеры являются общими для нормальных клеток и злокачественных клеток. В дополнение к этому, раковые клетки демонстрируют незрелый фенотип, экспрессирующий белки развития, белки, которые на ранних стадиях дифференциации являются общими для многих клеточных линий коммитированных стволовых клеток. Разница часто заключается в уровне экспрессии некоторых маркеров.
Также, поскольку событие превращения нормальной клетки в злокачественную клетку вызывается генетической дисфункцией, профиль экспрессии раковых клеток является уникальным для каждого индивидуума и может различаться даже между раковыми клетками одинакового происхождения.
Как вывод, один и тот же маркер может в некоторых случаях давать доказательство того, что клетка, экспрессирующая этот маркер, представляет собой раковую клетку, а в другом случае не давать. Назначение определенного маркера «маркером рака», таким образом, должно быть проделано с помощью дополнительной информации, такой как то, какой тип рака должен детектироваться, с какой частотой определенный маркер экспрессируется определенным типом рака, и в какой ткани обнаружена клетка, экспрессирующая маркер.
Детекция раковых клеток должна, таким образом, в идеале, учитывать индивидуальные вариации. Один и тот же определенный маркер может экспрессироваться многими клетками определенного типа рака, но не всеми клетками. Злокачественные клетки, происходящие от определенной ткани, могут потерять экспрессию определенного маркера, как правило, экспрессируемого этой тканью.
В противоположность способам, основывающимся только на одном маркере для детекции раковых клеток, использование панелей агентов, связывающихся с несколькими маркерами, понижает риск как ложноположительных, так и ложноотрицательных результатов. Применение по настоящему изобретению позволяет детектировать несколько маркеров, специфичных к раку, маркеров, специфичных к типу рака, и маркеров, специфичных к ткани, одновременно. Неспособность раковых клеток к экспрессии одного определенного маркера может затем компенсироваться с помощью детекции другого маркера.
В применении по настоящему изобретению для детекции раковых клеток в сигнальных онкоузлах, дренирующих узлах или в других лимфатических узлах, является также возможным использование первичной опухоли как положительного контроля для проверочного исследования. Это дополнительно понижает риск ложного результата исследования.
Известная первичная опухоль: выбор агентов
Одна из систем, где панели, обсуждаемые здесь, являются очень полезными для использования, предназначена для детекции распространения рака, то есть присутствия метастазов, включая микрометастазы, в лимфоидной системе, такие как метастазы в сигнальных и/или дренирующих лимфатических узлах.
Панели для использования в такой системе предпочтительно должны содержать один или несколько агентов, связывающихся с общими тканеспецифичными внеклеточными маркерами, такими например, как эпителиальные и/или мезенхимальные внеклеточные маркеры. Почти все раковые клетки будут экспрессировать, по меньшей мере, один из этих маркеров, поскольку они получаются либо из эпителиальных, либо из мезенхимальных клеток. В противоположность этому, большинство клеток, присутствующих в здоровом лимфатическом узле, как правило, не экспрессируют такие маркеры. Соответственно, с помощью включения, по меньшей мере, одного агента, связывающегося с общими эпителиальными и/или мезенхимальными маркерами, обеспечивается то, что любая клетка, как правило, не присутствующая в лимфатическом узле, детектируется. Однако, поскольку некоторые незлокачественные клетки, имеющие тканеспецифичные внеклеточные маркеры, могут также присутствовать в лимфатических узлах (например, клетки невусов, содержащие мезенхимальные внеклеточные маркеры), является важным, чтобы панель содержала, по меньшей мере, один специфичный к раку агент.
Соответственно, панели должны содержать один или несколько агентов, связывающихся со специфичными к раку, специфичными к типу рака и/или специфичными к субтипу рака внеклеточными маркерами. В принципе, может использоваться любой такой агент или маркер, который уже идентифицирован или неизвестен в настоящее время. Далее приводятся примеры, без ограничения ими настоящего изобретения.
Маркеры, которые могут использоваться, включают специфичные внеклеточные маркеры, общие эпителиальные маркеры, эпителиальный специфичный антиген, эпидермальный фактор роста, мезенхимальные внеклеточные маркеры, маркеры, специфичные к типу рака, и маркеры, специфичные к субтипу рака, а также маркеры для «солидных опухолей и других типов опухолей», для раковых клеток толстой кишки, раковых клеток мочевого пузыря, клеток злокачественной меланомы, раковых клеток молочной железы, раковых клеток предстательной железы, раковых клеток яичников, раковых клеток легких. Конкретные примеры маркеров представляют собой BC-10, углеводный антиген 125 (CA125), углеводный антиген 15-3 (CA15-3), углеводный антиген 19-9 (CA19-9), углеводный антиген 242 (CA242), раковоэмбриональный антиген (CEA), Ep-CAM, G250, MDR1, MDR2, MSH-R, NY-ESO-1, PRL-R, PSMA, RCAS1, STN, TA-90 и бета 2-микроглобулин (B2M).
Агенты, которые могут использоваться, включают агенты, связывающиеся с тканеспецифичными внеклеточными маркерами, общими эпителиальными маркерами, мезенхимальными внеклеточными маркерами, специфичными к типу рака, и/или специфичными к субтипу рака внеклеточными маркерами, и агенты, связывающиеся с внеклеточными маркерами, специфичными к типу рака, выбранными из маркеров рака молочной железы, рака толстой кишки, рака пищевода, рака почек, рака печени, рака легких, злокачественной меланомы, рака яичников, рака поджелудочной железы, рака предстательной железы, рака прямой кишки, рака желудка, рака щитовидной железы или любого их сочетания. Кроме того, возможные агенты включают в себя моноклональные антитела или их фрагменты, связывающиеся с одним или несколькими маркерами, характерными для рака толстой кишки, клеток злокачественной меланомы, раковых клеток молочной железы, раковых клеток предстательной железы, раковых клеток яичников, раковых клеток легких. Конкретные примеры агентов представляют собой моноклональные антитела к раковоэмбриональному антигену (CEA), углеводному антигену 15-3 (CA15-3), углеводному антигену 125 (CA125), углеводному антигену 19-9 (CA19-9), углеводному антигену 242 (CA242), Ep-CAM, G250, RCAS1, STN, TA-90, BC-10, NY-ESO-1, MSH-R, PRL-R и PSMA.
Как рассмотрено выше, агенты, связывающиеся с маркерами, характерными для конкретного субтипа раковых клеток (специфичными к субтипу рака внеклеточными маркерами), могут также включаться в панели. Примеры таких маркеров могут представлять собой маркеры, показывающие следующие характеристики опухоли/опухолевых клеток, а именно, например, агрессивность, метастатические свойства, инвазивность, способность к иммунносупрессии, чувствительность к химиотерапии, и присутствие антигенов опухоли, релевантных для иммунотерапии. Посредством анализа присутствия таких маркеров, лечение рака может планироваться на основе конкретного субтипа опухоли. Например, является известным, что имеется ряд мембранных белков, называемых белками множественной лекарственной устойчивости (MDR), которые могут тяжело экспрессироваться в раковых клетки и способны выкачивать антиканцерогенные агенты из раковых клеток, оставляя раковые клетки нечувствительными или менее чувствительными к антиканцерогенным веществам. С помощью включения одного или нескольких маркеров, связывающихся с MDR, является возможным определение того, будут ли раковые клетки чувствительными к химиотерапевтическому лечению, и если да, осуществление химиотерапии как части этого режима лечения. Однако если раковые клетки, как показано, являются нечувствительными к химиотерапии, другие режимы лечения могут быть подобраны непосредственно.
Неизвестная первичная опухоль: выбор агентов
Другое использование панели, как здесь обсуждается, представляет собой идентификацию происхождения раковых метастазов, то есть ситуацию, когда у пациента идентифицируют один или несколько метастазов, однако положение первичной опухоли, имеющей метастазы, является неизвестным.
Теоретически первичные опухоли происходят из клеток, присутствующих в органах или тканях, в которых опухоль развивается. Метастаз первичной опухоли определяется как рак, полученный из распространяющейся первичной опухоли. Процесс распространения метастазов зависит от раковых клеток, приобретающих две отдельных способности - увеличение подвижности и инвазивность. Клетки, которые дают метастазы, в основном принадлежат к тому же виду, что и клетки исходной опухоли. Если рак возникает, например, в толстой кишке, и дает метастазы, например, в печени, то раковые клетки в печени представляют собой раковые клетки толстой кишки. Однако клетки приобретают увеличенную подвижность и способность к инвазии в другой орган.
Посредством использования панели в соответствии с настоящим изобретением, содержащей один или несколько агентов, связывающихся с внеклеточными маркерами, специфичными к типу рака и/или специфичными к субтипу рака, может быть возможным определение происхождения метастазов, то есть определение того, в какой ткани развивается первичная опухоль.
Кроме того, панели могут содержать один или несколько агентов, связывающихся с тканеспецифичными внеклеточными маркерами, такими, например, как общие эпителиальные и/или мезенхимальные внеклеточные маркеры.
Метастаз может быть обнаружен где угодно в организме человека или животного, однако наиболее распространенные места обнаружения метастазов, представляют собой лимфатические узлы, печень, легкие, скелет, мозг, яичники, надпочечники и брюшную полость.
Соответственно, панель должна содержать один или несколько агентов, связывающихся со специфичными к раку, специфичными к типу рака и/или специфичными к субтипу рака внеклеточными маркерами. В принципе, может использоваться любой такой агент или маркер, который уже идентифицирован или является неизвестным в настоящее время. Далее приводятся примеры, без ограничения ими настоящего изобретения.
Маркеры, которые могут использоваться, включают специфичные внеклеточные маркеры, общие эпителиальные маркеры, эпителиальный специфичный антиген, эпидермальный фактор роста, мезенхимальные внеклеточные маркеры и маркеры, специфичные к типу рака, а также маркеры для раковых клеток толстой кишки, раковых клеток мочевого пузыря, клеток злокачественной меланомы, раковых клеток молочной железы, раковых клеток предстательной железы, раковых клеток яичников, раковых клеток легких. Конкретные примеры маркеров представляют собой BC-10, углеводный антиген 125 (CA125), углеводный антиген 15-3 (CA15-3), углеводный антиген 19-9 (CA19-9), углеводный антиген 242 (CA242), раковоэмбриональный антиген (CEA), Ep-CAM, G250, MDR1, MDR2, MSH-R, NY-ESO-1, PRL-R, PSMA, RCAS1, STN, TA-90 и бета 2-микроглобулин (B2M).
Агенты, которые могут использоваться, включают агенты, связывающиеся с тканеспецифичными внеклеточными маркерами, общими эпителиальными маркерами, мезенхимальными внеклеточными маркерами, специфичными к типу рака, и/или специфичными к субтипу рака внеклеточными маркерами, а также агенты, связывающиеся с внеклеточными маркерами, специфичными к субтипу рака, выбранными из маркеров рака молочной железы, рака толстой кишки, рака пищевода, рака почек, рака печени, рака легких, злокачественной меланомы, рака яичников, рака поджелудочной железы, рака предстательной железы, рака прямой кишки, рака желудка, рака щитовидной железы или любого их сочетания. Кроме того, возможные агенты включают моноклональные антитела или их фрагменты, связывающиеся с одним или несколькими маркерами, характерными для рака толстой кишки, клеток злокачественной меланомы, раковых клеток молочной железы, раковых клеток предстательной железы, раковых клеток яичников и раковых клеток легких. Конкретные примеры агентов представляют собой моноклональные антитела к раковоэмбриональному антигену (CEA), углеводному антигену 15-3 (CA15-3), углеводному антигену 125 (CA125), углеводному антигену 19-9 (CA19-9), углеводному антигену 242 (CA242), Ep-CAM, G250, RCAS1, STN, TA-90, BC-10, NY-ESO-1, MSH-R, PRL-R и PSMA.
Мечение агентов
Поскольку в качестве важной стадии при использовании панели здесь обсуждается идентификация количества клеток, несущих специфичные маркеры, может быть преимущественным мечение агентов одной или несколькими детектируемыми метками. Такие метки могут представлять собой ферменты, флуоресцентные молекулы, радиоактивные метки, биотин и/или олигонуклеотиды.
В предпочтительном варианте осуществления настоящего изобретения, агенты метятся флуоресцентными молекулами, такими, например, как нуклеиновые специфичные красители, фикобилипротеины, цианиновые производные, флуоресцеиновые производные и родаминовые производные. Различные агенты, используемые в панели, предпочтительно метят различными метками, так что их можно отличить один от другого. Когда для мечения используют флуоресцентные молекулы, способ может предпочтительно осуществляться с помощью инструмента для измерения флюоресценции, такого, например, как проточный цитометр.
Типичная процедура
Сигнальные лимфатические узлы пациента с показаниями на рак получают с помощью операции. Вкратце, сигнальный онкоузел идентифицируется во время операции с помощью перитуморальных инъекций трасерного вещества, например, красителя патентованный голубой, который отслеживает отток лимфы и окрашивает впервые дренирующие опухоль лимфатические узлы в голубой цвет.
Клеточную суспензию от цельного сигнального лимфатического узла/узлов, который нужно исследовать, получают с помощью осторожного выдавливания лимфатических узлов с использованием стеклянного гомогенизатора с большим зазором в 5 мл PBS, дополненного 2% фетальной сывороткой теленка и 0,05% азида натрия (буфер для окрашивания), или в среде для культивирования клеток, такой как X-Vivo 15 или Aim 5.
Образцы с 1×106 клеток промывают в 2 мл буфера для окрашивания.
Затем образцы клеток метят в 100 мкл буфера для окрашивания с помощью панели антител, конъюгированных с флуорофором, выбранных из тканеспецифичных, специфичных к типу рака и специфичных к субтипу рака внеклеточных маркеров, и инкубируют при комнатной температуре 15-30 минут. Достаточное количество используемых антител определяют с помощью титрования каждого антитела с использованием положительного контроля. Как правило, это количество находится в пределах 0,1-0,5 мкг. Для удаления избытка антител, образцы промывают 2 мл буфера для окрашивания и повторно суспендируют в 300 мкл буфера для окрашивания перед проточно-цитометрическим анализом.
Анализы осуществляют с использованием инструментов, таких как FACSAria, FACSCanto (Becton Dickinson) или Cytomics FC 500 (Beckman Coulter). Проточно-цитометрические анализы осуществляют, собирая по 100000 событий от каждого образца клеток.
Наборы
Для облегчения применения настоящего изобретения могут быть разработаны специализированные наборы для многочисленных применений по настоящему изобретению. Такие наборы могли бы содержать все необходимые агенты, метки и текучие среды, и инструкции, необходимые для осуществления определенного исследования. Набор может также содержать программное обеспечение для облегчения интерпретации результатов исследования, например, с заданными значениями точки разделения между положительными и отрицательными результатами исследований.
В предпочтительном варианте осуществления настоящего изобретения набор должен содержать панель флуоресцентно меченных моноклональных антител, где панель должна соответствовать определенному типу исследования. Кроме того, набор должен содержать текучие среды, необходимые для осуществления исследования с использованием проточной цитометрии, и программное обеспечение, способное надежно интерпретировать данные, получаемые в результате анализов.
Определение значений точки разделения, распространенности и использование базы данных
Применение программного обеспечения для интерпретации данных, получаемых от каждого исследования, зависит от надежных статистических методов и основополагающей информации для нахождения оптимальных значений точки разделения для каждого исследования, поскольку чувствительность и специфичность являются переменными, когда значение точки разделения между положительными и отрицательными результатами исследования изменяется.
Основополагающая информация может быть получена посредством осуществления исследований на большом количестве образцов с известным статусом или с известной распространенностью в релевантной популяции с рассматриваемой аномалией. Данные, получаемые в результате исследования, например, пропорция исследуемых положительных событий для каждого маркера, будут собираться вместе с информацией для категоризации популяции, к которой принадлежит субъект исследования, например, пол, возраст, заболевание, стадия заболевания, и тому подобное. Данные, которые получают в результате исследования, могут использоваться для нахождения оптимальных значений точки разделения.
Значения точки разделения необходимы, поскольку также и истинно отрицательные образцы будут демонстрировать различные уровни «положительности» по биологическим (различные уровни экспрессии маркеров также и в нормальном состоянии) и техническим (фоновый шум) причинам.
В случае, когда основополагающая информация генерируется с использованием образцов с известным статусом (положительным или отрицательным), нахождение оптимальных значений точки разделения является относительно простым и может быть достигнуто посредством анализа того, как чувствительность и специфичность исследования коррелирует со значением точки разделения.
Один из подходов к выбору точки разделения заключается в построении графика чувствительности как функции (1 - специфичность) для каждого возможного значения точки разделения, то есть несколько различных значений точки разделения сначала выбираются произвольным образом или систематически. Получаемая кривая известна как кривая «рабочей характеристики», кривая ROC. Точность исследования измеряют по площади под кривой ROC. Площадь, равная 1, представляет «совершенное исследование», и площадь, равная 0,5, представляет «негодное исследование».
Если ошибка ложноотрицательного результата равна ошибке ложноположительного результата, должно выбираться значение точки разделения, которое доводит до максимума площадь под кривой ROC. Однако во многих случаях должно быть учтено клиническое использование исследования при определении значения точки разделения. Для скрининговых исследований, например, является важным, чтобы было сведено к минимуму количество ложноотрицательных результатов, а умеренное количество ложноположительных являлось бы приемлемым, и значение точки разделения будет устанавливаться соответствующим образом, то есть значения точки разделения могут выбираться с учетом клинического использования/цели.
Кривые ROC не могут использоваться сами по себе для установления значений точки разделения, поскольку не учитывается распространенность отыскиваемой аномалии. Для оптимизации способности исследования к предсказанию истинного состояния заболевания, необходима основополагающая информация о распространенности аномалии, которая должна быть детектирована. Чувствительность и специфичность исследования может изменяться с распространенностью состояния, отыскиваемого в популяции, к которой принадлежит субъект исследования. Таким образом, может быть необходимо установление различных значений точки разделения для различных популяций.
В случае, когда истинный статус образца неизвестен, должны использоваться найденные различными способами оптимальные значения точки разделения. Образцовые интервалы могут использоваться для этой цели, если распространенность аномалии в различных популяциях известна.
Образцовый интервал представляет собой оцененный диапазон значений, который содержит определенный процент значений среди релевантной популяции. Наиболее широко используемый процент составляет 95%.
Два образцовых интервала должны быть вычислены для определения значений точки разделения, один интервал для предполагаемых отрицательных образцов и один интервал для предполагаемых положительных образцов. Категоризация каждого образца может быть проделана на основе распространенности аномалии в популяции, из которой отбирался образец. Пропорциональный размер каждой группы образцов должен совпадать с распространенностью аномалии в популяции. На основе результатов исследования каждого узла, каждый образец может быть категоризован в предполагаемую отрицательную группу и предполагаемую положительную группу. Образцовые интервалы могут генерироваться для каждой группы, и значение точки разделения может устанавливаться для сведения к минимуму перекрывания одного образцового интервала другим. Значение точки разделения может также устанавливаться для сведения к минимуму, например, риска ложноотрицательного диагноза.
Образцовые интервалы могут быть вычислены с помощью двух основных подходов. Если генерируемые данные совпадают с дистрибутивной функцией, такой, например, как нормальное распределение, образцовые интервалы могут быть вычислены с использованием параметрического способа, считая, что распределение совпадает с математически определенным статистическим распределением, например, с нормальным распределением. Использование параметрических способов, как правило, является предпочтительным, поскольку доверительные интервалы образцовых интервалов, как правило, являются более узкими, если только размер образца не является очень большим.
Если генерируемые данные не совпадают с любым математически определенным статистическим распределением, должен использоваться непараметрический (не связанный с конкретным распределением) способ, где оцененные распределения вычисляют с использованием только реальных данных, генерируемых с помощью анализов, для достижения приемлемого значения точки разделения. Для того чтобы уменьшить доверительные интервалы, потребовался бы образец очень больших размеров.
Распространенность аномалии, которая должна быть детектирована, может изменяться, например, с возрастом, полом и заболеванием/показаниями. Соответственно, доступ к большим количествам основополагающей информации для определения образцовых интервалов для каждой релевантной популяции может дополнительно улучшить диагностические характеристики, когда настоящее изобретение используют для детекции опухолевых клеток.
Сравнение данных, генерируемых с помощью анализов, с более ранними данными по истинно положительным и истинно отрицательным образцам может оптимизировать значение точки разделения между положительными и отрицательными результатами, делая возможными еще более высокие характеристики по отношению к чувствительности, специфичности и NPV.
В предпочтительном варианте осуществления настоящего изобретения, интерпретация каждого исследования осуществляется посредством использования программного обеспечения, связанного с базой данных основополагающей информации для каждого маркера, исследуемого в связи с релевантной популяцией. Программное обеспечение может также быть способным к генерированию данных для использования в такой же базе данных, которая сделала бы возможной непрерывную тонкую настройку значения точки разделения для каждого исследования и релевантной популяции.
Соответственно, в отдельных аспектах, настоящее изобретение относится к базе данных, сохраняющей результаты, полученные с помощью способа проточной цитометрии, заявляемого здесь, и к программному обеспечению для вычисления и непрерывного уточнения значений точки разделения, когда материал данных увеличивается. База данных содержит множество наборов данных, где каждый набор данных содержит данные для множества внеклеточных поверхностных маркеров и соответствующего типа или типов раковых клеток. Кроме того, настоящее изобретение относится к способу идентификации раковых клеток, как здесь заявляется, дополнительно содержащему стадию сохранения наборов данных, полученных способом проточной цитометрии (например, i), о количестве клеток, несущих агент, который связывается с одним или несколькими внеклеточными маркерами, ii) о типе раковых клеток, iii) о типе тканей, и тому подобное). Стадия сохранения данных может дополнительно включать в себя стадию введения данных известного происхождения с соответствующим набором данных.
Кроме того, в дополнительном аспекте настоящее изобретение относится к программе программного обеспечения, которая, когда запускается на компьютере, i) адаптируется для приема набора данных, полученных проточной цитометрией, содержащего данные для внеклеточных маркеров, ii) адаптируется для сравнения принятых данных с данными базы данных, и iii) адаптируется для вывода выходных данных, показывающих a) присутствие или отсутствие раковых клеток и, необязательно, b) тип или типы раковых клеток.
Пример того, как внеклеточные маркеры могли бы оцениваться для целей сравнения в базе данных, приведены в примере 4.
Описание фигур
Фиг.1 иллюстрирует идентификацию путем проточной цитометрии раковых клеток толстой кишки в смеси раковых клеток толстой кишки и лейкоцитов с использованием одного агента для идентификации. Различные количества раковых клеток толстой кишки CCL221 (0-3%) вводят в лейкоциты периферической крови, очищенные с помощью Ficoll и окрашенные с использованием непосредственно конъюгированных анти-CA19-9 как антител для детекции клеточных поверхностей. Присутствие опухолевых клеток детектируют путем проточной цитометрии. SSC, боковое рассеяние, указывает на структурированность клеток.
Фиг.2 иллюстрирует идентификацию путем проточной цитометрии раковых клеток толстой кишки в смеси раковых клеток толстой кишки и лейкоцитов с использованием одного агента для идентификации. Различные количества раковых клеток толстой кишки CCL221 (0-3%) вводят в лейкоциты периферической крови, очищенные с помощью Ficoll и окрашенные с использованием непосредственно конъюгированного антитела, подобного EpCAM, для детекции поверхности клеток. Присутствие опухолевых клеток детектируют путем проточной цитометрии. SSC, боковое рассеяние, указывает на структурированность клеток.
Фиг.3 иллюстрирует идентификацию путем проточной цитометрии раковых клеток толстой кишки в смеси раковых клеток толстой кишки и лейкоцитов с использованием панели из четырех агентов для идентификации. Раковые клетки толстой кишки CCL221, 10% (A) или 1% (B), вводят в лейкоциты периферической крови, очищенные с помощью Ficoll и окрашенные с использованием непосредственно конъюгированных антител, для одновременной четырехцветной детекции поверхностных клеточных маркеров CA19-9, эпитопа 5 CEA и эпитопа 4 CEA, и STN. Присутствие опухолевых клеток детектируют путем проточной цитометрии. Двукратно положительные клетки, распознанные с помощью CA19-9 и эпитопа 5 CEA (левая панель), выделяют путем проведения электронной сортировки и оценивают с помощью второй пары антител STN и эпитопа 4 CEA (правая панель).
Фиг.4 иллюстрирует идентификацию путем проточной цитометрии раковых клеток толстой кишки в смеси раковых клеток толстой кишки и лейкоцитов с использованием панели из четырех агентов для идентификации раковых клеток толстой кишки CCL221, 10% (A) или 1% (B), которые вводят в лейкоциты периферической крови, очищенные с помощью Ficoll и окрашенные с использованием непосредственно конъюгированных антител, для одновременной четырехцветной детекции поверхностных клеточных маркеров CA19-9, CA242 и эпитопа 4 CEA, и STN. Присутствие опухолевых клеток детектируют проточной цитометрией. Двукратно положительные клетки, которые распознают с помощью CA19-9 и CA242 (левая панель), выделяют путем проведения электронной сортировки и оценивают с помощью второй пары из антитела STN и эпитопа 4 CEA (правая панель).
Фиг.5 иллюстрирует идентификацию путем проточной цитометрии раковых клеток толстой кишки в смеси раковых клеток толстой кишки и лейкоцитов с использованием панели из четырех агентов для идентификации. Раковые клетки толстой кишки CCL221, 10% (A) или 1% (B), вводят в лейкоциты периферической крови, очищенные с помощью Ficoll и окрашенные с использованием непосредственно конъюгированных антител, для одновременной четырехцветной детекции поверхностных клеточных маркеров CA19-9, CA15-3, белка, подобного EpCAM, и STN. Присутствие опухолевых клеток детектируют путем проточной цитометрии. Двукратно положительные клетки, которые распознают с помощью CA19-9 и CA15-3 (левая панель), выделяют путем проведения электронной сортировки и оценивают с помощью второй пары из антитела STN и белка, подобного EpCAM (правая панель).
Фиг.6 иллюстрирует идентификацию путем проточной цитометрии раковых клеток толстой кишки в клеточной суспензии из сигнального лимфатического узла пациента с раком толстой кишки. Анализы осуществляют с использованием панели антител, распознающих четыре различных маркера для толстой кишки, CA19-9, CEA, STN и белок, подобный EpCAM.
Фиг.7 иллюстрирует уменьшение риска ложноотрицательного результата, когда анализируют клеточную суспензию, полученную из лимфатического узла, вместо анализа тонких срезов лимфатического узла гистохимией. А иллюстрирует ситуацию, где метастаз (показанный красным кластером) лежит вне срезов, которые являются, возможно, окрашенными и оцениваются под микроскопом. Опухолевые клетки в лимфатическом узле будут отсутствовать на срезах, и анализы будут давать ложноотрицательный результат. B иллюстрирует, как образец клеточной суспензии, полученной из лимфатического узла, представляет статус целого лимфатического узла. Анализы статистически релевантного количества клеток будут давать истинно-положительный результат.
Фиг.8 иллюстрирует оценку образцовых интервалов для маркеров EpCAM и CA 19-9 в популяции пациентов с раком толстой кишки, как обсуждается в Примере 4. А иллюстрирует результаты контрольных окрашиваний с изотипами, осуществляемых для каждого окрашенного сигнального онкоузла. B иллюстрирует результаты от окрашиваний сигнальных онкоузлов SN1, SN2 и SN3 пациента 1. Результаты показывают высокие и умеренные уровни присутствия маркеров, как SN1, так и SN2, соответственно, при этом экспрессия в SN3 близка к уровню детекции. C иллюстрирует результаты от окрашивания сигнальных онкоузлов SN1 и SN2 пациента 2. Результаты показывают присутствие обоих маркеров в SN1. В SN2 присутствие близко к уровню детекции.
Фиг.9.
Детекция опухолевых клеток путем проточной цитометрии после окрашивания на CK20. Последовательные разбавления PBMC, в которые быстро вводят раковые клетки толстой кишки DLD-1, окрашивают внутриклеточно на эпителиальный клеточный маркер CK20 и анализируют с использованием проточной цитометрии (1A). Данные о положительных по CK20 клетках в PBMC от одного пациента с раком толстой кишки и от одного здорового индивидуума изображены на (1B).
Фиг.10
Проточно-цитометрическая детекция опухолевых клеток путем окрашивания на ассоциированные с поверхностью опухолевых клеток маркеры EpCAM и CA19-9. Линию раковых клеток толстой кишки DLD-1, которые разбавляют в PBMC в диапазоне последовательных разбавлений 0,012-9%, добавляют опухолевые клетки, PBMC так таковой используют в качестве отрицательного контроля. Экспрессию EpCAM анализируют, и строят график зависимости от свойств SSC; число указывает на процент событий для EpCAM* (2A). Анализы экспрессии CA19-9 получают на графике зависимости от свойств SSC, число показывает процент положительных событий для CA19-9 (2B). Совместную экспрессию опухолевых маркеров исследуют с помощью графика EpCAM в зависимости от CA19-9, числа на графике показывают процент событий в соответствующих квадрантах (2C). В столбцах справа от Фиг.2C представлено общее количество детектируемых клеток, то есть сумма клеток с EpCAM+CA19-9-, EpCAM-CA19-9+ и EpCAM+CA19-9+, а также процент, ожидаемый от количества добавленных опухолевых клеток.
Фиг.11
Анализ в пределах одного анализа, коррелирующий два индивидуальных исследования. В PBMC, куда быстро вводят линию раковых клеток толстой кишки DLD-1 в низком диапазоне добавления опухолевых клеток (0, 0,012, 0,037 и 0,11, соответственно), анализируют на вариабельность в пределах одного анализа, собирая 106 событий. Образцы окрашивают антителами против EpCAM и CA19-9 и анализируют путем проточной цитометрии. Регрессионный анализ осуществляют, сравнивая исследования 1 и 2 для экспрессии EpCAM (3A), экспрессии CA19-9 (3B) и экспрессии EpCAM/CA19-9 (3C).
Фиг.12
Корреляция между детектируемыми и ожидаемыми количествами опухолевых клеток. Образцы PBMC. Куда быстро вводят линию раковых клеток толстой кишки DLD-1 (0,037, 0,11, 0,33, 1 и 3%, соответственно), и один образец с PBMC как таковым, разделяют на 10 аликвот для оценки вариабельности в пределах одного анализа. Образцы окрашивают антителами, специфичными в отношении EpCAM и CA19-9, и анализируют путем проточной цитометрии. Регрессионный анализ осуществляют на графике процента экспрессии EpCAM в зависимости от характеристик SSC (4A) и для графика экспрессии CA19-9 в зависимости от характеристик SSC (4B). Исследуют общее присутствие одинарно и двукратно положительных клеток, то есть сумму клеток для EpCAM+CA19-9-, EpCAM-CA19-9+ и EpCAM+CA19-9+, как показано на точечной диаграмме зависимости EpCAM от CA19-9 (4C). Данные представлены как средний (±SD) процент детектируемых опухолевых клеток на оси y, и количество ожидаемых клеток изображено на оси x.
Фиг.13
Присутствие метастазов рака толстой кишки в сигнальных онкоузлах. Четырнадцать сигнальных онкоузлов от семи пациентов с диагнозом рак толстой кишки окрашивают параллельно внутриклеточно на CK20 или внеклеточно на EpCAM и CA19-9 перед проточно-цитометрическим анализом. Для каждого сигнального онкоузла осуществляют окрашивание с релевантным изотип-контролем, здесь иллюстрируется с помощью окрашивания SN1 от пациента 5 (5A). У пациента один идентифицируются три сигнальных онкоузла. Присутствие метастатических клеток детектируют для SN1 и SN2, в то время как SN3 содержат только низкое количество положительных событий, близкое к уровню детекции, и считаются не содержащими метастазов (5B). Проточно-цитометрический анализ сигнальных онкоузлов, полученных от пациента два, указывает на метастатическое распространение SN1; для SN2 количество положительных событий близко к пределу детекции, и, таким образом, SN2 считают отрицательным (5C).
Примеры
Пример 1
Проточно-цитометрическая детекция раковых клеток толстой кишки в смеси лейкоцитов и раковых клеток толстой кишки
Результаты
Для оценки проточной цитометрии отдельных клеток для опухолевых клеток с окрашенной клеточной поверхностью авторы добавляют известное количество раковых клеток толстой кишки из линии раковых клеток толстой кишки CCL221 к лейкоцитам периферической крови. Таким образом, авторы воспроизводят ситуацию в лимфатическом узле, содержащем малые метастазы. Сначала авторы используют опухолевый маркер CA19-9, экспрессируемый, как известно, на поверхности раковых клеток толстой кишки. Анализы образца лучше всего осуществлять с использованием бокового рассеяния (SSC) для определения размеров и структурированности и FL-1, отражающего конъюгированные с FITC окрашенные клетки. Клетки, двукратно положительные по отношению к увеличению SSC и высокой флюоресценции, идентифицируют, как иллюстрируется на фиг.1. Уже при 0,33% добавленных клеток CCL221, их легко детектировать. Однако видно малое количество неспецифичного окрашивания, даже когда опухолевые клетки не присутствуют в образце, показывающее малую фракцию ложноположительных клеток. Для улучшения анализа эксперимент осуществляют с использованием антитела, распознающего клеточную поверхностную молекулу, подобную EpCAM, экспрессируемую на клетках толстой кишки, добавляя 0,0122-3% опухолевых клеток PBL. Опять же, опухолевую популяцию легко детектировать как кластер клеток, экспрессирующих высокое количество белка, подобного EpCAM, и увеличивающих SSC (фиг.2). Даже всего лишь 0,0122% клеток детектируются как различимая популяция клеток (фиг.2). Нет проблемы с ложноположительными клетками при использовании белка, подобного EpCAM, в качестве целевого клеточного поверхностного маркера, поскольку события не регистрируются как двукратно положительные, когда добавляют неопухолевые клетки. Поскольку хорошо известно, что опухолевые клетки могут терять экспрессию молекул при потере их созревания, авторы хотят объединить набор клеточных поверхностных молекул для улучшения точности диагностики с помощью анализа без риска появления необнаруженных опухолевых клеток, которые теряют экспрессию определенных клеточных поверхностных молекул. Авторы по этой причине исследуют сочетания четырех различных клеточных поверхностных маркеров. Сочетание CA19-9 и двух эпитопов CEA и STN детектирует подавляющее большинство клеток, являющихся четырехкратно положительными (фиг.3A, правая панель). Авторы отмечают, что небольшая доля, меньше чем 1%, когда имеются трехкратно положительные клетки (фиг.3A, правая панель, Q1), говорит, что на самом деле только малая часть клеток теряет экспрессию одного из эпитопов CEA. Когда еще меньше клеток (1%) добавляют к PBL, получают такой же результат (фиг.3B). Авторы затем исследуют различные сочетания четырех клеточных поверхностных белков, экспрессируемых на раковых клетках толстой кишки, CA19-9, CA242, STN и эпитопа 4 CEA. Это четырехкратное сочетание ведет себя сходным образом, когда распознается присутствие линии клеток CCL221 в PBL (фиг.4). Опять же, большинство клеток являются положительными по всем 4 маркерам, CA19-9, CA242, STN и эпитопу 4 CEA (фиг.4A, правая панель, Q2), и результат является идентичным, когда добавляют меньшее количество клеток CCL221 (фиг.4B, правая панель, Q2). Исследуют третье сочетание поверхностных клеточных белков, CA19-9, CA15-3, белок, подобный EpCAM, и STN, со сходными результатами (фиг.5A и B). Когда систему исследуют на сигнальный онкоузел, полученный от пациента с раком толстой кишки, авторы могут легко детектировать присутствие раковых клеток толстой кишки путем проточной цитометрии. При использовании маркеров CA19-9 и CEA, 33% клеток в сигнальном онкоузле идентифицируют как клетки, несущие маркеры раковых клеток толстой кишки (фиг.6). Кроме того, электронно отсортированные клетки CA19-9+ CEA+ и анализ на экспрессию STN и белка, подобного EpCAM, показывают, что 24% клеток выглядят как четырехкратно положительные, экспрессирующие все исследуемые маркеры, CA19-9*, CEA+, STN+, белок, подобный EpCAM+. Однако 1,7% клеток являются трехкратно положительными по сочетанию CA19-9+ CEA+ STN+, и 7,7% - положительными по CA19-9+ CEA+, белку, подобному EpCAM+, демонстрируя, что раковые клетки толстой кишки могут терять экспрессию некоторых клеточных поверхностных маркеров до различной степени.
Антитела против поверхностных маркеров на раковых клетках толстой кишки
Пример 2
Проточно-цитометрическая детекция метастатических раковых клеток толстой кишки в лимфатических узлах
Материалы и способы
Приготовление клеток
Лейкоциты периферической крови получают с помощью пакета Ficoll. Линию раковых клеток толстой кишки CCL221 выращивают, как предложено производителем (ATCC). Сигнальный лимфатический узел от пациента, у которого диагностирован рак толстой кишки, получают посредством операции. Клеточной суспензии из цельного сигнального лимфатического узла/узлов, которые надо исследовать, получают с помощью осторожного выдавливания лимфатических узлов с использованием стеклянного гомогенизатора с большим зазором.
Проточная цитометрия
Образцы из 1×106 клеток промывают в PBS, дополненном 2% фетальной сыворотки теленка и 0,05% азида натрия (FACS-буфер). Затем образцы клетки окрашивают с помощью панели антител, конъюгированных с флуорофором, выбранных из тканеспецифичных, специфичных к типу рака и специфичных к субтипу рака внеклеточных маркеров (см. примеры соответствующих маркеров в Таблице 1, выше) и инкубируют при комнатной температуре 15-30 минут. Для удаления избытка антитела образцы промывают буфером FACS перед проточно-цитометрическим анализом. Результаты анализов становятся доступны сразу. Исследуемые лимфатические узлы, как показано, содержат сложную смесь метастатических клеток, хотя большая доля составляет четырехкратно положительные клетки (фиг.6).
Пример 3
Проточно-цитометрическая детекция раковых клеток толстой кишки в образцах отдельных клеток и характеристики/устойчивость анализа
Анализируют клеточные суспензии из лимфоцитов сигнального онкоузла, опухолевых клеток и PBMC от исследуемых пациентов. Чтобы сделать возможным количественное определение образцов раковых клеток толстой кишки в PBMC от здоровых добровольцев, исследуют также быстро введенные раковые клетки толстой кишки линии DLD-1. Семистадийные, 3-кратные последовательные разбавления с начальной концентрацией опухолевых клеток 9% дают концентрации 9%, 3%, 1%, 0,33%, 0,11%, 0,037% и 0,012%. Образец PBMC, самого по себе, добавляют к этой серии.
Для внутриклеточного окрашивания эпителиальных клеточных маркеров, клетки CK20 сначала промывают в PBS, дополненном 2% BGS и 0,05% (масс/объем) азида натрия (буфер для окрашивания), а после этого обрабатывают Cytofix/Cytoperm (Becton Dickinson) в соответствии с инструкциями производителя. После этого клетки выдерживают в буфере для окрашивания, дополненном 0,3% сапонина (масс/объем) (Sigma). Первичное окрашивание осуществляют с помощью мышиного антитела против CK20 человека (Dakocytomation) или контроля, изотипа IgG2a (Dakocytomation), в течение 30 мин. Клетки промывают и инкубируют в течение 30 мин с помощью антитела козы против мыши, конъюгированного с аллофикоцианином (APC) (Jackson Immunoresearch) или антитела осла против мыши, конъюгированного с флуоресцеином изотиоцианатом (FITC) (Jackson Immunoresearch).
Окрашивание для клеточных поверхностных маркеров осуществляют в буфере для окрашивания. Клетки промывают, а затем инкубируют в течение 30 мин вместе с маркером адгезии неэпителиальной клетки (EpCAM) и анти-углеводным антигеном 19-9 (CA19-9) (Fujirebio diagnostics), конъюгированым с Alexa fluor 488 (AF488) (Molecular probes Invitrogen) или Перидинин-хлорофилл-протеиновым комплексом (PerCP) (Prozyme), соответственно, в соответствии с описаниями производителя. Используемые контрольные изотипы представляют собой IgG2a (клон G155-178), конъюгированый с AF488, и IgG1 (клон MOPC-21), конъюгированный с PerCP (Becton Dickinson). Получение данных от 100000 событий (таблица 2, таблица 4) или 1000000 событий (таблица 3), соответственно, от каждого образца осуществляют с использованием FACSAria (Becton Dickinson), и собранные данные анализируют с использованием программного обеспечения FACSDiva. Положительные события идентифицируют с помощью построения графика соответствующей флюоресценции в логарифмическом масштабе в зависимости от характеристики линейного бокового рассеяния (SSC). Верхний левый и правый квадранты подбирают для устранения мертвых клеток и дебрисов клеток, изначально исследуемых PI. Образцы, окрашенные как на EpCAM, так и на CA19-9, также анализируют с использованием точечных диаграмм логарифма зеленой флюоресценции (AF488) в зависимости от логарифма красной флюоресценции (PerCP).
Вариабельность в пределах одного анализа
Вариабельность в пределах одного анализа и для разных анализов
Исследование сигнальных онкоузлов от пациентов с раком толстой кишки
(%)
(%)
(%)
(%)
Характеристики анализа, устойчивость
Вариабельность для одного анализа, для проточно-цитометрического анализа опухолевых поверхностных маркеров исследуют с помощью разделения образца на десять аликвот перед проточно-цитометрическими анализами. К последовательно разбавленным образцам 0,037%, 0,11%, 0,33%, 1% и 3% добавляют опухолевые клетки DLD-1, и исследуют образцы PBMC сами по себе. Для EpCAM и CA19-9, когда они присутствуют по отдельности, количество положительных событий определяют по точечным диаграммам соответствующей флюоресценции в логарифмическом масштабе в зависимости от линейных свойств SSC. Анализ общего количества детектируемых клеток осуществляют с помощью графика логарифма зеленой флюоресценции как функции логарифма красной флюоресценции, и события, регистрируемые либо как EpCAM+CA19-9-, EpCAM-CA19-9+, либо EpCAM+CA19-9+, аккумулируют. Полученная средняя детеция раковых клеток толстой кишки, стандартное отклонение и коэффициент вариации приведены в Таблице 2.
Средние значения для опухолевых клеток, детектируемых с помощью экспрессии EpCAM, близки к ожидаемым, показывая, что почти все клетки DLD-1 экспрессируют EpCAM (таблица 2). Значения CV (коэффициентов вариации), полученные от образцов с 0,11, 0,33, 1 и 3% добавленных раковых клеток толстой кишки DLD-1, находятся в пределах 4,6-10,7%, показывая очень низкую вариабельность для одного анализа. Среднее количество детектируемых клеток для 0,037% добавленных клеток составляет 0,041% (диапазон 0,035-0,055%), а для PBMC без добавления опухолевых клеток, 0,002 (диапазон 0-0,004%) (таблица 2). Когда исследуют экспрессию CA19-9, средние значения извлечения опухолевых клеток ниже, чем ожидаемые количества, опять же, показывая, что не все опухолевые клетки экспрессируют CA19-9 (таблица 2). Среднее фоновое окрашивание в PBMC составляет 0,036%, что мешает детекции опухолевых клеток при низких концентрациях, но для 0,33, 1 и 3% добавленных клеток, 67, 71 и 82%, соответственно, видимо, экспрессируют CA19-9. Для диапазона 0,037-3% добавленных клеток, средний CV для детекции CA19-9 составляет 8,4%, показывая низкую вариабельность для одного анализа.
Когда исследуют экспрессию EpCAM+CA19-9-, EpCAM-CA19-9+ и EpCAM+CA19-9+, полученные средние значения близки к ожидаемым количествам клеток (таблица 2). В дополнение к этому, 106 клеток/образец собирают для дополнительной валидации способа при количествах клеток, близких к точке разделения (таблица 3). Стандартные отклонения для измерения являются низкими (диапазон 0,001-0,016), демонстрируя низкую вариабельность для одного анализа, когда исследуют 10 образцов. CV для детекции клеток EpCAM+ и CA19-9+, для всего диапазона добавленных клеток (0-0,11%), являются, как правило, низкими, также показывая стабильность анализа. Однако, когда измеряемые количества клеток близки к нулю, коэффициент вариации является математически чувствительным к малым изменениям в стандартном отклонении, ограничивая его пригодность для вычислений относительно низких количеств клеток. Сравнение характеристик исследования 1 и исследования 2 для детекции опухолевых клеток с использованием антител EpCAM, CA19-9 и EpCAM/CA19-9 дает хорошее согласие с коэффициентами регрессии, близкими к 1 (фиг.11A-C).
Динамический диапазон от 0 до 3% клеток исследуют посредством осуществления регрессионного анализа (фиг.12A-C). Коэффициент определения для образца составляет 1 для EpCAM+ (фиг.12A), CA19-9+ (фиг.12B) и для двукратно положительных клеток, (Фиг.12C), демонстрируя стабильные и надежные характеристики в пределах исследуемого диапазона. Корреляция между наблюдаемыми количествами и ожидаемым количеством опухолевых клеток для EpCAM+ (фиг.12A) и для суммы клеток с EpCAM+CA19-9-, EpCAM-CA19-9+ и EpCAM+CA19-9+ (фиг.12C) близки к тем, которые ожидаются для теоретического количества добавленных клеток. CA19-9, видимо, экспрессируются приблизительно на 73% опухолевых клеток DLD-1.
Пример 4
Оценка маркеров в сигнальных онкоузлах от пациентов с раком толстой кишки
Материалы и способы
Сигнальные лимфатические узлы от 7 пациентов идентифицируются во время операции с помощью перитуморальных инъекций трасерного вещества. Клеточную суспензию от каждого лимфатического узла приготавливают с использованием стеклянного гомогенизатора с большим зазором. Окрашивание на внеклеточные маркеры осуществляют в буфере для окрашивания. Клетки промывают и инкубируют в течение 30 минут с анти-EpCAM и анти-CA19-9, конъюгированными с Alexa488 и PerCP, соответственно.
Изотип-контроли осуществляют для каждого окрашенного сигнального онкоузла, как иллюстрируется с помощью окрашивания SN1 от пациента 5 (фиг.8A).
Анализы осуществляют с помощью получения данных от 100000 событий от каждого образца с использованием проточного цитометра FACSAria.
Результаты анализов представлены, как показано на фиг.8 B и 8 C (пациент 1 и 2, соответственно).
Результаты анализов представлены в таблице 2, ниже:
Данные, такие как те, что представлены в таблице выше, могли бы использоваться для нахождения оптимальных значений точки разделения для каждого маркера и маркеров в сочетании. Для нахождения надежных значений точки разделения, однако, размер образца должен быть гораздо больше.
В случае, когда истинный статус каждого образца известен, чувствительность и специфичность для различных значений точки разделения могут легко быть вычислены. Оптимальное значение точки разделения для каждой популяции может затем генерироваться с использованием, например, кривых ROC, как представлено выше.
В случае, если истинный статус неизвестен, должна быть известна распространенность раковых клеток толстой кишки в сигнальных лимфатических узлах у релевантной популяции пациентов. На основе результатов исследования для каждого узла, каждый образец категоризовался бы в предполагаемую отрицательную группу и предполагаемую положительную группу, где пропорциональный размер каждой группы согласовывался бы с распространенностью в релевантной популяции пациентов. Образцовые интервалы затем вычислялись бы для обеих групп.
Если генерируемые данные совпадают с дистрибутивной функцией, такой, например как, нормальное распределение, образцовые интервалы могут быть вычислены с использованием параметрического метода. Использование параметрических методов, как правило, является предпочтительным, поскольку доверительные интервалы образцовых интервалов, как правило, являются более узкими, если только размер образца не является очень большим.
Если генерируемые данные не совпадают с какой-либо дистрибутивной функцией, должен использоваться непараметрический метод. Для уменьшения доверительных интервалов потребовались бы очень большие размеры образцов.
Сравнение образцовых интервалов для обеих групп образцов (предполагаемых положительных и предполагаемых отрицательных) может использоваться для установления соответствующих значений точки разделения. Значение точки разделения может устанавливаться, например, для сведения к минимуму перекрывания интервалов или для сведения к минимуму риска ложноотрицательного диагноза.
Пример 5
Внутриклеточное окрашивание для CK20 в линии раковых клеток толстой кишки. Сравнительный эксперимент
Стандартный подход к детекции метастазов в лимфатических узлах от рака толстой кишки представляет собой иммуногистохимическое окрашивание с использованием антитела CK20. Для оценки этого маркера для детекции метастазов путем проточной цитометрии осуществляют внутриклеточное окрашивание CK20 и детекции с помощью вторичного антитела, конъюгированного с APC.
Для начального исследования, уменьшающиеся количества раковых клеток толстой кишки линии DLD-1 добавляют в PBMC. Начиная с концентрации в 9% добавленных опухолевых клеток, определяют, что все положительные по CK20 клетки детектируются (фиг.9A, верхняя панель). При использовании последовательных трехкратных разбавлений, является возможной детекция положительных по CK20 опухолевых клеток до концентрации добавленных клеток 0,037% (фиг.9A). Фоновое окрашивание в PBMC без добавления клеток DLD-1 составляет 0,009% положительных клеток CK20 (фиг.9A, нижняя панель), и изотип-контроли дают неспецифичное окрашивание со средним значением 0,011% положительных клеток (данные не показаны), показывающим низкое количество ложноположительных событий. Положительные по CK20 клетки описываются в PBMC от здоровых индивидуумов, говоря о нормальном временном существовании положительных по цитокератину эпителиальных клеток в крови. При внутриклеточном окрашивании PBMC на CK20, авторы были способны детектировать 0,19% и 0,16% положительных по CK20 клеток, как иллюстрируется для пациента с раком толстой кишки с метастатическим заболеванием и для здорового индивидуума, соответственно (фиг.9B, левые панели). В противоположность этому, 0,03% и 0,02% положительность детектируют, когда используют изотип-контроли (фиг.9B, правые панели). Таким образом, положительные по CK20 эпителиальные клетки, видимо, все же присутствуют в крови при низком уровне у здоровых индивидуумов.
Пример 6
Окрашивание поверхностных маркеров на линии раковых клеток толстой кишки
Поскольку положительные по CK20 клетки идентифицируются при низких уровнях даже у здоровых индивидуумов, и внутриклеточное окрашивание является более трудоемким, исследуем пригодность для использования непосредственно конъюгированных антител, распознающих поверхностные маркеры раковых клеток толстой кишки. Последовательные разбавления DLD-1, дополненного опухолевыми клетками, по этой причине, окрашивают с помощью антител, специфичных к двум ассоциирующимся с опухолями поверхностным антигенам EpCAM и CA19-9, конъюгированным с флуорофорами AF488 и PerCP, соответственно.
EpCAM экспрессируются почти на всех раковых клетках толстой кишки DLD-1 (фиг.9A). Количество детектируемых клеток хорошо коррелирует с окрашиванием для CK20. Детекция наименьшего количества добавленных опухолевых клеток (0,012% DLD-1 клетки) идентифицируется как 0,014% положительных по EpCAM клеток (фиг.9A). Поскольку фоновое окрашивание с использованием PBMC самого по себе составляет 0,004% детектируемых событий, авторы делают вывод, что положительные по EpCAM клетки могут быть детектированы с хорошей точностью в пределах малых образцов клеток.
Антиген CA19-9 экспрессируется на приблизительно 80% опухолевых клеток DLD-1 (фиг.10B). Среднее отношение между CA19-9+ и добавленным количеством клеток для 5 самых высоких концентраций составляет 0,80 (в диапазоне 0,73-0,91). Фоновое окрашивание в PBMC без добавления раковых клеток толстой кишки чуть выше для CA19-9, чем для EpCAM, при этом 0,017% клеток являются положительными по CA19-9 (фиг.10B, нижняя панель), по сравнению с 0,004%, являющимися положительными по EpCAM (фиг.10A, нижняя панель). Присутствие опухолевых клеток легко детектируется при такой низкой концентрации как 0,11% добавленных клеток без помех со стороны фонового окрашивания. Таким образом, даже, несмотря на то, что фон чуть выше, чем фон для окрашивания с помощью EpCAM, CA19-9, видимо, является пригодным для использования маркером для детекции раковых клеток толстой кишки путем проточной цитометрии.
Совместную экспрессию двух ассоциированных с опухолью маркеров оценивают с помощью анализов экспрессии EpCAM в зависимости от CA19-9, с использованием точечных диаграмм с логарифмом зеленой флюоресценции (AF488) как функцией логарифма красной флюоресценции (PerCP). Имеется хорошая корреляция с количеством детектируемых клеток от 9% и ниже до 0,11% добавленных клеток (фиг.10C). В среднем, 84% добавленных клеток являются двукратно положительными по экспрессии EpCAM и CA19-9 (фиг.10C, верхний правый квадрант), в соответствии с данными по отдельным окрашиваниям, при этом CA19-9 экспрессируется на 80% клеток (фиг.10B). В среднем 24% клеток представляют собой EpCAM+CA19-9- при последовательных разбавлениях (фиг.10C, нижние правые квадранты). Количества отдельных клеток, положительных по CA19-9, являются очень низкими (в среднем, 0,5%) (фиг.10C, верхний левый квадрант). Таким образом, подавляющее большинство клеток DLD-1 с CA19-9+ одновременно экспрессируют EpCAM. Использование флюоресценции на обеих осях увеличивает фоновое окрашивание в PBMC до 0,087% (фиг.10C, нижняя панель). Поскольку большая часть этих событий (0,079%) ограничивается верхним левым квадрантом, увеличение фона связано с увеличением количества ложноположительных событий для CA19-9. Ни один из изотип-контролей (IgG2a AF488 или IgG1 PerCP) не дает какого-либо значительного неспецифичного окрашивания (данные не включаются). Детекция опухолевых клеток в PBMC, куда быстро вводят раковые клетки толстой кишки линии DLD-1, может по этой причине быть облегчено с помощью окрашивания на множество клеточных поверхностных маркеров.
Пример 7
Детекция опухолевых клеток в сигнальных онкоузлах
Для проверки пригодности для использования непосредственно конъюгированных антител, специфичных к EpCAM и CA19-9, у пациентов с раком толстой кишки, анализируют свежеполученные клеточной суспензии от 14 сигнальных онкоузлов от 7 пациентов (таблица 4). Клетки параллельно окрашивают внутриклеточно на CK20, чтобы сделать возможным сравнение. Изотип-контроли для цитокератина 20, EpCAM и CA19-9 используют для определения присутствия положительных клеток (фиг.13A). В среднем 0,32, 0,21 и 0,16% клеток окрашиваются положительно, когда используют изотип-контроли для CK20, EpCAM и CA19-9, соответственно.
У пациента 1 идентифицируются три сигнальных онкоузла (SN1-3). В SN1 имеется четкое присутствие метастатических раковых клеток толстой кишки, из которых 5,6% являются положительными по CK20, и такая же доля клеток идентифицируются как положительная по CA19-9 (фиг.13A). EpCAM, видимо, экспрессируется на трети (34%) метастатических клеток (или 1,9% событий в целом). Метастатические клетки также присутствуют в SN2, 0,57% клеток являются положительными по CK20 и 0,72% являются положительными по CA19-9. Экспрессия EpCAM составляет 0,18%, что в сравнении с экспрессией цитокератина представляет 32% метастатических клеток, и 25%, в сравнении с клетками, положительными по CA19-9. Однако количество детектируемых клеток, положительных по EpCAM, близко к уровню изотип-контролей. Исследование SN3 показывает только очень малое количество событий, положительных по CK20, EpCAM или CA19-9, близкое к уровням детекции, определяемым с помощью изотип-контролей, и таким образом SN3 считается отрицательным по присутствию метастатических раковых клеток толстой кишки.
Два сигнальных онкоузла идентифицируются интраоперативно у пациента 2 (фиг.13B). В SN1 окрашивания на CK20 и CA19-9 сравнимы с 0,69% и 0,42% детектируемых метастатических клеток, в то время как 1,3% детектируемых событий представляют собой EpCAM+. Опять же, в SN2 детектируемое количество положительных событий с использованием всех трех маркеров близко к пределу детекции, как определено с помощью изотип-контролей, и SN2, таким образом, считается не содержащим метастазов. По сравнению с исследуемой системой с PBMC, куда быстро вводят опухолевые клетки (фиг.10), образцы тканей лимфатического узла являются менее гомогенными, что приводит к возникновению более высокого фона.
Обсуждение
Авторы представляют здесь новый мультиплексный способ быстрой и воспроизводимой детекции метастатических клеток в лимфатических узлах. До этого, детекцию метастазов осуществлялось на основе микроскопического исследования нескольких срезов материала лимфатического узла, которые оценивает патологоанатом. Способ занимает много времени, является трудоемким, дорогостоящим и субъективным по отношению к индивидуальной оценке патологоанатома. Например, давление, оказываемое на патологоанатома, делающего оценку замороженного среза, из операционной хирургом, ожидающим решения, по поводу того, должен ли он продолжать и расширять хирургическую процедуру или нет, создает ситуацию с риском получения ложноположительных результатов. Кроме того, процедура делает возможным только анализ нескольких 6-мкм срезов, создавая ситуацию, где ложноотрицательные результаты являются вероятными, поскольку части лимфатического узла даже не исследуются. Чтобы исключить эти недостатки и сделать возможным быстрый объективный способ оценки метастатических клеток в лимфатических узлах, авторы устанавливают систему исследования статистически релевантного образца цельного лимфатического узла, где присутствие метастатических клеток надежно идентифицируется с помощью мультиплексного окрашивания поверхностных клеточных молекул, присутствующих на клетках толстой кишки (фиг.6), для клеток, которые при нормальных условиях не присутствуют в лимфатическом узле. Сочетание, по меньшей мере, четырех маркеров увеличивает чувствительность и специфичность анализа посредством уменьшения количества ложноположительных и ложноотрицательных образцов. Таким образом, результаты исследования будут иметь увеличенные положительные и отрицательные предикативные значения по сравнению с оценками, сделанными под микроскопом, позволяя хирургу получить более надежный план степени операции из исследования лимфатического узла. Кроме того, поскольку извлечение отдельных клеток из лимфатических узлов является легкой и эффективной процедурой, и поскольку используют антитела с высоким сродством и высокими скоростями связывания (kon), связывание детектируемых реагентов является быстрым, делая возможными получение коротких времен инкубирования и объективную регистрацию в пределах нескольких минут путем проточной цитометрии. Использование проточной цитометрии для анализов делает возможным более высокую степень стандартизации и упрощает работу по контролю качества с помощью использования стандартов.

| название | год | авторы | номер документа |
|---|---|---|---|
| СРОЧНАЯ ФЛЮОРЕСЦЕНТНАЯ ИММУНОЦИТОХИМИЧЕСКАЯ ДИАГНОСТИКА МЕТАСТАТИЧЕСКОГО ПОРАЖЕНИЯ ЛИМФАТИЧЕСКИХ УЗЛОВ | 2014 |
|
RU2582275C1 |
| СПОСОБ СРОЧНОЙ ДИФФЕРЕНЦИАЛЬНОЙ ФЛУОРЕСЦЕНТНОЙ ИММУНОЦИТОХИМИЧЕСКОЙ ДИАГНОСТИКИ МЕТАСТАЗОВ РАКА В ЛИМФАТИЧЕСКИЕ УЗЛЫ И НЕХОДЖКИНСКОЙ ЛИМФОМЫ | 2015 |
|
RU2580612C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ЦИРКУЛИРУЮЩИХ В КРОВИ ОПУХОЛЕВЫХ КЛЕТОК МЕТОДОМ МНОГОПАРАМЕТРОВОЙ ПРОТОЧНОЙ ЦИТОМЕТРИИ | 2024 |
|
RU2825188C2 |
| РЕПРЕЗЕНТАТИВНАЯ ДИАГНОСТИКА | 2016 |
|
RU2743169C2 |
| СПОСОБ ДИАГНОСТИКИ СТОРОЖЕВЫХ ЛИМФОУЗЛОВ ПРИ РАКЕ ЖЕЛУДКА | 2020 |
|
RU2727251C2 |
| АГЕНТЫ, СВЯЗЫВАЮЩИЕ РЕЦЕПТОР "FRIZZLED", И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2579897C2 |
| Способ определения циркулирующих опухолевых клеток у больных раком молочной железы | 2021 |
|
RU2770284C1 |
| ФЛУОРЕСЦЕНТНЫЕ КОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ДИАГНОСТИКИ ОПУХОЛИ | 2016 |
|
RU2720976C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ КЛАУДИНА-18 ДЛЯ ЛЕЧЕНИЯ РАКА | 2008 |
|
RU2571923C2 |
| РАКОВЫЙ МАРКЕР И ТЕРАПЕВТИЧЕСКАЯ МИШЕНЬ | 2008 |
|
RU2529797C2 |

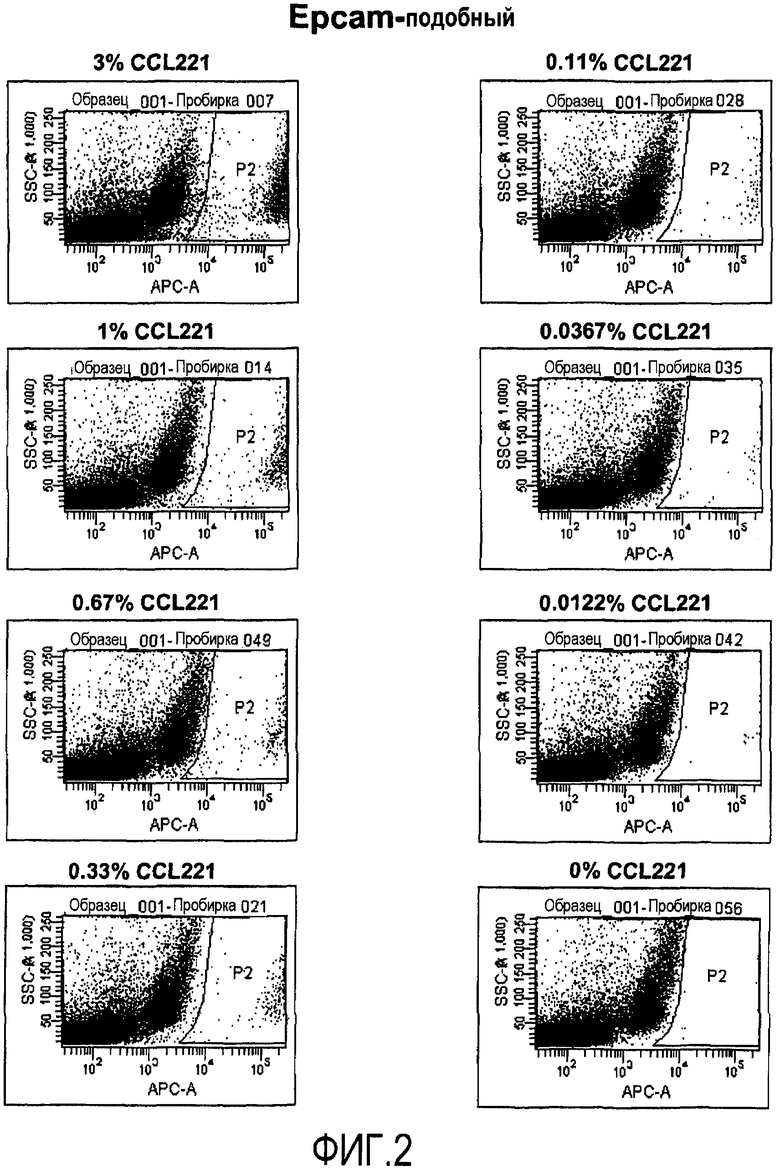
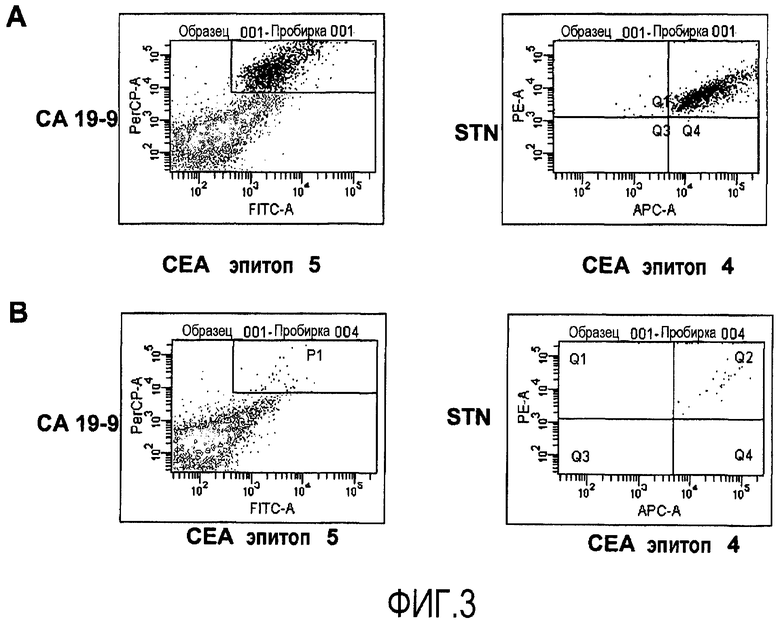
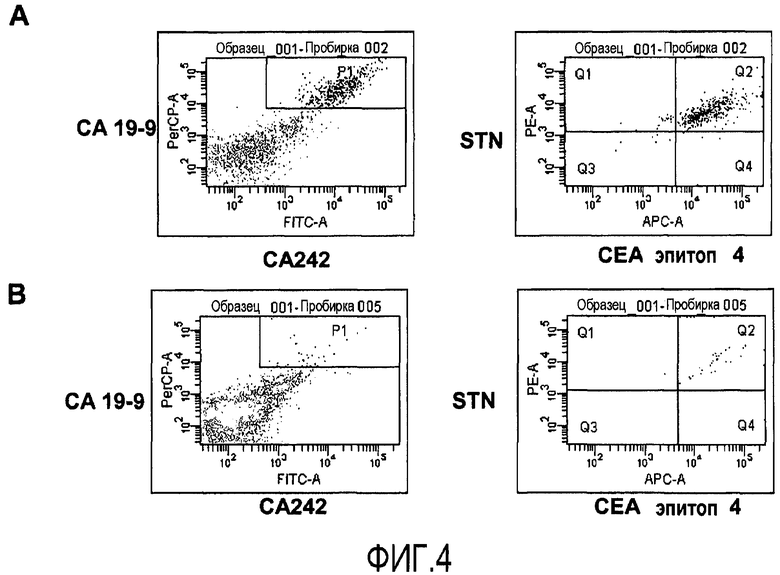
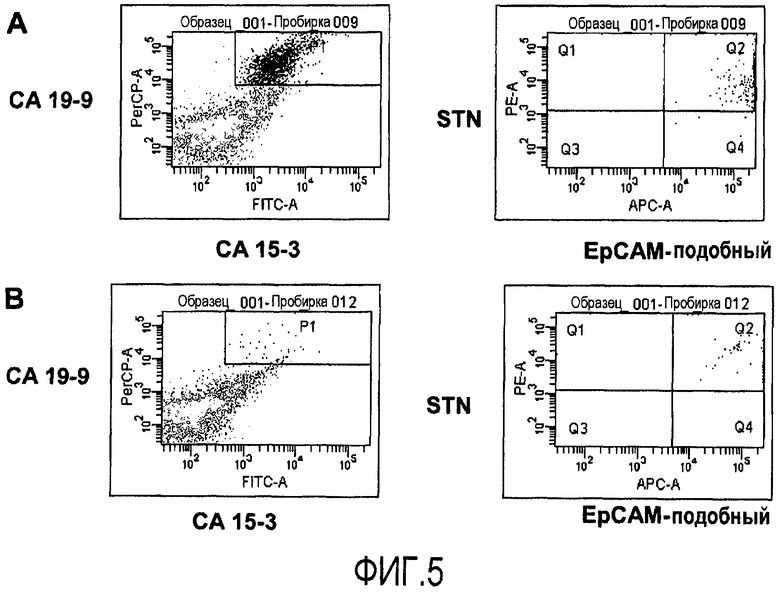
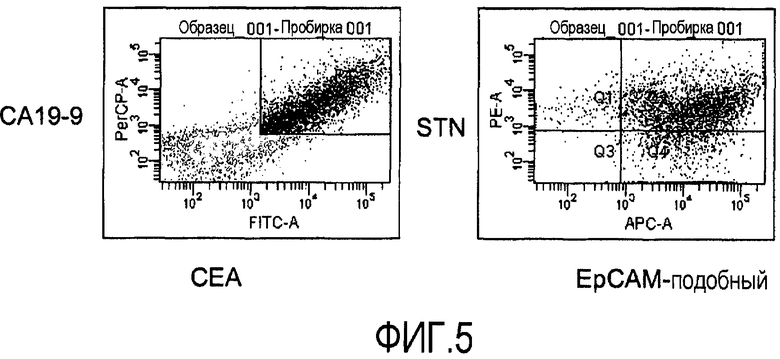

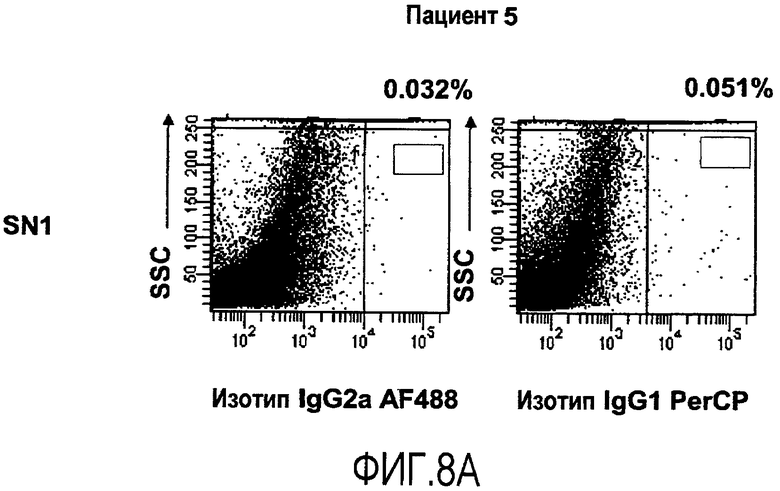
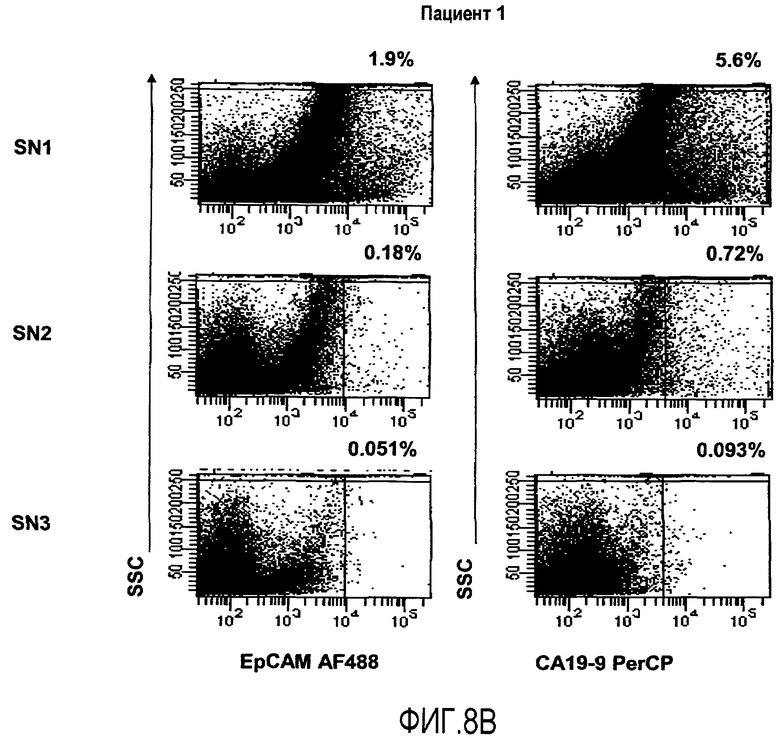
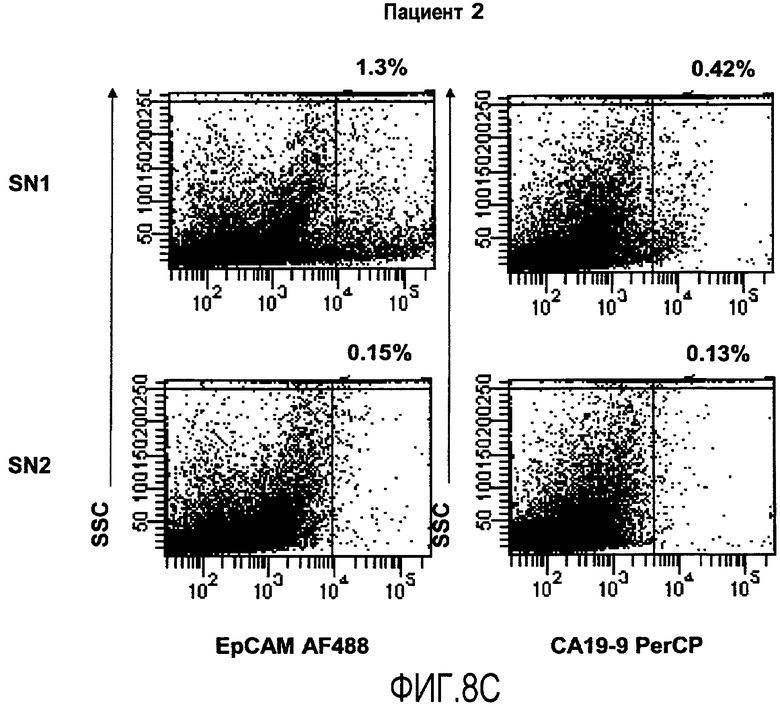
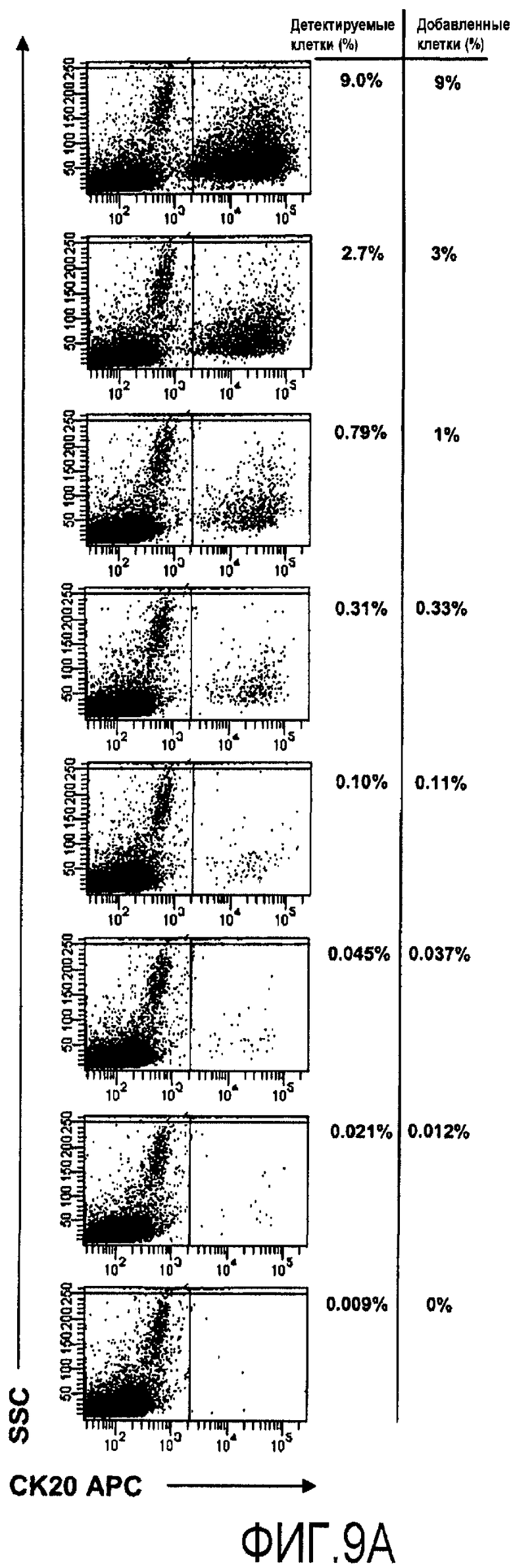
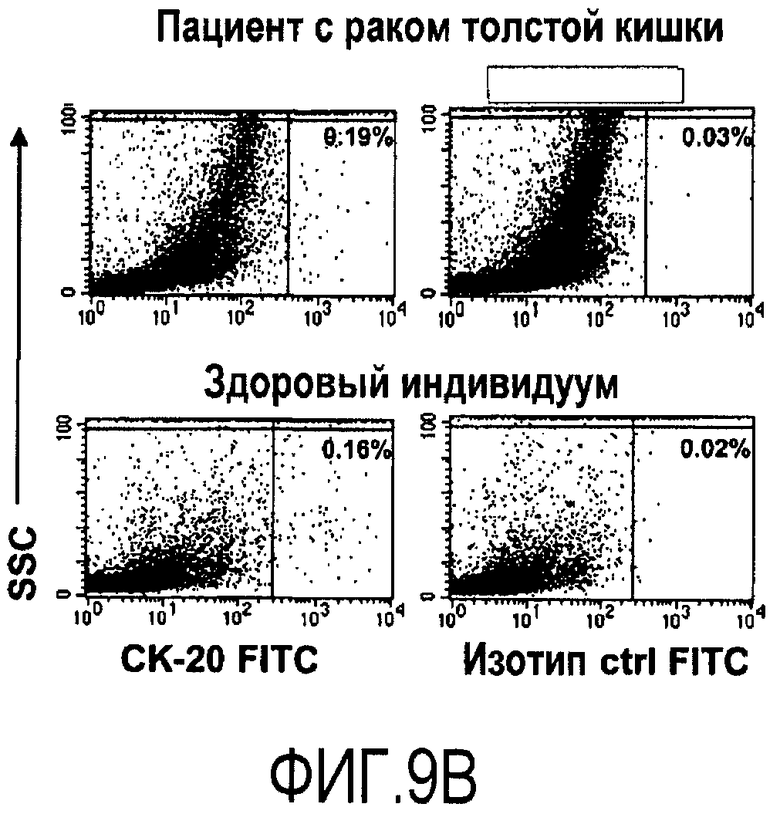
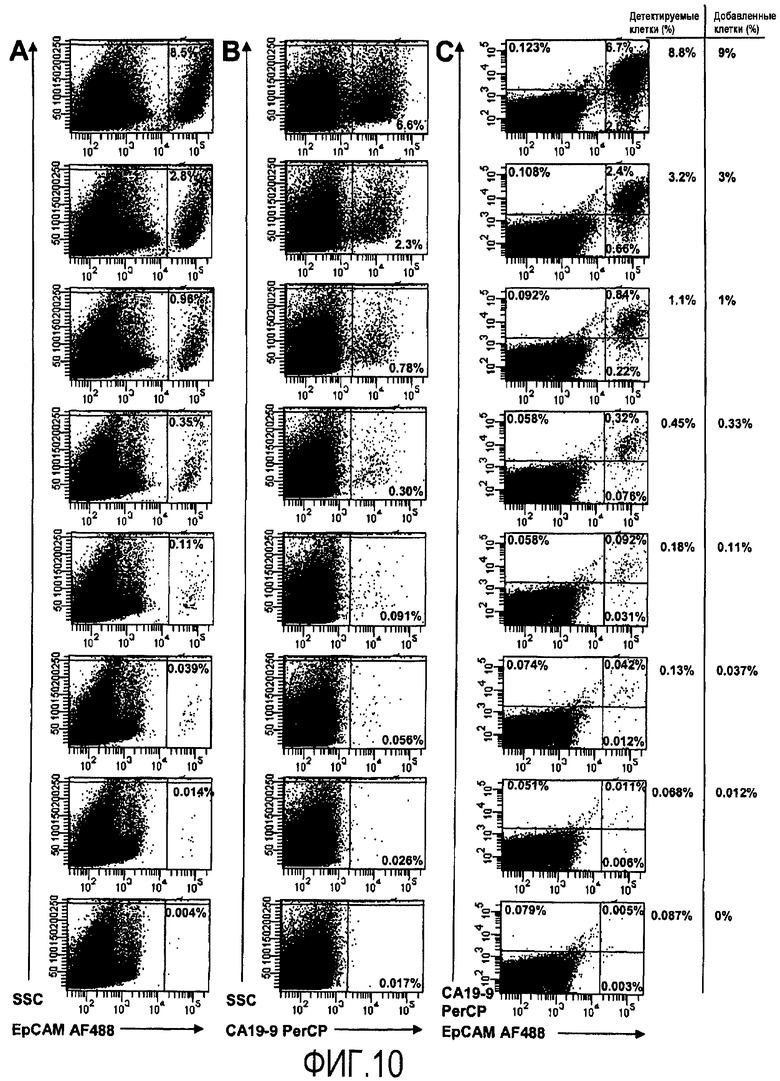
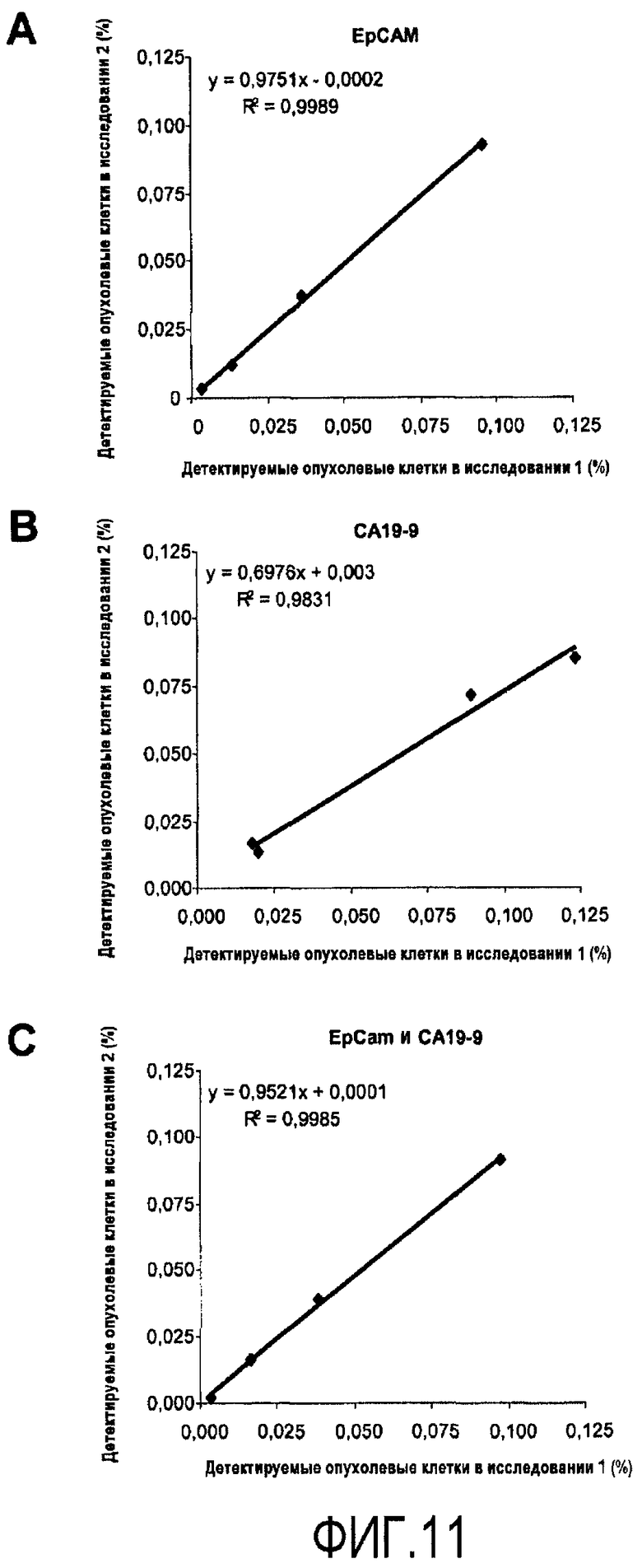
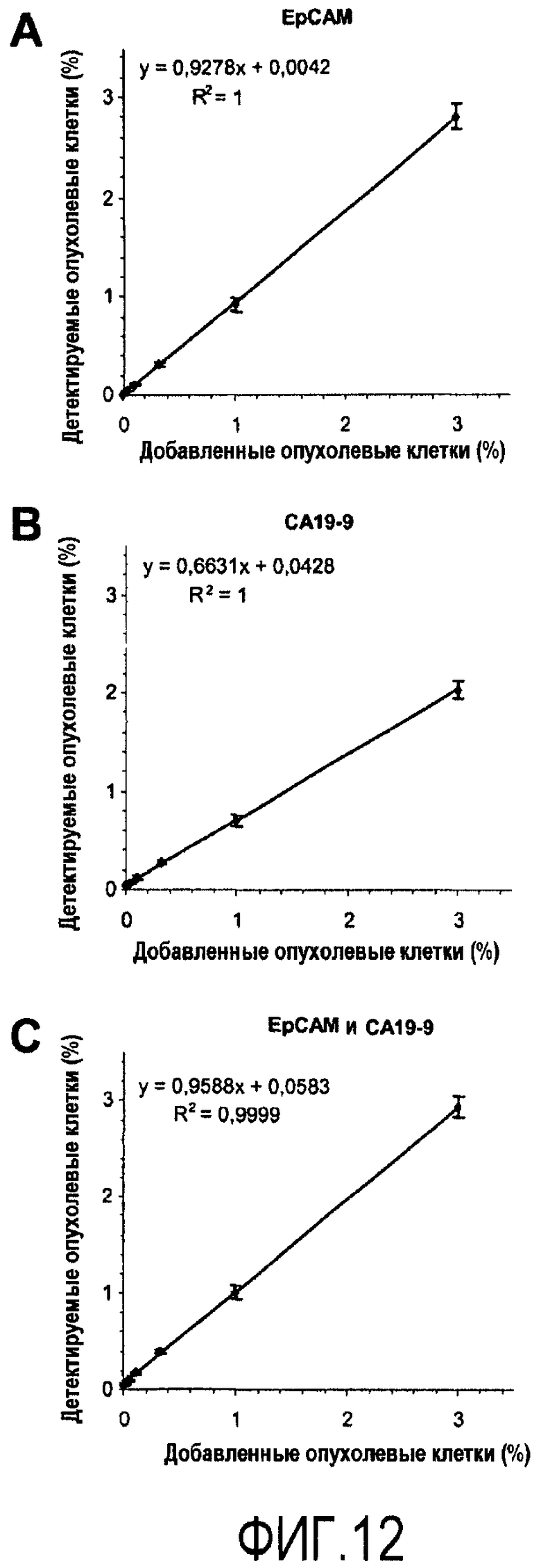
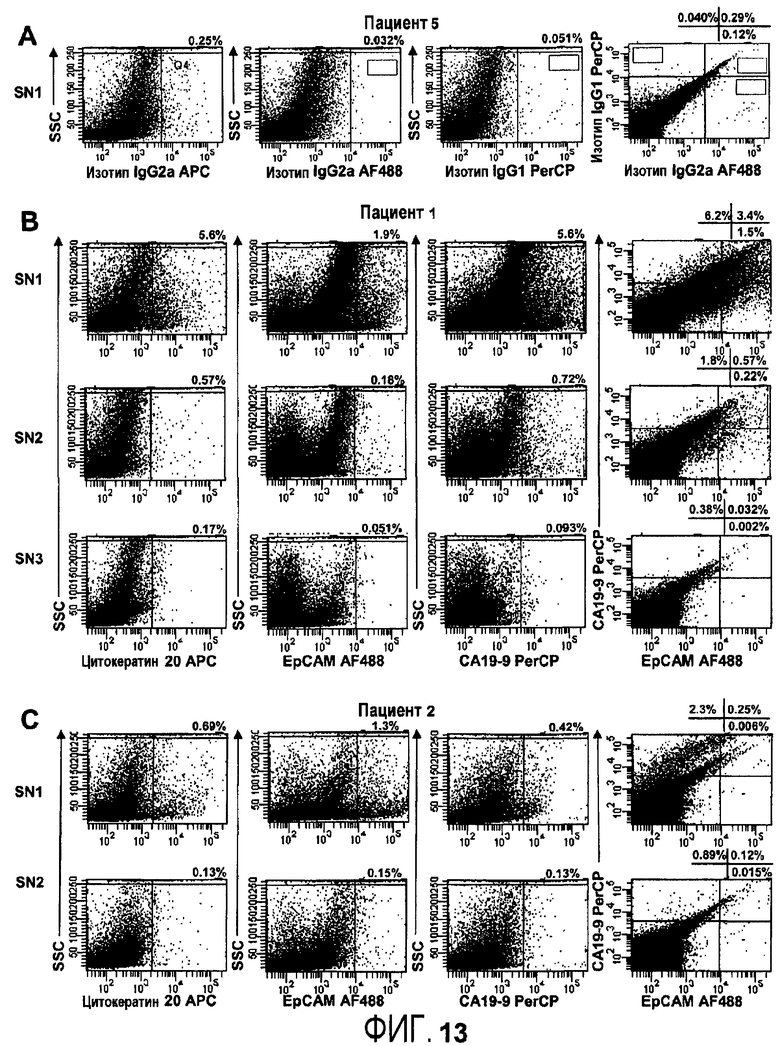
Изобретение относится к лабораторной диагностике, а именно к одностадийному способу одновременной детекции раковых клеток толстой кишки или элементов раковых клеток толстой кишки в биологическом образце из лимфатических узлов. Сущность способа состоит в том, что к образцу добавляют панель меченых агентов, которые связываются с двумя или более маркерами, экспрессируемыми на поверхности клетки, где, по меньшей мере, один из агентов является специфичным к раку и где панель содержит: один или нескольких агентов, связывающихся с рак специфичными маркерами, экспрессируемыми на поверхности раковой клетки толстой кишки, где один агент или один из агентов является агентом, связывающимся с СА 19-9, и один или нескольких агентов, связывающихся с тканеспецифичными маркерами, которые являются эпителиальными и/или мезенхимальными экспрессируемыми на поверхности клетки, где один агент или один из агентов является агентом, связывающимся с Ер-САМ. Набор, содержащий один или несколько агентов, связывающийся с внеклеточными рак специфичными маркерами, где один агент или один из агентов является антителом или фрагментом антитела, связывающимся с СА 19-9, и один или нескольких агентов, связывающихся с внеклеточными тканеспецифичными маркерами, которые являются эпителиальными маркерами и/или мезенхимальными маркерами, где один агент или один из агентов является антителом или фрагментом антитела, связывающимся с Ер-САМ. Использование заявленного способа и набора позволяет детектировать раковые клетки толстой кишки с высокой чувствительностью и специфичностью. 2 н. и 3 з.п. ф-лы, 5 табл., 13 ил., 7 пр.
1. Одностадийный способ непосредственной и одновременной детекции раковых клеток толстой кишки или элементов раковых клеток в биологическом образце сигнальных онкоузлов, дренирующих узлов или других лимфатических узлов, включающий:
i) добавление к указанному биологическому образцу панели меченых агентов, которые связываются с двумя или более маркерами, экспрессируемыми на поверхности клетки, где, по меньшей мере, один из агентов является специфичным к раку, и где панель содержит:
один или несколько агентов, связывающихся с рак-специфичными маркерами, экспрессируемыми на поверхности раковой клетки толстой кишки, где один агент или один из агентов является агентом, связывающимся с СА 19-9, и
один или несколько агентов, связывающихся с тканеспецифичными маркерами, экспрессируемыми на поверхности клетки, которые являются эпителиальными маркерами и/или мезенхимальными маркерами, где один агент или один из агентов является агентом, связывающимся с Ер-САМ;
ii) осуществление проточной цитометрии полученного биологического образца.
2. Способ по п.1, в котором мезенхимальный маркер выбран из CD44, c-Kit и рецептора 2 VEGF.
3. Способ по п.1, где эпителиальный маркер выбран из эпителиального специфичного антигена, эпидермального фактора роста и Е-кадгерина.
4. Способ по пп.1-3, где агентами являются моноклональные антитела или их фрагменты.
5. Набор для использования в способе по пп.1-4, содержащий один или несколько агентов, связывающихся с внеклеточными рак-специфичными маркерами, где один агент или один из агентов является антителом или фрагментом антитела, связывающимся с СА 19-9, и один или нескольких агентов, связывающихся с внеклеточными тканеспецифичными маркерами, которые являются эпителиальными маркерами и/или мезенхимальными маркерами, где один агент или один из агентов является антителом или фрагментом антитела, связывающимся с Ер-САМ.
| DURRANT L.G | |||
| et al | |||
| Enhanced recognition of human colorectal tumour cells using combinations of monoclonal antibodies | |||
| Br J Cancer | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| NI X.G | |||
| The clinical value of serum CEA, CA 19-9, and CA 242 in the diagnosis and prognosis of pancreatic cancer | |||
| Eur J Surg Oncol | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ANDREW | |||
Авторы
Даты
2013-08-10—Публикация
2008-02-27—Подача