Область техники
Настоящее изобретение относится к терапевтическим средствам, используемым против реакции трансплантат против хозяина. Более конкретно, настоящее изобретение относится к терапевтическим средствам, используемым против реакции трансплантат против хозяина, которые содержат в качестве активного ингредиента ингибитор рецептора интерлейкина-6 (IL-6).
Уровень техники
Несмотря на то, что лечение гематопоэтических опухолей, таких как лейкоз, начинают с химиотерапии противоопухолевыми средствами, для пациентов, плохо подающихся лечению или с низкой вероятностью лечения с помощью стандартной химиотерапии, в дальнейшем требуется трансплантация гематопоэтических стволовых клеток (например, стволовых клеток периферической крови, клеток костного мозга). При этом отмечается, что трансплантация гематопоэтических стволовых клеток вызывает реакцию трансплантат против хозяина (РТПХ).
РТПХ представляет собой общее название заболеваний, которые вызываются иммунной реакцией пересаженных или трансплантированных иммунокомпетентных клеток против тканей хозяина. Возможно, это в основном происходит из-за того, что иммунокомпетентные клетки (например, зрелые T-клетки), находящиеся в периферической крови для переливания или трансплантации вызывают иммунные ответы против тканей реципиента. РТПХ включает как острые, так и хронические типы заболеваний с симптомами, такими как кожные симптомы, диарея и желтуха, которые могут оказывать серьезные побочные явления, приводящие в некоторых случаях к смерти.
Методики, обычно используемые для подавления РТПХ, включают способы, основанные на использовании иммуносупрессивных средств, таких как метотрексат или циклоспорин A, а также способы, основанные на удалении зрелых T-клеток из группы трансплантатных клеток (трансплантата). В случае использования метотрексата или циклоспорина A возникает проблема их побочного воздействия на организм. Известно, что подобным эффектом циклоспорина A является сильная нефротоксичность, а побочным эффектом метотрексата является подавление костного мозга.
С другой стороны, удаление зрелых T-клеток из группы трансплантатных клеток позволяет подавлять РТПХ, однако недостатком такого удаления является снижение противоракового действия, что приводит, например, к рецидиву лейкоза (непатентный документ 1).
Интерлейкин-6 (IL-6) представляет собой цитокин, называемый фактором стимуляции 2 В-клеток (BSF2) или интерфероном β2. IL-6 был открыт как фактор дифференцировки, вовлеченный в активацию B-клеточных лимфоцитов (непатентный документ 3), а позднее было обнаружено, что он является многофункциональным цитокином, который оказывает влияние на функцию различных клеток (непатентный документ 3). Сообщалось, что IL-6 индуцирует созревание Т-лимфоцитарных клеток (непатентный документ 4).
IL-6 осуществляет свою биологическую активность через два типа белков на клетке. Первый тип белка представляет собой рецептор IL-6, который является лиганд-связывающим белком, с которым связывается IL-6; этот белок имеет молекулярную массу около 80 кДа (непатентные документы 5 и 6). Рецептор IL-6 представлен в мембраносвязанной форме, которая пронизывает клеточную мембрану и экспрессируется на клеточной мембране, а также в виде растворимого рецептора IL-6, который в основном состоит из внеклеточного участка мембраносвязанной формы.
Другим типом белка является мембранный белок gp130, который обладает молекулярной массой около 130 кДа и вовлечен в не связанную с лигандом передачу сигнала. Биологическая активность IL-6 передается в клетку путем образование комплекса IL-6/рецептор, состоящего из IL-6 и рецептора IL-6, после чего происходит связывание комплекса с gp130 (непатентный документ 7).
Ингибиторы IL-6 представляют собой вещества, которые ингибируют передачу биологической активности IL-6. В настоящее время известные ингибиторы IL-6 включают антитела против IL-6 (антитела анти-IL-6), антитела против рецептора IL-6 (антитела анти-рецептор IL-6), антитела против gp130 (антитела анти-gp130), варианты IL-6, частичные пептиды IL-6 или рецептора IL-6а и другие.
Существует несколько документов, посвященных антителам против рецептора IL-6а (непатентные документы 8 и 9, патентные документы 1-3). В одном из таких докладов подробно описано гуманизированное антитело PM-1, которое получено путем замены гипервариабельного участка (CDR) антитела PM-1 мыши (непатентный документ 10), которое представляет собой антитело против рецептора IL-6а, в антителе человека (патентный документ 4).
Антитела против рецептора IL-6а используют для лечения воспалительных заболеваний, таких как ревматизм. Однако действующие при воспалении цитокины, включая IL-6, образуют сложную сеть, и поэтому было неясно, являются ли ингибиторы рецептора IL-6а эффективными для лечения других заболеваний, таких как реакция трансплантат против хозяина.
Действительно, сообщалось, что на модели РТПХ с экспрессией IL-6 на мышах не было получено никакого терепевтического эффекта, даже при введении антитела против IL-6 (непатентный документ 11).
Документы, относящиеся к прототипам настоящего изобретения, представлены ниже.
Непатентный документ 1: Marmont, AM. et al., Blood (1991) 78, 2120-2123
Непатентный документ 2: Hirano, T. et al., Nature (1986) 324, 73-76
Непатентный документ 3: Akira, S. et al., Adv. in Immunology (1993) 54, 1-78
Непатентный документ 4: Lotz, M. et al., J. Exp. Med. (1988) 167, 1253-1258
Непатентный документ 5: Taga, T. et al., J. Exp. Med. (1987) 166, 967-981
Непатентный документ 6: Yamasaki, K. et al., Science (1988) 241, 825-828
Непатентный документ 7: Taga, T. et al., Cell (1989) 58, 573-581
Непатентный документ 8: Novick, D. et al., Hybridoma (1991) 10, 137-146
Непатентный документ 9: Huang, Y. W. et al., Hybridoma (1993) 12, 621-630
Непатентный документ 10: Hirata, Y. et al., J. Immunol. (1989) 143, 2900-2906
Непатентный документ 11: Knulst A. C. et al., Mediators of Inflammation (1994) 3, 33-40
Патентный документ 1: International Patent Publication No. WO 95/09873
Патентный документ 2: French Patent Publication No. FR 2694767
Патентный документ 3: U.S. Patent No. US 5216128
Патентный документ 4: International Patent Publication No. WO 92/19759
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
Конкретные детали роли рецептора IL-6а в РТПХ остаются неизвестными. Также не ясно, за счет чего оказывается эффект на РТПХ при введении ингибиторов рецептора IL-6а.
Настоящее изобретение было осуществлено на основании описанных выше обстоятельств. Объектом настоящего изобретения являются новые терапевтические средства, используемые при РТПХ.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМ
В результате всесторонних и интенсивных попыток, предпринимавшихся для достижения вышеупомянутого объекта, авторы настоящего изобретения обнаружили, что антитело против рецептора IL-6а вызывает значительный терепевтический эффект на модели РТПХ на мышах. Эти данные привели к созданию настоящего изобретения.
А именно, настоящее изобретение более конкретно определено ниже в пунктах [1]-[5].
[1]. Терапевтическое средство, используемое против реакции трансплантат против хозяина (РТПХ), которое содержит в качестве активного ингредиента ингибитор рецептора интерлейкина-6 (IL-6).
[2]. Терапевтическое средство, используемое против РТПХ, как указано выше в [1], при этом ингибитор рецептора IL-6а представляет собой ингибитор рецептора IL-6а человека.
[3]. Терапевтическое средство, используемое против РТПХ, как указано выше в [1], при этом ингибитор рецептора IL-6а представляет собой антитело против рецептора IL-6.
[4]. Терапевтическое средство, используемое против РТПХ, как указано выше в [3], при этом антитело против рецептора IL-6 представляет собой химерное антитело, гуманизированное антитело или антитело человека.
[5]. Терапевтическое средство, используемое против РТПХ, как указано в любом из указанных выше [1]-[4], которое предназначено для использования против РТПХ после трансплантации стволовых клеток периферической крови.
[6]. Способ, используемый против реакции трансплантат против хозяина (РТПХ), который включает введение терапевтически эффективного количества ингибитора рецептора интерлейкина-6 (IL-6).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖА
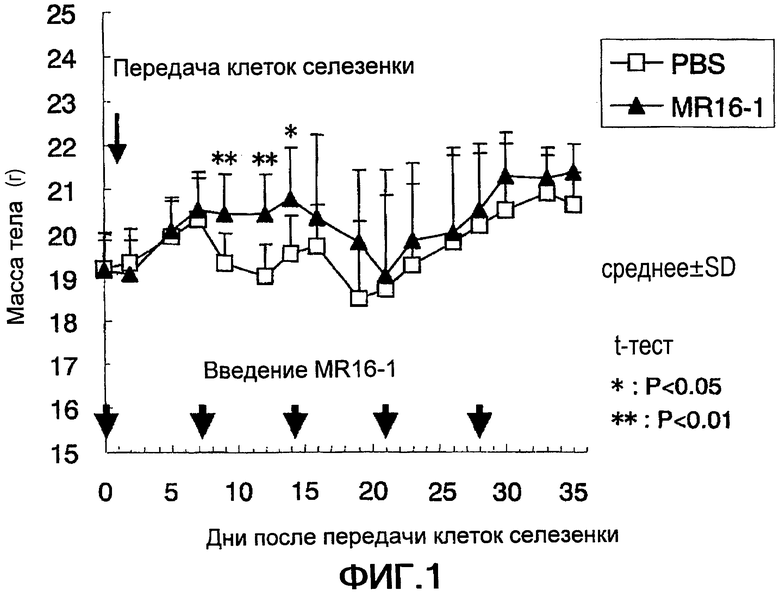
Фигура 1 представляет собой график, на котором показана кривая изменений массы тела у мышей с индуцированной РТПХ в группе с антителом против рецептора IL-6 и в контрольной группе в зависимости от времени.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящем документе, «ингибитор рецептора IL-6» представляет собой вещество, которое блокирует обусловленную рецептором IL-6 передачу сигнала и ингибирует биологическую активность рецептора IL-6. Таким ингибитором рецептора IL-6 может являться либо вещество, которое непосредственно ингибирует биологическую активность рецептора IL-6 посредством связывания с рецептором IL-6, либо вещество, которое опосредованно ингибирует биологическую активность рецептора IL-6 путем связывания с другим веществом, таким как gp130, однако предпочтительно представляет собой вещество, которое связывается с рецептором IL-6 и обладает ингибирующей активностью, препятствующей связыванию между IL-6 и рецептором IL-6.
Ингибиторы рецептора IL-6, по настоящему изобретению, включают, в качестве неограничивающих примеров, например, антитела против рецептора IL-6, растворимые варианты рецептора IL-6, частичные пептиды рецептора IL-6 и низкомолекулярные соединения, которые обладают сходной активностью. Предпочтительные примеры ингибиторов рецептора IL-6, по настоящему изобретению, включают антитела, которые распознают рецептор IL-6.
Источник антител против рецептора IL-6, использованный в настоящем изобретении, конкретно не ограничен; тем не менее, антитело предпочтительно получают из организма млекопитающего.
Антитела против рецептора IL-6, используемые в настоящем изобретении, могут быть получены в виде поликлональных или моноклональных антител, используя известные способы. В частности, антитела против рецептора IL-6, используемые в настоящем изобретении, представляют собой, предпочтительно, моноклональные антитела млекопитающих. Моноклональные антитела млекопитающих, включают моноклональные антитела, продуцируемые гибридомами, и моноклональные антитела, продуцируемые с помощью способов генной инженерии организмами-хозяевами, трансформированными вектором экспрессии, который содержит ген антитела. За счет связывания с рецептором IL-6 антитело ингибирует связывание IL-6 с рецептором IL-6 и, таким образом, блокирует передачу биологической активности IL-6 в клетку.
Примеры таких антител включают антитело MR16-1 (Tamura, T. et al., Proc. Natl. Acad. Sci. USA (1993) 90, 11924-11928); антитело PM-1 (Hirata, Y. et al., J. Immunol. (1989) 143, 2900-2906); антитело AUK12-20, антитело AUK64-7 и антитело AUK146-15 (WO 92/19759); tocilizumab; и т.д. Из них, антитело PM-1 является примером предпочтительного моноклонального антитела против рецептора IL-6 человека, f антитело MR16-1 - предпочтительного моноклонального антитела против рецептора IL-6 мыши.
В принципе, гибридомы, продуцирующие моноклональное антитело против рецептора IL-6, могут быть получены известными методиками, как указано ниже. В частности, такие гибридомы могуть быть получены с использованием рецептора IL-6 в качестве сенсибилизирующего антигена для проведения иммунизации с помощью общепринятого способа иммунизации, слияния полученных иммунных клеток с использованием известной родительской клетки с помощью общепринятого способа слияния клеток, и отбора продуцирующих моноклональные антитела клеток с помощью общепринятого способа отбора.
А именно, антитела против рецептора IL-6 могут быть получены следующим образом. Например, рецептор IL-6 человека или рецептор IL-6 мыши для использования в качестве сенсибилизирующего антигена для получения антител может быть получен с помощью генов рецептора IL-6 и/или аминокислотных последовательностей, описанных в публикациях Европейских патентов No. EP 325474 и JP 3-155795 A, соответственно.
Существует два вида IL-6-рецепторных белков: один, экспрессируемый на клеточной мембране и другой, выделенный из клеточной мембраны (растворимый рецептор IL-6) (Yasukawa, K. et al., J. Biochem. (1990) 108, 673-676). Растворимый рецептор IL-6 в основном состоит из внеклеточной области связанного с клеточной мембраной рецептора IL-6 и отличается от мембраносвязанного рецептора IL-6 тем, что в нем отсутствует трансмембранная область или как трансмембранная, так и внутриклеточная области. Любой рецептор IL-6 можно использовать в качестве IL-6-рецепторного белка, при условии, что его можно использовать в качестве сенсибилизирующего антигена для продуцирования антитела против рецептора IL-6, применяемого в настоящем изобретении.
После трансформации клетки соответствующего хозяина известной системой вектора экспрессии, несущей последовательность гена рецептора IL-6, необходимый IL-6-рецепторный белок очищают из содержимого клетки-хозяина или из культуральной среды с использованием известного способа. Этот очищенный IL-6-рецепторный белок можно использовать в качестве сенсибилизирующего антигена. Альтернативно, экспрессирующийся в клетке рецептор IL-6 или слитый белок белка рецептора IL-6 и другого белка можно использовать в качестве сенсибилизирующего антигена.
На млекопитающих, предназначенных для иммунизации сенсибилизирующим антигеном, не накладывается особых ограничений, однако их предпочтительно выбирают с учетом совместимости с родительской клеткой, используемой для слияния клеток. Как правило, используют грызунов, таких как мыши, крысы и хомяки.
Животных иммунизируют сенсибилизирующим антигеном известными способами. Например, в одном из общепринятых способов, животных иммунизируют путем внутрибрюшинной или подкожной инъекции сенсибилизирующего антигена. В частности, сенсибилизирующий антиген предпочтительно разводят или суспендируют в соответствующем количестве забуфернного фосфатом солевого раствора (PBS), физиологического солевого раствора или подобных и, при желании, дополнительно смешивают и эмульгируют с соответствующим количеством общеупотребительного адъюванта (например, полный адъювант Фрейнда), и затем вводят животному несколько раз, с интервалами от четырех дней до 21 дня. Кроме того, для иммунизации сенсибилизирующим антигеном можно использовать соответствующий носитель.
После такой иммунизации подтверждают увеличение уровня требуемого антитела в сыворотке и затем из млекопитающего получают иммунные клетки для слияния клеток. Предпочтительно, иммунные клетки для слияния клеток включают, в частности, клетки селезенки.
Клетки миеломы млекопитающих, используемые в качестве родительских клеток, т.е. в качестве клеток-партнеров для слияния с вышеупомянутыми иммунными клетками, включают различные известные линии клеток, например, P3X63Ag8,653 (Kearney, J. F. et al., J. Immunol (1979) 123, 1548-1550), P3X63Ag8U.1 (Current Topics in Microbiology и Immunology (1978) 81, 1-7), NS-1 (Kohler, G. и Milstein, C., Eur. J. Immunol. (1976) 6, 511-519), MPC-11 (Margulies, D. H. et al., клетка (1976) 8, 405-415), SP2/0 (Shulman, M. et al., Nature (1978) 276, 269-270), F0 (de St. Groth, S. F. et al., J. Immunol. Способы (1980) 35, 1-21), S194 (Trowbridge, I. S., J. Exp. Med. (1978) 148, 313-323), R210 (Galfre, G. et al., Nature (1979) 277, 131-133), и подобные.
В принципе, слияние клеток вышеупомянутых иммунных клеток и клеток миеломы можно осуществить с использованием известных способов, например, способа Milstein et al. (Kohler, G. и Milstein, C., Methods Enzymol. (1981) 73, 3-46), и подобных.
А именно, вышеуказанное слияние клеток проводят в культуральной среде со стандартными пищевыми добавками в присутствии вещества, усиливающего слияние клеток. Например, полиэтиленгликоль (ПЭГ), вирус Сендай (HVJ) и тому подобное, используют в качестве веществ, усиливающих слияние. Кроме того, для усиления эффективности слияния можно добавлять вспомогательные агенты, такие как диметилсульфоксид, в зависимости от необходимости.
Используемое соотношение иммунных клеток к клеткам миеломы составляет, предпочтительно, например, от 1 до 10 иммунных клеток на каждую клетку миеломы. Культуральная среда, используемая для вышеупомянутого слияния клеток, представляет собой, например, культуральную среду RPMI1640 или MEM, которые подходят для пролиферации вышеупомянутых клеток миеломы. Можно также использовать стандартную культуральную среду, используемую для культивирования этого типа клеток. Более того, можно использовать в комбинации сывороточные добавки, такие как эмбриональная сыворотка (FCS).
Для слияния клеток, представляющие интерес слитые клетки (гибридомы) образуются путем тщательного смешивания предопределенных количеств вышеупомянутых иммунных клеток и миеломных клеток в вышеупомянутой культуральной среде и последующего добавления и перемешивания раствора ПЭГ (например, раствор ПЭГ со средней молекулярной массой от около 1000 до 6000), предварительно нагретого до 37°C в концентрации от 30% до 60% (масса/объем). Затем вещества, способствующие слиянию клеток, и вещества, которые являются неподходящими для роста гибридом, можно удалить путем многократного добавления соответствующей культуральной среды и затем удаления супернатанта путем центрифугирования.
Вышеописанные гибридомы отбирают путем культивирования в стандартной селективной культуральной среде, например, культуральной среде HAT (культуральная среда, содержащая гипоксантин, аминоптерин и тимидин). Культуру в культуральной среде HAT поддерживают в течение достаточного периода, как правило, от нескольких дней до нескольких недель, для уничтожения клеток, отличных от представляющих интерес гибридом (неслитые клетки). Затем способом стандартных лимитированных разведений осуществляют скрининг и клонируют гибридомы, которые продуцируют представляющее интерес антитело.
Кроме способов иммунизации отличных от человека млекопитающих антигенами для получения вышеупомянутых гибридом, требуемые антитела человека с активностью связывания с требуемым антигеном или антиген-экспрессирующей клеткой могут быть получены путем сенсибилизирования лимфоцита человека требуемым антигенным белком или антиген-экспрессирующей клеткой in vitro и слияния сенсибилизированного B-лимфоцита с миеломной клеткой человека (например, U266) (см., JP 1-59878 B). Кроме того, желаемое антитело человека можно получить путем введения антигена или антиген-экспрессирующей клетки в трансгенное животное, которое обладает набором генов антитела человека, и затем следовать вышеупомянутому способу (см., публикации Международных патентов Nos. WO 93/12227, WO 92/03918, WO 94/02602, WO 94/25585, WO 96/34096, и WO 96/33735).
Полученные таким образом гибридомы, которые продуцируют моноклональные антитела, можно субкультивировать в общепринятой культуральной среде и хранить в жидком азоте в течение продолжительного периода времени.
При получении моноклональных антител из вышеупомянутой гибридомы можно использовать следующие способы: способ, при котором гибридомы культивируют в соответствии с общепринятыми способами и антитела получают в виде культурального супернатанта; способ, при котором гибридомы вводят и размножают в совместимом млекопитающем и антитело получают в виде асцитной жидкости; и так далее. Первый способ является предпочтительным для получения антител с высокой степенью очистки, а последний предпочтителен для крупномасштабного продуцирования антител.
Например, гибридомы, продуцирующие антитело против рецептора IL-6, можно получить способом, описанным в JP 3-139293 A. Такие гибридомы можно получать путем впрыскивания гибридомы, продуцирующей антитело PM-1, в брюшную полость BALB/c мыши, получения асцитов и затем очистки антитела PM-1 из асцитов; или путем культивирования гибридомы в соответствующей среде (например, среда RPMI1640, содержащая 10% эмбриональной бычьей сыворотки и 5% BM-Condimed H1 (Boehringer Mannheim); среда hybridoma SFM (GIBCO-BRL); среда PFHM-II (GIBCO-BRL) и т.д.) и затем получение антитела PM-1 из культурального супернатанта.
Рекомбинантные антитела можно использовать в качестве моноклональных антител по настоящему изобретению, когда антитела получают с использованием методик генетической рекомбинации путем клонирования гена антитела из гибридомы, встраивания гена в соответствующий вектор, и затем введения вектора в организм-хозяин (см., например, Borrebaeck, C. A. K. и Larrick, J. W., Therapeutic Monoclonal Antibodies, опубликованное в Великобритании издательством Macmillan Publishers Ltd, 1990).
А именно, мРНК, кодирующие вариабельные участки (V) антитела, выделяют из клеток, которые продуцируют представляющие интерес антитела, таких как гибридомы. мРНК можно выделять путем получения тотальных мРНК в соответствии с известными способами, такими как способ ультрацентрифугирования с гуанидином (Chirgwin, J. M. et al., Biochemistry (1979) 18, 5294-5299) и способ AGPC (Chomczynski, P. et al., Anal. Biochem. (1987) 162, 156-159), и получать мРНК с использованием набора для очистки мРНК “mRNA Purification Kit” (Pharmacia) и других. Альтернативно, мРНК можно непосредственно получать с использованием набора для очистки мРНК “QuickPrep mRNA Purification Kit” (Pharmacia).
кДНК V-областей антитела синтезируют из полученных мРНК с использованием обратной транскриптазы. кДНК можно синтезировать с использованием набора “AMV Reverse Transcriptase First-strand cDNA Synthesis Kit” и других. Кроме того, для синтезирования и амплификации кДНК можно применять способ 5'-RACE (Frohman, M. A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932) с использованием набора “5'-Ampli FINDER RACE Kit” (Clontech) и ПЦР. Представляющий интерес фрагмент ДНК очищают из полученных ПЦР-продуктов и затем лигируют с векторной ДНК. Затем рекомбинантный вектор получают с использованием вышеописанной ДНК и вводят в Escherichia coli или подобные, и затем их колонии отбирают для получения необходимого рекомбинантного вектора. Нуклеотидную последовательность представляющей интерес ДНК подтверждают известным способом, например, способом дидезокси-секвенирования.
Как только получена ДНК, кодирующая V-область представляющего интерес антитела, ДНК лигируют с ДНК, которая кодирует необходимую константную область (C-область) антитела, и вставляют в экспрессирующий вектор. Альтернативно ДНК, кодирующая V-область антитела, можно вставлять в экспрессирующий вектор, содержащий ДНК C-области антитела.
Для получения антитела, используемого в настоящем изобретении, как описано выше, ген антитела встраивают в экспрессирующий вектор так, чтобы он экспрессировался под контролем регуляторной области экспрессии, например, энхансера и промотора. Затем антитело можно экспрессировать путем трансформации клетки организма-хозяина этим экспрессирующим вектором.
По настоящему изобретению, для снижения гетероантигенности у людей и других можно применять искусственные генетически модифицированные рекомбинантные антитела, например, химерные антитела или гуманизированные антитела. Такие модифицированные антитела можно получить с использованием известных способов.
Химерное антитело можно получить путем лигирования ДНК, кодирующей V-область антитела, полученную как описано выше, с ДНК, кодирующей C-область антитела человека, затем встраивания ДНК в экспрессирующий вектор и введения его в организм хозяина для продуцирования (смотри, Европейская Патентная публикация No. EP 125023; Международная Патентная публикация No. WO 92/19759). Этот известный способ можно использовать для получения химерного антитела, подходящего для использования по настоящему изобретению.
Гуманизированные антитела также называют видоизмененными антителами человека, и они представляют собой антитела, где комплементарные детерминирующие области (CDR) антитела из отличного от человека млекопитающего (например, антитело мыши) перенесены в CDR антител человека. Общие способы для такой генной рекомбинации также известны (см., Европейская Патентная публикация No. EP 125023, Международная Патентная публикация No. WO 92/19759).
А именно, последовательности ДНК, спроектированные так, что CDR антитела мыши лигируют с каркасными областями (FR) антитела человека, синтезированными при помощи ПЦР из нескольких олигонуклеотидов, полученных с содержанием перекрывающихся частей на их концах. Полученную ДНК лигируют с ДНК, кодирующую C-области антитела человека - и затем вставляют в экспрессирующий вектор. Экспрессирующий вектор вводят в организм-хозяин для продуцирования гуманизированного антитела (см., Европейская Патентная публикация No. EP 239400, Международная Патентная публикация No. WO 92/19759).
FR антитела человека, лигированные через посредство CDR, отбирают, так что CDR образуют подходящие антиген-связывающие участки. Аминокислота(ы) внутри вариабельных областей FR антитела можно заменить, как необходимо, так что CDR перестраиваемого антитела человека образует соответствующие участки связывания антигена (Sato, K. et al., Cancer Res. (1993) 53, 851-856).
C-области антитела человека, как правило, используют для химерных и гуманизированных антител. Примеры C-областей тяжелой цепи антитела человека включают Cγ, Cα, Cµ, Cδ и Cε, и, например, можно использовать Cγ1, Cγ2, Cγ3 или Cγ4. Примеры C-областей легкой цепи антитела человека включают κ или λ. Более того, для улучшения стабильности антител или их продуцирования C-области антитела человека можно модифицировать.
Химерные антитела состоят из вариабельных областей антитела, полученного из отличного от человека млекопитающего и константных областей антитела, полученного из человека; гуманизированное антитело состоит из CDR антитела, полученного из отличного от человека млекопитающего, и каркасных областей и константных областей, полученных из антитела человека. Они обладают уменьшенной антигенностью в организме человека и, таким образом, пригодны в качестве антител для применения, по настоящему изобретению.
Предпочтительные конкретные примеры гуманизированных антител, которые могут использоваться в настоящем изобретении, включают гуманизированное антитело PM-1 (tocilizumab; см., Международная Патентная публикация No. WO 92/19759). Альтернативно, также возможны модифицированные формы гуманизированного антитела PM-1, которые конструируют для введения замен, делеций, добавлений или других модификаций в аминокислотную последовательность гуманизированного антитела PM-1.
Более того, кроме вышеупомянутых способов получения антител человека, также известны технические приемы для получения антитела человека путем сортировки (пэннинга) с использованием библиотеки антител человека. Например, вариабельные области антител человека можно экспрессировать на поверхности фагов в виде одноцепочечного антитела (scFv), используя способ фагового дисплея, селектируя тем самым антиген-связывающие фаги. Путем анализа генов отобранных фагов, можно определить последовательности ДНК, кодирующие вариабельные области антитела человека, которые связываются с антигеном. Как только можно выявить последовательность ДНК scFv, которое связывается с антигеном, можно сконструировать соответствующий экспрессирующий вектор, включающий последовательность, для получения антитела человека. Эти способы уже известны, и публикации WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438 и WO 95/15388 можно использовать в качестве ссылки.
Вышеописанные сконструированные гены антитела можно экспрессировать общепринятыми способами. При использовании клеток млекопитающих можно экспрессировать ген антитела при помощи ДНК, в которой ген экспрессируемого антитела состыкован с подходящим обычно используемым промотором и сигналом полиаденилирования, расположенным ниже гена антитела, или при помощи вектора, содержащего ДНК. Примеры промотора/энхансера включают быстрый ранний промотор/энхансер цитомегаловируса человека.
Более того, другие промоторы/энхансеры, которые можно использовать для экспрессии антител для использования, по настоящему изобретению, включают вирусные промоторы/энхансеры ретровируса, вируса полиомы, аденовируса, вакуолизирующего вируса 40 (SV40) обезьяны и других; и также включают промоторы/энхансеры, полученные из клеток млекопитающих, такие как относящиеся к фактору элонгации 1α (HEF1α) человека.
Например, при использовании промотора/энхансера SV40 экспрессию легко осуществять в соответствии со способом Mulligan et al. (Mulligan, R. C. et al., Nature (1979) 277, 108-114). Альтернативно, в случае использования промотора/энхансера HEF1α можно применить способ Mizushima et al. (Mizushima, S. и Nagata S., Nucleic Acids Res. (1990) 18, 5322).
Системы продуцирования с использованием прокариотических клеток-хозяев включают системы с использованием бактериальных клеток. Известные бактериальные клетки включают E. coli и Bacillus subtilis.
При использовании E. coli ген антитела можно экспрессировать путем сшивания общепринятого подходящего промотора, сигнальной последовательности для секреции антитела и гена антитела, который следует экспрессировать. Примеры такого промотора включают промотор lacZ, промотор araB и т.д. При использовании промотора lacZ гены можно экспрессировать в соответствии со способом Ward et al. (Ward, E. S. et al., Nature (1989) 341, 544-546; Ward, E. S. et al., FASEB J. (1992) 6, 2422-2427); и промотор araB можно использовать в соответствии со способом Better et al. (Better, M. et al., Science (1988) 240, 1041-1043).
При продуцировании антитела в периплазму E. coli можно использовать сигнальную последовательность pel B (Lei, S. P. et al., J. Бактериоl. (1987) 169, 4379-4383) в качестве сигнальнаой последовательности для секреции антитела. Продуцируемые в периплазме антитела выделяют и соответствующим образом подвергают повторному сворачиванию перед использованием (см., например, WO 96/30394).
В качестве участка начала репликации можно использовать участки начала репликации, полученные из SV40, вируса полиомы, аденовируса, вируса папилломы крупного рогатого скота (BPV) и другие. Кроме того, для увеличения числа копий гена в системе клеток-хозяев экспрессирующий вектор может содержать ген аминогликозидфосфотрансферазы (APH), ген тимидинкиназы (TK), ген ксантин-гуанин-фосфорибозилтрансферазы (Ecogpt) E. coli, ген дигидрофолатредуктазы (dhfr) или подобные в качестве селективного маркера.
Любую систему продуцирования можно использовать для получения антител для использования по настоящему изобретению. Системы продуцирования для получения антитела включают системы продуцирования in vitro и in vivo. Системы продуцирования in vitro включают системы с использованием эукариотических клеток или прокариотических клеток.
Системы продуцирования при помощи эукариотических клеток-хозяев включают системы продуцирования с использованием клеток животных, клеток растений или клеток грибков. Такие клетки животных включают (1) клетки млекопитающих, например, CHO, COS, клетки миеломы, клетки почки хомячка (BHK), HeLa, Vero и другие; (2) клетки земноводных, например, ооциты Xenopus; и (3) клетки насекомых, например, sf9, sf21, Tn, и другие. Известные клетки растений включают клетки, полученные из Nicotiana tabacum, которые можно культивировать в качестве каллюса. Известные клетки грибков включают дрожжи, такие как Saccharomyces (например, S. cerevisiae), плесневые грибки, такие как Aspergillus (например, A. niger), и другие.
Антитела можно получать при помощи трансформации для введения представляющего интерес гена антитела в эти клетки, и затем путем культивирования трансформированных клеток in vitro. Культуры наращивают известными способами. Например, в качестве среды для культивирования можно использовать DMEM, MEM, RPMI1640, IMDM, и можно использовать в комбинации сывороточные добавки, такие как FCS. Кроме того, клетки с введенным геном антитела можно передавать в брюшную полость или подобные животного для продуцирования антитела in vivo.
С другой стороны, системы продуцирования in vivo включают системы продуцирования с использованием животных или растений. Системы продуцирования с использованием животных включают системы продуцирования, которые используют млекопитающих или насекомых.
Млекопитающие, которых можно использовать, включают козлов, свиней, овец, мышей, быков и других (Vicki Glaser, SPECTRUM Biotechnology Applications, 1993). Кроме того, насекомые, которых можно использовать, включают тутовых шелкопрядов. При использовании растений можно применять, например, табак.
Ген антитела вводят в животные или растения, и антитело продуцируют в организме животных или растений и затем выделяют. Например, ген антитела можно получить в виде слитого гена путем встраивания в середину гена, кодирующего белок, такой как β-казеин козла, который продуцируется исключительно в молоко. Фрагменты ДНК, содержащие слитый ген, который включает ген антитела, впрыскивают в эмбрионы козла, и эмбрионы вводят в коз. Требуемое антитело получают из молока, вырабатываемого трансгенным животным, рожденным козами, которые получили эмбрионы, или полученного от потомства этих животных. Трансгенным козам можно давать гормоны для увеличения объема молока, содержащего требуемое антитело, которое они продуцируют (Ebert, K. M. et al., Bio/Technology (1994) 12, 699-702).
При использовании тутовых шелкопрядов, тутовых шелкопрядов инфицируют бакуловирусом с встроенным геном антитела, и требуемое антитело получают из жидкости организмов этих тутовых шелкопрядов (Maeda, S. et al., Nature (1985) 315, 592-594). Более того, при использовании табака требуемый ген антитела встраивают в экспрессирующий вектор растений (например, pMON530) и вектор вводят в бактериальные клетки, такие как Agrobacterium tumefaciens. Эти бактериальные клетки используют для инфицирования табака (например, Nicotiana tabacum), так что требуемое антитело можно получать из листьев этого табака (Julian, K. -C. Ma et al., Eur. J. Immunol. (1994) 24, 131-138).
При продуцировании антитела с использованием систем продуцирования in vitro или in vivo, как описано выше, ДНК, кодирующие тяжелую цепь (H-цепь) и легкую цепь (L-цепь) антитела, можно встроить в отдельные экспрессирующие векторы и совместно трансформировать в хозяина. Альтернативно, ДНК, кодирующие цепи H и L, можно встроить в общий экспрессирующий вектор для трансформации хозяина (смотри, Международная Патентная публикация No. WO 94/11523).
Антитела, используемые в настоящем изобретении, могут быть фрагментами антитела или их модифицированными продуктами, поскольку их можно соответственно использовать в настоящем изобретении. Например, фрагменты антитела включают Fab, F(ab')2, Fv, и одноцепочечные Fv (scFv), в которых Fv цепей H и L связаны посредством соответствующего линкера.
В частности, фрагменты антитела получают путем обработки антител ферментами, например, папаином или пепсином; или, альтернативно, кодирующие эти фрагменты гены конструируют, вводят в экспрессирующие векторы и затем экспрессируют в соответствующих клетках-хозяевах (см., например, Co, M. S. et al., J. Immunol. (1994) 152, 2968-2976; Better, M. & Horwitz, A. H., Methods in Enzymology (1989) 178, 476-496; Plueckthun, A. & Skerra, A., Способы in Enzymology (1989) 178, 497-515; Lamoyi, E., Methods in Enzymology (1989) 121, 652-663; Rousseaux, J. et al., Methods in Enzymology (1989) 121, 663-666; Bird, R. E. et al., TIBTECH (1991) 9, 132-137).
scFv можно получать путем соединения V-области H-цепи и V-области L-цепи антитела. В scFv, V-область H-цепи и V-область L-цепи связаны посредством линкера, предпочтительно, посредством пептидного линкера (Huston, J. S. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 5879-5883). V-области цепей H и L в scFv можно получить из любого из вышеописанных антител. Пептидные линкеры для связывания V-областей включают, например, произвольные одноцепочечные пептиды, включающие от 12 до 19 аминокислотных остатков.
scFv-кодирующую ДНК можно получить путем использования ДНК, кодирующей вышеописанные H-цепь или V-область H-цепи антитела, и ДНК, кодирующей вышеописанные L-цепь или V-область L-цепи антитела в качестве матриц для ПЦР-амплификации участка ДНК, который кодирует требуемую аминокислотную последовательность в матричной последовательности с праймеров, которые определяют концы участка, и затем дальнейшего амплифицирования части амплифицированной ДНК с ДНК, которая кодирует часть пептидного линкера и пары праймеров, которые соединяют оба конца линкера с цепями H и L, соответственно.
После получения scFv-кодирующей ДНК общепринятыми способами можно получить экспрессирующий вектор, содержащий ДНК и хозяина, трансформированного вектором. Кроме того, scFv можно получить в соответствии с общепринятыми способами с использованием хозяина.
Эти фрагменты антитела можно продуцировать из организмов-хозяев путем получения и экспрессирования их генов, как описано выше. В данном случае, термин «антитело» охватывает такие фрагменты антитела.
Антитела, связанные с различными молекулами, такими как полиэтиленгликоль (ПЭГ), можно также использовать в качестве модифицированных антител. В настоящем описании, термин «антитело» охватывает такие модифицированные антитела. Эти модифицированные антитела можно получить путем химического модифицирования полученных антител. Такие способы уже закрепились в рассматриваемой области.
Антитела, продуцированные и экспрессированные, как описано выше, можно выделять из содержимого или извне клеток или из организмов-хозяев, и затем очищать до гомогенности. Антитела, используемые по настоящему изобретению, можно выделять и/или очищать с использованием аффинной хроматографии. Колонки, использованные для аффинной хроматографии, включают, например, колонки с белком A и колонки с белком G. Носители, использованные для колонок с белком A, включают, например, HyperD, POROS, Sepharose FF и другие. В добавление к вышеописанным можно использовать другие общепринятые способы выделения и/или очистки белков, без какого-либо ограничения.
Например, антитела, используемые в настоящем изобретении, можно выделять и/или очищать путем соответствующего выбора и комбинирования хроматографий в дополнение к аффинной хроматографии, фильтрованиям, ультрафильтрации, высаливанию, диализу и другим. Хроматографии включают, например, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию и другие. Эти хроматографии можно применять для высокоэффективной жидкостной хроматографии (HPLC). Альтернативно, можно использовать обращеннофазную HPLC.
Концентрацию антител, полученных как описано выше, можно определить путем измерения оптической плотности, ELISA или другими. В частности, оптическую плотность определяют путем соответствующего разведения раствора антитела PBS(-), измерения оптической плотности при 280 нм и вычисления концентрации (1,35 OD = 1 мг/мл). Альтернативно, при использовании ELISA, измерение можно проводить следующим образом: В частности, антитела козла против IgG человека (TAG), разведенные до 1 мг/мл в 0,1 M бикарбонатном буфере (pH 9,6), добавляют по 100 мкл на лунку в 96-луночный планшет (Nunc) и инкубируют в течение ночи при 4°C для иммобилизации антитела. После умерщвления крыс, соответствующим образом разведенное антитело, по настоящему изобретению, или соответствующим образом разведенный образец, содержащий антитело, или IgG человека (CAPPEL) в качестве стандарта добавляют объемом по 100 мкл и инкубируют в течение часа при комнатной температуре.
После промывки разведенные в 5000 раз меченые щелочной фосфатазой IgG к человеку (BIO SOURCE) добавляют в объеме по 100 мкл и инкубируют в течение часа при комнатной температуре. После другой промывки добавляют раствор субстрата и инкубируют, и измеряют оптическую плотность при 405 нм с использованием Microplate Reader Model 3550 (Bio-Rad) для вычисления концентрации представляющего интерес антитела.
Частичные пептиды рецептора IL-6 представляют собой пептиды, которые содержат часть или всю целиком аминокислотную последовательность аминокислотной последовательности области рецептора IL-6, которая вовлечена в связывание между IL-6 и рецептором IL-6. Такие пептиды обычно включают от 10 до 80, предпочтительно, от 20 до 50, более предпочтительно, от 20 до 40 аминокислотных остатков.
Частичные пептиды рецептора IL-6 можно продуцировать в соответствии с общеизвестными способами, например, методами генетической инженерии или способами пептидного синтеза, путем точного определения области аминокислотной последовательности рецептора IL-6, которая вовлечена в связывание между IL-6 и рецептором IL-6, и использования части или всей целиком аминокислотной последовательности установленной области.
При получении частичного пептида рецептора IL-6 с использованием методов генетической инженерии последовательность ДНК, кодирующая требуемый пептид, встраивают в экспрессирующий вектор, и затем пептид можно получить вышеупомянутыми способами экспрессии, продукции и очистки рекомбинантных антител.
При продуцировании частичного пептида рецептора IL-6 способами пептидного синтеза можно использовать общеизвестные способы пептидного синтеза, например, способы твердофазного синтеза или способы жидкофазного синтеза.
В частности, пептиды можно синтезировать в соответствии со способом, описанным в «Continuation of Development of Pharmaceuticals, Vol. 14, Peptide Synthesis (in Japanese) (ed. Haruaki Yajima, 1991, Hirokawa Shoten)». В качестве способа твердофазного синтеза, например, можно использовать следующий способ: аминокислоту, соответствующую C-концу пептида, который следует синтезировать, связывают с подложкой, которая нерастворима в органических растворителях, затем пептидную нить удлиняют путем попеременного повторения (1) реакции конденсирования аминокислот, чьи α-аминогруппы и функциональные группы боковых цепей защищены соответствующими защитными группами, поочередно в направлении от C к N-концу; и (2) реакции удаления защитных групп из α-аминогрупп связанных со смолой аминокислот или пептидов. Твердофазный пептидный синтез грубо разделяют на Boc-способ и Fmoc-способ, в зависимости от типа используемых защищаемых групп.
После синтезирования представляющего интерес пептида, как описано выше, проводят реакцию снятия защиты, затем пептидную нить отщепляют от ее подложки. Для реакции отщепления пептидной нити обычно используют фтористый водород или трифторметансульфоновую кислоту в Boc-способе, и трифторуксусную кислоту обычно используют в Fmoc-способе. В Boc-способе, например, вышеописанная защищающую пептид смолу обрабатывают фтористым водородом в присутствии анизола. Затем пептид восстанавливают путем удаления защитных групп и отщепления пептида от его подложки. Путем замораживания-оттаивания восстановленного пептида можно получить неочищенный пептид. В Fmoc-способе, с другой стороны, можно проводить реакцию снятия защиты и реакцию отщепления пептидной нити от подложки в трифторуксусной кислоте с использованием способа, сходного, например, с вышеописанным способом.
Полученные неочищенные пептиды можно разделять и/или очищать с применением ВЭЖХ. Элюцию можно проводить при оптимальных условиях с использованием системы водно-ацетонитрилового растворителя, который обычно используют для очистки белка. Фракции, соответствующие пикам полученного хроматографического профиля, собирают и лиофилизируют. Таким образом очищенные пептидные фракции идентифицируют путем анализа молекулярных масс посредством масс-спектрометрии, анализа аминокислотной композиции, анализа аминокислотной последовательности или других.
Терапевтические средства, используемые против РТПХ, по настоящему изобретению, можно использовать для лечения и/или профилактики РТПХ. Терапевтические средства, используемые против РТПХ, по настоящему изобретению, также включают профилактические средства, используемые против РТПХ, которые подавляют развитие РТПХ. Таким образом, под выражением «терепевтическое (средство), используемое против РТПХ», как используют в настоящей заявке, понимают значение подавления РТПХ, уменьшения % появления РТПХ, лечения РТПХ, облегчения симптомов РТПХ и т.д.
Любой тип РТПХ можно лечить при помощи терапевтических средств по настоящему изобретению. РТПХ, которую можно лечить при помощи терапевтических средств по настоящему изобретению, включает острую РТПХ и хроническую РТПХ. Терапевтические средства, используемые против РТПХ по настоящему изобретению являются особенно эффективными против РТПХ после трансплантации гематопоэтических стволовых клеток, такой как РТПХ после трансплантации стволовых клеток периферической крови (например, трансплантация стволовых клеток аллогенной периферической крови) или РТПХ после трансплантации костного мозга (например, трансплантация аллогенного костного мозга).
Ингибиторы рецептора IL-6, использованные в настоящем изобретении, можно оценивать по их действию в качестве терапевтических средств, используемых против РТПХ, например, но без ограничения, путем использования их ингибиторной активности против трансдукции сигнала, в качестве индикатора. Ингибиторная активность ингибиторов рецептора IL-6 в отношении трансдукции сигнала можно оценивать при помощи общепринятых способов. В частности, IL-6 добавляют к культурам IL-6-зависимых линий клеток миеломы человека (S6B45 и KPMM2), линии клеток KT3 Lennert T-лимфомы человека, или IL-6-зависимой линии клеток MH60.BSF2; и накопление 3H-тимидина IL-6-зависимыми клетками измеряют в присутствии ингибитора рецептора IL-6. Альтернативно, рецептор IL-6-экспрессирующие клетки U266 культивируют, и в то же время к культуре добавляют 125I-меченый IL-6 и ингибитор рецептора IL-6; и затем определяют количество 125I-меченого IL-6, связанного с IL-6-рецептор-экспрессирующими клетками. В дополнение к группе ингибиторов рецептора IL-6 группа отрицательного контроля, которая не содержит ингибитор рецептора IL-6, включают в описанную выше систему тестирования. Активность ингибитора рецептора IL-6, ингибирующую рецептор IL-6, можно оценивать путем сравнения результатов обеих групп.
Субъектами введения терапевтических средств, используемых против РТПХ, по настоящему изобретению, являются млекопитающие. Млекопитающие предпочтительно представляют собой людей.
Терапевтические средства, используемые против РТПХ, по настоящему изобретению, можно вводить в виде фармацевтических препаратов, и можно вводить системно или местно путем перорального или парентерального введения. Например, можно использовать внутривенные инъекции, такие как инъекции при помощи капельницы, внутримышечные инъекции, внутрибрюшинные инъекции, подкожные инъекции, суппозитории, клизмы, пероральные энтеральные таблетки или т.д. Можно выбрать соответствующие способы введения, в зависимости от возраста пациента и симптомов. Эффективная доза на введение не ограничена каким-либо образом, однако ее выбирают из диапазона от 0,01 до 100 мг/кг массы тела. Альтернативно, дозу можно выбирать из диапазона от 1 до 1000 мг/пациента, предпочтительно из диапазона от 5 до 50 мг/пациента. Посредством конкретного примера, предпочтительная доза и способ введения представляют собой, как следует: Например, при использовании антитела против рецептора IL-6 доза от 0,5 до 40 мг/кг массы тела/в месяц (четыре недели), предпочтительно от 1 до 20 мг/кг массы тела/в месяц вводят посредством внутривенной инъекции, такой как инъекции при помощи капельницы, подкожной инъекции, внутримышечной инъекции или другой, от одного до нескольких раз в месяц, например, дважды в неделю, один раз в неделю, один раз в две недели или один раз в четыре недели. Режим введения можно подобрать, например, расширяя интервал введения дважды в неделю или один раз в неделю до одного раза каждые две недели, одного раза каждые три недели, или одного раза каждые четыре недели, в то же время контролируя состояние пациента и изменения в значениях показателей крови.
Как описано ниже в разделе “Примеры”, терапевтические средства, используемые против РТПХ по настоящему изобретению способны значительно подавлять развитие РТПХ при введении реципиентам до и после трансплантации гематопоэтических стволовых клеток. Таким образом, терапевтические средства, используемые против РТПХ по настоящему изобретению предпочтительно вводят перед трансплантацией гематопоэтических стволовых клеток и, кроме того, вводят после трансплантации, в зависимости от условий РТПХ.
Терапевтические средства, используемые против РТПХ по настоящему изобретению можно вводить в сочетании с по меньшей мере одним известным терапевтическим средством или способом, используемым против РТПХ. Например, терапевтические средства по настоящему изобретению можно вводить одновременно или последовательно с иммунодепрессивным средством(ами) (например, циклоспорин, такролимус, метотрексат), используемым для предупреждения РТПХ. Более того, терапевтические средства по настоящему изобретению можно комбинировать с удалением зрелых T клеток из группы трансплантируемых клеток (трансплантаты).
Терапевтические средства, используемые против РТПХ по настоящему изобретению могут содержать фармацевтически приемлемые носители, такие как консерванты и стабилизаторы. К «фармацевтически приемлемым носителям» относятся вещества, которые можно совместно вводить с вышеописанными средствами. Такие фармацевтически приемлемые материалы включают, например, стерилизованную воду, физиологический солевой раствор, стабилизаторы, наполнители, буферы, консерванты, детергенты, хелатобразующие агенты (например, EDTA) и связующие вещества.
В настоящем изобретении детергенты включают неионные детергенты, и характерные примеры таковых включают сорбитановые эфиры жирных кислот, такие как сорбитанмонокаприлат, сорбитанмонолаурат и сорбитанмонопальмитат; глицериновые эфиры жирных кислот, такие как глицеринмонокаприлат, глицеринмономиристат и глицеринмоностеарат; полиглицериновые эфиры жирных кислот, такие как декаглицерилмоностеарат, декаглицерилдистеарат и декаглицерилмонолинолеат; полиоксиэтиленсорбитановые эфиры жирных кислот, такие как полиоксиэтиленсорбитанмонолаурат, полиоксиэтиленсорбитанмоноолеат, полиоксиэтиленсорбитанмоностеарат, полиоксиэтиленсорбитанмонопальмитат, полиоксиэтиленсорбитантриолеат и полиоксиэтиленсорбитантристеарат; полиоксиэтиленсорбитовые эфиры жирных кислот, такие как полиоксиэтиленсорбиттетрастеарат и полиоксиэтиленсорбиттетраолеат; полиоксиэтиленглицериновые эфиры жирных кислот, такие как полиоксиэтиленглицерилмоностеарат; полиэтиленгликолевые эфиры жирных кислот, такие как полиэтиленгликоль дистеарат; полиоксиэтиленалкиловые эфиры, такие как полиоксиэтиленлауриловый эфиры; полиоксиэтиленполиоксипропиленалкиловые эфиры, такие как полиоксиэтиленполиоксипропиленгликоль, полиоксиэтиленполиоксипропиленпропиловый эфир и полиоксиэтиленполиоксипропиленцетиловый эфир; полиоксиэтиленалкилфениловые эфиры, такие как полиоксиэтиленнонилфениловый эфир; полиоксиэтиленовые твердые касторовые масла, такие как полиоксиэтиленовое касторовое масло и полиоксиэтиленовое твердое касторовое масло (полиоксиэтиленовое гидрогенизированное касторовое масло); полиоксиэтиленовые производные пчелиного воска, такие как полиоксиэтиленсорбитовый пчелиный воск; производные полиоксиэтиленланолина, такие как полиоксиэтиленланолин; и полиоксиэтиленовые амиды жирных кислот и подобные с гидрофильно-липофильным балансом от 6 до 18, такие как полиоксиэтиленовый амид стеариновой кислоты.
Детергенты также включают анионные детергенты, и их характерные примеры включают, например, алкилсульфаты, обладающие алкильной группой от 10 до 18 атомов углерода, такие как цетилсульфат натрия, лаурилсульфат натрия и олеилсульфат натрия; сульфаты полиоксиэтиленалкиловых эфиров, у которых алкильная группа содержит от 10 до 18 атомов углерода и среднее молярное число добавленного этиленоксида составляет от 2 до 4, такие как полиоксиэтиленлаурилсульфат натрия; соли алкилсульфосукцинатных эфиров, обладающих алкильной группой от 8 до 18 атомов углерода, такие как натрийлаурилсульфосукцинатный эфир; натуральные детергенты, например, лецитин; глицерофосфолипиды; сфинго-фосфолипиды, такие как сфингомиелин; и сахарозные эфиры жирных кислот, у которых жирные кислоты имеют от 12 до 18 атомов углерода.
Один или несколько вышеописанных детергентов можно комбинировать и добавлять к веществам, по настоящему изобретению. Детергенты, которые предпочтительно используют в препаратах, по настоящему изобретению, включают полиоксиэтиленсорбитановый эфир жирной кислоты, такие как полисорбаты 20, 40, 60 и 80. Полисорбаты 20 и 80 являются особенно предпочтительными. Полиоксиэтиленполиоксипропиленгликоли, такие как полоксамер (например, Pluronic F-68®), также являются предпочтительными.
Количество добавляемого детергента варьирует в зависимости от типа используемого детергента. При использовании полисорбата 20 или 80 количество, как правило, находится в диапазоне от 0,001 до 100 мг/мл, предпочтительно в диапазоне от 0,003 до 50 мг/мл, более предпочтительно, в диапазоне от 0,005 до 2 мг/мл.
В настоящем изобретении буферы включают фосфатный или цитратный буфер, уксусную кислоту, яблочную кислоту, виннокаменную кислоту, янтарную кислоту, молочную кислоту, фосфат калия, глюконовую кислоту, каприновую кислоту, дезоксихолевую кислоту, салициловую кислоту, триэтаноламин, фумаровую кислоту и другие органические кислоты; а также карбонатный буфер, Трис-буфер, гистидиновый буфер и имидазольный буфер.
Жидкие препараты можно получать путем растворения веществ в водных буферах, известных в данной области жидких препаратов. Концентрация буфера, как правило, находится в диапазоне от 1 до 500 мМ, предпочтительно, в диапазоне от 5 до 100 мМ, более предпочтительно, в диапазоне от 10 до 20 мМ.
Терапевтические средства по настоящему изобретению могут также содержать другие низкомолекулярные полипептиды; белки, такие как сывороточный альбумин, желатин и иммуноглобулин; аминокислоты; сахара и углеводороды, такие как полисахариды и моносахариды, сахарные спирты и другие.
В настоящем описании, аминокислоты включают основные аминокислоты, например, аргинин, лизин, гистидин, и орнитин, и неорганические соли этих аминокислот (предпочтительно гидрохлоридные соли и фосфатные соли, а именно фосфатные аминокислоты). При использовании свободных аминокислот pH доводят до предпочтительного значения добавлением соответствующих физиологически приемлемых забуферивающих веществ, например, неорганических кислот, в частности, соляной кислоты, фосфорной кислоты, серной кислоты, уксусной кислоты и муравьиной кислоты, и их солей. В этом случае использование фосфата является особенно полезным, поскольку это дает довольно стабильные продукты лиофилизации. Фосфат является особенно предпочтительным, когда препараты фактически не содержат органических кислот, таких как яблочная кислота, виннокаменная кислота, лимонная кислота, янтарная кислота, и фумаровая кислота, или не содержат соответствующих анионов (например, иона яблочной кислоты, иона винной кислоты, иона лимонной кислоты, иона янтарной кислоты, иона фумаровой кислоты). Предпочтительными аминокислотами являются аргинин, лизин, гистидин и орнитин. Также возможно использование кислых аминокислот, таких как глутаминовая кислота и аспарагиновая кислота, и их солей (предпочтительно, соли натрия); нейтральных аминокислот, таких как изолейцин, лейцин, глицин, серин, треонин, валин, метионин, цистеин, и аланин; или ароматических аминокислот, таких как фенилаланин, тирозин, триптофан и его производное, N-ацетилтриптофан.
В настоящем описании, сахара и углеводороды, такие как полисахариды и моносахариды, включают, например, декстран, глюкозу, фруктозу, лактозу, ксилозу, маннозу, мальтозу, сахарозу, трегалозу и рафинозу.
В настоящем описании, сахарные спирты включают, например, маннитол, сорбитол и инозитол.
Если вещества, по настоящему изобретению, получают в качестве водных растворов для инъекции, вещества можно смешивать, например, с физиологическим солевым раствором, и/или изотоническим раствором, содержащим глюкозу или другими вспомогательными веществами (например, D-сорбитолом, D-маннозой, D-маннитом, хлоридом натрия). Водные растворы можно использовать в сочетании с соответствующими солюбилизаторами, такими как спирты (например, этанол), полиспирты (например, пропиленгликоль, ПЭГ), или неионные детергенты (например, полисорбат 80, HCO-50).
Кроме того, вещества могут включать, если необходимо, разбавители, солюбилизаторы, регуляторы pH, успокаивающие средства, сера-содержащие восстанавливающие средства, антиоксиданты и другие.
В настоящем описании, сера-содержащие восстанавливающие средства включают, например, соединения, содержащие сульфгидрильные группы, такие как N-ацетилцистеин, N-ацетилгомоцистеин, тиоктовую кислоту, тиодигликоль, тиоэтаноламин, тиоглицерин, тиосорбитол, тиогликолевую кислоту и их соли, тиосульфат натрия, глутатион, и тиоалкановые кислоты, имеющие от 1 до 7 атомов углерода.
Более того, антиоксиданты, по настоящему изобретению, включают, например, эриторбовую кислоту, дибутилгидрокситолуол, бутилгидроксианизол, α-токоферол, токоферолацетат, L-аскорбиновую кислоту и их соли, пальмитат L-аскорбиновой кислоты, стеарат L-аскорбиновой кислоты, сульфит натрия однозамещенный, сульфит натрия, триамилгаллат, пропилгаллат и хелатирующие агенты, такие как динатрийэтилендиаминтетрацетат (ЭДТК), пирофосфат натрия и метафосфат натрия.
Если требуется, вещества могут быть заключены в микрокапсулы (микрокапсулы из гидроксиметилцеллюлозы, желатина, поли[метилметакриловой кислоты] и т.д.) или изготовлены в виде коллоидных систем высвобождения лекарственных средств (например, липосом, альбуминовых микросфер, микроэмульсий, наночастиц, нанокапсул) (смотри «Remington's Pharmaceutical Science 16th edition», Oslo Ed., 1980, и подобные). Более того, также известны способы изготовления веществ в виде веществ с замедленным высвобождением, и они применимым к настоящему изобретению (Langer et al., J. Biomed. Mater. Res. 1981, 15: 167-277; Langer, Chem. Tech. 1982, 12: 98-105; Патент США No. 3773919; Европейская Патентная публикация No. (EP) 58,481; Sidman et al., Biopolymers 1983, 22: 547-556; и EP 133,988).
Использованные фармацевтически приемлемые носители соответствующим образом выбирают из вышеописанных носителей или комбинируют в зависимости от типа лекарственной формы, но без ограничичения ими.
Настоящее изобретение относится к способу лечения и/или предупреждения РТПХ у субъект, который включает стадию введения ингибитора рецептора IL-6 субъекту с развивающейся РТПХ или субъекту с повышенным риском развития РТПХ.
В настоящем описании, «субъект» относится к организму или части тела организма, в который (ую) вводят терапевтические средства, используемые против РТПХ, по настоящему изобретению. Такой организм включает животных (например, человека, виды домашних животных и диких животных), но без особенного ограничения.
В настоящем описании, «введение» включает пероральное и парентеральное введение. Пероральное введение включает, например, введение оральных средств. Такие оральные средства включают, например, гранулы, порошки, таблетки, капсулы, микстуры, эмульсии и суспензии.
Парентеральное введение включает, например, введение инъекций. Такие инъекции включают, например, подкожные инъекции, внутримышечные инъекции, внутривенные инъекции и внутрибрюшинные инъекции. При этом можно достичь воздействий способа, по настоящему изобретению, путем введения генов, содержащих олигонуклеотиды для введения в живые организмы с использованием методик генной терапии. Альтернативно, вещества по настоящему изобретению можно вводить местно в предназначенные участки лечения. Например, вещества можно вводить путем местной инъекции во время хирургического вмешательства, использования катетеров или направленного трансгеноза ДНК, кодирующих пептиды, по настоящему изобретению.
Все цитированные в настоящем описании документальные источники, соответствующие прототипам, приведены в качестве ссылки.
Кроме того, настоящее изобретение будет описано более подробно посредством следующего примера, который не подразумевает ограничение изобретения. Различные изменения и модификации могут быть сделаны специалистами в данной области, и эти изменения и модификации также находятся в объеме настоящего изобретения.
ПРИМЕР
Пример 1: Действие антитела к рецептору IL-6 на РТПХ
Способ проверки
Клетки селезенки (6×107 клеток/мышь), полученные из самок мышей-доноров C57BL/6J в возрасте 8 недель (Charles River Japan, Inc.), передавали самкам мышей-реципиентов B6D2F1/Crlj в возрасте 8 недель (Charles River Japan, Inc.) через хвостовую вену для индуцирования РТПХ.
Мышей-реципиентов разделяли на две группы, одной из которых вводили антитело MR16-1 против рецептора IL-6 мыши (Chugai Pharmaceutical Co., Ltd., Japan) в количестве 4 мг/мышь через хвостовую вену за 1 день до передачи клеток селезенки и затем по 0,5 мг/мышь посредством внутрибрюшинного способа четыре раза каждые 7 дней. Контрольной группе вводили забуференный фосфатом солевой раствор (PBS; SIGMA-ALDRICH Inc.) (10 животных в каждой группе). После передачи клеток селезенки у мышей измеряли массу их тел три раза в неделю для оценки развития РТПХ, основанной на массе их тел.
Результаты
Полученные результаты продемонстрированы на Фигуре 1. Контрольная группа показала двухфазное уменьшение массы тела. А именно, масса тела уменьшалась в дни с 9 по 14 после трансплантации клеток селезенки и затем восстанавливалась на 16 день, однако вновь уменьшалась в дни с 19 по 21 и затем фактически восстанавливалась на 33 день. В отличие от этого группа, получающая MR16-1, демонстрировала отсутствие уменьшения массы тела в дни с 9 по 14. То есть эти результаты позволяют предположить, что антитело против рецептора IL-6 подавляет развитие РТПХ.
| название | год | авторы | номер документа |
|---|---|---|---|
| АГЕНТЫ ДЛЯ ПОДАВЛЕНИЯ ПОВРЕЖДЕНИЯ ТРАНСПЛАНТИРОВАННЫХ ОСТРОВКОВ ПОСЛЕ ТРАНСПЛАНТАЦИИ ОСТРОВКОВ | 2006 |
|
RU2446826C2 |
| СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ КАРДИОПАТИИ | 2006 |
|
RU2450830C2 |
| ИНГИБИТОР ХРОНИЧЕСКОГО ОТТОРЖЕНИЯ | 2008 |
|
RU2450829C2 |
| ТЕРАПЕВТИЧЕСКИЙ АГЕНТ ДЛЯ МЕЗОТЕЛИОМЫ | 2004 |
|
RU2392967C2 |
| ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО ПРОТИВ ВАСКУЛИТА | 2004 |
|
RU2379054C2 |
| ТЕРАПЕВТИЧЕСКИЙ АГЕНТ ДЛЯ МЕЗОТЕЛИОМЫ | 2004 |
|
RU2554942C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ РЕВМАТОИДНОГО АРТРИТА | 2010 |
|
RU2524152C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА АНТИТЕЛА ПРОТИВ IL-18 ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩЕЙ ЧАСТИ (ВАРИАНТЫ) | 2009 |
|
RU2514657C2 |
| АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО VISTA И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2746994C2 |
| ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ОТ ЗУДА | 2008 |
|
RU2596397C2 |
Группа изобретений относится к медицине, а именно к терапевтическому средству, используемому против реакции трансплантат против хозяина (РТПХ), которое содержит в качестве активного ингредиента ингибитор рецептора интерлейкина-6 (IL-6), где ингибитор рецептора интерлейкина-6 (IL-6) представляет собой антитело против рецептора IL-6. Заявлен также способ, используемый против реакции трансплантат против хозяина, который включает введение антитела против рецептора IL-6. Изобретение обеспечивает подавление развития реакции трансплантат против хозяина. 2 н. и 2 з.п. ф-лы, 1 ил., 1 пр.
1. Терапевтическое средство, используемое против реакции трансплантат против хозяина (РТПХ), которое содержит в качестве активного ингредиента ингибитор рецептора интерлейкина 6 (IL-6), где ингибитор рецептора интерлейкина 6 (IL-6) представляет собой антитело против рецептора IL-6.
2. Терапевтическое средство, используемое против РТПХ, по п.1, где ингибитор рецептора IL-6 представляет собой ингибитор рецептора IL-6 человека.
3. Терапевтическое средство, используемое против РТПХ, по п.1, где антитело против рецептора IL-6 представляет собой химерное антитело, гуманизированное антитело или антитело человека.
4. Способ, используемый против реакции трансплантат против хозяина (РТПХ), который включает введение терапевтически эффективного количества ингибитора рецептора интерлейкина-6 (IL-6), где ингибитор рецептора интерлейкина 6 (IL-6) представляет собой антитело против рецептора IL-6.
| RU 2004114882 A, 20.04.2005 | |||
| RU 2005136881 A, 10.06.2007 | |||
| EP 991661 B1, 18.10.2006 | |||
| WO 9509873 A1, 13.04.1995. |
Авторы
Даты
2013-08-20—Публикация
2008-10-01—Подача