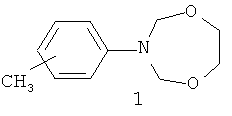
Предлагаемое изобретение относится к области органической химии, в частности, к способу получения 3-(м-,n-метилфенил)-тетрагидро-2H-1,5,3-диоксазепинов общей формулы (1):
Гетероциклические соединения известны как антибактериальные, антигрибковые и антивирусные агенты (Stillings M.R., Welbourn A.P., Walter D.J. Substituted 1,3,4-thiadiazoles with anticonvulsant activity // Med. Chem., 1986, 29, p.2280-2284; Kidwai M., Negi N., Chaudhary S.R. Cyclothiomethylation of arge hydrazines with formaldehyde // Acta Pharma., 1995, 45, p.511; Тюкавкина Н.А., Зурабян С.Э., Белобородов В.Л. и др. Органическая химия. M.: Дрофа, 2008, с.66-67), могут найти применение в тонком органическом синтезе.
Известен способ (С.Р. Хафизова, В.Р. Ахметова, Л.Ф. Коржова, Т.В. Хакимова, Р.В. Кунакова, Э.А. Круглов, У.М. Джемилев. Многокомпонентная конденсация алифатических аминов с формальдегидом и сероводородом. Изв. ан. Сер. хим., 2005, №2, с.423-427) получения N,O-содержащих гетероциклов, а именно, N-бутил-1,3,5-диоксазинана (2) с выходом 12% в смеси с N-бутил-1,3,5-дитиазинаном (3, 73%) и N-бутил-1,3,5-оксатиазинаном (4, 15%) взаимодействием бутиламина с формальдегидом (CH2O) и газообразным сероводородом по схеме:
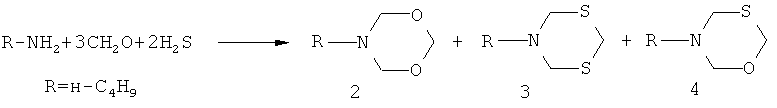
В известном способе 1,3,5-диоксазинан (2) образуется с выходом 12% в смеси с N-бутил-1,3,5-дитиазинаном (3) и N-бутил-1,3,5-оксатиазинаном (4). Реакция идет с участием в качестве одного из исходных реагентов газообразного и токсичного сероводорода. По известному способу 3-(м-, n-метилфенил)-тетрагидро-2H-1,5,3-диоксазепины общей формулы (1) не образуются.
Известен способ (H. Kapnang, G. Charles. Perhydro dioxazepines-1,5,3: methode generale de synthese. Tetrahedron Lett., 1980, 21, p.2949-2950) получения N,O-содержащих гетероциклов, а именно, 3-алкил(циклоалкил)-1,3,5-пергидродиоксазепинов (5) с выходом 50-80% взаимодействием первичных алкил(циклоалкил)аминов с 1,2-этандиолом и параформальдегидом в кипящем бензоле по схеме:
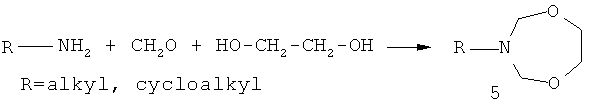
Известный способ не технологичен и пожароопасен, так как предполагает применение бензола (мутаген) в качестве растворителя при температуре его кипения. Кроме того, известным способом не могут быть получены 3-(м-, n-метилфенил)-тетрагидро-2H-1,5,3-диоксазепины общей формулы (1).
Таким образом, в литературе отсутствуют сведения по получению 3-(м-, n-метилфенил)-тетрагидро-2H-1,5,3-диоксазепинов общей формулы (1).
Предлагается новый способ получения 3-(м-,n-метилфенил)-тетрагидро-2H-1,5,3-диоксазепинов общей формулы (1).
Сущность способа заключается в предварительном перемешивании водного раствора (37%) формальдегида с 1,2-этандиолом при комнатной (~20°C) температуре в течение 30 мин с последующим добавлением катализатора Sm(NO3)3·6H2O, хлороформа (CHCl3) в качестве растворителя и соответствующего м-,n-метиланилина, взятых в мольном соотношении формальдегид: 1,2-этандиол: м-,n-метиланилин: Sm(NO3)3·6H2O = 20:10:10:(0.3-0.7). Смесь перемешивают 50-70 минут при температуре ~20°C и атмосферном давлении, выделяют соответствующий 3-(м-,n-метилфенил)-тетрагидро-2H-1,5,3-диоксазепин общей формулы (1) с выходом 67-83%. Реакция протекает по схеме:
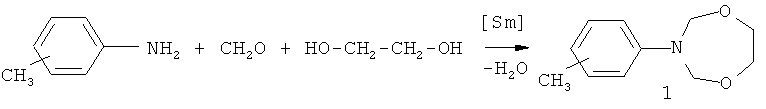
3-(м-,n-Метилфенил)-тетрагидро-2H-1,5,3-диоксазепины общей формулы (1) образуются только лишь с участием формальдегида, 1,2-этандиола и м-,n-метиланилина, взятых в мольном соотношении 20:10:10 (стехиометрические количества). При другом соотношении исходных реагентов снижается селективность реакции. В присутствии других альдегидов (например, алкил-, арилзамещенные альдегиды), других кислородсодержащих соединений (например, 1,3-пропандиол, 1,4-бутандиол) или других замещенных анилинов (например, ариланилины) целевые продукты (1) не образуются. Без катализатора реакция идет с выходом, не превышающим 10%.
Проведение указанной реакции в присутствии катализатора Sm(NO3)3·6H2O больше 7 мол.% не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Sm(NO3)3·6H2O менее 3 мол.% снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20°C. При температуре выше 20°C (например, 60°C) снижается селективность реакции и увеличиваются энергозатраты, а при температуре ниже 20°C (например, -10°C) снижается скорость реакции. Опыты проводили в хлороформе, т.к. в нем хорошо растворяются исходные реагенты и целевые продукты.
Существенные отличия предлагаемого способа:
В известном способе реакция идет с участием в качестве исходного реагентов алкил(циклоалкил)аминов в кипящем бензоле с образованием 3-алкил(циклоалкил)-1,3,5-пергидродиоксазепинов (5). Известный способ не позволяет получать 3-(м-,n-метилфенил)-тетрагидро-2H-1,5,3-диоксазепины общей формулы (1).
В предлагаемом способе в качестве исходных реагентов применяются м-,n-метиланилины, реакция идет в хлороформе в качестве растворителя при комнатной температуре под действием каталитических количеств Sm(NO3)3·6H2O. В отличие от известных предлагаемый способ позволяет получать индивидуальные 3-(м-,n-метилфенил)-тетрагидро-2H-1,5,3-диоксазепины общей формулы (1).
Способ поясняется следующими примерами:
ПРИМЕР 1. В сосуд Шленка, установленный на магнитной мешалке, в атмосфере аргона при температуре ~20°C помещают 20 ммоль водного раствора (37%) формальдегида и 10 ммоль 1,2-этандиола, перемешивают в течение 30 мин, затем добавляют 0.5 ммоль Sm(NO3)3·6H2O, 5 мл хлороформа, и 10 ммоль n-металанилина. Реакционную смесь перемешивают при температуре ~20°C в течение 60 минут, экстрагируют хлороформом, выделяют 3-(n-метилфенил)-тетрагидро-2H-1,5,3-диоксазепин с выходом 78%.
Другие примеры, подтверждающие способ, приведены в табл.1.
Все опыты проводили в хлороформе при комнатной температуре (~20°C).
Спектральные характеристики 3-(м-метилфенил)-тетрагидро-2H-1,5,3-диоксазепина:
Спектр ЯМР 1H (δ, м.д, CDCl3, J/Гц): 2.65 (с, 3H, CH3 (14)); 3.88 (с, 4H, CH2 (6,7); 4.89 (с, 4H, CH2 (2,4)); 6.70-7.28 (м, 4H, CH (9, 10, 11, 13)).
Спектр ЯМР 13С (δ, м.д., J/Гц): 21.33(С-14); 62.29(С-6,7) 82.90(С-2,4); 108.98(С-13); 113.66(С-9); 120.56(С-11); 129.97(С-10); 147.48(С-12); 148.93(С-8).
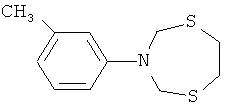
Спектральные характеристики 3-(n-метилфенил)-тетрагидро-2Н-1,5,3-диоксазепина:
Спектр ЯМР 1H (δ, м.д., CDCl3, J/Гц): 2.36 (с, 3H, CH3 (14)); 3.87 (с, 4H, CH2 (6,7); 4.44 (с, 4H, CH2 (2,4)); 6.75-7.23 (м, 4H, CH (9, 10, 11, 13)).
Спектр ЯМР 13С (δ, м.д., J/Гц): 21.34(С-14); 67.34(С-6,7) 83.22(С-2,4); 114.22(С-9,13); 120.18(С-10,12); 141.46(С-11); 147.55(С-8).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 3-(о-,м-,п-МЕТОКСИФЕНИЛ)-ТЕТРАГИДРО-2Н-1,5,3-ДИОКСАЗЕПИНОВ | 2011 |
|
RU2478096C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-(о-, м-, п-НИТРОФЕНИЛ)-ТЕТРАГИДРО-2Н-1,5,3-ДИОКСАЗЕПИНОВ | 2011 |
|
RU2490262C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АРИЛ-1,5,3-ДИОКСАЗЕПАНОВ | 2012 |
|
RU2529507C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-(м-, п-МЕТИЛФЕНИЛ)-1,5,3-ДИТИАЗЕПАНОВ | 2011 |
|
RU2478625C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АРИЛ-1,5,3-ДИТИАЗЕПАНОВ | 2011 |
|
RU2466997C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АРИЛ-1,5,3-ДИТИАЗОКАНОВ | 2013 |
|
RU2536408C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-АРИЛ-1,5,3-ДИТИАЗЕПАНОВ | 2011 |
|
RU2466996C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АРИЛ-1,5,3-ДИТИАЗАЦИКЛОУНДЕКАНОВ | 2014 |
|
RU2570207C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-АРИЛ-1,5,3-ДИТИАЗЕКАНОВ | 2014 |
|
RU2570206C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЦИКЛОГЕКСИЛЗАМЕЩЕННЫХ 1,5,3-ДИТИАЗЕПАНОВ | 2014 |
|
RU2574074C1 |
Изобретение относится к области органической химии, в частности к способу получения 3-(м-,n-метилфенил)-тетрагидро-2Н-1,5,3-диоксазепинов общей формулы (1):

который заключается в том, что к предварительно полученной при 20°C в течение 30 мин смеси формальдегида с 1,2-этандиолом добавляют катализатор Sm(NO3)3·6H2O, м- или n-метиланилин при мольном соотношении м- или n-метиланилин: формальдегид: 1,2-этандиол: Sm(NO3)3·6H2O=10:20:10:0.5 с последующим перемешиванием при комнатной (~20°C) температуре в течение 50-70 мин в хлороформе. Технический результат - разработан способ получения новых индивидуальных 3-(м-,n-метилфенил)-тетрагидро-2Н-1,5,3-диоксазепинов, которые могут найти применение в качестве антибактериальных, антигрибковых и антивирусных агентов, а также в тонком органическом синтезе. 1 табл., 1 пр.
Способ получения 3-(м-, п-метилфенил)-тетрагидро-2Н-1,5,3-диоксазепинов общей формулы (1):
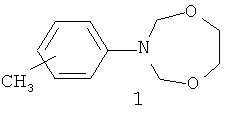
отличающийся тем, что к предварительно полученной при 20°C в течение 30 мин смеси формальдегида с 1,2-этандиолом добавляют катализатор Sm(NO3)3·6H2O, м-, или п-метиланилин при мольном соотношении м-, или п-метиланилин : формальдегид : 1,2-этандиол : Sm(NO3)3·6H2O=10:20:10:0.5, с последующим перемешиванием при комнатной (~20°C) температуре в течение 50-70 мин в хлороформе.
| ХАФИЗОВА С.Р | |||
| и др | |||
| Изв | |||
| АН | |||
| Сер | |||
| хим., т.54, №2, 2005, с.423-427 | |||
| KAPNANG H | |||
| ЕТ AL | |||
| Tetrahedron Letters, №21, 1980, p.2949-2950 | |||
| RU 2002123631 A, 20.03.2004. |
Авторы
Даты
2013-08-20—Публикация
2011-06-09—Подача