Настоящее изобретение относится к способу выделения и очистки целевого белка, который не содержит примеси патогенной белковой формы PrPSC.
В последнее время большое внимание уделяют инактивации и удалению PrPsc в способах очистки лекарственных препаратов, полученных из плазмы крови. Причиной, очевидно, является вспышка коровьего бешенства и т. д. Даже применение рекомбинантных клеточных линий для получения биофармацевтических лекарственных препаратов не считается полностью безопасным относительно присутствия в них прионовых белков (Vorberg et al., The Journal of infectious diseases 2004; 189:431-9. Susceptibility of common fibroblast cell lines to transmissible spongiform encephalopathy agents). В процессе установления способа очистки белков, предназначенных для применения в качестве биофармацевтических лекарственных препаратов, различные стадии очистки можно расценивать как возможные стадии удаления прионового белка (Foster PR, et al; Distribution of a bovine spongiform encephalopathy-derived agent over ion-exchange chromatography used in the preparation of concentrates of fibrinogen and factor VIII; Vox Sang. 2004 Feb;86(2): 92-9; Trejo SR, et al, Evaluation of virus and prion reduction in a new intravenous immunoglobulin manufacturing process. Vox Sang. 2003 Apr; 84(3): 176-87; Zeiler B, et al, Concentration and removal of prion proteins from biological solutions; Biotechnol Appl Biochem. 2003 Apr, 37(Pt 2): 173-82; Foster et al. Studies on the removal of abnormal prion protein by processes used in the manufacture of human blood plasma products, Vox Sang. 2000, 78: 86-95; Burnouf et al., Transfus Clin Biol. 2006 Nov; 13(5): 320-8. Epub 2007 Jan 23, Current strategies to prevent transmission of prions by human plasma derivatives).
Показано, что хроматографические смолы могут способствовать удалению PrPsc в способе очистки (ссылка 2-4, 6-7). Однако установлено, что тот факт, что в способах, применяющих хроматографические смолы различной химической структуры и с различными заместителями и в условиях различных буферных систем, обнаруживают сопоставимые показатели очистки от PrPsc, подтверждает наличие неспецифического связывания инфекционного агента на поверхности хроматографической подложки. Несмотря на то, что удаление PrPsc является воспроизводимым, недостаточное понимание механизма удаления вызывает вопросы, такие как, (a) как определить максимальную способность хроматографической подложки связывать агенты ТГЭ (трансмиссивная губчатая энцефалопатия), (b) как обеспечить эффективные процедуры очистки гелей для повторного применения и (c) как гарантировать сопоставимое удаление PrPsc в ходе производственных циклов (Thyer J, Prion-removal capacity of chromatographic and ethanol precipitation steps used in the production of albumin and immunoglobulins; Vox Sang. 2006 Nov; 91(4): 292-300).
WO-A-980041 раскрывает способ отделения приона от других белков, например, гемоглобина, посредством ионообменной хроматографии. Приготовление ионообменной хроматографической среды раскрывает силикагель, полученный из (g-глицидоксипропил)триметоксисилана и диметаноламина для обеспечения (однородной) поверхности с четвертичными аммониевыми группами.
WO-A-03105911 раскрывает способ очистки человеческой плазмы при помощи общепринятых средств ионообменной хроматографии с применением солевого градиента для элюирования.
WO-A-9408686 раскрывает способ осуществления последовательным образом различных элементов хроматографического разделения в колонке для жидкостной хроматографии с применением одной среды для разделения.
D. B. Brimacombe et al. в Biochem. J. (1999) 342, 605-613 раскрывает очистку белка recPrP посредством двух последовательных хроматографических стадий. Первая стадия представляет собой катионообменную хроматографию (150-650 градиент NaCl), осуществляемую на S-Сефарозе. Объединенные целевые элюаты подвергали второй хроматографической стадии (цинковая заряженная хелатирующая сефароза; 0-100 mM градиент имидазола).
P. R. Foster et al. Vox Sanguinis 2000; 78: 86-95 раскрывает способ удаления прионового белка при получении препаратов плазмы посредством множества стадий. Данный способ включает 4 ионообменные хроматографии (Стадии 2, 11, 13 и 15) и одну аффинную хроматографию (иммобилизованный гепарин на сефарозе-FF; Стадия 12), осуществляемые в разных колонках на различных хроматографических гелях.
T. Burnouf et al. обнародует в Tranfusion Clinique et Biologique 13 (2006) 320-328, степень удаления агента ТГЭ в ходе различных хроматографических стадий факторов свертывания крови, полученных из плазмы крови. В данной публикации большое внимание уделяют различным (главным образом) ионообменным хроматографическим стадиям, применяемым при получении FVIII (ДЭАЭ-Toyopearl 650M), vWF (ДЭАЭ-Toyopearl 650M), фибриногена (ДЭАЭ-Toyopearl 650M), протромбинового комплекса/FIX (ДЭАЭ-целлюлоза), PCC (ДЭАЭ-Сефароза), FIX (ДЭАЭ-Сефароза или Гепарин-Сефароза) и тромбина (S-Сефароза). Все данные системы исследовали отдельно.
J. Thyer et al. в Vox Sanguinis (2006) 91, 292-300, сообщает об удалении PrP при помощи хроматографических колонок с ДЭАЭ-Сефарозой, CM-Сефарозой и с Macro-Prep High Q ("Materials and Methods"; Fig. 1, page 294; Table 1). В еще одном эксперименте раскрывается последовательное применение одной колонки с ДЭАЭ-Сефарозой и одной колонки с CM-Сефарозой или колонки с Macro-Prep.
Сущность изобретения
Одной целью данного изобретения было обеспечение хроматографического способа, который удаляет PrPsc в ходе фракционирования исходных веществ, которые потенциально являются загрязненными PrPsc, таких как полученные биологически исходные вещества. В данном способе должны быть устранены недостатки известного уровня техники. Еще одной целью было разработать способ, который явился бы надежным способом очистки и обеспечил бы возможность регенерации хроматографических подложек.
Еще одной целью данного изобретения было получение обедненной прионом фракции белков.
В соответствии с данным изобретением обеспечивается способ выделения и очистки целевого белка посредством хроматографии, в котором хроматография удаляет или уменьшает содержание прионов (PrPsc), включающего стадии:
- взаимодействия потенциально PrPsc-загрязненного образца, содержащего целевой белок, с комбинированным хроматографическим материалом;
- создания буферных условий, таких, чтобы целевой белок связывался с комбинированным хроматографическим материалом, а PrPsc не связывался с комбинированным хроматографическим материалом;
- после чего следует элюирование целевого белка, и
- собирания целевого белка.
Способ данного изобретения обеспечивает значительное усовершенствование, так как хроматографическая смола связывает PrPsc менее сильно, что дает возможность удаления PrPsc с хроматографической смолы до того как элюируется целевой белок.
В соответствии с данным изобретением под "выделением и очисткой" подразумеваются, в частности, способы, которые применяются, для того чтобы, по крайней мере, повышать содержание любых целевых белковоподобных веществ или способы, которые уменьшают содержание нежелательных веществ. В соответствии с данным изобретением предпочтительным было бы получать целевой продукт насколько возможно чистым.
Понятие "целевой белок" означает белок, представляющий интерес, который нужно выделить и/или очистить от PrPsc. Данный целевой белок может также представлять собой смесь белков, по желанию, например, смесь различных факторов, обладающих биологическим эффектом при совместном применении.
"Прионы" представляют собой инфекционные белковоподобные вещества.
Подробное описание изобретения
Как ни удивительно, было обнаружено, что, применяя единственную хроматографическую смолу, можно было минимизировать связывание PrPsc с гелем в хроматографических условиях, а, следовательно, достичь превосходных значений уменьшения содержания вещества, которое связывается с ним. Данной смолой является смола коммерчески доступная и описанная, например, в WO-A-2004024318. Это раскрытие включено путем ссылки. Данная смола, которая, как было показано, обладает эффектом по отношению к PrPsc, называется комбинированной (или смешанного типа, или гидрофобной заряженной индукционной) смолой. В противоположность, например, стандартным хроматографическим средам, таким как ионообменные смолы и хроматографические смолы с гидрофобным взаимодействием, которые действуют лишь по одному принципу, комбинированные смолы действуют посредством комбинации ионных взаимодействий и гидрофобных взаимодействий. Примерами подобных смол являются коммерчески доступные Capto® MMC и Capto® Adhere из компании GE Healthcare, или смолы MEP, HEA или PPA Hypercel® из компании PALL. Для данных комбинированных смол могут быть приспособлены различные лиганды; примеры различных лигандов приведены ниже:
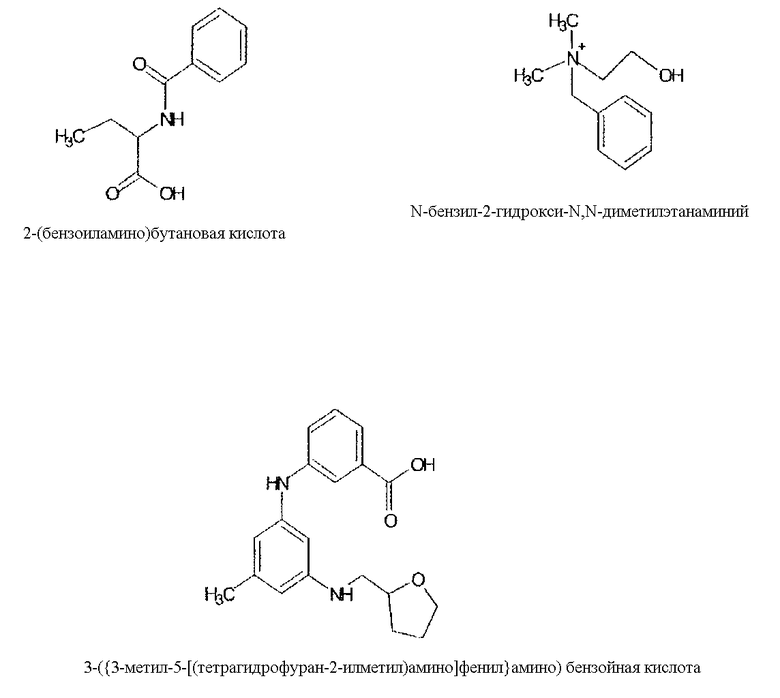
Тип комбинированного хроматографического материала выделяют ниже.
Настоящее изобретение обеспечивает твердый субстрат, который является эффективным сорбентом для применения при разделении и выделении многообразия биологических препаратов. Твердый субстрат данного изобретения можно применять, например, в препаративных методиках, таких как колоночная хроматография, и в аналитических приспособлениях, таких как биочипы. Одним преимуществом настоящего твердого субстрата, описанного в контексте данного документа, является его высокая селективность и специфичность к биологическим препаратам, таким как иммуноглобулины, наряду с устранением дорогих и часто определяющих способов очистки, необходимых для субстратов известного уровня техники. Вторым преимуществом является то, что твердый субстрат данного изобретения почти идеально подходит для применения к биологическим препаратам при физиологическом pH и ионной силе, что, таким образом, избавляет от необходимости в корректировке pH и добавления лиотропных солей, как предусмотрено на известном уровне техники. В качестве третьего преимущества можно рассматривать высокую емкость настоящих субстратов, которая, с точки зрения низкой стоимости реагентов, применяемых для их получения, предоставляет значительные экономические выгоды по сравнению с применением специализированных сорбентов известного уровня техники.
Лиганд смешанного типа
Твердые субстраты данного изобретения включают твердую подложку и лиганд, присоединенный к твердой подложке. Лиганд содержит циклическую группу, которой может быть моноциклическая группа или полициклическая группа, и связующую группу, которая необязательно содержит атом серы. Данный лиганд, который притягивает аналиты посредством действия смешанного типа, присоединен к твердой подложке.
Данный лиганд содержит циклическую группу, которая может быть моноциклической или полициклической группой, которая привязана к твердой подложке и которая замещена сульфатной, сульфонатной, фосфатной или фосфонатной группой. Данная моноциклическая или полициклическая группа может быть ароматической группой, которая, как определено в контексте данного документа, представляет собой циклический углеводород, содержащий только ненасыщенные углерод-углеродные связи, которые образуют ароматическую систему. Несмотря на то, что, в принципе, любую ароматическую группу можно применять в настоящем изобретении, подходящая ароматическая группа обычно содержит одно, два или три ароматических кольца. Таким образом, наглядными ароматическими группами являются фенил и его замещенные производные, такие как толил и ксилил. Бициклические ароматические группы содержат конденсированные отдельные кольца, и включают, но не ограничиваются, нафтил. Полициклические ароматические группы включают антраценил и фенантренил, и группы, такие как аценафтиленил, которые содержат конденсированные кольца различных размеров. При выборе ароматической группы предпочтительным, хотя не существенным, является, чтобы данная группа была конденсированной с гетероциклической или гетероароматической группой, как описано ниже.
"Гетероцикл" представляет собой насыщенное или частично насыщенное кольцо, содержащее, по крайней мере, один гетероатом. Аналогичным образом, "гетероароматическая группа" представляет собой ароматическую группу, в которой, по крайней мере, один атом углерода замещен на гетероатом. В настоящем изобретении гетероатом предпочтительно представляет собой N, S или O. Также предпочтительным является, если гетероциклическая или гетероароматическая группа представляет собой пяти- или шестичленное кольцо, так как реагенты, которые содержат данные группы легко и недорого получить из коммерческих источников.
Если связующая группа, определенная ниже, не содержит амбивалентный атом серы, то предпочтительным является, чтобы гетероциклическая или гетероароматическая группа представляла собой группу, которая создает или привносит "тиофильный" характер твердого субстрата, и, таким образом, группу, которая содержит, по крайней мере, один атом S. В случае применения других связующих групп, которые содержат бивалентные атомы серы, предпочтительные гетероциклические или гетероароматические группы могут содержать, по крайней мере, один атом N или комбинации атомов S и N.
Таким образом, примерные гетероциклические или гетероароматические группы включают тиазолин, тиазолидон, имидазол, имидазолин, тиазол, триазолы, тетразол, тиадиазол, пиридин и морфолин. В конкретном предпочтительном варианте осуществления подходящая гетероциклическая или гетероароматическая группа является конденсированной с ароматической группой, как описано выше. В данном контексте общедоступными претендентами являются бензимидазол и бензотиазол, которые дают превосходные твердые субстраты.
Как упомянуто выше, моноциклическая или полициклическая группа является замещенной сульфатной, сульфонатной, фосфатной или фосфонатной группой. Эти группы являются достаточно кислыми, чтобы существовать в виде заряженных частиц в широком диапазоне pH, например, от около 2 до около 12. В данном контексте твердая подложка идеально подходит для адсорбции биологических препаратов, таких как иммуноглобулины, при физиологической ионной силе и pH. Понятие "замещенный", применяемое в контексте данного документа, относится к прямому или косвенному прикреплению сульфатной, сульфонатной, фосфатной или фосфонатной группы к моноциклической или полициклической группе. Косвенное прикрепление может осуществляться через спейсерную группу, которая представляет собой C1-6 линейную или разветвленную алкиленовую группу. Данная алкиленовая группа необязательно прерывается одним или более бивалентными фрагментами, которые включают, но не ограничиваются, -C(O)NH-, NHC(O)-, -O-, -S-, -S(O)-, -S(O)2-, -NH-, -C(O)O- и -OC(O)-. Таким образом, наглядные спейсерные группы включают -CH2-, -CH2CH2-, -CH2-O-CH2- и -CH2C(O)NHCH2CH2-.
Моноциклическая или полициклическая группа привязана к твердой подложке посредством связующей группы, которая содержит меркапто-, эфирный или аминофрагмент. В соответствии с конструктивными соображениями, описанными ниже, предпочтительным является, чтобы связующая группа была гидрофобной, что, таким образом, сообщает твердой подложке гидрофобный характер при pH, при котором связывание биологического препарата осуществляется посредством как электростатических и гидрофобных взаимодействий. Гидрофобные фрагменты включают, но не ограничиваются, линейные или разветвленные C1-6 алкиленовые группы, C2-6 алкениленовые группы и C2-6 алкиниленовые группы. В частности, применяемыми фрагментами являются этилен и пропилен. Другие гидрофобные фрагменты включают ароматическую группу, как описано выше, с образованием, например, фенэтилена. Выше упомянутые фрагменты, таким образом, прерываются или пронизываются, по крайней мере, одним меркапто-, эфирным или аминофрагментом. В вариантах осуществления, в которых моноциклическая или полициклическая группа не содержит атом серы, связующая группа предпочтительно содержит меркаптофрагмент. В связи с этим связующая группа привносит гидрофобный и тиофильный характер твердому субстрату.
Гидрофобность связующей группы можно легко варьировать введением полярных заместителей, таких как гидроксил, галогенид или нитрогруппа; окислением меркаптофрагмента известными способами; включением в связующую группу эфирных или аминофрагментов; или их комбинациями.
Предпочтительно твердые субстраты, содержащие аминосодержащие связующие группы или субстраты, содержащие окисленные меркаптофрагменты, также содержат моноциклические или полициклические группы, которые содержат, по крайней мере, один атом S. В связи с этим данный твердый субстрат может сохранять некоторый тиофильный характер.
В еще одном предпочтительном варианте осуществления сама по себе связующая группа содержит полисахарид, такой как гидроксиэтилцеллюлоза, крахмал, амилоза или агароза. Предпочтительным полисахаридом в данном контексте является декстран. Таким образом, твердую подложку модифицируют полисахаридом, который можно получить вместе со связующей группой, как описано ниже.
Не ограничиваясь никакой конкретной теорией, изобретатели считают, что твердый субстрат данного изобретения функционирует посредством "комбинированных типов" взаимодействия между твердым субстратом и биологическим препаратом. Вышеупомянутые моноциклические и полициклические группы имеют показатель pK ниже 4, а следовательно, являются отрицательно заряженными в применяемых диапазонах pH, как описано выше. Биологический препарат, такой как иммуноглобулин, контактирует с твердым субстратом в диапазоне между около pH 4 и pH 6, в котором биологический препарат несет общий положительный или нейтральный заряд. В данном диапазоне pH биологический препарат связывается с твердым субстратом посредством одного или более типов взаимодействия с моно- или полициклическими группами. Данные взаимодействия включают кулоновские силы и слабые гидрофобные взаимодействия. При увеличении pH свыше около 8 биологический препарат приобретает общий отрицательный заряд, таким образом создавая электростатическое отталкивание между отрицательно заряженным твердым субстратом и отрицательно заряженным биологическим препаратом. Следовательно, биологический препарат отрывается от твердого субстрата при помощи электростатического отталкивания и затем его можно выделить. Считается, что данные отталкивающие ионные силы превосходят более слабые силы притяжения, описанные выше.
Твердый субстрат
Данное изобретение рассматривает твердую подложку, к которой присоединен лиганд смешанного типа. В частности, рассматриваются два различных варианта. В одном варианте твердая подложка имеет вид, обычно применяемый для хроматографической среды, то есть, гранула или частица. Такие гранулы или частицы получают с лигандом смешанного типа. Данные гранулы или частицы формируют хроматографическую среду, которую можно применять для набивки колонки. В другом варианте твердая подложка имеет форму чипа, то есть, твердой подложки, имеющей обычно плоскую поверхность, к которой можно присоединить лиганд смешанного типа ковалентно или иным способом. Чипы, которые приспособлены для того, чтобы занимать контактную поверхность датчика индикаторного прибора, также называют "датчики".
Гранулы и частицы
В соответствии с идеями данного изобретения твердый субстрат, прежде всего, включает твердую подложку, которая может содержать органическое вещество.
Показательными органическими веществами являются полисахариды, такие как целлюлоза, крахмал, агар, агароза и декстран. Рассматриваются гидрофильные синтетические полимеры, в том числе, замещенные или незамещенные полиакриламиды, полиметакриламиды, полиакрилаты, полиметакрилаты, поливиниловые гидрофильные полимеры, полистирол, полисульфон и coполимеры или стирол и дивинилбензол. В виде альтернативы в качестве материала твердой подложки можно применять неорганические вещества. Подобные неорганические вещества включают, но не ограничиваются, пористые минеральные вещества, такие как окись кремния; гидрогель, содержащий окись кремния, двуокись циркония, окись титана, окись алюминия; и другие керамические материалы. Также можно применять смеси этих веществ или композитные материалы, полученные посредством сополимеризации взаимопроникающей сети двух материалов, такие как материалы, раскрытые в US-A-5268097, US-A-5234991 и US-A-5075371.
Твердая подложка может быть в виде гранул или неоднородных частиц диаметром от около 0,1 мм до около 1000 мм. В виде альтернативы твердой подложке можно придать форму волокон, мембран или губчатых веществ, пронизанных отверстиями от микрона до многомиллиметровых размеров.
Моноциклические или полициклические группы, описанные выше, химически иммобилизованы на твердой подложке посредством образования ковалентных связей между твердой подложкой и связующей группой, и между связующей группой и моноциклическими или полициклическими группами. Обычно твердую подложку сначала обрабатывают бифункциональным реагентом, который служит для того, чтобы ввести на твердую подложку реакционно-способные группы, которые образуют часть или всю связующую группу. В случае некоторых твердых подложек, таких как целлюлоза, композиты, содержащие гидрогель или другие материалы, несущие гидроксильные группы, часто является предпочтительным депротонирование гидроксильных групп при помощи гидроксидного реагента, например, перед реакцией с бифункциональным реагентом. Бифункциональный реагент способен взаимодействовать как с твердой подложкой, так и с реагентами, которые содержат моноциклические или полициклические группы. Наглядные бифункциональные реагенты, которые содержат одинаковые или различные функциональные группы, включают, но не ограничиваются эпихлоргидрин, эпибромгидрин, дибром- и дихлорпропанол, дибромбутан, диглицидилэфир этиленгликоля, бутандиоловый диглицидилэфир, дивинилсульфон, аллилглицидилэфир и аллилбромид.
Сразу после функционализации твердую подложку тщательно промывают одним или более растворителями, чтобы удалить непрореагировавший бифункциональный реагент, побочные продукты реакции или и то и другое. Обычным растворителем, применяемым в этом случае, является вода.
Затем вводят моноциклические или полициклические группы при помощи реагентов, которые содержат подобные группы, замещенные меркапто-, гидроксильными или аминогруппами. Данные реагенты взаимодействуют с функциональными группами, присутствующими на функционализированной твердой подложке, как описано выше.
Специфическая конъюгация бифункционального реагента с моноциклическим или полициклическим реагентом осуществляется посредством хорошо известных механизмов. Например, твердые подложки, которые функционализированы эпоксидами, можно подвергать реакциям с меркапто-, гидрокси- или аминосодержащими реагентами для обеспечения субстрата с этиленсодержащими связующими группами. Другие твердые подложки, модифицированные аллилбромидом, например, несут алкеновые группы, которые могут вступать в реакцию непосредственно с меркаптосодержащими реагентами. В качестве альтернативы, можно дополнительно бромировать алкеновые группы с целью обеспечения подходящих реакционно-способных бромопроизводных.
Концентрация иммобилизованной моноциклической или полициклической группы может варьироваться от доли одного микромоля до нескольких сотен микромолей на миллилитр твердой подложки, в зависимости от концентрации бифункционального реагента, применяемого при создании твердой подложки.
Низкие концентрации иммобилизованной группы обычно приводят к низкой емкости твердого субстрата при разделении, тогда как высокие концентрации обычно приводят к повышенной емкости.
Как описано выше, существует несколько преимуществ смолы для удаления PrPsc, которая в основном не связывается с PrPsc, таким образом, что можно тщательно промывать смолу различными буферными композициями перед элюированием продукта, что дает возможность, по крайней мере, уменьшить количество PrPsc в биохимической композиции до очень низкого уровня или удалить PrPsc из композиции. Например, можно промывать смолу различными типами отмывочных буферов, в том числе буферами с высоким или с низким содержанием соли, чтобы препятствовать ионному или гидрофобному взаимодействию, при котором небольшое количество прионов может связываться со смолой или даже с самим продуктом, перед элюированием продукта. Детергенты, спирты и аминокислоты также представляют собой примеры веществ, которые можно добавлять к отмывочным буферам для достижения оптимальной чистоты перед элюированием продукта. Значительно труднее осуществлять подобную стадию отмывки в случае других типов "стандартных" хроматографических сред, таких как, например, различные типы ионообменных смол, когда PrPsc связывается со смолой. Даже если эта связывающая способность значительно выше по сравнению с продуктом, всегда существует опасность того, что PrPsc в некоторой степени будет элюироваться из смолы вместе с продуктом. Следовательно, налицо огромное преимущество применения смолы, в случае которой продукт "комбинированный" связывается с этой смолой, тогда как PrPsc обладает относительно низким сродством к данной смоле, что дает возможность применять соответствующие стадии отмывки перед элюированием продукта.
В соответствии с данным изобретением целевой белок элюируется после элюирования PrPsc, например, посредством
- изменения ионной силы элюирующего буфера посредством увеличения или уменьшения ионной силы,
- добавления спиртов к элюирующему буферу - в частности, в водном растворе - таких как моно- или дигидроксиалканолы, например, низшие алифатические спирты, такие как метанол, этанол, пропанол и/или
- изменения значения pH элюирующего буфера посредством увеличения или уменьшения pH.
Также можно применять комбинацию описанных методик элюирования. Например, в данном изобретении применяется повышенная ионная сила и повышенное содержание этиленгликоля.
Также можно применять другие условия элюирования, такие как повышенная концентрация аминокислот, повышенные концентрации конкретных солей в соответствии с "рядом Гофмейстера".
Элюирование целевого белка зависит от биохимического свойства целевого белка. Например, можно применять кофермент целевого белка или другие вещества с высокой степенью распознавания третичной структуры целевого белка, например, антитромбин в качестве целевого белка, который элюируется при повышенной концентрации гепарина.
Величина уменьшения содержания прионового белка в белковой фракции, содержащей целевой белок составляет от >1 до 4 lg(10), что рассчитано по его содержанию, которое изначально было в смоле. Аналитическое содержание приона в целевой белковой фракции ниже предела чувствительности анализа приона посредством Вестерн-блоттинга.
В варианте осуществления настоящего изобретения хроматографические условия включают, по крайней мере, две из ниже следующих стадий:
i) применение загрузочного и выравнивающего буфера, содержащего растворитель и/или неионный детергент;
ii) применение отмывочного буфера без растворителя и/или неионного детергента;
iii) применение отмывочного буфера, содержащего спирт и/или аминокислоту;
iv) применение отмывочного буфера, содержащего высокую концентрацию соли;
v) применение отмывочного буфера, содержащего низкую концентрацию соли;
vi) применение буфера, содержащего комбинацию спирта и высокой концентрации соли.
В дополнительном варианте осуществления настоящего изобретения хроматографические условия включают, по крайней мере, две из ниже следующих стадий:
i) применение загрузочного и выравнивающего буфера, содержащего растворитель и/или неионный детергент;
ii) применение первого отмывочного буфера, который представляет собой буфер без растворителя и неионного детергента;
iii) применение второго отмывочного буфера, содержащего спирт и аминокислоту;
iv) применение третьего отмывочного буфера, содержащего высокую концентрацию соли;
v) применение четвертого отмывочного буфера, содержащего низкую концентрацию соли;
vi) применение элюирующего буфера, содержащего комбинацию спирта и высокой концентрации соли.
Буферы, применяемые еще в одном варианте осуществления данного изобретения, приведены ниже:
i) загрузочный и выравнивающий буфер содержит три-н-бутилфосфат и/или Triton x-100 в концентрации, лежащей в диапазоне от около 0,1 до около 10% (по массе);
ii) второй отмывочный буфер содержит этиленгликоль и/или лизин/аргинин, в диапазоне от около 5 до около 30% (по массе) этиленгликоля и от 0,2 до около 1,5 M лизин/аргинин;
iii) третий отмывочный буфер содержит хлорид натрия в концентрации, лежащей в диапазоне от около 0,5 до около 4 M, в частности от около 0,5 до около 1,5 M;
iv) четвертый отмывочный буфер содержит хлорид натрия в концентрации, лежащей в диапазоне от около 0,01 до около 0,2, в частности, от 0,01 до около 0,1 M;
v) элюирующий буфер содержит этиленгликоль и/или хлорид натрия в диапазоне концентраций от около 25 до около 75% (по массе), в частности, от около 25 до около 50% этиленгликоля и от около 0,5 до около 4 M NaCl.
В дополнительном варианте осуществления настоящего изобретения хроматографические условия включают, по крайней мере, две из ниже следующих стадий:
i) загрузочный и выравнивающий буфер содержит три-н-бутилфосфат и/или Triton x-100 в концентрации, лежащей в диапазоне 0,3-5% (по массе);
ii) отмывка вторым отмывочным буфером, содержащим этиленгликоль и/или лизин/аргинин в диапазоне от 10-25% (по массе) ЭГ и 0,3-1,0 M смеси лизин/аргинин, в количестве >10 объемов колонки;
iii) отмывка третьим отмывочным буфером, содержащим хлорид натрия в концентрации, лежащей в диапазоне 0,8-1,5 M, в количестве >10 объемов колонки;
iv) отмывка четвертым отмывочным буфером, содержащим хлорид натрия в концентрации, лежащей в диапазоне 0,03-0,15 M, в количестве >10 объемов колонки;
v) элюирующий буфер содержит этиленгликоль и/или хлорид натрия в диапазоне концентраций 35-65% (по массе) для ЭГ и 0,8-3,0 NaCl.
Буферы, применяемые еще в одном варианте осуществления данного изобретения, приведены ниже:
i) загрузочный и выравнивающий буфер содержит три-н-бутилфосфат и/или Triton x-100 в концентрации, лежащей в диапазоне 0,8-1,2% (по массе);
ii) отмывка вторым отмывочным буфером, содержащим этиленгликоль и/или лизин/аргинин в диапазоне 18-22% (по массе) ЭГ и 0,4-0,6 M смеси лизин/аргинин, в количестве >20 объемов колонки;
iii) отмывка третьим отмывочным буфером, содержащим хлорид натрия в концентрации, лежащей в диапазоне 0,8-1,2 M, в количестве >20 объемов колонки;
iv) отмывка четвертым отмывочным буфером, содержащим хлорид натрия в концентрации, лежащей в диапазоне 0,08-0,12 M в количестве >20 объемов колонки;
v) элюирующий буфер содержит этиленгликоль и/или хлорид натрия в диапазоне концентраций 45-55% (по массе) для ЭГ и 1,3-1,7 для NaCl.
Преимущество применения отмывочных буферов различных типов состоит в том, что это увеличивает возможность удаления прионов различных типов, которые связываются со смолой или целевым белком посредством различных взаимодействий. Также соответственно путем увеличения количества отмывочного буфера (т. е. один объем колонки равен объему смолы) можно повысить безопасность "медленного действия" оставшихся прионов на применяемый буфер.
Комбинированный хроматографический материал может содержать
i) положительно заряженный N-бензил-N-метилэтаноламиновый лиганд;
ii) отрицательно заряженный лиганд 2-(бензоиламино)бутановой кислоты;
iii) фенилпропиловый лиганд;
iv) N-гексиловый лиганд;
v) 4-меркаптоэтилпиридиновый лиганд;
vi) лиганд 3-[{3-метил-5-((тетрагидрофуран-2-илметил)амино)-фенил}амино]бензойной кислоты.
Объектом настоящего изобретения также является белковая фракция, обедненная прионовым белком, выделенная из источников, содержащих потенциально инфекционные белки. Данная фракция содержит фармацевтически применимые белки, получаемые в соответствии со способом данного изобретения.
В частности, утверждается, что белковые фракции содержат белки плазмы, пептидные гормоны, факторы роста, цитокины и поликлональные иммуноглобулиновые белки, белки плазмы, выбранные из факторов свертываемости крови человека и животных, в том числе фибриногена, протромбина, тромбина, протромбинового комплекса, FX, FXa, FIX, FIXa, FVII, FVIIa, FXI, FXIa, FXII, FXIIa, FXIII и FXIIIa, фактора фон Виллебранда, транспортных белков, в том числе альбумина, трансферрина, церулоплазмина, гаптоглобина, гемоглобина и гемопексина, ингибиторов протеаз, в том числе β-антитромбина, α-антитромбина, α2-макроглобулина, Cl-ингибитора, ингибитора пути тканевого фактора (ИПТФ), гепарин-кофактора II, ингибитора белка C (PAI-3), белка C и белка S, белков ингибитора α-1 эстеразы, α-1 антитрипсина, антиангионетических белков, в том числе неактивного антитромбина, сильно гликозилированных белков, в том числе α-1-кислого гликопротеина, антихимотрипсина, ингибитора интер-α-трипсина, α-2-HS-гликопротеина и С-реактивного белка и других белков, в том числе обогащенного гистидином гликопротеина, маннан-связывающего лектина, C4-связывающего белка, фибронектина, GC-глобулина, плазминогена, факторов крови, таких как эритропоэтин, интерферон, опухолевые факторы, tPA, γCSF.
Данное изобретение дополнительно описывается ниже следующими неограничивающими примерами
ПРИМЕРЫ
ПРИМЕР 1
Колонка и смола
Колонку Tricorn (GE Healthcare, Sweden, площадь поперечного сечения: 0,2см2, диаметр 0,5 см) набивали смолой Capto MMC (GE Healthcare Cat. No. 17-5317-10, lot No. 308581), высота слоя 9 см, объем колонки: 1,8 мл.
Исходный материал
В качестве исходного материала применяют смесь рекомбинантных белков, полученных из клеток HEK 293 и собранных в процессе захвата на колонке (номер партии: BPP 047 SP элюат, 117 мкг белка/мл).
Буферные композиции*
Буфер 1 (Выравнивающий буфер с добавками растворителя/детергента)
0,3 M NaCl, 0,01 M CaCl2 (2×H2O), 0,01 M L-Гистидин, 1% масс. Triton X-100, 0,3% масс. ТНБП, pH: 7,0±0,1, проводимость: 29±3 мСм/см2 при +25°C.
Буфер 2 (Выравнивающий буфер без растворителя/детергента)
0,3 M NaCl, 0,01 M CaCl2 (2×H2O), 0,01 M L-Гистидин, 0,02% (по массе) Tween 80, pH: 6,5±0,1, проводимость: 31±3 мСм/см2 при +25°C.
Буфер 3 (Промывка 1: Лизин & Этиленгликоль (= ЭГ))
0,3 M NaCl, 0,01 M CaCl2 (2×H2O), 0,01 M L-Гистидин, 0,02% (по массе) Tween 80, 0,5 M монохлорид L-Лизина, 20% (по массе) Этиленгликоля (=ЭГ) pH: 6,5±0,1, проводимость: 37±3 мСм/см2 при +25°C.
Буфер 4 (Промывка 2: Промывка раствором с высоким содержанием соли)
1,0 M NaCl, 0,05 M CaCl2 (2×H2O), 0,05 M L-Гистидин, 0,02% (по массе) Tween 80, pH: 6,5±0,1, проводимость: 89±5 мСм/см2 при +25° C.
Буфер 5 (Промывка 3: Промывка раствором с низким содержанием соли)
0,1 M NaCl, 0,01 M CaCl2 (2×H2O), 0,01 M L-Гистидин, 0,02% (по массе) Tween 80 pH: 6,5±0,1, проводимость: 13±3 мСм/см2 при +25° C.
Буфер 6 (Элюирующий буфер)
1,5 M NaCl, 0,02 M CaCl2 (2×H2O), 0,02 M L-Гистидин, 0,02% (по массе) Tween 80, 50% (по массе) Этиленгликоля (ЭГ), pH: 6,5±0,1 (отрегулировать pH перед добавлением ЭГ), проводимость: 39±3 мСм/см2 при +25°C, измеренная после добавления ЭГ.
Буфер 7 (Буфер для регенерации)
1M Гидроксид Натрия
Для регулирования:
1 M HCl
*Данные буферы готовили из расчета на 1 кг добавляемой воды вместо 1 л конечного объема. Это оказывает небольшое влияние на конечные молярные концентрации, так как добавки будут немного увеличивать конечный объем.
MMC смолу набивали в колонку Tricorn с высотой слоя приблизительно 9 см. Хроматографическую стадию контролировали на проводимость и при 280 нм. Загрузка белка составляла приблизительно 3 мг на 1 мл смолы.
Сначала колонку приводили в состояние равновесия выравнивающим буфером, содержащим растворитель/детергент, до тех пор, пока не была получена устойчивая базовая линия. К исходному материалу добавляли растворитель/детергент в соотношении 14 г стока растворитель/детергент на кг, чтобы получить такую же концентрацию, как и в выравнивающем буфере, полученную смесь перемешивали в течение, по крайней мере, 10 минут перед нанесением белкового раствора на колонку. Фракции вытекающих буферов собирали и анализировали на общее количество белка (и прионов в пиковых экспериментах с PrPsc). Хроматографический профиль, измеренный при поглощении 280 нм:
Элюат (Буфер 1 + белки)
Буфер 1 (Буфер с высокой концентрацией неионного детергента; 0,3 M NaCl, 0,01 M CaCl2, 0,01 M L-Гистидин, 1% масс. Triton X-100, 0,3% масс. ТНБП, pH: 7,0).
Буфер 2 (Буфер с низкой концентрацией неионного детергента; 0,3 M NaCl, 0,01 M CaCl2, 0,01 M L-Гистидин, 0,02% (по массе) Tween 80 pH 6,5).
Буфер 3 (Аминокислотный/спиртовой буфер; 0,3 M NaCl, 0,01 M CaCl2, 0,01 M L-Гистидин, 0,02% (по массе) Tween 80, 0,5 M L-Лизина монохлорид, 20% (по массе) Этиленгликоль, pH 6,5).
Буфер 4 (Буфер с высокой концентрацией соли; 1,0 M NaCl, 0,05 M CaCl2, 0,05 M L-Гистидин, 0,02% (по массе) Tween 80, pH: 6,5).
Буфер 5 (Буфер с низкой концентрацией соли; 0,1 M NaCl, 0,01 M CaCl2, 0,01 M L-Гистидин, 0,02% (по массе) Tween 80 pH: 6,5).
Буфер 6 (Буфер с высокой концентрацией соли/высокой концентрацией спирта) 1,5 M NaCl, 0,02 M CaCl2, 0,02 M L-Гистидин, 0,02% (по массе) Tween 80, 50% (по массе) Этиленгликоль (ЭГ), pH: 6,5.
Буфер 7 (Буфер для регенерации; 2M NaCl).
Колонку регенерировали 20 объемами колонки 1 M NaOH и хранили в 20% (по объему) этаноле для дальнейшего применения.
Результаты
мг
%
Пример 2 (пиковый эксперимент с прионом)
Для того чтобы была возможность доказать факт удаления прионового белка в процессе хроматографической процедуры, описанной в примере 1, проводили пиковый эксперимент с прионом. Применяли такую же колонку, смолу, буферы и исходный материал, как и в Примере 1.
Исходный материал с инфекционным прионовым белком
В данном эксперименте применяли микросомальную/цитоплазматическую фракцию штамма возбудителя скрепи 263K от зараженного хомяка.
Приблизительно 54 г исходного белкового материала (такого же, как в примере 1; номер партии: BPP 047 SP элюат), содержащего 117 мкг/мл белка, размораживали на водяной бане при 25°C и нагревали до температуры 24,0°C (ориентировочно: 20-25°C). Затем взвешивали 51,12 г (ориентировочно: 50±2 г) исходного материала и добавляли 2,6 мл (ориентировочно: 2,5±0,2 мл) микросомальной/цитоплазматической фракции до конечной концентрации 5,1%. Определяли, что показатель pH исходного материала с добавкой составлял 6,994 (ориентировочно: 7,0±0,1). Затем отбирали аликвоту 6 мл, аликвотировали и хранили при ≤ -60°C (препарат исходного материала с добавкой - SSM).
1,955 г Triton X-100 смешивали с 0,582 г TnBP (ориентировочное соотношение: 10 частей + 3 части, расчет по массе) и перемешивали в течение 36 мин. Затем к оставшимся 47,72 г исходного материала с добавкой непосредственно прибавляли 0,665 г растворителя/детергента (ориентировочное соотношение: 14 г растворителя/детергента на кг исходного материала с добавкой) и перемешивали в течение 31 мин. Определяли, что температура исходного материала составляла 24,5°C в начале и 23,7°C по окончании фазы перемешивания (ориентировочный диапазон: 18-25°C).
Хроматографическая стадия
Колонку GE Healthcare Tricorn на 1,8 мл, набитую смолой Capto MMC (ОК=1,0 мл, высота слоя=9 см), приводили к равновесию при помощи Буфера 1 в количестве 8,3 ОК (объемов колонки) (Выравнивающий буфер с растворителем/детергентом) при скорости потока 1,0 мл/мин (ориентировочно: 5 ОК при 1,0 мл/мин). Затем 47,29 г исходного материала с добавкой, обработанного S/D, наносили на колонку при скорости потока 1,0 мл/мин (ориентировочно: 45±2 г при 1,0 мл/мин). После нанесения колонку промывали под давлением 10,0 ОК Буфера 2 (Выравнивающий буфер без растворителя/детергента) при скорости потока 0,8 мл/мин (ориентировочно: 10 ОК при 1,0 мл/мин). Сбор элюата начинали, когда УФ-сигнал начинал расти продолжали собирать до тех пор, пока поглощение не начинало падать. Определяли массу фракции элюата (фактическая масса: 48,23 г), отбирали аликвоту 16 мл, аликвотировали и хранили при ≤ -60°C (элюат препарата - FT). Промывочную фракцию 1 собирали в процессе промывки под давлением Буфером 2. Определили, что фактическая масса данной фракции составляла 12,75 г и отбирали аликвоту 12 мл и хранили при ≤ -60°C (промывка препарата 1 - W1).
Затем колонку промывали 22,2 ОК Буфера 3 (промывка смесью Лизин и Этиленгликоль) при скорости потока 0,6 мл/мин (ориентировочно: 20 ОК при 0,6 мл/мин). В процессе промывки Буфером 3 собирали промывочную фракцию 2, и определили, что фактическая масса данной фракции составляла 40,35 г. Отбирали аликвоту 16 мл и хранили при ≤ -60°C (промывка препарата 2 - W2).
В процессе промывки колонки 10,0 ОК Буфера 4 (Промывка высокой концентрацией соли) при скорости потока 0,9 мл/мин (ориентировочно: 10 ОК при 1,0 мл/мин) собирали промывочную фракцию 3. Определили, что фактическая масса составляла 18,48 г, отбирали аликвоту 16 мл, аликвотировали и хранили при ≤ -60°C (промывка препарата 3 - W3).
В процессе промывки колонки 5,0 ОК Буфера 5 (Промывка низкой концентрацией соли) при скорости потока 1,0 мл/мин (ориентировочно: 5 ОК при 1 мл/мин) собирали промывочную фракцию 4. Определили, что фактическая масса данной фракции составляла 12,22 г. Отбирали аликвоту 11,5 мл и хранили при ≤ -60°C (промывка препарата 4 - W4).
Затем элюировали продукт Буфером 6 в количестве 8,3 ОК (Элюирующий буфер) при скорости потока 0,2 мл/мин (ориентировочно: 7 ОК при 0,2 мл/мин). Сбор элюата осуществляли в течение всего периода промывки колонки под давлением Буфером 6. Определили, что фактическая масса фракции элюата составляла 13,54 г, отбирали аликвоту 12,5 мл и хранили при ≤ -60°C (элюат препарата - E).
В процессе регенерации колонки 9,4 ОК Буфера 7 (Буфер для регенерации) при скорости потока 0,6 мл/мин (ориентировочно: 20 ОК при 0,6 мл/мин) собирали регенерационную фракцию. Определили, что ее фактическая масса составляла 17,97 мл, отбирали аликвоту 16 мл и хранили при ≤ -60°C (регенерация препарата - Reg).
(мл)
Обсуждение
Как можно видеть из таблицы 3 и фиг. 1-5, можно отметить превосходные показатели удаления прионового белка для фракций Буферов 4-7. Таким образом, белковые продукты, которые элюируются в данных фракциях, должны иметь очень хорошие коэффициенты безопасности в отношении удаления PrPSC. Что также очень важно, так это то, что материальный баланс применяемого прионового белка показывает, что PrPSc вовсе не был обнаружен в каких-либо фракциях за исключением элюата и раннего отмывочного буфера. Насколько нам известно, это не было показано ранее на известном уровне техники. В опубликованных примерах хроматографических смол для стадии удаления прионового белка, даже если достигаются относительно приемлемые значения уменьшения содержания прионового белка, прионовые белки обычно можно обнаружить в нескольких фракциях, как перед, так и после получения фракции продукта, что говорит об опасности перекрестной контаминации.
Описание анализа
Определение общего содержания белка по Брэдфорду
Определение содержания белка по Брэдфорду основано на наблюдении, что максимум поглощения кислого раствора кумасси бриллиантового голубого G-250 сдвигается от 465 нм до 595 нм, когда происходит связывание белка. Как гидрофобные, так и ионные взаимодействия стабилизируют анионную форму красителя, что является причиной видимого изменения цвета. Данный анализ применяется, поскольку коэффициент экстинкции раствора комплекса краситель-альбумин является постоянным по всему 10-кратному концентрационному диапазону. Для получения дополнительной информации смотри также Bradford, MM. A rapid and sensitive for the quantitation of microgram quantitites of protein utilizing the principle of protein-dye binding. Analytical Biochemistry 72: 248-254. 1976.
Вестерн-блот анализ для определения содержания PrPSC
Вестерн-блот анализ представляет собой полуколичественное определение резистентного к протеиназе K сопутствующего скрепи прионового белка (PrPSC). Вестерн-блот анализ осуществляли, как описано DC Lee et al., Journal of Virological Methods 2000; 84: 77-89.http://www.wipo.int/portal/en/scam_warning.html.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЧИСТКИ БЕЛКА ФАКТОРА РОСТА | 2011 |
|
RU2571926C2 |
| СПОСОБ ОЧИСТКИ ВИТАМИН К-ЗАВИСИМЫХ БЕЛКОВ, ТАКИХ КАК КОАГУЛЯЦИОННЫЙ ФАКТОР VII | 2011 |
|
RU2731720C2 |
| Способ очистки фибриногена, продукт фибриногена и средство для очистки или производства продукта фибриногена | 2013 |
|
RU2663792C2 |
| СПОСОБ ОЧИСТКИ ВИТАМИН К-ЗАВИСИМЫХ БЕЛКОВ, ТАКИХ КАК КОАГУЛЯЦИОННЫЙ ФАКТОР IX | 2011 |
|
RU2590726C2 |
| СПОСОБ ОЧИСТКИ БЕЛКОВ | 2011 |
|
RU2610667C2 |
| РЕКОМБИНАНТНОЕ ПОЛУЧЕНИЕ СВЯЗЫВАЮЩИХ ГЕПАРИН БЕЛКОВ | 2006 |
|
RU2385877C1 |
| СПОСОБ ОЧИСТКИ БЕЛКА ФАКТОРА СВЕРТЫВАНИЯ VIII И СПОСОБ СТАБИЛИЗАЦИИ БЕЛКА ФАКТОРА VIII | 2008 |
|
RU2493163C2 |
| КОМПОЗИЦИИ БЕЗ ПРИОНА НА ОСНОВЕ НАНОЧАСТИЦ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2559570C2 |
| СПОСОБ ДЕТЕКЦИИ БЕЛКОВ В АМИЛОИДНОМ СОСТОЯНИИ И НАБОР ДЛЯ ДЕТЕКЦИИ БЕЛКОВ В АМИЛОИДНОМ СОСТОЯНИИ | 2012 |
|
RU2509155C1 |
| УЛУЧШЕННАЯ ОЧИСТКА БЕЛКА ПОСРЕДСТВОМ МОДИФИЦИРОВАННОГО ЭЛЮИРОВАНИЯ БЕЛКА А | 2010 |
|
RU2571929C2 |
Группа изобретений относится к области биохимии. Предложен способ выделения и очистки целевого белка посредством хроматографии, в котором хроматография удаляет или уменьшает содержание прионов (PrPsc). Осуществляют взаимодействие потенциально PrPsc-загрязненного образца, содержащего целевой белок, с комбинированным хроматографическим материалом, содержащим лиганд. Лиганд выбирают из положительно заряженного N-бензил-N-метилэтаноламинового лиганда; отрицательно заряженного лиганда 2-(бензоиламино)бутановой кислоты; фенилпропилового лиганда; N-гексилового лиганда; 4-меркаптоэтилпиридинового лиганда; лиганда 3-[{3-метил-5-((тетрагидрофуран-2-илметил)амино)-фенил}амино]бензойной кислоты. Затем создают буферные условия в хроматографических условиях, таких, чтобы целевой белок связывался с комбинированным хроматографическим материалом, а PrPsc не связывался с комбинированным хроматографическим материалом. Затем элюируют целевой белок. Также предложена фракция фармацевтически применимого целевого белка с пониженным содержанием прионового белка. Изобретение позволяет, применяя единственную хроматографическую смолу, получать фракцию целевого белка с уменьшенным содержанием PrPsc от >1 до 4 lg(10). 2 н. и 7 з.п. ф-лы, 3 табл., 2 пр.
1. Способ выделения и очистки целевого белка посредством хроматографии, в котором хроматография удаляет или уменьшает содержание прионов (PrPsc), включающий стадии
взаимодействия потенциально PrPsc-загрязненного образца, содержащего целевой белок, с комбинированным хроматографическим материалом, содержащим лиганд, выбранный из группы, состоящей из:
i) положительно заряженного N-бензил-N-метилэтаноламинового лиганда;
ii) отрицательно заряженного лиганда 2-(бензоиламино)бутановой кислоты;
iii) фенилпропилового лиганда;
iv) N-гексилового лиганда;
v) 4-меркаптоэтилпиридинового лиганда;
vi) лиганда 3-[{3-метил-5-((тетрагидрофуран-2-илметил)амино)-фенил}амино] бензойной кислоты
создания буферных условий в хроматографических условиях, таких, чтобы целевой белок связывался с комбинированным хроматографическим материалом, a PrPsc не связывался с комбинированным хроматографическим материалом;
последующего элюирования целевого белка.
2. Способ по п.1, в котором целевой белок элюируется после элюирования приона посредством
изменения ионной силы элюирующего буфера посредством увеличения или уменьшения ионной силы,
добавления спиртов к элюирующему буферу - в частности, в водном растворе - таких, как моно- или дигидроксиалканолы, например низшие алифатические спирты, такие, как метанол, этанол, пропанол, и/или
изменения значения pH элюирующего буфера посредством увеличения или уменьшения pH.
3. Способ по любому из предшествующих пунктов, в котором значение уменьшения содержания прионового белка в белковой фракции, содержащей целевой белок, составляет от >1 до 4 lg(10), что рассчитано по его содержанию, которое изначально было в смоле.
4. Способ по п.1, в котором аналитическая величина содержания прионового белка в представляющей интерес белковой фракции ниже предела чувствительности Вестерн-блот-анализа приона.
5. Способ по п.1, в котором хроматографические условия включают, по крайней мере, две из нижеследующих стадий:
i) применение загрузочного и выравнивающего буфера, содержащего растворитель и/или неионный детергент;
ii) применение отмывочного буфера без растворителя и/или неионного детергента;
iii) применение отмывочного буфера, содержащего спирт и/или аминокислоту;
iv) применение отмывочного буфера, содержащего высокую концентрацию соли;
v) применение отмывочного буфера, содержащего низкую концентрацию соли;
vi) применение буфера, содержащего комбинацию спирта и высокой концентрации соли.
6. Способ по п.1, в котором хроматографические условия включают, по крайней мере, две из ниже следующих стадий:
i) применение загрузочного и выравнивающего буфера, содержащего растворитель и/или неионный детергент;
ii) применение первого отмывочного буфера, который представляет собой буфер без растворителя и неионного детергента;
iii) применение второго отмывочного буфера, содержащего спирт и аминокислоту;
iv) применение третьего отмывочного буфера, содержащего высокую концентрацию соли;
v) применение четвертого отмывочного буфера, содержащего низкую концентрацию соли;
vi) применение элюирующего буфера, содержащего комбинацию спирта и высокой концентрации соли.
7. Способ по п.1, в котором:
i) загрузочный и выравнивающий буфер содержит три-н-бутилфосфат и/или Triton x-100 в концентрации, лежащей в диапазоне от около 0,1 до около 10% (по массе);
ii) второй отмывочный буфер содержит этиленгликоль и/или лизин/аргинин, в диапазоне от около 5 до около 30% (по массе) этиленгликоля и от 0,2 до около 1,5 М лизин/аргинин;
iii) третий отмывочный буфер содержит хлорид натрия в концентрации, лежащей в диапазоне от около 0,5 до около 4 М, в частности от около 0,5 до около 1,5 М;
iv) четвертый отмывочный буфер содержит хлорид натрия в концентрации, лежащей в диапазоне от около 0,01 до около 0,2, в частности от 0,01 до около 0,1 М;
v) элюирующий буфер содержит этиленгликоль и/или хлорид натрия в диапазоне концентраций от около 25 до около 75% (по массе), в частности от около 25 до около 50% этиленгликоля и от около 0,5 до около 4 M NaCl.
8. Фракция фармацевтически применимого целевого белка с пониженным содержанием прионового белка, выделенная из источника, содержащего потенциально инфекционные белки, где указанную фракцию получают в соответствии со способом по одному из предшествующих пунктов.
9. Фракция по п.8, содержащая белки плазмы, пептидные гормоны, факторы роста, цитокины и поликлональные иммуноглобулиновые белки, белки плазмы, выбранные из факторов свертываемости крови человека и животных, в том числе фибриногена, протромбина, тромбина, протромбинового комплекса, FX, FXa, FIX, FIXa, FVII, FVIIa, FXI, FXIa, FXII, FXIIa, FXIII и FXIIIa, фактора фон Виллебранда, транспортных белков, в том числе альбумина, трансферрина, церулоплазмина, гаптоглобина, гемоглобулина и гемопексина, ингибиторов протеаз, в том числе β-антитромбина, α-антитромбина, α2-макроглобулина, C1-ингибитора, ингибитора пути тканевого фактора (ИПТФ), гепарин-кофактора II, ингибитора белка C (PAI-3), белка C и белка S, белков ингибитора α-1 эстеразы, α-1 антитрипсина, антиангионетических белков, в том числе неактивного антитромбина, высоко гликозилированных белков, в том числе α-1-кислого гликопротеина, антихимотрипсина, ингибитора интер-α-трипсина, α-2-HS-гликопротеина и C-реактивного белка и других белков, в том числе обогащенного гистидином гликопротеина, маннан-связывающего лектина, C4-связывающего белка, фибронектина, GC-глобулина, плазминогена, факторов крови, таких как эритропоэтин, интерферон, опухолевые факторы, tPA, γCSF.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| WO 2004024318 A1, 25.03.2004 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Экономайзер | 0 |
|
SU94A1 |
| BRIMACOMBE D.B | |||
| ET AL | |||
| Characterization and polyanion-binding properties of purified recombinant prion protein | |||
| BIOCHEMICAL JOURNAL, PORTLAND PRESS, LONDON, GB, v.342, 1999, p.605-613 | |||
| FOSTER P.R | |||
| ET AL | |||
| Studies on the removal of abnormal | |||
Авторы
Даты
2013-08-27—Публикация
2008-08-25—Подача