РОДСТВЕННАЯ ЗАЯВКА
По настоящей заявке испрашивается приоритет и преимущества предварительной заявки США серийный No. 60/753615, поданной 22 декабря 2005, и предварительной заявки США серийный No. 60/807432, поданной 14 июля 2006, полное содержание описаний которых приведено здесь.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам получения связывающих гепарин белков, продуцированных в культуре клеток. Изобретение относится к способам выделения и очистки повторно уложенных связывающих гепарин белков, продуцированных в прокариотических клетках-хозяевах и присутствующих в этих клетках, как правило, в периплазматическом или внутриклеточном пространстве. Связывающие гепарин белки, продуцированные в прокариотических клетках-хозяевах, можно также обнаружить в форме растворимых белков или смеси растворимых и нерастворимых белков.
УРОВЕНЬ ТЕХНИКИ
Известно, что большое множество встречающихся в природе биологически активных полипептидов связывают гепарин. Такие связывающие гепарин полипептиды включают в себя цитокины, такие как фактор тромбоцитов 4 и IL-8 (Barber et al, (1972) Biochim. Biophys. Acta. 286:312-329; Handin et al, (1976) L Biol. Chem. 251:4273-422; Loscalzo et al., (1985) Arch. Biochem. Biophys. 240:446-455; Zucker et al., (1989) Proc. Natl. Acad. Sci. USA. 86:7571-7574; Talpas et al., (1991) Biochim. Biophys. Acta. 1078:208-218; Webb et al., (1993) Proc. Natl. Acad. Sci. USA. 90:7158-7162), связывающие гепарин факторы роста (Burgess and Maciag, (1989) Annu. Rev. Biochem. 58:576-606; Klagsbrun, (1989) Prog. Growth Factor Res. 1:207-235), такие как эпидермальный фактор роста (EGF); тромбоцитарный фактор роста (PDGF); основный фактор роста фибробластов (bFGF); кислый фактор роста фибробластов (aFGF); фактор роста эндотелия сосудов (VEGF); и фактор роста гепатоцитов (HGF) (Liu et al., (1992) Gastrointest. Liver Physiol. 26:G642-G649); и селектины, такие как L-селектин, E-селектин и P-селектин (Norgard-Sumnicht et al, (1993) Science. 261:480-483). Смотри также Munoz and Linhardt., (2004) Arterioscler Thromb Vase Biol. 24:1549-1557.
В Международной Публикации No. WO 95/07097 описаны составы связывающих гепарин белков, включая связывающие гепарин факторы роста, такие как VEGF, с очищенным нативным гепарином или другими полианионными соединениями для терапевтического применения. Показано, что полученные из гепарина олигосахариды и различные другие полианионные соединения стабилизируют активную конформацию связывающих гепарин факторов роста (Barzu et al., (1989) J. Cell. Physiol. 140:538-548; Dabora et al., (1991) J. Biol. Chem. 266:23627-23640), и аффинную хроматографию с гепарином применяли в различных схемах очистки (в общем, смотри Международную Публикацию No. WO 96/02562).
Множество связывающих гепарин белков, происходящих из млекопитающих, получены посредством рекомбинантного способа и являются клинически важными (Munoz and Linhardt, (2004) Arterioscler Thromb Vase Biol. 24:1549-1557; Favard et al. (1996) Diabetes and Metabolism 22(4):268- 73; Matsuda et al., (1995) J. Biochem. 118(3):643-9: Roberts et al., (1995) Brain Research 699(1):51-61). Например, VEGF является сильным митогеном для эндотелиальных клеток сосудов. Он известен также как фактор проницаемости сосудов (VPF). Смотри Dvorak et al., (1995) Am. J. Pathol. 146: 1029-39. VEGF играет важную роль как в васкулогенезе, развитии эмбриональной сосудистой сети, так и в ангиогенезе, процессе формирования новых кровеносных сосудов из уже существующих. Смотри, например, Ferrara, (2004) Endocrine Reviews 25(4):581-611; Risau et al., (1988) Dev. Biol. 125:441-450; Zachary. (1998) Intl. J. Biochem Cell Bio 30:1169-1174; Neufeld et al., (1999) FASEB J. 13:9-22; Ferrara (1999) J. MoL Med. 77:527-543; и Ferrara and Davis-Smyth, (1997) Endocri. Rev. 18:4-25. Клинические применения VEGF включают в себя применения, где на рост нового капиллярного ложа указывают, например, как на стимулирующий заживление ран (смотри, например, Международную публикацию No. WO 91/02058; и Декларацию поверенного No. P2358R1, озаглавленную «Заживление ран», поданную 16 июня 2006 г.), для стимуляции роста и восстановления тканей, например, печени (смотри, например, WO2003/0103581), кости (смотри, например, WO2003/094617) и т.д. Смотри также Ferrara, (2004) Endocrine Reviews 25(4):581-611.
Как правило, терапевтически важные рекомбинантные белки продуцируют множество организмов-хозяев. Большинство белков можно экспрессировать в их нативной форме в эукариотических хозяевах, таких как клетки CHO. Культура клеток животных, как правило, требует продолжительных периодов роста для достижения максимальной плотности клеток и в конечном счете достигает более низкой плотности клеток, чем культуры прокариотических клеток (Cleland, J. (1993) ACS Symposium Series 526, Protein Folding: In Vivo and In Vitro, American Chemical Society). Кроме того, для культуры клеток животных часто необходима дорогая среда, содержащая компоненты для роста, которые могут мешать выделению желаемого белка. Экспрессионные системы бактериальных хозяев обеспечивают экономически эффективную альтернативу производства рекомбинантных белков в промышленном масштабе. Существует множество патентов США по общей бактериальной экспрессии рекомбинантных белков, включая патенты США No. 4565785; 4673641; 4795706; и 4710473. Главным преимуществом способа получения является возможность простого выделения продукта из компонентов клетки посредством центрифугирования или микрофильтрации. Смотри, например, Kipriyanov and Little, (1999) Molecular Biotechnology, 12: 173- 201; и Skerra and Pluckthun, (1988) Science. 240: 1038-1040.
Рекомбинантные связывающие гепарин факторы роста, такие как кислый фактор роста фибробластов, основный фактор роста фибробластов и фактор роста сосудов эндотелия, выделяли и очищали из ряда источников, включая бактерии (Salter D. H. et al., (1996) Labor. Invest. 74(2):546-556 (VEGF); Siemeister et al., (1996) Biochem. Biophys. Res. Commun. 222(2):249-55 (VEGF); Cao et al., (1996) J. Biol. Chem. 261(6):3154-62 (VEGF); Yang et al., (1994) Gaojishu Tongxun. 4:28-31 (VEGF); Anspach et al., (1995) J. Chromatogr. A 5 711(1): 129-139 (aFGF и bFGF); Gaulandris (1994) J Cell. Physiol. 161(1): 149-59 (bFGF); Estape and Rinas (1996) Biotech. Tech. 10(7):481-484 (bFGF); McDonald et al., (1995) FASEB J. 9(3):A410 (bFGF)). Однако бактериальные экспрессирующие системы, такие как E. coli, лишены клеточного аппарата для облегчения правильной повторной укладки белков и, как правило, не обеспечивают секрецию крупных белков в культуральную среду. Рекомбинантные белки, экспрессированные в бактериальных клетках-хозяевах, часто обнаруживают в виде телец включения, состоящих из плотных масс частично уложенного и неправильно уложенного восстановленного белка. В этой форме рекомбинантный белок, как правило, является неактивным. Например, преобладающая активная форма VEGF представляет собой гомодимер из двух 165-аминокислотных полипептидов (VEGF-165). В этой структуре каждая субъединица содержит 7 пар внутрицепочечных дисульфидных связей и две дополнительные пары, обеспечивающие ковалентную связь двух субъединиц (Ferrara et al., (1991) J. Cell. Biochem. 47:211-218). Нативная конформация включает в себя сильно основной домен, который, как показано, легко связывает гепарин (Ferrara et al (1991) выше). Ковалентная димеризация VEGF необходима для эффективного связывания рецептора и биологической активности (Pӧtgens et al., (1994) J. Biol. Chem. 269:32879-32885; Claffey et al., (1995) Biochim. et Biophys. Acta 1246:1-9). Бактериальный продукт потенциально содержит несколько неправильно уложенных и связанных дисульфидными связями промежуточных соединений.
Кроме того, повторная укладка часто приводит к неправильно уложенным и связанным дисульфидными связями димерам, тримерам и мультимерам. (Morris et al., (1990) Biochem. J. 268:803-806; Toren et al., (1988) Anal. Biochem., 169:287-299). Этот феномен связывания является очень распространенным во время повторной укладки белка, особенно при более высоких концентрациях белка, и, по-видимому, часто вовлекает связывание через гидрофобное взаимодействие частично уложенных промежуточных соединений (Cleland and Wang, (1990) Biochemistry. 29:11072-11078).
Неправильная укладка происходит либо в клетке в процессе ферментации, либо в ходе процедуры выделения. Белки, выделенные из периплазматического или внутриклеточного пространства, необходимо солюбилизировать и растворимый белок повторно уложить в нативное состояние. Способы для повторной укладки белков in vitro в правильную, биологически активную конформацию необходимы для получения функциональных белков. Типичная последовательная переработка белков, выделенных из телец включения, включает в себя растворение тельца включения при высокой концентрации денатурирующего средства, такого как мочевина, с последующим разбавлением денатурирующего средства, чтобы обеспечить прохождение повторной укладки (смотри патенты США No. 4512922; 4511502; и 4511503). Смотри также, например, Rudolph and Lilie, (1996) FASEB J. 10:49-56; и Fischer et al, (1993), Biotechnology and Bioengineering, 41:3-13. Считают, что такие способы выделения являются универсально применимыми, с незначительными модификациями, для выделения биологически активных рекомбинантных белков из телец включения. Эти способы применяли для связывающего гепарин белка, такого как VEGF (Siemeister et al. (1996) supra). Этими способами стараются исключить случайное дисульфидное связывание перед сворачиванием рекомбинантного белка в его биологически активную конформацию через другие стабилизирующие его силы, и они могут не исключать неправильно уложенные промежуточные соединения или не обеспечивать гомогенных популяций правильно уложенного продукта.
Обратные мицеллы или ионообменную хроматографию использовали, чтобы способствовать повторной укладке денатурированных белков посредством заключения отдельных белков в мицеллы или выделения их на смоле и затем удаления денатурирующего средства (Hagen et al., (1990) Biotechnol. Bioeng. 35:966-975; Creighton (1985) in Protein Structure Folding and Design (Oxender, D.L. Ed.) pp.249-251, New York: Alan R. Liss, Inc.). Эти способы являлись применимыми для предупреждения агрегации белка и облегчения правильной повторной укладки. Для изменения скорости или степени повторной укладки проводили конформационно-специфичную повторную укладку с лигандами и антителами к нативной структуре белка (Cleland and Wang, (1993), in Biotechnology, (Rehm H. -J., and Reed G. Eds.) pp. 528-555, New York, VCH). Например, проводили повторную укладку креатинкиназы в присутствии антител к нативной структуре (Morris et al., (1987) Biochem. J. 248:53-57). В дополнение к антителам, лиганды и кофакторы использовали для улучшения повторной укладки. Эти молекулы будут более вероятно взаимодействовать с укладываемым белком после формирования нативного белка. Таким образом, равновесие укладки можно «направлять» к нативному состоянию. Например, скорость повторной укладки феррицитохрома улучшали с помощью внешнего лиганда для аксиального положения железа гема (Brems and Stellwagon, (1983) J. Biol. Chem. 258:3655-3661). Белки шапероны также использовали, чтобы способствовать укладке белка. Смотри, например, Baneyx, (1999) Current Opinion in Biotechnology, 10:411-421.
Существует необходимость в новых и более эффективных способах укладки и/или выделения связывающих гепарин белков из культуры клетки-хозяина, например, для эффективного и экономичного получения связывающих гепарин белков в культуре бактериальных клеток, обеспечивающего исключение или снижение количества биологически неактивных промежуточных соединений и улучшение выделения высокоочищенного биологически активного правильно уложенного белка, которые в основном являются применимыми для получения белков в промышленном масштабе. Изобретение относится к этим и другим нуждам, как будет очевидно при ознакомлении со следующим описанием.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способу выделения и очистки повторно уложенных связывающих гепарин белков из культуры клеток. В частности, изобретение относится к способу выделения связывающего гепарин белка из прокариотических клеток-хозяев, например бактериальных клеток. Например, способ включает в себя стадии (a) выделения нерастворимого связывающего гепарин белка из периплазматического или внутриклеточного пространства указанных бактериальных клеток; (b) солюбилизации указанного выделенного нерастворимого связывающего гепарин белка в первом буферном растворе, содержащем хаотропное средство и восстанавливающее средство, и
c) инкубации указанного солюбилизированного связывающего гепарин белка во втором буферном растворе, содержащем хаотропное средство и сульфатированное полианионное средство, в течение такого времени и в таких условиях, что происходит повторная укладка связывающего гепарин белка; и (d) выделения указанного повторно уложенного связывающего гепарин белка, где имеет место 2-10 кратное увеличение концентрации белка, выделенного посредством инкубации с сульфатированным полианионным средством, по сравнению с контролем. В одном варианте осуществления второй буферный раствор дополнительно содержит аргинин. В одном варианте осуществления второй буферный раствор дополнительно содержит цистеин или мягкое восстанавливающее средство.
В одном варианте осуществления изобретения имеет место, например, 2-8-кратное увеличение концентрации белка в выделенном биологически активном повторно уложенном белке, или 2-5-кратное увеличение концентрации белка в выделенном биологически активном повторно уложенном белке, или 3-5-кратное увеличение концентрации белка в выделенном биологически активном повторно уложенном белке, или 2-3-кратное увеличение концентрации белка в выделенном биологически активном повторно уложенном белке. В другом варианте осуществления изобретения имеет место, например, более чем 2,0-кратное, 2,5-кратное, 2,8-кратное, 3,0-кратное, 5-кратное, 6-кратное, 7,0-кратное, 8-кратное, 9-кратное и т.д. увеличение концентрации белка в выделенном, биологически активном, повторно уложенном белке. В одном варианте осуществления изобретения существует 3-5-кратное увеличение концентрации белка в выделенном биологически активном, повторно уложенном VEGF.
Способы по изобретению можно широко применять к связывающим гепарин белкам и особенно к связывающим гепарин факторам роста, в частности к фактору роста эндотелия сосудов (VEGF). В конкретных вариантах осуществления изобретения сульфатированное полианионное средство составляет между приблизительно 3000 и 10000 дальтон. В одном варианте осуществления сульфатированное полианионное средство, применяемое в способах получения, представляет собой декстрансульфат, сульфат натрия или гепаринсульфат. В одном аспекте декстрансульфат составляет между 3000 дальтон и 10000 дальтон.
Кроме того, изобретение относится к способам и методам очистки связывающих гепарин белков, либо отдельно, либо в сочетании с выделением связывающего гепарин белка, как описано в настоящем описании. В конкретном варианте осуществления способы очистки включают в себя контактирование указанного, повторно уложенного связывающего гепарин белка с подложкой для хроматографии на гидроксиапатите; с первой подложкой для хроматографии гидрофобного взаимодействия, с подложкой для катионной хроматографии и со второй подложкой для хроматографии гидрофобного взаимодействия, и избирательную элюцию связывающего гепарин белка с каждой подложки. В другом варианте осуществления способ очистки включает в себя контактирование указанного, повторно уложенного, связывающего гепарин белка с катионообменной подложкой; с первой подложкой для хроматографии гидрофобного взаимодействия и с подложкой для ионообменной или смешанной хроматографии, и избирательную элюцию связывающего гепарин белка с каждой подложки. Предусматривают, что стадии, в случае стадий выделения, можно проводить в любом порядке, например последовательно или с изменением порядка подложек для хроматографии. В конкретных вариантах осуществления изобретения представлены способы выделения и очистки повторно уложенных связывающих гепарин белков из культуры клеток в производственном или индустриальном масштабе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показана хроматограмма VEGF, продуцированного в бактериальном штамме W3110, нанесенного на колонку POROS HE2/M (4,6Ч100 мм, PerSeptive BioResearch Products, Cambridge, MA). Например, колонку POROS HE/2M уравновешивали в 10 мМ фосфате натрия, pH 7, содержащем 0,15 M хлорид натрия. Проводили элюцию с колонки с использованием линейного градиента 0,15-2 M хлорида натрия в 10 мМ фосфате натрия, pH 7, в течение 10 минут. Элюент мониторировали при 280 нм. Белок, выделившийся в каждом пике, соответствует VEGF, однако только пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 2 показан график, изображающий стабилизацию посредством гепарина нативного, правильно уложенного VEGF. VEGF суспендировали в 50 мМ HEPES, pH 8, содержащем 5 мМ ЭДТА, 0,2 M NaCl и 10 мМ цистеин.
На фигурах 3A-3D показаны хроматограммы VEGF, продуцированного в бактериальном штамме W3110 и инкубированного с 12 мкг/мл декстрансульфата 5000 дальтон (фигура 3A); 12 мкг/мл декстрансульфата 8000 дальтон (фигура 3B); 12 мкг/мл декстрансульфата 10000 дальтон (фигура 3C) или 25 мкг/мл гепарина (фигура 3D), 3000 дальтон и нанесенного на колонку POROS HE2/M (4,6×100 мм, PerSeptive BioResearch Products, Cambridge, MA). Например, колонку уравновешивали в 10 мМ фосфате натрия, pH 7, содержащем 0,15 M хлорид натрия. Проводили элюцию с колонки с использованием линейного градиента 0,15-2 M хлорида натрия в 10 мМ фосфате натрия, pH 7, в течение 10 минут. Элюент мониторировали при 280 нм. Белок, выделившийся в каждом пике, соответствует VEGF, однако только пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 4 показан эффект масштаба на повторную укладку VEGF.
На фигуре 5 показан эффект гепарина с низкой молекулярной массой (MW) и высокой MW, и декстрансульфата, 10000 дальтон, на повторную укладку VEGF. Пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 6 показан эффект сульфата натрия на повторную укладку VEGF. Пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 7 показан эффект гепарина с низкой молекулярной массой (MW) и высокой MW, и декстрансульфата, 5000 дальтон, 8000 дальтон, и 10000 дальтон на повторную укладку VEGF. Пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 8 показан эффект гепарина и декстрансульфата на повторную укладку VEGF. Пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 9 показан эффект мочевины и DTT на экстракцию VEGF из бактериальных телец включения.
На фигуре 10 показан эффект концентрации мочевины и DTT на повторную укладку VEGF.
На фигуре 11 показана аминокислотная последовательность VEGF165 с указанными дисульфидными связями (SEQ ID NO.:1).
На фигуре 12 показан эффект присутствия заряженных аминокислот. При концентрации 0,75 М во втором буферном растворе как аргинин, так и лизин являются благоприятными, в то время как гистидин оказывает небольшой дополнительный эффект по сравнению с буферным раствором без него. Кроме того, показано, что аргинин оказывает сходный эффект в концентрациях 0,1-1 М.
На фигуре 13 показан эффект разведения в % эффективности повторной укладки, где, хотя общая концентрация VEGF становится более низкой с увеличением разведения, % эффективности повторной укладки выше для большего разведения.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
«Гепарин» (обозначаемый также как гепариновая кислота) представляет собой гетерогенную группу высоко сульфатированных, неразветвленных анионных мукополисахаридов, называемых гликозаминогликанами. Хотя могут присутствовать и другие, основными сахарами в гепарине являются: α-L-идуроновая кислота-2-сульфат, 2-дезокси-2-сульфамино-α-глюкоза-6-сульфат, β-D-глюкуроновая кислота, 2-ацетамидо-2-дезокси-α-D-глюкоза и L-идуроновая кислота. Эти и, необязательно, другие сахара соединены гликозидными связями с формированием полимеров различных размеров. Из-за присутствия его ковалентно связанных групп сульфата и карбоновой кислоты гепарин является сильно кислым. Молекулярная масса гепарина меняется от приблизительно 3000 до приблизительно 20000 дальтон, в зависимости от источника и способа определения.
Нативный гепарин является составной частью различных тканей, особенно печени и легкого, и тучных клеток в нескольких видах млекопитающих. Гепарин и соли гепарина (гепарин натрия) являются коммерчески доступными, и их преимущественно используют в качестве антикоагулянтов в различных клинических ситуациях.
«Декстрансульфат» представляет собой сульфат декстрана, принципиальная структура которого представляет собой полимер D-глюкозы. Глюкоза и, необязательно, другие сахара соединены α-D(1-6)гликозидными связями, формируя полимеры различных размеров. Из-за присутствия ковалентно связанного сульфата декстрансульфат является сильно кислым. Содержание серы, как правило, составляет не менее чем 10% и, как правило, приблизительно 15%-20%, при вплоть до 3 сульфатных групп на молекулу глюкозы. Средняя молекулярная масса декстрансульфата составляет от приблизительно 1000 до приблизительно 40000000 дальтон. Примеры декстрансульфата, применимого по изобретению, включают в себя сульфаты декстранов, полученные из таких микроорганизмов, как Leuconostoc mesenteroides и L. dextranicum.
«Полианионное средство», как применяют в объеме изобретения, предназначено для описания коммерчески доступных очищенных препаратов и соединений нативного гепарина, способных связываться со связывающими гепарин белками, включая другие «полианионные средства», такие как сульфат натрия, гепаринсульфат, гепарансульфат, пентозан(поли)сульфат, декстран, декстрансульфат, гиалуроновая кислота, хондроитин, хондроитинсульфат, дерматансульфат и кератансульфат. Особенно применимым в контексте изобретения является «сульфатированное полианионное средство», например, такое как сульфатное производное полисахарида, такое как гепаринсульфат, декстрансульфат, сульфаты циклодекстрина, продуцируемые микроорганизмами, такими как Bacillus macerans, описанные в патенте США No. 5314872, также как сульфаты других глюканов, такие как β-1,3-глюкансульфаты, где β-1,3-глюкан продуцируют микроорганизмы, принадлежащие к роду Alcaligenes или Agrobacterium, и хондроитинсульфат, также как сульфатированные фрагменты гепарина.
Вышеупомянутые средства, как правило, являются доступными и известными специалисту в данной области. Например, сульфатированные фрагменты гепарина можно получить из библиотеки полученных из гепарина олигосахаридов, фракционированных посредством гель-проникающей хроматографии. Получение аффинно- фракционированных, полученных из гепарина олигосахаридов, опубликовано Ishihara et al., (1993) J. Biol. Chem., 268:4675-4683. Эти олигосахариды получили из коммерческого свиного гепарина с последующей частичной деполимеризацией азотистой кислотой, восстановлением боргидридом натрия и фракционированием гель-проникающей хроматографией. Полученные пулы ди-, тетра-, гекса-, окта- и декасахаридов последовательно наносили на аффинную колонку с рекомбинантным bFGF человека, ковалентно присоединенным к SEPHAROSE™ 4B, и далее фракционировали на подпулы на основе их элюции с колонки под действием градиентов хлорида натрия. В результате этого получили пять пулов, обозначенных Hexa-1 - Hexa-5, структуры и виды биологической активности которых дополнительно исследовали. Структура Hexa-5C и его спектр ЯМР при 500-MHz показаны на фигуре 4 из Tyrell et al., (1993) J. Biol. Chem. 268:4684-4689. Этот гексасахарид обладает структурой [IdoA(2-OSO3)α1-4GlcNSO3(6-OSO3)α1-4]2IdoA(2-OSO3)α1-4AManR(6-OSO3). Все полученные из гепарина олигосахариды, обсуждаемые выше, также как другие гепарин-подобные олигосахариды являются подходящими, и их можно использовать согласно изобретению. В одном варианте осуществления изобретения используют гексасахариды и полисахариды из гепарина с более высоким размером единицы (например гепта-, окта-, нона- и декасахариды). Более того, успешно используют полученные из гепарина или гепарин-подобные олигосахариды с более высоким отрицательным суммарным зарядом, например, из-за высокой степени сульфатирования.
Термин «связывающий гепарин белок» или «HPB», как применяют здесь, относится к полипептиду, способному связывать гепарин (как определено здесь выше). Определение относится к зрелой, пре-, пре-про-, и про-формам нативных и полученных рекомбинантным способом связывающих гепарин белков. Типичными примерами связывающих гепарин белков являются «связывающие гепарин факторы роста», включая в качестве неограничивающих примеров эпидермальный фактор роста (EGF), тромбоцитарный фактор роста (PDGF), основный фактор роста фибробластов (bFGF), кислый фактор роста фибробластов (aFGF), фактор роста эндотелия сосудов (VEGF), фактор роста гепатоцитов (HGF) (известный также как рассеивающий фактор, SF) и фактор роста нервов (NGF), IL-8 и т.д.
Как применяют здесь, «фактор роста эндотелия сосудов», или «VEGF», относится к фактору роста млекопитающих, первоначально полученному из фолликулярных клеток бычьего гипофиза, обладающему аминокислотной последовательностью, описанной в Castor, C. W., et al., (1991) Methods in Enzymol. 198:391-405, вместе с его функциональными производными, обладающими качественной биологической активностью соответствующего нативного VEGF, включая, в качестве неограничивающих примеров, аминокислотную последовательность VEGF, как опубликовано в Houck et al., (1991) MoL Endocrin. 5:1806-1814. Смотри также Leung et al. (1989) Science. 246:1306 и Robinson & Stringer, (2001) Journal of Cell Science. 144(5):853-865, патент США No. 5332671. Преобладающая форма VEGF представляет собой гомодимер из 165 аминокислот, обладающий шестнадцатью остатками цистеина, формирующими 7 внутримолекулярных дисульфидных связей и две межмолекулярные дисульфидные связи. Альтернативный сплайсинг вовлечен в формирование множества полипептидов VEGF человека, состоящих из 121, 145, 165, 189 и 206 аминокислот, однако вариант VEGF121 не обладает связывающим гепарин доменом из других вариантов и, таким образом, не подпадает под определение связывающего гепарин белка, указанное здесь. Все изоформы VEGF разделяют общий N-концевой домен, но различаются по длине C-концевой части молекулы. Предпочтительная активная форма VEGF, VEGF165 обладает дисульфидными связями между аминокислотными остатками Cys26-Cys68; Cys57-Cys104; Cys61-Cys102; Cys117-Cys135; Cys120-Cys137; Cys139-Cys158; Cys146-Cys160 в каждом мономере. Смотри фигуру 11. Смотри также, например, Keck et al., (1997) Archives of Biochemistry and Biophysics 344(1): 103-113. Молекула VEGF165 состоит из двух доменов: N-концевого связывающего рецептор домена (гомодимер со связанными дисульфидными связями аминокислотами 1-110) и C-концевого связывающего гепарин домена (остатки 111-165). Смотри, например, Keyt et al., (1996) J1 Biol. Chem.. 271(13):7788-7795. В конкретных вариантах осуществления изобретения выделенный и очищенный VEGF165 не является гликозилированным по остатку 75 (Asn). Смотри, например, Yang et al., (1998) Journal of Pharm. & Experimental Therapeutics, 284: 103-110. В конкретных вариантах осуществления изобретения выделенный и очищенный VEGF165 является по существу не дезамидированным по остатку Asn10. В конкретных вариантах осуществления изобретения выделенный и очищенный VEGF165 представляет собой смесь дезамидированного (по остатку Asn10) и недезамидированного белка, как правило, при большей части белка являющейся недезамидированной. Поскольку VEGF165 представляет собой гомодимер, дезамидирование может происходить на одной или обеих полипептидных цепях.
Как применяют здесь, «правильно уложенный» или «биологически активный» VEGF, или другой HBP и т.п., относится к молекуле с биологически активной конформацией. Специалисту в данной области понятно, что неправильно уложенные и связанные дисульфидными связями промежуточные соединения могут обладать биологической активностью. В таком случае правильно уложенный или биологически активный VEGF или HBP соответствует природному характеру укладки VEGF (описанному выше) или другого HBP. Например, правильно уложенный VEGF обладает указанными выше дисульфидными парами, в дополнение к двум межмолекулярным дисульфидным связям в димерной молекуле, однако культура бактериальных клеток может продуцировать другие промежуточные соединения (Фигура 1 и 3A-3D). В случае правильно уложенного VEGF существуют две межмолекулярные дисульфидные связи между теми же самыми остатками, Cys51 и Cys60, каждого мономера. Смотри, например, патент WO98/16551. Виды биологической активности VEGF включают в себя в качестве неограничивающих примеров, например, стимуляцию проницаемости сосудов, стимуляцию роста эндотелиальных клеток сосудов, связывание с рецептором VEGF, связывание и передачу сигнала через рецептор VEGF (смотри, например, Keyt et al., (1996) Journal of Biological Chemistry, 271(10):5638-5646), включая ангиогенез и т.д.
Термины «очищенный» или «чистый HBP» и т.п. относятся к материалу, свободному от веществ, в норме сопровождающих его, как обнаружено при его рекомбинантной продукции, и особенно в культуре прокариотических или бактериальных клеток. Таким образом, термины относятся к рекомбинантному HBP, свободному от загрязняющей ДНК, белков клетки-хозяина или других молекул, связанных с ним в окружении in situ. Термины относятся к степени чистоты, а именно по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 98% или более.
Термины «тельца включения» или «оптически плотные тельца» относятся к плотным внутриклеточным массам агрегированного интересующего полипептида, составляющим значительную часть общего белка клетки, включая все компоненты клетки. В некоторых случаях, но не во всех случаях, эти агрегаты полипептида можно распознать как яркие пятна, видимые внутри внутреннего пространства клеток под фазово-контрастным микроскопом при увеличениях ниже 1000-кратного.
Как применяют здесь, термин «неправильно уложенный» белок относится к преципитированным или агрегированным полипептидам, содержащимся внутри оптически плотных телец. Как применяют здесь, «нерастворимый» или «неправильно уложенный» VEGF, или другой HBP относится к преципитированному или агрегированному VEGF, содержащемуся внутри периплазмы или внутриклеточного пространства прокариотических клеток-хозяев, или другим образом связанному с прокариотической клеткой-хозяином, и принимающему биологически неактивную конформацию с несовпадающими или несформированными дисульфидными связями. Нерастворимый HBP, как правило, но необязательно, содержится в оптически плотных тельцах, т.е. может быть или не быть видимым под фазово-контрастным микроскопом.
Как применяют здесь, «хаотропное средство» относится к соединению, которое, в соответствующей концентрации в водном растворе, является способным изменять пространственную конфигурацию или конформацию полипептидов посредством изменения их поверхности, так что придает полипептиду растворимость в водной среде. Изменения могут происходить посредством изменения, например, состояния гидратации, окружения растворителя или взаимодействия растворитель-поверхность. Концентрация хаотропного средства будет напрямую влиять на его силу и эффективность. Сильный денатурирующий хаотропный раствор содержит хаотропное средство в больших концентрациях, которые в растворе будут эффективно разворачивать присутствующий в растворе полипептид, эффективно удаляя вторичную структуру белков. Разворачивание будет относительно обширным, но обратимым. Умеренный денатурирующий хаотропный раствор содержит хаотропное средство, которое, в достаточных концентрациях в растворе, позволяет частичную укладку полипептида от какой-либо искаженной конформации, которую полипептид принял, через промежуточные соединения, растворимые в растворе, в пространственную конформацию, в которой он находится при действии в своей активной форме в эндогенных или гомологичных физиологических условиях. Примеры хаотропных средств включают в себя гидрохлорид гуанидина, мочевину и гидроксиды, такие как гидроксид натрия или калия. Хаотропные средства включают в себя сочетание этих реагентов, такое как смесь гидроксида с мочевиной или гидрохлоридом гуанидина.
Как применяют здесь, «восстанавливающее средство» относится к соединению, которое, в подходящей концентрации в водном растворе, поддерживает свободные сульфгидрильные группы, так что химически разрушает внутри- или межмолекулярные дисульфидные связи. Репрезентативные примеры подходящих восстанавливающих средств включают в себя дитиотреитол (DTT), дитиоэритрит (DTE), бета-меркаптоэтанол (BME), цистеин, цистеамин, тиогликолят, глутатион, трис[2-карбоксиэтил]фосфин (TCEP) и боргидрид натрия.
Как применяют здесь, «буферный раствор» относится к раствору, устойчивому к изменению pH из-за действия его компонентов - конъюгатов кислота-щелочь.
«Бактерии» для целей здесь включают в себя эубактерии и архебактерии. В конкретных вариантах осуществления изобретения, эубактерии, включая грамположительные и грамотрицательные бактерии, используют в методах и способах, описанных здесь. В одном варианте осуществления изобретения используют грамотрицательные бактерии, например, Enterobacteriaceae. Примеры бактерий, принадлежащих к Enterobacteriaceae, включают в себя Escherichia, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, Serratia и Shigella. Другие типы подходящих бактерий включают в себя Azotobacter, Pseudomonas, Rhizobia, Vitreoscilla и Paracoccus. В одном варианте осуществления изобретения используют E. coli. Подходящие хозяева E. coli включают в себя E. coli W3110 (ATCC 27325), E. coli 294 (ATCC 31446), E. coli B и E. coli X1776 (ATCC 31537). Эти примеры являются иллюстративными, а не ограничивающими, и одним из примеров является W3110. Можно использовать также мутантные клетки любой из вышеупомянутых бактерий. Конечно, является необходимым выбрать подходящие бактерии, принимая во внимание способность к репликации репликона в клетках бактерии. Например, виды E. coli, Serratia, или Salmonella можно соответствующим образом использовать в качестве хозяина при использовании хорошо известных плазмид, таких как pBR322, pBR325, pACYC177 или pKN410, для предоставления репликона. Смотри далее ниже соответствующие примеры подходящих бактериальных клеток-хозяев.
Как применяют здесь, выражения «клетка», «линия клеток», «штамм» и «культура клеток» используют взаимозаменяемо, и все такие определения включают в себя потомство. Таким образом, слова «трансформанты» и «трансформированные клетки» включают в себя первичную рассматриваемую клетку и происходящие из нее культуры, независимо от числа пересевов. Понятно также, что все потомство может не являться точно идентичным по содержанию ДНК из-за намеренных или случайных мутаций. Включено мутантное потомство, обладающее той же самой функцией или биологической активностью, по какой проводили скрининг исходных трансформированных клеток. Где подразумевают отличные определения, это будет ясно из контекста.
Как применяют здесь, «полипептид» в основном относится к пептидам и белкам из любого клеточного источника, обладающим более чем приблизительно десятью аминокислотами. «Гетерологичные» полипептиды представляют собой полипептиды, чужие для применяемой клетки-хозяина, такие как белок человека, продуцируемый E. coli. В то время как гетерологичный полипептид может являться прокариотическим или эукариотическим, предпочтительно, он является эукариотическим, более предпочтительно, относящимся к млекопитающим, и наиболее предпочтительно, к человеку. В конкретных вариантах осуществления изобретения он представляет собой полученный рекомбинантным способом, или рекомбинантный полипептид.
Связывающие гепарин белки
Выделение связывающего гепарин белка
Нерастворимый, неправильно уложенный связывающий гепарин белок (HBP) выделяют из прокариотических клеток-хозяев, экспрессирующих белок, посредством любого из множества общепринятых в данной области способов. Например, нерастворимый HBP выделяют в подходящем буфере для выделения посредством подвергания клеток воздействию буфера подходящей для солюбилизации большинства белков хозяина ионной силы, в котором, однако, рассматриваемый белок является по существу нерастворимым, или посредством разрушения клеток, так чтобы высвободить тельца включения или белок из периплазматического или внутриклеточного пространства и сделать их доступными для выделения, например, посредством центрифугирования. Этот способ является хорошо известным и описан, например, в патенте США No. 4511503. Kleid et al., описывающем очистку оптически плотных телец посредством гомогенизации с последующим центрифугированием (Kleid et al., (1984) in Developments in Industrial Microbiology, (Society for Industrial Microbiology, Arlington, VA) 25:217-235). Смотри также, например, Fischer et al., (1993) Biotechnology and Bioengineering 41:3-13.
В патенте США No. 5410026 описан типичный способ для выделения белка из телец включения, и его можно суммировать следующим образом. Прокариотические клетки суспендируют в подходящем буфере. Как правило, буфер состоит из забуферивающего средства, пригодного для забуферивания при pH между 5 и 9, или при приблизительно 6-8, и соли. Любая подходящая соль, включая NaCl, является применимой для поддержания подходящей ионной силы в буферном растворе. Как правило, используют ионную силу приблизительно 0,01-2 M или 0,1-0,2 M. Клетки во время суспендирования в этом буфере разрушают или лизируют с использованием общепринятых способов, например, таких как механические способы, например, с помощью гомогенизатора (пресса Мэнтона-Голина, микрофлюидизатора или Ниро-Соави), французского пресса, шаровой мельницы или звукового генератора, или посредством химических или ферментативных способов.
Примеры химических или ферментативных способов разрушения клеток включают в себя перевод в сфероплаты, включающий в себя использование лизоцима для лизиса бактериальной стенки (H. Neu et al., (1964) Biochem. Biophys. Res. Comm., 17:215), и осмотический шок, включающий в себя обработку жизнеспособных клеток раствором высокой тоничности и промывку холодной водой низкой тоничности для высвобождения полипептидов (H. Neu et al., 1965 J. Biol. Chem.. 240(9):3685-3692). Обработку ультразвуком обычно используют для разрушения бактерий, содержащихся в аналитических масштабах объемов среды после ферментации. При более крупных масштабах, как правило, используют гомогенизацию при высоком давлении.
После разрушения клеток суспензию, как правило, центрифугируют при низкой скорости, обычно около 500-15000 × g, например, в одном варианте осуществления изобретения используют приблизительно 12000 × g, в стандартной центрифуге в течение времени, достаточного для осаждения по существу всего нерастворимого белка. Такие промежутки времени можно легко определить, и они зависят от объема, подлежащего центрифугированию, также как от конструкции центрифуги. Как правило, приблизительно от 10 минут до 0,5 часа достаточно для осаждения нерастворимого белка. В одном варианте осуществления суспензию центрифугируют при 12000 × g в течение 10 минут.
Полученный осадок содержит по существу всю фракцию нерастворимого белка. Если процесс разрушения клеток является незаконченным, осадок может также содержать интактные клетки или фрагменты разрушенных клеток. Полноту разрушения клеток можно оценить посредством ресуспендирования осадка в небольшом количестве того же самого буферного раствора и исследования суспензии с помощью фазово-контрастного микроскопа. Присутствие фрагментов разрушенных клеток или целых клеток указывает на необходимость дополнительной обработки ультразвуком или других средств для удаления фрагментов или клеток и связанных непреломляющих полипептидов. После такого дополнительного разрушения, если необходимо, суспензию снова центрифугируют и осадок отделяют, ресуспендируют и повторно исследуют. Процесс повторяют, пока визуальное обследование не выявит отсутствия фрагментов разрушенных клеток в осажденном материале или пока дополнительной обработкой нельзя будет уменьшить размер полученного осадка.
Вышеуказанный способ можно применять, находится ли нерастворимый белок во внутриклеточном или в периплазматическом пространстве. В одном варианте осуществления изобретения условия, приведенные здесь для выделения связывающего гепарин белка, предназначены для “телец включения”, преципитированных в периплазматическом пространстве или внутриклеточном пространстве, и относятся, в частности, к VEGF. Однако считают, что способы и процедуры можно применять в общем для связывающих гепарин белков с незначительными модификациями, как указано в нижеследующем тексте. В конкретных вариантах осуществления изобретения способы и процедуры можно применять для производства или получения повторной укладки и очистки HBP в промышленном масштабе.
Повторная укладка связывающих гепарин белков
Выделенный нерастворимый, неправильно уложенный связывающий гепарин белок инкубируют в первом буферном растворе, содержащем количество хаотропного средства и восстанавливающего средства, достаточное для солюбилизации, в основном, связывающего гепарин белка. Эта инкубация имеет место при условиях концентрации, времени инкубации и температуры инкубации, позволяющих солюбилизацию некоторой части или, в основном, всего связывающего гепарин белка и прохождение разворачивания.
Значение степени солюбилизации в буферном растворе можно легко определить, и это подходящим образом проводят, например, посредством определения мутности, посредством анализа фракционирования между супернатантом и осадком после центрифугирования, в восстанавливающих гелях для SDS-PAGE, посредством анализа белка (например, анализа белка с реагентом Бредфорд (например, Pierce, Bio-Rad и т.д.)) или посредством HPLC.
Первый буферный раствор содержит забуферивающее средство, подходящее для поддержания уровня pH в буфере по меньшей мере приблизительно 7,0, обычно в диапазоне, составляющем 7,5-10,5. В одном варианте осуществления pH для VEGF представляет собой pH 8,0. Примеры подходящих буферов, обеспечивающих pH в этом последнем диапазоне, включают в себя ТРИС-HCl (Трис[гидроксиметил]аминометан), HEPPS (N-[2-гидроксиэтил]пиперазин-N'-[3-пропан-сульфоновая кислота]), HEPES (N-[2-гидроксиэтил]пиперазин-N'-[2-этансульфоновая кислота])), CAPSO (3-[циклогексиламино]-2-гидрокси-1-пропансульфоновая кислота), AMP (2-амино-2-метил-1-пропанол), CAPS (3-[циклогексиламино]-1-пропансульфоновая кислота), CHES (2-[N-циклогексиламино]этансульфоновая кислота), глицин и ацетат натрия. В одном варианте осуществления изобретения буфер здесь представляет собой HEPPS при pH приблизительно 8,0. В дополнительном варианте осуществления буферы, например, такие как HEPPS, являются сульфатированными.
Хаотропные средства, пригодные для практического осуществления этого изобретения, включают в себя, например, мочевину и соли гуанидина или тиоцианата, например, мочевину, гидрохлорид гуанидина, тиоцианат натрия и т.д. Количество необходимого хаотропного средства, необходимое для присутствия в буфере, представляет собой количество, необходимое для разворачивания HBP в растворе. В конкретных вариантах осуществления изобретения хаотропное средство присутствует при молярности приблизительно между 4 и 10. В одном варианте осуществления изобретения хаотропное средство представляет собой мочевину при приблизительно 5-8 M, или при приблизительно 7 M. В другом примере хаотропное средство представляет собой гидрохлорид гуанидина при приблизительно 6-8 M.
Примеры подходящих восстанавливающих средств включают в себя в качестве неограничивающих примеров, дитиотреитол (DTT), дитиоэритрит (DTE), β-меркаптоэтанол (BME), цистеин, DTE и т.д. Количество восстанавливающего средства, необходимое для присутствия в буфере, будет в основном зависеть от типа восстанавливающего средства и хаотропного средства, типа и pH применяемого буфера, количества кислорода, захваченного раствором или введенного в раствор, и концентрации белка в буфере. Например, для 0,5-1,5 мг/мл белка в буферном растворе при pH 7,0-10,0, содержащем 4-8 M мочевину, восстанавливающее средство представляет собой, например, DTT в концентрации приблизительно 1-15 мМ, или BME в концентрации приблизительно 0,2-2 мМ, или цистеин в концентрации приблизительно 2-10 мМ. В одном варианте осуществления восстанавливающее средство представляет собой DTT при приблизительно от 0,5 до приблизительно 4 мМ, или 2-4 мМ. На фигуре 9 показан эффект мочевины и DTT на экстракцию VEGF. Пик 3 VEGF относится к правильно уложенному, биологически активному VEGF. В одном варианте осуществления восстанавливающее средство представляет собой DTT при приблизительно 10 мМ. В буфере здесь можно использовать одно восстанавливающее средство или сочетание восстанавливающих средств.
Концентрация белка в буферном растворе должна быть такой, чтобы белок являлся в основном солюбилизированным, как определяют по оптической плотности. Точное количество для применения будет зависеть, например, от концентраций и типов других ингредиентов в буферном растворе, в частности, концентрации белка, восстанавливающего средства и pH буфера. В одном варианте осуществления изобретения концентрация связывающего гепарин белка лежит в диапазоне 0,5-5,5 мг на мл, или 1,5-5,0 мг/мл. Солюбилизацию, как правило, проводят при приблизительно 0-45°C или приблизительно при 20-40°C, или приблизительно при 23-37°C, или приблизительно при 25-37°C, или приблизительно при 25°C, по меньшей мере приблизительно от одного до 24 часов. В одном варианте осуществления солюбилизацию проводят по меньшей мере приблизительно два часа при комнатной температуре. Как правило, на температуру не оказывают явного влияния соль, восстанавливающее средство и уровень хаотропного средства.
После солюбилизации полипептида его помещают во второй буферный раствор или разводят во втором буферном растворе, содержащем хаотропное средство и сульфатированное полианионное средство, как описано выше, однако при концентрации хаотропного средства, позволяющей повторную укладку связывающего гепарин белка.
Условия этой второй инкубации растворимого, неправильно уложенного белка будут, в основном, такими, что будет иметь место некоторая, или значительная, или полная повторная укладка белка. Точные условия будут зависеть, например, от pH буфера и типов и концентраций сульфатированных полианионных средств, и хаотропных и восстанавливающих средств, если какие-либо присутствуют. Температура инкубации, как правило, составляет приблизительно 0-40°C или 10-40°C, и инкубацию, как правило, будут проводить в течение по меньшей мере приблизительно 1 часа для осуществления повторной укладки. В конкретных вариантах осуществления реакцию проводят, например, при приблизительно 15-37°C, или при 20-30°C, в течение по меньшей мере приблизительно 6 часов, в течение по меньшей мере приблизительно 10 часов, или между приблизительно 10 и 48 часами, или между приблизительно 15 и 20 часами, или между 6 и 20 часами, или между 12 и 24 часами.
Степень повторной укладки соответствующим образом определяют по титру HPB в радиоиммуноанализе (RIA) или посредством анализа высокоэффективной жидкостной хроматографией (HPLC) с использованием, например, колонки POROS HE2/M (PerSeptive BioResearch Products) или другой подходящей аффинной колонки с гепарином. Увеличение титра в RIA или размер пика правильно уложенного HBP напрямую коррелируют с увеличением количеств правильно уложенного, биологически активного HPB, присутствующего в буфере. Инкубацию проводят до максимизации соотношения правильно уложенного HPB к неправильно уложенному выделенному HPB, как определяют по RIA или HPLC.
В одном варианте осуществления количество и качество правильно уложенного VEGF оценивают с использованием анализа связывания гепарина. Образцы, содержащие разведенный связывающий гепарин белок, наносят, например, на колонку POROS HE2/M (4,6×100 мм, PerSeptive BioResearch Products, Cambridge, MA) или другую подходящую аффинную колонку с гепарином. Например, аффинную колонку с гепарином уравновешивают в 10 мМ фосфате натрия, pH 7, содержащем 0,15 M хлорид натрия. При скорости протока 1 мл/мин или 2 мл/мин проводят элюцию с колонки с использованием линейного градиента 0,15-2 M хлорида натрия в 10 мМ фосфате натрия, pH 7, в течение 10 минут. Элюент мониторируют при 280 нм. В одном варианте осуществления белок выделяют в одном пике, соответствующем биологически активному, правильно повторно уложенному HBP. В одном варианте осуществления изобретения анализ для определения правильно повторно уложенного HBP представляет собой RPHPLC. Дисульфидные связи можно, необязательно, подтвердить по пептидной карте. Круговой дихроизм также можно использовать для определения 2 и 3D структуры/укладки.
Буфер для второго буферного раствора может представлять собой любой из буферов, перечисленных выше для первого буферного раствора, например, HEPPS pH 8,0, например, в концентрации приблизительно 50 мМ для повторной укладки VEGF. Полипептид можно разводить буфером для повторной укладки, например, по меньшей мере в пять раз, или по меньшей мере приблизительно в десять раз, приблизительно в 20 раз, или приблизительно в 40 раз. Альтернативно, полипептид можно диализовать против буфера для повторной укладки.
Второй буферный раствор содержит хаотропное средство в такой концентрации, что происходит повторная укладка HPB. Как правило, хаотропное средство присутствует при молярности приблизительно между 0,5 и 2. В одном варианте осуществления изобретения хаотропное средство здесь представляет собой мочевину при приблизительно 0,5-2 M, 0,5-2 M или при приблизительно 1 M. В одном варианте осуществления хаотропное средство представляет собой мочевину при концентрации приблизительно 1,3 M. В другом варианте осуществления изобретения хаотропное средство представляет собой гидрохлорид гуанидина при приблизительно 1 M. На фигуре 10 показан эффект мочевины и восстанавливающего средства DTT на повторную укладку VEGF. Пик 3 VEGF относится к правильно уложенному биологически активному VEGF.
Как указано, раствор, необязательно, содержит также восстанавливающее средство. Восстанавливающее средство подходящим образом выбрано из средств, описанных выше для стадии солюбилизации, в диапазоне концентраций от приблизительно 0,5 до приблизительно 10 мМ для цистеина, 0,1-1,0 мМ для DTT, и/или менее чем приблизительно 0,2 мМ для BME. В одном варианте осуществления изобретения восстанавливающее средство представляет собой DTT при приблизительно 0,5-2 мМ. В одном варианте осуществления изобретения восстанавливающее средство представляет собой DTT при приблизительно 0,5 мМ. Примеры подходящих восстанавливающих средств включают в себя в качестве неограничивающих примеров, например, дитиотреитол (DTT), β-меркаптоэтанол (BME), цистеин, DTE и т.д. В то время как DTT и BME можно использовать применительно к способам, представленным здесь в общем для связывающих гепарин белков, как правило, сочетание цистеина от приблизительно 0,1 до приблизительно 10 мМ и DTT от приблизительно 0,1 до приблизительно 1,0 мМ, как описано здесь, представляет собой пример для выделения VEGF.
Стадия повторной укладки включает в себя сульфатированное полианионное средство в концентрации, достаточной для достижения полной повторной укладки солюбилизированного белка. Примеры подходящих полианионных средств описаны здесь выше, например, сульфатное производное полисахарида, как указано выше, с сульфатированными полианионными средствами, такими как гепаринсульфат, декстрансульфат, гепаринсульфат и хондроитинсульфат, также как сульфатированные фрагменты гепарина. В случае гепаринсульфатов, применяемых в контексте изобретения, молекулярная масса, как правило, составляет между приблизительно 3000 и 10000 дальтон, или между приблизительно 3000 и 6000 дальтон.
В одном варианте осуществления изобретения декстрансульфат применяют в контексте изобретения. Молекулярная масса сульфатированного полианионного или другого средства, такого как декстрансульфат, применяемого по изобретению, зависит от размера конкретного, подлежащего выделению связывающего гепарин белка. Как правило, применяют декстрансульфат между приблизительно 3000 и 10000 дальтон. В одном варианте осуществления изобретения применяют декстрансульфат между приблизительно 5000 дальтон и 10000 дальтон, например, для выделения VEGF. В другом варианте осуществления применяют декстрансульфат между приблизительно 5000 и 8000 дальтон для выделения HBP. На фигуре 3A-3D показано выделение VEGF с различными концентрациями и молекулярными массами декстрансульфата (Фигуры 3A-C) и гепарина (Фигуре 3D), как анализировали посредством аффинной хроматографии с гепарином. Пик 3 соответствует правильно уложенному VEGF.
Концентрация применяемого полианионного соединения зависит от подлежащего выделению белка и его концентрации и от условий, таких как температура и pH буфера для повторной укладки. Типичные концентрации составляют между приблизительно 50 и 500 мМ для сульфата натрия, между приблизительно 10 и 200 мкг/мл для низкомолекулярных гепаринов, таких как гепарин 6000 дальтон (Sigma Chemical Co.), между приблизительно 10 и 200 мкг/мл для высокомолекулярных гепаринов, таких как свиной гепарин I-A (Sigma Chemical Co.), и между приблизительно 10 и 400 мкг/мл, или между приблизительно 10 и 200 мкг/мл для декстрансульфатов.
Буфер для повторной укладки может, необязательно, содержать дополнительные средства, такие как любой из множества неионных детергентов, таких как TRITON™ X-100, NONIDET™ P-40, серии TWEEN™ и серии BRIJ™. Неионный детергент присутствует при приблизительно между 0,01% и 1,0%. В одном из примеров концентрации неионного детергента составляют между приблизительно 0,025% и 0,05%, или приблизительно 0,05%.
Необязательно, положительно заряженные аминокислоты, например, аргинин (например, L-аргинин/HCl), лизин и т.д., могут присутствовать в буфере для повторной укладки. В конкретных вариантах осуществления изобретения концентрация аргинина составляет, например, конечную концентрацию приблизительно 0-1000 мМ или приблизительно 25-750 мМ, или приблизительно 50-500 мМ, или приблизительно 50-250 мМ, или приблизительно 100 мМ и т.д. В конкретных вариантах осуществления изобретения белок присутствует в буферном растворе при pH 7,0-9,0, содержащем 0,5-3 M мочевину, 0-30 мг/л декстрансульфата, 0-0,2% Тритон X-100, 2-15 мМ цистеин, 0,1-1 мМ DTT и 0-750 мМ аргинин, конечная концентрация. В одном варианте осуществления используют 50 мМ HEPPS. В одном варианте осуществления конечная концентрация раствора в буфере для повторной укладки составляет: 1 M мочевина, 50 мМ HEPPS, 15 мг/л декстрансульфат, 0,05% Тритон X-100, 7,5 мМ цистеин, 100 мМ аргинин, pH 8,0. В одном варианте осуществления конечная концентрация раствора в буфере для повторной укладки составляет: 1,3 M мочевина, 50 мМ HEPPS, 15 мг/л декстрансульфат, 0,05% Triton X-100, 7,5 мМ цистеин, 0,5 мМ DTT, 100 мМ аргинин, pH 8,0.
Выделение и очистка связывающих гепарин белков
Хотя выделение и очистка связывающего гепарин белка из культуральной среды может включать в себя различные методы и известные способы для разделения таких белков, например, такие как фракционирование солью и растворителем, адсорбция коллоидными материалами, гель-фильтрация, ионообменная хроматография, аффинная хроматография, иммуноаффинная хроматография, электрофорез и высокоэффективная жидкостная хроматография (HPLC), описан пример четырехстадийного хроматографического способа, включающего в себя контактирование указанного, повторно уложенного связывающего гепарин белка с подложкой для хроматографии на гидроксиапатите; с первой подложкой для хроматографии гидрофобного взаимодействия, с подложкой для катионной хроматографии и со второй подложкой для хроматографии гидрофобного взаимодействия, и избирательную элюцию связывающего гепарин белка с каждой подложки. Альтернативно, описан другой хроматографический способ, включающий в себя контактирование указанного, повторно уложенного связывающего гепарин белка с подложкой для катионообменной хроматографии; с подложкой для хроматографии гидрофобного взаимодействия и с подложкой для ионообменной хроматографии, и избирательную элюцию связывающего гепарин белка с каждой подложки. Предусматривают, что стадии любого способа можно проводить в любом порядке. В одном варианте осуществления изобретения стадии проводят последовательно.
Подходящая первая стадия в дополнительном выделении и очистке связывающего гепарин белка обычно обеспечивает концентрирование связывающего гепарин белка и уменьшение объема образца. Например, вторая стадия инкубации, описанная выше, может приводить к большому увеличению объема выделенного связывающего гепарин белка и сопутствующему разведению белка в буфере для повторной укладки. Подходящая первая хроматографическая подложка обеспечивает уменьшение объема выделенного связывающего гепарин белка и может преимущественно обеспечивать некоторую очистку белка от нежелательных загрязняющих белков. Подходящие первые стадии хроматографии включают в себя хроматографические подложки, с которых белок можно элюировать и наносить непосредственно на первую подложку для хроматографии гидрофобного взаимодействия. Например, используют хроматографические подложки, с которых связывающий гепарин белок можно элюировать при высокой концентрации соли, подходящей для нанесения на подложку для хроматографии гидрофобного взаимодействия.
Примерные первые хроматографические подложки включают в себя в качестве неограничивающих примеров подложки для хроматографии на гидроксиапатите, например, CHT керамику типа I и типа II (ранее известную как керамика MacroPrep), Bio-Gel HT, Bio-Gel HTP, Biorad, Hercules, CA и т.д.; хелатирующие металл хроматографические подложки, состоящие из инертной смолы с иммобилизованными ионами металла, такими как медь, никель и т.д.; также как недериватизированные силикагели. В одном варианте осуществления изобретения первые хроматографические подложки для очистки и выделения VEGF представляют собой подложки для хроматографии на гидроксиапатите. В другом варианте осуществления изобретения первые хроматографические подложки для очистки и выделения VEGF представляют собой катионообменные подложки, например, более подробно описанные ниже.
Элюцию с первой хроматографической подложки осуществляют согласно общепринятым в данной области способам. Подходящие условия элюции и буферы будут облегчать нанесение элюированного HPB непосредственно на первую подложку для хроматографии гидрофобного взаимодействия, как описано ниже.
Хроматография гидрофобного взаимодействия хорошо известна в данной области и основана на взаимодействии гидрофобных частей молекулы, взаимодействующих с гидрофобными лигандами, присоединенными к «хроматографическим подложкам». Гидрофобный лиганд, присоединенный к матрице, обозначают по-разному, как хроматографическую подложку HIC, гель HIC или колонку HIC и т.п. Кроме того, принимают во внимание, что сила взаимодействия между белком и колонкой HIC является не только функцией соотношения неполярных к полярным поверхностям белка, но также распределения неполярных поверхностей.
Ряд матриц можно использовать для получения колонок HIC. Наиболее широко используемой является агароза, хотя можно использовать оксид кремния и смолы из органических полимеров. Применимые гидрофобные лиганды включают в себя в качестве неограничивающих примеров алкильные группы, обладающие от приблизительно 2 до приблизительно 10 атомов углерода, такие как группы бутила, пропила или октила, или арила, такого как фенил. Общепринятые подложки HIC для гелей и колонок можно получить коммерчески от поставщиков, например, от GE Healthcare, Uppsala, Sweden под торговыми наименованиями бутил-SEPHAROSE™, фенил-SEPHAROSE™ CL-4B, октил-SEPHAROSE™ FF и фенил-SEPHAROSE™ FF, и от Tosoh Corporation, Tokyo, Japan под торговыми наименованиями TOYOPEARL™ бутил 650M (Fractogel TSK бутил-650) или TSK-GEL фенил 5PW. В одном варианте осуществления очистки и выделения VEGF присутствует первая хроматографическая подложка HIC, а именно, бутил-агароза и вторая гидрофобная хроматографическая подложка, а именно фенил-агароза. В другом варианте осуществления первая хроматографическая подложка HIC представляет собой фенил-агарозу.
Плотность лиганда является важным параметром, то есть он влияет не только на силу взаимодействия белка, но также и на емкость колонки. Плотность лиганда коммерчески доступных фенил- или октилфенил-гелей составляет порядка 5-40 мкмоль/мл подложки геля. Емкость геля является функцией конкретного рассматриваемого белка, также как pH, температуры и концентрации соли, однако, как правило, можно ожидать, что она будет попадать в диапазоне 3-20 мг/мл геля.
Выбор конкретного геля может определить специалист в данной области. Как правило, сила взаимодействия белка и лиганда HIC увеличивается с длиной цепи алкильных лигандов, однако лиганды, обладающие от приблизительно 4 до приблизительно 8 атомов углерода, пригодны для большинства разделений. Фенильная группа обладает почти такой же гидрофобностью, как пентильная группа, хотя избирательность может быть разной из-за возможности π-π взаимодействия с ароматическими группами белка.
Адсорбции белка на колонке HIC благоприятствует высокая концентрация соли, однако действительная концентрация может меняться в широком диапазоне в зависимости от природы белка и конкретного выбранного лиганда HIC. Как правило, концентрация соли межу приблизительно 1 и 4 M является применимой.
Элюцию с подложки HIC либо ступенчатую, либо в форме градиента, можно осуществлять множеством способов, таких как a) изменение концентрации соли, b) изменение полярности растворителя или c) добавление детергентов. Посредством уменьшения концентраций соли адсорбированные белки элюируют в порядке увеличения гидрофобности. Изменения полярности можно вызывать добавлением растворителей, таких как этиленгликоль или изопропанол, таким образом увеличивая силу гидрофобных взаимодействий. Детергенты функционируют как вытеснители белков, и их используют, в первую очередь, применительно к очистке мембранных белков.
Различные анионные компоненты можно присоединять к матрицам для получения подложек для катионной хроматографии. Анионные компоненты включают в себя карбоксиметильные, сульфэтильные группы, сульфопропильные группы, фосфат и сульфонат (S). Целлюлозные ионообменные смолы, такие как SE52, SE53, SE92, CM32, CM52, CM92, P11, DE23, DE32, DE52, EXPRESS ION™ S и EXPRESS ION™ C, доступны из Whatman LTD, Maidstone Kent U.K. Основанные на SEPHADEX™ и SEPHAROSE™ и перекрестно сшитые ионообменники известны также под торговыми наименованиями CM SEPHADEX™ C-25, CM SEPHADEX™ C-50 и SP-SEPHADEX™ C-25, SP-SEPHADEX™ C-50 и SP-SEPHAROSE™ High Performance, SP-SEPHAROSE™ Fast Flow, SP-SEPHAROSE XL, CM-SEPHAROSE™ Fast Flow, и CM-SEPHAROSE™, CL-6B - все доступны из GE Healthcare. Примеры ионообменников для практического осуществления изобретения включают в себя в качестве неограничивающих примеров, например, ионообменники под торговыми наименованиями MACROPREP™, например, такие как подложка MACROPREP™ S, подложка MACROPREP™ High S и подложка MACROPREP™ CM из BioRad, Hercules, CA.
Элюцию с подложек для катионной хроматографии, как правило, осуществляют посредством увеличения концентраций соли. Поскольку элюция с ионных колонок включает в себя добавление соли и поскольку, как упомянуто, HIC увеличивается с концентрацией соли, необязательно, используют введение стадии HIC после ионной стадии или другой стадии соли. В одном варианте осуществления изобретения стадия катионообменной хроматографии предшествует стадии HIC.
Примеры способов очистки VEGF описаны здесь ниже, например, смотри примеры V и VI. После повторной укладки нерастворимый материал в пуле удаляют глубокой фильтрацией. Затем осветленный пул наносят на керамический гидроксиапатит (Bio Rad, Hercules, CA), уравновешенный в 5-мМ HEPPS/0,05% TRITON™ X100/pH 8. Несвязавшийся белок удаляют промывкой буфером для уравновешивания и VEGF элюируют с использованием изократической стадии с 50 мМ HEPPS/0,05% TRITON™ X100/0,15 M фосфатом натрия/pH 8. Пул VEGF наносят на колонку с бутил-SEPHAROSE™ Fast Flow (GE Healthcare, Uppsala, Sweden), уравновешенную в 50 мМ HEPPS/0,05% TRITON™ X100/0,15 M фосфате натрия/pH 8. Колонку промывают буфером для уравновешивания и VEGF собирают в протоке с колонки. Пул после бутил-SEPHAROSE™ наносят на колонку Macro Prep High S (BioRad, Hercules, CA), уравновешенную в 50 мМ HEPES/pH 8. После промывки до фонового поглощения протока при 280 нм колонку промывают двумя объемами колонки 50 мМ HEPES/0,25 M хлорида натрия/pH 8. VEGF элюируют с использованием 8 объемов колонки линейного градиента 0,25-0,75 M хлорида натрия в 50 мМ HEPES/pH 8. Фракции собирают и пулируют те, которые содержат правильно уложенный VEGF, как определяют посредством анализа связывания гепарина.
Пул после Macro Prep High S кондиционируют равным объемом 50 мМ HEPES/0,8 M цитрата натрия/pH 7,5. Затем кондиционированный пул наносят на колонку с фенил 5PW TSK (Tosoh Bioscience LLC, Montgomeryville, PA), уравновешенную 50 мМ HEPES/0,4 M цитратом натрия/pH 7,5. После отмывки несвязавшегося белка с колонки буфером для уравновешивания VEGF элюируют с колонки с использованием 10 объемов колонки градиента 0,4-0 M цитрата натрия в 50 мМ HEPES, pH 7,5. Фракции анализируют посредством SDS-полиакриламидного гель-электрофореза и фракции, содержащие VEGF достаточной чистоты, пулируют.
Экспрессия связывающего гепарин белка в клетках-хозяевах
Коротко, экспрессирующие векторы, способные к автономной репликации и экспрессии белка относительно генома прокариотической клетки-хозяина, вводят в клетку-хозяина. Конструирование подходящих экспрессирующих векторов хорошо известно в данной области, включая нуклеотидные последовательности связывающих гепарин белков, описанных здесь. Смотри, например, Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press (Cold Spring Harbor, New York) (2001); Ausubel et al., Short Protocols in Molecular Biology, Current Protocols John Wiley and Sons (New Jersey) (2002); и Baneyx, (1999) Current Opinion in Biotechnology, 10:411-421. Подходящие прокариотические клетки, включая бактерии, экспрессирующие векторы, коммерчески доступны, например, из Американской коллекции типовых культур (ATCC), Rockville, Maryland. Способы крупномасштабного выращивания прокариотических клеток, и особенно культуры бактериальных клеток, хорошо известны в данной области, и эти способы можно использовать в контексте изобретения.
Например, прокариотические клетки-хозяева трансфицируют экспрессирующими или клонирующими векторами, кодирующими интересующий связывающий гепарин белок, и культивируют в общепринятой питательной среде, модифицированной соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности. Нуклеиновая кислота, кодирующая интересующий полипептид, подходящим образом представляет собой РНК, кДНК или геномную ДНК из любого источника, при условии, что она кодирует интересующий полипептид(ы). Хорошо известны способы отбора соответствующей нуклеиновой кислоты для экспрессии гетерологичных полипептидов (включая их варианты) в микроорганизмах-хозяевах. Молекулы нуклеиновой кислоты, кодирующие полипептид, получают множеством способов, известных в данной области. Например, ДНК, кодирующую VEGF, выделяют и секвенируют, например, с использованием олигонуклеотидных зондов, способных специфически связываться с геном, кодирующим VEGF.
Гетерологичную нуклеиновую кислоту (например, кДНК или геномную ДНК) подходящим образом вставляют в реплицируемый вектор для экспрессии в микроорганизме под контролем подходящего промотора. Множество векторов доступно для данной цели, и выбор подходящего вектора будет зависеть, в основном, от размера нуклеиновой кислоты, подлежащей вставке в вектор, и конкретной клетки-хозяина, подлежащей трансформации вектором. Каждый вектор содержит различные компоненты, в зависимости от конкретной клетки-хозяина, с которой он совместим. В зависимости от конкретного типа хозяина, компоненты вектора, как правило, включают в себя в качестве неограничивающих примеров одно или несколько из следующего: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов, промотор и последовательность терминации транскрипции.
Как правило, плазмидные векторы, содержащие репликон и контрольные последовательности, полученные из видов, совместимых с клеткой-хозяином, используют в связи с микроорганизмами-хозяевами. Вектор обычно несет участок репликации, также как маркерные последовательности, способные обеспечивать фенотипический отбор трансформированных клеток. Например, E. coli, как правило, трансформируют с использованием pBR322, плазмиды, полученной из видов E. coli (смотри, например, Bolivar et al., (1977) Gene, 2: 95). pBR322 содержит гены для устойчивости к ампициллину и тетрациклину и, таким образом, предоставляет простые средства для идентификации трансформированных клеток. Плазмида pBR322, или другая бактериальная плазмида или фаг, также, как правило, содержит промоторы или является модифицированной, чтобы содержать промоторы, которые может использовать хозяин для экспрессии генов селективного маркера.
(i) Сигнальная последовательность
Полипептиды по изобретению можно получать рекомбинантным способом не только напрямую, но также как слитый полипептид с гетерологичным полипептидом, который, как правило, представляет собой сигнальную последовательность или другой полипептид, обладающий участком специфического расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность, как правило, представляет собой последовательность, которую узнает и перерабатывает (т.е. расщепляет посредством сигнальной пептидазы) клетка-хозяин. В случае прокариотических клеток-хозяев, которые не узнают и не перерабатывают сигнальную последовательность природного полипептида, сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбранной, например, из группы из лидеров щелочной фосфатазы, пенициллиназы, lpp, или термостабильного энтеротоксина II.
(ii) Компонент точки начала репликации
Экспрессирующие векторы содержат последовательность нуклеиновой кислоты, позволяющую репликацию вектора в одной или нескольких выбранных клетках-хозяевах. Такие последовательности хорошо известны для множества микроорганизмов. Точка начала репликации из плазмиды pBR322 подходит для большинства грамотрицательных бактерий, таких как E. coli.
(iii) Компонент селективного гена
Экспрессирующие векторы, как правило, содержат селективный ген, также называемый селективным маркером. Этот ген кодирует белок, необходимый для выживания или роста трансформированных клеток-хозяев, выращиваемых на селективной культуральной среде. Клетки-хозяева, не трансформированные вектором, содержащим селективный ген, не будут выживать в культуральной среде. Это селективный маркер отделяют от генетических маркеров, как используют и определяют по этому изобретению. Типичные селективные гены кодируют белки, которые (a) придают устойчивость к антибиотикам или другим токсинам, например ампициллину, неомицину, метотрексату или тетрациклину, (b) комплементируют виды ауксотрофной недостаточности, отличные от обусловленных присутствием генетического маркера (маркеров), или (c) предоставляют критические питательные добавки, не доступные из комплексной среды, например, ген, кодирующий D-аланин рацемазу, в случае Bacilli.
В одном из примеров схемы отбора используют лекарственное средство для ареста роста клетки-хозяина. В этом случае клетки, успешно трансформированные интересующей нуклеиновой кислотой, производят полипептид, придающий устойчивость к лекарственному средству и, таким образом, выживают при режиме отбора. В примерах такого доминантного отбора используют лекарственные средства неомицин (Southern et al., (1982) J. Molec. Appl. Genet.. 1: 327), микофеноловую кислоту (Mulligan et al., (1980) Science 209: 1422) или гигромицин (Sugden et al., (1985) Mol. Cell. Biol., 5: 410-413). В трех примерах, приведенных выше, применяют бактериальные гены под эукариотическим контролем для придания устойчивости к соответствующему лекарственному средству G418 или неомицину (генетицину), xgpt (микофеноловой кислоте), или гигромицину соответственно.
(iv) Компонент промотора
Экспрессирующий вектор для продукции интересующего связывающего гепарин белка содержит подходящий промотор, распознаваемый организмом-хозяином, и функционально связанный с нуклеиновой кислотой, кодирующей интересующий полипептид. Промоторы, подходящие для использования с прокариотическими хозяевами, включают в себя промоторные системы бета-лактамазы и лактозы (Chang et al., (1978) Nature, 275: 615; Goeddel et al., (1979) Nature, 281: 544), промоторную систему арабинозы (Guzman et al., (1992) J. Bacteriol., 174: 7716-7728), щелочной фосфатазы, промоторную систему триптофана (trp) (Goeddel, (1980) Nucleic Acids Res.. 8: 4057 и EP 36,776) и гибридные промоторы, такие как промотор tac (deBoer et al., (1983) Proc. Natl. Acad. Sci. USA, 80: 21- 25). Однако пригодны другие известные бактериальные промоторы. Их нуклеотидные последовательности опубликованы, таким образом, обеспечивая специалисту в данной области возможность функционально лигировать их с ДНК, кодирующей интересующий полипептид (Siebenlist et al, (1980) Cell, 20: 269), с использованием линкеров или адаптеров для предоставления любых требуемых участков рестрикции. Смотри также, например, Sambrook et al., supra; и Ausubel et al., supra.
Промоторы для использования в бактериальных системах также, как правило, содержат последовательность Шайна-Дальгарно (S.D.), функционально связанную с ДНК, кодирующую интересующий полипептид. Промотор можно вырезать из бактериального источника ДНК посредством расщепления ферментом рестрикции и вставлять в вектор, содержащий желаемую ДНК.
(v) Конструирование и анализ векторов
Конструирование подходящих векторов, содержащих один или несколько перечисленных выше компонентов, включает в себя общепринятые способы лигирования. Выделенные плазмиды или фрагменты ДНК расщепляют, подготавливают и повторно лигируют в форме, желательной для получения требуемых плазмид.
Для анализа для подтверждения правильных последовательностей в сконструированных плазмидах смеси после лигирования используют для трансформации E. coli K12 штамма 294 (ATCC 31446) или других штаммов, и успешные трансформанты отбирают по устойчивости к ампициллину или тетрациклину, когда это целесообразно. Плазмиды из трансформантов выделяют, анализируют посредством расщепления рестрикционной эндонуклеазой и/или секвенируют способом Sanger et al., (1977) Proc. Natl. 5 Acad. Sci. USA, 74: 5463-5467 или Messing et al., (1981) Nucleic Acids Res.. 9: 309, или способом Maxam et al., (1980) Methods in Enzvmology, 65: 499. Смотри также, например, Sambrook et al., supra; и Ausubel et al., supra.
Нуклеиновую кислоту, кодирующую интересующий связывающий гепарин белок, вводят в клетки-хозяева. Как правило, это осуществляют посредством трансформации клеток-хозяев с помощью вышеописанных экспрессирующих векторов и культивирования в общепринятой питательной среде, модифицированной соответствующим образом для индукции различных промоторов.
Культивирование клеток-хозяев
Подходящие прокариотические клетки для использования для экспрессии интересующих связывающих гепарин белков хорошо известны в данной области. Как правило, используют клетки-хозяева, обильно экспрессирующие рекомбинантный белок в форме телец включения или в периплазматическом или внутриклеточном пространстве. Подходящие прокариоты включают в себя бактерии, например, эубактерии, такие как грамотрицательные или грамположительные организмы, например E. coli, Bacilli, такие как B. subtilis, виды Pseudomonas, такие как P. aeruginosa, Salmonella typhimurium, или Serratia marcescens. Одним из примеров хозяина - E. сoli является E. coli 294 (ATCC 31446). Пригодны также другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Эти примеры являются скорее иллюстративными, чем ограничивающими. Штамм W3110 является типичным хозяином, поскольку он является общепринятым штаммом для ферментации продукта рекомбинантной ДНК. В одном аспекте изобретения клетка-хозяин должна секретировать минимальные количества протеолитических ферментов. Например, штамм W3110 можно модифицировать для получения генетических мутаций в генах, кодирующих белки, и примеры таких хозяев включают в себя E. coli W3110 штаммы 1A2, 27A7, 27B4 и 27C7, описанные в патенте США No. 5410026, выданном 25 апреля 1995. Например, штамм для продукции VEGF представляет собой E. coli штамм W3110, обладающий генотипом tonAΔ ptr3 phoAΔE15 Δ (argF-lac) 169 degP41 ilvg, обозначенным 49B3. В другом примере штамм для продукции VEGF представляет собой штамм E. coli (62A7), обладающий генотипом ΔfhuA (ΔtonA)ptr3, lacI q , lacL8, ΔompT A(nmpC-fepE) ΔdegP ilvG + . Смотри также, например, таблицу на страницах 23-24 WO2004/092393.
Прокариотические клетки, используемые для продукции интересующего связывающего гепарин белка, выращивают в среде, известной в данной области и подходящей для культивирования выбранных клеток-хозяев, включая среду, в основном, описанную Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press (Cold Spring Harbor, New York) (2001). Среды, пригодные для бактерий, включают в себя в качестве неограничивающих примеров среду AP5, питательный бульон, среду Лурия-Бертани (LB), минимальную среду Neidhardt и минимальную или полную среду C.R.A.P. плюс необходимые питательные добавки. В конкретных вариантах осуществления среда содержит также селективное средство, выбранное на основании конструкции экспрессирующего вектора, чтобы избирательно позволять рост прокариотических клеток, содержащих экспрессирующий вектор. Например, ампициллин добавляют к среде для роста клеток, экспрессирующих ген устойчивости к ампициллину. Любые необходимые добавки, помимо источников углерода, азота и неорганического фосфата, также можно включать в соответствующих концентрациях, вводить по отдельности или в виде смеси с другой добавкой или средой, такой как комплексный источник азота. Необязательно, культуральная среда может содержать одно или несколько восстанавливающих средств, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолята, дитиоэритрита и дитиотреитола.
Примеры подходящей среды приведены в патентах США No. 5304472 и 5342763. Ограниченная по фосфату среда C.R.A.P. состоит из 3,57 г (NH4)2(SO4), 0,71 г Na цитрата-2H2O, 1,07 г KCl, 5,36 г дрожжевого экстракта (сертифицированного), 5,36 г HycaseSF™-Sheffield, pH доводят с помощью KOH до 7,3, qs объем доводят до 872 мл с помощью H2O и автоклавируют; охлаждают до 55°C и дополняют 110 мл 1 M MOPS pH 7,3, 11 мл 50% глюкозы, 7 мл 1M MgSO4). Затем можно добавлять карбенициллин к индуцируемой культуре в концентрации 50 мкг/мл.
Прокариотические клетки-хозяева культивируют при подходящих температурах. Например, для выращивания E. coli температура находится в диапазоне, например, от приблизительно 20°C до приблизительно 39°C, или от приблизительно 25°C до приблизительно 37°C, или приблизительно 30°C.
При применении промотора щелочной фосфатазы клетки E. coli, применяемые для продукции интересующего полипептида по этому изобретению, культивируют в подходящей среде, в которой промотор щелочной фосфатазы можно частично или полностью индуцировать, как описано, в основном, например, в Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press (Cold Spring Harbor, New York) (2001). Культивирование никогда не должно иметь место в отсутствие неорганического фосфата или при уровнях голодания по фосфату. Сначала среда содержит неорганический фосфат в количестве, превышающем уровень индукции синтеза белка и достаточном для роста бактерий. По мере того как клетки растут и утилизируют фосфат, они снижают уровень фосфата в среде, таким образом, вызывая индукцию синтеза полипептида.
Если промотор представляет собой индуцируемый промотор, чтобы происходила индукция, клетки, как правило, культивируют до достижения конкретной оптической плотности, например, A550 около 200 с использованием способа с высокой плотностью клеток, и в этой точке инициируют индукцию (например, добавлением индуктора, истощением компонента среды и т.д.) для индукции экспрессии гена, кодирующего интересующий полипептид.
Любые необходимые добавки также можно включать в подходящих концентрациях, известных специалистам в данной области, вводить по отдельности или в смеси с другой добавкой или средой, такой как комплексный источник азота. pH среды может представлять собой любой pH от приблизительно 5-9, в основном, в зависимости от организма-хозяина. Для E. coli pH составляет, например, от приблизительно 6,8 до приблизительно 7,4, или приблизительно 7,0.
Составы связывающих гепарин белков
Полипептид, выделенный, например, с использованием способов, описанных здесь, можно составлять в фармацевтически приемлемом носителе и использовать для различных диагностических, терапевтических или других применений, известных для таких молекул. Например, VEGF, описанный здесь, можно использовать в иммуноанализах, таких как ферментные иммуноанализы. Предусматривают также терапевтические применения для связывающих гепарин белков, полученных с использованием способов, описанных здесь. Например, фактор роста или гормон, например, VEGF, можно использовать для усиления роста, как желательно. Например, VEGF можно использовать для стимуляции заживления ран, например, тяжелой раны (например, ожога, хирургической раны, обычной раны и т.д.) или хронической раны (например, диабетической язвы, пролежневой язвы, пролежня, трофической язвы и т.д.), для стимуляции роста волос, для стимуляции роста и восстановления тканей (например, кости, печени и т.д.) и т.д.
Терапевтические составы связывающих гепарин белков получают для хранения посредством смешивания молекулы, например, полипептида, обладающей желаемой степенью чистоты, с необязательными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 18th edition, Gennaro, A. Ed. (1995)), в форме лиофилизированных составов или водных растворов. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают в себя буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензэтония; фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и m-крезол); низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие средства, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы с металлом (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
В конкретных вариантах осуществления составы, подлежащие введению in vivo, являются стерильными. Это легко осуществляют фильтрованием через стерильные мембраны для фильтрации. HBP можно хранить в лиофилизированной форме или в форме водного раствора или геля. pH препаратов HBP может составлять, например, приблизительно 5-8, хотя более высокие или более низкие значения pH также могут являться подходящими в определенных случаях. Будет понятно, что использование определенных наполнителей, носителей или стабилизаторов может приводить к формированию солей HBP.
Как правило, для заживления ран HBP составляют для сайт-специфической доставки. При местном применении HBP подходящим образом объединяют с другими ингредиентами, такими как носители и/или адъюванты. Не существует ограничений по природе таких других ингредиентов, за исключением того, что они должны быть фармацевтически приемлемыми и эффективными для предназначенного для них введения и не могут значительно снижать активность активных ингредиентов композиции. Примеры подходящих носителей включают в себя мази, кремы, гели, спреи или суспензии, с очищенным коллагеном или без. Композициями, необязательно, в жидкой или полужидкой форме, можно также пропитывать стерильные повязки, трансдермальные пластыри, пластыри и повязки.
Для получения гелевого состава HBP, составленный в жидкой композиции, можно смешивать с эффективным количеством водорастворимого полисахарида или синтетического полимера, такого как полиэтиленгликоль, для получения геля подходящей вязкости для местного применения. Полисахарид, который можно использовать, включает в себя, например, производные целлюлозы, такие как этерифицированные производные целлюлозы, включая алкилцеллюлозы, гидроксиалкилцеллюлозы и алкилгидроксиалкилцеллюлозы, например, метилцеллюлозы, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу и гидроксипропилцеллюлозу; крахмал и фракционированный крахмал; агар; альгиновую кислоту и альгинаты; гуммиарабик; пуллулан; агарозу; каррагинан; декстраны; декстрины; фруктаны; инулин; маннан; ксиланы; арабинаны; хитозаны; гликогены; глюканы; и синтетические биополимеры; так же как смолы, такие как ксантановую смолу; гуаровую камедь; камедь бобов рожкового дерева; гуммиарабик; трагакантовую камедь; и камедь карайи; и производные и их смеси. В конкретных вариантах осуществления изобретения желирующее средство здесь представляет собой средство, которое, например, является инертным в биологических системах, нетоксичным, простым для получения и/или не является слишком текучим или вязким, и не будет дестабилизировать HBP, заключенный внутри него.
В конкретных вариантах осуществления полисахарид представляет собой этерифицированное производное целлюлозы, в другом варианте осуществления один из полисахаридов, четко определенных, очищенных и перечисленных в USP, например, производные метилцеллюлозы и гидроксиалкилцеллюлозы, такие как гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилметилцеллюлоза. В одном варианте осуществления метилцеллюлоза представляет собой полисахарид. Если метилцеллюлозу применяют, например, в геле, она, как правило, составляет приблизительно 2-5%, или приблизительно 3%, или приблизительно 4%, или приблизительно 5% геля, и HBP присутствует в количестве приблизительно 300-1000 мг на мл геля.
Полиэтиленгликоль, применяемый для гелеобразования, как правило, представляет собой смесь низко- и высокомолекулярных полиэтиленгликолей для получения соответствующей вязкости. Например, смесь полиэтиленгликоля молекулярной массы 400-600 с полиэтиленгликолем молекулярной массы 1500 будет эффективной для этой цели при смешивании в соответствующем соотношении для получения пасты.
Термин «водорастворимый», как применяют к полисахаридам и полиэтиленгликолям, предназначен, чтобы включать коллоидные растворы и дисперсии. Как правило, растворимость производных целлюлозы определяется степенью замещения эфирных групп, и стабилизированные производные, применяемые здесь, должны обладать достаточным количеством таких эфирных групп на единицу ангидроглюкозы в цепи целлюлозы, чтобы сделать производные водорастворимыми. Степень эфирного замещения по меньшей мере 0,35 эфирных групп на единицу ангидроглюкозы, как правило, является достаточной. Кроме того, производные целлюлозы могут присутствовать в форме солей щелочных металлов, например, солей Li, Na, K или Cs.
Активные ингредиенты можно также заключать в микрокапсулы или препараты с замедленным высвобождением. Смотри, например, Remington's Pharmaceutical Sciences 18th edition, Gennaro, A. Ed. (1995). Смотри также Johnson et al, Nat. Med.. 2:795-799 (1996); Yasuda, Biomed. Ther.. 27:1221-1223 (1993); Hora et al., Bio/Technology. 8:755-758 (1990); Cleland, "Design and Production of Single Immunization Vaccines Using Polylactide Polyglycolide Microsphere Systems," in Vaccine Design: The Subunit and Adjuvant Approach, Powell and Newman, eds, (Plenum Press: New York, 1995), pp. 439-462; WO 97/03692, WO 96/40072, WO 96/07399; Патент США No. 5654010; DE 3218121; Epstein et al., (1985) Proc. Natl. Acad. Sci. USA. 82: 3688-3692; Hwang et al., (1980) Proc. Natl. Acad. Sci. USA. 77: 40304034; EP 52322; EP 36676; EP 88046; EP 143949; EP 142641; патентную заявку Японии 83-118008; Патенты США No. 4485045 и 4544545; и EP 102324.
Следующие примеры представлены с целью иллюстрации, а не с целью ограничения.
ПРИМЕРЫ
ПРИМЕР 1: Рекомбинантный VEGF человека, экспрессированный в Escherichia coli
Рекомбинантный VEGF человека экспрессировали в Escherichia coli. Во время синтеза белок секретировался в периплазматическом пространстве и накапливался в виде оптически плотных телец. Соответственно, проводили исследования для достижения выделения и повторной укладки белка. Эти исследования выявили, что по меньшей мере 3 вида VEGF (Фигура 1) выделили с использованием общепринятых способов выделения без добавления полианионного средства. Исследования с нативным VEGF показали, что добавление гепарина увеличивало устойчивость к денатурации, вызванной хаотропным средством и тиолом (Фигура 2). Кроме того, гепарин значительно увеличивал количество правильно, повторно уложенного VEGF в экспериментах по повторной укладке в малом масштабе. Чтобы адаптировать этот результат к крупномасштабному способу, выявили условия, позволяющие повторную укладку VEGF в присутствии декстрансульфата, молекулы, структурно аналогичной гепарину. Добавление декстрансульфата улучшало выходы правильно уложенного биологически активного VEGF в 3-5 раз относительно контролей.
Методы
Плазмида для экспрессии VEGF 165 - Плазмиду pVEGF171 сконструировали для экспрессии VEGF165 человека (смотри, например, Leung et al, (1989) Science, 246:1306-1309) в периплазме E. coli. Транскрипцию кодирующей последовательности VEGF помещали под жесткий контроль промотора щелочной фосфатазы (AP) (смотри, например, Kikuchi et al., (1981) Nucleic Acids Research, 9:5671-8), тогда как последовательности, необходимые для инициации трансляции, предоставляли посредством области Шайна-Дальгарно trp (смотри, например, Yanofsky et al., (1981) Nucleic Acids Research, 9:6647-68). Кодирующую последовательность VEGF сливали ниже по ходу транскрипции с сигнальной последовательностью бактериального термостабильного энтеротоксина II (STII) (смотри, например, Lee et al., (1983) Infect. Immun. 42:264-8; и Picken et al., (1983) Infect. Immun. 42:269-75) для последующей секреции в периплазму E. coli. Предусматривали модификации кодонов в сигнальной последовательности STII для регуляции уровня трансляции, приводящие к оптимальному уровню накопления VEGF в периплазме (смотри, например, Simmons and Yansura, (1996) Nature Biotechnoloy, 14:629-34). Терминатор транскрипции лямбда (смотри, например, Scholtissek and Grosse, (1987) Nucleic Acids Research 15:3185) локализовали ниже кодона терминации трансляции VEGF. Точку начала репликации и гены устойчивости как к ампициллину, так и к тетрациклину, получали из плазмиды pBR322. Смотри, например, Bolivar et al., (1977) Gene 2:95-113.
Гомогенизация клеток и получение оптически плотных телец - Собранные клетки Escherichia coli замораживали и сохраняли при -70°C. Клетки собирали центрифугированием посредством BTUX (центрифуга, Alfa laval) и замораживанием с использованием BEPEX (крупномасштабный морозильник). Клетки суспендировали в 5 объемах 50 мМ HEPES/150 мМ NaCl/5 мМ ЭДТА pH 7,5 (5 л/кг осадка) и гомогенизировали в лабораторном гомогенизаторе модели 15 M Gaulin 15M (малый масштаб) или M3 (большой масштаб) (Gaulin Corporation, Everett, MA). Затем суспензию клеток разводили равным объемом такого же буфера и собирали оптически плотные тельца посредством центрифугирования в центрифуге с непрерывной загрузкой BTPX 205 (Alfa Laval Separation AB (Tumba, Sweden). В качестве центрифуги среднего масштаба использовали SA1. Альтернативно, клетки можно гомогенизировать и осадок можно собирать непосредственно без замораживания в BEPEX и регидратации.
ПРИМЕР II: Экстракция и повторная укладка рекомбинантного VEGF человека, экспрессированного в Escherichia coli-I
Методы
Экстракция и повторная укладка - Оптически плотный осадок суспендировали в буфере для экстракции, содержащем 7 M мочевину/50 мМ HEPPS/pH 8 (конечная концентрация) в 5 л буфера/кг осадка. Затем добавляли твердый дитиотреитол до 3,7 г/кг осадка для конечной концентрации 4 мМ. Смотри, например, на фигуре 9 эффект мочевины и DTT на экстракцию VEGF. Суспензию тщательно перемешивали в течение 1-2 час при 20°C. pH можно доводить с помощью 50% гидроксида натрия (мас./мас.) до pH 8,0. Повторную укладку инициировали посредством добавления 19 объемов буфера для повторной укладки на объем буфера для экстракции. Буфер для повторной укладки содержал 50 мМ HEPPS/1 M-2M мочевину/2-5мМ цистеин / 0,05%-0,2% TRITON™ X100/pH 8, конечная концентрация. Смотри, например, на фигуре 10 эффект концентрации мочевины и DTT, присутствующих во время повторной укладки. Декстрансульфат, гепарин или сульфат натрия добавляли, как указано. Инкубацию для повторной укладки проводили при комнатной температуре в течение 4-24 часов. Необязательно, инкубацию можно проводить при комнатной температуре в течение вплоть до приблизительно 48 часов. Укладку мониторировали посредством SDS-PAGE и/или HPLC с гепарином. Продукт осветляли глубокой фильтрацией с помощью фильтра Cuno 90SP с последующей фильтрацией при 0,45 мкм.
Анализ HPLC связывания гепарина - Количество и качество правильно, повторно уложенного VEGF определяли с использованием колонки, содержащей иммобилизованный гепарин. Колонку POROS HE2/M (4,6×100 мм, HE2/M от PerSeptive BioResearch Products, Cambridge, MA) уравновешивали в 10 мМ фосфате натрия, pH 7, содержащем 0,15 M хлорид натрия. При скорости потока 1 мл/мин или 2 мл/мин проводили элюцию с колонок с использованием линейного градиента от 0,15 M до 2 M хлорида натрия в буфере для уравновешивания в течение 10 мин. В некоторых анализах элюцию проводили в течение 16 мин. Элюент мониторировали при 280 нм. Как правило, большинство белка элюировали в свободном объеме, и можно было идентифицировать 3 класса VEGF. Виды с наивысшей аффинностью, элюированные последними, идентифицировали как правильно уложенный VEGF, и идентифицировали как «Пик 3 VEGF».
Результаты
Гепарин защищает VEGF от опосредованной цистеином денатурации - Добавление 10 мМ цистеина к нативному VEGF приводит к большому уменьшению числа правильно уложенных молекул (Фигура 2). Эту денатурацию предупреждали посредством добавления 2 различных форм гепарина в концентрации настолько низкой, как 20 мМ.
Эффект гепарина и декстрансульфата на повторную укладку VEGF
Эффект сульфата натрия на повторную укладку VEGF
Эффект гепаринов и декстрансульфатов на повторную укладку VEGF
Заключение
Гепарин и декстрансульфат увеличивают выходы повторной укладки - Из-за защитных свойств против денатурации, описанных выше, исследовали эффект нескольких различных форм сульфатированных полимеров на повторную укладку VEGF. Как видно в ТАБЛИЦЕ Ia (и на Фиг. 5), как низко-, так и высокомолекулярные формы гепарина увеличивают выход повторно уложенного VEGF приблизительно в 3 раза. Как видно в ТАБЛИЦЕ Ib (и на фигуре 6), сульфат натрия увеличивал выход повторно уложенного VEGF приблизительно в 2 раза. Форма декстрансульфата 10 кДа также была эффективной для увеличения выходов повторной укладки; однако более высокий исследуемый диапазон концентрации приводил к ингибированию субстрата. Дальнейшие исследования показали, что формы декстрансульфата 5 кДа, 8 кДа и 10 кДа - все значительно увеличивали выход VEGF при повторной укладке (ТАБЛИЦА II). Смотри фигуру 7. Смотри также фигуру 8.
ПРИМЕР III: Эффект различных буферов и TRITON™ X-100 на выделение VEGF
Результаты
Заключение
Объединенные данные из примеров I, II и III показали значительное (2-5-кратное) улучшение выхода посредством включения либо гепаринсульфатов, либо декстрансульфатов при повторной укладке VEGF, связывающего гепарин фактора роста, также как посредством условий выделения. Этот способ успешно осуществляли в индустриальном масштабе. Ожидают, что этот способ является применимым для повторной укладки других основных факторов роста и других белков, связывающих гепарин.
ПРИМЕР IV: Экстракция и повторная укладка рекомбинантного VEGF человека, экспрессированного в Escherichia coli-II
Методы
Экстракция и повторная укладка - Оптически плотный осадок суспендировали в буфере для экстракции, где конечная концентрация составляла: 7M мочевина, 2-30мМ DTT (например, 10мМ DTT), 50мМ HEPPS/pH 7-9 (например, pH 8) в 5 л буфера/кг осадка. Суспензию тщательно перемешивали в течение 1-2 часов при комнатной температуре. Повторную укладку инициировали посредством добавления 19 объемов буфера для повторной укладки на объем буфера для экстракции. Буфер для повторной укладки содержал в качестве конечной концентрации 1M или 1,3M мочевину, 2-15мМ цистеин (например, 7,5мМ цистеин), 0,5мМ DTT, 0-0,75M аргинин (например, 100мМ аргинин), 15 мг/л декстрансульфата, 50мМ HEPPS, 0,05% TRITON™ X100/pH 8. Смотри, например, на фигуре 12 эффект на повторную укладку присутствия заряженных аминокислот, где при добавлении гистидина получили такой же эффект, как без добавлений аминокислот. Инкубацию для повторной укладки проводили при комнатной температуре в течение 12-24 часов. Необязательно, инкубацию можно проводить при комнатной температуре в течение вплоть до приблизительно 48 часов. Необязательно, во время процесса повторной укладки можно добавлять воздух или кислород (0,3-1см3/мин/л). Укладку мониторировали посредством SDS-PAGE и/или HPLC с гепарином. Продукт осветляли глубокой фильтрацией с помощью фильтра Cuno 90SP с последующей фильтрацией при 0,45 мкм.
Общее разведение на стадиях экстракции и повторной укладки составляло 1:100. Увеличение общего разведения на стадиях экстракции и повторной укладки, например, от 1:100 до 1:200, увеличивало общее количество активного VEGF, хотя концентрация является более низкой. Смотри фигуру 13.
Эффективность повторной укладки можно определять посредством определения количества димера/мономера, где мономеры можно определять посредством колонки C18 для обращеннофазовой HPLC, а формирование димера можно определять посредством хроматографии на колонке с гепарином или анализа катионообменной хроматографией на SP-5PW.
ПРИМЕР V: Крупномасштабная повторная укладка
Чтобы тестировать масштабируемость оптимизированных условий повторной укладки, проводили исследования для проверки кинетики повторной укладки в малом (0,1 л), среднем (1 л) и пилотном (250 л - 400 л) масштабе. Как показано на фигуре 4, кинетика повторной укладки в большом масштабе неотличима от кинетики для меньших масштабов, а конечный титр повторно уложенного VEGF немного увеличен. Этими данными показали масштабируемость повторной укладки с декстрансульфатом. Продукт дополнительно осветляли глубокой фильтрацией с помощью фильтра Cuno 90SP с последующей фильтрацией при 0,45 мкм.
ПРИМЕР VI: Очистка I rhVEGF после повторной укладки
Хроматография на керамическом гидроксиапатите MacroPrep - После повторной укладки нерастворимый материал в пуле удаляли глубокой фильтрацией. Затем осветленный пул наносили на колонку с керамическим гидроксиапатитом (35D × 31H= 30л) (Bio Rad, Hercules, CA), уравновешенную 50 мМ HEPPS/0,05% TRITON™ X100/pH 8. Несвязавшийся белок удаляли промывкой буфером для уравновешивания и VEGF элюировали с использованием изократической стадии с 50 мМ HEPPS/0,05% TRITON™ X100/0,15 M фосфатом натрия/pH 8. Скорость потока составляла 120 см/час. Пулированные фракции определяли посредством анализа фракций HPLC с гепарином.
Хроматография на бутил-SEPHAROSE™ Fast Flow - Пул VEGF наносили на колонку с бутил-SEPHAROSE™ Fast Flow (35 D × 26 H=25 л) (GE Healthcare, Uppsala, Sweden), уравновешенную 50 мМ HEPPS/0,05% TRITON™ X100/0,15 M фосфатом натрия/pH 8. Скорость потока составляла 100 см/час. Колонку промывали буфером для уравновешивания и VEGF собирали в протоке с колонки. Фракции собирали и содержащие белок фракции пулировали посредством измерения A280нм.
Хроматография на MacroPrep High S - Пул после бутил-SEPHAROSE™ наносили на колонку Macro Prep High S (30D × 39 H=27 л) (BioRad, Hercules, CA), уравновешенную 50 мМ HEPES/pH 8. После промывки до фонового поглощения протока при 280 нм колонку промывали двумя объемами колонки 50 мМ HEPES/0,25 M хлорида натрия/pH 8. VEGF элюировали с использованием 8 объемов колонки линейного градиента 0,25-0,75 M хлорида натрия в 50 мМ HEPES/pH 8. Скорость протока составляла 75-200 см/час. Фракции собирали и пулировали те, которые содержали правильно уложенный VEGF, как определяли посредством анализа связывания гепарина, например, HPLC с гепарином.
Хроматография на фенил 5PW TSK - Пул после Macro Prep High S кондиционировали равным объемом 50 мМ HEPES/0,8 M цитрата натрия/pH 7,5. Затем кондиционированный пул наносили на колонку с фенил 5PW TSK (18D × 43 H= 11 л) (Tosohaas, Montgomeryville, PA), уравновешенную 50 мМ HEPES/0,4 M цитратом натрия/pH 7,5. После отмывки несвязавшегося белка с колонки буфером для уравновешивания VEGF элюировали с колонки с использованием 10 объемов колонки градиента 0,4-0 M цитрата натрия в 50 мМ HEPES, pH 7,5. Фракции анализировали посредством SDS-полиакриламидного гель-электрофореза и фракции, содержащие VEGF достаточной чистоты, пулировали.
Ультрафильтрация/диафильтрация - Пулированный VEGF подвергали ультрафильтрации на регенерированной целлюлозной мембране 5кДа (G30619); Unit Pellicon; скорость подачи 17,1 л/мин. Мембрану кондиционировали полисорбатом 20. Пулированный VEGF подвергали ультрафильтрации при концентрации 6 г/л (UF1). Образец подвергали диафильтрации 7-14 DV (объемами диафильтрации) 5 мМ сукцината натрия /275 мМ трегалозы/pH 5,0. Конечный состав представлял собой 5 мМ сукцинат натрия /275 мМ трегалоза/0,01% полисорбат 20/pH 5,0, при концентрации 5 мг/мл.
ПРИМЕР VII: Очистка II rhVEGF после повторной укладки
Катионообменная жидкостная хроматография - После повторной укладки нерастворимый материал в пуле можно удалить глубокой фильтрацией. Повторно уложенный пул кондиционировали до pH 5,0-7,5 и приблизительно 2-6,5 мСм/см. В одном варианте осуществления пул кондиционировали до pH 6,5 и 5 мСм/см. Затем повторно уложенный пул можно наносить на колонку с сульфопропилом для предельной нагрузки (SPXL) и элюировать с использованием градиента увеличивающейся концентрации соли. Пулируемые фракции можно определить посредством анализа фракций посредством HPLC с гепарином.
Колонка для гидрофобного взаимодействия (HIC): - Пул VEGF после элюции с SPXL можно кондиционировать до 50 мСм/см для нанесения на колонку для хроматографии с фенил TSK (Tosohaas, Montgomeryville, PA). Собирали фракции и пулировали содержащие белок фракции.
IEX или смешанный способ: - Пул после фенил-TSK можно наносить на колонку для ионообменной хроматографии (IEX) или смешанной хроматографии. Фракции собирали и пулировали те, которые содержали правильно уложенный VEGF, как определяли посредством анализов, описанных здесь.
Ультрафильтрация/диафильтрация - Пулированный VEGF можно подвергать ультрафильтрации на регенерированной целлюлозной мембране 5кДа (G30619); Unit Pellicon; скорость подачи 17,1 л/мин. Например, мембрану кондиционировали полисорбатом 20. Пулированный VEGF подвергали ультрафильтрации при концентрации 6 г/л (UFl). Образец подвергали диафильтрации 7-14 DV (объемами диафильтрации) 5 мМ сукцината натрия /275 мМ трегалозы /pH 5,0.
В способах и процессах, описанных здесь, конечную чистоту и/или активность можно оценивать посредством пептидного картирования, дисульфидного картирования, SDS-PAGE (как восстанавливающего, так и невосстанавливающего), кругового дихроизма, лизата амебоцитов Limulus (LAL), хроматографии с гепарином, HPLC с гепарином (например, HPLC с гепарином можно использовать для определения концентрации димера VEGF), обращеннофазовой (rp) хроматографии HPLC (например, rpHPLC можно использовать для определения концентрации мономера VEGF), связывания гепарина, связывания рецептора (например, для VEGF, связывание рецептора KDR - Bioanalytic R&D, и/или связывание рецептора Flt1), анализа SEC, анализов клеток, анализов активности HUVEC, ELISA с антителами против VEGF, масс-спектрометрического анализа и т.д.
Понятно, что депозиты, примеры и варианты осуществления, описанные здесь, приведены только для иллюстративных целей, и что в свете этого специалисты в данной области могут предложить различные модификации или изменения, и их следует включать в объем и содержание данной заявки и в объем прилагаемой формулы изобретения. Полное содержание всех публикаций, цитат, патентов и патентных заявок, процитированных здесь, таким образом, приведено в качестве ссылки для всех целей.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ ПОВТОРНО СВЕРНУТОГО РЕКОМБИНАНТНОГО БЕЛКА ИЗ КУЛЬТУРЫ ПРОКАРИОТИЧЕСКИХ КЛЕТОК (ВАРИАНТЫ) | 2007 |
|
RU2439076C2 |
| ОЧИСТКА АНТИТЕЛ С ПОМОЩЬЮ КАТИОНООБМЕННОЙ ХРОМАТОГРАФИИ | 2008 |
|
RU2498991C2 |
| СПОСОБЫ ОЧИСТКИ БЕЛКОВ, СОДЕРЖАЩИХ ОБЛАСТЬ Fc | 2006 |
|
RU2415865C2 |
| СПОСОБ ОЧИСТКИ ГЕТЕРОЛОГИЧНОГО ПОЛИПЕПТИДА | 2004 |
|
RU2337968C2 |
| СПОСОБ ПРОМОТИРОВАНИЯ АКТИВНОЙ КОНФОРМАЦИИ ГЛИКОЗИЛИРОВАННОГО РЕКОМБИНАНТНОГО БЕЛКА, СПОСОБ ПОЛУЧЕНИЯ АКТИВНОГО ГЛИКОЗИЛИРОВАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ УКАЗАННОГО БЕЛКА ДЛЯ ВВЕДЕНИЯ ПОТРЕБИТЕЛЮ И/ИЛИ ПАЦИЕНТУ ИЛИ ПОТРЕБЛЕНИЯ ПОТРЕБИТЕЛЕМ И/ИЛИ ПАЦИЕНТОМ | 2002 |
|
RU2316563C2 |
| ГЕПАРАНСУЛЬФАТЫ | 2013 |
|
RU2700877C2 |
| СПОСОБЫ ОЧИСТКИ ПОЛИПЕПТИДОВ | 2011 |
|
RU2594163C2 |
| АНТИТЕЛО ПРОТИВ panNrp (ВАРИАНТЫ) | 2007 |
|
RU2454427C2 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2824045C2 |
| УЛУЧШЕННАЯ ОЧИСТКА БЕЛКА ПОСРЕДСТВОМ МОДИФИЦИРОВАННОГО ЭЛЮИРОВАНИЯ БЕЛКА А | 2010 |
|
RU2571929C2 |
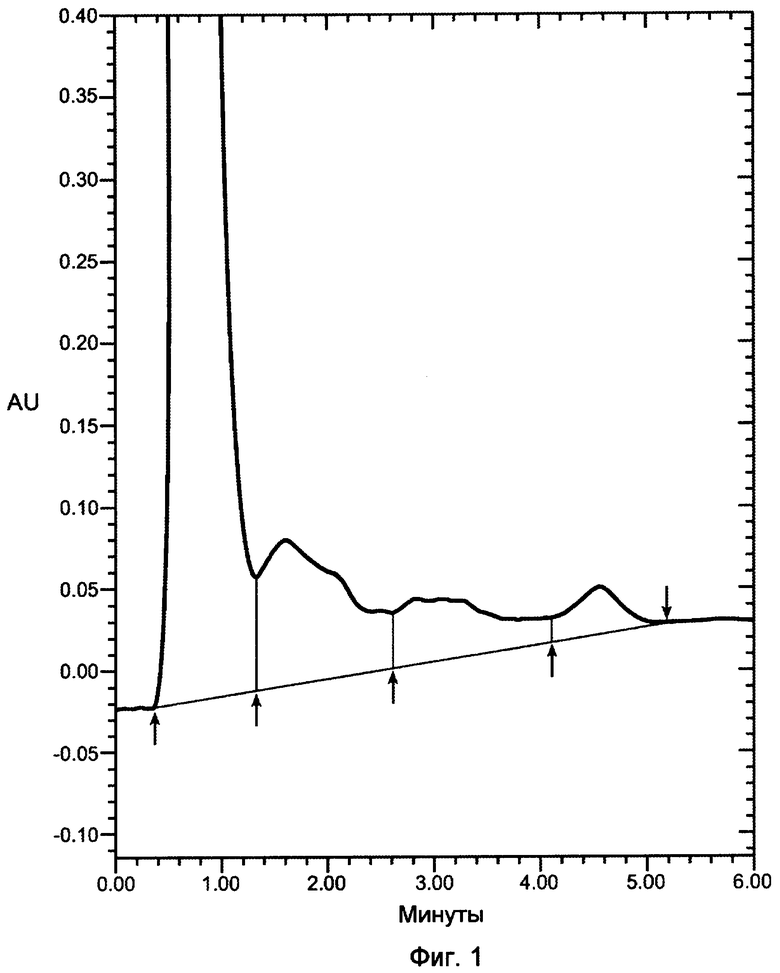
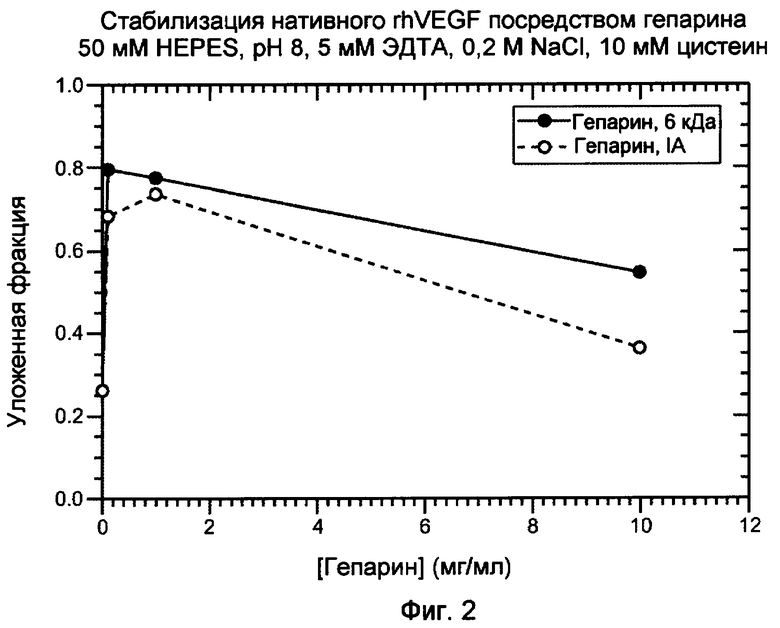
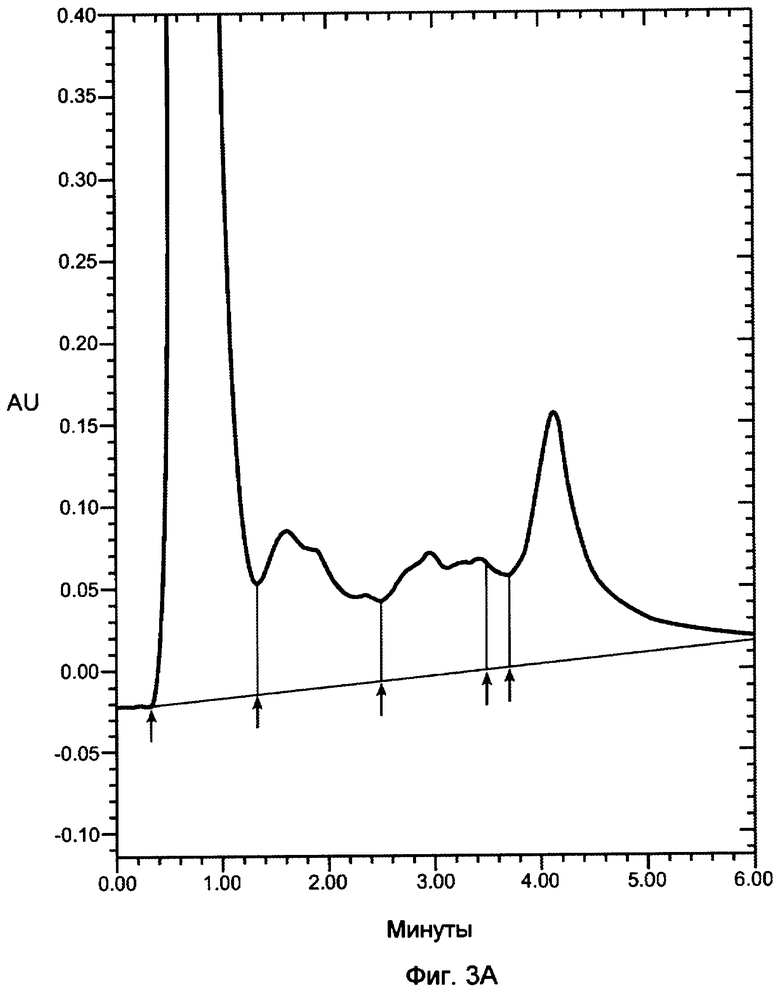
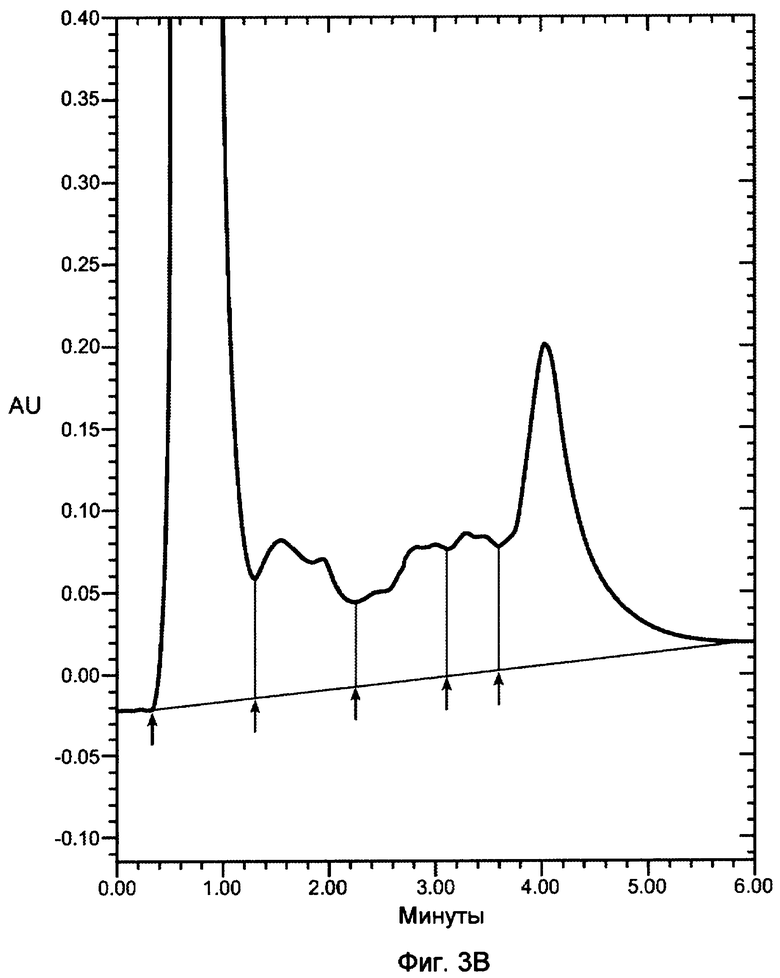
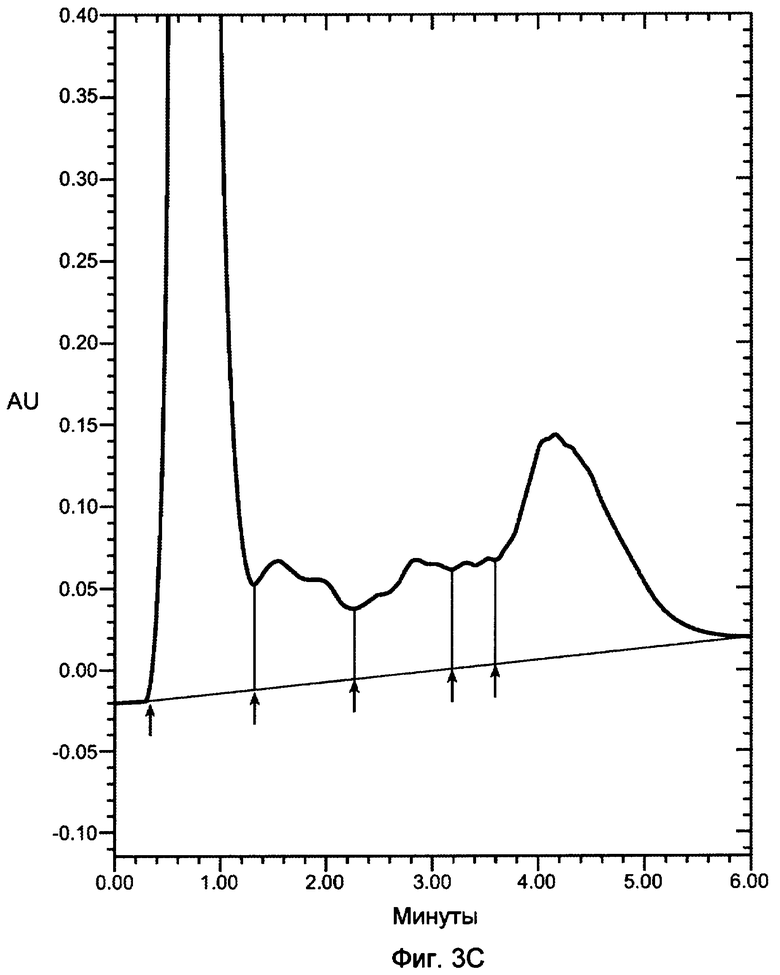
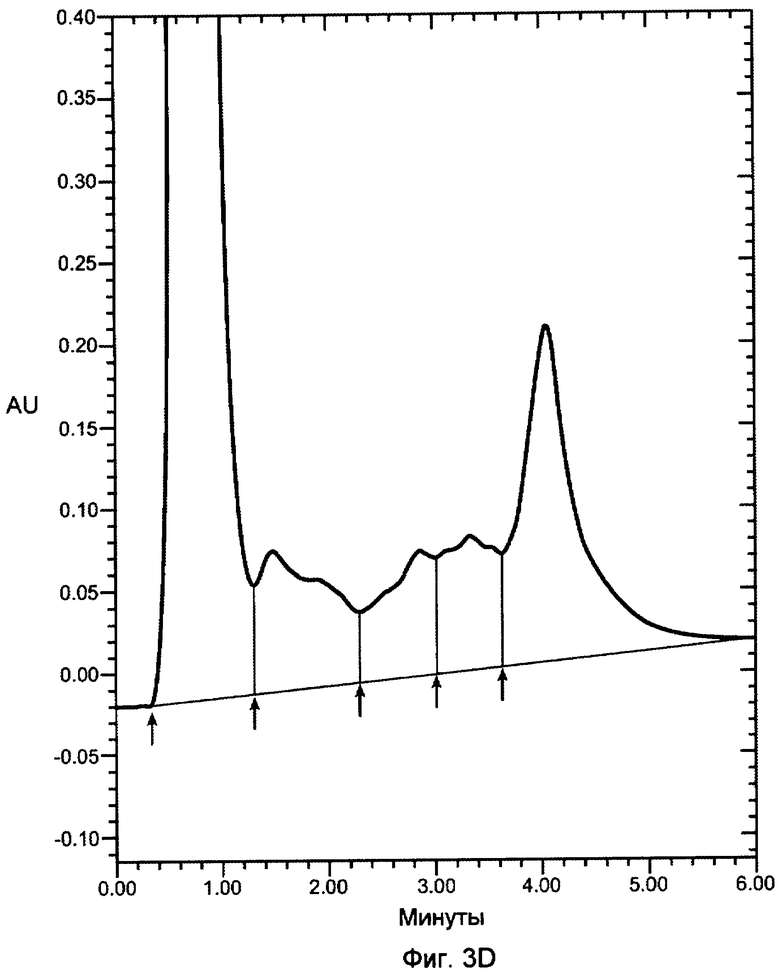
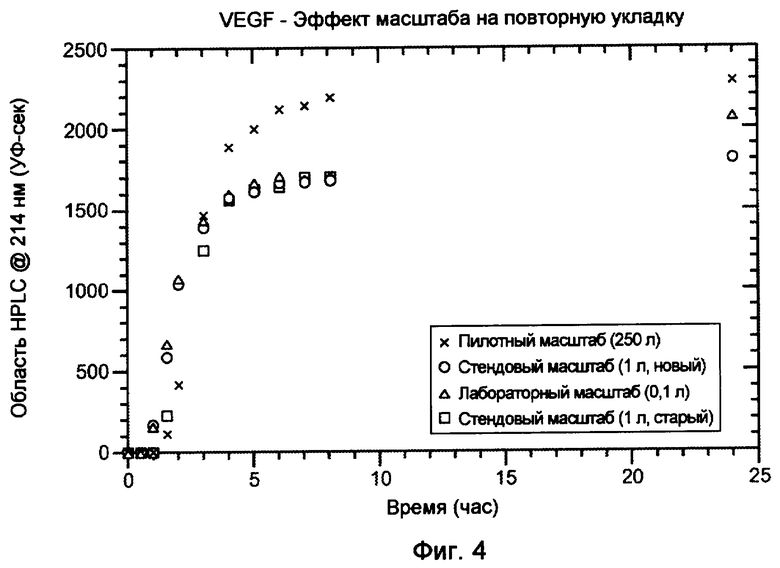
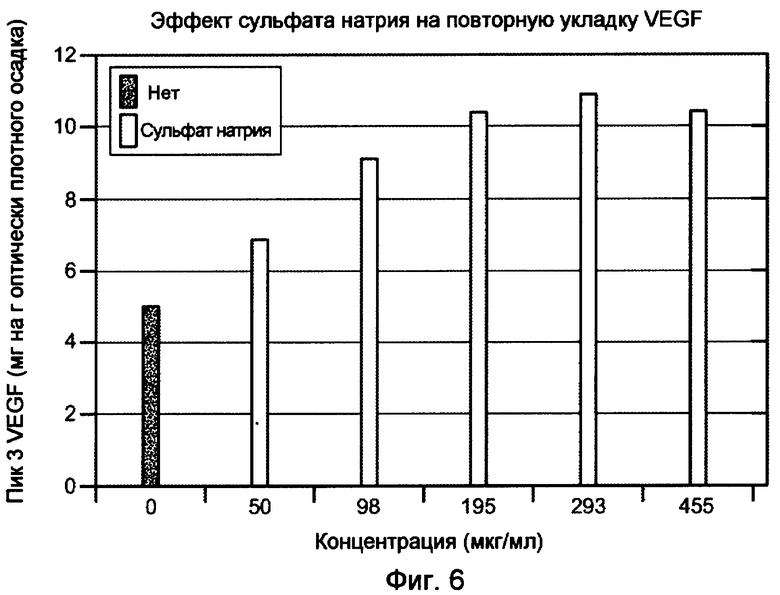
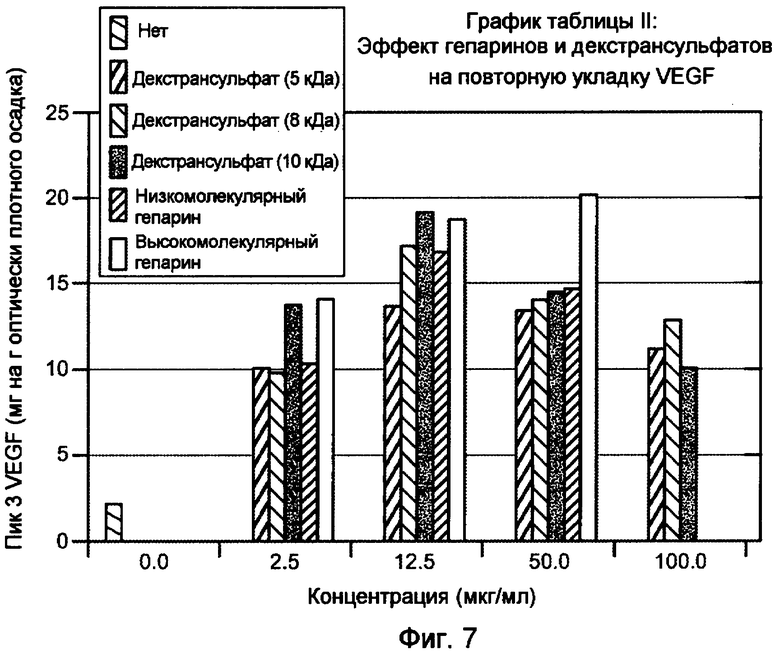
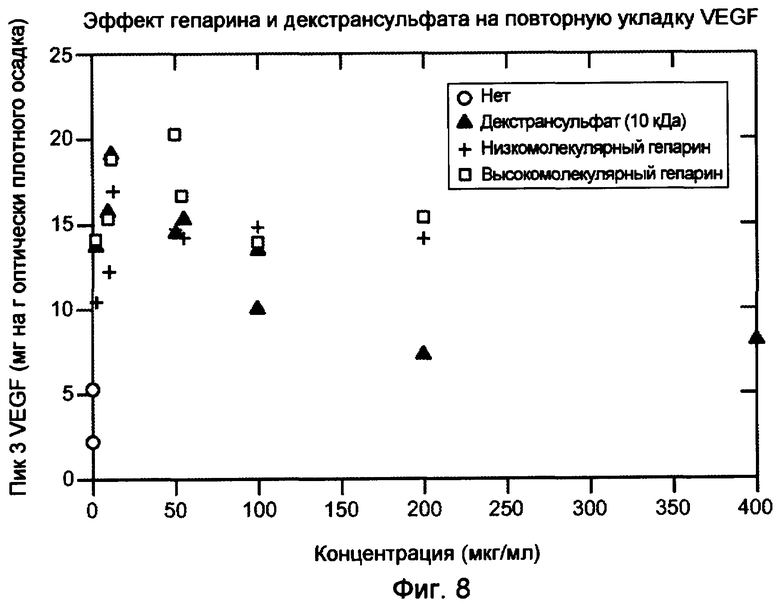
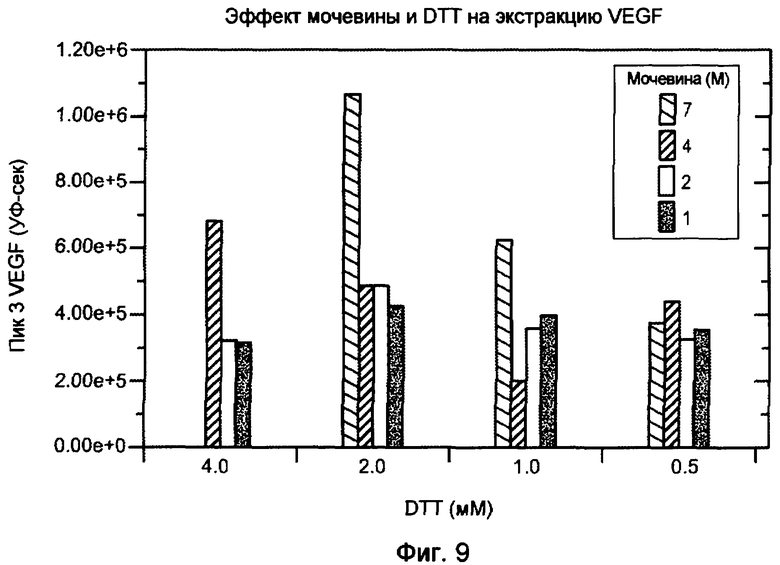
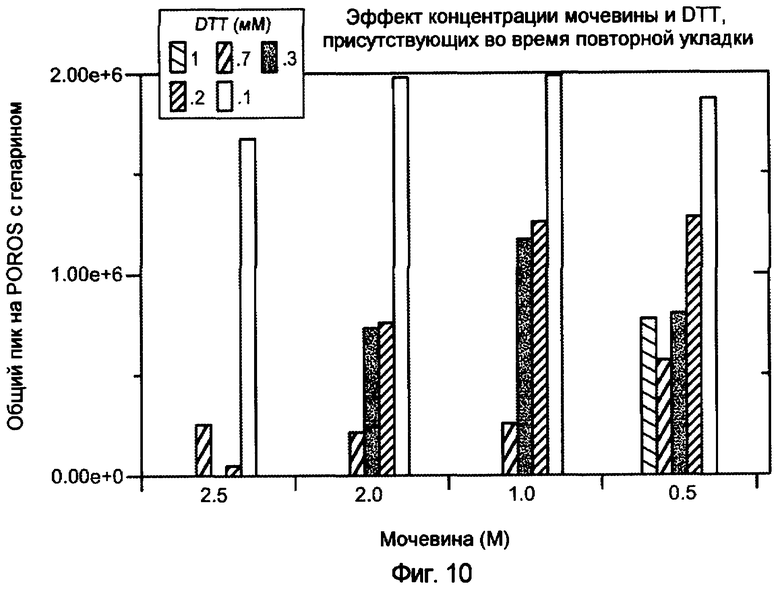
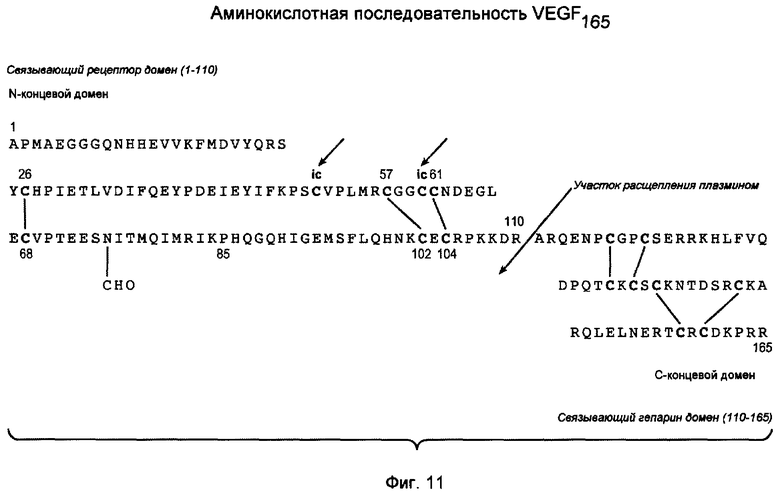
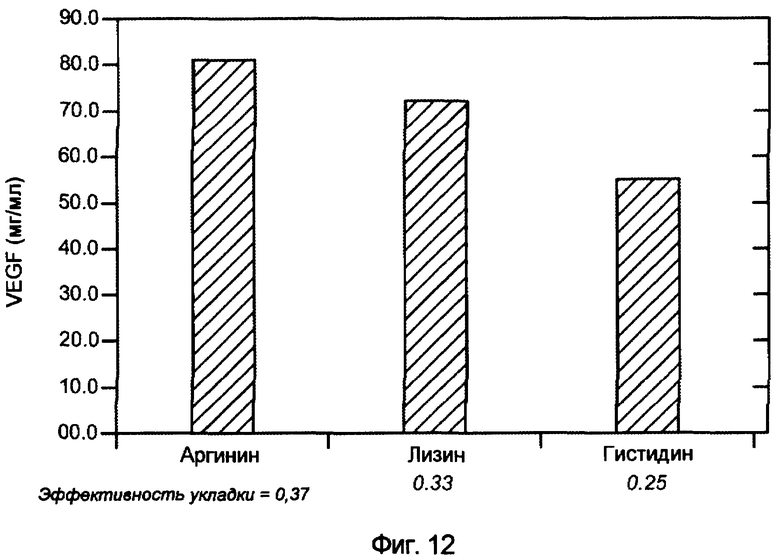
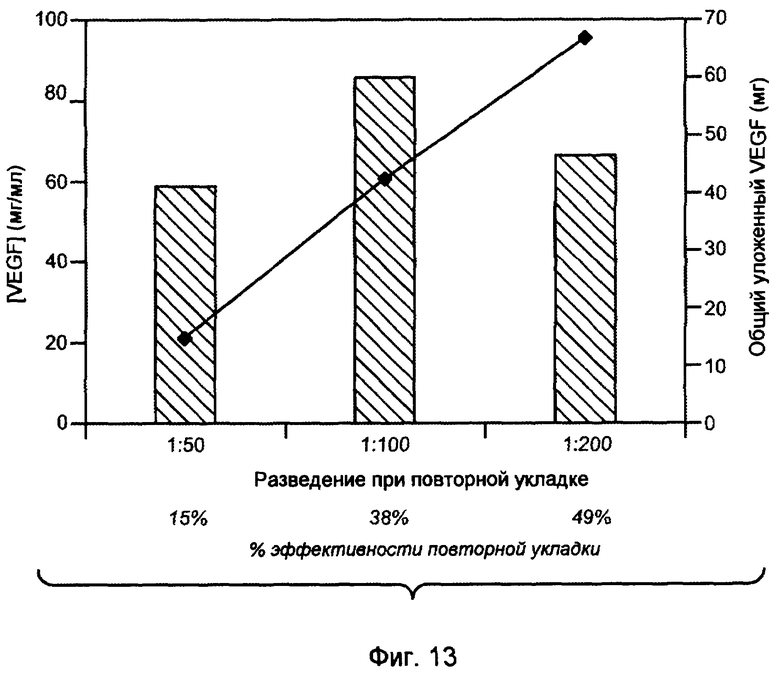
Изобретение относится к биотехнологии. Выделяют связывающий гепарин белок из периплазмы культуры прокариотических клеток. Денатурируют выделенный связывающий гепарин белок в первом буферном растворе, содержащем хаотропное средство и восстанавливающее средство и инкубируют выделенный денатурированный связывающий гепарин белок во втором буферном растворе, содержащем хаотропное средство и сульфатированное полианионное средство, где указанное сульфатированное полианионное средство представляет собой декстрансульфат или сульфат натрия, в течение такого времени и при таких условиях, что происходит повторная укладка связывающего гепарин белка. Изобретение позволяет получать повторно уложенный связывающий гепарин белок, где имеет место приблизительно 2-5-кратное увеличение количества полученного повторно уложенного связывающего гепарин белка по сравнению с инкубацией без сульфатированного полианионного средства. 2 н. и 10 з.п. ф-лы, 13 ил., 3 табл.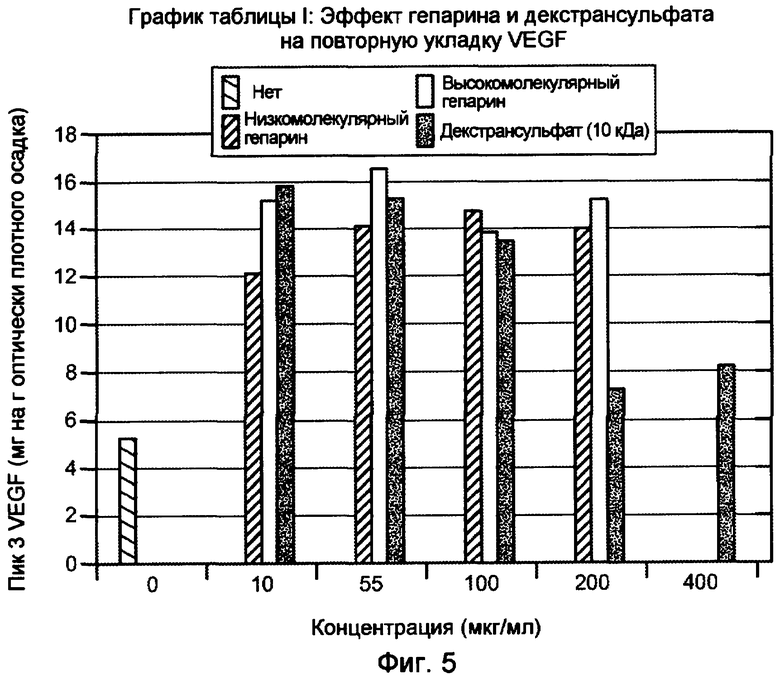
1. Способ получения связывающего гепарин белка из культуры прокариотических клеток, где указанный связывающий гепарин белок представляет собой связывающий гепарин фактор роста эндотелия сосудов (VEGF), причем способ включает в себя стадии
(a) выделения указанного связывающего гепарин белка из периплазмы указанной культуры прокариотических клеток;
(b) денатурации указанного выделенного связывающего гепарин белка в первом буферном растворе, содержащем хаотропное средство и восстанавливающее средство;
(c) инкубации указанного выделенного денатурированного связывающего гепарин белка во втором буферном растворе, содержащем хаотропное средство и сульфатированное полианионное средство, где указанное сульфатированное полианионное средство представляет собой декстрансульфат или сульфат натрия, в течение такого времени и при таких условиях, что происходит повторная укладка связывающего гепарин белка; и
(а) получения указанного повторно уложенного связывающего гепарин белка, где имеет место приблизительно 2-5-кратное увеличение количества полученного повторно уложенного связывающего гепарин белка по сравнению с инкубацией без сульфатированного полианионного средства.
2. Способ по п.1, где VEGF представляет собой VEGF165.
3. Способ по п.1, где декстрансульфат составляет приблизительно между 3000 и 10000 дальтон.
4. Способ по п.1, где декстрансульфат составляет приблизительно между 8000 и 10000 дальтон.
5. Способ по п.1, где указанные первый и второй буферные растворы содержат HEPPS рН 8,0.
6. Способ по п.1, где концентрация сульфата натрия составляет приблизительно 50-500 мМ.
7. Способ по п.1, где указанный второй буферный раствор дополнительно содержит
(i) восстанавливающее средство;
(ii) неионный детергент; или (iii) аргинин и/или лизин.
8. Способ по п.11, где восстанавливающее средство из второго буферного раствора содержит сочетание цистеина и DTT.
9. Способ по п.1, где указанная стадия выделения (d) включает в себя
(i) последовательное приведение указанного повторно уложенного связывающего гепарин белка в контакт с подложкой для хроматографии на гидроксиапатите, первой подложкой для хроматографии гидрофобного взаимодействия; с подложкой для катионной хроматографии и второй подложкой для хроматографии гидрофобного взаимодействия, и избирательную элюцию связывающего гепарин белка с каждой подложки; или
(ii) последовательное приведение указанного повторно уложенного связывающего гепарин белка в контакт с катионообменной подложкой; с подложкой для хроматографии гидрофобного взаимодействия и с подложкой для ионообменной хроматографии, и избирательную элюцию связывающего гепарин белка с каждой подложки.
10. Способ по п.9(i), где указанные первая и вторая подложки для хроматографии гидрофобного взаимодействия выбраны из группы, состоящей из бутил-, пропил-, октил- и арилагарозных смол.
11. Способ по п.9(i), где указанная первая подложка для хроматографии гидрофобного взаимодействия представляет собой бутилагарозную подложку, и указанная вторая подложка для хроматографии гидрофобного взаимодействия представляет собой подложку из фенилагарозной смолы.
12. Способ получения связывающего гепарин белка из культуры прокариотических клеток, где указанный связывающий гепарин белок представляет собой связывающий гепарин фактор роста эндотелия сосудов (VEGF), причем способ включает в себя стадии
(a) выделения указанного связывающего гепарин белка из периплазмы указанной культуры прокариотических клеток;
(b) денатурации указанного выделенного связывающего гепарин белка в первом буферном растворе, содержащем хаотропное средство и восстанавливающее средство;
(c) инкубации указанного денатурированного связывающего гепарин белка во втором буферном растворе, содержащем хаотропное средство и сульфатированное полианионное средство, где указанное сульфатированное полианионное средство представляет собой декстрансульфат или сульфат натрия, в течение такого времени и при таких условиях, что происходит повторная укладка связывающего гепарин белка, где имеет место приблизительно 2-5-кратное увеличение количества полученного повторно уложенного связывающего гепарин белка по сравнению с инкубацией без сульфатированного полианионного средства; и
(d) последовательного приведения указанного повторно уложенного связывающего гепарин белка в контакт с
(i) подложкой для хроматографии на гидроксиапатите, первой подложкой для хроматографии гидрофобного взаимодействия, подложкой для катионной хроматографии и второй подложкой для хроматографии гидрофобного взаимодействия, и избирательной элюции связывающего гепарин белка с каждой подложки; или
(ii) катионообменной подложкой; подложкой для хроматографии гидрофобного взаимодействия и подложкой для ионообменной хроматографии, и избирательной элюции связывающего гепарин белка с каждой подложки.
| WO 9524473 A1, 14.09.1995 | |||
| СВЯЗЫВАЮЩИЙ ГЕПАРИН БЕЛОК ДЛЯ ЛЕЧЕНИЯ СЕПСИСА | 1995 |
|
RU2200573C2 |
Авторы
Даты
2010-04-10—Публикация
2006-12-19—Подача