Данное изобретение относится к аналитической химии и предназначено для экспресс-анализа концентрации ионов в водных растворах электролитов.
Известен фотоколориметрический способ анализа концентрации ингредиентов растворов электролитов (Ляликов Ю.С. Физико-химические методы анализа. М.: Химия, 1974, - 536 с.) [1].
Способ основан на том, что определяемый ингредиент раствора образует с реактивом комплексное соединение, имеющее яркую окраску. Интенсивность окраски пропорциональна концентрации определяемого вещества. Для определения концентрации необходимо определить оптическую плотность раствора. По изменению интенсивности излучения источника света на входе и выходе кюветы с исследуемой пробой, согласно закону Бугера-Ламберта-Бэра оптическую плотность раствора определяют по формуле
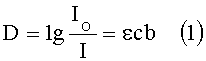
где D - оптическая плотность раствора,
IO - интенсивность излучения на входе кюветы с исследуемым веществом,
I - интенсивность излучения на ее выходе,
с - концентрация исследуемого вещества,
b - толщина поглощающего слоя,
ε - молярный коэффициент поглощения.
Оценку производят визуально путем сравнения со стандартной шкалой или с помощью фотоколориметра.
Однако данный способ контроля трудоемок и требует больших затрат времени.
Задачей предлагаемого способа является уменьшения трудоемкости и снижение временных затрат.
Поставленная задача достигается тем, что в известном способе определения концентрации ионов электролитов, заключающемся в том, что определяют концентрации катионов и анионов, согласно изобретению концентрацию катионов определяют путем пропускания раствора электролита через катионообменную смолу в Н-форме и сравнивают концентрацию ионов водорода исходного раствора и концентрацию ионов водорода раствора, пропущенного через катионообменную смолу и по разнице значений концентрации ионов водорода исходного и конечного растворов с учетом валентности катионов находят их концентрацию по формуле:
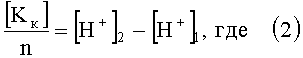
[Kк] - концентрация катионов электролита;
n - валентность катионов электролита;
[H+]2 - концентрация ионов водорода в конечной пробе;
[H+]1 - концентрация ионов водорода в исходной пробе;
а при определении анионов исследуемый раствор электролита пропускают через анионообменную смолу в ОН-форме и сравнивают концентрации гидроксил-ионов исходного раствора и раствора, пропущенного через смолу и по разнице значений концентрации гидроксил-ионов исходного и конечного растворов с учетом валентности анионов находят их концентрацию по формуле:
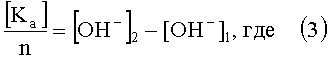
[Kа] - концентрация анионов;
n - валентность аниона;
[OH-]2 - концентрация гидроксил-ионов в конечной пробе;
[OH-]1 - концентрация гидроксил-ионов в исходной пробе
Предлагаемый способ заключается в следующем: для определения содержания катионов в электролите его пропускают через катионообменную смолу в H-форме. Ионы водорода H+ в катионообменной смоле замещаются катионами электролита. Количество вытеснившихся ионов водорода эквивалентно суммарному эквиваленту катионов, осевших в катионобменной смоле. Суммарный эквивалент катионов подсчитывается по разнице концентрации ионов водорода в электролите до пропускания его через катионообменную смолу и после по формуле (2).
Для определения анионов электролит пропускают через анионообменную смолу в OH-форме. При прохождении через анионообменную смолу анионы будут в ней оседать, вытесняя ионы ОН-. Суммарный эквивалент анионов подсчитывают по разнице концентрации гидроксил-ионов в электролите до пропускания его через анионообменную смолу и после. Количественное содержание анионов подсчитывают по разнице концентрации гидроксил-ионов до и после прохождения раствора электролита через анионообменную смолу по формуле (3).
Для реализации данного способа требуются сильнокислотные катионообменные смолы, например, марки КУ-2 и сильнощелочные анионообменные смолы, например, марки АВ-17 и pH-метр с диапазоном измерений от - 2 до +20.
Пример:
пусть требуется провести анализ концентрации ионов аммофоса (химическая формула NH4H2PO4 -) в водном растворе. Основными составляющими раствора будут следующие ионы:
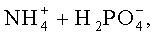
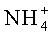
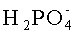
Раствор аммофоса пропускают через катионообменную смолу в Н-форме, например, марки КУ-2. Ионы аммония в ней заменяются на ионы водорода. На выходе получают раствор следующего состава:
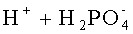
H+ - ионы водорода; 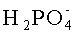
Количество вытеснившихся ионов водорода эквивалентно осевшим в ней ионам аммония.
Пропускают через смолу, например, 1 литр исходного раствора, измеряют концентрацию ионов водорода в исходной и в конечной пробах с помощью pH-метра. В исходной пробе pH=7, следовательно [H+]1=10-7 грамм-ион/литр. Пусть в конечной пробе рН=-0,2, следовательно [Н+]2=100,2=1,58 грамм-ион/литр. Валентность ионов аммония равна единице, по формуле (2) концентрация ионов аммония составит:
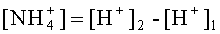
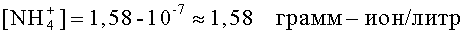
Для определения концентрации фосфат-ионов, пропускают контролируемый раствор через анионообменную смолу, например, марки АВ-17. Ионы Н2РО- 4 вытеснят в ней ионы ОН-. На выходе получают раствор следующего состава:
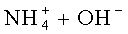
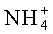
Пропускают через смолу, например, 1 литр исходного раствора, измеряют концентрацию ионов водорода с помощью pH-метра. В исходной пробе pH=7. Известна зависимость между водородным и гидроксильным показателями (Петров М.М и другие. Неорганическая химия. - Л.: Химия, 1981, - 544 с.) [2]
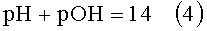
где pH - водородный показатель;
pOH - гидроксильный показатель.
По формуле (4), в исходном растворе рОН=7, концентрация гидроксил-ионов [OH-]1=10-7 грамм-ион/литр.
Пусть в конечной пробе рН=14,43. По формуле (4), в конечном растворе рОН=-0,43. Тогда [ОН-]2=100,43≈2,69 грамм-ион/литр. Валентность фосфат ионов равна единице. По формуле (3) концентрация фосфат-ионов в растворе составит:
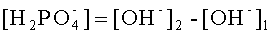
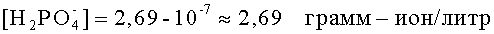
Таким образом, предлагаемый способ более прост в применении, чем известный, не требует наличия реактивов и снижает временные затраты. Например, на определение ионов аммония в аммофосе известным способом требуется около 30 мин, а предлагаемым - 10-12 мин.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ОБЕССОЛЕННОЙ ВОДЫ | 1997 |
|
RU2136604C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗДЕЛИЯ, СОДЕРЖАЩЕГО ПОЛИСИЛОКСАНОВОЕ ПОКРЫТИЕ НА ПОЛИМЕРНОЙ ПОДЛОЖКЕ, И ИЗДЕЛИЕ | 1991 |
|
RU2086415C1 |
| Способ получения , -диалкил -с1 -с3-тетрагидро-4,4-бипиридила | 1978 |
|
SU843741A3 |
| СПОСОБ ПОЛУЧЕНИЯ СОЛЕЙ ДОДЕКАГИДРО-КЛОЗО-ДОДЕКАБОРНОЙ КИСЛОТЫ | 2006 |
|
RU2323879C2 |
| СПОСОБ ДЕМИНЕРАЛИЗАЦИИ НЕЙТРАЛИЗАЦИОННЫМ ДИАЛИЗОМ РАСТВОРА СМЕСИ АМИНОКИСЛОТЫ И СОЛИ | 2015 |
|
RU2607227C1 |
| СПОСОБ СЕЛЕКТИВНОГО ИЗВЛЕЧЕНИЯ ДОННАНОВСКИМ ДИАЛИЗОМ ИОНОВ ЭЛЕКТРОЛИТА ИЗ РАСТВОРА С ФЕНИЛАЛАНИНОМ | 2015 |
|
RU2618839C2 |
| СПОСОБ ОЧИСТКИ СИАЛОВОЙ КИСЛОТЫ ИЗ ФЕРМЕНТАЦИОННОГО БУЛЬОНА | 2018 |
|
RU2780437C1 |
| СПОСОБ РЕГЕНЕРАЦИИ АКРИЛОВОЙ СМОЛЫ | 2016 |
|
RU2730337C2 |
| Электрохимическая установка обессоливания высокоминерализованных вод | 2023 |
|
RU2825947C1 |
| ВЫДЕЛЕНИЕ И ОЧИСТКА КОМПОНЕНТОВ СЫВОРОТКИ | 2010 |
|
RU2522491C2 |
Изобретение относится к способу определения концентрации катионов и анионов в растворах электролитов. При этом концентрацию катионов определяют путем пропускания раствора электролита через катионообменную смолу и сравнивают концентрацию ионов водорода исходного раствора и концентрацию ионов водорода раствора, пропущенного через катионообменную смолу, и по разнице значений концентрации ионов водорода исходного и конечного растворов с учетом валентности катионов находят их концентрацию по формуле
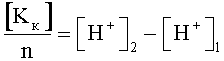
где [Kк] - концентрация катионов электролита;
n - валентность катионов электролита;
[H+]2 - концентрация ионов водорода в конечной пробе;
[H+]1 - концентрация ионов водорода в исходной пробе;
а при определении анионов исследуемый раствор электролита пропускают через анионообменную смолу и сравнивают концентрации гидроксил-ионов исходного раствора и раствора, пропущенного через смолу, и по разнице значений концентрации гидроксил-ионов исходного и конечного растворов с учетом валентности анионов находят их концентрацию по формуле:
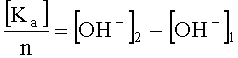
где [Kа] - концентрация анионов; n - валентность аниона; [OH-]2 - концентрация гидроксил-ионов в конечной пробе; [OH-]1 - концентрация гидроксил-ионов в исходной пробе. Предлагаемый способ позволяет сократить временные затраты на проведение анализа и отказаться от применения реактивов.
Способ определения концентрации ионов в растворах электролитов, заключающийся в том, что определяют концентрации катионов и анионов, отличающийся тем, что концентрацию катионов определяют путем пропускания раствора электролита через катионообменную смолу и сравнивают концентрацию ионов водорода исходного раствора и концентрацию ионов водорода раствора, пропущенного через катионообменную смолу, и по разнице значений концентрации ионов водорода исходного и конечного растворов с учетом валентности катионов находят их концентрацию по формуле:
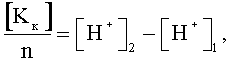
где [Kк] - концентрация катионов электролита;
n - валентность катионов электролита;
[H+]2 - концентрация ионов водорода в конечной пробе;
[H+]1 - концентрация ионов водорода в исходной пробе;
а при определении анионов исследуемый раствор электролита пропускают через анионообменную смолу и сравнивают концентрации гидроксил-ионов исходного раствора и раствора, пропущенного через смолу, и по разнице значений концентрации гидроксил-ионов исходного и конечного растворов с учетом валентности анионов находят их концентрацию по формуле:
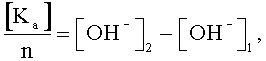
где [Ka] - концентрация анионов;
n - валентность аниона;
[OH-]2 - концентрация гидроксил-ионов в конечной пробе;
[OH-]1 - концентрация гидроксил-ионов в исходной пробе.
| ЛЯЛИКОВ Ю.С | |||
| Физико-химические методы анализа | |||
| - М.: Химия, 1974, 536 с | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ИОНОВ В ЖИДКИХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ | 2008 |
|
RU2386124C1 |
| Электрод для определения концентрации ионов в растворе | 1978 |
|
SU765720A1 |
| KAMAYA MINORI ET AL | |||
| Res | |||
| Repts Kogakuin Univ., 1993, №75, p.153-156 | |||
| US 20090289009 A1, 26.11.2009 | |||
| US 0006425284 B1, 30.07.2002. | |||
Авторы
Даты
2013-09-20—Публикация
2012-07-18—Подача