Изобретение относится к области лечения загрязнения кожи актинидами.
Каждый год деятельность ядерной промышленности требует обращения с десятками тысяч тонн урана во время различных стадий обработки ядерного топлива: добычи из урановых рудников, химической очистки, обогащения, производства топливных элементов, переработки отработанного топлива и мониторинга его хранения. Таким образом, уран и трансурановые актиниды (например, плутоний и америций) обрабатывают в установках, связанных с топливным циклом, а также в исследовательских лабораториях, работающих на стадиях как производства, так и утилизации топлива.
Для обеспечения защиты работников ядерного сектора воздействие ионизирующего излучения, связанного с данным протоколом, должно быть как можно меньшим. Для этого участки потенциального воздействия подвергаются значительным техническим ограничениям, которые обеспечивают мониторинг внешнего воздействия радиации (сигнальные маяки, предупреждающие об опасности γ-излучения, индивидуальные дозиметры), а также внутреннего загрязнения (устройства для отбора проб аэрозолей, общая радиометрия легких, анализы урана в моче и кале) рабочих, потенциально подвергавшихся загрязнению [1]. Однако, несмотря на защитные средства, которые обеспечиваются в рабочей среде, регистрируется некоторое число случаев загрязнения рабочих ядерной промышленности. Основные пути, с помощью которых актиниды попадают в организм, представляют собой вдыхание, проглатывание и кожный путь (поверхностное загрязнение и/или рана).
Загрязнение через рану вызывает сильное беспокойство, поскольку оно может быть причиной значительного и длительного внутреннего загрязнения индивидуумов после попадания актинидов в организм. Действительно, в случае случайного повреждения, включающего загрязнение актинидами, такими как растворимые соединения урана, перенос актинидов через поврежденную кожу и, таким образом, всасывание в кровоток могут происходить очень быстро (30 минут). Более того, если очистка поверхностной раны от загрязнения является лишь частичной, то уран остается биологически доступным, поскольку жизнеспособный эпидермис выступает в качестве резервуара урана [2]. Таким образом, в коже наблюдаются ранние цитотоксические эффекты. Затем уран распространяется по телу через системный кровоток, и первая порция урана удаляется с мочой. Количество радиоактивного элемента, остающееся в организме, концентрируется в двух основных органах-мишенях, а именно в почках и костной системе. Затем в этих органах могут проявляться различные эффекты, демонстрируя, таким образом, длительную химическую и радиологическую токсичность урана, особенно в случае наиболее активных соединений (обогащенный уран) [2-4].
Современные способы дезактивации кожи включают, после доставки индивидуума в медицинское учреждение, очистку кожи с использованием подходящего дезинфицирующего раствора, дополненного хелатирующим агентом, таким как 25% диэтилентриаминпентауксусной кислоты (DTPA), например, в случае ран. Очистка ран затем может быть дополнена хирургическим иссечением загрязненной ткани в случае загрязнения частицами. В случае растворимых соединений урана важно подчеркнуть, что период времени между моментом загрязнения и прибытием в медицинское учреждение (в среднем 15 минут) является достаточным для того, чтобы уран диффундировал через роговой слой кожи, что приводит к образованию резервуара урана, который затем может диффундировать в более глубокие слои [5].
Однако не существует альтернативной экстренной меры для удовлетворительного предотвращения или ограничения переноса актинидов через рану в момент и в месте аварии. Более того, доступные в медицинских учреждениях хелатирующие агенты, такие как DTPA, не способны селективно образовывать комплексы с урановыми соединениями, и их эффективность в биологической среде остается очень ограниченной.
Предпочтительная терапия в случае внутреннего загрязнения актинидами далее состоит в инъецировании пострадавшему системным путем растворов, содержащих агенты для выведения радионуклидов из организма, которые ускоряют выведение с мочой включенных актинидов (например, раствор DTPA для Pu и Am). Поскольку раствор DTPA не эффективен для выведения урана из организма, были предложены другие потенциально эффективные агенты для выведения радионуклидов из организма, такие как катехолатные (САМ) и гидроксипиридинонатные (НОРО) лиганды, но они еще не одобрены для клинического применения [6, 7]. Обнаружили, что лиганд этан-1-гидрокси-1,1-бисфосфонат (ЕНВР) так же эффективен в качестве агента, образующего комплекс с ураном, как НОРО и САМ, и имеет преимущество в том, что его уже используют клинически при других показаниях [8]. Однако действие этих агентов по выведению радионуклидов сильно зависит от времени, прошедшего между моментом загрязнения и инъекцией [8].
Наконец, отсутствие возможности экстренной меры по введению в момент и в месте аварии образует промежуток времени, который желательно исключить с целью ограничения потенциального проникновения актинидов в организм из раны или с поверхности кожного загрязнения. Поиск дезактивирующего агента с целью уменьшения чрескожного потока актинидов после загрязнения при контакте или ранении является предметом местного интереса, для которого было выполнено довольно мало работ [3, 4, 9-11].
В заявке WO 2006/123051 описано применение пара-трет-бутилкаликс[6]аренов, связанных с подложкой, для образования селективных комплексов с ураном, америцием и плутонием в моче.
В заявке WO 95/19974 описано применение каликс[3-8]аренов для лечения бактериальных или грибковых инфекций, ВИЧ и рака.
Каликсарены представляют собой особые комплексообразующие структуры. В 1993 г. Araki с соавт. продемонстрировал посредством жидкость-жидкостной экстракции комплексообразующие свойства 1,3,5-O-триметил-2,4,6-O-три(карбоновая кислота)-пара-трет-бутилкаликс[6]арена (молекула представлена ниже формулой IA) в отношении урана (Chem. Lett., 829-832, 1993). В 1994 г. Van Duynhoven с соавт. использовал ту же молекулу для изучения ее конформационных равновесий (J. Am. Chem. Soc., 116, 5814-5822). В 1997 г. С. Dinse с соавт. (Radioprotection, 32 no.5, 659-671) продемонстрировал посредством жидкость-жидкостной экстракции селективность молекулы формулы (IA) к урану в присутствии плутония и натрия.
Ни один из продуктов или методов из предшествующего уровня техники не позволяет предложить местную экстренную меру для ограничения или прекращения проникновения в организм актинидов из кожного загрязнения.
Неожиданно авторы изобретения показали, что наноэмульсия в форме масло-в-воде, содержащая пара-трет-бутилкаликс[6]арены в масляной фазе, позволяет связывать уран и предотвращать его чрескожную диффузию.
Таким образом, настоящее изобретение относится к каликсарену, предпочтительно, каликс[6]арену, для его применения в лечении актинидного загрязнения кожи.
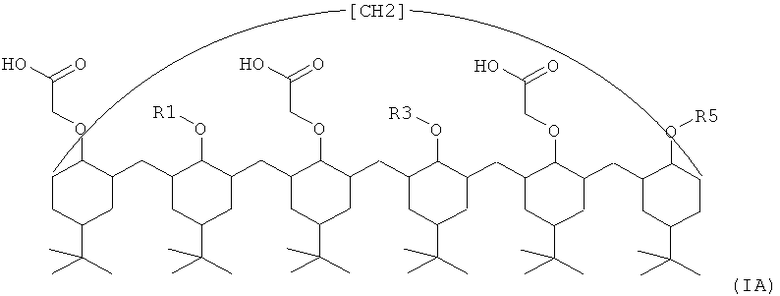
Предпочтительно, каликсарен по изобретению представляет собой пара-трет-бутилкаликс[6]арен формулы (IA) или (IB)

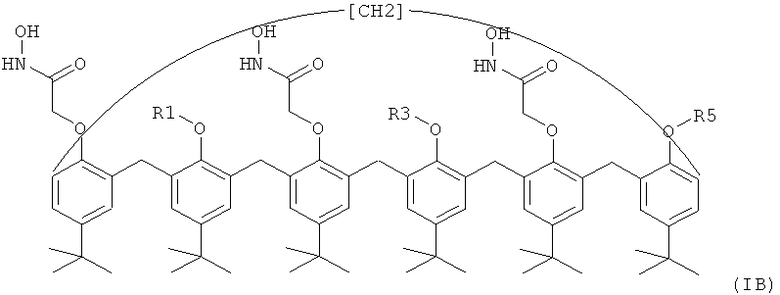
где каждый из R1, R3 и R5, одинаковых или разных, независимо представляет собой:
(1) атом водорода или галогена,
(2) ацетильный, амино, фосфатный, нитро, сульфатный, карбокси, карбоксильный, тиокарбокси, карбаматный или тиокарбаматный радикал,
(3) возможно замещенный линейный или разветвленный алкил, имеющий от 1 до 60, предпочтительно от 1 до 30 атомов углерода, который возможно имеет по меньшей мере одну этиленовую или ацетиленовую ненасыщенность,
(4) возможно замещенный циклоалкил, имеющий от 3 до 12 атомов углерода, который возможно имеет по меньшей мере одну этиленовую или ацетиленовую ненасыщенность,
(5) возможно замещенный арил, возможно замещенный нафтил, возможно замещенный арил(С1-С30алкил) или возможно замещенный (C1-С30алкил)арил,
где радикалы (2)-(5) могут быть замещены атомами галогена, металлоорганическими соединениями, спиртовой, аминной, карбоновокислотной, сульфокислотной, сернокислотной, фосфорнокислотной, фосфоновокислотной или гидроксамовокислотной или сложноэфирной, карбаматной, тиокарбаматной, простоэфирной, тиольной, эпоксидной, тиоэпоксидной, изоцианатной или изотиоцианатной функциональными группами, или атом углерода указанных радикалов может быть заменен гетероатомом азота, серы, фосфора, кислорода, бора или мышьяка,
(6) полисахарид.
Согласно предпочтительному воплощению в формулах (IA) и (IB) два из R1, R3 и R5 представляют собой водород или метил, при этом третий представляет собой полисахарид.
Предпочтительно, указанный полисахарид выбран из группы, состоящей из декстранов, хитозана и агароз.
Согласно другому предпочтительному воплощению пара-трет-бутилкаликс[6]арены по изобретению представляют собой соединения формулы (IA) или (IB), где R1, R3 и R5 являются одинаковыми и предпочтительно представляют собой водород.
Настоящее изобретение также относится к применению каликсарена для изготовления лекарственного средства для лечения актинидного загрязнения кожи.
Настоящее изобретение также относится к способу лечения актинидного загрязнения кожи, включающему нанесение на кожу эффективного количества каликсарена.
Актиниды включают химические элементы из периодической таблицы, расположенные между актинием и лоуренсием, имеющие, таким образом, атомный номер от 89 до 103 включительно, а именно актиний (Ас), торий (Th), протактиний (Ра), уран (U), нептуний (Np), плутоний (Pu), америций (Am), кюрий (Cm), берклий (Bk), калифорний (Cf), эйнштейний (Es), фермий (Fm), менделевий (Md), нобелий (No) и лоуренсий (Lr).
Все актиниды представляют собой радиоактивные элементы, и их название происходит от актиния (Z=89), тяжелого металла, поскольку они обладают сходными химическими свойствами.
Актинид, наиболее часто образующийся в цикле ядерного топлива, представляет собой плутоний, в основном его главный изотоп плутоний-239, который сам способен расщепляться. Но ядерные реакторы генерируют в меньших количествах и другие актиниды, которые по этой причине называются "минорными" актинидами. Главными актинидами являются нептуний-237, америций-241, америций-243, кюрий-244 и кюрий-245. Минорные актиниды вместе с продуктами распада составляют наиболее высокоактивные, долгоживущие ядерные отходы, т.е. наиболее опасные отходы ядерной промышленности.
Предпочтительно, изобретение используют для лечения загрязнения кожи ураном, плутонием и/или америцием.
Настоящее изобретение также относится к применению каликсаренов, предпочтительно каликс[6]аренов, для предотвращения или ограничения переноса актинида в организм из участка загрязнения кожи, предпочтительно для предотвращения или ограничения переноса урана, плутония и/или америция в организм из участка загрязнения кожи.
Действительно, в изобретении предложена дермокосметическая композиция для предотвращения проникновения актинидов в организм из участка загрязнения кожи или для ограничения количества актинида, проникающего в организм, до количества, недостаточного для вызывания симптома, связанного с загрязнением, в частности почечного и костного симптома.
Настоящее изобретение также относится к дермокосметической композиции, содержащей одно или более каликсареновых соединений в качестве активного ингредиента и один или более косметически приемлемых эксципиентов.
Термин "дермокосметическая композиция" означает косметическую композицию, предназначенную для нанесения на кожу.
Настоящее изобретение также относится к дерматологической композиции, содержащей одно или более каликсареновых соединений в качестве активного ингредиента и один или более косметически приемлемых эксципиентов.
Термин "дерматологическая композиция" означает фармацевтическую композицию, предназначенную для нанесения на кожу.
Предпочтительно, эксципиенты препарата по изобретению выбраны в соответствии с фармакопеей Франции.
Предпочтительно, эксципиенты дермокосметического или дерматологического препарата по изобретению не включают стимуляторы проникновения через кожу, которые могут нарушать структуру кожи и стимулировать проникновение через кожу загрязняющих актинидов.
Учитывая сильный липофильный характер каликсареновых молекул, дермокосметическая или дерматологическая композиция по изобретению предпочтительно предложена в форме, содержащей масляную фазу, где каликсареновые соединения находятся в масляной фазе, такой как:
- гель на основе масла;
- безводная паста, основой которой является фаза твердого жира или воск;
- эмульсия в форме масло-в-воде (O/W), состоящая из дисперсии капель масла в воде, или эмульсия в форме вода-в-масле (W/O), состоящая из дисперсии капель воды в масляной фазе.
Предпочтительно, дермокосметическая или дерматологическая композиция по изобретению представляет собой наноэмульсию в форме масло-в-воде или вода-в-масле, предпочтительно, наноэмульсию в форме масло-вводе.
Термин "наноэмульсия" относится к эмульсии, размер капель которой составляет от 50 нм до 200 нм.
Доказано, что эмульсия, и, в частности, наноэмульсия (средний диаметр диспергированных капель менее одного микрона), является особенно предпочтительным препаратом, поскольку она демонстрирует относительно низкую стойкость и поэтому легко смывается, таким образом делая возможной более эффективную дезактивацию. Более того, она, по-видимому, обеспечивает лучшую доступность каликсаренов на поверхности кожи и имеет большую общую развернутую поверхность благодаря тому, что капли масла тонко диспергированы в водной фазе.
Предпочтительно, дермокосметическая или дерматологическая композиция по изобретению в форме наноэмульсии имеет размер капель от 50 нм до 200 нм, предпочтительно от 100 нм до 200 нм.
Предпочтительно, масляная фаза состоит из минеральных масел, растительных масел, синтетических масел или их смеси. Предпочтительно, масляная фаза включает парафин. Особенно предпочтительно, масляная фаза состоит из парафина.
Предпочтительно, по меньшей мере одно из каликс[6]ареновых соединений, присутствующих в дерматологической композиции по изобретению в качестве активного ингредиента, представляет собой соединение формулы (IA) или (IB), как определено выше, где R1, R3 и R5 являются такими, как определено выше.
Предпочтительно, все каликс[6]ареновые соединения, присутствующие в дерматологической композиции по изобретению в качестве активного ингредиента, представляют собой соединение формулы (IA) или (IB), как определено выше, где R1, R3 и R5 являются такими, как определено выше.
Предпочтительно, дерматологическая композиция по изобретению сожержит от 50% до 95% воды, предпочтительно от 70% до 80% воды. Предпочтительно, дерматологическая композиция по изобретению содержит от 5% до 50% масляной фазы, предпочтительно от 15% до 25% масляной фазы. Предпочтительно, дерматологическая композиция по изобретению содержит от 1% до 15% поверхностно-активных веществ. Предпочтительно, дерматологическая композиция по изобретению содержит от 2 мг до 30 мг, предпочтительно от 2 мг до 12 мг каликс[6]арена на грамм композиции. Когда дерматологическая композиция по изобретению представляет собой наноэмульсию, тогда указанная композиция содержит от 2 мг до 30 мг, предпочтительно от 2 мг до 12 мг каликс[6]арена на грамм композиции.
Предпочтительно, по меньшей мере одно из каликсареновых соединений, присутствующих в дермокосметической композиции по изобретению, представляет собой каликс[6]арен.
Предпочтительно, все каликсареновые соединения, присутствующие в дермокосметической композиции по изобретению в качестве активного ингредиента, представляют собой каликс[6]арены.
Предпочтительно, по меньшей мере одно из каликсареновых соединений, присутствующих в дермокосметической композиции по изобретению в качестве активного ингредиента, представляет собой соединение формулы (IA) или (IB), как определено выше, где R1, R3 и R5 являются такими, как определено выше.
Предпочтительно, все каликсареновые соединения, присутствующие в дермокосметической композиции по изобретению в качестве активного ингредиента, представляют собой соединения формулы (IA) или (IB), как определено выше, где R1, R3 и R5 являются такими, как определено выше.
Предпочтительно, дермокосметическая композиция по изобретению содержит от 50% до 95% воды, предпочтительно от 70% до 80% воды. Предпочтительно, дермокосметическая композиция по изобретению содержит от 5% до 50% масляной фазы, предпочтительно от 15% до 25% масляной фазы. Предпочтительно, дермокосметическая композиция по изобретению содержит от 1% до 15% поверхностно-активных веществ. Предпочтительно, дермокосметическая композиция по изобретению содержит от 2 мг до 30 мг, предпочтительно от 2 мг до 12 мг каликсарена на грамм композиции. Когда дермокосметическая композиция по изобретению представляет собой наноэмульсию, тогда указанная композиция содержит от 2 мг до 30 мг, предпочтительно от 2 мг до 12 мг каликсарена на грамм композиции.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1: Схема эмульсии в форме масло-в-воде.
Фиг.2: Примеры наноэмульсий.
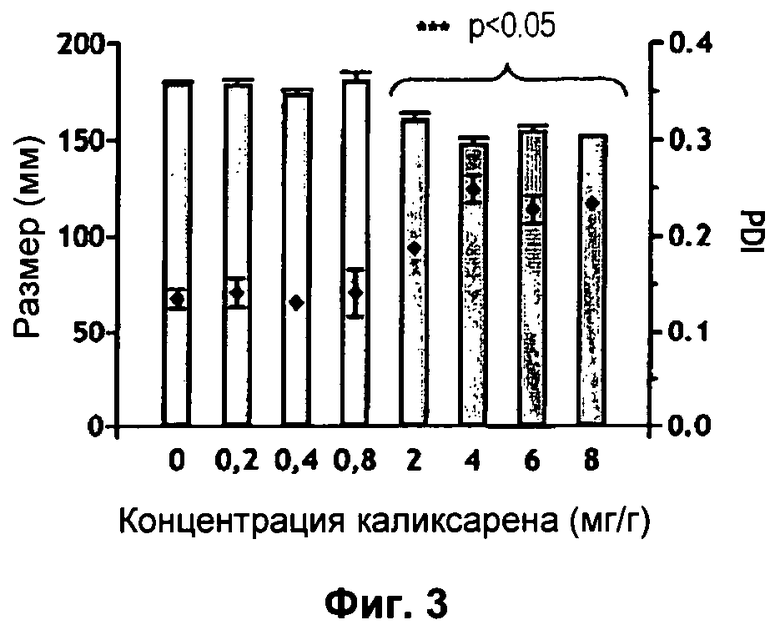
Фиг.3: Изменения размера диспергированных частиц в зависимости от концентрации каликсарена в наноэмульсиях.
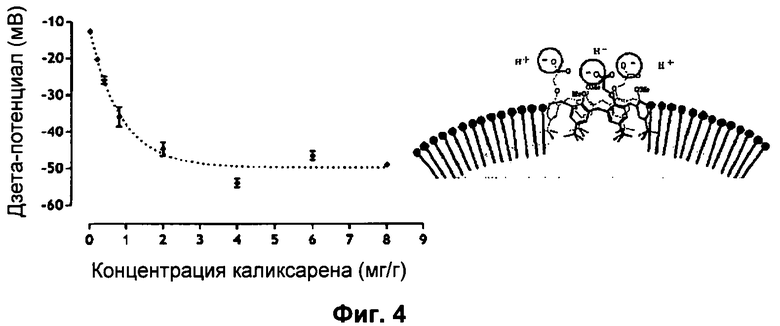
Фиг.4: Изменения дзета-потенциала частиц масла в зависимости от концентрации каликсарена в эмульсии (А). Гипотеза о локализации молекул каликсарена на поверхности частиц масла в эмульсии (Б).
Фиг.5: Изменения рН эмульсий в зависимости от концентрации включенного каликсарена (А). Гипотеза о локализации молекул каликсарена на поверхности частиц масла в эмульсии (Б).
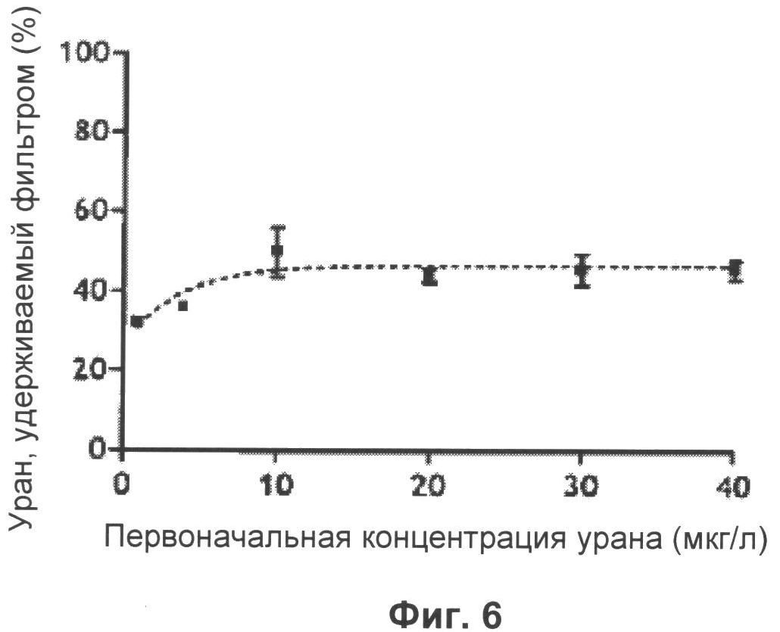
Фиг.6: Процент урана, удерживаемого фильтром системы ультрафильтрации в зависимости от концентрации осажденного урана.
Фиг.7: Распределение урана между ретентатом, фильтром и фильтратом после ультрафильтрации (А). Представление системы ультрафильтрации (В).
Фиг.8: Процент экстрагированного урана в зависимости от времени контакта между загрязняющим раствором и наноэмульсией и в зависимости от типа контакта (динамический и статический). Примечание: представленное время контакта = фактическое время эксперимента + 30 минут ультрафильтрации.
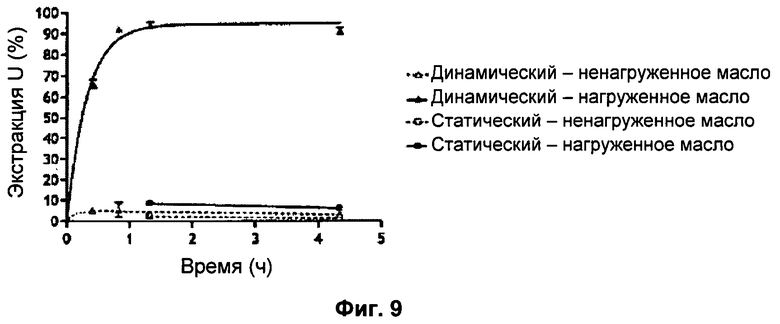
Фиг.9: Процент экстрагированного урана в зависимости от времени контакта между загрязняющим раствором и дисперсией каликсарена в парафионовом масле и в зависимости от типа контакта (динамический и статический). Примечание: представленное время контакта = фактическое время эксперимента + 20 минут обработки.
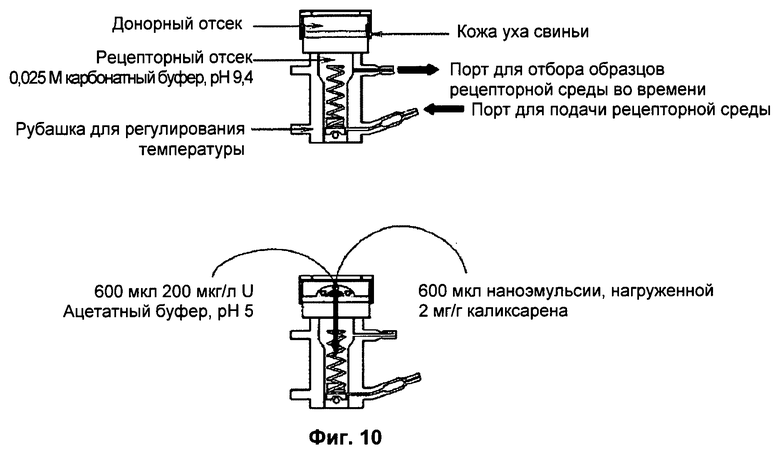
Фиг.10: Схемы (диффузионных) ячеек Франца, используемых для исследования чрескожного прохождения урана или молекул каликсарена из препаратов.
Фиг.11: Кинетика чрескожной диффузии урана в течение 24 часов в ячейке Франца (n=5) в отсутствие или присутствие наноэмульсии каликсарена.
Следующие примеры иллюстрируют изобретение без ограничения его объема.
ПРИМЕРЫ
Пример 1: Получение наноэмульсии каликс[6]арена в форме масло-в-воде
Получают наноэмульсию в форме масло-в-воде, где молекулы каликсарена включены в масляную фазу. Указанные наноэмульсии состоят из минерального масла (парафинового масла), неионных поверхностно-активных веществ (Tween 80® и Span 80®), воды Milli-Q и 1,3,5-O-Ме-2,4,6-ОСН2СООН-пара-трет-бутилкаликс[6]арена. Процентные содержания по массе поверхностно-активных веществ, масла и воды устанавливали на уровне 5%, 20% и 75%, соответственно. Относительные процентные содержания по массе двух поверхностно-активных веществ оптимизировали с целью получения оптимальных условий эмульгирования (гидрофильно-липофильный баланс (HLB)=11).
Наноэмульсии каликсарена получали согласно методу фазовой инверсии. Масляную фазу эмульсии, соответствующую смеси масло-каликсарен-поверхностно-активные вещества, и водную фазу сначала помещают раздельно в баню с контролируемой температурой при 50°С при легком перемешивании на 30 минут. В конце этого периода уравновешивания температуры водную фазу по каплям добавляют к масляной фазе при легком перемешивании (Фиг.2). Полученные таким образом наноэмульсии оставляют при перемешивании в бане с контролируемой температурой на 45 минут и затем перемешивают при комнатной температуре в течение 45 минут. Затем наноэмульсии оставляют при комнатной температуре без доступа света.
Пример 2: Характеристика наноэмульсий, полученных в Примере 1
Наноэмульсии характеризовали путем измерения размера диспергированных капель, дзета-потенциала (общего поверхностного заряда, который капли приобретают в водной среде) и рН. Тип эмульсии также проверяли посредством кондуктометрии и теста на растворимость эмульсии в воде.
Средний размер диспергированных капель масла и индекс полидисперсности (PDI), отражающий равномерность распределения по размеру, измеряли посредством фотонно-корреляционной спектроскопии.
Это исследование показало, что диаметр масляных глобул составляет менее 200 нм и что он значительно уменьшается (p<0,05), когда количество вводимого каликсарена составляет более 2 мг на грамм эмульсии (Фиг.3). Это уменьшение размера коррелирует со значительным (p<0,05) увеличением индекса полидисперсности, отражая таким образом уменьшение гомогенности эмульсии. Однако значение PDI остается небольшим (<0,250), что указывает на то, что распределение размера капель масла остается однородным для наноэмульсии, нагруженных каликсареном вплоть до 8 мг/г.
Дзета-потенциал определяли путем измерения электрофоретической подвижности диспергированных масляных глобул.
Это измерение продемонстрировало присутствие каликсарена на поверхности этих капель (Фиг.4). Действительно, увеличение концентрации каликсарена в наноэмульсиях приводит к уменьшению поверхностного заряда капель масла вплоть до концентрации 4 мг/г, концентрации, за пределами которой дзета-потенциал стремится к стабилизации. Эта стабилизация может быть объяснена возможным депротонированием молекул каликсарена, находящихся на поверхности масляных глобул.
Присутствие каликсарена на поверхности диспергированных капель масла также было продемонстрировало путем измерения рН. Сравнение рН эмульсий, не нагруженных каликсареном, и эмульсий, нагруженных 2 мг/г, 4 мг/г, 6 мг/г и 8 мг/г каликсарена, показало снижение рН приблизительно на одну единицу в присутствии хелатирующего агента. Этот феномен объясняется депротонированием молекул каликсарена, находящихся на поверхности масляных глобул (Фиг.5).
Пример 3: Эффективность in vitro наноэмульсий каликсарена в отношении дезактивации
Эффективность наноэмульсий каликсарена оценивали in vitro с использованием метода ультрафильтрации. Действительно, ультрафильтрация позволяет извлекать часть водной фазы наноэмульсий, после чего становится возможной оценка количества свободного урана с использованием масс-спектрометрии с индуктивно связанной плазмой (ICP-MS).
Сначала параметры ультрафильтрации-ультрацентрифугирования оптимизировали с целью получения в фильтрате только водной фазы наноэмульсий:
- пористость фильтра: 3000 кДа
- объем для центрифугирования: 400 мкл
- температура центрифугирования: 20°С
- скорость центрифугирования: 6000 об/мин
- продолжительность центрифугирования: 30 мин
Полученные таким образом прозрачные фильтраты анализировали посредством высокоэффективной жидкостной хроматографии (HPLC). HPLC-анализ показал, что фильтраты состоят только из воды, таким образом указывая на отсутствие масла, поверхностно-активных веществ или каликсарена.
Затем проводили исследование, нацеленное на оценку удерживания урана фильтрами, используемыми при ультрафильтрации. Это исследование привело к заключению, что в среднем 47% урана, осажденного на фильтре в форме нитрата уранила в ацетатном буфере, рН 5, удерживается в фильтре во время ультрафильтрации (Фиг.6). Это происходит вследствие того, что фильтр состоит из регенерированной целлюлозы, материала, который имеет отрицательно заряженные участки, с которыми уран может взаимодействовать посредством электростатических связей и, таким образом, может удерживаться [16]. То, что это процентное содержание хорошо соответствовало урану, удерживаемому в фильтре, а не концентрации урана в фазе, осажденной на фильтре (ретентат), также было подтверждено посредством оценки компонентов (Фиг.7). Действительно, не наблюдается никакого увеличения концентрации урана в ретентате после ультрафильтрации по сравнению с первоначально осажденной концентрацией.
Зная, что при использовании метода ультрафильтрации можно извлекать фильтраты наноэмульсий, состоящие только из воды, и что в среднем 47% урана удерживается фильтром системы ультрафильтрации, можно таким образом оценить in vitro дезактивирующую способность наноэмульсий каликсарена.
Этот тест на эффективность наноэмульсий каликсарена в отношении дезактивации проводили в соответствии с двумя режимами контакта между загрязнителем и наноэмульсией:
- динамический контакт: перемешивание путем переворачивания пробирки, содержащей раствор загрязнителя и наноэмульсию каликсарена, в течение заданного промежутка времени,
- статический контакт: приведение наноэмульсии каликсарена в контакт с раствором загрязнителя в течение заданного промежутка времени без перемешивания.
Таким образом, можно было определить кинетику экстракции урана наноэмульсиями каликсарена (со следующими соотношениями: Qкаликсарен/Qуран=10000 и Vзагрязнение/Vпрепарат=1, (Фиг.8)).
Это исследование показывает, что наноэмульсии, не нагруженные каликсареном, экстрагируют приблизительно 25% урана в статическом режиме и 40% в динамическом режиме. Это может объяснить захватом урана неионными поверхностно-активными веществами, поскольку последние имеют этоксильные группы, способные образовывать водородные связи с гидроксильными ионами [17], и, таким образом, также способные удерживать уран. Перемешивание наноэмульсионной смеси, не нагруженной каликсареном, и раствора загрязнителя обеспечивает контакт между ураном и поверхностно-активными веществами, что может объяснить, почему экстракция урана является большей в динамических условиях.
Что касается наноэмульсии, нагруженных 2 мг/г каликсарена, примерно 90% урана экстрагируется через 35 минут (5 минут фактического времени эксперимента) в динамическом режиме по сравнению с примерно 85% в статическом режиме. Таким образом, эти результаты показывают, что присутствие каликсарена в наноэмульсиях по меньшей мере в два раза увеличивает выход экстракции урана.
Более того, исследование кинетики, выполненное ранее с парафиновым маслом, нагруженным каликсареном, в виде галенова препарата, показало, что менее 10% урана экстрагировалось этим препаратом в статическом режиме, при прочих равных условиях (Qкаликсарен/Qуран=10000 и Vзагрязнение/Vпрепарат=1, (Фиг.9)).
Таким образом, ясно, что выбранный препарат (наноэмульсия каликсарена) является намного более эффективным, чем только эксципиент (парафиновое масло), нагруженный каликсареном. Наиболее вероятно, что это происходит благодаря тому, что поверхность, образующаяся между каликсареном и ураном в наноэмульсиях, является намного большей.
В заключение, данные результаты показывают, что выбранный препарат (наноэмульсия) и используемый активный ингредиент, т.е. каликсарен, способствуют эффективности галеновой формы. Таким образом, наноэмульсии каликсарена являются эффективными при статической дезактивации. Таким образом, они представляют собой системы, хорошо подходящие для дезактивации ран.
Пример 4: Эффективность ex vivo наноэмульсий каликсарена в отношении дезактивации
Эффективность наноэмульсий каликсарена оценивали с использованием системы ячеек Франца путем исследования кинетики чрескожного прохождения урана с нанесением наноэмульсий и без нанесения наноэмульсий (Фиг.10). Все исследования чрескожной диффузии проводили на эксплантатах кожи уха свиньи в герметичных условиях (n=5). Загрязнение осуществляли путем внесения раствора обедненного урана (238U) в ацетатном буфере, рН 5.
Первый эксперимент, нацеленный на определение кинетики чрескожного прохождения каликсарена, высвобожденного 1 мл наноэмульсий, нагруженной 4 мг/г каликсарена, показал, что приготовленный таким образом каликсарен не проходил через кожу во время периода экспозиции 24 часа (HPLC-детекция с длиной волны λ=210 нм: предел обнаружения (LD)=17 нг/мл; предел количественного определения (LQ)=52 нг/мл).
Исследование эффективности наноэмульсии, нагруженной 4 мг/г карбоксильного каликсарена (соотношение Qкаликсарен/Qуран=10000) в отношении дезактивации продемонстрировало 98%-ное уменьшение количества урана, диффундировавшего через кожу по прошествии 24 часов.
Действительно, обработка загрязнения путем нанесения наноэмульсии, не нагруженной каликсареном, уже делает возможным 71%-ное уменьшение количества диффундировавшего урана. Это происходит частично благодаря растворению урана в водной фазе эмульсии и частично благодаря захвату порции урана компонентами наноэмульсии (показано в тестах in vitro). Добавление каликсарена к наноэмульсии дополнительно уменьшает на 93% количество диффундировавшего урана по сравнению с наноэмульсией, не нагруженной каликсареном (Фиг.11).
В заключение, данные результаты подтверждают эффективность наноэмульсии каликсарена в отношении дезактивации кожи, загрязненной ураном, поскольку указанные наноэмульсии каликсарена уменьшают чрескожный перенос указанного актинида.
Ссылки
[1] Le Guen В and Bérard P. Uranium et ses composés. In: Toxicologie-Pathologie professionnelle, Paris; Elsevier, 1998, Encyclopédic Médico Chirurgicale 16-008-10.
[2] Petitot F, Moreels AM and Paquet F. In vitro evaluation of percutaneous diffusion of uranyl nitrate through intact or excoriated skin of rat and pig. Can J Physiol Pharmacol 82(2): 133-9 (2004).
[3] Tymen H, Gerasimo P and Hoffschir D. Contamination and decontamination of rat and human skin with plutonium and uranium, studied with a Franz's chamber. Int J Radiat Biol 76(10): 1417-24 (2000).
[4] Tymen H, Rateau G, Guillet К, Ramounet-Le Gall В, Gerasimo P and Fritsch P. Methods to measure transfer of radionuclides through intact or injured skin: Application to radiotoxicology. Canadian Journal of Physiology and Pharmacology 80(7): 733-741 (2002).
[5] De Rey BM, Lanfranchi HE and Cabrini RL. Percutaneous absorption of uranium compounds. Environmental Research 30(2): 480-491 (1983).
[6] Durbin PW, Kullgren B, Xu J and Raymond KN. Development of decorporation agents for the actinides. Radiation Protection Dosimetry 79(1-4): 433-443(1998).
[7] Fukuda S, Lida H, Ikeda M, Yan X and Xie Y. Toxicity of uranium and the removal effects of CBMIDA and EHBP in simulated wounds of rats. Health Phys 89(1): 81-8(2005).
[8] Henge-Napoli MH, Ansoborlo E, Chazel V, Houpert P, Paquet F and Gourmelon P. Efficacy of ethane-1-hydroxy-1,1-bisphosphonate (EHBP) for the decorporation of uranium after intramuscular contamination in rats. Int J Radiat Biol 75(11): 1473-7(1999).
[9] Houpert P, Chazel V, Paquet F, Bailly T, Burgada R and Henge-Napoli MH. Reduction of uranium transfer by local chelation in simulated wounds in rats. Hum Exp Toxicol 20(5): 237-41 (2001).
[10] Houpert P, Chazel V and Paquet F. A local approach to reduce industrial uranium wound contamination in rats. Can J Physiol Pharmacol 82(2): 73-8 (2004).
[11] Yang Z, Xu K, Wang L, Gu H, Wei H, Xang M and Xu B. Self-assembly of small molecules affords multifunctional supramolecular hydrogels for topically treating simulated uranium wounds. Chem Commun 35: 4414-4416 (2005).
[12] Shan Z, Yang Y-Z, Tao Z, Jian H and Chang-Hong L. Uranium(VI) extraction by Winsor microemulsion systems using trialkyl phosphine oxide. Journal of Radioanalytical and Nuclear Chemistry 265(3): 419-421 (2005).
[13] Guo J-x, Sun X, Du D-l, Wu X, Li M-x, Pang H, Sun S-x and Wang A-h. Uranium(VI) extraction from chloride solution with benzyloctadecyldimethyl ammonium chloride (BODMAC) in a liquid membrane process. Journal of Radioanalytical and Nuclear Chemistry 275(2): 365-369 (2008).
[14] Seiller M and Martini MC. Formes pharmaceutiques pour application locale. Lavoisier, 1996.
[15] Martini M-C. Introduction à la dermopharmacie et à la cosmétologie. Lavoisier 2006, p.411.
[16] Guo L, Warnken KW and Santschi PH. Retention behavior of dissolved uranium during ultrafiltration: Implications for colloidal U in surface waters. Marine Chemistry 107(2): 156-166 (2007).
[17] Liu W, Sun D, Li C, Liu Q and Xu J. Formation and stability of paraffin oil-в-water nano-emulsions prepared by the emulsion inversion point method. Journal of Colloid and Interface Science 303(2): 557-563 (2006).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПАРА-ТРЕТ-БУТИЛ-КАЛИКС[6]АРЕНЫ, СОДЕРЖАЩИЕ ТРИ КИСЛОТНЫЕ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ В ПОЛОЖЕНИИ 2, 4 И 3, НАНЕСЕННЫЕ НА ПОДЛОЖКУ ЖИДКИЕ МЕМБРАНЫ, СОДЕРЖАЩИЕ ИХ МАТЕРИАЛЫ-ПОДЛОЖКИ И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2422432C2 |
| СПОСОБ ВЫДЕЛЕНИЯ МЕТАЛЛОВ ИЗ РАСТВОРОВ (ВАРИАНТЫ) | 2007 |
|
RU2343164C1 |
| СПОСОБ ОБНАРУЖЕНИЯ РЕАГЕНТА, ПОЛИМЕР, ЭЛЕКТРОДНАЯ ОСНОВА, ЭЛЕКТРОД И КАЛИКСАРЕН | 1994 |
|
RU2133463C1 |
| ГИДРИРОВАННЫЕ ПОЛИМЕРЫ С РАДИАЛЬНОЙ СТРУКТУРОЙ, ИМЕЮЩИЕ ЯДРО НА ОСНОВЕ КАЛИКСАРЕНОВ, И ИХ ПРИМЕНЕНИЕ В СМАЗОЧНЫХ КОМПОЗИЦИЯХ | 2015 |
|
RU2672421C2 |
| Металлические соединения каликсаренов, содержащие их моющие составы и их применение в составах смазочных масел | 2016 |
|
RU2719473C2 |
| ВОДНАЯ СИСТЕМА, СОДЕРЖАЩАЯ СУПРАМОЛЕКУЛЯРНЫЕ КАЛИКСАРЕНОВЫЕ НАНОКОНТЕЙНЕРЫ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2007 |
|
RU2362761C1 |
| НАНОСТРУКТУРИРОВАННЫЕ КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ СИЛИБИНИНА И ДРУГИХ АКТИВНЫХ ИНГРЕДИЕНТОВ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2726193C2 |
| СПОСОБ ОЧИСТКИ МАТЕРИАЛА, СОДЕРЖАЩЕГО РАДИОАКТИВНЫЕ ЗАГРЯЗНЕНИЯ | 1992 |
|
RU2122249C1 |
| СПОСОБ ПОЛУЧЕНИЯ СМЕШАННОГО ТОПЛИВА, СОДЕРЖАЩЕГО УРАН И ПО МЕНЬШЕЙ МЕРЕ, ОДИН АКТИНИД И/ИЛИ ЛАНТАНИД С ИСПОЛЬЗОВАНИЕМ КАТИОНООБМЕННОЙ СМОЛЫ | 2009 |
|
RU2516282C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-МЕТИЛЦИКЛОПРОПЕНА | 2011 |
|
RU2459791C1 |






Изобретение относится к фармацевтической промышленности и представляет собой применение каликс[6]арена формулы (IA) или (IB) для лечения загрязнения кожи ураном, плутонием или америцием. Изобретение обеспечивает стабильность каликс[6]аренов с актинидами в статическом режиме. 3 н. и 2 з.п. ф-лы, 4 пр., 11 ил.
1. Применение каликс[6]арена формулы (IA) или (IB):

где каждый из R1, R3 и R5 являются одинаковыми или различными и независимо представляют собой:
(1) атом водорода или галогена,
(2) ацетильный, амино, фосфатный, нитро, сульфатный, карбокси, карбоксильный, тиокарбокси, карбаматный или тиокарбаматный радикал,
(3) возможно замещенный линейный или разветвленный алкил, имеющий от 1 до 60, предпочтительно от 1 до 30 атомов углерода, который возможно имеет по меньшей мере одну этиленовую или ацетиленовую ненасыщенность,
(4) возможно замещенный циклоалкил, имеющий от 3 до 12 атомов углерода, который возможно имеет по меньшей мере одну этиленовую или ацетиленовую ненасыщенность,
(5) возможно замещенный арил, возможно замещенный нафтил, возможно замещенный арил(С1-С30алкил) или возможно замещенный (C1-С30алкил)арил,
где радикалы (2)-(5) могут быть замещены атомами галогена, металлоорганическими соединениями, спиртовой, аминной, карбоновокислотной, сульфокислотной, сернокислотной, фосфорнокислотной, фосфоновокислотной или гидроксамовокислотной или сложноэфирной, карбаматной, тиокарбаматной, простоэфирной, тиольной, эпоксидной, тиоэпоксидной, изоцианатной или изотиоцианатной функциональными группами, или атом углерода указанных радикалов может быть заменен гетероатомом азота, серы, фосфора, кислорода, бора или мышьяка,
(6) полисахарид
для лечения загрязнения кожи ураном, плутонием или америцием.
2. Дерматологическая композиция для лечения загрязнения кожи ураном, плутонием или америцием в форме наноэмульсии масло-в-воде или вода-в-масле, содержащая в качестве активного ингредиента одно или более каликс[6]ареновых соединений формулы (IA) или (IB):


где каждый из R1, R3 и R5 являются одинаковыми или различными и независимо представляют собой:
(1) атом водорода или галогена,
(2) ацетильный, амино, фосфатный, нитро, сульфатный, карбокси, карбоксильный, тиокарбокси, карбаматный или тиокарбаматный радикал,
(3) возможно замещенный линейный или разветвленный алкил, имеющий от 1 до 60, предпочтительно от 1 до 30 атомов углерода, который возможно имеет по меньшей мере одну этиленовую или ацетиленовую ненасыщенность,
(4) возможно замещенный циклоалкил, имеющий от 3 до 12 атомов углерода, который возможно имеет по меньшей мере одну этиленовую или ацетиленовую ненасыщенность,
(5) возможно замещенный арил, возможно замещенный нафтил, возможно замещенный арил(С1-С30алкил) или возможно замещенный (C1-С30алкил)арил,
где радикалы (2)-(5) могут быть замещены атомами галогена, металлоорганическими соединениями, спиртовой, аминной, карбоновокислотной, сульфокислотной, сернокислотной, фосфорнокислотной, фосфоновокислотной или гидроксамовокислотной или сложноэфирной, карбаматной, тиокарбаматной, простоэфирной, тиольной, эпоксидной, тиоэпоксидной, изоцианатной или изотиоцианатной функциональными группами, или атом углерода указанных радикалов может быть заменен гетероатомом азота, серы, фосфора, кислорода, бора или мышьяка,
(6) полисахарид,
и один или более фармацевтически приемлемых эксципиентов.
3. Дермокосметическая композиция для лечения загрязнения кожи ураном, плутонием или америцием, содержащая в качестве активного ингредиента одно или более каликс[6]ареновых соединений формулы (IA) или (IB):


где каждый из R1, R3 и R5 являются одинаковыми или различными и независимо представляют собой:
(1) атом водорода или галогена,
(2) ацетильный, амино, фосфатный, нитро, сульфатный, карбокси, карбоксильный, тиокарбокси, карбаматный или тиокарбаматный радикал,
(3) возможно замещенный линейный или разветвленный алкил, имеющий от 1 до 60, предпочтительно от 1 до 30 атомов углерода, который возможно имеет по меньшей мере одну этиленовую или ацетиленовую ненасыщенность,
(4) возможно замещенный циклоалкил, имеющий от 3 до 12 атомов углерода, который возможно имеет по меньшей мере одну этиленовую или ацетиленовую ненасыщенность,
(5) возможно замещенный арил, возможно замещенный нафтил, возможно замещенный арил(С1-С30алкил) или возможно замещенный (С1-С30алкил)арил,
где радикалы (2)-(5) могут быть замещены атомами галогена, металлоорганическими соединениями, спиртовой, аминной, карбоновокислотной, сульфокислотной, сернокислотной, фосфорнокислотной, фосфоновокислотной или гидроксамовокислотной или сложноэфирной, карбаматной, тиокарбаматной, простоэфирной, тиольной, эпоксидной, тиоэпоксидной, изоцианатной или изотиоцианатной функциональными группами, или атом углерода указанных радикалов может быть заменен гетероатомом азота, серы, фосфора, кислорода, бора или мышьяка,
(6) полисахарид,
и один или более косметически приемлемых эксципиентов.
4. Дермокосметическая композиция по п.3 в форме наноэмульсии масло-в-воде или вода-в-масле.
5. Дермокосметическая композиция по п.3, содержащая от 2 мг до 30 мг каликс[6]арена формулы (IA) или (IB) на грамм композиции.
| WO 03024583 A1, 27.03.2003 | |||
| WO 2004085441 A1, 07.10.2004 | |||
| US 5441983 A, 15.08.1995 | |||
| WO 2004085442 A2, 07.10.2004 | |||
| Ахтямов С.Н., Бутов Ю.С | |||
| Практическая дерматокосметология | |||
| - Медицина, 2003, релевантная стр | |||
| ПОКРОВСКИЙ В.И | |||
| Энциклопедический словарь медицинских терминов, 2-е изд | |||
| - М.: Медицина, 2001, с.267 | |||
| Беликов В.Г | |||
| Фармацевтическая химия. |
Авторы
Даты
2013-09-27—Публикация
2009-12-17—Подача