Изобретение обносится к области химии биологически активных веществ, в частности к способу получения октреотида или его фармацевтически приемлемых солей.
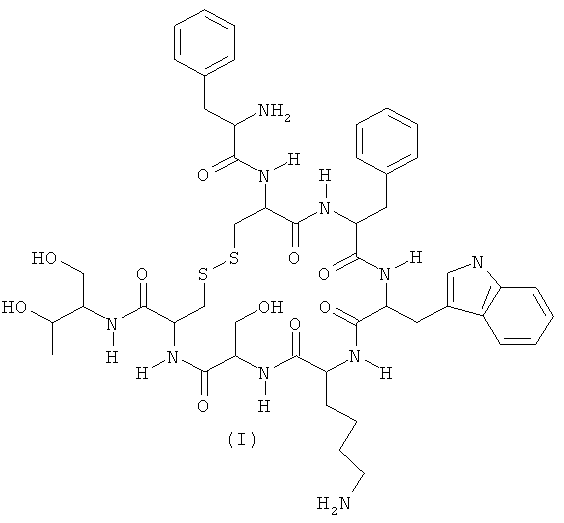
Октреотид (I) (Схема 1) представляет собой метаболически стабильный аналог пептидного гормона соматостатина и является ингибитором гормона роста, и инсулина. Октреотид применяют в медицине при акромегалии для регулирования уровня гормона роста в плазме крови, а также для лечения опухолей, содержащих соматостати новые рецепторы.
В уровне техники известно несколько способов получения октреотида. Первый синтез был осуществлен Вильфредом Бауэром с использованием классического подхода, такого как химический синтез в растворе [см. напр. US 4395403]. После пионерской работы Бауэра появилось еще несколько способов получения октреотида, основанных на технологии в растворе [US 4395403, US 2004225108, WO 03097668, WO 2007110765].
Принципиально иной подход к синтезу соединения (I) базируются на применении различных функциональных полимеров в качестве нерастворимой твердой подложки. Несмотря на то, что при классическом синтезе в растворе расход реактивов ниже, чем в случае твердофазного синтеза, последний используется все чаще ввиду меньшей длительности производственного цикла и возможности автоматизации процесса.
Известен способ получения защищенного октреотида [W.В. Edwards, J. Med. Chem., 1994, 37, 3749-3757], при котором последовательность D-Phe-Cys(Acm)-Phe-D-Trp(Boc)-Lys(Boc)-Thr(tBu)-Cys(Acm)-HMP-resin (Boc-трет-бутилоксикарбонильная группа) была синтезирована твердофазным методом с использованием Fmoc- (9-флуоренилметилоксикарбонильных) защитных групп для временного блокирования Nα-аминогрупп концевых аминокислот в сочетании с ортогональной кислотолабильной защитой функциональных групп в боковых цепях аминокислот. Окислительная циклизация проводилась на полимере с использованием йода, ацетата ртути и трифлата таллия. Окисление йодом приводило к сложной смеси продуктов, окисление ацетатом ртути (II) приводило к образованию значительного количества пептида, содержащего связанную ртуть, в то время как трифлат таллия (III) давал наиболее чистый результат окисления. Защищенный октапептид был получен при удалении защищенного гептапептида с полимера аминолизом под действием треонинола при повышенной температуре.
Недостатками данного способа являются использование высокотоксичной соли таллия, а также то, что синтез был начат с цистеина, прикрепленного к полимеру с С-конца, что повышает возможность рацемизации при многократной обработке основаниями.
Известен способ синтеза производного октреотида, содержащего Вос-группу на ε-аминогруппе остатка лизина и изотопные метки в остатках D-фенилаланина и тирозина [R. Albert, et al., Bioorg. Med. Chem. Lett., 1998, 8, 1207-1210]. По этому методу пептидную последовательность октреотида синтезировали по классической Fmoc/tBu-стратегии на твердой фазе, модифицированной (4-формилфенокси)уксусной кислотой, начиная с треонинола. Наращивание цепи проводили с использованием комбинации DCC (дицикло-гексилкарбодиимида) и HOBt (1-гидроксибензотриазола), а удаление Fmoc-групп действием пиперидина в диметилформамиде. После селективного удаления S-tBu-групп трибутилфосфином проводилась внутримолекулярная окислительная циклизация на полимере с образованием S-S-связи под действием перекиси водорода, соединяющей остатки цистеина. Отщепление октреотида, содержащего меченые атомы и защитную Вос-группу на ε-аминогруппе остатка лизина, с полимерного носителя достигалось при действии 2%-ного раствора трифторуксусной кислоты в хлористом метилене. Выход продукта составлял ~80%, чистота неизвестна.
Описанный способ синтеза производного октреотида может быть применен и к синтезу самого октреотида. К недостаткам данного способа следует отнести стадию окислительной циклизации, проводимую на полимере. Эта стадия накладывает ограничение на эффективность синтеза в целом, так как при высокой загрузке на полимер неизбежна окислительная сшивка между остатками цистеина от разных молекул пептида. При низкой загрузке на полимер этот нежелательный процесс уменьшается, но падает эффективность использования полимерного носителя.
Описанный в американском патенте US 6346601 подход к получению целевой молекулы основан на комбинировании твердофазного синтеза гептапептидного фрагмента, в котором остаток цистеина на С-конце прикреплен к 2-хлортритильной смоле, и наращиванием остатка треонинола в растворе. Несмотря на то, что применение стерически затрудненной 2-хлортритильной смолы практически полностью предохраняет пептиды с цистеином на С-конце от рацемизации под действием оснований [Y. Fujiwara, et al., Chem. Pharm. Bull., 1994, 42, 724-726], данный подход все же страдает недостатками, связанными с необходимостью активировать концевой остаток цистеина, не имеющий защиты уретанового типа, которая могла бы обеспечить низкий уровень рацемизации, а также большим числом неавтоматизированных стадий, проводимых в растворе.
Известен комбинированный способ получения октреотида, по которому аминокислотная последовательность наращивалась на Fmoc-треонинол-2-хлортритильном полимере [ЕР 2163558 А2]. При этом гидроксигруппа треони-нола защищалась в виде трет-бутилового эфира (tBu), меркапто-группа цистеина в положении 7 защищалась ацетамидометильной группой (Acm), меркапто-группа цистеина в положении 2 - тритильной (Trt), ε-аминогруппа лизина - Вос-группой. Активация Fmoc-защищенных аминокислот достигалась под действием TBTU/HOBt. Линейный пептид отщеплялся с полимера с одновременным удалением кислотолабильных групп (Trt, Boc, tBu) под действием кислотной смеси, и после выделения из раствора, подвергался очистке с помощью обращеннофазной ВЭЖХ. Таким образом, отщепленный линейный пептид содержал одну защитную группу (Acm) на остатке цистеина. Далее линейный пептид подвергался окислению в растворе действием йода с последующей повторной очисткой методом обращеннофазной ВЭЖХ. Следует отметить, что в данном патенте не указано, каким способом удалялась Acm-группа с остатка цистеина. Традиционно ацетамидометильную группу удаляют действием солей ртути, например Hg2+(СОО-)2. Применение высокотоксичных соединений ртути является основным препятствием для использования данной защитной группы в синтетической практике. Другой особенностью данного способа является то, что хроматографическая очистка проводилась два раза: после стадии отщепления с полимера и после окислительной циклизации. Еще одним недостатком является применение взрывоопасного 1-гидроксибензотриазола (HOBt) вместо его стабильного гидрата (HOBt*H2O).
Описан способ, описанный в работе [Y.-T. Wu, et al., Tetrahedron Lett., 1998, 39, 1783-1784], согласно которому аминокислотная последовательность октреотида была синтезирована твердофазным методом с использованием Fmoc-треонинол п-карбоксибензацетального полимера Ринка. Наращивание пептидной последовательности проводилось в автоматическом синтезаторе. Для временной защиты α-аминогрупп аминокислот применялась Fmoc-защита. Активация проводилась in situ под действием HOBt/HBTU/DIEA в среде N-метилпирролидона (NMP). Аминокислотная последовательность отщеплялась с полимера под действием «коктейля» на основе трифторуксусной кислоты. После удаления растворителя в вакууме и экстракции линейного пептида 5%-ной водной уксусной кислотой, после чего проводилось окисление с получением октреотида. К сожалению, в данном источнике не было указано ни окислителя ни способа, которым проводилось окисление. Также не указано, какие защитные группы применялись для защиты функциональных групп в боковых цепях аминокислот. Вместе с тем, полуперманентная защита меркапто-групп двух остатков цистеина и ε-аминогруппы лизина совершенно необходимы для получения целевого соединения с использованием Fmoc-стратегии. Также, весьма желательно использование защиты Nim триптофана и гидрокси-группы треонина. Таким образом, отсутствие подробного описания способа получения октреотида не позволяет воспроизвести синтез октреотида по данному способу. Поскольку 1-гидроксибензотриазол (HOBt) является взрывоопасным соединением, применение данного способа получения октреотида сопряжено с известными рисками.
Задача состоит в том, чтобы разработать способ получения октреотида, который исключает недостатки ближайшего аналога и более прост в осуществлении.
Поставленная задача решается предложенным способом получения октреотида или его фармацевтически приемлемых солей с использованием твердофазного синтеза на полимере Ринке, активации аминокислоты, отщепления полученного пептида и его окисления.
Отличие способа состоит в том, что линейную пептидную последовательность синтезируют в автоматическом режиме с использованием Fmoc-стратегии на полимере, модифицированном N-Fmoc-треонинол-п-карбоксибензацетальным линкером, Fmoc-аминокислоты активируют действием гидроксибензотриазола/O-(бензотриазолN,N,N,N-тетраметилуроний гексафторфосфат)/диизопропил-этиламина (HOBt/HBTU/DIEA) в среде диме-тилформамида, отщепление с полимера с одновременным удалением всех защитных групп проводят действием кислотной смеси, содержащей раствор трифторуксусной кислоты в уксусной кислоте в присутствии этандитиола, тиоанизола, фенола и воды, и, полностью деблокированный линейный окта-пептид растворяют в диметилформамиде после добавления водного раствора аммиака подвергают окислению с использованием окислителя йода.
Преимущество выбранного нами подхода состоит в том, что Fmoc-Thr-ol является доступным веществом, в то время как Fmoc-Thr(tBu)-ol, предложенный в европейской патентной заявке ЕР 1164143 и австралийском патенте AU 778031, чрезвычайно дорог и сам по себе требует многостадийного синтеза.
Дальнейшее наращивание пептидной последовательности H-D-Phe-Cys(S-Trt)-Phe-Lys(Boc)-Thr-Cys(S-Trt)-Thr(ol)-CHC6H4-CONH-resin проводилось на автоматическом пептидном синтезаторе, позволяющем уменьшить количество ручного труда и повысить точность операций. Отщепление линейного пептида с полимера, деблокирование меркапто-групп цистеина и ε-аминогруппы лизина проводилось в одну стадию под действием раствора трифторуксусной кислоты в уксусной кислоте в присутствии этандитиола, тиоанзола, фенола и воды в качестве антиоксидантных и/или связывающих трет-бутил- и тритил-катионы добавок, что позволило избежать преждевременного окисления остатков цистеина и нежелательного алкилирования остатков триптофана. Полностью деблокированный октапептид подвергали внутримолекулярной окислительной циклизации под действием йода в разбавленном растворе. Известно, что йод способен вызывать нежелательную реакцию между остатками цистеина и триптофана в пептидах с образованием циклических триптофан-2-тиоэфиров, содержащих данные аминокислоты. Однако в случае, когда между триптофаном и цистеином находится менее трех аминокислот, данный побочный процесс практически не реализуется [Р. Sieber, et al. Helv. Chim. Acta, 1980, 63, 2358-2363]. Эти данные позволили нам уверенно использовать на йод в качестве окислителя на конечной стадии синтеза. Одним из преимуществ йода является то, что реакцию можно проводить в режиме титрования, что позволяет точно определить конец реакции и избежать введения избытка окислителя. Для того, чтобы подавить нежелательный процесс окислительной димеризации октапептида было создано сильное разбавление. Известные в уровне техники методы, основанные на окислительной циклизации пептида на полимере, характеризуются низкой эффективностью использования полимера, связанной с низкой загрузкой на полимер. Метод по изобретению позволяет получать октреотид более экономично эффективно, увеличив загрузку пептида на полимер до 0.6-0.75 ммоль/г с высокой чистотой 98,8%.
Изобретение иллюстрируется следующим примером, который не ограничивает его объем.
Пример 1
Октреотида диацетат
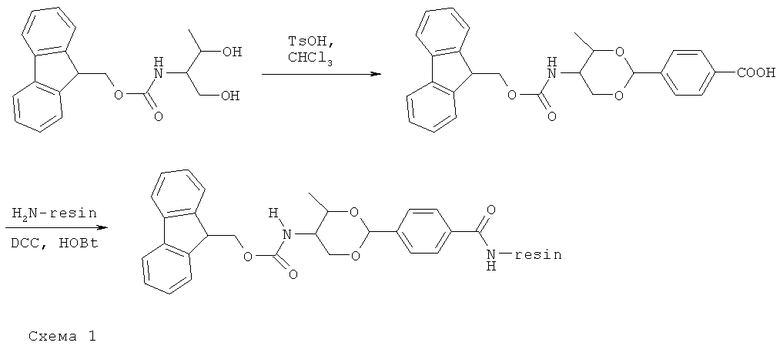
Fmoc-треонинол п-карбоксибензацетальный полимер Ринка был получен по известному методу [Y.-T. Wu, et al., Tetrahedron Lett., 1998, 39, 1783-1784]. Загрузка на полимер составила 0.6-0.75 ммоль/г. Дальнейшее наращивание пептидной последовательности проводилось в автоматическом твердофазном реакторе путем последовательного проведения следующих стадий:
1. Удаление Fmoc-защиты с аминогруппы концевой аминокислоты пептида под действием 20% раствора пиперидина в ДМФА. Полнота деблокирования определялась с помощью УФ-детектора на выходе из реактора при длине волны 304 нм.
2. Промывание чистым ДМФА.
3. Активация Fmoc- аминокислоты с помощью HOBt*H2O/HBTU/DIEA в ДМФА.
4. Ацилирование концевой аминогруппы пептида, прикрепленного к полимеру с помощью активированной Fmoc- аминокислоты (4 эквивалента).
5. Промывание чистым ДМФА.
6. Блокирование непрореагировавших аминогрупп раствором уксусного ангидрида в коллидине.
7. Промывание чистым ДМФА.
Отщепление с полимера с одновременным удалением всех кислотолабильных групп проводилось под действием раствора трифторуксусной кислоты в уксусной кислоте в присутствии 2,5% этандитиола, 5% тиоанизола, фенола (0,75 г/мл), 2,5% воды. Полученный раствор был упарен при пониженном давлении и температуре 40°С, а остаток растворен в ДМФА с образованием примерно 1%-ного раствора. К полученному раствору был добавлен водный раствор аммиака до достижения рН 7.0-7.5. После этого медленно прибавляли по каплям при перемешивании раствор йода до тех пор, пока коричневая окраска не переставала исчезать. Реакционный раствор обесцветили добавлением водного раствора тиосульфата натрия. Растворители удалили в вакууме при температуре не выше 38°С, остаток растворили в минимальном объеме уксусной кислоты, полученный раствор пропускали через колонку, содержащую Sephadex G10. Собранные фракции, содержащие продукт, лиофилизовали. Остаток очищали с использованием препаративной обращеннофазной высокоэффективной жидкостной хроматографии на приборе Waters 600Е с колонке С18 (250×10 мм, диаметр пор 300 Å, размер зерна 10 мкм) и УФ детектором (при 280 нм). Октреотид (I) получили в виде диацетата после лиофилизации, чистота 98.8% по RP-HPLC-UV. Выход 24%. Продукт показывал одинаковое время выхода вместе с коммерчески доступным образцом. ESI-MS: 1006 [М+H+].
Предложенный способ получения октреотида основан на комбинировании твердофазного синтеза и классического синтеза в растворе, и сочетает в себе преимущества обоих подходов. Твердофазный синтез основан на полимере Ринка, модифицированном недорогим и простом в получении N-Fmoc-треонинол-п-карбоксибензацетальным линкером. Данный линкер позволяет не использовать дополнительную защитную группу для гидрокси-группы треонинола, как это делается в европейском патенте [ЕР 2163558 А2] (ближайший аналог данного изобретения). Наращивание пептидной цепи и контроль на каждой стадии осуществляется в автоматическом режиме. Активация Fmoc-аминокислот проводится с помощью HOBt*H2O/HBTU/DIEA в ДМФА. Использование стабильного гидрата 1-гидроксибензотриазола (HOBt*Н2О) вместо взрывоопасного 1-гидроксибензотриазола (HOBt) позволяет повысить безопасность процесса. После отщепления с полимера с одновременным удалением всех защитных групп, полностью деблокированный линейный октапептид без дополнительной очистки подвергается окислению в растворе под действием раствора йода при сильном разбавлении. После выделения из раствора октреотид-сырец очищают методом хроматографии.
Предложен способ получения октреотида или его фармацевтически приемлемых солей, таких как октреотида диацетат, в котором линейная пептидная последовательность синтезируется в автоматическом режиме на полимере Ринка, модифицированном N-Fmoc-треонинол-п-карбоксибензацетальным линкером, Fmoc-аминокислоты активируют действием гидроксибензотриазола/O-(бензотриазолN,N,N,N-тетраметилуроний гексафторфосфат)/диизопропил-этиламина (HOBVHBTU/DIEA) в среде диметилформамида, отщепление с полимера с одновременным удалением всех защитных групп проводят действием кислотной смеси, и полностью деблокированный линейный октапептид окисляют с использованием йода. 1 з.п. ф-лы, 1 пр.
1. Способ получения октреотида или его фармацевтически приемлемых солей с использованием твердофазного синтеза на полимере Ринка, активации аминокислоты, отщепления полученного пептида и его окисления, отличающийся тем, что линейную пептидную последовательность синтезируют в автоматическом режиме с использованием Fmoc-стратегии на полимере, модифицированном N-Fmoc-треонинол-п-карбоксибензацетальным линкером, Fmoc-аминокислоты активируют действием гидроксибензотриазола/O-(бензотриазолN,N,N,N-тетраметилуроний гексафторфосфат)/диизопропил-этиламина (HOBt/HBTU/DlEA) в среде диметилформамида, отщепление полимера с одновременным удалением всех защитных групп проводят действием кислотной смеси, содержащей раствор трифторуксусной кислоты в уксусной кислоте в присутствии этандитиола, тиоанизола, фенола и воды, и, полностью деблокированный линейный октапептид растворяют в диметилформамиде после добавления водного раствора аммиака подвергают окислению с использованием окислителя йода.
2. Способ по п.1, отличающийся тем, что фармацевтически приемлемой солью октреотида является диацетат.
| Ying-Ta Wu at al "FACILE SOID PHASE SYNTHESIS OF OCTREOTIDE ANALOGS USING P-CARBOXYBENZALDEHYDE AS A NOVEL LINKER TO ANCHOR FMOC-THREONINOL TO SOLID PHASE RESINS", TETRAHEDRON LETTERS, 1998, 39, 1783-1784 | |||
| УПАКОВОЧНЫЙ МАТЕРИАЛ ДЛЯ ПИЩЕВЫХ ПРОДУКТОВ | 2000 |
|
RU2163558C1 |
| US 5889146 A, 30.03.1999 | |||
| Форма обводов корпуса плавучей ледостойкой установки (ее варианты) | 1983 |
|
SU1164143A1 |
| Сидорова М.В | |||
| и др | |||
| Применение перекиси водорода для замыкания | |||
Авторы
Даты
2013-09-27—Публикация
2010-12-29—Подача