Область техники
Настоящее описание относится к имплантируемому медицинскому устройству и системе, в частности, к имплантируемому медицинскому устройству, внутренняя схема которого способна выдерживать некоторое определенное количество стерилизующего облучения.
Уровень техники
Ожирение вызывает растущую озабоченность, особенно в Соединенных Штатах, поскольку число людей, страдающих ожирением, продолжает увеличиваться, при этом все больше становится известно об отрицательном воздействии ожирения на здоровье. Патологическое ожирение, при котором человек имеет массу выше идеальной массы тела на 100 фунтов или более, представляет, в частности, существенный риск возникновения тяжелых заболеваний. Таким образом, большое внимание уделяется лечению пациентов, страдающих ожирением. Один из способов лечения патологического ожирения включал наложение ограничивающего устройства, такого как удлиненный бандаж, на верхнюю часть желудка. Желудочные бандажи обычно включали наполненный жидкостью эластомерный баллон с фиксированными конечными положениями, который окружает желудок немного ниже соединения пищевода с желудком, с формированием малого желудочка над бандажом и уменьшенного просвета устья желудка. Когда жидкость закачивается в баллон, бандаж расширяется и вызывает сжатие желудка или устья желудка, создавая ограничение потребления пищи. Чтобы уменьшать указанное сжатие, жидкость удаляется из бандажа. Эффект бандажа заключается в уменьшении доступного объема желудка и, таким образом, количества пищи, которое может потребляться до тех пор, пока желудок не станет "полным".
Устройства для ограничения потребления пищи также включали механически регулируемые бандажи, которые аналогичным образом окружают верхнюю часть желудка. Указанные бандажи включают любое количество эластичных материалов или приводных устройств, а также элементы привода для регулировки бандажей. Кроме того, были разработаны желудочные бандажи, которые включают как гидравлические, так и механические элементы привода. Пример такого регулируемого желудочного бандажа раскрыт в Патенте США 6067991, озаглавленном "Механическое устройство для ограничения потребления пищи", который был опубликован 30 мая 2000 года и включен в настоящее описание посредством отсылки. Также известно ограничение доступного для заполнения пищей объема полости желудка посредством введения накачиваемого эластомерного баллона непосредственно в полость желудка. Баллон наполняется жидкостью и упирается в стенки желудка и, таким образом, уменьшает доступный для заполнения пищей объем желудка.
Что касается каждого из вышеуказанных устройств для ограничения потребления пищи, то в целях безопасного, эффективного лечения необходимо, чтобы устройство регулярно проверяли и регулировали, изменяя степень ограничения, приложенного к желудку. Из-за бандажных устройств малый желудочек над бандажом существенно увеличивается в размере после первоначальной имплантации. Таким образом, просвет устья желудка первоначально необходимо сделать достаточно большим, чтобы позволить пациенту получать достаточное питание, пока желудок приспосабливается к бандажному устройству. По мере того как малый желудочек увеличивается в размере, бандаж можно регулировать, чтобы изменять просвет устья. Кроме того, желательно изменять просвет устья в целях приспособления к изменениям в организме пациента или режиме лечения, или, в экстренном случае, для снятия непроходимости или тяжелого расширения пищевода. Обычно при регулировании гидравлического желудочного бандажа требовалось регулярно посещать лечащего врача, при этом использовали иглу Хьюбера и шприц для прохода через кожу пациента и добавления или удаления жидкости из баллона через инъекционный порт. Недавно были разработаны имплантируемые насосы, которые обеспечивают неинвазивное регулирование бандажа. Внешнее программное устройство, связанное с имплантированным насосом, управляет насосом посредством телеметрии. В ходе регулярного посещения врач помещает переносную часть программного устройства вблизи желудочного импланта и передает силовые и командные сигналы импланту. Имплант в свою очередь регулирует уровни текучей среды в бандаже и передает ответный сигнал программному устройству.
Импланты, такие как описанные выше, включают электронные схемы для хранения данных, передачи данных, электропитания и т.п. Например, такие устройства могут оборудоваться внутренним источником питания или конденсатором, тогда как другие могут оснащаться внешним источником питания или пассивной телеметрической системой. Часто такая внутренняя электронная схема может повреждаться при воздействии внешнего источника энергии. Например, воздействие стерилизующего облучения может неблагоприятно повлиять на схему и, в конечном счете, привести к отказу системы. Поскольку стерилизация облучением является предпочтительной, исходя из экономических, экологических и эксплуатационных факторов, сохраняется потребность в системе и способе, обеспечивающих устойчивость к воздействию облучения в процессе стерилизации.
Сущность изобретения
Настоящее изобретение обеспечивает имплантируемое медицинское устройство и систему с внутренней электронной схемой, устроенной таким образом, чтобы выдерживать определенное количество облучения, включая количество облучения, применяемое в процессе стерилизации. В общем, система включает внутренний модуль управления, электрически связанный с имплантируемым медицинским устройством, которое устроено таким образом, чтобы располагаться в брюшной полости пациента. Например, медицинское устройство может являться имплантируемым ограничивающим устройством, устроенным таким образом, чтобы производить ограничение в проводящем пути. Внутренний модуль управления может включать монтажную плату, отдельные компоненты и/или любое количество интегральных схем (например, специализированных интегральных схем), где схема, или, по меньшей мере, некоторая ее часть, изготовлена таким образом, чтобы выдерживать некоторое количество радиации. Например, некоторая часть схемы может быть изготовлена с использованием радиационностойкого (устойчивого к облучению) материала (например, керамического материала, титана, золота, серебра, тантала, платины, палладия, родия и т.д.). Кроме того, схема может быть изготовлена (по меньшей мере, частично) из арсенида галлия. Кроме того, по меньшей мере, некоторая часть схемы может быть изготовлена с использованием технологии "кремний на диэлектрике" ("КНД"). Дополнительно, схема может включать различные компоненты, которые являются по природе не поддающимися воздействию такой радиации (например, Магниторезистивное Оперативное Запоминающее Устройство).
Настоящее изобретение обеспечивает различные аспекты имплантируемого медицинского устройства и системы, имеющей внутреннюю схему, которая способна выдерживать определенное количество радиации (облучения). В одном из таких аспектов система включает имплантируемое медицинское устройство, устроенное таким образом, чтобы располагаться в брюшной полости пациента. Например, имплантируемое устройство может являться имплантируемым ограничивающим устройством, устроенным таким образом, чтобы производить ограничение проводящего пути. Дополнительно система включает внутренний модуль управления в электрической связи, по меньшей мере, с одним из имплантируемого медицинского устройства или внешнего устройства, где модуль управления может включать компоненты схемы, устойчивые к некоторому количеству радиации (например, количеству радиации, которое применяется в процессе стерилизации имплантируемого устройства). Компоненты схемы (которые могут присутствовать в любом датчике, микропроцессоре, микроконтроллере, схеме формирования сигнала, вентильной матрице, специализированной интегральной схеме, запоминающем устройстве, магнитном оперативном запоминающем устройстве, магнитной схеме управления, устройстве на акустических волнах, монтажной плате и т.д.) могут быть изготовлены различными способами, таким образом, чтобы выдерживать такое облучение (то есть функционировать после воздействия облучения, например, в целях стерилизации). Например, по меньшей мере, один из компонентов схемы может быть изготовлен, по меньшей мере, частично, из радиационностойкого материала. Такие материалы могут включать керамический материал, титан, золото, серебро, тантал, платину, палладий, родий и т.д. Дополнительно, в некоторых вариантах исполнения, по меньшей мере, один из компонентов схемы может быть изготовлен, по меньшей мере, частично, из арсенида галлия. В одном варианте исполнения, по меньшей мере, один из компонентов схемы может быть изготовлен с использованием технологии "кремний на диэлектрике". Например, компоненты схемы могут включать, по меньшей мере, один слой кремния, имеющий верхнюю поверхность и нижнюю поверхность, при этом компоненты схемы могут дополнительно включать, по меньшей мере, один слой диэлектрика, расположенный, по меньшей мере, на одной из поверхностей слоя кремния. Слой диэлектрика может включать различные материалы. Например, слой диэлектрика может включать сапфир, диоксид кремния и т.д.
Компоненты системы могут быть устойчивыми к различным типам и/или дозам радиации. В примере осуществления компоненты схемы могут быть устойчивыми к количеству радиации, применяемому в процессе обработки гамма-излучением. Стерилизующая радиация на одну дозу может являться любым количеством приблизительно до 50 килогрей (кГр) (например, в диапазоне приблизительно от 25 килогрей (кГр) до приблизительно 50 кГр). Дополнительно компоненты могут быть также устроены таким образом, чтобы выдерживать дополнительные дозы приблизительно от 25 кГр до приблизительно 50 кГр, в общей сложности приблизительно до 100 кГр или выше, если необходимо. Более низкие дозы радиации (например, ниже 25 кГр) могут использоваться тогда, когда состояние среды производства строго контролируют. Как указано, также могут использоваться различные типы излучения. Например, излучение (радиация) может являться гамма-излучением, рентгеновским излучением, электроннолучевым излучением и т.д.
В другом аспекте настоящее изобретение обеспечивает имплантируемую медицинскую систему, которая включает имплантируемое медицинское устройство, устроенное таким образом, чтобы располагаться в брюшной полости пациента, а также имплантируемый модуль управления, имеющий множество электронных компонентов (например, устройство на поверхностных акустических волнах), которые устроены таким образом, чтобы выдерживать определенную дозу радиации (например, гамма-излучения, рентгеновского излучения, электроннолучевого излучения). В примере осуществления определенная доза радиации представляет собой гамма-излучение, обеспечивающее стерилизацию имплантируемого медицинского устройства. Хотя различные дозы радиации находятся в пределах сущности и объема настоящего описания, в примере осуществления определенная доза радиации представляет собой любое количество до приблизительно 50 кГр. Дополнительно, компоненты могут быть также устроены таким образом, чтобы выдерживать дополнительные дозы приблизительно от 25 кГр до приблизительно 50 кГр, в общей сложности приблизительно до 100 кГр или выше, если необходимо. Компоненты электронной схемы могут быть изготовлены различными способами, таким образом, чтобы являться устойчивыми к радиации. Например, по меньшей мере, один из компонентов электронной схемы может быть изготовлен с использованием технологии "кремний на диэлектрике". При использовании такой технологии компоненты электронной схемы могут включать, по меньшей мере, один слой кремния, имеющий верхнюю поверхность и нижнюю поверхность, при этом компоненты электронной схемы могут дополнительно включать, по меньшей мере, один слой диэлектрика, расположенный, по меньшей мере, на одной из поверхностей слоя кремния. Кроме того, компоненты электронной схемы могут быть изготовлены, по меньшей мере, частично, из радиационностойкого материала.
Дополнительно, настоящее изобретение обеспечивает различные аспекты способа стерилизации имплантируемого медицинского устройства. В одном таком аспекте способ включает обеспечение имплантируемого медицинского устройства, устроенного таким образом, чтобы располагаться в брюшной полости пациента. Например, имплантируемое устройство может представлять собой имплантируемое ограничивающее устройство, устроенное таким образом, чтобы производить ограничение проводящего пути. Имплантируемое устройство включает внутренний модуль управления с любым числом электронных компонентов, устроенных таким образом, чтобы являться стойкими к определенной дозе радиации. Кроме того, способ включает обработку имплантируемого медицинского устройства определенной дозой радиации. Компоненты электронной схемы могут быть устроены и/или изготовлены различными способами при условии, что они будут обладать такой радиационной стойкостью. Например, компоненты электронной схемы могут быть изготовлены с использованием технологии "кремний на диэлектрике", изготовлены, по меньшей мере, частично, из радиационностойких материалов, изготовлены, по меньшей мере, частично, из арсенида галлия и т.д.
Определенная доза радиации может включать любой тип и/или количество радиации, способное к обеспечению нужного эффекта (например, стерилизации имплантируемого медицинского устройства). Например, радиация может являться гамма-излучением, рентгеновским излучением, электроннолучевым излучением и т.д. Дополнительно, радиацию можно подавать в различных количествах. Например, радиацию можно подавать в количестве приблизительно до 50 кГр. Кроме того, способ может включать подачу, по меньшей мере, одной дополнительной дозы определенного количества радиации. Например, способ может включать воздействие дополнительных доз приблизительно от 25 кГр до приблизительно 50 кГр, в общей сложности приблизительно до 100 кГр или выше, если необходимо.
Краткое описание чертежей
Настоящее описание можно будет понять в полной мере из последующего подробного описания, рассматриваемого в совокупности с сопровождающими чертежами, в которых:
фиг.1A представляет собой изображение в перспективе одного из вариантов осуществления системы ограничения потребления пищи;
фиг.1B представляет собой изображение в перспективе одного из вариантов осуществления системы ограничения;
фиг.2А представляет собой изображение в перспективе желудочного бандажа системы ограничения, показанной на фиг.1B;
фиг.2B представляет собой изображение в перспективе желудочного бандажа, показанного на фиг.2A, наложенного на соединение желудка с пищеводом пациента;
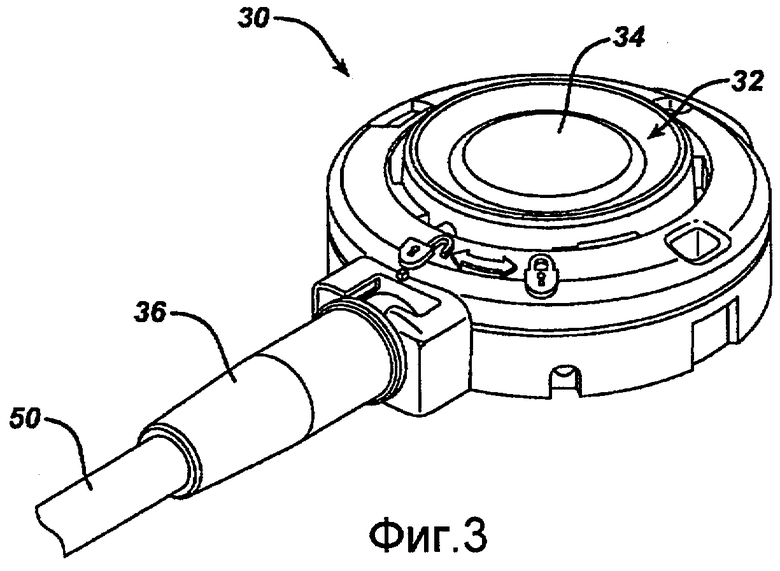
фиг.3 представляет собой изображение в перспективе инъекционного порта для жидкости системы ограничения, показанной на фиг.1B;
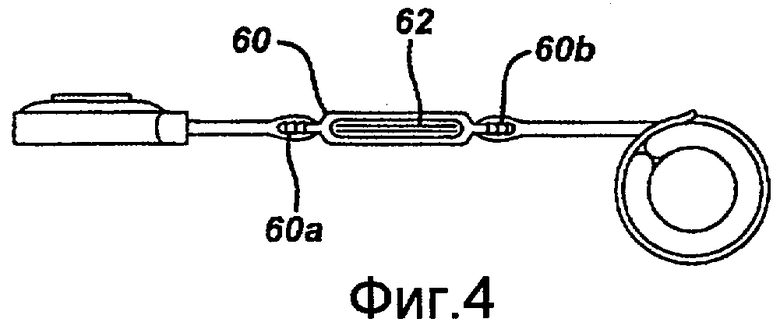
фиг.4 представляет собой изображение в перспективе другого варианта осуществления системы ограничения;
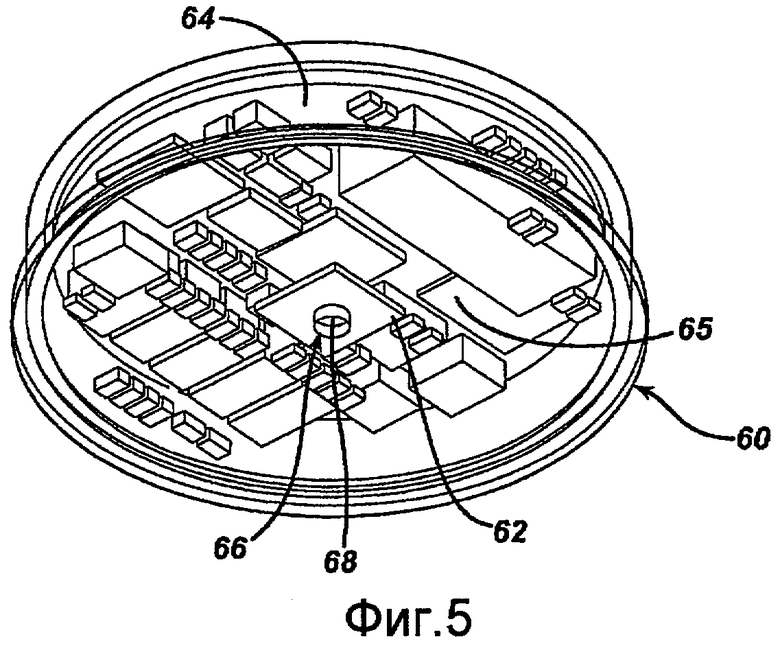
фиг.5 представляет собой изображение в перспективе корпуса датчика, показанного на фиг.1А;
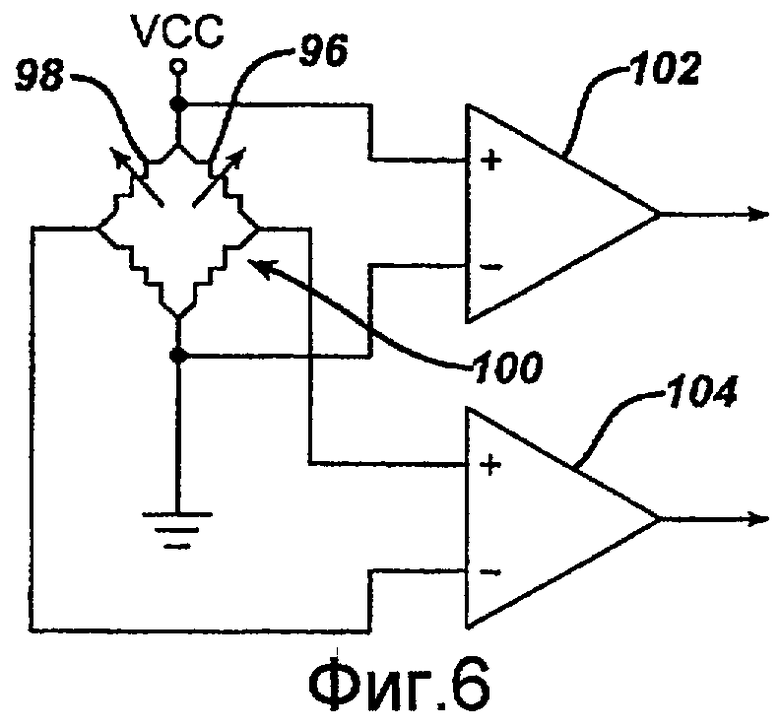
фиг.6 представляет собой схематическое изображение варианта осуществления схемы переменного сопротивления для датчика давления фиг.5;
фиг.7 представляет собой блок-схему одного из вариантов осуществления системы управления давлением для использования вместе с системой ограничения, показанной на фиг.4;
фиг.8A представляет собой изображение интегральной схемы, изготовленной с использованием технологии "кремний на диэлектрике";
фиг.8B представляет собой поперечное сечение интегральной схемы фиг.8A;
фиг.8C представляет собой другое поперечное сечение интегральной схемы фиг.8A;
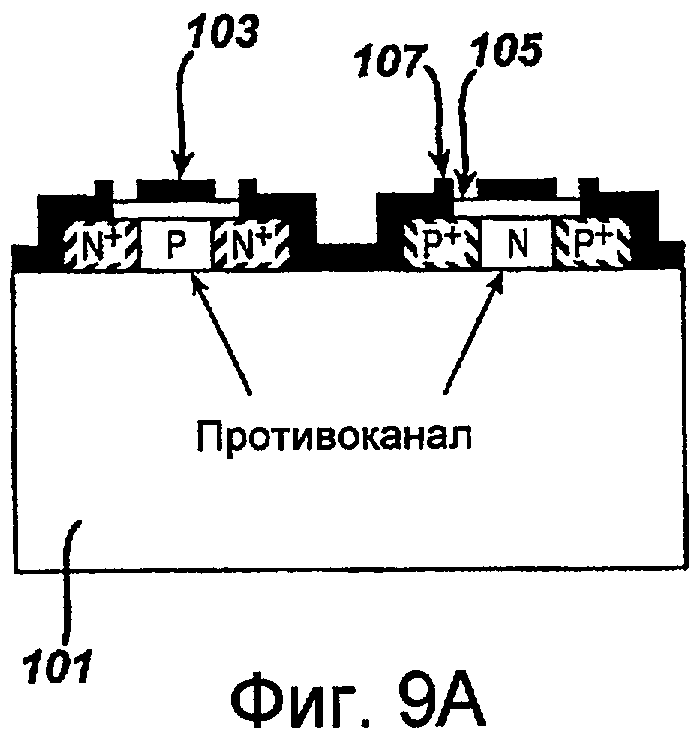
фиг.9A представляет собой поперечное сечение другого варианта осуществления интегральной схемы, изготовленной с использованием технологии "кремний на диэлектрике";
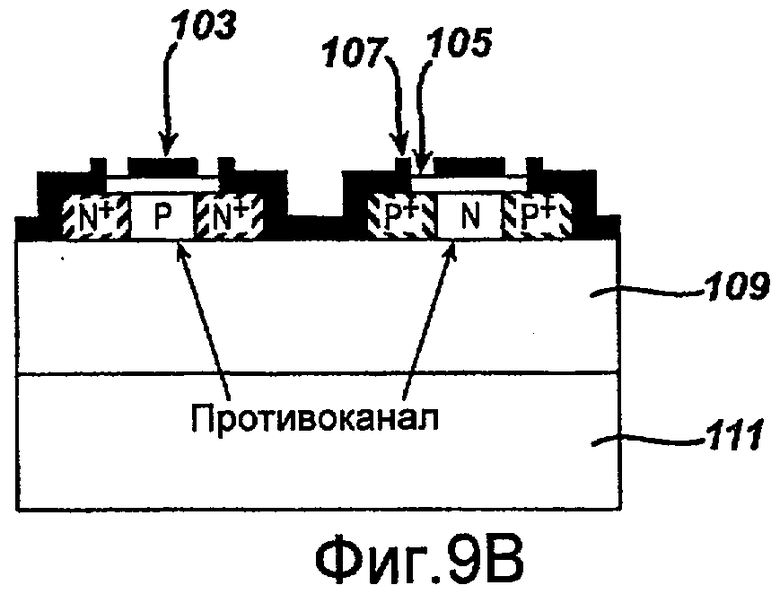
фиг.9B представляет собой поперечное сечение еще одного варианта осуществления интегральной схемы, изготовленной с использованием технологии "кремний на диэлектрике";
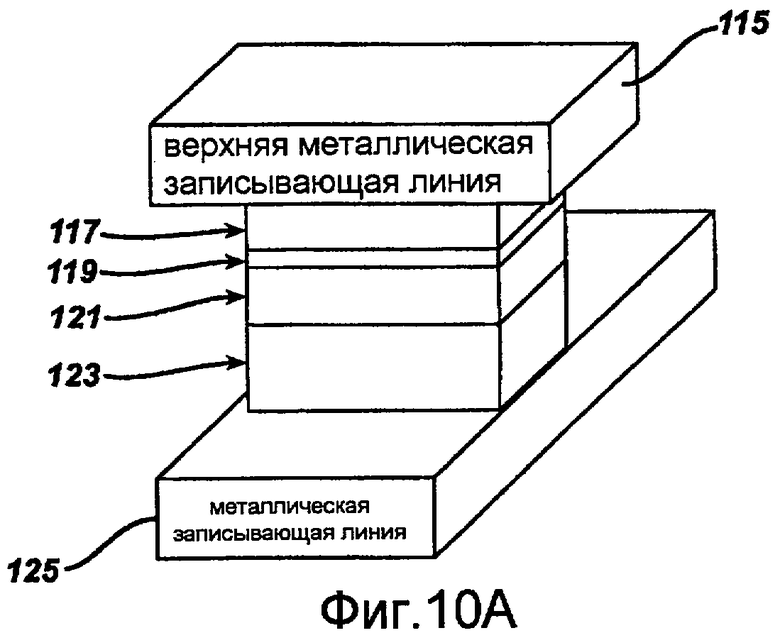
фиг.10A представляет собой изображение внутренней схемы, включая Магнитное Оперативное Записывающее Устройство ("МОЗУ"); и
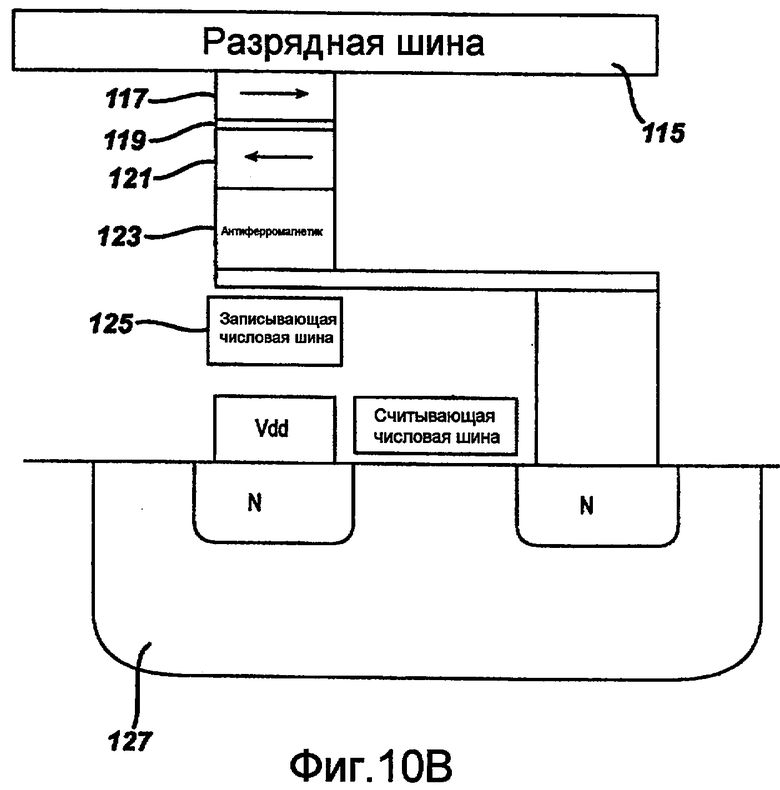
фиг.10B представляет собой поперечное сечение компонента МОЗУ, включенного в интегральную схему.
Подробное описание изобретения
Некоторые примеры осуществления будут описаны далее, с целью обеспечить полное понимание принципов конструкции, действия, изготовления, а также применения устройств, систем и способов, раскрытых в настоящем описании. Один или более примеров указанных вариантов осуществления показаны в сопровождающих чертежах. Специалисты, квалифицированные в данной области, осведомлены, что устройства и способы, конкретно описанные в настоящем документе и показанные в сопровождающих чертежах, представляют собой неограничивающие примеры осуществления, и что возможности настоящего описания определяются исключительно формулой изобретения. Признаки, показанные или описанные применительно к одному примеру осуществления, могут быть объединены с признаками других вариантов осуществления. Такие модификации и изменения включены в объем настоящего описания.
Настоящее изобретение обеспечивает имплантируемое медицинское устройство и систему, имеющую такую внутреннюю схему, которая выдерживает определенное количество радиации. Количество радиации может являться любым количеством, быть любого типа (например, гамма-излучением, рентгеновским излучением, электроннолучевым излучением), и/или дозой, необходимой для достижения требуемого терапевтического эффекта (например, стерилизации). Например, внутренняя схема может являться устойчивой к дозе радиации в количестве приблизительно до 100 килогрей ("кГр"), включая разовую дозу в диапазоне приблизительно от 25 кГр до приблизительно 50 кГр. Как будет описано, внутренняя схема может быть устроена таким образом, чтобы выдерживать подобные требуемые количества радиации различными способами. Например, некоторая часть схемы (например, монтажной платы, интегральной схемы, индивидуального компонента и т.д.) может быть изготовлена, по меньшей мере, частично, с использованием широкого диапазона радиационностойких материалов (например, керамического материала, титана, золота, серебра, тантала, платины, палладия и родия). Дополнительно, схема может быть изготовлена с использованием арсенида галлия. Кроме того, некоторая часть схемы может быть изготовлена с использованием технологии "кремний на диэлектрике" ("КНД"), которая, например, позволяет различным компонентам интегральной схемы быть электрически изолированными друг от друга благодаря присутствию диэлектрического материала (например, сапфира), нанесенного на обычную кремниевую подложку. Дополнительно, схема может включать компоненты, которые являются по природе стойкими к радиации в некоторой степени. Например, такие компоненты могут включать Магниторезистивное Оперативное Записывающее Устройство ("МОЗУ"), устройства на поверхностных акустических волнах и т.д. Таким образом, подобная радиационная защита обеспечивает эффективное сопротивление имплантируемой системы воздействию облучения в процессе требуемой стерилизации.
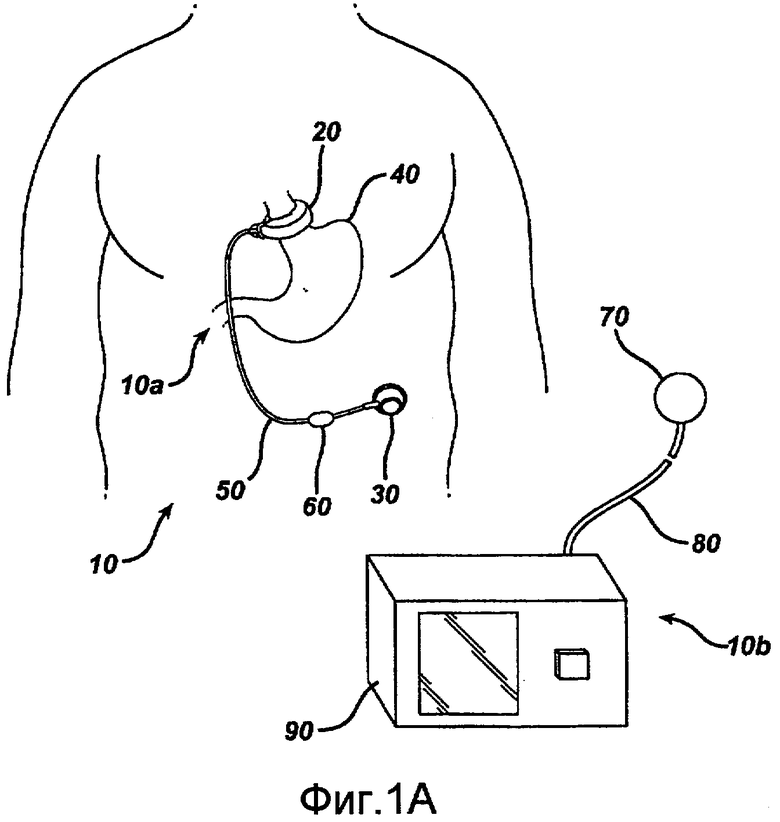
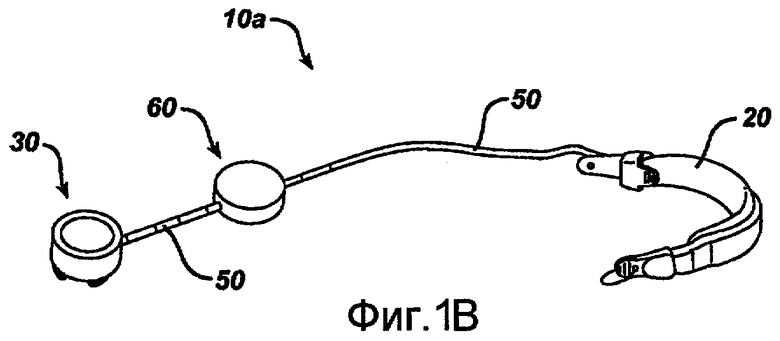
Как смогут оценить специалисты, квалифицированные в данной области техники, различные варианты осуществления имплантируемого медицинского устройства и системы находятся в рамках сущности и объема настоящего раскрытия. В примере осуществления имплантируемая система включает имплантируемое медицинское устройство, имеющее такую конструкцию, чтобы располагаться в брюшной полости пациента. Например, имплантируемое медицинское устройство может представлять собой имплантируемое ограничивающее устройство, которое имеет такую конструкцию, чтобы производить ограничение проводящего пути. На фиг.1А показан один пример осуществления системы ограничения потребления пищи 10. Как показано, система 10 обычно включает имплантируемую часть 10a и внешнюю часть 10b. На фиг.1B показана имплантируемая часть 10a вне организма пациента. Как показано, имплантируемая часть 10a включает регулируемый желудочный бандаж 20, который устроен таким образом, чтобы его можно было разместить вокруг верхней части желудка пациента 40, и корпус инъекционного порта 30, который находится в жидкостной связи с регулируемым желудочным бандажом 20, например, посредством катетера 50. Инъекционный порт 30 может иметь такое устройство, чтобы обеспечивать введение и удаление жидкости из желудочного бандажа 20, чтобы таким образом регулировать размер бандажа 20, в результате чего к желудку 40 прикладывается давление. Инъекционный порт 30, таким образом, может быть имплантирован в участок тела, который является доступным через ткань. Как правило, инъекционные порты помещают в боковую подреберную область брюшной полости пациента под кожу и слои жировой ткани. Хирурги обычно также имплантируют инъекционные порты на грудину пациента.
Внутренняя часть 10a может также включать сенсорный или измерительный прибор, который находится в жидкостной связи с закрытым жидкостным контуром в имплантируемой части 10a. В одном варианте осуществления сенсорное устройство представляет собой устройство для измерения давления, устроенное таким образом, чтобы измерять давление жидкости (текучей среды) в закрытом жидкостном контуре. Хотя устройство для измерения давления может иметь различную конструкцию и может быть помещено в любое положение вдоль внутренней части 10a, включая положение внутри инъекционного порта 30, в показанном варианте осуществления устройство для измерения давления является датчиком давления, который расположен в корпусе 60 датчика, расположенного рядом с инъекционным портом 30. Катетер 50 может включать первую часть, которая соединяет желудочный бандаж 20 и корпус 60 датчика давления, и вторую часть, которая соединяет корпус 60 датчика давления и инъекционный порт 30. Хотя вполне ясно, что сенсорное устройство может быть устроено таким образом, чтобы регистрировать данные, относящиеся к одному или более текущим параметрам, обычно оно будет описываться в настоящем документе в контексте устройства для измерения давления.
Кроме того, как показано на фиг.1А, внешняя часть 10b обычно включает устройство для считывания данных 70, которое устроено таким образом, чтобы находиться на поверхности кожи над корпусом 60 датчика давления (который может быть имплантирован под толстым слоем ткани, например, более 10 см толщиной), неинвазивно сообщаясь с корпусом 60 датчика давления и, таким образом, регистрируя параметры давления. Устройство для считывания данных 70 необязательно может быть электрически соединено (беспроводным способом или с помощью проводов, в данном варианте осуществления посредством электрического кабеля в сборе 80) с блоком управления 90, который может показывать значения давления, другие данные, получаемые от устройства для считывания данных 70, и/или предупредительные сигналы. Хотя в данном примере показанный блок управления 90 расположен поблизости с пациентом, он может быть расположен поблизости или на удалении от пациента.
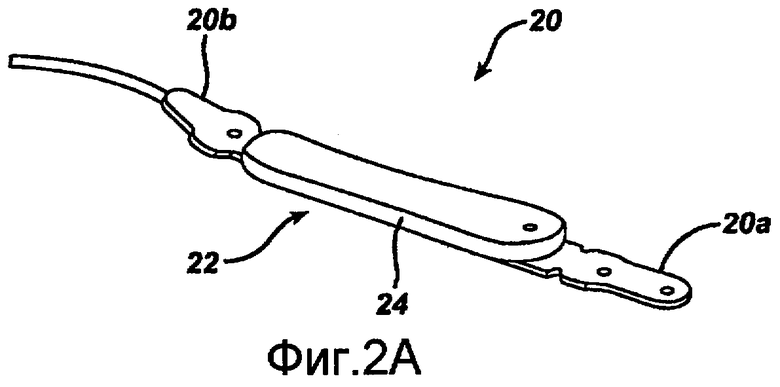
На фиг.2А желудочный бандаж 20 показан более подробно. Хотя желудочный бандаж 20 может иметь различные конструкции, и с настоящим описанием могут использоваться различные желудочные бандажи, известные на настоящий момент в уровне техники, в показанном варианте осуществления желудочный бандаж 20 обычно имеет удлиненную форму, при этом несущий элемент 22, имеющий первый и второй противоположные концы 20a и 20b, может принимать форму петли, причем концы соединяются друг с другом. Различные способы соединения могут использоваться для соединения концов 20a и 20b друг с другом. В показанном варианте осуществления концы 20a и 20b находятся в форме ремней, которые соединяются вместе, и при этом один расположен сверху другого. В другом варианте осуществления, показанном, например, на фиг.1B и 2B, несущий элемент на одном конце желудочного бандажа 20 может включать отверстие, через которое может проходить другой конец желудочного бандажа 20, и, таким образом, концы фиксируются друг с другом. Желудочный бандаж 20 может также включать элемент переменного объема, такой как накачиваемый баллон 24, который расположен или закреплен на одной из сторон несущего элемента 22 и который устроен таким образом, чтобы соприкасаться с тканью. Баллон 24 может расширяться или сжиматься вокруг внешней стенки желудка, регулируя просвет устья с целью контролируемого ограничения поступления пищи в желудок.
Специалист, квалифицированный в данной области техники, осведомлен, что желудочный бандаж может иметь ряд других конструкций. Кроме того, различные способы и устройства, раскрытые в настоящем описании, имеют равную применимость к другим типам имплантируемых бандажей. Например, бандажи используются для контроля недержания кала, как описано в Патенте США 6461292, который, таким образом, включен посредством отсылки. Бандажи могут также использоваться для контроля недержания мочи, как описано в заявке на патент США 2003/0105385, которая, таким образом, включена посредством отсылки. Бандажи могут также использоваться для лечения изжоги и/или кислотного рефлюкса, как описано в Патенте США 6470892, который, таким образом, включен посредством отсылки. Бандажи могут также использоваться для лечения импотенции, как описано в заявке на патент США 2003/0114729, которая, таким образом, включена посредством отсылки.
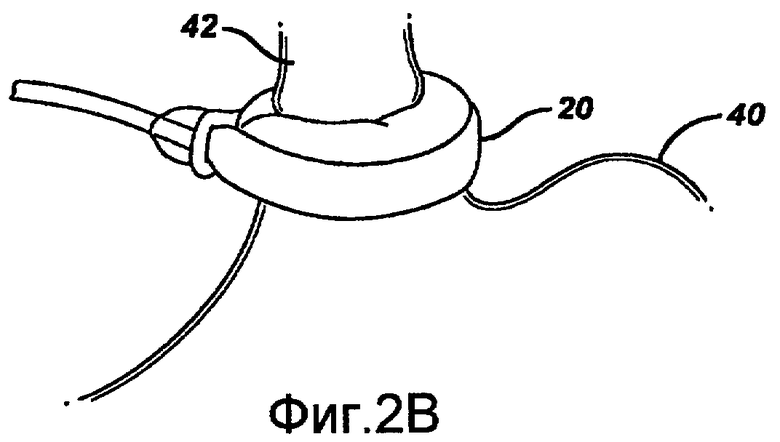
На фиг.2B показан регулируемый желудочный бандаж 20, наложенный на соединение желудка с пищеводом пациента. Как показано, бандаж 20, по меньшей мере, почти полностью окружает верхнюю часть желудка 40 вблизи соединения с пищеводом пациента 42. После того как бандаж 20 имплантирован, предпочтительно в спущенной конфигурации, когда бандаж 20 содержит малое количество или не содержит жидкости, бандаж 20 может быть накачан, например, с использованием соляного раствора, с целью уменьшения просвета устья. Специалисту, квалифицированному в данной области техники, понятно, что различные способы, включая механические и электрические способы, могут использоваться для регулировки бандажа 20. На фиг.2B также показан альтернативный вариант положения сенсорного устройства 41, расположенного в застежке 43 бандажа 20.
Инъекционный порт 30 для жидкости может также иметь различную конфигурацию. В варианте осуществления, показанном на фиг.3, инъекционный порт 30 имеет в целом цилиндрический корпус, причем внешняя или нижняя поверхность и периферическая стенка тянутся проксимально от нижней поверхности и определяют внутреннее отверстие 32. Внутреннее отверстие 32 может включать мембрану 34, протыкаемую иглой, расположенную в отверстии и обеспечивающую доступ в емкость для жидкости (не показана на фиг.3), расположенную внутри корпуса. Мембрана 34 предпочтительно расположена на достаточно близком расстоянии, при котором глубина бассейна является вполне достаточной, чтобы открытый наконечник иглы, например иглы Хьюбера, выходил наружу, в результате чего может происходить подача жидкости. Мембрана 34 предпочтительно устроена таким образом, что она сама затягивается после прокола иглой и извлечения иглы. Как также показано на фиг.3, порт 30 может дополнительно включать элемент для присоединения катетера 36, который находится в жидкостной связи с емкостью и устроен таким образом, чтобы присоединять катетер (например, катетер 50). Специалист, квалифицированный в данной области техники, осведомлен, что корпус может быть изготовлен из ряда материалов, включая нержавеющую сталь, титан или полимерные материалы, а мембрана 34 аналогично может быть изготовлена из ряда материалов, включая силикон.
Считывающее устройство 70 может также иметь ряд конфигураций, при этом один из примеров считывающего устройства для определения давления более подробно описан в заявках на патент США 2006/0189888 и 2006/0199997 настоящего заявителя, которые, таким образом, включены посредством отсылки. В целом, считывающее устройство 70 позволяет неинвазивно определять давление жидкости в имплантированной части 10a, даже когда датчик-измеритель давления имплантирован под толстым слоем (по меньшей мере, более 10 см) подкожной жировой ткани. Врач может прижимать считывающее устройство 70 к коже пациента вблизи положения корпуса 60 датчика и/или положения (положений) датчика-измерителя давления, получая зарегистрированные значения давления и, возможно, другую информацию, как обсуждалось в настоящем описании, и наблюдая показатели давления (и/или другие данные) на экране блока управления 90. Устройство для считывания данных 70 может быть также присоединено к пациенту с возможностью отсоединения, как дополнительно описано ниже, например, в ходе длительного обследования, с помощью ремней, клейких материалов и других известных способов. Устройство для считывания данных 70 может работать через обычные тканевые или бумажные хирургические салфетки и может также включать съемный чехол (не показан), который можно менять для каждого пациента.
Как указано выше, система 10 может также включать один или более датчиков для контроля работы системы ограничения желудка 10. Датчик(и) может быть устроен таким образом, чтобы измерять различные рабочие параметры системы 10, включая, помимо прочих, давление в системе, температуру в системе, такт или частоту перистальтических импульсов, ширину перистальтических импульсов, продолжительность перистальтических импульсов, а также амплитуду перистальтических импульсов. В одном из примеров осуществления система может включать датчик в виде устройства для измерения давления, который соединен с закрытым жидкостным контуром и устроен таким образом, чтобы измерять давление жидкости в системе, которое соответствует степени сжатия, приложенного регулируемым желудочным бандажом к желудку пациента. В ходе использования измерение давления жидкости или любого другого контрольного параметра системы может позволить врачу оценить работу системы ограничения. В варианте осуществления, показанном на фиг.4, устройство для измерения давления присутствует в виде датчика давления 62, расположенного в корпусе 60 датчика. Впрочем, устройство для измерения давления может быть расположено в любом месте в пределах закрытого гидравлического контура имплантируемой части, при этом различные примеры расположения и конфигураций более подробно раскрыты в заявке на патент США 2006/0211913 настоящего заявителя, озаглавленной "Неинвазивное измерение давления в регулируемом жидкостью ограничивающем устройстве", поданной 7 марта 2006 года и, таким образом, включенной посредством отсылки. Как правило, показанный корпус 60 датчика включает впускное отверстие 60a и выпускное отверстие 60b, которые находятся в жидкостной связи с жидкостью в имплантируемой части 10a. Имплантированный ранее катетер 50 может быть оснащен корпусом 60 датчика, например, путем разъединения катетера 50 и вставки зазубренных наконечников (или любых других соединителей, таких как зажимы, хомуты, клейкие материалы, сварка и т.д.) в разъединенные концы катетера 50. Датчик 62 может быть расположен в корпусе 60 и устроен таким образом, чтобы регистрировать изменения давления жидкости в пределах гидравлического контура и преобразовывать изменения давления в подходящую форму данных.
Различные датчики давления, известные в уровне техники, могут использоваться в качестве датчика давления 62, например, беспроводной датчик давления, поставляемый CardioMEMS, Inc. of Atlanta, Georgia, хотя подходящий датчик давления на основе Микроэлектромеханических Систем ("MEMS") может быть получен из любого другого источника, включая, помимо прочих, Integrated Sensing Systems, Inc. (ISSYS) Ypsilanti, Michigan и Remon Medical Technologies, Inc. Waltham, Massachusetts. Один из примеров MEMS-датчика давления описан в Патенте США 6855115, описание которого включено в настоящее описание путем отсылки исключительно в наглядных целях. Специалист, квалифицированный в данной области техники, сумеет оценить, что подходящие датчики давления могут включать, помимо прочих, емкостные, пьезорезистивные, кремниевые тензорезисторные или ультразвуковые (акустические) датчики давления, а также различные другие устройства, позволяющие измерять давление.
Один из вариантов конфигурации корпуса 60 датчика, внутри которого расположен датчик 62, показан на фиг.5. Корпус 60 датчика в данном примере включает объединительную плату, которая может служить в качестве герметичного контейнера, предотвращая контакт жидкости с какими-либо элементами, расположенными внутри корпуса 60 датчика, кроме датчика 62, как указано выше. Корпус 60 датчика может быть изготовлен из любого биологически совместимого материала, подходящего для применения внутри тела, такого как полимер, биологически совместимый металл и материал других подобных типов. Кроме того, корпус 60 датчика может быть изготовлен из какого-либо одного или нескольких прозрачных (как показано на фиг.5), непроницаемых, полупроницаемых и непроницаемых для излучения материалов. Монтажная плата 64, включающая помимо других элементов микроконтроллер 65 (например, процессор), может также располагаться внутри корпуса 60, помогая обрабатывать и передавать показатели давления, собранные датчиком 62, а также, возможно, другие данные, связанные с бандажом 20. Как дополнительно указано ниже, монтажная плата 64 может также включать телеметрическую катушку и конденсатор для чрескожной передачи энергии (TET). Необязательно в монтажную плату 64 может быть интегрирован датчик температуры. Микроконтроллер 65, TET/телеметрическая катушка, конденсатор и/или датчик температуры могут быть связаны через монтажную плату 64 или через любой другой подходящий компонент(ы). Как описано ниже, TET/телеметрическая катушка и конденсатор могут вместе формировать регулируемый резонансный контур для приема энергии от внешней части 10b и передачи измеренных значений давления в считывающее устройство для определения давления, например, считывающее устройство 70. Кроме того, поскольку телеметрический элемент, связанный с датчиком давления 62, не может достичь внешнего, по отношению к пациенту, телеметрического устройства без некоторой помощи, то такую помощь можно обеспечить любым подходящим количеством реле (не показаны) или других устройств, подходящим количеством реле (не показаны) или других устройств.
При использовании жидкость (текучая среда) может поступать в корпус 60 датчика через отверстие 66, расположенное где-либо на поверхности корпуса (в данном случае нижняя поверхность), и приходить в контакт с чувствительной к давлению сенсорной поверхностью 68 датчика 62. Датчик 62 обычно герметично впаян на объединительной плате, в результате чего жидкость, входящая в отверстие 66, не может проникнуть внутрь и повлиять на работу датчика 62 за исключением чувствительной к давлению сенсорной поверхности 68. Датчик 62 может измерять давление жидкости, приходя в соприкосновение с чувствительной к давлению сенсорной поверхностью 68, когда жидкость затекает и вытекает из отверстия 66. Например, чувствительная к давлению сенсорная поверхность 68 может включать диафрагму, имеющую такую деформируемую поверхность, что когда жидкость (текучая среда) движется через отверстие 66, жидкость воздействует на поверхность диафрагмы, заставляя поверхность механически деформироваться. Механическая деформация диафрагмы может преобразовываться в электрический сигнал схемой переменного сопротивления, включающей пару переменного сопротивления, кремниевые тензометрические датчики. Один из тензометрических датчиков может быть прикреплен к центральной части диафрагмы для измерения деформации диафрагмы, тогда как второй, спаренный тензометрический датчик может быть прикреплен около внешнего края диафрагмы. Тензометрические датчики могут быть присоединены к диафрагме с помощью клеящих материалов или могут быть распространены в структуре диафрагмы. При колебании давления жидкости в бандаже 20 поверхность диафрагмы может деформироваться вверх или вниз, что вызывает изменение сопротивления в центральном тензометрическом датчике.
Один из вариантов осуществления схемы переменного сопротивления для датчика 62 показан на фиг.6. Схема включает первый и второй тензометрические датчики 96 и 98, которые формируют два верхних элемента сопротивления полукомпенсированного контура измерительного моста Уитстона 100. Поскольку первый тензометрический датчик 96 реагирует на механические деформации диафрагмы сенсора, изменение сопротивления первого датчика 96 изменяет потенциал по верхней части мостикового контура 100. Второй тензометрический датчик 98 спарен с первым тензометрическим датчиком 96 и атермализует мостиковый контур Уитстона 100. Первый и второй дифференциальные усилители 102 и 104 связаны с мостиковым контуром 100 для измерения изменений потенциала в мостиковом контуре 100, вызванных переменным сопротивлением тензометрических датчиков 96 и 98. В частности, первый дифференциальный усилитель 102 измеряет напряжение во всем мостиковом контуре 100, а второй дифференциальный усилитель 104 измеряет дифференциальное напряжение в части тензометрических датчиков мостикового контура 100. Чем больше разность между напряжениями тензометрических датчиков, при постоянном напряжении в мосту, тем больше перепад давления. Выходные сигналы дифференциальных усилителей 102 и 104 могут поступать в микроконтроллер 65, интегрированный в монтажную плату 64, в свою очередь микроконтроллер 65 может передавать показатели давления во внешнее, по отношению к пациенту, устройство. Если необходимо, полностью компенсированный мостиковый контур Уитстона может также использоваться для увеличения чувствительности и точности датчика давления 62. В полностью компенсированном мостиковом контуре к поверхности диафрагмы присоединены четыре тензометрических датчика, а не два.
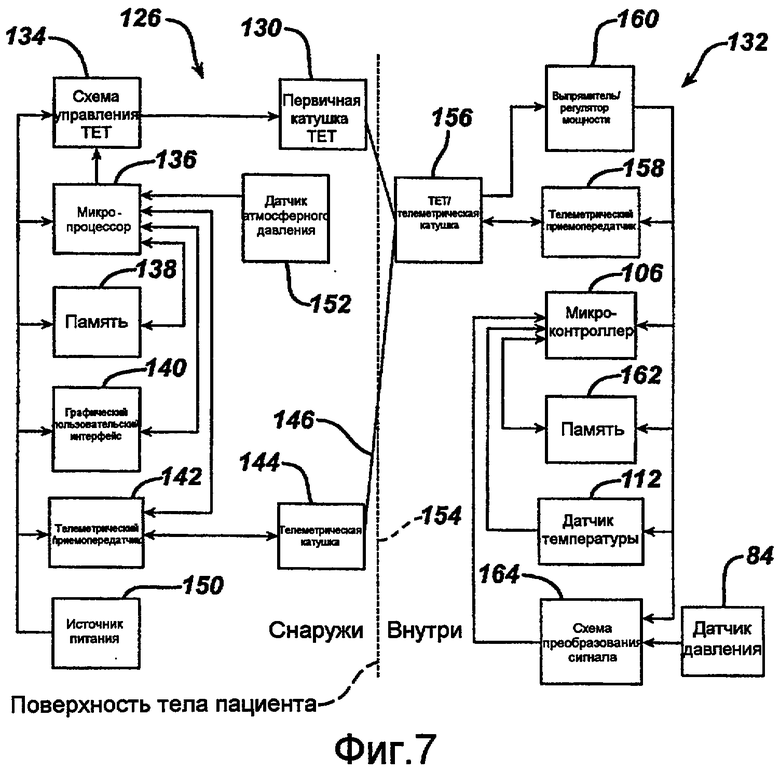
На фиг.7 показан один из вариантов компонентов, включенных во внутренние и внешние части 10a и 10b. Как показано на фиг.7, внешняя часть 10b включает первичную TET-катушку 130, предназначенную для передачи силового сигнала к внутренней части 10a. Телеметрическая катушка 144 также включена во внешнюю часть для передачи сигнала данных к внутренней части 10a. Первичная TET-катушка 130 и телеметрическая катушка 144 объединены и формируют внешнюю антенну, например, считывающее устройство 70. Внешняя часть 10b, например, расположенная в блоке управления 90, может включать схему управления TET 134 для управления подводом энергии к первичной катушке TET 130. Схемой управления TET 134 управляет микропроцессор 136, имеющий сопряженную память 138. Графический пользовательский интерфейс 140 связан с микропроцессором 136 для ввода информации пациента, отображения данных и инструкций врача, и/или печати данных и инструкций врача. Через пользовательский интерфейс 140 пользователь, например, пациент или лечащий врач, может передать запрос на регулировку врачу и может также ввести причины для запроса. Дополнительно пользовательский интерфейс 140 может позволить пациенту прочитать и ответить на инструкции врача и/или сигналы показателей давления.
Внешняя часть 10b может также включать первичный телеметрический приемопередатчик 142 для передачи команд запроса микроконтроллеру 65 и получения от микроконтроллера ответных данных, включая зарегистрированные показатели давления. Первичный приемопередатчик 142 электрически связан с микропроцессором 136 для ввода и приема сигналов команд и данных. Первичный приемопередатчик 142 управляет телеметрической катушкой 144, которая резонирует на выбранной коммуникационной радиочастоте РЧ. Резонирующий контур может генерировать нисходящее переменное электромагнитное поле 146, которое передает командные данные микроконтроллеру 65. В альтернативном варианте приемопередатчик 142 может получать телеметрические сигналы, передаваемые от вторичной TET/телеметрической катушки 156 ("внутренней антенны") во внутренней части 10a. Полученные данные могут быть сохранены в памяти 138, сопряженной с микропроцессором 136. Источник питания 150 может подавать энергию в блок управления 90 с целью подвода питания к элементу (элементам) во внутренней части 10a. Датчик атмосферного давления 152 связан с микропроцессором 136. Микропроцессор 136 может использовать сигнал, поступающий от датчика атмосферного давления 152, регулируя полученные показатели давления в соответствии с изменениями атмосферного давления, обусловленными, например, изменениями атмосферных условий или высоты, что позволяет увеличить точность измерения давления.
На фиг.7 также показаны компоненты внутренней части 10a, которые в данном варианте осуществления включены в корпус 60 датчика (например, на монтажной плате 64). Как показано на фиг.7, вторичная TET/телеметрическая катушка 156 получает силовой/коммуникационный сигнал 132 от внешней антенны. Вторичная катушка 156 формирует регулируемый резонансный контур, который индуктивно соединен с первичной TET катушкой 130 для подачи энергии в имплант или с первичной телеметрической катушкой 144 для приема и передачи данных. Телеметрический приемопередатчик 158 регулирует обмен данными с вторичной катушкой 156. Дополнительно внутренняя часть 10a включает выпрямитель/регулятор мощности 160, микроконтроллер 65, память 162, сопряженную с микроконтроллером 65, датчик температуры 112, датчик давления 62 и схему преобразования сигнала 164. Имплантированные компоненты могут передавать показатели давления (с поправками или без поправок на температуру и т.д.) от датчика 62 в блок управления 90 через антенну (первичную TET катушку 130 и телеметрическую катушку 144). Показатели давления могут храниться в памяти 138, корректироваться с учетом атмосферного давления, отображаться на дисплее блока управления 90 и/или передаваться, по возможности в режиме реального времени, на удаленную контрольную станцию, находящуюся на расстоянии от пациента.
Как указано выше, внутренняя схема или, по меньшей мере, некоторая ее часть может быть изготовлена и/или разработана так, чтобы она могла выдерживать воздействие радиации. Обеспечение радиационной стойкости представляет собой способ разработки и испытания электронных компонентов и систем, который позволяет сделать их устойчивыми к повреждению или сбоям, вызванным высокоэнергетическими субатомными частицами и электромагнитным излучением. Как известно специалистам, квалифицированным в данной области техники, излучение может оказывать широкий спектр неблагоприятных воздействий на электросхему. Подобные эффекты могут накапливаться в ходе многократных воздействий излучения (то есть, Суммарная Доза Ионизации), или подобные эффекты могут вытекать из разового приложения такой энергии (то есть, Разовые Эффекты). В любом случае, такие эффекты могут повредить внутреннюю схему, что приводит к неэффективной обработке данных и/или отказу системы. Представленная в данный момент внутренняя схема может быть защищена от эффекта (эффектов) некоторой определенной дозы, типа и/или количества излучения, воздействующего на устройство, обеспечивая некоторый желательный терапевтический эффект (например, стерилизацию устройства). В примере осуществления внутренняя схема изготовлена и/или разработана так, чтобы схема и, таким образом, функциональные возможности устройства непосредственно могли выдерживать количество излучения в диапазоне приблизительно до 100 кГр (включая разовую дозу в диапазоне приблизительно от 25 кГр до приблизительно 50 кГр). В некоторых вариантах осуществления внутренняя схема может быть изготовлена таким образом, чтобы выдерживать многократные дозы радиации в диапазоне приблизительно от 25 кГр до приблизительно 50 кГр (приблизительно до 100 кГр или выше, если необходимо). Примеры внутренней схемы, которая может быть изготовлена, скомпонована и/или произведена таким образом, чтобы выдерживать такое излучение, включают монтажную плату, интегральную схему (например, специализированную интегральную схему), вентильную матрицу, устройство на поверхностных акустических волнах (ПАВ), схему с магнитным управлением, датчик, микропроцессор, микроконтроллер, запоминающее устройство, схемы формирования сигнала и т.д.
Стойкость внутренней схемы к воздействию излучения может обеспечиваться различными способами. Например, схема может быть изготовлена, по меньшей мере, частично, из любого материала из ряда радиационностойких материалов. Примеры таких материалов включают керамические материалы, титан, золото, серебро, тантал, платину, палладий, родий и т.д. Различные другие подобные материалы будут известны специалистам, квалифицированным в данной области. В примере осуществления внутренняя схема или, по меньшей мере, некоторая ее часть может быть изготовлена с применением технологии "кремний на диэлектрике" (КНД). Технология КНД относится к применению кремниевой подложки, прослоенной кремниевым диэлектриком, вместо обычных кремниевых подложек в производстве полупроводников, в особенности микроэлектроники, что позволяет снизить паразитную емкость устройства и, таким образом, улучшить рабочие характеристики. Устройства на основе технологии КНД отличаются от обычных производимых на основе кремния устройств тем, что кремниевый p-n-переход находится над электрическим диэлектриком, обычно сапфиром или диоксидом кремния. Выбор диэлектрика зависит в значительной степени от предполагаемого применения, при этом сапфир используется в чувствительных к излучению применениях, а диоксид кремния обычно используется для улучшения производительности и уменьшения короткоканальных эффектов в микроэлектронике. Точная толщина изолирующего слоя и внешнего слоя кремния может также значительно изменяться в зависимости от назначения, о чем осведомлен специалист в данной области.
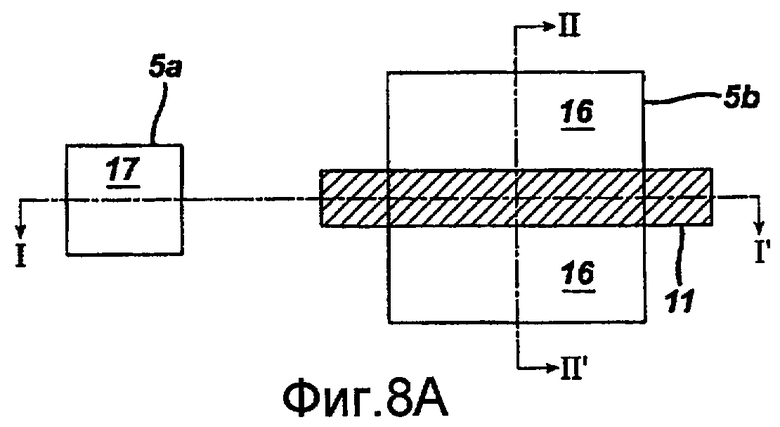
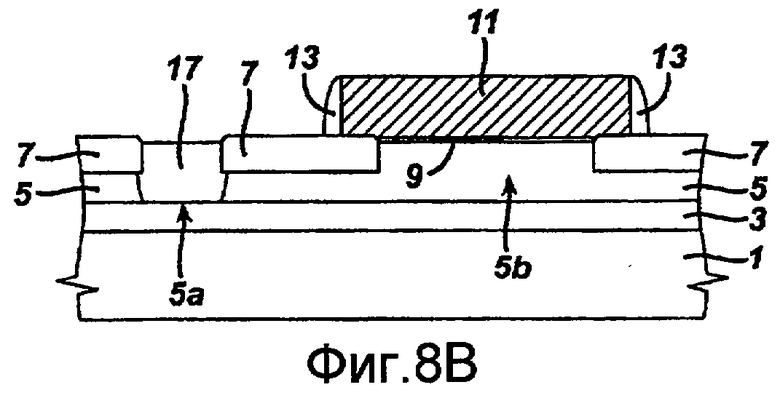
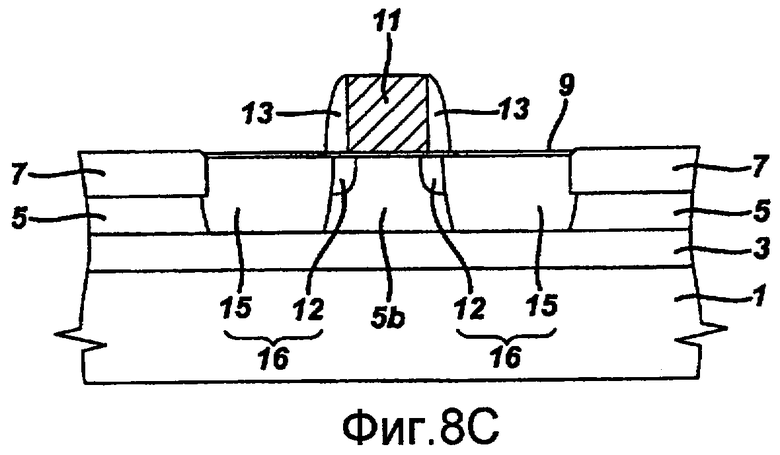
На фиг.8A-8C приведен пример интегральной схемы, изготовленной с помощью технологии КНД. Фиг.8A является видом сверху, на котором схематично изображен обычный транзистор КНД. Кроме того, фиг.8B является поперечным сечением по линии I-I' фиг.8A, а фиг.8C является поперечным сечением по линии II-II' фиг.8A. Как показано, структура КНД обычно включает несущую подложку 1, внутренний изолирующий слой 3 на несущей подложке 1 и слой полупроводника 5 первого типа проводимости на внутреннем изолирующем слое 3. Слой полупроводника 5 может быть вытравлен с формированием области частичных канавок, глубина которых меньше, чем толщина слоя полупроводника 5. Таким образом, остальной слой полупроводника находится под областью частичных канавок. Область частичных канавок определяет активную область транзистора 5b, при этом активная область контакта 5a отделена от активной области транзистора 5b. Затем область частичных канавок заполняется изолирующим слоем 7. Структура изолированного затвора 11 пересекает активную область транзистора 5b. Структура изолированного затвора 11 электрически изолирована от активной области транзистора 5b слоем подзатворного диэлектрика 9. Истоковые/стоковые области 16 второго типа проводимости сформированы в активной области транзистора 5b и расположены по обеим сторонам структуры изолированного затвора 11. Каждая из истоковых/стоковых областей 16 может иметь структуру слаболегированного стока (LDD). Указанная структура LDD включает слаболегированную область 12 и сильнолегированную область 15 и может быть выполнена с использованием разделителя 13, расположенного на боковой стенке структуры изолированного затвора 11. Здесь истоковые/стоковые области 16 сформированы так, чтобы они соприкасались с внутренним изолирующим слоем 3 для уменьшения паразитной емкости. Легирующие примеси первого типа проводимости внесены в активную область контакта 5a, формируя, таким образом, контактный карман 17 в активной области контакта 5a.
На фиг.9A и 9B приведены альтернативные варианты осуществления такой устойчивой КНД схемы. Например, на фиг.9A показано поперечное сечение интегральной схемы, в которой тонкий слой кремния 107 расположен на сапфировой подложке 101. Дополнительно схема включает затворный элемент, включающий металл 103 и нижележащий оксид 105. В качестве альтернативы на фиг.9B показана интегральная схема, сформированная из слоя диэлектрика 109, изготовленного, например, из диоксида кремния, расположенного на кремниевой подложке 111. Кроме того, как и на фиг.9A, схема дополнительно включает тонкий слой кремния 107, расположенный на слое диэлектрика 109. Как сможет оценить специалист, квалифицированный в данной области, идентичность и/или толщина каждого слоя могут быть разработаны специальным образом, чтобы обеспечить требуемые функциональные свойства и/или устойчивость к излучению.
КНД обеспечивает множество специфических преимуществ, способных ослабить или устранить и эффекты Суммарной Дозы Ионизации, и эффекты Разового Облучения. Например, КНД по существу устраняют фиксирование. Фиксирование представляет собой самопроизвольное формирование, что может происходить из-за воздействия стерилизующей радиации, низкоомного пути между планками источника питания электронного компонента, приводящего к возникновению паразитной структуры, которая затем действует как цепь короткого замыкания, нарушая правильное функционирование части, и возможно даже ведущий к ее разрушению из-за перегрузки по току. Конструкция на основе КНД устраняет возможность фиксирования, что достигается посредством слоя изолирующего оксида (называемого "канавкой") вокруг, например, n-МОП ("n-МОП") и p-МОП ("p-МОП") транзисторов. Это нарушает паразитную структуру между указанными транзисторами.
Дополнительно, во внутренней схеме может применяться технология с использованием арсенида галлия (GaAs). Как известно, GaAs проявляет различные свойства, превосходящие свойства кремния (например, способность выдерживать излучение) в работе полупроводников. Таким образом, технология с использованием GaAs может применяться, например, в таких компонентах как запоминающие устройства, солнечные устройства, солнечные фотогальванические элементы и полевые транзисторы (ПТ). Как было указано, GaAs обладает некоторыми электронными свойствами, которые превосходят свойства кремния. Например, GaAs имеет более интенсивную скорость движения электронов и более высокую подвижность электронов, что позволяет транзисторам, изготовленным из GaAs, функционировать при частотах выше приблизительно 250 ГГц. Кроме того, устройства на основе GaAs производят меньше шума, чем устройства на основе кремния, при работе на высоких частотах. Устройства на основе GaAs могут также работать при более высоких уровнях мощности, чем эквивалентное устройство на основе кремния, поскольку они имеют более высокие значения напряжения туннельного пробоя.
В дополнение к изготовлению различных частей внутренней схемы, способных выдерживать определенную дозу стерилизующей радиации, внутренняя схема может включать любое количество и/или любой тип компонента (компонентов), которые по природе являются устойчивыми к излучению. Например, во внутренней схеме может использоваться технология на основе магнитного поля, которая позволяет внутренней схеме выдерживать требуемые количества излучения. Различные варианты осуществления такой технологии на основе магнитного поля находятся в рамках сущности и объема настоящего описания. Подобные варианты осуществления могут включать применение Магниторезистивного Оперативного Запоминающего Устройства (МОЗУ), герконов, в которых магнитное поле используется для размыкания и замыкания выключателя, устройств на основе Эффекта Холла, а также индуктивно связанных схем подачи питания, которые включают магнитные катушки, выпрямители и схему регулирования мощности.
Обращаясь снова к Магниторезистивному Оперативному Запоминающему Устройству, МОЗУ представляет собой технологию постоянного запоминающего устройства вычислительной машины (ПЗУ), которая, как известно, по существу является стойкой к излучению. В отличие от обычных технологий чипов ОЗУ, в МОЗУ данные не сохраняются в форме электрического заряда или электротоков, а сохраняются на магнитных элементах запоминающего устройства. Как показано на фиг.10A, элементы сформированы из двух ферромагнитных пластин 117 и 121, каждая из которых может сохранять магнитное поле, отделенных тонким изолирующим слоем 119. Одна из указанных двух пластин представляет собой постоянный магнит 121 с установленной специфической полярностью, а поле другой пластины 117 изменяется, приходя в соответствие с внешним полем. Запоминающее устройство состоит из сетки таких "ячеек".
Считывание достигается путем измерения электрического сопротивления ячейки. Конкретная ячейка (обычно) выбирается посредством включения сопряженного транзистора, который переключает ток от линии подачи питания через ячейку к земле. Из-за магнитного туннельного эффекта электрическое сопротивление ячейки изменяется из-за ориентации полей в указанных двух пластинах 117 и 121. Путем измерения результирующего тока может быть определено сопротивление в любой конкретной ячейке и, таким образом, полярность перезаписываемой пластины. Обычно, если указанные две пластины имеют одну и ту же полярность, это означает "0", а если указанные две пластины имеют противоположную полярность, сопротивление будет выше, и это означает "1".
Данные записываются в ячейки с помощью различных способов. Например, в одном варианте осуществления каждая ячейка лежит между парой записывающих линий 115 и 125, расположенных под прямым углом друг к другу, выше и ниже ячейки. Когда ток пропускается через линии 115 и 125, в узле создается индуцированное магнитное поле, которое собирает перезаписываемая пластина. На фиг.10B приведен пример схемы МОЗУ, включенной в кремниевую (или КНД) подложку 127. Опять же, квалифицированные в данной области специалисты сумеют понять, что данные изображения являются лишь примерами, а схема может включать широкий диапазон архитектуры и/или компонентов, способных выдерживать требуемый процесс стерилизации.
Другим примером радиационностойкого устройства является устройство на поверхностных акустических волнах (ПАВ), такое как метка радиочастотной идентификации (RFID). Устройства ПАВ по существу устойчивы к повышенным рабочим температурам, жесткому рентгеновскому излучению и/или стерилизующему гамма-излучению. В примере осуществления ПАВ RFID-метка (поставляемая фирмой RF SAW, Inc.; Richardson, Texas) работает с использованием пьезоэлектрического эффекта и передает заданные программные данные с устройства, посылая акустические импульсы, которые отражаются назад к блоку считывания. Устройства ПАВ также обычно используются для генерации электромагнитных импульсов, которые отражаются назад к блоку считывания. Дополнительно, устройства ПАВ могут применяться в качестве фильтров электропомех из-за их длительного времени распространения. Например, устройство ПАВ могло бы являться полосовым фильтром, а также другими типами радиочастотных фильтров, что будет очевидно для специалистов, квалифицированных в данной области.
В дополнение к системам и устройствам, описанным выше, предлагается способ стерилизации имплантируемого медицинского устройства. Как указано выше, различные типы имплантируемых медицинских устройств могут применяться совместно с раскрытым в настоящем описании способом. Например, имплантируемое устройство может быть устроено таким образом, чтобы располагаться в брюшной полости пациента. В примере осуществления способ включает обеспечение имплантируемого ограничивающего устройства, которое устроено таким образом, чтобы производить ограничение проводящего пути. Аналогично вышеуказанному, имплантируемое медицинское устройство может включать внутренний модуль управления с электронными компонентами, устроенными таким образом, чтобы выдерживать определенную дозу радиации. Примеры электронных компонентов, которые могут быть изготовлены, скомпонованы и/или произведены согласно указанному способу, включают монтажную плату, интегральную схему (например, специализированную интегральную схему), вентильную матрицу, устройство на поверхностных акустических волнах, схему с магнитным управлением, датчик, микропроцессор, микроконтроллер, запоминающее устройство, схему формирования сигнала и т.д. Способ может также включить поставку предопределенной дозы радиации на имплантируемое медицинское устройство.
Внутренние компоненты могут быть скомпонованы любым способом, который позволяет обеспечить требуемую стойкость к излучению. Например, электронный компонент (компоненты) может быть изготовлен, по меньшей мере, частично, из радиационностойкого материала (например, керамического материала, титана, золота, серебра, тантала, платины, палладия, родия и т.д.). Дополнительно, компоненты электронной схемы могут быть изготовлены, по меньшей мере, частично, с применением технологии с использованием арсенида галлия. Кроме того, по меньшей мере, некоторая часть внутренней схемы может быть изготовлена с использованием технологии КНД. Кроме того, внутренняя схема может включать различные компоненты, которые являются по природе стойкими к излучению. Как указано выше, такие компоненты могут включать устройства ПАВ и/или различные устройства, изготовленные с использованием технологии на основе магнитного поля (например, МОЗУ).
Внутренняя схема может быть изготовлена и/или разработана таким образом, чтобы являться устойчивой к любой степени, дозе, типу и/или количеству радиации, необходимым для обеспечения требуемой стерилизации. Например, радиация может представлять собой гамма-излучение, рентгеновское излучение, электроннолучевое излучение и т.д. Кроме того, доза радиации (разовая доза или суммарная) может являться любым количеством, необходимым для обеспечения требуемой стерилизации. Например, в примере осуществления суммарная доза может составлять приблизительно до 100 кГр (включая разовые дозы в диапазоне приблизительно от 25 кГр до приблизительно 50 кГр). В некоторых вариантах осуществления режим стерилизации может включать обработку, по меньшей мере, одной дополнительной дозой определенного количества радиации. Как смогут оценить специалисты, квалифицированные в данной области, любое количество стерилизующей радиации, поданной в виде разовой дозы или многократных доз, находится в рамках сущности и объема раскрытого в настоящем описании способа.
Устройства, раскрытые в настоящем описании, могут быть сконструированы таким образом, чтобы их необходимо было утилизировать после разового применения, или они могут быть сконструированы таким образом, чтобы их можно было применять многократно. Впрочем, в любом случае устройство может быть восстановлено для повторного применения, по меньшей мере, после одного использования. Восстановление может включать любую комбинацию операций разборки устройства с последующей чисткой или заменой отдельных деталей и последующей повторной сборкой. В частности, устройство может быть разобрано, при этом любое число отдельных деталей или частей устройства может быть выборочно заменено или удалено в любой комбинации. После очистки и/или замены отдельных деталей устройство может быть повторно собрано для последующего использования либо на ремонтном предприятии, либо операционной бригадой непосредственно перед хирургической операцией. Квалифицированные специалисты смогут оценить, что при ремонте устройства могут применяться различные способы разборки, очистки/замены и повторной сборки. Применение таких способов и получаемое отремонтированное устройство находятся в рамках объема настоящей заявки.
Специалист, квалифицированный в данной области техники, способен оценить дополнительные признаки и преимущества изобретения, основываясь на вышеописанных вариантах осуществления. Таким образом, настоящее изобретение не должно ограничиваться тем, что было конкретно показано и описано, за исключением указанного в приложенной формуле. Все публикации и ссылки, процитированные в настоящем описании, прямо включены в настоящее описание в полном объеме путем отсылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| АВТОМАТИЧЕСКИ РЕГУЛИРУЮЩАЯСЯ БАНДАЖНАЯ СИСТЕМА С НАСОСОМ МЕМS | 2009 |
|
RU2506060C2 |
| АВТОМАТИЧЕСКИ РЕГУЛИРУЮЩАЯСЯ БАНДАЖНАЯ СИСТЕМА | 2009 |
|
RU2493784C2 |
| СПОСОБЫ И УСТРОЙСТВА ДЛЯ ФИКСИРОВАНИЯ ОРИЕНТАЦИИ АНТЕННЫ В ОГРАНИЧИТЕЛЬНОЙ СИСТЕМЕ | 2009 |
|
RU2506050C2 |
| УПРАВЛЕНИЕ ДАВЛЕНИЕМ В РЕГУЛИРУЕМЫХ ОГРАНИЧИТЕЛЬНЫХ УСТРОЙСТВАХ | 2009 |
|
RU2499564C2 |
| ЭЛЕКТРОННО-ЛУЧЕВАЯ СТЕРИЛИЗАЦИЯ МЕДИЦИНСКОГО УСТРОЙСТВА С БИОАКТИВНЫМ ПОКРЫТИЕМ | 2010 |
|
RU2591829C2 |
| ЭНЕРГОСНАБЖЕНИЕ ИМПЛАНТИРУЕМЫХ СИСТЕМ ОГРАНИЧЕНИЯ С ПРИМЕНЕНИЕМ ТЕМПЕРАТУРЫ | 2009 |
|
RU2495646C2 |
| АНАЛИЗ ФИЗИОЛОГИЧЕСКИХ ПАРАМЕТРОВ ДЛЯ ИМПЛАНТИРУЕМОГО УСТРОЙСТВА ОГРАНИЧЕНИЯ И РЕГИСТРИРУЮЩЕГО УСТРОЙСТВА | 2009 |
|
RU2501519C2 |
| АНАЛИЗ ДАННЫХ ДЛЯ ИМПЛАНТИРУЕМОГО ОГРАНИЧИВАЮЩЕГО УСТРОЙСТВА И УСТРОЙСТВА РЕГИСТРАЦИИ ДАННЫХ | 2009 |
|
RU2502460C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ СТЕРИЛИЗОВАННОГО УСТРОЙСТВА ПОДКОЖНОГО ДОСТУПА И СТЕРИЛИЗОВАННОЕ УСТРОЙСТВО ПОДКОЖНОГО ДОСТУПА | 2015 |
|
RU2674082C2 |
| СИСТЕМА И СПОСОБ ИЗМЕРЕНИЯ КОНЦЕНТРАЦИИ РАДИОФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ | 2011 |
|
RU2599866C2 |
Группа изобретений относится к медицине. Способ стерилизации имплантируемого медицинского устройства по первому варианту включает обеспечение имплантируемого медицинского устройства, сконструированного таким образом, чтобы располагаться в брюшной полости пациента. Имплантируемое медицинское устройство находится в электрической связи с внутренним модулем контроля, содержащим любое количество электронных компонентов, выполненных таким образом, чтобы являться устойчивыми к определенной дозе радиации. По меньшей мере один из электронных компонентов содержит Магниторезистивное Оперативное Запоминающее Устройство (МОЗУ). По меньшей мере один из электронных компонентов выполнен с возможностью измерения давления текучей среды внутри имплантируемого медицинского устройства. Способ также включает подвод определенной дозы радиации к имплантируемому медицинскому устройству. Способ по второму варианту включает обеспечение имплантируемого медицинского устройства, содержащего любое количество электронных компонентов, выполненных с возможностью управления имплантируемым медицинским устройством. По меньшей мере один из электронных компонентов содержит Магниторезистивное Оперативное Запоминающее Устройство (МОЗУ). По меньшей мере один из электронных компонентов изготовлен с использованием технологии "кремний на диэлектрике" с сапфировым диэлектриком. Способ также включает подвод радиации к имплантируемому медицинскому устройству для его стерилизации. Способ по третьему варианту включает обеспечение имплантируемого медицинского устройства, содержащего любое количество электронных компонентов, выполненных с возможностью управления имплантируемым медицинским устройством. По меньшей мере один из электронных компонентов содержит Магниторезистивное Оперативное Запоминающее Устройство (МОЗУ). По меньшей мере один из электронных компонентов изготовлен с использованием технологии "кремний на диэлектрике" с диэлектриком диоксидом кремния. Подвод радиации к имплантируемому медицинскому устройству для его стерилизации. Изобретения обеспечивают устойчивость к воздействию облучения в процессе стерилизации. 3 н. и 10 з.п. ф-лы, 10 ил.
1. Способ стерилизации имплантируемого медицинского устройства, включающий:
обеспечение имплантируемого медицинского устройства, сконструированного таким образом, чтобы располагаться в брюшной полости пациента, причем имплантируемое медицинское устройство находится в электрической связи с внутренним модулем контроля, содержащим любое количество электронных компонентов, выполненных таким образом, чтобы являться устойчивыми к определенной дозе радиации, где по меньшей мере один из электронных компонентов содержит Магниторезистивное Оперативное Запоминающее Устройство (МОЗУ), при этом по меньшей мере один из электронных компонентов выполнен с возможностью измерения давления текучей среды внутри имплантируемого медицинского устройства; и
подвод определенной дозы радиации к имплантируемому медицинскому устройству.
2. Способ по п.1, где имплантируемое медицинское устройство представляет собой ограничивающее устройство, сконструированное таким образом, чтобы производить ограничение проводящего пути.
3. Способ по п.1, где по меньшей мере один из электронных компонентов изготовлен с применением технологии "кремний на диэлектрике".
4. Способ по п.1, где радиация выбрана из группы, состоящей из гамма-излучения, рентгеновского излучения и электронно-лучевого излучения.
5. Способ по п.1, где определенная доза радиации составляет любое количество приблизительно до 100 кГр.
6. Способ по п.1, дополнительно включающий подвод по меньшей мере одной дополнительной дозы определенного количества радиации.
7. Способ стерилизации имплантируемого медицинского устройства, включающий:
обеспечение имплантируемого медицинского устройства, содержащего любое количество электронных компонентов, выполненных с возможностью управления имплантируемым медицинским устройством, где по меньшей мере один из электронных компонентов содержит Магниторезистивное Оперативное Запоминающее Устройство (МОЗУ), при этом по меньшей мере один из электронных компонентов изготовлен с использованием технологии "кремний на диэлектрике" с сапфировым диэлектриком; и
подвод радиации к имплантируемому медицинскому устройству для его стерилизации.
8. Способ по п.7, где имплантируемое медицинское устройство представляет собой ограничивающее устройство, сконструированное таким образом, чтобы производить ограничение проводящего пути.
9. Способ по п.7, где определенная доза радиации составляет любое количество приблизительно до 100 кГр.
10. Способ по п.7, где радиация выбрана из группы, состоящей из гамма-излучения, рентгеновского излучения и электроннолучевого излучения.
11. Способ стерилизации имплантируемого медицинского устройства, включающий:
обеспечение имплантируемого медицинского устройства, содержащего любое количество электронных компонентов, выполненных с возможностью управления имплантируемым медицинским устройством, где по меньшей мере один из электронных компонентов содержит Магниторезистивное Оперативное Запоминающее Устройство (МОЗУ), при этом по меньшей мере один из электронных компонентов изготовлен с использованием технологии "кремний на диэлектрике" с диэлектриком диоксидом кремния; и
подвод радиации к имплантируемому медицинскому устройству для его стерилизации.
12. Способ по п.11, где имплантируемое медицинское устройство представляет собой ограничивающее устройство, сконструированное таким образом, чтобы производить ограничение проводящего пути.
13. Способ по п.11, где определенная доза радиации составляет любое количество приблизительно до 100 кГр.
| US 2007167672 A1, 19.07.2007 | |||
| US 2005283172 A1, 22.12.2005 | |||
| Механический колун | 1946 |
|
SU71173A1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ МОРБИДНОГО ОЖИРЕНИЯ | 2001 |
|
RU2207060C1 |
| ХИРУРГИЧЕСКИЙ ЖЕЛУДОЧНЫЙ БАНДАЖ | 2004 |
|
RU2285472C2 |
| US 2007280851 A1, 06.12.2007. | |||
Авторы
Даты
2013-11-10—Публикация
2009-02-06—Подача