МАГНИТНЫЕ ПРЕОБРАЗОВАТЕЛИ
Настоящее изобретение относится к получению биосовместимых магнитных наночастиц, которые генерируют большое количество тепла при воздействии переменного магнитного поля. Генерированное тепло можно использовать, в числе прочего, для терапевтических целей, в частности для борьбы с раком.
Магнитные наночастицы могут преобразовывать энергию магнитного поля в тепло различными путями. Помимо нагрева посредством так называемых потерь на гистерезис, наночастицы могут генерировать тепло посредством релаксации (релаксации по методу Нееля и по методу Брауна, соответственно). Количество генерированной тепловой энергии зависит от напряженности магнитного поля (амплитуды) и частоты переменного поля. Эффективность генерации тепла можно, при определенной напряженности и частоте магнитного поля, оценить посредством значений так называемой SAR (удельный коэффициент поглощения) или SLP (удельная потеря мощности). Значения SAR вещества нормализуют к массе (в граммах), используемой для измерения, и выражают в единицах [Вт/г]. Однако величина SAR магнитного вещества зависит и от других факторов, таких как размер частиц и форма частиц, анизотропия вещества и содержание в нем металла. SAR, предпочтительно, определяют согласно способу, разработанному Jordan et al. [International Journal of Hyperthermia, 1993, Vol. 9, N1, 51-68], при частоте 100 кГц и напряженности поля до 18 кА/м. Здесь, величину SAR показывают нормализацией по содержанию железа в веществе в мВт/мг Fe.
Уровень техники
Биосовместимые магнитные наночастицы часто получают так называемым способом осаждения. Он описывается многими примерами в литературе [например, DE 196 14 136 A1]. Поскольку данные частицы получают в водном растворе, их можно без проблем функционализировать, и обычно они обладают хорошей биосовместимостью. Однако полученные таким способом частицы показывают относительно низкие значения SAR и, следовательно, не могут отвечать изобретательским требованиям данного патента.
Магнитные наночастицы также можно получить так называемыми магнитотактическими бактериями WO 98/40049]. Наночастицы, полученные таким способом, имеют более высокий SAR. Однако способ получения является очень сложным и дорогим. Кроме того, частицы осаждаются относительно быстро, тем самым сильно ограничивая возможные применения.
Давно известно, что термическое разложение комплексов металлов в органических растворителях приводит к образованию коллоидов или наночастиц [например, Smith et al., J. Phys. Chem. 1980, 84, 1621-1629]. Монодисперсные частицы различных размеров можно получить методом, опубликованным Peng et al. [US 2006/0211152 A1] и Hyeon et al. [WO 2006/057533 A1]. Однако частицы, полученные данным методом, диспергируются только в органических растворителях и, следовательно, не являются биосовместимыми. Более того, значения SAR частиц, полученных таким методом, являются низкими. Дисперсии таких (гидрофобных) частиц в воде можно принципиально добиться модифицированием оболочки [например, Wang et al., Nano Lett., 2003, 3(11), 1555-1559 или De Palma et al., Chem. Mater., 2007, 19, 1821-1831]. Данные способы основаны на непосредственном обмене гидрофобных лигандов на гидрофильные лиганды. Данные методы покрытия дают только тонкое (монослойное) покрытие, которое не отвечает требованию стабильного биосовместимого покрытия согласно изобретению. Кроме того, коллоидная стабильность частиц является ограниченной, так что частицы по изобретению нельзя покрыть данным методом. Более того, можно покрыть только сильно разбавленные дисперсии частиц. Таким образом, в промышленном масштабе не существует удовлетворительного технического решения для дисперсии частиц по изобретению. Далее, вещества или растворители, используемые для дисперсии, обычно обладают высокой токсичностью, таким образом, ограничивая биосовместимость.
Биосовместимые наночастицы оксида железа также можно получить покрытием силанами согласно DE 196 14 136 A1, однако данный метод применим только, когда частицы уже диспергированы в воде, тогда как гидрофобные частицы не могут быть легко покрыты силанами или кремниеземом.
Поэтому, цель настоящего изобретения состоит в предложении биосовместимых магнитных частиц с высоким значением SAR в переменном магнитном поле, где покрытие частиц состоит из стабильной, кремнийсодержащей оболочки с толщиной, находящейся в диапазоне от 0,5 до 10 нм, предпочтительно, от 1 нм до 6 нм и, более предпочтительно, 3 нм. Напряженность переменного магнитного поля, используемого для определения SAR, находится в диапазоне, предпочтительно, между 3 и 18 кА/м, и частота находится в диапазоне между 1 кГц и 100 МГц и, предпочтительно, между 10 и 1000 кГц.
Описываемая задача решается способом получения по пункту 1, наночастицами по пункту 26, фармацевтической композицией по пункту 28 и использованием наночастиц по пункту 31.
Дальнейшие преимущественные варианты осуществления вытекают из зависимых пунктов формулы изобретения, примеров, фигур и описания.
Настоящее изобретение относится к биосовместимым наночастицам со стабильной кремнийсодержащей оболочкой, которая имеет предпочтительную толщину в диапазоне от 0,5 до 10 нм, более предпочтительно, от 1 нм до 6 нм, еще более предпочтительно, от 2 нм до 4 нм и, наиболее предпочтительно, 3 нм, и которая имеет высокое значение SAR в переменном магнитном поле, где напряженность переменного магнитного поля, предпочтительно, находится между 3 и 18 кА/м, и где частота, предпочтительно, находится между 10 и 1000 кГц.
Согласно настоящему изобретению частицы с высоким значением SAR можно получить способом, включающим следующие стадии:
A1) подготовку композиции, по меньшей мере, одного железосодержащего соединения A в, по меньшей мере, одном органическом растворителе LM1,
B1) нагрев композиции при температуре в диапазоне от 50°C до температуры на 50°C ниже действительной температуры реакции железосодержащего соединения A согласно стадии C1 в течение по меньшей мере 10 минут,
C1) нагрев композиции до температуры между 200°C и 400°C,
D1) очистку полученных частиц,
E1) суспендирование очищенных наночастиц в воде или водном растворе кислоты,
F1) добавление поверхностно-активного соединения в водный раствор, полученный согласно стадии E1),
G1) обработку водного раствора согласно стадии F1) ультразвуком,
H1) очистку водной дисперсии частиц, полученных согласно стадии G1),
I1) получение дисперсии частиц согласно стадии H1) в смеси растворителя, содержащей воду и растворитель, смешиваемый с водой,
J1) добавление алкоксисилана к дисперсии частиц в смеси растворителя согласно стадии I1),
K1) очистку частиц.
Стадии от A1 до K1 обычно следуют одна за другой, где дополнительная стадия A2 может иметь место после стадии A1 и до стадии B1, и/или дополнительная стадия B2 может иметь место после стадии B1 и до стадии C1. Аналогично, после стадий C1, D1, E1, F1, G1, H1, I1, J1 или K1 может необязательно следовать стадия окисления C2, D2, E2, F2, G2, H2, I2, J2 или K2. Здесь, стадия C2, D2, E2, F2, G2, H2, I2, J2 или K2 также обозначается как стадия X2. Дополнительные стадии A2, B2 и/или X2 являются необязательными и несущественными для выполнения изобретения.
Далее, специалист в данной области способен адаптировать и оптимизировать реакционные параметры в зависимости от выбранной температуры реакции или от выбранного железосодержащего соединения A или от других выбранных компонентов. Например, специалист в данной области может оптимизировать продолжительность периода нагрева B1 соответствующей реакции таким образом, чтобы образовывались частицы с максимальным SAR. Продолжительность минимального периода нагрева составляет 10 минут; для специалиста в данной области техники очевидно, что период нагрева станет короче с повышением температуры. Подобным образом, специалист в данной области техники может адаптировать скорость нагрева, конечную температуру и время выдерживания конечной температуры в стадии C1 таким образом, чтобы образовывались частицы с максимальным SAR.
Частицы, предпочтительно, представляют собой наночастицы, имея в виду частицы с диаметром в нанометровом диапазоне, где микрочастицы также могут быть получены согласно способу по изобретению.
Используемые железосодержащие соединения A или используемое железосодержащее соединение A будет, предпочтительно, выбрано из группы, включающей в себя или состоящей из соединений комплексов железа, соединений карбонилов железа, солей железа, особенно солей железа с насыщенными или ненасыщенными жирными кислотами, органических соединений железа и сандвичевых комплексов железа.
В качестве соединений карбонилов железа можно назвать дикарбонил железа (Fe(CO)2), тетракарбонил железа (Fe(CO)4) или пентакарбонил железа (Fe(CO)5), а примерами солей железа являются дихлорид железа, дибромид железа, дифторид железа, дийодид железа, трихлорид железа, трибромид железа, трифторид железа, трийодид железа, сульфат железа (II), сульфат железа (III), ацетат железа, оксалат железа, нитрат железа (II), нитрат железа (III), карбонат железа, гидроксид железа (II), гидроксид железа (III), фосфат железа, трехжелезистый дифосфат. Ферроцен представляет собой пример комплекса железа типа ″сэндвич″, а ацетилацетонат железа является примером соединения комплекса железа. В качестве металлоорганических соединений железа рассматриваются, например, ацетат железа (II), акрилат железа (III), олеат железа (III), алкоксиды железа, такие как этоксид (этилат) железа (III), или также соединения карбонилов железа, такие как ацетилциклобутадиен(трикарбонил)железо, бутадиен(трикарбонил)железо и олефин(тетракарбонил)железо.
В качестве органического растворителя LM1 можно использовать все высококипящие растворители. Предпочтительными являются растворители из группы, включающей в себя или состоящей из высококипящих аминов, алканов, олефинов, спиртов или эфиров. Более того, можно использовать моноэфиры и диэфиры диолов (алкандиолов), а также моноэфиры, диэфиры, триэфиры триолов (алкантриолов), моноэфиры алкиленгликоля, диэфиры алкиленгликоля, моноэфиры этиленгликоля, диэфиры этиленгликоля, моноэфиры пропиленгликоля, диэфиры пропиленгликоля, моноэфиры глицерина, диэфиры глицерина, триэфиры глицерина и диэфиры гликоля (глимы). Растворитель L2 также можно выбрать из группы, указанной выше.
Особенно предпочтительными растворителями LM1, а также LM2, являются диэфиры гликоля (также называемые ″глимами″) с минимальной температурой кипения 200°C. Для получения наночастиц из солей железа (например, хлоридов) также подходит этиленгликоль. В принципе, точка кипения растворителя должна быть выше 150°C, более предпочтительно, выше, чем 175°C и, особенно предпочтительно, выше, чем 200°C.
По меньшей мере, одно железосодержащее соединение A диспергируют, растворяют или суспендируют в растворителе LM1 и затем полученную композицию нагревают до температуры в диапазоне от 50°C до температуры на 50°C ниже действительной температуры реакции железосодержащего соединения A согласно стадии C1 в течение минимального периода 10 минут. Под действительной температурой реакции понимают температуру образования частиц, которая находится в диапазоне между 200°C и 400°C. Таким образом, температура зародышеобразования согласно стадии B1 находится в диапазоне между 50°C и максимум 350°C, однако всегда, по меньшей мере, на 50°C ниже температуры согласно стадии C1. Таким образом, нагревание одного или более железосодержащих соединений A в органическом растворителе LM1 или в смеси органических растворителей LM1, предпочтительно, осуществляют при температуре примерно на 50°C ниже действительной температуры образования частиц соединения A согласно стадии C1.
Данную фазу нагрева перед образованием частиц согласно стадии B1 используют для формирования так называемых затравочных кристаллов, которые в дальнейшем дают возможность образования заданных частиц. Период времени фазы нагрева оказывает значительное влияние на SAR полученных в результате частиц, предпочтительно, наночастиц, генерируемых на стадии C1. Для получения частиц или наночастиц с высоким значением SAR достигнутую температуру поддерживают в течение минимального периода 10 минут, предпочтительно, в течение минимального периода 30 минут и особенно предпочтительно в течение минимального периода примерно 40 минут. Таким образом, композицию, по меньшей мере, одного железосодержащего соединения A и, по меньшей мере, одного растворителя LM1 следует нагреть до вышеуказанной температуры в течение, предпочтительно, 30-50 минут.
В зависимости от используемого железосодержащего соединения A, предпочтительно, добиваются температуры, которая примерно на 100°C-300°C, предпочтительно, примерно на 130°C-270°C, более предпочтительно, примерно на 150°C-250°C, еще более предпочтительно, примерно на 170°C-230°C, еще более предпочтительно, примерно на 180°C-220°C, еще более предпочтительно, примерно на 190°C-210°C и, особенно предпочтительно, примерно на 200°C ниже действительной температуры реакции для формирования частиц согласно стадии C1, где предназначенная температура составляет не ниже 70°C, предпочтительно, не ниже 90°C и особенно предпочтительно не ниже 100°C. Предпочтительно, температуру в течение первой фазы нагрева будут поддерживать при 100°C-150°C, согласно стадии B1.
Чтобы оказать влияние на образование затравочных кристалов, или содействовать этому, можно добавить добавки или поверхностно-активные соединения согласно стадии A2). Используемые здесь термины ″добавка″ или ″поверхностно-активное соединение″ ставятся в контексте, что большинство добавок также представляет собой поверхностно-активные соединения, что, однако, не является необходимым случаем для всех добавок. Поэтому, каждое поверхностно-активное соединение можно называть добавкой, где, однако, не каждую добавку можно назвать поверхностно-активным соединением. Они включают тенсиды, силаны, Si- или Al-содержащие органические соединения, фосфины, насыщенные или ненасыщенные жирные кислоты, амины, диамины, карбоновые кислоты и их соли, насыщенные или ненасыщенные жирные кислоты, а также полимеры. Примерами полимеров являются поливиниловый спирт, полиэтиленгликоль, полиакриловая кислота, декстран, PLGA (сополимер молочной и гликолевой кислот), хитин, фибрин, гепарин, хитозан и полиэтиленимин.
После фазы нагрева согласно стадии B1) формирование истинных частиц проводят на стадии C1). Затравочные кристаллы, сформированные на стадии B1), нагревают вплоть до 500°C, однако, предпочтительно, до температуры, находящейся в диапазоне от 200°C до 400°C.
Посредством этого из затравочных кристаллов и избыточного железосодержащего соединения A формируют железосодержащие частицы, предпочтительно, железосодержащие наночастицы.
Было показано, что является выгодным начать и осуществить фазу нагрева согласно B1) не со всем количеством железосодержащего соединения A, а добавить дополнительное железосодержащее соединение B в органическом растворителе L2 на стадии B2) после стадии формирования затравочных кристаллов согласно B1).
По меньшей мере, одно железосодержащее соединение B можно здесь выбрать из вышеуказанной группы железосодержащих соединений, и оно может быть идентичным, по меньшей мере, одному железосодержащему соединению A, или быть отличным от него.
То же самое подразумевается для органического растворителя L2, который можно выбрать из вышеуказанной группы растворителей LM1, и он является идентичным или отличным от растворителя LM1, где предпочтительным является, если растворители LM1 и LM2 являются идентичными.
Таким образом, предпочтительно, если после стадии образования затравочных кристаллов B1) добавляют новое железосодержащее соединение B, предпочтительно, в том же растворителе (LM1=LM2) и композицию, полученную посредством этого, согласно C1) нагревают до температуры вплоть до 500°C, предпочтительно в диапазоне от 200°C до 400°C. LM1 и LM2, предпочтительно имеют минимальную точку кипения 200°C.
Таким образом, истинные частицы получают после добавления, по меньшей мере, одного железосодержащего соединения B в растворителе L2. Вместе с железосодержащим соединением B к композиции, полученной после стадии B1, также можно добавить дополнительные добавки. Любая из этих добавок не должна быть обязательно выбрана из тех же добавок, которые уже присутствуют в растворе, однако это является предпочтительным.
Здесь, кроме того, количество добавленного железосодержащего соединения B, из добавок, и вид и количество растворителя L2 могут быть вновь адаптированы специалистом в данной области таким образом, чтобы образовывались частицы с максимальным SAR.
Как уже сформулировано, общее количество требующегося железосодержащего соединения можно, однако, добавить на стадии A, так что стадия B2) является предпочтительной, но не обязательной. Даже если никакое дополнительное железосодержащее соединение B больше не добавляют после первой фазы нагрева согласно стадии B1), в качестве стадии B2) можно добавить дополнительную добавку, которая должна быть такой же, как добавка, уже присутствующая в композиции. Таким образом, в качестве стадии B2) можно добавить только добавку или только железосодержащее соединение B или то и другое одновременно или последовательно.
Длительность второй фазы нагрева согласно стадии C1) составляет, по меньшей мере, 30 минут, предпочтительно 1-30 часов, более предпочтительно 10-20 часов и особенно предпочтительно 15 часов.
Неожиданно стало очевидно, что SAR можно дополнительно увеличить удлинением фаз нагрева или просто более длинными фазами нагрева, так что длительные фазы нагрева и особенно дополнительные фазы термической обработки (отпуска) являются предпочтительными. В частности, в стадии C1) предпочтительной является фаза нагрева, которая составляет более чем 10 часов и, более предпочтительно более чем 14 часов.
Фазы термической обработки, необязательно следующие после стадии D1 в виде D1* и/или D2*, также могут дополнительно увеличить SAR, и, следовательно, также, предпочтительно более чем 10 часов, более предпочтительно более чем 14 часов и, особенно предпочтительно, более, чем 18 часов. Таким образом, фаза термической обработки может занять 1-30 часов, предпочтительно 10-25 часов, более предпочтительно 13-22 и особенно предпочтительно 15-20 часов.
SAR полученных в результате частиц можно адаптировать, варьированием продолжительности фазы нагрева B1), конечной температурой и продолжительностью выдерживания конечной температуры на стадии C1), и количеством добавляемых соединений железа или добавок на стадии C1) так, что формируются частицы с максимальным SAR. Данные параметры зависят от вида используемых соединений железа и вида растворителя и добавок. Следовательно, фазы нагрева должны быть адаптированы к каждой системе, что может быть легко осуществлено специалистом в данной области, исходя из его специальных знаний.
SAR полученных частиц по изобретению находится между 10-40 Вт на г Fe при напряженности магнитного поля 4 кА/м, предпочтительно 20-40 Вт на г Fe при напряженности магнитного поля 4 кА/м, более предпочтительно 25-40 Вт на г Fe при напряженности магнитного поля 4 кА/м и особенно предпочтительно 30-40 Вт на г Fe при напряженности магнитного поля 4 кА/м и частоте переменного магнитного поля 100 кГц.
Ниже предоставляются некоторые примеры систем для получения частиц по изобретению, а также значения SAR полученных частиц. Примеры (I)-(VIII) приводят к частицам по изобретению со значениями SAR 20-40 Вт на г Fe при напряженности магнитного поля 4 кА/м и частоте переменного магнитного поля 100 кГц. Термин ″Fe″ относится к общему количеству железа Fe0, Fe+2, Fe+3.
Примеры подходящих компонентов для получения частиц по изобретению
(Температура кипения)
[Вт/г Fe]
без добавки
без добавки
без добавки
без добавки
без добавки
без добавки
В вышеуказанной таблице 1 ″без добавки″ означает, что синтез по данному изобретению осуществили с компонентами, названными в соответствующей колонке, но без добавления добавки. Компоненты, указанные в таблице 1, использовали согласно примеру 1 и 3A или 2 и 3A (стадии А1-C2), и затем все системы далее использовали согласно примерам 4-6, а также 4-7. Было показано, что применением дополнительной фазы термической обработки (пример 7, стадия D1* или D2*) SAR можно увеличить на 5 Вт/г Fe при примерно 5 кА/м. Величины SAR, показанные в таблице 1, относятся к напряженности магнитного поля 4 кА/м и частоте переменного магнитного поля 100 кГц.
Примеры систем по изобретению
(Na-соль)
вода
(Na-соль)
вода
Фазы A) и C) можно осуществить необязательно при нормальном давлении на воздухе или под атмосферой защитного газа (аргон, азот) или в реакционном автоклаве под давлением вплоть до 400 бар.
После этой второй фазы нагрева согласно стадии C1) может последовать фаза окисления X2). Фаза окисления X2) является опциональной и необязательно должна следовать непосредственно после стадии C1, а также может иметь место после одной из стадий C1)-K1). Частицы здесь окисляют, предпочтительно, подводом атмосферного кислорода. Подвод атмосферного кислорода осуществляют в течение 4-24 часов, предпочтительно 8-16 часов и, более предпочтительно при 20°C-50°C. Однако также можно использовать другие летучие окислители или окислители, удаляемые дистилляцией, такие как кислород (чистый), перекись водорода, или другие органические окислители, такие как аминоксиды. Таким образом, предпочтительно, если после одной из стадий C1)-K1) следует стадия окисления X2), где X представляет собой переменную для букв C-K в зависимости от того, после какой стадии выполняется окисление. Если необязательное окисление следует проводить после стадии E1), окисление называют стадией E2), и если его следует проводить после K1, стадию окисления будут называть K2). Далее, стадию окисления можно повторить множество раз, или дополнительная стадия окисления X2' может следовать после дополнительной процедурной стадии, которая является возможной, но не предпочтительной. Поэтому, способ по изобретению мог бы включать первую стадию окисления X2 (например, F2) и вторую стадию окисления X2' (например, H2'). Для частиц, которые уже находятся в частично или полностью окисленном состоянии, дальнейшее окисление, конечно, не является необходимым. Обычно окисление под действием атмосферного воздуха является самозапускающимся, так что дополнительная стадия, т.е. стадия окисления X2, дополнительная к самозапускающемуся окислению, не является необходимой. Стадию окисления X2 можно осуществить даже, если это не является абсолютно необходимым, поскольку было показано, что это также не принесет вреда.
Частицы, предпочтительно, наночастицы, сформированные согласно стадии C1, необходимо очистить. Данная стадия является существенной и важной для изобретения. Использование неочищенных частиц не даст частицы по изобретению, с хорошей диспергируемостью в воде и, в конечном счете, с высоким SAR. Данную очистку осуществляют согласно стадии D1), предпочтительно, экстракцией в аппарате Сокслета до тех пор, пока диспергируемость частиц в неполярных растворителях больше не будет придаваться. Как было неожиданно обнаружено, для последующей дисперсии в воде [стадия F1)] важно, чтобы добавка и особенно поверхностно-активное соединение из стадии A2) и/или B2) - насколько это возможно - были полностью смыты с частиц, т.е. большей частью были бы вновь удалены. Под терминами ″насколько это возможно″ и ″большей частью″, соответственно, понимают удаление добавок в диапазоне 70-100%, предпочтительно вплоть до 90%. Таким образом, добавки будут удалены с частиц более чем на 70%, предпочтительно более чем на 80%, более предпочтительно более чем на 90% и, особенно предпочтительно более чем на 95%. Вышеуказанные процентные содержания относятся к добавке, прилипшей к частицами. Свободную добавку, т.е. добавку, свободно плавающую в растворе и не адсорбированную частицами, можно в значительной степени удалить центрифугированием, т.е. на >95%, предпочтительно на >98%. Количество остающейся добавки, прилипшей к частицам, можно определить, например, элементарным анализом или ИК спектроскопией. В настоящем описании процентное содержание относится к массе (% по массе). Добавку, не прилипшую к частицами, удаляют центрифугированием, а удаление добавки, прилипшей к частицам, можно, предпочтительно, осуществить экстракцией образовавшихся частиц в аппарате Сокслета, где также можно использовать экстракцию, поддерживаемую ультразвуком. Для данного использования наночастицы сначала будут отделены центрифугированием перед наступлением следующей стадии очистки.
Растворитель, используемый для экстракции в аппарате Сокслета, может представлять собой широко распространенный полярный органический растворитель, такой как спирты, кетоны, (простые) эфиры или сложные эфиры. Предпочтительными являются ацетон, этилацетат или этанол.
Продолжительность экстракции составляет между 1 и 8 часами, предпочтительно между 2 и 6 часами и особенно предпочтительно примерно 4 часа. Важный момент состоит в том, что железосодержащие частицы, предпочтительно наночастицы, больше не диспергируемые в неполярных растворителях, таких как толуол, ксилол или гексан, после экстракции. Тем не менее, чтобы это имело место, время экстракции необходимо регулировать. Порошок наночастиц, очищенных таким образом, сушат в условиях вакуума.
Несколько ″фаз термической обработки″ могут следовать после стадии D1, чтобы увеличить кристалличность частиц. Данные фазы термической обработки можно осуществить в высококипящих растворителях при температуре вплоть до 400°C в течение нескольких часов. Растворители называют высококипящими, если они имеют минимальную точку кипения 200°C, предпочтительно 300°C. Процесс термической обработки может иметь здесь место на воздухе или в защитном газе (например, аргоне). При температурах примерно от 200°C до 250°C реакцию, предпочтительно, осуществляют без защитного газа, а при температурах выше, чем примерно от 200°C до 250°C реакцию, предпочтительно, осуществляют под защитным газом. Альтернативно, наночастицы можно термически обработать в виде порошка (без растворителей) при температурах вплоть до 1000°C под защитным газом. Предпочтительными защитными газами являются аргон или CO2/H2 смеси. Данная, по меньшей мере, одна стадия термической обработки следует в виде стадии D1* после стадии D1 или в виде стадии D2* после стадии окисления D2.
Окисление согласно стадии X2, где X=C или D, или E, или F, или G, или H, или I, или J, или K, можно, предпочтительно, осуществить суспендированием частиц в 0,5-2М HNO3, предпочтительно 1М HNO3, добавлением Fe(NO3)3 и последующим кипячением с обратным холодильником. Отношение Fe(NO3)3 к FeOx или, в общем, отношение Fe(III) к FeOx, предпочтительно, составляет 1:2. Данный процесс окисления оказывает благоприятное воздействие на SAR частиц и, следовательно, является предпочтительным. Следует отметить, что данная стадия не ограничивается Fe(NO3)3, и что также можно использовать другие соли Fe(III), такие как FeCl3, FePO4 и т.д.
Далее осуществляют диспергирование очищенных частиц или наночастиц в воде, обратимым покрытием поверхностно-активным соединением согласно стадиям E1) и F1).
На данной стадии очищенный порошок частиц или наночастиц суспендируют в воде, где гидрофильный слой присоединен таким образом, что легко осуществить последующее удаление данного слоя. В начале содержание твердого вещества (оксида железа) для данного покрытия устанавливают предпочтительно 2-20%, более предпочтительно 3-12%, еще более предпочтительно 5%-8%, еще более предпочтительно, 6%-7% и особенно предпочтительно примерно 6,5%. Для достижения более тонкой дисперсии частиц до добавления поверхностно-активного соединения можно добавить кислоту, предпочтительно, минеральную кислоту согласно стадии F1), такую как хлористоводородная кислота или азотная кислота, чтобы получить значение рН 2-6, предпочтительно 3-5 и особенно предпочтительно примерно 4.
Кислоту можно, предпочтительно, выбрать из минеральных кислот, таких как хлористоводородная кислота, фосфорная кислота, серная кислота, бромистоводородная кислота, борная кислота или азотная кислота. Но является важным, что используют кислоту, предпочтительно, минеральную кислоту, которая не связывается необратимо с поверхностью частицы. В экспериментах было показано, что предпочтительными являются минеральные кислоты, а аминокислот, а также карбоновых кислот, следует избегать. Однако в способе по изобретению в основном используют нижеследующие кислоты: сульфоновую кислоту, азотную кислоту, хлорную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, гидроксиэтансульфоновую кислоту, этиленсульфоновую кислоту, р-толуолсульфоновую кислоту, нафталинсульфоновую кислоту, нафтиламинсульфоновую кислоту, сульфаниловую кислоту и камфорсульфоновую кислоту.
Если рН водного раствора устанавливают кислотой или минеральной кислотой, осуществляют добавление, по меньшей мере, одного поверхностно-активного соединения согласно стадии F1). По меньшей мере, одно поверхностно-активное соединение, предпочтительно, выбрано из группы, включающей в себя или состоящей из солей насыщенных и особенно ненасыщенных жирных кислот. Более того, можно использовать тенсиды или полимеры, такие как поливиниловый спирт, полиэтиленгликоль, полиакриловая кислота, декстран, PLGA (сополимер молочной и гликолевой кислот), хитозан и полиэтиленимин.
Примерами насыщенных жирных кислот являются уксусная кислота, пропионовая кислота, масляная кислота, капроновая кислота, каприновая кислота, лауриновая кислота, миристиновая кислота, пальмитиновая кислота, маргариновая кислота, стеариновая кислота, арахиновая кислота, бегеновая кислота и лигноцериновая кислота.
В качестве примеров предпочтительных ненасыщенных жирных кислот или их солей можно указать любые жирные кислоты, такие как цис-9-тетрадеценовая кислота (миристолеиновая кислота), цис-9-гексадеценовая кислота (пальмитолеиновая кислота), цис-6-октадеценовая кислота (петроселиновая кислота), цис-9-октадеценовая кислота (олеиновая кислота), цис-11-октадеценовая кислота (вакценовая кислота), цис-9-эйкозеновая кислота (гадолиновая кислота), цис-11-эйкозеновая кислота (гондоиновая кислота), цис-13-докозеновая кислота (эруковая кислота), цис-15-тетракозеновая кислота (ацетэруковая кислота), t-9-октадеценовая кислота (элаидиновая кислота), t-11-октадеценовая кислота (t-вакценовая кислота), t-3-гексадеценовая кислота, 9,12-октадекадиеновая кислота (линоленовая кислота), 6,9,12-октадекатриеновая кислота (γ-линолевая кислота), 8,11,14-эйкозатриеновая кислота (дигомо-γ-линоленовая кислота), 5,8,11,14-эйкозатетраеновая кислота (арахидоновая кислота), 7,10,13,16-докозатетраеновая кислота, 4,7,10,13,16-докозапентаеновая кислота, 9,12,15-октадекатриеновая кислота (α-линоленовая кислота), 6,9,12,15-октадекатетраеновая кислота (стеаридоновая кислота), 8,11,14,17-эйкозатетраеновая кислота, 5,8,11,14,17-эйкозапентаеновая кислота (EPA), 7,10,13,16,19-докозапентаеновая кислота (DPA), 4,7,10,13,16,19-докозагексаеновая кислота (DHA), 5,8,11-эйкозатриеновая кислота, медовая кислота, 9c,11t,13t-элеостеариновая кислота, 8t,10t,12c-календовая кислота, 9c,11t,13c-катальповая кислота, 4,7,9,11,13,16,19-докозагептадекановая кислота (стелла гептановая кислота,), таксолеиновая кислота, пинолеиновая кислота, скиадоновая кислота, 6-октадециновая кислота (таририновая кислота), t11-октадецен-9-иновая кислота (санталбиновая или ксимениновая кислота), 9-октадециновая кислота (стеаролиновая кислота), 6-октадецен-9-иновая кислота (6,9-октадецениновая кислота), t10-гептадецен-8-иновая кислота (пирулиновая кислота), 9-октадецен-12-иновая кислота (крепениновая кислота), t7,t11-октадекадиен-9-иновая кислота (гейстериновая кислота,), t8,t10-октадекадиен-12-иновая кислота, 5,8,11,14-эйкозатетраиновая кислота (ETYA) и t8,t10-октадекадиен-12-иновая кислота. Соли жирных кислот, предпочтительно, получают с ионами щелочных и щелочноземельных металлов.
Массовое отношение наночастиц к поверхностно-активному соединению, предпочтительно составляет от 1:0,02 до 1:10, более предпочтительно 1:0,1 до 1:2 и особенно предпочтительно 1:0,5.
После добавления поверхностно-активного соединения, суспензию согласно стадии G1), предпочтительно, обрабатывают ультразвуком в течение минимального периода 30 минут.
Затем суспензию перемешивают в течение примерно 2 часов при температуре, предпочтительно в диапазоне от 30°C до 70°C, более предпочтительно от 50°C до 60°C и особенно предпочтительно при 40°C. Затем проводят очистку согласно стадии I1). Недиспергированные частицы будут отделены, предпочтительно, центрифугированием (1000 об./мин).
Дисперсию частиц необходимо освободить от избытка поверхностно-активного вещества незамедлительно после покрытия. Данную очистку можно выполнить диализом или экстракцией с диэтиловым эфиром. Альтернативно, частицы можно отделить центрифугированием, используя ультрацентрифугу, и промыв водой и смесью воды и диэтилового эфира.
Затем покрытие на основе жирной кислоты на частицах обменивают на кремнийсодержащую биосовместимую оболочку согласно стадиям I1) и J1).
Для обмена оболочки, частицы необходимо диспергировать в смеси воды и, по меньшей мере, одного растворителя, смешивающегося с водой, согласно стадии I1). В качестве растворителей, смешивающихся с водой, можно указать спирты, полиолы, тетрагидрофуран (ТГФ), диметилформамид (ДМФА), диметилацетамид, диметилсульфоксид (ДМСО), ацетон, уксусную кислоту, муравьиную кислоту, метиловый эфир муравьиной кислоты, этиловый эфир муравьиной кислоты, метиловый эфир уксусной кислоты, этиловый эфир уксусной кислоты и другие.
Однако особенно предпочтительными являются спирты. Спирт можно, предпочтительно, выбрать из группы, включающей в себя или состоящей из метанола, этанола, пропанола, изопропанола и этиленгликоля, где этанол является предпочтительным.
Соотношение воды и спирта и воды и этанола в смеси, соответственно, составляет предпочтительно 1:1 до 1:5 и особенно предпочтительно 1:3, так что удаление оболочки жирной кислоты и замену на кремнийсодержащую оболочку можно осуществить параллельно.
Далее, предпочтительно, если смесь спирта и воды содержит 1-5% по массе, более предпочтительно 1-3% по массе и особенно предпочтительно 1,5% по массе амина, предпочтительно первичного амина и особенно предпочтительно аммиака.
Вскоре после добавления дисперсии наночастиц к смеси растворителей, в частности, к смеси спирта и воды и, предпочтительно, к смеси воды и этанола, согласно стадии I1) необходимо добавить подходящий алкоксисилан. Добавление алкоксисилана должно происходить под обработкой ультразвуком. Подходящими алкоксисиланами являются все тетраалкоксисиланы, такие как тетраметоксисилан и тертаэтоксисилан, и триалкоксисиланы, диалкоксисиланы и моноалкоксисиланы, которые, предпочтительно, имеют функциональную группу, связанную Si-C связью, такую как аминогруппа, тиольная группа и/или эпоксидная группа.
Чтобы обмен оболочки протекал ровно, молярное отношение железа и алкоксисилана должно быть 1:1 до 1:5 и предпочтительно 1:3.
После добавления реагентов дисперсию обрабатывают ультразвуком в течение 1-8 часов, предпочтительно в течение 3-5 часов и особенно предпочтительно в течение 4 часов, согласно стадии J1). Затем проводят очистку частиц, предпочтительно диализом против воды. Альтернативно, очистку можно провести отделением частиц центрифугированием при высоком значении g и промывкой осадка ультрачистой водой.
Кроме того, настоящее изобретение относится к частицам и, предпочтительно, наночастицам, которые можно получить описанным здесь способом.
Сами железосодержащие частицы по изобретению являются ферромагнитными, ферримагнитными или суперпарамагнитными. Такие частицы или наночастицы можно нагреть переменным магнитным полем. Возможен нагрев ткани, содержащей частицы или наночастицы, выше 50°C, поскольку частицы или наночастицы имеют высокие значения SAR согласно изобретению.
Железосодержащие частицы, изготовленные согласно изобретению, обладают минимальным значением SAR 18, предпочтительно 20 и особенно предпочтительно 22 мВт/мг Fe при напряженности поля 6 кА/м.
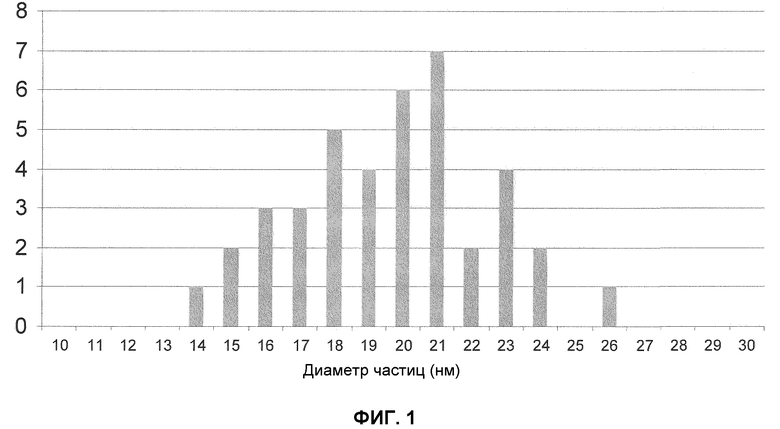
Частицы, предпочтительно, имеют диаметр менее чем 500 нм. Наночастицы, предпочтительно, имеют средний диаметр 20 нм или, предпочтительно находятся в диапазоне размеров 1-100 нм и особенно предпочтительно в диапазоне размеров 15-30 нм.
Стабильная кремнийсодержащая оболочка наночастиц имеет толщину между 0,5 и 10 нм, предпочтительно 3 нм.
Кремнийсодержащую оболочку можно функционализировать дополнительными алкоксисиланами, чтобы модифицировать свойства частиц. Это, предпочтительно, представляет собой триалкоксисиланы, несущие функциональную группу, соединенную Si-C связью. Примерами являются (3-акрилоксипропил)триметоксисилан, триэтоксисилилбутиральдегид, 3-аминопропилтриэтоксисилан и 3-изоцианатопропилтриэтоксисилан. Триалкоксисиланы также могут нести присоединенные Si-C связями боковые цепи полиэтиленгликоля различной длины. В качестве примера этого служит 2-[метокси(полиэтиленокси)пропил]триметоксисилан.
Железосодержащие частицы по данному изобретению можно использовать в области медицины и, например, вводить в форме водного раствора. Железосодержащие частицы по данному изобретению можно использовать для лечения и профилактики пролиферативных заболеваний, рака, опухолей, ревматизма, артрита, артроза и бактериальных инфекций.
Далее, настоящее изобретение относится к фармацевтическим композициям, содержащим наночастицы по данному изобретению, а также к использованию наночастиц по изобретению для приготовления таких фармацевтических композиций.
Данные фармацевтические композиции, в частности, представляют собой растворы для инфузий или инъекции. Такие растворы наночастиц, например, в физиологическом солевом растворе, подходят для интерстициального или внутриопухолевого применения. Более того, внутриартериальное или внутривенное применение позволяет вариант системной терапии, воздействующей на все тело для неоднородных и/или образующих метастазы типов опухолей.
Дальнейшими предпочтительными фармацевтическими композициями являются порошок, порошок для ингаляций и лиофилизат, содержащие железосодержащие частицы по изобретению.
Наночастицы и фармацевтические композиции по изобретению будут предпочтительно использованы для лечения, а также для профилактики болезней, которые характеризуются дегенеративными видами клеток или экзогенными клетками, и для которых можно использовать особенность наночастиц отличать экзогенные или дегенеративные клетки от собственных здоровых клеток организма. В качестве дегенеративных клеток, в частности, рассматриваются раковые клетки или клетки с нарушенным разростанием, а также стенотическая или рестенотическая ткань. Примерами экзогенных клеток, в частности, являются бактерии.
Следовательно, наночастицы по изобретению и фармацевтические композиции, содержащие наночастицы, будут использоваться для профилактики и лечения опухолей, карцином и рака.
Примерами видов рака и опухолей, для которых можно использовать наночастицы по изобретению, являются: аденокарцинома, хороидальная меланома, острая лейкемия, акустическая невринома, ампулярная карцинома, рак анального канала, астроцитома, базально-клеточная карцинома, рак поджелудочной железы, опухоль соединительной ткани, рак мочевого пузыря, бронхиальная карцинома, немелкоклеточная бронхиальная карцинома, рак молочной железы, лимфома Беркитта, опухоль мозолистого тела, CUP-синдром, рак толстой кишки, рак тонкой кишки, опухоли тонкой кишки, рак яичника, эндометриальная карцинома, эпендимальная глиома, эпителиальные раки, опухоли Эвинга, опухоли желудочно-кишечного тракта, рак желчного пузыря, карцинома желчного пузыря, рак матки, рак шейки матки, глиобластома, гинекологические опухоли, опухоли уха, носа и горла, опухоль кроветворной системы, лейкоз ворсистых клеток, уретральный рак, рак кожи, опухоли головного мозга (глиомы), метастазы головного мозга, рак яичка, опухоль гипофиза, карциноидная опухоль, саркома Капоши, рак гортани, герминома, рак кости, колоректальная карцинома, опухоли головы и шеи (опухоли, расположенные в области шеи, носа и уха), рак толстой кишки, краниофарингиома, рак в области рта и на губе, рак печени, метастазы печени, лейкемия, опухоли век, рак легкого, злокачественная лимфома (Ходжкина/не-Ходжкина), лимфома, рак желудка, злокачественная меланома, злокачественные новообразования, малигнома желудочно-кишечного тракта, карцинома молочной железы, рак прямой кишки, медуллобластома, меланома, менингиома, болезнь Ходжкина, грибовидный микоз, рак носа, нейринома, нейробластома, рак почки, карцинома клеток почечного эпителия, лимфома не-ходжкина, олигодендроглиома, карцинома пищевода, остеолитические опухоли и остеобластические опухоли, остеосаркома, карцинома яичника, карцинома поджелудочной железы, рак полового члена, плазмацитома, плоскоклеточный рак головы и шеи, рак простаты, рак горла, рак прямой кишки, ретинобластома, рак влагалища, рак щитовидной железы, рак легких Шнейберга, рак пищевода, спиноклеточная карцинома, Т-клеточная лимфома (грибовидный микоз), тимома, рак маточных труб, опухоли глаза, рак мочеиспускательного канала, урологические опухоли, уротелиальная карцинома, карцинома влагалища, появление бородавок, опухоли мягких тканей, саркома мягких тканей, опухоль Вилмса, рак шейки матки и рак языка.
Однородные опухоли особенно предпочтительны. Далее предпочтительными являются карцинома простаты, опухоли головного мозга, саркомы, рак шейки матки, карцинома яичника, карцинома молочной железы, бронхиальная карцинома, меланома, опухоли головы и шеи, рак пищевода, рак прямой кишки, карцинома поджелудочной железы, мочевого пузыря и рак почки, и метастазы в печени, в головном мозге и лимфатических узлах.
Особенно предпочтительным является применение и использование наночастиц по изобретению в комбинации с традиционной гипертермией, радиационной терапией и/или в комбинации с традиционной химиотерапией.
Далее, можно было бы обнаружить, что магнитные и, предпочтительно, суперпарамагнитные частицы по изобретению увеличивают активность противоопухолевых средств и, кроме того, уменьшают их побочные эффекты.
Таким образом, частицы, полученные согласно изобретению, будут использоваться, предпочтительно, в комбинации с противоопухолевыми лекарственными препаратами, т.е. с цитотоксическими и/или цитостатическими соединениями, т.е. химическими соединениями с цитотоксическими и/или цитостатическими свойствами. Примеры противоопухолевых лекарственных препаратов включают, среди прочего, алкилирующие агенты, антибиотики с цитостатическими свойствами, антиметаболиты, микротубулярные ингибиторы и ингибиторы топоизомеразы, платиносодержащие соединения и другие цитостатики, такие как аспарагеназа, третиноин, алкалоиды, подофиллотоксины, таксаны и милтефозин®, гормоны, иммуномодуляторы, моноклональные антитела, сигнальные трансдукторы (молекулы для сигнальной трансдукции), ингибиторы киназ и цитокины.
Примеры алкилирующих агентов включают, среди прочего, хлорэтамин, циклофосфамид, трофосфамид, ифосфамид, мелфалан, хлорамбуцил, бусульфан, тиотепа, кармустин, ломустин, дакарбазин, прокарбазин, темозоломид, треосульфан, эстрамустин и нимустин.
Примерами антибиотиков, имеющих цитостатические свойства, являются даунорубицин, а также липосомный даунорубицин, доксорубицин (адриамицин), диактиномицин, митомицин С, блеомицин, эпирубицин (4-эпи-адриамицин), идарубицин, диактиномицин, митоксатрон, амсакрин и актиномицин D.
В качестве примеров антиметаболитов (антиметаболических лекарственных препаратов) можно указать метотрексат, 5-флуорорацил, 6-тиогуанин, 6-меркаптопурин, флударабин, кладрибин, пентостатин, гемцитабин, цитарабин, азатиоприн, ралтитрексид, капецитабин, цитозин арабинозид, тиогуанин и меркаптопурин.
К классу алкалоидов и подофиллотоксинов принадлежат, среди прочего, винкристин, винбластин, виндезин, этопозид, а также тенипозид. Более того, согласно изобретению можно использовать платиносодержащие соединения. Цисплатин, карбоплатин и оксалиплатин являются примерами соединений, содержащих платину. Среди микротубулярных ингибиторов принимают во внимание, например, алкалоиды, такие как винка-алкалоиды (винкристин, винбластин, виндезин, винорельбин) и паклитаксел (Таксол®), а также производные паклитаксела. Примеры ингибиторов топоизомеразы включают этопозид, тенипозид, камптотецин, топотекан и иринотекан.
Паклитаксел и доцетаксел представляют собой примеры соединений таксана, и среди прочих цитостатических агентов (других цитостатиков) принимают во внимание, например, гидроксикарбамид (гидроксимочевину), иматиниб, Милтефозин®, амсакрин, топотекан (ингибитор топоизомеразы I), пентостатин, бексаротен, третиноин и аспарагиназу. Представителями класса соединений моноклональных антител являются, среди прочих, трастузумаб (также известный как Герцептин®), алемтузумаб (также известный как МабКампат®) и ритуксимаб (также известный как МабТера®). Представителями ингибиторов киназы являются сорафениб (Нексавар®) и санитиниб (Сутент®). Примерами гормонов являются глюкокортикоиды (преднизон), эстрогены (фосфестрол, эстрамустин), LHRH (бусерелин, гозерелин, леупрорелин, трипторелин), флутамид, ципротерон ацетат, тамоксифен, торемифен, аминоглутетимид, форместан, экземестан, летрозол и анастрозол. Среди классов иммуномодуляторов, цитокинов, антител и сигнальных трансдукторов принимают во внимание интерлейкин-2, интерферон-α, эритропоэтин, G-CSF, трастузумаб (Герцептин®), ритуксимаб (МабТера®), гефитиниб (Иресса®), ибритумомаб (Зевалин®), левамизол, а также ретиноиды.
Таким образом, настоящее изобретение также относится к комбинациям частиц, полученных в соответствии с изобретением, по меньшей мере, с одним противоопухолевым препаратом, таким как актиномицин Д, аминоглутетимид, амсакрин, анастрозол, антагонисты пуриновых и пиримидиновых оснований, антрациклины, ингибиторы ароматазы, аспарагиназа, антиэстрогены, бексаротен, блеомицин, бусерелин, бусульфан, производные камптотецина, капецитабин, карбоплатин, кармустин, хлорамбуцил, цисплатин, кладрибин, циклофосфамид, цитарабин, цитозина арабинозид, алкилирующие цитостатики, дакарбазин, дактиномицин, доцетаксел, доксорубицин (адриамицин), доксорубицин липо, эпирубицин, экстрамустин, этопозид, экземестан, флударабин, флуороурацил, антагонисты фолиевой кислоты, форместан, гемцитабин, глюкокортикоиды, госелерин, гормоны и антагонисты гормонов, гистамин, гидроксимочевина, идарубицин, ифосфамид, имантиниб, иринотекан, летрозол, леупрорелин, ломустин, мелфалан, меркаптопурин, метотрексат, милтефозин, митомицин, ингибиторы митоза, митоксантрон, нимустин, оксалиплатин, паклитаксел, пентостатин, прокарбазин, тамоксифен, темозоломид, тенипозид, тестолактон, тиотепа, тиогуанин, ингибиторы топоизомеразы, топотекан, треосульфан, третиноин, трипторелин, трофосфамид, винбластин, винкристин, виндезин, винорелбин, цитостатически активными антибиотиками, и фармацевтическими композициями, содержащими вышеуказанные комбинации.
Вышеуказанные лекарственные препараты можно использовать не только в комбинации с частицами по изобретению, но также их можно ковалентно связать с частицами, предпочтительно, наночастицами, чтобы еще более эффективно импортировать в раковые клетки.
Таким образом, дальнейший аспект настоящего изобретения нацелен на частицы, получаемые согласно способу по изобретению, в котором терапевтически активное вещество ковалентно связано с частицей или наночастицей. Терапевтически активные вещества можно выбрать из антипролиферативных, антимиграторных, антиангиогенных, антитромботических, антивоспалительных, противовоспалительных, цитостатических, цитотоксических, антикоагулянтных, противобактериальных, противовирусных и/или противогрибковых лекарственных препаратов, где антипролиферативные, антимиграторные, антиангиогенные, цитостатические и/или цитотоксические лекарственные препараты, а также нуклеиновые кислоты, аминокислоты, пептиды, белки, углеводы, липиды, гликопротеины, гликаны или липопротеины с антипролиферативными, антимиграторными, антиангиогенными, антитромботическими, антивоспалительными, противовоспалительными, цитостатическими, цитотоксическими, антикоагулянтными, противобактериальными, противовирусными и/или противогрибковыми свойствами являются предпочтительными. Более того, данные вещества также могут содержать радиосенсибилизаторы или сенсибилизаторы или усилители из других традиционных методов лечения рака, которые также объединяют или включают такие сенсибилизаторы.
Связывание терапевтически активного вещества можно осуществить, например, посредством гидроксильных групп, аминогрупп, карбонильных групп, тиольных групп или карбоксильных групп, в зависимости от того, какую функциональную группу несет соответствующий лекарственный препарат. Гидроксильные группы, предпочтительно, связываются в виде сложных эфиров, ацеталей или кеталей, тиольные группы, предпочтительно, в виде сложных тиоэфиров, тиоацеталей или тиокеталей, аминогруппы, предпочтительно, в виде амидов и частично также в виде иминов (оснований Шиффа), карбоксильные группы, предпочтительно, в виде сложных эфиров или амидов, и карбонильные группы, предпочтительно, в виде кеталей. Кроме того, известна функционализация поверхности наночастиц, так что, используя известные методы на поверхности наночастиц можно получить аминогруппы, гидроксигруппы, карбоксильные группы или карбонильные группы.
Дополнительное покрытие активируемых коньюгатов наночастица-лекарственный препарат (например, полимером), как описано в патенте WO 98/58673, также возможно и можно использовать для улучшения биологических свойств коньюгатов наночастица-лекарственный препарат. Также можно присоединить дополнительные молекулы, предоставляющие целевые свойства всей конструкции (например, поликлональные антитела, моноклональные антитела, гуманизированные антитела, человеческие антитела, химерные антитела, рекомбинантные антитела, биспецифические антитела, фрагменты антител, аптамеры, Fab-фрагменты, Fc-фрагменты, пептиды, пептидомиметики, гэпы, рибозимы, CpG-олигомеры, ДНК-зимы, рибо-переключатели или липиды). Существенно, что все дальнейшие модификации не препятствуют активируемому высвобождению терапевтически активного вещества на сайт-мишени.
Далее предпочтительно, чтобы терапевтически активное вещество было бы не связано непосредственно с наночастицей, а иммобилизовано, используя линкер-молекулу. В качестве линкера могут служить разнообразные молекулы, содержащие вплоть до 50 атомов углерода при условии, что линкер содержит группу, которую можно расщепить термически, фотохимически или ферментативно, кислотно-неустойчивую группу или группу, которую можно легко отщепить другими методами. Связь внутри линкер-молекулой и/или связь линкера с лекарственным препаратом и/или связь линкера с поверхностью наночастицы должна быть расщепляемой непосредственно или косвенно действием переменного магнитного поля. Косвенный разрыв задается, если, например, стимулируются ферменты, такие как пептидазы, эстеразы или гидролазы, или если увеличивают их активность или экспрессию переменным магнитным полем на сайт-мишени, например, в клетке злокачественной опухоли, и если данные ферменты могут затем осуществить вышеуказанный разрыв. Более того, косвенный разрыв также может иметь место при использовании магнитных наночастиц, если их нагревают переменным магнитным полем, и посредством этого отщепляется термически неустойчивая группа. Также можно увеличить pH на целевом участке воздействием переменного магнитного поля, чтобы впоследствии разорвать кислотно-неустойчивые связи внутри линкер-молекулы.
В качестве ферментативно отщепляемой группы внутри или у линкер-молекулы необходимо указать амидную группу. Группы, расщепляемые термически или посредством кислоты, включают, например, фосфатные группы, тиофосфатные группы, сульфатные группы, фосфамидные группы, карбаматные группы или иминные группы.
Линкер-молекула также может представлять собой молекулу нуклеиновой кислоты, полипептид, пептид-нуклеиновую кислоту, аптамер, ДНК, РНК, лейциновую застежку, оликонуклеотид, биотин, авидин, стрептавидин, мостик гаптен-антитело или мостик биотин-авидин.
Лекарственный препарат не должен быть связан ковалентно с линкером, а может быть также связан ионными или водородными связями, или интеркалирован, или закомплексован.
Различные возможности связывания терапевтически активного вещества, такого как противоопухолевый препарат, моноклональное антитело, аптамер, нуклеиновая кислота, аминокислота, пептид, белок, углевод, липид, гликопротеин, гликан, липопротеин, или антипролиферативный, антимиграторный, антиангиогенный, антитромботический, антивоспалительный, противовоспалительный, цитостатический, цитотоксический, антикоагулянтный, противобактериальный, противовирусный или противогрибковый лекарственный препарат, к микрочастицам и наночастицам детально описываются в WO2006108405A.
Таким образом, способ по изобретению может включать дополнительную стадию L1), которая относится к связыванию противоопухолевого препарата, моноклонального антитела, аптамера, нуклеиновой кислоты, аминокислоты, пептида, белка, углевода, липида, гликопротеина, гликана, липопротеина, или антипролиферативного, антимиграторного, антиангиогенного, антитромботического, антивоспалительного, противовоспалительного, цитостатического, цитотоксического, антикоагулянтного, противобактериального, противовирусного или противогрибкового лекарственного препарата с частицами согласно стадии K1).
Более того, также можно связать лекарственные препараты с поверхностью наночастиц адсорбцией и покрыть их барьерным слоем, который, главным образом, предотвращает высвобождение лекарственного препарата до тех пор, пока барьерный слой не модифицирован или частично не разрушен воздействием переменного магнитного поля таким образом, что может произойти высвобождение лекарственного препарата.
Описание чертежей
Фиг.1 показывает распределение размера частиц (полученные просвечивающей электронной микроскопией) наночастиц оксида железа по изобретению.
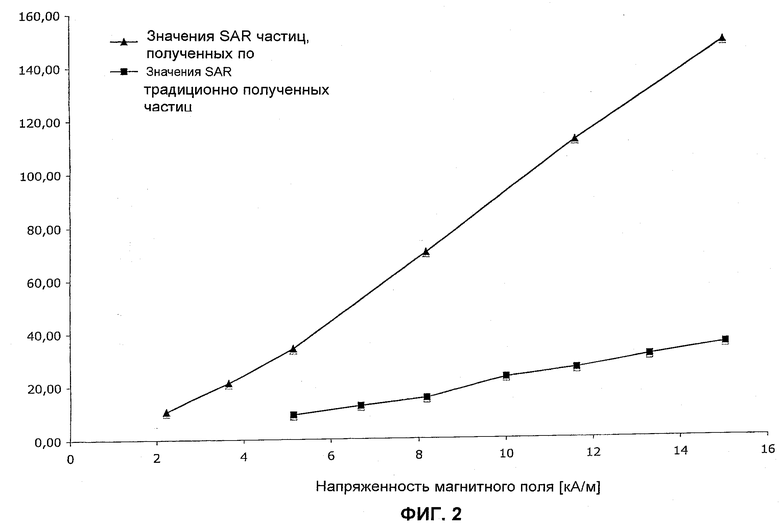
Фиг.2 показывает значения SAR наночастиц оксида железа по изобретению в воде по сравнению со значениями SAR традиционных наночастиц оксида железа, изготовленных осаждением согласно описанию патента DE19614136A1. Значения SAR относятся к переменному магнитному полю с частотой 100 кГц.
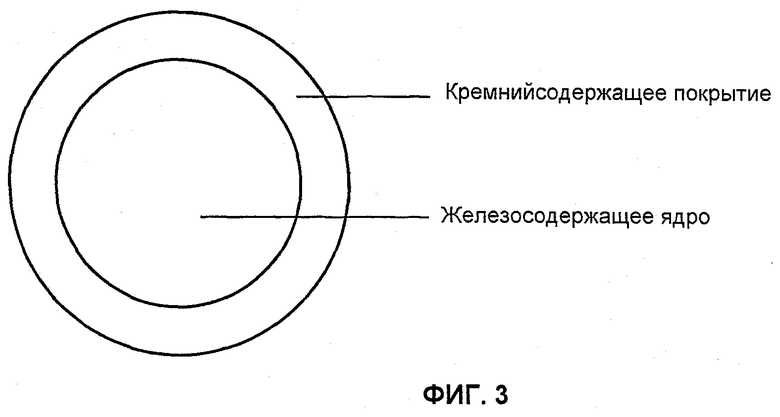
Фиг.3 показывает схематическое представление железосодержащих наночастиц по изобретению с ядром и оболочкой.
Общее описание синтеза для получения частиц по изобретению
Стадия А1)
Для получения затравочных кристаллов частиц в органическом растворителе LM1 с точкой кипения примерно от 200°C до примерно 400°C, в стеклянную колбу добавляют 0,02 моля железосодержащего соединения A и 100 мл растворителя.
Стадия А2)
Теперь можно необязательно добавить одну из добавок, описанных в настоящем описании, в количестве от 0,008 до 0,05 моль.
Стадия B1)
Раствор нагревают в течение минимального периода 10 минут и, предпочтительно, в течение 1 часа до температуры между 50°C и 350°C, которая примерно на 50°C ниже температуры последующей реакции.
Стадия B2)
Теперь можно необязательно добавить дополнительную добавку, а также дополнительное железосодержащее соединение B.
Стадия C1)
Полученную смесь нагревают в трехгорлой колбе с обратным холодильником, пропуская защитный газ, до температуры кипения соответствующего растворителя LM1 или LM2, которая должна быть, по меньшей мере, на 50°C выше температуры фазы нагрева согласно стадии B1), и выдерживают при данной температуре в течение минимального периода примерно 1 час.
Стадия C2)
Теперь можно необязательно окислить полученные частицы оксида железа.
Стадия D1)
Теперь выполняют очистку частиц центрифугированием, промывкой и, предпочтительно, экстракцией в аппарате Сокслета.
Стадия D1*)
Необязательно можно выполнить, по меньшей мере, одну фазу термической обработки наночастиц оксида железа.
Стадия D2)
Если это еще не было сделано, наночастицы оксида железа теперь можно необязательно окислить.
Стадия D2*)
Необязательно можно выполнить, по меньшей мере, одну фазу термической обработки наночастиц оксида железа.
Стадия E1)
Для дисперсии или суспензии очищенных частиц, они будут повторно суспендированы в воде с нейтральной рН или в кислотном водном растворе, предпочтительно, содержащем минеральную кислоту. Концентрация кислоты составляет от 0,002 до 0,1М. Для поддержания дисперсии или суспензии можно осуществить ультразвуковую обработку.
Стадия E2)
Если это еще не было сделано, наночастицы оксида железа теперь можно необязательно окислить.
Стадия F1)
Теперь осуществляют добавление поверхностно-активного соединения в количестве от 3 до 8 ммоль.
Стадия F2)
Если это еще не было сделано, наночастицы оксида железа теперь можно необязательно окислить.
Стадия G1)
Это необязательно будет перемешано, предпочтительно, в течение от 1 до 2 часов при температуре от 50°C до 90°C. При перемешивании следует обработка ультразвуком в течение 1-3 часов.
Стадия G2)
Если это еще не было сделано, наночастицы оксида железа теперь можно необязательно окислить.
Стадия H1)
Теперь проводят очистку полученных частиц центрифугированием, промывкой, экстракцией и/или диализом в зависимости от того, какой способ или комбинация способов лучше.
Стадия H2)
Если это еще не было сделано, наночастицы оксида железа теперь можно необязательно окислить.
Стадия I1)
Полученные частицы будут повторно суспендированы в смеси воды и спирта (от 1:1 до 5:1), которая необязательно содержит амин и предпочтительно аммиак в низких концентрациях.
Стадия I2)
Если это еще не было сделано, наночастицы оксида железа теперь можно необязательно окислить.
Стадия J1)
Теперь осуществляют добавление алкоксисилана в количестве от 0,04 до 0,08 моль.
Стадия J2)
Если это еще не было сделано, наночастицы оксида железа теперь можно необязательно окислить.
Стадия K1)
Теперь проводят очистку полученных частиц центрифугированием, диализом, промывкой, экстракцией и/или повторным диспергированием в зависимости от того, какой способ или комбинация способов лучше.
Стадия K2)
Если это еще не было сделано, наночастицы оксида железа теперь можно необязательно окислить.
Стадия L1)
Теперь необязательно можно осуществить связывание лекарственных препаратов с наночастицами оксида железа.
Примеры
Пример 1
Для получения затравочных кристаллов частиц в дибутиловом эфире диэтиленгликоля в стеклянной колбе 0,3 г пентакарбонила железа растворяли в 50 мл дибутилового эфира диэтиленгликоля. К раствору добавляли 1,7 г олеиновой кислоты. Раствор нагревали до 150°C в течение 1 часа.
Пример 2
Для получения затравочных кристаллов частиц в полигликоле DME 500 (компания Clariant) в стеклянной колбе 8 г олеата железа (III) растворяли в 50 мл полигликоля DME 500. К раствору добавляли 1,5 г олеиновой кислоты. Раствор нагревали до 120°C в течение 30 мин.
Пример 3A
Для получения наночастиц оксида железа растворы из примеров 1-2 нагревали в трехгорлой колбе с обратным холодильником, при пропускании защитного газа (аргона) вплоть до температуры кипения соответствующего растворителя и выдерживали при данной температуре в течение минимального периода 1 час. Из-за этого раствор становился красным. После охлаждения, частицы окислялись в течение ночи подачей атмосферного кислорода.
Пример 3B
Для получения наночастиц оксида железа растворы из примеров 1-2 нагревали в трехгорлой колбе с обратным холодильником, при пропускании защитного газа (аргона) вплоть до температуры кипения соответствующего растворителя и выдерживали при данной температуре в течение минимального периода 1 час. Здесь раствор становился черным.
Пример 4
Частицы из примера 3 отделяли центрифугированием при высоких значениях g и промывали этанолом. 500 мг промытого продукта взвешивали в экстракционной гильзе (603 г компании Whatman) и помещали к аппарат Сокслета. В колбу для извлечения аппарата Сокслета заливали 200 мл этанола в качестве экстрагента. Экстрагент нагревали до его температуры кипения. Непрерывную экстракцию осуществляли в течение 8 часов, и она включала примерно 16 циклов экстракции. Из-за этого раствор этанола становился желтоватым. После завершения экстракционную гильзу извлекали, порошок переносили в колбу Шленка и сушили в вакууме в течение 1 часа.
Пример 5
Для дисперсии частиц после экстракции, 0,5 г порошка наночастиц из примера 4 суспендировали в 20 мл 0,01М HCl. Затем наночастицы обрабатывали ультразвуком в течение 30 минут. Затем добавляли 0,5 г твердого олеата натрия.
Стадия G1
Затем перемешивали при 70°C в течение 1,5 часа, после чего следовала ультразвуковая обработка при перемешивании в течение 2 часов. После успешного диспергирования, дисперсию центрифугировали при низких значениях g для отделения недиспергированных частиц. Альтернативно, остающуюся дисперсию промывали для удаления избыточного олеата натрия. Это осуществляли центрифугированием при высоких значениях g, и промывали диэтиловым эфиром и повторно диспергировали в воде. Альтернативно, можно осуществить экстракцию диэтиловым эфиром или диализом. Для полного повторного диспергирования дисперсию обрабатывали ультразвуком.
Пример 6
3,3 мл дисперсии частиц согласно примеру 5 (0,97 моль/л Fe) и 2,14 мл тетраэтоксисилана добавляли к 120 мл смеси воды и этанола (3:1) и 1,5% по массе аммиака. В течение добавления дисперсию перемешивали и затем обрабатывали ультразвуком в течение 6 часов. Дисперсию очищали центрифугированием и повторным диспергированием в воде.
Пример 7 (фаза термической обработки)
Частицы, полученные в примере 4, суспендировали в 200 мл дибутилового эфира диэтиленгликоля. Затем их фумигировали воздухом при 80°C в течение 12 часов и затем кипятили с обратным холодильником в течение 8 часов (точка кипения примерно при 256°C). Затем суспензию медленно охлаждали до комнатной температуры (в течение 8 часов). Эту процедуру повторяли дважды.
Полученные таким способом (термически обработанные) частицы промывали и суспендировали в 20 мл 1М HNO3. Затем добавляли 0,3 ммоль нитрата железа (Fe(NO3)3·9H2O) и кипятили с обратным холодильником в течение 1 часа (100°C). Частицы три раза промывали водой, по 100 мл каждый раз.
Затем частицы покрывали также как в примерах 4-6.
Пример 8A (с окислением/без фумигации воздухом)
Для получения наночастиц оксида железа в этиленгликоле, 0,1 моль FeCl3·6H2O и 0,2 моль FeCl3 (безводного), 50 г ацетата натрия и 195 г диаминогексана растворяли в 900 мл этиленгликоля и нагревали до 60°C в течение одного часа.
Затем раствор нагревали до точки кипения в течение 30 минут. Температуру кипения поддерживали в течение 6 часов. Образовавшуюся дисперсию медленно охлаждали до комнатной температуры.
Частицы три раза промывали смесью этанола и воды. Затем частицы повторно суспендировали в 900 мл этиленгликоля. Суспензию нагревали до точки кипения этиленгликоля и выдерживали при данной температуре в течение 24 часов.
После охлаждения частицы промывали смесью воды и этанола и повторно суспендировали в 900 мл 1М HNO3. Затем добавляли 450 мл 0,7М раствора нитрата железа (Fe(NO3)3·9H2O) и кипятили с обратным холодильником в течение одного часа (100°C). Частицы три раза промывали водой, по 500 мл каждый раз.
Данные частицы покрывали также как в примерах 4-6.
Пример 8B (без окисления/с фумигацией воздухом)
Для получения наночастиц оксида железа в этиленгликоле, 0,1 моль FeCl3·6H2O и 0,2 моль FeCl3 (безводного), 50 г ацетата натрия и 195 г диаминогексана растворяли в 900 мл этиленгликоля и нагревали до 60°C в течение одного часа.
Затем раствор нагревали до точки кипения в течение 30 минут. Температуру кипения поддерживали в течение 6 часов. Образовавшуюся дисперсию медленно охлаждали до комнатной температуры.
Частицы три раза промывали смесью этанола и воды. Затем частицы повторно суспендировали в 900 мл этиленгликоля и фумигировали атмосферным кислородом. Суспензию нагревали до точки кипения этиленгликоля и выдерживали при данной температуре в течение 24 часов.
После охлаждения частицы промывали смесью воды и этанола и повторно суспендировали в воде.
Данные частицы покрывали также как в примерах 4-6.
Пример 8C (с окислением/с фумигацией воздухом)
Для получения наночастиц оксида железа в этиленгликоле, 0,1 моль FeCl3·6H2O и 0,2 моль FeCl3 (безводного), 50 г ацетата натрия и 195 г диаминогексана растворяли в 900 мл этиленгликоля и нагревали до 60°C в течение одного часа.
Затем раствор нагревали до точки кипения в течение 30 минут. Температуру кипения поддерживали в течение 6 часов. Образовавшуюся дисперсию медленно охлаждали до комнатной температуры.
Частицы три раза промывали смесью этанола и воды. Затем частицы повторно суспендировали в 900 мл этиленгликоля и фумигировали атмосферным кислородом. Суспензию нагревали до точки кипения этиленгликоля и выдерживали при данной температуре в течение 24 часов.
После охлаждения частицы промывали смесью воды и этанола и повторно суспендировали в 900 мл 1М HNO3. Затем добавляли 450 мл 0,7М раствора нитрата железа (Fe(NO3)3·9H2O) и кипятили с обратным холодильником в течение одного часа (100°C). Частицы три раза промывали водой, по 500 мл каждый раз.
Данные частицы покрывали также как в примерах 4-6.
Пример 8D (без окисления/без фумигации воздухом)
Для получения наночастиц оксида железа в этиленгликоле, 0,1 моль FeCl3·6H2O и 0,2 моль FeCl3 (безводного), 50 г ацетата натрия и 195 г диаминогексана растворяли в 900 мл этиленгликоля и нагревали до 60°C в течение одного часа. Затем раствор нагревали до точки кипения в течение 30 минут. Температуру кипения поддерживали в течение 6 часов. Образовавшуюся дисперсию медленно охлаждали до комнатной температуры.
Частицы три раза промывали смесью этанола и воды. Затем частицы повторно суспендировали в 900 мл этиленгликоля. Суспензию нагревали до точки кипения этиленгликоля и выдерживали при данной температуре в течение 24 часов.
После охлаждения частицы промывали смесью воды и этанола и повторно суспендировали в воде.
Данные частицы покрывали также как в примерах 4-6.
Пример 9
Для получения наночастиц оксида железа раствор 96 г гидроксида натрия и 680 мл олеиновой кислоты в 2000 мл метанола добавляли к раствору 216 г гексагидрата хлорида Fe (III) в 500 мл метанола. Полученное в результате твердое вещество промывали метанолом и растворяли в диэтиловом эфире. Затем его несколько раз экстрагировали водой. Твердое вещество осаждали ацетоном, промывали и сушили под вакуумом.
75 г данного твердого вещества растворяли в 250 мл триоктиламина и нагревали до 120°C в течение одного часа.
Затем раствор нагревали в автоклаве до температуре 380°C в течение 30 минут. Данную температуру поддерживали в течение 4 часов. Образовавшуюся дисперсию медленно охлаждали до комнатной температуры.
Частицы три раза промывали смесью этанола и воды.
Затем частицы суспедировали в 300 мл дибутилового эфира диэтиленгликоля и фумигировали атмосферным кислородом. Суспензию нагревали в автоклаве до температуры 300°C и выдерживали при данной температуре в течение 24 часов.
Данные частицы окисляли также как в примере 8C и затем покрывали также как в примерах 4-6.
Изобретение относится к получению биосовместимых магнитных наночастиц и может быть использовано для терапевтических целей, в частности для борьбы с раком. Способ получения наночастиц, включающих оксид железа и кремнийсодержащую оболочку и имеющих значение удельного коэффициента поглощения (SAR) 10-40 Вт на г Fe при напряженности поля 4 кА/м и частоте переменного магнитного поля 100 кГц, содержит следующие стадии: А1) приготовление композиции по меньшей мере одного железосодержащего соединения в по меньшей мере одном органическом растворителе; В1) нагрев композиции до температуры в диапазоне от 50°C до температуры на 50°C ниже температуры реакции железосодержащего соединения согласно стадии С1 в течение минимального периода 10 минут; С1) нагрев композиции до температуры между 200°C и 400°C; D1) очистку полученных частиц; Е1) суспендирование очищенных наночастиц в воде или водном растворе кислоты; F1) добавление поверхностно-активного соединения в водный раствор, полученный согласно стадии E1); G1) обработку водного раствора согласно стадии F1) ультразвуком; H1) очистку водной дисперсии частиц, полученных согласно стадии G1); I1) получение дисперсии частиц согласно стадии H1) в смеси растворителя из воды и растворителя, смешивающегося с водой; J1) добавление алкоксисилана в дисперсию частиц в смеси растворителя согласно стадии I1); и К1) очистку частиц. Изобретение позволяет получить биосовместимые магнитные частицы с высоким значением удельного коэффициента поглощения (SAR). 6 н. и 36 з.п. ф-лы, 3 ил., 9 пр.
1. Способ получения наночастиц, включающих оксид железа и кремнийсодержащую оболочку и имеющих значение удельного коэффициента поглощения (SAR) 10-40 Вт на г Fe при напряженности поля 4 кА/м и частоте переменного магнитного поля 100 кГц, содержащий следующие стадии:
А1) приготовление композиции по меньшей мере одного железосодержащего соединения А в по меньшей мере одном органическом растворителе LM1;
В1) нагрев композиции до температуры в диапазоне от 50°C до температуры на 50°C ниже действительной температуры реакции железосодержащего соединения А согласно стадии С1 в течение минимального периода 10 мин;
С1) нагрев композиции до температуры между 200°C и 400°C;
D1) очистку полученных частиц;
Е1) суспендирование очищенных наночастиц в воде или водном растворе кислоты;
F1) добавление поверхностно-активного соединения в водный раствор, полученный согласно стадии Е1);
G1) обработку водного раствора согласно стадии F1) ультразвуком;
H1) очистку водной дисперсии частиц, полученных согласно стадии G1);
I1) получение дисперсии частиц согласно стадии H1) в смеси растворителя из воды и растворителя, смешивающегося с водой;
J1) добавление алкоксисилана в дисперсию частиц в смеси растворителя согласно стадии I1); и
К1) очистку частиц.
2. Способ по п.1, дополнительно содержащий стадию А2), следующую за стадией А1):
А2) добавление добавки, выбранной из группы, включающей тенсиды, силаны, Si- или Al-содержащие органические соединения, фосфины, насыщенные или ненасыщенные жирные кислоты, амины, диамины, карбоновые кислоты и их соли, насыщенные и ненасыщенные жирные кислоты, полимеры.
3. Способ по п.1, дополнительно содержащий стадию В2), следующую за стадией В1):
В2) добавление добавки, выбранной из группы, включающей тенсиды, силаны, Si- или Al-содержащие органические соединения, фосфины, насыщенные или ненасыщенные жирные кислоты, амины, диамины, карбоновые кислоты и их соли, насыщенные и ненасыщенные жирные кислоты, полимеры, или
В2) добавление композиции по меньшей мере одного железосодержащего соединения В в по меньшей мере одном органическом растворителе L2,
или
В2) добавление композиции по меньшей мере одного железосодержащего соединения В в по меньшей мере одном органическом растворителе L2 и добавление добавки, выбранной из группы, содержащей тенсиды, силаны, Si- или Al-содержащие органические соединения, фосфины, насыщенные или ненасыщенные жирные кислоты, амины, диамины, карбоновые кислоты и их соли, насыщенные и ненасыщенные жирные кислоты, полимеры.
4. Способ по п.3, в котором упомянутое по меньшей мере одно железосодержащее соединение В выбрано из группы, содержащей соединения комплексов железа, соединения карбонилов железа, соли железа, органические соединения железа, соли железа и насыщенных/ненасыщенных жирных кислот и сандвичевые комплексы железа.
5. Способ по п.3, в котором упомянутый по меньшей мере один растворитель L2 имеет минимальную точку кипения 200°C.
6. Способ по п.3, в котором упомянутый по меньшей мере один растворитель L2 выбран из группы, содержащей высококипящие амины, алканы, олефины, спирты или простые эфиры, простые моноэфиры алкиленгликоля, простые диэфиры алкиленгликоля, простые моноэфиры этиленгликоля, простые диэфиры этиленгликоля, простые моноэфиры пропиленгликоля, простые диэфиры пропиленгликоля, простые моноэфиры глицерина, простые диэфиры глицерина, простые триэфиры глицерина, простые диэфиры гликоля (глимы).
7. Способ по п.3, в котором упомянутое по меньшей мере одно железосодержащее соединение В идентично упомянутому по меньшей мере одному железосодержащему соединению А, и/или упомянутый по меньшей мере один органический растворитель LM1 идентичен упомянутому по меньшей мере одному органическому растворителю LM2.
8. Способ по п.1, дополнительно содержащий стадию Х2), следующую за стадиями С1 или D1, или Е1, или F1, или G1, или H1, или I1, или J1, или К1:
Х2) окисление образовавшихся частиц.
9. Способ по п.1, дополнительно содержащий стадию термической обработки D1*), следующую за стадией D1:
D1*) термическую обработку полученных частиц.
10. Способ по п.1, в котором упомянутое по меньшей мере одно железосодержащее соединение А выбрано из группы, содержащей соединения комплексов железа, соединения карбонилов железа, соли железа, органические соединения железа, соли железа и насыщенных/ненасыщенных жирных кислот и сандвичевые комплексы железа.
11. Способ по п.1, в котором упомянутый по меньшей мере один растворитель имеет минимальную точку кипения 200°C.
12. Способ по п.1, в котором упомянутый по меньшей мере один растворитель LM1 выбран из группы, содержащей высококипящие амины, алканы, олефины, спирты, простые эфиры, простые моноэфиры алкиленгликоля, простые диэфиры алкиленгликоля, простые моноэфиры этиленгликоля, простые диэфиры этиленгликоля, простые моноэфиры пропиленгликоля, простые диэфиры пропиленгликоля, простые моноэфиры глицерина, простые диэфиры глицерина, простые триэфиры глицерина, простые диэфиры гликоля (глимы).
13. Способ по п.1, в котором нагрев согласно стадии С1) осуществляют в течение минимального периода 30 мин.
14. Способ по п.1, в котором очистку согласно стадии D1) выполняют экстракцией в аппарате Сокслета.
15. Способ по п.1, в котором на стадии очистки согласно стадии D1) присутствующие добавки будут, по существу, удалены.
16. Способ по п.1, в котором водный раствор минеральной кислоты имеет pH от 2 до 6, предпочтительно от 3 до 5.
17. Способ по п.1, в котором минеральная кислота согласно стадии Е1) выбрана из группы, содержащей хлористоводородную кислоту, фосфорную кислоту, серную кислоту, бромистоводородную кислоту, борную кислоту или азотную кислоту.
18. Способ по п.1, в котором поверхностно-активное соединение согласно стадии F1) выбрано из группы, содержащей жирные кислоты, соли жирных кислот, тенсиды, полимеры, поливиниловый спирт, полиэтиленгликоль, полиакриловую кислоту, декстран, PLGA (сополимер молочной и гликолевой кислот), хитозан и полиэтиленимин.
19. Способ по п.1, в котором смесь растворителя согласно стадии I1) представляет собой спиртоводную смесь с объемным отношением спирта к воде, находящимся в диапазоне от 1:1 до 1:5.
20. Способ по п.19, в котором смесь растворителя дополнительно содержит амин или аммиак.
21. Способ по п.19, в котором спирт выбран из группы, содержащей метанол, этанол, пропанол и изопропанол.
22. Способ по п.1, в котором алкоксисилан согласно стадии J1) выбран из группы, содержащей тетраалкоксисиланы, триалкоксисиланы, диалкоксисиланы и моноалкоксисиланы.
23. Способ по п.1, в котором молярное отношение частицы к алкоксисилану согласно стадии J1) находится в диапазоне от 1:1 до 1:5.
24. Способ по п.1, в котором алкоксисилан согласно стадии J1) добавляют при ультразвуковой обработке.
25. Способ по п.1, в котором дисперсию, полученную согласно стадии J1), обрабатывают ультразвуком в течение 1-8 ч.
26. Способ по п.1, дополнительно содержащий стадию L1):
L1) связывания противоракового соединения, моноклонального антитела, аптамера, нуклеиновой кислоты, аминокислоты, пептида, белка, углевода, липида, гликопротеина, гликана, липопротеина, или антипролиферативного, антимиграторного, антиангиогенного, антитромботического, антивоспалительного, противовоспалительного, цитостатического, цитотоксического, антикоагулянтного, противобактериального, противовирусного или противогрибкового лекарственного препарата с частицами, полученными согласно стадии К1).
27. Железосодержащие наночастицы, получаемые способом по любому из пп.1-26.
28. Железосодержащие наночастицы по п.27, причем наночастицы имеют минимальное значение удельного коэффициента поглощения (SAR) 20 мВт/мг Fe при напряженности поля 6 кА/м.
29. Наночастицы, включающие оксид железа и кремнийсодержащую оболочку, причем наночастицы имеют значение удельного коэффициента поглощения (SAR) 10-40 Вт на г Fe при напряженности поля 4 кА/м и частоте переменного магнитного поля 100 кГц.
30. Наночастицы по п.29, причем кремнийсодержащая оболочка имеет толщину между 0,5 и 10 нм, предпочтительно от 1 до 6 нм, более предпочтительно от 2 до 4 нм, а в частности 3 нм.
31. Наночастицы по любому из пп.29 и 30, причем наночастицы содержат железо.
32. Наночастицы по п.31, причем наночастицы являются ферромагнитными, ферримагнитными или суперпарамагнитными.
33. Наночастицы по п.29, причем наночастицы имеют значение SAR 20-40 Вт на г Fe, в частности 25-40 Вт на г Fe, более конкретно 30-40 Вт на г Fe, при напряженности поля 4 кА/м и при частоте переменного магнитного поля 100 кГц.
34. Наночастицы по п.29, причем наночастицы являются не диспергируемыми в неполярных растворителях и диспергируемыми в воде.
35. Наночастицы по п.29, причем наночастицы имеют диаметр менее 500 нм, в частности 1-100 нм, предпочтительно 15-30 нм.
36. Наночастицы по п.29, причем кремнийсодержащая оболочка функционализирована алкоксисиланами.
37. Наночастицы по п.36, причем алкоксисиланы представляют собой триалкоксисиланы, при этом упомянутые триалкоксисиланы являются
(i) несущими функциональную группу, соединенную Si-C связью, предпочтительно (3-акрилоксипропил)триметоксисилан, триэтоксисилилбутиральдегид, 3-аминопропилтриэтоксисилан, 3-изоцианатопропилтриэтоксисилан; или
(ii) несущими присоединенные Si-C связями боковые цепи полиэтиленгликоля различной длины, предпочтительно 2-[метокси(полиэтиленокси)пропил]триметоксисилан.
38. Наночастицы, включающие оксид железа и кремнийсодержащую оболочку, получаемые способом по любому из пп.1-26, причем наночастицы характеризуются по любому из пп.29-37.
39. Фармацевтическая композиция, содержащая железосодержащие наночастицы по любому из пп.27 и 28 или наночастицы по любому из пп.29-38.
40. Фармацевтическая композиция по п.39 в форме инфузионного раствора, раствора для инъекций, порошка, порошка для ингаляций или лиофилизата.
41. Применение железосодержащих наночастиц по любому из пп.27 и 28 или наночастиц по любому из пп.29-38 для получения фармацевтической композиции для лечения и/или профилактики пролиферативных заболеваний, рака, опухолей, ревматизма, артрита, артроза и бактериальных инфекций.
42. Применение по п.41 в сочетании с противораковым препаратом.
| SHOUHENG SUN et al | |||
| Monodisperse MFeO (M=Fe, Co, Mn) | |||
| Nanoparticles, Journal of the American Chemical Society, 2004, vol | |||
| Ударно-вращательная врубовая машина | 1922 |
|
SU126A1 |
| GUPTA A.K | |||
| GUPTA M | |||
| Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications, Biomaterials, 2005, vol | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ЖЕЛЕЗА - ФЕРРОЦЕНИЛАЛКИЛПОЛИФТОРАЗОЛЫ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1996 |
|
RU2089507C1 |
Авторы
Даты
2013-12-10—Публикация
2009-01-09—Подача