Изобретение относится к биотехнологии и касается способа получения водных растворов амидов путем гидратации нитрилов карбоновых кислот с помощью иммобилизованного биокатализатора, который представляет собой содержащий нитрилгидратазу белковый препарат, ковалентно связанный с активированным хитозаном.
Хитозан является перспективным носителем для иммобилизации ферментов, используемых в промышленности. Большое количество свободных аминогрупп в молекуле определяет его способность взаимодействовать с бифункциональными реагентами, образующими химические связи как с молекулой хитозана, так и с молекулой белка, что делает возможным ковалентную сшивку фермента с хитозаном. Известны способы иммобилизации фермента путем простой адсорбции на хитозане за счет большого количества образующихся водородных связей [1], а также ковалентное присоединение фермента к хитозану, активированному глутаровым альдегидом [2], гидрохлоридом этил (3-демитиламинопропил) карбодиимида [3], эпихлоргидрином [4]. Так, использование в качестве сшивающего агента глутарового альдегида и карбодиимида гидрохлорида при иммобилизации липазы на хитозане дало возможность шестикратного повторного использования фермента [3].
Биотехнологическое производство амидов (акриламида) в настоящее время основано на гидратации водных растворов нитрилов (нитрила акриловой кислоты), причем в качестве катализатора процесса используется суспендированная биомасса бактерий, обладающих нитрилгидратазной активностью, либо иммобилизованная в гель полиакриламида [5, 6]. Недостатком способа, при котором катализатором является неиммобилизованная биомасса бактерий, является ее однократное использование, что приводит к образованию большого количества отработанного шлама биокатализатора, требующего утилизации.
При включении клеток бактерий в структуру полиакриламидного геля происходит затруднение массообмена за счет диффузионных ограничений, что в свою очередь снижает скорость ферментативной реакции.
Недостатком использования в качестве биокатализатора данного процесса целых клеток микроорганизмов является присутствие амидазной активности, сопряженной с нитрилгидратазной, что приводит к образованию побочных продуктов - карбоновых кислот из соответствующих амидов.
Эти недостатки могут быть преодолены при использовании частично очищенных ферментных препаратов, ковалентно иммобилизованных на нерастворимом носителе.
Наиболее близким по технической сущности к предлагаемому решению является способ получения иммобилизованного биокатализатора и способ получения водных растворов амидов с использованием этого биокатализатора [7], принятый за прототип. Способ осуществляется путем иммобилизации клеток микроорганизмов рода Rhodococcus, обладающих нитрилгидратазной активностью, на углеродных носителях - активных углях из растительного и полимерного сырья, а также путем использования этого биокатализатора для получения водных растворов амидов из нитрилов карбоновых кислот. Недостатками данного способа являются:
- небольшое количество циклов синтеза амидов (6-7 циклов), осуществляемое иммобилизованными клетками бактерий без потери нитрилгидратазной активности;
- использование целых клеток в процессе конверсии нитрилов, что приводит к образованию побочного продукта - карбоновой кислоты, синтез которой осуществляется ферментом амидазой, присутствующей в бактериальной клетке вместе с нитрилгидратазой;
- большое количество некаталитической массы в виде углеродных носителей.
Технической задачей настоящего изобретения является увеличение количества циклов гидратации нитрилов и времени работы биокатализатора без снижения нитрилгидратазной активности, повышение выхода амидов и снижение образования побочных продуктов, в частности, карбоновых кислот; а также уменьшение доли некаталитической массы в реакторе.
Задача осуществляется с помощью признаков, указанных в 1-м пункте формулы изобретения, таких как Способ получения иммобилизованного биокатализатора для синтеза водных растворов амидов, в том числе акриламида и никотинамида из нитрилов карбоновых кислот, на основе ферментного препарата, содержащего нитрилгидратазу, отличающийся тем, что на хитозане, полученном в виде микрогранул диаметром 1-2 мм в результате продавливания его 2-4% раствора с помощью экструдера в 1 М раствор гидрооксида калия и активации 0,01-0,5% раствором бензохинона в соотношении 1:1, иммобилизуют ферментный препарат путем ковалентного присоединения белков при 20 мин инкубации при температуре 22-25°.
Задача осуществляется с помощью признаков, указанных во 2-м пункте формулы изобретения, таких как Способ получения водных растворов амидов, в том числе акриламида и никотинамида, путем гидратации нитрилов карбоновых кислот с использованием иммобилизованного биокатализатора, полученного на основе содержащего нитрилгидратазу белкового препарата, иммобилизованного путем ковалентного присоединения белков к хитозану, активированному бензохиноном.
Способ осуществляется за счет иммобилизации содержащего нитрилгидратазу ферментного препарата, полученного грубой очисткой из разрушенных клеток родококков, на хитозановых микросферах, активированных бензохиноном.
Решение поставленной задачи достигается тем, что каталитически активные клетки родококков разрушают ультразвуком, выделяют нитрилгидратазу, последовательно повышая концентрацию сульфата аммония, и иммобилизуют ферментный препарат на микросферах хитозана, предварительно активированных раствором бензохинона. Для получения нитрилгидратазы используют штамм Rhodococcus ruber GT (Патент RU 2223316). Клетки бактерий выращивают на синтетической минеральной среде с глюкозой в качестве источника углерода и хлоридом аммония в качестве источника азота, отделяют центрифугированием от ростовой среды и разрушают ультразвуком с частотой 22 кГц. Отделяют центрифугированием обломки клеток, из надосадочной жидкости фракционируют нитрилгидратазу, добавляя сульфат аммония, постепенно повышая его концентрацию. Полученные фракции проверяют на нитрилгидратазную активность быстрым спектрофотометрическим методом при длине волны 240-260 нм, отслеживая повышение оптической плотности раствора белка в течение 1 мин после внесения акрилонитрила до концентрации 0,4%. Фракцию с высокой нитрилгидратазной активностью смешивают с предварительно подготовленными микросферами хитозана. Микросферы хитозана готовят следующим образом: раствор хитозана в уксусной кислоте накапывают в раствор щелочи, что приводит к отвердению гранул. Полученные микросферы активируют раствором бензохинона. Отмывают от бензохинона фосфатным буфером и микросферы активированного хитозана используют для иммобилизации ферментного препарата. Иммобилизованную нитрилгидратазу используют для получения акриламида из акрилонитрила или других амидов из соответствующих нитрилов в периодическом, либо проточном режиме.
Вышеперечисленная совокупность существенных признаков позволяет получить следующий технический результат - увеличение количества циклов гидратации нитрилов и времени работы биокатализатора без снижения нитрилгидратазной активности, повышение выхода амидов и снижение образования побочных продуктов, в частности, карбоновых кислот; а также уменьшение доли некаталитической массы в реакторе.
Способ поясняется следующими примерами:
Пример 1. Получение ферментного препарата, содержащего нитрилгидратазу
Клетки Rhodococcus (R. ruber GT) выращивают на синтетической среде состава (г/л): глюкоза - 1-5; NH4Cl (либо мочевина) - 0,3-1; KH2PO4 - 1,0; K2HPO4×3H2O - 1,6; NaCl - 0,5; MgSO4×7H2O - 0,5; FeSO4×7H2O - 0,002; CoCl2×6H2O - 0,01; pH 7,4 в течение 30-45 ч до достижения плотности суспензии 4-10 г/100 мл и нитрилгидратазной активности не менее 100 ед.
Клеточную суспензию центрифугируют 20 мин при 10500×g при 4°C, осадок клеток отмывают фосфатным буфером (pH 7,2), содержащим 44 мМ бутират натрия. Осадок клеток ресуспендируют в фосфатном буфере, содержащем 44 мМ бутират натрия, и подвергают клетки воздействию ультразвука с частотой 22 кГц 10 раз по 15 с, поддерживая температуру 0-+4°С. Суспензию, содержащую разрушенные клетки, центрифугируют 20 мин при 10500×g при 4°C, из надосадочной жидкости высаливают нитрилгидратазу, последовательно добавляя сульфат аммония до концентрации 35% и 60% от насыщающей. Каждый раз раствор белка центрифугируют 20 мин при 10500×g при 4°C. Осадок, полученный при концентрации сульфата аммония 35% от насыщающей, отбрасывают, осадок, полученный при концентрации сульфата аммония 60% от насыщающей, растворяют в фосфатном буфере (pH 7,2), содержащем 44 мМ бутират натрия. Концентрацию белка определяют по методу Бредфорд [8], активность - по реакции с акрилонитрилом [9]. Белковый препарат, содержащий нитрилгидратазу, хранят при -18°C.
Пример 2. Иммобилизация нитрилгидратазы на хитозане, активированном бензохиноном
Готовят 2-4% (вес/объем) раствор хитозана в 2%-ной уксусной кислоте. Раствор хитозана продавливают с помощью экструдера в 1 М раствор гидрооксида калия. Полученные микросферы диаметром 1-2 мм оставляют на 1 ч для отвердения и отмывают однократно фосфатным буфером (pH 7,2). Активируют гранулы 0,01-0,5% раствором бензохинона в течение 15 мин в соотношении гранул и активатора 1:1. Отмывают 3 раза фосфатным буфером, двукратно превышающим объем раствора бензохинона. Активированные гранулы смешивают с ферментным препаратом в соотношении 2,5:1, после 20 мин инкубации при температуре 22-25°C отмывают 3 раза фосфатным буфером, пятикратно превышающим объем раствора белка. Полученный иммобилизованный препарат хранят при температуре от 0°C до +10°C.
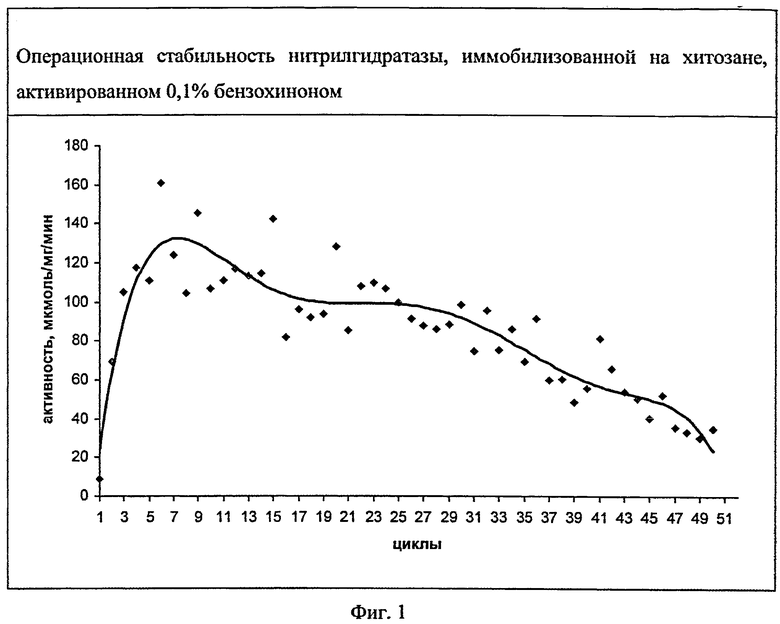
Пример 3. Трансформация нитрилов в соответствующие амиды нитрилгидратазой, иммобилизованной на активированном хитозане. Многоцикловая конверсия нитрилов нитрилгидратазой, иммобилизованной на активированном хитозане.
Трансформацию нитрилов осуществляют в водной среде (вода либо калий- фосфатный буфер). Нитрил вносят до концентрации 10%, по мере полной трансформации в амид добавляют новую порцию нитрила. Концентрацию амида оценивают методом высокоэффективной жидкостной хроматографии.
Каждый цикл конверсии нитрилов проводят в реакторах объемом от 0,001 до 10 м3. Реакция катализируется ферментным препаратом, содержащим нитрилгидратазу, ковалентно связанным с хитозаном, активированным 0,1% бензохиноном. Активность нитрилгидратазы после иммобилизации составляет от 5 до 150 мкмоль/мг/мин. Оценивают сохранение нитрилгидратазной активности при последовательном проведении конверсии нитрила, вносимого в каждом цикле до концентрации 5% в воде, либо калий-фосфатном буфере pH 6,5-8,3. Активность определяют через 10 мин от начала реакции. Иммобилизованный катализатор после проведения цикла реакции отмывают водой либо калий-фосфатным буфером pH 6,5-8,3.
В данных условиях иммобилизованная нитрилгидратаза при конверсии акрилонитрила не теряет своей активности по меньшей мере в пятидесяти циклах реакций, причем во втором и последующих циклах активность фермента превышает таковую в первом цикле. Результаты представлены на фиг.1. Нитрилгидратаза в растворе может быть использована лишь для однократной конверсии нитрила.
Выход акриламида при трансформации акрилонитрила нитрилгидратазой, ковалентно связанной с хитозаном, составляет 4300-6400 г акриламида на 1 г белка, что превышает выход продукта при многоцикловой конверсии акрилонитрила клетками Rhodococcus, иммобилизованными на углеродных носителях (1600-5400 г акриламида на 1 г сухой биомассы) [7].
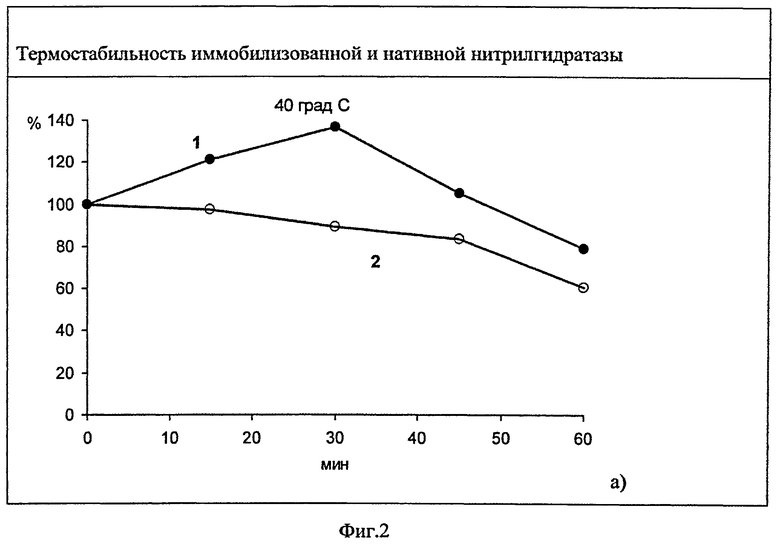
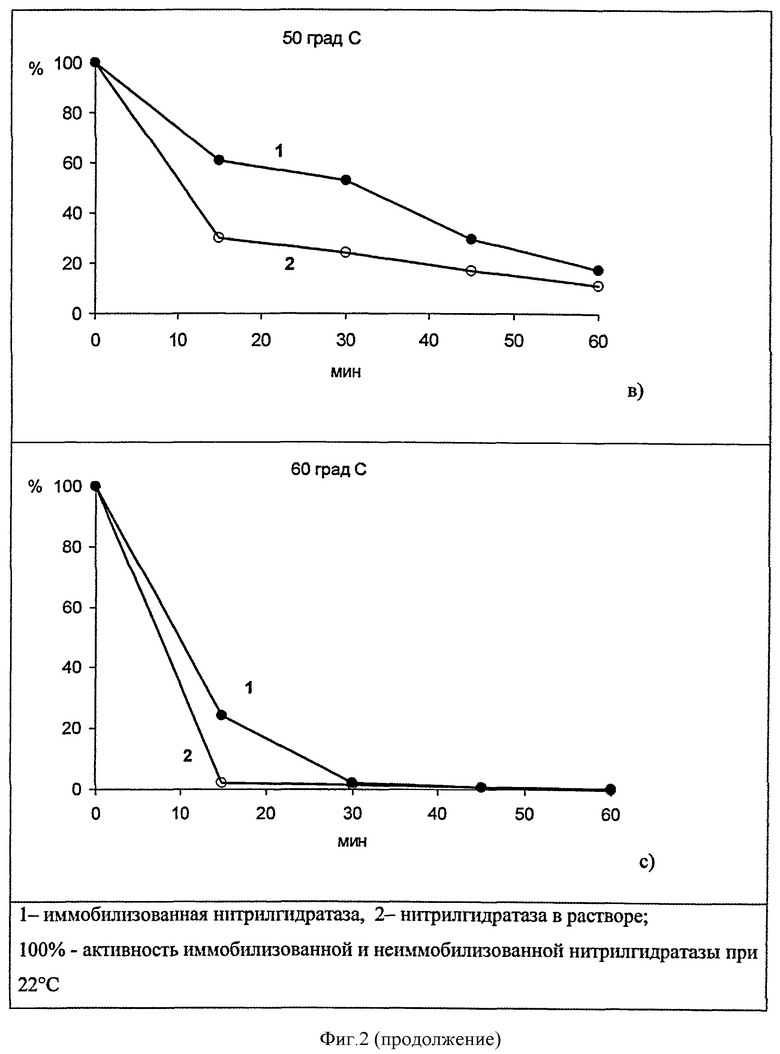
Пример 4. Термостабильность нитрилгидратазы, иммобилизованной на активированном хитозане.
Для определения термостабильности иммобилизованного биокатализатора нитрилгидратазу, ковалентно связанную с активированным бензохиноном, инкубируют при температурах 40, 50 и 60°C в течение 15-60 мин, после чего резко охлаждают и проводят реакцию с акрилонитрилом в качестве субстрата в течение 10 мин при температуре 22°C. Количество образовавшегося продукта определяют методом высокоэффективной жидкостной хроматографии. Термостабильность иммобилизованной нитрилгидратазы сравнивают с термостабильностью нитрилгидратазы в растворе при проведении реакции в идентичных условиях. Результаты представлены на фиг.2.
При воздействии повышенных температур иммобилизованная нитрилгидратаза более стабильна, чем находящаяся в растворе. Воздействие температуры 40°C в течение 30 мин приводит к повышению активности иммобилизованного биокатализатора по сравнению с его активностью при 22°C. При нагревании до 60°C в течение 15 мин иммобилизованная нитрилгидратаза сохраняет от 25 до 60% активности, измеренной при 22°C, а фермент в растворе - от 2 до 15%. Стабилизация нитрилгидратазы иммобилизацией на хитозане, активированном бензохиноном, приводит к сохранению более высокой активности при воздействии повышенных температур, по сравнению с ферментом в растворе при прочих равных условиях.
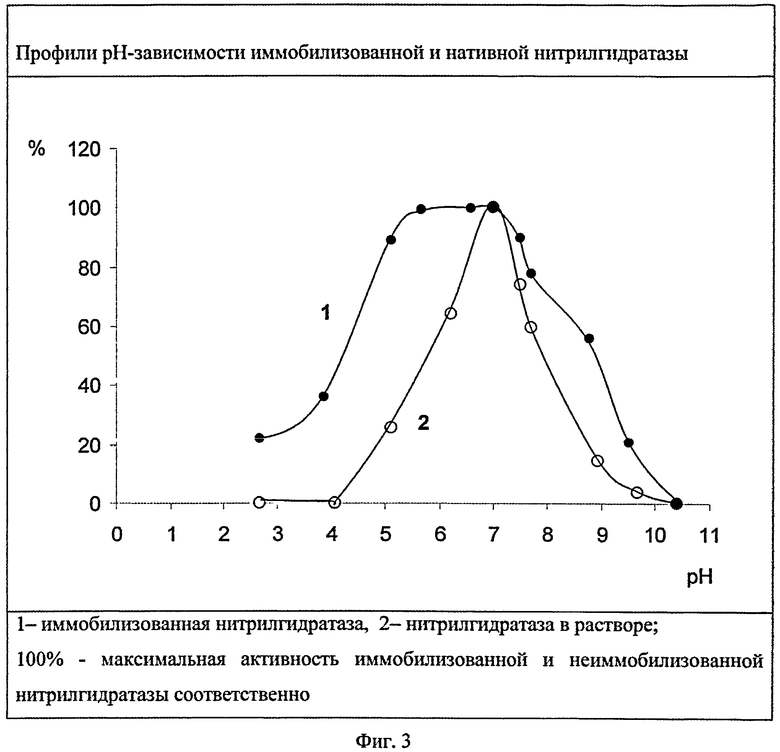
Пример 5. Кислотоустойчивость нитрилгидратазы, иммобилизованной на активированном хитозане.
Для определения pH реакционной среды, при котором активность ковалентно связанной с бензохиноном нитрилгидратазы максимальна, и диапазона pH, при котором иммобилизованный фермент катализирует синтез амидов, иммобилизованную и находящуюся в растворе нитрилгидратазу вносят в универсальный буферный раствор (буфер Теорелла-Стенхагена) [10] pH от 2 до 10,5 и проводят трансформацию 0,58 М раствора акрилонитрила в течение 10 мин при 22°C. Профили pH-зависимости активности иммобилизованной и нативной нитрилгидратазы сравнивают при проведении реакции в идентичных условиях. Результаты представлены на фиг.3.
Нитрилгидратаза, иммобилизованная на хитозане, активированном бензохиноном, при pH 2,7 проявляет активность, составляющую 22% от максимальной, при pH 4-36% от максимальной. Нитрилгидратаза в растворе при данных pH инактивируется. Максимальная активность нитрилгидратазы в растворе проявляется при pH 7, тогда как ковалентно связанный фермент проявляет активность, близкую к максимальной в широком диапазоне pH - от 5,0 до 7,5. В щелочном диапазоне pH>10,0 инактивируется и свободный, и иммобилизованный фермент.
Таким образом, заявленный способ дает следующие преимущества перед известными способами: возможность долговременного и многократного использования иммобилизованной нитрилгидратазы; возможность получения растворов амидов, не загрязненных карбоновыми кислотами; возможность достижения более высокой концентрации биокатализатора в единице объема реактора, возможность более продуктивного синтеза растворов амидов в расчете на единицу массы катализатора, возможность функционирования иммобилизованной нитрилгидратазы при кислотности реакционной среды от 2,7 до 9,5, возможность проявления максимальной активности в широком диапазоне pH - от 5,0 до 7,5.
Используемые источники
1. Ковалева Т.А., Беленова А.С., Сливкин А.И., Лапенко В.Л. Хитозан как перспективный носитель для иммобилизации липазы // Биотехнология. - 2010. - №4. - С.59-64.
2. Патент CN 101775386 (A). Qixing Jiang; Li Tan; Wenshui Xia. Method for immobilizing trypsinase by chitosan microspheres.
3. Патент CN 101113433 (A). Peilong Sun; Ping Shao; Xianghe Meng. Process for preparing chitosan microsphere immobilized lipolytic enzyme.
4. Патент JP 9094090 (A). Shinonaga Masaaki; Kawamura Yoshihide. Production of carrier for enzyme immobilization
5. Патент РФ 2077588. Дебабов В.Г., Воронин С.П., Козулин С. В., Синолицкий М.К., Козулина Т.Н., Полянский А.Б., Синтин А.А., Яненко А.С., Байбурдов Т.А., Хоркин А.А., Луйксаар И.В., Решетникова Л.В., Федченко Н.Н. Способ получения акриламида.
6. Hughes J., Armitage Y.C., Symes K.C. Application of whole cell rhodococcal biocatalysts in acrylic polymer manufacture // Antonio van Leeuwenhoek. - 1998. - V.74. - P.107-118.
7. Патент РФ 2352635. Максимов А.Ю., Демаков В.А., Максимова Ю.Г., Олонцев В.Ф. Способ получения иммобилизованного биокатализатора и способ получения водных растворов амидов с использованием этого биокатализатора - прототип.
8. Bradford M.M. A rapid and sensitive method for quantification of microgram quantities of protein utilizing the principle of protein-dye-binding. Anal Biochem 1976. - V.72. - P.248-254.
9. Максимов А.Ю., Кузнецова М.В., Овечкина Г.В., Козлов С.В., Максимова Ю.Г., Демаков В.А. Влияние нитрилов и амидов на рост и нитрилгидратазную активность штамма Rhodococcus sp. gt1 // Прикл. биохим. микробиол. - 2003. - Т.39. - №1. - С.63-68.
10. Биссвангер X. Практическая энзимология. - М.: БИНОМ. Лаборатория знаний. - 2010. - С.96.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО БИОКАТАЛИЗАТОРА И СПОСОБ ПОЛУЧЕНИЯ ВОДНЫХ РАСТВОРОВ АМИДОВ С ИСПОЛЬЗОВАНИЕМ ЭТОГО БИОКАТАЛИЗАТОРА | 2007 |
|
RU2352635C2 |
| ШТАММ RHODOCOCCUS RHODOCHROUS NCIMB 41164 И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОДУЦЕНТА НИТРИЛГИДРАТАЗЫ | 2004 |
|
RU2403280C2 |
| СПОСОБ ПРОИЗВОДСТВА АМИДНОГО СОЕДИНЕНИЯ С ПРИМЕНЕНИЕМ МИКРОБНОГО КАТАЛИЗАТОРА | 2001 |
|
RU2288270C2 |
| СПОСОБ ПОЛУЧЕНИЯ АКРИЛАМИДА | 1996 |
|
RU2077588C1 |
| СПОСОБ ПОЛУЧЕНИЯ АКРИЛОВЫХ МОНОМЕРОВ И ШТАММ БАКТЕРИЙ RHODOCOCCUS RHODOCHROUS ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2006 |
|
RU2304165C1 |
| ШТАММ БАКТЕРИЙ rhodococcus ruber - ПРОДУЦЕНТ НИТРИЛГИДРАТАЗЫ | 2001 |
|
RU2223316C2 |
| ПОВЫШЕНИЕ РЕАКЦИОННОЙ СПОСОБНОСТИ НИТРИЛГИДРАТАЗЫ С ПОМОЩЬЮ АЛЬДЕГИДА | 2022 |
|
RU2827406C2 |
| ШТАММ БАКТЕРИЙ BACILLUS СEREUS-ПРОДУЦЕНТ НИТРИЛГИДРАТАЗЫ | 1999 |
|
RU2160778C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ПРЕПАРАТА РАЗЛИЧНОЙ ДИСПЕРСНОСТИ НА ОСНОВЕ БРОМЕЛАЙНА И ХИТОЗАНА | 2017 |
|
RU2677232C2 |
| ШТАММ БАКТЕРИЙ RHODOCOCCUS AETHERIVORANS BKM AC-2610D - ПРОДУЦЕНТ НИТРИЛГИДРАТАЗЫ, СПОСОБ ЕГО КУЛЬТИВИРОВАНИЯ И СПОСОБ ПОЛУЧЕНИЯ АКРИЛАМИДА | 2012 |
|
RU2520870C1 |
Изобретение относится к области биохимии. Предложен способ получения иммобилизованного биокатализатора для синтеза водных растворов амидов, в том числе акриламида и никотинамида из нитрилов карбоновых кислот. Получают микрогранулы хитозана диаметром 1-2 мм в результате продавливания его 2-4% раствора в 2% уксусной кислоте с помощью экструдера в 1М раствор гидроксида калия. Далее активируют хитозан 0,01-0,5% раствором бензохинона в соотношении 1:1. Затем иммобилизуют ферментный препарат нитрилгидратазы при 20 мин инкубации при температуре 22-25°C. Иммобилизованная нитрилгидратаза при конверсии нитрилов не теряет своей активности по меньшей мере в пятидесяти циклах реакций, работает при кислотности среды от 2,7 до 9,5. 3 ил., 5 пр.
Способ получения иммобилизованного биокатализатора для синтеза водных растворов амидов, в том числе акриламида и никотинамида из нитрилов карбоновых кислот, на основе ферментного препарата, содержащего нитрилгидратазу, отличающийся тем, что на хитозане, полученном в виде микрогранул диаметром 1-2 мм в результате продавливания его 2-4%-ного раствора в 2%-ной уксусной кислоте с помощью экструдера в 1М раствор гидроксида калия и активации 0,01-0,5%-ным раствором бензохинона в соотношении 1:1, иммобилизуют ферментный препарат нитрилгидратазы при 20 мин инкубации при температуре 22-25°C.
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО БИОКАТАЛИЗАТОРА И СПОСОБ ПОЛУЧЕНИЯ ВОДНЫХ РАСТВОРОВ АМИДОВ С ИСПОЛЬЗОВАНИЕМ ЭТОГО БИОКАТАЛИЗАТОРА | 2007 |
|
RU2352635C2 |
| CHIOU SHAO-HUA et al | |||
| Immobilization of Candida rugosa lipase on chitosan with activation of the hydroxyl groups// Biomaterials, v.25, №2, January 2004, pp.197-204 | |||
| CARRARA CARLOS R | |||
| et al | |||
| Immobilization of β-Galactosidase on Chitosan// Biotechnology Progress, v.10, №2, pp.220-224, March/April 1994 | |||
| SU | |||
Авторы
Даты
2013-12-10—Публикация
2011-08-19—Подача