Способ предназначается для удаления двухвалентного железа из питьевых, преимущественно углекислых минеральных вод. Минеральные воды, содержащие двухвалентное железо и разлитые в бутылки, после хранения теряют товарный вид из-за появления на внутренних поверхностях бутылок ржавого бурого налета гидроксидов трехвалентного железа, образовавшегося в результате окисления двухвалентного железа, что ухудшает спрос на такую продукцию. Хотя состав и свойства минеральной воды при этом остаются практически без изменения.
Специальными медико-биологическими исследованиями было показано, что терапевтическое действие железа в минеральных водах проявляется только при его массовой концентрации 5 мг/дм3 и более. Такие минеральные воды называют железистыми. При меньших концентрациях (менее 5 мг/дм3) железо не проявляет терапевтического эффекта, при питьевом использовании минеральных вод, поэтому оно может быть удалено без существенного изменения лечебных свойств природных минеральных питьевых вод.
Известен способ удаления двухвалентного железа (железо 2) из хлоридных натриевых рассолов Московского артезианского бассейна, содержащих 12-40 мг/дм3 железа 2, используемых для бальнеолечения, принятый нами в качестве аналога [Евстафьев В.П., Пэн Э.З., Федькушов Ю.И. «Инженерное оборудование в бальнеотехнике», стр.53-62]. Данный способ основан на окислении железа 2 кислородом воздуха, путем аэрации воздухом (барботированием) воды в течение не менее 2-х часов с последующим удалением образовавшегося осадка гидроксида окисного железа 3Fe(ОН)3 последовательно на песочных фильтрах первой и второй ступенях. Без такого кондиционирования рассола, используемого для бальнеолечения, - приводит к образованию железистых ржавых отложений на стенках ванн и бассейна, что ухудшает их эстетический вид, а железистые отложения на внутренних стенках бальнеотехнических систем и аппаратов ухудшает их работу. К сожалению, этот способ находит все большее применение на заводах розлива углекислых минеральных вод. Основным недостатком данного способа особенно при его применении к обработке углекислых минеральных вод, является неизбежное удаление из них диоксида углерода. Это приводит к нарушению карбонатно-кальциевого равновесия, установившегося в подземных условиях и описываемого уравнением:

Если в подземных условиях известняки СаСО3, реагируя с СО2 и водой, образуют растворимый гидрокарбонат кальция Ca(НСО3)2 при течении реакции слева направо, то при удалении из углекислых минеральных вод диоксида углерода, сохраняющего растворимый гидрокарбонат кальция в правой части, который, кстати, придает минеральным водам приятный освежающий привкус, то реакция сдвигается влево. В этом случае растворимый гидрокарбонат кальция (кислый карбонат кальция) переходит в нерастворимый средний карбонат кальция СаСО3 в количестве эквивалентном потере равновесного диоксида углерода в левой части уравнения. Образовавшийся осадок нерастворимого карбоната кальция, называемого травертин выводит из строя песочные фильтры, в которых подвижный песок превращается в прочную глыбу, а тонкопористые фильтры закупориваются травертинами полностью. При этом изменяется солевой состав выпускаемых бутылочных минеральных вод.
Известен так же способ обезжелезивания минеральных вод путем окисления железа кислородом, выделяющимся на аноде при электролизе минеральных вод в герметичном электролизере. При этом способе переход растворенного двухвалентного железа в нерастворимой гидроксид окислого железа Fe(ОН)3 не сопровождается потерей содержащегося в минеральной воде диоксида углерода, поэтому в минеральных водах карбонатно-кальциевое равновесие не нарушается и гидрокарбонат кальция не переходит в нерастворимый средний карбонат. В этом способе, принятом нами за прототип, выделение на аноде кислорода производят при низком анодном потенциале не достигающем потенциале выделения активного хлора в заметных количествах, не более 0,2 мг/дм3. Такой потенциал обеспечивают низкой анодной плотностью тока не превышающей 500 а/м2 при концентрации хлор-иона 0,3 г/дм3 и 400 а/м2 при его концентрации 3 г/дм3. Общее количество тока, пропускаемого в электролизере, эквивалентно общей пермангонатной окисляемости железа и минеральной воды [см. патент РФ №2240983, опубл. 27.11.2004 г. Бюл. №33]
Недостатками данного способа являются необходимость установки дополнительного оборудования в линии обработки минеральной воды (герметичного электролизера), расход электроэнергии, а также необходимость удаления гидроксидного осадка окислившегося железа 3.
С целью устранения отмеченных недостатков и упрощения процесса обезжелезивания минеральных вод предлагается новый способ обезжелезивания минеральных питьевых вод. Техническим результатом этого способа обезжелезивания минеральных вод является снижение содержание железа 2 в минеральных водах до величины не более 0.3 мг/дм3. При такой концентрации железа 2, как установлено, не возникает ржавого налета в выпускаемых бутылках с минеральной водой после их хранения, следовательно, не происходит ухудшения товарного вида и снижения спроса на выпускаемую продукцию. Получение такого технического результата обеспечивается обработкой минеральных вод активным гранулированным угольным сорбентом в угольных колонных фильтрах, в присутствии природных гумосовых кислот в концентрации не менее 1 мг/дм3. При этом, расход минеральной воды, подаваемой в угольный фильтр, должен быть не более рабочего параметра фильтра, а время пребывания минеральной воды в фильтре, т.е. время контакта минеральной воды с угольным сорбентом должно быть не менее 7 минут. Кроме того, для увелечения сорбционной емкости угля по железу обезжелезивание минеральных вод предпочтительно проводить кокосовым гранулированным активным углем, предназначенным для осветления растворов, в котором удельный объем мезопор составляет 0.7 см3/г, а удельная площадь этих пор достигает 200-450 м2/г. Предположительно что в таких мезопорах способны сорбироваться, согласно выдвинутой гипотезе, гигантские молекулы гуминовых кислот, содержащих в своем составе прочные хелатные комплексы железа. Это должно повысить сорбционную емкость сорбента по железу и тем самым снизить частоту регенирации при работе этого сорбента. Использование угольных фильтров производят до полного их насыщения сорбируемыми ионами двухвалентного железа, что проявляется в появлении проскока железа в фильтрат, где его содержание повышается и становится более допустимого 0.3 мг/дм3. В этом случае в фильтре заменяют уголь на новую порцию или регенерируют его одним из известных способов.
Для пояснения текста прилагаются следующие фигуры:
1. Фигура 1. Структурная формула гумусовой кислоты по Комисарову И,Д., где под индексом «А» обозначено возможное положение хелатного комплекса железа в молекуле.
2. Фигура 2. Фотография пилотной установки в цехе завода «Нарзан», состоящей из колонного угольного фильтра AKF 30/31 SM, содержащего 0,45 м3 гранулированного какосового угля марки «Silcarbon К - 814» и системы управления им. На этой установке выполнены эксперименты по обезжелезиванию минеральной воды в динамических условиях.
3. Фигура 3. Результаты обезжелезивания минеральной воды в динамических условиях на указанной пилотной установке при разных производительностях, где «А» кривая остаточного содержания железа при Q1=7 м3/час, «В» - при Q2=10,5 м3/час, и «С» - при Q3=12,5 м3/час.
Расход минеральной воды, пропускаемой через активный уголь, определяется оптимальными гидродинамическими параметрами используемой угольной фильтрующей колонны и временем пребывания воды в угольной колонне не менее 7 минут. В предлагаемом способе допускаемая емкость активного угля, например кокосового, по сорбируемому железу определяется началом проскока двухвалентного железа на выходе воды из фильтра в концентрации более 0,3 мг/дм3.
В процессе проведении экспериментов по сорбционному обезжелезиванию минеральных вод мы столкнулись с проявлением угольным сорбентом не свойственных ему, как нам казалось, ионообменных свойств. Активированный уголь поглощает ионы двухвалентного железа в значительном количестве и довольно прочно удерживает их, т.к. поглощенные ионы железа не вымываются из угля обратным током пресной водопроводной воды. Поэтому возник вопрос о выяснении причин такого аномального поведения угольного сорбента по отношению к ионам Fe2+ находящемся в минеральной воде.
При изучении показателей состава минеральных вод мы обратили внимание на то, что практически все типы углекислых минеральных вод имеют в своем составе гумусовые вещества. Эти органические вещества создаются в почве и являются результатом жизнедеятельности многих поколений живых существ, обитающих в почве и перерабатывающих возникающие в почве органические вещества в форме продуктов метаболизма и останков отмерших существ (насекомых, червей, простейших и микроорганизмов). Это органическое вещество называемое гумусом имеет очень сложное строение, состоящее из многих гетерогенных циклических соединений, снабженных разнообразными радикалами. Многочисленным разрозненным сведениям о гуминовых веществах посвящена монография А.И. Попова [«Гуминовые вещества: свойства, строение, образование»под редакцией Е.И. Ермакова - СПб.: Изд-во Санкт-Петерб. ун-та, 2004 г. - 248 с. Библиография 807 наименований.] В этой монографии так охарактеризованы гумусовые вещества: «ГВ - это природные супермолекулы, которые представляют собой высокомолекулярные органические азотсодержащие рандомизованные редокс-гетерополимеры арил-гликопротейновой природы. Им не свойственно постоянство химического состава, молекулярной массы, они имеют темную окраску». Гумусовые вещества подразделяют на гумингумусовые кислоты (ГК), фульвокислоты (ФК). Гумины-довольно химически инертная группа.
Гумусовые кислоты весьма химически реактивные соединения склонные к комплексообразованию с многовалентными катионами. Они осаждаются в кислой среде и растворяются в нейтрально-щелочной среде с образованием растворимых солей. Молекулярная масса гуминовых кислот значительна и достигает 1300-2000 углеродных единиц.
Присутствие гумосовых веществ в минеральных водах, как представляется, является результатом захоронения в существующих водных горизонтах древних почв прошлых геологических эпох, из которых и вымываются гумусовые вещества, растворяющиеся в вымывающих их нейтральных и слабощелочных минеральных водах.
В указанной монографии приведены результаты исследований Ж.Ш. Жоробековой и др. [в статье «особенности комплексообразования гуминовых кислот с ионами металла» Биологические науки: научные доклады высшей школы №19 (334), 1991 г.]
С ионами металлов гумусовые кислоты взаимодействуют с помощью 2-х типов, функциональных групп - сильнокислыми и слабокислыми. Этими авторами экспериментально установлено, что с увеличением рН возникает комплексообразование с ионами многовалентных металлов в частности с железом Fe2+ и устойчивость этих комплексов усиливается, так как включаются функциональные группы с пониженными кислотными свойствами. Установлено так же, что при малых концентрациях многовалентных металлов образуются весьма устойчивые координационные узлы с участием наиболее сильных донорных центров макролигандов. По заключению других авторов гумосовые кислоты образуют внутрикомплексные хелатные соединения с железом [Дроздова Т.В., Емельянова М.П., «Внутрикомплексные соединения с гуминовыми кислотами» ДАН СССР, 1960 Т132, №3] [Дьякова К.В. «Железогумосовые компоненты и их роль в питании ростений» Почвоведение. 1962 г. №7]. В железогумосовых хелатных соединениях катионы железа не только замещают ион водорода карбоксильных и фенолгидроксильных групп гуминовых кислот, но и образуют связи с азотосодержащими функциональными группами гумосовых кислот [Левашкевич Г.А. «Взаимодействие гумусовых кислот с гидроокисями железа и алюминия» Почвоведение. 1966. №4].
В другом источнике указывается, что при взаимодействии гумусовых кислот с многовалентными металлами, например, с Fe2+ образуются хелатные внутрикомплексные циклические соединения металла, в которых центральный атом входит в один или несколько циклов. Например, в замкнутых пяти или шестичленных циклах, включающих ион металла, донорный атом и гидроксильный кислород карбоксигруппы образуют, например, замкнутый пятичленный цикл с гумусовыми кислотами хелатного соединения металла, представленный ниже.
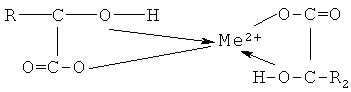
«Карбоновые кислоты и карбоксилатные комплексы в химическом анализе» Л. 1991
Из изложенных сведений о взаимодействии гумусовых веществ с ионами многовалентных металлов можно сделать вывод о том, что в минеральных водах, имеющих близкую к нейтральной реакцию среды и имеющих в своем составе гумусовые вещества, среди которых доминирующее положение занимают гумусовые кислоты, и ионы двухвалентного железа, как представляется, прочно связанные хелатными комплексами с супер молекулами гумусовых веществ. При контактировании минеральной воды, содержащей эти крупные комплексы железа, с углем на его активной поверхности сорбируются не мелкие ионы железа, а его крупные комплексные соединения с гумусовыми веществами.
На фигуре 1 представлен один из вариантов структурной формулы гумусовой кислоты составленный ее автором Комисаровым И.Д., где под индексом А обозначено возможное положение комплексного хелатного узла иона железа в молекуле гумисовой кислоты. Не исключено наличие нескольких таких комплексных хелатных узлов железа в молекулах гумусовых веществ. В производственных экспериментах мы использовали две марки кокосовых активных угольных сорбентов «Silcarbon K-814», а в пилотной установке и позже в промышленной установке гранулированный кокосовый уголь Carbon DK 12*40. В лабораторных исследованиях в статических условиях был использован гранулированный березовый активный уголь БАУ-А.
В угольных сорбентах различают макро-, мезо- и микропоры, их размер «X» составляет:
1) размер микропор 0.6-0.7 нм (нм=1*10-9 м),
2) супермикропоры 0.6-0.7<Х<1,5-1,6 нм,
3) мезопоры 1.5-1.6<Х<100-200 нм,
4) макропоры х>100-200 нм.
Удельный объем и площадь пор активных углей составляют следующие величины.
В микропорах удельный объем пор составляет от 0.2-0.6 см3/г а удельная площадь 800-1000 м2/г.
В супермикропорах - 0.15-0.2 см3/г.
В мезопорах - 0.7 см3/г, а площадь 200-450 м3/г.
В макропорах, служащих транспортным каналом для сорбируемых молекул, их объем составляет - 0.2-0.8 см3/г.
В зависимости от своего размера сорбируемые молекулы заполняют микро и супермикропоры, а мезопоры заполняют более крупные молекулы послойно и заполнение завершается по механизму капиллярной конденсации.
В нашем случае сорбируемые молекулы гумусовых кислот с хелатными комплексами железа имеют крупные размеры и, как представляется, должны сорбироваться в мезопорах и частично в субмикропорах.
Рассмотрим механизм сорбирования молекул гумусовых веществ, содержащих хелатный комплекс железа, на активном угольном сорбенте.
Как показано выше, активный уголь имеет чрезвычайно большую удельную поверхность - до 1000 м2 в/г кокосового угля. Лежащие на этой поверхности атомы углерода имеют связи, направленные вглубь, которые скомпенсированы связями соседних молекул, и имеют связи, направленные от поверхности и эти связи ничем не скомпенсированы. Такие нескомпенсированные связи образуют свободную энергию поверхности, представляющую собой межмолекулярные силы притяжения, названные ван-дер-ваальсовыми по имени открывшего их голландского физика Ян Дидерик Ван-дер-Ваальса (1837-1923). Эти силы действуют на очень коротком расстоянии составляющим 500 пм (10-12 м), а начинают действовать на расстоянии меньше 1000 пм. За счет этих сил происходит сорбция молекул поверхностью сорбента при приближении сорбируемых молекул к поверхности угля на расстоянии действия ван-дер-ваальсовых сил. При приближении молекул к поверхности угля на расстоянии 400пм возникает взаимопроникновение внешних электронных оболочек молекул и сила притяжения уравновешивается силой отталкивания этих электронов.
По свидетельству Л. Полинга и П. Полинга «как правило электронное ван-дер-ваальсово притяжение между молекулами возрастает с увеличением числа электронов в молекуле, поскольку молекулярная масса примерно пропорциональна числу электронов в молекуле и обычно вдвое превышает число электронов, ван-дер-ваальсово притяжение, как правило, возрастает с увеличением молекулярной массы» [Лаймус Полинг, Питер Полинг. Химия. Перевод с английского В. Сахарова под редакцией доцента Карапитяна М.М. «Мир», 1978, стр.246 ]. В этом свете крупные молекулы гумусовых веществ, в которых ион Fe2+ прочно связан хелатным комплексом со структурой молекулы, эффективно притягивются ван-дер-ваальсовыми силами к поверхности и прочно удерживаются на ней. Это показали производственные испытания в цехе кисловодского завода «Нарзан», когда при периодический промывке угольной колонны обратным током пресной воды после пропускания через колонну минеральной воды в объеме ~ 100 м3 через 0,45 м3 окосового угля, в промывной воде практически были обнаружены лишь следы отмываемых ионов железа (менее 0.3-0.5 мг/дм3).
На основании описанного мы считаем, что обезжелезивание минеральной воды «Нарзан» способом обработки ее угольным сорбентом происходит с помощью гумусовых веществ, содержащихся в минеральной воде в количестве 2.4-2.6 мг/дм3. Среди углекислых подземных минеральных вод практически отсутствуют воды, не имеющие в своем составе природных гумусовых веществ. Их концентрация в углекислых минеральных водах колеблется от 1-1,5 мг/дм3 до 3-3,5 мг/дм3.
Следовательно, предлагаемый способ обезжелезивания может быть использован и для других минеральных вод, содержащих гумусовых веществ не менее 1-1,5 мг/дм3.
В предлагаемой формуле изобретения в качестве существенных отличительных признаков первого независимого пункта мы включили два признака: «обезжелезивание осуществляют только одной операцией -обработкой минеральных вод гранулированными угольными сорбентами, в присутствии природных гумусовых кислот в концентрации не менее 1 мг/дм3 до остаточного содержания Fe2+ не более 0,3 мг/ дм3.
При таком остаточном содержании двухвалентного железа не наблюдается ухудшения товарного вида бутылочных минеральных вод при их хранении. Что касается других признаков, то мы их квалифицировали как несущественные признаки и отнесли их в зависимые пункты 2, 3 и 4, так как они не влияют непосредственно на получаемый технический результат, а облегчают его достижение. Например, по п.2, расход минеральной воды, подаваемой на фильтр, определяется рабочими параметрами используемого колонного угольного фильтра. По п.3 способ отличается тем, что для обезжелезивания, применяют кокосовый гранулированный уголь, используемый для осветления растворов, в котором превалируют более крупные мезопоры размером 1,6÷100 нм объемом 0,7 см3/г и удельной площадью 200-450 м2/г. В таких порах теоретически способны сорбироваться гигантские молекулы гумусовых кислот с хелатными комплексами железа. На такой площади больше разместится этих сорбируемых крупных молекул гумосовых кислот с закомплексованными в них ионами Fe2+. В результате увеличится емкость сорбента по отношению к удаляемому железу. Это очевидно приведет к снижению частоты регенераций сорбента. Согласно п.4. время контакта минеральных вод с угольным сорбентом должно быть не менее семи минут для достижения требуемой степени очистки минеральных вод от ионов Fe2+.
Практическое осуществление предлагаемого способа обезжелезивания минеральных углекислых питьевых вод путем их обработки, активированным угольным сорбентом описано ниже.
Исследования проводились на минеральной воде, поступавшей по минералопроводу из резервной скважины №107-Д Северного участка Кисловодского месторождения. Первая серия экспериментов проведена в лабораторных условиях. В этих экспериментах, выполненных в статических условиях, изучалась зависимость степени обезжелезивания минеральной воды от соотношения количества угольного сорбента, вводимого в одинаковые объемы (1 дм3) минеральной воды в условиях исключающих окисление двухвалентного железа кислородом воздуха.
В этих лабораторных исследованиях был использован березовый гранулированный активный уголь марки БАУ-А. Этот уголь для экспериментов был измельчен и просеян через сито с отверстиями 0,1 мм. Ниже в таблице 1 представлены полученные результаты.
Вторая серия исследований выполнена в цехе кисловодского завода ОАО «Нарзан». Здесь в динамических условиях на пилотной установке «Угольный фильтр AKF 30/31 SM», содержавшего 0,45 м3 кокосового гранулированного активного угля марки «Silcarbon К-814», были проведены опытно-промышленные исследования по обезжелезиванию минеральной воды «Нарзан».
Пример 1. Лабораторные исследования по обезжелезиванию минеральной воды «Нарзан», разливаемой в бутылки.
Для этого были подготовлены пластмассовые бутылки емкостью 1,8 дм3 с риской на объем 1 дм3. Исследования выполнялись в условиях, исключающих окисление железа кислородом воздуха, т.к. остаточное железо в минеральной воде, обработанной навесками активного угля, определялось в двухвалентной форме. Железо определяли в минеральной воде колориметрически по интенсивности окраски его розового комплекса с реагентом 2,2-дипиридилом против дистиллированной воды в стеклянной кювете с толщиной слоя раствора 10 мм на колориметре КФК-3 на длине волны 520 нм (зеленый светофильтр).
Перед исследованиями подготовленные пронумерованные бутылки были промыты углекислым газом для удаления кислорода и в них количественно были перенесены отвешенные навески измельченного активного березового угля массой от 50 г до 1 мг и две бутылки без угля для определения в них исходного содержания железа. После этого бутылки были помещены в углекислую атмосферу, заполнены минеральной водой из минералопровода до метки 1 дм3 и плотно закрыты пробкой. Для установления равновесия железа между водой и углем бутылки периодически встряхивали и оставили на ночь. Через сутки отстоявшуюся минеральную воду отфильтровывали в стеклянную кювету емкостью 20 см3, добавляли 0,3 см3 0,3% раствора 2,2-дипиридила, закрывали стеклянной крышкой, перемешивали и выдерживали 15 минут для развития окраски. После этого смесь переносили в измерительную кювету с толщиной слоя жидкости 10 мм, закрывали стеклянной крышкой и измеряли экстинкцию в колориметре КФК-3 при длине волны 520 нм. Величину экстинкции пересчитывали по калиброванной кривой в мг/дм3 остаточного железа.
Полученные данные сведены в представленной таблице 1.
Из таблицы видно, что с увеличением массы активного угля, введенного в минеральную воду, содержание железа в ней постепенно снижается и при массе угля 10 г/дм3 остаточное содержание двухвалентного железа уменьшается с 2,2 мг/дм3 в исходной воде до 0,25 мг/дм3. Такая величина остаточного содержания железа приемлема для технологии обезжелезивания минеральных вод, т.к. не приводит к образованию бурых ржавых налетов на стенках бутылок, ухудшающих их товарный вид.
Расчетную концентрацию железа, сорбированного навесками веденного угля после его взаимодействия с водой можно принять с доверительной вероятностью в пределах 1,2-1,5%, т.е. в количестве 12-15 кг в 1 т угольного сорбента. Это ориентировочно определяет момент наступления замены угля в угольном фильтре или его регенерации по разработанной в будущем технологии.
Пример 2. Определение в лабораторных условиях скорости сорбции железа из минеральной воды навеской активированного березового угля.
Для проведения этих исследований было подготовлено шесть пластмассовых бутылок с пробками объемом 1,8 дм3 с риской на 1 дм3. Все бутылки были промыты углекислым газом для удаления кислорода и пронумерованы. В бутылки с №2 по №6 были количественно введены навески измельченного активного березового угля, просеянного через сито с отверстиями 0,1 мм, массой 40,00 г.
В бутылке №1 навеска отсутствовала.
Затем в атмосфере углекислого газа бутылки поочередно заполнялись минеральной водой до риски (1 дм3), включался секундомер, бутылка с навеской взбалтывалась и после прохождения заданного времени из бутылки отфильтровывали часть смеси и определяли в фильтрате колориметрически содержание железа по описанному выше методу. Данные этих определений и время контактирования навесок угля с минеральной водой представлены ниже в таблице 2.
Из таблицы видно, что процесс сорбции железа на угле происходит довольно быстро и уже через 7 минут концентрация железа снижается до 0,28 мг/дм3, что приемлемо для технологии обезжелезивания.
Пример 3. Опытно-промышленные исследования обезжелезивания минеральной воды «Нарзан» в динамических условиях в цехе завода ОАО «Нарзан» на пилотной установке.
Пилотная установка, фотография которой в цехе завода представлена на фиг.2, состоит из угольного фильтра марки AKF 30/31 SM, содержащего 0,45 м3 гранулированного кокосового уголя марки «Silcarbon K-814», и системы управления им.
Паспортные данные этого фильтра включают:
- номинальная производительность по жидкости составляет 6,7 м3/час;
- линейная скорость фильтрации 15 м/час;
- высота 2280 мм;
- диаметр 770 мм;
- объем активного гранулированного кокосового угля 450 дм3;
- масса гравия для поддерживающего слоя 100 кг;
- подача воды на обратную взрыхляющую промывку 9,5 м3/час;
- рекомендуемая продолжительность обратной промывки - 10 мин (1,6 м3).
Эта пилотная установка была подключена к минералопроводу от скважины 107-Д. Для выяснения влияния на обезжелезивание изменения производительности фильтра были заданы три режима производительности: Q1=7 м3/час, Q2=10,5 м3/час и Q3=12,5 м3/час, т.е. при превышении его паспортной производительности в 10,5 м3/час: 6,7 м3/час = 1,57 раз и при превышении паспортной производительности в 12,5 м3/час: 6,7 м3/час = 1,87 раз. В процессе работы этой пилотной установки проводился систематический контроль остаточного содержания железа в минеральной воде на выходе из установки. Определение железа 2 проводилось по описанной выше колориметрической методике.
Результаты производственных испытаний проведенных при трех величинах производительности представлены в форме колебаний остаточного содержания железа в минеральной воде на выходе из установки (см. фиг.2, 3).
На кривой «А» представлена кривая колебания остаточного содержания железа в обработанной воде в концентрации менее 0,2 мг/дм3 почти за 12 часов беспрерывной работы при производительности 7 м3/час.
На кривой «В» представлено колебание остаточного содержания Fe2+ в минеральной воде, обработанной углем при производительности 10,5 м3/час, т.е. в 1,6 раза больше паспортной производительности пилотной установки. По кривой видно, что в течении 5 часов остаточное содержание железа было близко к допустимой величине 0,3 мг/дм3. Однако затем произошел всплеск содержания железа до 0,35 мг/дм3. Произведенная промывка угля обратным током пресной воды (снизу вверх) позволила устранить проскок железа и снизить его содержание на выходе до 0,05 мг/дм3. Следует отметить, что в промывочной воде не отмечен всплеск содержания железа более 0,3 мг/дм3. Это говорит о том, что сорбировавшееся на угле железо довольно прочно удерживается им и при промывке угля не вымывается из него.
На кривой «С» показано колебание остаточного содержания железа в минеральной воде на ее выходе из пилотной установки при производительности возросшей до 12,5 м3/час минеральной воды. При такой производительности превышавшей паспортную производительность пилотной установки в 1,9 раза, эффект проскока железа до 0,6 мг/дм3 произошел через 3,7 часа работы установки. Проведенная промывка угля пресной водой позволила резко снизить остаточное содержание железа в фильтре почти до нуля. Однако и в этом случае в промывных водах не было отмечено содержание железа в концентрации превышавшей 0,3 мг/дм3.
После опытов, описанных выше, в цехе завода «Нарзан» был введен в эксплуатацию промышленный угольный колонный фильтр, объемом 4 м3, в котором был использован гранулированный активный кокосовый уголь марки «Carbon Tech DK 12×40». Было установлено, что подача минеральной воды, не превышавшей параметр этого фильтра, позволила получать минеральную воду с допустимым остаточным содержанием железа (не более 0,3 мг/дм3).
Таким образом, можно сделать вывод о том, что сорбированное железо прочно удерживается углем и не вымывается из него даже интенсивным обратным током пресной воды.
Кроме того, как показали производственные испытания, производительность угольного фильтра по минеральной воде не должна быть выше его паспортной производительности.
Так, при проведении прокачки через пилотную установку минеральной воды с производительностью не более 7 м3/час (ее паспортная производительность) в объеме до 40000 м3 в период с 26.04.2011 г. по 12.07.2011 г. (в течении ~3-х месяцев), не было зафиксировано проскока железа на выходе из фильтра в концентрации более 0,2 мг/л.
При этом не требовалось проведения операции промывки фильтра обратным током пресной воды.
Достоинством предлагаемого способа обезжелезивания является простота проведения операции обезжелезивания и не осложняется необходимостью удаления из минеральной воды осадка окисленного железа, как это происходит в описанных известных способах.
Единственной проблемой при промышленном освоении этого способа является необходимость создания эффективного способа непрерывного контроля остаточного железа в фильтрате и устройства автоматического управления процессом обезжелезивания.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБЕЗЖЕЛЕЗИВАНИЯ МИНЕРАЛЬНЫХ ПИТЬЕВЫХ ВОД | 2003 |
|
RU2240983C1 |
| СПОСОБ ОЧИСТКИ ВОДЫ ОТ ГУМУСОВЫХ ВЕЩЕСТВ И ЖЕЛЕЗА | 1998 |
|
RU2158231C2 |
| СПОСОБ ОЧИСТКИ СТОЧНЫХ И ПРИРОДНЫХ ВОД ОТ ИОНОВ СУЛЬФАТНОГО ДВУХВАЛЕНТНОГО ЖЕЛЕЗА | 2006 |
|
RU2329955C2 |
| СПОСОБ ОЧИСТКИ ПОДЗЕМНЫХ ВОД ОТ ЖЕЛЕЗА, МАРГАНЦА И СОЛЕЙ ЖЕСТКОСТИ | 2005 |
|
RU2285669C1 |
| СПОСОБ ОЧИСТКИ ПРИРОДНЫХ И СТОЧНЫХ ВОД И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2003 |
|
RU2337070C2 |
| Способ получения бромидных солей при комплексной переработке бромоносных поликомпонентных промысловых рассолов нефтегазодобывающих предприятий (варианты) | 2021 |
|
RU2780216C2 |
| СПОСОБ ОЧИСТКИ ПРИРОДНЫХ ВОД ОТ ЖЕЛЕЗА | 1999 |
|
RU2179956C2 |
| СПОСОБ ОЧИСТКИ ПОДЗЕМНЫХ ВОД ДЛЯ СЕЛЬСКОХОЗЯЙСТВЕННОГО ИСПОЛЬЗОВАНИЯ | 2019 |
|
RU2717522C1 |
| КАТАЛИТИЧЕСКИЙ СОРБЕНТ ДЛЯ ОЧИСТКИ ВОДНЫХ СРЕД | 2016 |
|
RU2617492C1 |
| Способ комплексной сорбционной очистки сточных вод | 2022 |
|
RU2784984C1 |



Изобретение относится к способу удаления двухвалентного железа из питьевых, преимущественно углекислых минеральных вод. Способ обезжелезивания минеральных питьевых вод, разливаемых в бутылки включает предочистку минеральных вод от взвешенных примесей, при этом обезжелезивание осуществляют только одной операцией - обработкой минеральных вод активными гранулированными угольными, сорбентами в присутствии природных гумусовых кислот в концентрации не менее 1 мг/дм3. Этот способ позволяет снизить содержание двухвалентного железа до величины 0,3 мг/дм3, так как установлено, что такая остаточная концентрация железа не ухудшает товарного вида бутылочных вод при их хранении. 3 з.п. ф-лы, 2 табл., 3 ил.
1. Способ обезжелезивания минеральных питьевых вод, разливаемых в бутылки, включающий предочистку минеральных вод от взвешенных примесей, отличающийся тем, что обезжелезивание осуществляют только одной операцией - обработкой минеральных вод активными гранулированными угольными сорбентами в присутствии природных гумусовых кислот в концентрации не менее 1 мг/дм3.
2. Способ по п.1, отличающийся тем, что расход минеральной воды, подаваемой на фильтр, определяется рабочими параметрами используемого колонного угольного фильтра.
3. Способ по п.2, отличающийся тем, что для обезжелезивания применяют кокосовый гранулированный уголь, предназначенный для осветления, который имеет объем мезопор 0,7 см3 и удельную площадь 200-450 м2/г, который увеличивает сорбционную емкость по железу.
4. Способ по п.1, отличающийся тем, что время контакта минеральной воды с угольным сорбентом составляет не менее семи минут.
| СПОСОБ ОБЕЗЖЕЛЕЗИВАНИЯ МИНЕРАЛЬНЫХ ПИТЬЕВЫХ ВОД | 2003 |
|
RU2240983C1 |
| Смирнов А.Д | |||
| Сорбционная очистка воды | |||
| - Л.: Химия, 1982, с.42 | |||
| МАЛОГАБАРИТНЫЙ ГАРАЖ | 1995 |
|
RU2057237C1 |
| СПОСОБ ПРОИЗВОДСТВА КИСЛОМОЛОЧНОГО НАПИТКА ИЗ ВЕРБЛЮЖЬЕГО МОЛОКА | 2009 |
|
RU2409963C1 |
Авторы
Даты
2014-01-10—Публикация
2012-01-19—Подача