Изобретение относится к области ветеринарной вирусологии и биотехнологии и касается получения и применения вакцины для профилактики респираторных заболеваний крупного рогатого скота (КРС) и особенно у новорожденных телят.
Заболевания органов дыхания у телят имеют широкое распространение и наносят значительный ущерб животноводству. По широте распространения, смертности, вынужденному убою и недополучению привесов они превалируют над всеми прочими заболеваниями. По данным многих исследователей до 80-100% телят в послеотъемный период подвержены респираторным заболеваниям (1, 2, 3).
Как правило, респираторные заболевания молодняка КРС протекают по типу смешанных инфекций. В патогенезе респираторной инфекции новорожденных телят основная роль принадлежит ассоциации возбудителей, таких как вирус парагриппа-3 (ПГ-3), инфекционного ринотрахеита (ИРТ) и вирусной диареи (ВД).
Известно, что вирусы ПГ-3, ИРТ и ВД КРС относятся к возбудителям, которые оказывают прямое воздействие на респираторный тракт животного. При этом они имеют общие «клетки-мишени», в которых размножаются.
Чрезвычайно широкое распространение, тенденция вызывать длительную персистенцию, относительная устойчивость к воздействию разнообразных факторов обусловливают энзоотическое течение данных заболеваний в хозяйствах с неблагополучными условиями содержания и кормления.
Смешанные вирусные инфекции или осложненные вторичной бактериальной микрофлорой особенно тяжело протекают и представляют серьезную проблему в плане их диагностики, лечения и профилактики.
Вакцинация животных против указанных инфекционных болезней имеет основное значение в системе профилактики эпизоотии.
В арсенале биологической промышленности во всем мире имеется большое количество препаратов, предназначенных для специфической профилактики вирусных и смешанных инфекционных респираторных заболеваний КРС и телят. При определенных условиях применения все вакцины эффективны, но отличаются по дозировке, видовому антигенному составу, сочетанию биотипов, методу инактивации вируса, используемому адъюванту и типу культуры клеток.
Однако применение известных в настоящее время препаратов не всегда сопровождается положительным эффектом из-за низкой иммуногенной активности и наличия антигенных и иммунобиологических отличий между вакцинными штаммами вирусов, входящих в состав вакцин, и эпизоотическими штаммами возбудителей, циркулирующих на территории России и стран СНГ.
Стратегия борьбы с перечисленными заболеваниями КРС во многих странах, в том числе и в России, основывается прежде всего на применении вакцин живых или инактивированных как в виде моно-, так и ассоциированных препаратов (1, 2, 3).
В настоящее время живые вакцины широко испытаны с хорошими результатами, однако они имеют ряд недостатков. Иммунная реакция у животных при их введении не всегда стабильна и в ряде случаев вызывает осложнения после вакцинации: вакцина может вызвать повышенную реактогенность, иммуносупрессию, а иногда и гибель до 2% животных при вакцинации в зависимости от условий содержания и наличия коинфекций, проблемы воспроизводства, длительную персистенцию и выделение вакцинного вируса во внешнюю среду. Кроме того, применение живых вакцин, содержащих неинактивированные антигены вирусов ИРТ и ВД КРС, категорически противопоказано для стельных коров и новорожденных телят из-за возможности гомологичной рекомбинации вакцинного и полевого штаммов вируса, ведущей к обострению инфекции, абортам и гибели отдельных животных.
Для специфической профилактики указанных заболеваний широко используют инактивированные вакцины как сорбированные, так и эмульсионные.
Известна ассоциированная вакцина против вирусной диареи - болезни слизистых (ВД-БС), рота- и коронавирусной инфекций и эшерихиоза КРС эмульсионная инактивированная, содержащая в качестве активного вещества смесь авирулентных очищенных антигенных материалов из штамма VDV-Oregon-C24 V (САРМ V -293) вируса ВД-БС КРС, из штамма ТМ-91 (САРМ V-279) ротавируса КРС, из штамма BCV-9 (САРМ V-280) коронавируса КРС и из штаммов 3935/1 (САРМ 6233), 4804 (САРМ 6234) и 6304 (САРМ 6235) бактерий Е. coli, полученных в чувствительных биологических системах, и в качестве целевой добавки масляный адъювант в эффективных соотношениях (4).
Известна ассоциированная вакцина против ИРТ, рота- и коронавирусной инфекций и эшерихиоза КРС эмульсионная инактивированная, содержащая в качестве активного вещества смесь авирулентных очищенных антигенных материалов из штамма IBR-BK-5-РТОВ-8 INRV №3760 вируса ИРТ КРС, из штамма ТМ-91 (САРМ V-279) ротавируса КРС, из штамма BCV-9 (САРМ V-280) коронавируса КРС и из штаммов 3935/1 (САРМ 6234) и 6304 (САРМ 6235) бактерий Е. coli, полученных в чувствительных биологических системах, и в качестве целевой добавки масляный адъювант в эффективных соотношениях (5).
Известна ассоциированная вакцина против ПГ-3, рота- и коронавирусной инфекций и эшерихиоза КРС эмульсионная инактивированная, содержащая в качестве активного вещества смесь авирулентных очищенных антигенных материалов из штамма PI-3/T1/11 V-30 вируса ПГ-3 КРС, из штамма ТМ-91 (САРМ V-279) ротавируса КРС, из штамма BCV-9 (САРМ V-280) коронавируса КРС и из штаммов 3935/1 (САРМ 6233), 4808 (САРМ 6234) и 6304 (САРМ 6235) бактерий Е. coli, полученных в чувствительных биологических системах, и в качестве целевой добавки масляный адъювант в эффективных соотношениях (6).
Известна ассоциированная вакцина против ИРТ, ПГ-3, вирусной диареи, респираторно-синцитиальной инфекции, рота- и коронавирусных заболеваний телят «КОМБОВАК» сорбированная инактивированная, содержащая в качестве активного вещества смесь авирулентных очищенных антигенных материалов из 6 производственных штаммов вирусов: ИРТ, ПГ-3, ВД-БС, респираторно-синцитиальной инфекции, рота- и коронавирусных заболеваний КРС, полученных в чувствительных биологических системах, и в качестве целевой добавки адъювант-сорбент ГОА в эффективных соотношениях (7).
Известна ассоциированная вакцина против вирусных пневмогастроэнтеритов КРС и телят сорбированная инактивированная, содержащая в качестве активного вещества смесь авирулентных очищенных антигенных материалов из штаммов В-25 и ТК-А вируса ИРТ КРС, из штаммов ВД-N и ВД-R вируса ВД-БС КРС, из штаммов В-19 и ПТК-45/86 вируса ПГ-3 КРС, из штаммов К-88 и РП-82 ротавируса КРС, из штаммов КВ-90 и К-22 коронавируса КРС и из штаммов РС-89 и РС-71 возбудителя респираторно-синцитиальной инфекции КРС, полученных в чувствительных биологических системах, и в качестве целевой добавки адъювант-сорбент ГОА в эффективных соотношениях (8).
Наиболее близким аналогом является вакцина «ТРИВАК (ВИЭВ)» для профилактики ИРТ, ПГ-3 и вирусной диареи - болезни слизистых (ВД-БС) КРС, содержащая в качестве активного вещества смесь аттенуированных вирусов из штамма Herpes virus bovis «ТК-А(ВИЭВ)В-2» с активностью 4,5-6,5 lg ТЦД50/см3, штамма Virus diarrhea - mucosal disease bovinum «BK-1(B-1)N28» с активностью 4,0-6,0 lg ТЦД50/см3, штамма Paramyxovirus «ПТК-45/86» с активностью 5,0-7,0 lg ТЦД50/см3 (9).
Общим существенным недостатком известных ассоциированных вакцин, в том числе вакцины-прототипа, предназначенных для профилактики массовых инфекционных респираторных заболеваний КРС различных половозрастных групп, является их недостаточно высокая эффективность вследствие:
1) неполноценности (неполноты) антигенного состава входящих в них ингредиентов и сложных взаимодействий антигенов, из которых они изготовлены;
2) невысокий титр инфекционной активности входящих в состав вакцин вирусных суспензий, в результате чего в прививной дозе не обеспечивается необходимое количество протективных антигенов против указанных болезней;
3) вакцинные штаммы, входящие в состав препаратов, не обеспечивают формирование иммунитета по отношению к разным подтипам и основным антигенным вариантам эпизоотических штаммов возбудителей, циркулирующих в хозяйствах;
4) низкой иммуногенной активности препаратов. Причиной указанного недостатка может быть использование для инактивации вирусов формалина, вызывающего деструктивные изменения вирусных белков.
Задача, на решение которой направлено настоящее изобретение, заключается в получении ассоциированной вакцины против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной, создающей эффективную защиту восприимчивых животных различных половозрастных групп по отношению к разным подтипам и основным антигенным вариантам эпизоотических штаммов возбудителей, циркулирующих в хозяйствах на территории РФ.
Технический результат от использования предлагаемого изобретения заключается в расширении арсенала высокоиммуногенных, безвредных и ареактогенных ассоциированных вакцин эмульсионных инактивированных против инфекционных болезней КРС, сопровождающихся поражением органов дыхания, а также в повышении стабильности, антигенной и иммуногенной активности ассоциированной вакцины и создании напряженного и длительного иммунитета у привитых животных.
Указанный технический результат достигнут созданием вакцины ассоциированной против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной, охарактеризованной следующей совокупностью признаков.
Предлагаемая вакцина содержит в качестве активного вещества смесь авирулентных очищенных антигенных материалов из штамма «ВГНКИ-4» (авторское наименование) вируса ПГ-3 КРС, из штамма «ВНИИЗЖ» (авторское наименование) вируса ИРТ КРС и из штамма «NADL-ВНИИЗЖ» (авторское наименование) вируса ВД КРС, полученных в культурах клеток животного происхождения в количествах, обеспечивающих протективную иммунную активность в организме животного при введении ему целевого препарата, и в качестве целевой добавки масляный адъювант в эффективном соотношении. Предлагаемое изобретение включает следующую совокупность существенных признаков, обеспечивающих получение технического результата во всех случаях, на которые испрашивается правовая охрана:
1. Вакцина ассоциированная против ПГ-3, ИРТ и ВД КРС эмульсионная инактивированная.
2. Активное вещество в виде смеси авирулентных очищенных антигенных материалов из штамма «ВГНКИ-4» вируса ПГ-3 КРС, из штамма «ВНИИЗЖ» вируса ИРТ КРС и из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученных в культурах клеток животного происхождения в количествах, обеспечивающих протективную иммунную активность каждого антигена в организме животного при введении ему целевого препарата.
3. Целевые добавки.
Признаками изобретения, характеризующими предлагаемую вакцину и совпадающими с признаками прототипа, в том числе родовое понятие, отражающее назначение, являются:
1. Вакцина ассоциированная против ПГ-3, ИРТ и ВД КРС эмульсионная инактивированная.
2. Активное вещество.
3. Целевые добавки.
По сравнению с вакциной-прототипом существенные отличительные признаки предлагаемой вакцины заключаются в том, что в качестве активного вещества она содержит смесь авирулентных очищенных антигенных материалов из штамма «ВГНКИ-4» вируса ПГ-3, из штамма «ВНИИЗЖ» вируса ИРТ и из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, в эффективном количестве.
Предлагаемое изобретение характеризуется также другими отличительными признаками, выражающими конкретные формы выполнения или особые условия его использования:
1. Авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток млекопитающих, в эффективном количестве.
2. Авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток сирийского хомячка (ВНК-21), в эффективном количестве.
3. Авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток ВНК-21 с инфекционной активностью не менее 6,5 lg ТЦД50/см3 и гемагглютинирующей активностью не ниже 5,0 log2 до инактивации, в количестве 10,0 мас.%.
4. Авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток почки теленка (MDBK), в эффективном количестве.
5. Авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток MDBK с инфекционной активностью не менее 6,5 lg ТЦД50/см3 и гемагглютинирующей активностью не ниже 5,0 log2 до инактивации, в количестве 10,0 мас.%.
6. Авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток почки теленка (Таурус-2), в эффективном количестве.
7. Авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток Таурус-2 с инфекционной активностью не менее 6,5 lg ТЦД50/см3 и гемагглютинирующей активностью не ниже 5,0 log2 до инактивации, в количестве 10,0 мас.%.
8. Авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток млекопитающих, в эффективном количестве.
9. Авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток гонады козы (Ch-91), в эффективном количестве.
10. Авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток Ch-91 с инфекционной активностью не менее 6,0 lg ТЦД50/см3 до инактивации, в количестве 10,0 мас.%.
11. Авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток MDBK, в эффективном количестве.
12. Авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток MDBK с инфекционной активностью не менее 6,0 lg ТЦД50/см3 до инактивации, в количестве 10,0 мас.%.
13. Авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток почки теленка (RBT), в эффективном количестве.
14. Авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток RBT с инфекционной активностью не менее 6,0 lg ТЦД50/см3 до инактивации, в количестве 10,0 мас.%.
15. Авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток млекопитающих, в эффективном количестве.
16. Авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток Таурус-2, в эффективном количестве.
17. Авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток Таурус-2 с инфекционной активностью не менее 6,0 lg ТЦД50/см3 и активностью в ИФА не менее 6,65 log2 до инактивации, в количестве 10,0 мас.%.
18. Авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток RBT, в эффективном количестве.
19. Авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток RBT с инфекционной активностью не менее 6,0 lg ТЦД50/см3 и активностью в ИФА не менее 6,65 log2 до инактивации, в количестве 10,0 мас.%.
20. Авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток почки сайги (ПС), в эффективном количестве.
21. Авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток ПС с инфекционной активностью не менее 6,0 lg ТЦД50/см3 и активностью в ИФА не менее 6,65 log2 до инактивации, в количестве 10,0 мас.%.
22. Из целевых добавок масляный адъювант.
23. Масляный адъювант в количестве 69,6 мас.%.
24. Из целевых добавок дополнительно адъювант сапонин.
25. Сапонин в количестве 0,4 мас.%.
26. Авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3, из штамма «ВНИИЗЖ» вируса ИРТ и из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученных в перевиваемых культурах клеток млекопитающих, и целевые добавки масляный адъювант и сапонин в соотношении, мас.%:
В результате проведенных исследований авторами установлено, что между антигенами, входящими в состав предлагаемой вакцины, отсутствует конкуренция. Авторами обнаружено также явление синергизма при соединении указанных антигенов в предлагаемой вакцине, что позволило снизить их количественное содержание в препарате при сохранении такой же напряженности и длительности иммунитета у вакцинированных животных, как и при использовании для иммунизации соответствующих монопрепаратов.
Вирусный изолят, послуживший источником для получения производственного штамма «ВГНКИ-4» вируса ПГ-3 КРС, выделен из легких 2-3-месячных телят с респираторной патологией. Штамм «ВГНКИ-4» адаптирован к культуре клеток почек сирийского хомячка ВНК-21 и к культуре клеток теленка Таурус-1.
Штамм «ВГНКИ-4» вируса ПГ-3 КРС депонирован 09 сентября 1999 года во Всероссийскую государственную коллекцию штаммов микроорганизмов, используемых в ветеринарии и животноводстве, Всероссийского государственного научно-исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов (ВГНКИ) под регистрационным наименованием «ВГНКИ-4» ДЕП.
Штамм «ВГНКИ-4» вируса ПГ-3 КРС характеризуется следующими признаками и свойствами (10).
Морфологические признаки
Штамм «ВГНКИ-4» вируса ПГ-3 КРС относится к семейству Paramyxoviridae, роду Parainfluenza, подтипу Parainfluenza virus 3 и по своему строению является классическим парамиксовирусом. Внешне вирус почти сферический, но часто встречаются полиморфные формы. Размер сферических форм от 80 до 300 нм, но большинство вирионов в среднем от 130 до 140 нм.
Вирус ПГ-3 КРС штамма «ВГНКИ-4» имеет 7 структурных белков:
1. Фосфопротеиды (Р,. м.м. 83 кД).
2. ГА-нейраминидазный гликопротеин (HN, м.м. 69 кД).
3. Главный нуклеокапсидный протеин (NP, м.м. 66 кД).
4. Гликопротеин (F, м.м. 55 кД).
5. Матричный белок (М, м.м. 38 кД).
6. Белок L-полимераза (м.м. 180 кД).
7. Клеточный активный белок А (м.м. 43 кД).
В двухслойной содержащей липиды оболочке (толщина 10-И 5 нм) размещены 2 различные макромолекулы: гликопротеин гемагглютинин нейраминидаза (HN) и гликопротеин слияния (F). Оба выступают на 8 нм над оболочкой вириона с интервалом 7÷8 нм. Гемагглютинин осуществляет прикрепление вириона к рецепторам клетки-хозяина, содержащим нейраминовую (сиаловую) кислоту, а нейраминидаза разрушает рецепторы и тем самым помогает элюции вируса в процессе отпочковывания от клетки-хозяина. F-белок отвечает за проникновение вируса в клетку, осуществляя слияние с клеточной мембраной и неся ответственность за гемолиз, который происходит за счет точечного гидролиза молекулы неактивного предшественника F0. Известна зависимость между структурой гликопротеидов и патогенностью вируса. У патогенных штаммов оба поверхностных гликопротеида в клетках ВНК-21 включаются в вирионы только в расщепленной форме. У апатогенных штаммов гликопротеид F включается в вирионы в виде предшественника F0. Вирусы с нерасщепленными гликопротеидами обладают очень низкой биологической активностью, однако, если их обрабатывать трипсином, они проявляют полную биологическую активность. Белок F ответственен за гемолитическую активность и вирусиндуцируемый кариоцитоз. Посттрансляционное расщепление белка предшественника F0 на F1 и F2 осуществляется клеточными ферментами.
Антигенные свойства
Штамм «ВГНКИ-4» вируса ПГ-3 КРС агглютинирует эритроциты морской свинки, кролика, свиньи, коровы, мыши, овцы, козы, человека и белой мыши. Клетки, инфицированные вирусом ПГ-3 КРС из штамма «ВГНКИ-4», сорбируют эритроциты морской свинки, КРС, овцы, кролика и белой мыши. При вакцинации вирус индуцирует образование специфических антител на 8÷14 сутки после ревакцинации, антитела достигают пика к 16÷28 дню и сохраняются до одного года. Продолжительность и напряженность поствакцинального иммунитета обеспечивается преимущественно IgG и секреторными IgA, выработка которых стимулируется активным вакцинальным процессом. Привитые телята с титром гуморальных антител от 6,0 до 10,3 log2 устойчивы к заражению вирусом ПГ-3 КРС. Полевые изоляты вируса ПГ-3 КРС имеют близкое антигенное родство с вирусом ПГ-3 КРС штамма «ВГНКИ-4».
Генотаксономическая характеристика
Парамиксовирусы обычно состоят из одной молекулы однонитевой, линейной, спиральной РНК диаметром 15 нм, имеющей внутри полую сердцевину, модель которой напоминает колос. Молекулярный вес ее приблизительно 4,5×106, что составляет примерно 5% веса вирусной частицы. Она содержит генетическую информацию для 6 структурных протеинов. Нуклеотидное секвенировние генома вируса ПГ-3 КРС показало, что он состоит из 15156 нуклеотидов.
Биотехнологические характеристики
Штамм «ВГНКИ-4» вируса ПГ-3 КРС предназначен для приготовления живых и инактивированных вакцин против ПГ-3 КРС. Вирус штамма «ВГНКИ-4» ПГ-3 КРС репродуцируется в культурах клеток ПЭК, ПТ, MDBK, Таурус-2 и ВНК-21 и накапливается в титрах от 6,5 до 8,5 lg ТЦД50/см3. Результаты адаптации вируса ПГ-3 КРС штамма «ВГНКИ-4» к культуре клеток ВНК-21 представлены в таблице 1. Штамм «ВГНКИ-4» является стабильным и безвредным.
Физические свойства
Плавучая плотность вирионов в градиенте сахарозы находится в диапазоне 1,197 г/см3, коэффициент седиментации вирионной РНК составляет 42S.
Устойчивость к внешним факторам
Вирус ПГ-3 КРС штамма «ВГНКИ-4» быстро разрушается под действием высокой температуры. Возбудитель чувствителен к хлороформу, эфиру, формалину и детергентам.
Дополнительные признаки и свойства
Антигенная активность - обладает антигенностью в составе инактивированной вакцины и препарата для гипериммунизации доноров диагностических и лечебных сывороток.
Реактогенность - реактогенными свойствами не обладает.
Стабильность - сохраняет исходные биологические (антигенные) свойства при пассировании в культуре клеток MDBK, ВНК-21, Таурус-2 в течение 10 серийных пассажей.
Патогенность - не патогенен для морских свинок, кроликов и белых мышей.
Вирулентность - выражена.
Контагиозность - выражена.
Онкогенность - отсутствует.
Свободен от контаминации бактериями, микоплазмами и посторонними вирусами.
Для получения антигенного материала из штамма «ВГНКИ-4» вируса ПГ-3 КРС в качестве чувствительной биологической системы используют преимущественно культуры клеток ВНК-21, или Таурус-2, или MDBK. Полученный вируссодержащий материал очищают от балластных примесей центрифугированием или любым другим известным методом.
Для инактивации вируса ПГ-3 используют аминоэтилэтиленимин (АЭЭИ), который добавляют в очищенную вируссодержащую суспензию до концентрации 0,10%. Инактивацию вируса проводят при температуре 36÷37°С в течение 24 часов при значении рН 7,6÷7,8 с периодическим перемешиванием суспензии (каждые 5÷6 часов по 3÷5 минут). По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную до 2÷8°С суспензию антигена добавляют 1М раствор тиосульфата натрия из расчета 10% к объему использованного АЭЭИ.
Для изготовления эмульсионной формы предлагаемой вакцины используют авирулентный очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3, полученного в культуре клеток ВНК-21, или Таурус-2, или MDBK с инфекционной активностью не менее 6,5 lg ТЦД50/см3 и гемагглютинирующей активностью не менее 5,0 log2 до инактивации, в количестве не менее 10,0 мас.%.
Вирусный изолят, послуживший источником для получения производственного штамма «ВНИИЗЖ» вируса ИРТ КРС, выделен из патологического материала телят, павших с явлениями ИРТ во время вспышки заболевания в СПК «Миневское» Нижегородской области в 1998 году. Вакцинный штамм «ВНИИЗЖ» вируса ИРТ КРС адаптирован к культурам клеток RBT, MDBK и Ch-91.
Штамм «ВНИИЗЖ» вируса ИРТ КРС депонирован 12 марта 2001 года во Всероссийскую государственную коллекцию штаммов микроорганизмов, используемых в ветеринарии и животноводстве, Государственного учреждения «Всероссийский государственный научно-исследовательский институт контроля, стандартизации и сертификации ветеринарных препаратов» (ВГНКИ) под регистрационным наименованием «ВНИИЗЖ-ДЕП».
Штамм «ВНИИЗЖ» вируса ИРТ КРС характеризуется следующими признаками и свойствами (11).
Морфологические свойства
Штамм «ВНИИЗЖ» вируса ИРТ КРС относится к семейству Herpesviridae, подсемейству Alphaherpesviridae, роду Varicellavirus, группе HPV-1, обладает морфологическими признаками, характерными для данного семейства.
Штамм «ВНИИЗЖ» включает линейную 2-цепочечную ДНК с молекулярной массой 92÷102 кД. Вирионы округлой формы, состоят из 4-х структурных компонентов: нуклеоида, капсида диаметром 120÷150 нм, окруженного содержащей липиды оболочкой, мембраны (тегумента) и наружной оболочки. Нуклеоид тороидальной формы содержит ДНК и окружен икосаэдрическим капсидом диаметром 100-5-110 нм, содержащим 162 частично полых капсомера. Капсид окружает ядро вириона, состоящее из ДНК, покрытой белком. Мембрана из глобулярного материала окружает капсид. В составе вириона определено до 32 белков с молекулярной массой до 200 кД.
Вирионы имеют сложную четырехуровневую (от центра к периферии) организацию: нуклеоид, капсид, суперкапсидную структуру и оболочку. Наружная оболочка вирионов имеет типичное строение и содержит многочисленные выступы (шипы) длиной около 8 нм. Вирусы формируют характерные внутриядерные включения. При прохождении через внутренний листок ядерной мембраны в эндоплазматический ретикулум вирионы покрываются дополнительной оболочкой, содержащей гликопротеины и липиды.
Антигенные свойства
По своим антигенным свойствам штамм «ВНИИЗЖ» вируса ИРТ КРС относится к группе 1 герпесвирусов КРС. Вирус стабильно нейтрализуется гомологичной антисывороткой. Вирус обладает гемагглютинирующей активностью (ГА-активностью), реагируя с антителами переболевших или иммунизированных животных в реакции непрямой гемагглютинации (РИГА). При вакцинации лабораторных и естественно-восприимчивых животных вирусный антиген индуцирует образование специфических антител, выявляемых в РИГА в разведении 1:16-5-1:256.
Генотаксономическая характеристика
Выделено и охарактеризовано 9 структурных белков вируса ИРТ штамма «ВНИИЗЖ»: VP 105, VP 90 (гемагглютинин), VP 74, VP 64, VP 54, VP 50, VP 47, VP 40 и VP 31. Гликопротеины g I, g III, g IV участвуют в формировании гуморального и клеточного иммунитета. Наиболее эффективным в этом отношении является g IV. По данным реакции нейтрализации наибольшей иммуногенностью обладают VP 90 и VP 74. Белок, маркированный как VP 8 с м.м. 96 кД, является одним из главных белков герпесвируса-1 КРС. Он участвует в модуляции экспрессии генов класса А, стимулирует пролиферацию Т-клеток и образование антител у телят как после заражения, так и после иммунизации животных очищенным белком. За индукцию вируснейтрализующих антител к герпесвирусу-1 КРС ответственны 4- оболочечные гликопротеины, главными из которых являются g 70 и g 97, расположенные в шипиках вириона. В структуре g IV вируса ИРТ идентифицированы 3 нейтрализующих домена. Домен 1 содержит 2 перекрывающих эпитопа, домен 2 - один эпитоп. Домен 1 имеет отношение к проникновению вируса в клетки-мишени.
Биотехнологические характеристики
Вирус ИРТ КРС штамма «ВНИИЗЖ» репродуцируется в культурах клеток MDBK, Ch-91 и RBT, вызывая цитопатическое действие (ЦПД), и в течение 48÷96 часов инкубирования накапливается в титрах от 6,0 до 8,0 lg ТЦД50/см3. Результаты адаптации вируса ИРТ КРС штамма «ВНИИЗЖ» к культурам клеток Ch-91 и RBT представлены в таблицах 2 и 3. Штамм «ВНИИЗЖ» является стабильным и сохраняет свои свойства на протяжении 10 пассажей (срок наблюдения).
Физические свойства
Плавучая плотность вирионов в градиенте CsCl составляет 1,27÷1,29 г/см3.
Устойчивость к внешним факторам
Штамм «ВНИИЗЖ» вируса ИРТ КРС устойчив к воздействию низких температур: при минус 60÷70°С вирус выживает 7÷9 месяцев, при 56°С вирус инактивируется через 20 минут, при 37°С - через 4÷10 суток, при 22°С - через 50 суток, при 4°С активность вируса снижается через 30÷40 суток лишь на 1,0 lg. Раствор формалина 1:500 инактивирует вирус через 24 часа. Ацетон, эфир, хлороформ и этиловый спирт инактивируют его немедленно. В кислой среде вирус быстро теряет свою активность, но длительно (до 9 месяцев) сохраняется при рН 6÷9 и в условиях 4°С. Лиофилизация почти не влияет на его активность, однако многократное замораживание и оттаивание снижают вирулентность и иммуногенность вируса. Дополнительные признаки и свойства
Антигенная активность - обладает антигенностью в составе инактивированной вакцины и препарата для гипериммунизации доноров диагностических и лечебных сывороток.
Реактогенность - реактогенными свойствами не обладает.
Стабильность - сохраняет исходные биологические (антигенные) свойства при пассировании в культуре клеток MDBK, Ch-91 и RBT в течение 10 серийных пассажей.
Патогенность - не патогенен для морских свинок, кроликов и белых мышей.
Вирулентность - выражена.
Контагиозность - выражена.
Онкогенность - отсутствует.
Свободен от контаминации бактериями, микоплазмами и посторонними вирусами.
Для получения антигенного материала из штамма «ВНИИЗЖ» вируса ИРТ КРС в качестве чувствительной биологической системы используют преимущественно монослойные культуры клеток MDBK, Ch-91 и RBT, выращенные в 1,5 дм3 матрасах или вращающихся сосудах объемом 3 дм3. Полученный вируссодержащий материал освобождают от клеточного детрита и других балластных примесей низкоскоростным центрифугированием или любым другим известным методом.
Для инактивации вируса ИРТ штамма «ВНИИЗЖ» используют АЭЭИ, который вносят в очищенную вируссодержащую суспензию до концентрации 0,10%. Инактивацию вируса проводят при температуре 36÷37°С в течение 24 часов при значении рН 7,6÷7,8 с периодическим перемешиванием суспензии (каждые 5÷6 часов по 3÷5 минут). По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную до 2÷8°С суспензию антигена добавляют 1М раствор тиосульфата натрия из расчета 10% к объему использованного АЭЭИ.
Для изготовления эмульсионной формы предлагаемой вакцины используют антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в культуре клеток Ch-91, или MDBK, или RBT с инфекционной активностью не менее 6,0 lg ТЦД50/см3 до инактивации, в количестве не менее 10,0 мас.%.
Источником для получения производственного штамма «NADL-ВНИИЗЖ» вируса ВД КРС послужил референсный штамм «NADL» вируса ВД КРС, полученный ФГУ «ВНИИЗЖ» 11.08.2004 г. из коллекции типовых культур АТСС (США).
Производственный штамм «NADL-ВНИИЗЖ» получен путем многократных последовательных пассажей на чувствительных биологических системах культивирования.
Штамм «NADL-ВНИИЗЖ» адаптирован к перевиваемой культуре клеток млекопитающих, выбранной из группы, содержащей монослойную перевиваемую культуру клеток почки сайги (ПС), монослойную перевиваемую культуру клеток почки теленка (Таурус-2) и монослойную перевиваемую культуру клеток почки теленка (RBT), имеет стабильные биологические свойства, которые позволяют использовать его в качестве производственной расплодки для получения антигенного материала для вакцины против ВД КРС эмульсионной инактивированной.
Штамм «NADL-ВНИИЗЖ» вируса ВД КРС депонирован 4 августа 2009 года во Всероссийскую государственную коллекцию штаммов микроорганизмов, используемых в ветеринарии и животноводстве Федерального государственного учреждения «Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов» (ФГУ «ВГНКИ») под регистрационным номером (ссылкой) - производственный штамм «NADL-ВНИИЗЖ» - ДЕП вируса диареи КРС (12).
По сравнению с исходным штаммом штамм «NADL-ВНИИЗЖ» имеет генетические и фенотипические особенности. В отличие от штамма «NADL» штамм «NADL-ВНИИЗЖ» репродуцируется в перевиваемых культурах клеток RBT, ПС и Таурус-2, обладает инфекционной, антигенной и иммуногенной активностью в нативном виде и сохраняет высокую антигенную и иммуногенную активность после инактивации.
Штамм «NADL-ВНИИЗЖ» вируса ВД КРС характеризуется следующими признаками и свойствами(12).
Морфологические признаки
Штамм «NADL-ВНИИЗЖ» вируса ВД КРС относится к семейству Flaviviridae, роду Pestivirus и обладает морфологическими признаками, характерными для возбудителя ВД КРС: сферический вирион диаметром 40÷60 нм состоит из нуклеокапсида икосаэдрической симметрии, содержащего позитивную одноцепочечную РНК.
Антигенные свойства
По своим антигенным свойствам штамм «NADL-ВНИИЗЖ» относится к первому генотипу.
Вирус стабильно нейтрализуется гомологичной антисывороткой.
Вирус реагирует с антителами переболевших или иммунизированных животных в реакции иммуноферментного анализа (ИФА) и реакции микронейтрализации (РМН). При вакцинации лабораторных и естественно-восприимчивых животных инактивированный вирус индуцирует образование вирусспецифических и вируснейтрализующих антител в организме морских свинок в титрах от 10,9 до 11,2 log2 в ИФА и 7,0 log2 в РМН, у кроликов - от 10,8 до 11,4 log2 (ИФА) и от 6,0 до 7,1 log2 (РМН), у телят и коров - от 10,2 до 10,7 log2 (ИФА) и от 7,6±0,40 до 7,3±0,31 log2 (РМН).
Генотаксономическая характеристика
Геном штамма «NADL-ВНИИЗЖ» вируса ВД КРС представлен позитивной одноцепочечной РНК размером около 12500 нуклеотидов с единственной открытой рамкой считывания. Открытая рамка считывания начинается с 386 нуклеотида. Вся информация о протеинах содержится в одной рамке считывания.
Выделено и охарактеризовано 10 протеинов: 4 структурных и 6 неструктурных. Одноцепочечная РНК связана с капсидным протеином р14/С, окруженным наружными гликопротеинами (др25/Е1, др53/Е2, др48/Е0), и липидной оболочкой.
Наружный гликопротеин gp53/E2 индуцирует в организме животных выработку вируснейтрализующих антител в высоких титрах. Протеин др48/Е0 способен индуцировать у инфицированных животных высокий уровень антител, но с низкой вируснейтрализирующей активностью. У инфицированных животных антитела к gp25/Е1 вырабатываются в низких титрах.
Методом ОТ-ПЦР был амплифицирован участок генома вируса диареи КРС, включающий 149 н.о. 5'-нетранслируемой области.
В результате проведенных исследований было установлено, что штамм «NADL-ВНИИЗЖ» вируса ВД КРС является близкородственным референтному штамму «NADL», от которого отличается на анализируемом участке одним нуклеотидом.
Такие единичные замены в структуре белка предположительно привели к существенным изменениям в антигенных свойствах вируса.
Биотехнологическая характеристика
Штамм «NADL-ВНИИЗЖ» вируса ВД КРС репродуцируется в перевиваемых культурах клеток почки теленка (MDBK, Таурус-2, ПТ, RBT), перевиваемой линии культуры клеток ПС, перевиваемой линии культуры клеток слизистой кишечника КРС (FBI) и внутривидовой гибридной перевиваемой линии культуры клеток почки эмбриона свиньи со спленоцидами свиньи (А4С2).
Результаты адаптации вируса ВД КРС штамма «NADL-ВНИИЗЖ» к культурам клеток Таурус-2, RBT и ПС представлены в таблицах 4, 5, 6. Штамм «NADL-ВНИИЗЖ» вируса ВД КРС является стабильным и сохраняет свои свойства на протяжении 10 пассажей (срок наблюдения).
Физические свойства
Плавучая плотность вирионов в градиенте сахарозы находится в диапазоне 1,12÷1,13 г/см3, коэффициент седиментации вирионной РНК составляет 138S.
Устойчивость к внешним факторам
Штамм «NADL-ВНИИЗЖ» вируса ВД КРС наиболее устойчив при рН 7,4. Вирус хорошо сохраняется в нативном виде при 4°С, минус 20°С и минус 40°С. Вирус чувствителен к эфиру, хлороформу, трипсину, кислому значению рН (3,0) и дезоксихалату натрия; при 37°С погибает через 5 дней.
Инактивированный вирус ВД КРС штамма «NADL-ВНИИЗЖ» устойчив при хранении при 4°С как в нативном состоянии, так и в составе инактивированной вакцины.
Лиофилизация почти не влияет на его активность, однако многократное замораживание и оттаивание снижают вирулентность и иммуногенность вируса.
Дополнительные признаки и свойства
Антигенная активность - обладает антигенностью в составе инактивированной вакцины и препарата для гипериммунизации доноров диагностических и лечебных сывороток.
Реактогенность - реактогенными свойствами не обладает.
Стабильность - сохраняет исходные биологические (антигенные) свойства при пассировании в культуре клеток Таурус-2, RBT, ПС в течение 10 серийных пассажей.
Патогенность - не патогенен для морских свинок, кроликов и белых мышей.
Вирулентность - выражена.
Контагиозность - выражена.
Онкогенность - отсутствует.
Свободен от контаминации бактериями, микоплазмами и посторонними вирусами.
Для получения антигенного материала из штамма «NADL-ВНИИЗЖ» вируса ВД КРС в качестве чувствительной биологической системы используют преимущественно монослойные культуры клеток Taypyc-2, RBT и ПС выращенные в 1,5 дм3 матрасах или вращающихся сосудах объемом 3 дм3. Полученный вируссодержащий материал освобождают от клеточного детрита и других балластных примесей низкоскоростным центрифугированием или любым другим известным методом.
Для инактивации вируса ВД штамма «NADL-ВНИИЗЖ» используют АЭЭИ, который вносят в очищенную вируссодержащую суспензию до концентрации 0,15%. Инактивацию вируса проводят при температуре 36÷37°С в течение 24 часов при значении рН 7,6÷7,8 с периодическим перемешиванием суспензии (каждые 5÷6 часов по 3÷5 минут). По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную до 2÷8°С суспензию антигена добавляют 1М раствор тиосульфата натрия из расчета 10% к объему использованного АЭЭИ.
Для изготовления эмульсионной формы предлагаемой вакцины используют антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в культуре клеток Таурус-2, или RBT, или ПС, с инфекционной активностью не менее 6,0 lg ТЦД50/см3 и активностью в ИФА не менее 6,65 log2 до инактивации, в количестве не менее 10,0 мас.%.
Сущность предлагаемого изобретения пояснена примерами его реализации и использования.
Пример 1
Для приготовления ассоциированной вакцины против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной используют производственные штаммы вирусов: штамм «ВГНКИ-4» вируса ПГ-3 КРС, штамм «ВНИИЗЖ» вируса ИРТ КРС и штамм «NADL-ВНИИЗЖ» вируса ВД КРС.
Технологический процесс состоит из следующих технологических этапов:
получения вирусных суспензий из штаммов вируса ПГ-3 КРС «ВГНКИ-4», вируса ИРТ КРС «ВНИИЗЖ» и вируса ВД КРС «NADL-ВНИИЗЖ»;
определения активности каждой вирусной суспензии;
инактивации вируссодержащих культуральных жидкостей каждого штамма отдельно;
объединения полученных инактивированных суспензий
вирусов;
добавления адъюванта;
смешивания всех компонентов вакцины с последующей расфасовкой готового продукта.
Стадия получения вирусных суспензий согласно изобретению основывается на системе посевных материалов (Seed lot system) - это система, при которой последовательные серии производственного штамма получают из главного посевного материала (Master seed) при определенном количестве пересевов (пассажей). В текущем производстве из главного посевного материала готовится производственный штамм посевного материала. Производственное сырье культурального вируса производится из рабочего посевного материала (Working seed) или его следующей генерации - рабочей расплодки. При этом число пересевов из главного посевного материала не должно превышать значений, установленных для каждого конкретного микроорганизма или биопрепарата, изготовленного на их основе.
Процесс получения системы посевных материалов каждого вируса включает несколько этапов:
- подбор кондиционных культур клеток;
- освежение главного посевного материала;
- сбор инфекционного материала;
контроль стерильности и биологической активности главного посевного материала;
- расфасовка и хранение главного посевного материла;
- приготовление рабочего посевного материала;
- сбор инфекционного материала;
- контроль стерильности и биологической активности рабочего посевного материала;
расфасовка и хранение рабочего посевного материала.
Посевной материал, используемый для изготовления вакцины, получают в перевиваемых культурах клеток.
Для изготовления вакцины ассоциированной против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной используют культуральный вирус ПГ-3 КРС, выращенный в роллерных сосудах, культуральный вирус ИРТ КРС, выращенный в 1,5 дм3 матрасах или в роллерных сосудах, и культуральный вирус ВД КРС, выращенный в 1,5 дм3 матрасах или в роллерных сосудах.
В составе вакцины должны содержаться:
1. Антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, репродуцированного в перевиваемой культуре клеток ВНК-21, или Таурус-2, или MDBK с инфекционной активностью не менее 6,5 lg ТЦД50/см3 и гемагглютинирующей активностью не ниже 5,0 log2, в количестве 10,0 мас.%.
2. Антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, репродуцированного в перевиваемой культуре клеток RBT, или Ch-91, или MDBK с ифекционной активностью не менее 6,0 lg ТЦД50/см3, в количестве 10,0 мас.%.
3. Антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, репродуцированного в перевиваемой культуре клеток Таурус-2, или RBT или ПС с инфекционной активностью не менее 6,0 lg ТЦД50/см3 и активностью в ИФА не ниже 6,65 Iog2, в количестве 10,0 мас.%.
4. Масляный адъювант в количестве 69,6 мас.%.
5. Сапонин в количестве 0,4 мас.%.
Содержимое матрасов, роллерных сосудов сливают в отдельные емкости и охлаждают при температуре 2÷8°С, освобождают от клеточного детрита известным способом, используя низкоскоростное центрифугирование. Освобожденная от детрита суспензия должна иметь вид прозрачной жидкости розового цвета. Затем из емкости отбирают пробу для производственного контроля вирусного сырья.
Производственная серия вируса ПГ-3 КРС должна иметь инфекционную активность не менее 6,5 lg ТЦД50/см3; гемагглютинирующую активность в РГА не ниже 5,0 log2.
Производственная серия вируса ИРТ КРС должна иметь инфекционную активность не менее 6,0 lg ТЦД50/см3.
Производственная серия вируса ВД КРС должна иметь инфекционную активность не менее 6,0 lg ТЦД50/см3; активность в ИФА не ниже 6,65 log2.
Инактивацию вирусного сырья осуществляют с помощью 6%-ного раствора АЭЭИ, вносимого в вирусную суспензию каждого вируса до конечной концентрации 0,10÷0,15 мас.%. Инактивацию проводят при температуре 37,0°С в течение 24 часов с периодическим перемешиванием (каждые 5÷6 часов по 3÷5 мин).
По окончании инактивации антигенный материал каждого вируса охлаждают до температуры 2÷8°С и отбирают пробы для определения рН, стерильности и полноты инактивации.
Для нейтрализации АЭЭИ в суспензию антигенного материала добавляют 1М раствор тиосульфата натрия из расчета 10% к объему использованного АЭЭИ.
Полученный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, штамма «ВНИИЗЖ» вируса ИРТ КРС и штамма «NADL-ВНИИЗЖ» вируса ВД КРС используют для изготовления эмульсионной формы вакцины против ПГ-3, ИРТ и ВД КРС.
Для этого антигенный материал тщательно эмульгируют с масляным адъювантом и сапонином в соотношении, мас.%: 10,0:10,0:10,0:69,6:0,4 соответственно.
Полученная вакцина представляет собой эмульсию белого или бело-розового цвета слегка вязкой консистенции. При хранении допускается незначительное отслоение минерального масла в верхней и уплотнение эмульсии в нижней части флакона. При тщательном взбалтывании эмульсия приобретает однородную структуру.
Вакцину контролируют на стерильность, стабильность, полноту инактивации (авирулентность), безвредность и антигенную активность, а затем фасуют в стерильные флаконы.
Стерильность вакцины определяют в соответствии с ГОСТ 28085.
Контроль вакцины на стабильность эмульсии осуществляют посредством центрифугирования при 400 g в течение 10 минут с последующей визуальной оценкой однородности эмульсии.
Полноту инактивации препарата определяют методом трехкратных последовательных пассажей вакцины в перевиваемой культуре клеток по отсутствию ЦПД, а также в РГА (для вируса ПГ-3).
Определение безвредности вакцины проводят на белых мышах или на естественно восприимчивых животных - телятах 2÷3-месячного возраста. Для этого препарат вводят подкожно в область спины в дозе 0,1 см3 десяти белым мышам или внутримышечно в области средней трети шеи по 4 см3 двум телятам (две прививные дозы).
Вакцина считается безвредной, если телята и лабораторные животные в течение 10 суток наблюдения остаются клинически здоровыми без каких-либо патологических изменений. На месте введения допускается местная тканевая реакция.
Антигенность вакцины проверяют на кроликах. В опыт берут 7 кроликов массой 2,0-2,5 кг. Вакцину вводят 5 кроликам подкожно в области спины по 2 см3. Перед вакцинацией и через 28 сут после двукратного введения вакцины с интервалом 20-25 сут у кроликов берут кровь, выдерживают при температуре (37±0,5)°С, отделяют сыворотку и исследуют на наличие антител к вирусу ПГ-3 КРС в реакции торможения гемагглютинации (РТГА), к вирусу ИРТ КРС в реакции нейтрализации (РН), или в реакции микронейтрализации (РМН), или в реакции непрямой гемагглютинации (РНГА) и к вирусу ВД КРС в реакции ИФА или в реакции нейтрализации (РН) или в реакции микронейтрализации (РМН). У невакцинированных (контрольных) животных (2 головы) кровь отбирают и исследуют одновременно с вакцинированными животными. Серию вакцины считают прошедшей контроль на антигенную активность, если титр специфических антител к вирусу ПГ-3 КРС в РТГА≥1:32, к вирусу ИРТ КРС в РН≥1:8, или в РМН≥1:4, или в РНГА≥1:16, к вирусу ВД КРС в ИФА≥1:50, или в РН≥1:4, или в РМН≥1:2.
Из полученного антигенного материала была приготовленна серия вакцины ассоциированной против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной, содержащей, мас.%:
Пример 2
Проведены испытания антигенной активности предлагаемой вакцины ассоциированной против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной, изготовленной так, как описано в примере 1, и содержащей, мас.%:
Антигенную активность вакцины ассоциированной против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной проверяли на кроликах, которым вводили вакцину в дозе 2,0 см2. Животных иммунизировали двукратно с интервалом 20-25 суток. Через 28 суток после двукратного введения вакцины у животных отбирали кровь, отделяли сыворотку и исследовали на наличие антител к вирусу ИРТ в реакции РН, к вирусу ПГ-3 в реакции РТГА, к вирусу ВД в ИФА. Результаты исследований представлены в табл.7.
Из полученных результатов, приведенных в табл.7, видно, что средний уровень антител в сыворотках крови кроликов, привитых вакциной ассоциированной против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной, к вирусу ПГ-3 КРС составлял 7,0 log2, к вирусу ИРТ КРС 5,7 log2 и к вирусу ВД КРС 7,5 log2.
Таким образом, результаты, полученные на лабораторных животных, свидетельствуют о высокой антигенной активности вакцины ассоциированной против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной.
Пример 3
Проведены испытания антигенной активности предлагаемой вакцины ассоциированной против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной, изготовленной так, как описано в примере 1, и содержащей, мас.%:
Вакцину применяли в неблагополучных по данным инфекциям хозяйствах для профилактики ПГ-3, ИРТ и ВД КРС у молодняка КРС. Вакцинации подлежали клинически здоровые животные в возрасте 7-14 дней, то есть до перевода из профилактория в телятник. До вакцинации в хозяйстве отмечали массовые заболевания среди телят 1-3-месячного возраста со следующей клинической картиной: угнетение, ухудшение аппетита, серозные истечения из носа, кашель, пневмония, диарея. Количество молодняка КРС в хозяйстве составляло 495 голов, гибель среди заболевшего молодняка достигала 10%. В пробах патологического материала обнаружены геномы вирусов ВД, ИРТ и ПГ-3 КРС.
Были сформированы 2 группы телят. Первой группе (10 голов) вакцину вводили внутримышечно в области средней трети шеи двукратно с интервалом 20-25 суток в дозе 2 см3. Вторая группа (4 головы) служила контролем. За животными вели наблюдение в течение 35 дней. Сыворотку крови животных исследовали на наличие антител к вирусу ВД КРС в ИФА, к вирусу ИРТ КРС в РИГА, к вирусу ПГ-3 КРС в РТГА. Отбор проб сывороток крови проводили по следующей схеме: до вакцинации, перед ревакцинацией на 21 день и после ревакцинации на 35 день. Результаты представлены в табл.8.
Из табл.8 видно, что в опытной группе после ревакцинации на 35 день происходил значительный подъем уровня антител к вирусу ВД КРС до 10,9±0,35 log2, к вирусу ИРТ КРС до 8,6±0,47 log2 и к вирусу ПГ-3 КРС до 7,8±0,41 log2. Таким образом, прирост титра антител к 35 дню после вакцинации к вирусу ВД КРС составил 3,0 log2, к вирусу ИРТ КРС - 3,6 log2, к вирусу ПГ-3 КРС - 3,1 log2. В контрольной группе животных титр антител к 21 дню после начала опыта постепенно снижался и составлял 5,6 log2 к вирусу ВД, 3,8 log2 к вирусу ИРТ и 3,0 log2 к ПГ-3 КРС.
Применение вакцины позволило снизить падеж молодняка в хозяйстве с 10% до 5%. Заболевание отдельных животных протекало с менее выраженной клинической картиной.
Таким образом, вакцина ассоциированная против ПГ-3, ИРТ и ВД КРС эмульсионная инактивированная обладает высокой антигенной активностью, а титры антител, полученные в результате двукратной иммунизации животных, достигали достаточного уровня, чтобы защитить животное от данных инфекций.
Пример 4
Проведены испытания эффективности предлагаемой вакцины ассоциированной против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной, изготовленной так, как описано в примере 1, и содержащей, мас.%:
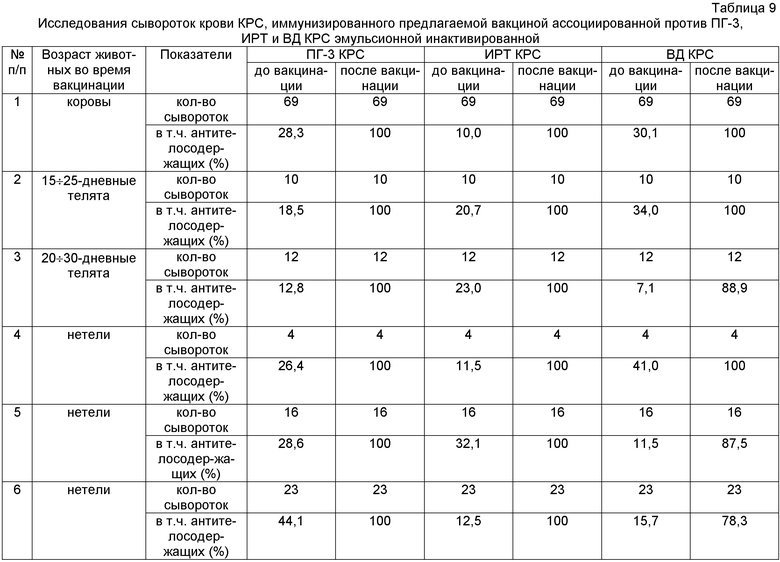
В 19 животноводческих хозяйствах была испытана предлагаемая вакцина. В таблице 9 приведены результаты исследований сывороток крови от КРС, привитого вакциной ассоциированной против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной. Эти данные свидетельствуют об эффективности указанного препарата.
Таким образом, показана возможность оздоровления стада от респираторных заболеваний вирусной этиологии посредством применения ассоциированной вакцины против ПГ-3, ИРТ и ВД КРС эмульсионной инактивированной.
Источники информации
1. Инфекционные болезни животных: Справочник. Под ред. Д.Ф. Осидзе. - М.:Агропромиздат, 1987, 288 с.
2. Сюрин В.Н., Самуйленко А.Я., Соловьев Б.В. и Фомина Н.В. Вирусные болезни животных. - М.: ВНИИТИБН, 1998, 928 с.
3. Инфекционная патология животных: В 2Т./под ред. А.Я.Самуйленко, Б.В.Соловьева, Е.А.Непоклонова, Е.С.Воронина. - М.: «Академкнига»,2006. - Т. 1. - 911 с.
4. Пат. ЧССР №249880; А61К 39/295, 39/108; 16.04.1987 г.
5. Пат. ЧССР №250849; А61К 39/295, 39/108; 14.05.1987 г.
6. Пат. ЧССР №250850; А61К 39/295, 39/108; 14.05.1987 г.
7. Наставление по применению вакцины инактивированной комбинированной против инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синцитиальной, рота-, коронавирусных болезней телят Комбовак, №13-3-04/0703 от 20.03.2003 г., утвержденное Департаментом ветеринарии 20.03.2003 г.
8. Пат. РФ №2261111; А61К 39/295, 27.09.2005 г.
9. Пат. РФ №2111011; А61К 39/295, 20.05.1998 г.(прототип).
10. Пат. РФ №2182494; А61К 39/155, 20.05.2002 г.
11. Пат. РФ №2221040; C12N 7/00, А61К 39/265(C12N 7/00, C12R 1:93), 10.01.2004 г.
12. Пат. РФ №2449013, C12N 7/00, А61К 39/12, 27.04.2012 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ВИРУСНОЙ ДИАРЕИ, РОТАВИРУСНОЙ И КОРОНАВИРУСНОЙ ИНФЕКЦИЙ КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2012 |
|
RU2515058C1 |
| ВАКЦИНА ПРОТИВ ВИРУСНОЙ ДИАРЕИ КРУПНОГО РОГАТОГО СКОТА | 2011 |
|
RU2457859C1 |
| ШТАММ "NADL-ВНИИЗЖ" ВИРУСА ВИРУСНОЙ ДИАРЕИ КРУПНОГО РОГАТОГО СКОТА DIARRHEA VIRUS BOVINUM ДЛЯ ИЗГОТОВЛЕНИЯ БИОПРЕПАРАТОВ ДЛЯ ДИАГНОСТИКИ, СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНОЙ ДИАРЕИ КРУПНОГО РОГАТОГО СКОТА | 2010 |
|
RU2449013C2 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ПРОТИВ ПАРАГРИППА-3, ИНФЕКЦИОННОГО РИНОТРАХЕИТА И КОРОНАВИРУСНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2007 |
|
RU2378014C2 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА И КОРОНАВИРУСНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2007 |
|
RU2378017C2 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ПРОТИВ РОТАВИРУСНОЙ И КОРОНАВИРУСНОЙ ИНФЕКЦИЙ КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2008 |
|
RU2366458C1 |
| ВАКЦИНА ПРОТИВ КОРОНАВИРУСНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА СОРБИРОВАННАЯ ИНАКТИВИРОВАННАЯ | 2005 |
|
RU2301079C2 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ПАРВОВИРУСНОЙ, РЕОВИРУСНОЙ, ГЕРПЕСВИРУСНОЙ ТИПА I ИНФЕКЦИЙ И ВИРУСНОЙ ДИАРЕИ - БОЛЕЗНИ СЛИЗИСТЫХ ОБОЛОЧЕК КРУПНОГО РОГАТОГО СКОТА ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ | 2010 |
|
RU2452512C2 |
| ВАКЦИНА ПРОТИВ КОРОНАВИРУСНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2007 |
|
RU2342157C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2004 |
|
RU2271220C1 |
Изобретение относится к ветеринарной вирусологии и биотехнологии. Вакцина содержит активное вещество и целевую добавку. В качестве активного вещества вакцина содержит смесь из авирулентного очищенного антигенного материала из штамма «ВГНКИ-4» вируса ПГ-3 КРС, сем. Paramyxoviridae, рода Parainfluenza, подтипа Parainfluenza virus 3, коллекция ВГНКИ «ВГНКИ-4»-ДЕП, из авирулентного очищенного антигенного материала из штамма «ВНИИЗЖ» вируса ИРТ КРС, сем. Herpesviridae, рода Varicellavirus, коллекция ВГНКИ «ВНИИЗЖ-ДЕП» и из авирулентного очищенного антигенного материала из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, сем. Flaviviridae, рода Pestivirus, коллекция ФГУ «ВГНКИ» «NADL-ВНИИЗЖ» - ДЕП. Штаммы взяты в соотношении 1:1:1 в количествах, обеспечивающих протективную иммунную активность каждого антигена в организме животного после введения ему целевого препарата. Вакцина индуцирует у иммунизированных животных высокий уровень антител, иммунитет у привитых животных формируется через 10-15 суток после повторного введения вакцины и сохраняется не менее 6 месяцев. Также при соединении указанных антигенов наблюдается эффект синергизма, что позволяет снизить количественное содержание антигенов в препарате при сохранении напряженности и длительности иммунитета. 26 з.п. ф-лы, 9 табл., 4 пр.
1. Вакцина ассоциированная против парагриппа-3 (ПГ-3), инфекционного ринотрахеита (ИРТ) и вирусной диареи (ВД) крупного рогатого скота (КРС) эмульсионная инактивированная, содержащая активное вещество и целевые добавки, отличающаяся тем, что в качестве активного вещества она содержит смесь из авирулентного очищенного антигенного материала из штамма «ВГНКИ-4» вируса ПГ-3 КРС, сем. Paramyxoviridae, рода Parainfluenza, подтипа Parainfluenza virus 3, коллекция ВГНКИ «ВГНКИ-4»-ДЕП, из авирулентного очищенного антигенного материала из штамма «ВНИИЗЖ» вируса ИРТ КРС, сем. Herpesviridae, рода Varicellavirus, коллекция ВГНКИ «ВНИИЗЖ-ДЕП» и из авирулентного очищенного антигенного материала из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, сем. Flaviviridae, рода Pestivirus, коллекция ФГУ «ВГНКИ» «NADL-ВНИИЗЖ»-ДЕП, в эффективном количестве.
2. Вакцина по п.1, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток млекопитающих, в эффективном количестве.
3. Вакцина по п.2, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток сирийского хомячка (ВНК-21), в эффективном количестве.
4. Вакцина по п.3, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток ВНК-21 с инфекционной активностью не менее 6,5 lg ТЦД50/см3 и гемагглютинирующей активностью не ниже 5,0 log2 до инактивации, в количестве 10,0 мас.%.
5. Вакцина по п.2, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток почки теленка (MDBK), в эффективном количестве.
6. Вакцина по п.5, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток MDBK с инфекционной активностью не менее 6,5 lg ТЦД50/см3 и гемагглютинирующей активностью не ниже 5,0 log2 до инактивации, в количестве 10,0 мас.%.
7. Вакцина по п.2, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток почки теленка (Таурус-2), в эффективном количестве.
8. Вакцина по п.7, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВГНКИ-4» вируса ПГ-3 КРС, полученного в перевиваемой культуре клеток Таурус-2 с инфекционной активностью не менее 6,5 lg ТЦД50/см3 и гемагглютинирующей активностью не ниже 5,0 log2 до инактивации, в количестве 10,0 мас.%.
9. Вакцина по п.1, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток млекопитающих, в эффективном количестве.
10. Вакцина по п.9, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток гонады козы (Ch-91), в эффективном количестве.
11. Вакцина по п.10, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток Ch-91 с инфекционной активностью не менее 6,0 lg ТЦД50/см3 до инактивации, в количестве 10,0 мас.%.
12. Вакцина по п.9, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток MDBK, в эффективном количестве.
13. Вакцина по п.12, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток MDBK с инфекционной активностью не менее 6,0 lg ТЦД50/см3 до инактивации, в количестве 10,0 мас.%.
14. Вакцина по п.9, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток RBT, в эффективном количестве.
15. Вакцина по п.14, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «ВНИИЗЖ» вируса ИРТ КРС, полученного в перевиваемой культуре клеток RBT с инфекционной активностью не менее 6,0 lg ТЦД50/см3 до инактивации, в количестве 10,0 мас.%.
16. Вакцина по п.1, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток млекопитающих, в эффективном количестве.
17. Вакцина по п.16, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток Таурус-2, в эффективном количестве.
18. Вакцина по п.17, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток Таурус-2 с инфекционной активностью не менее 6,0 lg ТЦД50/см3 и активностью в ИФА не менее 6,65 log2 до инактивации, в количестве 10,0 мас.%.
19. Вакцина по п.16, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток RBT, в эффективном количестве.
20. Вакцина по п.19, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток RBT с инфекционной активностью не менее 6,0 lg ТЦД50/см3 и активностью в ИФА не менее 6,65 log2 до инактивации, в количестве 10,0 мас.%.
21. Вакцина по п.16, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток почки сайги (ПС), в эффективном количестве.
22. Вакцина по п.21, отличающаяся тем, что она содержит авирулентный и очищенный антигенный материал из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученного в перевиваемой культуре клеток ПС с инфекционной активностью не менее 6,0 lg ТЦД50/см3 и активностью в ИФА не менее 6,65 log2 до инактивации, в количестве 10,0 мас.%.
23. Вакцина по п.1, отличающаяся тем, что из целевых добавок она содержит масляный адъювант.
24. Вакцина по п.23, отличающаяся тем, что она содержит масляный адъювант в количестве 69,6 мас.%.
25. Вакцина по п.1, отличающаяся тем, что из целевых добавок она содержит дополнительно адъювант сапонин.
26. Вакцина по п.25, отличающаяся тем, что она содержит сапонин в количестве 0,4 мас.%.
27. Вакцина по любому из пп.1÷26, отличающаяся тем, что в качестве активного вещества она содержит смесь авирулентных и очищенных антигенных материалов из штамма «ВГНКИ-4» вируса ПГ-3 КРС, из штамма «ВНИИЗЖ» вируса ИРТ КРС и из штамма «NADL-ВНИИЗЖ» вируса ВД КРС, полученных в перевиваемых культурах клеток млекопитающих, и целевые добавки масляный адъювант и сапонин в соотношении, мас.%:
| АССОЦИИРОВАННАЯ ВАКЦИНА ПРОТИВ ПАРАГРИППА-3, ИНФЕКЦИОННОГО РИНОТРАХЕИТА И КОРОНАВИРУСНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2007 |
|
RU2378014C2 |
| RU 2010127726 А, 10.01.2012 | |||
| Станок для резки труб | 1977 |
|
SU650734A2 |
Авторы
Даты
2014-01-20—Публикация
2012-09-25—Подача