Изобретение относится к ингибиторам NS5A, к новой фармацевтической композиции, противовирусному лекарственному средству, способу профилактики и лечения вирусных заболеваний, особенно вызываемых вирусами гепатита С (HCV).
Вирусные инфекции могут вызывать множество заболеваний, что создает серьезную угрозу для здоровья и жизни человечества. За последние 20 лет обнаружено не менее 30 совершенно новых возбудителей инфекционных болезней: СПИДа, вирусных гепатитов, острых и хронических диарей, геморрагических лихорадок (Эбола, венесуэльской, бразильской, долины Рифт) [a) Lednicky J.A., Rayner J.O. Uncommon respiratory pathogens. Curr. Opin. Pulm. Med. 2006, 12(3), 235-239. b) Hayden F.G. Respiratory viral threats. Curr. Opin. Infect. Dis. 2006, 19(2), 169-178]. В частности, особую тревогу вызывает возможность заболевания человека так называемым «птичьим гриппом» [a) Liu J.P. Avian influenza-a pandemic waiting to happen, J. Microbiol. Immunol. Infect. 2006, 39(1), 4-10. b) Henter J.I.; Chow C.B.; Leung C.W, Lau Y.L. Cytotoxic therapy for severe avian influenza A (H5N1) infection. Lancet. 2006 367(9513), 870-873. Review]. Согласно статистическим данным 60-65% эпидемических инфекций имеют вирусную этиологию. Из-за сложности взаимодействия в триаде «вирус - организм хозяина - лекарство», большинство современных противовирусных препаратов в процессе терапии проявляют побочные эффекты и формируют резистентные вирусные штаммы [Jain R., Clark N.M., Diaz-Linares М., Grim S.A. Limitations of current antiretroviral agents and opportunities for development. Curr. Pharm. Des. 2006, 12(9), 1065-1074.]. В настоящее время количество противовирусных лекарственных препаратов, которые могут быть использованы в клинической практике, чрезвычайно ограничено - всего 43 низкомолекулярных вещества [http://integrity.prous.com/integrity], что далеко не удовлетворяет потребностям профилактики и лечения вирусных заболеваний. Кроме того, существует значительное число вирусных инфекций, вызывающих заболевания, для лечения которых в настоящее время не существует химиотерапевтических средств. Это относится, например, к заболеваниям, вызываемым вирусами папилломы, аденовирусам, герпеса-6, оспы, синдрома SARS, геморрагических лихорадок, лихорадки Западного Нила, птичьего гриппа и т.д. [De Clercq Е. Recent highlights in the development of new antiviral drugs. Curr Opin Microbiol. 2005,5(5), 552-560].
Вирус гепатита C относится к Флавивирусам (genus Flaviviridae), наряду с другими важными патогенами чловека, такими как вирус желтой лихорадки, вирус West Nile, вирус Денги (Dengue) и вирус гепатита GBV-C). Флавивирусы обладают сходной организацией генома, в том числе наличием гена, кодирующего неструктурный белок NS5A. NS5A играет важную роль в репликации вирусного РНК-генома, являясь структурным компонентом вирусного репликационного комплекса. Поскольку данный белок в настояще время валидирован в клинических испытаниях как мишень для разработки лекарственных средств против хронического гепатита C, NS5A представляется перспективной мишенью и для других клинически важных флавивирусов, перечисленных выше.
Таким образом, большое значение имеет изыскание новых противофлавивирусных препаратов, в особенности, обладающих высокой активностью и низкой токсичностью.
В патентной литературе имеются публикации, посвященные различным производным 2-пирролидин-2-ил-1Н-имидазолам, которые являются лигандами неструктурного белкаКБ5А и подавляют вирус гепатита C (HCV) [WO 2008021927А2, WO 2009020825А1, WO 2009020828А1, WO 2010065668А1, WO 2010065681A1, WO 2010096302A1, WO 2010096462A1, WO 2010096777A1, WO2010111534A1, WO 2010111673A1, WO 2010117635A1, WO 2010117977A1], в том числе известен патент RU 2452735 РФ, 2012, в котором описан метил [(S)-1-((S)-2-{5-[4-(4-{2-[(S)-1-((S)-2-метоксикарбониламино-3-метил-бутирил)-пирролидин-2-ил]-ЗН-имидазол-4-ил}-бута-1,3-диинил)-фенил]-1Н-имидазол-2-ил}-пирролидин-1-карбонил)-2-метил-пропил]-карбамат формулы А и его дигидрохлорид A·2HCl.
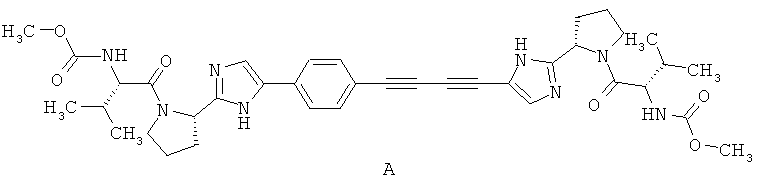
Однако из-за громоздкости молекул очистка этих соединений сильно затруднена. Кроме того, гидрохлорид A·2НС1 при очистке перекристаллизацией дополнительно загрязняется, по-видимому, продуктами присоединения хлористого водорода по тройным связям. Это затрудняет испытание и использование этих соединений в качестве лекарственных кандидатов.
Поиск новых высокоэффективных противофлавивирусных лекарственных препаратов в настоящее время по-прежнему является одним из основных направлений создания новых фармакологических средств для лечения широкого и разнообразного круга вирусных инфекций.
«Лекарственное начало» (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего. «Терапевтический коктейль» представляет одновременно администрируемую комбинацию двух и более лекарственных препаратов, обладающих различным механизмом фармакологического действия и направленных на различные биомишени, участвующие в патогенезе заболевания.
«Фармацевтическая композиция» обозначает композицию, включающую в себя соединение формулы I и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлимых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависят от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Авторы обнаружили не известные ранее стериоизомеры алкил [(S)-1-((S)-2-{5-[4-(4-{2-[(8)-1-((8)-2-метоксикарбониламино-3-метил-бутирил)-пирролидин-2-ил]-3Н-имидазол-4-ил}-бута-1,3-диинил)-фенил]-1 Н-имидазол-2-ил} -пирролидин-1 -карбонил)-2-метил-пропил]-карбамат нафталин-1,5-дисульфонат общей формулы 1, где:
R принимает значение C1-C3 алкил.
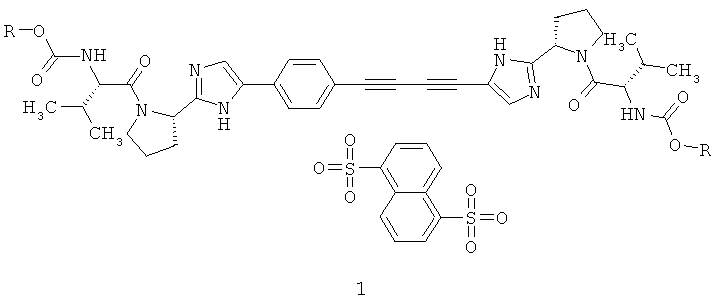
Более предпочтительным согласно данному изобретению является также метил [(8)-1-((8)-2-{5-[4-(4-{2-[(8)-1-((8)-2-метоксикарбониламино-3-метил-бутирил)-пирролидин-2-ил] -ЗН-имидазол-4-ил}-бута-1,3-диинил)-фенил]-1Н-имидазол-2-ил} -пирролидин-1 -карбонил)-2-метил-пропил]-карбамат нафталин-1,5-дисульфонат 1.1
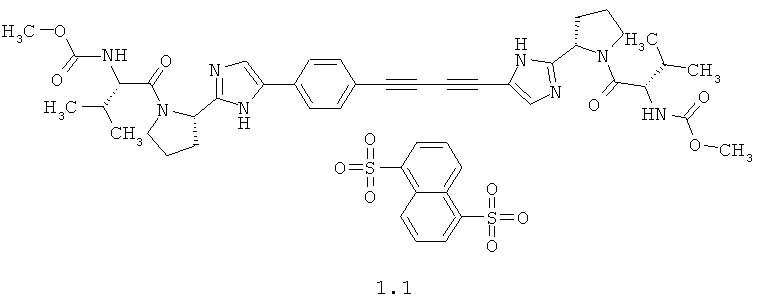
Основание общей формулы 1 было получено с использованием методики, описанной в патенте RU 2452735 РФ (2012), стр.66-68.
В соответствии с данным изобретением соли нафталин-1.5-дисульфонаты общей формулы 1 получают взаимодействием оснований формулы 1, с нафталин-1,5-дисульфокислотой в метаноле, этаноле или изопропаноле.
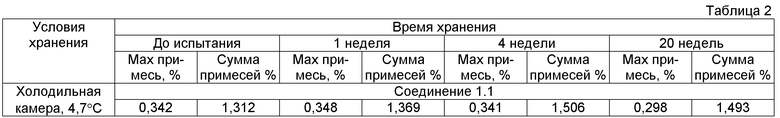
Получаемые по данному изобретению соли общей формулы 1 отличаются высокой чистотой, необходимой для использования в фармакопии, и хорошо хранятся при пониженной температуре (4,7°C).
Строение новых соединений и их чистота подтверждены данными аналитической хроматографии и LC MS. Соединения названы с использованием программы ChemDrow (Chembridge Soft Inc.).
Предметом данного изобретения является ингибитор белка NS5A, представляющий собой соединение общей формулы 1 или формулы 1.1, возможно в кристаллической или поликристаллической форме.
Предметом данного изобретения является фармацевтическая композиция для лечения и предупреждения заболеваний, обусловленных вирусом гепатита C и вирусом гепатита GBV-C, содержащая в качестве ингибитора белка NS5A соединения общей формулы 1 или формулы 1.1 в терапевтически эффективном количестве.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция, наряду с соединением общей формулы 1 или его кристаллической формой, поликристаллической формой, по настоящему изобретению может включать и другие активные ингредиенты при условии, что они не вызывают нежелательных эффектов, например аллергических реакций.
При необходимости использования фармацевтических композиций по настоящему изобретению в клинической практике они могут смешиваться для изготовления различных форм, при этом они могут включать в свой состав традиционные фармацевтические носители; например, пероральные формы (такие как таблетки, желатиновые капсулы, пилюли, растворы или суспензии); формы для инъекций (такие как растворы или суспензии для инъекций, или сухой порошок для инъекций, который требует лишь добавления воды для инъекций перед использованием); местные формы (такие как мази или растворы).
Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Фармацевтическую композицию получают смешением, по крайней мере, одного соединения общей формулы 1 или его кристаллической формы, поликристаллической формы с инертным наполнителем и/или растворителем.
Клиническая дозировка фармацевтической композиции, содержащей в качестве активного компонента соединение формулы 1, у пациентов может корректироваться в зависимости от: терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10~500 мг. Поэтому во время приготовления фармацевтических композиций по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10~500 мг соединения формулы 1. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз).
Предметом данного изобретения является лекарственное средство в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, для лечения и предупреждения заболеваний, обусловленных вирусом гепатита C и вирусом гепатита GBV-C, содержащее в качестве ингибитора белка NS5A хотя бы одно соединение общей формулы 1 или формулы 1.1 или новую фармацевтическую композицию в терапевтически эффективном количестве.
Предметом данного изобретения является терапевтический коктейль для профилактики и лечения заболеваний, обусловленных вирусом гепатита C и вирусом гепатита GBV-C, включающий в свой состав хотя бы одно соединение общей формулы 1 или 1.1, или новую фармацевтическую композицию, или новое лекарственное средство в терапевтически эффективном количестве.
Терапевтические коктейли для профилактики и лечения указанных выше флававирусных заболеваний, в том числе гепатита C и гепатита GBV-C, наряду с лекарственными средствами по данному изобретению, могут включать: ингибиторы инозин-5-монофосфат дегидрогеназы, например, Рибавирин (разрешен) и Рибамидин; ингибиторы NS3 протеазы гепатита C, например, Телапревир, Силупревир и SCH-503034; ингибиторы РНК-полимеразы NS5B, например, XTL-2125; ингибиторы альфа-глюкозидазы, например, аминоуглевод Селгозивир; а также агонисты TLR-рецепторов, гепатопротекторы, циклоспорины, различные белки (например, интерфероны), антитела, вакцины и т.д.
Для комбинированной терапии любые классы агентов, которые могут оказаться полезными будучи объединены с бис-азолами настоящего изобретения и которые могут подразумевать, например, нуклеозидные и ненуклеозидные ингибиторы HCV полимеразы, ингибиторы протеазы, ингибиторы геликазы, NS4B ингибиторы и медицинские агенты, которые функционально ингибируют внутренний рибосомный сайт вхождения (IRES), и другие медикаменты, которые ингибируют прикрепление HCV клетки или вхождение вируса, HCV RNA перемещение, HCV RNA транскрибирование, реплакацию или HCV созревание, сосредоточение или ослабление вируса. Специфические соединения в этих классах и полезные в этом изобретении включат, но не ограничивают макроциклические, гетероциклические и линейные HCV ингибиторы протеазы HCV, такие как telaprevir (VX-950), boceprevir (SCH-503034), narlaprevir (SCH-900518), ITMN-191 (R-7227), TMC-435350 (a.k.a. TMC-435), MK-7009, BI-201335, BI-2061 (ciluprevir), BMS-650032, ACH-1625, ACH-1095 (HCV NS4A ингибитор сопутствующего фактора протеазы) VX-500, VX-813, PHX-1766, PHX2054, IDX-136, IDX-316, ABT-450 EP-013420 (и родственные) и VBY-376; ингибиторы нуклеозидной HCV полимеразы (репликазы), полезные в данном изобретении, включают, но не ограничены следующим: R7128, PSI-7851, IDX-184, IDX-102, R1479, UNX-08189, PSI-6130, PSI-938 и PSI-879 и различные другие нуклеозиды и нуклеотидные аналоги и HCV ингибиторы, включающие (но не ограничивающие) происходящие от 2'-С-метил модифицированные нуклеозиды и нуклеотиды; и 7'-деаза модифицированные нуклеозиды и нуклеотиды. Ингибиторы ненуклеозидной HCV полимеразы (репликазы), полезные в данном изобретении, включают, но не ограничены: HCV-796, HCV-371, VCH-759, VCH-916, VCH-222, ANA-598, МК-3281, АВТ-333, АВТ-072, PF-00868554, BI-207127, GS-9190, А-837093, JKT-109, GL-59728 и GL-60667.
Кроме того, ингибиторы NS5A настоящего изобретения могут быть использованы в комбинации с антагонистами циклофиллина и иммунофиллина (например, без ограничений DEBIO соединения, NM-811, а также циклоспорин и его производные), ингибиторы киназ, ингибиторы протеинов теплового шока (например, HSP90, HSP70), другие иммуномодуляторные агенты, которые могут включать без ограничения интерфероны (альфа-, бета-, омега-, гамма-, lambda или синтетические), такие как Intron A™, Roferon-А™, Canferon-А300™, Advaferon™, Infergen™, Humoferon™, Sumiferon MP™, Alfaferon, IFN-P, Feron, и подобные, интерфероновые соединения, дериватизированные полиэтиленгликолем (pegylated), такие как: PEG interferon-a-2a (Pegasys™), PEG interferon-a-2b (PEGIntron™), pegylated IFN-a-con 1 и подобные; пролонгированные формулы и производные интерфероновых соединений, такие как альбумин-конденсированный интерферон, Albuferon™, Locteron™, и подобные; интерфероны с различными типами контролируемой доставки (например, ITCA-638, омега-интерферон, доставляемый DUROS подкожной системой доставки); соединения, которые стимулируют синтез интерферона в клетках, такие как resiquimod и подобные; интерлейкины; соединения, которые улучшают развитие отклика клетки type 1 helper Т, такие как SCV-07 и подобные; TOLL- подобные агонисты рецепторов, такие как: CpG-10101 (action), isotorabine, ANA773 и подобные; thymosin α-1, ANA-245 и ANA-246, гистамин дигидрохлорид, propagermanium; tetrachlorodecaoxide; ampligen; IMP-321; KRN-7000; антитела, такие как: civacir, XTL-6865 и подобные и профилактические и терапевтические вакцины такие как: Inno Vac, HCV E1E2/MF59 и подобные. В добавление, любой из вышеописанных методов, включающий введение NS5A ингибитора, агонист рецептора интерферона типа 1 (например, IFN-α) и агонист рецептора интерферона типа II (например, IFN-γ) могут быть усилены введением эффективного количества TNF-α антагониста. Типичный неограничивающий TNF-α антагонист, который подходит для использования в такой комбинированной терапии - ENBREL™ и HUMIRA™.
В дополнение, NS5A ингибиторы настоящего изобретения могут быть использованы в комбинации с антипротозоанами, а другие антивирусы считаются эффективными при лечении HCV инфекции такие как: пролекарство nitazoxanide. Nitazoxanide может быть использован как агент в комбинации с соединениями, раскрытыми в этом изобретении, а также в комбинации с другими агентами, полезными при лечении HCV инфекции, такими как: peginterferon alfa-2a и ribavarin (например Rossignol, JF и Keeffe, ЕВ, Future Microbiol. 3:539-545,2008).
NS5A ингибиторы настоящего изобретения могут быть также использованы с альтернативными формами интерферонов и пегилированных интерферонов, ribavirin или его аналоги (например, Tarabavarin, levovirion), microRNA, мало вредные RNA соединения (например, SIRPLEX-140-N и подобные), аналоги нуклеотидов или нуклеозидов, иммуноглобулины, гепатопротекторы, противовоспалительные агенты и другие ингибиторы NS5A. Ингибиторы других мишеней в жизненном цикле HCV включают ингибиторы NS3 геликазы; ингибиторы NS4A ко-фактора, ингибиторы антисмысловых олигонуклеотидов, такие как: ISIS-14803, AVI-4065 и подобные; вектор-зашифрованная короткая «шпилька» RNA (shRNA); HCV специфические рибозимы, такие как: heptazyme, RPI, 139199 и подобные; ингибиторы вхождения, такие как: НереХ-С, HuMax-НерС и подобные; ингибиторы альфа-глюкозидазы, такие как: celgosivir, UT-231B и подобные; КРЕ-02003002 и BIVN 401 и IMPDH ингибиторы. Другие показательные соединения ингибиторы HCV включают ингибиторы, раскрытые в известных научных и патентных публикациях.
Дополнительно, комбинации, например, рибавирина и интеферона могут быть введены как комбинированная терапия с, по крайней мере, одним соединением формулы 1 или соединения 1.1. Настоящее изобретение не ограничивается вышеуказанными классами или соединениями и рассматривает известные и новые соединения и комбинации биологически активных агентов. Имеется в виду, что комбинированные терапии настоящего изобретения включают любые химические совместимые комбинации бис-азолов этой патентоспособной группы с другими соединениями патентоспособной группы или другими соединениями вне патентоспособной группы, а также комбинация не исключает антивирусную активность соединения этой патентоспособной группы или антивирусную активность самой фармацевтической композиции.
Комбинированная терапия может быть последовательной, т.е. лечение сначала одним агентом, а затем другим (например, когда каждый этап лечения подразумевает другое соединение настоящего изобретения или когда один этап лечения включает соединение настоящего изобретения, а другой - подразумевает один или более биологически активных агентов), или может быть лечение обоими агентами одновременно. Последовательная терапия может включать существенное время после завершения первой терапии и до начала второй терапии. Лечение обоими агентами в одно и то же время может осуществляться в одной ежедневной дозе или в разных дозах. Комбинированная терапия не нуждается в ограничении двумя агентами и может включать три или более агентов. Дозы для одновременной и последовательной комбинированной терапии будут зависеть от всасывания, распределения, скоростей обмена веществ и выведения компонентов комбинированной терапии, а также других факторов, хорошо известных специалисту. Размер дозы будет также изменяться в зависимости от тяжести состояния, которое нужно облегчить. Следует понимать, что для каждого особого субъекта специфическая схема приема доз и расписание могут быть отрегулированы по времени в соответствии с потребностью индивидуума и профессиональным суждением лица, которое лечит или наблюдает за лечением методом комбинированной терапии.
Предметом данного изобретения является способ профилактики и лечения заболеваний, обусловленных вирусом гепатита C и вирусом гепатита GBV-C, путем введения терапевтически эффективного количества хотя бы одного соединения общей формулы 1, или формулы 1.1, или новой фармацевтической композиции, или нового лекарственного средства, или терапевтического коктейля.
Представленные ниже премеры демонстрируют, но не ограничивают данное изобретение.
Пример 1. Общий способ получения нафталин-1,5-дисульфонатов общей формулы 1. Растворяют 5 г основания общей формулы 1 в 150 мл метанола. Полученный раствор фильтруют через Celite и при перемешивании добавляют в него 1,05 экв. раствора тетрагидрата нафталин-1,5-дисульфокислоты в метаноле из расчета 50 мл на 5 г основания. Смесь перемешивают 45-60 мин (но не более, так как при увеличении времени перемешивания осадок становится чрезвычайно мелкодисперсным), выпавший осадок отделяют центрифугированием, промывают дважды метанолом, эфиром (после каждого промывания осадок центрифугируют), переносят с эфиром в круглодонную колбу и сушат на роторном испарителе, а затем в лиофильной сушилке. Получают с выходом выше 75% нафталин-1,5-дисульфонаты: 1.1, LC MS, 711 (M+1H) 1Н ЯМР (DMSO-D6,400 МГц) δ 0.96-1.05 (d, J1=6.1,12Н), 1.70 (м, 2Н), 1.79 (м, 2Н), 1.94 (м, 2Н), 2.04 (м, 2Н), 2.31 (м, 2Н), 3.48 (м, 2Н), 3.56 (s, 6Н), 3.58 (м, 2Н), 4.16 (м, 2Н), 4.56 (м, 2Н), 6.85 (d, J1=8.0, 2Н), 6.98 (s, 1Н), 7.20 (bd, 2H), 7.58 (d, J1=7.8, 2H), 7.64 (s, 1H), 7.83 (bs, 2H), 8.02 (t, Ji=8.0,2H), 8.29 (d, J1=7.8,2H), 9.56 (d, J1=8.0,2H), 11.60 (bs, 2H), чистота соединений 98,8% по данным метода ВЭЖХ;
1.2, LC MS, 739 (М+1Н) 1Н ЯМР (DMSO-D6, 400 МГц) δ 0.96-1.05 (d, J1=6.1, 12Н), 1.28 (t, J1=7.1, 6H), 1.70 (м, 2Н), 1.79 (м, 2Н), 1.94 (м, 2Н), 2.04 (м, 2Н), 2.31 (м, 2Н), 3.48 (м, 2Н), 3.58 (м, 2Н), 4.16 (м, 2Н), 4.19 (q, J1=7.1,4Н), 4.56 (м, 2Н), 6.85 (d, J1=8.0,2Н), 6.98 (s, 1H), 7.20 (bd, 2Н), 7.58 (d, J1=7.8, 2Н), 7.64 (s, 1H), 7.83 (bs, 2H), 8.02 (t, J1=8.0, 2H), 8.29 (d, J1=7.8, 2H), 9.56 (d, J1=8.0, 2H), 11.60 (bs, 2H), чистота соединений 98,6% по данным метода ВЭЖХ;
1.3, LC MS, 767 (М+1Н), 1Н ЯМР (DMSO-D6,400 МГц) δ 0.96-1.05 (d, J1=6.1,12Н), 1.03 (t, J1=7.1, 6H), 1.60 (м, 4Н), 1.70 (м, 2Н), 1.79 (м, 2Н), 1.94 (м, 2Н), 2.04 (м, 2Н), 2.31 (м, 2Н), 3.48 (м, 2Н), 3.58 (м, 2Н), 3.96 (t, J1=7.1, 4Н), 4.16 (м, 2Н), 4.56 (м, 2Н), 6.85 (d, J1=8.0,2Н), 6.98 (s, 1Н), 7.20 (bd, 2H), 7.58 (d, J1=7.8, 2H), 7.64 (s, 1H), 7.83 (bs, 2H), 8.02 (t, J1=8.0,2H), 8.29 (d, J1=7.8,2H), 9.56 (d, J1=8.0,2H), 11.60 (bs, 2H), чистота соединений 98,5%; по данным метода ВЭЖХ.
Если чистота целевого продукта менее 98,5%, проводят дополнительную очистку повторным высаживанием нафталин-1,5-дисульфоната. Для этого соль 1.1, 1.2 или 1.3 повторно переводят в основание. Для этого ее суспендируют в 100 мл этанола, добавляют 100 мл 10% раствора карбоната натрия. После полного растворения добавляют 400 мл дихлорметана. Органический слой отделяют, промывают по 1 разу водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия, упаривают в вакууме при температуре не выше 40°C. Далее высаживают нафталин-1,5-дисульфонат 1.1, 1.2 или 1.3 указанным выше способом.
Для получения нафталиндисульфоната чистотой более 99% проводят очистку основания методом колоночной хроматографии. Элюэнт диоксан : толуол=1:1,5. Объединяют средние фракции, упаривают их в вакууме при температуре не выше 40°C. Далее высаживают нафталин-1,5-дисульфонат 1.1,1.2 или 1.3 указанным выше способом. Выход 60%, чистота более 99%.
Пример 2. Определение противовирусной активности соединений общей формулы 1 (ингибирующей способности белка NS5A).
Ингибирующую способность соединений формулы 1 белка NS5A определяли в клеточной линии гепатомы человека Huh7, содержащую субгеномный РНК-репликон ВГС (генотип 1b, клон Con1). В качестве экспериментальной методики был использован вариант иммунного теста ИФА на вирусный белок NS5A в 96-луночном формате. Цитотоксичность соединений оценивали в параллельном режиме.
Клетки Huh7 высевались в 96-луночные планшеты (7.5×103 клеток на лунку в 100 мкл питательной среды), растворы тестируемых соединений в среде ДМЕМ {(DMEM) IX; Источник: Cellgro; Каталог: 10-013-CV} готовились непосредственно перед использованием. Всего готовилось одиннадцать серийных трехкратных разведений с концентрацией от 20 нМ до 0,2 пМ. Через 4 часа после высевания клеток серийные разведения препаратов добавлялись к клеткам (100 мкл на лунку). Конечная концентрация тестируемых соединений составляла от 10 нМ до 0,1 пМ, а ДМСО - 0.5%. При необходимости исследовались более высокие концентрации тестируемых бис-азола. Каждое разведение препарата тестировалось на двух идентичных лунках. Далее клетки инкубировали в течение трех дней при 37°С/5% CO2. Клетки фиксировали добавлением 250 мкл/лунку смеси ацетон/метанол (1:1). Через 1 минуту клетки трижды промывали раствором PBS (Phosphate Buffered Saline). После этого клетки блокировали добавлением 150 мкл/лунку 10% фетальной телячьей сыворотки в растворе PBS на 1 час при комнатной температуре. Далее, клетки инкубировали с мышиными моноклональными антителами к кор-антигену ВГС, клон С7-50 (Источник: Affinity BioReagents; Каталог: МА1-080) (100 мкл/лунку, рабочее разведение - 1:500 в 10% фетальной телячьей сыворотке в растворе PBS) в течение двух часов при 37°C. Клетки промывали 6 раз раствором PBS/0.05% Твин 20, после чего инкубировали в течение 1 часа с антителами козы к иммуноглобулинам мыши (конъюгированными с пероксидазой хрена, 100 мкл/лунку, рабочее разведение - 1:2500 в 10% фетальной телячьей сыворотке в растворе PBS). Клетки промывали 6 раз раствором PBS/0.05% Твин 20, один раз раствором PBS, после чего добавляли 100 мкл/лунку субстрата (1 таблетка ОПД+12 мл цитрат/фосфатного буфера+5 мкл 30% H2O2). Планшеты выдерживали 30 мин в темноте при комнатной температуре. Реакцию останавливали добавлением 100 мкл/лунку 2N H2SO2, и измеряли оптическую плотность (длина волны 490 нм) при помощи многоканального спектрофотометра Victor3 V 1420 (Perkin Elmer). Значения ИК50 (концентрация азола, понижающая уровень вирусного РНК-репликона на 50%) для каждого тестируемого бис-азола рассчитывали при помощи программы XLfit 4.
Цитотоксичность соединений общей формулы 1 изучалась в опытах на культуре линии клеток гепатомы человека Huh7. Количество живых клеток определяли при помощи набора ATPLite (Perkin Elmer, Бостон, США) в соответствии с инструкциями производителя. Цитотоксическое действие оценивали, высеивая клетки в черной микроплате с прозрачным дном (96 ячеек, 104 клеток на лунку). Для каждого бис-азола использовали три независимых повтора. Тестируемые бис-азолы добавляли через 18 часов, после чего клетки инкубировали с веществами в течение 96 часов. Промывали дважды каждую лунку фосфатно-солевым буфером (0,2 мл/лун) и затем лизировали клетки добавлением клеточного буфера (50 мкл/лун) (все указанные реактивы входят в комплект набора ATPLite). Микроплату инкубировали в течение 5 минут на вращающейся платформе при 600 об/мин, после чего добавляли в каждую лунку 50 мкл раствора субстрата (часть набора ATPLite). Инкубировали еще 5 минут на вращающейся платформе при 600 об/мин, выдерживали 10 минут в темноте и затем измеряли люминесценцию на приборе TopCount NXT (Packard, Perkin Elmer). В качестве количественного параметра для оценки цитотоксичности использовали величину ЦК50, которая соответствует концентрации бис-азола, при которой погибает 50% клеток. Расчет параметра ЦК50: для расчета эффективности ингибирования (% Инг) использовали формулу: 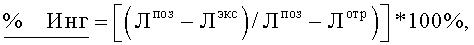
Результаты испытаний новых соединений общей формулы 1 свидетельствуют об их высокой пикомолярной активности. Ингибирующая активность по отношению к генотипу lb, 1а и 2а HCV новых соединений представлена в таблице 1.
Пример 3. Исследование хранения нафталин 1,5-дисульфонатов общей формулы 1. Все образцы хранились в стеклянных виалах, укупоренных резиновыми пробками с алюминиевыми колпачками, в холодильной камере при температуре ~ 4,7°С. Количество примесей определялось методом внутренней нормализации, детектирование проводилось УФ детектором при длине волны 220 нм. В таблице 2 представлены результаты испытаний соединения 1.1, свидетельствующие о их стабильности при температуре 4,7°С.
Пример 4. Получение фармацевтической композиции в форме таблеток. Смешивают 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и 1000 мг соединения 1.1. Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 560 мг каждая.
Пример 4. Получение фармацевтической композиции в форме капсул. Тщательно смешивают соединения 1.2 с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера.
Пример 5. Получение фармацевтической композиции в форме инъекционных композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивают 500 мг соединения 1.1 с 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают.
Настоящее изобретение относится к новым алкил [(S)-1-((S)-2-{5-[4-(4-{2-[(S)-1-((S)-2-метоксикарбониламино-3-метил-бутирил)-пирролидин-2-ил]-3Н-имидазол-4-ил}-бута-1,3-диинил)-фенил]-1Н-имидазол-2-ил}-пирролидин-1-карбонил)-2-метил-пропил]-карбамат нафталин-1,5-дисульфонатам общей формулы 1, которые являются ингибиторами NS5A и могут быть использованы в качестве активного компонента для получения фармацевтической композиции и противовирусного лекарственного средства для лечения и профилактики вирусных заболеваний, вызываемых вирусами гепатита С (HCV) и гепатита GBV-C. В общей формуле 1

R означает C1-C3 алкил. 5н. и 1 з.п. ф-лы, 2 табл.,6 пр.
1.Алкил [(S)-1-((S)-2-{5-[4-(4-{2-[(S)-1-((S)-2-метоксикарбониламино-3-метил-бутирил)-пирролидин-2-ил]-3Н-имидазол-4-ил}-бута-1,3-диинил)-фенил]-1Н-имидазол-2-ил}-пирролидин-1-карбонил)-2-метил-пропил]-карбамат нафталин-1,5-дисульфонат общей формулы 1
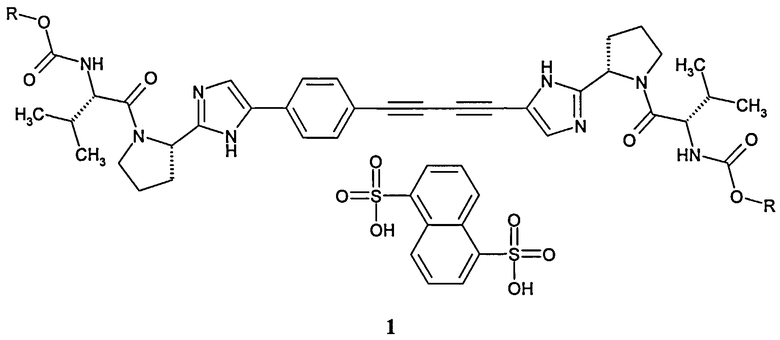
где: R - C1-С3 алкил.
2. Соединение по п.1, представляющее собой соединение формулы 1.1.
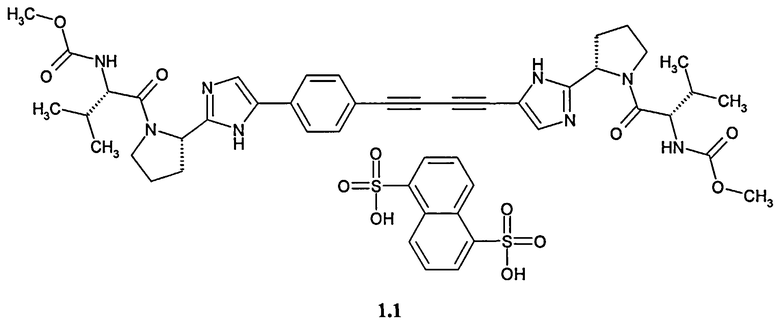
3. Алкил [(S)-1-((S)-2-{5-[4-(4-{2-[(S)-1-((S)-2-метоксикарбониламино-3-метил-бутирил)-пирролидин-2-ил]-3Н-имидазол-4-ил}-бута-1,3-диинил)-фенил]-1Н-имидазол-2-ил}-пирролидин-1-карбонил)-2-метил-пропил]-карбамат нафталин-1,5-дисульфонат, по любому из пунктов 1-2, обладающий свойством ингибитора белка NS5A, для фармацевтических композиций или лекарственных средств.
4. Фармацевтическая композиция, обладающая свойствами ингибитора белка NS5A для лечения и предупреждения заболеваний, обусловленных вирусом гепатита С и вирусом гепатита GBV-C, содержащая в качестве активного компонента соединение по пункту 3 в терапевтически эффективном количестве.
5. Лекарственное средство, обладающее свойствами ингибитора белка NS5A для лечения и предупреждения заболеваний, обусловленных вирусом гепатита С и вирусом гепатита GBV-C, в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, содержащее в качестве активного компонента соединение по п.3 или фармацевтическую композицию по п.4 в терапевтически эффективном количестве.
6. Способ профилактики и лечения заболеваний, обусловленных вирусом гепатита С и вирусом гепатита GBV-C, путем введения терапевтически эффективного количества соединения по п.3 или фармацевтической композиции по п.4, или лекарственного средства по п.5.
| ЗАМЕЩЕННЫЕ АЗОЛЫ, ПРОТИВОВИРУСНЫЙ АКТИВНЫЙ КОМПОНЕНТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2452735C1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| WO 2010017401 A1, 11.02.2010 | |||
| WO 2008021928 A2, 21.02.2008. | |||
Авторы
Даты
2014-02-20—Публикация
2013-02-07—Подача