Изобретение относится к медицине, а именно к генетике, молекулярной биологии, онкологии, и касается способа определения чувствительности рака легкого к противоопухолевой таргетной терапии, современного метода лечения с помощью препаратов, направленных на рецепторы опухолевых клеток.
Известен способ анализа транслокаций EML4-ALK с использованием набора праймеров, позволяющих амплифицировать исследуемый фрагмент и анализировать результат с помощью полимеразной цепной реакции (ПЦР) в реальном времени, капиллярного или обычного гель-электрофореза и набора антител для иммуногистохимического анализа, позволяющего идентифицировать мутантные белки (международная патентная заявка WO 2011087709).
Недостатки способа: данный способ имеет ограниченное применение ввиду дорогостоящих реактивов и оборудования для его осуществления.
Известен способ анализа транслокаций гена ALK, включая инверсию EML4-ALK, с использованием флуоресцентной гибридизации in situ (FISH) и ПЦР в реальном времени (международная патентная заявка WO 2011087709).
Недостатки способа: использование дорогостоящих реактивов и дорогого специфического оборудования, исследование занимает более 24 часов.
Известен способ анализа транслокации EML4-ALK для диагностики и терапии немелкоклеточного рака легких с использованием одностадийной ПЦР с обратной транскрипцией (ОТ-ПЦР) и набора антител к химерному белку (международная патентная заявка WO 2011095894).
Недостатки способа: осуществление данного способа требует дорогостоящих реактивов и оборудования.
Наиболее близким к заявляемому способу (прототипом) является способ анализа транслокации гена ALK, включая EML4-ALK, с использованием флуоресцентной гибридизации с биочипами. Прототип включает следующие приемы: выделение РНК-матрицы из биологического материала; двухэтапную стандартную ОТ-ПЦР; изготовление зондов, представляющих собой амплифицированные последовательности ДНК, комплементарные анализируемому участку гена; гибридизацию флуоресцентно-меченого продукта, полученного в ОТ-ПЦР, с зондом на биочипе; анализ результатов гибридизации с помощью сканера и специальных компьютерных программ (международная патентная заявка WO 2010132888).
Недостатки способа: для осуществления данного способа используют дорогостоящую тест-систему; анализ генетических изменений занимает более суток; не исключена неспецифическая гибридизация ПЦР-продукта с зондом, что снижает чувствительность и точность способа; требуется нефиксированный в формалине биологический материал.
Задачей заявляемого изобретения является создание нового, более точного, простого в исполнении, менее дорогостоящего и занимающего меньше времени способа анализа транслокаций EML4-ALK, ассоциированных с чувствительностью рака легкого к противоопухолевой таргетной терапии.
Технический результат. Заявляемый способ прост в исполнении, является экономически оправданным, осуществляется без использования специального дорогостоящего оборудования; обладает высокой чувствительностью и специфичностью, универсален, его осуществление возможно с операционным материалом и опухолевой тканью, заключенной в парафиновые блоки, регистрацию результатов производят однократно в конце исследования, способ занимает менее 24 часов.
Сущность заявляемого способа заключается в анализе транслокаций EML4-ALK, ассоциированных с чувствительностью рака легкого к противоопухолевой таргетной терапии, с использованием технологии мультиплексной ОТ-ПЦР и последующей гибридизации флуоресцентно-меченого ПЦР-продукта с биологическим микрочипом (биочипом), в ячейки которого нанесены высокоспецифичные зонды для дифференцировки сигналов гибридизации. Анализ результатов гибридизации осуществляется с помощью детектирующей системы, распознающей флуоресцентный сигнал портативным анализатором биочипов, снабженным ПЗС-камерой со специальным программным обеспечением.
Заявляемый способ анализа основан на определении 6 вариантов транслокаций EML4-ALK (V2, V3, V5, V4, V7, V1) с использованием мультиплексной ОТ-ПЦР и биочипа, содержащего набор иммобилизованных дифференцирующих зондов для гибридизации с ПЦР-продуктами.
Способ иллюстрируется фигурами 1-3 и таблицами 1-3.
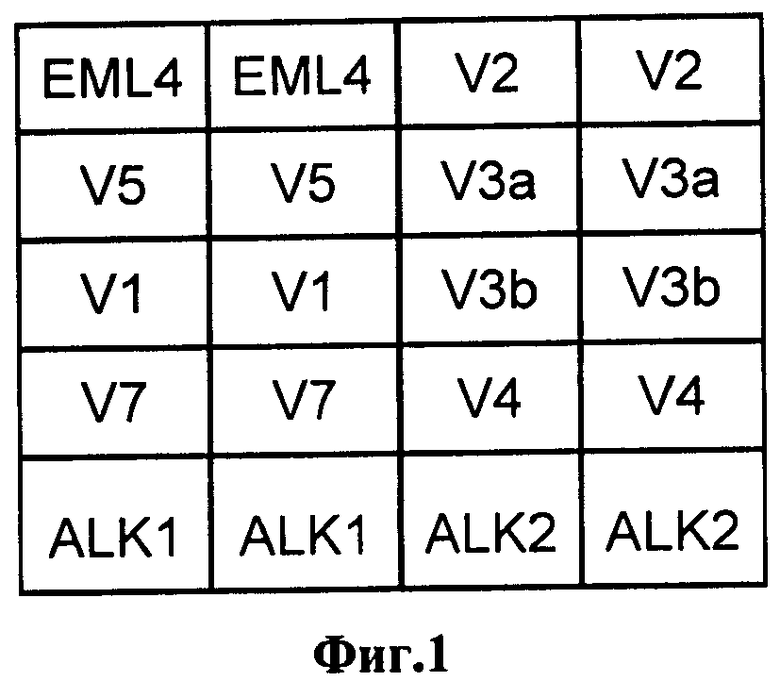
На фиг.1 представлена схема биочипа для анализа транслокаций EML4-ALK.
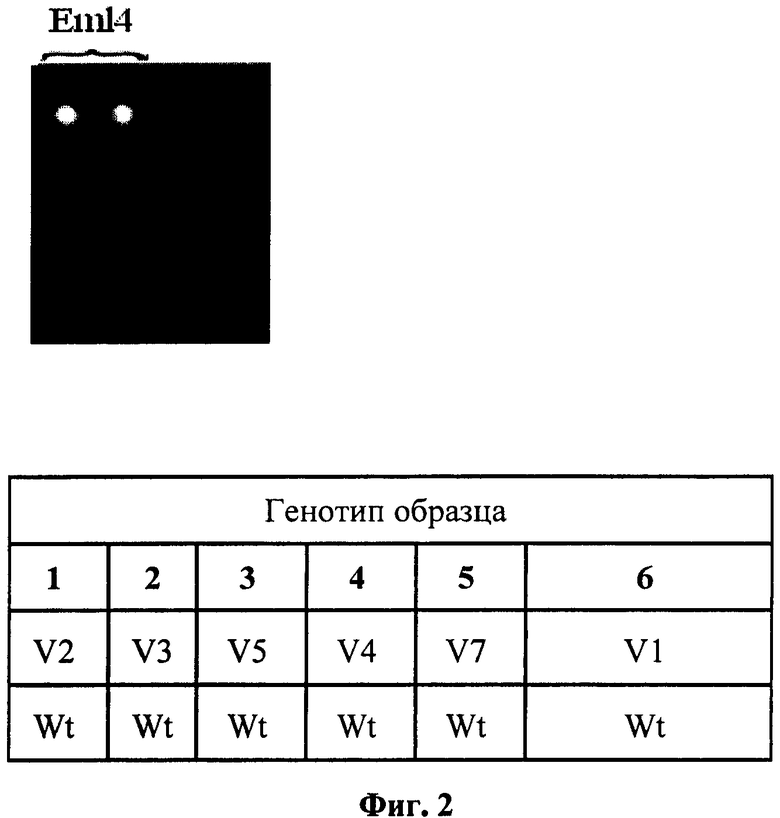
На фиг.2 представлена картина гибридизации экспериментального образца опухоли, не несущей транслокаций EML4-ALK.
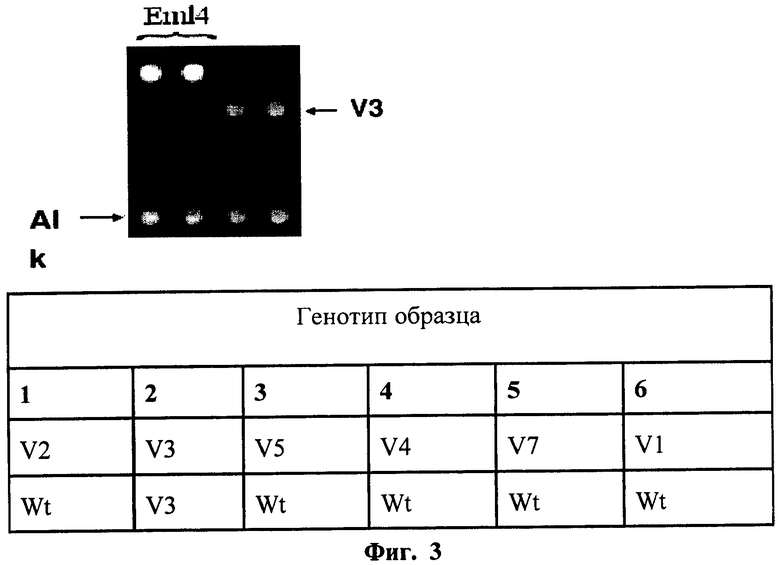
На фиг.3 - картина образца опухоли, несущей вариант транслокации EML4-ALK V3.
В табл.1 представлены выбранные последовательности прямого и обратного праймеров для ОТ-ПЦР.
В табл.2 представлены последовательности праймеров для первого этапа мультиплексной ПЦР (SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17, 18).
В табл.3 представлены последовательности набора 11 зондов, использованных для изготовления биочипа (SEQ ID NO: 21-31).
Заявляемый способ включает следующие приемы: получение кДНК EML4-ALK с помощью ОТ-ПЦР на матрице РНК гена EML4-ALK с использованием специфичных праймеров; амплификацию фрагментов гена EML4-ALK методом мультиплексной ПЦР на матрице кДНК, полученной на первом этапе ОТ-ПЦР, с помощью набора высокоспецифичных праймеров; получение флуоресцентно-меченого ПЦР-продукта на втором этапе ОТ-ПЦР; создание биочипа для анализа транслокаций EML4-ALK, содержащего набор иммобилизованных зондов; гибридизацию флуоресцентно-меченого ПЦР-продукта с зондами в гелевых ячейках на пластиковой подложке биочипа; регистрацию и интерпретацию результатов гибридизации.
Заявляемый способ осуществляется следующим образом. На первом этапе забирали биологический материал - опухолевую ткань, замороженную в жидком азоте или заключенную в парафин в виде блоков. Фрагменты опухолевой ткани измельчали или снимали стерильным скальпелем со стекол путем микродиссекции, суспендировали и выделяли тотальную РНК с помощью набора RNeasy FFPE Kit.
Анализируемые последовательности гена EML4-ALK амплифицировали с помощью ОТ-ПЦР. Для амплификации гена EML4-ALK (V3a) использовали праймеры SEQ ID NO: 11, 15. ПЦР-смесь первого этапа общим объемом 25 мкл содержала 1 × ПЦР-буфер (трис-НСl - 67 мМ, рН 8.6, (NH4)2SO4 - 166 мМ, 0,01% Тритон Х-100), MgCl2 - 1,5 мМ, дНТФ - по 0,2 мМ, 2,5 Ед Taq-полимеразы, праймеры - по 0,2 мкМ (SEQ ID NO: 11, 15) и 20 нг ДНК. Амплификацию проводили по следующей схеме: денатурация при t=94°С в течение 3 мин 30 с и далее 35 циклов амплификации при t=94°C в течение 30 с, при t=62°C в течение 20 с, при t=72°C в течение 10 с и элонгация при t=72°C в течение 3 мин.
Смесь второго этапа ПЦР отличалась составом, концентрацией, температурой отжига праймеров и содержала прямой праймер - 0,2 мкМ (SEQ ID NO: 12), обратный праймер - 2 мкМ (SEQ ID NO: 16). Для флуоресцентного мечения ПЦР-продукта второго этапа в смесь добавляли флуоресцентно-меченый дУТФ-Су5 - 0,2 нМ, который встраивался в цепь в процессе амплификации. Для этого в стандартную реакционную смесь добавляли избыток одного из пары праймеров и флуоресцентной метки (дезоксинуклеотидтрифосфата Су5-дУТФ), получали избыток флуоресцентно-меченого одноцепочечного ПЦР-продукта - ампликона, способного к гибридизации с аллель-специфичными зондами, иммобилизованными в ячейках биочипа.
Полученную на первом этапе ОТ-ПЦР кДНК использовали как матрицу и проводили амплификацию по схеме: денатурация при t=94°С в течение 3 мин 30 с, далее 35 циклов амплификации при t=94°C в течение 30 с, при t=56°C в течение 20 с, при t=72°C в течение 10 с, затем элонгация при t=72°C в течение 3 мин.
Праймеры и зонды синтезировали с помощью фосфоамидитного метода на автоматическом ДНК/РНК синтезаторе. В табл.1 представлены выбранные последовательности прямого и обратного праймеров для ОТ-ПЦР. Модификацию зондов для введения активной группы проводили как в автоматическом режиме при синтезе с использованием широкого спектра коммерческих модификаторов, так и после синтеза, в ручном режиме. При синтезе зондов с помощью 3'-Amino-Modifier С7 CPG 500 на 3'-конец присоединяли последовательность-спейсер со свободной аминогруппой для последующей иммобилизации зонда в ячейке биочипа.
В табл.2 представлены последовательности праймеров для первого этапа мультиплексной ПЦР (SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17, 18). На втором этапе использовали праймеры SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 19, 20. Для оптимизации ПЦР использовали только праймеры, которые не образовывали между собой высокоэнергетических внутренних структур: шпилек и дуплексов, и обеспечивали специфичную амплификацию необходимого количества продукта. Отжиг праймеров осуществляли при одинаковой температуре. Оптимизировали такие параметры ПЦР, как концентрацию MgCl2 и праймеров в ПЦР-смеси, соотношение прямых и обратных праймеров, количество циклов амплификации, время элонгации, денатурации и отжига праймеров на первом и втором этапах ПЦР.
Зонды для иммобилизации на биочипе и праймеры подбирали так, чтобы идентифицировать все выбранные для анализа транслокации EML4-ALK варианты. Затем проводили гибридизацию флуоресцентно-меченых ПЦР-продуктов, полученных после второго этапа ОТ-ПЦР, с иммобилизованными в ячейках геля зондами - участками гена EML4-ALK, комплементарными последовательности гена дикого типа или мутантного гена.
Ампликоны денатурировали путем прогрева гибридизационной смеси при t=95°C в течение 5 мин с последующим быстрым охлаждением на льду 2 мин и затем проводили гибридизацию SSPE-буфере 1X. Состав буфера 20 X: NaCl - 174 г, Na3C6H5O7 - 88,2 г, деионизированной Н2О - 800 мл, ЭДТА - 7,4 г, доводили рН до 7,0 с помощью 1 ON раствора NaOH (6,5 мл), затем объем буфера доводили Н2О до 1 л и стерилизовали автоклавированием. Продолжительность гибридизации составляла 12-14 ч при t=37°C.
Анализ генотипов и аллелей в исследуемом образце проводили с учетом расположения зондов на биочипе, схема которого указывала на вариант транслокации. При наличии стабильных совершенных дуплексов между ПЦР-продуктом и зондом получали сигнал флуоресценции. При отсутствии комплементарности между ПЦР-продуктом и зондом сигнал флуоресценции отсутствовал.
Биочипы изготовливали путем последовательного нанесения ячеек акриламидного геля на пластиковую подложку матрицы с иммобилизацией зондов в соответствующих ячейках. Для иммобилизации использовали зонды, несущие по 5'- или 3'-концу активную группу. В табл.3 представлены последовательности набора 11 зондов, использованных для изготовления биочипа (SEQ ID NO: 21-31). Дискриминацию совершенных и несовершенных дуплексов проводили после отмывки биочипа, сравнивая интенсивность сигналов флуоресценции в соответствующих ячейках биочипа. Для этого биочип отмывали в буфере с добавлением соли: SSC 20Х: NaCl - 175, 3 г, Na3C6H5O7 - 88,2 г и деионизированной Н2О - 800 мл, доводили рН до 7,0 с помощью 10 N раствора NaOH и объем до 1 л, затем автоклавировали. Далее анализировали полученную флуоресцентную картину с помощью детектирующей системы, распознающей флуоресцентный сигнал - портативного анализатора биочипов, снабженного ПЗС-камерой и специальным программным обеспечением производства ООО «Биочип-ИМБ» (Россия), и делали вывод о генотипе опухоли в исследуемом образце.
Наличие транслокации ассоциировалось с чувствительностью рака легкого к противоопухолевой таргетной терапии. Схема биочипа для анализа транслокаций EML4-ALK представлена на фиг.1. Праймеры в первых двух ячейках верхнего ряда соответствовали контрольной последовательности. В ячейки нижнего ряда нанесли праймеры, соответствующие участку гена ALK, в первом, втором и третьем ряду - праймеры, соответствующие различным вариантам транслокаций EML4-ALK. Картина гибридизации образца опухоли, не несущей транслокаций EML4-ALK, представлена на фиг.2. Флуоресцентный сигнал наблюдается только в ячейках биочипа с праймерами, контрольными для ОТ-ПЦР, следовательно, анализируемый образец не содержит транслокациий EML4-ALK. Картина образца опухоли, несущей вариант транслокации EML4-ALK V3, представлена на фиг.3. Флуоресцентный сигнал наблюдается в ячейках с праймерами, соответствующими транслокации EML4-ALK (V3a), анализируемый образец содержит этот вариант транслокации. При сравнении картин гибридизации образцов опухолей без транслокаций и образцов опухолей с транслокациями показано, что чувствительность и специфичность заявляемого способа составляет не более 1% клеток с мутацией (транслокацией AML4-ALK) на 99% клеток, не несущих транслокацию.
Изобретение относится к молекулярной генетике. Способ включает: получение кДНК EML4-ALK с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) на матрице РНК гена EML4-ALK с использованием специфичных праймеров; амплификацию фрагментов гена EML4-ALK методом мультиплексной ПЦР на матрице кДНК, полученной на первом этапе ОТ-ПЦР, с помощью набора высокоспецифичных праймеров; получение флуоресцентно-меченого ПЦР-продукта на втором этапе ОТ-ПЦР; создание биочипа для анализа транслокаций EML4-ALK, содержащего набор иммобилизованных зондов; гибридизацию флуоресцентно-меченого ПЦР-продукта с зондами в гелевых ячейках на пластиковой подложке биочипа; регистрацию и интерпретацию результатов гибридизации. Способ предусматривает использование технологии ДНК-биочипов, сконструированных с целью определения 6 вариантов транслокаций EML4-ALK (V2, V3, V5, V4, V7, V1). Способ обладает высокой чувствительностью и специфичностью, универсален, его осуществление возможно с операционным материалом и опухолевой тканью, заключенной в парафиновые блоки; регистрацию результатов производят однократно в конце исследования, способ занимает менее 24 часов. 2 з.п. ф-лы, , 3 табл., 3 ил.
1. Способ анализа транслокаций EML4-ALK, ассоциированных с чувствительностью рака легкого к противоопухолевой таргетной терапии, включает: получение кДНК EML4-ALK с помощью реакции ПЦР с обратной транскрипцией (ОТ-ПЦР) на матрице РНК EML4-ALK со специфичными праймерами (SEQ ID NO: 1-2); амплификацию фрагментов гена EML4-ALK методом мультиплексной ПЦР на матрице кДНК с наборами специфичных праймеров (SEQ ID NO: 3-20); получение флуоресцентно-меченого ПЦР-продукта на втором этапе ОТ-ПЦР; создание биочипа для анализа 6 вариантов транслокаций EML4-ALK (V2, V3, V5, V4, V7, V1), содержащего набор иммобилизованных дифференцирующих зондов (SEQ ID NO: 21-31); гибридизацию флуоресцентно-меченого ПЦР-продукта с зондами в ячейках биочипа; регистрацию и интерпретацию результатов гибридизации.
2. Способ по п.1, в котором для идентификации транслокаций EML4-ALK, амплифицированных с помощью набора специфичных праймеров, используют биочип, представляющий собой пластиковую подложку с гелевыми ячейками, содержащими набор иммобилизованных зондов, комплементарных анализируемым участкам гена EML4-ALK.
3. Способ по п.1, в котором регистрацию результатов гибридизации проводят с помощью портативного устройства, регистрирующего и записывающего сигналы флуоресценции.
| WO 2010132888 A1, 18.11.2010 | |||
| US 20110110923 A1, 12.05.2011 | |||
| US 20120237930 A1, 20.09.2012. |
Авторы
Даты
2014-03-10—Публикация
2012-11-28—Подача