По данной заявке испрашивается приоритет по предварительной патентной заявке США No. 61/022179, поданной 18 января 2008 года, по предварительной патентной заявке США No. 61/099373, поданной 23 сентября 2008 года, и по предварительной патентной заявке США No. 61/110246, поданной 31 октября 2008 года, описания которых включены в настоящий документ в качестве ссылок.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к технической области клеточной и молекулярной биологии и медицины, в частности к изготовлению активных высокофосфорилированных лизосомальных ферментов сульфатаз человека и к их применению для управления течением лизосомальных болезней накопления, связанных с дефицитом лизосомальных ферментов сульфатаз. В частности, настоящее изобретение относится к изготовлению активной высокофосфорилированной рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека и к ее применению для управления течением мукополисахаридоза IVa (MPS Iva, или синдрома Моркио A) и других лизосомальных болезней накопления, ассоциированных с дефицитом GALNS.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Лизосомальные болезни накопления (LSD) являются следствием дефицита определенных лизосомальных ферментов в клетке, которые необходимы для деградации клеточных отходов в лизосоме. Дефицит таких лизосомальных ферментов ведет к накоплению в лизосоме недеградированного "материала накопления", который вызывает набухание и нарушение функции лизосом, и, в конечном итоге, к повреждению клеток и тканей. Большое количество лизосомальных ферментов идентифицировано и соотнесено со связанными с ними заболеваниями. После идентификации недостающего фермента лечение может быть сведено к единственной проблеме эффективной доставки заместительного фермента в пораженные ткани пациентов.
Одним из способов лечения лизосомальных болезней накопления является внутривенная фермент-заместительная терапия (ERT) (Kakkis, Expert Opin. Investig. Drugs 11 (5): 675-685, 2002). В ERT используются сосуды для доставки фермента из одной области введения в большинство тканей. После того как фермент широко распределяется, он должен быть захвачен клетками. Основа для захвата в клетки состоит в уникальном признаке лизосомальных ферментов. Лизосомальные ферменты представляют собой отдельный класс гликопротеинов, определяемый по фосфату в 6 положении концевых остатков маннозы. Манноза-6-фосфат связывается с высокой аффинностью и специфичностью рецептором, находящимся на поверхности большинства клеток (Munier-Lehmann et al., Biochem. Soc. Trans. 24(1): 133-136, 1996; Marnell et al., J. Cell. Biol. 99(6): 1907-1916, 1984). Рецептор манноза-6-фосфата (MPR), который имеет по два связывающих маннозу-6-фосфат участка на полипептидную цепь (Tong et al., J. Biol Chem. 264:7962-7969, 1989), обеспечивает захват фермента из крови в ткани, а затем опосредует внутриклеточную доставку к лизосоме.
Крупномасштабная продукция лизосомальных ферментов вовлекает экспрессию в клеточных линиях млекопитающих. Ее целью является преобладающая секреция рекомбинантного фермента в окружающую среду для роста в целях последующего сбора и переработки. В идеальной системе для крупномасштабной продукции лизосомальных ферментов, фермент эффективно фосфорилируется, а затем направляется, главным образом, к клеточной поверхности (т.е. для секреции), вместо направления, в первую очередь, в лизосому. Как описано выше, это разделение фосфорилированных лизосомальных ферментов полностью противоположно тому, что происходит в нормальных клетках. Изготовление клеточных линий, используемых для продукций лизосомальных ферментов, сфокусировано на максимальном увеличении уровня манноза-6-фосфата на моль фермента, но оно характеризуется низкой удельной продуктивностью. Попытки продукции in vitro лизосомальных ферментов, содержащих высокие уровни групп манноза-6-фосфата, имели переменный успех (Canfield et al., патент США No. 6537785). Фермент in vitro обладает высокими уровнями манноза-6-фосфата, а также высокими уровнями немодифицированной концевой маннозы. Конкуренция между маннозой-6-фосфатом и рецепторами маннозы за лизосомальный фермент приводит к необходимости высоких доз фермента для эффективности и может привести к большей иммуногенности, вредной для субъекта, подвергаемого лечению.
Сульфатазы представляют собой уникальный подкласс лизосомальных ферментов. Сульфатазы отщепляют сульфатные сложные эфиры от различных субстратов, включая, например, стероиды, углеводы, протеогликаны и гликолипиды. Все известные эукариотические сульфатазы содержат остаток цистеина в их каталитическом центре. Активность сульфатазы требует посттрансляционной модификации этого остатка цистеина в Cα-формилглицин (FGly). Посттрансляционная активация фермента путем модификации цистеина в FGly происходит в эндоплазматической сети на несвернутых сульфатазах сразу после трансляции, перед направлением сульфатаз в лизосому (Dierks et al., Proc. Natl. Acad. Sci. USA 94:11963-11968, 1997). Образующим формилглицин ферментом, который катализирует эту реакцию, является модифицирующий сульфатазу фактор 1 (SUMF1). На важность этой уникальной посттрансляционной модификации указывает то, что мутации в SUMF1, которые приводят к нарушению образования FGly в лизосомальных ферментах сульфатазах, приводят к множественной сульфатазной недостаточности (MSD) у людей (Diez-Ruiz et al., Annu. Rev. Genomics Hum. Genet. 6:355-379, 2005).
Таким образом, терапевтическая эффективность препарата лизосомального фермента сульфатазы зависит от уровня манноза-6-фосфата и от присутствия активного фермента в этом препарате.
Таким образом, в данной области существует необходимость в эффективной и продуктивной системе для крупномасштабного изготовления терапевтически эффективных активных высокофосфорилированных лизосомальных ферментов сульфатаз для управления течением лизосомальных болезней накопления, вызываемых дефицитом таких лизосомальных ферментов сульфатаз или ассоциированных с ним.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с открытием, что когда производное клеточной линии CHO-K1 (обозначаемое G71), которое является дефектным по эндосомальному закислению, конструируют таким образом, чтобы оно экспрессировало рекомбинантный модифицирующий сульфатазу фактор 1 (SUMF1) человека, модифицированные клетки G71 продуцируют с высоким выходом активные высокофосфорилированные рекомбинантные лизосомальные ферменты сульфатазы отчасти путем препятствования утрате материала в лизосомальном отделе продуцирующей клеточной линии. В одном варианте осуществления, изобретение относится к клеточной линии группы комплементации END3, которая коэкспрессирует рекомбинантный SUMF1 человека и рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека, обеспечивая высокие выходы активного высокофосфорилированного фермента. Иллюстративными клеточными линиями являются G71, G71S и их производные, которые сохраняют требуемое свойство G71, т.е. способность продуцировать с высоким выходом активные высокофосфорилированные рекомбинантные лизосомальные ферменты сульфатазы. Это применение модифицированной клеточной линии CHO-K1 группы комплементации END3, коэкспрессирующей рекомбинантный SUMF1 человека и рекомбинантный лизосомальный фермент сульфатазу, может быть особенно пригодным для изготовления активных высокофосфорилированных лизосомальных ферментов сульфатаз для применения в целях управления течением лизосомальными болезнями накопления путем фермент-заместительной терапии (ERT).
В первом аспекте, настоящее изобретение относится к новому способу продукции активных высокофосфорилированных рекомбинантных лизосомальных ферментов сульфатаз человека или их биологически активных фрагментов, мутантов, вариантов или производных в клетке CHO группы комплементации END3 или ее производном в количествах, которые обеспечивают их терапевтическое применение. В широком варианте осуществления, способ включает стадии: (a) культивирования происходящей из CHO клетки группы комплементации END3 или ее производного; (b) получения первого экспрессирующего вектора млекопитающих, способного экспрессировать активный высокофосфорилированный рекомбинантный лизосомальный фермент сульфатазу человека или его биологически активный фрагмент, мутант, вариант или производное в происходящей из CHO клетке группы комплементации END3 или ее производном; (c) получения второго экспрессирующего вектора млекопитающих, способного экспрессировать рекомбинантный модифицирующий сульфатазу фактор 1 (SUMF1) человека или его биологически активный фрагмент, мутант, вариант или производное в происходящей из CHO клетке группы комплементации END3 или ее производном; (d) трансфекции происходящей из CHO клетки группы комплементации END3 или ее производного первым и вторым экспрессирующими векторами; (e) селекции и клонирования трансфектанта происходящей из CHO клетки группы комплементации END3 или ее производного, которая экспрессирует активный высокофосфорилированный рекомбинантный лизосомальный фермент сульфатазу человека или его биологически активный фрагмент, мутант, вариант или производное; и (f) оптимизации способа культивирования клеток для изготовления высокофосфорилированного рекомбинантного лизосомального фермента сульфатазы человека или его биологически активного фрагмента, мутанта, варианта или производного. Рекомбинантный лизосомальный фермент сульфатаза человека выбран из группы, состоящей из арилсульфатазы A (ARSA), арилсульфатазы B (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH), N-ацетилглюкозамин-сульфатазы (G6S) и N-ацетилгалактозамин-6-сульфатазы (GALNS).
Способ вовлекает стадии трансфекции кДНК, кодирующей весь лизосомальный фермент сульфатазу или его часть, и кДНК, кодирующей весь SUMF1 человека или его часть, в происходящую из CHO клетку группы комплементации END3 или ее производное. В некоторых вариантах осуществления, первый и второй экспрессирующие векторы, которые способны экспрессировать кДНК, кодирующую активный высокофосфорилированный рекомбинантный лизосомальный фермент сульфатазу человека и SUMF1 человека, соответственно, трансфицируют одновременно в происходящую из CHO клетку группы комплементации END3 или ее производное. В некоторых вариантах осуществления, первый и второй экспрессирующие векторы трансфицируют в происходящую из CHO клетку группы комплементации END3 или ее производное последовательно. В некоторых вариантах осуществления, используют кДНК, кодирующую полноразмерный лизосомальный фермент сульфатазу человека, в то время как в других вариантах осуществления используют кДНК, кодирующую его биологически активный фрагмент, мутант, вариант или производное. В некоторых вариантах осуществления, используют кДНК, кодирующую полноразмерный SUMF1 человека, в то время как в других вариантах осуществления используют кДНК, кодирующую его биологически активный фрагмент, мутант, вариант или производное. В некоторых вариантах осуществления, для одновременного переноса кДНК лизосомального фермента сульфатазы человека и SUMF1 или последовательно в происходящую из CHO клетку группы комплементации END3 или ее производное используют несколько экспрессирующих векторов. В некоторых вариантах осуществления, для одновременного переноса кДНК лизосомального фермента сульфатазы и SUMF1 человека в происходящую из CHO клетку группы комплементации END3 или ее производное используют один экспрессирующий вектор. В предпочтительном варианте осуществления, происходящая из CHO клетка группы комплементации END3 или ее производное представляет собой клеточную линию G71, клеточную линию G71S или производное G71 или G71S.
В предпочтительном варианте осуществления, способ включает продукцию активного высокофосфорилированного рекомбинантного лизосомального фермента сульфатазы человека, например арилсульфатазы A (ARSA), арилсульфатазы B (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH), N-ацетилглюкозамин-сульфатазы (G6S) или N-ацетилгалактозамин-6-сульфатазы (GALNS), клеточной линией CHO группы комплементации END3 или ее производным. В особенно предпочтительном варианте осуществления, способ включает продукцию активной высокофосфорилированной рекомбинантной N-ацетилгалактозамин-6-сульфатазы человека (GALNS) клеточной линией CHO группы комплементации END3 или ее производным. Клеточная линия группы комплементации END3 представляет собой любую модифицированную клеточную линию CHO, которая сохраняет свойства клеточной линии группы комплементации END3, такие как дефектное эндосомальное закисление. В предпочтительном варианте осуществления, происходящая из CHO клетка группы комплементации END3 или ее производное представляет собой клеточную линию G71, клеточную линию G71S или производное G71 или G71S.
Во втором аспекте, настоящее изобретение относится к дефицитной по эндосомальному закислению клеточной линии, характеризующейся ее способностью продуцировать активные высокофосфорилированные рекомбинантные лизосомальные ферменты сульфатазы человека в количествах, которые дают возможность терапевтического применения лизосомального фермента сульфатазы. В предпочтительных вариантах осуществления, изобретение относится к происходящим из CHO-K1 клеточным линиям группы комплементации END3, обозначаемым G71, G71S, или к их производным, которые способны продуцировать с высоким выходом активные высокофосфорилированные рекомбинантные лизосомальные ферменты сульфатазы человека, тем самым позволяя крупномасштабную продукцию таких терапевтических лизосомальных ферментов сульфатаз. В более предпочтительных вариантах осуществления, клеточная линия экспрессирует и секретирует рекомбинантный лизосомальный фермент сульфатазу человека в количестве по меньшей мере приблизительно 0,5, предпочтительно по меньшей мере приблизительно 0,75, более предпочтительно по меньшей мере приблизительно 1,0 и еще более предпочтительно по меньшей мере приблизительно 1,25 пикограмм/клетка/сутки.
Клеточная линия группы комплементации END3 представляет собой любую модифицированную клеточную линию CHO, которая сохраняет свойства клеточной линии группы комплементации END3, такие как дефектное эндосомальное закисление. В одном варианте осуществления, клеточная линия CHO группы комплементации END3 образована из G71 или ее производного и содержит (a) экспрессирующий вектор для рекомбинантного модифицирующего сульфатазу фактора 1 (SUMF1) человека и (b) экспрессирующий вектор для рекомбинантного лизосомального фермента сульфатазы человека, где рекомбинантный лизосомальный фермент сульфатаза человека выбран из группы, состоящей из арилсульфатазы A (ARSA), арилсульфатазы B (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH), N-ацетилглюкозамин-сульфатазы (G6S) и N-ацетилгалактозамин-6-сульфатазы (GALNS). В предпочтительном варианте осуществления, клеточная линия CHO группы комплементации END3 содержит экспрессирующий вектор для рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека. В более предпочтительном варианте осуществления, клеточная линия CHO группы комплементации END3 экспрессирует и секретирует рекомбинантную GALNS человека. В другом предпочтительном варианте осуществления, клеточная линия CHO группы комплементации END3 выбрана из группы, состоящей из клона 4, клона 5, клона C6, клона C2, клона C5, клона C7, клона C10, клона C11 и клона C30. В более предпочтительном варианте осуществления, клеточная линия CHO группы комплементации END3 представляет собой клон C2. В другом предпочтительном варианте осуществления, клеточная линия CHO группы комплементации END3 адаптирована для роста в суспензии.
В третьем аспекте, изобретение относится к рекомбинантным лизосомальным ферментам сульфатазам человека, продуцированным способами по настоящему изобретению и, таким образом, присутствующим в количествах, которые делают возможным терапевтическое применение лизосомальных ферментов сульфатаз. Лизосомальные ферменты сульфатазы могут представлять собой полноразмерные белки или их фрагменты, мутанты, варианты или производные. В некоторых вариантах осуществления, лизосомальный фермент сульфатаза или его фрагмент, мутант, вариант или производное по этому изобретению можно, при желании, модифицировать для повышения их стабильности или фармакокинетических свойств (например, пегилирование, мутагенез, слияние, конъюгация). В предпочтительных вариантах осуществления, фермент представляет собой лизосомальный фермент сульфатазу человека, фрагмент лизосомального фермента сульфатазы человека, имеющий биологическую активность нативного фермента сульфатазы, или полипептид, который обладает существенной гомологией аминокислотной последовательности с лизосомальным ферментом сульфатазой человека. В некоторых вариантах осуществления, лизосомальный фермент сульфатаза представляет собой белок, источником или происхождением последовательности которого является человек или млекопитающее. В других вариантах осуществления, лизосомальный фермент сульфатаза является таким, что его дефицит приводит к заболеванию у человека, такому как метахромная лейкодистрофия, или MLD (т.е. арилсульфатаза A (ARSA)), синдром Марото-Лами, или MPS VI (т.е. арилсульфатаза B (ARSB)), синдром Хантера, или MPS II (т.е. идуронат-2-сульфатаза (IDS)), синдром Санфилиппо A, или MPS IIIa (т.е. сульфамидаза/гепарин-N-сульфатаза (SGSH)), синдром Санфилиппо D, или MPS IIId (т.е. N-ацетилглюкозамин-сульфатаза (G6S)), и синдром Моркио A, или MPS IVa (т.е. N-ацетилгалактозамин-6-сульфатаза (GALNS)). В особенно предпочтительном варианте осуществления, лизосомальный фермент сульфатаза является таким, что его дефицит вызывает синдром Моркио A или MPS IVa (т.е. N-ацетилгалактозамин-6-сульфатаза (GALNS)). В другом особенно предпочтительном варианте осуществления, лизосомальный фермент сульфатаза является таким, что его дефицит ассоциирован с заболеванием у человека, таким как множественная сульфатазная недостаточность или MSD (т.е. N-ацетилгалактозамин-6-сульфатаза (GALNS)).
Источником или происхождением последовательности лизосомального фермента сульфатазы также может быть человек или млекопитающее. В других вариантах осуществления изобретения, в каждом из его аспектов, лизосомальный фермент сульфатаза является идентичным по аминокислотной последовательности соответствующей части аминокислотной последовательности лизосомального фермента сульфатазы человека или млекопитающего. В других вариантах осуществления, полипептидная часть представляет собой нативный лизосомальный фермент сульфатазу из человека или млекопитающего. В других вариантах осуществления, полипептид лизосомального фермента сульфатазы является по существу гомологичным (т.е. по меньшей мере приблизительно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичным по аминокислотной последовательности) на протяжении по меньшей мере приблизительно 25, 50, 100, 150 или 200 аминокислот или полной длины полипептида аминокислотной последовательности нативного лизосомального фермента сульфатазы человека или млекопитающего. В других вариантах осуществления, субъектом, которому вводят лизосомальный фермент сульфатазу, является человек.
В предпочтительных вариантах осуществления, лизосомальный фермент сульфатаза представляет собой высокофосфорилированный рекомбинантный лизосомальный фермент сульфатазу человека, продуцированный дефицитной по эндосомальному закислению клеточной линией, например, происходящей из CHO клеточной линии группы комплементации END3. Клеточная линия группы комплементации END3 представляет собой любую модифицированную клеточную линию CHO, которая сохраняет свойства клеточной линии группы комплементации END3, такие как дефектное эндосомальное закисление. В предпочтительном варианте осуществления, происходящая из CHO клетка группы комплементации END3 или ее производное представляют собой клеточную линию G71, клеточную линию G71S или производное G71 или G71S.
В более предпочтительных вариантах осуществления, рекомбинантный лизосомальный фермент сульфатаза человека обладает высоким уровнем фосфорилированных олигосахаридов (т.е. более чем приблизительно 0,25, предпочтительно более чем 0,5 и более предпочтительно более чем приблизительно 0,75 бис-фосфорилированных олигоманнозных цепей на белковую цепь). В более предпочтительных вариантах осуществления, фермент представляет собой высокофосфорилированную рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека.
В более предпочтительных вариантах осуществления, рекомбинантный лизосомальный фермент сульфатаза человека имеет высокий процент (т.е. по меньшей мере приблизительно 50%, предпочтительно по меньшей мере приблизительно 70%, более предпочтительно по меньшей мере приблизительно 90%, более предпочтительно по меньшей мере приблизительно 95%) остатка цистеина активного центра, преобразованного в Cα-формилглицин (FGly). В еще более предпочтительных вариантах осуществления, фермент представляет собой активную рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека.
В более предпочтительных вариантах осуществления, рекомбинантный лизосомальный фермент сульфатаза человека имеет высокий уровень фосфорилированных олигосахаридов (т.е. более чем приблизительно 0,25, предпочтительно более чем 0,5 и более предпочтительно более чем приблизительно 0,75 бис-фосфорилированных олигоманнозных цепей на белковую цепь) и высокий процент (т.е. по меньшей мере приблизительно 50%, предпочтительно по меньшей мере приблизительно 70%, более предпочтительно по меньшей мере приблизительно 90%, более предпочтительно по меньшей мере приблизительно 95%) остатка цистеина активного центра, преобразованного в Cα-формилглицин (FGly). В наиболее предпочтительных вариантах осуществления, фермент представляет собой активную высокофосфорилированную рекомбинантную N-ацетилгалактозамин-6-сульфатазу человека (GALNS).
В четвертом аспекте, изобретение относится к способу очистки рекомбинантных лизосомальных ферментов сульфатаз человека, продуцированных способами по настоящему изобретению. В предпочтительном варианте осуществления, лизосомальные ферменты сульфатазы очищают с использованием способа с двумя колонками (хроматография краситель-лиганд, например Blue-Sepharose, и анионообменная хроматография, например SE Hi-Cap), включающего по меньшей мере пять стадий очистки: (1) фильтрация собранного материала, т.е. культуральной среды, из клеточной линии CHO группы комплементации END3 или ее производного, которое экспрессирует модифицирующий сульфатазу фактор 1 (SUMF1) человека и рекомбинантный лизосомальный фермент сульфатазу человека; (2) доведение pH отфильтрованного собранного материала до pH 4,5 (для индукции осаждения загрязняющих белков); (3) нанесение отфильтрованного собранного материала с доведенным pH на колонку краситель-лиганд, например колонку Blue-Sepharose, промывание колонки и элюирование лизосомального фермента сульфатазы из колонки; (4) нанесение элюата из колонки краситель-лиганд в анионообенную колонку, например колонку SE Hi-Cap, промывание колонки и элюирование лизосомального фермента сульфатазы из колонки; (5) ультрафильтрация и диафильтрация элюата из анионообменной колонки. Необязательно, отфильтрованный собранный материал стадии (1) концентрируют в 10-20 раз путем ультрафильтрации перед доведением pH. Необязательно, ультрафильтрованный и диафильтрованный лизосомальный фермент сульфатазу стадии (5) приготавливают в буфере для изготовления. В особенно предпочтительном варианте осуществления, лизосомальный фермент представляет собой рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека.
В другом предпочтительном варианте осуществления, лизосомальные ферменты сульфатазы очищают с использованием способа с тремя колонками (хроматография с улавливанием, например анионообменная SE Hi-Cap; промежуточная хроматография, например краситель-лиганд Capto BlueZinc, Chelating Sepharose FF или Capto Adhere; и хроматография доочистки, например ToyoPearl Butyl 650M, Phenyl Sepharose Hi-Sub или Phenyl Sepharose Low-Sub), включающего по меньшей мере пять стадий очистки: (1) ультрафильтрация собранного материала, т.е. культуральной среды клеточной линии CHO группы комплементации END3 или ее производного, которые экспрессируют модифицирующий сульфатазу фактор 1 (SUMF1) человека и рекомбинантный лизосомальный фермент сульфатазу человека, например, с помощью Sartoon Cassettes (10 кДа, Hydrosart); (2) доведение pH отфильтрованного собранного материала до pH 4,5 (для индукции осаждения загрязняющих белков); (3) нанесения отфильтрованного собранного материала с доведенным pH на улавливающую колонку, например анионообменную колонку Fractogel EMD SE Hi-CAP (M), промывание колонки и элюирование лизосомального фермента сульфатазы из колонки; (4) нанесения элюата из улавливающей колонки на промежуточную колонку, например колонку краситель-лиганд Capto BlueZinc, Chelating Sepharose FF или Capto Adhere, промывание колонки и элюирование лизосомального фермента сульфатазы из колонки; (5) нанесение элюата на колонку доочистки, например, ToyoPearl Butyl 650M, Phenyl Sepharose Hi-Sub или Phenyl Sepharose Low-Sub, промывание колонки и элюирование лизосомального фермента из колонки. Элюированный лизосомальный фермент стадии (5) приготавливают в буфере для изготовления. Необязательно, элюированный лизосомальный фермент сульфатазу стадии (5) подвергают ультрафильтрации, а затем приготавливают в буфере для изготовления. Необязательно, лизосомальный фермент сульфатазу из колонки стадии (4) подвергают воздействию pH 3,5 для инактивации вирусов низким pH перед нанесением в колонку доочистки стадии (5). В особенно предпочтительном варианте осуществления, лизосомальный фермент представляет собой рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека.
В пятом аспекте, изобретение относится к очищенной активной высокофосфорилированной рекомбинантной N-ацетилгалактозамин-6-сульфатазе (GALNS) человека или ее биологически активному мутанту, варианту или производному, пригодным для лечения субъекта, страдающего лизосомальной болезнью накопления, которая вызвана (например, мукополисахаридоз типа IVa (MPS IVa), или синдром Моркио A) или ассоциирована с (например, множественная сульфатазная недостаточность (MSD)) дефицитом фермента GALNS. В предпочтительном варианте осуществления, очищенная активная высокофосфорилированная рекомбинантная GALNS человека: (a) имеет чистоту по меньшей мере приблизительно 90% при определении окрашиванием кумасси синим при SDS-PAGE в невосстанавливающих условиях; (b) имеет по меньшей мере приблизительно 90% остатка цистеина в положении 53, преобразованного в Сα-формилглицин (FGly); и (c) является гликозилированной N-связанным гликозилированием по остаткам аспарагина в положениях 178 и 397, где по меньшей мере приблизительно 50% олигоманнозных цепей, связанных с остатком аспарагина в положении 178, являются бис-фосфорилированными. Очищенная активная высокофосфорилированная рекомбинантная GALNS человека имеет основную полосу на уровне приблизительно 55-60 кДа (т.е. предшественник GALNS человека, составляющий по меньшей мере приблизительно 75%, предпочтительно по меньшей мере приблизительно 85%, более предпочтительно по меньшей мере приблизительно 90% и более предпочтительно по меньшей мере приблизительно 95% видимых белков) и второстепенные полосы на уровне ~39 кДа и ~19 кДа (т.е. зрелая или процессированная GALNS человека, составляющая менее чем приблизительно 25%, предпочтительно менее чем приблизительно 15%, более предпочтительно менее чем приблизительно 10% и еще более предпочтительно менее чем приблизительно 5% видимых белков) при SDS-PAGE в восстанавливающих условиях. В особенно предпочтительном варианте осуществления, очищенная активная высокофосфорилированная рекомбинантная GALNS человека имеет по существу одну полосу на уровне приблизительно 55-60 кДа (т.е. предшественник GALNS человека) при SDS-PAGE в восстанавливающих условиях. В одном варианте осуществления, очищенная активная высокофосфорилированная рекомбинантная GALNS человека пригодна для лечения MPS IVa, или синдрома Моркио A. В одном варианте осуществления, очищенная активная высокофосфорилированная рекомбинантная GALNS человека пригодна для лечения MSD.
В шестом аспекте, изобретение относится к способу лечения заболеваний, вызываемых полностью или частично дефицитом лизосомального фермента сульфатазы или ассоциированных с его дефицитом. Способ включает введение терапевтического рекомбинантного лизосомального фермента сульфатазы человека, продуцированного способами по настоящему изобретению, где лизосомальный фермент сульфатаза связывается с рецептором MPR и транспортируется через клеточную мембрану, проникает в клетку и доставляется к лизосомам в клетке.
В одном варианте осуществления, способ включает лечение субъекта, страдающего дефицитом лизосомального фермента сульфатазы, включающее введение субъекту, нуждающемуся в этом, терапевтически эффективного количества указанного лизосомального фермента сульфатазы, где указанный лизосомальный фермент сульфатаза представляет собой рекомбинантный лизосомальный фермент сульфатазу человека или его биологически активный фрагмент, мутант, вариант или производное, продуцированные происходящей из CHO клеткой группы комплементации END3 или ее производным. В некоторых вариантах осуществления, способ включает введение терапевтического рекомбинантного лизосомального фермента сульфатазы человека или его биологически активного фрагмента, мутанта, варианта или производного отдельно или в сочетании с фармацевтически приемлемый носителем, разбавителем или эксципиентом. Предпочтительные варианты осуществления включают оптимизацию дозировки в соответствии с потребностями субъектов, подвергаемых лечению, предпочтительно млекопитающих и наиболее предпочтительно людей, для наиболее эффективного смягчения дефицита лизосомального фермента сульфатазы.
Такие терапевтические лизосомальные ферменты сульфатазы особенно пригодны, например, для лечения пациентов, страдающих лизосомальными болезнями накопления, вызываемыми дефицитом лизосомального фермента сульфатазы, таких как пациенты, страдающие метахроматической лейкодистрофией, или MLD, мукополисахаридозом типа VI (MPS VI), или синдромом Марото-Лами, мукополисахаридозом типа II (MPS II), или синдромом Хантера, мукополисахаридозом типа IIIa (MPS IIIa), или синдромом Санфилиппо A, мукополисахаридозом типа IIId (MPS IIId), или синдромом Санфилиппо D, и мукополисахаридозом типа IVa (MPS IVa), или синдромом Моркио A. В особенно предпочтительном варианте осуществления, лизосомальная болезнь накопления представляет собой MPS Iva, или синдром Моркио A, и лизосомальный фермент сульфатаза представляет собой рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека. В других вариантах осуществления, изобретение также относится к фармацевтическим композициям, содержащим дефектный лизосомальный фермент сульфатазу, вызывающий лизосомальную болезнь накопления, и фармацевтически приемлемый носитель, разбавитель или эксципиент.
В другом варианте осуществления, способ включает лечение субъекта, страдающего лизосомальной болезнью накопления, которая ассоциирована с дефицитом одного или нескольких лизосомальных ферментов сульфатаз, включающее введение субъекту, нуждающемуся в этом, терапевтически эффективного количества лизосомального фермента сульфатазы, где указанный лизосомальный фермент сульфатаза представляет собой рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека или ее биологически активный фрагмент, мутант, вариант или производное, продуцированные происходящей из CHO клеткой группы комплементации END3 или ее производным. В некоторых вариантах осуществления, способ включает введение терапевтического рекомбинантного фермента GALNS человека или его биологически активного фрагмента, мутанта, варианта или производного отдельно или в сочетании с фармацевтически приемлемым носителем, разбавителем или эксципиентом. В особенно предпочтительном варианте осуществления, лизосомальная болезнь накопления представляет собой множественную сульфатазную недостаточность (MSD).
В особенно предпочтительных вариантах осуществления, происходящая из CHO клетка группы комплементации END3 или ее производное представляет собой клеточную линию G71, клеточную линию G71S или производное G71 или G71S.
В другом варианте осуществления, настоящее изобретение относится к способу фермент-заместительной терапии путем введения терапевтически эффективного количества лизосомального фермента сульфатазы субъекту, нуждающемуся в фермент-заместительной терапии, где клетки пациента имеют лизосомы, которые содержат недостаточные количества лизосомального фермента сульфатазы, для предотвращения или уменьшения повреждения клеток, где в лизосомы проникают достаточные количества лизосомального фермента сульфатазы для предотвращения или уменьшения повреждения клеток. Клетки могут находиться в ЦНС или за ее пределами или не должны выходить из крови через стенки капилляров, эндотелиальные клетки которых плотно закрыты для диффузии активного вещества через плотные контакты.
В конкретном варианте осуществления, изобретение относится к композициям и фармацевтическим композициям, содержащим активный рекомбинантный лизосомальный фермент сульфатазу человека, который имеет биологическую активность, которая является сниженной, дефектной или отсутствует в лизосоме-мишени, и который вводят субъекту. Предпочтительные активные лизосомальные ферменты сульфатазы человека включают, но не ограничиваются ими, арилсульфатазу A, арилсульфатазу B, идуронат-2-сульфатазу, сульфамидазу/гепаран-N-сульфатазу, N-ацетилглюкозамин-6-сульфатазу и N-ацетилгалактозамин-6-сульфатазу. В предпочтительном варианте осуществления, N-ацетилгалактозамин-6-сульфатаза представляет собой активный рекомбинантный лизосомальный фермент сульфатазу человека.
В предпочтительном варианте осуществления, изобретение относится к способу лечения субъекта, страдающего MPS Iva, или синдромом Моркио A, или MSD, путем введения субъекту терапевтически эффективного количества рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, где рекомбинантная GALNS человека имеет высокий уровень преобразования остатка цистеина в активном центре в Cα-формилглицин (FGly) (т.е. по меньшей мере приблизительно 50%, предпочтительно по меньшей мере приблизительно 70%, более предпочтительно по меньшей мере приблизительно 90%, более предпочтительно по меньшей мере приблизительно 95% преобразования) и высокие уровни фосфорилирования (т.е. более чем приблизительно 0,25, предпочтительно более чем приблизительно 0,5 и более предпочтительно более чем приблизительно 0,75 бис-фосфорилированных олигоманнозных цепей на белковую цепь).
В более предпочтительном варианте осуществления, изобретение относится к способу лечения субъекта, страдающего MPS Iva, или синдромом Моркио A, или MSD, путем введения субъекту терапевтически эффективного количества рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, продуцированной клетками группы комплементации END3, где рекомбинантная GALNS человека имеет высокий уровень преобразования остатков цистеина в активном центре в Cα-формилглицин (FGly) (т.е. по меньшей мере приблизительно 50%, предпочтительно по меньшей мере приблизительно 70%, более предпочтительно по меньшей мере приблизительно 90%, более предпочтительно по меньшей мере приблизительно 95% преобразования) и высокие уровни фосфорилирования (т.е. более чем приблизительно 0,25, предпочтительно более чем 0,5 и более предпочтительно более чем приблизительно 0,75 бис-фосфорилированных олигоманнозных цепей на белковую цепь).
В особенно предпочтительном варианте осуществления, изобретение относится к способу лечения субъекта, страдающего MPS Iva, или синдромом Моркио A, или MSD, путем введения субъекту терапевтически эффективного количества очищенной активной высокофосфорилированной рекомбинантной GALNS человека, которая: (a) имеет чистоту по меньшей мере приблизительно 90% при определении окрашиванием кумасси синим при SDS-PAGE в невосстанавливающих условиях; (b) имеет по меньшей мере приблизительно 90% остатков цистеина в положении 53, преобразованных в Сα-формилглицин (FGly); и (c) является гликозилированной N-связанным гликозилированием по остаткам аспарагина в положениях 178 и 397, где по меньшей мере приблизительно 50% олигоманнозных цепей, связанных с остатком аспарагина в положении 178, являются бис-фосфорилированными. Очищенная активная высокофосфорилированная рекомбинантная GALNS человека имеет основную полосу на уровне приблизительно 55-60 кДа (т.е. предшественник GALNS человека, составляющий по меньшей мере приблизительно 75%, предпочтительно по меньшей мере приблизительно 85%, более предпочтительно по меньшей мере приблизительно 90% и более предпочтительно по меньшей мере приблизительно 95% видимых белков) и второстепенные полосы на уровне ~39 кДа и ~19 кДа (т.е. зрелая или процессированная GALNS человека, составляющая менее чем приблизительно 25%, предпочтительно менее чем приблизительно 15%, более предпочтительно менее чем приблизительно 10% и еще более предпочтительно менее чем приблизительно 5% видимых белков) при SDS-PAGE в восстанавливающих условиях. В особенно предпочтительном варианте осуществления, очищенная активная высокофосфорилированная рекомбинантная GALNS человека имеет по существу одну полосу на уровне приблизительно 55-60 кДа (т.е. предшественник GALNS человека) при SDS-PAGE в восстанавливающих условиях.
В некоторых вариантах осуществления, субъект страдает MPS Iva, или синдромом Моркио A. В некоторых вариантах осуществления, субъект страдает MSD.
Также предусматривается соответствующее применение активных высокофосфорилированных лизосомальных ферментов сульфатаз по изобретению, которые предпочтительно продуцируют способами по изобретению, для изготовления лекарственного средства для лечения лизосомальных болезней накопления, описанных выше.
В седьмом аспекте, настоящее изобретение относится к фармацевтическим композициям, содержащим активный высокофосфорилированный рекомбинантный лизосомальный фермент сульфатазу человека, как описано в настоящем документе выше, который пригоден для лечения заболеваний, вызываемых полностью или частично дефицитом такого лизосомального фермента сульфатазы или ассоциированных с ним, и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. В предпочтительном варианте осуществления, фармацевтическая композиция содержит активную высокофосфорилированную рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека или ее биологически активный фрагмент, мутант, вариант или производное, продуцированные способами по изобретению, и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. Такие фармацевтические композиции могут быть пригодны для введения различными путями, такими как интратекальное, парентеральное, местное, интраназальное, ингаляционное или пероральное введение. В предпочтительном варианте осуществления, фармацевтические композиции пригодны для парентерального введения. В объеме этого аспекта находятся варианты осуществления, относящиеся к последовательностям нуклеиновых кислот, кодирующим полноразмерные лизосомальные ферменты сульфатазы или их фрагменты, мутанты, варианты или производные, которые можно вводить in vivo в клетки, пораженные дефицитом лизосомальных ферментов.
В другом аспекте изобретение относится к способу детекции активности лизосомального фермента сульфатазы, включающему (a) культивирование клеток хондроцитов от пациента, страдающего дефицитом лизосомального фермента сульфатазы, например пациента, страдающего синдромом Моркио, в условиях, которые обеспечивают поддержание дифференцировки хондроцитов; (b) контактирование хондроцитов с лизосомальным ферментом сульфатазой, который разрушает кератансульфат; и (c) детекцию уровней кератансульфата в клетках, где сниженный уровень кератансульфата в клетках, которые подвергали контактированию с лизосомальным ферментом сульфатазой, по сравнению с клетками, которые не подвергали контактированию с лизосомальным ферментом сульфатазой, указывает на активность лизосомального фермента сульфатазы. В некоторых вариантах осуществления, лизосомальный фермент сульфатаза представляет собой N-ацетилгалактозамин-6-сульфатазу (GALNS). В некоторых вариантах осуществления, культивирование проводят в среде, содержащей фактор роста инсулина 1 (IGF1), трансформирующий фактор роста-бета (TGF-β), трансферрин, инсулин и аскорбиновую кислоту. В некоторых вариантах осуществления, детекцию каратансульфата проводят с помощью конфокальной микроскопии или посредством связывания с антителом против кератансульфата. Способ можно проводить с любым лизосомальным ферментом сульфатазой, включая встречающийся в природе или рекомбинантный фермент человека, или его фрагменты или варианты, включая варианты, содержащие аминокислотную последовательность, по меньшей мере на 80%, 85%, 90%, 95% или 100% идентичную предшественнику фермента человека, без сигнальной последовательности, или его зрелой форме.
В другом аспекте, изобретение относится к клеточному анализу для измерения активности рекомбинантного лизосомального фермента человека в отношении деградации природных субстратов. Способ включает (a) культивирование выделенной клетки человека с дефицитом лизосомального фермента в условиях, в которых накапливаются природные субстраты лизосомального фермента; (b) контактирование клетки с лизосомальным ферментом; (c) лизис клетки; (d) добавление к клетке лизата фермента, который (i) является специфичным к природным субстратам, (ii) отщепляет небольшие олигосахариды от природных субстратов; (e) мечение небольших олигосахаридов поддающейся детекции группой; (f) необязательно разделение меченых небольших олигосахаридов; (g) детекцию меченых небольших олигосахаридов; (h) определение активности лизосомального фермента в отношении деградации природных субстратов путем сравнения (i) количества меченого небольшого олигосахарида из клеток, которые подвергали контактированию с лизосомальным ферментом, и (ii) количества меченых небольших олигосахаридов из клеток, которые не подвергали контактированию лизосомального фермента, где снижение (h)(i) по сравнению с (h)(ii) указывает на активность лизосомального фермента в отношении деградации природных субстратов. В одном варианте осуществления, небольшой олигосахарид представляет собой моно-, ди- или трисахарид. В родственных вариантах осуществления, небольшой олигосахарид представляет собой дисахарид. В некоторых вариантах осуществления, лизосомальный фермент выбран из группы, состоящей из арилсульфатазы B (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH), N-ацетилглюкозамин-сульфатазы (G6S) и N-ацетилгалактозамин-6-сульфатазы (GALNS). В некоторых вариантах осуществления, лизосомальный фермент представляет собой α-L-идуронидазу (IDU). В некоторых вариантах осуществления, лизосомальный фермент представляет собой кислую α-глюкозидазу (GAA). В некоторых вариантах осуществления, лизосомальный фермент представляет собой β-глюкуронидазу (GUSB). В некоторых вариантах осуществления, лизосомальный фермент представляет собой β-галактозидазу (GLB1).
Пригодные клетки человека, которые можно использовать в клеточном анализе, включают любую клетку человека, которая является дефицитной по лизосомальному ферменту, подлежащему тестированию, так чтобы она могла накапливать природные субстраты для лизосомального фермента. Например, можно использовать клетки, естественным образом проявляющие полный (100%) или частичный дефицит активности, например 30%, 50%, 70%, 80%, 90%, 95% снижение активности или более. Можно использовать клетки, экспрессирующие мутантный фермент со сниженной активностью, или клетки от пациентов, страдающих лизосомальной болезнью накопления, например мукополисахаридозом. Можно использовать клетки, рекомбинантно измененные для нокаута или снижения активности лизосомального фермента, например, путем внесения мутации в кодирующий ген, или его промотор, или другую регуляторную область. Можно использовать клетки, обработанные для снижения активности лизосомального фермента, например обработанные антисмысловой РНК или RNAi для индукции экспрессии фермента.
Специалисты в данной области могут выбрать пригодные ферменты, которые отщепляют (гидролизуют) небольшие олигосахариды от углеводов и которые являются "специфичными к" (т.е. преимущественно гидролизуют) природным субстратам лизосомального фермента. Например, для детекции активности GALNS или GLB1 (ферменты, которые разрушают кератансульфат) фермент стадии (d) может представлять собой каратаназу II или любой фермент, который преимущественно действует на кератансульфат. В качестве другого примера, для детекции IDU, ARSB, IDS или GUSB (ферменты, которые разрушают дерматансульфат) фермент стадии (d) может представлять собой хондроитиназу ABC или любой фермент, который действует преимущественно на дерматансульфат. В качестве другого примера, для детекции IDU, IDS, SGHS, G6S или GUSB (ферменты, которые разрушают гепарансульфат) фермент стадии (d) может представлять собой гепараназу I, или гепараназу II, или оба из них. В качестве другого примера, для детекции GAA (фермент, который разрушает гликоген) фермент стадии (d) может представлять собой α-амилазу или любой фермент, который преимущественно действует на гликоген.
Этот клеточный способ способен с высокой чувствительностью определять активность лизосомального фермента. В некоторых вариантах осуществления, активность лизосомального фермента определяется, когда концентрация лизосомального фермента составляет только приблизительно 10 нМ, или приблизительно 5 нМ, или приблизительно 1 нМ, или приблизительно 0,75 нМ, или приблизительно 0,5 нМ, или приблизительно 0,25 нМ, или приблизительно 0,1 нМ, или приблизительно 0,05 нМ, или приблизительно 0,01 нМ, или приблизительно 0,005 нМ, или приблизительно 1 пМ, или приблизительно 0,5 пМ.
Другие признаки и преимущества изобретения будут очевидны из представленного ниже подробного описания. Однако следует понимать, что подробное описание и конкретные примеры, хотя и указывают на предпочтительные варианты осуществления изобретения, приведены только для иллюстрации, поскольку различные изменения и модификации, относящиеся к сущности и объему изобретения, будут очевидны специалистам в данной области из этого подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 представлена нуклеотидная последовательность модифицирующего сульфатазу фактора 1 (SUMF1) человека (SEQ ID NO:1).
На фигуре 2 представлена аминокислотная последовательность модифицирующего сульфатазу фактора 1 (SUMF1) человека (SEQ ID NO:2).
На фигуре 3 представлена нуклеотидная последовательность N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (SEQ ID NO:3).
На фигуре 4 представлена аминокислотная последовательность N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (SEQ ID NO:4). В процессированной GALNS отсутствует сигнальный пептид из 26 аминокислот на N-конце.
На фигуре 5 представлена структура и характеристики процессированной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (SEQ ID NO: 5).
На фигуре 6 представлена экспрессия N-ацетилгалактозамин-6-сульфатазы (GALNS) человека из клеток G71S, котрансфицированных экспрессирующими векторами для модифицирующего сульфатазу фактора 1 (SUMF1) человека и GALNS человека. (A) Скрининг клона G71S в отношении активной GALNS в 96-луночных планшетах. (B) Продуктивность клона G71S в отношении GALNS в пикограммах на клетку в сутки.
На фигуре 7 представлена схема биореакторного контроллера WAVE, использованного для крупномасштабной продукции клеток G71S, экспрессирующих N-ацетилгалактозамин-6-сульфатазу (GALNS) человека и ее варианты.
На фигуре 8 представлена стабильность очищенного фермента N-ацетилгалактозамин-6-сульфатазы (GALNS) человека при хранении при 4°С (ромбы) или при -70°С (треугольники).
На фигуре 9 представлена очистка N-ацетилгалактозамин-6-сульфатазы (GALNS) человека с помощью (A) хроматографии с Blue Sepharose 6 Fast Flow с последующей (B) хроматографией с Fractogel SE Hi-CAP. Чистоту определяют окрашиванием кумасси синим в SDS-PAGE (слева) и посредством вестерн-блоттинга с использованием антитела против GALNS (IVA) (справа).
На фигуре 10 представлена очистка N-ацетилгалактозамин-6-сульфатазы (GALNS) человека ультрафильтрацией/диафильтрацией (UF/DF), хроматографией с Fractogel SE Hi-Cap, хроматографией с Zn-хелатирующей Sepharose и хроматографией с ToyoPearl Butyl 650M. Чистоту определяют окрашиванием кумасси синим в SDS-PAGE (сверху слева) и посредством вестерн-блоттинга с использованием антитела против GALNS (сверху справа), антитела против катепсина L (снизу слева) и антитела против CHOP (белки клетки яичника китайского хомяка) (снизу справа).
На фигуре 11 показано, что в обработанных IDU клетках GM01391 наблюдали дозозависимое снижение количества субстрата дерматансульфата.
На фигуре 12 показано, что в обработанных ARSB клетках GM00519 наблюдали дозозависимое снижение количества субстрата дерматансульфата.
На фигуре 13 представлен захват N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, либо немеченой (круги), либо конъюгированной с A488 (квадраты) или A555 (треугольники), культивируемыми синовиоцитами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к открытию способа, который удовлетворяет необходимость в крупномасштабном изготовлении рекомбинантных лизосомальных ферментов сульфатаз, требующем продукта в виде активного высокофосфорилированного лизосомального фермента сульфатазы, который является эффективным для нацеливания на лизосомы и, таким образом, является терапевтически эффективным.
Терапевтическая эффективность препарата лизосомального фермента зависит от уровня манноза-6-фосфата в препарате. Фосфат добавляется к гликопротеину-мишени путем посттрансляционной модификации в эндоплазматической сети и раннем аппарате Гольджи. Свернутые лизосомальные ферменты обладают уникальной третичной структурой детерминанты, которая распознается ферментом модификации олигосахаридом. Детерминанта состоит из ряда определенным образом расположенных остатков лизина, и она обнаружена на большинстве лизосомальных ферментов несмотря на отсутствие гомологии первичной последовательности. Модифицирующий фермент, UDP-GlcNAc фосфотрансфераза, связывается с белковой детерминантой и добавляет GlcNAc-1-фосфат к 6-положению концевых остатков маннозы на олигосахаридах вблизи участка связывания; затем второй фермент, фосфодиэфир-α-GlcNAcase, расщепляет GlcNAc-фосфатную связь с образованием манноза-6-фосфатного концевого олигосахарида (Canfield et al., патент США No. 6537785). Целью модификации манноза-6-фосфатом является отклонение лизосомальных ферментов от секреторного каскада на лизосомальный каскад в клетке. Фермент, несущий манноза-6-фосфат, связывается MPR в транс-аппарате Гольджи и направляется в лизосому вместо клеточной поверхности.
В дополнение к наличию манноза-6-фосфатного маркера на олигосахаридах лизосомальных ферментов, направление ферментов в лизосомы зависит от закисления транспортирующихся эндосом, выходящих из конца стопки транс-аппарата Гольджи. Химическое гашение кислого окружения в этих эндосомах диффундирующими основными молекулами приводит к выходу содержимого везикул, включая лизосомальные ферменты, во внеклеточную среду (Braulke et al., Eur. J. Cell Biol. 43(3): 316-321, 1987). Закисление требует специфичной вакуолярной ATPазы, покруженной в мембрану эндосомы (Nishi et al., Nat. Rev. Mol. Cell Biol. 3(2): 94-103, 2002). Нехватка этой ATPазы, как ожидается, может усилить секрецию лизосомальных ферментов вместо направления в лизосомы. Можно ожидать, что производство клеточных линий, которые обладают дефектами в вакуолярной ATPазе, может предотвратить непродуктивное отклонение фосфорилированного рекомбинантного фермента во внутриклеточный лизосомальный компартмент.
В 1984 году были получены и охарактеризованы мутанты клеток яичника китайского хомяка (CHO), дефектные по эндосомальному закислению (Park et al., Somat. Cell Mol. Genet. 17(2): 137-150, 1991). Клетки CHO-K1 подвергали химическому мутагенезу и отбирали по выживаемости при повышенных температурах в присутствии токсинов. Эти токсины требовали эндосомального закисления для полного проявления их летальности (Marnell et al., J. Cell. Biol. 99(6): 1907-1916, 1984). В предыдущем исследовании, выбирали комбинации из двух токсинов с различными механизмами действия, чтобы избежать токсин-специфической устойчивости. Принцип состоит в том, что хотя вероятность случайных мутаций, которые приводят к устойчивости к одному конкретному токсину, является очень небольшой, вероятность двух одновременных случайных мутаций, специфичных к двум полностью отличающимся токсинам, является несуществующей. Селекцию проводили при повышенной температуре для того, чтобы позволить чувствительные к температуре мутации. Этот генетический скрининг привел к двум мутантам, один из которых был обозначен как G.7.1 (G71), которые были устойчивыми к токсинам при повышенных температурах. Повреждение в G71 не было следствием захвата или механизма действия двух токсинов, а было следствием неспособности клона закислять эндосомы при повышенных температурах. Эта неспособность была также очевидна при пермиссивных температурах (34°C), хотя и в меньшей степени. Также было выявлено, что клетки G71 являются ауксотрофными в отношении железа при повышенных температурах несмотря на нормальный захват трансферрина из среды (Timchak et al., J. Biol. Chem. 261(30): 14154-14159, 1986). Поскольку железо высвобождалось из трансферрина только при низком pH, ауксотрофность по железу несмотря на нормальный захват трансферрина указывала на отсутствие эндосомального закисления. В другом исследовании было показано, что дефект закисления проявлялся, главным образом, в эндосомах, а не в лизосомах (Stone et al., J. Biol. Chem. 262(20): 9883-9886, 1987). Данные, касающиеся G71, согласовывались с заключением, что мутация привела к дестабилизации вакуолярной ATPазы, ответственной за эндосомальное закисление. Дестабилизация была наиболее очевидной при повышенных температурах (39,5°C), но частично проявлялась даже при более низких температурах (34°C). Исследование транспорта двух эндогенных лизосомальных ферментов, катепсина D и альфа-глюкозидазы, в клетках G71 (Park et al., Somat. Cell Mol. Genet. 17(2): 137-150, 1991) показало, что оба фермента в выявляемых количествах секретировались при повышенных температурах, и гликозилирование ферментов не было изменено. Секреция фосфорилированной кислой альфа-глюкозидазы была значительно повышена при непермиссивных температурах.
Терапевтическая эффективность препарата лизосомального фермента сульфатазы зависит не только от уровня манноза-6-фосфата, но также она зависит от присутствия активного фермента в этом препарате. Все известные сульфатазы содержат остаток цистеина в их каталитическом центре; этот остаток цистеина посттрансляционно модифицируется в Cα-формилглицин (FGly) для активации фермента. Эта посттрансляционная активация фермента, которая катализируется модифицирующим сульфатазу фактором 1 (SUMF1), происходит в эндоплазматической сети на несвернутых сульфатазах сразу после трансляции, перед нацеливанием сульфатаз в лизосому (Dierks et al., Proc. Natl. Acad. Sci. USA 94:11963-11968, 1997). На важность этой уникальной посттрансляционной модификации указывает то, что мутации в SUMF1, которые приводят к нарушению образования FGly в лизосомальных ферментах сульфатазах, приводят к множественной сульфатазной недостаточности (MSD) у людей (Diez-Ruiz et al., Annu. Rev. Genomics Hum. Genet. 6:355-379, 2005).
Таким образом, способность клеток G71 - мутантных клеток CHO, которые являются дефектными по эндосомальному закислению, коэкспрессировать рекомбинантный модифицирующий сульфатазу фермент (SUMF1) человека и лизосомальный фермент сульфатазу человека обеспечивает механизм для крупномасштабной продукции активных высокофосфорилированных рекомбинантных лизосомальных ферментов сульфатаз человека, пригодных для управления течением лизосомальных болезней накопления, вызванных дефицитом таких лизосомальных ферментов сульфатаз или ассоциированных с ним.
I ОПРЕДЕЛЕНИЯ
Если не определено иначе, все технические и научные термины, используемые в настоящем документе, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится это изобретение. В представленных ниже ссылках предоставлены для специалистов в данной области общие определения многих терминов, используемых для этого изобретения: Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY (2d ed. 1994); THE CAMBRIDGE DICTIONARY OF SCIENCE AND TECHNOLOGY (Walker ed., 1988); THE GLOSSARY OF GENETICS, 5TH ED., R. Rieger et al. (eds.), Springer Verlag (1991); и Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY (1991).
Каждая публикация, патентная заявка, патент и другая ссылка, цитированная в настоящем документе, включены в настоящий документ в качестве ссылок в полном объеме в той степени, чтобы они не противоречили настоящему описанию.
Следует отметить, что, как используют в этом описании и прилагаемой формуле изобретения, форма единственного числа включает форму множественного числа, если контекст явно не указывает на иное.
Как используют в настоящем документе, представленные ниже термины имеют приписываемые им значения, если не указано иное.
"Аллельный вариант" относится к любой из двух или более полиморфных форм гена, занимающих один и тот же генетический локус. Аллельные варианты возникают в природе путем мутации и могут приводить к фенотипическому полиморфизму в популяциях. Мутации в генах могут быть молчащими (т.е. без изменения в кодируемом полипептиде), или они могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. "Аллельные варианты" также относятся к кДНК, происходящим из мРНК-транскриптов генетических аллельных вариантов, а также к белкам, кодируемым ими.
"Амплификация" относится к любому способу, с помощью которого полинуклеотидная последовательность копируется и, таким образом, размножается в большее число полинуклеотидных молекул, например, путем обратной транскрипции, полимеразной цепной реакции и лигазной цепной реакции.
Первая последовательность представляет собой "антисмысловую последовательность" в отношении второй последовательности, если полинуклеотид, последовательность которого представляет собой первую последовательность, специфично гибридизуется с полинуклеотидом, последовательность которого представляет собой вторую последовательность.
"кДНК" относится к ДНК, которая комплементарна или идентична мРНК, либо в одноцепочечной, либо в двухцепочечной форме.
Для описания полинуклеотидных последовательностей в настоящем документе используют общепринятые обозначения: левый конец одноцепочечной полинуклеотидной последовательности представляет собой 5'-конец; левое направление двухцепочечной полинуклеотидной последовательности называют 5'-направлением. Направление добавления нуклеотидов к образующимся РНК-транскриптам от 5' к 3' называют направлением транскрипции. Цепь ДНК, имеющую ту же последовательность, что и мРНК, называют "кодирующей цепью"; последовательности на цепи ДНК, имеющие ту же последовательность, что и мРНК, транскрибированная с этой ДНК, и расположенные с 5'-стороны от 5'-конца РНК-транскрипта, называют "вышерасположенными последовательностями"; последовательности на цепи ДНК, имеющие ту же последовательность, что и РНК, и расположенные с 3'-стороны от 3'-конца кодирующего РНК-транскрипта, называют "нижерасположенными последовательностями".
"Комплементарный" относится к топологической совместимости или соответствию взаимодействующих поверхностей двух полинуклеотидов. Таким образом, две молекулы могут быть описаны как комплементарные, и более того, свойством поверхностей их контакта является то, что они комплементарны друг другу. Первый полинуклеотид комплементарен второму полинуклеотиду, если нуклеотидная последовательность первого полинуклеотида идентична нуклеотидной последовательности полинуклеотид-связывающего партнера второго полинуклеотида. Таким образом, полинуклеотид с последовательностью 5'-TATAC-3' комплементарен полинуклеотиду с последовательностью 5'-GTATA-3'. Нуклеотидная последовательность "по существу комплементарна" эталонной нуклеотидной последовательности, если последовательность, комплементарная рассматриваемой нуклеотидной последовательности, по существу идентична эталонной нуклеотидной последовательности.
"Консервативная замена" относится к замене в полипептиде аминокислоты функционально сходной аминокислотой. Каждая из представленных ниже шести групп содержит аминокислоты, которые являются консервативными заменами друг для друга:
1) аланин (A), серин (S), треонин (T);
2) аспарагиновая кислота (D), глутаминовая кислота (E);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (K);
5) изолейцин (I), лейцин (L), метионин (M), валин (V);
6) фенилаланин (F), тирозин (Y), триптофан (W).
Термин "фрагмент", когда его используют в отношении полипептидов, относится к полипептидам, которые являются более короткими, чем полноразмерный полипептид, вследствие укорочения либо на N-конце, либо на C-конце белка или на обоих из них и/или вследствие делеции внутренней части или области белка. Фрагменты полипептида можно получать способами, известными в данной области.
Термин "мутант", когда его используют в отношении полипептидов, относится к полипептидам, в которых одна или несколько аминокислот белка заменены отличающейся аминокислотой. Аминокислотная замена может представлять собой консервативную замену, как определено выше, или она может представлять собой неконсервативную замену. Мутантные полипептиды можно получать способами, известными в данной области.
Термин "производное", когда его используют в отношении полипептидов, относится к полипептидам, химически модифицированным такими способами, как, например, но не ограничиваясь ими, убиквитинилирование, мечение (например, радионуклидами или различными ферментами), ковалентное присоединение полимера, такое как пегилирование (т.е. образование производного с полиэтиленгликолем) и встраивание или замена путем химического синтеза аминокислот, таких как орнитин, которые в норме не встречаются в белках человека. Производные полипептидов можно получать способами, известными в данной области.
Термин "производное", когда его используют в отношении клеточных линий, относится к клеточным линиям, которые являются потомками родительской клеточной линии; например, этот термин включает клетки, которые пассировали или субклонировали из родительских клеток и которые сохраняют требуемое свойство потомков родительской клеточной линии, которые были подвергнуты мутации и отобраны по сохранению желаемого свойства, и потомков родительской клеточной линии, которые были изменены, чтобы они содержали различные экспрессирующие векторы или различные экзогенно добавленные нуклеиновые кислоты.
"Детекция" относится к определению наличия, отсутствия или количества анализируемого компонента в образце, и она может включать определение количества анализируемого компонента в образце или на клетку в образце.
"Поддающаяся детекции группа" или "метка" относится к композиции, поддающейся детекции спектроскопическими, фотохимическими, биохимическими, иммунохимическими или химическими способами. Например, пригодные метки включают 32P, 35S, флуоресцентные красители, электроноплотные реагенты, ферменты (например, как обычно используют в ELISA), биотин-стрептавидин, диоксигенин, гаптены и белки, для которых доступны антисыворотки, или моноклональные антитела, или молекулы нуклеиновых кислот с последовательностью, комплементарной мишени. Поддающаяся детекции группа часто дает поддающийся измерению сигнал, такой как радиоактивный, хромогенный или флуоресцентный сигнал, который можно использовать для определения количества связанной поддающейся детекции группы в образце. Поддающуюся детекции группу можно включать в праймер или зонд или присоединять к ним либо ковалентно, либо посредством ионных, ван-дер-ваальсовых или водородных связей, например, можно включать нуклеотиды или биотинилированные нуклеотиды, которые распознаются стрептавидином. Поддающаяся детекции группа может поддаваться детекции прямо или непрямо. Непрямая детекция может вовлекать связывание с поддающейся детекцией группой второй поддающейся прямой или непрямой детекции группы. Например, поддающаяся детекции группа может представлять собой лиганд партнера по связыванию, такого как биотин, который представляет собой партнер по связыванию для стрептавидина, или нуклеотидную последовательность, которая является партнером по связыванию для комплементарной последовательности, с которой она может специфично гибридизоваться. Партнер по связыванию сам может поддаваться прямой детекции, например, антитело само может быть мечено флуоресцентной молекулой. Партнер по связыванию также может непрямо поддаваться детекции, например, нуклеиновая кислота, имеющая комплементарную нуклеотидную последовательность, может быть частью разветвленной молекулы ДНК, которая, в свою очередь, поддается детекции посредством гибридизации с другими мечеными молекулами нуклеиновых кислот (см., например, Fahrlander et al., Bio/Technology 6:1165, 1988). Количественное определение сигнала проводят, например, путем сцинтилляционного подсчета, денситометрии или проточной цитометрии.
"Диагностика" означает выявление наличия или определение характера патологического состояния. Диагностические способы отличаются их специфичностью и селективностью. Хотя конкретный диагностический способ может не обеспечить окончательного диагноза состояния, достаточно, чтобы способ обеспечивал положительный признак, который способствует диагностике.
Термин "эффективное количество" означает дозировку, достаточную для обеспечения желательного эффекта на состояние здоровья, патологию и заболевание субъекта или для диагностической цели. Желательный результат может включать субъективное или объективное улучшение у реципиента дозировки. "Терапевтически эффективное количество" относится к количеству средства, эффективному для оказания определенного благоприятного эффекта на здоровье.
"Кодирующий" относится к свойству, присущему определенным последовательностям нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, выступать в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах, имеющих либо определенную последовательность нуклеотидов (т.е. рРНК, тРНК и мРНК), либо определенную последовательность аминокислот и биологические свойства, вытекающие из них. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, образующейся с этого гена, приводит к образованию белка в клетке или другой биологической системе. Как кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно предоставляется в списках последовательностей, так и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут быть указаны в качестве кодирующих белок или другой продукт этого гена или кДНК. Если нет иных указаний, "нуклеотидная последовательность, кодирующая аминокислотную последовательность", включает все нуклеотидные последовательности, которые являются вырожденными вариантами друг друга и которые кодируют одну и ту же аминокислотную последовательность. Нуклеотидные последовательности, которые кодируют белки и РНК, могут включать интроны.
"Эквивалентная доза" относится к дозе, которая содержит равное количество активного средства.
"Последовательность контроля экспрессии" относится к нуклеотидной последовательности в полинуклеотиде, которая регулирует экспрессию (транскрипцию и/или трансляцию) нуклеотидной последовательности, функционально с ней связанной. "Функционально связанный" относится к функциональной взаимосвязи между двумя частями, в которых активность одной части (например, способность регулировать транскрипцию) приводит к действию на другую часть (например, транскрипции последовательности). Последовательности контроля экспрессии могут включать, например, не ограничиваясь этим, последовательности промоторов (например, индуцибельные или конститутивные), энхансеров, терминаторов транскрипции, инициирующий кодон (т.е. ATG), сигналы сплайсинга для интронов и стоп-кодоны.
"Экспрессирующий вектор" относится к вектору, содержащему рекомбинантный полинуклеотид, содержащий последовательности контроля экспрессии, функционально связанные с нуклеотидной последовательностью, подлежащей экспрессии. Экспрессирующий вектор содержит достаточное количество цис-регуляторных элементов для экспрессии; другие элементы для экспрессии могут быть предоставлены клеткой-хозяином или экспрессирующей системой in vitro. Экспрессирующие векторы включают все векторы, известные в данной области, такие как космиды, плазмиды (например, простые или находящиеся в липосомах) и вирусы, которые включают рекомбинантный полинуклеотид.
Выражения "высокофосфорилированный", "высокий уровень фосфорилирования" и "высокий уровень фосфорилированных олигосахаридов" относятся к препаратам лизосомальных ферментов сульфатаз, в которых по меньшей мере 50% лизосомального фермента сульфатазы связывается с катион-независимым рецептором манноза-6-фосфата через фосфорилированные олигосахариды. Связывание, кроме того, характеризуется подверженностью конкуренции с манноза-6-фосфатом. Высокофосфорилированный лизосомальный фермент сульфатаза также может относиться к лизосомальному ферменту сульфатазе с по меньшей мере 0,25, предпочтительно по меньшей мере 0,5 и более предпочтительно по меньшей мере 0,75 бис-фосфорилированных олигоманнозных цепей на белковую цепь.
Термин "бис-фосфорилированные олигоманнозные цепи", как используют в настоящем документе, относится к содержащим маннозу олигосахаридным цепям, которые являются N-связанными с остатками аспарагина в лизосомальных ферментах сульфатазах и содержат два остатка манноза-6-фосфата. Как правило, бис-фосфорилированные олигоманнозные цепи имеют 7 остатков маннозы, т.е. бис-фосфатманноза 7 (BPM7), которые связаны с двумя остатками GlcNAc, которые, в свою очередь, связаны с остатком аспарагина в лизосомальном ферменте сульфатазе.
Термины "активный", "активированный" и "высокий уровень активации" относятся к препаратам лизосомальных ферментов сульфатаз, в которых по меньшей мере 50%, предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 90% и еще более предпочтительно по меньшей мере 95% остатка цистеина активного центра белка посттрансляционно модифицированы в Cα-формилглицин (FGly).
"Активный высокофосфорилированный" относится к препаратам лизосомальных ферментов сульфатаз, в которых по меньшей мере 50%, предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 90% и еще более предпочтительно по меньшей мере 95% остатка цистеина активного центра белка посттрансляционно модифицированы в Cα-формилглицин (FGly) и с по меньшей мере 0,25, предпочтительно по меньшей мере 0,5 и более предпочтительно по меньшей мере 0,75 бис-фосфорилированных олигоманнозных цепей на белковую цепь.
Термин "биологически активный" относится к полипептиду (т.е. ферменту) фрагментам, мутантам, вариантам или их производным, которые сохраняют по меньшей мере значительное количество (например, по меньшей мере приблизительно 50%, предпочтительно по меньшей мере приблизительно 70% и более предпочтительно по меньшей мере приблизительно 90%) одного или нескольких видов биологической активности полноразмерного полипептида. Когда этот термин используют в отношении лизосомального фермента сульфатазы, его биологически активный фрагмент, мутант, вариант или производное сохраняют по меньшей мере значительный уровень активности сульфатазы (т.е. отщепление сульфатных сложных эфиров от их субстратов-мишеней). Когда его используют в отношении модифицирующего сульфатазу фактора 1 (SUMF1), его биологически активный фрагмент, мутант, вариант или производное сохраняет по меньшей мере значительный уровень активности образования формилглицина (т.е. модификации остатка цистеина активного центра лизосомального фермента сульфатазы в Cα-формилглицин (FGly)).
Термин "чистота" или "чистый", когда его используют в отношении полипептидов, относится к количеству полипептида, подвергаемого анализу, по сравнению с любыми загрязняющими веществами, которые можно выявлять с использованием конкретного способа. Для рекомбинантных лизосомальных ферментов сульфатаз по изобретению, "чистоту" можно определить, подвергая препарат фермента сульфатазы электрофоретическому разделению посредством SDS-PAGE в восстанавливающих или невосстанавливающих условиях с последующим окрашиванием кумасси синим или серебром, или посредством хроматографического разделения путем ВЭЖХ (например, обращено-фазовая (ОФ) C4), или посредством любого другого хроматографического разделения, например гель-фильтрации (SEC) и т.п. С использованием этих способов, очищенные рекомбинантные лизосомальные ферменты сульфатазы по изобретению обладают чистотой по меньшей мере приблизительно 80%, предпочтительно по меньшей мере приблизительно 90%, более предпочтительно по меньшей мере приблизительно 95% и еще более предпочтительно по меньшей мере приблизительно 98% или 99%.
Термин "предшественник" или "форма предшественника" относится к форме рекомбинантного лизосомального фермента сульфатазы, которая секретируется из клетки млекопитающего, т.е. лишенной сигнальной последовательности, но которая лишена определенных модификаций, например внутреннего расщепления белков, которое в норме происходит в лизосоме. Термины "зрелый", "зрелая форма", "процессированный" или "процессированная форма" относятся к форме рекомбинантного лизосомального фермента сульфатазы, которая в норме существует в лизосоме. Для рекомбинантных лизосомальных ферментов сульфатаз по изобретению, относительное содержание "предшественника" или "формы предшественника" и "зрелого", "зрелой формы", "процессированного" или "процессированной формы" фермента можно определять, подвергая препарат фермента сульфатазы электрофоретическому разделению посредством SDS-PAGE в восстанавливающих условиях с последующим окрашиванием кумасси синим или серебром, или посредством хроматографического разделения путем ВЭЖХ (например, обращено-фазовая (ОФ) C4) или посредством любого другого хроматографического разделения, например гель-фильтрации (SEC) и т.п. С использованием этих способов, очищенные рекомбинантные лизосомальные ферменты сульфатазы по изобретению состоят из по меньшей мере приблизительно 75%, предпочтительно по меньшей мере приблизительно 85%, более предпочтительно по меньшей мере приблизительно 90% и еще более предпочтительно по меньшей мере приблизительно 95% "предшественника" или "формы предшественника". Альтернативно с использованием этих способов, очищенные рекомбинантные лизосомальные ферменты сульфатазы по изобретению содержат менее чем приблизительно 25%, предпочтительно менее чем приблизительно 15%, более предпочтительно менее чем приблизительно 10% и еще более предпочтительно менее чем приблизительно 5% "зрелого", "зрелой формы", "процессированного" или "процессированной формы" фермента. В некоторых вариантах осуществления, выявляется только "предшественник" или "форма предшественника" (т.е. препарат фермента сульфатазы по существу состоит из одной поддающейся детекции полосы при SDS-PAGE в восстанавливающих условиях или одного пика при анализе ВЭЖХ).
Термины "идентичный" или процентная "идентичность" в контексте двух или более полинуклеотидных или полипептидных последовательностей относятся к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или обладают определенным процентом нуклеотидов или аминокислотных остатков, которые являются одинаковыми, при сравнении и выравнивании на максимальное соответствие, при измерении с использованием одного из представленных ниже алгоритмов сравнения последовательностей или визуальным исследованием.
"Линкер" относится к молекуле, которая связывает две другие молекулы либо ковалентно, либо через ионные, ванн-дер-ваальсовы или водородные связи, например молекулу нуклеиновой кислоты, которая гибридизуется с одной комплементарной последовательностью на 5'-конце и с другой комплементарной последовательностью на 3'-конце, таким образом, соединяя две некомплементарные последовательности.
"Низкий уровень фосфорилирования" или "низкое фосфорилирование" относится к препарату лизосомальных ферментов сульфатаз, в котором половинная максимальная концентрация для захвата в фибробластные клетки составляет менее 10 нМ или фракция лизосомальных ферментов сульфатаз, которая связывается колонкой с рецептором манноза-6-фосфата, составляет менее чем приблизительно 25%.
Термин "встречающийся в природе", применяемый к объекту, относится к тому факту, что объект может быть найден в природе. Например, последовательность полипептида или полинуклеотида, которая присутствует в организме (включая вирусы), которая может быть выделена из источника в природе и которая не является намеренно модифицированной человеком в лаборатории, является встречающейся в природе.
"Фармацевтическая композиция" относится к композиции, пригодной для фармацевтического применения у животного-субъекта, в том числе у людей и млекопитающих. Фармацевтическая композиция содержит фармакологически эффективное количество терапевтического лизосомального фермента сульфатазы, а также она содержит один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. Фармацевтическая композиция охватывает композицию, содержащую активный ингредиент(ы) и инертный ингредиент(ы), которые представляют собой носитель, разбавитель или эксципиент, а также любой продукт, который является следствием, прямо или непрямо, комбинации, образования комплексов или агрегации любых двух или более ингредиентов, или диссоциации одного или нескольких ингредиентов, или других типов реакций или взаимодействий одного или более из ингредиентов. Таким образом, фармацевтические композиции по настоящему изобретению включают любую композицию, изготовленную смешиванием лизосомального фермента сульфатазы по настоящему изобретению и одного или нескольких фармацевтически приемлемых носителей, разбавителей или эксципиентов.
Выражение "фармацевтически приемлемый носитель, разбавитель или эксципиент" относится к любому из стандартных фармацевтических носителей, разбавителей, буферов и эксципиентов, такому как, например, не ограничиваясь ими, фосфатно-солевой буфер, 5% водный раствор декстрозы, и эмульсии, такие как эмульсия типа масло/вода или вода/масло, и различные типы смачивающих веществ и/или адъювантов. Пригодные фармацевтические носители, разбавители или эксципиенты и составы описаны в Remington's Pharmaceutical Sciences, 19th Ed. (Mack Publishing Co., Easton, 1995). Предпочтительные фармацевтические носители, разбавители или эксципиенты зависят от предполагаемого способа введения активного вещества. Типичные способы введения включают, например, не ограничиваясь ими, энтеральную (например, пероральную) или парентеральную (например, подкожную, внутримышечную, внутривенную или внутрибрюшинную) инъекцию или местное, трансдермальное или трансмукозальное введение.
"Фармацевтически приемлемая соль" представляет собой соль, в виде которой можно изготавливать лизосомальный фермент сульфатазу для фармацевтического применения, включая, например, соли металлов (натрий, калий, магний, кальций и т.д.) и соли аммиака или органических аминов.
"Полинуклеотид" относится к полимеру, состоящему из нуклеотидных элементов. Полинуклеотиды включают встречающиеся в природе нуклеиновые кислоты, такие как дезоксирибонуклеиновая кислота ("ДНК") и рибонуклеиновая кислота ("РНК"), а также аналоги нуклеиновых кислот. Аналоги нуклеиновых кислот включают аналоги, которые содержат не встречающиеся в природе основания, нуклеотиды, которые имеют связи с другими нуклеотидами, отличными от встречающейся в природе фосфодиэфирной связи, или которые содержат основания, связанные через связи, отличные от фосфодиэфирных связей. Таким образом, аналоги нуклеотидов включают, например, не ограничиваясь ими, фосфоротиоаты, фосфородитиоаты, фосфоротриэфиры, фосфорамидаты, боранофосфаты, метилфосфонаты, хиральные метилфосфонаты, 2-O-метилрибонуклеотиды, пептидные нуклеиновые кислоты (PNA) и т.п. Такие полинуклеотиды можно синтезировать, например, с использованием автоматизированного устройства для синтеза ДНК. Термин "нуклеиновая кислота", главным образом, относится к крупным полинуклеотидам. Термин "олигонуклеотид", главным образом, относится к коротким полинуклеотидам, как правило, не более чем приблизительно из 50 нуклеотидов. Будет понятно, что когда нуклеотидная последовательность представляет собой последовательность ДНК (т.е. A, T, G, C), она также включает последовательность РНК (т.е. A, U, G, C), в которой "U" заменяет "T".
"Полипептид" относится к полимеру, состоящему из аминокислотных остатков, родственных им встречающихся в природе структурных вариантов и их синтетических не встречающихся в природе аналогов, связанных через пептидные связи. Синтетические полипептиды можно синтезировать, например, с использованием автоматизированного устройства для синтеза полипептидов. Термин "белок", главным образом, относится к крупным полипептидам. Термин "пептид", главным образом, относится к коротким полипептидам. В настоящем документе для описания полипептидных последовательностей используют общепринятое обозначение: левый конец полипептидной последовательности представляет собой N-конец; правый конец полипептидной последовательности представляет собой С-конец.
"Праймер" относится к полинуклеотиду, который способен специфично гибридизоваться с определенной полинуклеотидной матрицей и обеспечивать точку инициации синтеза комплементарного полинуклеотида. Такой синтез происходит, когда полинуклеотидный праймер находится в условиях, в которых индуцируется синтез, т.е. в присутствии нуклеотидов, комплементарных полинуклеотидной матрице, и средства для полимеризации, такого как ДНК-полимераза. Праймер, как правило, является одноцепочечным, однако может быть двухцепочечным. Праймеры, как правило, представляют собой дезоксирибонуклеиновые кислоты, однако для многих применений пригодно широкое множество синтетических и встречающихся в природе праймеров. Праймер комплементарен матрице, для гибридизации с которой он сконструирован, чтобы служить в качестве участка для инициации синтеза, однако он не должен отражать точную последовательность матрицы. В таком случае, специфичная гибридизация праймера с матрицей зависит от строгости условий гибридизации. Праймеры могут быть мечеными, например, хромогенной, радиоактивной или флуоресцентной группами, и их можно использовать в качестве поддающихся детекции групп.
"Зонд", когда его используют в отношении полинуклеотида, относится к полинуклеотиду, который способен специфично гибридизоваться с определенной последовательностью другого полинуклеотида. Зонд специфично гибридизуется с комплементарным полинуклеотидом-мишенью, однако он не должен отражать точную комплементарную последовательность матрицы. В таком случае, специфичная гибридизация зонда с матрицей зависит от строгости условий гибридизации. Зонды могут быть мечены, например, хромогенной, радиоактивной или флуоресцентной группами, и их можно использовать в качестве поддающихся детекции групп.
"Профилактическое" лечение представляет собой лечение, проводимое у субъекта, который не имеет признаков заболевания или имеет только ранние признаки, для снижения риска развивающейся патологии. Соединения по изобретению можно вводить в качестве профилактического лечения для снижения вероятности развития патологии или для минимизации тяжести патологии, если она разовьется.
"Рекомбинантный полинуклеотид" относится к полинуклеотиду, имеющему последовательности, которые не связаны в природе друг с другом. Амплифицированный или собранный рекомбинантный полинуклеотид можно включать в пригодный вектор, и вектор можно использовать для трансформации пригодной клетки-хозяина. Клетку-хозяина, которая содержит рекомбинантный полинуклеотид, называют "рекомбинантной клеткой-хозяином". Затем ген экспрессируется в рекомбинантной клетке-хозяине с образованием, например, "рекомбинантного полипептида". Рекомбинантный полинуклеотид также может выполнять некодирующую функцию (например, промотор, ориджин репликации, участок связывания рибосом).
Выражения "гибридизация специфично с", "специфичная гибридизация" или "селективно гибиридизуется с" относится к связыванию, образованию дуплексов или гибридизации молекулы нуклеиновой кислоты предпочтительно с конкретной нуклеотидной последовательностью в строгих условиях, когда эта последовательность присутствует в комплексной смеси (например, тотальной клеточной) ДНК или РНК.
Термин "строгие условия" относится к условиям, при которых зонд гибридизуется предпочтительно с его последовательностью-мишенью и в меньшей степени гибридизуется, или не гибридизуется, с другими последовательностями. "Строгая гибридизация" и "строгие условия промывания при гибридизации" в контексте экспериментов по гибридизации нуклеиновых кислот, таких как саузерн- и нозерн-гибридизация, являются зависимыми от последовательности и отличаются при различных параметрах окружающей среды. Подробное руководство по гибридизации нуклеиновых кислот можно найти в Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology - Hybridization with Nucleic Acid Probes part I chapter 2 "Overview of principles of hybridization and the strategy of nucleic acid probe assays", Elsevier, New York. Как правило, условия гибридизации высокой строгости и промывания выбирают так, чтобы они были приблизительно на 5°C ниже температуры отжига (Tm) для конкретной последовательности при определенной ионной силе и pH. Tm представляет собой температуру (при определенной ионной силе и pH), при которой 50% последовательности-мишени гибридизуется с точно соответствующим зондом. Условия очень высокой строгости выбирают так, чтобы они были равны Tm для конкретного зонда.
Пример условий гибридизации высокой строгости для гибридизации комплементарных нуклеиновых кислот, которые обладают более чем 100 комплементарных остатков, на фильтре в саузерн- или нозерн-блоте представляет собой 50% формалин с 1 мг гепарина при 42°C, причем гибридизацию проводят в течение ночи. Примером условий промывания высокой строгости являются 0,15 M NaCl при 72°C в течение приблизительно 15 минут. Пример строгих условий промывания является 0,2× SSC при 65°C в течение 15 минут (см. Sambrook et al. для описания буфера SSC). Часто промыванию высокой строгости предшествует промывание низкой строгости для удаления фонового сигнала зонда. Примером промывания средней строгости для дуплекса, например, из более чем 100 нуклеотидов является 1× SSC при 45°C в течение 15 минут. Пример промывания низкой строгости для дуплекса, например, из более чем 100 нуклеотидов является 4-6× SSC при 40°С в течение 15 минут. Как правило, отношение сигнала к шуму, составляющее 2× (или более) относительно отношения, наблюдаемого для неродственного зонда в конкретном анализе гибридизации, указывает на детекцию специфичной гибридизации.
"Субъектом" диагностики или лечения является человек или не являющееся человеком животное, включая млекопитающего или примата.
Выражение "по существу гомологичный" или "по существу идентичный" в контексте двух нуклеиновых кислот или полипептидов, как правило, относится к двум или более последовательностям или подпоследовательностям, которые обладают по меньшей мере 40%, 60%, 80%, 90%, 95%, 96%, 97%, 98% или 99% идентичностью нуклеотидов или аминокислотных остатков, при сравнении и выравнивании на максимальное соответствие и при определении с использованием одного из представленных ниже алгоритмов сравнения последовательностей или визуальным исследованием. Предпочтительно, существенная идентичность существует на протяжении области последовательностей длиной по меньшей мере приблизительно 50 остатков, более предпочтительно на протяжении области из по меньшей мере приблизительно 100 остатков, и наиболее предпочтительно последовательности являются по существу идентичными на протяжении по меньшей мере приблизительно 150 остатков. В наиболее предпочтительном варианте осуществления, последовательности являются по существу идентичными на протяжении всей длины любого или обоих сравниваемых биополимеров.
Для сравнения последовательностей, как правило, одна последовательность действует в качестве эталонной последовательности, с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения последовательностей, тестируемую и эталонную последовательности вводят в компьютер, обозначают координаты субпоследовательностей, если необходимо, и указывают параметры программы с алгоритмом сравнения последовательностей. Затем алгоритм сравнения последовательностей вычисляет процентную идентичность последовательностей для тестируемой последовательности(ей) относительно эталонной последовательности на основании указанных параметров программы.
Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с помощью алгоритма локальной гомологии Smith & Waterman, Adv. Appl. Math. 2:482, 1981, с помощью алгоритма выравнивания по гомологии Needleman & Wunsch, J. Mol. Biol. 48:443, 1970, посредством способа поиска сходства Pearson & Lipman, Proc. Natl. Acad. ScL USA 85:2444, 1988, с помощью компьютеризованных осуществлений этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI) или визуальным исследованием.
Одним из примеров пригодного алгоритма является PILEUP. PILEUP осуществляет множественное выравнивание последовательностей из группы родственных последовательностей с использованием прогрессирующего попарного выравнивания, чтобы показать взаимосвязь и процентную идентичность последовательностей. Он также строит дерево или дендрограмму, показывающие кластерную взаимосвязь, используемую для проведения выравнивания. В PILEUP используется упрощение способа прогрессирующего выравнивания Feng & Doolittle, J. Mol. Evol., 35:351-360, 1987. Используемый способ является сходным со способом, описанным Higgins & Sharp, CABIOS 5:151-153, 1989). Программа может выравнивать вплоть до 300 последовательностей, максимальная длина каждой из которых составляет 5000 нуклеотидов или аминокислот. Процесс множественного выравнивания начинается с попарного выравнивания двух наиболее сходных последовательностей, обеспечивающего кластер из двух выровненных последовательностей. Затем этот кластер выравнивают со следующей наиболее сходной последовательностью или кластером выровненных последовательностей. Два кластера последовательностей выравнивают простым расширением попарного выравнивания двух отдельных последовательностей. Конечное выравнивание проводят с помощью серии прогрессирующих попарных выравниваний. Программу выполняют, указывая определенные последовательности и их аминокислотные или нуклеотидные координаты для областей сравнения последовательностей и указывая параметры программы. Например, эталонную последовательность можно сравнивать с другими тестируемыми последовательностями для определения соотношения процентных идентичностей последовательностей с использованием следующих параметров: штраф за внесение пропуска по умолчанию (3,00), штраф за продолжение пропуска по умолчанию (0,10) и оцениваемые концевые пропуски. Другим алгоритмом, который пригоден для проведения множественных выравниваний последовательностей, является Clustal W (Thompson et al., Nucleic Acids Research 22: 4673-4680, 1994).
Другим примером алгоритма, пригодного для определения процентной идентичности последовательностей и сходства последовательностей, является алгоритм BLAST, который описан в Altschul, et al., J. Mol. Biol., 215: 403-410, 1990. Программное обеспечение для проведения анализов BLAST находится в свободном доступе через National Center for Biotechnology Information. Этот алгоритм включает первичную идентификацию пар последовательностей с максимальным сходством (HSP) посредством идентификации коротких слов с длиной W в представляющей интерес последовательности, которые либо совпадают, либо удовлетворяют некоторому оцениваемому положительно порогу значения T при выравнивании со словом такой же длины в последовательности из базы данных. T определяется как пороговое значение для соседних слов (Altschul, et al., J. Mol. Biol., 215: 403-410, 1990). Эти первоначальные совпадения соседних слов выступают в роли предшественников для начала поиска с целью обнаружения более длинных HSP, содержащих их. Поиск совпадений слов распространяется в обоих направлениях вдоль каждой последовательности до тех пор, пока суммарное значение для выравнивания может возрастать. Суммарные значения вычисляют с использованием, в случае нуклеотидных последовательностей, параметров M (величина компенсации за пару совпавших остатков, всегда >0) и N (величина штрафа за не совпавшие остатки, всегда <0). В случае аминокислотных последовательностей, для вычисления суммарного значения используют оценочную матрицу. Продолжение поиска совпадений слов в каждом направлении останавливается, если: суммарное значение для выравнивания уменьшается по величине X относительно его максимального достигнутого значения; суммарное значение снижается до нуля или ниже вследствие накопления одного или нескольких выровненных остатков с отрицательным значением; достигнут конец любой последовательности. Параметры алгоритма BLAST W, T и X определяют чувствительность и скорость выравнивания. Программа BLASTN (для нуклеотидных последовательностей) использует в качестве параметров по умолчанию длину слова (W) 11, ожидаемое значение (E) 10, M=5, N=-4 и сравнение обеих цепей. В случае аминокислотных последовательностей, программа BLASTP использует в качестве параметров по умолчанию длину слова 3 и ожидаемые значения (E) 10 и оценочную матрицу BLOSUM62 (см. Henikoff & Henikoff, Proc. Natl. Acad. Sci. USA 89:10915, 1989).
В дополнение к вычислению процентной идентичности последовательностей, алгоритм BLAST также осуществляет статистический анализ сходства между двумя последовательностями (см., например, Karlin and Altschul, Proc. Nat'l. Acad. Sci. USA 90:5873-5787, 1993). Одним из параметров сходства, получаемых с помощью алгоритма BLAST, является наименьшая суммарная вероятность (P(N)), которая предполагает указание вероятности, с которой совпадение между двумя нуклеотидными или аминокислотными последовательностями может произойти случайным образом. Например, нуклеиновую кислоту считают сходной с нуклеиновой кислотой эталонной последовательностью, если наименьшая суммарная вероятность при сравнении анализируемой нуклеиновой кислоты с эталонной нуклеиновой кислотой составляет менее чем приблизительно 0,1, менее чем приблизительно 0,01 или менее чем приблизительно 0,001.
Следующим показателем того, что две последовательности нуклеиновых кислот или два полипептида являются по существу идентичными, является то, что полипептид, кодируемый первой нуклеиновой кислотой, иммунологически перекрестно реагирует с полипептидом, кодируемым второй нуклеиновой кислотой, как описано ниже. Таким образом, полипептид, как правило, по существу идентичен второму полипептиду, например, где два пептида отличаются только консервативными заменами. Другим показателем того, что две последовательности нуклеиновых кислот являются по существу идентичными, является то, что две молекулы гибридизуются друг с другом в строгих условиях, как описано в настоящем документе.
"По существу чистый" или "выделенный" означает, что рассматриваемый компонент является преобладающим присутствующим компонентом (т.е. на молярной основе он является более распространенным, чем любой другой отдельный макромолекулярный компонент в композиции), и по существу очищенная фракция представляет собой композицию, где рассматриваемый компонент содержит по меньшей мере приблизительно 50% (на молярной основе) всех присутствующих макромолекулярных продуктов. Как правило, по существу чистая композиция означает, что приблизительно от 80% до 90% или более макромолекулярных компонентов, присутствующих в композиции, представляют собой представляющий интерес очищенный компонент. Рассматриваемый компонент очищают по существу до гомогенного состояния (загрязняющие компоненты не могут быть выявлены в композиции общепринятыми способами детекции), если композиция состоит по существу из одного макромолекулярного продукта. Для этого определения, различные растворители, низкомолекулярные соединения (<500 дальтон), стабилизаторы (например, BSA) и частицы элементных ионов не считают макромолекулярными компонентами. В некоторых вариантах осуществления, лизосомальные ферменты сульфатазы по изобретению являются по существу чистыми или выделенными. В некоторых вариантах осуществления, лизосомальные ферменты сульфатазы по изобретению являются по существу чистыми или выделенными в отношении макромолекулярных исходных материалов, используемых для их синтеза. В некоторых вариантах осуществления, фармацевтическая композиция по изобретению содержит по существу очищенный или выделенный терапевтический лизосомальный фермент сульфатазу, смешанную с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами.
"Терапевтическое" лечение представляет собой лечение, проводимое у субъекта, который имеет признаки или симптомы патологии, для снижения или устранения этих признаков или симптомов. Признаки или симптомы могут быть биохимическими, клеточными, гистологическими, функциональными, субъективными или объективными. Лизосомальные ферменты сульфатазы по изобретению можно вводить в качестве медикаментозного лечения или для диагностики.
"Терапевтический индекс" относится к диапазону дозировок (количественному и/или временному) выше минимального терапевтического количества и ниже неприемлемого токсического количества.
"Лечение" относится к профилактическому лечению, или терапевтическому лечению, или диагностическому лечению.
Термин "единичная дозированная форма", как используют в настоящем документе, относится к физически дискретным единицам, пригодным в качестве однократных дозировок для субъектов-людей или животных, причем каждый элемент содержит заданное количество лизосомального фермента сульфатазы по настоящему изобретению, вычисленное так, чтобы оно было достаточным для оказания желательного эффекта, вместе с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами. Характеристики новых единичных дозированных форм по настоящему изобретению зависят от конкретного используемого лизосомального фермента сульфатазы и эффекта, подлежащего достижению, и фармакодинамики, ассоциированной с каждым лизосомальным ферментом сульфатазой у хозяина.
II ПРОДУКЦИЯ ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ СУЛЬФАТАЗ
В одном аспекте настоящее изобретение относится к новому способу продукции активных высокофосфорилированных лизосомальных ферментов сульфатаз в количествах, которые позволяют применение таких ферментов. Как правило, способ включает трансформацию пригодной клеточной линии кДНК, кодирующей модифицирующий сульфатазу фактор 1 (SUMF1) человека или его биологически активный фрагмент, мутант, вариант или производное, и кДНК, кодирующей полноразмерный лизосомальный фермент сульфатазу или его биологически активный фрагмент, мутант, вариант или производное. Специалисты в данной области могут получить экспрессирующие конструкции, отличные от конструкций, конкретно описанных в настоящем документе, для оптимальной продукции таких лизосомальных ферментов сульфатаз в пригодных трансфицированных ими клеточных линиях. Более того, квалифицированные специалисты могут легко сконструировать фрагменты кДНК, кодирующие биологически активные фрагменты, варианты, мутанты или производные встречающегося в природе SUMF1 или лизосомального фермента сульфатазы, которые обладают такой же биологической активностью, как и у встречающихся в природе полноразмерных ферментов, или сходной с ней.
Клетки-хозяева
Клетки-хозяева, используемые для продукции рекомбинантных лизосомальных ферментов сульфатаз, представляют собой дефицитные по эндосомальному закислению клеточные линии, характеризующиеся их способностью продуцировать такие лизосомальные ферменты сульфатазы в количествах, которые позволяют терапевтическое применение фермента. Изобретение относится к происходящей из CHO-K1 клеточной линии группы комплементации END3, обозначаемой G71. Изобретение также относится к клеточной линии G71, которая адаптирована для роста в бессывороточной суспензионной культуре, обозначаемой G71S. Изобретение также относится к производным G71 и клеточным линиям G71S, которые далее субклонированы или которые содержат отличающиеся экспрессирующие плазмиды.
Клетки, которые содержат и экспрессируют ДНК или РНК, кодирующую рекомбинантный белок, называют в настоящем документе генетически модифицированными клетками. Клетки млекопитающих, которые содержат и экспрессируют ДНК или РНК, кодирующую рекомбинантный белок, называют генетически модифицированными клетками млекопитающих. Введение ДНК или РНК в клетки проводят известным способом трансфекции, например, таким как, но не ограничиваясь ими, электропорация, микроинъекция, бомбардировка микроснарядами, осаждение с фосфатом кальция, модифицированное осаждение с фосфатом кальция, обработку катионными липидами, фотопорацию, способы слияния, опосредуемый рецепторами перенос или осаждение с полибреном. Альтернативно ДНК или РНК можно вводить путем инфицирования вирусным вектором. Способы продукции для клеток, включая клетки млекопитающих, которые экспрессируют ДНК или РНК, кодирующую рекомбинантный белок, описаны в одновременно рассматриваемых патентных заявках США с серийными номерами No. 08/334797, под названием "In Vivo Protien Production and Delivery System for Gene Therapy", Richard F. Selden, Douglas A. Treco, Michael W. Heartlein (поданной 4 ноября 1994 года); в заявке США с серийным номером No. 08/334455, под названием "In Vivo Production and Delivery of Erythropoetin or Insulinotropin for Gene Therapy", Richard F. Selden, Douglas A. Treco и Michael W. Heartlein (поданной 4 ноября 1994 года), и в заявке США с серийным No. 08/231439, под названием "Targeted Introduction of DNA Into Primary or Secondary Cells and Their Use for Gene Therapy", Douglas A. Treco, Michael W. Heartlein и Richard F. Selden (поданной 20 апреля 1994 года). Указания всех из этих заявок включены в настоящий документ в качестве ссылок в полном объеме.
В предпочтительных вариантах осуществления, клетка-хозяин, используемая для продукции рекомбинантных лизосомальных ферментов сульфатаз, представляет собой клеточную линию, дефицитную по эндосомальному закислению, характеризующуюся ее способностью продуцировать такие лизосомальные ферменты сульфатазы в количествах, которые позволяют терапевтическое применение фермента. В предпочтительных вариантах осуществления, изобретение относится к происходящей из CHO-K1 клеточной линии группы комплементации END3, обозначаемой G71, и к клеточной линии G71, которая адаптирована для роста в бессывороточной суспензионной культуре, обозначаемой G71S, которая коэкспрессирует модифицирующий сульфатазу фактор 1 (SUMF1) человека и рекомбинантный лизосомальный фермент сульфатазу и, таким образом, способна продуцировать с высоким выходом активные высокофосфорилированные лизосомальные ферменты сульфатазы, как определено в разделе "ОПРЕДЕЛЕНИЯ", тем самым позволяя крупномасштабную продукцию терапевтических лизосомальных ферментов сульфатаз. В наиболее предпочтительных вариантах осуществления, клеточная линия G71 или G71S или ее производное экспрессирует и секретирует рекомбинантные лизосомальные ферменты сульфатазы в количествах по меньшей мере приблизительно 0,5, предпочтительно по меньшей мере приблизительно 0,75, более предпочтительно по меньшей мере приблизительно 1,0 и еще более предпочтительно по меньшей мере приблизительно 1,25 пикограмм/клетка/сутки.
Векторы и конструкции нуклеиновых кислот
Конструкция нуклеиновой кислоты, используемая для экспрессии рекомбинантного белка, либо модифицирующего сульфатазу фактора 1 человека (SUMFl), либо лизосомального фермента сульфатазы, либо обоих из них, может представлять собой конструкцию, которая экспрессируется внехромосомно (эписомно) в трансфицированной клетке млекопитающего, или конструкцию, которая встраивается, либо случайно, либо в предварительно выбранном участке-мишени, посредством гомологичной рекомбинации, в геном клетки реципиента. Конструкция, которая экспрессируется внехросомомно, содержит, в дополнение к кодирующим рекомбинантный белок последовательностям, последовательности, достаточные для экспрессии белка в клетках и, необязательно, для репликации конструкции. Она, как правило, включает промотор, кодирующую рекомбинантный белок ДНК и участок полиаденилирования. ДНК, кодирующая рекомбинантный белок, расположена в конструкции таким образом, чтобы ее экспрессия находилась под контролем промотора. Необязательно, конструкция может содержать дополнительные компоненты, такие как один или несколько из следующих: участок сплайсинга, последовательность энхансера, ген селективного маркера под контролем соответствующего промотора, амплифируемый маркерный ген под контролем соответствующего промотора и область прикрепления к матриксу (MAR) или другие элементы, известные в данной области, которые усиливают экспрессию области, куда она встраивается.
В вариантах осуществления, в которых конструкция ДНК встраивается в геном клетки, она обязательно включает только кодирующие рекомбинантный белок последовательности нуклеиновых кислот. Необязательно, она может включать промоторную и энхансерную последовательность, участок или участки полиаденилирования, участок или участки сплайсинга, последовательности нуклеиновых кислот, которые кодируют селективный маркер или маркеры, последовательности нуклеиновых кислот, которые кодируют амплифицируемый маркер, область прикрепления к матриксу (MAR) или другие элементы, известные в данной области, которые усиливают экспрессию области, в которую она встраивается, и/или ДНК, гомологичную геномной ДНК в клетке реципиента, для направленного встраивания ДНК в выбранный участок генома (для нацеливания на ДНК или последовательности ДНК).
Способы культивирования клеток
Клетки млекопитающих, содержащие кодирующую рекомбинантный белок ДНК или РНК, культивируют в условиях, пригодных для роста клеток и экспрессии ДНК или РНК. Клетки, которые экспрессируют рекомбинантный белок, можно идентифицировать с использованием известных способов и способов, описанных в настоящем документе, и рекомбинантный белок можно выделять и очищать с использованием известных способов и способов, также описанных в настоящем документе, либо с усилением продукции рекомбинантного белка, либо без него. Идентификацию можно проводить, например, путем скрининга генетически модифицированных клеток млекопитающих, которые обладают фенотипом, указывающим на присутствие ДНК или РНК, кодирующей рекомбинантный белок, такого как скрининг с помощью ПЦР, скрининг саузерн-блот анализом, или скрининг экспрессии рекомбинантного белка. Селекцию клеток, которые содержат включенную в них кодирующую рекомбинантный белок ДНК, можно проводить путем включения селективного маркера в конструкцию ДНК с последующим культивированием трансфицированных или инфицированных клеток, содержащих ген селективного маркера, в условиях, пригодных для выживания только тех клеток, которые экспрессируют ген селективного маркера. Кроме того, амплификацию введенной конструкции ДНК можно обеспечивать культивированием генетически модифицированных клеток млекопитающих в соответствующих условиях (например, культивированием генетически модифицированных клеток млекопитающих, содержащих амплифицируемый маркерный ген, в присутствии концентраций лекарственного средства, при которых могут выжить только клетки, содержащие множество копий амплифицируемого маркерного гена).
Генетически модифицированные клетки млекопитающих, экспрессирующие рекомбинантный белок, можно идентифицировать, как описано в настоящем документе, путем детекции экспрессирующего продукта. Например, клетки млекопитающих, экспрессирующие активные высокофосфорилированные лизосомальные ферменты сульфатазы, можно идентифицировать иммунологическим ферментным сэндвич-анализом. Антитела могут быть направлены на часть активного средства.
Варианты лизосомальных ферментов сульфатаз
В определенных вариантах осуществления, можно получать мутанты или варианты активного высокофосфорилированного лизосомального фермента сульфатазы, и они могут быть пригодны в различных применениях, в которых можно использовать активные высокофосфорилированные лизосомальные ферменты сульфатазы. Мутанты или варианты по аминокислотной последовательности полипептида могут представлять собой мутанты или варианты с заменами, вставками или делециями. Мутанты или варианты с делециями лишены одного или нескольких остатков нативного белка, которые не являются необходимыми для функции или иммуногенной активности. Распространенным типом мутанта или варианта с делецией является мутант или вариант, лишенный секреторных сигнальных последовательностей или сигнальных последовательностей, направляющих белок на связывание с конкретной частью клетки. Мутанты или варианты с инсерциями, как правило, вовлекают добавление материала в неконцевой точке полипептида. Это может включать инсерцию иммунологически реактивного эпитопа или просто одного остатка. Концевые добавления, также называемые слитыми белками, рассмотрены ниже.
Варианты могут быть по существу гомологичны или по существу идентичны немодифицированному лизосомальному ферменту сульфатазе, как указано выше. Предпочтительные варианты представляют собой варианты полипептида активного высокофосфорилированного лизосомального фермента сульфатазы, которые сохраняют по меньшей мере часть биологической активности, например сульфатазной активности, лизосомального фермента сульфатазы. Другие предпочтительные варианты включают полипептид N-ацетилгалактозамин-6-сульфатазы человека, который сохраняет по меньшей мере часть сульфатазной активности N-ацетилгалактозамин-6-сульфатазы человека.
В мутантах или вариантах с заменами, как правило, одна аминокислота полипептида дикого типа заменена другой аминокислотой в одном или нескольких участках белка, и они могут быть сконструированы так, чтобы модулировалось одно или несколько свойств полипептида, таких как, например, не ограничиваясь этим, устойчивость к протеолитическому расщеплению, без потери других функций или свойств. Замены этого типа предпочтительно являются консервативными, т.е. одна аминокислота заменяется аминокислотой со сходной формой и зарядом. Консервативные замены хорошо известны в данной области и включают, например, замены: аланина на серин; аргинина на лизин; аспарагина на глутамин или гистидин; аспартата на глутамат; цистеина на серин; глутамина на аспарагин; глутамата на аспартат; глицина на пролин; гистидина на аспарагин или глутамин; изолейцина на лейцин или валин; лейцина на валин или изолейцин; лизина на аргинин; метионина на лейцин или изолейцин; фенилаланина на тирозин, лейцин или метионин; серина на треонин; треонина на серин; триптофана на тирозин; тирозина на триптофан или фенилаланин; валина на изолейцин или лейцин.
Один из аспектов настоящего изобретения предусматривает получение мутантов или вариантов по участку гликозилирования, в которых является мутантным участок O- или N-связанного гликозилирования лизосомального фермента сульфатазы. Такие мутанты или варианты могут обеспечить важную информацию, касающуюся биологической активности, физической структуры и потенциала в отношении связывания субстрата у активного высокофосфорилированного лизосомального фермента сульфатазы. В конкретных аспектах, предусматривается, что можно получать другие мутанты или варианты пептида активного высокофосфорилированного лизосомального фермента сульфатазы, которые сохраняют биологическую активность, но обладают повышенной или сниженной активностью связывания субстрата. По существу, конкретно предусматриваются мутации активного центра или каталитической области для образования мутантов или вариантов белка с измененной активностью связывания субстрата. В таких вариантах осуществления, последовательность активного высокофосфорилированного лизосомального фермента сульфатазы сравнивают с последовательностью других родственных ферментов и выбранные остатки подвергают определенной мутации.
При нумерации аминокислоты зрелого белка с предполагаемого N-конца в качестве аминокислоты номер 1, иллюстративные мутации, которые могут быть пригодны, включают, например, замену всех или некоторых из потенциально гликозилированных остатков аспарагина, включая положения 178 и 397 рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (см. фигуру 5).
Связывание субстрата можно модифицировать с помощью мутаций в активном центре/вблизи активного центра лизосомального фермента сульфатазы. Принимая такие мутации в качестве иллюстративных, специалисты в данной области поймут, что можно вносить другие мутации последовательности фермента для получения структурной и функциональной информации об этом белке и его активности.
Для конструирования мутантов или вариантов, таких как мутанты или варианты, описанные выше, специалист в данной области может использовать хорошо известные стандартные способы. Конкретно предусматриваются N-концевые делеции, C-концевые делеции, внутренние делеции, а также случайный и точечный мутагенез.
N-концевые и C-концевые делеции представляют собой формы делеционного мутагенеза, в которых используется, например, наличие пригодного одного участка рестрикции вблизи конца C- или N-концевой области. ДНК расщепляется в этом участке и отщепленные концы разрушаются нуклеазами, такими как BAL31, экзонуклеаза III, ДНКаза I и S1-нуклеаза. Соединение двух концов приводит к серии ДНК с делециями различного размера в области участка рестрикции. Белки, экспрессированные с такого мутанта, можно анализировать в отношении соответствующей биологической функции, например ферментативной активности, с использованием способов, стандартных в данной области и описанных в описании. Для мутантов с внутренней делецией можно применять сходные способы с использованием двух пригодным образом помещенных участков рестрикции, тем самым обеспечивая проведение точно определенной делеции, и повторного лигирования концов, как описано выше.
Также предусматриваются мутанты с неполным расщеплением. В таких случаях, специалист в данной области может использовать "частый расщепитель", который расщепляет ДНК в различных местах, в зависимости от длительности времени реакции. Таким образом, варьируя условия реакции, можно получить серию мутантов различного размера, которые затем можно подвергать скринингу в отношении активности.
Также можно вносить случайную инсерционную мутацию, разрезая последовательность ДНК ДНКазой I, например, и встраивая участок из нуклеотидов, которые кодируют 3, 6, 9, 12 и т.д., аминокислот и повторно лигируя конец. После внесения мутации, мутанты можно подвергать скринингу в отношении различных видов активности, которые проявляет белок дикого типа.
Также можно использовать точечный мутагенез для точной идентификации того, какие аминокислотные остатки важны для конкретных видов активности, ассоциированных с биологической активностью лизосомального фермента сульфатазы. Таким образом, специалист в данной области способен провести замены отдельных оснований в цепи ДНК, чтобы получить измененный кодон или миссенс-мутацию.
Аминокислоты конкретного белка можно изменять для создания эквивалентной, или даже улучшенной, молекулы второго поколения. Такие изменения предусматривают замену данной аминокислоты белка без заметной потери способности связывающего взаимодействия структурами, например, такими как антигенсвязывающие области антител или участки связывания на молекулах субстратов или рецепторах. Поскольку именно способность к взаимодействию и природа белка определяют эту биологическую функциональную активность белка, в белковую последовательность можно вносить определенные аминокислотные замены, а также в лежащую в ее основе кодирующую последовательность ДНК, и, тем не менее, получить белок со сходными свойствами. Таким образом, в последовательности ДНК генов можно вносить различные изменения без заметной потери их биологической применимости или активности, как рассмотрено ниже.
При проведении таких изменений, можно учитывать индекс гидрофобности аминокислот. Является общепризнанным, что относительный характер гидрофобности аминокислоты обеспечивает вторичную структуру конечного белка, которая, в свою очередь, определяет взаимодействие белка с другими молекулами, например ферментами, субстратами, рецепторами, ДНК, антителами, антигенами и т.п. Каждой аминокислоте присвоен индекс гидрофобности на основе ее характеристик гидрофобности и заряда (Kyte & Doolittle, J. Mol. Biol., 157(1): 105-132, 1982, включенная в настоящий документ в качестве ссылки). Как правило, аминокислоты можно заменять другими аминокислотами, которые обладают сходным индексом или показателем гидрофобности и, тем не менее, приводят к белку со сходной биологической активностью, т.е., тем не менее, обеспечивают получение эквивалентного с точки зрения биологической функции белка.
Кроме того, замену подобных аминокислот можно эффективно проводить на основе гидрофильности. В патенте США 4554101, включенном в настоящий документ в качестве ссылки, указано, что наиболее высокая локальная средняя гидрофильность белка, определяемая гидрофильностью его соседних аминокислот, коррелирует с биологическим свойством белка. По существу, аминокислоту можно заменить другой аминокислотой, имеющей сходную величину гидрофильности, и, тем не менее, получить биологически эквивалентный и иммунологически эквивалентный белок.
Иллюстративные аминокислотные замены, которые можно использовать в этом контексте изобретения, включают, но не ограничиваются ими, замену между аргинином и лизином; глутаматом и аспартатом; серином и треонином; глутамином и аспарагином; валином, лейцином и изолейцином. Другие такие замены, в которых учитывается необходимость в сохранении части или всей биологической активности при изменении вторичной структуры белка, хорошо известны специалистам в данной области.
Другой тип варианта, который предусматривается для получения полипептидов по изобретению, представляет собой применение пептидных миметиков. Миметики представляют собой содержащие пептид молекулы, которые имитируют элементы вторичной структуры белка. См., например, Johnson et al., "Pepride Turn Mimetics", BIOTECHNOLOGY AND PHARMACY, Pezzuto et al., Eds., Chapman and Hall, New York (1993). Основанием для применения пептидных миметиков является то, что пептидный остов белков существует, главным образом, для ориентации боковых цепей аминокислот таким образом, чтобы упрощались молекулярные взаимодействия, такие как взаимодействия антитела и антигена. Пептидный миметик, согласно ожиданиям, может позволить молекулярные взаимодействия, сходные с природной молекулой. Эти принципы можно использовать совместно с принципами, описанными выше, для конструирования молекул второго поколения, имеющих множество из природных свойств лизосомальных ферментов сульфатаз, но с измененными или даже улучшенными характеристиками.
Модифицированное гликозилирование лизосомальных ферментов сульфатаз
Также можно получать варианты активного высокофосфорилированного лизосомального фермента сульфатазы, которые обладают модифицированным паттерном гликозилирования относительно исходного полипептида, например, делецией одной или нескольких углеводных групп и/или добавлением одного или нескольких участков гликозилирования, которые не присутствуют в нативном полипептиде.
Гликозилирование, как правило, является либо N-связанным, либо O-связанным. N-связанное гликозилирование относится к присоединению углеводной группы к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту, за исключением пролина, представляют собой последовательности, распознаваемые для ферментативного присоединения углеводной группы к боковой цепи аспарагина. Наличие любой из этих трипептидных последовательностей в полипептиде создает потенциальный участок гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров, представляющих собой N-ацетилгалактозамин, галактозу или ксилозу, к гидроксиаминокислоте, обычно к серину или треонину, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин. Участки O-связанного гликозилирования можно добавлять встраиванием или заменой одного или нескольких остатков серина или треонина в последовательность исходного полипептида.
Переключение доменов
Различные участки белков лизосомальных ферментов сульфатаз обладают значительной гомологией последовательностей. В полипептидах лизосомального фермента сульфатазы можно идентифицировать мутации, которые изменяют их функцию. Эти исследования потенциально являются важными по меньшей мере по двум причинам. Во-первых, они обеспечивают обоснованное ожидание того, что в родственных видах, таких как крыса, кролик, обезьяна, гиббон, шимпанзе, человекообразные обезьяны, бабуин, корова, свинья, лошадь и кошка, могут существовать другие гомологи, аллельные варианты и мутанты этого гена. При выделении этих гомологов, вариантов и мутантов и совместно с другими анализами можно идентифицировать определенные активные или функциональный домены. Во-вторых, это может обеспечить начальную точку для дальнейшего мутационного анализа молекулы, как описано выше. Одним из способов, в котором можно использовать эту информацию, является "переключение доменов".
Переключение доменов вовлекает получение рекомбинантных молекул с использованием различных, но родственных полипептидов. Например, путем сравнения последовательности лизосомального фермента сульфатазы, например N-ацетилгалактозамин-6-сульфатазы, с последовательностью сходного лизосомального фермента сульфатазы из другого источника и с мутантами и аллельными вариантами этих полипептидов можно предсказывать функционально значимые области этих молекул. Затем можно переключать родственные домены этих молекул для определения важности этих областей для функции фермента и эффектов при лизосомальных болезнях накопления. Эти молекулы могут обладать дополнительным значением, поскольку эти "химеры" могут отличаться от природных молекул, при возможном осуществлении такой же или даже усиленной функции.
На основе множества лизосомальных ферментов сульфатаз, идентифицированных в настоящее время, дополнительный анализ мутаций и их предсказанного эффекта на вторичную структуру дополнит это понимание. Предусмотрено, что мутанты, в которых переключены домены между лизосомальными ферментами сульфатазами, могут обеспечить пригодную информацию о взаимосвязях структур/функций этих молекул и полипептидов, с которыми они взаимодействуют.
Слитые белки
В дополнение к мутациям, описанным выше, настоящее изобретение, кроме того, предусматривает получение специализированного типа варианта с инсерцией, известного как слитый белок. Эта молекула, как правило, имеет всю или значительную часть природной молекулы, связанную на N- или C-конце со всем вторым полипептидом или его частью. Например, при слиянии, как правило, используются лидерные последовательности из других видов для обеспечения рекомбинантной экспрессии белка в гетерологичном хозяине. Другое пригодное слияние включает добавление иммунологически активного домена, такого как эпитоп антитела, для упрощения очистки слитого белка. Включение участка расщепления в месте слияния или вблизи него может облегчить удаление ненужного полипептида после очистки. Другие пригодные слияния включают связывание функциональных доменов, таких как активные центры ферментов, домены гликозилирования, клеточные сигналы нацеливания или трансмембранные области.
Существуют различные коммерчески доступные экспрессирующие системы для слитых белков, которые можно использовать в настоящем изобретении. Особенно пригодные системы включают, но не ограничиваются ими, систему глутатион-S-трансферазы (GST) (Pharmacia, Piscataway, NJ), систему связывающего мальтозу белка (NEB, Beverley, MA), систему FLAG (IBI, New Haven, CT), систему 6×His (Qiagen, Chatsworth, CA). Эти системы способны продуцировать рекомбинантные полипептиды, обладающие только небольшим количеством дополнительных аминокислот, которые, вероятно, не влияют на антигенную способность рекомбинантного полипептида. Например, системы как FLAG, так и 6×His добавляют только короткие последовательности, обе из которых, как известно, являются слабо антигенными не оказывают неблагоприятного влияния на сворачивание полипептида в его нативную конформацию. Другим N-концевым слиянием, которое считается пригодным, является слияние дипептида Met-Lys с N-концевой областью белка или пептидов. Такое слияние может обеспечивать благоприятное повышение экспрессии или активности белка.
Особенно пригодной конструкцией для слияния может быть конструкция, в которой полипептид активного высокофосфорилированного лизосомального фермента сульфатазы или его фрагмент являются слитыми с гаптеном для усиления иммуногенности слитой конструкции лизосомального фермента сульфатазы. Это может быть пригодно для продукции антител к активному высокофосфорилированному лизосомальному ферменту сульфатазе для обеспечения детекции белка. В других вариантах осуществления можно получать слитую конструкцию, которая может усилить нацеливание связанных с лизосомальным ферментом сульфатазой композиций в конкретную область или клетку.
Другие слитые конструкции, включающие гетрологичный пептид с требуемыми свойствами, например мотив, могут нацеливать лизосомальный фермент сульфатазу в конкретный орган, ткань или тип клетки. В предпочтительном варианте осуществления, слитая конструкция, включающая нацеливающий на кость пептид, например 6 остатков аспарагиновой кислоты (6×Asp или 6D), слитый с лизосомальным ферментом сульфатазой, может нацеливать фермент в конкретные области кости.
Также предусмотрены другие слитые конструкции, включающие гетерологичный полипептид с требуемыми свойствами, например константный участок Ig для продления времени полужизни в сыворотке или антитело или его фрагмент для нацеливания. Другие слитые системы образуют полипептидные гибриды, где является желательным отщепление партнера по слиянию от требуемого полипептида. В одном варианте осуществления, партнер по слиянию связан полипептидом рекомбинантного активного высокофосфорилированного лизосомального фермента сульфатазы с помощью пептидной последовательности, содержащий специфичную последовательность для распознавания протеазой. Примерами пригодных последовательностей являются последовательности, распознаваемые протеазой вируса гравировки табака (Life Technologies, Gaithersburg, MD) или фактором Xa (New England Biolabs, Beverley, MA).
Производные
Как указано выше, производное относится к полипептидам, химически модифицированным такими способами, как, например, не ограничиваясь ими, убиквитинилирование, мечение (например, радионуклидами или различными ферментами), ковалентное присоединение полимера, такое как пегилирование (преобразование полиэтиленгликолем) и встраивание или замена химическим синтезом аминокислот, таких как орнитин. Производные лизосомального фермента сульфатазы также пригодны в качестве лекарственных средств, и их можно получить способами по изобретению.
Полиэтиленгликоль (PEG) может бить присоединен к лизосомальному ферменту сульфатазе, продуцированному способами по изобретению, для обеспечения более длительного времени полужизни in vivo. Группа PEG может иметь любую подходящую молекулярную массу и может быть линейной или разветвленной. Средняя молекулярная масса PEG предпочтительно находится в диапазоне от приблизительно 2 килодальтон ("кДа") до приблизительно 100 кДа, более предпочтительно от приблизительно 5 кДа до приблизительно 50 кДа, наиболее предпочтительно от приблизительно 5 кДа до приблизительно 10 кДа. Группы PEG, главным образом, могут быть связаны с лизосомальными ферментами сульфатазами по изобретению путем ацилирования или восстановительного алкилирования через реакционноспособную группу на группе PEG (например, альдегидную, амино, тиольную или сложноэфирную группу) и реакционноспособную группу на группе белка (например, альдегидную, амино, тиольную или сложноэфирную группу). Добавление групп PEG к представляющим интерес полипептидам можно проводить с использованием способов, хорошо известных в данной области. См., например, международную публикацию No. WO 96/11953 и патент США No. 4179337.
Лигирование полипептида лизосомального фермента сульфатазы с PEG обычно проводят в водной фазе, и его можно легко подвергать мониторингу с помощью обращено-фазовой аналитической ВЭЖХ. Пегилированные пептиды можно легко очищать препаративной ВЭЖХ и охарактеризовывать аналитической ВЭЖХ, анализом аминокислот и масс-спектрометрией с лазерной десорбцией.
Метки
В некоторых вариантах осуществления, терапевтический лизосомальный фермент сульфатазу метят для облегчения его детекции. "Метка" или "поддающаяся детекции группа" представляет собой композицию, поддающуюся детекции спектроскопическими, фотохимическими, биохимическими, иммунохимическими, химическими или другими физическими способами. Например, метки, пригодные для применения в настоящем изобретении, включают, но не ограничиваются ими, радиоактивные метки (например, 32P), флуорофоры (например, флуоресцеин), электронно-плотные реагенты, ферменты (например, как обычно используют в ELISA), биотин, дигоксигенин или гаптены, а также белки, которые могут быть сделаны поддающимися детекции, например, путем включения радиоактивной метки в гаптен или пептид или которые можно использовать для детекции антител, специфично реактивных к гаптену или пептиду.
Примеры меток, пригодных для применения в настоящем изобретении, включают, но не ограничиваются ими, флуоресцентные красители (например, флуоресцеинизотиоцианат, техасский красный, родамин и т.п.), радиоактивные метки (например, 3H, 125I, 35S, 14C или 32P), ферменты (например, пероксидазу хрена, щелочную фосфатазу и другие обычно используемые в ELISA) и колориметрические метки, такие как коллоидное золото, цветное стекло или пластмассовые гранулы (например, полистироловые, полипропиленовые, латексные и т.д.).
Метка может быть присоединена прямо или непрямо к требуемому компоненту лизосомального фермента сульфатазы в соответствии со способами, хорошо известными в данной области. Предпочтительно, в одном варианте осуществления метка ковалентно связана с лизосомальным ферментом сульфатазой с использованием реагента на основе изоцианата для конъюгации активного средства по изобретению. В одном аспекте изобретения, для конъюгации метки с лизосомальным ферментом сульфатазой можно использовать бифункциональные реагенты на основе изоцианата по изобретению с образованием конъюгата метки и лизосомального фермента сульфатазы без активного средства, связанного с ним. Конъюгат метки и лизосомального фермента сульфатазы можно использовать в качестве промежуточного соединения для синтеза меченого конъюгата по изобретению или его можно использовать для детекции конъюгата лизосомального фермента сульфатазы. Как указано выше, можно использовать широкое множество меток, причем выбор метки зависит от требуемой чувствительности, простоты конъюгации с требуемым компонентом лизосомального фермента сульфатазы, требований к устойчивости, доступного оборудования и обеспечения удаления. Нерадиоактивные метки часто связывают непрямыми способами. Как правило, молекулу лиганда (например, биотин) ковалентно связывают с лизосомальным ферментом сульфатазой. Затем лиганд связывают с другой молекулой (например, стрептавидином), который либо по своей природе поддается детекции, либо ковалентно связан с сигнальной системой, такой как поддающийся детекции фермент, флуоресцентное соединение или хемилюминесцентное соединение.
Лизосомальные ферменты сульфатазы по изобретению также можно конъюгировать прямо с создающими сигнал соединениями, например, путем конъюгации с ферментом или флуорофором. Ферменты, пригодные для применения в качестве меток, включают, но не ограничиваются ими, гидролазы, в частности фосфатазы, эстеразы и гликозидазы или оксидазы, в частности пероксидазы. Флуоресцентные соединения, т.е. флуорофоры, пригодные для применения в качестве меток, включают, но не ограничиваются ими, флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон и т.д. Следующие примеры пригодных флуорофоров включают, но не ограничиваются ими, эозин, TRITC-амин, хинин, флуоресцеин W, акридиновый желтый, лиссамин-родамин B, сульфонилхлорид-эритросцеин, рутений (трис, бипиридиний), техасский красный, никотинамидадениндинуклеотид, флавинадениндинуклеотид и т.д. Хемилюминесцентные соединения, пригодные для применения в качестве меток, включают, но не ограничиваются ими, люциферин и 2,3-дигидрофталазиндионы, например люминол. Для обзора различных систем для мечения или образования сигнала, которые можно использовать в способах по настоящему изобретению, см. патент США No. 4391904.
Средства для детекции меток хорошо известны специалистам в данной области. Таким образом, например, когда метка является радиоактивной, средства для детекции включают сцинтилляционный счетчик или фотографическую пленку, например, при радиоавтографии. Когда метка представляет собой флуоресцентную метку, ее детекцию можно проводить путем возбуждения флуорохрома соответствующей длиной волны и детекции полученной флуоресценции. Детекцию флуоресценции можно проводить визуально, с использованием электронных детекторов, таких как приборы с зарядовой связью (CCD) или фотоумножители и т.п. Аналогично, детекцию ферментных меток можно проводить путем предоставления соответствующих субстратов для фермента и детекции полученного продукта реакции. Детекцию колориметрических или хемилюминесцентных меток можно проводить просто наблюдением цвета, ассоциированного с меткой. Другие системы для мечения и детекции, пригодные для применения в способах по настоящему изобретению, будут очевидны специалистам в данной области. Такие меченые модуляторы и лиганды можно использовать в диагностике состояния заболевания или здоровья.
В предпочтительном варианте осуществления, способ включает стадию продукции активных высокофосфорилированных лизосомальных ферментов сульфатаз из клеточных линий с дефектами в эндосомальном транспорте. В особенно предпочтительном варианте осуществления, способ включает стадию продукции активной высокофосфорилированной рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека из клеточной линии CHO G71 или ее производного. Продукция лизосомальных ферментов сульфатаз, таких как, например, не ограничиваясь ими, GALNS, включает стадии: (a) разработки производного клеточной линии G71 или G71, которое коэкспрессирует рекомбинантный лизосомальный фермент сульфатазу человека, например N-ацетилгалактозамин-6-сульфатазу (GALNS), и рекомбинантный модифицирующий сульфатазу фактор 1 (SUMF1) человека; (b) культивирования клеточных линий, коэкспрессирующих лизосомальный фермент сульфатазу и SUMF1 человека; и (c) увеличение масштаба клеточных линий, коэкспрессирующих лизосомальный фермент сульфатазу человека и SUMF1 до биореактора для продукции лизосомальных ферментов сульфатаз. В предпочтительных вариантах осуществления, кДНК лизосомального фермента сульфатазы человека, например N-ацетилгалактозамин-6-сульфатазы (GALNS) и SUMF1 человека, субклонируют в экспрессирующие векторы млекопитающих, по существу как описано в настоящем документе ниже.
Для разработки клеточной линии G71 или G71S, клон G71, адаптированный для роста в бессывороточной суспензионной культуре, котрансфицировали вектором млекопитающих, экспрессирующим GALNS человека, вектором млекопитающих, экспрессирующим SUMF1 человека, и ген селективного маркера и отбирали стабильные трансформанты. После первого раунда субклонирования стабильных трансфектантов, клеточные линии подвергали селекции с использованием флуоресцентного субстрата и определенным образом обозначали. Клеточные линии G71 или G71S анализировали в отношении клеточно-специфической продуктивности (пг продукта/клетка) во вращающих устройствах с микроносителями или в суспензионной культуре, соответственно. Наилучших продуцентов GALNS человека идентифицировали и масштабировали до биореактора для продукции доклинического материала.
В другом варианте осуществления, изобретение относится к клеточному анализу для измерения активности рекомбинантного лизосомального фермента человека для деградации природных субстратов. Способ включает (a) культивирование выделенной клеточной линии человека, дефицитной по лизосомальному ферменту, в условиях, при которых накапливаются природные субстраты для лизосомального фермента; (b) контактирование клетки с лизосомальным ферментом; (c) лизис клетки; (d) добавление к клеточному лизату фермента, который (i) является специфичным для природных субстратов, (ii) отщепляет небольшие олигосахариды от природных субстратов; (e) мечение небольшими олигосахаридами с поддающейся детекции группой; (f) необязательно разделение меченых небольших олигосахаридов; (g) детекцию меченых небольших олигосахаридов; (h) определение активности лизосомального фермента в отношении деградации природных субстратов путем сравнения (i) количества меченого небольшого олигосахарида из клеток, которые подвергали контактированию с лизосомальным ферментом с (ii) количеством меченых небольших олигосахаридов из клеток, которые не подвергали контактированию с лизосомальным ферментом, где снижение (h)(i) по сравнению с (h)(ii) указывает на активность лизосомального фермента в отношении деградации природных субстратов. В одном варианте осуществления, небольшой олигосахарид представляет собой моно-, ди- или трисахарид. В родственных вариантах осуществления, небольшой олигосахарид представляет собой дисахарид.
В некоторых вариантах осуществления, лизосомальный фермент выбран из группы, состоящей из арилсульфатазы B (ARSB), идуронат-2-сульфатазы (IDS), сульфамидаза/гепарин-N-сульфатазы (SGSH), N-ацетилглюкозаминсульфатазы (G6S) и N-ацетилгалактозамин-6-сульфатазы (GALNS). В некоторых вариантах осуществления, лизосомальный фермент представляет собой α-L-идуронидазу (IDU). В некоторых вариантах осуществления, лизосомальный фермент представляет собой кислую α-глюкозидазу (GAA). В некоторых вариантах осуществления, лизосомальный фермент представляет собой β-глюкуронидазу (GUSB). В некоторых вариантах осуществления, лизосомальный фермент представляет собой β-галактозидазу (GLB1).
Пригодные клетки человека, которые можно использовать в клеточном анализе, включают любую клетку человека, которая является дефицитной по лизосомальному ферменту, подвергаемому тестированию, так чтобы она могла накапливать природные субстраты для лизосомального фермента. Например, можно использовать клетки, в природе обладающие полным (100%) или частичным дефицитом активности, например 30%, 50%, 70%, 80%, 90%, 95% снижением активности или более. Можно использовать клетки, экспрессирующие мутантный фермент со сниженной активностью, или клетки, полученные от пациентов, страдающих лизосомальной болезнью накопления, например мукополисахаридозом. Можно использовать клетки, рекомбинантно измененные для нокаута или снижения активности лизосомального фермента, например, путем внесения мутации в кодирующий ген или его промотор или другую регуляторную область. Можно использовать клетки, обработанные для снижения активности лизосомального фермента, например обработанные антисмысловой РНК или RNAi для снижения экспрессии фермента.
Пригодные ферменты, которые отрезают (отщепляют) небольшие олигосахариды от углеводов и которые являются "специфичными для" (т.е., главным образом, расщепляют) природных субстратов лизосомального фермента, могут выбрать специалисты в данной области. Например, для детекции активности GALNS или GLB1 (ферменты, которые осуществляют деградацию кератансульфата) фермент стадии (d) может представлять собой кератаназу II или любой фермент, который действует, главным образом, на кератансульфат. В качестве другого примера, для детекции IDU, ARSB, IDS или GUSB (ферментов, которые осуществляют деградацию дерматансульфата), фермент стадии (d) может представлять собой хондроитиназу ABC или любой фермент, который действует, главным образом, на дерматансульфат. В качестве другого примера, для детекции IDU, IDS, SGHS, G6S или GUSB (ферментов, которые осуществляют деградацию гепарансульфата), фермент стадии (d) может представлять собой гепараназу I, или гепараназу II, или оба из них. В качестве другого примера, для детекции GAA (фермента, который осуществляет деградацию гликогена), фермент стадии (d) может представлять собой α-амилазу или любой фермент, который действует, главным образом, на гликоген.
Этот клеточный способ может иметь высокую чувствительность в отношении детекции активности лизосомального фермента. В некоторых вариантах осуществления, активность лизосомального фермента поддается детекции, когда концентрация лизосомального фермента составляет только приблизительно 10 нМ, или приблизительно 5 нМ, или приблизительно 1 нМ, или приблизительно 0,75 нМ, или приблизительно 0,5 нМ, или приблизительно 0,25 нМ, или приблизительно 0,1 нМ, или приблизительно 0,05 нМ, или приблизительно 0,01 нМ, или приблизительно 0,005 нМ, или приблизительно 1 пМ, или приблизительно 0,5 пМ.
III ОЧИСТКА ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ СУЛЬФАТАЗ
Материал биореактора, содержащий рекомбинантную GALNS человека, подвергали стерильной фильтрации через 0,2-мкм фильтр и держали при 4°C. Материал биореактора либо наносили на улавливающую колонку прямо, либо концентрировали от 10 до 20 раз путем ультрафильтрации перед нанесением на улавливающую колонку. В материале биореактора или концентрированном материале биореактора pH доводили до pH 4,5, а затем наносили его на колонку Blue-Sepharose, промывали последовательно 20 мМ смесью ацетат/фосфат, 50 мМ NaCl, pH 4,5, и 20 мМ смесью ацетат/фосфат, 50 мМ NaCl, pH 6,0, и элюировали 20 мМ смесью ацетат/фосфат, 100 мМ NaCl, pH 7,0. Затем элюат колонки Blue-Sepharose наносили на Fractogel SE Hi-Cap, промывали последовательно 20 мМ смесью ацетат/фосфат, 50 мМ NaCl, pH 5,0, и 20 мМ смесью ацетат/фосфат, 50 мМ NaCl, pH 5,5, и элюировали 20 мМ смесью ацетат/фосфат, 50-350 мМ градиентом NaCl, pH 5,5. Элюат Fractogel SE Hi-Cap изготавливали в 10 мМ NaOAc, 1 мМ NaH2PO4, 0,005% Tween-80, pH 5,5.
Альтернативно, материал биореактора, содержащий рекомбинантную GALNS человека, концентрировали в 20 раз ультрафильтрацией перед нанесением на улавливающую колонку. В концентрированном материале биореактора pH доводили до pH 4,5, фильтровали его, а затем наносили на колонку Fractogel SE Hi-Cap, промывали последовательно 10 мМ смесью ацетат/фосфат, 50 мМ NaCl, pH 4,5, и 10 мМ смесью ацетат/фосфат, 50 мМ NaCl, pH 5,0, и элюировали 10 мМ смесью ацетат/фосфат, 140 мМ NaCl, pH 5,0. Затем элюат колонки Fractogel SE Hi-Cap доводили до 500 мМ NaCl, pH 7,0, и наносили на колонку с Zn-хелатирующей Sepharose (Zn-IMAC), промывали 10 мМ смесью ацетат/фосфат, 125 мМ NaCl, 10 мМ имидазолом, pH 7,0, и элюировали 10 мМ смесью ацетат/фосфат, 125 мМ NaCl, 90 мМ имидазолом, pH 7,0. Элюат колонки с Zn-хелатирующей Sepharose (Zn-IMAC) доводили до pH 3,5 для инактивации вируса низким pH, доводили до 10 мМ смеси ацетат/фосфат, 2M NaCl, pH 5,0, а затем наносили в колонку ToyoPearl Butyl 650M, промывали 10 мМ смесью ацетат/фосфат, 2M NaCl, pH 5,0, и элюировали 10 мМ смесью ацетат/фосфат, 0,7 M NaCl, pH 5,0. Элюат ToyoPearl Butyl 650M подвергали ультафильтрации и диафильтрации в 20 мМ ацетате, 1 мМ фосфате, 150 мМ NaCl, pH 5,5, и затем приготавливали в 20 мМ ацетате, 1 мМ фосфате, 150 мМ NaCl, 0,01% Tween-20, pH 5,5.
Очистка рекомбинантной GALNS человека подробно описана ниже, и очистка рекомбинантной GALNS человека согласно способам, модифицированным из указанного выше протокола, подробно описана ниже.
Рекомбинантный фермент GALNS человека экспрессировали в клетках G71S, как описано в примере III, и очищали, как описано в примере V. Очищенную рекомбинантную GALNS человека по изобретению можно сравнить с другими описанными препаратами GALNS. В Masue et al., J. Biochem. 110:965-970, 1991, описана очистка и охарактеризация GALNS из плаценты человека. Было выявлено, что очищенный фермент обладает молекулярной массой 120 кДа и состоит из полипептидов массой 40 кДа и 15 кДа, последний из которых, как было показано, является гликопротеином. Таким образом, в Masue et al. фермент GALNS, по-видимому, соответствует процессированной форме, представленной на фигуре 5. В Bielicki et al., Biochem. J. 279:515-520, 1991, описана очистка и охарактеризация GALNS из печени человека. При анализе посредством SDS-PAGE, фермент имел молекулярную массу 70 кДа в невосстанавливающих условиях и молекулярные массы 57 кДа, 39 кДа и 19 кДа в восстанавливающих условиях. В Bielicki et al., Biochem J. 311: 333-339, 1995, описана очистка и охрактеризация рекомбинантной GALNS человека из клеток яичника китайского хомяка. При SDS-PAGE было выявлено, что очищенный фермент имеет молекулярную массу 58-60 кДа в невосстанавливающих условиях и молекулярные массы 55-57 кДа, 39 кДа и 38 кДа в восстанавливающих условиях. Таким образом, в Bielicki et al. ферменты GALNS, по-видимому, соответствуют смеси препроцессированной формы (предшественника) фермента и процессированной формы, представленной на фигуре 5. Напротив, рекомбинантный фермент GALNS человека по изобретению состоит практически полностью из формы предшественника фермента (см. фигуру 9), или преимущественно (т.е. по меньшей мере приблизительно на 85%) из формы предшественника фермента (см. фигуру 10).
IV ЛИЗОСОМАЛЬНЫЕ ФЕРМЕНТЫ СУЛЬФАТАЗЫ И ЛИЗОСОМАЛЬНЫЕ БОЛЕЗНИ НАКОПЛЕНИЯ
Лизосомальный фермент сульфатаза представляет собой полноразмерный фермент или любой его фрагмент, мутант, вариант или производное, которые сохраняют по меньшей мере на значительном уровне (например, по меньшей мере приблизительно на 50%, предпочтительно по меньшей мере приблизительно на 75% и более предпочтительно по меньшей мере приблизительно на 90%), по существу всю или всю терапевтическую или биологическую активность (например, сульфатазной активности) фермента.
В некоторых вариантах осуществления, лизосомальный фермент сульфатаза представляет собой фермент, который, если он не экспрессируется или не продуцируется или если его экспрессия или продукция по существу снижены, может привести к заболеванию, включая, но не ограничиваясь ими, лизосомальные болезни накопления. В некоторых вариантах осуществления, лизосомальный фермент сульфатаза представляет собой фермент, который, если он не экспрессируется или не продуцируется или если его экспрессия или продукция по существу снижены, может не привести к заболеванию, но отсутствие или сниженная экспрессия или продукция которого ассоциированы с заболеванием, включая, но не ограничиваясь ими, лизосомальные болезни накопления. Предпочтительно, лизосомальный фермент сульфатаза происходит или получен от человека.
Предпочтительно, при лечении лизосомальных болезней накопления, лизосомальный фермент сульфатаза представляет собой фермент, который находится в клетке и который, если он не экспрессируется или не продуцируется или если его экспрессия или продукция по существу снижены, может привести к лизосомальной болезни накопления. Альтернативно при лечении лизосомальных болезней накопления, лизосомальный фермент сульфатаза представляет собой фермент, отсутствие или существенно сниженная экспрессия или продукция которого ассоциированы с заболеванием, хотя его отсутствие или по существу сниженная экспрессия или продукция сами по себе могут не привести к заболеванию. Предпочтительно, лизосомальный фермент сульфатаза происходит или получен от человека.
Предпочтительно, фермент представляет собой лизосомальный фермент сульфатазу, такой как арилсульфатаза A (ARSA) (регистрационный номер Genbank No. NPJ300478 (изоформа a), регистрационный номер Genbank No. NP_001078897 (изоформа b) и другие варианты), арилсульфатаза B/N-ацетилглюкозамин-4-сульфатаза (ARSB) (регистрационный номер Genbank No. P15848), идуронат-2-сульфатаза (IDS) (регистрационный номер Genbank No. NP_000193 (изоформа a), регистрационный номер Genbank No. NP_006114 (изоформа b)), сульфамидаза/гепарин-N-сульфатаза (SGSH) (регистрационный номер Genbank No. NP_000190), N-ацетилглюкозамин-сульфатаза (G6S) (регистрационный номер Genbank No. NP_002067) и галактозо-6-сульфатаза/N-ацетилгалактозамин-6-сульфатаза (GALNS) (регистрационный номер Genbank No. NP_000503). Ниже представлена таблица лизосомальных болезней накопления и лизосомальных ферментов сульфатаз, дефицитных при них, которые пригодны в качестве лекарственных средств:
В предпочтительных вариантах осуществления, лизосомальный фермент сульфатаза представляет собой рекомбинантный лизосомальный фермент сульфатазу человека, продуцированный дефицитной по эндосомальному закислению клеточной линией. В более предпочтительных вариантах осуществления, рекомбинантный лизосомальный фермент сульфатаза человека является активным и обладает высоким уровнем фосфорилированных олигосахаридов, как описано в разделе "ОПРЕДЕЛЕНИЯ". В наиболее предпочтительных вариантах осуществления, лизосомальный фермент сульфатаза представляет собой активную высокофосфорилированную рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека.
Таким образом, лизосомальные болезни накопления, которые можно лечить или предупреждать с использованием способов по настоящему изобретению, включают, но не ограничиваются ими, метахромную лейкодистрофию, или MLD, синдром Марото-Лами, или MPS VI, синдром Хантера, или MPS II, синдром Санфилиппо A, или MPS IIIa, синдром Санфилиппо D, или MPS IIId, и синдром Моркио A, или MPS IVa. В особенно предпочтительном варианте осуществления, лизосомальный фермент сульфатаза является таким, что его дефицит вызывает синдром Моркио A, или MPS IVa. В другом особенно предпочтительном варианте осуществления, лизосомальный фермент сульфатаза является таким, что его дефицит ассоциирован с лизосомальной болезнью накопления человека, такой как множественная сульфатазная недостаточность или MSD.
Таким образом, согласно указанной выше таблице, для каждого заболевания лизосомальный фермент сульфатаза предпочтительно включает специфический активный лизосомальный фермент сульфатазу, дефицитную при заболевании. Например, для способов, вовлекающих MPS II, предпочтительным ферментом является идуронат-2-сульфатаза. Для способов, вовлекающих MPS IIIA, предпочтительным ферментом является сульфамидаза/гепарин-N-сульфатаза. Для способов, вовлекающих MPS IIID, предпочтительным ферментом является N-ацетилглюкозамин-6-сульфатаза. Для способов, вовлекающих MPS IVA, предпочтительным ферментом является галактозо-6-сульфатаза/N-ацетилгалактозамин-6-сульфатаза. Для способов, вовлекающих MPS VI, предпочтительным ферментом является N-ацетилгалактозамин-4-сульфатаза. Для способов, вовлекающих метахроматичскую лейкодистрофию (MLD), предпочтительным ферментом является арилсульфатаза A. Для способов, вовлекающих множественную сульфатазную недостаточность (MSD), фермент может представлять собой арилсульфатазу A, арилсульфатазу B/N-ацетилглюкозамин-4-сульфатазу, идуронат-2-сульфатазу, сульфамидазу/гепарин-N-сульфатазу, N-ацетилглюкозамин-сульфатазу или галактозо-6-сульфатазу/N-ацетилгалактозамин-6-сульфатазу, и предпочтительным ферментом является галактозо-6-сульфатаза/N-ацетилгалактозамин-6-сульфатаза.
V МУКОПОЛИСАХАРИДОЗ ТИПА IVA (СИНДРОМ МОРКИО, MPS IVA)
Мукополисахаридоз типа IVA (синдром Моркио, MPS IVa) представляет собой врожденное аутосомно-рецессивное заболевание, относящееся к группе болезней накопления мукополисахаридов. Синдром Моркио вызывается дефицитом лизосомального фермента, требуемого для деградации двух гликозаминогликанов (GAG): кератансульфата (KS) и хондроитин-6-сульфата (C6S). Конкретно, MPS IVa харатеризуется отсутствием фермента N-ацетилгалактозамин-6-сульфатазы (GALNS) и экскрецией KS в мочу. Отсутствие GALNS приводит к аномально большим количествам мукополисахаридов в гиалиновом хряще, основном компоненте скелетных тканей. Все пациенты обладают системной дисплазией скелета. Другие симптомы варьируют по тяжести от пациента к пациенту и могут включать утрату слуха, катаракту, нестабильность позвоночника, болезнь клапанов сердца и респираторные проблемы, помимо прочих.
GALNS гидролизует сульфатные сложноэфирные связи в галактозо-6-сульфате из KS и в N-ацетилгалактозамин-6-сульфате из C6S. GALNS человека экспрессируется в качестве белка-предшественника массой 55-60 кДа только с 2 потенциальными связанными с аспарагином участками гликозилирования. Манноза-6-фосфат (M6P) является частью олигосахаридов, присутствующих на молекуле GALNS. M6P распознается рецептором на поверхности лизосомальных клеток и, следовательно, является важным для эффективного захвата GALNS.
Подобно всем сульфатазам, GALNS должна процессироваться формилглицин-активирующим ферментом (FGE), кодируемым геном модифицирующего сульфатазу фактора 1 (SUMF1), для увеличения активности. Вследствие этой стадии активации, вовлекающей посттрансляционную модификацию остатка цистеина активного центра в Cα-формилглицин (FGly), сверхэкспрессия рекомбинантных сульфатаз может привести к продукции ферментов сульфатаз как с низкой удельной активностью (т.е. смесь активированных и неактивированных сульфатазных ферментов), так и с низким титром продукции (т.е. деградация и/или отсутствие секреции неактивированных сульфатаз).
Задачей этого изобретения является предоставление активного высокофосфорилированного фермента N-ацетилгалактозамин-6-сульфатазы человека, пригодного для лечения синдрома Моркио и других заболеваний, например множественной сульфатазной недостаточности (MSD), которые вызываются дефицитом фермента N-ацетилгалактозамин-6-сульфатазы или ассоциированы с ним. Такой активный высокофосфорилированный фермент N-ацетилгалактозамин-6-сульфатаза человека обладает способностью локализоваться в тканях, в которых накапливается KS и C6S, имеет достаточные уровни M6P для эффективного захвата, имеет достаточно высокий процент FGly для активности фермента и обладает относительно высокими уровнями продукции.
Следует понимать, что способы по изобретению, описанные в настоящем документе, применимы для продукции других лизосомальных ферментов сульфатаз, например арилсульфатазы A (ARSA), арилсульфатазы B/N-ацетилглюкозамин-4-сульфатазы (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH) и N-ацетилглюкозамин-сульфатазы (G6S), пригодных для лечения лизосомальных болезней накопления, которые вызываются или характеризуются их дефицитом.
VI ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ВВЕДЕНИЕ
Лизосомальные ферменты сульфатазы по изобретению можно вводить различными способами. Для пероральных препаратов, лизосомальные ферменты сульфатазы можно использовать отдельно или в сочетании с соответствующими добавками для изготовления таблеток, порошков, гранул или капсул, например с общепринятыми добавками, такими как лактоза, маннит, кукурузный крахмал или картофельный крахмал; со связующими веществами, такими как кристаллическая целлюлоза, производные целлюлозы, гуммиарабик, кукурузный крахмал или желатины; с дезинтегрирующими веществами, такими как кукурузный крахмал, картофельный крахмал или карбоксиметилцеллюлоза натрия; со смазывающими веществами, такими как тальк или стеарат магния; и если желательно, с разбавителями, буферными средствами, увлажняющими средствами, консервантами и вкусовыми добавками.
Лизосомальные ферменты сульфатазы по изобретению можно изготавливать в виде препаратов для инъекции путем растворения, суспендирования или эмульгации их в водном или неводном растворителе, таком как растительное или другие сходные масла, синтетические глицериды алифатических кислот, сложные эфиры высших алифатических кислот или пропиленгликоль; и если желательно, с общепринятыми добавками, такими как солюбилизаторы, обеспечивающие изотоничность вещества, суспендирующие вещества, эмульгаторы, стабилизаторы и консерванты.
Лизосомальные ферменты сульфатазы по изобретению можно использовать в аэрозольном составе для введения путем ингаляции. Лизосомальные ферменты сульфатазы по изобретению можно изготавливать в приемлемых пропеллентах под давлением, таких как дихлордифторметан, пропан, азот и т.п.
Более того, лизосомальные ферменты сульфатазы по изобретению можно изготавливать в виде суппозиториев смешиванием с различными основами, такими как эмульгирующие основы или растворимые в воде основы. Лизосомальные ферменты сульфатазы по изобретению можно вводить ректально с помощью суппозитория. Суппозиторий может включать носители, такие как масло какао, карбоваксы и полиэтиленгликоли, которые плавятся при температуре тела и являются твердыми при комнатной температуре.
Могут быть предоставлены единичные дозированные формы лизосомальных ферментов сульфатаз по изобретению для перорального или ректального введения, такие как сиропы, эликсиры и суспензии, где каждая дозированная единица, например чайная ложка, столовая ложка, таблетка или суппозиторий, содержит заданное количество лизосомального фермента сульфатазы, содержащей активное вещество. Аналогично, единичные дозированные формы для инъекции или внутривенного введения могут содержать лизосомальный фермент сульфатазу в качестве раствора в стерильной воде, нормальном солевом растворе или другом фармацевтически приемлемом носителе.
При практическом применении, лизосомальные ферменты сульфатазы по изобретению можно комбинировать в качестве активного ингредиента в однородной смеси с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами согласно общепринятым способам изготовления. Носитель, разбавитель или эксципиент могут иметь различные формы, в зависимости от предпочтительной формы желаемого препарата для введения, например пероральной или парентеральной (включая внутривенную) формы. При получении композиций лизосомального фермента сульфатазы для пероральной дозированной формы, можно использовать любую из обычных фармацевтических сред, например, таких как вода, гликоли, масла, спирты, вкусовые добавки, консерванты, красители и т.п., в случае пероральных жидких препаратов, например суспензий, эликсиров и растворов; или носителей, таких как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие средства, смазывающие вещества, связующие вещества, дезинтегрирующие вещества и т.п., в случае пероральных твердых препаратов, например порошков, твердых и мягких капсул и таблеток, причем твердые пероральные препараты являются предпочтительными относительно жидких препаратов.
В отношении трансдермальных способов введения, способы трансдермального введения лекарственных средств описаны в Remington's Pharmaceutical Sciences, 17th Edition (Gennaro et al., Eds. Mack Publishing Co., 1985). Дермальные или кожные пластыри являются предпочтительными средствами для трансдермальной доставки лизосомальных ферментов сульфатаз по изобретению. В пластырях предпочтительно предусмотрен усилитель всасывания, такой как DMSO, для повышения всасывания лизосомальных ферментов сульфатаз. Другие способы трансдермальной доставки лекарственных средств описаны в патентах США No. 5962012, 6261595 и 6261595, все из которых включены в настоящий документ в качестве ссылок в полном объеме.
Фармацевтически приемлемые эксципиенты, такие как переносчики, адъюванты, носители или разбавители, являются коммерчески доступными. Более того, также являются коммерчески доступными фармацевтически приемлемые вспомогательные вещества, такие как корректирующие pH и буферные средства, корректирующие тоничность средства, стабилизаторы, смачивающие вещества и т.п.
В каждом из этих аспектов, композиции лизосомальных ферментов сульфатаз включают, но не ограничиваются ими, композиции, пригодные для перорального, ректального, местного, парентерального (включая подкожное, внутримышечное и внутривенное), легочное (назальная или буккальная ингаляция) или назальное введение, хотя наиболее пригодный способ в любом данном случае частично зависит от природы и тяжести состояний, подвергаемых лечению, и от природы активного ингредиента. Иллюстративными способами введения являются пероральный и внутривенный способ. Композиции лизосомального фермента сульфатазы могут удобным образом быть представлены в единичной дозированной форме и получены любыми из способов, хорошо известных в области фармацевтики.
Вследствие простоты введения, таблетки и капсулы представляют собой наиболее преимущественную пероральную единичную дозированную форму, в случае которых обычно используют твердые фармацевтические носители. Если желательно, таблетки можно покрывать стандартными водными или неводными способами. Процент активного лизосомального фермента сульфатазы в этих композициях может, безусловно, варьировать, и удобно, чтобы он составлял между приблизительно 2 процентами и приблизительно 60 процентами массы единицы.
Композиции лизосомального фермента сульфатазы по изобретению можно вводить инкапсулированными в вирусные оболочки или везикулы, или прикрепленными к ним, или включенными в клетки. Везикулы представляют собой мицеллярные частицы, которые обычно являются сферическими и которые часто являются липидными. Липосомы представляют собой везикулы, образованные из двухслойной мембраны. Пригодные везикулы включают, но не ограничиваются ими, однослойные везикулы и многослойные липидные везикулы или липосомы. Такие везикулы и липосомы могут быть изготовлены из широкого диапазона липидных или фосфолипидных соединений, таких как фосфатидилхолин, фосфатидная кислота, фосфатидилсерин, фосфатидилэтаноламин, сфингомиелин, гликолипиды, ганглиозид и т.д., с использованием стандартных способов, таких как описаны, например, в патенте США No. 4394448. Такие везикулы или липосомы можно использовать для введения лизосомальных ферментов сульфатаз внутриклеточно и для доставки лизосомальных ферментов сульфатаз в органы-мишени. Также с использованием инкапсулирования можно достигать контролируемого высвобождения представляющего интерес лизосомального фермента сульфатазы (см., например, патент США No. 5186941).
Можно использовать любой способ введения, который рассредотачивает композицию лизосомального фермента сульфатазы в кровотоке или предпочтительно по меньшей мере за пределами гематоэнцефалического барьера. Предпочтительно композицию лизосомального фермента сульфатазы вводят на периферии, наиболее предпочтительно внутривенно или путем сердечного катетера. Также пригодны внутрияремные и внутрикаротидные инъекции. Композиции лизосомального фермента сульфатазы можно вводить местно или регионально, например внутрибрюшинно, подкожно или внутримышечно. В одном аспекте композиции лизосомального фермента сульфатазы вводят с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами.
Специалисты в данной области оценят, что уровни доз могут варьировать в зависимости от конкретного лизосомального фермента сульфатазы, тяжести симптомов и чувствительности субъекта к побочным эффектам. Предпочтительные дозировки для данного лизосомального фермента сульфатазы могут легко определить специалисты в данной области различными способами, включая, но не ограничиваясь ими, оценку ответа на дозу и фармакокинетические оценки, проводимые у пациентов, у тестируемых животных и in vitro.
Дозировки, подлежащие введению, также могут зависеть от индивидуальных потребностей, от желаемого эффекта, от конкретного используемого лизосомального фермента сульфатазы и от выбранного способа введения. Дозировки лизосомального фермента сульфатазы варьируют от приблизительно 0,2 пмоль/кг до приблизительно 20 нмоль/кг, предпочтительные дозировки варьируют от 2 пмоль/кг до 2 нмоль/кг, и особенно предпочтительные дозировки варьируют от 2 пмоль/кг до 200 пмоль/кг. Альтернативно дозировки лизосомального фермента сульфатазы могут находиться в диапазоне от 0,01 до 1000 мг/кг, предпочтительные дозировки могут находиться в диапазоне от 0,1 до 100 мг/кг, и особенно предпочтительные дозировки варьируют от 0,1 до 10 мг/кг. На эти дозировки могут влиять, например, не ограничиваясь ими, конкретный лизосомальный фермент сульфатаза, форма фармацевтической композиции, способ введения и область действия конкретного лизосомального фермента сульфатазы.
Лизосомальные ферменты сульфатазы по изобретению пригодны для терапевтического и диагностического вмешательства у животных, в частности у человека. Лизосомальные ферменты сульфатазы могут демонстрировать предпочтительное накопление в конкретных тканях. Предпочтительные медицинские показания для диагностических применений включают, например, любое состояние, ассоциированное с представляющим интерес органом-мишенью (например, легким, печенью, почкой, селезенкой).
Рассматриваемые способы применимы для лечения множества различных болезненных состояний. В определенных вариантах осуществления, особый интерес представляет применение рассматриваемых способов при болезненных состояниях, при которых ранее был идентифицирован лизосомальный фермент сульфатаза, имеющий требуемую активность, но при которых лизосомальный фермент сульфатаза не доставляется надлежащим образом в участок-мишень, область-мишень или компартмент-мишень для обеспечения полностью удовлетворительного терапевтического результата. В случае таких лизосомальных ферментов сульфатаз, рассматриваемые способы продукции активных высокофосфорилированных лизосомальных ферментов сульфатаз можно использовать для повышения терапевтической эффективности и терапевтического индекса лизосомального фермента сульфатазы.
Подразумевают, что лечение охватывает любой благоприятный исход у субъекта, ассоциированный с введением лизосомального фермента сульфатазы, включая снижение вероятности возникновения заболевания, предупреждение заболевания, замедление, остановку или реверсию прогрессирования заболевания или смягчение симптомов, ассоциированных с болезненным состоянием, которым страдает хозяин, где термины "смягчение" или "польза" используют в широком значении для обозначения по меньшей мере снижения величины параметра, например симптома, ассоциированного с патологическим состоянием, подвергаемым лечению, такого как воспаление и ассоциированная с ним боль. По существу, лечение также включает случаи, когда патологическое состояние или по меньшей мере симптомы, ассоциированные с ним, полностью ингибируются, например предотвращаются или останавливаются, например завершаются, так что хозяин более не страдает патологическим состоянием или по меньшей мере не страдает более от симптомов, которые характеризуют патологическое состояние.
Множество хозяев или субъектов можно лечить рассматриваемыми способами. Как правило, такими хозяевами являются "млекопитающие" или "млекопитающее", где эти термины широко используют для описания организмов, которые относятся к классу млекопитающих, включая отряды хищников (например, собак и кошек), грызунов (например, мышей, морских свинок и крыс) и приматов (например, людей, шимпанзе и обезьян). Во многих вариантах осуществления, хозяином является человек.
После описания, в общем, изобретения, описанное будет более понятно с помощью представленных ниже примеров, в которых предоставлены иллюстративные протоколы для продукции и очистки активных высокофосфорилированных лизосомальных ферментов сульфатаз и их применение для лечения лизосомальных болезней накопления. Примеры предоставлены только для иллюстративных целей, и не предназначены для ограничения объема настоящего изобретения никоим образом. Были предприняты усилия для обеспечения точности в отношении используемых чисел (например, количеств, температур и т.д.), однако, безусловно, следует допускать некоторую экспериментальную ошибку и отклонение.
ПРИМЕРЫ
ПРИМЕР I
ЭКСПРЕССИРУЮЩИЕ ВЕКТОРЫ МЛЕКОПИТАЮЩИХ ДЛЯ МОДИФИЦИРУЮЩЕГО СУЛЬФАТАЗУ ФАКТОРА 1 (SUMF1) ЧЕЛОВЕКА И N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА
Задачей было конструировать экспрессирующие векторы млекопитающих, пригодные для продукции в стабильно трансфицированных клетках активного лизосомального фермента сульфатазы в достаточных количествах с повышенными уровнями фосфорилирования.
кДНК полноразмерного модифицирующего сульфатазу фактора 1 (SUMF1) человека (см. патентные заявки США No. US 20005/0123949, с датой публикации 9 июня 2005 года, и US 2004/0229250, с датой публикации 8 ноября 2004 года, обе из которых включены в настоящий документ в качестве ссылок в полном объеме), которая кодирует полипептид из 374 аминокислот, клонировали в экспрессирующий вектор млекопитающих cDNA4 (Invitrogen, Carlsbad, CA), который содержит энхансер-промотор CMV человека и полилинкер. Эффективную терминацию транскрипции обеспечивали наличием последовательности полиаденилирования бычьего гормона роста. Селективный маркер представлял собой ген устойчивости к зеоцину под контролем промотора EM-7 и ранней последовательности полиаденилирования SV40. Полученная плазмида была обозначена как pcDNA4 SUMF1. Полинуклеотидная (SEQ ID NO:1) и полипептидная (SEQ ID NO:2) последовательности SUMF1 человека представлены на фигуре 1 и фигуре 2, соответственно.
кДНК полноразмерной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (см. Tomatsu et al., Biochem. Biophys. Res. Commun. 181(2):677-683, 1991), которая кодирует полипептид из 522 аминокислот, включающий сигнальный пептид из 26 аминокислот, клонировали в экспрессирующий вектор млекопитающих pCIN (BioMarin), который содержит энхансер-промотор CMV человека, связанный с интроном β-глобина IVS2 кролика, и полилинкер. Эффективную терминацию транскрипции обеспечивали наличием последовательности полиаденилирования бычьего гормона роста. Селективный маркер представлял собой ген фосфотрансферазы неомицина, который несет точковую мутацию, снижающую эффективность фермента. Ослабленный маркер далее ослабляли слабым промотором HSV-tk. Полученная плазмида была обозначена как pCIN 4A. Полинуклеотидная (SEQ ID NO:3) и полипептидная (SEQ ID NO:4) последовательности GALNS человека представлены на фигуре 3 и фигуре 4, соответственно.
Для повышения уровней экспрессии SUMF1 и GALNS, элементы каркаса/области прикрепления к матриксу (MAR) (см. Mermod et al., патент США No. 7129062) клонировали в экспрессирующие плазмиды для SUMF1 и GALNS.
BMAR SUMF1 получали расщеплением P<1_68 X_X NcoI filled MAR (Selexis) посредством BamHI и HincII, а затем встраиванием высвобожденного фрагмента MAR в pcDNA4 SUMF1, расщепленную BgIII и NruI.
PMAR SUMF1 получали расщеплением P<1_68 NcoI filled (MAR) SV40 EGFP (Selexis) посредством HindIII и XbaI для удаления гена EGFP, а затем встраивания гена SUMF1, который высвобождали из pcDNA4 SUMF1 путем расщепления HindIII и XbaI.
BMAR 4A получали расщеплением BMAR SUMF1 посредством PmeI и SpeI для удаления гена SUMF1 и затем встраивания гена GALNS, который высвобождали из pCIN 4A путем расщепления PmeI и SpeI.
PMAR 4A получали расщеплением P<1_68 NcoI filled (MAR) SV40 EGFP (Selexis) посредством HindIII и XbaI для удаления гена EGFP, а затем встраивания гена GALNS, который высвобождали из pCIN 4A расщеплением HindIII и XbaI.
Полноразмерную кДНК GALNS человека также клонировали в экспрессирующий вектор млекопитающих pcDNA4 (Invitrogen, Carlsbad, CA). pcDNA4 SUMF1 расщепляли посредством HindIII и XbaI для удаления кДНК SUMF1 и pCIN 4A расщепляли HindIII и XbaI для выделения кДНК GALNS. Фрагмент кДНК GALNS HindIII/XbaT лигировали во фрагмент вектора pcDNA4 HindIII/XbaI. Полученную плазмиду обозначили pcDNA4-4A.
Целостность гена GALNS в экспрессирующих векторах pCIN 4A, BMAR и pcDNA4-4A подтверждали рестрикционным картированием с использованием ферментов, полученных от New England Biolabs. Экспрессирующий вектор PMAR 4A не картировали.
Структура полностью процессированной формы N-ацетилгалактозамин-6-сульфатазы (GALNS) человека представлена на фигуре 5. GALNS экспрессируется в качестве полипептида из 522 аминокислот с последовательностью сигнального пептида из 26 аминокислот. Полипептид GALNS из 496 аминокислот секретируется в качестве предварительно процессированной формы (предшественника) фермента, имеющей молекулярную массу приблизительно 55-60 кДа. В активной GALNS, остаток цистеина в положении 53 предшественника или полностью процессированного полипептида GALNS (соответствующий положению 79 полноразмерного полипептида GALNS) превращен в Cα-формилглицин (FGly) с помощью модифицирующего сульфатазу фактора 1 (SUMF1). В лизосоме GALNS расщепляется после положения 325 полностью процессированного полипептида GALNS, образуя пептидные фрагменты GALNS массой приблизительно 40 кДа и 19 кДа. Эти пептиды GALNS связываются дисульфидным мостиком между остатками цистеина (C) в положениях 282 и 393 полностью процессированного полипептида GALNS. Существует два канонических участка N-связанного гликозилирования, в положениях 178 и 397 полностью процессированного полипептида GALNS. Бис-фосфорилированная манноза 7 (BPM7), содержащая остатки 2 манноза-6-фосфата, была выявлена на N178, но не на N397.
ПРИМЕР II
КЛЕТОЧНЫЕ ЛИНИИ G71S, КОЭКСПРЕССИРУЮЩИЕ МОДИФИЦИРУЮЩИЙ СУЛЬФАТАЗУ ЧЕЛОВЕКА ФАКТОР 1 (SUMF1) И N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗУ (GALNS) ЧЕЛОВЕКА
Задачей была разработка клеточных линий, способных продуцировать активные лизосомальные ферменты сульфатазы с повышенными уровнями фосфорилирования.
Клетки G71 (Rockford K. Draper) были получены непосредственно из CHO-K1 (ATCC CCL-61). Клеточная линия G71 представляет собой чувствительный к температуре мутант CHO-K1 в отношении закисления эндосом, который, как было показано, осуществляет отличающуюся общую секрецию белка и фосфорилирование на остатках маннозы нескольких ферментов при повышенных температурах (Park et al., Somat. Cell Mol. Genet. 17(2): 137-150, 1991; Marnell et al., J. Cell. Biol. 99(6): 1907-1916, 1984).
Клетки G71 поддерживали при 34°C в среде BioWhittaker UltraCHO, дополненной 2,5% эмбриональной телячьей сывороткой, 2 мМ глутамином, гентамицином и амфотерицином.
Для обеспечения более простого применения клеточных линий для продукции белка, прикрепляющиеся клетки G71 предварительно адаптировали к бессывороточной среде для роста с использованием протокола для адаптации зависимых от прикрепления, зависимых от сыворотки клеточных линий млекопитающих к высокоплотной бессывороточной суспензионной культуре (Sinacore et al., Mol. Biotechnol. 15(3):249-257, 2000), получая адаптированную к бессывороточной суспензионной культуре клеточную линию G71S. Альтернативно прикрепленные клетки G71 после стабильной трансфекции, как описано ниже, можно адаптировать к бессывороточной среде для роста, как описано в Sinacore et al.
Парные комбинации экспрессирующих векторов для SUMF1 человека и GALNS человека (пример I): либо pcDNA4 SUMF1 вместе с pCIN4 4A, либо BMAR SUMF1 вместе с BMAR 4A, либо PMAR SUMF1 вместе PMAR 4A, трансфицировали в соответствии с протоколом MARtech II, как описано Selexis, в клетки G71S, растущие в культуральной среде, дополненной антибиотическим-антимикотическим раствором (100 МЕ пенициллина, 10 мг стрептомицина, 25 мкг амфотерицина B, Cellgro). Пулы трансфектантов выращивали в среде UltraCHO (Cambrex), дополненной 5% γ-облученной эмбриональной телячьей сывороткой (FBS, JRH), 200 мкг/мл G418 (AG Scientific) и 200 мкг/мл зеоцина (Invitrogen), и клонировали способом лимитирующих разведений в 96-луночных планшетах в той же среде для роста. Мониторинг роста клонов проводили визуализацией Cell Screen (Innovatis). Все клоны подвергали скринингу с использованием ELISA с активностью улавливания фермента для активной GALNS (см. пример IV). Клеточную продуктивность вычисляли делением активности GALNS при ELISA с активностью улавливания фермента на рост клеток (Vi-Cell, Beckman Coulter) в сутки в течение 4 суток.
Было получено 202 клона G71S, и они были подвергнуты скринингу в отношении активной GALNS: 86 клонов, котрансфицированных pcDNA4 SUMF1 вместе с pCIN 4A, 65 клонов, котрансфицированных BMAR SUMF1 вместе с BMAR 4A, и 51 клонов, котрансфицированных PMAR SUMF1 вместе PMAR 4A. Сначала клоны подвергали селекции на основе высоких уровней GALNS из 96-луночных планшетов для культивирования тканей (фигура 6A). Активность GALNS измеряли с использованием ELISA с активностью улавливания фермента и представляли в нг/мл (ось y). На оси x представлены три условия котрансфекции, использованные для экспрессии SUMF1 и GALNS: промотор hCMV без MAR, промотор hCMV с MAR и промотор SV40 с MAR. Каждый столбец соответствует отдельному клону из соответствующей популяции. В этом скрининге клонов из 96-лунок не учитывали клеточную плотность, и на этой фигуре представлены не все из котрансфицированных клонов G71S.
Наиболее активные продуцирующие GALNS клоны G71S выбирали для анализа продуктивности (фигура 6B). Клеточную продуктивность в сутки выражали в пг/клетка/сутки и получали делением активности GALNS на клеточную плотность на данные сутки. На этой фигуре представлены четвертые сутки (96 часов) после высевания в количестве 5×105 клеток/флакон. Клоны анализировали в отношении GALNS с использованием ELISA с активностью улавливания фермента в пг/клетка/сутки (ось y). Положительные контроли состояли из BHK, экспрессирующих GALNS, и клонов CHO (BioMarin). Каждый вертикальный столбец соответствует отдельному клону. Активную GALNS продуцировали клоны pCIN 4A, но только немного выше фонового уровня в анализе.
Анализ клонов скринингом 96 лунок и анализ продуктивности на 4 сутки показал, что котрансфекция экспрессирующих векторов с элементами MAR повышала продуктивность клонов G71S по сравнению с котрансфекцией экспрессирующих векторов без элементов MAR. Котрансфицированные клоны BMAR 4A + BMAR SUMF1 продемонстрировали быстрое образование пула, быстрый рост клонов и способность продуцировать более чем в 2 раза больше активной GALNS по сравнению с наиболее высокопродуцирующими клонами PMAR 4A и вплоть до 10-кратного повышения относительно клонов CHO 4A и BHK 4A, лишенных элементов MAR.
Экспрессирующие GALNS клоны G71S адаптировали к бессывороточной среде для роста с использованием протокола, описанного в Sinacore et al., Mol. Biotechnol. 15(3):249-257, 2000. Полную адаптацию проводили в присутствии обоих средств для селекции (зеоцина в концентрации 200 мкг/мл и неомицина в концентрации 200 мкг/мл). Экспрессирующие GALNS клоны G71, культивированные в T-флаконах, разделяли следующим образом: (1) в 125-мл флаконы для встряхивания со средой Cambrex UltraCHO и 5% FBS (партия # 8L2242); (2) в 125-мл флаконы для встряхивания со средой JRH 302M (среда для продукции) и 5% FBS; (3) в T-флаконы в качестве дублирования (UltraCHO, 5% FBS). После установления суспензионной культуры, прикрепленные клетки удаляли и начинали устранение FBS. Когда скорость роста возвращалась до >0,5 (л/сутки) в течение 3 пассажей и жизнеспособность составляла >95%, концентрацию FBS снижали на 50%. Клетки оставляли при данной концентрации FBS в течение минимум 3 пассажей. После адаптации для роста в 2,5% FBS, клетки отбирали прямо в бессывороточную среду. Клетки держали в свежей среде с 10% (об./об.) DMSO. Тестировали испытательное размораживание для того, чтобы убедиться, что клетки выживают после процесса замораживания. Для двух экспрессирующих GALNS клонов G71S после трансфекции BMAR 4A + BMAR SUMF1, клонов 4 и 5, адаптация к бессывороточной суспензионной культуре заняла приблизительно 15 пассажей. Также выделяли клон C6, экспрессирующий GALNS после трансфекции pcDNA4 SUMF1 вместе с pCIN 4A, и адаптировали его к бессывороточной культуре.
Парные комбинации экспрессирующих векторов для SUMF1 человека и GALNS человека (пример I), pcDNA4 SUMF1 вместе с pcDNA4-4A, трансфицировали в клетки G71S, главным образом, как описано выше, за исключением того, что для селекции использовали 200 мкг/мл зеоцина (Invitrogen). Шесть клонов, экспрессирующих GALNS, C2, C5, C7, C10, C11 и C30, выделяли и адаптировали к бессывороточной суспензонной культуре, главным образом, как описано выше.
ПРИМЕР III
КРУПНОМАСШТАБНАЯ КУЛЬТУРА КЛЕТОЧНЫХ ЛИНИЙ G71S, ЭКСПРЕССИРУЮЩИХ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗУ (GALNS) ЧЕЛОВЕКА
Задачей было измерение продукции фермента из клонов G71S, экспрессирующих N-ацетилгалактозамин-6-сульфатазу (GALNS) человека. Адаптированные к бессывороточной суспензионной культуре клеточные линии G71S, коэкспрессирующие SUMF1 человека и GALNS человека, культивировали в большом масштабе и оценивали в отношении продукции активного фермента GALNS.
Поскольку адаптация к бессывороточной суспензионной культуре была относительно быстрой для клеточной линии-хозяина G71S, было решено, что продукцию можно проводить в биореакторе WAVE, действующем в режиме перфузии. Биореактор WAVE позволяет большую универсальность в отношении объема инокулята, поскольку масштабирование можно проводить непосредственно в мешке, снижая риск контаминации и ускоряя продукцию материала. На фигуре 7 представлена схема системы биореактора WAVE. На диаграмме представлено, в режиме перфузии, что датчик напряжения осуществляет мониторинг объема среды в мешке путем определения массы мешка и коррекции уровней подачи и сбора для поддержания желаемого объема. В мешке объемом 10 л, pH также контролируется до желаемой заданной величины зондом, который помещен в мешок.
Материал из экспрессирующих GALNS клонов G71S 4 и 5 получали в масштабе 1 л. В этих анализах pH культуры не контролировали. Эксплуатационное ограничение мешка WAVE составляет выработку 3 объемов емкости в сутки (VV/сутки). Для предотвращения какой-либо инактивации материала, удельная скорость перфузии клеток-мишеней (CSPR) составляла 0,3 нл/клетка/сутки, обеспечивая среднее время нахождения для ферментов GALNS, составляющее восемь часов. Таким образом, плотность клеток в мешке поддерживали на уровне приблизительно 10-12×106 клеток/мл. Скорость роста экспрессирующих GALNS клонов G71S 4 и 5 составила 0,16 и 0,20, соответственно. Сливания для поддержания плотности клеток-мишеней проводили непосредственно из мешка.
pH собранной жидкости доводили до pH между 5,5 и 6,5 для поддержания ферментативной активности, поскольку ранее было показано, что GALNS является стабильной при pH 6. Это проводили болюсным добавлением по расписанию 5% по объему pH 4,0 цитратно-натриевого буфера, однородно смешанного с собранной жидкостью, выходящей из реактора. Доведенную собранную жидкость хранили при 4°C перед последующей переработкой. Два экспрессирующих GALNS клона G71S 4 и 5 имели средние титры приблизительно 4,2 мг/л с ассоциированной удельной продуктивностью приблизительно 1,25 пг/клетка/сутки.
Экспрессирующие GALNS клоны G71S, C2, C5, C6, C7, C10, C11 и C30 аналогичным образом культивировали в большом масштабе и оценивали в отношении продукции активного фермента GALNS.
ПРИМЕР IV
ИЗМЕРЕНИЕ КОНЦЕНТРАЦИИ И АКТИВНОСТИ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА
Твердофазные иммуноферментные анализы (ELISA) разрабатывали для измерения концентрации и активности фермента GALNS из клонов G71S, коэкспрессирующих SUMF1 человека и N-ацетилгалактозамин-6-сульфатазу (GALNS) человека.
ELISA с активностью улавливания фермента
В ELISA с активностью улавливания ферментов измеряется активность фермента GALNS в твердой фазе, с последующим улавливанием специфическим антителом против GALNS, связанным с планшетом для ELISA.
Буферы. Буфер A (карбонатный буфер): растворить 3,09 граммов Na2CO3 и 5,88 граммов NaHCO3 в 900 мл деионизированной (DI) H2O, затем добавить DI H2O до конечного объема 1000 мл. Проверить, что pH составляет между 9,4 и 9,6, затем провести стерилизацию фильтрованием. Для нанесения полностью в один 96-луночный микропланшет по 100 мкл на лунку, разбавить 19 мкл антитела против GALNS в одной пробирке (12 мл). Буфер B (блокирующий буфер для ELISA и буфер для серийного разведения): 1× кислый PBS, 0,05% Tween-20 и 2% BSA, доведенные до pH 6,5 уксусной кислотой. Буфер Bw (буфер для промывания): 100 мМ NaOAc и 0,05% Tween-20, доведенные до pH 6,5 уксусной кислотой. Буфер C (буфер для субатрата): 25 мМ ацетат натрия, 1 мМ NaCl, 0,5 мг/мл обессоленная BSA и 0,01% азид натрия, доведенный до pH 4,0 ледяной уксусной кислотой. Буфер D (буфер для β-галактозидазы): 300 мМ двухосновный фосфат натрия, 0,1 мг/мл BSA, 0,01% азид натрия и 0,01% Tween-20, доведенный до pH 7,2 фосфорной кислотой. Буфер E (Буфер для остановки): 350 мМ глицин и 440 мМ карбонатный буфер, доведенные до pH 10,7 с помощью 6 M NaOH.
Реагенты. Антитело IgG против GALNS: поликлональные антитела кролика являются очищенными с белком G из сыворотки. В D-PBS, общий белок = 3,17 мг/мл (BCA). Аликвоты (19 мкл) хранят при -20°С, каждую для однократного применения. Субстрат 4MU-Gal-6-S (твердый; ММ 440): 100 мМ исходный раствор получали в DI воде и хранили при 4°С. β-галактозидаза (Sigma G-4155): разбавить до 12 мкг/мл в буфере D перед применением.
Протокол. Связать антитело против GALNS с планшетом: планшет Nunc MaxiSorp ELISA (Nalge/Nunc International, Fisher # 12-565-135) покрывают антителом против GALNS при конечной концентрации белка 5 мкг/мл в буфере A. Для приготовления этого раствора разморозить одну 19-мкл аликвоту, отцентрифугировать быстро (10 с) в микроцентрифуге для сбора жидкости. Перенести все 19 мкл в 12 мл буфера A. Перемешивать энергично переворачиванием, затем перелить в емкость, а затем нанести в планшет (100 мкл на лунку) с использованием многоканальной пипетки. Закрыть планшет и инкубировать при 4°С в течение ночи. Удалить несвязанное антитело против GALNS: промыть планшет наполнением буфером Bw три раза. Блокировать: блокировать планшет буфером B (320 мкл на лунку), затем закрыть планшет и инкубировать при 37°С в течение 1 ч. Приготовить серии разведений очищенного стандарта GALNS и тестируемых образцов (неизвестных) в ходе стадии блокирования: стандарт разбавляют в буфере B до верхнего значения линейного диапазона анализа (128 нг/мл в ряду A), затем серийно разбавляют (в 2 раза) в рядах B-G 96-луночного планшета. Ряд H представляет собой пустой буфер (т.е. без фермента GALNS). Сначала приготовить 500 мкл с концентрацией 128 нг/мл в буфере B. Затем серийно разбавлять в 2 раза в буфере B (250 мкл в 250 мкл) до достижения 2 нг/мл. Удалить буфер для блокирования: после стадии блокирования буфер B удаляют. Связать стандарт фермента GALNS и тестируемые образцы с антителом против GALNS: нанести на планшет с 100 мкл/лунка серийно разбавленного стандарта и тестируемых образцов (в двух экземплярах). Закрыть планшет и инкубировать при 37°С в течение 1 ч. Удалить ингибиторы GALNS: промыть планшет заполнением буфером Bw три раза. Добавить субстрат GALNS (первая реакция): приготовить достаточное количество конечного раствора субстрата для нанесения 100 мкл на лунку (приготавливают не более чем за 1 час до применения). Разбавить исходный раствор 4MU-Gal-6-S (100 мМ) до 1 мМ в буфере C. Нанести 100 мкл на лунку. Закрыть планшет и инкубировать при 37°C в течение 30 мин. Добавить β-галактозидазу (вторая реакция): добавить 50 мкл β-галактозидазы в концентрации 12 мкг/мл в буфере D в каждую лунку. Закрыть планшет и инкубировать при 37°С в течение 15 мин. Реакция остановки: добавить 100 мкл буфера E (буфер для остановки) в каждую лунку для ионизации высвобожденного 4MU. Перенести в планшет для определения флуоресценции: перенести (по 8 лунок за один раз) 200 мкл из 250 мкл в каждой лунке планшета для ELISA в черный необработанный микропланшет для титрования с плоским дном (Fluoroplate, Costar #3915). Считывание флуоресценции: считывать планшет в устройстве для считывания Gemini (Molecular Devices Corporation) с использованием программы SOFTmax PRO (возбуждение - 366 нм, испускание - 446 нм, граница - 435 нм).
ELISA для GALNS
В ELISA для GALNS определяют концентрацию фермента GALNS в кондиционированной клеточной культурой среде или других технологических образцах с использованием иммунологического сэндвич-анализа.
Буферы. Буфер A (карбонатный буфер): растворить 3,09 граммов Na2CO3 и 5,88 граммов NaHCO3 в 900 мл деионизированной (DI) H2O, затем добавить DI H2O до конечного объема 1000 мл. Проверить, что pH составляет между 9,4 и 9,6, затем провести стерилизацию фильтрованием. Для полного покрытия одного 96-луночного микропланшета 100 мкл на лунку, разбавить 19 мкл антитела против GALNS в одной пробирке (12 мл). Буфер B (блокирующий буфер для ELISA и буфер для серийного разведения): 1× кислый PBS, 0,05% Tween-20 и 2% BSA, доведенные до pH 6,5 уксусной кислотой. Буфер Bw (буфер для промывания): 100 мМ NaOAc и 0,05% Tween-20, доведенные до pH 6,5 уксусной кислотой. Буфер F (буфер для остановки): 2 Н H2SO4: всего для 600 мл, добавить 100 мл 12 Н H2SO4 и 500 мл воды MilliQ.
Реагенты. Антитело IgG против GALNS: поликлональные антитела кролика являются очищенными с белком G из сыворотки. В D-PBS, общий белок = 3,17 мг/мл (BCA). Аликвоты (19 мкл) хранят при -20°С, каждую для однократного применения. Конъюгированное с HRP антитело для детекции (RIVAH): конечное конъюгированное антитело разбавляют 1:100 в D-PBS/1% BSA и хранят в 120-мкл аликвотах при -20°С для однократного применения. Набор субстрата TMB EIA Substrate Kit (BioRad #172-1067).
Протокол. Связать антитело против GALNS с планшетом: планшет Nunc MaxiSorp ELISA (Nalge/Nunc International, Fisher # 12-565-135) покрывают антителом против GALNS при конечной концентрации белка 5 мкг/мл в буфере A. Для приготовления этого раствора, разморозить одну 19-мкл аликвоту, отцентрифугировать быстро (10 с) в микроцентрифуге для сбора жидкости. Перенести все 19 мкл в 12 мл буфера A. Перемешивать энергично переворачиванием, затем перелить в емкость, а затем нанести в планшет (100 мкл на лунку) с использованием многоканальной пипетки. Закрыть планшет и инкубировать при 37°С (конвекционный инкубатор) в течение двух часов. Не использовать горячее блокирование. Удалить несвязанное антитело против GALNS: промыть планшет наполнением буфером Bw три раза. Блокировать: блокировать планшет буфером B (320 мкл на лунку), затем закрыть планшет и инкубировать при 37°С в течение 1 ч. Приготовить серии разведений очищенного стандарта GALNS и тестируемых образцов (неизвестных) в ходе стадии блокирования: стандарт разбавляют в буфере B до верхнего значения линейного диапазона анализа (128 нг/мл в ряду A), затем серийно разбавляют (в 2 раза) в рядах B-G 96-луночного планшета. Ряд H представляет собой пустой буфер (т.е. без фермента GALNS). Сначала приготовить 500 мкл с концентрацией 40 нг/мл в буфере B. Затем серийно разбавлять в 2 раза в буфере B (250 мкл в 250 мкл) до достижения 0,625 нг/мл. Удалить буфер для блокирования: после стадии блокирования буфер B удаляют. Связать стандарт фермента GALNS и тестируемые образцы с антителом против GALNS: нанести на планшет с 100 мкл/лунка серийно разбавленного стандарта и тестируемых образцов (в двух экземплярах). Закрыть планшет и инкубировать при 37°С в течение 1 ч. Промыть: промыть планшет заполнением буфером Bw три раза. Связать конъюгат антитела для детекции: разморозить одну аликвоту (120 мкл) антитела RIVAH, кратковременно отцентрифугировать (10 с) в микроцентрифуге для сбора жидкости. Разбавить все 120 мкл в 11,9 мл буфера B и энергично переворачивать пробирку для смешивания. Перелить в резервуар и добавить 100 мкл на лунку с помощью многоканальной пипетки. Закрыть планшет и инкубировать при 37°С в течение 30 мин. Промыть: промыть планшет заполнением буфером Bw три раза. Субстрат TMB: приготовить конечный раствор субстрата смешиванием 1,2 мл раствора B с 10,8 мл раствора A. Перелить в емкость и добавить по 100 мкл на лунку с помощью многоканальной пипетки. Закрыть планшет и инкубировать при 37°С в течение 15 мин. Раствор для остановки: пипетировать 12 мл 2 Н H2SO4 стоп-раствора в емкости и добавить по 100 мкл на лунку с помощью многоканальной пипетки. Осторожно постучать для перемешивания. Считать A450: считать планшет в устройстве для считывания планшетов.
Анализ удельной активности GALNS
В анализе удельной активности GALNS измеряют ферментативную активность GALNS в растворе с использованием специфичного субстрата для GALNS.
Буферы. Для всех буферов используют MilliQ H2O. Буфер для разведения (DB): для 1 л DB, растворить 1,74 мл уксусной кислоты, 0,75 г ацетата натрия, 233,6 мг NaCl, 2 мл 50% Tween-20 и 10 мл 1% азида натрия в MilliQ H2O и довести pH до 4,0 +/- 0,5 с помощью 0,1 M NaOH, если pH составляет менее 3,95, и с помощью 0,1 M уксусной кислоты, если pH превышает 4,05. Конечные концентрации составляют: 19,5 мМ уксусная кислота, 5,5 мМ ацетат натрия, 1 мМ NaCl, 0,1% Tween-20 и 0,01% азид натрия. Фосфатный буфер (PB): для 1 л PB, растворить 13,9 г NaH2PO4-H2O и 55 г NaHPO4-7H2O в MilliQ H2O и довести pH до 7,2. Конечная концентрация составляет 300 мМ NaPi. Буфер для остановки (SB): для 1 л SB, растворить 26,2 г глицина и 46,6 г карбоната натрия в MilliQ H2O и довести pH до 10,6 с помощью NaOH. Буфер для анализа (AB): разбавить исходный раствор 4MU-Gal-6S 1:50 в DB (конечная концентрация 2 мМ). Буфер для β-галактозидазы (βGB): 25 мкл/мл β-галактозидазы в 300 мМ NaPi, pH 7,2.
Реагенты. 4MU-Gal-6S: 100 мМ в H2O (Toronto Research Chemicals, каталожный # M334480). β-галактозидаза: Sigma G-4155. 4-метилумбеллиферон (стандарт 4MU): Sigma M-1381 (10 мМ исходный раствор в DMSO).
Протокол. Выполнить серийные разведения фермента GALNS. Для очищенной и приготовленной GALNS (~1,5 мг/мл), разбавить образцы 1:10,000 в микроцентрифужных пробирках с низкой адгезией белка (USA Scientific, каталожный #1415-2600), содержащих DB, перед серийными разведениями 1:1. Поместить 100 мкл DB в 96-луночный планшет. В первом ряду пипетировать 100 мкл образца GALNS. Далее провести серийные разведения (1:1) в планшете (A-G на 96-луночных планшетах). В лунку H (пустую) образец не добавляют. Линейный диапазон в этом анализе составляет 1-75 нг/мл. Использовать ту же процедуру для получения стандартной кривой 4MU. Разбавить 10 мМ исходный раствор 4MU в DMSO 1:100 в DB. Начать стандартную кривую 4MU добавлением 50 мкл 50 мкМ 4MU в первую лунку, затем провести серийные разведения. Добавить 50 мкл субстрата, разбавленного в AB (2 мМ 4MU-галактозо-6S в DB) в 96-луночный планшет для определения флуоресценции. Предварительно инкубировать субстрат в течение 10 мин при 37°C. Добавить 50 мкл 100-мкл серийных разведений GALNS и стандартов 4MU в 50 мкл субстрата в AB. Инкубировать при 37°C в течение 30 мин (эта первая реакция удаляет сульфат из субстрата), гасить первую реакцию и начать вторую реакцию добавлением 50 мкл β-галактозидазы (разбавить исходный раствор β-галактозидазы до 25 мкг/мл в βGB). Фосфат ингибирует GALNS, и повышение pH также останавливает реакцию GALNS. После этого конечный pH находится в оптимальном диапазоне pH для β-галактозидаз. Инкубировать эту вторую реакционную смесь в течение 15 мин при 37°C. Ионизировать высвобожденный 4MU добавлением 100 мкл SB. Считывать при Ex355, Em460 на устройстве для считывания 96-луночных планшетов для определения флуоресценции. Вычисления активности ферментов (при 37°С в буфере с pH 4,0): 1 единица = количество мкмоль высвобожденного 4MU/мин; активность = количество мкмоль 4MU/мин/мл; удельная активность = мкмоль 4MU/мин/мг. Вычисление концентрации белка: использовать коэффициент экстинкции GALNS (1 мг/мл = 1,708 единиц поглощения при 280 нм).
ПРИМЕР V
ОЧИСТКА N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ ЧЕЛОВЕКА (GALNS)
Задача состояла в получении большого количества рекомбинантной N-ацетилгалактозамин-6-сульфатазы человека (GALNS). Стабильно трансфицированные клетки G71, коэкспрессирующие SUMF1 человека и GALNS человека, выращивали в условиях культивирования в биореакторе и из клеточной среды очищали активный фермент GALNS.
Устройство для жидкостной хроматографии. Система Amersham Pharmacia Biotech AKTA explorer 900, использующая программное обеспечение Unicorn control.
Способы анализа белка. Для SDS-PAGE, окрашивания кумасси синим (B101-02-COOM), вестерн-блоттинга и анализа белка Брэдфорд следовали стандартным способам. Очистку оценивали по выходу активности и чистоту продукта GALNS оценивали визуально с помощью SDS-PAGE. Присутствие процессированных примесей выявляли вестерн-блоттингом с использованием антитела против GALNS. Концентрацию белка измеряли с использованием анализа белка Брэдфорд. Концентрацию конечного очищенного белка GALNS измеряли путем измерения A280 с использованием коэффициента экстинкции 1,708.
Хроматографические смолы. Blue Sepharose 6 FF (GE Healthcare, партия #306346) и Fractogel SE Hi-Cap (Merck KgaA, FC040894449).
Определение активности фермента GALNS. Удельную активность GALNS определяли с использованием небольшого флуоресцентного субстрата 4-метилумбеллиферил-6-S-GAL (4-MU-6-S-GAL). Анализ удельной активности GALNS вовлекает двухстадийную реакцию, где необходимо добавление β-галактозидазы после инкубации GALNS с субстратом в течение определенного периода времени для высвобождения флуоресцентной метки. Измерения проводят с использованием флуоресцентного устройства для считывания планшетов.
Колонку для обессоливания 10DG (Bio-RAD) уравновешивали буфером для уравновешивания (EQB, 50 мМ NaOAc, 10 мМ NaCl, pH 5,8). Для всех буферов использовали MilliQ H2O. Три (3) мл очищенной GALNS (0,5-2 мг/мл) наносили на колонку для обессоливания, элюировали и собирали 4-мл аликвотами в отдельные тестируемые пробирки с использованием EQB. Концентрацию белка вычисляли с использованием коэффициента экстинкции GALNS (1 мг/мл = 1,708 единиц поглощения при 280 нм).
Обессоленные образцы GALNS подвергали серийному разведению (1:1) в буфере для разведения (DB, 50 мМ NaOAc, 1 мМ NaCl, pH 4,0+0,5 мг/мл BSA). Исходный раствор BSA обессоливали перед применением путем нанесения исходного раствора BSA в концентрации 50 мг/мл (не более чем 5% CV) на колонку G25, предварительно уравновешенную milliQ H2O. 100 мкл обессоленного образца GALNS пипетировали в первом ряду 96-луночного планшета с низким связыванием белка, и серийно разведенные образцы GALNS переносили пипеткой в планшет (ряды A-G на 96-луночных планшетах). 100 мкл DB пипетировали в последнюю лунку (H). Верхний конец линейного диапазона в этом анализе составляет 200 нг/мл, и линейный диапазон составляет 3-200 нг/мл. Тот же способ проводили для получения стандартной кривой с 4-метилумбеллифероном (4MU) (Sigma M-1381, 10 мМ исходный раствор в DMSO). 50 мкл 100-мкл серийных разведений GALNS и 4MU переносили в новый 96-луночный планшет для определения флуоресценции (планшет с черным дном). 50 мкл 2 мМ 4MU-галактозо-6S (в milliQ H2O) добавляли к образцам, подлежащим анализу, и инкубировали при 37°С в течение 30 минут. Эту первую реакцию гасили и начинали вторую реакцию добавлением 50 мкл β-галактозидазы (Sigma G-4155, исходный раствор, разбавленный до 12 мкг/мл в 300 мМ NaPi, pH 7,2) и инкубировали при 37°C в течение 15 минут. Высвобожденный 4MU ионизировали добавлением 100 мкл буфера для остановки (глицин/карбонат, pH 10,6). Проводили считывание планшетов на флуоресцентном устройстве для считывания 96-луночных планшетов (возбуждение 355 нм, испускание 460 нм). 1 единицу определяют как 1 мкмоль высвобожденного 4MU/мин, активность фермента приведена в мкмоль 4MU/мин/мл, и удельная активность приведена в мкмоль 4MU/мин/мг, все при 37°С в буфере с pH 4,0.
Первый процесс очистки. Первый процесс очистки включал стадию ультрафильтрации (UF) с последующим процессом очистки на 2 колонках.
1. Фильтрация собранной жидкости (HF): материал биореактора подвергали стерильной фильтрации через 0,2-мкм фильтр.
2. Ультрафильтрация (UF): материал биореактора концентрировали 10-20× ультрафильтрацией через 30-кДа мембрану Sartocon.
3. Доведение pH 4,5: концентрированный материал биореактора (UF (20×)) доводили до pH 4,5 буфером для доведения pH (1,75 M NaOAc, pH 4,0) при комнатной температуре и перед нанесением на колонку Blue Sepharose подвергали стерильной фильтрации.
4. Blue Sepharose 6 Fast Flow (FF): UF с доведенным pH до 4,5 (20×) наносили на колонку Blue Sepharose и белок GALNS элюировали, как представлено в таблице 1 и на фигуре 9A.
5. Fractogel SE Hi-Cap: элюат из колонки с Blue Sepharose доводили до pH 4,3 и наносили в колонку с Fractogel SE Hi-Cap и белок GALNS элюировали, как представлено в таблице 2 и на фигуре 9B.
Белок GALNS в элюате собирали фракционированием, удалением преэлюированной начальной фракции и постэлюированной конечной фракции.
6. Конечная UF/HF: элюат с колонки Fractogel SE Hi-CAP концентрировали ультрафильтрацией и подвергали стерильной фильтрации, как описано выше.
Состав. Очищенный белок GALNS приготавливали в 10 мМ NaOAc, 1 мМ NaH2PO4, 0,005% Tween-80, pH 5,5.
Исследования стабильности. Мониторинг стабильности конечной приготовленной очищенной GALNS проводили при 4°C и -70°C в качестве функции времени путем хранения небольших аликвот образцов GALNS при соответствующих температурах. В определенные моменты времени, аликвоты замороженных образцов быстро размораживали на водяной бане при 37°C перед измерениями активности. На фигуре 8 показано, что очищенная GALNS была стабильна в буфере для изготовления при 4°C и -70°С в течение вплоть до по меньшей мере 79 суток.
Результаты первой очистки. В таблице 3 представлены выходы после очистки трех препаратов белка GALNS, продуцированного клоном 4 G71S в биореакторе для суспензионной культуры. Чистоту оценивали визуально при SDS-PAGE на уровне 95% во всех случаях.
На фигуре 9 представлен SDS-PAGE белка GALNS, разделенного (A) хроматографией с Blue Sepharose 6 Fast Flow с последующей (B) хроматографией с Fractogel SE Hi-CAP. Гели окрашивали кумасси синим (слева) или антителом против GALNS (справа). Для вестерн-блотов, антитело против GALNS кролика разбавляли 1:5000, и вторичное антитело представляло собой антитело кролика против щелочной фосфатазы. Белок GALNS обладал кажущейся молекулярной массой ~55-60 кДа при SDS-PAGE, что согласуется с ожидаемым размером секретированной предварительно процессированной формы (предшественника) фермента, лишенного сигнального пептида из 26 аминокислотных остатков, и также без расщепления после положения 325.
Охарактеризация N-конца. N-конец очищенного белка GALNS определяли посредством LC/MS. Последовательность N-конца представляла собой APQPPN, что соответствует предсказанному N-концу секретированной формы GALNS, лишенной сигнального пептида из 26 аминокислотных остатков (сравнить: полипептидные последовательности GALNS человека на фигуре 4 и фигуре 5).
Второй процесс очистки. Второй процесс очистки включал стадию ультрафильтрации/диафильтрации (UF/DF) с последующим процессом очистки на 3 колонках.
1. Ультрафильтрация (UF/DF): материал биореактора концентрировали 20× ультрафильтрацией/диафильтрацией через 30-кДа мембрану Sartocon при pH 5,5.
2. Доведение pH 4,5: концентрированный материал биореактора (UF/DF (20×)) доводили до pH 4,5 с помощью буфера для доведения pH (1,75 M NaOAc, pH 4,0) при комнатной температуре и перед нанесением на колонку с Fractogel EMD SE Hi-Cap подвергали стерильной фильтрации.
3. Fractogel EMD SE Hi-Cap: UF/DF (20×), доведенный до pH 4,5, наносили на колонку с Fractogel EMD SE Hi-Cap, промывали последовательно 10 мМ смесью ацетат/фосфат, 50 мМ NaCl, pH 4,5, и 10 мМ смесью ацетат/фосфат, 50 мМ NaCl, pH 5,0, и белок GALNS элюировали 10 мМ смесью ацетат/фосфат, 140 мМ NaCl, pH 5,0.
5. Zn-хелатирующая Sepharose FF: элюат из колонки с Fractogel EMD SE Hi-Cap доводили до 500 мМ NaCl, pH 7,0, и наносили на колонку с Zn-хелатирующей Sepharose FF (Zn-ОЄMAC), промывали 10 мМ смесью ацетат/фосфат, 125 мМ NaCl, 10 мМ имидазолом, pH 7,0, и белок GALNS элюировали 10 мМ смесью ацетат/фосфат, 125 мМ NaCl, 90 мМ имидазолом, pH 7,0.
6. Доведение до pH 3,5: элюат из Zn-хелатирующей колонки Sepharose FF, содержащей белок GALNS, доводили до pH 3,5 для инактивации вируса низким pH, а затем доводили до 10 мМ смеси ацетат/фосфат, 2 M NaCl, pH 5,0.
7. ToyoPearl Butyl 650M: элюат с доведенным до низкого значения pH из Zn-хелатирующей колонки Sepharose FF, наносили в колонку ToyoPearl Butyl 650M, промывали 10 мМ смесью ацетат/фосфат, 2 M NaCl, pH 5,0, и белок GALNS элюировали 10 мМ смесью ацетат/фосфат, 0,7 M NaCl, pH 5,0.
8. Конечная UF/HF: элюат из ToyoPearl Butyl 650M подвергали ультрафильтрации и диафильтрации в 20 мМ ацетате, 1 мМ фосфате, 150 мМ NaCl, pH 5,5.
Приготовление. Очищенный белок GALNS приготавливали в 10 мМ NaOAc/HOAc, 1 мМ NaH2PO4, 150 мМ NaCl, 0,01% Tween-20, pH 5,5.
Результаты второго процесса очистки. В таблице 4 представлен выход белка GALNS, продуцированного из клона C2 G71S в биореакторе с суспензионной культурой с использованием второго процесса очистки. Чистота приготовленного фермента GALNS (т.е. формы предшественника и зрелой или процессированой формы вместе) составила приблизительно 98% при определении с помощью C3 ОФ-ВЭЖХ. Процент формы предшественника фермента GALNS составил приблизительно 85% при определении SDS-капиллярным гель-электрофорезом.
На фигуре 10 представлен SDS-PAGE фермента GALNS, разделенного ультрафильтрацией/диафильтрацией (UF/DF), хроматографией с Fractogel SE Hi-CAP, хроматографией с Zn-хелатирующей Sepharose FF и хроматографий с ToyoPearl Butyl 650M. Гели окрашивали кумасси синим (слева сверху), антителом против GALNS (сверху справа), антителом против катепсина L (снизу слева) и антителом против белков CHO (CHOP, снизу справа). Для вестерн-блотов, поликлональное антитело кролика против GALNS разбавляли до 1:5000, и вторичное антитело представляло собой конъюгат антитела против антител кролика и AP; поликлональное антитело козы против катепсина L разбавляли до 1:1000, и вторичное антитело представляло собой конъюгат антитела против антител козы и HRP; и поликлональное антитело кролика против CHOP разбавляли до 1:1000, и вторичное антитело представляло собой конъюгат антитела против антител кролика и HRP. Предшественник фермента GALNS имеет кажущуюся молекулярную массу ~55-60 кДа при SDS-PAGE, и зрелая или процессированная формы фермента GALNS имеют кажущиеся молекулярные массы ~39 кДа и ~19 кДа при SDS-PAGE.
Обобщение первого процесса очистки. Фермент GALNS очищали с использованием серии очисток, которая представляла собой модифицированную стандартную серию (см. таблицу 5). Собранный материал из биореактора подвергали стерильной фильтрации через 0,2-мкм фильтр и держали при 4°C перед нанесением на колонку для улавливания Blue-Sepharose. Отфильтрованный материал биореактора либо наносили непосредственно, либо концентрировали вплоть до 15× ультрафильтрацией. Модификация серии очисток была необходима, поскольку последующие стадии очистки, хроматография с SP Sepharose с последующей хроматографией с Phenyl Sepharose не привели к достаточно чистой GALNS. С использованием хроматографии с SE Hi-Cap в качестве замены для двух последующих колонок для очистки в процессе очистки с 2 колонками, чистота конечного материала существенно повышалась, и общий выход GALNS значительно возрастал от ~22% до ~80%. Чистота фермента GALNS (состоящего по существу из формы предшественника, см. фигуру 9), при определении C4-ОФ-хроматографией, была приближенно оценена как >95%, и очищенный фермент GALNS оставался стабильным в буфере для изготовления в течение более чем 79 суток как при 4°C, так и при -70°С.
Обобщение второго процесса очистки. Фермент GALNS также очищали с использованием второй серии очисток (см. таблицу 6). Общий выход GALNS составил приблизительно 70%, и чистота фермента GALNS (включая как предшественника, так и зрелую или процессированную форму, см. фигуру 10), при определении C4-ОФ-хроматографией, была грубо оценена как приблизительно 97%.
Эти анализы указывают на то, что протоколы, описанные выше для получения рекомбинантных лизосомальных ферментов сульфатаз, обеспечивают эффективный способ продукции больших количеств высокоочищенного фермента, в частности секретированной предварительно процессированной формы (предшественника) N-ацетилгалактозамин-6-сульфатазы (GALNS) человека.
ПРИМЕР VI
ОХАРАКТЕРИЗАЦИЯ ОЧИЩЕННОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА
Клеточные линии G71 продуцируют белки (например, лизосомальные ферменты) с более высокими уровнями фосфорилирования олигосахаридов с высоким содержанием маннозы, чем отмечается в средней клеточной линии млекопитающих, и соответственно более низким уровнем нефосфорилированных олигосахаридов с высоким содержанием маннозы. Лизосомальный фермент сульфатазу (например, рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека), имеющую высокий уровень бис-фосфорилированных олигосахаридов с высоким содержанием маннозы, как определено в настоящем документе, сравнивают с молекулами, полученными согласно Canfield et al., патент США 6537785, которые не содержат сложных олигосахаридов и обладают только олигосахаридами с высоким содержанием маннозы.
Для определения уровней нефосфорилированных олигосахаридов с высоким содержанием маннозы на лизосомальном ферменте сульфатазе, специалист в данной области может использовать секвенирование с помощью экзогликозидазы высвобожденных олигосахаридов ("секвенирование FACE"), для выявления процентов нефосфорилированных олисахаридных цепей с высоким содержанием маннозы. На нормальном профилирующем геле FACE в уменьшенном объеме, нефосфорилированные олигосахариды с высоким содержанием маннозы совместно мигрируют с конкретными сложными олигосахаридами (например, олигоманнозой 6 и полностью сиалированным комплексом из двух ветвей). Затем нефосфорилированные олигосахариды с высоким содержанием маннозы дифференцируют от других олигосахаридов с помощью ферментативного секвенирования.
Для определения того, обладает ли очищенный лизосомальный фермент сульфатаза (например, рекомбинантная N-ацетилгалактозамин-6-сульфатаза (GALNS) человека), экспрессированный в клетках G71S, повышенным фосфорилированием, определяли уровень манноза-6-фосфата (M6P) на лизосомальном ферменте сульфатазе, а также способность фермента связываться с рецептором M6P (MPR).
Рекомбинантный фермент GALNS человека, экспрессированный в клетках G71S и очищенный, анализировали электрофорезом углеродов с помощью флуоресценции (FACE) и хроматографией на смоле MPR-Sepharose. В системе FACE используется полиакриламидный гель-электрофорез для разделения, количественного определения и определения последовательности олигосахаридов, высвобожденных из гликопротеинов. Относительная интенсивность полосы олигоманнозо-7-бис-фосфата (O7P) при FACE (Hague et al., Electrophoresis 19(15): 2612-20, 1998) и процент активного вещества, удержанного на колонке MPR (Cacia et al., Biochemistry 37(43): 15154-61, 1998), обеспечивают надежные показатели уровня фосфорилирования на моль белка.
Удельная активность. Удельную активность рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека определяли с использованием небольшого флуоресцентного субстрата 4-метилумбеллиферил-6-S-GAL (4MU-Gal-6S) при 37°C. С использованием этого анализа, удельная активность очищенной GALNS составляла 165 мкмоль/мин/мг (0,165 Е/мг).
Стабильность в сыворотке человека. Определяли стабильность GALNS в сыворотке ex vivo. Сыворотку человека (Sigma H-4522) подвергали стерильной фильтрации через 0,2-мкм фильтр PES и 4 мл стерилизованной фильтрацией сыворотки человека предварительно инкубировали во флаконах для культивирования клеток T-25 в течение 1 часа при 37°С в атмосфере 10% CO2 (pH в этот момент составляет 7,4 ± 0,1). К предварительно инкубированной сыворотке добавляли 0,4 мл обессоленной очищенной GALNS (2 мг/мл очищенной GALNS обессоливали в PBS с использованием колонок Bio-RAD 10DG) или контроля в виде PBS, содержащего 0,5 мг/л BSA. 100-мкл образцы отбирали в указанные моменты времени (например, 0, 1, 3,5, 7,5 и 26 часов) и добавляли к 900 мл буфера для гашения (QB, 50 мМ NaOAc, pH 5,6 + 150 мМ NaCl + 0,5 мг/мл BSA + 0,001% Tween-80). Образцы хранили при 4°С до измерения активности фермента GALNS.
Активность фермента GALNS измеряли с использованием ELISA с активностью улавливания фермента. Экстраполируя экспоненциальную спадающую кривую % остаточной активности фермента GALNS, оценили, что время полужизни очищенной GALNS ex vivo в сыворотке составляет 217 часов.
Захват в синовиоциты (хондроциты). Определяли способность GALNS захватываться синовиоцитами (хондроцитами).
Хондроциты (номер ATCC CRL-1832) культивируют в среде для роста (F12 Хэма + 10% FBS) при 37°С в 5% CO2 в 12-луночных чашках. Анализ улавливания в трех образцах требует 4× 12-луночных планшета. Очищенные образцы GALNS и эталонную GALNS разбавляли до 1 мкМ в acPBS/BSA (кислый PBS + 200 мкг/мл BSA). Из 1 мкМ исходных растворов получали кривые захвата для разведений образцов GALNS и эталона: 50,5 мкл (1 мкМ rhASB) в 5 мл разбавителя для анализа захвата (UAD, DMEM + 2 мМ L-глутамин + 0,5 мг/мл BSA), что приводило к 10 нМ образцам GALNS и эталона, которые далее серийно разбавляли до 5, 2,5, 1,25, 0,62, 0,31 и 0,16 нМ серийными двукратными разведениями в UAD. Среду для роста из 12-луночных чашек с монослоем хондроцитов аспирировали, в лунки добавляли 1 мл либо UAD (пустые), либо серийных разведений образцов GALNS или эталонов и инкубировали в течение 4 часов при 37°C в инкубаторе с 10% CO2. Среду для улавливания аспирировали, наклоняя каждую чашку полностью, и каждую лунку промывали 1 мл PBS. PBS аспирировали и хондроциты открепляли добавлением 0,5 мл смеси трипсин/ЭДТА (0,25% трипсин/ 0,1% ЭДТА (Mediatech 25-053-CI, партия 25053025)) на лунку. После открепления от планшета, хондроциты разделяли на аликвоты в предварительно охлажденные на льду пробирки Eppendorf (всего 30 пробирок). Трипсинизированные хондроциты охлаждали, а затем осаждали при низкой скорости в микроцентрифуге (4000 об/мин в течение 3 минут). Трипсин аспирировали полностью, клеточный осадок промывали 1 мл PBS, повторяя один раз стадию в микроцентрифуге и аспирирования. В каждую пробирку добавляли 200 мкл буфера для лизиса клеток (CLB, 50 мМ ацетат натрия, pH 5,6 + 0,1% Triton X-100). Клеточные осадки ресуспендировали импульсным встряхиванием три раза. После ресуспендирования, смеси для лизиса клеток хранили в течение ночи при -80°С или непосредственно анализировали.
Клеточные лизаты размораживали при комнатной температуре и после размораживания переносили на лед. Клеточные лизаты встряхивали для ресуспендирования какого-либо видимого твердого материала, а затем центрфугировали в микроцентрифуге при 14 тысячах об/мин в течение 10 минут при 4°C для осаждения нерастворимого материала. Супернатанты переносили в свежий набор пробирок и осадок удаляли. Затем проводили анализ активности GALNS в супернатантах. Обычно получают кривую разведения из семи точек (серийные двукратные разведения, начиная с 10 нМ и заканчивая 0,16 нМ), которая охватывает ожидаемую Kзахвата довольно равномерно с обеих сторон. Молярность исходных образцов вычисляют с использованием молекулярной массы только белка.
Очищенная GALNS имела Kd захвата синовиоцитами исходя из связывания лиганда в одном участке, составляющую 4,9 нМ.
Анализ связывания с планшетом с рецептором манноза-6-фосфата (M6P). Способность GALNS связываться с рецептором манноза-6-фосфата (M6P) определяли в анализе связывания с планшетом. На планшеты FluoroNunc с высоким связыванием наносили 4 мкг/мл рецептора M6P. Покрытые планшеты промывали два раза 250 мкл/лунка буфера для промывания (WB, TBS + 0,05% Tween 20) и неспецифическое связывание блокировали 200 мкл/лунка буфера для блокирования и разведения (BDB, Pierce SuperBlock buffer, партия #CA46485). Планшеты инкубировали в течение 1 часа при комнатной температуре (RT). В ходе этой стадии блокирования, очищенные образцы GALNS (0,5-2 мг/мл, хранившиеся при 4°С в течение 2 недель) разбавляли до 10 нМ в BDB, а затем серийно разбавляли буфером для разведения (DB, 50 мМ NaOAc, 1 мМ NaCl, pH 4,0 + 0,5 мг/мл BSA) (250 мкл + 250 мкл) до 5, 2,5, 1,25, 0,62, 0,31 и 0,16 нМ. Блокированные планшеты промывали WB, как описано выше, и разбавленные образцы GALNS распределяли в лунки в двух экземплярах в количестве 100 мкл/лунка и инкубировали в течение 1 часа при КТ. В ходе этой стадии инкубации, получали 2 мМ субстрат для определения активности разведением 0,1 мл 100 мМ исходного раствора 6S-галактозо-4MU (хранившегося в H2O, -20°С) в 5 мл DB и предварительно нагревали на водяной бане при 37°C. После инкубации планшеты промывали два раза WB, как описано выше, добавляли 100 мкл разбавленного субстрата и определяли удельную активностью GALNS.
При применении этого анализа, очищенная GALNS имела Kd для связывания с рецептором M6P исходя из связывания в одном участке, составляющую 2,4 нМ.
Связывание с колонкой с рецептором манноза-6-фосфата (M6P). Способность GALNS связываться с рецептором манноза-6-фосфата (M6P) определяли в анализе связывания с колонкой. Колонку с рецептором M6P получали согласно инструкциям изготовителя. Рецептор M6P был из лаборатории Peter Lobel, смола колонки представляла собой активированную смолу NHS (Bio-RAD Affi-Gel 15), и размер колонки составлял 0,7 мл. Колонку с рецептором M6P уравновешивали 10 объемами колонки (CV) буфера для уравновешивания (EQ, кислый PBS, pH 6,0, содержащий 5 мМ β-глицерофосфат, 0,05% Tween 20, 5 мМ глюкозо-1-фосфат и 0,02% NaN3) со скоростью потока 0,25 мл/мин. 6 мкг очищенной GALNS (на 200 мкл) наносили на колонку с рецептором M6P со скоростью потока 0,1 мл/мин. Несвязанную GALNS смывали с колонки с помощью 10 CV EQ со скоростью потока 0,25 мл/мин. Связанную GALNS элюировали с колонки с использованием 0-100% градиента буфера для элюирования (EL, кислый PBS, pH 6,0, содержащий 5 мМ β-глицерофосфат, 0,05% Tween 20, 5 мМ манноза-6-фосфат и 0,02% NaN3) (10 CV), а затем 2 CV 100% EL. Колонку повторно уравновешивали с помощью 3 CV EQ.
С использованием ELISA для GALNS, было определено, что процент очищенной GALNS, которая связалась с рецептором M6P, составил 56%.
Анализ тотальных олигосахаридов капиллярным электрофорезом (CE). Для определения уровня фосфорилирования манноза-6 на GALNS, определяли профиль N-связанных углеводов на тотальных олигосахаридах на GALNS капиллярным электрофорезом (CE), как описано в Ma et al., Anal. Chem. 71(22):5185-5192, 1999. В способе использовали PNGase F для расщепления N-связанных с аспарагином олигосахаридов. Отщепленные олигосахариды выделяли, получали их производное с флуоресцентным красителем и наносили на вращающуюся колонку G10 для удаления избыточного красителя. Очищенные флуоресцентно меченные олигосахариды разделяли электрофоретически, а затем определяли пики с использованием программного обеспечения MDQ-CE (32 Karat Ver. 7.0).
С использованием этого анализа количества олигосахаридов, содержащих бис-фосфорилированную маннозу 7 (BPM7), моно-фосфорилированную маннозу 6 (MPM6) и сиаловую кислоту, для очищенной GALNS составляли 0,58 моль/моль фермента, 0,08 моль/моль фермента и не определялись, соответственно. Было оценено, что процент белков GALNS, содержащих BPM7, составил 29%.
Охарактеризация бис-7 олигосахарида. Определяли локализацию олигосахаридов с бис-фосфорилированной маннозой 7 (BPM7) на GALNS. Остаток аспарагина (Asn) в положении 178 был гликозилирован N-связанным гликозилированием посредством BPM7. Остаток Asn в положении 397 не был гликозилирован N-связанным гликозилированием посредством BPM7, однако было выявлено, что он преимущественно гликозилирован сахарами типа олигоманноз.
Аффинность к гидроксиапатиту. Была разработана модель кости in vitro для определения того, обладает ли GALNS способностью к нацеливанию на кость. Суспензию гидроксиапатита в концентрации 4 мг/мл класса HTP-DNA (Bio-RAD) получали и уравновешивали в DBS + 50 мкг/мл BSA, pH 7,4. Очищенную GALNS, после добавления 50 мкг/мл BSA, обессоливали в DBS, pH 7,4. Обессоленную GALNS в конечной концентрации приблизительно 2 мг/мл подвергали серийному разведению в DBS + 50 мкг/мл BSA, pH 7,4, в 96-луночном планшете. 50 мкл серийно разведенной GALNS переносили в 96-луночный планшет для фильтрации (Millipore #MSGVN2210, гидрофильный PVDF, низкое связывание белка, размер пор 22 мкм). 50 мкл суспензии гидроксиапатита добавляли в лунки планшета для фильтрации, содержащие серийные разведения GALNS, и инкубировали в течение 1 часа при 37°C при мягком встряхивании. Планшет подвергали вакуумной фильтрации.
Супернатанты с вакуумного фильтра анализировали либо посредством ВЭЖХ, либо по активности фермента GALNS, как описано выше. Очищенная GALNS имела Kd для гидроксиапатита 3-4,0 мкМ.
Клеточная линия G71S, экспрессирующая модифицирующий сульфатазу фактор 1 (SUMF1) человека, продуцирует лизосомальные ферменты сульфатазы с более высокими уровнями активации (т.е. превращения остатка цистеина активного центра в Cα-формилглицин (FGly)).
Для определения того, проявляет ли очищенный рекомбинантный лизосомальный фермент сульфатаза (например, N-ацетил галактозамин-6-сульфатаза (GALNS) человека), коэкспрессированный с SUMF1 в клетках G71S, повышенную активацию, определяли величину преобразования остатка цистеина активного центра в FGly на очищенном лизосомальном ферменте сульфатазе.
Активация GALNS. Процентная активация, т.е. процентное преобразование остатка цистеина (Cys) активного центра в Cα-формилглицин (FGly), в GALNS определяли посредством LC/MS (TFA). TIC/1000 для Cys, FGly и Gly составила 39, 1840 и 183, соответственно, указывая на то, что приблизительно 90% очищенной GALNS представляет собой активную форму (т.е. FGly).
Обобщение. В таблице 7 представлено обобщение для охарактеризации рекомбинантной GALNS, экспрессированной в клетках клона 4 G71S. В таблице 8 представлено обобщение для охарактеризации рекомбинантной GALNS, экспрессированной в клетках C2 клона.
Эти результаты демонстрируют, что очищенная рекомбинантная GALNS человека обладает высоким уровнем активации и высокими уровнями фосфорилирования манноза-6-фосфата. Таким образом, клетки G71S, коэкспрессирующие SUMF1 и лизосомальный фермент сульфатазу (т.е. GALNS), эффективно продуцируют активный высокофосфорилированный лизосомальный фермент сульфатазу. Повышенный уровень остатков с высоким содержанием маннозы на таких лизосомальных ферментах сульфатазах приводит к повышенному захвату с помощью MPR на клетках.
ПРИМЕР VII
ЗАХВАТ И АКТИВНОСТЬ РЕКОМБИНАНТНОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА В ХОНДРОЦИТАХ ПРИ СИНДРОМЕ МОРКИО IN VITRO
Оценивали захват рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека лизосомами хондроцитов при синдроме Моркио и способность GALNS разрушать кератансульфат (KS) in vitro.
Хондроциты от пациентов с мукополисахаридозом типа IVa (MPS IVa, синдром Моркио) имеют сниженную активность GALNS и проявляют накопление в лиозосомах KS. Создавали модель MPS IVa in vitro с использованием хондроцитов, выделенных из биоптатов подвздошного гребня пациента с MPS IVa. Однако в культуре первичные хондроциты утрачивают дифференцировку и теряют их характеристики хондроцитов. Таким образом, устанавливали такие условия культивирования, чтобы индуцировать дифференцировку хондроцитов in vitro.
Хондроциты, выделенные от пациента с MPS IVa, обозначаемые MQCH, культивировали в альгинатных гранулах в присутствии IGF-1, TGF-β, трансферрина, инсулина и аскорбиновой кислоты (Chondrocyte Growth Medium, Lonza #CC-3225). Культуральную среду заменяли два раза в неделю в ходе экспериментов в течение от 6 до 15 недель. Эти условия культивирования индуцировали экспрессию фенотипа хондроцитов и дифференцировку. Эти клетки MQCH экспрессировали маркеры хондроцитов, включая определяющую пол область Y-box 9 (Sox 9), коллаген II, коллаген X, олигомерный матриксный белок хряща и мРНК аггрегана, при измерении количественным анализом ОФ-ПЦР с использованием РНК, выделенной из культур клеток MQCH. Эти культивированные клетки MQCH также вырабатывали внеклеточный матрикс.
Для подтверждения того, что клетки MQCH накапливали KS, проводили конфокальную микроскопию. Клетки MQCH в 8-недельной культуре трипсинзировали, осаждали цитоцентрифугированием на стеклянные предметные стекла, фиксировали в ацетоне и замораживали до применения. После размораживания клетки регидратировали и окрашивали с использованием, в качестве первичных и вторичных антител, моноклонального антитела против KS (Chemicon) и конъюгированного с Alexa-488 (зеленый) антитела козы против антител кролика, соответственно. Клетки MQ-CH проявляли точечное внутриклеточное окрашивание, что согласуется с накоплением KS в лизосомах.
Для определения того, может ли очищенная рекомбинантная GALNS человека захватываться клетками MQCH в лизосомы и осуществлять деградацию KS, 6-недельную культуру клеток MQCH инкубировали с 10 нМ рекомбинантной GALNS человека два раза в неделю в течение 9 недель. Захват GALNS и выведение KS определяли конфокальной микроскопией. Использованные первичные антитела представляли собой: (a) поликлональное антитело кролика против GALNS и моноклональное антитело против ассоциированного с лизосомами мембранного белка 1 (LAMP-1) или (b) моноклональное антитело против KS и поликлональное антитело против LAMP-1. Использованные вторичные антитела представляли собой: конъюгированные с Alexa-488 (зеленый) антитела для детекции антител против GALNS или против KS или конъюгированные с Alexa-555 или -594 (красный) антитела для детекции антител против LAMP-1. Препараты клеток MQCH приготавливали для микроскопического исследования в гистологической среде DAPI, которая окрашивает ядра.
В клетках MQCH, обработанных GALNS, наблюдали выраженную колокализацию фермента GALNS и KS с лизосомальным маркером LAMP-1. При воздействии на MQCH рекомбинантной GALNS человека, количество внутриклеточного KS снижалось.
Также измеряли захват GALNS с использованием ELISA для улавливания фермента GALNS и ELISA для удельной активности GALNS, оба из которых описаны в примере IV выше. Нормальные хондроциты человека (NHKC), которые экспрессируют GALNS, использовали в качестве положительного контроля. Как представлено в таблицах 9 и 10, необработанные клетки MQCH не обладали поддающимся детекции ферментом GALNS или активностью, где клетки MCQH, обрабатываемые в течение 9 недель 10 нМ GALNS, имели значительные количества фермента и активность GALNS.
Эти результаты демонстрируют, что очищенная рекомбинантная GALNS человека захватывается хондроцитами при синдроме Моркио в лизосомы и может осуществлять деградацию лизосомального KS in vitro. Эти хондроциты при синдроме Моркио пригодны в качестве модели эффективности in vitro для тестирования лизосомальных ферментов сульфатаз, таких как GALNS, которые осуществляют деградацию KS.
ПРИМЕР VIII
АКТИВНОСТЬ РЕКОМБИНАНТНЫХ ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ ЧЕЛОВЕКА В ОТНОШЕНИИ ДЕГРАДАЦИИ ПРИРОДНЫХ СУБСТРАТОВ В КЛЕТОЧНОМ АНАЛИЗЕ IN VITRO
Клеточные анализы in vitro разрабатывали для измерения активности рекомбинантных лизосомальных ферментов человека, например лизосомальных ферментов сульфатаз, в отношении деградации природных субстратов.
Ферментативную активность рекомбинантных лизосомальных ферментов человека, например лизосомальных ферментов сульфатаз, как правило, измеряют в бесклеточном анализе in vitro с использованием искусственного флуорогенного субстрата (см. пример 4 для GALNS). Однако измеренная активность фермента зависит от размера искусственного субстрата, т.е. от числа моносахаридных элементов. Кроме того, активность фермента измеряют в окружении, которое не отражает ситуацию in vivo. Таким образом, бесклеточный анализ in vitro не учитывает ни способность лизосомальных ферментов расщеплять природные, ни их способность захватываться в клетки-мишени и локализовываться в лизосомах.
Был разработан клеточный анализ in vitro для измерения активности рекомбинантных лизосомальных ферментов человека: альфа-L-идуронидазы (IDU) и арилсульфатазы B (ARSB), в отношении деградации их природных субстратов, т.е. внутриклеточных содержащих дерматансульфат (DS) субстратов. DS содержит вариабельным образом сульфатированные дисахаридные элементы идуроновая кислота-β-(1-3)-N-ацетилгалактозамин β(1-4).
Дефицитные по ARSB фибробластныые клетки GM00519 человека или дефицитные по IDU фибробластные клетки GM01391 человека культивирования до монослоя в 12-луночных планшетах и культуры после смыкания монослоя поддерживали в течение 3-6 недель для обеспечения накопления внутриклеточного DS.
Затем на клетки GM00519 или GM01391 после смыкания монослоя воздействовали насыщающими дозами рекомбинантной ARSB человека (10 нМ) или рекомбинантной IDU человека (25 нМ), соответственно, в течение 4-5 суток. Необработанные и обработанные лизосомальным ферментом сульфатазой клетки собирали, подвергали лизису и центрифугировали.
Активность лизосомального фермента в клеточных лизатах измеряли путем определения содержания остаточного DS в клетках посредством: (1) лизиса клеток; (2) специфичного расщепления содержащих DS субстратов на дисахариды с использованием хондроитин-ABC-лиазы (EC 4.2.2.4) в клеточном лизате; (3) мечения дисахаридов DS флуоресцентным красителем (например, 2-аминоакридоном, AMAC); (4) разделения дисахаридов DS (например, капиллярным зонным электрофорезом, CZE); (5) детекции меченых дисахаридов DS (например, индуцированной лазером флуоресценцией, LIF). Такие способы описаны, например, в Zinellu et al., Electrophoresis 2:2439-2447, 2007, и Lamari et al., J. Chromatogr. B 730:129-133, 1999 (обзор Volpi et al., Electrophoresis 29:3095-3106, 2008).
В таблице 11 представлена процентная деградация DS с использованием клеток GM00519, обработанных ARSB, при определении путем измерения количества дисахарида, содержащего N-ацетилгалактозамин-4-сульфат (дисахарид 4S), который является преобладающим дисахаридом DS. Сходные результаты получили с использованием клеток GM01391, обработанных IDU.
Указанный выше анализ показал, что клетки-мишени захватывают рекомбинантные ARSB и IDU человека, которые затем локализуются в лизосомах, где они осуществляют деградацию их природного субстрата, внутриклеточного DS.
Эксперимент по выявлению дозы проводили для определения концентрации, при которой IDU становится скорость-лимитирующим в этом клеточном анализе. Клетки GM01391 культивировали в 12-луночных планшетах. Через 4 недели после смыкания монослоя, клетки подвергали воздействию различных концентраций IDU, от 0,8 нМ до 25 нМ, в течение 6 или 26 часов. Клеточные лизаты получали и обрабатывали, как описано выше. Определили, что IDU не становится скорость-лимитирующим ниже 1 нМ.
Во втором эксперименте по выявлению дозы, клетки GM01391 через 3 недели после смыкания монослоя подвергали воздействию различных концентраций IDU, от 0,01 до 0,2 нМ, в течение 2 суток. Клеточные лизаты получали и обрабатывали, как описано выше. В этом эксперименте, в клеточные лизаты добавляли известное количество внутреннего стандартного моносахарида, GlcNAc-6S, для контроля выхода в ходе переработки. Как представлено на фигуре 11, в обработанных IDU клетках GM01391 наблюдали зависимое от дозы снижение количества субстрата DS.
В сходном эксперименте по выявлению дозы, клетки GM00519 через 3 недели после смыкания монослоя подвергали воздействию различных концентраций ARSB, от 0,001 до 0,06 нМ, в течение 5 суток. Клеточные лизаты получали и обрабатывали, как описано выше. В этом эксперименте, в клеточные лизаты добавляли известное количество внутреннего стандартного моносахарида, GlcNAc-6S, для контроля выхода в ходе переработки. Как представлено на фигуре 12, в обработанных ARSB клетках GM00519 наблюдали зависимое от дозы снижение количества субстрата DS.
Разрабатывали клеточный анализ in vitro для измерения активности рекомбинантного лизосомального фермента сульфатазы человека, GALNS, в отношении деградации его природного субстрата, т.е. внутриклеточных содержащих кератансульфат (KS) субстратов.
Дефицитные по GALNS клетки MQCH культивировали, как описано в примере 7 выше, и обрабатывали рекомбинантной GALNS человека в количестве 1 или 10 нМ. После обработки клеточные лизаты MQCH получали и расщепляли кератаназой II (EC 3.2.1), которая разрушает более крупные олигосахариды KS до дисахаридов KS. Дисахариды KS метили AMAC, разделяли посредством CZE и подвергали детекции посредством LIF, как описано выше, для DS-дисахаридов. GlcNAc-6S, моносахарид KS, добавляли в клеточные лизаты в качестве внутреннего контроля для выхода в ходе переработки. Измеряли количества двух характерных дисахаридов KS, Gal6S-GlcNAc6S и Gal-GlcNAc6S, и полученные данные корректировали по количеству выделенного GlcNAc6S. В таблице 12 представлена процентная деградация KS с использованием клеток MQCH, обработанных GALNS, при определении путем измерения количества двух характерных дисахаридов KS.
Указанный выше анализ показал, что клетки-мишени захватывают рекомбинантную GALNS человека, которая затем локализуется в лизосомах, где GALNS осуществляла деградацию ее природного субстрата, внутриклеточного KS.
В общем, эти результаты продемонстрировали, что активность рекомбинантных лизосомальных ферментов человека, ARSB, IDU и GALNS, в отношении деградации их природных субстратов можно измерять и количественно определять в клеточных анализах in vitro. Понятно, что этот клеточный анализ in vitro можно легко модифицировать для измерения и количественного определения активности других лизосомальных ферментов сульфатаз, а также широкого множества рекомбинантных лизосомальных ферментов.
ПРИМЕР IX
ДОСТАВКА РЕКОМБИНАНТНОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА В КОНКРЕТНЫЕ ТКАНИ
Оценивали способность рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, экспрессированной в клетках G71 и очищенной, быть доставленной в конкретные ткани, пораженные дефицитом GALNS или ассоциированные с ним, при введении мышам.
Высокоспецифичное распределение кератансульфата обеспечивает в высокой степени характерный фенотип мукополисахаридоза типа IVa (MPS IVA), или синдрома Моркио. Кератансульфат, главным образом, обнаруживается в хряще (соединения пластинок роста кости, сердечные клапаны, гортань и носовая перегородка) и в роговице, и именно в этих тканях проявляется накопление кератансульфата у пациентов с MPS IVA. Таким образом, для N-ацетилгалактозамин-6-сульфатазы (GALNS), которая является дефицитной при MPS IVA, или синдроме Моркио, важно показать доставку фермента GALNS в пластинки роста трубчатых костей, сердечные клапаны, роговицу, гортань и нос. Для изучения этих конкретных тканей, которые представляют собой слабо васкуляризованные мишени, исследовали доставку флуоресцентной GALNS у мышей.
У мышей тестировали два способа иммуногистохимического окрашивания: (1) GALNS человека, конъюгированная с Alexa 488, и (2) неконъюгированная GALNS человека. Конъюгацию GALNS человека с Alexa 488 проводили с использованием набора для мечения малеинимидом Molecular Probes Alexa Fluor 488 C5 maleimid labeling kit (A-10254). Реакция конъюгации с малеинимидом привела к соотношению 1:1 между меткой и белком.
Для подтверждения того, что флуоресцентная метка не препятствует захвату GALNS, проводили имуноцитохимический эксперимент с использованием культивированных синовиоцитов (ATCC # CRL-1832). Для сравнения неконъюгированной GALNS с конъюгированной GALNS (GALNS-A488 или GALNS-A555) использовали стандартный анализ захвата. Клетки инкубировали с ферментом GALNS в течение 4 часов с последующим вытеснением α-L-идуронидазой (IDU) в течение 2 часов. Результат показал, что конъюгация с Alexa 488 не препятствовала захвату в клетки. На фигуре 13 представлена оцененная Kd для GALNS, GALNS-A488 и GALNS-A555. Захват измеряли с помощью ELISA с антигеном в клеточном лизате, а не по активности фермента вследствие мечения инактивированного фермента. Kd неконъюгированных и конъюгированных ферментов GALNS определили, как приблизительно равные.
Для определения стабильности флуоресцентной метки после включения фермента GALNS в клетку, проводили иммунное окрашивание по неконъюгированной и конъюгированной GALNS. Использованное для окрашивания первичное антитело представляло собой очищенное с белком G антитело кролика против GALNS в концентрации 1 мкг/мл. Все изображения получали на широкопольном эпифлуоресцентном микроскопе Leica IRE2 с использованием программного обеспечения MetaMorph. Для измерения колокализации в этих изображениях требовалась обратная свертка множества изображений вследствие присутствия внеплосткостного света. Обратную свертку проводили с использованием программы для визуализации AutoQuant/AutoDeblur с применением теоретической функции точечного разворачивания (слепой алгоритм).
Иммунное окрашивание показало достаточно хорошее перекрывание с усиленным сигналом на материале GALNS-A488. Наблюдаемое повышение чувствительности было следствием того, что как первичное, так и вторичное антитела были поликлональными.
Для определения того, является ли фермент GALNS нацеленным на лизосому, проводили иммунное окрашивание культивированных синовиоцитов с помощью Molecular Probes Lysotracker или другого фермента, который локализуется в лизосоме. Оказалось, что Lysotracker показал некоторое перекрывание с ферментом GALNS-488; однако окрашивание не было однородным. Вытеснение в течение 2 ч рекомбинантной N-ацетилгалактозоамин-4-сульфатазой (rhASB) человека, лизосомальным ферментом, не показало какой-либо колокализации с GALNS.
Указанные выше эксперименты показали, что фермент GALNS-A488 захватывается клетками и локализуется в лизосоме, и его можно использовать для определения биораспределения in vivo.
Проводили два исследования in vivo. Первое пробное исследование проводили с болюсной инъекцией однократной дозы (10 мг/кг) в хвостовую вену нормальных мышей Balb/c, с последующим вторым исследованием с несколькими (5) инъекциями 10 мг/кг раз в двое суток в хвостовую вену нормальных мышей Balb/c. В таблице 13 и таблице 14 описаны схемы экспериментов для первого и второго исследований, соответственно.
В первом пробном исследовании, сердце, печень и сустав голень/бедро получали в моменты времени 2 часа и 24 часа. Во втором исследовании получали сердце, почку, печень и кость с четырехглавой мышцей и камбаловидной мышцей в моменты времени 2 часа, 4 часа и 8 часов. Для обоих исследований, сердце, почку и печень фиксировали погружением в 4% параформальдегид (PFA) в течение 4 суток, погружали в парафин, затем делали их срезы толщиной 7 мкм. Кость, включающую мышцу во втором исследовании, фиксировали погружением в 4% PFA в течение 8 суток, декальцинировали, погружали в парафин и делали их срезы толщиной 7 мкм.
Изображения мышей, которым инъецировали GALNS-A488, получали на лазерном сканирующем конфокальном микроскопе Zeiss. Для анализа в первом пробном исследовании получали один конфокальный набор на образец клапана сердца и печени и использовали его для волюметрического анализа. Для пластинки роста получали два конфокальных набора/образец и использовали для волюметрического анализа. Во втором исследовании получали один конфокальный набор/образец клапана сердца, почки и печени и использовали для волюметрического анализа; два конфокальных набора/образец получали для пластинки роста и зоны остального хряща (zrc) и использовали для волюметрического анализа.
Из исследований по визуализации конфокальной микроскопией сделали следующие заключения: (1) можно было выявить флуоресцентную GALNS in vivo; (2) сигнал был специфическим (отсутствие фона) и локализация была лизосомальной; (3) присутствие GALNS было показано в синусоидальной клетке в печени; (5) в сердце, фермент GALNS присутствовал в перегородке и предсердии, однако наиболее важно, что он был отчетливо видим на уровне клапана сердца, где он был более глубоко распределен после многократных инъекций; (6) в суставе бедро/большеберцовая кость, фермент GALNS находился в минерализованной части кости (эпифизе), а также в костном мозге. GALNS присутствовала в пластинке роста. Более конкретно, GALNS была распространена в хондроцитах покоящейся зоны (или зоны резервного хряща), присутствовала в начале пролиферативной зоны и вновь появлялась в большом количестве в зоне оссификации в конце пластинки роста. Хотя трудно количественно определить совокупный эффект многократных инъекций, второе исследование, как оказалось, показало более широкое распределение. В таблице 15 представлено обобщение исследований визуализации конфокальной микроскопией.
Для вторичного окрашивания, начальная стадия представляла собой оптимизацию первичного антитела GALNS. Различные ткани окрашивали разведениями от 1:100 до 1:400 с помощью очищенного белком G антитела кролика против GALNS. Результаты в первом пробном исследовании показали, что разведение 1:100 было оптимальным для высокого отношения сигнала к шуму. Этот результат подтвердился во втором исследовании. Остальные предметные стекла обрабатывали при разведении первичного антитела 1:100 и разведении вторичного антитела 1:1000.
Сигнал для мышей Balb/c, которым вводили GALNS, был выше сигнала контроля (т.е. для мышей, которым вводили PBS-Cys) при окрашивании очищенным с белком G антителом против GALNS. Для подтверждения того, что фермент GALNS был локализован в лизосоме, срезы окрашивали антителом против LAMP1. LAMP1 является маркером лизосом. Изображения показали перекрывание между антителами против LAMP1 и против GALNS, указывая на то, что фермент GALNS был локализован в лизосоме.
В общем, два исследования in vivo указывают на то, что биораспределение GALNS связано с васкуляризацей, т.е. более васкуляризованные ткани обладают большим флуоресцентным сигналом. Более важно, исследования показали наличие GALNS в областях накопления кератансульфата при синдроме Моркио, даже если эти области являются слабо васкуляризованными.
ПРИМЕР X
ЭФФЕКТЫ РЕКОМБИНАНТНОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА И ДРУГИХ ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ СУЛЬФАТАЗ У МЫШЕЙ, ДЕФИЦИТНЫХ ПО АКТИВНОСТИ ЛИЗОСОМАЛЬНОГО ФЕРМЕНТА СУЛЬФАТАЗЫ
Оценивали эффекты активных высокофосфорилированных лизосомальных ферментов сульфатаз человека по изобретению, например рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, у мышей, дефицитных по активности лизосомального фермента сульфатазы.
Рекомбинантный белок GALNS человека экспрессировали в клетках G71S и очищали. Другие рекомбинантные лизосомальные ферменты сульфатазы человека можно экспрессировать и очищать, по существу согласно способам, описанным в настоящем документе или известным в данной области.
Описано несколько моделей на мышах для дефицита лизосомального фермента сульфатазы человека, включая: метахроматическую лейкодистрофию (MLD) (дефицит арилсульфатазы A), (Hess et al., Proc. Natl. Acad. Sci. USA 93:14821-14826, 1996), мукополисахаридоз типа VI (MPS VI), или синдром Марото-Лами (дефицит арилсульфатазы B) (Evers et al., Proc. Natl. Acad. Sci. USA 93:8214-8219, 1996), мукополисахаридоз типа II (MPS II), или синдром Хантера (дефицит идуронат-2-сульфатазы) (Muenzer et al., Acta Paediatr. Suppl. 91(439): 98-99, 2002; Cardone et al., Hum. Mol. Genet. 15:1225-1236, 2006), мукополисахардиоз типа IIIa (MPS IIIa), или синдром Санфилиппо A (дефицит сульфамидазы/гепаран-N-сульфатазы) (Bhaumik et al., Glycohiology 9(12): 1389-1396, 1999), мукополисахаридоз типа IVa (MPS IVa), или синдром Моркио A (дефицит N-ацетилгалактозамин-6-сульфатазы) (Tomatsu et al., Hum. Mol. Genet. 12:3349-3358, 2003), и множественную сульфатазную недостаточность (MSD) (дефицит модифицирующего сульфатазу фактора 1) (Settembre et al., Proc. Natl. Acad. ScL USA 104:4506-4511, 2007). Модель на мышах для мукополисахаридоза типа IIId (MPS IIId), или синдрома Санфилиппо D (дефицит N-ацетилглюкозамин-6-сульфатазы), еще не описана.
Модели на мышах для дефицита лизосомального фермента сульфатазы человека можно использовать для оценки возможности фермент-заместительной терапии (ERT) в качестве способа для лечения лизосомальных болезней накопления. Например, мыши с нокаутом MPS IVa (GALNS-/-; Tomatsu et al., Hum. Mol. Genet. 12:3349-3358, 2003) не обладают поддающейся детекции активности фермента GALNS и имеют повышенные уровни гликозаминогликанов (GAG) в моче, т.е. кератинсульфата и хондроитин-6-сульфата, и накопление GAG во множестве тканей и органов, например печени, почке, селезенке, сердце, головном мозге и хряще. Однако мыши GALNS-/- не обладают аномалиями скелета, ассоциированными с заболеванием человека. Была разработана другая модель на мышах MPS IVa, у которых экспрессируется неактивная GALNS человека и мутантная неактивная эндогенная GALNS мыши (мыши GALNStm(hC79S.mC76S)slu; Tomatsu et al., Hum. Mol. Genet. 14:3321- 3335, 2005). У мышей GALNStm(hC79S.mC76S)slu, которые не имеют поддающейся детекции активности фермента GALNS, экскреция GAG в мочу является повышенной, GAG накапливаются во множестве тканей, включая внутренние органы, головной мозг, роговицу, кость, связки и костный мозг, накопление в лизосомах является выраженным во многих тканях, и накопление в костях является очевидным. Патологические изменения у мышей GALNStm(hC79S.mC76S)slu отличаются от патологических изменений, наблюдаемых у мышей GAINS-/-. Однако подобно мышам GAINS-/-, мыши GALNStm(hC79S.mC76S)slu не обладают нарушениями скелета, ассоциированными с заболеванием человека. Таким образом, мышей GAINS-/- или GALNStm(hC79S.mC76S)slu можно использовать для исследования эффекта введения рекомбинантной GALNS человека на повышенные GAG в моче и накопление GAG в тканях.
Мышам GAINS-/-, GALNStm(hC79S.mC76S)slu или дикого типа в возрасте четырех недель проводят еженедельные внутривенные инъекции (n = по меньшей мере 6 или 8 на группу) различных доз рекомбинантной GALNS человека (например, 0,1, 0,3, 1, 3, 10 мг/кг) или контроля в виде носителя до возраста 16-20 недель, а затем их умерщвляют для гистологического исследования. Мочу мышей собирают и определяют экскрецию GAG в мочу, как описано (Tomatsu et al., Hum. Mol. Genet. 12: 3349-3358, 2003). Патологическое исследование различных тканей проводят, как описано (Tomatsu et al., Hum. Mol. Genet. 12:3349-3358, 2003).
При использовании мышей GAINS-/- или GALNStm(hC79S.mC76S)slu, ожидается, что рекомбинантная GALNS человека продемонстрирует способность по изобретению снижать: (1) экскрецию GAG с мочой; (2) накопление GAG во множестве тканей, например висцеральных органах, головном мозге, роговице, кости, связках и костном мозге; (3) лизосомальное накопление во множестве тканей; (4) накопление в костях.
Эффект рекомбинантной GALNS человека исследуют в модели на мышах для множественной сульфатазной недостаточности (MSD) (мыши SUMF-/-; Settembre et al., Proc. Natl. Acad. Sci USA 104: 4506-4511, 2007). Поскольку мыши SUMF1-/- проявляют частую смертность на ранних этапах жизни, инъекции этим мышам рекомбинантной GALNS человека начинали более рано, чем описано для мышей GALNS-/-.
Следуя способам, известным в данной области, эффекты других рекомбинантных лизосомальных ферментов сульфатаз человека, т.е. арилсульфатазы A, арилсульфатазы B, идуронат-2-сульфатазы, сульфамидазы/гепарин-N-сульфатазы и N-ацетилглюкозамин-6-сульфатазы, исследуют в моделях на мышах для MLD (мыши ASA -/-; Hess et al., Proc. Natl. Acad. Sci. USA 93: 14821-14826, 1996), MPS VI (мыши Asl-s -/-; Evers et al., Proc. Natl. Acad. Sci. USA 93:8214-8219, 1996), MPS II (мыши ids y/-; Cardone et al., Hum. Mol. Genet. 15: 1225-1236, 2006), MPS IIIa (Bhaumik et al., Glycobiology 9(12): 1389-1396, 1999) и MSD (мыши SUMF1-/-; Settembre et al., Proc. Natl. Acad. Sci. USA 104:4506-4511, 2007).
ПРИМЕР XI
ЛЕЧЕНИЕ ПАЦИЕНТОВ-ЛЮДЕЙ С МУКОПОЛИСАХАРИДОЗОМ ТИПА IVA (ИЛИ СИНДРОМОМ МОРКИО) ИЛИ ДРУГИМИ ДЕФИЦИТАМИ ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ СУЛЬФАТАЗ РЕКОМБИНАНТНОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗОЙ (GALNS) ЧЕЛОВЕКА И ДРУГИМИ СУЛЬФАТАЗНЫМИ ФЕРМЕНТАМИ
Предполагается, что для фермент-заместительной терапии рекомбинантным ферментом, т.е. N-ацетилгалактозамин-6-сульфатазой (GALNS) человека, подлежат пациенты-люди с проявлениями клинического фенотипа дефицита лизосомального фермента сульфатазы, такие как пациенты с диагнозом мукополисахаридоза типа IVA (MPS IVa, или синдром Моркио). У всех пациентов, страдающих дефицитом лизосомального фермента сульфатазы, имеются проявления некоторых клинических признаков избыточного или вредного накопления во внутренних органах и мягких тканях запасающего материала в их лизосомах, что проявляется различными степенями функциональных нарушений или ухудшения состояния здоровья, ассоциированных с конкретной лизосомальной болезнью накопления. Все пациенты с MPS IVa имеют проявления некоторых клинических признаков деформации костей, низкий рост и нарушенную походку и/или накопление гликозаминогликана (GAG) в крови или моче с различными степенями функционального нарушения.
Предпочтительно, у пациента, страдающего дефицитом лизосомального фермента сульфатазы, проводят мониторинг уровней ферментов для подтверждения отсутствия активности или сниженной активности лизосомального фермента сульфатазы в их тканях. Пациенты с активностью лизосомального фермента менее 10%, предпочтительно менее 5%, более предпочтительно менее 2% и еще более предпочтительно менее 1%, в остальном являющиеся здоровыми субъектами, являются подходящими кандидатами для лечения соответствующим лизосомальным ферментом сульфатазой. При определении активности лизосомального фермента сульфатазы у пациента можно получать данные до, в ходе и после терапии.
Эффективность определяют путем измерения процентного снижения экскреции с мочой субстрата, т.е. гликозаминогликана (GAG), лизосомального фермента сульфатазы с течением времени. Уровни GAG в моче у пациентов, страдающих дефицитом лизосомального фермента сульфатазы, сравнивают с нормальными уровнями экскреции, и/или уровнями у пациентов без лечения, страдающих дефицитом того же лизосомального фермента сульфатазы, и/или уровнями у того же пациента до терапии лизосомальным ферментом сульфатазой. Надежными показателями для измерения индивидуального ответа на терапию являются более чем 25% снижение, предпочтительно более чем 50% снижение, экскреции недеградированных GAG после терапии лизосомальным ферментом сульфатазой.
Также эффективность можно определять по уменьшению признаков и симптомов патологии, ассоциированной с лизосомальной болезнью накопления. Эффективность можно определять с помощью биопсии ткани и исследования клеток и/или лизосом для определения степени, на которую GAG снижаются в лизосомах, клетках или тканях. Эффективность можно определять с помощью функциональной оценки, которая может быть объективной или субъективной (например, снижение боли или затруднения функционирования, повышенная сила мышц или выносливость, повышенный сердечный выброс, выносливость при физической нагрузке, изменения массы тела, роста или внешнего вида и т.п.).
Фармацевтическая композиция содержит рекомбинантную GALNS человека, экспрессированную в клетках G71S и очищенную, изготовленную способами, известными в данной области. Предпочтительным является введение фармацевтической композиции по изобретению внутривенно.
Основная схема исходного клинического исследования для изучения эффекта введения рекомбинантной GALNS человека пациентам с MPS IVa вовлекает открытое исследование безопасности/эффективности с повышением дозы при различных дозах, при котором различные дозы фермента вводят пациентам внутривенно с фиксированными промежутками времени, например, не ограничиваясь этим, инъекции ферментов раз в неделю.
Для пациентов с MPS IVa, эффективность определяют путем измерения, например, сниженного GAG в крови или моче, которое, вероятно, может наблюдаться при ERT в течение недель, повышенной выносливости при тестах сердечной, легочной и/или двигательной функции, которая, вероятно, может наблюдаться при ERT в течение месяцев, и/или изменения скелета и/или рост организма, которые, вероятно, могут наблюдаться при ERT в течение лет.
Измерения GAG в моче пригодны для установления соответствующего режима дозирования, а также для определения эффективности, путем измерения процентного снижения экскреции GAG с мочой с течением времени.
Можно использовать множество тестов выносливости, включая, например, не ограничиваясь ими, тесты ходьбы (расстояние, проходимое в течение 6 или 12 минут), подъема по лестнице (ступеней в минуту) и легочной/дыхательной функции, включая сердечную функцию (ECG, эхокардиограмма), легочную функцию (FVC, FEV1, максимальная скорость выдоха).
Для более молодых пациентов, подвергаемых лечению в течение длительных периодов времени, можно измерять рост (высоту).
Лизосомальные болезни накопления, ассоциированные с дефицитом активности лизосомального фермента сульфатазы, которые можно лечить или предупреждать с использованием способов по настоящему изобретению, представляют собой: метахроматическую лейкодистрофию (MLD), мукополисахаридоз типа VI (MPS VI), или синдром Марото-Лами, мукополисахаридоз типа II (MPS II), или синдром Хантера, мукополисахаидоз типа IIIa (MPS IIIa), или синдром Санфилиппо A, мукополисахаридоз типа IIId (MPS IIId), или синдром Санфилиппо D, мукополисахаридоз типа IVa (MPS TVa), или синдром Моркио A, или множественную сульфатазную недостаточность (MSD). Для каждой лизосомальной болезни накопления, рекомбинантный лизосомальный фермент сульфатаза может включать конкретный лизосомальный фермент сульфатазу.
Для способов, вовлекающих MLD, предпочтительным лизосомальным ферментом сульфатазой является арилсульфатаза A. Для способов, вовлекающих MPS VI, предпочтительным лизосомальным ферментом сульфатазой является арилсульфатаза B. Для способов, вовлекающих MPS II, предпочтительным лизосомальным ферментом сульфатазой является идуронат-2-сульфатаза. Для способов, вовлекающих MPS IIIA, предпочтительным лизосомальным ферментом сульфатазой является сульфамидаза/гепаран-N-сульфатаза. Для способов, вовлекающих MPS IIID, предпочтительным лизосомальным ферментом сульфатазой является N-ацетилглюкозамин-β-сульфатаза. Для способов, вовлекающих MPS IVA, предпочтительным лизосомальным ферментом сульфатазой является N-ацетилгалактозамин-6-сульфатаза. Для способов, вовлекающих MSD, предпочтительным лизосомальным ферментом сульфатазой является N-ацетилгалактозамин-6-сульфатаза.
Ожидается, что специалисты в данной области могут придумать различные модификации и варианты изобретения, указанного в проиллюстрированных примерах. Следовательно, на изобретение должны налагаться только такие ограничения, которые указаны в прилагаемой формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДСТВО АКТИВНОЙ ВЫСОКОФОСФОРИЛИРОВАННОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ ЧЕЛОВЕКА И ЕЕ ПРИМЕНЕНИЕ | 2011 |
|
RU2607376C2 |
| КЛЕТКА, ПРОДУЦИРУЮЩАЯ С ВЫСОКОЙ ЭФФЕКТИВНОСТЬЮ АКТИВНЫЙ БЕЛОК АРИЛСУЛЬФАТАЗУ В, И СПОСОБ ПОЛУЧЕНИЯ ЭТОЙ КЛЕТКИ | 2020 |
|
RU2763990C2 |
| АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ЛЕЧЕНИЯ МУКОПОЛИСАХАРИДОЗОВ ТИПА IV A | 2019 |
|
RU2794960C2 |
| ОПОСРЕДОВАННЫЙ АДЕНОАССОЦИИРОВАННЫМ ВИРУСОМ ПЕРЕНОС ГЕНОВ В ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ | 2014 |
|
RU2801511C1 |
| ОПОСРЕДОВАННЫЙ АДЕНОАССОЦИИРОВАННЫМ ВИРУСОМ ПЕРЕНОС ГЕНОВ В ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ | 2014 |
|
RU2692251C2 |
| Лекарственное средство на основе бифункционального антитела для лечения мукополисахаридоза II типа | 2016 |
|
RU2673038C2 |
| СОЕДИНЕНИЕ, СОДЕРЖАЩЕЕ ТЕРАПЕВТИЧЕСКИЙ ФЕРМЕНТ И ТРАНСПОРТНЫЙ ЭЛЕМЕНТ, СОЕДИНЕННЫЕ ДРУГ С ДРУГОМ НЕПОСРЕДСТВЕННО ИЛИ ПРИ ПОМОЩИ ЛИНКЕРА | 2022 |
|
RU2811100C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НЕДОСТАТОЧНОСТИ ЛИЗОСОМАЛЬНОГО ФЕРМЕНТА У СУБЪЕКТА, ИМЕЮЩЕГО МУКОПОЛИСАХАРИДОЗ II ТИПА | 2023 |
|
RU2814280C1 |
| НАПРАВЛЕННЫЕ ТЕРАПЕВТИЧЕСКИЕ ХИМЕРНЫЕ БЕЛКИ ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2680581C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ В ЦНС ИДУРОНАТ-2-СУЛЬФАТАЗЫ | 2011 |
|
RU2774112C2 |















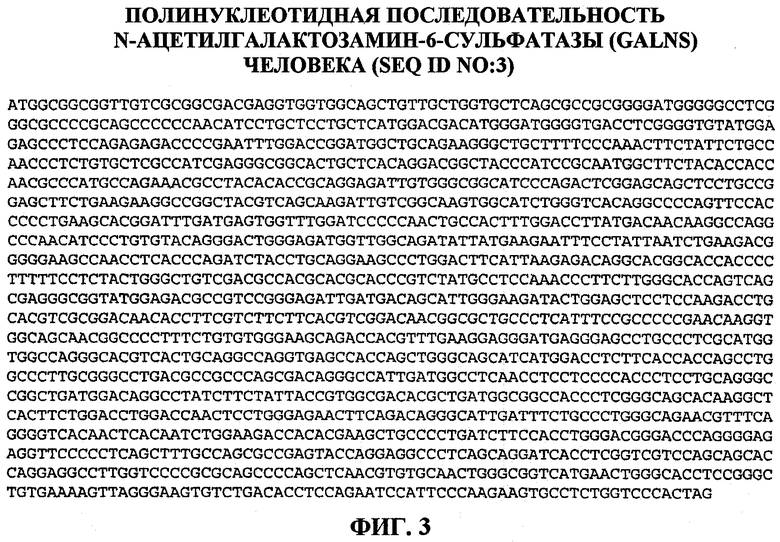


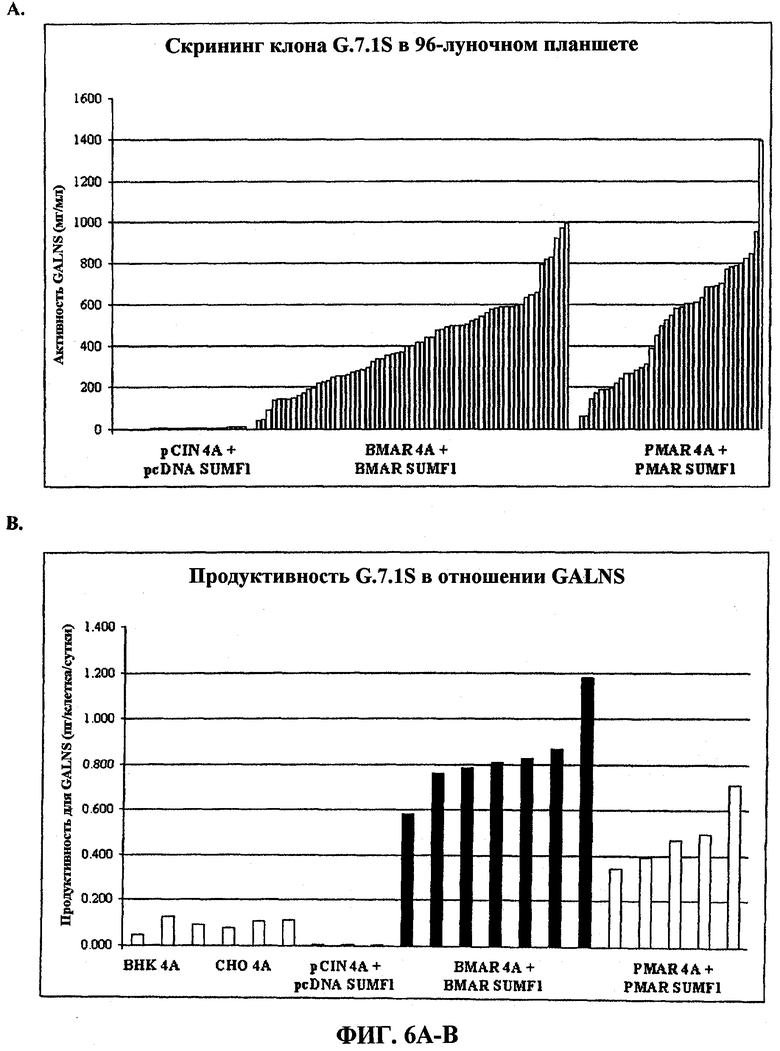
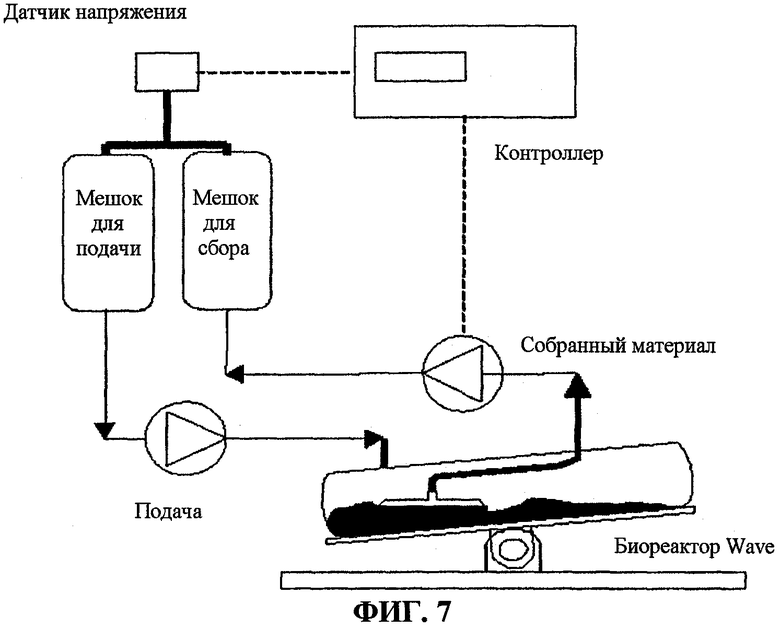
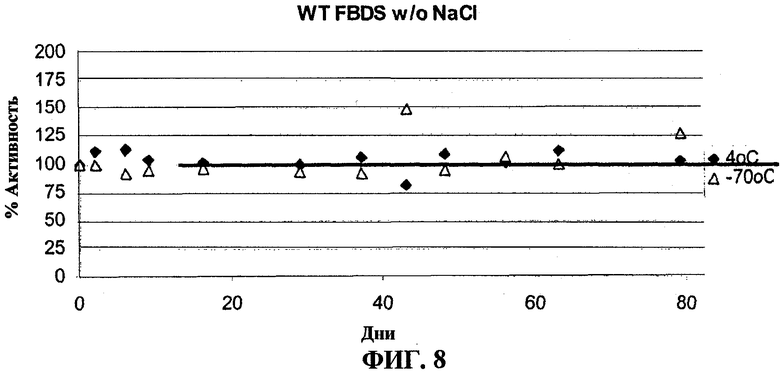

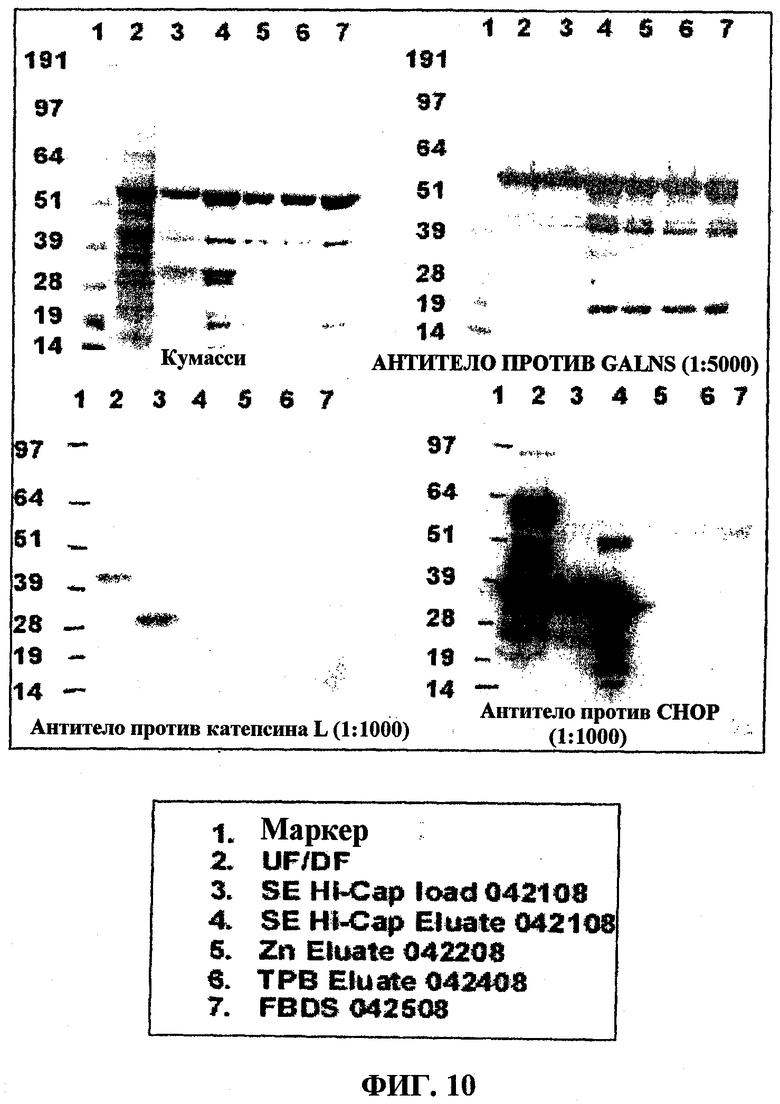
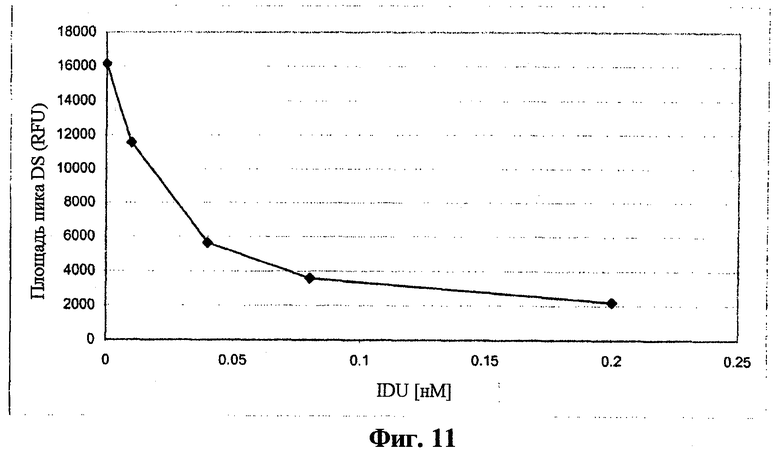

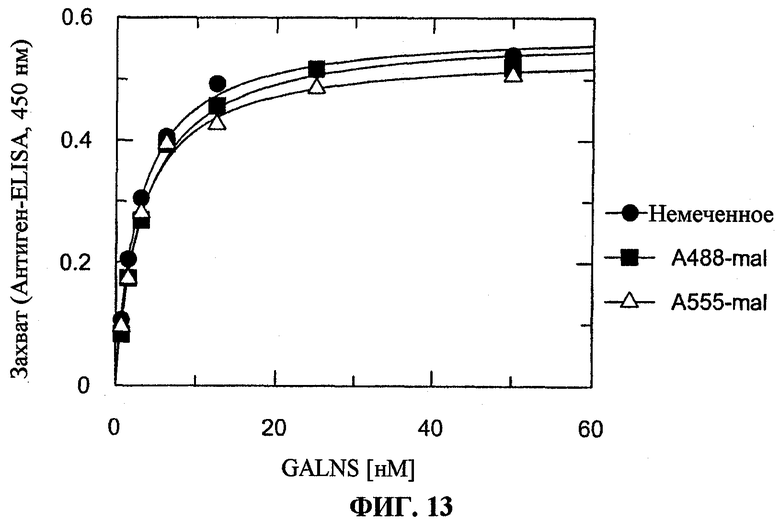
Изобретение относится к области биотехнологии. Представлен очищенный препарат рекомбинантного фермента N-ацетилгалактозамин-6-сульфатаза (GALNS) человека, где указанный фермент включает аминокислотную последовательность, по меньшей мере, на 95% идентичную аминокислотам 27-522 SEQ ID NO:4, пригодный для лечения субъекта, страдающего лизосомальной болезнью накопления, которая ассоциирована с GALNS, где: (a) указанный препарат фермента GALNS имеет чистоту, по меньшей мере, приблизительно 95% при определении окрашиванием кумасси синим при SDS-PAGE в невосстанавливающих условиях; и (b) остаток цистеина в положении 79, по меньшей мере, приблизительно в 50% молекул фермента GALNS в указанном препарате фермента GALNS преобразован в Cα-формилглицин (FGly); где указанный фермент GALNS является гликозилированным N-связанным гликозилированием по остаткам аспарагина в положениях 204 и 423, где, по меньшей мере, приблизительно 50% олигоманнозных цепей, присоединенных к остатку аспарагина в положении 204, являются бис-фосфорилированными. Предложен способ лечения субъекта, страдающего мукополисахаридозом типа IVa (MPS IVa), синдромом Моркио A или множественной сульфатазной недостаточностью (MSD), включающий введение субъекту терапевтически эффективного количества указанного очищенного препарата рекомбинантного GALNS человека. Изобретение позволяет получить фармацевтический препарат рекомбинантной высокофосфорилированной GALNS человека, имеющий высокий уровень молекул с преобразованным в Cα-формилглицин остатком цистеина в положении 79, в силу чего он высоко поглощается через рецептор манноза-6-фосфата (MPR) и имеет высокую активность. 2 н. и 27 з.п. ф-лы, 13 ил., 15 табл., 11 пр.
1. Очищенный препарат рекомбинантного фермента N-ацетилгалактозамин-6-сульфатаза (GALNS) человека, где указанный фермент включает аминокислотную последовательность, по меньшей мере, на 95% идентичную аминокислотам 27-522 SEQ ID NO:4, пригодный для лечения субъекта, страдающего лизосомальной болезнью накопления, которая вызвана дефицитом указанной GALNS или ассоциирована с ним, где
(a) указанный препарат фермента GALNS имеет чистоту по меньшей мере приблизительно 95% при определении окрашиванием кумасси синим при SDS-PAGE в невосстанавливающих условиях; и
(b) остаток цистеина в положении 79 по меньшей мере приблизительно в 50% молекул фермента GALNS в указанном препарате фермента GALNS преобразован в Cα-формилглицин (FGly);
где указанный фермент GALNS
(c) является гликозилированным N-связанным гликозилированием по остаткам аспарагина в положениях 204 и 423, где по меньшей мере приблизительно 50% олигоманнозных цепей, присоединенных к остатку аспарагина в положении 204, являются бис-фосфорилированными.
2. Препарат GALNS по п.1, где лизосомальная болезнь накопления представляет собой мукополисахаридоз типа IVa (MPS IVa), или синдром Моркио A.
3. Препарат GALNS по п.1, где лизосомальная болезнь накопления представляет собой множественную сульфатазную недостаточность.
4. Препарат GALNS по п.1, где фермент GALNS имеет основную полосу на уровне приблизительно 55-60 кДа, которая составляет по меньшей мере приблизительно 75% видимых белков при определении окрашиванием кумасси синим при SDS-PAGE в восстанавливающих условиях.
5. Препарат GALNS по п.1, где фермент GALNS имеет основную полосу на уровне приблизительно 55-60 кДа, которая составляет по меньшей мере приблизительно 85% видимых белков при определении окрашиванием кумасси синим при SDS-PAGE в восстанавливающих условиях.
6. Препарат GALNS по п.1, где фермент GALNS имеет основную полосу на уровне приблизительно 55-60 кДа, которая составляет по меньшей мере приблизительно 90% видимых белков при определении окрашиванием кумасси синим при SDS-PAGE в восстанавливающих условиях.
7. Препарат GALNS по п.1, где остаток цистеина в положении 79, по меньшей мере, приблизительно в 70% молекул фермента GALNS в указанном препарате фермента GALNS преобразован в Cα-формилглицин (FGly).
8. Препарат GALNS по п.1, где остаток цистеина в положении 79, по меньшей мере, приблизительно в 90% молекул фермента GALNS в указанном препарате фермента GALNS преобразован в Cα-формилглицин (FGly).
9. Препарат GALNS по п.1, где фермент GALNS представляет собой слитый белок, содержащий клеточный сигнал нацеливания, расположенный на N- или C-конце фермента GALNS.
10. Препарат GALNS по п.9, где клеточный сигнал нацеливания содержит нацеливающий на кость пептид.
11. Препарат GALNS по п.10, где нацеливающий на кость пептид содержит шесть остатков аспарагиновой кислоты.
12. Способ лечения субъекта, страдающего мукополисахаридозом типа IVa (MPS IVa), или синдромом Моркио A, или множественной сульфатазной недостаточностью (MSD), включающий введение субъекту терапевтически эффективного количества очищенного препарата рекомбинантного фермента N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, где указанный фермент включает аминокислотную последовательность, по меньшей мере, на 95% идентичную аминокислотам 27-522 SEQ ID NO:4, где
(a) указанный препарат фермента GALNS имеет чистоту, по меньшей мере, приблизительно 95% при определении окрашиванием кумасси синим при SDS-PAGE в невосстанавливающих условиях; и
(b) остаток цистеина в положении 79 по меньшей мере приблизительно в 50% молекул фермента GALNS в указанном препарате фермента GALNS преобразован в Cα-формилглицин (FGly);
где указанный фермент GALNS
(c) является гликозилированным N-связанным гликозилированием по остаткам аспарагина в положениях 204 и 423, где по меньшей мере приблизительно 50% олигоманнозных цепей, присоединенных к остатку аспарагина в положении 204, являются бис-фосфорилированными.
13. Способ по п.12, где субъект страдает MPS Iva, или синдромом Моркио A.
14. Способ по п.12, где субъект страдает MSD.
15. Способ по п.12, где фермент GALNS имеет основную полосу на уровне приблизительно 55-60 кДа, которая составляет по меньшей мере приблизительно 75% видимых белков при определении окрашиванием кумасси синим при SDS-PAGE в восстанавливающих условиях.
16. Способ по п.12, где фермент GALNS имеет основную полосу на уровне приблизительно 55-60 кДа, которая составляет по меньшей мере приблизительно 85% видимых белков при определении окрашиванием кумасси синим при SDS-PAGE в восстанавливающих условиях.
17. Способ по п.12, где фермент GALNS имеет основную полосу на уровне приблизительно 55-60 кДа, которая составляет по меньшей мере приблизительно 90% видимых белков при определении окрашиванием кумасси синим при SDS-PAGE в восстанавливающих условиях.
18. Способ по п.12, где остаток цистеина в положении 79, по меньшей мере, приблизительно в 70% молекул фермента GALNS в указанном препарате фермента GALNS преобразован в Cα-формилглицин (FGly).
19. Способ по п.12, где остаток цистеина в положении 79, по меньшей мере, приблизительно в 90% молекул фермента GALNS в указанном препарате фермента GALNS преобразован в Cα-формилглицин (FGly).
20. Способ по п.13, где эффективность лечения определяют путем измерения мочевой экскреции кератинсульфата (KS) у субъекта, где уровни KS в моче у субъекта, страдающего мукополисахаридозом типа IVa (MPS IVa), или синдромом Моркио A, сравнивают с уровнями KS в моче у обычных субъектов и/или субъекта, не получающего лечение, страдающего мукополисахаридозом
типа IVa (MPS IVa), или синдромом Моркио A, и/или у того же субъекта до лечения ферментом GALNS.
21. Способ по п.20, где после лечения ферментом GALNS достигается более чем 25% понижение KS в моче.
22. Способ по п.20, где после лечения ферментом GALNS достигается более чем 50% понижение KS в моче.
23. Способ по п.13, где эффективность лечения определяется функциональными оценками субъекта с помощью измерения выносливости тестами ходьбы, подъема по лестнице и легочной/дыхательной функции.
24. Способ по п.23, где в тесте ходьбы измеряют расстояние, проходимое в течение 6 или 12 минут.
25. Способ по п.23, где в тесте подъема по лестнице измеряют количество ступеней, проходимое в минуту.
26. Способ по п.23, где легочную/дыхательную функцию измеряют посредством измерения сердечной функции (эхокардиограмма) или посредством измерения легочной функции (FVC, FEV1 или максимальная скорость выдоха).
27. Способ по п.12, где фермент GALNS представляет собой слитый белок, содержащий клеточный сигнал нацеливания, расположенный на N- или C-конце фермента GALNS.
28. Способ по п.27, где клеточный сигнал нацеливания содержит нацеливающий на кость пептид.
29. Способ по п.28, где нацеливающий на кость пептид содержит шесть остатков аспарагиновой кислоты.
| WO 2005077093 А2, 25.08.2005 | |||
| DATABASE: UniProtKB/Swiss-Prot, P34059, 01.02.1994 | |||
| SHUNJI TOMATSU, et al "Enzyme replacement therapy in a murine model of Morquio A syndrome", Human Molecular Genetics, 2008, Vol | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Автомотриса для железных дорог | 1923 |
|
SU815A1 |
Авторы
Даты
2014-04-10—Публикация
2009-01-16—Подача