Область техники
Изобретение относится к области биотехнологии, конкретно, к доставке (транспортировке) терапевтических ферментов, что может быть использовано в медицине. Настоящее изобретение относится к соединению, содержащему терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, при этом транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG, специфичного к эпитопу в рецепторе инсулина, к применению указанного соединения для получения фармацевтической композиции для лечения заболеваний и к применению указанного соединения для лечения и профилактики заболеваний, в частности, лизосомных болезней накопления, в том числе, для лечения и профилактики недостаточности соответствующего фермента, характерной для соответствующей лизосомной болезни накопления, таких как мукополисахаридоз, в частности, мукополисахаридоз I и II типов.
Предшествующий уровень техники
Применение ферментов в терапии известно из уровня техники давно. Современная медицина все шире использует терапевтические ферменты в самых различных отраслях медицины вследствие их высокой активности и специфичности. В настоящее время наметились следующие направления энзимотерапии (Казанская Н. Ф. и др., 1984): 1) устранение дефицита ферментов с целью компенсации врожденной или приобретенной функциональной недостаточности; 2) удаление нежизнеспособных, денатурированных структур, клеточных и тканевых осколков; 3) лизис тромбов; 4) комплексная терапия злокачественных новообразований; 5) детоксикация организма.
Применение терапевтических ферментов для устранения дефицита ферментов с целью компенсации врожденной или приобретенной функциональной недостаточности практикуется уже давно. Лечение врожденных дефицитов ферментов, которых описано более 150, является важной проблемой заместительной терапии. Такие наследственные заболевания, как гликогенозы, липидозы, мукополисахаридозы и другие лизосомные болезни накопления преимущественно лечат путем внутривенного введения рекомбинантных аналогов соответствующих нативных ферментов.
Лизосомные болезни накопления – группа редких (орфанных) наследственных метаболических заболеваний, обусловленных отсутствием или недостаточностью лизосомных ферментов, участвующих в расщеплении сложных молекул.
В настоящее время (Новиков П. В., 2014) выделяют следующие группы лизосомных болезней накопления: 1) мукополисахаридозы; 2) липидозы (сфинголипидозы — GM1- и GM2-ганглиозидозы, болезнь Гоше, галактосиалидоз, гранулематоз Фарбера, лейкодистрофии, болезнь Ниманна—Пика типы А и В и др.); 3) муколипидозы, 4) гликопротеинозы (фукозидоз, сиалидоз, маннозидоз, болезнь накопления гликогена II типа — болезнь Помпе, болезнь Данон и др.); 5) нейрональные цероидные липофусцинозы; 6) другие болезни накопления (болезнь Ниманна—Пика тип С, болезнь Вольмана, болезнь накопления холестерина, цистиноз, болезнь Сала, пикнодизостоз и др.).
Мукополисахаридозы (МПС) – группа, объединяющая девять (I – IX, с промежуточными формами - 14) метаболических заболеваний, обусловленных более чем 40 генетическими нарушениями, приводящими к отсутствию или функциональной недостаточности ряда лизосомальных ферментов, участвующих в гидролитическом расщеплении гликозаминогликанов (мукополисахаридов). Гликозаминогликаны - олигосахариды, принимающие участие в формировании костей, хрящей, связок, роговицы, кожи, соединительной ткани и синовиальной жидкости (Burrow T. A. et al, 2013).
У пациентов, страдающих мукополисахаридозом, наблюдается недостаточность или отсутствие, как минимум, одного из 11 ферментов катаболизма гликозаминогликанов, что с течением времени приводит к постепенному накоплению этих углеводов в клетках, жидкостях организма, в т.ч. и в соединительной ткани. В результате, перманентное накопление мукополисахаридов приводит к повреждению клеток, дисфункциям тканей и органов, наиболее часто проявляющимся в гипретензионно-гидроцефальном синдроме, гепатоспленомегалии, сердечно-сосудистой недостаточности, костно-суставных осложнениях, функциональных расстройствах центральной нервной системы (ЦНС) вплоть до тяжелых когнитивных расстройств и деменций (таблица 1) (Burrow T. A. et al, 2013).
Таблица 1. Характеристика различных синдромов МПС.
Тип В — b-N-ацетил- люкозаминидаза
Тип С — ацетил- КоА-глюкозамини-N- ацетилтрансфераза Тип Д — a-N-ацетил- глюкозамин-6-фосфатаза
Мукополисахаридоз I типа вызывается дефицитом фермента лизосом, α-L-идуронидазы. Этот недостаток приводит к накоплению мукополисахаридов, особенно дерматансульфата, в тканях и органах. Накопление избыточного сульфата дерматана приводит к постепенному развитию многочисленных морфологических аномалий в тканях и органах. Мукополисахаридоз I типа характеризуется аутосомно-рецессивным типом наследования.
На сегодняшний день разработаны два эффективных метода лечения МПС I типа: трансплантация гемопоэтических стволовых клеток (ТГСК) и ферментная заместительная терапия (ФЗТ).
ТГСК применяется для лечения только тяжелых форм МПС I типа – синдрома Гурлер, что позволяет корректировать недостаточность фермента α-L-идуронидазы и, в свою очередь, приводит к значительному улучшению состояния пациента, хотя некоторые тяжелые осложнения заболевания полностью не регрессируют. ТГСК должна быть проведена как можно раньше, до появления грубых неврологических расстройств. Несмотря на улучшение состояния пациента, ТГСК сопровождается высоким риском серьезных посттрансплантационных осложнений и является сложной многоэтапной высокозатратной процедурой.
ФЗТ безопасна, хорошо переносится больными, не вызывает тяжелых нежелательных явлений и приводит к разложению негидролизованного субстрата. Возможные редкие реакции на введение препарата обусловлены образованием антител против введенного белка, но они не постоянны и, как правило, быстро купируются стандартными лекарственными средствами. Принцип ФЗТ основан на восстановлении уровня энзиматической активности, достаточной для гидролиза накопленных субстратов и для предотвращения их дальнейшего накопления.
Препарат Альдуразим (МНН: ларонидаза) (Джензайм, США) предназначен для ФЗТ больным с тремя клиническими вариантами I типа мукополисахаридоза (IH, IH/S и IS типы или синдромы Гурлер, Гурлер-Шейе и Шейе), а также детям с синдромом Гурлер до проведения ТГСК (во время поиска родственного/неродственного донора) и в течение 3 - 6 месяцев после ТГСК до стабилизации состояния ребенка; наряду с этим, Альдуразим показан больным, страдающим синдромом Гурлер, после проведенной ТГСК в тех случаях, когда уровень донорского фермента α-L-идуронидазы сохраняется на низких значениях.
Ларонидаза (Байомарин Фармасьютикал Инк., США) - рекомбинантная форма человеческой α-L-идуронидазы, производится с помощью технологии рекомбинантной ДНК с использованием клеточной культуры яичника китайского хомячка. Установлено, что после внутривенного введения ларонидаза быстро покидает системный кровоток и поглощается клетками посредством маннозо-6-фосфатных рецепторов (М6РR), поступая в лизосомы. Препарат вводится внутривенно (в дозе 100 ЕД/кг массы тела), в течение 3 – 4 часов 1 раз в неделю.
Ларонидаза представляет собой рекомбинантный белок из 628 аминокислотных остатков с молекулярной массой приблизительно 83 кДа. Ее молекула содержит 6 участков, связывающихся через аминогруппу с разными по структуре олигосахаридами, в том числе включающими остатки маннозо-6-фосфатов (М6Р) (Rodney J.Y. Ho, Biotechnology and biopharmaceuticals: transforming proteins and genes into drugs. – Wiley-Blackwell, 2013, p. 380). Установлено, что молекула ларонидазы не проникает через гематоэнцефалический барьер (физиологический барьер между периферическим кровообращением и головным мозгом, который образован плотными соединениями плазматических мембран эндотелиальных клеток капилляров мозга, создающими плотный барьер, ограничивающий перенос молекул в мозг, даже очень малых молекул; далее также указывается как ГЭБ) и, таким образом, не замедляет и не предотвращает развитие нарушений со стороны центральной нервной системы (ЦНС), характерных для мукополисахаридоза I типа (Pastores G.M. et al, 2007).
Мукополисахаридоз II типа (МПС-II, синдром Хантера), в отличие от всех остальных форм мукополисахаридозов, имеющих аутосомно-рецессивный тип наследования, представляет собой единственную форму мукополисахаридозов с Х-сцепленным рецессивным типом наследования. МПС II – гетерогенная по клиническим проявлениям, прогрессирующая патология лизосомального накопления, возникающая вследствие недостаточности фермента идуронат-2-сульфатазы (идурсульфазы). Данный фермент в норме участвует в деградации мукополисахаридов дерматан-сульфата и гепаран-сульфата за счет гидролитического отщепления О-связанной сульфатной группы. Соответственно, в случае МПС II основной патогенетический механизм связан с прогрессирующим накоплением дерматан- и гепаран-сульфатов в лизосомах.
Наиболее частыми клиническими симптомами МПС-II являются задержка умственного развития, увеличенный язык, характерные патологии лицевого скелета, алопеция, аномалии развития зубов, рестриктивное заболевание легких, гепатоспленомегалия, патология клапанов сердца, костно-суставные патологии, тяжелая низкорослость. Также, часто наблюдаются прогрессирующие неврологические расстройства, сопровождающиеся гидроцефалией и повышенным внутричерепным давлением. Смертельный исход обычно наступает в течение второй – третьей декады жизни, чаще всего, по причине дыхательной и/или сердечной недостаточности. Важно подчеркнуть, что заболевание протекает с вовлечение в патологический процесс нервной системы, в том числе со снижением интеллекта.
На сегодняшний день имеется два принципиальных способа лечения МПС II – ФЗТ и симптоматическая терапия (включает в себя применение гепатопротекторов, сердечно-сосудистых и противовоспалительных средств, витаминов и препаратов, улучшающих антиоксидантную защиту). ТГСК для лечения МПС II, в отличие от мукополисахаридоза I типа, не эффективна.
Элапраза (МНН: идурсульфаза) (Шайер, США) – медицинский продукт, представляющий рекомбинантную идуронат-2-сульфатазу человека. Этот фермент отвечает за гидролиз С2-сульфатных эфирных связей остатков идуроновой кислоты, входящей в состав глюкозаминогликанов (мукополисахаридов) дерматан-сульфата и гепаран-сульфата (Burrow T. A. et al., 2013). Обычный режим введения Элапразы – 0,5 мг/кг веса тела, раз в неделю; введение осуществляется путем внутривенной инфузии в течение 3 часов (время инфузии может быть постепенно сокращено до 1 часа).
Идурсульфаза содержит две дисульфидные связи и восемь N-связанных сайтов гликозилирования, занятых сложными высокоманнозными олигосахаридами. Присутствие в олигосахаридных цепях остатков М6Р позволяет рекомбинантному ферменту связываться с М6Р-рецепторами на поверхности целевых клеток, что приводит к интернализации указанного фермента в клетки и его интернализации в лизосомы, где он и обеспечивает деградацию лизосомальных мукополисахаридов (Muenzer J., et al., Genet. Med. 2006 Aug; 8(8):465 – 473).
При проведении ФЗТ продолжительность жизни больных с синдромом Хантера увеличивается в несколько раз. Несмотря на это, Элапраза также не проникает через гематоэнцефалический барьер, в результате при использовании ФЗТ Элапразой пациенты погибают в возрасте 20 лет от нейродегенеративных последствий, при этом во второй декаде жизни больные, получающие Элапразу, как правило, испытывают большие сложности в обучении и нуждаются в помощниках даже в бытовой жизни (da Silva E. M. et al., 2016; Wraith J.E. et al., 2008).
Таким образом, общим недостатком всех существующих на сегодняшний день препаратов, используемых для ФЗТ мукополисахаридозов I и II типов, является их неспособность проникать через гематоэнцефалический барьер в центральную нервную систему, что ограничивает эффективность применения данных препаратов у больных с поражением нервной системы, ассоциированным с мукополисахаридозом, включая мукополисахаридоз I и II типов.
При многих болезнях лизосомного накопления есть потребность в улучшенной интернализации фермента в клетки определенных периферических тканей (мышцы диафрагмы в болезни Помпе, печень и селезенка в болезни Хантера, почки в болезни Фабри и т.д.) (Hawkes C. et al., 2004).
Таким образом, актуальна задача разработки терапевтического соединения, которое могло бы использоваться для лечения лизосомной болезни накопления, такой как МПС I типа или МПС II типа, и которое сохраняло бы функциональные свойства соответствующего терапевтического фермента, при этом демонстрируя высокую активность и улучшенную способность транспортироваться к лизосомам клеток тканей различных органов, в том числе, к лизосомам клеток нервной ткани, и позволяло бы достичь значительного улучшения качества и продолжительности жизни больных МПС I и II типов.
Преимущества изобретения
Вышеуказанные задачи успешно решаются в настоящем изобретении, которое относится к соединению, предназначенному для лечения лизосомной болезни накопления, содержащему терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, при этом указанный транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG, специфичного к эпитопу в рецепторе инсулина. Изобретение основано на неожиданном открытии того, что транспортный элемент, представляющий собой Fab-фрагмент иммуноглобулина IgG, специфичный к эпитопу в рецепторе инсулина, соединенный непосредственно или при помощи линкера с терапевтическим ферментом, приводит неожиданно к улучшению способности фермента транспортироваться к лизосомам различных органов и тканей, в том числе, к лизосомам клеток нервной ткани, и одновременно ферментативная активность соединения остается на высоком уровне. Благодаря этому неожиданному эффекту достигается прогресс в области ферментной заместительной терапии лизосомных болезней накопления, таких как мукополисахаридоз I и II типов, и увеличение продолжительности, и улучшение качества жизни субъектов, страдающих лизосомными болезнями накопления и нуждающихся в терапии. Соединение согласно настоящему изобретению также обеспечивает расширение арсенала средств, применяемых для лечения и профилактики заболеваний, в частности, лизосомных болезней накопления, таких как мукополисахаридоз, в частности, мукополисахаридоз I и II типов.
Кроме того неожиданно было обнаружено увеличение ферментативной активности соединения, содержащего транспортный элемент, представляющий собой Fab-фрагмент иммуноглобулина IgG, специфичный к эпитопу в рецепторе инсулина, соединенный непосредственно или при помощи линкера с терапевтическим ферментом, в сравнении с терапевтическим ферментом без транспортного элемента; а также, что введение соединения, содержащего транспортный элемент, представляющий собой Fab-фрагмент иммуноглобулина IgG, специфичный к эпитопу в рецепторе инсулина, соединенный непосредственно или при помощи линкера с терапевтическим ферментом обеспечивает более высокую степень замещения активности терапевтического фермента в мозге человека в сравнении с соединениями, содержащими Mab-фрагмент.
Краткое описание изобретения
Настоящее краткое описание предлагает краткое описание настоящего изобретения с той целью, чтобы вкратце обозначить предмет и сущность настоящего изобретения. Краткое описание представляют с пониманием того, что его не следует применять для толкования или ограничения объема или смыслового содержания формулы изобретения.
Первым объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, при этом транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG, специфичного к эпитопу в рецепторе инсулина.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, при этом транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG, специфичного к эпитопу в рецепторе инсулина, и способен транспортировать указанный фермент через гематоэнцефалический барьер.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, при этом транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG, специфичного к эпитопу в рецепторе инсулина, и способен транспортировать указанный фермент через гематоэнцефалический барьер, при этом терапевтический фермент и транспортный элемент, соединены друг с другом при помощи линкера. Линкер может представлять собой пептидный линкер, содержащий одну или более аминокислот. Линкер может представлять собой пептидный линкер, содержащий одну или более аминокислот, выбранных из глицина, серина и лейцина.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, где транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG, где иммуноглобулин IgG представляет собой IgG1, IgG2 или IgG4.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, где транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG, где иммуноглобулин IgG представляет собой IgG1.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, где транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG1, состоящий из легких цепей иммуноглобулина IgG1 к рецептору инсулина (SEQ ID NO:2, 8, 9, 10 и 11) и тяжелой цепи (SEQ ID NO:3). В частном варианте объектом настоящего изобретения является соединение, где транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG1, состоящий из легкой цепи иммуноглобулина IgG1 к рецептору инсулина SEQ ID NO:2 и тяжелой цепи SEQ ID NO:3.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, где терапевтический фермент применяется для лечения лизосомной болезни накопления, в том числе, для лечения ферментной недостаточности, характерной для данной лизосомной болезни накопления.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, где терапевтический фермент применяется для лечения лизосомной болезни накопления с неврологической составляющей, в том числе, для лечения ферментной недостаточности, характерной для данной лизосомной болезни накопления.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, где терапевтический фермент для лизосомной болезни накопления с неврологической составляющей выбран из группы, состоящей из идуронат-2-сульфатазы и α-L-идуронидазы.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, где терапевтический фермент для лизосомной болезни накопления с неврологической составляющей выбран из группы, состоящей из идуронат-2-сульфатазы, фрагмента идуронат-2-сульфатазы, имеющего активность идуронат-2-сульфатазы, или аналога идуронат-2-сульфатазы.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, где терапевтический фермент для лизосомной болезни накопления с неврологической составляющей выбран из группы, состоящей из α-L-идуронидазы, фрагмента α-L-идуронидазы, имеющего активность α-L-идуронидазы, или аналога α-L-идуронидазы.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, в котором указанный линкер представляет собой пептидный линкер, содержащий одну или более аминокислот.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, в котором указанный линкер представляет собой пептидный линкер, содержащий одну или более аминокислот, выбранных из глицина, серина и лейцина.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, в котором указанный транспортный элемент способен транспортировать указанный фермент к лизосомам клеток тканей.
В конкретном варианте объектом настоящего изобретения является соединение, предназначенное для лечения лизосомной болезни накопления, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, в котором указанный транспортный элемент способен транспортировать указанный фермент к лизосомам клеток нервной ткани.
Еще одним объектом изобретения является соединение для лечения или профилактики ферментной недостаточности (недостаточности идуронат-2-сульфатазы) у субъекта, имеющего мукополисахаридоз типа II, представленное первой аминокислотной последовательностью, выбранной из SEQ ID NO:2, 8, 9, 10 или 11, и второй аминокислотной последовательностью, выбранной из SEQ ID NO:4, 5, 12, 13, 14 или 15. В частном варианте объектом настоящего изобретения является соединение для лечения или профилактики ферментной недостаточности (недостаточности идуронат-2-сульфатазы) у субъекта, имеющего мукополисахаридоз типа II, представленное аминокислотными последовательностями SEQ ID NO:2 и SEQ ID NO:4.
Следующим объектом изобретения является соединение для лечения или профилактики ферментной недостаточности (недостаточности идуронат-2-сульфатазы) у субъекта, имеющего мукополисахаридоз типа II с неврологической составляющей, представленное аминокислотными последовательностями SEQ ID NO:2 и SEQ ID NO:4.
Следующим объектом изобретения является соединение для лечения или профилактики ферментной недостаточности (недостаточности идуронат-2-сульфатазы) у субъекта, имеющего мукополисахаридоз типа II с неврологической составляющей, представленное аминокислотными последовательностями SEQ ID NO:2 и SEQ ID NO:5.
Еще одним объектом изобретения является соединение для лечения или профилактики ферментной недостаточности (недостаточности α-L-идуронидазы) у субъекта, имеющего мукополисахаридоз типа I, представленное аминокислотными последовательностями SEQ ID NO:2 и SEQ ID NO:6.
Следующим объектом изобретения является соединение, представленное аминокислотными последовательностями SEQ ID NO:2 и SEQ ID NO:6, для лечения или профилактики ферментной недостаточности (недостаточности α-L-идуронидазы) у субъекта, имеющего мукополисахаридоз типа I.
Следующим объектом изобретения является соединение, представленное аминокислотными последовательностями SEQ ID NO:2 и SEQ ID NO:6, для лечения или профилактики ферментной недостаточности (недостаточности α-L-идуронидазы) у субъекта, имеющего мукополисахаридоз типа I с неврологической составляющей.
Следующим объектом изобретения является соединение, представленное аминокислотными последовательностями SEQ ID NO:2 и SEQ ID NO:7, для лечения или профилактики ферментной недостаточности (недостаточности α-L-идуронидазы) у субъекта, имеющего мукополисахаридоз типа I с неврологической составляющей.
Кроме того, настоящее изобретение относится к применению соединения, содержащего терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, для получения фармацевтической композиции, содержащей указанное соединение в эффективном количестве и фармацевтически приемлемый носитель.
Кроме того, настоящее изобретение относится к применению соединения, содержащего терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, для лечения или профилактики у субъекта, имеющего лизосомную болезнь накопления, включающие введение указанному субъекту указанное соединения в эффективном количестве.
В конкретном варианте изобретение относится к применению соединения, содержащего терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, для лечения или профилактики ферментной недостаточности у субъекта, имеющего лизосомную болезнь накопления, где лизосомная болезнь накопления представляет собой мукополисахаридоз, при этом соединение вводят указанному субъекту в эффективном количестве, предпочтительно, совместно с фармацевтически приемлемым носителем.
В конкретном варианте изобретение относится к применению соединения, содержащего терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, для лечения или профилактики ферментной недостаточности (недостаточности идуронат-2-сульфатазы) у субъекта, имеющего лизосомную болезнь накопления, где лизосомная болезнь накопления представляет собой мукополисахаридоз типа II с неврологической составляющей, при этом соединение вводят указанному субъекту в эффективном количестве, предпочтительно, совместно с фармацевтически приемлемым носителем.
В конкретном варианте изобретение относится к применению соединения, содержащего терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, для лечения или профилактики ферментной недостаточности (недостаточности α-L-идуронидазы) у субъекта, имеющего лизосомную болезнь накопления, где лизосомная болезнь накопления представляет собой мукополисахаридоз типа I с неврологической составляющей, при этом соединение вводят указанному субъекту в эффективном количестве, предпочтительно, совместно с фармацевтически приемлемым носителем.
Кроме того, настоящее изобретение относится к применению соединения, содержащего терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, для лечения или профилактики ферментной недостаточности (недостаточности идуронат-2-сульфатазы) у субъекта, имеющего лизосомную болезнь накопления, где лизосомная болезнь накопления представляет собой мукополисахаридоз типа II, при этом соединения, представленного аминокислотными последовательностями SEQ ID NO:2 и SEQ ID NO:4, для получения фармацевтической композиции, содержащей указанное соединение в эффективном количестве и фармацевтически приемлемый носитель.
Кроме того, настоящее изобретение относится к применению соединения, содержащего терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, для лечения или профилактики ферментной недостаточности (недостаточности идуронат-2-сульфатазы) у субъекта, имеющего лизосомную болезнь накопления, где лизосомная болезнь накопления представляет собой мукополисахаридоз типа II, при этом соединения, представленного аминокислотнымиой последовательностямиью SEQ ID NO:2 и SEQ ID NO:4, для лечения или профилактики ферментной недостаточности у субъекта.
В других вариантах осуществления настоящего изобретения предлагаемый в настоящем изобретении подход можно использовать и для лечения других лизосомальных болезней накопления, в частности, для лечения других типов мукополисахаридоза, таких как мукополисахаридоз III типа (синдром Санфилиппо), включая мукополисахаридоз IIIA типа, IIIB типа, IIIC типа и IIID типа; мукополисахаридоз IV типа (синдром Моркио), включая мукополисахаридоз IVA типа и IVB типа; мукополисахаридоз VI типа (синдром Марото-Лами), мукополисахаридоз VII типа (синдром Слая) и мукополисахаридоз IX типа. В этих случаях в качестве соответствующего терапевтического фермента вместо α-L-идуронидазы или идуронат-2-сульфатазы используют иной терапевтический фермент, с недостаточностью которого сталкиваются больные соответствующей формой мукополисахаридоза: гепарансульфамидазу — при мукополисахаридозе IIIA типа, N-ацетилглюкозаминидазу — при мукополисахаридозе IIIВ типа, гепаран-α-глюкозаминид-N-ацетилтрансферазу — при мукополисахаридозе IIIС типа, N-ацетилглюкозамин-6-сульфатазу — при мукополисахаридозе IIID типа, галактоза-6-сульфатсульфатазу — при мукополисахаридозе IVA типа, β-галактозидазу — при мукополисахаридозе IVB типа, N-ацетилгалактозамин-4-сульфатазу — при мукополисахаридозе VI типа, β-глюкуронидазу — при мукополисахаридозе VII типа и гиалуронидазу — при мукополисахаридозе IX типа. Аминокислотные последовательности указанных терапевтических ферментов можно получить при помощи любой из ряда компьютерных программ, известных в данной области техники, например, BLAST или FASTA и т.д. Как в BLAST, так и в FASTA доступны оффлайн- и онлайн-поиск (см. Ausubel et al., 1999 ibid, pages 7-58 - 7-60, веб-сайт Национального центра биотехнологической информации на веб-сайте Национального института здравоохранения).
Предлагаемый в настоящем изобретении подход, в альтернативных вариантах осуществления изобретения, может быть также применен и для лечения лизосомных болезней накопления, не относящихся к мукополисахаридозам, путем использования вместо α-L-идуронидазы или идуронат-2-сульфатазы иного лизосомального фермента, с недостаточностью сталкиваются больные соответствующей лизосомной болезнью накопления. В отдельных неограничивающих вариантах осуществления настоящего изобретения, предлагаемый подход может быть, в частности, применен для лечения нарушений обмена аминокислот, таких как цистиноз; для лечения нарушений обмена углеводов, таких как болезни накопления гликогена, в частности, болезнь Помпе; нарушений обмена сфинголипидов и других болезней накопления липидов, в частности, GMHYPERLINK "https://ru.wikipedia.org/wiki/GM2_%D0%B3%D0%B0%D0%BD%D0%B3%D0%BB%D0%B8%D0%BE%D0%B7%D0%B8%D0%B4%D0%BE%D0%B7"2HYPERLINK "https://ru.wikipedia.org/wiki/GM2_%D0%B3%D0%B0%D0%BD%D0%B3%D0%BB%D0%B8%D0%BE%D0%B7%D0%B8%D0%B4%D0%BE%D0%B7" ганглиозидоза, включая болезнь Сандхоффа и болезнь Тау-Сакса; других ганглиозидозов, в частности, GMHYPERLINK "https://ru.wikipedia.org/wiki/GM2_%D0%B3%D0%B0%D0%BD%D0%B3%D0%BB%D0%B8%D0%BE%D0%B7%D0%B8%D0%B4%D0%BE%D0%B7"1HYPERLINK "https://ru.wikipedia.org/wiki/GM2_%D0%B3%D0%B0%D0%BD%D0%B3%D0%BB%D0%B8%D0%BE%D0%B7%D0%B8%D0%B4%D0%BE%D0%B7" ганглиозидоза и муколипидоза IV; других сфинголипидозов, в частности, болезни Фабри, болезни Гоше, болезни Краббе, болезни Ниманна-Пика, синдрома Фарбера, метахромной лейкодистрофии и множественной сульфатазной недостаточности; липофусциноза нейронов, в частности, болезни Баттена, Бильшовского-Янского, Куфса, Шпильмейера-Фогта; других нарушений накопления липидов, в частности, болезни Вольмана, а также для лечения нарушений обмена гликопротеинов, включая муколипидоз II (I-клеточную болезнь), муколипидоз III (псевдолиподистрофию Гурлер), и для лечения дефектов деградации гликопротеинов, включая аспартилглюкозаминоурию, фукозидоз, маннозидоз и сиалидоз.
В этих случаях к транспортному элементу вместо α-L-идуронидазы или идуронат-2-сульфатазы присоединяют непосредственно или при помощи линкера, аминокислотную последовательность соответствующего фермента, с недостаточностью которого сталкиваются больные соответствующей лизосомной болезнью накопления.
Наиболее предпочтительные варианты осуществления настоящего изобретения описаны ниже. При этом указанные предпочтительные варианты приводятся лишь для целей иллюстрации настоящего изобретения, а не для ограничения объема притязаний.
Краткое описание фигур
Изобретение проиллюстрировано следующими фигурами.
На фиг. 1 показана репрезентативная авторадиограмма самца яванского макака, зарегистрированная через 2 часа после однократного внутривенного введения [125I]- HIR-Fab-IDS с номинальным уровнем дозы 0,0020 мг/кг массы тела.
На фиг. 2 показана репрезентативная авторадиограмма самца яванского макака, зарегистрированная через 2 часа после однократного внутривенного введения [125I]-HIR-Mab-IDS с номинальным уровнем дозы 0,0015 мг/кг массы тела.
На фиг. 3 показана репрезентативная авторадиограмма самца яванского макака, зарегистрированная через 2 часа после однократного внутривенного введения [125I]-IDS (контроль) с номинальным уровнем дозы 0,0010 мг/кг массы тела.
Подробное описание
Если не указано иное, все технические и научные термины, применяемые в настоящем описании, используют то же значение, какое обычно понимается средним специалистом в данной области техники (например, в молекулярной генетике, химии нуклеиновых кислот, химии белков, биохимии, органической химии, иммунологии, микробиологии, генетике и т.д.).
В контексте настоящего описания термин «соединение» понимается в самом широком смысле как по меньшей мере одна молекула, представляющая собой конъюгат, слитый белок, белковый конструкт, белковый комплекс и т.д.
Как используется в настоящем описании, под термином «содержащий» понимают соединение, включающие перечисленные элементы, не исключая другие.
В настоящем описании термины «терапевтический фермент» и «фермент» являются синонимами и относятся к ферменту для лечения заболеваний, возникающих вследствие отсутствия, дефицита, нарушений функций фермента и так далее, при этом субъекта, страдающего заболеваниями, можно лечить посредством ФЗТ, введения фермента и так далее. В частности, фермент может представлять собой фермент для лечения заболеваний, которые могут возникать вследствие отсутствия, дефицита и нарушений функций лизосомного фермента, но, не ограничиваясь таковым.
Терапевтический фермент, который входит в состав соединения по настоящему описанию, охватывает любой фермент, который обладает терапевтическим эффектом в отношении лизосомной болезни накопления, включая, без ограничения, β-глюкозидазу, β-галактозидазу, галактозо-6-сульфатазу, кислую церамидазу, кислую сфингомиелиназу, галактоцереброзидазу, арилсульфатазу А, β-гексозаминидазу А, β-гексозаминидазу В, гепарин-N-сульфатазу, α-D-маннозидазу, β-глюкуронидазу, N-ацетилгалактозамин-6-сульфатазу, лизосомную кислую липазу, α-N-ацетил-D-глюкозаминидазу (NAGLU), глюкоцереброзидазу, бутирилхолинэстеразу, хитиназу, глутаматдекарбоксилазу, липазу, уриказу, ацетилгидролазу фактора активации тромбоцитов, нейтральную эндопептидазу, миелопероксидазу, ацетил-СоА-глюкозаминид-N-ацетилтрансферазу, N-ацетилглюкозамин-6-сульфатазу, галактозамин-6-сульфатазу (GALN), гиалуронидазу, α-фукозидазу, β-маннозидазу, α-нейраминидазу (сиалидазу), N-ацетил-глюкозамин-1-фосфотрансферазу, муколипина-1, α-N-ацетил-галактозаминидазу, N-аспартил-β-глюкозаминидазу, LAMP-2 (связанный с лизосомами мембранный белок 2), цистинозин, сиалин, церамидазу, кислую Р-глюкозидазу, галактозилцерамидазу, NPC1 (белок болезни Ниманна-Пика типа С1), катепсин A, SUMF-1 (модифицирующий сульфатазу фактор-1), лизосомную кислую липазу (LIPА) и трипептидилпептидазу 1.
В частности, терапевтический фермент охватывает такие ферменты как агалcидаза, имиглюцераза, галсульфаза, идуронат-2-сульфатаза и α-L-идуронидаза. Наиболее предпочтительно, терапевтический фермент представляет собой идуронат-2-сульфатазу или α-L-идуронидазу.
Однако настоящее описание также может охватывать любой терапевтический фермент, без ограничения, независимо от типа или происхождения фермента.
В настоящем описании термин «идуронат-2-сульфатаза», а также «идурсульфаза», «IDS», «ИДС», «I2S» подразумевает рекомбинантный аналог лизосомного фермента идуронат-2-сульфатазы, в норме гидролизирующего О-связанную сульфатную группу мукополисахаридов - дерматан- и гепаран-сульфатов. В настоящем изобретении термин «идуронат-2-сульфатаза» можно использовать взаимозаменяемо с термином «идурсульфаза».
В контексте настоящего описания термины «HIR-Fab-IDS», а также «rIDS-FAB-HI», «rHI-FAB-IDS», «rIDS-FAB-HIR» и «rHIR-FAB-IDS» являются синонимами и обозначают гибридный рекомбинантный белок идуронат-2-сульфатазы, ковалентно соединенный с Fab-фрагментом моноклонального антитела к инсулиновому рецептору человека. В контексте настоящего описания «HIR-Fab-IDS» подразумевает, не ограничиваясь таковым, идуронат-2-сульфатазу с фрагментом моноклонального антитела к инсулиновому рецептору человека. В частных (неограничивающих) вариантах настоящего изобретения, варианты HIR-Fab-IDS, представлены первой аминокислотной последовательностью, выбранной из SEQ ID NO:2, 8, 9, 10 или 11, и второй аминокислотной последовательностью, выбранной из SEQ ID NO:4, 5, 12, 13, 14 или 15. В конкретном варианте осуществления настоящего изобретения HIR-Fab-IDS представлено первой аминокислотной последовательность SEQ ID NO:2 и второй аминокислотной последовательностью SEQ ID NO:4.
В контексте настоящего описания «HIR-Mab-IDS» - гибридный рекомбинантный белок идуронат-2-сульфатазы, ковалентно соединенный с полноразмерным моноклональным антителом к инсулиновому рецептору человека. В частных (неограничивающих) вариантах настоящего изобретения, варианты HIR-Mab-IDS представляют собой варианты согласно патентному документу США US8834874 B2, 16.09.2014. В конкретном варианте осуществления настоящего изобретения HIR-Mab-IDS представлено аминокислотной последовательностью продукта по проекту AGT-182 компании ArmaGen Technologies Inc.
В настоящем описании термин «α-L-идуронидаза», а также «идуронидаза», «ларонидаза», «IDUA» подразумевает фермент, задействованный в гидролизе гликозаминогликанов, таких как дерматансульфат и гепарансульфат. В настоящем описании термин «α-L-идуронидаза» можно использовать взаимозаменяемо с термином «ларонидаза». Дефицит (генетически обусловленная недостаточность) идуронидазы, имеющая место при мукополисахаридозе типа I, приводит к постепенному накоплению в клетках и тканях организма гликозаминогликанов – гепарансульфата и дерматансульфата.
«HIR-Fab-IDUA», а также «rIDUA-FAB-HI», «rHI-FAB-IDUA», «rIDUA-FAB-HIR», «rHIR-FAB-IDS» - гибридный рекомбинантный белок α-L-идуронидаза, ковалентно соединенный с Fab-фрагментом моноклонального антитела к инсулиновому рецептору человека. В частных (неограничивающих) вариантах настоящего изобретения, варианты HIR-Fab- IDUA, представлены первой аминокислотной последовательностью, выбранной из SEQ ID NO:2, 8, 9, 10 или 11, и второй аминокислотной последовательностью, выбранной из SEQ ID NO:6,7.
HIR-Mab-IDUA - гибридный рекомбинантный белок α-L-идуронидаза, ковалентно соединенный с полноразмерным моноклональным антителом к инсулиновому рецептору человека.
Терапевтические ферменты, которые могут входить в состав соединений по настоящему изобретению, могут находиться в своей нативной форме, а также в форме фрагментов, состоящих из частей ферментов, или аналогов ферментов, в которых возникла вариация, выбранная из группы, состоящей из замены, добавления, делеции, модификации некоторых аминокислот и их комбинации, без ограничения, при условии, что они обладают такой же ферментативной активностью, как и нативные формы соответствующих терапевтических ферментов. В частных (неограничивающих) вариантах осуществления изобретения, могут использоваться фрагменты ферментов, обладающие активностью нативных форм соответствующих ферментов. Аналогами ферментов, без ограничения, считаются те ферменты, которые, имеют различные характеристики гликозилирования и степень гликозилирования, обусловленные экспрессией известного фермента в различных хозяевах, а также различную степень замен конкретных аминокислотных остатков соответствующего фермента относительно стандартной последовательности, где степень замен не является 100% заменой. В частных (неограничивающих) вариантах осуществления изобретения, могут использоваться аналоги α-L-идуронидазы, известные из патентов US5932211 A, 03.08.1999, US6153188 A, 28.11.2006 и US6541254 B1, 01.04.2003, а также аналоги идуронат-2-сульфатазы. Специалисту в данной области понятно, что могут использоваться и другие фрагменты и аналоги ферментов α-L-идуронидазы и идуронат-2-сульфатазы, обладающие активностью нативных форм соответствующих ферментов, которые известны из уровня техники в настоящее время или станут известны впоследствии.
Ферменты можно получать традиционными для данной области техники методами, например, посредством генетической рекомбинации в клетках животных, Е. coli, дрожжей, насекомых, растений и в живых животных и так далее, с использованием различных экспрессирующих векторов, хорошо известных специалисту в данной области. Способы получения не ограничиваются указанными и включают в себя также другие способы получения ферментов, известные специалисту в данной области. Неограничивающие примеры таких способов получения ферментов в клетках различных организмов, а также неограничивающие примеры экспрессирующих векторов см. в руководстве Sambrook et al., “Molecular Cloning: A Laboratory Manual” - CSH Press, Cold Spring Harbor, 1989, “Current Protocols in Molecular Biology, John Wiley & Sons, New York, 2001. В предпочтительных вариантах осуществления изобретения, ферменты получают в клетках млекопитающих. В наиболее предпочтительных вариантах осуществления изобретения, ферменты получают в клетках яичника китайского хомячка.
В отдельных предпочтительных воплощениях изобретения, ферменты могут быть коммерчески доступными ферментами. Кроме того, ферменты могут включать аминокислотную последовательность, которая обладает гомологией по меньшей мере 80%, более конкретно, 90% и еще более конкретно 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% или выше с указанными выше ферментами или их аналогами, и ферменты могут быть получены из микроорганизмов при помощи рекомбинантной технологии или могут быть приобретены из коммерческих источников, без ограничения.
В настоящем описании термин «гомология» означает степень сходства с аминокислотной последовательностью белка дикого типа или нуклеотидной последовательностью, кодирующей аминокислоты, и охватывает последовательности, которые имеют указанную выше степень сходства последовательностей, выраженную в процентах, с аминокислотными последовательностями или нуклеотидными последовательностями по настоящему изобретению. Гомологию можно определять путем сравнения двух заданных последовательностей невооруженным глазом или можно определять при помощи биоинформационного алгоритма, который позволяет анализировать гомологию путем выравнивания рассматриваемых последовательностей для сравнения. Гомология между двумя заданными аминокислотными последовательностями может быть указана в процентах. Существуют эффективные автоматизированные алгоритмы, которые можно применять в программных модулях GAP, BESTFIT, FASTA и TFASTA пакета программ Wisconsin Genetics (Genetics Computer Group, Madison, WI, США). Алгоритм выравнивания, автоматизированный в указанных модулях, включает алгоритмы выравнивания последовательностей Нидлмана и Вунша, Пирсона и Липмана, а также Смита и Ватермана. Другие алгоритмы, которые можно применять для выравнивания последовательностей и определения гомологии, автоматизированы в программах FASTP, BLAST, BLAST2, PSIBLAST и CLUSTAL W. Аминокислотные последовательности и нуклеотидные последовательности, кодирующие ферменты и их аналоги, могут быть взяты в известной базе данных, такой как GenBank NCBI, не ограничиваясь ей.
В некоторых вариантах реализации изобретения транспортный элемент соединения содержит Fab-фрагмент иммуноглобулина IgG1, состоящий из первой аминокислотной последовательности, по меньшей мере на 50, 55, 60, 65, 70, 75, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более идентичную SEQ ID NO:2.
В конкретных вариантах реализации изобретения транспортный элемент соединения содержит Fab-фрагмент иммуноглобулина IgG1, состоящий из первой аминокислотной последовательности, по меньшей мере на 80% или более идентичную SEQ ID NO:2.
В некоторых вариантах реализации изобретения соединение, представленное первой аминокислотной последовательностью по меньшей мере на 50, 55, 60, 65, 70, 75, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более идентичную SEQ ID NO:2, и второй аминокислотной последовательностью, по меньшей мере идентичной SEQ ID NO:4, применяемое для лечения или профилактики недостаточности лизосомального фермента у субъекта, имеющего мукополисахаридоз II типа.
В конкретных вариантах реализации изобретения соединение, представленное первой аминокислотной последовательностью по меньшей мере на 80% или более идентичную SEQ ID NO:2, и второй аминокислотной последовательностью, по меньшей мере идентичной SEQ ID NO:4, применяемое для лечения или профилактики недостаточности лизосомального фермента у субъекта, имеющего мукополисахаридоз II типа.
Термин «аминокислота» обозначает группу карбокси-α-аминокислот либо встречающихся в природе, т.е. которые непосредственно или в виде предшественника могут кодироваться нуклеиновой кислотой, либо не встречающихся в природе. Индивидуальные встречающиеся в природе аминокислоты кодируются нуклеиновыми кислотами, состоящими из трех нуклеотидов - так называемых кодонов или триплетов оснований. Каждая аминокислота кодируется по меньшей мере одним кодоном.
Термин «аминокислота» в том виде, в котором он используется в пределах настоящего описания, обозначает встречающиеся в природе карбокси-α-аминокислоты, включающие следующие: аланин (трехбуквенный код: Ala, однобуквенный код: А), аргинин (Arg, R), аспарагин (Asn, N), аспарагиновая кислота (Asp, D), цистеин (Cys, С), глутамин (Gln, Q), глутаминовая кислота (Glu, Е), глицин (Gly, G), гистидин (His, Н), изолейцин (IIе, I), лейцин (Leu, L), лизин (Lys, K), метионин (Met, М), фенилаланин (Phe, F), пролин (Pro, Р), серии (Ser, S), треонин (Thr, Т), триптофан (Trp, W), тирозин (Tyr, Y) и валин (Val, V). Примеры аминокислот, не встречающихся в природе (непротеиногенных аминокислот), включают, Aad (альфа-аминоадипиновая кислота), Abu (аминомасляная кислота), Ach (альфа-аминоциклогексан-карбоновая кислота), Аср (альфа-аминоциклопентан-карбоновая кислота), Асрс (1-аминоциклопропан-1-карбоновая кислота), Aib (альфа-аминоизомасляная кислота), Aic (2-аминоиндан-2-карбоновая кислота; также именуемая 2-2-Aic), 1-1-Aic (1-аминоиндан-1-карбоновая кислота), (2-аминоиндан-2-карбоновая кислота), аллилглицин (аллилGlу), аллоизолейцин (allo-Ile), Asu (альфа-аминосубериновая кислота, 2-аминооктандиовая кислота), Bip (4-фенил-фенилаланин-карбоновая кислота), BnHP ((2S,4R)-4-гидроксипролин), Cha (бета-циклогексилаланин), Cit (цитруллин), циклогексилглицин (Chg), циклопентилаланин, бета-циклопропилаланин, Dab (1,4-диаминомасляная кислота), Dap (1,3-диаминопропионовая кислота), п-(3,3-дифенилаланин-карбоновая кислота), 3,3-дифенилаланин, ди-н-пропилглицин (Dpg), 2-фурилаланин, гомоциклогексилаланин (HoCha), гомоцитруллин (HoCit), гомоциклолейцин, гомолейцин (HoLeu), гомоаргинин (HoArg), гомосерин (HoSer), гидроксипролин, Lys(Ac), (1) Nal (1-нафтилаланин), (2) Nal (2-нафтилаланин), 4-МеО-Арс (1-амино-4-(4-метоксифенил)-циклогексан-1-карбоновая кислота), нор-лейцин (Nle), Nva (норвалин), оматин, 3-Pal (альфа-амино-3-пиридилаланин-карбоновая кислота), 4-Pal (альфа-амино-4-пиридилаланин-карбоновая кислота), 3,4,5,F3-Phe (3,4,5-трифтор-фенилаланин), 2,3,4,5,6,F5-Phe (2,3,4,5,6-пентафтор-фенилаланин), Pqa (4-оксо-6-(1-пиперазинил)-3(4Н)-хиназолин-уксусная кислота (CAS 889958-08-1)), пиридилаланин, хинолилаланин, саркозин (Sar), тиазолилаланин, тиенилаланин, Tic (альфа-амино-1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота), Tic(OH), Tle (трет-бутилглицин) и Tyr(Ме), но не ограничиваются ими.
Термин «аминокислотная последовательность» относится к полипептидам, имеющим аминокислотные последовательности, которые в некоторой степени отличаются от полипептида с нативной последовательностью соответствующего терапевтического фермента. Обычно варианты аминокислотной последовательности будут обладать по меньшей мере примерно 70%-ной идентичностью последовательности с полипептидом с нативной последовательностью соответствующего терапевтического фермента. В одном воплощении вариант имеет примерно 80% или более идентичности последовательности с полипептидом с нативной последовательностью соответствующего терапевтического фермента. В одном воплощении вариант имеет примерно 90% или более идентичности последовательности с полипептидом с нативной последовательностью соответствующего терапевтического фермента. В одном воплощении вариант имеет примерно 95% или более идентичности последовательности с полипептидом с нативной последовательностью соответствующего терапевтического фермента. В одном воплощении вариант имеет примерно 98% или более идентичности последовательности с полипептидом с нативной последовательностью соответствующего терапевтического фермента. Варианты аминокислотной последовательности обладают заменами, делециями и/или вставками в определенных положениях в пределах аминокислотной последовательности нативной аминокислотной последовательности соответствующего терапевтического фермента. Аминокислоты обозначаются традиционными названиями, однобуквенными и трехбуквенными кодами.
Термин «первая аминокислотная последовательность», используемый в данном изобретении, относится к аминокислотной последовательности иммуноглобулина IgG в общем, к легкой цепи иммуноглобулина IgG, в частности. В частных (неограничивающих) вариантах первая аминокислотная последовательность представляет собой аминокислотную последовательность иммуноглобулина IgG1, аминокислотную последовательности легкой цепи иммуноглобулина IgG1, фрагмент аминокислотной последовательности легкой цепи иммуноглобулина IgG1, выбранную из SEQ ID NO:2, 8, 9, 10 или 11. В конкретном воплощении первая аминокислотная последовательность представляет собой аминокислотную последовательность легкой цепи иммуноглобулина IgG - SEQ ID NO:2.
Термин «вторая аминокислотная последовательность», используемый в данном изобретении, относится к аминокислотной последовательности иммуноглобулина IgG в общем; к тяжелой цепи иммуноглобулина IgG, к фрагменту тяжелой цепи иммуноглобулина IgG, к фрагменту тяжелой цепи иммуноглобулина IgG, соединенного с последовательностью фермента непосредственно или при помощи линкера, в частности. В частных (неограничивающих) вариантах вторая аминокислотная последовательность представляет собой аминокислотную последовательность иммуноглобулина IgG1, аминокислотную последовательность фрагмента тяжелой цепи - SEQ ID NO:3, представляет собой фрагмент тяжелой цепи иммуноглобулина IgG1, соединенный с последовательностью идуронат-2-сульфатазы, выбранный из SEQ ID NO:4, 5, 12, 13, 14 или 15.
Термин «транспортный элемент», используемый в данном изобретении, относится к веществу, которое способно переносить, транспортировать, доставлять терапевтический фермент к лизосомам клеток различных тканей. В частности, но, не ограничиваясь таковым, транспортный элемент будет специфически взаимодействовать с эпитопом, антигеном, рецептором или мишенью таким образом, чтобы обеспечивать эффективную доставку к лизосомам клеток нервной ткани. Таким эпитопом, антигеном, рецептором или мишенью в контексте настоящего описания может являться инсулиновый рецептор человека или его часть, через который осуществляется доставка лекарственного средства, пептида или белка в том числе через ГЭБ.
«Иммуноглобулин» является тетрамерной молекулой, в контексте настоящего описания понятие «полноразмерное антитело». В иммуноглобулине природного происхождения каждый тетрамер состоит из двух идентичных пар полипептидных цепей, при этом каждая пара имеет одну «легкую» (примерно 25 кД) и одну «тяжелую» цепь (примерно 50-70 кД). N-концевая часть каждой цепи включает вариабельную область длиной примерно от 100 до 110 или более аминокислот, главным образом, ответственных за узнавание антигена. Часть карбоксильного конца каждой цепи определяет константную область, главным образом, ответственную за эффекторную функцию.
В контексте настоящего описания понятие «антитело» применяют в его наиболее широком смысле и оно включает, в частности, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антитела при условии, что они обладают требуемой биологической активностью.
В контексте настоящего описания «фрагменты антител» содержат часть интактного антитела, которая сохраняет способность связываться с антигеном. Примерами фрагментов антител являются Fab, Fab', F(ab')2 и Fv-фрагменты; димерные антитела (диабоди); линейные антитела; одноцепочечные молекулы антител, такие, например, как одноцепочечные Fab, scFv и мультиспецифические антитела, образованные из фрагментов антител. В результате расщепления антител папаином образуется два идентичных антигенсвязывающих фрагмента, называемых «Fab-фрагментами», каждый из которых имеет один антигенсвязывающий сайт, и остаточный «Fc-фрагмент», название которого отражает его способность легко кристаллизоваться.
«Fab-фрагмент», «Fab», «FAB» является моновалентным фрагментом, который содержит вариабельные домены тяжелой и легкой цепи и также содержит константный домен легкой цепи и первый константный домен тяжелой цепи. В контексте настоящего описания транспортный элемент содержит аминокислотную последовательность Fab-фрагмента иммуноглобулина IgG, где иммуноглобулин IgG представляет собой IgG1, IgG2 или IgG4. В частных (неограничивающих) вариантах осуществления настоящего изобретения иммуноглобулин IgG представляет собой IgG1. В конкретном воплощении транспортный элемент содержит аминокислотную последовательность Fab-фрагмента иммуноглобулина IgG1, состоящую из первой аминокислотной последовательности, выбранной из SEQ ID NO:2, 8, 9, 10 или 11, и второй аминокислотной последовательности SEQ ID NO:3. В более конкретном воплощении транспортный элемент содержит аминокислотную последовательность Fab-фрагмента иммуноглобулина IgG1, состоящую из SEQ ID NO:2 и SEQ ID NO:3.
В контексте настоящего описания термин «линкер» относится к химическому линкеру или одноцепочечному пептидному линкеру, который соединяет терапевтический фермент и транспортный элемент соединения, предлагаемого в настоящем изобретении. Линкер соединяет, например, одновалентный связывающий элемент содержит СН2-СН3-домен Ig и sFab, мишенью которого является рецептор инсулина, т.е. линкер соединяет sFab с С-концом СН3-СН2-домена Ig.
В некоторых вариантах осуществления изобретения линкер представляет собой химический линкер. Можно применять одноцепочечные пептидные линкеры, содержащие от одной до двадцати аминокислот, сцепленных пептидными связями. В конкретных вариантах осуществления изобретения аминокислоты выбирают из двадцати встречающихся в естественных условиях (протеиногенных) аминокислот. В других конкретных вариантах осуществления изобретения одну или несколько аминокислот выбирают из глицина, аланина, пролина, аспарагина, глутамина и лизина. В частных (неограничивающих) вариантах осуществления настоящего изобретения, одну или несколько аминокислот выбирают из глицина, серина и лейцина.
В конкретных вариантах осуществления изобретения указанный линкер представляет собой одноцепочечный пептид, аминокислотная последовательность которого состоит по меньшей мере из 1 аминокислоты, предпочтительно, из 1-2 аминокислоты. В частных (неограничивающих) вариантах осуществления настоящего изобретения, аминокислотная последовательность линкера может состоять более чем из 1-2 аминокислот, например, из 3 или 15 аминокислот.
Соединение терапевтического фермента и транспортного элемента можно осуществлять с непосредственно или с использованием разнообразных химических линкеров, известных в уровне техники. В отдельных предпочтительных (неограничивающих) вариантах осуществления изобретения, соединение терапевтического фермента и транспортного элемента может быть осуществлено с использованием разнообразных бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональных производных сложных имидоэфиров (таких как диметиладипимидат⋅HCl), активных сложных эфиров (таких как дисукцинимидилсуберат), альдегидов (таких как глутаровый альдегид), бисазидосоединений (таких как бис(пара-азидобензоил)гександиамин), производных бисдиазония (таких как бис(пара-диазонийбензоил)этилендиамин), диизоцианатов (таких как толуол-2,6-диизоцианат) и бис-активных соединений фтора (таких как 1,5- дифтор-2,4-динитробензол). Специалисту в данной области понятно также, что для целей настоящего изобретения могут быть использованы и другие известные из уровня техники химические и пептидные линкеры, не указанные явным образом в настоящем описании.
В отдельных предпочтительных вариантах осуществления изобретения линкер может представлять собой «расщепляемый линкер», который облегчает высвобождение терапевтического фермента после транспортировки соединения в клетки и ткани. Например, можно применять неустойчивый в кислой среде линкер, чувствительный к действию пептидаз линкер, фотолабильный линкер, диметильный линкер или содержащий дисульфид линкер (Chari R. и др., Cancer Res. 52, 1992, сс. 127-131; US 5208020, Chari Ravi J. et al., 04.05.1993). Специалисту в данной области понятно также, что для целей настоящего изобретения могут быть использованы и другие известные из уровня техники расщепляемые линкеры, облегчающие высвобождение терапевтического фермента после проникновения соединения в клетки и ткани центральной нервной системы.
Термин «эпитоп» представляет собой область антигена, которая связывается антигенсвязывающим белком, в том числе антителом. Эпитопы могут быть определены как структурные или функциональные. Функциональные эпитопы, как правило, представляют собой подгруппу структурных эпитопов и имеют те остатки, которые непосредственно способствуют аффинности взаимодействия. Эпитопы также могут быть конформационными, которые состоят из нелинейных аминокислот, другими словами, конформационные эпитопы состоят из непоследовательных аминокислот. Эпитопы могут включать детерминанты, которые являются химически активными поверхностными группировками молекул, такими как аминокислоты, боковые сахарные цепи, фосфорильные группы или сульфонильные группы, а также они могут иметь специфические трехмерные структурные характеристики и/или специфические характеристики заряда. В контексте настоящего описания эпитоп представляет собой эпитоп в рецепторе инсулина, представленного последовательностью SEQ ID NO:1, описанный в работах Zhang B, Roth RA. (1991) Proc Natl Acad Sci U S A.; 88(21):9858-9862 и S A Prigent, K K Stanley, and K Siddle. (1990) J. Biol. 1991.
«Рецептор инсулина» (HIR) представляет собой трансмембранный гликопротеин (с молекулярной массой примерно 320000 Да), который состоит из двух α субъединиц и двух β субъединиц, связанных дисульфидными мостиками (α субъединицы расположены внеклеточно и содержат инсулин-связывающий домен) и участвует в регуляции всасывания и распределения глюкозы, а также синтезе и накоплении жиров, белков и углеводов в организме человека. Рецепторы инсулина и их внеклеточный инсулинсвязывающий домен (ECD) широко известны в данной области техники как структурно, так и функционально. Под локализацией рецепторов инсулина чаще всего понимают поверхности клеток инсулинчувствительных тканей, таких как клеток соединительных тканей, скелетных мышц, клеток жировой ткани, клеток печени и т.д. Смотри, например, Yip et al. (2003), J Biol. Chem. 278 (30): 27329-27332; и Whittaker et al. (2005), J Biol Chem, 280 (22): 20932-20936. В одном из воплощений HIR в данном документе является человеческим инсулиновым рецептором, содержащим аминокислотную последовательность, указанную в Kasuya et al. (Biochemistry 32 (1993) 13531-13536).
Рецептор инсулина экспрессируется практически повсеместно и использование подобного пути доставки может существенно увеличить биодоступность рекомбинантного фермента и увеличить эффективность терапии. Доставка в ткани мозга осуществляется за счет трансцитоза через капиллярный эндотелий ЦНС, посредством взаимодействия с рецептором инсулина человека.
В периферических тканях и тканях мозга (Hawkes C. et al., 2004), экспрессирующих M6PR, интернализация химерной молекулы может осуществляться обоими путями: взаимодействием антитело – HIR и фермент – M6PR. При этом адресная доставка в лизосомы происходит посредством взаимодействия с M6P рецепторами. Интернализация посредством HIR (человеческого инсулинового рецептора) приводит к попаданию в эндосомы раннего порядка и последующего трансцитоза. Помимо доставки работоспособного фермента в ЦНС, при многих болезнях лизосомного накопления есть потребность в улучшенной интернализации определенными периферическими тканями (мышцы диафрагмы в болезни Помпе, печень и селезенка в болезни Хантера, почки в болезни Фабри и т.д.).
Термин «специфичный» обозначают то, что молекула, имеющая отношение к термину, может образовывать комплекс со специфическим участком другой молекулы. Связывание может быть выявлено методами анализа in vitro, как, например, методом плазмонного резонанса (BIAcore, GE-Healthcare, Уппсала, Швеция). Специфичное взаимодействие молекулы с сайтом связывания другой молекулы (аффинность образования комплекса) определяется по показателям ka (константа скорости для ассоциации соединений с образованием комплекса), kD (константа диссоциации, диссоциации комплекса) и KD(kD/ka). Связывание или специфичное связывание означает аффинность связывания (KD) примерно 10-7 М или менее, в одном воплощении - от примерно 10-8 М до примерно 10-13 М, в одном воплощении - от примерно 10-9 М до примерно 10-13 М.
Термин «лизосома» обозначает клеточный органоид, один из видов везикул, который содержит ряд ферментов (кислых гидролаз), способных расщеплять макромолекулы либо самой клетки (например, когда перерабатываются структурные компоненты клетки), либо захваченные извне. Унаследованные дефекты или недостатки лизосомальных ферментов (или других лизосомальных компонентов) могут привести к накоплению недеградированных метаболитов. Гликозаминогликаны (ранее называвшиеся мукополисахаридами) являются обычными полисахаридами поверхности клеток и внеклеточного матрикса и структур. Дефициты ферментов, препятствующие разрушению гликозаминогликана, вызывают накопление фрагментов гликозаминогликана в лизосомах и вызывают обширные изменения костей, мягких тканей и ЦНС.
«Активность» фермента (ферментов) по изобретению может быть измерена с применением любого подходящего теста. Обычно определение рН и определение температуры может быть адаптировано к рассматриваемому ферменту. Примеры тестируемых величин рН составляют рН 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12. Примеры тестируемых температур составляют 30, 35, 37, 40, 45, 50, 55, 60, 65, 70, 80, 90 или 95°C. Предпочтительные величины рН и температуры находятся в физиологическом диапазоне, таком как величины рН 4, 5, 6, 7 или 8 и температура 30, 35, 37 или 40°C. Например, протеазная активность может быть измерена с применением любого теста, в котором применяется субстрат, который включает пептидные связи, имеющие отношение к специфичности рассматриваемой протеазы.
Примеры подходящих тестов ферментов включены в экспериментальную часть, в частности, см. пример 2. Как используется в настоящем описании, под термином «активность» понимают «ферментативная активность», «специфическая активность», «ферментативная специфическая активность»; «удельная активность» в зависимости от контекста описания.
Термин «гематоэнцефалический барьер» или «ГЭБ» относится к физиологическому барьеру между периферическим кровотоком и головным мозгом и спинным мозгом, который формируется в результате плотных контактов в эндотелиальных плазматических мембранах капилляров головного мозга, создающих плотный барьер, который ограничивает транспорт молекул в головной мозг, даже очень малых молекул, таких как мочевина (60 Да). ГЭБ в головном мозге, барьер между кровью и спинным мозгом в спинном мозге и гематоретинальный барьер в сетчатке представляют собой непрерывные капиллярные барьеры в ЦНС и в настоящем описании они в целом обозначены как гематоэнцефалический барьер (далее также указывается как ГЭБ). ГЭБ включает также барьер между кровью и спинномозговой жидкостью.
«Фармацевтическая композиция» относится к смеси одного или более чем одного из соединений, описанных здесь, или их физиологически/фармацевтически приемлемых солей или пролекарств, с другими химическими компонентами, такими как физиологически/фармацевтически приемлемые носители и эксципиенты. Целью фармацевтической композиции является облегчение введения соединения в организм.
Термин «эффективное количество» соединения, например, в фармацевтической композиции, относится к количеству, которое является эффективным в дозах и в течение периодов времени, необходимых для достижения требуемого терапевтического или профилактического результата (эффекта) у субъекта, подвергаемого лечению, при разумном соблюдении польза/риск.
Термин «фармацевтически приемлемый носитель» относится к ингредиенту фармацевтической композиции, отличному от действующего вещества (соединения, агента и т.д.), который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает (но, не ограничиваясь только ими) буфер, эксципиент, стабилизатор или консервант. В частных (неограничивающих) вариантах осуществления настоящего изобретения, фармацевтически приемлемый носитель вводят совместно с соединением.
Фармацевтические композиции, которые содержат соединения, применяемые согласно настоящему изобретению, приготавливают с целью хранения путем смешения с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences, 16-е изд., под ред. Osol А., 1980), предпочтительно, в форме лиофилизированных композиций или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для субъектов в применяемых дозах и концентрациях и они включают буферы, такие как фосфатный, цитратный буферы, а также буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и мета-крезол); полипептиды с низкой молекулярной массой (содержащие менее приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; содержащие металл комплексы (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ).
Фармацевтические композиции, применяемые в настоящем описании, при необходимости могут содержать также более одного действующего вещества (лекарственного средства), активного в отношении лизосомной болезни накопления, необязательно вещества с дополнительными видами активности, которые не оказывают отрицательного воздействия друг на друга. Тип и эффективные количества таких лекарственных средств зависят, например, от количества соединения, содержащего терапевтический фермент и транспортный элемент, присутствующего в композиции, и клинических параметров субъектов.
Введение доз заявляемого терапевтического соединения можно осуществлять любым пригодным для этого путем, хорошо известным специалисту в данной области, например, путем инъекций, таких как внутривенные, внутримышечные или подкожные инъекции. Выбор конкретного пути введения терапевтического соединения осуществляется специалистом в данной области и зависит, в частности, от того, является ли введение кратковременным или длительным. Специалисту в данной области понятно, что для введения доз заявляемого терапевтического соединения могут быть использованы и другие пути введения, известные из уровня техники, например (без ограничения), интратекальное введение, внутриартериальное введение, внутрибрюшинное введение, трансдермальное введение, ингаляционное введение, трансбуккальное введение, интраназальное введение, пероральное введение, сублингвальное введение или трансназальное введение (Felice B.R., Wright T.L., Boyd R.B. Safety Evaluation of Chronic Intrathecal Administration of Idursulfase-IT in Cynomolgus Monkeys. - Toxicol Pathol. 2011 Aug;39(5):879-9, WO 2011/044542 A1).
В контексте настоящего описания можно рассматривать различные схемы введения доз, включая, но не ограничиваясь только ими, одноразовые или многократные введения в различные моменты времени, болюсное введение и пульсирующую инфузию.
«Субъект», «индивидуум» или «пациент» является млекопитающим. Млекопитающие включают, но, не ограничиваясь ими, домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, таких как обезьяны, в частности, высшие обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых вариантах осуществления субъект или пациент является человеком.
В контексте настоящего описания термин «лечение» (и его грамматические вариации, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству с целью изменения естественного течения болезни у индивидуума, подлежащего лечению, и его можно осуществлять либо для профилактики или в процессе развития клинической патологии. Требуемыми действиями лечения являются (но, не ограничиваясь только ими) предупреждение возникновения или рецидива болезни, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий болезни, предупреждение метастазов, снижение скорости развития болезни, облегчение или временное ослабление болезненного состояния и ремиссия или улучшение прогноза. В некоторых вариантах осуществления предлагаемые соединения применяют для задержки развития болезни или замедления прогрессирования болезни.
Термин «ЦНС» или «центральная нервная система» относится к комплексу нервных тканей, которые контролируют функцию организма, и включают головной мозг и спинной мозг.
В настоящем описании термин «лизосомная болезнь накопления» (LSD, от англ. "lysosomal storage disease"; также может указываться как «лизосомальная болезнь накопления») относится к редкому генетическому заболеванию, приводящему к потере лизосомных функций, описанных выше, вследствие частичной или полной утраты активности одного из лизосомных ферментов. В этом случае для восполнения фермента, активность которого полностью или частично утрачена, или недостающего фермента, необходима ФЗТ. В настоящем описании термин «лизосомная болезнь накопления» взаимозаменяемо используют с термином «лизосомное расстройство накопления» (также может указываться как «лизосомальное расстройство накопления»). Лизосомные болезни накопления можно классифицировать в зависимости от дефекта или дефицита фермента на: (i) сфинголипидоз, (ii) мукополисахаридоз, (iii) болезнь накопления гликогена, (iv) муколипидоз, (у) олигосахаридоз, (vi) липидоз, (vii) нарушение лизосомного транспорта и так далее.
Далее лизосомные болезни накопления будут описаны более подробно в соответствии с их классификацией.
В настоящем описании термин «сфинголипидоз» относится к генетически обусловленному синдрому недостаточности лизосомного фермента, гидролизующего боковые углеводные цепи или боковые холиновые цепи сфинголипидов. Заболевания классифицируют в зависимости от распределения каждого запасаемого липида, так, сюда входят болезнь Краббе, вызванная дефицитом галактоцереброзидазы, болезнь Фабри, вызванная дефицитом α-галактозидазы А, болезнь Ниманна-Пика, вызванная дефицитом сфингомиелиназы, болезнь Гоше, вызванная дефицитом глюкоцереброзидазы, болезнь Тау-Сакса, вызванная дефицитом гексозаминидазы А и так далее, и они являются заболеваниями, которые наследуются по аутосомно-рецессивному типу, за исключением болезни Фабри, которая представляет собой генетическое заболевание, сцепленное с Х-хромосомой.
В настоящем описании термин «мукополисахаридоз» (MPS) относится к синдрому с генетической недостаточностью гидролазы мукополисахаридов, вызванному дефицитом фермента, разлагающего углеводные цепи, сульфатазы, ацетилтрансферазы и так далее. Основным симптомом мукополисахаридоза (MPS) является избыточная секреция мукополисахаридов с мочой. В настоящее время MPS классифицируют на 6 типов, среди которых заболевание I типа включает синдром Гурлер и синдром Шейе, II тип включает синдром Хантера, III тип включает синдром Санфилиппо типов А, В, С и D; IV тип включает синдром Моркио А и В; VI тип включает синдром Марото-Лами и VII тип включает синдром Слая.
В настоящем описании термин «болезнь накопления гликогена» (также известная под названием «гликогеноз») относится к заболеванию с врожденным нарушением метаболизма углеводов, вызванному накоплением гликогена, и подразделяется на подтипы I-VII. Подтипами болезни накопления гликогена, ассоциированной с лизосомной болезнью накопления (LSD), являются типы II (болезнь Помпе) и III b (болезнь Данона).
Подробное описание лизосомных болезней накопления, приведенных в настоящем описании, а также раскрытых в таблице 1, приведено в: The Online Metabolic & Molecular Bases of Inherited Diseases (Scriver’s OMMBID), Part 16 (David L. Valle, Stylianos Antonarakis, Andrea Ballabio, Arthur L. Beaudet, Grant A. Mitchell, McGraw-Hill Education, 2007).
«Мукополисахаридоз типа I (МПС I)» представляет собой наследственное метаболическое заболевание, вызванное дефектом фермента α-L-идуронидазы (IDUA), функция которого заключается в том, чтобы расщеплять кислые мукополисахариды - гепарансульфат и дерматансульфат. Недостаточный уровень IDUA приводит к патологическому накоплению указанных мукополисахаридов в тканях и органах больного, например, в сердце, печени и центральной нервной системе. Симптомы, включая нейродегенерацию и задержку умственного развития, появляются в детстве и, из-за повреждения органов, может произойти ранняя смерть. Генетический дефицит расщепления углеводов, лизосомального фермента α-L-идуронидазы вызывает лизосомную болезнь накопления, известную как мукополисахаридоз типа I (МПС I). МПС I (MPS I) в тяжелой форме широко известный как синдром Гурлер, и связанный с множеством проблем, такими как задержка умственного развития, помутнение роговицы, грубые черты лица, сердечные заболевания, заболевания дыхательных путей, увеличение печени и селезенки, грыж, и скованность суставов. Пациенты, страдающие от синдрома Гурлер, обычно умирают в возрасте до 10 лет. При средней форме, известной как синдром Гурлер-Шейе, как правило, психические функции сильно не затрагиваются, но и физические проблемы могут привести к смерти в подростковом возрасте или в возрасте от двадцати до двадцати девяти лет. Синдром Шейе представляет собой легкую форму МПС I. Он совместим с нормальной продолжительностью жизни, но скованность суставов, помутнение роговицы и болезни сердечных клапанов взывают серьезные проблемы.
«Мукополисахаридоз типа II (МПС II)» или «синдром Хантера» представляет собой Х-сцепленное наследственное метаболическое расстройство, обусловленное недостаточностью фермента идуронат-2-сульфатазы (I2S). I2S локализуется в лизосомах и играет важную роль в катаболизме гликозаминогликанов (ГАГ) гепаран- и дерматансульфата. В отсутствие фермента эти субстраты накапливаются в клетках, в конечном счете вызывая застой, а затем гибель клеток и разрушение тканей. В связи с распространенной экспрессией фермента у пациентов с MPS II поражаются различные типы клеток, органов и систем. Характерной клинической особенностью этого заболевания является дегенерация центральной нервной системы (ЦНС), которая приводит к когнитивным нарушениям (например, снижению IQ). Кроме того, МРТ-сканирование больных выявило повреждения белого вещества, расширение периваскулярных пространств в паренхиме головного мозга, ганглиях, мозолистом теле и стволе мозга, атрофию и вентрикуломегалию (Wang et al. Molecular Genetics and Metabolism, 2009). Болезнь обычно проявляется в первые годы жизни органомегалией и скелетными аномалиями. Некоторые больные испытывают прогрессирующую потерю когнитивных функций, причем большинство больных умирают от осложнений, связанных с заболеванием, в первом или втором десятилетии жизни (Raluy-Callado M. et al. Orphanet J Rare Dis. 2013; 8: 101;).
В контексте настоящего описания термин «неврологическая составляющая» относится к заболеванию или нарушению, которое поражает ЦНС и/или этиология которого связана с ЦНС. Примерами заболеваний или нарушений ЦНС являются (но, не ограничиваясь только ими) невропатия, амилоидоз, рак, глазное заболевание или нарушение, вирусная или микробная инфекция, воспаление, ишемия, нейродегенеративное заболевание, эпилептический припадок, нарушения поведения и лизосомная болезнь накопления. Конкретными примерами неврологических нарушений являются (но, не ограничиваясь только ими) нейродегенеративные заболевания (включая, но, не ограничиваясь только ими, болезнь (диффузных) телец Леви, постмиелитический синдром, синдром Шая-Дрейджера, оливопонтоцеребеллярную атрофию, болезнь Паркинсона, мультисистемную атрофию, стриатонигральную дегенерацию), тауопатии (включая, но, не ограничиваясь только ими, болезнь Альцгеймера и супрануклеарный паралич), прионные заболевания (включая, но, не ограничиваясь только ими, бычью спонгиформную энцефалопатию, скрепи, синдром Крейтцфельдта-Якоба, куру, болезнь Герстманна-Штросслера-Шейнкера, хроническую изнуряющую болезнь и фатальную семейную бессонницу), бульварный паралич, болезнь двигательных нейронов и гетеродегенеративные нарушения нервной системы (включая, но, не ограничиваясь только ими, болезнь Канавана, болезнь Гентингтона, нейронный цероидный липофусциноз, болезнь Александера, синдром Туретта, синдром курчавых волос Менкеса, синдром Коккейна, синдром Галлервордена-Шпатца, болезнь Лафоры, синдром Ретта, гепатолентикулярную дегенерацию, синдром Леша-Найхана и синдром Унферрихта-Лундборга), деменцию (включая, но не ограничиваясь только ими, болезнь Пика и спиноцеребеллярную атаксию), рак (например, рак ЦНС и/или головного мозга, включая метастазы в головной мозг, образующиеся от рака в какой-либо области организма).
Соединения, предлагаемые в изобретении, можно применять в терапии либо индивидуально, либо в комбинации с другими средствами. Например, предлагаемое соединение, содержащее терапевтический фермент и транспортный элемент, соединенные линкером, можно вводить совместно по меньшей мере с одним дополнительным терапевтическим средством. В конкретных вариантах осуществления изобретения дополнительное терапевтическое средство представляет собой терапевтическое средство, эффективное в отношении лечения того же самого неврологического нарушения, для которого применяют соединение, предлагаемое в изобретении, или другого неврологического нарушения. Примерами дополнительных терапевтических средств являются, без ограничения ими, различные описанные выше неврологические лекарственные средства, включая ингибиторы холинэстеразы (такие как донепезил, галантамин, ровастигмин и такрин), антагонисты NMDA-рецептора (такие как мемантин), ингибиторы агрегации пептида амилоида бета, антиоксиданты, модуляторы γ-секретазы, имитаторы фактора роста нервной ткани (NGF) или агенты для генной терапии NGF, агонисты PPARy, ингибиторы HMS-CoA-редуктазы (статины), ампакины, блокаторы кальциевого канала, антагонисты ГАМК-рецептора, ингибиторы киназы - гликогенсинтазы, иммуноглобулин, предназначенный для внутривенного введения, агонисты мускаринового рецептора, модуляторы никотинового рецептора, средства активной или пассивной иммунизации против пептида амилоид бета, ингибиторы фосфодиэстеразы, антагонисты рецептора серотонина и антитела к пептиду амилоиду бета. Такие указанные выше комбинированные терапии включают совместное введение (когда два или большее количество терапевтических средств включают в одну и ту же или в различные композиции) и раздельное введение, в этом случае введение соединения, содержащего терапевтический фермент и транспортный элемент, соединенных линкером, предлагаемого в изобретении, можно осуществлять до, одновременно и/или после введения дополнительного терапевтического средства и/или адъюванта.
Некоторые определенные выше термины могут встречаться более чем один раз, и в таком случае каждый термин должен определяться независимо от другого.
Далее подробно будут описаны приведенные в качестве примера осуществления настоящего изобретения. При этом каждое из объяснений и осуществлений, приведенных в качестве примера в данном документы, может быть справедливо и для других объяснений и приведенных в качестве примера осуществлений. Таким образом, все комбинации различных факторов, описанных в данном документе, входят в объем настоящего изобретения. Более того, объем настоящего изобретения не ограничивается конкретным описанием, приведенным ниже.
Примеры осуществления изобретения
Далее настоящее изобретение будет описано более подробно с отсылкой к следующим Примерам. Однако описанные ниже Примеры приведены исключительно в иллюстративных целях и не предназначены ограничивать это изобретение.
Пример 1. Получение
Для получения соединений культивировали и очищали клетки животных, в которые был введен экспрессирующий вектор для клеток животных.
Конструирование экспрессирующих векторов
Аминокислотные последовательности первая LC-HIR-FAB-IDS (SEQ ID NO:2, 8, 9, 10 и 11) и вторая HC-HIR-FAB-IDS (SEQ ID NO:4, 5, 12, 13, 14, 15)) для получения вариантов HIR-FAB-IDS, включая сигнальный пептид MDWTWRVFCLLAVAPGAHS, были конвертированы в нуклеотидные последовательности. Для синтеза гена с последующим клонированием в вектора pCLN-1 к 5’-концу последовательностей были добавлены: сайт рестрикции HindIII и последовательность Kozak. К 3’-концу последовательностей были добавлены 2 стоп-кодона и сайт рестрикции XbaI.
Оптимизацию нуклеотидной последовательности по кодонному составу для клеток китайского хомячка проводили с помощью ресурсов: http://gcua.schoedl.de и http://www.kazusa.or.jp. Синтез легкой и тяжелой цепи LC-HIR-FAB-IDS и HC-HIR-FAB-IDS был осуществлён в GenArt (США) и переданы в составе векторов pRA1675 и pRA1673 (содержащие гены LC-HIR-FAB-IDS и HC-HIR-FAB-IDS, соответственно).
Последовательности HC-HIR-FAB-IDS, LC-HIR-MAB из плазмид pRA1675 и pRA1673 клонировали в экспрессионный вектор pCLN-1 по сайтам HindIII/XbaI с получением векторов pGNR-055-007 (pCLN-1- HC-HIR-FAB-IDS) и pGNR-055-008 (pCLN-1- LC-HIR-FAB-IDS). Полученные вектора линеаризовали по сайтам BspHI/PvuI.
Векторы по настоящему изобретению конструировали в соответствии с методами молекулярной биологии, хорошо известными в данной области техники. Смотрите Brown T, "Gene Cloning" (Chapman & Hall, London, GB, 1995); Watson R, et al., "Recombinant DNA", 2nd Ed. (Scientific American Books, New York, NY, US, 1992); Alberts B, et al., "Molecular Biology of the Cell" (Garland Publishing Inc., New York, NY, US, 2008); Innis M, et al., Eds., "PCR Protocols. A Guide to Methods and Applications" (Academic Press Inc., San Diego, CA, US, 1990); Erlich H, Ed., "PCR Technology. Principles and Applications for DNA Amplification" (Stockton Press, New York, NY, US, 1989); Sambrook J, et al., "Molecular Cloning. A Laboratory Manual" (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, US, 1989); Bishop T, et al., "Nucleic Acid and Protein Sequence. A Practical Approach" (IRL Press, Oxford, GB, 1987); Reznikoff W, Ed., "Maximizing Gene Expression" (Butterworths Publishers, Stoneham, MA, US, 1987); Davis L, et al., "Basic Methods in Molecular Biology" (Elsevier Science Publishing Co., New York, NY, US, 1986), Schleef M, Ed., "Plasmid for Therapy and Vaccination" (Wiley-VCH Verlag GmbH, Weinheim, DE, 2001).
Получение моноклональной клеточной линии
Родительская клеточная линия СHO-S. Клетки культивировали при 37°С, 5% СO2, 70% влажности, в среде BalanCD CHO Growth A (Invitrogen). Стабильную трансфекцию проводили на приборе NEON (Invitrogen) по стандартному протоколу для клеток СHO c использованием двух линеаризованных плазмид pCLN-1-HC-HIR-FAB-IDS и pCLN-1- LC-HIR-FAB-IDS. Соотношение ДНК для проведения трансфекции использовали эквимолярное.
Через 48 ч был проведен рассев трансфицированных пулов на минипулы в 96-луночные планшеты в среду BalanCD CHO Growth A, содержащую 600 мкг/мл селективного антибиотика неомицина. Минипулы культивировали в стационарных условиях 10 дней при 37°С, 5% СO2, 70% влажности, после чего был проведен ряд скринингов по продуктивности с помощью ИФА. Лидерный минипул был клонирован в полутвердую среду ClonaCell Flex (STEMCELL) для роста отдельных колоний, используя 6-ти луночные планшеты. Планшеты инкубировали 10 дней при 37°С, 5% СO2, 70% влажности.
В ходе скрининга определялась концентрация целевого белка HIR-FAB-IDS, секретируемого в культуральную жидкость. Определение проводилось методом «сэндвич» ИФА, с использованием вместо первичных антител фрагмента рекомбинантного инсулинового рецептора человека (5 мкг/мл в карбонатно-бикарбонатном буфере pH 9,6), в качестве вторых антител использовались конъюгированные с пероксидазой хрена крысиные антитела к идуронат-2-сульфатазе (в разведении к 1:10000). Проявляли раствором тетраметилбензидина, реакцияю останавливали 0,5 М серной кислотой.
По результатам скрининга 6-ти лун. планшетов были выбраны 20 лидерных минипулов с продуктивностью от 0,4 до 2,1 мг/л, которые были перенесены в колбы для адаптации к суспензионному культивированию. Для адаптации к суспензионному культивированию, было проведено 3 пассажа, после чего 20 минипулов были заморожены.
Отбор клонов проводили в автоматическом режиме с помощью робота ClonePix (Molecular Devices) в 96-ти луночные планшеты. Полученные клоны подвергались скринингу. Для этого моделировался 7-дневный процесс культивирования в режиме batch, в котором клоны оценивались по следующим параметрам динамики жизнеспособности культуры, динамики плотности жизнеспособных клеток, концентрация целевого HIR-FAB-IDS, зависимость волюметрической продукции от кумулятивной плотности клеток.
Культивирование клеток продуцента
Культивирование клеток продуцента, экспрессирующего HIR-FAB-IDS, проводилось в периодическом режиме с подпиткой (фед-батч) c использованием питательной среды BalanCD CHO Growth A (Irvine Scientific) и нутриентной добавки BalanCD CHO Feed 2 (Irvine Scientific) в течение 12 суток в биореакторе с верхнеприводной мешалкой при температуре 37°С и рН 6,9. После процесса культивирования культуральная жидкость осветлялась путём глубинной фильтрации и передавалась на выделение.
Выделение и очистка
Выделение и очистку проводят при помощи стандартных технологий выделения, очистки белков. Соединение можно выделить или очистить любым способом, известным в данном уровне техники, для выделения или очистки белка, например с помощью хроматографии (например, ионообменной, высокоэффективной жидкостной хроматографии, с помощью аффинности, с использованием белка A и сортирующей по размеру колоночной хроматографии), центрифугирования, дифференциальной растворимости или с помощью любой другой стандартной техники выделения или очистки белков.
Пример 2. Определение уровня ферментативной активности Fab-фрагмента антитела к инсулиновому рецептору, соединенного с аминокислотной последовательностью идуронат-2-сульфатазы
Специфическую активность HIR-FAB-IDS и HIR-MAB-IDS определяют флуориметрическим методом используя 4-мутилумбеллиферил–L-идуронид-2-сульфат (4-MUS) (Moscerdam Substrates, Нидерланды) (Voznyi YV et al., 2001; Tolun AA, et al., 2012; 9. Johnson BA et al., 2013; Azadeh M et al., 2017). В процессе проведения анализа субстрат гидролизуется идуронат-2-сульфатазой с получением 4-мутилумбеллиферил–L-идуронид (MUBI), которая гидролизуется идуронидазой (IDUA, Альдуразим, Джензайм, США) до 4-метилумбеллиферила (4-MU), который детектируют флуориметрически, используя следующие настройки флуориметра: возбуждение флуоресценции при длине волны 450 нм и детекции флуоресценции при длине волны 365 нм. Калибровочную кривую строят по стандартному раствору 4-MU (Sigma-Aldrich, США). В ходе анализа смесь сначала инкубируют при 37 °C, значении водородного показателя pH = 4,5 в течение 4 часов, затем добавляют IDS в количестве 12 мкг и дополнительно инкубируют смесь при 37°C в течение 24 ч. Инкубацию останавливают добавлением 0,2 мл 0,5 M карбоната натрия pH=10,3. HIR-FAB-IDS проявляет специфическую ферментативную (идуронат-2-сульфатазную) активность в отношении субстрата 4-MU-αIdoA-2S (4-метилумбелиферил α-L-идопиранозидуронат-2-сульфат).
Приборы и оборудование
1. Термостатируемый шейкер PST-60 HL-4 (ВioSan, Латвия или аналогичный).
2. Многофункциональный ридер Spectra Max M3 (Molecular Devices, США или аналогичный).
3. Программное обеспечение для многофункционального ридера Soft Max Pro (Molecular Devices, США или аналогичное).
4. Весы аналитические ML 204 (Mettler Toledo, Швейцария или аналогичного качества).
5. 96-луночный черный планшет с несорбирующей поверхностью (Corning, США, кат. № 3916 или аналогичный).
Реактивы
• 4-метилумбеллиферона натриевая соль (Sigma-Aldrich, кат. № M1508 или аналогичного качества).
2. Рекомбинантная α-L-идуронидаза человека (R&D SYSTEM, кат. № 4119-GH или аналогичного качества).
3. 4-метилумбеллиферил α-L-идопиранозидуроновой кислоты 2-сульфат натриевая соль, 0,5 мг/флакон (USBiological, кат. № 017551 или аналогичного качества).
4. Натрия ацетат безводный (AppliChem Panreac, кат. № 141633.1211 или аналогичного качества).
5. Кислота уксусная (Fluka, кат. № 49199 или аналогичного качества).
6. Бычий сывороточный альбумин (Sigma, кат. № A7030 или аналогичного качества).
7. Натрия карбонат (Sigma-Aldrich , кат. № S7795 или аналогичного качества).
8. Натрия бикарбонат (Sigma-Aldrich, кат. № S6297 или аналогичного качества).
9. Свинца диацетата тригидрат (Aldrich, кат.№ 467863 или аналогичного качества).
10. Натрия фосфат двузамещенный дигидрат (Sigma-Aldrich, кат. № 71643 или аналогичного качества).
11. Кислота лимонная безводная (AppliChem Panreac, кат. № 141808 или аналогичного качества).
Приготовление растворов
Раствор для разведения образцов, pH (5,5 ± 0,2). Около 4,1 г натрия ацетата безводного и 0,5 г бычьего сывороточного альбумина помещают в химический стакан вместимостью 1 л, растворяют в 700 мл воды очищенной. Доводят pH раствора до значения (5,5 ± 0,2) кислотой уксусной. Полученный раствор переносят в мерную колбу вместимостью 1 л, доводят объем раствора водой очищенной до метки и перемешивают и фильтруют через мембранный фильтр с диаметром пор 0,45 мкм.
Срок годности – 3 мес при температуре от 2 до 8 °С.
Раствор для разведения субстрата, pH (5,00 ± 0,05). В химический стакан вместимостью 500 мл помещают 4,1 г натрия ацетата безводного, 1,9 г свинца диацетата тригидрата, прибавляют 450 мл воды очищенной, перемешивают до растворения. Доводят pH раствора до значения (5,00 ± 0,05) кислотой уксусной (около 1,1 мл). Полученный раствор переносят в мерную колбу вместимостью 500 мл, объем раствора доводят водой очищенной до метки, перемешивают и фильтруют через мембранный фильтр с диаметром пор 0,45 мкм.
Срок годности – 3 мес при температуре от 2 до 8 °С.
Раствор субстрата (1,25 ммоль/л). 0,83 мл раствора для разведения субстрата вносят во флакон, содержащий субстрат (4-метилумбеллиферил α-L-идопиранозидуроновой кислоты 2-сульфат натриевая соль), аккуратно перемешивают. Полученный раствор делят на аликвоты по 0,2 мл и замораживают.
Срок годности – 3 мес при температуре не выше минус 70 °С.
Раствор рекомбинантной α-L-идуронидазы человека. Во флакон, содержащий рекомбинантную α-L-идуронидазу человека (10 мкг) прибавляют 400 мкл воды очищенной, перемешивают. Полученный раствор делят на аликвоты по 0,1 мл и замораживают.
Срок годности – 3 мес при температуре не выше минус 70 °С.
0,1 М раствор кислоты лимонной. Около 19,2 г кислоты лимонной безводной помещают в мерную колбу вместимостью 1 л, растворяют в 900 мл воды очищенной, доводят объем раствора водой очищенной до метки, фильтруют через мембранный фильтр 0,22 мкм.
Срок годности – 3 мес при температуре от 15 до 25 °С.
0,2 М раствор натрия фосфата двузамещенного. Около 35,6 г натрия фосфата двузамещенного дигидрата помещают в мерную колбу вместимостью 1 л, растворяют в 900 мл воды очищенной, доводят объем раствора водой очищенной до метки, фильтруют через мембранный фильтр 0,22 мкм.
Срок годности – 3 мес при температуре от 15 до 25 °С.
Фосфатно-цитратный буферный раствор, pH (4,5 ± 0,1). В мерной колбе вместимостью 100 мл смешивают 55,0 мл 0,1 М раствора кислоты лимонной и 45,0 мл 0,2 М раствора натрия фосфата двузамещенного и фильтруют через мембранный фильтр с диаметром пор 0,22 мкм.
Срок годности – 3 мес при температуре от 15 до 25 °С.
0,5 М раствор натрия бикарбоната. Около 42,0 г натрия бикарбоната помещают в мерную колбу вместимостью 1 л, растворяют в 900 мл воды очищенной, доводят объем раствора водой очищенной до метки и перемешивают и фильтруют через мембранный фильтр с диаметром пор 0,22 мкм.
Срок годности – 6 мес при температуре от 15 до 25 °С.
0,5 М раствор натрия карбоната. Около 53,0 г натрия карбоната помещают в мерную колбу вместимостью 1 л, растворяют в 900 мл воды очищенной, доводят объем раствора водой очищенной до метки и перемешивают и фильтруют через мембранный фильтр с диаметром пор 0,22 мкм.
Срок годности – 6 мес при температуре от 15 до 25 °С.
Стоп-раствор, pH (10,8 ± 0,5). В мерную колбу вместимостью 1 л вносят 900 мл 0,5 М раствора натрия карбоната и 100 мл 0,5 М раствора натрия бикарбоната, перемешивают и фильтруют через мембранный фильтр с диаметром пор 0,22 мкм.
Срок годности – 6 мес при температуре от 15 до 25 °С.
Исходный раствор 4-метилумбеллиферона натриевой соли (100 мкмоль/мл). В мерную колбу объемом 50 мл помещают около 1,0 г (точная навеска) 4-метилумбеллиферона натриевой соли, прибавляют 30 мл воды очищенной, перемешивают, доводят водой очищенной до метки. Раствор делят на аликвоты по 2,0 мкл.
Срок годности – 6 мес при температуре не выше минус 18 °С.
Рабочий стандартный раствор 4-метилумбеллиферона натриевой соли (50 нмоль/мл).
Аликвоту исходного раствора 4-метилумбеллиферона натриевой соли выдерживают в водяной бане в течение 5 минут при температуре 37 °С. Готовят последовательные разведения по следующей схеме:
à 4-MU – 4-метилумбеллиферона натриевой соли.
Разведения рабочего стандартного раствора 4-метилумбеллиферона натриевой соли. Готовят разведения рабочего стандартного раствора 4-метилумбелиферона натриевой соли по следующей схеме:
разведения
стоп-раствора, мл
Разведения испытуемого образца. Испытуемый образец разбавляют раствором для разведения образцов до концентрации 1 мг/мл, исходя из фактического содержания HIR-FAB-IDS, указанного в сертификате. Затем готовят последовательные разведения по следующей схеме:
пробирок
Все разведения хранят во льду до начала испытания.
В дальнейших исследованиях используют растворы из пробирок № 5-7.
Проведение анализа
1-я ферментативная реакция
В лунки планшета вносят по 10 мкл каждого разведения испытуемого образца (в 2-х повторностях), в качестве раствора сравнения используют раствор для разведения образцов. Прибавляют по 20 мкл раствора субстрата (4-метилумбеллиферил α-L-идопиранозидуроновой кислоты 2-сульфат натриевая соль). Закрывают планшет пленкой, инкубируют в термостатируемом шейкере в течение 4 часов при температуре (37,0 ± 0,2) °С и скорости перемешивания 250 об/мин. Планшет должен быть защищен от света в течение всего времени инкубации.
2-я ферментативная реакция
По окончании инкубации вносят в лунки планшета по 20 мкл фосфатно-цитратного буферного раствора для остановки 1-ой ферментативной реакции. Затем в каждую лунку добавляют по 10 мкл раствора рекомбинатнной α-L-идуронидазы, аккуратно перемешивают. Закрывают планшет пленкой, инкубируют в термостатируемом шейкере в течение 22-26 часов при температуре 37 °С и скорости перемешивания 250 об/мин. Планшет должен быть защищен от света в течение всего времени инкубации.
Для остановки реакции в каждую лунку с инкубируемой смесью вносят 200 мкл стоп-раствора.
В пустые лунки планшета вносят по 260 мкл разведений рабочего стандартного раствора 4-метилумбеллиферона натриевой соли.
В лунках планшета измеряют сигнал флуоресценции при длине волны возбуждения 365 нм и длине волны детекции 460 нм.
Оценка результатов
На основании результатов измерений сигнала флуоресценции в лунках с разведениями рабочего стандартного раствора 4-метилумбеллиферона натриевой соли, строят график линейной зависимости между сигналом флуоресценции и концентрацией 4-метилумбеллиферона натриевой соли (нмоль/мл). Используя уравнение линейной функции, рассчитывают концентрацию 4-метилумбеллиферона, наработанного в ходе реакции в лунках с разведениями испытуемых образцов и раствором сравнения (нмоль/мл).
Специфическую активность А, в ЕД/мкг, для каждого разведения испытуемых образцов рассчитывают по формуле:
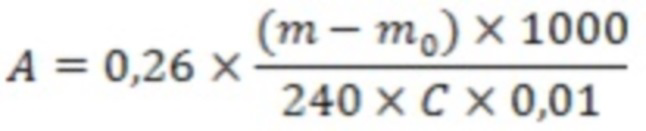
где: m - концентрация 4-метилумбелиферона, наработанного в ходе реакции в лунках с данным разведением испытуемого образца (среднее значение по 2-м повторностям), нмоль/мл;
mo - концентрация 4-метилумбелиферона, наработанного в ходе реакции в лунках с раствором сравнения (среднее значение по 2-м повторностям), нмоль/мл;
0,26 - финальный объем разведений рабочего стандартного раствора и испытуемого образца, внесенных в лунки планшета для измерения сигнала флуоресценции, мл;
240 - время 1-й ферментативной реакции, мин;
C - содержание HIR-Fab-IDS в каждом из приготовленных разведений испытуемого образца, нг/мл;
0,01 - объем разведений испытуемого образца, внесенного в 1-ю ферментативную реакцию, мл;
1000 - коэффициент пересчета нг в мкг.
Итоговое значение специфической активности для испытуемого образца вычисляют как среднее значение специфической активности, вычисленной по каждому разведению.
Полученные результаты определения ферментативной активности вариантов HIR-FAB-IDS и HIR-MAB-IDS в сравнении с препаратом Элапраза представлены в таблице 2.
Таблица 2. Оценка идуронат-2-сульфатазной активности вариантов HIR-FAB-IDS и HIR-MAB-IDS против немодифицированного фермента идуронат-2-сульфатазы (Элапраза)
(значение взято из патента на AGT-182 US8834874 B2, Fig.12 пример 4, стр. 35)
US8834874 B2
Как видно из результатов, представленных в таблице 2, препарат HIR-FAB-IDS проявляет специфическую ферментативную (идуронат-2-сульфатазную) активность в отношении субстрата 4-MU-αIdoA-2S (4-метилумбелиферил α-L-идопиранозидуронат-2-сульфат) 27,0 ЕД/мкг. При этом свободный рекомбинантный фермент идуронат-2-сульфатазы проявляет активность 14,6 ЕД/мкг. Полноразмерное антитело к инсулиновому рецептору, соединенного с аминокислотной последовательностью идуронат-2-сульфатазы (HIR-MAB-IDS), проявляет меньшую специфическую активность (11,0 ЕД/мкг), в сравнении с HIR-FAB-IDS.
В результате проведенных исследований было показано, что идуронат-2-сульфатаза в составе HIR-FAB-IDS сохраняет основные функциональные (ферментативные) свойства на уровне свободного рекомбинантного фермента. При этом удельная активность HIR-FAB-IDS выше, чем для препарата Элапраза и HIR-MAB-IDS (AGT-182)
Таким образом, обнаружено увеличение ферментативной активности соединения, содержащее транспортный элемент, представляющий собой Fab-фрагмент иммуноглобулина IgG, специфичный к эпитопу в рецепторе инсулина, соединенный непосредственно или при помощи линкера с терапевтическим ферментом, в сравнении с терапевтическим ферментом без транспортного элемента, и с терапевтическим ферментом с транспортным элементом, представленным MAB. .
Пример 3. Анализ взаимодействия модифицированных Fab-фрагментов антител к инсулиновому рецептору с инсулиновым рецептором человека и мыши.
Для выполнения количественной оценки взаимодействия с инсулиновым рецептором полноразмерных рекомбинантных моноклональных антител, вариантов Fab-фрагментов, а также их модификаций с IDS, используют метод твердофазного иммуноферментного анализа (ИФА) в формате «сэндвич» (Kim C, Seo J, Chung Y et al., 2017). Метод основан на связывании белков HIR-MAB (83-14 Mab), HIR-MAB-IDS и HIR-FAB-IDS с фрагментом белка инсулинового рецептора человека (Human Insulin Receptor protein fragment (Abcam cat#ab200510)) или инсулиновым рецептором мыши (mInsR, R&D Systems, Inc., кат. № 7544-MR).
Процесс детекции осуществляется после инкубации комплекса инсулинового рецептора человека и исследуемого белка с вторичными антителами – конъюгированные с пероксидазой хрена Fab-специфичные антитела козы к иммуноглобулину человека (Anti-Human IgG (Fab specific)- Peroxidase (Sigma-Aldrich, cat#A0293)).
В качестве положительного контроля использовали ранее описанные мышиные антитела к инсулиновому рецептору человека (INSR/Insulin Receptor alpha Antibody 83-14 AHR0221 Life technologies, cat#AHR0221) и к инсулиновому рецептору мыши (Mouse Anti-Human Insulin Receptor Clone 83-14 mAb Cell sciences, cat# MAI1). Детекцию осуществляют с помощью конъюгированных с пероксидазой хрена поликлональных антител козы к иммуноглобулину мыши (Goat pAb to Ms IgG (HRP) Abcam, cat# ab97023).
Полученные результаты определения взаимодействия тестируемых молекул с инсулиновым рецептором человека и мыши представлены в таблицах 3 и 4.
Таблица 3. Связывание модифицированных Fab-фрагментов антител к инсулиновому рецептору с инсулиновым рецептором человека (Abcam cat#ab200510).
Таблица 4. Связывание модифицированных Fab-фрагментов антител к инсулиновому рецептору с инсулиновым рецептором мыши (R&D Systems, Inc., кат. № 7544-MR).
Таким образом, продемонстрировано, что HIR-FAB-IDS специфично взаимодействует с внеклеточным доменом альфа субъединицы инсулинового рецептора человека, но при этом не взаимодействует с внеклеточным доменом инсулинового рецептора мыши. Связывание Fab-фрагментов антител к инсулиновому рецептору с инсулиновым рецептором человека сопоставимо с контрольным антителом (83-14 mAb) и превышает связывание с аналогичным полноразмерным антителом к инсулиновому рецептору (HIR-MAB-IDS).
Взаимодействие HIR-FAB-IDS с инсулиновым рецептором человека принципиально для обеспечения активного трансцитоза молекулы к лизосомам клеток, в общем, через ГЭБ, в частности.
Пример 4. Анализ распределения в тканях радиоактивно меченых Fab-фрагментов антитела к инсулиновому рецептору, соединенного с аминокислотной последовательностью идуронат-2-сульфатазы [125I]-HIR-Fab-IDS (SEQ ID NO:2 и SEQ ID NO:4), [125I]-HIR-Mab-IDS, [125I]-IDS (контроля) после внутривенного введения у яванского макака.
Подопытным животным в левую бедренную вену однократно вводили соответствующую молекулу испытуемого вещества в целевой дозе 2 мл/кг массы тела путем внутривенной болюсной инъекции в течение 1-2 минут. Целевой уровень радиоактивной дозы составлял 1 МБк/кг массы тела животного для всех исследуемых молекул.
Животное, получившее испытуемое вещество, подвергали седации путем внутримышечной инъекции кетамина гидрохлорида перед внутривенным введением избыточной дозы Долетила (пентаборбитона натрия). Животных гуманно эвтаназировали через 2 часа после введения испытуемого вещества. Во время седации у каждого животного из цефалической вены отбирали 2 мл крови, которую центрифугировали для получения плазмы. Концентрация радиоактивности измерялась в плазме крови животных. После подтверждения наступления смерти каждое животное быстро замораживали в смеси твердого диоксида углерода в гексане. После полного замораживания тела помещали в форму, содержащую 2% (вес/объем) водной карбоксиметилцеллюлозной пасты. Выполняли несколько продольных сагиттальных срезов (номинально 30 мкм) не меньше, чем на 5 уровнях тела и, при необходимости, 3 уровнях головы для каждой особи.
Срезы, закрепленные на ленту Filmolux 610 (Neschan), лиофилизировали в настольной сублимационной сушилке GVD03 (Girovac Ltd) и накладывали на рентгенографические пластины FUJI (тип BAS-MS, Raytek Scientific Ltd). Стандарты крови, меченные изотопом [125I] с соответствующей активностью, также подготовленные в виде срезов с номинальной толщиной 30 мкм, накладывали на рентгенографические пластины.
После проявления в свинцовом ящике с медным покрытием в течение 7 дней рентгенографические пластины обрабатывали с помощью радиографической системы FUJI FLA-5000 (Raytek Scientific Ltd). Электронные изображения были проанализированы с использованием системы анализа изображений на базе ПК (программное обеспечение Seescan 2, LabLogic Ltd). Стандарты [125I], включенные в каждую авторадиограмму, использовались для построения калибровочных кривых в диапазоне концентраций радиоактивности.
Концентрацию радиоактивности в плазме определяли методом гаммаметрии.
Данные концентрации в тканях регистрировались в виде нг эквивалентов [125I] HIR-Fab-IDS [125I] HIR-Mab-IDS и [125I]-IDS (контроль).
Результаты были выражены тремя значимыми числами с не более чем двумя знаками после запятой. Таблицы данных были созданы компьютером, и отдельные данные были надлежащим образом округлены.
[125I] HIR-Fab-IDS, [125I] HIR-Mab-IDS и [125I]-IDS (контроль) вводили самцам яванского макака однократно внутривенно с номинальным уровнем дозы 0,0020 мг/кг, 0,0015 мг/кг и 0,0010 мг/кг массы тела. Эвтаназия животного выполнялась через 2 ч после введения каждого препарата, после чего животные были заморожены для исследований методом авторадиографии всего тела.
После внутривенного введения препараты абсорбировались и широко распределялись по тканям организма, и на момент забоя все исследуемые ткани подверглись его воздействию. Нижний предел количественной оценки составлял 0,2, 0,03 и 0,097 нг эквивалента препарата/г для всех измерений концентрации в тканях животного, соответственно.
Концентрации радиоактивности в плазме и крови животного, получавшего [125I] HIR-Fab-IDS, составили 2,55 и 3,11 нг экв/г, соответственно (соотношение кровь: плазма 1,22). Количественно определяемые уровни радиоактивности присутствовали в некоторых областях мозга, включая продолговатый мозг (1,09 нг экв/г), кору головного мозга (1,03 нг экв/г), мозжечок (0,908 нг экв/г), гипоталамус (0,869 нг экв/г), древовидное вещество мозжечка (0,799 нг экв/г), мост (0,793 нг экв/г) и мозговое вещество (0,562 нг экв/г); соотношение TП составляло от 0,22 до 0,43.
Концентрации радиоактивности в плазме и крови животного, получавшего [125I] HIR-Mab-IDS, составляли 2,13 и 1,86 нг экв/г, соответственно (соотношение кровь: плазма 0,87). Количественно определяемые уровни радиоактивности присутствовали в ряде областей мозга животного. Эти области включали продолговатый мозг (0,803 нг экв/г), древовидное вещество мозжечка (0,606 нг экв/г), мозжечок (0,494 нг экв/г), кору головного мозга (0,453 нг экв/г), мост (0,438 нг экв/г) ), мозговое вещество (0,288 нг экв/г) и гипоталамус (0,279 нг экв/г), соотношения концентрации ТР составляли от 0,13 до 0,38
Концентрации в плазме и крови животного, получавшего [125I] IDS, составляли 0,910 и 0,753 нг экв/г, соответственно (соотношение кровь: плазма 0,83). Количественно определяемые уровни радиоактивности присутствовали во всем мозге (0,113 нг экв/г), но концентрации были ниже предела количественной оценки (0,097 нг экв/г) во всех исследованных областях: продолговатом мозге, коре головного мозга, мозжечке, гипоталамуса, древовидном веществе мозжечка, мосту и мозговом веществе. Концентрации в тканях ЦНС были значительно ниже, чем в плазме и крови.
Эти результаты свидетельствуют о том, что вещества, связанные с HIR-Fab-IDS, а также с HIR-Mab-IDS, по сравнению с веществом, связанным с IDS, проникали через гематоэнцефалический барьер, ткани ЦНС подвергались воздействию исследуемого вещества или его меченых метаболитов, и радиоактивность, передаваемая через кровь, незначительно влияла на определение концентрации в тканях ЦНС (фигуры 1 и 2). При этом HIR-Fab-IDS демонстрировал более широкое распределение в ткани организма по сравнению с молекулой HIR-Mab-IDS (таблица 5, фигура 3).
Необходимо отметить, что в примере 10 изобретения US8834874 B2 (AGT-182 или HIR-MAB-IDS) эффективность проникновения в головной мозг человека оценивают на уровне 1 % от введенной дозы на 1000 грамм мозговой ткани на основании экспериментальных данных проникновения AGT-182 (HIR-MAB-IDS) в мозг на макаках- резусах. При этом утверждается, что при таком уровне проникновения, ожидается достижение 20% от идуронат-2-сульфатазной (IDS) активности в мозге человека ,что позволит элиминировать накопление гликозаминогликанов в мозге больного человека.
С учетом полученных данных по проникновению в мозг яванских макак (таблица 5), можно сделать вывод о том, что настоящее соединение проникает почти в 2 раза лучше в мозг яванской макаки, чем HIR-MAB-IDS, так - 0,84 нг экв/г HIR-FAB-IDS против 0,43 нг экв/г для HIR-MAB-IDS. Это соответственно означает, что HIR-FAB-IDS проникает с 2% эффективностью в мозг человека. С учетом расчетов, указанных в примере 10 изобретения US8834874B2, ожидается достижение 40% от идуронат-2-сульфатазной активности в мозге человека, без учета увеличенной активности HIR-FAB-IDS в сравнении с HIR-MAB-IDS , см. таблицу 2.
Если учесть факт увеличения удельной активности HIR-FAB-IDS над HIR-MAB-IDS , показанный в примере 2, таблица 2 – 27 Ед/мкг для настоящего соединения и 11 Ед/мкг для противопоставляемого, а также большее проникновение в мозг: 27/11=в 2,4 удельная идуронат-2-сульфатазная активность выше, 0,84/0,43= в 1,95 раза большее проникновение в мозг, то получается 20% восстановление IDS активности в мозге больного при терапии HIR-MAB-IDS и 20%*2,4 *1,95= 93,6% восстановление идуронат-2-сульфатазной активности в мозге больного МПС II типа от уровня активности IDS в мозге здорового человека. Таким образом, настоящее изобретение позволит практически полностью восстановить ферментативную функцию IDS в мозге больного человека, в то время как противопоставляемое HIR-MAB-IDS только на 20% (93% vs 20%).
Таким образом, обнаружено, что введение соединения, содержащее транспортный элемент, представляющий собой Fab-фрагмент иммуноглобулина IgG, специфичный к эпитопу в рецепторе инсулина, соединенный непосредственно или при помощи линкера с терапевтическим ферментом, обеспечивает более высокую степень замещения активности терапевтического фермента в мозге человека в сравнении с соединениями, содержащими Mab.
Таблица 5. Концентрации радиоактивности в тканях яванского макака после однократного внутривенного введения [125I]- HIR- Fab-IDS с номинальным уровнем дозы 0,0020 мг/кг массы тела
(SEQ ID NO:2 и SEQ ID NO:4)
.
NA - Не применимо
BLQ - Концентрация ниже нижнего предела количественного определения
В настоящем описании представлены соединения, содержащие терапевтические ферменты, проявляющие свою специфическую ферментативную активность в указанных соединениях, и транспортные элементы, способные взаимодействовать с инсулиновым рецептором, при этом обладают способностью транспортировать терапевтические ферменты к лизосомам тканей, в том числе через ГЭБ к лизосомам нервной ткани. Таким образом, соединения проявляют высокую активность и улучшенную способность транспортироваться к лизосомам клеток тканей различных органов, в том числе к лизосомам клеток нервной ткани, что предполагает использование настоящего изобретения для ферментативной заместительной терапии для лечения или профилактики у субъекта c лизосомной болезнью накопления.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ МБЦ ГЕНЕРИУМ
<120> СОЕДИНЕНИЕ, СОДЕРЖАЩЕЕ ТЕРАПЕВТИЧЕСКИЙ ФЕРМЕНТ И ТРАНСПОРТНЫЙ
ЭЛЕМЕНТ, СОЕДИНЕННЫЕ ДРУГ С ДРУГОМ НЕПОСРЕДСТВЕННО ИЛИ ПРИ ПОМОЩИ
ЛИНКЕРА
<130> GNR-055
<160> 7
<170> PatentIn версия 2.0
<210> 1
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> Эпитоп в рецепторе инсулина, распознаваемый иммуноглобулином
IgG
<400> 1
Met Glu Glu Val Ser Gly Thr Lys Gly Arg Gln Glu Arg Asn Asp Ile
1 5 10 15
Ala Leu Lys Thr Asn Gly Asp Gln Ala Ser Cys Glu Asn Glu Leu Leu
20 25 30
Lys Phe Ser Tyr Ile Arg Thr Ser Phe Asp Lys Ile Leu Leu Arg Trp
35 40 45
Glu Pro Tyr Trp Pro Pro Asp Phe Arg Asp Leu Leu Gly Phe Met Leu
50 55 60
Phe Tyr Lys Glu Ala Pro Tyr Gln Asn Val Thr Glu Phe Asp Gly Gln
65 70 75 80
Asp Ala Cys Gly Ser Asn Ser Trp Thr Val Val Asp Ile Asp Pro Pro
85 90 95
Leu Arg Ser Asn Asp Pro Lys Ser Gln Asn His Pro Gly Trp Leu Met
100 105 110
Arg Gly Leu Lys Pro Trp Thr Gln Tyr Ala Ile Phe
115 120
<210> 2
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь иммуноглобулина IgG к рецептору инсулина
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Ser Leu Thr Cys Arg Ala Ser Gln Asp Ile Gly Gly Asn
20 25 30
Leu Tyr Trp Leu Gln Gln Gly Pro Asp Gly Thr Ile Lys Arg Leu Ile
35 40 45
Tyr Ala Thr Ser Ser Leu Asp Ser Gly Val Pro Lys Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Ser Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Ser
65 70 75 80
Glu Asp Phe Val Asp Tyr Tyr Cys Leu Gln Tyr Ser Ser Ser Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Met Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 3
<211> 221
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фрагмент VH-CH1 тяжелой цепи иммуноглобулина IgG
к рецептору инсулина
<400> 3
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Leu Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Asp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Lys Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Trp Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Leu
210 215 220
<210> 4
<211> 748
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фрагмент VH-CH1 тяжелой цепи иммуноглобулина IgG к рецептору
инсулина, соединенный с последовательностью идуронат-2-сульфатазы
<400> 4
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Leu Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Asp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Lys Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Trp Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Leu Ser Ser Ser
210 215 220
Glu Thr Gln Ala Asn Ser Thr Thr Asp Ala Leu Asn Val Leu Leu Ile
225 230 235 240
Ile Val Asp Asp Leu Arg Pro Ser Leu Gly Cys Tyr Gly Asp Lys Leu
245 250 255
Val Arg Ser Pro Asn Ile Asp Gln Leu Ala Ser His Ser Leu Leu Phe
260 265 270
Gln Asn Ala Phe Ala Gln Gln Ala Val Cys Ala Pro Ser Arg Val Ser
275 280 285
Phe Leu Thr Gly Arg Arg Pro Asp Thr Thr Arg Leu Tyr Asp Phe Asn
290 295 300
Ser Tyr Trp Arg Val His Ala Gly Asn Phe Ser Thr Ile Pro Gln Tyr
305 310 315 320
Phe Lys Glu Asn Gly Tyr Val Thr Met Ser Val Gly Lys Val Phe His
325 330 335
Pro Gly Ile Ser Ser Asn His Thr Asp Asp Ser Pro Tyr Ser Trp Ser
340 345 350
Phe Pro Pro Tyr His Pro Ser Ser Glu Lys Tyr Glu Asn Thr Lys Thr
355 360 365
Cys Arg Gly Pro Asp Gly Glu Leu His Ala Asn Leu Leu Cys Pro Val
370 375 380
Asp Val Leu Asp Val Pro Glu Gly Thr Leu Pro Asp Lys Gln Ser Thr
385 390 395 400
Glu Gln Ala Ile Gln Leu Leu Glu Lys Met Lys Thr Ser Ala Ser Pro
405 410 415
Phe Phe Leu Ala Val Gly Tyr His Lys Pro His Ile Pro Phe Arg Tyr
420 425 430
Pro Lys Glu Phe Gln Lys Leu Tyr Pro Leu Glu Asn Ile Thr Leu Ala
435 440 445
Pro Asp Pro Glu Val Pro Asp Gly Leu Pro Pro Val Ala Tyr Asn Pro
450 455 460
Trp Met Asp Ile Arg Gln Arg Glu Asp Val Gln Ala Leu Asn Ile Ser
465 470 475 480
Val Pro Tyr Gly Pro Ile Pro Val Asp Phe Gln Arg Lys Ile Arg Gln
485 490 495
Ser Tyr Phe Ala Ser Val Ser Tyr Leu Asp Thr Gln Val Gly Arg Leu
500 505 510
Leu Ser Ala Leu Asp Asp Leu Gln Leu Ala Asn Ser Thr Ile Ile Ala
515 520 525
Phe Thr Ser Asp His Gly Trp Ala Leu Gly Glu His Gly Glu Trp Ala
530 535 540
Lys Tyr Ser Asn Phe Asp Val Ala Thr His Val Pro Leu Ile Phe Tyr
545 550 555 560
Val Pro Gly Arg Thr Ala Ser Leu Pro Glu Ala Gly Glu Lys Leu Phe
565 570 575
Pro Tyr Leu Asp Pro Phe Asp Ser Ala Ser Gln Leu Met Glu Pro Gly
580 585 590
Arg Gln Ser Met Asp Leu Val Glu Leu Val Ser Leu Phe Pro Thr Leu
595 600 605
Ala Gly Leu Ala Gly Leu Gln Val Pro Pro Arg Cys Pro Val Pro Ser
610 615 620
Phe His Val Glu Leu Cys Arg Glu Gly Lys Asn Leu Leu Lys His Phe
625 630 635 640
Arg Phe Arg Asp Leu Glu Glu Asp Pro Tyr Leu Pro Gly Asn Pro Arg
645 650 655
Glu Leu Ile Ala Tyr Ser Gln Tyr Pro Arg Pro Ser Asp Ile Pro Gln
660 665 670
Trp Asn Ser Asp Lys Pro Ser Leu Lys Asp Ile Lys Ile Met Gly Tyr
675 680 685
Ser Ile Arg Thr Ile Asp Tyr Arg Tyr Thr Val Trp Val Gly Phe Asn
690 695 700
Pro Asp Glu Phe Leu Ala Asn Phe Ser Asp Ile His Ala Gly Glu Leu
705 710 715 720
Tyr Phe Val Asp Ser Asp Pro Leu Gln Asp His Asn Met Tyr Asn Asp
725 730 735
Ser Gln Gly Gly Asp Leu Phe Gln Leu Leu Met Pro
740 745
<210> 5
<211> 760
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фрагмент VH-CH1 тяжелой цепи иммуноглобулина IgG
к рецептору инсулина, соединенный с последовательностью
идуронат-2-сульфатазы посредством глицин-серинового линкера
<400> 5
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Leu Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Asp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Lys Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Trp Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Thr Gln Ala
225 230 235 240
Asn Ser Thr Thr Asp Ala Leu Asn Val Leu Leu Ile Ile Val Asp Asp
245 250 255
Leu Arg Pro Ser Leu Gly Cys Tyr Gly Asp Lys Leu Val Arg Ser Pro
260 265 270
Asn Ile Asp Gln Leu Ala Ser His Ser Leu Leu Phe Gln Asn Ala Phe
275 280 285
Ala Gln Gln Ala Val Cys Ala Pro Ser Arg Val Ser Phe Leu Thr Gly
290 295 300
Arg Arg Pro Asp Thr Thr Arg Leu Tyr Asp Phe Asn Ser Tyr Trp Arg
305 310 315 320
Val His Ala Gly Asn Phe Ser Thr Ile Pro Gln Tyr Phe Lys Glu Asn
325 330 335
Gly Tyr Val Thr Met Ser Val Gly Lys Val Phe His Pro Gly Ile Ser
340 345 350
Ser Asn His Thr Asp Asp Ser Pro Tyr Ser Trp Ser Phe Pro Pro Tyr
355 360 365
His Pro Ser Ser Glu Lys Tyr Glu Asn Thr Lys Thr Cys Arg Gly Pro
370 375 380
Asp Gly Glu Leu His Ala Asn Leu Leu Cys Pro Val Asp Val Leu Asp
385 390 395 400
Val Pro Glu Gly Thr Leu Pro Asp Lys Gln Ser Thr Glu Gln Ala Ile
405 410 415
Gln Leu Leu Glu Lys Met Lys Thr Ser Ala Ser Pro Phe Phe Leu Ala
420 425 430
Val Gly Tyr His Lys Pro His Ile Pro Phe Arg Tyr Pro Lys Glu Phe
435 440 445
Gln Lys Leu Tyr Pro Leu Glu Asn Ile Thr Leu Ala Pro Asp Pro Glu
450 455 460
Val Pro Asp Gly Leu Pro Pro Val Ala Tyr Asn Pro Trp Met Asp Ile
465 470 475 480
Arg Gln Arg Glu Asp Val Gln Ala Leu Asn Ile Ser Val Pro Tyr Gly
485 490 495
Pro Ile Pro Val Asp Phe Gln Arg Lys Ile Arg Gln Ser Tyr Phe Ala
500 505 510
Ser Val Ser Tyr Leu Asp Thr Gln Val Gly Arg Leu Leu Ser Ala Leu
515 520 525
Asp Asp Leu Gln Leu Ala Asn Ser Thr Ile Ile Ala Phe Thr Ser Asp
530 535 540
His Gly Trp Ala Leu Gly Glu His Gly Glu Trp Ala Lys Tyr Ser Asn
545 550 555 560
Phe Asp Val Ala Thr His Val Pro Leu Ile Phe Tyr Val Pro Gly Arg
565 570 575
Thr Ala Ser Leu Pro Glu Ala Gly Glu Lys Leu Phe Pro Tyr Leu Asp
580 585 590
Pro Phe Asp Ser Ala Ser Gln Leu Met Glu Pro Gly Arg Gln Ser Met
595 600 605
Asp Leu Val Glu Leu Val Ser Leu Phe Pro Thr Leu Ala Gly Leu Ala
610 615 620
Gly Leu Gln Val Pro Pro Arg Cys Pro Val Pro Ser Phe His Val Glu
625 630 635 640
Leu Cys Arg Glu Gly Lys Asn Leu Leu Lys His Phe Arg Phe Arg Asp
645 650 655
Leu Glu Glu Asp Pro Tyr Leu Pro Gly Asn Pro Arg Glu Leu Ile Ala
660 665 670
Tyr Ser Gln Tyr Pro Arg Pro Ser Asp Ile Pro Gln Trp Asn Ser Asp
675 680 685
Lys Pro Ser Leu Lys Asp Ile Lys Ile Met Gly Tyr Ser Ile Arg Thr
690 695 700
Ile Asp Tyr Arg Tyr Thr Val Trp Val Gly Phe Asn Pro Asp Glu Phe
705 710 715 720
Leu Ala Asn Phe Ser Asp Ile His Ala Gly Glu Leu Tyr Phe Val Asp
725 730 735
Ser Asp Pro Leu Gln Asp His Asn Met Tyr Asn Asp Ser Gln Gly Gly
740 745 750
Asp Leu Phe Gln Leu Leu Met Pro
755 760
<210> 6
<211> 850
<212> Protein
<213> Искусственная последовательность
<220>
<223> Фрагмент VH-CH1 тяжелой цепи антитела к инсулиновому рецептору
человека, соединенный с последовательностью ?-L-идуронидазы
<400> 6
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Leu Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Asp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Lys Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Trp Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Leu Ser Ser Glu
210 215 220
Ala Pro His Leu Val Gln Val Asp Ala Ala Arg Ala Leu Trp Pro Leu
225 230 235 240
Arg Arg Phe Trp Arg Ser Thr Gly Phe Cys Pro Pro Leu Pro His Ser
245 250 255
Gln Ala Asp Gln Tyr Val Leu Ser Trp Asp Gln Gln Leu Asn Leu Ala
260 265 270
Tyr Val Gly Ala Val Pro His Arg Gly Ile Lys Gln Val Arg Thr His
275 280 285
Trp Leu Leu Glu Leu Val Thr Thr Arg Gly Ser Thr Gly Arg Gly Leu
290 295 300
Ser Tyr Asn Phe Thr His Leu Asp Gly Tyr Leu Asp Leu Leu Arg Glu
305 310 315 320
Asn Gln Leu Leu Pro Gly Phe Glu Leu Met Gly Ser Ala Ser Gly His
325 330 335
Phe Thr Asp Phe Glu Asp Lys Gln Gln Val Phe Glu Trp Lys Asp Leu
340 345 350
Val Ser Ser Leu Ala Arg Arg Tyr Ile Gly Arg Tyr Gly Leu Ala His
355 360 365
Val Ser Lys Trp Asn Phe Glu Thr Trp Asn Glu Pro Asp His His Asp
370 375 380
Phe Asp Asn Val Ser Met Thr Met Gln Gly Phe Leu Asn Tyr Tyr Asp
385 390 395 400
Ala Cys Ser Glu Gly Leu Arg Ala Ala Ser Pro Ala Leu Arg Leu Gly
405 410 415
Gly Pro Gly Asp Ser Phe His Thr Pro Pro Arg Ser Pro Leu Ser Trp
420 425 430
Gly Leu Leu Arg His Cys His Asp Gly Thr Asn Phe Phe Thr Gly Glu
435 440 445
Ala Gly Val Arg Leu Asp Tyr Ile Ser Leu His Arg Lys Gly Ala Arg
450 455 460
Ser Ser Ile Ser Ile Leu Glu Gln Glu Lys Val Val Ala Gln Gln Ile
465 470 475 480
Arg Gln Leu Phe Pro Lys Phe Ala Asp Thr Pro Ile Tyr Asn Asp Glu
485 490 495
Ala Asp Pro Leu Val Gly Trp Ser Leu Pro Gln Pro Trp Arg Ala Asp
500 505 510
Val Thr Tyr Ala Ala Met Val Val Lys Val Ile Ala Gln His Gln Asn
515 520 525
Leu Leu Leu Ala Asn Thr Thr Ser Ala Phe Pro Tyr Ala Leu Leu Ser
530 535 540
Asn Asp Asn Ala Phe Leu Ser Tyr His Pro His Pro Phe Ala Gln Arg
545 550 555 560
Thr Leu Thr Ala Arg Phe Gln Val Asn Asn Thr Arg Pro Pro His Val
565 570 575
Gln Leu Leu Arg Lys Pro Val Leu Thr Ala Met Gly Leu Leu Ala Leu
580 585 590
Leu Asp Glu Glu Gln Leu Trp Ala Glu Val Ser Gln Ala Gly Thr Val
595 600 605
Leu Asp Ser Asn His Thr Val Gly Val Leu Ala Ser Ala His Arg Pro
610 615 620
Gln Gly Pro Ala Asp Ala Trp Arg Ala Ala Val Leu Ile Tyr Ala Ser
625 630 635 640
Asp Asp Thr Arg Ala His Pro Asn Arg Ser Val Ala Val Thr Leu Arg
645 650 655
Leu Arg Gly Val Pro Pro Gly Pro Gly Leu Val Tyr Val Thr Arg Tyr
660 665 670
Leu Asp Asn Gly Leu Cys Ser Pro Asp Gly Glu Trp Arg Arg Leu Gly
675 680 685
Arg Pro Val Phe Pro Thr Ala Glu Gln Phe Arg Arg Met Arg Ala Ala
690 695 700
Glu Asp Pro Val Ala Ala Ala Pro Arg Pro Leu Pro Ala Gly Gly Arg
705 710 715 720
Leu Thr Leu Arg Pro Ala Leu Arg Leu Pro Ser Leu Leu Leu Val His
725 730 735
Val Cys Ala Arg Pro Glu Lys Pro Pro Gly Gln Val Thr Arg Leu Arg
740 745 750
Ala Leu Pro Leu Thr Gln Gly Gln Leu Val Leu Val Trp Ser Asp Glu
755 760 765
His Val Gly Ser Lys Cys Leu Trp Thr Tyr Glu Ile Gln Phe Ser Gln
770 775 780
Asp Gly Lys Ala Tyr Thr Pro Val Ser Arg Lys Pro Ser Thr Phe Asn
785 790 795 800
Leu Phe Val Phe Ser Pro Asp Thr Gly Ala Val Ser Gly Ser Tyr Arg
805 810 815
Val Arg Ala Leu Asp Tyr Trp Ala Arg Pro Gly Pro Phe Ser Asp Pro
820 825 830
Val Pro Tyr Leu Glu Val Pro Val Pro Arg Gly Pro Pro Ser Pro Gly
835 840 845
Asn Pro
850
<210> 7
<211> 872
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фрагмент VH-CH1 тяжелой цепи антитела к инсулиновому рецептору
человека, соединенный с последовательностью ?-L-идуронидазы
посредством глицин-серинового линкера
<400> 7
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Leu Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Asp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Lys Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Trp Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ala Pro His Leu
225 230 235 240
Val Gln Val Asp Ala Ala Arg Ala Leu Trp Pro Leu Arg Arg Phe Trp
245 250 255
Arg Ser Thr Gly Phe Cys Pro Pro Leu Pro His Ser Gln Ala Asp Gln
260 265 270
Tyr Val Leu Ser Trp Asp Gln Gln Leu Asn Leu Ala Tyr Val Gly Ala
275 280 285
Val Pro His Arg Gly Ile Lys Gln Val Arg Thr His Trp Leu Leu Glu
290 295 300
Leu Val Thr Thr Arg Gly Ser Thr Gly Arg Gly Leu Ser Tyr Asn Phe
305 310 315 320
Thr His Leu Asp Gly Tyr Leu Asp Leu Leu Arg Glu Asn Gln Leu Leu
325 330 335
Pro Gly Phe Glu Leu Met Gly Ser Ala Ser Gly His Phe Thr Asp Phe
340 345 350
Glu Asp Lys Gln Gln Val Phe Glu Trp Lys Asp Leu Val Ser Ser Leu
355 360 365
Ala Arg Arg Tyr Ile Gly Arg Tyr Gly Leu Ala His Val Ser Lys Trp
370 375 380
Asn Phe Glu Thr Trp Asn Glu Pro Asp His His Asp Phe Asp Asn Val
385 390 395 400
Ser Met Thr Met Gln Gly Phe Leu Asn Tyr Tyr Asp Ala Cys Ser Glu
405 410 415
Gly Leu Arg Ala Ala Ser Pro Ala Leu Arg Leu Gly Gly Pro Gly Asp
420 425 430
Ser Phe His Thr Pro Pro Arg Ser Pro Leu Ser Trp Gly Leu Leu Arg
435 440 445
His Cys His Asp Gly Thr Asn Phe Phe Thr Gly Glu Ala Gly Val Arg
450 455 460
Leu Asp Tyr Ile Ser Leu His Arg Lys Gly Ala Arg Ser Ser Ile Ser
465 470 475 480
Ile Leu Glu Gln Glu Lys Val Val Ala Gln Gln Ile Arg Gln Leu Phe
485 490 500
Pro Lys Phe Ala Asp Thr Pro Ile Tyr Asn Asp Glu Ala Asp Pro Leu
510 515 520
Val Gly Trp Ser Leu Pro Gln Pro Trp Arg Ala Asp Val Thr Tyr Ala
525 530 535
Ala Met Val Val Lys Val Ile Ala Gln His Gln Asn Leu Leu Leu Ala
540 545 550
Asn Thr Thr Ser Ala Phe Pro Tyr Ala Leu Leu Ser Asn Asp Asn Ala
555 560 565 570
Phe Leu Ser Tyr His Pro His Pro Phe Ala Gln Arg Thr Leu Thr Ala
575 580 585
Arg Phe Gln Val Asn Asn Thr Arg Pro Pro His Val Gln Leu Leu Arg
590 595 600
Lys Pro Val Leu Thr Ala Met Gly Leu Leu Ala Leu Leu Asp Glu Glu
605 610 615
Gln Leu Trp Ala Glu Val Ser Gln Ala Gly Thr Val Leu Asp Ser Asn
620 625 630
His Thr Val Gly Val Leu Ala Ser Ala His Arg Pro Gln Gly Pro Ala
635 640 645 650
Asp Ala Trp Arg Ala Ala Val Leu Ile Tyr Ala Ser Asp Asp Thr Arg
655 660 665
Ala His Pro Asn Arg Ser Val Ala Val Thr Leu Arg Leu Arg Gly Val
670 675 680
Pro Pro Gly Pro Gly Leu Val Tyr Val Thr Arg Tyr Leu Asp Asn Gly
685 690 695
Leu Cys Ser Pro Asp Gly Glu Trp Arg Arg Leu Gly Arg Pro Val Phe
700 705 710
Pro Thr Ala Glu Gln Phe Arg Arg Met Arg Ala Ala Glu Asp Pro Val
715 720 725 730
Ala Ala Ala Pro Arg Pro Leu Pro Ala Gly Gly Arg Leu Thr Leu Arg
735 740 745
Pro Ala Leu Arg Leu Pro Ser Leu Leu Leu Val His Val Cys Ala Arg
750 755 760
Pro Glu Lys Pro Pro Gly Gln Val Thr Arg Leu Arg Ala Leu Pro Leu
765 770 775
Thr Gln Gly Gln Leu Val Leu Val Trp Ser Asp Glu His Val Gly Ser
780 785 790
Lys Cys Leu Trp Thr Tyr Glu Ile Gln Phe Ser Gln Asp Gly Lys Ala
795 800 805 810
Tyr Thr Pro Val Ser Arg Lys Pro Ser Thr Phe Asn Leu Phe Val Phe
815 820 825
Ser Pro Asp Thr Gly Ala Val Ser Gly Ser Tyr Arg Val Arg Ala Leu
830 835 840
Asp Tyr Trp Ala Arg Pro Gly Pro Phe Ser Asp Pro Val Pro Tyr Leu
845 850 855
Glu Val Pro Val Pro Arg Gly Pro Pro Ser Pro Gly Asn Pro
860 865 870
<210> 8
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь иммуноглобулина IgG к рецептору инсулина LFR1
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Gly Gly Asn
20 25 30
Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Thr Ser Ser Leu Asp Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Tyr Ser Ser Ser Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 9
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь иммуноглобулина IgG к рецептору инсулина LFR2
<400> 9
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Gly Gly Asn
20 25 30
Leu Tyr Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
Lys Ala Thr Ser Ser Leu Asp Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Ala Tyr Tyr Cys Leu Gln Tyr Ser Ser Ser Pro Trp
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 10
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь иммуноглобулина IgG к рецептору инсулина LFR3
<400> 10
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
Arg Val Thr
Ile Thr Cys Arg Ala Ser Gln Asp Ile Gly Gly Asn Leu Tyr Trp Tyr Gln
Gln Lys Pro
Gly Lys Ala Pro Lys Val Leu Ile Tyr Ala Thr Ser Ser Leu Asp Ser Gly
Val Pro Ser
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
Leu Gln Pro
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Ser Ser Ser Pro Trp Thr
Phe Gly Gln
Gly Thr Lys Val Glu Ile Lys Arg Thr Val a laAla Pro Ser Val Phe Ile
Phe Pro Pro
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
Asn Phe Tyr
Pro Arg Glu Ala Lys Val Gln Trp Lys Val a spAsn Ala Leu Gln Ser Gly
Asn Ser Gln
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
Thr Leu Thr
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr
His Gln Gly
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
<210> 11
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь иммуноглобулина IgG к рецептору инсулина LFR4
<400> 11
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu
Arg Ala Thr
Leu Ser Cys Arg Ala Ser Gln Asp Ile Gly Gly Asn Leu Tyr Trp Tyr Gln
Gln Lys Pro
Gly Gln Ala Pro Arg Leu Leu Ile Tyr Ala Thr Ser Ser Leu Asp Ser Gly
Ile Pro Ala
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
Leu Glu Pro
Glu Asp Phe Ala Val Tyr Tyr Cys Leu Gln Tyr Ser Ser Ser Pro Trp Thr
Phe Gly Gln
Gly Thr Arg Leu Glu Ile Lys Arg Thr Val a laAla Pro Ser Val Phe Ile
Phe Pro Pro
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
Asn Phe Tyr
Pro Arg Glu Ala Lys Val Gln Trp Lys Val a spAsn Ala Leu Gln Ser Gly
Asn Ser Gln
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
Thr Leu Thr
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr
His Gln Gly
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
<210> 12
<211> 748
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фрагмент VH-CH1 тяжелой цепи антитела к инсулиновому рецептору
человека, соединенный с последовательностью идуронат-2-сульфатазы
HFR1
<400> 12
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg Ser
Leu Arg Leu
Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asn Tyr Asp Ile His Trp Val
Arg Gln Ala
Pro Gly Lys Gly Leu Glu Trp Val Ser Trp Ile Tyr Pro Gly Asp Gly Ser
Thr Lys Tyr
Asn Glu Lys Phe Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn
Ser Leu Tyr
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
Lys Glu Trp
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
Gly Pro Ser
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
Leu Gly Cys
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
Ala Leu Thr
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
Leu Ser Ser
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
Val Asn His
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
Lys Thr His
Leu Ser Ser Ser Glu Thr Gln Ala Asn Ser Thr Thr Asp Ala Leu Asn Val
Leu Leu Ile
Ile Val a spAsp Leu Arg Pro Ser Leu Gly Cys Tyr Gly Asp Lys Leu Val
Arg Ser Pro
Asn Ile Asp Gln Leu Ala Ser His Ser Leu Leu Phe Gln Asn Ala Phe Ala
Gln Gln Ala
Val Cys Ala Pro Ser Arg Val Ser Phe Leu Thr Gly Arg Arg Pro Asp Thr
Thr Arg Leu
Tyr Asp Phe Asn Ser Tyr Trp Arg Val His Ala Gly Asn Phe Ser Thr Ile
Pro Gln Tyr
Phe Lys Glu Asn Gly Tyr Val Thr Met Ser Val Gly Lys Val Phe His Pro
Gly Ile Ser
Ser Asn His Thr Asp Asp Ser Pro Tyr Ser Trp Ser Phe Pro Pro Tyr His
Pro Ser Ser
Glu Lys Tyr Glu Asn Thr Lys Thr Cys Arg Gly Pro Asp Gly Glu Leu His
Ala Asn Leu
Leu Cys Pro Val Asp Val Leu Asp Val Pro Glu Gly Thr Leu Pro Asp Lys
Gln Ser Thr
Glu Gln Ala Ile Gln Leu Leu Glu Lys Met Lys Thr Ser Ala Ser Pro Phe
Phe Leu Ala
Val Gly Tyr His Lys Pro His Ile Pro Phe Arg Tyr Pro Lys Glu Phe Gln
Lys Leu Tyr
Pro Leu Glu Asn Ile Thr Leu Ala Pro Asp Pro Glu Val Pro Asp Gly Leu
Pro Pro Val
Ala Tyr Asn Pro Trp Met Asp Ile Arg Gln Arg Glu Asp Val Gln Ala Leu
Asn Ile Ser
Val Pro Tyr Gly Pro Ile Pro Val Asp Phe Gln Arg Lys Ile Arg Gln Ser
Tyr Phe Ala
Ser Val Ser Tyr Leu Asp Thr Gln Val Gly Arg Leu Leu Ser Ala Leu Asp
Asp Leu Gln
Leu Ala Asn Ser Thr Ile Ile Ala Phe Thr Ser Asp His Gly Trp Ala Leu
Gly Glu His
Gly Glu Trp Ala Lys Tyr Ser Asn Phe Asp Val Ala Thr His Val Pro Leu
Ile Phe Tyr
Val Pro Gly Arg Thr Ala Ser Leu Pro Glu Ala Gly Glu Lys Leu Phe Pro
Tyr Leu Asp
Pro Phe Asp Ser Ala Ser Gln Leu Met Glu Pro Gly Arg Gln Ser Met Asp
Leu Val Glu
Leu Val Ser Leu Phe Pro Thr Leu Ala Gly Leu Ala Gly Leu Gln Val Pro
Pro Arg Cys
Pro Val Pro Ser Phe His Val Glu Leu Cys Arg Glu Gly Lys Asn Leu Leu
Lys His Phe
Arg Phe Arg Asp Leu Glu Glu Asp Pro Tyr Leu Pro Gly Asn Pro Arg Glu
Leu Ile Ala
Tyr Ser Gln Tyr Pro Arg Pro Ser Asp Ile Pro Gln Trp Asn Ser Asp Lys
Pro Ser Leu
Lys Asp Ile Lys Ile Met Gly Tyr Ser Ile Arg Thr Ile Asp Tyr Arg Tyr
Thr Val Trp
Val Gly Phe Asn Pro Asp Glu Phe Leu Ala Asn Phe Ser Asp Ile His Ala
Gly Glu Leu
Tyr Phe Val Asp Ser Asp Pro Leu Gln Asp His Asn Met Tyr Asn Asp Ser
Gln Gly Gly
Asp Leu Phe Gln Leu Leu Met Pro
<210> 13
<211> 748
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фрагмент VH-CH1 тяжелой цепи антитела к инсулиновому рецептору
человека, соединенный с последовательностью идуронат-2-сульфатазы
HFR2
<400> 13
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser
Leu Arg Leu
Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Asp Ile His Trp Val
Arg Gln Ala
Pro Gly Lys Gly Leu Glu Trp Val a laTrp Ile Tyr Pro Gly Asp Gly Ser
Thr Lys Tyr
Asn Glu Lys Phe Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
Thr Leu Tyr
Leu Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
Arg Glu Trp
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
Gly Pro Ser
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
Leu Gly Cys
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
Ala Leu Thr
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
Leu Ser Ser
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
Val Asn His
Lys Pro Ser Asn Thr Lys Val a spLys Arg Val Glu Pro Lys Ser Cys Asp
Lys Thr His
Leu Ser Ser Ser Glu Thr Gln Ala Asn Ser Thr Thr Asp Ala Leu Asn Val
Leu Leu Ile
Ile Val Asp Asp Leu Arg Pro Ser Leu Gly Cys Tyr Gly Asp Lys Leu Val a
rgSer Pro
Asn Ile Asp Gln Leu Ala Ser His Ser Leu Leu Phe Gln Asn Ala Phe Ala
Gln Gln Ala
Val Cys Ala Pro Ser Arg Val Ser Phe Leu Thr Gly Arg Arg Pro Asp Thr
Thr Arg Leu
Tyr Asp Phe Asn Ser Tyr Trp Arg Val His Ala Gly Asn Phe Ser Thr Ile
Pro Gln Tyr
Phe Lys Glu Asn Gly Tyr Val Thr Met Ser Val Gly Lys Val Phe His Pro
Gly Ile Ser
Ser Asn His Thr Asp Asp Ser Pro Tyr Ser Trp Ser Phe Pro Pro Tyr His
Pro Ser Ser
Glu Lys Tyr Glu Asn Thr Lys Thr Cys Arg Gly Pro Asp Gly Glu Leu His
Ala Asn Leu
Leu Cys Pro Val Asp Val Leu Asp Val Pro Glu Gly Thr Leu Pro Asp Lys
Gln Ser Thr
Glu Gln Ala Ile Gln Leu Leu Glu Lys Met Lys Thr Ser Ala Ser Pro Phe
Phe Leu Ala
Val Gly Tyr His Lys Pro His Ile Pro Phe Arg Tyr Pro Lys Glu Phe Gln
Lys Leu Tyr
Pro Leu Glu Asn Ile Thr Leu Ala Pro Asp Pro Glu Val Pro Asp Gly Leu
Pro Pro Val
Ala Tyr Asn Pro Trp Met Asp Ile Arg Gln Arg Glu Asp Val Gln Ala Leu
Asn Ile Ser
Val Pro Tyr Gly Pro Ile Pro Val a spPhe Gln Arg Lys Ile Arg Gln Ser
Tyr Phe Ala
Ser Val Ser Tyr Leu Asp Thr Gln Val Gly Arg Leu Leu Ser Ala Leu Asp
Asp Leu Gln
Leu Ala Asn Ser Thr Ile Ile Ala Phe Thr Ser Asp His Gly Trp Ala Leu
Gly Glu His
Gly Glu Trp Ala Lys Tyr Ser Asn Phe Asp Val a laThr His Val Pro Leu
Ile Phe Tyr
Val Pro Gly Arg Thr Ala Ser Leu Pro Glu Ala Gly Glu Lys Leu Phe Pro
Tyr Leu Asp
Pro Phe Asp Ser Ala Ser Gln Leu Met Glu Pro Gly Arg Gln Ser Met Asp
Leu Val Glu
Leu Val Ser Leu Phe Pro Thr Leu Ala Gly Leu Ala Gly Leu Gln Val Pro
Pro Arg Cys
Pro Val Pro Ser Phe His Val Glu Leu Cys Arg Glu Gly Lys Asn Leu Leu
Lys His Phe
Arg Phe Arg Asp Leu Glu Glu Asp Pro Tyr Leu Pro Gly Asn Pro Arg Glu
Leu Ile Ala
Tyr Ser Gln Tyr Pro Arg Pro Ser Asp Ile Pro Gln Trp Asn Ser Asp Lys
Pro Ser Leu
Lys Asp Ile Lys Ile Met Gly Tyr Ser Ile Arg Thr Ile Asp Tyr Arg Tyr
Thr Val Trp
Val Gly Phe Asn Pro Asp Glu Phe Leu Ala Asn Phe Ser Asp Ile His Ala
Gly Glu Leu
Tyr Phe Val Asp Ser Asp Pro Leu Gln Asp His Asn Met Tyr Asn Asp Ser
Gln Gly Gly
Asp Leu Phe Gln Leu Leu Met Pro
<210> 14
<211> 748
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фрагмент VH-CH1 тяжелой цепи антитела к инсулиновому рецептору
человека, соединенный с последовательностью идуронат-2-сульфатазы
HFR3
<400> 14
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
Leu Arg Leu
Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr Asn Tyr Asp Ile His Trp Val
Arg Gln Ala
Pro Gly Lys Gly Leu Glu Trp Val Gly Trp Ile Tyr Pro Gly Asp Gly Ser
Thr Lys Tyr
Asn Glu Lys Phe Lys Gly Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser
Thr Ala Tyr
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
Lys Glu Trp
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
Gly Pro Ser
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
Leu Gly Cys
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
Ala Leu Thr
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
Leu Ser Ser
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
Val Asn His
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
Lys Thr His
Leu Ser Ser Ser Glu Thr Gln Ala Asn Ser Thr Thr Asp Ala Leu Asn Val
Leu Leu Ile
Ile Val Asp Asp Leu Arg Pro Ser Leu Gly Cys Tyr Gly Asp Lys Leu Val
Arg Ser Pro
Asn Ile Asp Gln Leu Ala Ser His Ser Leu Leu Phe Gln Asn Ala Phe Ala
Gln Gln Ala
Val Cys Ala Pro Ser Arg Val Ser Phe Leu Thr Gly Arg Arg Pro Asp Thr
Thr Arg Leu
Tyr Asp Phe Asn Ser Tyr Trp Arg Val His Ala Gly Asn Phe Ser Thr Ile
Pro Gln Tyr
Phe Lys Glu Asn Gly Tyr Val Thr Met Ser Val Gly Lys Val Phe His Pro
Gly Ile Ser
Ser Asn His Thr Asp Asp Ser Pro Tyr Ser Trp Ser Phe Pro Pro Tyr His
Pro Ser Ser
Glu Lys Tyr Glu Asn Thr Lys Thr Cys Arg Gly Pro Asp Gly Glu Leu His
Ala Asn Leu
Leu Cys Pro Val Asp Val Leu Asp Val Pro Glu Gly Thr Leu Pro Asp Lys
Gln Ser Thr
Glu Gln Ala Ile Gln Leu Leu Glu Lys Met Lys Thr Ser Ala Ser Pro Phe
Phe Leu Ala
Val Gly Tyr His Lys Pro His Ile Pro Phe Arg Tyr Pro Lys Glu Phe Gln
Lys Leu Tyr
Pro Leu Glu Asn Ile Thr Leu Ala Pro Asp Pro Glu Val Pro Asp Gly Leu
Pro Pro Val
Ala Tyr Asn Pro Trp Met Asp Ile Arg Gln Arg Glu Asp Val Gln Ala Leu
Asn Ile Ser
Val Pro Tyr Gly Pro Ile Pro Val a spPhe Gln Arg Lys Ile Arg Gln Ser
Tyr Phe Ala
Ser Val Ser Tyr Leu Asp Thr Gln Val Gly Arg Leu Leu Ser Ala Leu Asp
Asp Leu Gln
Leu Ala Asn Ser Thr Ile Ile Ala Phe Thr Ser Asp His Gly Trp Ala Leu
Gly Glu His
Gly Glu Trp Ala Lys Tyr Ser Asn Phe Asp Val a laThr His Val Pro Leu
Ile Phe Tyr
Val Pro Gly Arg Thr Ala Ser Leu Pro Glu Ala Gly Glu Lys Leu Phe Pro
Tyr Leu Asp
Pro Phe Asp Ser Ala Ser Gln Leu Met Glu Pro Gly Arg Gln Ser Met Asp
Leu Val Glu
Leu Val Ser Leu Phe Pro Thr Leu Ala Gly Leu Ala Gly Leu Gln Val Pro
Pro Arg Cys
Pro Val Pro Ser Phe His Val Glu Leu Cys Arg Glu Gly Lys Asn Leu Leu
Lys His Phe
Arg Phe Arg Asp Leu Glu Glu Asp Pro Tyr Leu Pro Gly Asn Pro Arg Glu
Leu Ile Ala
Tyr Ser Gln Tyr Pro Arg Pro Ser Asp Ile Pro Gln Trp Asn Ser Asp Lys
Pro Ser Leu
Lys Asp Ile Lys Ile Met Gly Tyr Ser Ile Arg Thr Ile Asp Tyr Arg Tyr
Thr Val Trp
Val Gly Phe Asn Pro Asp Glu Phe Leu Ala Asn Phe Ser Asp Ile His Ala
Gly Glu Leu
Tyr Phe Val Asp Ser Asp Pro Leu Gln Asp His Asn Met Tyr Asn Asp Ser
Gln Gly Gly
Asp Leu Phe Gln Leu Leu Met Pro
<210> 15
<211> 748
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фрагмент VH-CH1 тяжелой цепи антитела к инсулиновому рецептору
человека, соединенный с последовательностью идуронат-2-сульфатазы
HFR4
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg Ser
Leu Arg Leu
Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asn Tyr Asp Ile His Trp Val
Arg Gln Ala
Pro Gly Lys Gly Leu Glu Trp Val Ser Trp Ile Tyr Pro Gly Asp Gly Ser
Thr Lys Tyr
Asn Glu Lys Phe Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys
Ser Leu Tyr
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys Ala
Lys Glu Trp
Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys
Gly Pro Ser
Val Phe Pro Leu Ala Pro Gly Ser Ser Lys Ser Thr Ser Gly Thr Ala Ala
Leu Gly Cys
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
Ala Leu Thr
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
Leu Ser Ser
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
Val Asn His
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
Lys Thr His
Leu Ser Ser Ser Glu Thr Gln Ala Asn Ser Thr Thr Asp Ala Leu Asn Val
Leu Leu Ile
Ile Val a spAsp Leu Arg Pro Ser Leu Gly Cys Tyr Gly Asp Lys Leu Val
Arg Ser Pro
Asn Ile Asp Gln Leu Ala Ser His Ser Leu Leu Phe Gln Asn Ala Phe Ala
Gln Gln Ala
Val Cys Ala Pro Ser Arg Val Ser Phe Leu Thr Gly Arg Arg Pro Asp Thr
Thr Arg Leu
Tyr Asp Phe Asn Ser Tyr Trp Arg Val His Ala Gly Asn Phe Ser Thr Ile
Pro Gln Tyr
Phe Lys Glu Asn Gly Tyr Val Thr Met Ser Val Gly Lys Val Phe His Pro
Gly Ile Ser
Ser Asn His Thr Asp Asp Ser Pro Tyr Ser Trp Ser Phe Pro Pro Tyr His
Pro Ser Ser
Glu Lys Tyr Glu Asn Thr Lys Thr Cys Arg Gly Pro Asp Gly Glu Leu His
Ala Asn Leu
Leu Cys Pro Val Asp Val Leu Asp Val Pro Glu Gly Thr Leu Pro Asp Lys
Gln Ser Thr
Glu Gln Ala Ile Gln Leu Leu Glu Lys Met Lys Thr Ser Ala Ser Pro Phe
Phe Leu Ala
Val Gly Tyr His Lys Pro His Ile Pro Phe Arg Tyr Pro Lys Glu Phe Gln
Lys Leu Tyr
Pro Leu Glu Asn Ile Thr Leu Ala Pro Asp Pro Glu Val Pro Asp Gly Leu
Pro Pro Val
Ala Tyr Asn Pro Trp Met Asp Ile Arg Gln Arg Glu Asp Val Gln Ala Leu
Asn Ile Ser
Val Pro Tyr Gly Pro Ile Pro Val Asp Phe Gln Arg Lys Ile Arg Gln Ser
Tyr Phe Ala
Ser Val Ser Tyr Leu Asp Thr Gln Val Gly Arg Leu Leu Ser Ala Leu Asp
Asp Leu Gln
Leu Ala Asn Ser Thr Ile Ile Ala Phe Thr Ser Asp His Gly Trp Ala Leu
Gly Glu His
Gly Glu Trp Ala Lys Tyr Ser Asn Phe Asp Val Ala Thr His Val Pro Leu
Ile Phe Tyr
Val Pro Gly Arg Thr Ala Ser Leu Pro Glu Ala Gly Glu Lys Leu Phe Pro
Tyr Leu Asp
Pro Phe Asp Ser Ala Ser Gln Leu Met Glu Pro Gly Arg Gln Ser Met Asp
Leu Val Glu
Leu Val Ser Leu Phe Pro Thr Leu Ala Gly Leu Ala Gly Leu Gln Val Pro
Pro Arg Cys
Pro Val Pro Ser Phe His Val Glu Leu Cys Arg Glu Gly Lys Asn Leu Leu
Lys His Phe
Arg Phe Arg Asp Leu Glu Glu Asp Pro Tyr Leu Pro Gly Asn Pro Arg Glu
Leu Ile Ala
Tyr Ser Gln Tyr Pro Arg Pro Ser Asp Ile Pro Gln Trp Asn Ser Asp Lys
Pro Ser Leu
Lys Asp Ile Lys Ile Met Gly Tyr Ser Ile Arg Thr Ile Asp Tyr Arg Tyr
Thr Val Trp
Val Gly Phe Asn Pro Asp Glu Phe Leu Ala Asn Phe Ser Asp Ile His Ala
Gly Glu Leu
Tyr Phe Val Asp Ser Asp Pro Leu Gln Asp His Asn Met Tyr Asn Asp Ser
Gln Gly Gly
Asp Leu Phe Gln Leu Leu Met Pro
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НЕДОСТАТОЧНОСТИ ЛИЗОСОМАЛЬНОГО ФЕРМЕНТА У СУБЪЕКТА, ИМЕЮЩЕГО МУКОПОЛИСАХАРИДОЗ II ТИПА | 2023 |
|
RU2814280C1 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, СОДЕРЖАЩАЯ ДВА АНТИГЕНСВЯЗЫВАЮЩИХ ДОМЕНА, КОТОРЫЕ СВЯЗАНЫ ДРУГ С ДРУГОМ | 2019 |
|
RU2838581C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИНТЕРНАЛИЗАЦИИ ФЕРМЕНТОВ | 2018 |
|
RU2806021C2 |
| НАЦЕЛЕННЫЕ НА uPARAP КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2740311C2 |
| СКОНСТРУИРОВАННЫЕ МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И ДРУГИЕ МУЛЬТИМЕРНЫЕ БЕЛКИ С АСИММЕТРИЧНЫМИ МУТАЦИЯМИ В ОБЛАСТИ CH2-CH3 | 2018 |
|
RU2804031C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ НА ОСНОВЕ ПСЕВДО-FAB | 2019 |
|
RU2820254C2 |
| АНТИТЕЛА, СОДЕРЖАЩИЕ ПОЛИПЕПТИД, ВСТРОЕННЫЙ В УЧАСТОК КАРКАСНОЙ ОБЛАСТИ 3 | 2019 |
|
RU2796254C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ ПРОТИВ GITR И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2795625C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДНОГО ГЕТЕРОМУЛЬТИМЕРА | 2014 |
|
RU2758952C1 |
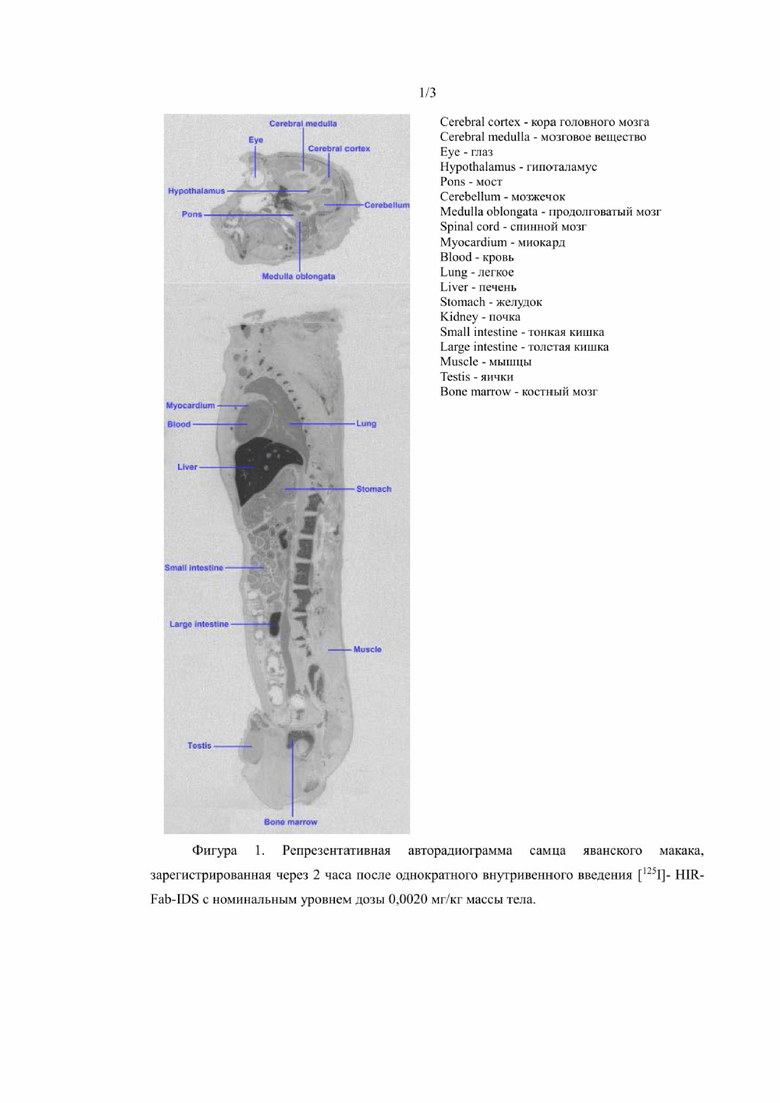
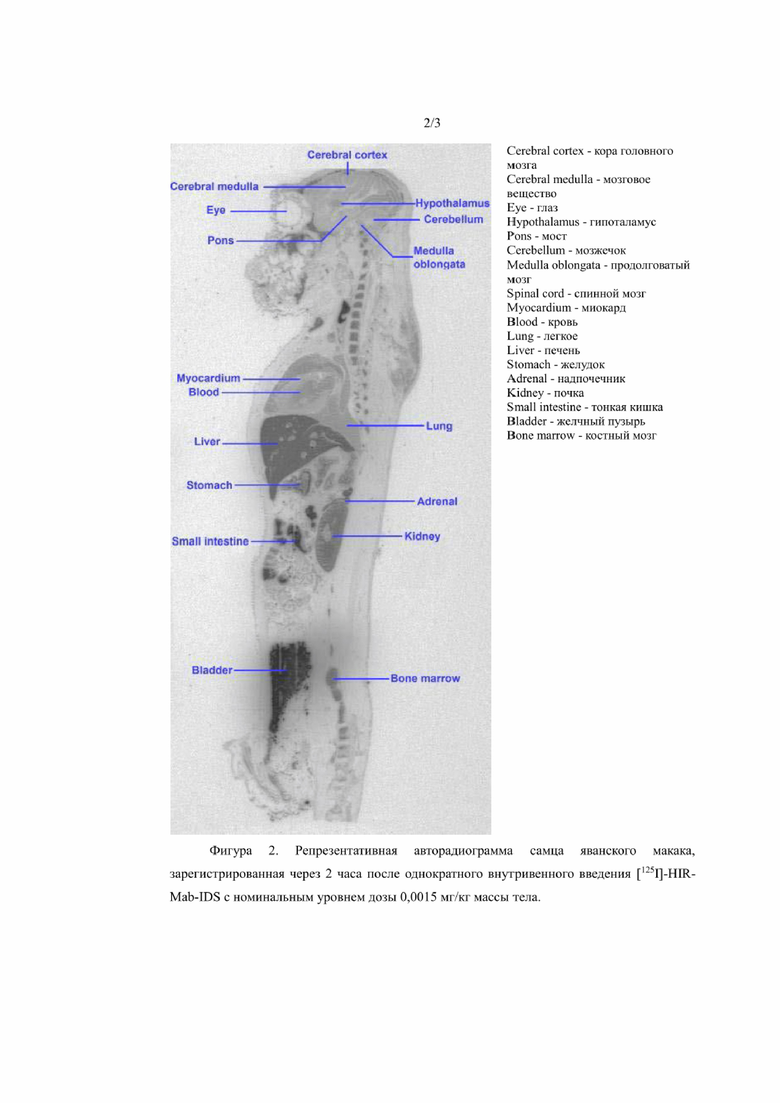
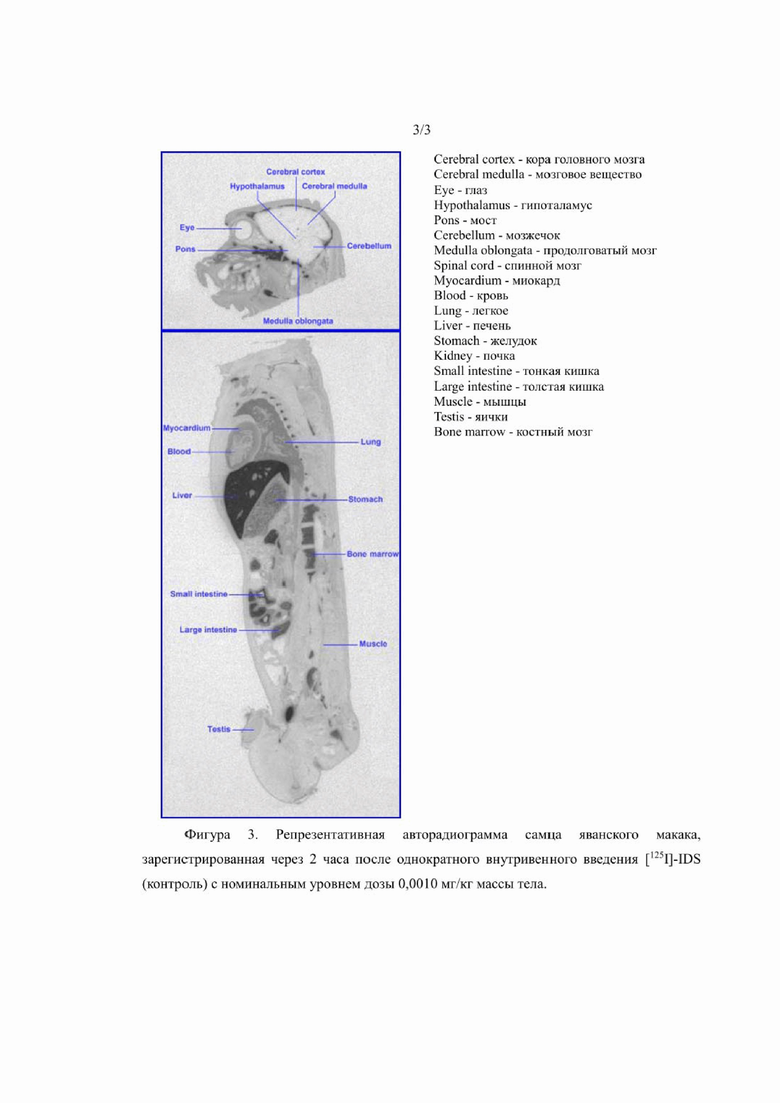
Настоящее изобретение относится к области биотехнологии, конкретно, к доставке (транспортировке) терапевтических ферментов, что может быть использовано в медицине. Настоящее изобретение относится к соединению, содержащему терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, при этом транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG, специфичного к эпитопу в рецепторе инсулина, к применению указанного соединения для получения фармацевтической композиции для лечения заболеваний и к применению указанного соединения для лечения и профилактики заболеваний, в частности лизосомных болезней накопления, в том числе для лечения и профилактики недостаточности соответствующего фермента, характерной для соответствующей лизосомной болезни накопления, таких как мукополисахаридоз, в частности мукополисахаридоз I и II типов. 3 н. и 8 з.п. ф-лы, 4 пр., 5 табл., 3 ил.
1. Соединение для лечения или профилактики ферментативной недостаточности идуронат-2-сульфатазы у субъекта, имеющего мукополисахаридоз типа II,
содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, представленное
первой аминокислотной последовательностью, выбранной из SEQ ID NO: 2, 8, 9, 10 или 11, и
второй аминокислотной последовательностью, выбранной из SEQ ID NO: 4, 5, 12, 13, 14 или 15,
при этом терапевтический фермент предназначен для лечения или профилактики недостаточности лизосомального фермента у субъекта, имеющего мукополисахаридоз II типа,
при этом транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG1 и способен транспортировать указанный фермент к лизосомам.
2. Соединение по п. 1, представленное
первой аминокислотной последовательностью, выбранной из SEQ ID NO: 2, и
второй аминокислотной последовательностью, выбранной из SEQ ID NO: 4,
при этом терапевтический фермент предназначен для лечения или профилактики недостаточности лизосомального фермента у субъекта, имеющего мукополисахаридоз II типа,
при этом транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG1 и способен транспортировать указанный фермент к лизосомам.
3. Соединение по п. 1, представленное
первой аминокислотной последовательностью, выбранной из SEQ ID NO: 2, и
второй аминокислотной последовательностью, выбранной из SEQ ID NO: 5,
при этом терапевтический фермент предназначен для лечения или профилактики недостаточности лизосомального фермента у субъекта, имеющего мукополисахаридоз II типа,
при этом транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG1 и способен транспортировать указанный фермент к лизосомам.
4. Соединение по пп. 1-3, содержащее терапевтический фермент и транспортный элемент, соединенные друг с другом непосредственно или при помощи линкера, при этом указанный транспортный элемент представляет собой Fab-фрагмент иммуноглобулина IgG1, специфичного к эпитопу в рецепторе инсулина.
5. Соединение по п. 4, где эпитоп в рецепторе инсулина представлен аминокислотной последовательностью SEQ ID NO: 1.
6. Соединение по п. 5, в котором указанный транспортный элемент способен транспортировать указанный фермент к лизосомам клеток нервной ткани.
7. Соединение по п. 6, в котором указанный транспортный элемент способен транспортировать указанный фермент к лизосомам клеток нервной ткани и способен транспортировать указанный терапевтический фермент через гематоэнцефалический барьер.
8. Соединение по пп. 1-3, применяемое для лечения или профилактики недостаточности лизосомального фермента у субъекта, имеющего мукополисахаридоз II типа с неврологической составляющей.
9. Применение соединения по пп. 1-3 для получения фармацевтической композиции, содержащей указанное соединение в эффективном количестве и фармацевтически приемлемый носитель.
10. Применение соединения по пп. 1-3 для лечения или профилактики недостаточности лизосомального фермента у субъекта, имеющего лизосомную болезнь накопления, которая представляет собой мукополисахаридоз II типа, где указанное применение включает введение указанному субъекту указанного соединения в эффективном количестве.
11. Применение соединения по п. 10 для лечения или профилактики недостаточности лизосомального фермента у субъекта, имеющего лизосомную болезнь накопления, которая представляет собой мукополисахаридоз II типа с неврологической составляющей.
| WO 2015009961 A1, 22.01.2015 | |||
| Лекарственное средство на основе бифункционального антитела для лечения мукополисахаридоза II типа | 2016 |
|
RU2673038C2 |
| WO 2011044542 A1, 14.04.2011 | |||
| US 2014178350 A1, 26.06.2014 | |||
| ВЕКТОРЫ НА ОСНОВЕ АДЕНОАССОЦИИРОВАННЫХ ВИРУСОВ ДЛЯ ЛЕЧЕНИЯ МУКОПОЛИСАХАРИДОЗОВ | 2016 |
|
RU2744593C2 |
| RU 2010134412 A1, 27.02.2012. | |||
Авторы
Даты
2024-01-11—Публикация
2022-12-29—Подача