ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет предварительной заявки на патент США номер 61/032831 от 29 февраля 2008 года, полное описание которой включено в настоящей документ в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее описание относится к способам лечения рака у млекопитающих путем введения Люкантона (Lucanthone) и, по меньшей мере, одного антиметаболита. Также раскрыты фармацевтические композиции и наборы реагентов, включающие Люкантон, и, по меньшей мере, один антиметаболит.
УРОВЕНЬ ТЕХНИКИ
Люкантон представляет собой тиоксантион. Люкантон был открыт и разрабатывался в 1930-ые и 1940-вые годы для лечения шистосомоза у людей. Люкантон использовали для лечения шистосомоза у пациентов во всем мире в 1950-ые и 1960-ые с отличной статистикой по безопасности.
Люкантон обладает противоопухолевой активностью. Hirschberg et al. (J. Natl. Cancer Inst. (1959) 22, 567-579) были первыми, кто исследовал противоопухолевую активность Люкантона in vitro. Впоследствии Люкантон тестировали в Национальном Институте Рака на предмет противоопухолевой активности in vitro с использованием панели из 60 клеточных линий. Результаты исследования продемонстрировали, что Люкантон обладает противоопухолевой активностью in vitro по отношению ко всем тестированным клеточным линиям в концентрациях порядка мкМ. Интервалы GI50 (концентрация, необходимая для 50%-ингибирования роста), TGI (концентрация, необходимая для 100%-ингибирования роста), и LC50 (концентрация, необходимая для 50%-уменьшения клеточного белка) были относительно узкими, что указывало на то, что чувствительность клеточных линий к Люкантону широко не варьировалась.
Было продемонстрировано, что Люкантон в концентрации 3 мкг/мл также повышает повреждение клеток HeLa рентгеновским излучением, возможно, путем ингибирования процесса репарации после излучения. Радиосенсибилизирующий эффект Люкантона зависел от времени экспонирования и был обратимым. Способность Люкантона ингибировать топоизомеразу II и апуриновую/апиримидиновую (AP) эндонуклеазу, которая приводит к ингибированию ДНК-репарации, возможно, объясняет противоопухолевую активность и радиосенсибилизирующую активность Люкантона.
Радиосенсибилизирующий эффект Люкантона в клетках CHO исследовали Leeper et al. (Int. J. Radiat. Oncol. Biol. Phys. 1978 Mar-Apr; 4 (3-4): 219-27), которые продемонстрировали, что Люкантон в концентрациях 5 мкг/мл или выше уменьшает способность клеток CHO к аккумулированию и репарации сублетального радиационного повреждения в зависимости от времени, независимо от того присутствовало ли лекарственное средство перед или после облучения. Было обнаружено, что радиосенсибилизирующий эффект Люкантона является обратимым после удаления лекарственного средства. Аналогичные наблюдения были сделаны Durand et al. (Int. J. Radiat. Oncol. Biol. Phys. 1980 Nov.; 6(11): 1525-30), которые исследовали эффект Люкантона в клетках китайского хомяка V-79. Было продемонстрировано, что Люкантон в концентрации 4 мкМ повышает в два раза цитотоксическую активность алкилирующего агента темозоламида по отношению к клеткам MDA-MB231 рака груди.
Противоопухолевая активность Люкантона по отношению к различным опухолям исследовалась рядом исследователей с использованием модельных животных, мыши, крысы и хомяка. В этих исследованиях, рассмотренных у Hirschberg (Antibiotics. New York: Springer Verlag; (1974) 3, 274-303), было продемонстрировано, что Люкантон ингибирует рост около половины опухолей, тестированных без какой-либо заметной формы ответной реакции. Люкантон также тестировали в Национальном Институте Рака (NCI) по отношению к ряду опухолей на мышиных моделях. В этих исследованиях Люкантон вводили или подкожно или внутрибрюшинно в дозах до 600 мг/кг после применения разнообразных схем лечения. Среднюю массу опухоли или среднее время выживания, измеренные в виде процента от контроля, использовали в качестве конечных данных. В этих исследованиях Люкантон продемонстрировал противоопухолевую активность по отношению приблизительно к 30% тестированных опухолей.
Люкантон представляет собой перорально доступный низкомолекулярный ингибитор апуриновой/апиримидиновой (AP) эндонуклеазы. Ингибирование AP-эндонуклеазы приводит к аккумулированию отличных от оснований сайтов в ДНК, которые превращаются в летальные двухцепочечные разрывы, приводящие к сенсибилизации опухолевых клеток к алкилирующим агентам и к радиации. Так как известно, что такие агенты-антиметаболиты, как Пеметрексед (Pemetrexed), также производят отличные от оснований сайты в ДНК, то существует необходимость применения комбинированной терапии рака, при которой применяются одновременно Люкантон и антиметаболит.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее описание относится к способам лечения рака у млекопитающих путем одновременного или последовательного введения Люкантона и, по меньшей мере, одного антиметаболита. Также раскрыты фармацевтические композиции и наборы реагентов, включающие Люкантон и, по меньшей мере, один антиметаболит.
В одном воплощении, настоящее описание относится к способу лечения рака, включающему введение нуждающемуся в этом млекопитающему терапевтически эффективного количества Люкантона и, по меньшей мере, одного антиметаболита. Альтернативно, Люкантон и, по меньшей мере, один антиметаболит могут вводиться одновременно или последовательно. Альтернативно, введение каждого из Люкантона и, по меньшей мере, одного антиметаболита может осуществляться в течение около трех часов. Альтернативно, введение каждого из Люкантона и, по меньшей мере, одного антиметаболита также может осуществляться в течение около двух часов. Альтернативно, введение каждого из Люкантона и, по меньшей мере, одного антиметаболита также может осуществляться в течение около одного часа. Альтернативно, рак, подвергаемый лечению, может представлять собой рак легкого. Альтернативно, рак легкого может представлять собой немелкоклеточную карциному легкого. Альтернативно, терапевтически эффективное количество Люкантона и терапевтически эффективное количество, по меньшей мере, одного антиметаболита вводятся однократной суточной дозой или поделены на более чем одну суточные дозы. Альтернативно, для всех введений Люкантона и, по меньшей мере, одного антиметаболита согласно настоящему описанию, введение может осуществляться ежедневно дважды в день.
Альтернативно, Люкантон и, по меньшей мере, один антиметаболит согласно настоящему лечению вводятся перорально. Альтернативно, Люкантон и, по меньшей мере, один антиметаболит вводятся парентерально. Альтернативно, Люкантон и, по меньшей мере, один антиметаболит вводятся в форме капсулы или таблетки. Альтернативно, Люкантон и, по меньшей мере, один антиметаболит вводятся в течение одного или более циклов. Альтернативно, один цикл включает введение один раз каждые четыре дня семь раз.
В другом воплощении, настоящий способ лечения рака дополнительно включает введение лучевой терапии, гормональной терапии или иммунотерапии.
Настоящее описание также относится к фармацевтической композиции, включающей терапевтически эффективные количества Люкантона и, по меньшей мере, одного антиметаболита, и фармацевтически приемлемого носителя.
Настоящее описание также относится к фармацевтическому набору реагентов, включающему: терапевтически эффективное количество Люкантона и фармацевтически приемлемый носитель, и фармацевтическую композицию, включающую терапевтически эффективное количество, по меньшей мере, одного антиметаболита и фармацевтически приемлемый носитель.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
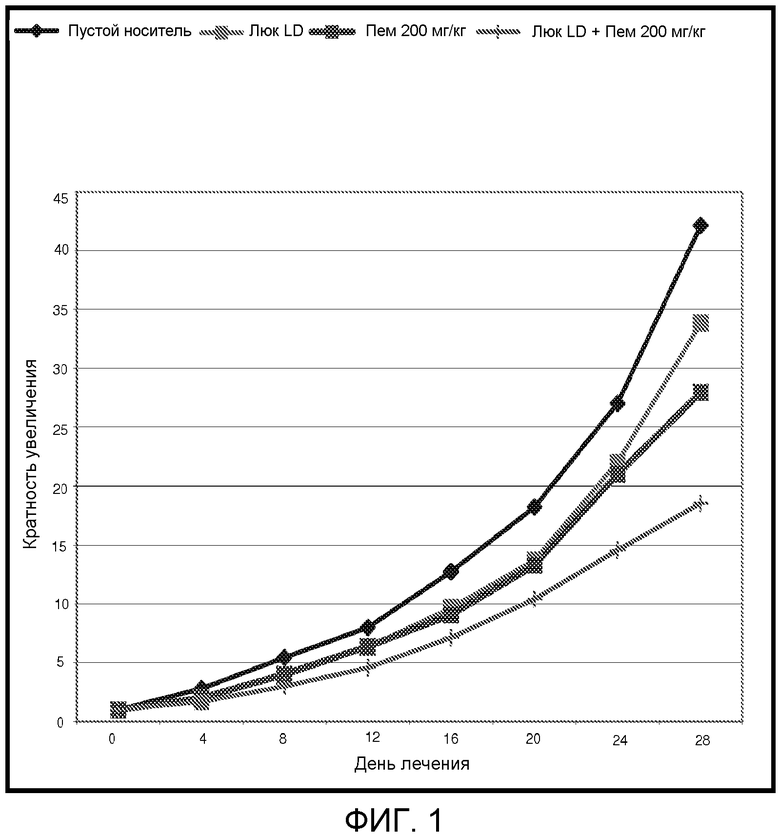
Фиг.1 представляет собой график, демонстрирующий противоопухолевую активность Люкантона и Пеметрекседа в качестве индивидуального агента или в комбинации.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Люкантон представляет собой химиотерапевтический или радиосенсибилизирующий интеркалирующий агент. В настоящем описании принято, что термин Люкантон включает Люкантон, употребленный в собственном смысле слова, в виде 1-диэтиламиноэтиламино-4-метил-10-тиаксантенона вместе с его физиологически переносимыми производными, аналогами и солями. Такие физиологически переносимые производные, аналоги и соли включают в частности аналоги Люкантона гикантон, индазол и другие аналоги, такие как раскрытые у Thomas Corbett et al., Antitumor Activity of N-[[1-[[2-(diethylamino)ethyl]amino]-9-oxo-9H-thiaxanthen-4-yl]methyl]meth anesulfonamide (WIN33377) and analogues, Exp. Opin. Invest. Drugs 3:1281-1292 (1994); и у Mark P. Wentland et al., Anti-solid Tumor Efficacy and Preparation of N-[[1-[[2-(diethylamino)ethyl]amino]-9-oxo-9H-thiaxanthen-4-yl]methyl]meth anesulfonamide (WIN33377) and Related Derivatives, Bioorg. & Med. Chem Lett. 4:609-614 (1994).
Люкантон использовали в качестве лечения шистосомоза. Известно, что Люкантон обладает цитотоксическим или цитостатическим эффектом, оказываемым на растущие клетки. Повышенное объединенное летальное действие Люкантона и ионизирующей радиации в клетках может объясняться получением двухцепочечных разрывов ДНК (DSB) в расщепляемых комплексах благодаря ингибированию Люкантоном топоизомеразы II, в комбинации с DSB, индуцированными только радиацией. R. Bases, DNA Intercalating Agents as Adjuvants in Radiation Therapy, Int J Radiat Oncol Biol Phys 4:345-346 (1978) (editorial); R. E. Bases et al., Topoisomerase Inhibition by Lucanthone, an Adjuvant in Radiation Therapy, Int J Radiat Oncol Biol Phys 37:1133-1137 (1997).
Топоизомераза II может быть также вовлечена в механизм индуцированных радиацией DSB с помощью дополнительного механизма. Когда ДНК-основания повреждаются ионизирующей радиацией, они сначала удаляются клеточными ферментами эксцизионной репарация оснований, причем ферменты сначала удаляют поврежденные основания (с помощью гликозилазы) и оставляют сайты, отличные от оснований. Удаление сайтов, отличных от оснований, достигается во второй стадии, осуществляемой эндонуклеазами, которые вызывают разрезание цепи и оставляют 3'-OH-группы, которые необходимы рецепторам в репаративном синтезе ДНК. Последующие стадии включают удаление 5'-фосфатных групп в сайтах вырезанных оснований с последующим заполнением разрыва с помощью ДНК-полимеразы бета, которая вставляет подходящие заменяющие нуклеотиды. ДНК-лигаза завершает репарацию путем сшивания замененных нуклеотидов.
Преимущество Люкантона заключается в том, что для ДНК-репликации необходима активность топоизомеразы II, что создает селективную токсичность для делящихся клеток, таких как раковые клетки. Нормальные клетки, большинство из которых не делится, будут таким образом менее чувствительны к терапии на основе Люкантона и с меньшей вероятностью будут неселективно повреждаться. Кроме того, эффекты Люкантона на костный мозг и кишечник умеренны и в достаточной степени быстро обратимы.
Антиметаболит, использованный в настоящем документе, представляет собой химическое вещество со структурой, подобной такому веществу, как метаболит, который необходим для нормальных биохимических реакций, но со структурой, достаточно отличной от него, чтобы препятствовать нормальным функциям клеток, включая клеточное деление. Антиметаболиты могут препятствовать синтезу ДНК и, таким образом, клеточному делению и росту опухолей. Так как раковые клетки проводят больше времени в делении, чем другие клетки, то ингибирование клеточного деления вредит раковым клеткам больше, чем другим клеткам. Антиметаболиты могут имитировать пурин (азатиоприн, меркаптопурин) или пиримидин, которые становятся структурными элементами ДНК. Антиметаболиты предотвращают включение этих веществ в ДНК во время S-фазы (клеточного цикла), останавливают нормальное развитие и деление. Они также воздействуют на синтез РНК. Однако так как тимидин используется в ДНК, но не в РНК (где вместо него используется урацил), ингибирование синтеза тимидина посредством тимидилат-синтазы селективно ингибирует синтез ДНК относительно синтеза РНК.
Один пример антиметаболита представляет собой антиметаболит фолата. Другой пример антиметаболита представляет собой Пеметрексед. Пеметрексед (торговая или рыночная марка Алмита® (Alimta®) обозначает Пеметрексед, взятый вместе с его физиологически переносимыми производными, аналогами и солями. Его химическое название представляет собой N-[4-[2-(2-амино-4,7-дигидро-4-оксо-1H-пирроло[2,3-d]пиримидин-5-ил)этил]-бензоил]-L- глутаминовая кислота. Пеметрексед может обладать ингибирующим эффектом на один или более ферментов, которые используют фолиевую кислоту, и, конкретно, метаболические производные фолиевой кислоты в качестве субстрата. По-видимому, соединения являются особенно активными в качестве ингибиторов тимидилат-синтетазы, которая катализирует метилирование дезоксиуридиловой кислоты до дезокситимидиловой кислоты. Таким образом, Пеметрексед может использоваться индивидуально или в комбинации для ингибирования роста новообразований, который в противном случае зависит от ингибируемого фермента.
Авторы изобретения неожиданно обнаружили, что Люкантон и, по меньшей мере, один антиметаболит могут преимущественно вводиться одновременно или последовательно при лечении раковых заболеваний, где они могут вводиться в количествах, эффективных для того, чтобы вызвать угнетение или регрессию рака у хозяина.
Настоящее описание относится к способам лечения рака у млекопитающего путем одновременного или последовательного введения Люкантона и, по меньшей мере, одного антиметаболита. Также раскрыты фармацевтические композиции и наборы реагентов, включающие Люкантон.
В одном воплощении, настоящее описание относится к способу лечения рака, включающему введение нуждающемуся в этом млекопитающему терапевтически эффективного количества Люкантона и терапевтически эффективного количества, по меньшей мере, одного антиметаболита. "Терапевтически эффективное количество" обозначает количество соединения, которое может быть терапевтически эффективным для ингибирования, предотвращения или лечения симптомов конкретного заболевания, расстройства или побочного эффекта, например, для того, чтобы вызвать угнетение или регрессию рака.
Альтернативно, Люкантон и, по меньшей мере, один антиметаболит могут вводиться одновременно или последовательно. Это обозначает, что каждый компонент может вводиться в одно и то же время (одновременно) или последовательно в любом порядке в различные моменты времени. Также, термин одновременно может использоваться для обозначения того, что Люкантон и, по меньшей мере, один антиметаболит могут быть взяты вместе в одно и то же время в виде части одной фармацевтической композиции или вместе в одно и то же время, но в отдельных фармацевтических композициях. Таким образом, каждый компонент может вводиться отдельно, но достаточно близко по времени так, чтобы обеспечить целевой терапевтический эффект. Альтернативно, введение каждого из Люкантона и, по меньшей мере, одного антиметаболита может осуществляться в течение около трех часов. Альтернативно, введение каждого из Люкантона и, по меньшей мере, одного антиметаболита может осуществляться в течение около двух часов. Альтернативно, введение каждого из Люкантона и, по меньшей мере, одного антиметаболита может осуществляться в течение около одного часа.
Не все комбинации Люкантона и противораковых агентов будут демонстрировать противоопухолевый эффект, достигаемый по настоящему изобретению. Люкантон и, по меньшей мере, один антиметаболит по настоящему документу, по-видимому, работают вместе для достижения результатов, невозможных с другими комбинациями известных противораковых агентов.
С использованием настоящего изобретения может подвергаться лечению широкий интервал раковых заболеваний. Эти раковые заболевания включают и первичные и метастазирующие раковые заболевания. В качестве примера рак, подвергаемый лечению, представляет собой рак легкого. Альтернативно, рак легкого может представлять собой немелкоклеточную карциному легкого.
Определенная доза Люкантона и, по меньшей мере, одного антиметаболита, которые вводятся для получения терапевтического или угнетающего заболевание эффекта будет, безусловно, определяться конкретными обстоятельствами, сопутствующими положению, включающими, например, вводимое соединение, путь введения и индивидуальные особенности хозяина или пациента, подвергаемого лечению. Альтернативно, терапевтически эффективное количество Люкантона и терапевтически эффективное количество, по меньшей мере, одного антиметаболита вводятся однократной суточной дозой или поделены на более чем одну суточную дозу. Альтернативно, для всех введений Люкантона и, по меньшей мере, одного антиметаболита согласно настоящему описанию введение может осуществляться ежедневно дважды в сутки.
Люкантон и Прексемед могут вводиться в течение одного или более циклов. В одном воплощении, один цикл включает введение один раз каждые четыре дня семь раз.
В другом воплощении, настоящий способ лечения рака дополнительно включает введение лучевой терапии, гормональной терапии или иммунотерапии.
Настоящее описание также относится к фармацевтической композиции, включающей терапевтически эффективное количество Люкантона и Перексемеда и фармацевтически приемлемый носитель.
Настоящее описание также относится к фармацевтическому набору реагентов, включающему фармацевтическую композицию, включающую терапевтически эффективное количество Люкантона и фармацевтически приемлемый носитель, и фармацевтическую композицию, включающую терапевтически эффективное количество Пеметрекседа и фармацевтически приемлемый носитель.
Фармацевтические композиции по настоящему изобретению включают Люкантон и Пеметрексед, включенные в композиции вместе с одним или более фармацевтически приемлемыми носителями, адъювантами или переносчиками, которые все вместе обозначаются в настоящем документе как носители. Фармацевтические наборы реагентов по настоящему описанию включают фармацевтическую композицию, включающую Люкантон, и другую фармацевтическую композицию, включающую Пеметрексед.
Фармацевтические композиции и наборы реагентов могут вводиться людям и животным или перорально, ректально, парентерально (внутривенно, внутримышечно или подкожно), интрацистернально, интравагинально, местно (порошки, мази или капли), или в виде трансбуккального или назального спрея. Каждый или оба, Люкантон и антиметаболит, могут вводиться различными путями, включающими пероральное введение, парентеральное, внутрибрюшинное, внутривенное, внутриартериальное, чрескожное, подъязычное, внутримышечное, ректальное, трансбуккальное, внутриназальное, липосомальное, посредством ингаляции, вагинальное, внутриглазное, посредством местной доставки с помощью катетера или стента, подкожное введение, внутрижировое, внутрисуставное, интратекальное или введение в дозированной форме с замедленным высвобождением. В другом воплощении, Люкантон и, по меньшей мере, один антиметаболит вводятся перорально. Альтернативно, Люкантон и, по меньшей мере, один антиметаболит вводятся парентерально. Альтернативно, Люкантон и, по меньшей мере, один антиметаболит вводятся в форме капсулы или таблетки.
"Фармацевтически приемлемые" обозначает соединения, вещества, композиции и/или дозированные формы, которые в рамках целесообразной медицинской оценки являются подходящими для контакта с тканями людей и животных без избыточной токсичности, раздражения, аллергической реакции или других проблемных затруднений, соразмерно обоснованному соотношению пользы/риска.
Композиции, подходящие для парентеральной инъекции, могут включать физиологически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии и стерильные порошки для восстановления в стерильных растворах или дисперсиях для инъекции. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или переносчиков включают воду, этанол, полиолы, (пропиленгликоль, полиэтиленгликоль (ПЭГ), глицерин и тому подобное), их подходящие смеси, растительные масла (такие как оливковое масло) и органические эфиры для инъекции, такие как этилолеат. Подходящее жидкое состояние может поддерживаться, например, с помощью использования покрытия, такого как лецитин, путем поддержания необходимого размера частиц в случае дисперсий и путем использования поверхностно-активных веществ.
Эти композиции также могут содержать адъюванты, такие как консервирующие, увлажняющие, эмульгирующие и диспергирующие агенты. Предотвращение действия микроорганизмов может гарантироваться использованием различных противобактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты и тому подобное. Также может быть желательным включение изотонических агентов, например, сахаров, хлорида натрия и тому подобное. Продолжительное всасывание фармацевтической формы для инъекции может достигаться путем использования агентов, замедляющих всасывание, например, моностеарата алюминия и желатина.
Если желательно, и для эффективного распределения соединения могут быть включены в системы замедленного высвобождения или направленной доставки, такие как полимерные матриксы, липосомы и микросферы. Они могут стерилизоваться, например, путем фильтрации через фильтр, задерживающий бактерии, или путем включения стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены в стерильной воде, или в какой-то другой стерильной среде для инъекции непосредственно перед использованием.
Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активное соединение может быть смешано, по меньшей мере, с одним инертным стандартным вспомогательным веществом (или носителем), таким как цитрат натрия или дикальцийфосфат, или (a) с наполнителями или добавками, например, крахмалами, лактозой, сахарозой, глюкозой, маннитом и кремниевой кислотой, (b) со связующими веществами, например, карбоксиметилцеллюлозой, альгинатами, желатином, полливинилпирролидоном, сахарозой и гуммиарабиком, (c) с увлажнителями, например, с глицерином, (d) дезинтегрирующими агентами, например, агар-агаром, карбонатом кальция, картофельным или маниоковым крахмалом, альгиновой кислотой, определенными сложными силикатами и карбонатом натрия, (e) с замедлителями растворения, например, парафином, (f) ускорителями всасывания, например, с соединениями четвертичного аммония, (g) с увлажняющими агентами, например цетиловым спиртом и моностеаратом глицерина, (h) с адсорбентами, например, с каолином и бентонитом, и (i) с лубрикантами, например, с тальком, стеаратом кальция, стеаратом магния, твердыми полиэтиленгликолями, лаурилсульфатом натрия или с их смесями. В случае капсул, таблеток и пилюль дозированные формы также могут включать буферирующие агенты.
Процентное содержание активного компонента в композиции и способ лечения опухолей могут варьироваться так, чтобы получалась подходящая дозировка. Дозировка, вводимая конкретному пациенту, зависит изменчивым образом от заключения врача с использованием в качестве критериев: пути введения, продолжительности лечения, параметров и состояния пациента, эффективности активного компонента и реакции на него пациента. Таким образом, эффективное дозированное количество может быть легко определено врачом, рассматривая все критерии и применяя свое точное заключение на пользу пациента.
Настоящие способы лечения могут дополнительно включать введение дополнительных способов лечения рака, включающих в частности лучевую терапию, гормональную, биологическую и иммунотерапию. Лучевая терапия, гормональная, биологическая и иммунотерапия могут вводиться перед, после или во время введения Люкантона и, по меньшей мере, одного антиметаболита.
Лучевая терапия может вводиться различными способами. Например, лучевая терапия по природе может быть электромагнитной или корпускулярной. Электромагнитная лучевая терапия, применяемая при практическом осуществлении настоящего изобретения, включает в частности рентгеновское излучение и гамма-излучение. В предпочтительном воплощении, рентгеновское излучение высокого напряжения (рентгеновское излучение ≥4 МэВ) может использоваться при практическом осуществлении изобретения. Корпускулярное излучение, используемое при практическом осуществлении настоящего изобретения, включает в частности электронные пучки, пучки протонов, пучки нейтронов, альфа-частицы, и отрицательные пи-мезоны. Лучевая терапия может быть доставлена с использованием приборов и методов стандартной лучевой терапии и с помощью интраоперационных и стереотаксических методов. Дополнительное обсуждение, касающееся лучевой терапии, подходящей для использования при практическом осуществлении настоящего изобретения, можно обнаружить в публикации Steven A. Leibel et al., Textbook of Radiation Oncology (1998) (publ. W. B. Saunders Company), и конкретно в Главах 13 и 14. Лучевая терапия также может быть доставлена с помощью других методов, таких как направленная доставка, например, с помощью радиоактивных «семян» или с помощью системной доставки направленных радиоактивных конъюгатов. J. Padawer et al., Combined Treatment with Radioestradiol Lucanthone in Mouse C3HBA Mammary Adenocarcinoma and with Estradiol Lucanthone in an Estrogen Bioassay, Int. J. Radiat. Oncol. Biol. Phys. 7:347-357 (1981). Для практического осуществления настоящего изобретения могут использоваться и другие методы доставки лучевой терапии.
Количество лучевой терапии, доставленной в целевую область лечения, может варьироваться. В предпочтительном воплощении, лучевая терапия может вводиться в количестве, эффективном для того, чтобы вызвать угнетение или регрессию рака центральной нервной системы у хозяина, когда лучевая терапия вводится вместе с Люкантоном и Пеметрекседом. В другом воплощении, лучевая терапия вводится с помощью, по меньшей мере, примерно 1 Грей (Гр) фракции, по меньшей мере, один раз через день в область лечения, и, более предпочтительно, лучевая терапия вводится с помощью, по меньшей мере, примерно 2 Грей (Гр) фракций, по меньшей мере, один раз в день в область лечения, еще более предпочтительно, лучевая терапия вводится с помощью, по меньшей мере, примерно 2 Грей (Гр) фракций, по меньшей мере, один раз в день в область лечения в течение пяти последовательных дней в неделю. В другом воплощении, лучевая терапия вводится с помощью 3 Гр фракций через день три раза в неделю в область лечения. В другом воплощении, первые 23 фракции вводятся в исходную область лечения, в то время как другие 7 лечебных фракций доставляются в увеличенную область лечения. Еще в другом воплощении, нуждающемуся в этом хозяину вводится в целом, по меньшей мере, примерно 20 Гр, еще более предпочтительно, по меньшей мере, примерно 30 Гр, наиболее предпочтительно, по меньшей мере, примерно 60 Гр лучевой терапии. В другом более предпочтительном воплощении, лучевая терапия вводится в цельный мозг, а не в область лечения. При облучении цельного мозга, рекомендуется максимальная дозировка 30 Гр. В наиболее предпочтительном воплощении, лучевая терапия вводится в цельный мозг хозяина, где хозяин подвергается лечению от метастазирующего рака.
В предпочтительном воплощении, область лечения включает контрастно-усиленное повреждение при КТ- или МРТ-сканировании, более предпочтительно, контрастно-усиленное повреждение и близлежащую эдему при КТ- или МРТ-сканировании и еще плюс, по меньшей мере, примерно 1 см запаса.
План лечения может включать в частности методы противоположных боковых полей, клиновидных пар полей, чередующихся полей или множества полей. Предполагается, что план лечения, управляемый КТ, улучшает точность в выборе расположения области. Распределение изодозы для исходной области лечения и усеченной области лечения предлагаются для всех пациентов, включая пациентов с параллельными противоположными полями. Желательным является сводный план, демонстрирующий распределение дозы в исходной области лечения и в увеличенной области лечения. Минимальная и максимальная доза для области лечения предпочтительно поддерживаются в количестве примерно 10% дозы в центре области лечения.
Гормональная терапия включает управление эндокринной системой посредством экзогенного введения определенных гормонов, конкретно, стероидных гормонов или лекарственных средств, которые ингибируют продуцирование или активность таких гормонов (антагонисты гормонов). Так как стероидные гормоны представляют собой мощные двигатели генной экспрессии в определенных раковых клетках, то изменение уровня активности определенных гормонов может вызвать прекращение роста определенных раковых клеток или даже клеточную смерть. Оперативное удаление эндокринных органов, такое как орхиэктомия и овариэктомия, также может применяться в качестве формы гормональной терапии.
Иммунотерапии представляют собой типы лечения, которые используют природные вещества или лекарственные средства, сделанные из природных веществ. Они стимулируют организм для воздействия на раковые клетки и для преодоления побочных эффектов, вызванных другими типами лечения рака. Иммунотерапии используют иммунную систему для устранения рака. Главная предпосылка заключается в стимулировании иммунной системы пациента для воздействия на злокачественные опухолевые клетки, которые ответственны за заболевание. Этого можно добиться или посредством иммунизации пациента, в случае чего собственная иммунная система пациента вырабатывает способность распознавать опухолевые клетки в виде мишеней, которые необходимо разрушить, или посредством введения терапевтических антител в виде лекарственных средств, в случае чего иммунная система пациента вовлекается в разрушение опухолевых клеток с помощью терапевтических антител.
Специалисту в данной области очевидно, что, не выходя за рамки смысла и сущности изобретения, могут быть произведены различные модификации и вариации в способах и фармацевтических композициях и в наборах реагентов по настоящему описанию. Таким образом, подразумевается, что настоящее описание охватывает модификации и вариации настоящего изобретения при условии, что они попадают в рамки сущности прилагаемой формулы изобретения и ее эквивалентов. Кроме того, следующие примеры прилагаются в целях иллюстрации заявленного изобретения и не должны рассматриваться как ограничение рамок сущности заявленного изобретения.
ПРИМЕРЫ
Пример 1
Методы: Группам голых мышей CD-1 подкожно трансплантировали человеческие клетки H460 немелкоклеточной карциномы легкого. Лечение инициировали, когда опухолевый рост достигал приблизительно 130 мм3. Лечение вводили 7 раз с частотой один раз каждые 4 дня, оно включало пустые носители, Пеметрексед, который давали внутрибрюшинно в дозе 200 мг/кг, Люкантон, который давали перорально в дозе 80 мг/кг, и комбинации Пеметрекседа и Люкантона в тех же дозах. За опухолевым ростом и изменением массы тела следили в течение 28 дней.
Результаты: Оба средства, Пеметрексед и Люкантон, ингибировали опухолевый рост относительно пустых носителей в течение 28 дней лечения. Для каждого лечения кратность увеличения размера опухоли составила 42, 28, 34 и 19 для пустых носителей, Пеметрекседа, Люкантона и комбинации Пеметрекседа и Люкантона, соответственно. По сравнению с группой лечения пустым носителем это обозначает 19%, 33% и 55% ингибирования роста для групп, подвергнутых лечению Люкантоном, Пеметрекседом и комбинацией Пеметрекседа и Люкантона, соответственно (Фиг.1). В течение 28-дневного периода изменения массы тела за исключением масс опухолей составило -2,9%, -0,9%, -6,1% и -1,7% для пустых носителей, Пеметрекседа, Люкантона и комбинации Пеметрекседа и Люкантона, соответственно. Эти данные по массе тела выявляют, что лечения переносились с минимальной общей токсичностью или в ее отсутствии.
Пример 2
Методы согласно Примеру 1, приведенному выше, могут использоваться для введений дважды в сутки, один раз утром и один раз вечером. Процедура суммирована в Таблице 1, приведенной ниже.
Внутрибрюшинно: Один раз в каждый 4-дневный цикл
Лечение может быть инициировано приблизительно через 10 дней после имплантации опухолевых клеток, когда средний размер опухоли составит приблизительно 100 мм3, и затем один раз каждые четыре дня. Объем дозировки может регулироваться один раз каждые четыре дня.
До тех пор, пока не указано по-другому, все цифры, выражающие количества ингредиентов, такие свойства, как молекулярная масса, условия реакции и так далее, используемые в описании и формуле изобретения, следует понимать как возможные для модификации во всех случаях с помощью термина «примерно». Соответственно, пока не указано противное, числовые параметры, представленные в описании и прикрепленной формуле изобретения, представляют собой приблизительные значения, которые могут варьироваться в зависимости от целевых свойств, которые необходимо получить с помощью настоящего изобретения. Самое меньшее, и не в качестве попытки ограничить доктрину заявки эквивалентов рамкам сущности формулы изобретения, каждый числовой параметр следует понимать, по меньшей мере, в свете значения представленной значащей цифры и путем применения обычных методов округления. Несмотря на то, что числовые интервалы и параметры, представляющие широкие рамки сущности изобретения, представляют собой приблизительные значения, числовые значения, представленные в определенных примерах, являются настолько точными, насколько возможно. Однако любое числовое значение по существу содержит определенные ошибки, всегда возникающие в результате стандартного отклонения, обнаруженного при их соответствующих тестирующих измерениях.
Использованные термины в единственном числе в контексте описания изобретения (особенно в контексте следующей формулы изобретения) следует понимать, как охватывающие и единственное и множественное число до тех пор, пока в настоящем документе не указано по-другому или очевидно не противоречит контексту. Перечисление интервалов значений в настоящем документе предназначено лишь для того, чтобы служить в качестве упрощенного метода индивидуального обозначения каждого отдельного значения, попадающего в интервал. До тех пор пока в настоящем документе не указано по-другому, каждое индивидуальное значение включено в описание, как если бы оно было индивидуально приведено там. Все методы, описанные в настоящем документе, могут быть представлены в любом подходящем порядке до тех пор, пока в настоящем документе не указано по-другому или очевидно не противоречит контексту. Использование любого и всех примеров или типичных фраз (например, «такой как»), предложенных в настоящем документе, предназначено всего лишь для лучшего освещения изобретения и не является ограничением рамок сущности изобретения, заявленного по-другому. Никакие фразы описания не следует понимать как указания на любой не заявленный элемент, существенный для практического осуществления изобретения.
Классификацию альтернативных элементов или воплощений изобретения, раскрытого в настоящем документе, не следует понимать как ограничение. Каждый член группы может быть обозначен и заявлен индивидуально или в комбинации с другими членами группы или другими элементами, которые находятся в настоящем документе. Понятно, что один или более членов группы могут быть включены в группы или удалены из них по причинам удобства и/или патентоспособности. Когда происходит любое такое включение или удаление, то считается, что описания содержит группу в модифицированном виде, отвечая, таким образом, письменному изложению всех групп формулы Маркуша, использованных в формуле изобретения.
Определенные воплощения настоящего изобретения описаны в настоящем документе, включая лучший способ осуществления изобретения, известный авторам изобретения. Безусловно, вариации этих описанных воплощений будут очевидны специалисту в данной области при чтении вышеизложенного описания. Авторы изобретения ожидают, что специалисты будут применять такие вариации по необходимости, и авторы изобретения подразумевают, что изобретение будет осуществлено на практике по-другому, чем конкретно приводится в настоящем описании. Соответственно, настоящее изобретение включает все модификации и эквиваленты объекта, приведенного в формуле изобретения, прилагаемой к настоящему описанию, как разрешенные применяемой правовой нормой. Кроме того, любая комбинация вышеописанных элементов во всех их возможных вариациях охвачена изобретением до тех пор, пока в настоящем документе не указано по-другому или очевидно не противоречит контексту.
Кроме того, на протяжении настоящей описании были сделаны многочисленные ссылки на патенты и печатные публикации. Каждая из цитированных выше ссылок и печатных публикаций индивидуально включена в настоящий документ в полном объеме с помощью ссылки.
В заключение следует понимать, что воплощения изобретения, раскрытого в настоящем документе, являются иллюстрацией принципов настоящего изобретения. Другие модификации, которые могут применяться, находятся в рамках сущности изобретения. Таким образом, в качестве примера, а не ограничения могут применяться альтернативные конфигурации настоящего изобретения согласно идее настоящего документа. Соответственно, настоящее изобретение не ограничено в точности тем, что продемонстрировано и описано.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИИ АНТИФОЛАТНОГО АГЕНТА В ЛЕЧЕНИИ РАКА | 2007 |
|
RU2423114C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S, 4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2006 |
|
RU2592231C2 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ ЭПОТИЛОНЫ И АНТИМЕТАБОЛИТЫ | 2003 |
|
RU2346686C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2015 |
|
RU2708374C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2006 |
|
RU2429838C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2010 |
|
RU2587013C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2006 |
|
RU2428983C2 |
| ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ С ПОМОЩЬЮ СОЕДИНЕНИЯ 4-ИОД-3-НИТРОБЕНЗАМИД В КОМБИНАЦИИ С ПРОТИВООПУХОЛЕВЫМИ СРЕДСТВАМИ | 2008 |
|
RU2480211C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2009 |
|
RU2531758C2 |
| СОКРИСТАЛЛЫ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2014 |
|
RU2675270C2 |
Группа изобретений относится к медицине, а именно к онкологии и может быть использована для лечения рака у млекопитающих, в частности рака легкого. Для этого млекопитающему вводят антиметаболит фолата - пеметрексед в сочетании с ингибитором апуриновой/апиримидиновой эндонуклеазы - люкантоном в терапевтически эффективных количествах. Предложены также фармацевтическая композиция, содержащая указанные компоненты и набор, включающий две фармацевтические композиции указанных компонентов. Такое сочетание конкретных препаратов указанных групп обеспечивает неочевидное повышение эффективности лечения рака легкого у млекопитающих. 3 н. и 15 з.п. ф-лы, 2 пр., 1 табл., 1 ил.
1. Способ лечения рака у млекопитающего, включающий введение млекопитающему люкантона и пеметрекседа (Pemetrexed), где указанный люкантон и указанный пеметрексед вводят в терапевтически эффективных количествах.
2. Способ по п.1, где указанный рак представляет собой рак легкого.
3. Способ по п.2, где указанный рак легкого представляет собой немелкоклеточную карциному легкого.
4. Способ по п.1, где указанные люкантон и пеметрексед вводят одновременно.
5. Способ по п.1, где указанные люкантон и пеметрексед вводят последовательно.
6. Способ по п.5, где каждый из указанных люкантона и пеметрекседа вводят в течение примерно трех часов.
7. Способ по п.5, где каждый из указанных люкантона и пеметрекседа вводят в течение примерно двух часов.
8. Способ по п.5, где каждый из указанных люкантона и пеметрекседа вводят в течение примерно одного часа.
9. Способ по п.1, где указанное терапевтически эффективное количество люкантона и указанное терапевтически эффективное количество пеметрекседа вводят однократной суточной дозой или поделены на более чем одну суточные дозы.
10. Способ по п.9, где указанная более чем, одна суточная доза представляет собой две суточные дозы.
11. Способ по п.1, где указанный люкантон и указанный пеметрексед вводят перорально.
12. Способ по п.1, где указанный люкантон и указанный пеметрексед вводят парентерально.
13. Способ по п.1, где указанный люкантон и указанный пеметрексед вводят в форме капсулы или таблетки.
14. Способ по п.1, где указанный люкантон и указанный пеметрексед вводят в течение одного или более циклов.
15. Способ по п.14, где указанный один цикл включает введение через каждые 4 дня 7 раз.
16. Способ по п.1, дополнительно включающий проведение лучевой терапии, гормональной терапии или иммунотерапии.
17. Фармацевтическая композиция для лечения рака у млекопитающего, включающая терапевтически эффективные количества люкантона и пеметрекседа (Pemetrexed) и фармацевтически приемлемый носитель.
18. Фармацевтический набор для лечения рака у млекопитающего, включающий: фармацевтическую композицию, включающую терапевтически эффективное количество люкантона и фармацевтически приемлемый носитель, и фармацевтическую композицию, включающую терапевтически эффективное количество пеметрекседа (Pemetrexed) и фармацевтически приемлемый носитель.
| ГУТУРОВ С.Л., Современные позиции гемцитабина и пеметрекседа в лечении немелкоклеточного рака легкого, 2006, найдено из интернет: http://netoncology.ru/press/articles/673/674/ | |||
| US 6391911 B1 (BASES ROBERT E.), 21.05.2002 | |||
| WO 2007071970 A2 (ASTRAZENECA AB), 28.06.2007 | |||
| US 6562363 B1 (NOVEN PHARMA), 13.05.2003 | |||
| БИОАДГЕЗИВНАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ), СПОСОБ ЕЕ ПОЛУЧЕНИЯ (ВАРИАНТЫ), УСТРОЙСТВО ДЛЯ ДОСТАВКИ ЧЕРЕЗ СЛИЗИСТУЮ ОБОЛОЧКУ АКТИВНОГО АГЕНТА, СПОСОБ ПРОЛОНГИРОВАННОГО МЕСТНОГО ВВЕДЕНИЯ ОДНОГО ИЛИ БОЛЕЕ АКТИВНЫХ АГЕНТОВ СУБЪЕКТУ (ВАРИАНТЫ) И СПОСОБ СОКРАЩЕНИЯ ВРЕМЕНИ, ТРЕБУЕМОГО ДЛЯ ПРИКЛЕИВАНИЯ КОМПОЗИЦИИ К СЛИЗИСТОЙ ТКАНИ | 1998 |
|
RU2234337C2 |
Авторы
Даты
2014-05-20—Публикация
2009-02-20—Подача