Область изобретения
Настоящее изобретение относится к способам ингибирования роста опухоли, повышения выживаемости пациента, страдающего опухолевым заболеванием, и индуцирования защиты от рецидива опухоли у млекопитающих. Данные способы включают введение гуманизированных моноклональных антител, включающих CDR-области (гипервариабельные участки, определяющие комплементарность), полученные из моноклонального антитела мыши, обозначенного mBAT-1, в сочетании по меньшей мере с одним химиотерапевтическим агентом.
Предпосылки создания изобретения
За последние годы быстрое развитие знаний о молекулярных и клеточных основах иммунной регуляции, в частности, относительно уровня Т-клеточного ответа обеспечивает новый арсенал иммунотерапевтических подходов, включая разработку противоопухолевых вакцин. Обнаружено, что отдельные моноклональные антитела обладают иммуномодулирующей активностью, включая способность связывать детерминанты на поверхности Т-клеток и индуцировать пролиферацию, активацию, созревание или дифференцировку этих клеток.
ВАТ (также называемое mBAT-1 или ВАТ-1) представляет собой моноклональное антитело мыши против мембранного препарата клеточной линии лимфомы Беркитта (линия Дауди), которое обладает противоопухолевым и иммуностимулирующим действием на различные виды опухолей (Hardy с сотр., 2001, Int. J. Oncol. 19:897). Данное моноклональное антитело первоначально было описано Hardy с сотр. в патенте США №5,897,862. ВАТ-1 секретируется клеточной линией гибридомы с номером I-1397 базы CNCM.
Полинуклеотидная и аминокислотная последовательности ВАТ мыши описаны Hardy с сотр. в WO 00/58363 и в публикации патента США №2003/0026800. Ряд гуманизированных моноклональных антител на основе ВАТ мыши описаны в публикации патента США №2008/0025980. В соответствии с данным описанием гуманизированное моноклональное антитело ВАТ индуцирует более выраженное противоопухолевое действие, чем исходное (материнское) антитело ВАТ мыши. Среди многих протестированных модельных систем противоопухолевую активность ВАТ изучали с использованием SCID-мышей (тяжелый комбинированный иммунодефицит - ТКИД), beige мышей, которые являются дефицитными по NK-клеткам, и nude мышей, которые являются дефицитными по Т-клеткам (Hardy В., 1997, Proc. Natl. Acad. Sci. USA 94:5756). Всем мышам вводили внутривенно клетки меланомы В16 мыши, из которых впоследствии развивались опухолевые образования в легких. ВАТ оказывал противоопухолевое действие только у SCID-мышей, которым прививали лимфоциты мыши или человека. У бестимусных nude мышей и beige мышей ВАТ проявлял противоопухолевую активность, хотя эта активность была менее эффективной по сравнению с противоопухолевой активностью ВАТ у мышей дикого типа.
Иммуномодулирующее действие ВАТ мыши также изучали in vitro. BAT мыши активирует CD4+ Т-клетки и индуцирует секрецию IFN-γ данными клетками (Hardy с сотр., 2000, bit. Immunol. 12:1623 и Quaglino E. с сотр, 2005, Vaccine 9:23(25):3280-7, соответственно). Кроме того, было показано, что ВАТ запускает пролиферацию Т-клеток и повышает их цитолитическую активность (Hardy В. с сотр., 1997, Hum. Antibodies, 8:95).
Berger с сотр. (2008) предложил введение гуманизированного моноклонального антитела СТ-011, которое основано на mBAT-1, пациентам, страдающим запущенными гемобластозами, и соответсвующую фармакокинетику (Berger с сотр. din. Cancer Res., 2008; 14(10) 15 мая 2008 года).
Следует принимать во внимание, что мишенью антител ВАТ являются не опухолевые клетки, а скорее иммунные клетки субъекта или пациента, чтобы модулировать иммунный ответ благоприятным образом.
Одним из самых распространенных способов терапевтического лечения рака является химиотерапия. Лекарственные препараты для химиотерапии разделяют на несколько групп в зависимости от оказываемого действия на специфические химические соединения внутри раковых клеток, активность клеток или вовлекаемые процессы, или на специфические фазы клеточного цикла. Группы препаратов для химиотерапии включают: алкилирующие агенты, производные нитрозомочевины, антиметаболиты, антрациклиновые соединения, ингибиторы топоизомеразы I и II, митотические ингибиторы и стероидные ингибиторы.
Химиотерапевтический лекарственный препарат может обеспечиваться в качестве отдельной терапии, (монотерапии), но чаще всего используют в комбинации с одним или более другими активными агентами. В некоторых случаях специфические комбинации препаратов были адаптированы для обеспечения значительно более высоких клинических результатов. Например, антиметаболит фторурацил (5-ФУ) и алкилирующий агент оксалиплатин используют в комбинации для лечения рака ободочной и прямой кишки (колоноректального). Комбинированная терапия фторурацилом, лейковорином (фолиниевая кислота) и оксалимлатином также предназначена для лечения рака ободочной и прямой кишки и имеет аббревиатуру FOLFOX. Комбинированную терапию циклофосфамидом, доксорубицином, винкристином и преднизолоном (имеет аббревиатуру CHOP) используют для лечения неходжкинской лимфомы, а комбинацию CHOP и химерного моноклонального антитела ритуксимаб (имеет аббревиатуру R-CHOP) используют для лечения диффузной крупноклеточной В-клеточной лимфомы и других злокачественных B-клеточных неходжкинских лимфом.
Комбинированная терапия урацилом, 5-ФУ или урамустином совместно с облучением (радиационной терапией) и терапией моноклональным антителом, которое специфически связывается с внеклеточным доменом рецептора фактора роста эндотелия сосудов (VEGF), описана в патенте США №6,811,779. Такая комбинированная терапия направлена на ингибирование ангиогенеза. В патенте США №6,217,866 описан способ подавления роста клеток опухоли человека, экспрессирующих рецепторы фактора роста эпидермиса человека (EGF), включающий введение пациенту с раковым заболеванием, имеющего указанные клетки опухоли, эффективного количества антинеопластического (противоопухолевого) агента и эффективного количества моноклонального антитела; (i) причем указанное антитело связывается с внеклеточным доменом рецептора EGF человека указанных клеток опухоли; (ii) причем антитело не конъюгировано с антинеопластическим агентом; и (iii) причем антитело подавляет связывание EGF с рецептором EGF.
В уровне техники полностью отсутствуют рекомендации или предположения относительно того, что использование гуманизированного моноклонального антитела mBAT-1 в комбинации с химиотерапией может быть полезным. Фактически, поскольку известно, что ВАТ и антитела на его основе обладают иммуностимулирующими свойствами, удивительно и неожиданно, что такие антитела в комбинации с цитотоксическими или другими химиотерапевтическими агентами, действие которых заключается в уничтожении пролиферирующих клеточных популяций, могут быть использованы для достижения более высокой клинической эффективности, чем любой из агентов в отдельности.
Краткое описание изобретения
Настоящее изобретение обеспечивает способы ингибирования роста опухоли, уменьшения объема опухоли, повышения выживаемости субъекта и индуцирования защиты от рецидива опухоли у субъектов, имеющих солидные и несолидные опухоли. Данные способы включают использование гуманизированного моноклонального антитела, содержащего по меньшей мере один гипервариабельный участок, определяющий комплементарность (CDR) моноклонального антитела BAT-1 (mBAT-1) мыши и каркасного участка (FR), полученного из акцепторного иммуноглобулина человека. Примером подобного антитела является hBAT-1 (также называемое здесь СТ-011). Некоторые из способов, описанных в данном документе, предпочтительно включают использование гуманизированного моноклонального антитела в комбинации по меньшей мере с одним химиотерапевтическим агентом, тогда как другие способы, описываемые в данном документе, относятся к использованию собственно гуманизированного моноклонального антитела, но которое может быть использовано в комбинации с одним или более химиотерапевтическими агентами.
Принципы настоящего изобретения изложены в данном документе с использованием как mBAT-1, так и СТ-011 в культурах лимфоцитов и на моделях опухоли животных и при действии СТ-011 на человека с различными типами гематологических опухолей.
Настоящее изобретение частично основано на неожиданно обнаруженном факте, что включение СТ-011 в схему лечения различными химиотерапевтическими агентами приводит к некоторым полезным противоопухолевым и противораковым эффектам, включая, например, снижение скорости роста опухоли, ингибирование роста опухоли и увеличение времени выживаемости по сравнению с монотерапией любым из способов лечения отдельно. Также было обнаружено, что включение гуманизированного антитела, такого как СТ-011, в схему химиотерапевтического лечения может обеспечить дополнительный полезный эффект, заключающийся в повышении переносимости уровней дозолимитирующей токсичности (ДЛТ) химиотерапевтического агента.
Настоящее изобретение также частично основано на наблюдении, что лечение индуцированных опухолей в животных моделях заявленными антителами, используемых отдельно или в комбинации с химиотерапевтическими агентами, приводит не только к "исцелению", но также к возникновению эффекта памяти (запоминания) для продолжительной защиты от рецидива опухоли при последующем поражении такими опухолевыми клетками. Животные, вылеченные с использованием гуманизированного антитела СТ-011, оказались, таким образом, устойчивыми к рецидиву или повторному проявлению данной опухоли. Более того, в настоящее время описано, что в определенных обстоятельствах у людей, которые принимали участие на ранних этапах клинических исследований с использованием СТ-011, также наблюдался длительный контроль опухоли и защитные эффекты после введения однократной дозы данного антитела и его элиминации из системы кровотока.
Не основываясь на какой-либо теории или механизме действия, активность гуманизированного моноклонального антитела ВАТ в отношении защиты от рецидива опухоли или ее развития может быть связана с активностью данного антитела по защите эффекторных Т-клеток / Т-клеток памяти от апоптоза, как описано в данном документе и пояснено на примере антитела СТ-011.
Таким образом, в различных аспектах настоящее изобретение обеспечивает комбинации противоопухолевых агентов, неизвестные до настоящего времени в качестве обладающих кумулятивным или даже аддитивным эффектом. В соответствии с определенными принципами настоящего изобретения указанные комбинации включают один вариант лечения, представляющий собой введение по меньшей мере одного химиотерапевтического агента, и другой вариант лечения, представляющий собой введение иммуностимулирующего гуманизированного моноклонального антитела, основанного на mBAT-1. Неожиданно проведение указанных двух вариантов лечения обеспечивает больший полезный противоопухолевый эффект при их использовании в комбинации, а не раздельно или при использовании каждого из них по отдельности. Комбинированная терапия, как показано в описании и формуле изобретения может относиться к любому числу различных комбинированных вариантов лечения, включая, например, по существу перекрывающиеся периоды применения двух или более вариантов лечения; одновременное, последовательное или поочередное применение двух или более вариантов лечения или регулярное применение двух или более вариантов лечения в течение переменных периодов времени.
В соответствии с первым аспектом настоящее изобретение обеспечивает способ лечения опухоли, включающий (i) введение субъекту, нуждающемуся в таком лечении, эффективного количества гуманизированного моноклонального антитела или его фрагмента, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши, и каркасный участок (FR) из акцепторного иммуноглобулина человека, или их модификации; и (ii) введение субъекту эффективного количества по меньшей мере одного химиотерапевтического агента; таким образом обеспечивая лечение опухоли.
В соответствии с другим аспектом настоящее изобретение также обеспечивает способ улучшения переносимости по меньшей мере одного химиотерапевтического агента, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества гуманизированного моноклонального антитела или его фрагмента, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши, и каркасный участок (FR) из акцепторного иммуноглобулина человека или их модификации; причем указанный субъект подвергается химиотерапии по меньшей мере с одним химиотерапевтическим агентом; таким образом обеспечивая улучшение переносимости указанного химиотерапевтического агента.
В соответствии с еще одним аспектом настоящего изобретения обеспечивается способ увеличения выживаемости или подавления (ингибирования) прогрессирования заболевания у субъекта, имеющего опухоль, причем указанный субъект подвергается лечению по меньшей мере одним химиотерапевтическим агентом, где указанный способ включает введение эффективного количества гуманизированного моноклонального антитела или его фрагмента, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши, и каркасный участок (FR) из акцепторного иммуноглобулина человека или их модификации; таким образом обеспечивая увеличение выживаемости указанного субъекта.
В соответствии с еще одним аспектом настоящее изобретение обеспечивает способ снижения или предотвращения рецидива опухоли, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества гуманизированного моноклонального антитела или его фрагмента, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши, и каркасный участок (FR) из акцепторного иммуноглобулина человека или их модификации; таким образом обеспечивая снижение или предотвращение рецидива опухоли.
В соответствии с одним вариантом осуществления изобретения указанный способ снижения или предотвращения рецидива опухоли дополнительно включает введение субъекту по меньшей мере одного химиотерапевтического агента.
В соответствии с другими вариантами осуществления изобретения субъект подвергается или закончил курс химиотерапии с применением по меньшей мере одного химиотерапевтического агента.
В соответствии с различными вариантами осуществления изобретения вариабельный участок легкой цепи гуманизированного моноклонального антитела описывается формулой:
FRL1-CDRL1-FRL2-CDRL2-FRL3-CDRL3-FRL4,
где каждый FR независимо представляет собой каркасный участок антитела человека и каждый CDR независимо представляет собой участок, определяющий комплементарность моноклонального антитела mBAT-1.
В соответствии с другими вариантами осуществления изобретения вариабельный участок тяжелой цепи гуманизированного моноклонального антитела описывается формулой:
FRH1-CDRH1-FRH2-CDRH2-FRH3-CDRH3-FRH4,
где каждый FR независимо представляет собой каркасный участок антитела человека и каждый CDRнезависимо представляет собой участок, определяющий комплементарность моноклонального антитела mBAT-1.
В соответствии с другими вариантами осуществления изобретения FR-участки получены из вариабельных участков легкой цепи антитела Т9 человека (SEQ ID NO:130) или его модификации.
В соответствии с другими вариантами осуществления изобретения аминокислотные последовательности FR, полученные или модифицированные из вариабельного участка легкой цепи антитела TEL9 человека, выбраны из группы, состоящей из: FRL1, [EIVLT QSPSS LSASV GDRVT ITC; SEQ ID NO:1]; FRL2, [W (F или Y) QQKPG KAPKL (W или L) IY; SEQ ID NO:2]; FRL3, [GVPSR FSGSG SGT (D или S) (Y или F) (С или Т) LTINS LQPED FATYY C; SEQ ID NO:3]; и FRL4, [FGGGT KLEIK; SEQ ID NO:4].
В соответствии с другими вариантами осуществления изобретения FR получены из вариабельных участков тяжелой цепи антитела hsighv1295 человека (SEQ ID NO:146) или их модификаций.
В соответствии с другими вариантами осуществления изобретения аминокислотные последовательности FR, полученные или модифицированные из вариабельного участка тяжелой цепи антитела hsighvl295 человека, выбраны из группы, состоящей из: FRH1, [Q (I или V) QLV QSGSE LKKPG ASVKI SCKAS GY (Т или S) F (Т или S); SEQ ID NO:5]; FRH2, [WV (R OR K) QAPGQ GL (Q или K) WMG; SEQ ID NO:6]; FRH3, [RF (V или A) FSLDT SV (N или S) TAYLQ ITSL (Т или N) AEDTG MYFC (V или A) (R или K); SEQ ID NO:7]; и FRH4, [WGQGT LVTVS S; SEQ ID NO:8].
В соответствии с другими вариантами осуществления изобретения вариабельный участок легкой цепи включает по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из: CDRL1 [SARSS VSYMH; SEQ ID NO:9]; CDRL2 [RTSNL AS; SEQ ID NO:10]; CDRL3 [QQRSS FPLT; и SEQ ID NO:11], причем CDR получены из антитела BAT-1, мыши и нижние индексы "L" и "Н" обозначают участки легких и тяжелых цепей соответственно.
В соответствии с другими вариантами осуществления изобретения вариабельный участок тяжелой цепи включает по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из: CDRH1 [NYGMN; SEQ ID NO:12]; CDRH2 [WINTD SGEST YAEEF KG; SEQ ID NO:13]; и CDRH3 [VGYDA LDY; SEQ ID NO:14].
В соответствии с другими вариантами осуществления изобретения гуманизированное антитело включает вариабельный участок легкой цепи, выбранный из группы, состоящей из: BATRκA (SEQ ID NO:15), BATRκB (SEQ ID NO:16), BATRκC (SEQ ID NO:17), и BATRκD (SEQ ID NO:18); и вариабельный участок тяжелой цепи, выбранный из группы, состоящей из: А (SEQ ID NO:20), BATRHB (SEQ ID NO:21), BATRHC (SEQ ID NO:22), BATRHD (SEQ ID NO:23) и BATRHE (SEQ ID NO:24).
В соответствии с другими вариантами осуществления изобретения гуманизированное антитело включает вариабельные участки, выбранные из группы, состоящей из: BATRHA/BATRκA (SEQ ID NO:20/SEQ ID NO:15), BATRHB/BATRκA (SEQ ID NO:21/SEQ ID NO:15), BATRHB/BATRκB (SEQ ID NO:21/SEQ ID NO:16), BATRHC/BATRκB (SEQ ID NO:22/SEQ ID NO:16), BATRHB/BATRκD (SEQ ID NO:21/SEQ ID NO:18) и BATRHC/BATRκD (SEQ ID NO:22/SEQ ID NO:18).
В соответствии с другими предпочтительными вариантами осуществления изобретения вариабельные участки гуманизированного моноклонального антитела соответствуют BATRHC/BATRκD (SEQ ID NO:22/SEQ ID NO:18).
В соответствии с другими вариантами осуществления изобретения противоопухолевая активность гуманизированного антитела или его фрагмента аналогична или превосходит активность mBAT-1.
В соответствии с другими вариантами осуществления изобретения фрагмент гуманизированного антитела выбирают из группы, состоящей из: Fv, F(ab'), F(ab')2 и одноцепочечного антитела.
Гуманизированное моноклональное антитело согласно настоящему изобретению, предпочтительно получают с использованием технологии рекомбинантной ДНК, применяя CDR-привитие (grafting). Соответственно, гуманизированное антитело получают путем экспрессии полинуклеотидов, причем полинуклеотиды могут кодировать гуманизированное антитело полностью или вариабельный участок легкой цепи, или вариабельный участок тяжелой цепи, или вариабельные участки обеих цепей гуманизированного антитела. Кроме того, гуманизированное антитело может экспрессироваться в клетках-хозяевах после ко-трансфекции различных векторов, каждый из которых включает полинуклеотиды, кодирующие легкую или тяжелую цепь, или после трансфекции одного вектора, включающего обе полинуклеотидные последовательности легкой и тяжелой цепи.
В соответствии с другими вариантами осуществления изобретения легкая цепь гуманизированного антитела кодируется полинуклеотидной последовательностью, выбранной из группы, состоящей из: SEQ ID NO:87, SEQ ID NO:88 и SEQ ID NO:89.
В соответствии с другими вариантами осуществления изобретения тяжелая цепь гуманизированного антитела кодируется полинуклеотидной последовательностью, выбранной из группы, состоящей из: SEQ ID NO:90, SEQ ID NO:91, и SEQ ID NO:92.
В соответствии с другими вариантами осуществления изобретения по меньшей мере один химиотерапевтический агент выбирают из следующей группы: антиметаболиты, лекарственные средства на основе платины, митотические ингибиторы, антрациклиновые антибиотики, ингибиторы топоизомеразы, антиангиогенные агенты и их комбинации.
В соответствии с предпочитаемым в настоящее время вариантом осуществления изобретения по меньшей мере один химиотерапевтический агент выбирают таким образом, что hBAT-1 повышает выживаемость лимфоцитов при использовании в комбинации с указанным химиотерапевтическим агентом. Обычно повышенная или улучшенная выживаемость может быть удобным образом проанализирована in vitro, как показано далее на примерах.
В соответствии с некоторыми вариантами осуществления изобретения по меньшей мере один химиотерапевтический агент представляет собой антиметаболит, включая антагонисты пуринов, антагонисты пиримидинов и антагонисты фолатов. В соответствии с некоторыми вариантами осуществления изобретения указанный антиметаболит представляет собой антагонист пиримидина. В соответствии с некоторыми вариантами осуществления изобретения антиметаболит выбирают из группы, включающей 5-фторурацил, урамустин, урацил, капецитабин, 6-меркаптопурин, метотрексат, гемцитабин, цитарабин, флударабин и пеметрексед.
В соответствии с некоторыми вариантами осуществления изобретения по меньшей мере один химиотерапевтический агент представляет собой 5-фторурацил.
В соответствии с некоторыми вариантами осуществления изобретения по меньшей мере один химиотерапевтический агент представляет собой цитарабин.
В соответствии с некоторыми вариантами осуществления изобретения по меньшей мере один химиотерапевтический агент представляет собой лекарственное средство на основе платины, выбранное из группы, включающей ципластин, карбоплатин и оксалиплатин.
В соответствии с другими дополнительными вариантами осуществления изобретения по меньшей мере один химиотерапевтический агент представляет собой митотический ингибитор, выбранный из группы, включающей паклитаксел, доцетаксел, этопозид, винбластин, винкристин и виноребин.
В соответствии с другими дополнительными вариантами осуществления изобретения по меньшей мере один химиотерапевтический агент представляет собой антрациклиновый антибиотик, выбранный из группы, включающей даунорубицин, респиномицин D и идарубицин.
В соответствии с некоторыми вариантами осуществления изобретения по меньшей мере один химиотерапевтический агент представляет собой антиангиогенный агент, выбранный из группы, включающей бевацизумаб, допамин, тетратиомолибдат и антиангиогенные варианты VEGF.
В соответствии с некоторыми вариантами осуществления изобретения по меньшей мере один химиотерапевтический агент не является ингибитором топоизомеразы I. В соответствии с некоторыми вариантами осуществления изобретения по меньшей мере один химиотерапевтический агент не является алкилирующим агентом.
В соответствии с другими вариантами осуществления изобретения введение гуманизированного антитела и по меньшей мере одного химиотерапевтического агента осуществляют по существу одновременно, параллельно, альтернативно, последовательно или поочередно. При некоторых вариантах осуществления изобретения гуманизированное антитело и по меньшей мере один химиотерапевтический агент вводят в соответствии с перекрывающимися режимами применения.
В соответствии с некоторыми вариантами осуществления изобретения введение гуманизированного антитела осуществляют до первоначального введения по меньшей мере одного химиотерапевтического агента.
В соответствии с другими вариантами осуществления изобретения введение одного из или обоих препаратов - гуманизированного антитела и по меньшей мере одного химиотерапевтического агента - осуществляют по одному из следующих способов, выбранных из следующей группы: внутривенно, перорально, внутрибрюшинно, подкожно, путем изолированной перфузии конечностей, путем инфузии внутрь органа или их комбинаций.
В соответствии с другими вариантами осуществления изобретения способы дополнительно включают лечение субъекта посредством радиационной терапии (облучение). В соответствии с различными вариантами осуществления изобретения указанные способы включают введение гуманизированного антитела, введение по меньшей мере одного химиотерапевтического агента и радиационной терапии.
В соответствии с некоторыми вариантами осуществления изобретения введение гуманизированного антитела, введение по меньшей мере одного химиотерапевтического агента и применение радиационной терапии осуществляют по существу одновременно, параллельно, альтернативно, поочередно или в соответствии с перекрывающимися режимами применения.
В некоторых вариантах осуществления изобретения способы согласно изобретению дополнительно включают оценку по меньшей мере одного параметра, выбранного из следующей группы, включающей: скорость роста опухоли, объем опухоли, число метастазов, рецидив опухоли и их комбинации.
При некоторых вариантах осуществления изобретения опухоль является солидной или несолидной. При некоторых вариантах осуществления изобретения несолидная опухоль представляет собой гематобластозы. В некоторых вариантах осуществления изобретения опухоль относится к одному из следующих заболеваний: колоректальная карцинома; немелкоклеточный рак легких (НМРЛ); мелкоклеточный рак легких (МРЛ); карцинома молочной железы; меланома; карцинома яичников; карцинома шейки матки; рак поджелудочной железы; карцинома головы и шеи; карцинома желудочно-кишечного тракта; рак пищевода; печеночноклеточная карцинома; множественная миелома; почечноклеточная карцинома; рак простаты; неходжкинская лимфома; болезнь Ходжкина (лимфогранулематоз); лимфома из клеток мантийной зоны; саркома Капоши; плоскоклеточная карцинома; базальноклеточная карцинома; острая миелоидная лейкемия (ОМЛ); хронический миелоидный лейкоз (ХМЛ); острый лимфоцитарный лейкоз (ОЛЛ) и хронический лимфоцитарный лейкоз (ХЛЛ).
В соответствии с различными вариантами осуществления изобретения субъект представляет собой человека или млекопитающее, отличное от человека. В соответствии с различными предпочитаемыми вариантами осуществления изобретения субъектом является человек.
В дополнительном аспекте настоящее изобретение обеспечивает использование (i) гуманизированного моноклонального антитела или его фрагмента, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши и каркасный участок (FR) из акцепторного иммуноглобулина человека, или их модификаций; и (ii) по меньшей мере один химиотерапевтический агент; для приготовления медикамента для лечения опухолей.
В другом аспекте настоящее изобретение обеспечивает гуманизированное моноклинальное антитело или его фрагмент, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши и каркасный участок (FR) из акцепторного иммуноглобулина человека, или их модификаций; для лечения опухоли у субъекта, подвергнутого химиотерапии с применением по меньшей мере одного химиотерапевтического агента.
В другом аспекте настоящее изобретение обеспечивает использование гуманизированного моноклонального антитела или его фрагмента, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши и каркасный участок (FR) из акцепторного иммуноглобулина человека, или их модификаций, для приготовления медикамента для улучшения переносимости по меньшей мере одного химиотерапевтического агента у субъекта, подвергнутого химиотерапии с применением указанного по меньшей мере одного химиотерапевтического агента.
В дополнительном аспекте настоящее изобретение обеспечивает гуманизированное моноклональное антитело или его фрагмент, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши и каркасный участок (FR) из акцепторного иммуноглобулина человека, или их модификаций, для улучшения переносимости по меньшей мере одного химиотерапевтического агента у субъекта, подвергнутого химиотерапии с применением указанного по меньшей мере одного химиотерапевтического агента.
Согласно другому аспекту настоящее изобретение обеспечивает использование гуманизированного моноклонального антитела или его фрагмента, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши и каркасный участок (FR) из акцепторного иммуноглобулина человека, или их модификаций, для приготовления медикамента для улучшения (увеличения) выживаемости или подавления прогрессирования заболевания у субъекта, имеющего опухоль, причем субъект подвергается воздействию по меньшей мере одного химиотерапевтического агента.
Согласно другому аспекту настоящее изобретение обеспечивает гуманизированное моноклональное антитело или его фрагмент, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши и каркасный участок (FR) из акцепторного иммуноглобулина человека, или их модификаций, для улучшения выживаемости или подавления развития заболевания у субъекта, имеющего опухоль, причем субъект подвергается воздействию по меньшей мере одного химиотерапевтического агента.
В соответствии с другим аспектом настоящее изобретение обеспечивает использование гуманизированного моноклонального антитела или его фрагмента, причем антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность моноклонального антитела ВАТ (mBAT-1) мыши и каркасный участок (FR) из акцепторного иммуноглобулина человека, или их модификаций; для приготовления медикамента для снижения или предотвращения рецидива опухоли.
В соответствии с другим аспектом настоящее изобретение обеспечивает гуманизированное моноклональное антитело или его фрагмента, причем указанное антитело или его фрагмент имеет по меньшей мере один участок, определяющий комплементарность, моноклонального антитела ВАТ (mBAT-1) мыши и каркасный участок (FR) из акцепторного иммуноглобулина человека, или их модификаций; для снижения или предотвращения рецидива опухоли.
При некоторых вариантах осуществления изобретения субъект был подвергнут, подвергается или будет подвергнут химиотерапии с применением по меньшей мере одного химиотерапевтического агента.
Краткое описание фигур
На фигуре 1 показано влияние hBAT-1 в анализе, основанном на жизнеспособности лимфоцитов при добавлении к культурам параллельно с контрольным опытом со средой (серые столбцы) или в комбинации с 5-ФУ (0,5 мг/мл, белые столбцы) и последующего инкубирования в течение 72 часов. Фиг.1А. Активность hBAT-1 (0,5 или 0,75 мкг/мл, как указано) в отсутствие и в присутствии 5-ФУ, представленная как % разность выживаемости клеток. Фиг.1В. Активность hBAT-1 (0,75 мкг/мл) в отсутствие и в присутствии 5-ФУ, выраженная площадью под кривой эффекта дозы (AUC, представленной как % разность × мкг/мл). Время инкубирования с hBAT-1 (72 часа) указано по оси X. Фиг.1C. Влияние 5-ФУ или контрольной среды при проведении функционального теста, представленное в числе жизнеспособных клеток/мл. Время инкубации с 5-ФУ или контрольной средой (72 часа) указано по оси X.
На фигуре 2 показано влияние hBAT-1 в анализе, основанном на жизнеспособности лимфоцитов при добавлении к культурам за 24 часа перед добавлением контрольной среды (серые столбцы) или 5-ФУ (0,5 мг/мл, белые столбцы) и последующего инкубирования в течение 72 часов. Фиг.2А. Активность hBAT-1 (0,5 или 0,75 мкг/мл как указано) в отсутствие и в присутствии 5-ФУ, представленная как % разность выживаемости клеток. Фиг.2В. Активность hBAT-1 (0,75 мкг/мл) в отсутствие и в присутствии 5-ФУ, представленная площадью под кривой эффекта дозы (AUC, представленная как % разность × мкг/мл). Время инкубирования с hBAT-1 (72 часа) указано по оси X.
На фигуре 3 показано влияние hBAT-1 в анализе, основанном на жизнеспособности лимфоцитов при параллельном добавлении к культурам с контрольной средой (серые столбцы) или в комбинации с SN-38 (активная форма иринотекана в концентрации 0,1 мг/мл, белые столбцы) и последующего инкубирования в течение 72 часов. Фиг.3А. Активность hBAT-1 (0,5 или 0,75 мкг/мл как указано) в отсутствие и в присутствии SN-38, представленная как % разность выживаемости клеток. Фиг.3В. Активность hBAT-1 (0,75 мкг/мл), выраженная площадью под кривой эффекта дозы (AUC, представленная как % разность × мкг/мл). Время инкубирования с hBAT-1 (72 часа) указано по оси X.
На фигуре 4 показано влияние hBAT-1 в анализе, основанном на жизнеспособности лимфоцитов при добавлении к культурам за 24 часа перед добавлением контрольной среды (серые столбцы) или SN-38 (активная форма иринотекана в концентрации 0,1 мг/мл, белые столбцы) и инкубировании в течение 72 часов. Фиг.4А. Активность hBAT-1 (0,5 или 0,75 мкг/мл как указано) в отсутствие и в присутствии SN-38, представленная как % разность выживаемости клеток. Фиг.4В. Активность hBAT-1 (0,75 мкг/мл), выраженная площадью под кривой эффекта дозы (AUC, представленная как % разность × мкг/мл). Время инкубирования с hBAT-1 (72 часа) указано по оси X.
На фигуре 5 показано влияние hBAT-1 в анализе, основанном на жизнеспособности лимфоцитов при добавлении к культурам (в дозозависимых концентрациях от 0,25 до 1,25 мкг/мл) параллельно (Фиг.5А) или за 24 часа (Фиг.5В) перед добавлением контрольной среды (серые столбцы) или указанного химиотерапевтического агента (белые столбцы) и инкубировании в течение 72 часов. Цис, циспластин (10 мкг/мл); Окса, оксалиплатин (10 мкг/мл); Такс, паклитаксел (0,43 мкг/мл); Дак, дакарбазин (1 мкг/мл). Активность hBAT-1 представлена как площадь под кривой эффекта дозы (AUC, представленная как % разность × мкг/мл). Время инкубирования с hBAT-1 (72 часа) указано по оси X.
На фигуре 6 показано влияние hBAT-1 (0,75 или 1 мкг/мл, как указано) в анализе, основанном на жизнеспособности лимфоцитов при параллельном добавлении к культурам с контрольной средой (черные столбцы) или в комбинации с химиотерапевтическим агентом (белые столбцы) и инкубировании в течение 72 часов. Были использованы следующие химиотерапевтические агенты: цитарабин в концентрации 2 мг/мл (Фиг.6А), циклофосфамид в концентрации 1 мг/мл (Фиг.6В) и доксорубицин в концентрации 0,03 мг/мл (Фиг.6С). Активность hBAT-1 представлена как % разность клеточной выживаемости.
На фигуре 7 показано влияние hBAT-1 в анализе, основанном на жизнеспособности изолированных CD4+ лимфоцитов человека при добавлении (в концентрации 0,75 мкг/мл) за 24 часа до добавления контрольной среды (черные столбцы) или химиотерапевтического агента (белые столбцы) и инкубировании в течение 72 часов. Были использованы следующие химиотерапевтические агенты: 5-ФУ в концентрации 1 мкг/мл (Фиг.7А) и цисплатин в концентрации 10 мкг/мл (Фиг.7В). Активность hBAT-1 представлена как % разность клеточной выживаемости.
На фигуре 8 показано противоопухолевое действие среды у мышей с колоректальной аденокарциномой (CRC) (черные кружки); 5-ФУ (введение 20 мг/кг в дни 6-9 и 15-16; белые квадраты); hBAT-1 (введение 10 мкг/мышь на 10 день; черные квадраты); и комбинированной схемы применения (белые кружки) hBAT-1 (введение 10 мкг/мышь на 10 день) и 5-ФУ (введение 20 мг/кг в дни 6-9 и 15-16).
На фигуре 9 показано противоопухолевое действие 5-ФУ у CRC мышей (введение 20 мг/кг в дни 6-9, 15-17, 22-24 и 29-31; белые квадраты) и комбинированной схемы применения (белые треугольники) hBAT-1 (введение 10 мкг/мышь в дни 10, 18 и 25) и 5-ФУ (введение 20 мг/кг в дни 6-9, 15-17, 22-24 и 29-31).
На фигуре 10 показан процент выживаемости CRC мышей при использовании для лечения среды (белые кружки); 5-ФУ (введение 20 мг/кг в дни 6-9, 15-17, 22-24, 29-31, 36-38 и 43-45; черные треугольники); hBAT-1 (введение 10 мкг/мышь в дни 10, 18, 25, 32 и 39; черные квадраты); и комбинированной схемы применения (черные ромбы) hBAT-1 (введение 10 мкг/мышь в дни 10, 18, 25, 32 и 39) и 5-ФУ (введение 20 мг/кг в дни 6-9, 15-17, 22-24, 29-31, 36-38 и 43-45).
На фигуре 11 показан процент выживаемости мышей, которым сделана инъекция клеток меланомы В 16 и проведено лечение 5-ФУ (введение 50 мг/кг в дни 1-4 и 7-8; черные ромбы) или при лечении по комбинированной схеме применения (белые квадраты) hBAT-1 (введение 10 мкг/мышь на день 10) и 5-ФУ (введение 50 мг/кг в дни 1-4 и 7-8).
На фигуре 12 показано противоопухолевое действие, которое оценивали по среднему объему опухоли, при использовании для лечения среды (черные кружки); иринотекана (100 мг/кг в дни 7 и 15; черные квадраты); hBAT-1 (введение 10 мкг/мышь на 10 день; белые кружки); и при лечении по комбинированной схеме применения (белые треугольники) hBAT-1 (введение 10 мкг/мышь на 10 день) и иринотекана (введение 100 мг/кг в дни 7 и 15) у CRC мышей.
На фигуре 13 показан процент выживаемости CRC мышей при использовании для лечения среды (черные кружки); иринотекана (введение 100 мг/кг в дни 7 и 15, 22 и 29; черные треугольники); hBAT-1 (введение 10 мкг/мышь в дни 10, 18, 25 и 32; белые квадраты); и при лечении по комбинированной схеме применения (черные ромбы) hBAT-1 (введение 10 мкг/мышь в дни 10, 18, 25 и 32) и иринотекана (введение 100 мг/кг в дни 7 и 15, 22 и 29).
На фигуре 14 показано противоопухолевое действие, которое оценивали по среднему объему опухоли, при использовании для лечения среды (черные кружки); оксалиплатина (1 мг/кг в дни 4, 7-10, 14-17 и 22-23; белые квадраты); и при лечении по комбинированной схеме применения (черные треугольники) hBAT-1 (введение 10 мкг/мышь в дни 11 и 18) и оксалиплатина (1 мг/кг в дни 4, 7-10, 14-17 и 22-23) CRC мышей.
На фигуре 15 показан процент выживаемости CRC мышей при использовании для лечения среды (черные кружки); оксалиплатина (1 мг/кг в дни 4, 7-10, 14-17, 22-24, 29-31; белые квадраты); и при лечении по комбинированной схеме применения (черные треугольники) of hBAT-1 (10 мкг/мышь в дни 11, 18, 25 и 32) и оксалиплатина (1 мг/кг в дни 4, 7-10, 14-17, 22-24, 29-31).
На фигуре 16 показано влияние совместного применения hBAT-1 и химиотерапевтического агента относительно защиты от рецидива опухоли, которое оценивали по среднему объему опухоли (Фиг.16А) и проценту выживаемости (Фиг.16В). Мыши (n=3), которые были излечены от CRC (колоректальной аденокарциномы) в течение 2 или 5 месяцев путем лечения по комбинированной схеме применения hBAT-1 и оксалиплатина, были повторно заражены той же клеточной линией CRC (белые квадраты). Кроме того, CRC вводили ранее не подвергнутым эксперименту (naive mice) мышам (n=6) (черные кружки).
На фигуре 17 показано влияние совместного применения hBAT-1 и химиотерапевтического агента относительно защиты от рецидива опухоли, которое оценивали по среднему объему опухоли (Фиг.17А) и проценту выживаемости (Фиг.17В). Мыши (n=2), которые были излечены от CRC путем лечения по комбинированной схеме применения hBAT-1 и оксалиплатина, что подтверждало отсутствие рецидива опухоли при повторном введении той же клеточной линии CRC, были повторно заражены карциномой молочной железы (белые квадраты). Поражение карциномой молочной железы проводили через 2 месяца после того, как у данных мышей проявилась устойчивость к рецидиву опухоли CRC. Кроме того, CRC вводили ранее не подвергнутым эксперименту мышам (naive mice) (n=6) (черные кружки).
На фигуре 18 показано влияние СТ-11 в анализе на выживаемость клеток с использованием CD4+CD45RO+ эффекторных Т-клеток / Т-памяти клеток человека (черные столбцы) и нативных (naive) CD4+CD45RO- Т-клеток (белые столбцы), подвергнутых действию hBAT (1 мкг/мл) и последующем инкубировании в течение 72 и 96 часов. Результаты выражали как % разность выживаемости клеток.
На фигуре 19 представлены аминокислотные последовательности различных вариантов осуществления изобретения относительно VK-участка гуманизированного ВАТ-1 (SEQ ID NOS. 15-18). Совпадающие остатки VK-участка ВАТ-1 и последовательности V□-участка TEL9 человека (SEQ ID NO. 130) отмечены точками [.]. Отсутствие аминокислоты на специфическом участке остатка отмечены тире [-]. Аминокислотная замена FR TEL9 в V□-участке гуманизированного ВАТ-1 выделена полужирным шрифтом. CDR-участки описаны с использованием номенклатуры [==L1==]. Нумерацию использовали согласно Kabat (Kabat с сотр., Sequences of proteins of immunological interest, Fifth Edition, U.S. Department of Health и Human Services, U.S. Government Printing Office, 1991).
На фигуре 20 представлены аминокислотные последовательности различных вариантов осуществления изобретения относительно VH-участка гуманизированного BAT-1 (SEQ ID NOS. 20-24). Совпадающие остатки V□-участка ВАТ-1 и последовательности VH-участка hsighv1295 человека (SEQ ID NO. 146) отмечены точками [.] Отсутствие аминокислоты на специфическом участке остатка отмечены тире [-]. Аминокислотная замена FR TEL9 в VH-участке гуманизированного ВАТ-1 выделена полужирным шрифтом. CDR-участки описаны с использованием номенклатуры [==Н1==], где [-----] обозначает часть структурной петли H1. Нумерацию использовали согласно Kabat (Kabat с сотр., ibid).
Подробное описание изобретения
Определения
Термин "антитело" (также обозначаемый "иммуноглобулин") используется в самом широком смысле и включает моноклональные антитела (включая полноразмерные моноклональные антитела) и фрагменты антител достаточной длины для сохранения их биологической активности. "Фрагменты антитела" включают часть полноразмерного антитела, обычно его антигенсвязывающий или вариабельный участок. Примеры фрагментов антитела включают: Fab, Fab', F(ab')2, и Fv-фрагменты; диатела; линейные антитела; одноцепочечные молекулы антител и мультиспецифичные антитела, полученные из фрагментов антител.
Базовой единицей природной молекулы антитела является гетеротетрамерный гликопротеиновый комплекс размером приблизительно 150000 Да, состоящий из двух идентичных легких (L) и двух идентичных тяжелых (Н) цепей, связанных вместе нековалентными и дисульфидными связями. Каждая тяжелая и легкая цепь также имеет внутрицепочечные регулярно расположенные дисульфидные мостики. Выделяют пять классов антител человека (IgG, IgA, IgM, IgD и IgE) и внутри данных классов выделяют несколько подклассов на основании структурных различий, таких как число единиц иммуноглобулина в отдельной молекуле антитела, структура дисульфидного мостика отдельных структурных единиц и различия в длине и последовательности цепей. Класс и подкласс антитела представляют его изотип.
N-концевые участки тяжелых и легких цепей характеризуются большим разнообразием последовательности, чем C-концевые участки, и поэтому называются вариабельными доменами. Данный участок структуры антитела отвечает за антигенсвязывающую специфичность антитела. Вариабельные домены тяжелой (VH) и легкой (VL) цепей вместе формируют единый антигенсвязывающий сайт, таким образом, базовая единица иммуноглобулина содержит два антигенсвязывающих сайта. Считается, что особенные аминокислотные остатки формируют поверхность между вариабельными доменами легкой и тяжелой цепей (Chothia с сотр., J. Mol. Biol. 186, 651-63 (1985); Novotny и Haber, (1985) Proc. Natl. Acad. Sci. USA 82 4592-4596).
C-концевые участки тяжелых и легких цепей формируют константные домены, т.е. СН1, СН2, СН3, CL. Такие домены в значительно меньшей степени варьируются, поэтому имеются видоспецифические различия между разными животными и, более того, у одного и того же субъекта имеются несколько изотипов одного антитела, каждый из которых имеет отдельную функцию.
Термин "каркасный участок", или "FR", относится к аминокислотным остаткам в вариабельном домене антитела, которые отличаются от аминокислотных остатков гипервариабельного участка, как указано в описании. Термин "гипервариабельный участок", используемый в описании, относится к аминокислотным остаткам в вариабельном домене антитела, которые отвечают за связывание антигена. Гипервариабельный участок состоит из аминокислотных остатков "участка, определяющего комплементарность", или "CDR". CDR отвечают в первую очередь за связывание эпитопа антигена. Размеры FR и CDR были точно определены (см. Kabat с сотр., ibid).
Термин "акцепторный иммуноглобулин человека" относится к иммуноглобулину человека, который обеспечивает каркас гуманизированного антитела.
Термин "гуманизированное антитело" в описании относится к антителу, состоящему из каркасного участка антитела человека и одного или более CDR нечеловеческого иммуноглобулина (обычно мыши или крысы). Участки гуманизированного иммуноглобулина, возможно, за исключением CDR, по существу идентичны соответствующим участкам последовательностей природного иммуноглобулина человека. Однако в некоторых случаях могут быть модифицированы специфические аминокислотные остатки, например, каркасных участков для оптимизации свойств гуманизированного антитела. Важное предположение состоит в том, что гуманизированное антитело связывает тот же самый антиген, что и донорное антитело, которое обеспечивает CDR. Подробная информация представлена, например, в патенте США №5,225,539, принадлежащем Совету по медицинским исследованиями (Соединенное Королевство).
Термины "каркасный участок из акцепторного иммуноглобулина человека" и "каркасный участок, полученный из акцепторного иммуноглобулина человека" и похожие выражения используют в описании взаимозаменяемо для обозначения каркасного участка или его части, который имеет аналогичную аминокислотную последовательность акцепторного иммуноглобулина человека.
Термин "каркасный участок модифицированный из акцепторного иммуноглобулина человека" и похожие выражения относятся к каркасному участку, в аминокислотную последовательность которого были внесены изменения, например замена, делеция или химическая модификация одного или более аминокислотных остатков,по сравнению с последовательностью исходного акцепторного иммуноглобулина человека. Модификации FR-участка могут проводиться для оптимизации свойств конструируемого гуманизированного антитела, например, для оптимизации связывания антигена и исключения стерических затруднений. Подробное объяснение основы и логическое обоснование модификации специфических остатков FR-участков акцепторного иммуноглобулина при создании гуманизированного антитела ВАТ обеспечивается в публикации заявки на патент США №2008/0025980.
Кроме того, FR может быть подвергнут химической модификации на одном или более аминокислотных остатках как с использованием естественных процессов, таких как процессинг или другие посттрансляционные модификации, так и с использованием технологий химической модификации. Химические модификации включают без ограничений: ацетилирование, ацилирование, аминирование, АДФ-рибозилирование, гликозилирование, формирование ГФИ-якорной последовательности, ковалентное присоединение жидкости или липидных производных, метилирование, миристилирование, пегилирование, пренилирование, фосфорилирование, убиквитинилирование или другие похожие процессы.
Термин "антитело человека" относится к антителу, кодируемому геном, фактически характерным для человека, или его аллелью, или вариантом, или мутантом человека.
Термин "противоопухолевое действие (эффект)", в настоящем описании относится к полезному биологическому эффекту, который может проявляться в виде одного или более из перечисленных: уменьшение или стабилизация объема опухоли, уменьшение или стабилизация числа клеток опухоли, уменьшение или стабилизация скорости роста опухоли, уменьшение или стабилизация числа метастазов, защита от рецидива опухоли, увеличение ожидаемого срока жизни или выживаемости субъекта с опухолью, увеличение ожидаемого срока жизни или выживаемости без прогрессирования заболевания у субъекта с опухолью, или улучшение различных физиологических симптомов, связанных с раком. "Противоопухолевое действие" также проявляется в в способности комбинации согласно изобретению предотвращать возникновение опухоли или рецидив опухоли. С учетом свойств способов согласно изобретению они могут применяться при лечении острых, латентных, контролируемых или стабилизированных форм рака, а также для профилактики его возникновения.
Термин "млекопитающее" означает любое млекопитающее, включая домашних животных, таких как собаки и кошки; сельскохозяйственные животные, такие как свиньи, крупный рогатый скот, овцы и козы; лабораторные животные, такие как мыши и крысы; приматы, такие как мартышки, человекообразные обезьяны и шимпанзе; и предпочтительно человек.
Термин "эффективное количество" в отношении гуманизированного антитела и химиотерапевтического агента (ов) согласно настоящему изобретению следует понимать как количество каждого из данных активных агентов, требуемое для достижения терапевтического эффекта без возникновения избыточных или неконтролируемых нежелательных побочных явлений. Эффективное количество, требуемое для достижения терапевтического конечного результата, может зависеть от ряда факторов, включая, например, специфический тип опухоли и тяжесть состояния пациента, а также совместного применения такой комбинации и облучения. Эффективное количество (доза) активных агентов в контексте настоящего изобретения должно быть достаточным для достижения полезного ответа у субъекта со временем, включая подавление (ингибирование) роста опухоли, снижение скорости роста опухоли, предотвращение роста опухоли и образования метастазов, а также улучшение выживаемости.
Термин "улучшение выживаемости", используемый в описании, относится к продленному периоду времени, в течение которого субъект или пациент жив после проведения лечения по способу согласно изобретению. Улучшение выживаемости означает повышение вероятности отсутствия прогрессирования болезни у субъекта, страдающего раковым заболеванием, после конкретного лечения. Данный термин также используют для описания повышенного процента субъектов в группе, болезнь которых, очевидно стабилизируется (не проявляет признаков прогрессирования) по прошествии определенного периода времени по сравнению с контрольной группой. Данный термин также используют для описания повышенного процента субъектов в группе, очевидно вылеченных (не проявляют симптомов болезни) по прошествии определенного периода времени по сравнению с контрольной группой. Данный параметр может быть определен с использованием одного из типичных клинических результатов, обозначенного как "выживаемость без прогрессирования заболевания", "общая выживаемость" и "выживаемость без признаков рецидива заболевания", используемых для определения эффективности режима лечения.
Термин "переносимость химиотерапевтических агентов" относится к физиологической, физико-химической и иммунологической способности субъекта переносить нежелательные побочные эффекты, связанные с лечением с применением одного или более химиотерапевтических агентов. Также термин "улучшение переносимости химиотерапевтических агентов" относится к улучшению физиологической и физико-химической устойчивости к данным нежелательным побочным эффектам, таким образом, что тяжесть данных нежелательных побочных эффектов снижается и/или число нежелательных побочных эффектов снижается. Также "улучшение переносимости химиотерапевтических агентов" может относиться к улучшению качества жизни раковых пациентов, подвергнутых лечению с использованием химиотерапевтических агентов.
Термин "рецидив опухоли" относится к возобновлению, повторному появлению, повторному росту или пролиферации опухоли такого же типа в том же или ином месте по прошествии периода времени, в течение которого рост исходной опухоли был реверсирован, приостановлен или подавлен.
Термин "улучшение или повышение выживаемости лимфоцитов", используемый в описании, относится к способности определенной комбинации лечения пролонгировать жизнеспособность лимфоцитов in vitro или in vivo по сравнению с жизнеспособностью идентичной популяции клеток при применении только одного варианта лечения. Например, использование определенных комбинаций hBAT-1 и химиотерапевтических агентов повышает выживаемость лимфоцитов, что показано при проведении тестов in vitro как продемонстрировано в Примере 1.
Способы согласно изобретению
Способы иммунотерапевтического лечения рака нацелены и основаны на модулировании ответа иммунной системы на индукцию или усиление уничтожения опухолевых клеток и контроле роста опухоли. При осуществлении данного подхода используют различные иммуномодуляторы, включая моноклональные антитела, которые избирательно связываются со специфическими детерминантами на поверхности Т-клеток и, таким образом, инициируют путь активации или индуцируют эффект подавления.
В соответствии с определенными аспектами настоящего изобретения введение гуманизированного антитела, обладающего иммуностимулирующим действием, в комбинации по меньшей мере с одним противоопухолевым химиотерапевтическим агентом усиливает противоопухолевое действие химиотерапевтических агентов и наоборот. В предпочтительных вариантах изобретения введение гуманизированного антитела, обладающего иммуностимулирующим действием, в комбинации по меньшей мере с одним химиотерапевтическим агентом приводит к значительному улучшению исхода болезни по сравнению с применением только одного из способов лечения. В предпочтительных вариантах изобретения отмечали синергетическое действие при лечении опухолей с использованием гуманизированного антитела согласно изобретению в комбинации по меньшей мере с одним химиотерапевтическим агентом и, возможно, дополнительно в сочетании с применением облучения.
Другими словами, в соответствии с одним из аспектов настоящего изобретения противоопухолевое действие гуманизированного антитела согласно изобретению превышает ожидаемый результат при комбинировании по меньшей мере с одним химиотерапевтическим агентом. Синергетический эффект состоит в превышающем ожидания противоопухолевом действии комбинированного способа лечения, чем это может прогнозироваться исходя из аддитивного эффекта лечения с использованием гуманизированного антитела и химиотерапевтического агента (ов) в отдельности. Например, синергетический эффект продемонстрирован в Примерах 2, 3 и 6, где показано, что комбинированная терапия в соответствии с настоящим изобретением оказывает повышенное противоопухолевое действие, на основании измерения объема опухоли и выживаемости мышей с опухолью по сравнению с действием только антитела или химиотерапии в отдельности. В частности, при оценке объема опухоли показано (Фиг.8), что введение комбинации hBAT-1 и 5-ФУ является более эффективным по сравнению с каждым из данных агентов в отдельности, и на Фиг.9 показано, что комбинация hBAT-1 и 5-ФУ приводит к синергетическому эффекту по сравнению с использованием только 5-ФУ. Аналогично, при проведении оценки на выживаемость показано, что введение комбинации hBAT-1 и 5-ФУ является более эффективным по сравнению с каждым из данных агентов в отдельности (Фиг.10) или по сравнению с использованием только 5-ФУ (Фиг.11). Использование другой комбинации, а именно hBAT-1 и оксалиплатина, не только обладает преимуществами по сравнению с использованием одного оксалиплатина для повышения выживаемости, но также индуцирует полную ремиссию у некоторых субъектов (Фиг.15). Синергетический эффект комбинированной терапии, описываемой в настоящем изобретении, по сравнению с соответствующей монотерапией также представлен полной ремиссией и созданием защитной опухоль-специфической памяти у мышей с опухолью (Фиг.10, 15, 16, 17).
Эффекты in vivo, проявляемые комбинациями согласно изобретению, подтверждаются при проведении функциональных тестов на выживаемость лимфоцитов in vitro, как показано в Примере 1. Как показано в данном примере, последовательная обработка лимфоцитов мыши hBAT-1 и затем 5-ФУ (вводили через 24 часа) неожиданным образом приводила к повышению выживаемости лимфоцитов приблизительно на 30% (Фиг.2А). При одновременной обработке лимфоцитов hBAT-1 и 5-ФУ выживаемость лимфоцитов повышалась незначительно (Фиг.1А) по сравнению с обработкой отдельно hBAT-1 и отдельно 5-ФУ, что не повышало выживаемости клеток (Фиг.1C), это свидетельствует о наличии механистического синергетического эффекта последовательного режима лечения. Синергетическую активность также наблюдали при проведении тестов in vitro с использованием комбинации химиотерапевтического агента цисплатина и гуманизированного антитела (Фиг.7В). Таким образом, сочетания определенных химиотерапевтических агентов и гуманизированного антитела согласно изобретению приводит к синергетическим эффектам in vitro и in vivo.
Синергетический эффект, обнаруженный и подтвержденный примерами в данном документе, является полностью неожиданным, учитывая, что известные механизмы действия и мишени антител ВАТ и химиотерапевтических агентов полностью различны и даже противоположны. Антитела ВАТ оказывают действие путем стимулирования иммунных клеток (как показано, например. Hardy с сотр., 1994; Hardy с сотр., 1997), тогда как действие химиотерапевтических агентов, таких как 5-ФУ и оксалиплатин, обусловлено уничтожением быстро делящихся клеток, включая иммунные клетки.
Как показано на примере, комбинации согласно данному изобретению, представляющие собой такие, которые используют химиотерапевтические агенты в комбинации с гуманизированным антителом согласно изобретению, демонстрируют повышение или улучшение выживаемости лимфоцитов. Как показано в Примере 1 и на Фиг.1-7, оценку выживаемости лимфоцитов можно проводить с использованием типичных in vitro тестов.
Таким образом, в разных вариантах изобретения химиотерапевтический агент может быть выбран из группы антиметаболитов, таких как аналог пиримидина 5-фторурацил, или цитарабин, или лекарственное вещество на основе платины, такое как оксалиплатин или цисплатин. Более того, в различных вариантах осуществления изобретения химиотерапевтический агент может отличаться от агента, выбранного из ингибиторов топоизомеразы I (таких, как SN-38) или алкилирующих агентов (таких, как циклофосфамид). Противоопухолевое действие, индуцированное комбинациями согласно изобретению, включает предотвращение, подавление прогрессирования опухоли, снижение роста опухоли и защиту от рецидива опухоли, включая злокачественные и доброкачественные опухоли. Прогрессирование опухоли включает инвазивность, формирование метастазов, возобновление роста и увеличение размеров опухоли. Снижение роста опухоли также включает разрушение или элиминацию опухоли, которое приводит к полному выздоровлению.
Кроме того, было показано, что настоящее изобретение также является эффективным для улучшения переносимости химиотерапевтических агентов. Как известно в данной области техники, главным препятствием использования противораковой химиотерапии является проявление острых и разрушительных нежелательных побочных эффектов по причине сильной токсичности большинства химиотерапевтических агентов. Как показано в Примере 3, использование гуманизированного антитела ВАТ (СТ-011) в комбинации с 5-ФУ при концентрациях дозолимитирующей токсичности (DLT) с использованием последовательного введения приводит к улучшению выживаемости у мышей. Данные наблюдения подтверждают использование гуманизированного антитела ВАТ для улучшения переносимости химиотерапевтических агентов у пациентов, подвергаемых химиотерапии.
Данное изобретение также обеспечивает способ повышения выживаемости субъектов с опухолью, включающий введение гуманизированного антитела согласно изобретению, или отдельно, или возможно в комбинации с дополнительным введением одного или более химиотерапевтических агентов. Например, эффект "исцеления", индуцированный введением СТ-011 людям с раковыми опухолями (Пример 8), подтверждает такую монотерапию с использованием антитела. Данный аспект изобретения обладает особенным преимуществом в случаях, где применение химиотерапии оказалось неэффективным или где пациент не способен переносить химиотерапевтические агенты.
Данное изобретение также обеспечивает способ снижения или предотвращения рецидива опухоли, включающий введение гуманизированного антитела согласно изобретению, или отдельно, или возможно в комбинации с дополнительным введением одного или более химиотерапевтических агентов. Как показано в Примере 6, комбинированное лечение экспериментальных животных с использованием гуманизированного антитела согласно изобретению и химиотерапевтических агентов явным образом индуцирует "эффект памяти", обеспечивающий подавление рецидива опухоли при повторном заражении исходным типом опухоли.
Можно проводить лечение всех типов опухолей с применением способов согласно изобретению. Опухоли могут быть солидными и несолидными.
Некоторые примеры солидных опухолей, лечение которых можно проводить с использованием комбинаций согласно настоящему изобретению, включают карциномы, саркомы, бластомы или глиомы. Некоторые примеры таких опухолей включают эпидермальные карциномы, ороговевающие карциномы, такие как карциномы головы и шеи, колоректальные карциномы, карциномы простаты, карциномы молочных желез, карцинома легких, включая немелкоклеточный рак легких (НМРЛ) и мелкоклеточный рак легких (МРЛ), рак поджелудочной железы, карциномы щитовидной железы, карциномы яичников, рак печени, рак пищевода и рак желудка. Другие примеры включают такие заболевания, как: саркома Капоши, новообразования в ЦНС, нейробластомы, капиллярные гемангиобластомы, менингиомы и церебральные метастазы, меланому, карциному желудочно-кишечного тракта и почечные карциномы и саркомы, рабдомиобластома, глиобластома, особенно мультиформная глиобастома, и лейомиосаркома. Примеры васкуляризированных раковых заболеваний кожи включают такие заболевания, как: плоскоклеточная карцинома, базальноклеточная карцинома и типы раковых заболеваний кожи, которые могут быть вылечены при подавлении роста злокачественных кератиноцитов, таких как злокачественный кератиноцитоз.
Некоторые примеры несолидных опухолей включают лейкемии, множественные миеломы и лимфомы. Некоторые примеры лейкемий включают острую миелоидную лейкемию (ОМЛ); хронический миелоидный лейкоз (ХМЛ); острый лимфоцитарный лейкоз (ОЛЛ) и хронический лимфоцитарный лейкоз (ХЛЛ), эритроцитарный лейкоз или моноцитарный лейкоз. Некоторые примеры лимфом включают такие заболевания, как: болезнь Ходжкина (лимфогранулематоз), неходжкинская лимфома или лимфома из клеток мантийной зоны.
В настоящее время предпочтительные типы опухолевых заболеваний выбирают из следующей группы: колоректальная карцинома; карцинома легких, включая немелкоклеточный рак легких (НМРЛ) и мелкоклеточный рак легких (МРЛ); карцинома молочной железы; меланома; карцинома яичников; карцинома шейки матки; рак поджелудочной железы; карцинома головы и шеи; карцинома желудочно-кишечного тракта; рак пищевода; печеночноклеточная карцинома; множественная миелома; почечноклеточная карцинома; рак простаты; неходжкинская лимфома; болезнь Ходжкина (лимфогранулематоз); лимфома из клеток мантийной зоны; саркома Капоши; плоскоклеточная карцинома; базальноклеточная карцинома; острая миелоидная лейкемия (ОМЛ); хронический миелоидный лейкоз (ХМЛ); острый лимфоцитарный лейкоз (ОЛЛ) и хронический лимфоцитарный лейкоз (ХЛЛ).
Следует отметить, что в соответствии с рекомендациями настоящего изобретения гуманизированное антитело согласно изобретению можно вводить до, во время или после начала химиотерапии и, возможно, лучевой терапии, как и любой их комбинации, т.е. до и во время, до и после, во время и после, или до, во время и после начала химиотерапии и, возможно, лучевой терапии. Например, введение антитела согласно изобретению, может быть осуществлено между 1 и 30 сутками до или после начала химиотерапии. В антитело можно дополнительно вводить между курсами химиотерапии.
При использовании способов комбинированной терапии согласно изобретению, антитела могут вводиться параллельно с химиотерапией, например по существу одновременно или согласованно. Также могут быть использованы другие схемы введения, например перекрывающиеся режимы или схемы, включающие альтернативное, последовательное или поочередное введение двух вариантов лечения.
Гуманизированное антитело согласно изобретению
В данном документе, термины "ВАТ" и "антитело ВАТ " используют в широком смысле для обозначения антител, идентичных или основанных на моноклональном антителе мыши, известном как mBAT-1, или его антиген-связывающем фрагменте. Моноклональное антитело mBAT-1 секретируется клеточной линией гибридомы, которые хранятся в Национальной коллекции культур микроорганизмов (Collection Nationale de Cultures de Microorganismes, CNCM), под номером доступа 1-1397, как указано в Патенте США №5,897,862. Также термины "ВАТ" и "антитело ВАТ" могут обозначать антитело, которое распознает такой же эпитоп антигена, как mBAT-1, например химерное антитело, описанное в Публикации заявки на патент США №2003/0026800. Термин антитело ВАТ также включает гуманизированные антитела, различные примеры которых описаны в WO03/099196 и Публикации заявки на патент США №2008/0025980. Термины "СТ-011", "hBAT" и "hBAT-1" используют в описании взаимозаменяемо для обозначения одного гуманизированного антитела согласно изобретению.
В общем виде вариабельный участок легкой цепи гуманизированного моноклонального антитела описывают формулой:
FRL1-CDRL1-FRL2-CDRL2-FRL3-CDRL3-FRL4,
где каждый FR независимо представляет собой каркасный участок антитела человека и каждый CDR независимо представляет собой участок, определяющий комплементарность, моноклонального антитела mBAT-1.
В общем виде вариабельный участок тяжелой цепи гуманизированного моноклонального антитела описывают формулой:
FRH1-CDRH1-FRH2-CDRH2-FRH3-CDRH3-FRH4,
где каждый FR независимо представляет собой каркасный участок антитела человека, и каждый CDR независимо представляет собой участок, определяющий комплементарность, моноклонального антитела mBAT-1.
В частных вариантах осуществления изобретения FR получены из вариабельного участка легкой цепи антитела TEL9 человека (SEQ ID NO:130) или их модификаций в определенных аминокислотных остатках.
Антитело TEL-9 человека было идентифицировано в различных библиотеках вариабельных (V) генов тяжелой (VH) и легкой (V каппа и V лямбда) цепей иммуноглобулинов, полученных из лимфоцитов периферической крови неиммунизированных доноров (Marks с сотр., J Mol Biol. 1991, 222:581-97). Было показано, что данное антитело специфически связывает антиген лизоцима яичного белка индейки (turkey egg-white, TEL).
Аминокислотные последовательности FR получены из вариабельных участков легкой цепи антитела TEL9 человека или их модификаций и могут быть выбраны из следующей группы: FRL1, [EIVLT QSPSS LSASV GDRVT ITC; SEQ ID NO:1]; FRL2, [W (F или Y) QQKPG KAPKL (W или L) IY; SEQ ID NO:2]; FRL3, [GVPSR FSGSG SGT (D или S) (Y или F) (С или Т) LTINS LQPED FATYY C; SEQ ID NO:3]; и FRL4, [FGGGT KLEIK; SEQ ID NO:4].
В частных вариантах осуществления изобретения FR получены из вариабельных участков тяжелой цепи антитела hsighv1295 человека (SEQ ID NO:146) или их модификаций в определенных аминокислотных остатках.
Антитело hsiggv1295 человека было выделено из стабильных гибридом и B-клеточных линий, трансформированных вирусом Эпштейна-Барра из синовиальной жидкости или периферической крови трех пациентов с диагнозом ревматоидный артрит и одного пациента с диагнозом системная красная волчанка (Fang с сотр., J Exp Med. 1994, 179:1445-56).
Аминокислотные последовательности FR получены из вариабельных участков тяжелой цепи антитела hsighvl295 человека или их модификаций и могут быть выбраны из следующей группы: FRH1, [Q (I или V) QLV QSGSE LKKPG ASVKI SCKAS GY (Т или S) F (Т или S); SEQ ID NO:5]; FRH2, [WV (R OR K) QAPGQ GL (Q или K) WMG; SEQ ID NO:6]; FRH3, [RF (V или A) FSLDT SV (N или S) TAYLQ ITSL (Т или N) AEDTG MYFC (V или А) (R или K); SEQ ID NO:7]; и FRH4, [WGQGT LVTVS S; SEQ ID NO:8].
В соответствии с различными вариантами осуществления изобретения вариабельный участок легкой цепи состоит по крайней мере из одной аминокислотной последовательности, выбранной из следующей группы: CDRL1 [SARSS VSYMH; SEQ ID NO:9]; CDRL2 [RTSNL AS; SEQ ID NO:10]; CDRL3 [QQRSS FPLT; SEQ ID NO:11], где CDR получены из антитела BAT-1 мыши, где нижние индексы "L" и "Н" относятся к участкам легкой и тяжелой цепи, соответственно.
В соответствии с различными вариантами осуществления изобретения вариабельный участок тяжелой цепи состоит по меньшей мере из одной аминокислотной последовательности, выбранной из следующей группы: CDRH1 [NYGMN; SEQ ID NO:12]; CDRH2 [WINTD SGEST YAEEF KG; SEQ ID NO:13]; CDRH3 [VGYDA LDY; SEQ ID NO:14].
В соответствии с различными вариантами осуществления изобретения данное гуманизированное антитело включает вариабельный участок легкой цепи, выбранный из группы: BATRκA (SEQ ID NO:15), BATRκB (SEQ ID NO:16), BATRκC (SEQ ID NO:17), и BATRκD (SEQ ID NO:18); и вариабельный участок тяжелой цепи, выбранный из группы: А (SEQ ID NO:20), BATRHB (SEQ ID NO:21), BATRHC (SEQ ID NO:22), BATRHD (SEQ ID NO:23) и BATRHE (SEQ ID NO:24).
В соответствии с другими вариантами осуществления изобретения гуманизированное антитело включает вариабельные участки, выбранные из группы: BATRHA/BATRκA (SEQ ID NO:20/SEQ ID NO:15), BATRHB/BATRκA (SEQ ID NO:21/SEQ ID NO:15), BATRHB/BATRκB (SEQ ID NO:21/SEQ ID NO:16), BATRHC/BATRκB (SEQ ГО NO:22/SEQ ID NO:16), BATRHB/BATRκD (SEQ ID NO:21/SEQ ID NO:18) и BATRHC/BATRκD (SEQ ID NO:22/SEQ ID NO:18).
В соответствии с другими предпочтительными вариантами осуществления изобретения вариабельные участки гуманизированного моноклонального антитела соответствуют BATRHC/BATRκD (SEQ ID NO:22/SEQ ID NO:18).
В одном варианте осуществления изобретения вариабельный участок тяжелой цепи гуманизированного антитела ВАТ соответствует SEQ ID NO:22, которая может кодироваться полинуклеотидной последовательностью SEQ ID NO:90.
В одном варианте осуществления изобретения вариабельный участок легкой цепи гуманизированного антитела соответствует SEQ ID NO:18, которая может кодироваться полинуклеотидной последовательностью SEQ ID NO:89. Аминокислотная и нуклеотидная последовательности гуманизированного антитела, пригодного для использования согласно изобретению, описаны в Публикации заявки на патент США №2008/0025980. Каркасные участки вариабельных участков тяжелой цепи и вариабельные участки легкой цепи антитела человека, пригодны для использования согласно изобретению включают, например, SEQ ID NOS: 111-128 и SEQ ID NOS: 130-144 соответственно.
Химиотерапия
Лекарственные препараты для химиотерапии разделяют на несколько групп в зависимости от оказываемого действия на раковые клетки, активность клетки или вовлекаемые процессы или специфические фазы клеточного цикла. Соответственно препараты для химиотерапии попадают в одну из следующих категорий: алкилирующие агенты, нитрозомочевины, антиметаболиты, антрациклины, ингибиторы топоизомеразы I и II, митотические ингибиторы, inter alia лекарственные препараты на основе платины, стероиды и антиангиогенные агенты.
Антиметаболиты, также называемые "аналоги нуклеозидов", замещают природные вещества в качестве структурных блоков молекул ДНК и, таким образом, изменяют функционирование ферментов, требуемых для метаболизма клетки и синтеза белка. В случае если они замещают нутриенты, требуемые для роста клеток, данные клетки в итоге подвергаются лизису. Если происходит замещение нуклеозида его нефункциональным аналогом, последний встраивается в ДНК и РНК, что в конечном итоге приводит к задержанию клеточного цикла и апоптозу путем подавления способности клетки синтезировать ДНК. Антиметаболиты являются специфичными в отношении стадий клеточного цикла и наиболее эффективно действуют в S-фазе клеточного деления, так как в первую очередь их действие направлено на клетки, осуществляющие синтез новой ДНК для формирования новых клеток. Токсичность, ассоциированная с данным типом лекарственных препаратов, наблюдается для быстро растущих и делящихся клеток. Примеры антиметаболитов включают антагонисты пуринов, антагонисты пиримидинов и антагонисты фолатов. Данные агенты повреждают клетки в S-фазе, и обычно их используют для лечения лейкемии, карциномы молочной железы, карциномы яичников и карциномы желудочно-кишечного тракта, а также при других типах рака. Специфические примеры антиметаболитов включают 5-фторурацил (также называемый 5-ФУ), капецитабин, 6-меркаптопурин, метотрексат, гемцитабин, флударабин и пеметрексед.
Химиотерапевтические агенты на основе платины перекрестно связывают ДНК разными способами, что подавляет клеточное деление путем митоза. Поврежденная ДНК запускает механизмы репарации ДНК, которые, в свою очередь, активируют апоптоз, в том случае если репарация невозможна. Наиболее заметными изменениями ДНК являются 1,2-внутринитевые поперечные сшивки пуриновых оснований, которые включают 1,2-внутринитевые d(GpG) аддукты, которые формируют приблизительно 90% аддуктов, и менее распространенные 1,2-внутринитевые d(ApG) аддукты. Формирование 1,3-внутринитевых d(GpXpG) аддуктов происходит, но быстро устраняется путем эксцизионной репарации нуклеотидов. Другие аддукты включают внутринитевые поперечные сшивки и нефункциональные аддукты, которые, как утверждают, вносят вклад в активность лекарственных препаратов на основе платины. Взаимодействие с клеточными белками, особенно с белками доменов HMG, также было предложено в качестве механизма, вовлекающегося в митоз, хотя это, вероятно, не является первичным способом действия. Химиотерапевтические препараты на основе платины включают цисплатин (также называемый цисплатинум или цис-диаминдихлоридоплатина II) (CDDP), карбоплатин и оксалиплатин. Цисплатин часто относят к алкилирующим агентам, хотя он не имеет алкильной группы и не может принимать участия в реакциях алкилирования. Корректно классифицировать данный агент как подобный алкилирующему агенту. Химиотерапевтические препараты на основе платины используют для лечения разных типов опухолевых заболеваний, включая саркомы, некоторые карциномы (например, мелкоклеточный рак легких и карциному яичников), лимфомы и эмбрионально-клеточные опухоли.
Митотические ингибиторы вовлекаются в деление клетки. Наиболее известным химиотерапевтическим агентом в данной категории является паклитаксел (также называемый Таксол®, "растительный алкалоид", "таксан" и "противомикротрубочковый агент"). При совместном применении с доцетакселем паклитаксел формирует категорию лекарственных препаратов - таксаны. Однако другие известные митотические ингибиторы, включают (но не ограничиваясь указанными) этопозид, винбластин и винкристин. Паклитаксел препятствует нормальному росту микротрубочек в процессе деления клеток, подавляя их функцию; это гиперстабилизирует структуру микротрубочек, что лишает клетку способности использовать гибкость цитоскелета. В частности, паклитаксел связывает β-субъединицу тубулина, «строительные блоки» микротрубочек, и связывание паклитаксела удерживает эти строительные блоки на месте. Полученный комплекс микротрубочка / паклитаксел не обладает способностью разбираться. Это оказывает нежелательное действие на функции клетки, поскольку укорачивание и удлинение микротрубочек (динамическая нестабильность) необходимы для их функционирования в качестве механизма для транспортировки других клеточных компонентов. Например, в процессе митоза микротрубочки позиционируют хромосомы в течение всего процесса репликации и последующего разделения в два дочерних ядра клетки. Более того, паклитаксел индуцирует механизм программируемой клеточной смерти (апоптоз) раковых клеток, связываясь с белком останавливающим апоптоз Вс1-2 (В-клеточная лейкемия 2) и таким образом останавливая его действие.
Другой группой лекарственных препаратов, взаимодействующих с ДНК, являются широко используемые при противораковой химиотерапии препараты из группы антрациклиновых антибиотиков, которая включает, inter alia, даунорубицин, доксорубицин (также называемый Адриамицин® и доксорубицина гидрохлорид), респиномицин D и идарубицин. Данные агенты взаимодействуют с ДНК путем интеркаляции и подавляют биосинтез макромолекул, таким образом, ингибируя передвижение фермента топоизомеразы II, которая раскручивает ДНК для транскрипции. Они стабилизируют комплекс топоизомеразы II после того, как произошел разрыв цепи ДНК для репликации, предотвращая восстановлению двойной спирали ДНК, и таким образом останавливают процесс репликации. Это широко применяют для лечения широкого спектра раковых заболеваний.
Алкилирующие антинеопластичекие агенты непосредственно атакуют ДНК. Они присоединяются алкильной группой к ДНК, образуя поперечные сшивки гуаниновых оснований в двойных цепях ДНК, что делает невозможным раскручивание и разделение цепей. Поскольку это необходимо при репликации ДНК, клетки не могут больше делиться. Данные лекарственные препараты действуют неспецифически. Циклофосфамид является алкилирующим агентом, однако также представляет собой высокоактивный иммуносупрессор.
Ингибиторы топоизомеразы I и II влияют на ферментативную активность топоизомеразы I и 2, соответственно, что со временем приводит к подавлению репликации и транскрипции ДНК. Примеры ингибиторов топоизомеразы I включают топотекан и иринотекан. Иринотекан представляет собой пролекарство, которое превращается в биологически активный метаболит 7-этил-10-гидрокси-кампотецин (SN-38) при действии карбоксилэстераза-превращающего фермента. Будучи в тысячу раз более активным, чем исходное вещество иринотекан, SN-38 подавляет активность топоизомеразы I, стабилизируя расщепляемый комплекс между топоизомеразой I и ДНК, что приводит к разрывам в молекуле ДНК, которые являются причиной подавления репликации ДНК и запускают апоптотическую гибель клетки. Поскольку продолжающийся синтез ДНК необходим для приведения в действие цитотоксического эффекта иринотекана, данный агент также классифицируют как агент, специфичный для S-фазы. Примеры ингибиторов топоизомеразы II включают этопозид и тенипозид.
Антиангиогенные агенты вовлекаются в образование новых кровеносных сосудов, что со временем приводит к "голоданию" опухоли. Примеры антиангиогенных агентов включают (не ограничиваясь указанными) моноклональное антитело бевацизумаб, допамин и тетратиомолибдат.
Фактор роста эндотелия сосудов (vascular endothelial growth factor, VEGF) представляет собой димерный гликопротеин размером 32-42 кДа, опосредующий вазодилятацию, повышенную проницаемость сосудов и митогенез клеток эндотелия. Дифференциальный сплайсинг экзонов гена VEGF приводит к образованию трех основных видов мРНК, кодирующих три секретируемые изоформы (нижний индекс обозначает число аминокислотных остатков): VEGF189, VEGP165, и VEGF121. Также описан ряд второстепенных вариантов сплайсинга (VEGF206, VEGF183, VEGF145 и VEGF148). Варианты полипептидов VEGF и их использование при лечении рака описаны, например, в WO/2003/012105.
Лучевая терапия
Источник радиационного излучения, который может быть использован в комбинации с гуманизированном антителом согласно изобретению, и химиотерапевтическим агентом (агентами) может быть как внешним, так и внутренним относительно пациента. При использовании внешнего относительно пациента источника радиационного излучения терапию называют наружной лучевой терапией (НЛТ). При использовании внутреннего относительно пациента источника радиационного излучения лечение называют брахитерапией (контактной лучевой терапией (КЛТ)).
Радиационное излучение применяют в соответствии с хорошо известными стандартными технологиями и с использованием стандартного оборудования, предназначенного для этих целей, например AECL Theratron и Varian Clinac.
Расстояние между внешним источником излучения и точкой входа в пациента может быть любым расстоянием, которое обеспечивает приемлемое соотношение между уничтожением клеток-мишеней и минимизированием нежелательных побочных эффектов. Обычно расстояние между внешним источником и точкой входа в пациента находится между 70 и 100 см.
Лечение способом КЛТ (брахитерапия) обычно проводят путем помещения источника радиационного излучения внутрь пациента. Обычно источник излучения помещают на расстоянии приблизительно 0-3 см от обрабатываемой ткани. Известные технологии включают внутритканевую, внутриполостную и поверхностную контактную лучевую терапию. Радиоактивные импланты ("семена") могут быть помещены внутрь пациента на временной или постоянной основе. Для перманентных имплантов используют несколько типов радиоактивных атомов, включая йод-125 и радон. Для временных имплантов используют несколько типов радиоактивных атомов, включая радий, цезий-137 и иридий-192. Дополнительно при брахитерапии используют америций-241 и золото-198.
Доза радиации зависит от ряда факторов, которые хорошо известны специалистам в данной области техники. Данные факторы включают такие, как орган, подвергаемый облучению, здоровые органы на пути радиационного излучения, которым может быть нанесен непреднамеренный вред, переносимость пациентом лучевой терапии и площадь тела, которую необходимо подвергнуть облучению. Обычно доза составляет от 1 Гр до 100 Гр, зачастую между 2 Гр и 80 Гр. Некоторые отдельные дозы составляют 35 Гр при лечении спинного мозга, 15 Гр - при лечении почек, 20 Гр - при лечении печени и 65-80 Гр при лечении простаты. Однако следует отметить, что настоящее изобретение не ограничено какой-либо определенной дозой. Дозу излучения определяет лечащий специалист в соответствии с конкретными факторами в данной ситуации, включая вышеперечисленные факторы.
Доза радиационного излучения для проведения брахитерапии может быть аналогичной указанной выше для проведения наружной лучевой терапии. Кроме вышеперечисленных факторов при определении дозы для проведения наружной лучевой терапии при определении дозы для КЛТ принимают во внимание природу используемого радиоактивного атома.
Композиции, введение и дозировки
Для применения способов согласно изобретению гуманизированное антитело может быть включено в состав общепринятым способом, используя один или более фармацевтически приемлемых носителей, стабилизаторов или вспомогательных веществ (сред) для формирования фармацевтической композиции, как известно в данной области техники, в частности, в отношении активных веществ белковой природы. Носитель (носители) являются "приемлемыми" с точки зрения совместимости с остальными компонентами композиции и не обладать вредными свойствами для реципиента. Пригодные носители обычно включают физиологический раствор или этанол, полиолы, такие как глицерин или пропиленгликоль.
Антитело может включаться в состав как в нейтральной форме, так и в форме соли. Фармацевтически приемлемые соли включают соли присоединения кислоты (сформированные свободными аминогруппами) и полученные из неорганических кислот, таких как соляная или фосфорная кислота, или органических кислот, таких как уксусная кислота, щавелевая кислота, винная кислота и малеиновая кислота. Соли, полученные за счет свободных карбоксильных групп, также могут быть получены из неорганических оснований, например гидроксидов натрия, калия, аммония, кальция или железа, и органических оснований, таких как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин и прокаин.
Композиция может быть составлена для внутривенного, внутримышечного, подкожного или внутрибрюшинного введения и традиционно включает стерильный водный раствор антитела, предпочтительно изотоничный крови реципиента. Такие составы обычно приготавливают путем растворения твердого активного ингридиента в воде, содержащей физиологически совместимые вещества, такие как хлорид натрия, глицин и подобные им, с добавлением буферных веществ для поддержания совместимого с физиологическими условиями значения рН с получением водного раствора и обеспечения указанного раствора стерильным. Они могут быть приготовлены в одно- или многодозовых контейнерах, например в запаянных ампулах или флаконах.
Такие композиции могут включать стабилизатор, например полиэтиленгликоль, белки, сахариды (например, трегалозу), аминокислоты, неорганические кислоты и их смеси. Стабилизаторы используют в водных растворах при подходящих концентрациях и значениях рН. Значение рН водного раствора должно быть доведено до интервала 5,0-9,0 единиц рН, предпочтительно интервала 6-8 единиц рН. При разработке состава антитела могут использовать антиадсорбционные агенты. Другие пригодные вспомогательные вещества обычно включают антиоксиданты, такие как аскорбиновая кислота.
Композиции могут быть составлены в виде препаратов с контролируемым высвобождением, что может быть достигнуто при использовании полимера, связывающего в комплекс или абсорбирующего белки. Подходящие полимеры для получения составов с контролируемым высвобождением включают, например, полиэфир, полиаминокислоты, поливинил, пирролидон, этиленвинилацетат и метилцеллюлозу. Другой возможный способ обеспечения контролируемого высвобождения представляет собой введение антитела внутрь частиц из полимерных материалов, таких как полиэфир, полиаминокислоты, гидрогели, сополимера молочной кислоты или этиленвинилацетата. Альтернативно вместо введения указанных агентов в полимерные частицы можно заключить такие материалы в микрокапсулы, полученные, например, с использованием технологий коацервации или межфазной полимеризации, например капсулы из гидроксиметилцеллюлозы, или желатиновые микрокапсулы, или капсулы из полиметилметакрилата соответственно, или использовать коллоидные системы для доставки лекарственных препаратов, такие как липосомы, альбуминовые микросферы, микроэмульсии, наночастицы, нанокапсулы или макроэмульсии.
Если необходимы пероральные препараты, то композиции могут быть составлены с такими носителями, как лактоза, сахароза, крахмал, тальк, стеарат магния, кристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза, глицерин, альгинат натрия или гуммиарабик.
Предпочтительно парентеральное введение гуманизированного антитела согласно изобретению, обычно путем внутривенной инфузии. Введение также могут осуществлять внутрибрюшинно, перорально, подкожно или внутримышечно. Антитела обычно вводят в интервале концентраций от приблизительно 0,1 до приблизительно 20 мг/кг массы пациента, обычно от приблизительно 0,5 до приблизительно 10 мг/кг, и часто от приблизительно 1 до приблизительно 5 мг/кг. В связи с этим предпочтительно использовать антитела с периодом полураспада в кровотоке по меньшей мере 12 часов, предпочтительно по меньшей мере 4 дней, наиболее предпочтительно до 21 дня. Ожидаемые значения периода полураспада в кровотоке химерных и гуманизированных антител составляют до четырех и до 14-21 дня соответственно. В некоторых случаях может быть полезно ввести большую ударную дозу, после которой вводить периодические поддерживающие дозы (например, еженедельно) в течение периода лечения. Антитела также могут быть доставлены с использованием систем медленной доставки, системы насосов и других известных систем доставки для продолжительной инфузии. Режим дозирования может варьироваться для обеспечения желаемого уровня циркулирования конкретного антитела на основании его фармакокинетических свойств. Таким образом, дозы рассчитывают так, чтобы поддерживать желаемую концентрацию (уровень циркулирования) терапевтического агента.
Обычно эффективную дозу определяют исходя из активности терапевтической комбинации и состояния субъекта, а также на основании массы тела или площади поверхности субъекта, который подвергается лечению. Размер дозы и режим дозирования также определяют с учетом наличия, природы и степени любых нежелательных побочных эффектов, которые сопровождают применение каждого агента комбинации согласно изобретению у конкретного субъекта. При определении эффективного количества терапевтической композиции для введения специалист должен оценивать inter alia уровень активного вещества в плазме крови, токсичность и прогрессирования заболевания.
В различных вариантах осуществления комбинации способов согласно изобретению гуманизированное антитело и химиотерапевтический агент можно вводить в соответствии с любым числом схем лечения, также называемыми "схемами дозирования " и "режимами введения", относящимся к частоте введения и порядку введения каждого активного агента. Например, гуманизированное антитело и химиотерапевтический агент могут быть введены по существу одновременно, т.е. в одно время, например, с использованием комбинированных дозированных форм или отдельных дозированных форм. Данная форма введения также может быть названа "сопутствующим" введением. Сопутствующее введение относится к введению активных веществ в течение одного общего периода времени, например в тот же день (дни), но не обязательно в одно время. Например, одно из активных веществ требуется принимать во время еды, тогда как остальные нужно принимать натощак. Альтернативное применение включает введение одного агента в течение определенного периода времени, например в течение курса из нескольких дней или недели, после чего следует введение другого агента в течение последующего идентичного периода времени, и затем данная схема повторяется в течение одного или более циклов. Последовательное или поочередное применение включает введение одного агента в течение первого периода времени с использованием одной или более доз, после чего следует введение второго агента в течение второго периода времени с использованием одной или более доз. Также может быть использован режим перекрывания, который включает введение активных агентов в разные дни в течение одного периода лечения, необязательно в соответствии с регулярной последовательностью. Также могут быть использованы разные варианты данных общих схем в соответствии с используемыми агентами и состоянием субъекта.
В некоторых частных случаях может быть полезно использование специфической последовательности введения, например одного перед другим. Например, как показано в данном документе (Фиг.5), нежелательные побочные явления дакарбазина оказывают влияние на активность антитела при совместном применении, но не в случае введения через 24 часа после гуманизированного антитела.
После общего описания настоящего изобретения изложенные принципы будут более понятными при обращении к нижеследующим примерам, которые представлены для пояснения и не ограничивают настоящего изобретения.
Примеры
Пример 1. Функциональный тест in vitro
Функциональный тест основан на способности hBAT-1 повышать выживаемость лимфоцитов мыши и лимфоцитов человека в культуре. В данном Примере проводили оценку влияния hBAT-1 на повышение выживаемости лимфоцитов как отдельно, так и в комбинации с химиотерапевтическими лекарственными препаратами; полученные результаты выражали в % разности выживаемости клеток или по площади под кривой эффекта дозы (AUC, выраженная в % разности × мкг/мл). Химиотерапевтический агент применяли одновременно или через 24 часа после лечения hBAT-1 в указанных концентрациях. Влияние химиотерапевтических агентов оценивали в функциональном тесте, включающим 5-ФУ (Фиг.1, 2 и 7), SN - 38 (активное производное иринотекана) (Фиг.3 и 4), цисплатин, оксалиплатин, таксол (паклитаксел) и дакарбазин (Фиг.5 и 7), цитарабин, циклофосфамид и доксорубицин (Фиг.6).
Полученные результаты указывают на то, что специфические агенты (например, 5-ФУ, цисплатин, оксалиплатин, паклитаксел и цитарабин) не оказывают нежелательного побочного действия на активность hBAT-1 в лимфоцитах мышей. Более того, при одновременном (цисплатин) или последовательном применении (5-ФУ и паклитаксел) с hBAT-1, наблюдали синергетический эффект, который выражался в повышении значений активности от 20% до 30% (% разности выживаемости клеток и AUC). При использовании только химиотерапевтического агента не наблюдали активности в повышении выживаемости лимфоцитов при проведении данного теста (Фиг.1C). Синергические результаты были получены с использованием изолированных CD4+ лимфоцитов человека и показывали, что последовательное лечение 5-ФУ или цисплатином в комбинации с hBAT приводит к двукратному повышению активности (% разности выживаемости клеток) по сравнению с активностью антитела, используемого отдельно (Фиг.7). Полученные результаты также позволяют предположить, что определенные химиотерапевтические агенты (например, SN - 38; циклофосфамид) могут не быть пригодными для использования в комбинации с гуманизированными антителами ВАТ, поскольку они не приводят к повышению выживаемости клеток при использовании в комбинации с hBAT-1 в культуре лимфоцитов мыши. Кроме того, определенные химиотерапевтические агенты (например, дакарбазин) могут быть пригодными только при последовательном введении (Фиг.3-5).
Пример 2. Комбинированная терапия для лечения колоректальной карциномы
Колоректальные карциномы (опухоли СТ26) индуцировали путем подкожной инъекции суспензии клеток СТ26 в количестве 106 клеток/мышь (n=6). День введения инъекции обозначен как день 0. 5-ФУ в количестве 20 мг/кг вводили внутрибрюшинно (i.p.) в дни 6-9, 15-17, 22-24 и 29-31, 36-38 и 43-45. hBAT-1 в количестве 10 мг/мышь вводили внутривенно (i.v.) в дни 10, 18, 25, 32 и 39 (Фиг.8-10). В случае рецидива заболевания после полного выздоровления (наблюдали только в группе животных, подвергнутых комбинированной терапии) продолжали лечение 5-ФУ в количестве 20 мг/кг в дни 73-74, 77-80, 85-87, 92-93 и hBAT-1 в количестве 10 мг/мышь внутривенно в дни 81 и 88.
При проведении исследования размеров опухоли после проведения единичного курса лечения объемы опухоли измеряли через день в дни с 4 по 16 после инокуляции опухолевых клеток. Полученные результаты указывают на то, что комбинированная терапия с использованием 5-ФУ является более эффективной по сравнению с применением 5-ФУ или hBAT-1 по отдельности (Фиг.8).
При проведении исследования размеров опухоли после проведения трех альтернативных курсов лечения, объемы опухоли измеряли через день в дни с 4 по 28. Полученные результаты указывают на то, что комбинированная терапия с использованием антитела hBAT-1 и химиотерапевтического агента 5-ФУ не только является более эффективной по сравнению с монотерапией 5-ФУ, но также сопровождается синергетическим эффектом повышения активности (Фиг.9).
При проведении исследования общей выживаемости определяли процент выживаемости, полученные данные представлены на Фиг.10 начиная с дня 28 и далее. Полученные результаты четко показывают, что среди мышей, подвергнутых комбинированной терапии, процент выживаемости значительно выше, чем среди мышей, подвергнутых монотерапии с использованием hBAT-1 или 5-ФУ, что приводит к стойкому полному выздоровлению приблизительно 17% мышей.
Пример 3. Комбинированная терапия для лечения меланомы
Мышам (n=7) подкожно вводили клетки В 16 меланомы в количестве 5×105 клеток/мышь. День инокуляции обозначен как день 0. 5-ФУ вводили внутрибрюшинно в количестве 50 мг/кг в дни 1-4 и 7-8. Группе мышей, подвергнутых комбинированной терапии, вводили внутривенно единичную дозу hBAT-1 в количестве 10 мг/мышь в день 10.
Процент выживаемости определяли начиная с 8 дня. У мышей, подвергнутых комбинированной терапии, процент выживаемости был значительно выше, чем у мышей, подвергнутых лечению высокими дозами 5-ФУ (Фиг.11).
Напротив, применение комбинированного лечения с использованием схемы последовательного введения, где введение гуманизированного антитела проводили после окончания 9-дневных циклов введения 5-ФУ на уровне дозолимитирующей токсичности (DLT) (50 мг/кг/день), что привело к повышению выживаемости мышей с экспериментальной моделью меланомы. Полученные результаты очевидно позволяют предположить, что применение комбинированной терапии повышает переносимость уровней DLT 5-ФУ.
Пример 4. Комбинированная терапия с использованием иринотекана (1)
Мышам (n=6) подкожно вводили клетки колоректальной карциномы (СТ26 опухоли) в количестве 106 клеток/мышь. День инокуляции обозначен как день 0. Иринотекан вводили i.p. в количестве 100 мг/кг в дни 7 и 15. hBAT-1 вводили внутривенно i.v. в количестве 10 мг/мышь на 10 день (Фиг.12).
При проведении исследования размеров опухоли после проведения единичного курса лечения объемы опухоли измеряли через день в дни с 4 по 18. Полученные результаты указывают на то, что комбинированная терапия с использованием антитела hBAT-1 и иринотекана является такой же эффективной, как монотерапия с использованием иринотекана, но менее эффективной, чем монотерапия с использованием hBAT-1 (Фиг.12).
Пример 5. Комбинированная терапия с использованием иринотекана (2)
Мышам (n=6) подкожно вводили клетки колоректальной карциномы (СТ26 опухоли) в количестве 106 клеток/мышь. День инокуляции обозначен как день 0. Иринотекан вводили i.p. в количестве 100 мг/кг в дни 7 и 15. hBAT-1 вводили внутривенно в количестве 10 мг/мышь на 10 день (Фиг.13).
Процент выживаемости определяли начиная с 16 дня. Полученные результаты показывают, что у мышей, подвергнутых комбинированной терапии, процент выживаемости сравним с процентом выживаемости мышей, подвергнутых монотерапии с использованием иринотекана, но ниже, чем у мышей, подвергнутых монотерапии с использованием hBAT-1 (Фиг.13).
Пример 6. Комбинированная терапия с использованием оксалиплатина
Мышам (n=6) подкожно вводили клетки колоректальной карциномы (СТ26 опухоли) в количестве 106 клеток/мышь. День инокуляции обозначен как день 0. Оксалиплатин вводили i.p. в количестве 1 мг/кг в дни 4, 7-10, 14-17, 22-24 и 29-31. hBAT-1 вводили внутривенно в количестве 10 мг/мышь в дни 11, 18, 25 и 32 (Фиг.14-15).
При проведении исследования размеров опухоли объем опухолей измеряли через день в дни с 4 по 23 после инокуляции. Полученные результаты указывают на то, что применение комбинированной терапии с использованием оксалиплатина более эффективно по сравнению с применение только оксалиплатина (Фиг.14).
При проведении исследования общей выживаемости процент выживаемости определяли начиная с 15 дня. Полученные результаты четко показывают, что у мышей, подвергнутых комбинированной терапии, процент выживаемости значительно выше, чем у мышей, подвергнутых монотерапии с использованием оксалиплатина, и приводит к стойкому полному выздоровлению у приблизительно 20% мышей (Фиг.15).
Мышам (n=3), которые были вылечены с применением комбинированной терапии с использованием hBAT-1 и оксалиплатина в течение 2-5 месяцев, повторно подкожно вводили клетки колоректальной карциномы (СТ26 опухоли) в количестве 10 клеток/мышь. Клетки колоректальной карциномы также вводили мышам, не подвергавшимся такому лечению ранее (naive) такого же возраста, используемым в качестве контроля (n=6). День инокуляции обозначен как день 0 (Фиг.16). Перед повторной инъекцией клеток CRC (заражением) мышам, проводили оценку ранее подвергнутые лечению мышей для полного клиренса уровня hBAT-1 в сыворотке крови с использованием способа специфической ELISA.
При проведении исследования размеров опухоли, объем опухолей измеряли через день в дни с 4 по 23 после инокуляции. У мышей, ранее вылеченных с применением комбинированной терапии с использованием hBAT-1 и оксалиплатина, не наблюдали развития опухоли в течение 2 месяцев последующего наблюдения, тогда как у мышей из контрольной группы в течение нескольких дней развитие опухоли было обнаружено у всех животных (Фиг.16А).
При проведении исследования общей выживаемости процент выживаемости определяли начиная с 21 дня после повторной инокуляции. Мыши, которым впервые вводили опухолевые клетки (CRC) умерли в течение 35 дней, тогда как у мышей, ранее вылеченных с применением комбинированной терапии с использованием hBAT-1 и оксалиплатина, не наблюдали роста опухоли, рецидива опухоли, и смертности в течение более чем 72 дней (Фиг.16В).
Мышам (описанные на Фиг.16, n=2), которые были вылечены с применением hBAT-1 и оксалиплатина и оказались устойчивыми к повторному заражению CRC в течение примерно 3 месяцев, вводили подкожно клетки опухоли карциномы молочной железы (опухоли 4Т1) в количестве 106 клеток/мышь. Данным мышам клетки опухоли вводили подкожно в участок, отличающийся от 1-го и 2-го (повторное заражение CRC) участков инъекции клеток CRC. Клетки 4Т1 также вводили мышам, не подвергавшимся такому лечению ранее (naive), такого же возраста (n=6). День инокуляции обозначен как день 0 (Фиг.17).
При проведении исследования размеров опухоли объем опухолей измеряли через день в дни с 3 по 21 после инокуляции. Развитие карциномы молочной железы наблюдали у мышей из обеих групп (Фиг.17А). Полученные результаты четко показывают, что мыши, вылеченные с применением комбинированной терапии hBAT-1 и оксалиплатина и обладающие приобретенной полной защитой против развития колоректальной карциномы (Фиг.16А), не обладают защитой против развития карциномы молочных желез (Фиг.17А).
При проведении исследования общей выживаемости процент выживаемости определяли начиная с 21 дня после повторной инокуляции. Мыши из обеих групп умерли в течение периода времени от 28 до 35 дней по причине развития карциномы молочных желез, что указывает на то, что мыши, обладающие продолжительной устойчивостью против рецидива CRC не обладают полной защитой от развития опухоли другого типа, например, карциномы молочных желез. Поскольку все мыши, ранее подвергнутые лечению, были протестированы на полную элиминацию циркулирующего в сыворотке крови антитела согласно изобретению, вероятно, что приобретенная специфическая устойчивость к развитию колоректальной карциномы является результатом не активной терапии, а скорее, ответной реакции иммунной памяти, индуцированной ранее проведенным лечением с использованием антитела согласно изобретению, и оксалиплатина.
В целом, применение комбинированной терапии с использованием антитела согласно изобретению и специфических химиотерапевтических агентов, таких как 5-ФУ или оксалиплатин, при переменном режиме введения приводит к повышению противоопухолевой активности, что подтверждается снижением роста опухоли и повышением выживаемости мышей с опухолью. Неожиданным образом, у мышей, подвергнутых комбинированной терапии, наблюдали полное стойкое выздоровление и, в случае использования оксалиплатина, даже приобретение защитной памяти против рецидива опухоли, что было показано при повторном заражении специфической опухолью (CRC).
Пример 7. Влияние СТ-011 на Т - эффекторные / Т - клетки памяти человека
Активность hBAT-1 (СТ-011) оценивали при проведении теста, основанного на жизнеспособности лимфоцитов человека. Эффекторные клетки / клетки памяти CD4+CD45RO+ и нативные (naive) CD4+CD45RO - лимфоциты обрабатывали hBAT в концентрации 1 мкг/мл с последующей инкубацией в течение 72 часов и 96 часов. Полученные результаты выражали как % разности выживаемости клеток (Фиг.18).
Полученные результаты четко указывают на то, что СТ-011 значительно влияет на повышение выживаемости эффекторных клеток / клеток памяти CD4+CD45RO+ лимфоцитов человека, но не нативных (naive) CD4+CD45RO - лимфоцитов. Данные об активности СТ-011 по обеспечению жизнеспособности предшественников клеток памяти находятся в соответствии с результатами, полученными in vivo, которые указывают на то, что СТ-011 индуцирует формирование иммунной памяти против рецидива опухоли.
Пример 8. Клиническое испытание фазы I гуманизированного моноклонального антитела СТ-011
Введение
Целью данного исследования является проведение оценки значений дозолимитирующей токсичности (DLT, ДЛТ), определение максимальной переносимой дозы (MTD, МПД) и изучение фармакокинетических параметров СТ-011 при единичном введении пациентам с диагнозом запущенные гематобластозы (поздняя стадия). Полное описание проведенного исследования см. Berger с сотр. (Clin. Cancer Res. 2008; 14(10) May 15, 2008).
Пациенты и способы
В данное исследование включали пациентов с диагнозом, который соответствовал одному из нижеперечисленных гемобластозов: острый лимфоцитарный лейкоз (ОЛЛ), хронический лимфоцитарный лейкоз (ХЛЛ), неходжкинская лимфома (НХЛ), лимфома Ходжкина (ХЛ) или множественная миелома (ММ) в поздней стадии после проведения химиотерапии и/или трансплантации стволовых клеток (SCT, ТСК). Пациенты допускались до участия в данном исследовании при условии, что они соответствовали критериям, установленным Berger et al.
Важно заметить, что данные критерии включали: не менее 4 недель после трансплантации стволовых клеток (ТСК) или 1 недели после инфузии донорских лимфоцитов (DLI, ИДЛ); ожидаемая продолжительность жизни >3 месяцев. Исключали пациентов, которые или получали или еще не отвечали на действия иммуносупрессивной терапии, или с диагнозами аутоиммунных нарушений. Исключение было сделано для лечения с применением гидроксимочевины у пациентов с диагнозом ОЛЛ (AML), которым было разрешено принять участие в данном исследовании. Было запрещено применение сопутствующего противоракового лечения (химиотерапии и иммунотерапии), которое соответственно должно было быть закончено по меньшей мере за 4 недели до введения СТ-011.
В данном исследовании принимали участие 17 пациентов. Один из пациентов, получавший самую низкую дозу препарата (0,2 мг/кг), был повторно принят для участия в исследовании через 5 месяцев после первого введения самой высокой дозы (3,0 мг/кг) в качестве благотворительно-испытательного лечения в целом для 18 типов лечения. Общее количество СТ-011 определяли на основании планового дозирования (мг/кг) и массы тела. Инфузию проводили пошаговым способом с повышением скорости потока с 50 мл/час до 100 мл/час, и все пациенты получали предварительное лекарственное средство до начала инфузии, состоящее из болеутоляющего средства (парацетамол), кортикостероидного препарата (гидрокортизона 100 мг) и антигистаминный препарат (фенерган). Начальная доза составляла 0,2 мг/кг, которая была в несколько десятков раз более низкой, чем самая высокая доза, проверенная при проведении токсикологических исследований у низших приматов и мышей на основании дозы, эквивалентной для человека. В дальнейшем применяли дозы 0,6 мг/кг; 1,5 мг/кг; 3 мг/кг, и 6 мг/кг. Повышение дозы с одного уровня на другой осуществляли только после оценки параметров всех пациентов, получавшие предыдущую дозу, в течение по меньшей мере 7 дней после введения дозы.
Токсичность оценивали в соответствии с Общими критериями токсичности Национального института рака (CTCAE V2) и по интенсивности (т.е., слабо выраженная, умеренная, острая). ДЛТ определяли как дозу, которая индуцирует любое проявление токсичности уровня 3 или уровня 4 у одного или более пациентов, или любое проявление токсичности уровня 2 по меньшей мере у 2/3 или 3/6 пациентов. Развитие нежелательных явлений, которые не были отнесены к СТ-011, не считали связанными с токсичностью в отношении повышения дозы и правил МПД.
После введения лекарственного препарата проводили проверку пациентов на безопасность, включая развитие нежелательных явлений и оценку клинических и лабораторных ответных реакций через 24 часа, 48 часов, и в дни 7, 14, и 21.
Отбор образцов и показателей, используемых для оценки клинических реакций, анализа фармакокинетических параметров, активации иммунной системы и статистического анализа проводили согласно Berger с сотр. (2008).
Результаты
Основные характеристики пациентов, принимавших участие в данном исследовании (n=17), перечислены в Таблице 1. Пациенту 003, изначально получавшему дозу 0,2 мг/кг, потребовалось повторное благотворительно-испытательное лечение, в виде повторного лечения с использованием дозы 3 мг/кг. Интервал в 5 месяцев между первым и вторым этапом лечения, разные схемы лечения были проанализированы у отдельных пациентов. Таким образом, число введений СТ-011, используемых для проведения анализа, составило 18.
Сокращения: ОЛЛ - острый лимфоцитарный лейкоз, ХМЛ - хронический миеломоноцитарный лейкоз, ДККЛ - диффузная крупноклеточная В-клеточная лимфома; FAB классификация - French, American и British (французский, американский и британский); M1, M2, М4 в соответствии с FAB- классификацией; NR - незначимый; ТСК - трансплантация стволовых клеток.
При проведении данного исследования отсутствует ДЛТ. Показаны безопасность и хорошая переносимость СТ-011 без проявления токсичности, связанной с лечением. Отсутствует МПД единичной дозы.
При проведении данного исследования 61% (11 из 18) пациентов отмечали развитие нежелательных явлений (АЕ), наиболее частым из которых была диарея, но решено, что развитие данной нежелательной реакции не было связано с лечением СТ-011.
Наблюдали развитие четырех случаев нежелательных явлений, которые закончились смертью пациентов и проявившихся у пациентов с диагнозом ОЛЛ. При проведении клинического анализа показано, что причиной смерти указанных пациентов был приступ устойчивой лейкемии, что не связано с исследованием лекарственным препаратом.
Через 21 день после начала исследования не наблюдали изменений среднего процентного значения бластных клеток в периферической крови у пациентов с диагнозом ОЛЛ за исключением одного пациента с диагнозом ОЛЛ (снижение числа бластных клеток в периферической крови с 50% до 5%). Кроме того, не наблюдали изменений параметров заболевания в течение 21 для исследования у 2 пациентов с диагнозом ХЛЛ, у 4 пациентов с диагнозом НХЛ и у одного пациента с диагнозом Множественная Миелома.
Общая выживаемость всех пациентов (n=18) в течение 21 дня составила 76%, с 95% доверительным интервалом 48% - 90%. Не отмечено различий в средних значениях времени выживания в зависимости от применяемой дозы.
Проводили наблюдение выживаемости пациентов по прошествии 21 дня исследования. Среднее время выживания при проведении исследования составило 25±27 недель в интервале от 1,7 до более 77 недель. Результаты данного исследования позволяют предположить, что у 6 пациентов наблюдали заметную реакцию на лечение, которая сопровождалась продлением времени выживания в среднем но меньшей мере 60 недель. Данные 6 "ответивших на лечение" пациентов представлены в Таблице 2. У одного пациента, 015, получавшего дозу четвертого уровня 3,0 мг/кг наблюдали полную ремиссию. Данному пациенту был поставлен диагноз фолликулярная лимфома III стадии, включая узлы ниже и выше диафрагмы. Данный пациент ранее не получал никакого лечения указанного заболевания. При проведении компьютерной томографии при периодической проверке через 10 после лечения с использованием СТ-011 наблюдали полное исчезновение опухолевых образований. Интересно отметить, что данный пациент не получал никакого дальнейшего лечения между лечением с использованием СТ-011 и проверкой по истечении 10 месяцев. У данного пациентов наблюдали стойкое выздоровление через 68 недель после завершения лечения с использованием СТ-011. Одну минимальную ответную реакцию наблюдали у пациента с диагнозом ОЛЛ, получавшим СТ-011 в концентрациях 0,2 и 3 мг/кг). У данного пациента наблюдалась прогрессия 61 неделю после получения СТ-011. У четырех пациентов наблюдали стабильное течение заболевание: один пациент с диагнозом болезнь Ходжкина получал СТ-011 в количестве 0,6 мг/кг имел стабильное течение заболевания в течение 35 недель. Два пациента с диагнозом ХЛЛ получали антитело в количестве 0,6 мг/кг и в количестве 1,5 мг/кг и показывали стабильное течение заболевания в течение 36 недель и более 78 недель соответственно. Пациент с диагнозом ММ получавший СТ-011 в количестве 6,0 мг/кг, показывал стабильное течение заболевание в течение более 60 недель.
Предыдущее лечение данного заболевания отсутствует
Исчезновение опухолевых образований на КТ замечено через 10 месяцев после использования СТ-011
Стабильное течение заболевания >17 месяцев
Стабильное течение заболевания в течение 8 месяцев до ухудшения
Предыдущее лечение данного заболевания отсутствует
Стабильное течение заболевания в течение >13 месяцев
Трансфузия тромбоцитов - независимо в течение 9 месяцев
Снижение числа периферических бластных клеток (с 50% до 5%) при получении первой дозы
Обсуждение и выводы
Общая выживаемость всех пациентов в течение периода лечения составила 76% и при последующем наблюдении по прошествии 21 дней данного исследования средняя выживаемость составила 25 недель. При том обстоятельстве, что большинство пациентов находились на поздней стадии заболевания, удивительным и неожиданным оказалось то, что у шести пациентов наблюдали признаки клинического улучшения и пролонгированный период выживаемости, который в среднем составил 60 недель.
Среднее значение t½ CT - 011 находилось в интервале от 217 часов до 410 часов (от 9 до 17 дней) в соответствии с результатами наблюдений по другим моноклональным антителам у человека. Важно заметить, что средние значения t½ для шести пациентов с выраженными клиническими результатами (Таблица 2) были несколько выше, чем у остальных пациентов. Принимая во внимание продолжительность реакции, которая у данных шести пациентов в среднем составила 60 недель, и фармакокинетические параметры для данного антитела, по которым наивысшее значение времени полужизни составило 410 часов, вероятно, что у некоторых пациентов индуцируются механизмы опухоль-специфической иммунной памяти, что приводит к продолжительному противоопухолевой иммунной реакции, которая сохраняется в течение продолжительного периода времени после элиминации антитела из кровотока.
Последующее описание специфических вариантов осуществления изобретения содержит достаточно полное описание сущности настоящего изобретения и с использованием современных знаний специалист способен легко модифицировать и/или адаптировать данные специфические варианты осуществления изобретения для различного применения без проведения дополнительной экспериментальной работы и без отклонения от центральной концепции. Таким образом, данные адаптации и модификации включены в изобретение и находятся в числе эквивалентов описанных вариантов осуществления изобретения. Следует понимать, что стиль или терминология используются для описания изобретения, но не для его ограничения. Могут быть внесены изменения в средства, материалы и стадии процесса, необходимые для осуществления различных действий, описываемых в настоящем документе, без отклонения от сущности настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ ГУМАНИЗИРОВАННЫХ ИММУНОМОДУЛИРУЮЩИХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ | 2012 |
|
RU2604814C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ К КЛАУДИНУ 18.2 ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2789478C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ К КЛАУДИНУ 18.2 ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2665321C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ К КЛАУДИНУ 18.2 ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2662066C2 |
| ИНГИБИТОРЫ PD-1 / PD-L1 ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2742312C1 |
| ПРИМЕНЕНИЕ КОНЪЮГАТА АНТИ-HER2 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ПРИ ЛЕЧЕНИИ УРОТЕЛИАЛЬНОЙ КАРЦИНОМЫ | 2019 |
|
RU2750817C1 |
| ИНГИБИТОРЫ PD-1 / PD-L1 ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2714233C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ПРИМЕНЕНИЕМ АНТАГОНИСТОВ АКСИАЛЬНОГО СВЯЗЫВАНИЯ PD-1 И VEGF АНТАГОНИСТОВ | 2013 |
|
RU2689760C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ И ДИАГНОСТИКИ РЕЗИСТЕНТНОГО К ХИМИОТЕРАПИИ РАКА | 2015 |
|
RU2710735C2 |
| ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩАЯ АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 | 2014 |
|
RU2678700C2 |



















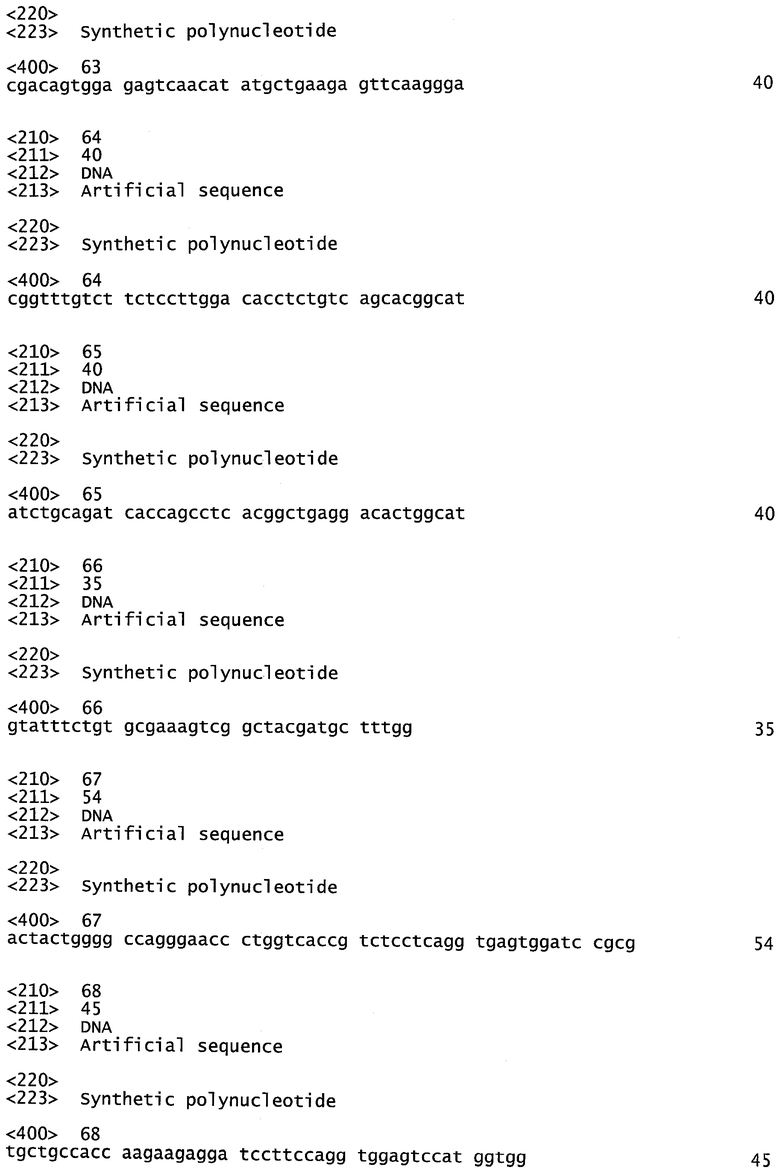






















































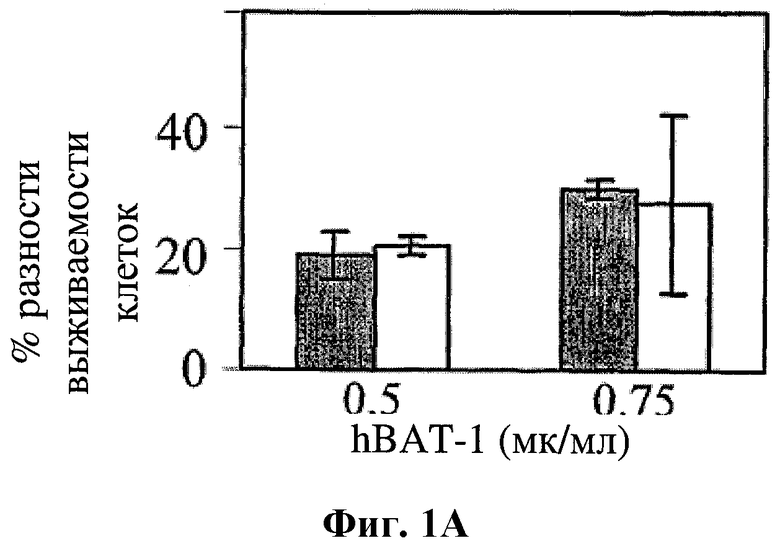
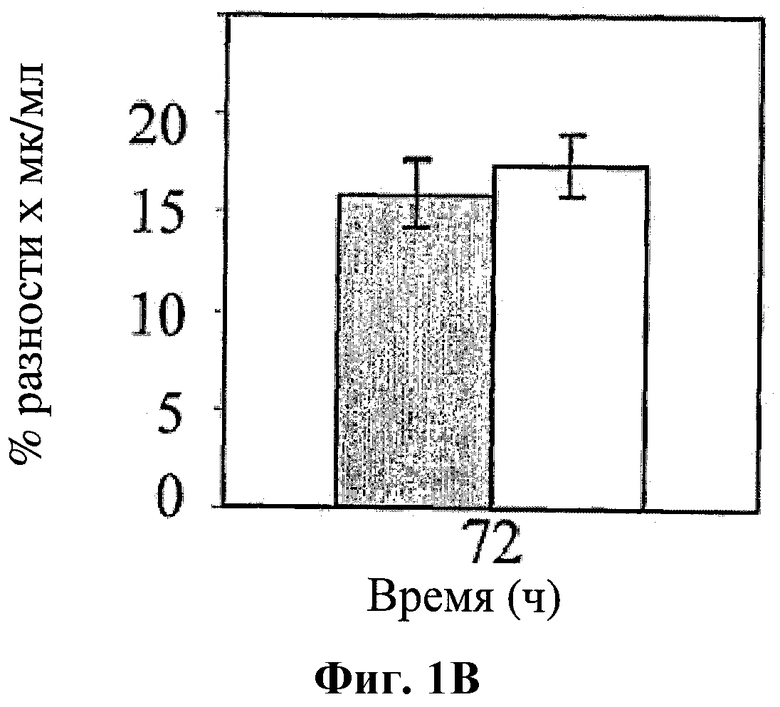
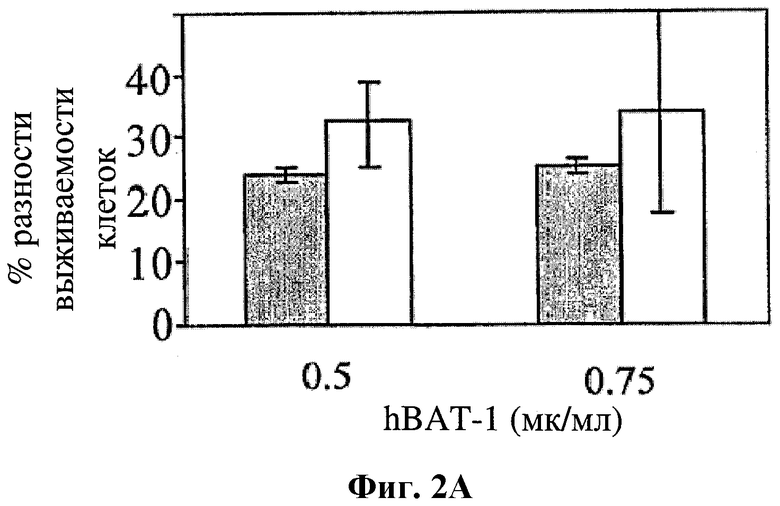
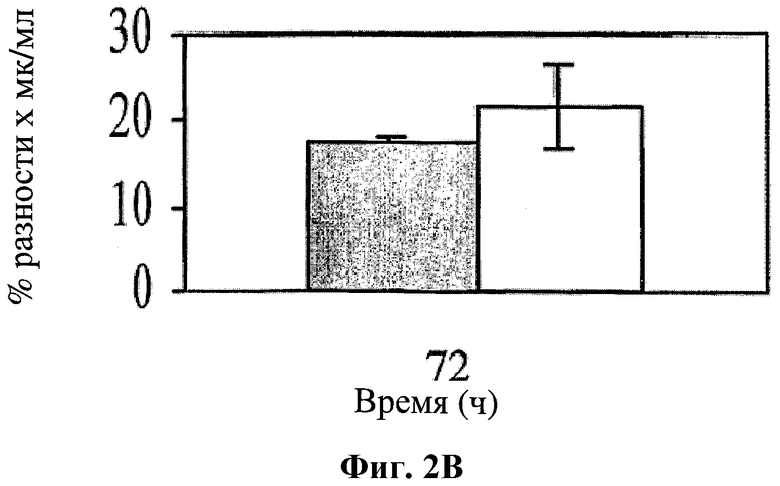
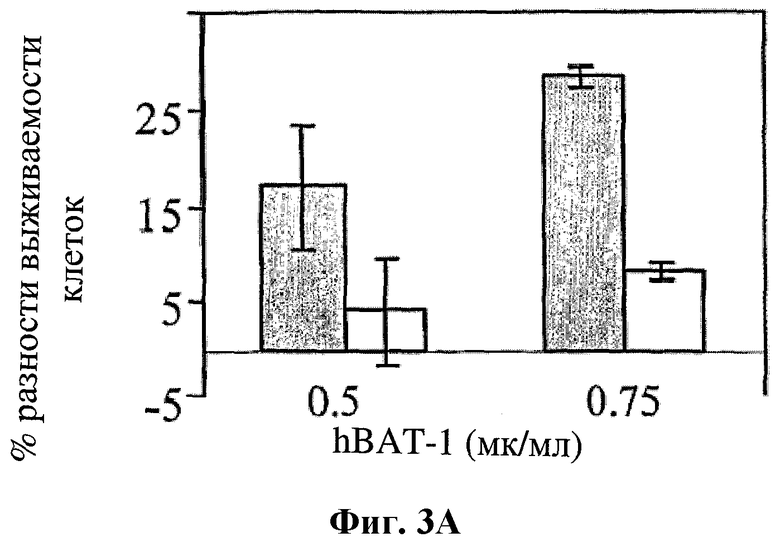

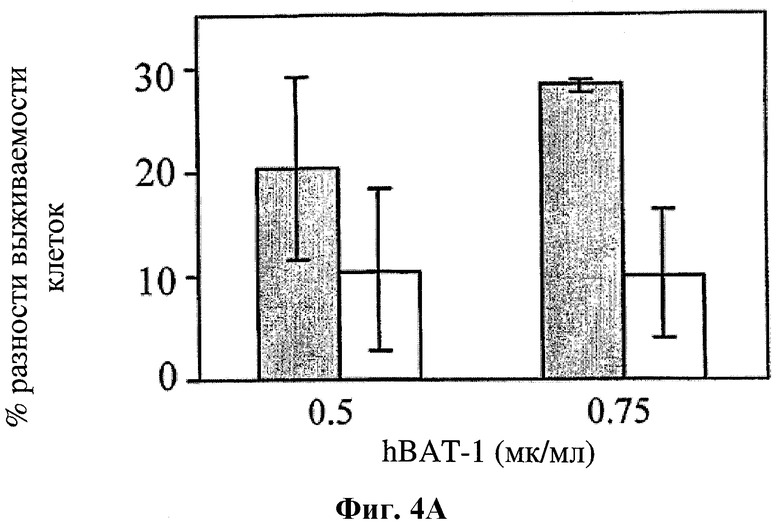
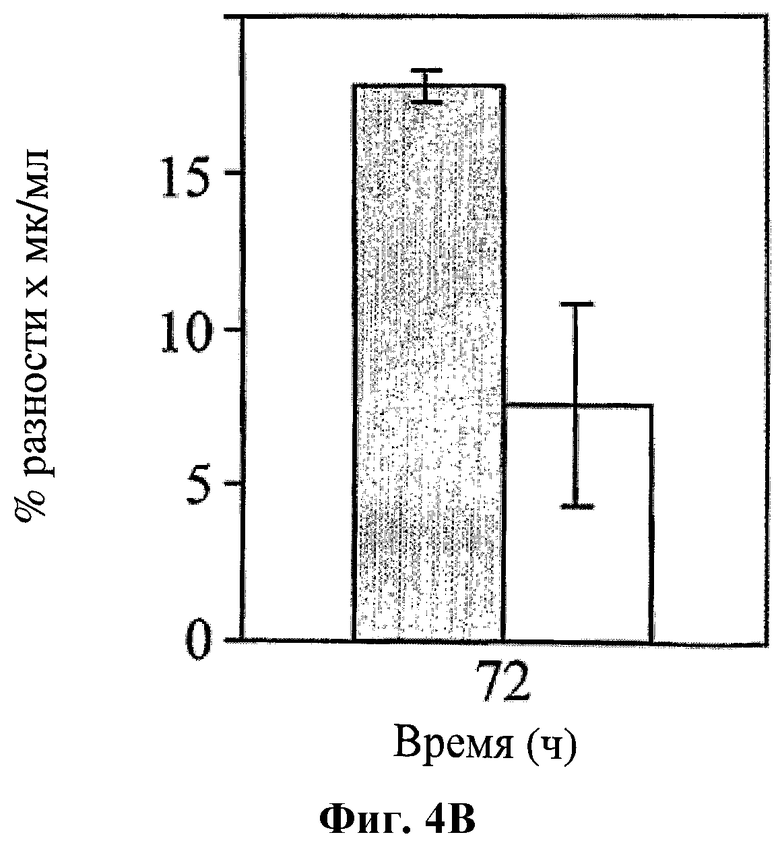
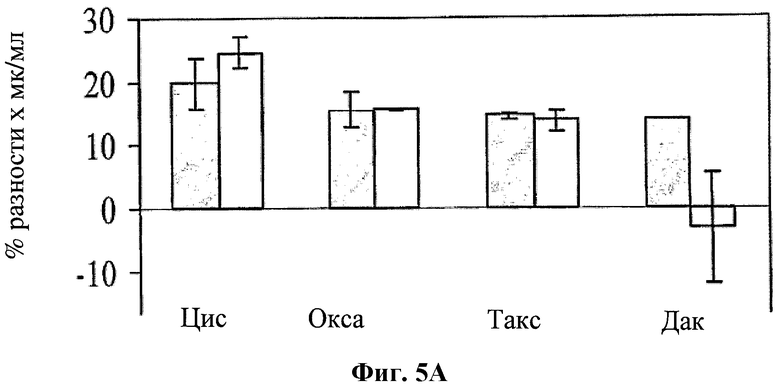
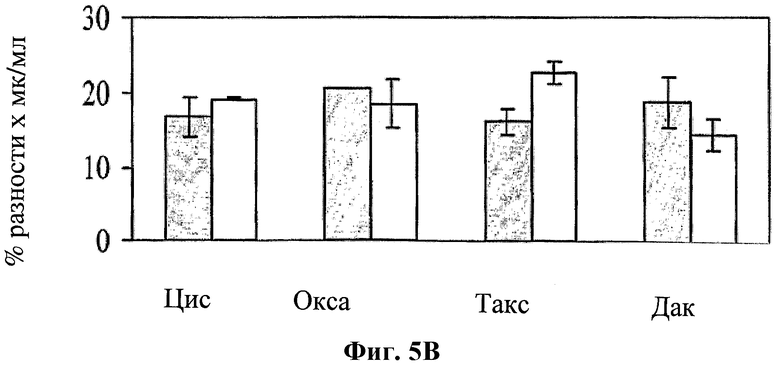

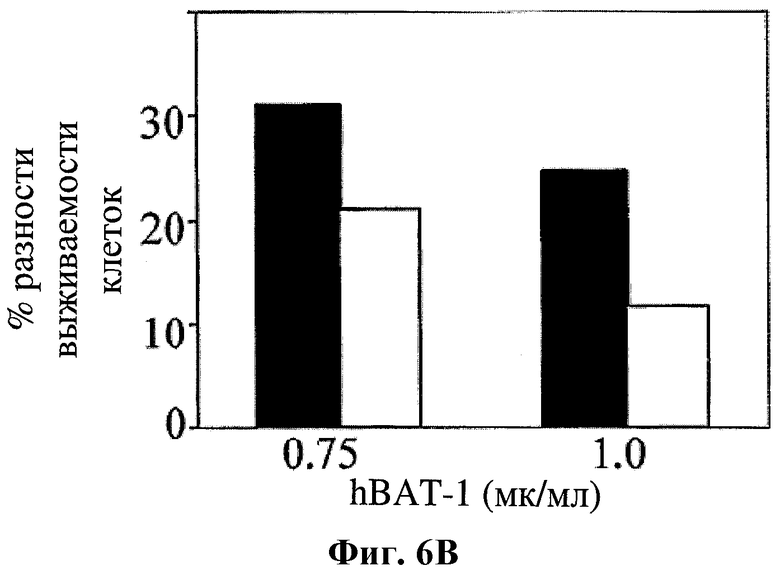
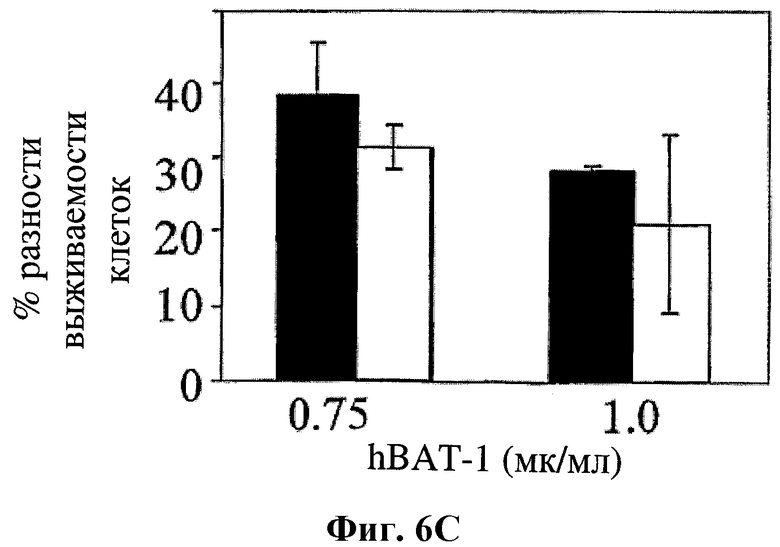
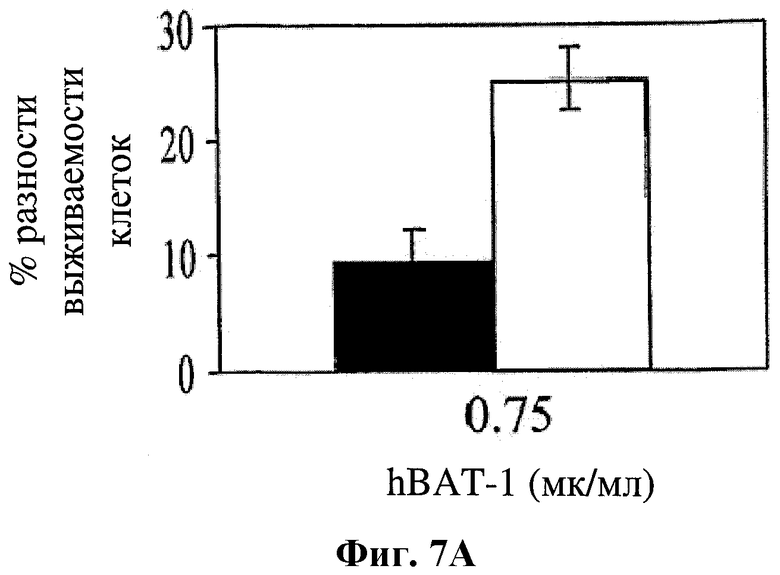
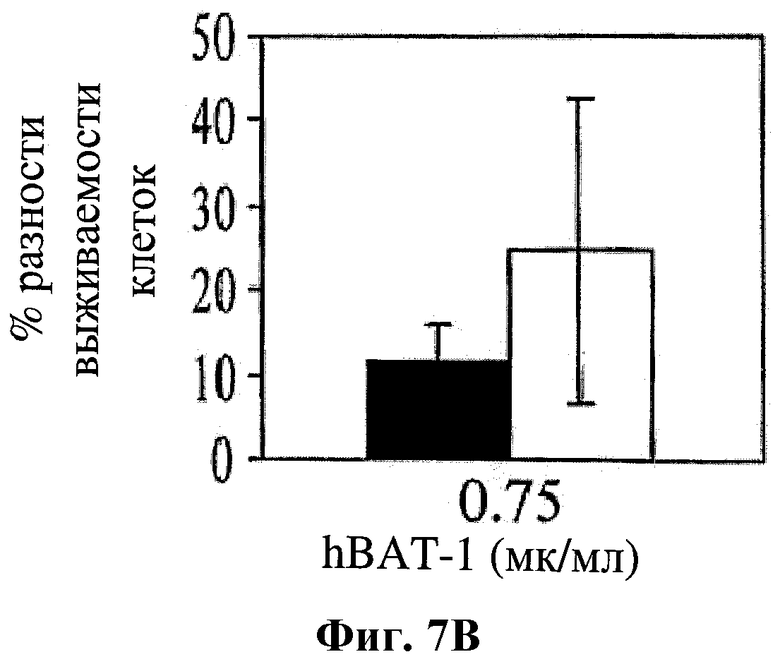
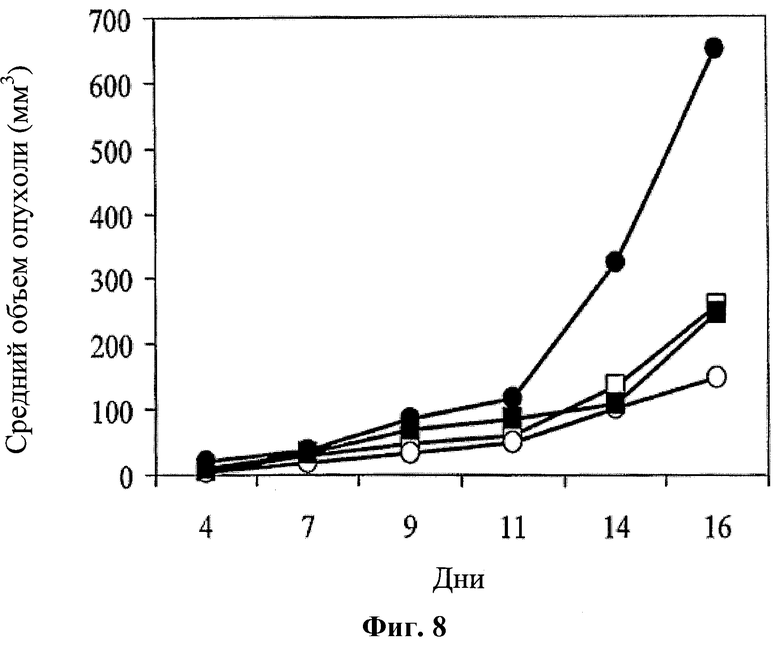
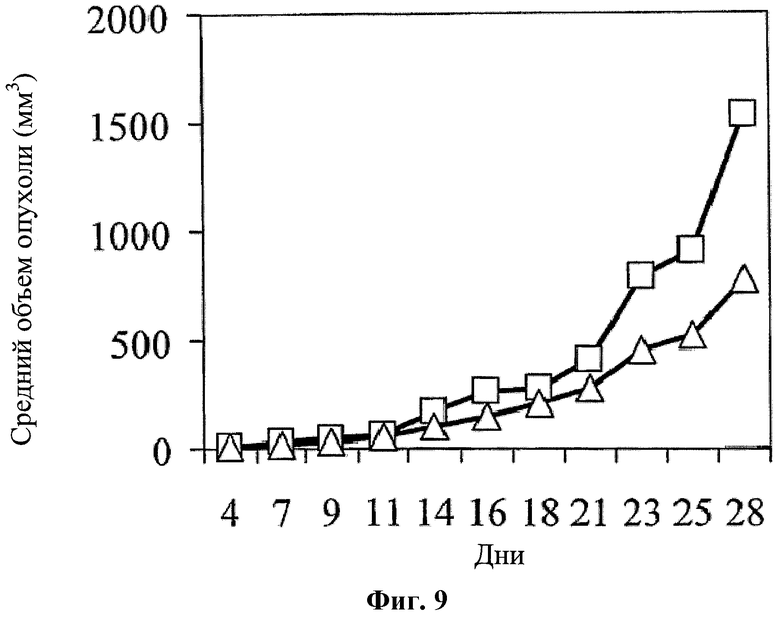
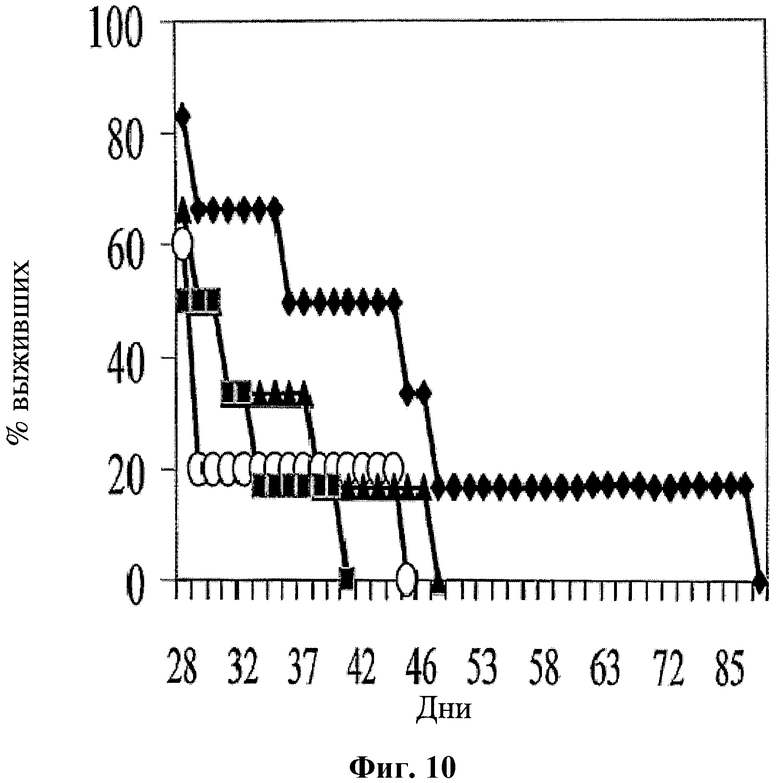
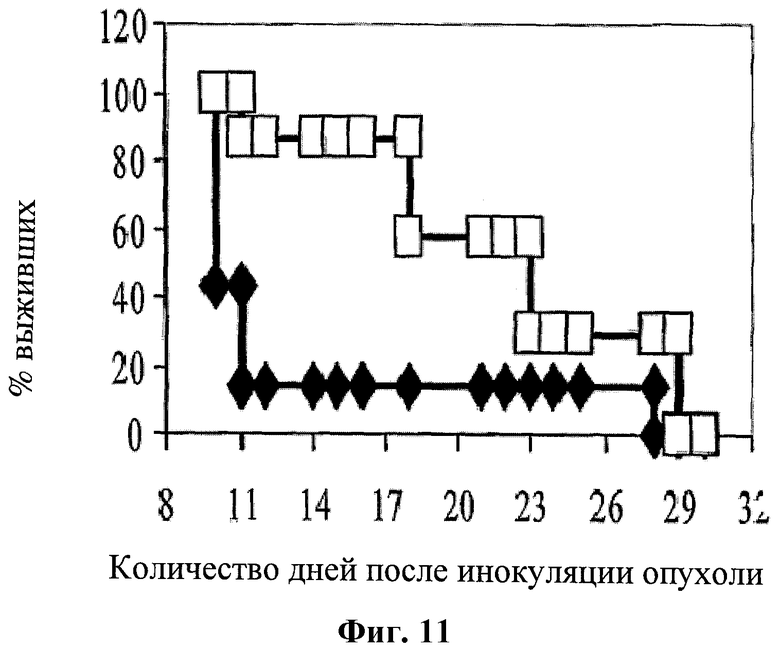
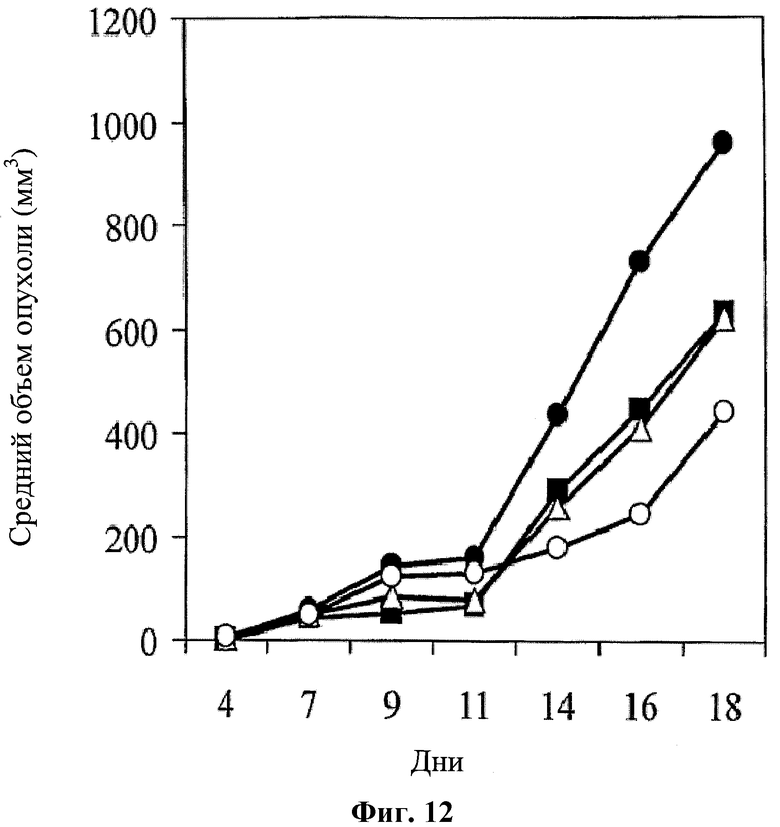
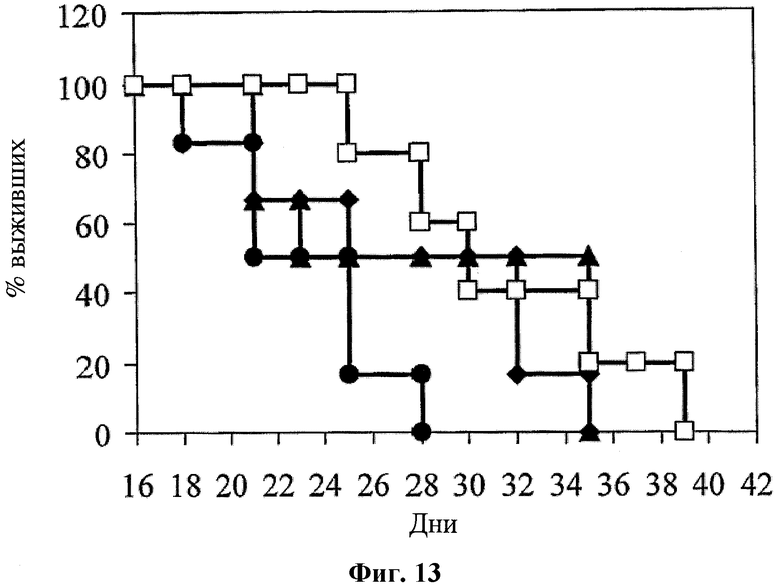
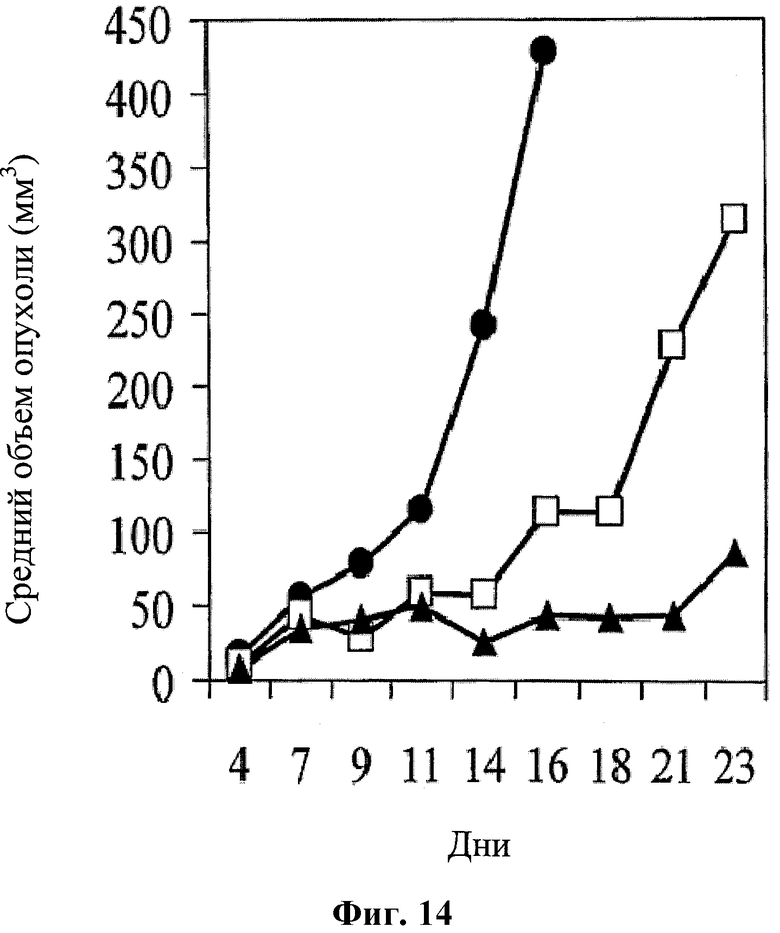
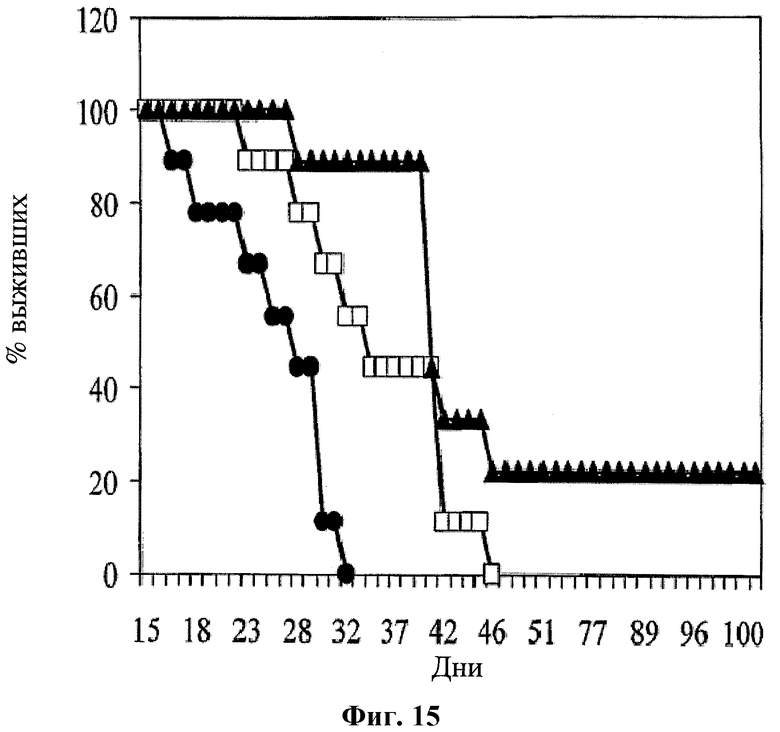
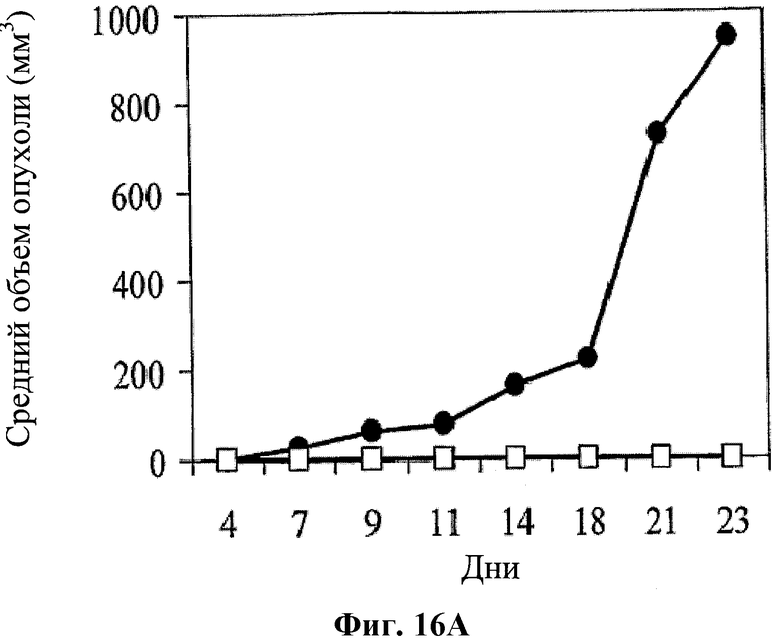
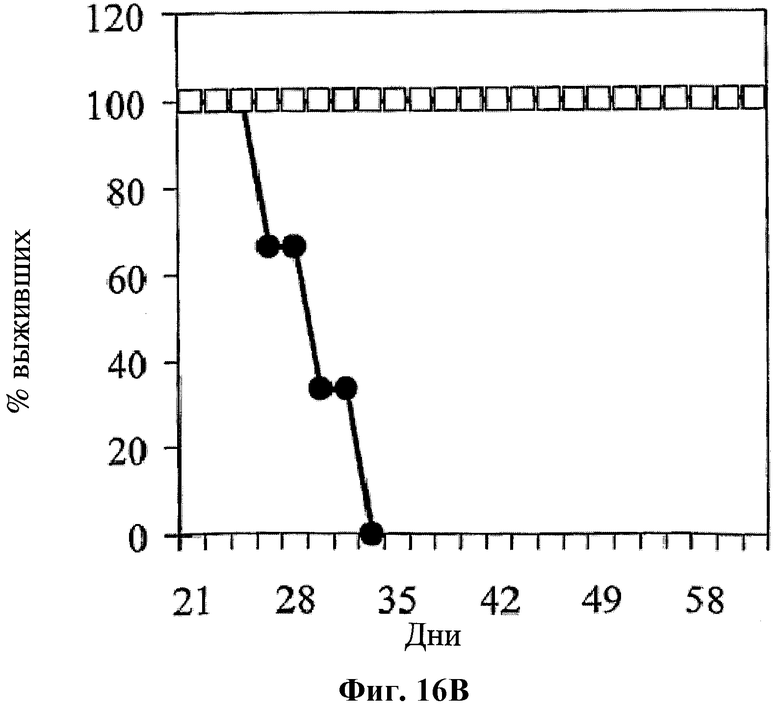
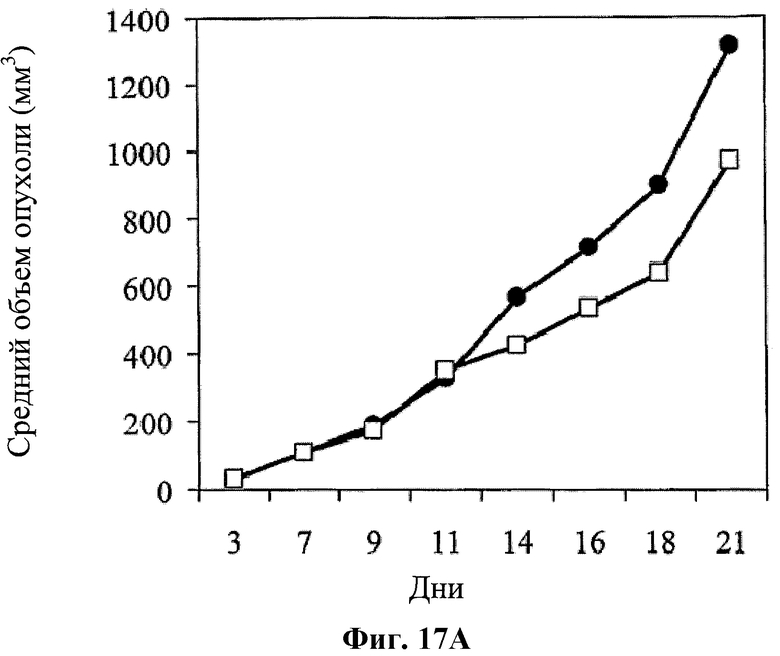
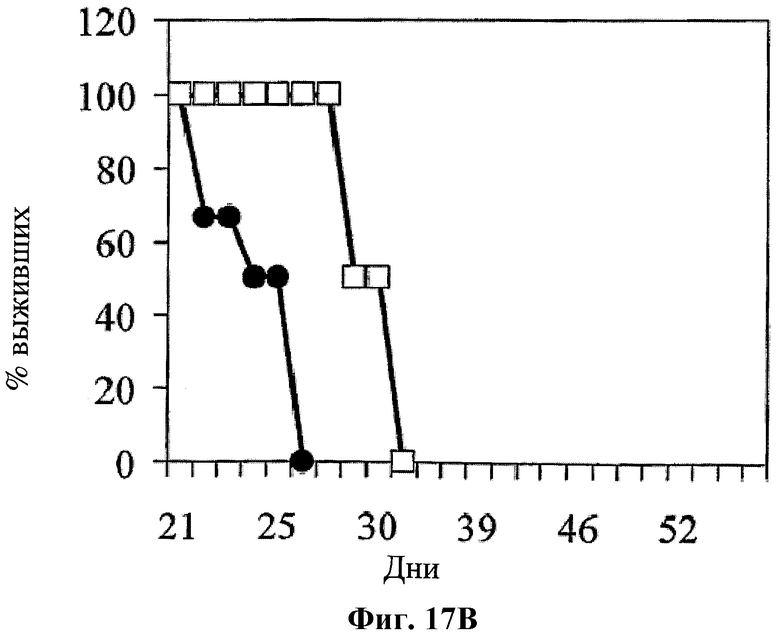
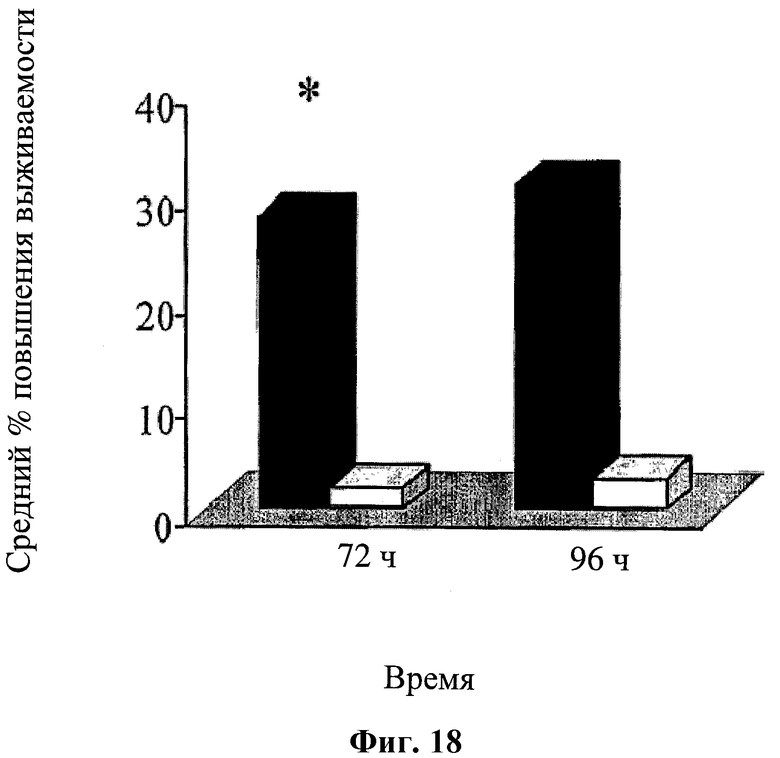


Настоящее изобретение относится к иммунологии и биотехнологии. Предложено применение гуманизированного моноклонального антитела или его фрагмента, включающего вариабельные области лёгкой и тяжелой цепи, полученные из моноклонального антитела мыши mBAT-1, в комбинации по меньшей мере с одним химиотерапевтическим агентом на основе платины, антиметаболитов или паклитаксела для лечения опухолевого заболевания. Описано применение гуманизированного моноклонального антитела или его фрагмента, включающего вариабельные области лёгкой и тяжелой цепи, полученные из моноклонального антитела мыши mBAT-1, в комбинации с по меньшей мере одним химиотерапевтическим агентом на основе платины, антиметаболитов или паклитаксела для повышения выживаемости субъекта с опухолью, которого лечат по меньшей мере одним химиотерапевтическим агентом. Изобретение обеспечивает синергетический эффект, выраженный в увеличении жизнеспособности лимфоцитов или уменьшении объёма опухоли по сравнению с использованием h-ВАТ, что может найти применение в медицине для лечения опухолей. 2 н. и 9 з.п. ф-лы, 20 ил., 2 табл., 8 пр.
1. Применение (i) гуманизированного моноклонального антитела или его фрагмента, содержащего вариабельную область легкой цепи, выбранную из группы, состоящей из: BATRκA (SEQ ID NO: 15), BATRκB (SEQ ID NO: 16), BATRκC (SEQ ID NO: 17)и BATRκD (SEQ ID NO: 18), и вариабельную область тяжелой цепи, выбранную из группы, состоящей из: BATRHА (SEQ ID NO: 20), BATRHB (SEQ ID NO: 21), BATRHC (SEQ ID NO: 22), BATRHD (SEQ ID NO: 23) и BATRHE (SEQ ID NO: 24) в комбинации с (ii) по меньшей мере одним химиотерапевтическим агентом, выбранным из лекарственных средств на основе платины, антиметаболитов или паклитаксела, для лечения опухолевого заболевания.
2. Применение (i) гуманизированного моноклонального антитела или его фрагмента, содержащего вариабельную область легкой цепи, выбранную из группы, состоящей из: BATRκA (SEQ ID NO: 15), BATRκB (SEQ ID NO: 16), BATRκC (SEQ ID NO: 17)и BATRκD (SEQ ID NO: 18), и вариабельную область тяжелой цепи, выбранную из группы, состоящей из: BATRHА (SEQ ID NO: 20), BATRHB (SEQ ID NO: 21), BATRHC (SEQ ID NO: 22), BATRHD (SEQ ID NO: 23) и BATRHE (SEQ ID NO: 24), в комбинации с (ii) по меньшей мере одним химиотерапевтическим агентом, выбранным из лекарственных средств на основе платины, антиметаболитов или паклитаксела, для повышения выживаемости субъекта с опухолью, причём указанного субъекта лечат с использованием по меньшей мере одного химиотерапевтического агента.
3. Применение гуманизированного моноклонального антитела по п.1, причём указанное гуманизированное антитело включает вариабельные участки, выбранные из группы, включающей: BATRHA/BATRκA (SEQ ID NO: 20/SEQ ID NO: 15), BATRHB/BATRκA (SEQ ID NO: 21/SEQ ID NO: 15), BATRHB/BATRκB (SEQ ID NO: 21/SEQ ID NO: 16), BATRHC/BATRκB (SEQ ID NO: 22/SEQ ID NO: 16), BATRHB/BATRκD (SEQ ID NO: 21/SEQ ID NO: 18), и BATRHC/BATRκD (SEQ ID NO: 22/SEQ ID NO: 18), предпочтительно где указанное гуманизированное моноклональное антитело включает вариабельные области, соответствующие BATRHC/BATRκD (SEQ ID NO: 22/SEQ ID NO: 18).
4. Применение гуманизированного моноклонального антитела по любому из пп.1-3, в котором фрагмент гуманизированного антитела выбран из группы, включающей: Fv, F(ab'), F(ab')2 и одноцепочечное антитело, или в котором гуманизированное антитело или его фрагмент сохраняет противоопухолевую активность mBAT-1.
5. Применение гуманизированного моноклонального антитела по любому из пп.1 или 2, в котором указанный по меньшей мере один химиотерапевтический агент выбран из группы, включающей антиметаболит, выбранный из группы, состоящей из следующего: 5-фторурацил, урамустин, урацил, капецитабин, 6-меркаптопурин, метотрексат, гемцитабин, цитарабин, флударабин и пеметрексед; и лекарственное средство на основе платины, выбранное из группы, включающей: цисплатин, карбоплатин и оксалиплатин.
6. Применение гуманизированного моноклонального антитела по любому из пп.1-3, в котором указанный по меньшей мере один химиотерапевтический агент выбран из группы, состоящей из 5-фторурацила, цитарабина, оксалиплатина, паклитаксела и их комбинаций.
7. Применение гуманизированного антитела по любому из пп.1-2, в котором введение гуманизированного антитела и по меньшей мере одного химиотерапевтического агента осуществляют по существу одновременно, параллельно, альтернативно, последовательно или поочередно или в котором введение гуманизированного антитела осуществляют до первичного введения по меньшей мере одного химиотерапевтического агента.
8. Применение по любому из пп.1-2, в котором гуманизированное антитело и по меньшей мере один химиотерапевтический агент вводят по перекрывающейся схеме; или дополнительно включающее лечение субъекта путём лучевой терапии.
9. Применение по п.1, дополнительно включающее оценку по меньшей мере одного параметра, выбранного из группы, состоящей из: скорости роста опухоли, объема опухоли, количества метастазов, рецидива опухоли и их комбинаций.
10. Применение по любому из пп.1-2, в котором введение гуманизированного антитела и по меньшей мере одного химиотерапевтического агента, либо каждого отдельно, либо обоих осуществляют способом, выбранным из группы, включающей внутривенное, пероральное, внутрибрюшинное, подкожное введение, изолированную перфузию конечностей, инфузию внутрь органа и их комбинаций.
11. Применение гуманизированного моноклонального антитела по любому из пп.1-2, в котором опухолевое заболевание выбрано из группы, включающей следующие: колоректальная карцинома; легочная карцинома; карцинома молочных желез; меланома; карцинома яичников; карцинома шейки матки, рак поджелудочной железы; множественная миелома; почечноклеточная карцинома; неходжкинская лимфома; Болезнь Ходжкина; лимфома из клеток мантийной зоны; саркома Капоши, плоскоклеточная карцинома, базальноклеточная карцинома, острый миелолейкоз; хронический миелоцитоз; острый лимфоцитарный лейкоз и хронический лимфоцитарный лейкоз.
| WO2006021955 A2, 02.03.2006, | |||
| HARDY et al., "BAT monoclonal antibody immunotherapy of human metastatic | |||
| colorectal carcinoma in mice", Cancer Letters 229, 2005, pp | |||
| Искусственный двухслойный мельничный жернов | 1921 |
|
SU217A1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, НУКЛЕИНОВАЯ КИСЛОТА И ВЕКТОР, КОДИРУЮЩИЕ АНТИТЕЛО, И ИСПОЛЬЗОВАНИЕ АНТИТЕЛА ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ЗАБОЛЕВАНИЙ | 1999 |
|
RU2235131C2 |
| При публикации сведений о выдаче патента будет использовано описание в первоначальной редакции | |||
Авторы
Даты
2014-10-27—Публикация
2009-02-11—Подача