Область техники
Данное изобретение относится к медицине, в частности к применению глутарилгистамина или его фармацевтически приемлемой соли для профилактики и лечения заболеваний, вызываемых (+)РНК-содержащими вирусами.
Уровень техники
Вирусные инфекции являются огромной проблемой для здравоохранения. Количество лицензированных антивирусных препаратов в отношении большинства опасных и особо опасных вирусных инфекций не разработаны, а существующие нередко являются токсичными для человека или обладают недостаточной эффективностью. Большинство существующих или находящихся в разработке препаратов действуют через специфическое взаимодействие с определенными вирусными белками. Такие препараты имеют ограниченный спектр действия и способствуют быстрому появлению резистентных вариантов вирусов. В системе классификации вирусов по Балтимору к IV классу относятся вирусы, содержащие одноцепочечную (+)РНК. К этому классу принадлежат представители рода энтеровирусов из семейства пикорнавирусов и рода флавивирусов из семейства флавивирусов.
Перечисленные группы вирусов выработали эффективную стратегию подавления антивирусных программ клетки. Столь агрессивная стратегия подавления системы клеточной противовирусной защиты приводит к высокой контагиозности и патогенности данных групп вирусов, подтверждаемой списком заболеваний, вызываемых представителями рода энтеровирусов (полиомиелит, вирусный ринит (риновирусная простуда), инфекция, вызванная энтеровирусом 71) и представителями рода флавивирусов (желтая лихорадка, лихорадки Западного Нила и денге, клещевого энцефалита, энцефалита Сент-Луис, энцефалита долины Муррей).
Среди представителей рода энтеровирусов в настоящее время наибольшую проблему составляют человеческие риновирусы. Риновирусы вызывают у человека и животных воспалительные заболевания верхних дыхательных путей, размножаясь в клетках слизистой оболочки носоглотки. Риновирусы ответственны за как минимум 80% простудных заболеваний. Помимо огромного экономического ущерба (20 млн человек/часов в США ежегодно), риновирусные инфекции вызывают большое количество осложнений, таких как синусит и воспаление среднего уха и часто обнаруживаются при вирусологическом обследовании детей, больных пневмонией. Также у детей-астматиков риновирусная инфекция является причиной обострения в 80% случаев. У взрослых, риновирусы могут вызывать как обострение астмы, так и хронической обструктивной болезни легких, хронического бронхита, муковисцидоза и были изолированы у больных пневмонией при иммунодефицитных состояниях.
В связи с тем, что существует более 100 антигенных разновидностей риновирусов, создание эффективной вакцины не представляется возможным (Palmenberg, А.С.; Spiro, D; Kuzmickas, R; Wang, S; Djikeng, A; Rathe, JA; Fraser-Liggett, CM; Liggett, SB (2009). "Sequencing and Analyses of All Known Human rhinovirus Genomes Reveals Structure and Evolution". Science 324 (5923): 55-9. doi:10.1126/science.1165557. PMID 19213880.). Кроме того, не существует эффективного химиотерапевтического средства для лечения риновирусной инфекции.
Энтеровирус типа 71 (EV71) был впервые выделен в 1970-1972 гг. от больных асептическим менингитом и больного энцефалитом в Калифорнии. Важно отметить, что в тяжелых случаях вирус приводит к развитию неврологических нарушений, таких как менингит, паралич и энцефалит. Вирус распространяется в условиях антисанитарии. При заражении вирусом EV71 поднимается температура, появляется сыпь на коже рук и ног, на ладонях, стопах, отек конечностей, возникают язвы в ротовой полости. В тяжелой форме энтеровирус может привести к летальному исходу. Как отмечается, энтеровирус-71 - один из наиболее «тяжелых» из общего числа энтеровирусов человека. Этот вирус может вызывать крупные вспышки с летальными исходами. За последние 40 лет зарегистрировано 3 волны вспышек этой инфекции: в 1969-1978 годах в США, Австралии, Болгарии, Японии, в 1985-1991 годах - Гонконг, Бразилия, Тайвань и в 1996-2006 годах - Малайзия, Канада, Китай, Вьетнам, Япония. Например, в 1998 году на Тайване было зарегистрировано почти полтора миллиона случаев заболеваний, вызванных энтеровирусом-71, 78 человек скончались. В 2006-2007 годах вспышки и отдельные случаи энтеровируса-71 имели место в Индии, Таиланде, Китае, Малайзии, Брунее, Японии. Вакцины против энтеровируса-71 не существует, а неспецифическая терапия не разработана.
Род флавивирусов включает более 100 вирусов, из которых 2/3 связаны с членистоногими переносчиками вирусов, патогенных для человека. Эти вирусы вызывают различные заболевания от эфемерной лихорадки до геморрагической лихорадки и энцефалитов.
Лихорадка Западного Нила (синонимы: западно-нильский энцефалит, энцефалит Западного Нила; West-Nile encephalitis - англ.; Encephalitis Nili occidentalis - лат.) - вирусное заболевание, характеризующееся лихорадкой, менингитом, системным поражением слизистых оболочек и лимфатических узлов. Инфекция передается человеку с укусами кровососущих насекомых, чаще всего - комаров рода кулекс (Culex pipiens). Лихорадка Западного Нила широко распространена в Северной Африке, странах Средиземноморья, а также в Индии и Индонезии. Природные очаги лихорадки существуют на территории Азербайджана, Армении, Казахстана, Молдавии, Туркмении, Таджикистана, а также Астраханской и Волгоградской областей России. Flavivirus - род вирусов, передающихся преимущественно членистоногими (клещами и комарами). С 1999 года лихорадка распространилась по всей территории США. Согласно данным Центра по контролю и профилактике заболеваний (CDC), по состоянию на 21 августа 2012 г. в 38 штатах отмечено 1118 случаев заражения, 41 человек погибли, из них 200 случаев и 10 погибших - только в Далласе и его окрестностях.
Лихорадка денге (синонимы: костоломная лихорадка, суставная лихорадка, лихорадка жирафов, пятидневная лихорадка, семидневная лихорадка, финиковая болезнь; dengue - англ., dengue-awn - нем., франц., исп.; dangy-fever, breakbonefever - лат.; denguero - итал.) - вирусное заболевание, широко распространенное в тропических и субтропических регионах. Иногда встречается и в зонах умеренного климата. Так, серьезные вспышки заболеваемости отмечались в Техасе в 1922 г. и в Греции в 1927 г. Последняя эпидемия в США была зарегистрирована в середине 1940-х годов. Лихорадка денге проявляется через 5-6 дней после заражения. Характеризуется внезапным повышением температуры, которое продолжается 5-7 дней, головной болью, сильной болью в суставах и мышцах, иногда сыпью. За этим следует период физического истощения и депрессии длительностью не менее недели. Вирусы-возбудители лихорадки денге очень близки к вирусам желтой лихорадки и почти повсеместно переносятся тем же видом комаров (в основном Aedes aegypti), что и вирус желтой лихорадки. Выявлено четыре близких серотипа вируса денге. Заражение каждым из них оставляет после себя достаточно прочный иммунитет, но он практически не распространяется на другие серотипы. В 1950-х годах в Юго-Восточной Азии были зарегистрированы две крайне тяжелые формы заболевания: геморрагическая лихорадка денге и шоковый синдром денге. Они вызывали у маленьких детей прострацию и смерть, причем число смертельных случаев было очень велико. Причины столь тяжелого течения болезни остаются неясными. Возможно, мутации некоторых штаммов вируса денге привели к образованию более патогенных форм. Не исключено также, что имело место повторное, в течение короткого срока, заражение другими серотипами вируса, что привело к нарушению иммунных механизмов. Специфических средств лечения лихорадки денге не существует. При геморрагической лихорадке и шоковом синдроме используют кортикостероиды и антибиотики, но их эффективность не доказана. В случаях шокового синдрома рекомендуются меры по поддержанию водного баланса организма и применение средств, увеличивающих объем плазмы. Продолжается разработка вакцин против лихорадки денге, но пока без определенных результатов. Более того, если будет доказано, что развитие тяжелых геморрагических и шоковых синдромов обусловлено сенсибилизацией (повышением чувствительности) иммунной системы, то сама целесообразность иммунизирующей вакцинации окажется сомнительной.
Клещевой энцефалит (весеннее-летний, таежный, русский, дальневосточный; tick-borne encephalitis - англ.; Encephalitis ocarina - лат.) - природно-очаговая трансмиссивная (передающаяся клещами) вирусная инфекция, характеризующаяся преимущественным поражением центральной нервной системы. Инкубационный период заболевания длится 7-14 суток, возможно дольше. Обычно начинается с лихорадки и миалгии, которые длятся 2-4 суток. Полагают, что этот период соответствует вирусемии. Затем на несколько дней наступает кратковременная ремиссия, после чего возникает вторая волна лихорадки и появляются менингеальные симптомы. Спектр клинических проявлений этой стадии болезни довольно широк - от серозного менингита, свойственного относительно молодым людям, до тяжелейшего энцефалита с комой, эпилептическими припадками, тремором и двигательными нарушениями, длящегося 7-10 суток. Поражение спинного и продолговатого мозга чревато параличом дыхательных мышц и мышц плечевого пояса. Большинство больных выздоравливают, но иногда остаются тяжелые неврологические дефекты. Этиотропного лечения этой инфекции не существует. Выпускаются эффективные инактивированные вакцины против клещевого энцефалита с солями алюминия в качестве адъюванта. Вакцина против клещевого энцефалита австрийского производства обеспечивает противовирусный иммунитет, если ее вводить дважды с интервалом 0,5-3 мес. Остальные вакцины примерно столь же эффективны. В редких случаях вакцинация осложняется синдромом Гийена-Барре, поэтому она показана только людям, проживающим в природных очагах или посещающим их в весенне-летний период. В природных очагах инфицировано от 0,2 до 4,0% клещей, поэтому в случае обнаружения на теле присосавшихся клещей встает вопрос об экстренной иммунопрофилактике. Можно незамедлительно прибегнуть к введению иммуноглобулина против клещевого энцефалита, однако у многих людей существуют противопоказания к его введению в силу наличия проявлений аллергических реакций организма.
Заболевание энцефалит Сент-Луис (Saint-Lois encephalitis - анг.; Encephalitis Americana - лат.) эндемично для большей территории США, Мексики, Аргентины, Суринама, стран Карибского бассейна, Колумбии, юга Канады. Во время вспышки заболевание охватывает от сотен до тысячи человек с 15-30% летальностью. В Северной Америке природные очаги поддерживаются дикими птицами и комарами рода Culex. Начало заболевание внезапное, с лихорадкой, тошнотой, рвотой, головной болью, менингеальным синдромом. Затем появляется атаксия, нарушение речи, непроизвольное мочеиспускание, спутанность сознания, тремор. Возможное молниеносное течение. В 5% случаев развиваются остаточные изменения ЦНС. До настоящего времени специфических средств профилактики и лечения заболевания не разработаны. Попытки разработать вакцину не увенчались успехом. Так, применение формолвакцины из мозга зараженных мышей создает у привитых людей лишь кратковременный иммунитет. Применяют лишь патогенетические и симптоматические средства.
Заболевание энцефалит долины Муррей (Murray Valley encephalitis - англ.; Encephalitis Avstralia - лат.) эндемично для территории Австралии, Новой Зеландии и окружающей территории. Во время сезонной вспышки летальность достигает 20-50%. В Австралии природные очаги поддерживаются дикими птицами (цаплями) и комарами рода Culex. Заболевание сопровождается лихорадкой, головной болью, менингиальным синдромом, нередко параличами. До настоящего времени специфических средств профилактики и лечения заболевания не разработаны. Применяют лишь патогенетические и симптоматические средства.
Следует отметить, что единственным химиотерапевтическим средством, оказывающим некоторый положительный эффект при инфекциях, вызываемых (+)РНК-содержащими вирусами, является рибавирин. Однако рибавирин является относительно токсичным средством, часто вызывающим анемию. Основной его особенностью является длительное депонирование в эритроцитах. В результате, следы рибавирина обнаруживаются даже через 6 месяцев после окончания курса терапии. Упоминается также о тератогенном действии рибавирина.
Раскрытие изобретения
Авторами изобретения неожиданно обнаружено, что глутарилгистамин может использоваться в качестве нетоксичного противовирусного средства при инфекциях, вызываемых вирусами, относящимися к родам энтеровирус и флавивирус (без ограничения перечисленными).
С учетом изложенного, настоящее изобретение относится к средству для лечения и/или профилактики заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими роду энтеровирусов или роду флавивирусов, представляющему собой глутарилгистамин, который соответствует следующей формуле
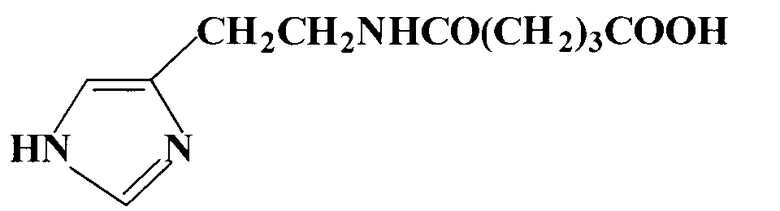
Глутарилгистамин, согласно изобретению, вводится в твердой лекарственной форме.
Изобретение далее охватывает способ профилактики и лечения заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими роду энтеровирусов или роду флавивирусов, предусматривающий введение пациенту эффективного количества глутарилгистамина или его фармацевтически приемлемой соли.
Вирус, принадлежащий семейству энтеровирусов, может быть выбран из группы, включающей риновирусы и энтеровирус типа 71. Вирус, принадлежащий к семейству флавивирусов, может быть выбран из группы, включающей вирус Западного Нила, вирус денге, вирус клещевого энцефалита, вирус энцефалита Сент-Луис, вирус энцефалита долины Муррей и вирус желтой лихорадки. Доза глутарилгистамина или его фармацевтически приемлемой соли может составлять приблизительно 0,1-30 мг/кг массы тела пациента. При этом разовая доза глутарилгистамина может составлять приблизительно 100 мг. Предпочтительная длительность приема глутарилгистамина составляет от 5 дней до 12 месяцев. В одном из вариантов изобретения, осуществляют профилактику или лечение обострений астмы, бронхита и муковисцидоза, вызванных риновирусом.
Далее, изобретение относится к фармацевтической композиции для лечения заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими роду энтеровирусов или роду флавивирусов, содержащей эффективное количество глутарилгистамина или его фармацевтически приемлемой соли. Эффективное количество глутарилгистамина или его фармацевтически приемлемой соли, предпочтительно, составляет 0,1-30 мг/кг массы тела. При этом доза глутарилгистамина может составлять 100 мг при введении 1 раз в день.
Изобретение также относится к набору для лечения заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими роду энтеровирусов или роду флавивирусов, включающему композицию по изобретению и инструкции по ее применению.
Кроме этого, изобретение относится к применению глутарилгистамина или его фармацевтически приемлемой соли для производства фармацевтической композиции для лечения заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими к роду энтеровирусов или роду флавивирусов. Изобретение также включает применение глутарилгистамина или его фармацевтически приемлемой соли для лечения заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими роду энтеровирусов или роду флавивирусов.
В качестве фармацевтически приемлемых солей глутарилгистамина в настоящем изобретении могут быть использованы его соли с щелочными и щелочноземельными металлами, предпочтительно натриевая, калиевая, литиевая соли.
Глутарилгистамин или его соли вводят в эффективном количестве, которое обеспечивает желаемый терапевтический результат.
Глутарилгистамин или его соли могут быть введены пациенту в дозах, составляющих от 0,1 до 30 мг/кг веса тела человека в день, предпочтительно в дозах от 0,3 до 1,5 мг/кг один или более раз в день.
При этом следует отметить, что конкретная доза для каждого конкретного пациента будет зависеть от многих факторов, таких как возраст, вес тела, пол, общее состояние здоровья и режим питания пациента, время и способ введения лекарственного средства, скорость его выведения из организма, а также тяжесть заболевания у данного индивида, подвергаемого лечению.
Фармацевтические композиции по настоящему изобретению содержат глутарилгистамин или его фармацевтически приемлемую соль в количестве, эффективном для достижения желаемого результата, и могут быть приготовлены в виде стандартных лекарственных форм (например, в твердой, полутвердой или жидкой формах), содержащих глутарилгистамин или его соль в качестве активного ингредиента в смеси с носителем или наполнителем, пригодным для внутримышечного, внутривенного, перорального, сублингвального, ингаляционного, интраназального, интраректального и трансдермального применения. Активный ингредиент может быть включен в композицию вместе с обычно используемыми нетоксичными фармацевтически приемлемыми носителями, пригодными для изготовления растворов, таблеток, пилюль, капсул, драже, суппозиториев, эмульсий, суспензий, мазей, гелей, пластырей и любых других лекарственных форм.
В качестве наполнителей могут быть использованы различные вещества, такие как сахариды, например глюкоза, лактоза или сахароза, маннит или сорбит, производные целлюлозы и/или фосфаты кальция, например, трикальций фосфат или кислый фосфат кальция; в качестве связующего компонента могут быть использованы такие, как крахмальная паста, например, кукурузный, пшеничный, рисовый, картофельный крахмал, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон. При необходимости могут быть использованы разрыхляющие агенты, такие как вышеупомянутые крахмалы и карбоксиметилкрахмал, поперечно сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия.
Могут быть использованы необязательные добавки, такие как агенты, регулирующие текучесть, и смазывающие агенты, такие как диоксид кремния, тальк, стеариновая кислота и ее соли, такие как стеарат магния или стеарат кальция, и/или пропиленгликоль.
В качестве добавок могут быть также использованы стабилизаторы, загустители, красители и отдушки.
В качестве мазевой основы могут быть использованы углеводородные мазевые основы, такие как вазелин белый и желтый (Vaselinum album, Vaselinum flavum), вазелиновое масло (Oleum Vaselini), мазь белая и жидкая (Unguentum album, Unguentum flavum), а в качестве добавок для придания более плотной консистенции - такие как твердый парафин и воск; абсорбтивные мазевые основы, такие как гидрофильный вазелин (Vaselinum hydrophylicum), ланолин (Lanolinum), кольдкрем (Unguentum leniens); мазевые основы, смываемые водой, такие как гидрофильная мазь (Unguentum hydrophylum); водорастворимые мазевые основы, такие как полиэтиленгликолевая мазь (Unguentum Glycolis Polyaethyleni), бентонитовые основы и другие.
В качестве основы для гелей могут быть использованы метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, оксипропилцеллюлоза, полиэтиленгликоль или полиэтиленоксид, карбопол.
В качестве основы для суппозитория могут быть использованы основы, не растворимые в воде, такие как масло какао; основы, растворимые в воде или смешиваемые с водой, такие как желатино-глицериновые или полиэтиленоксидные; комбинированные основы - мыльно-глицериновые.
При приготовлении стандартной лекарственной формы количество активного ингредиента, используемого в комбинации с носителем, может варьироваться в зависимости от реципиента, подвергающегося лечению, от конкретного способа введения лекарственного средства.
Так, например, при использовании глутарилгистамина или его солей в виде растворов для инъекций, содержание активного агента в них составляет 0,1-5%. В качестве разбавителей могут быть использованы 0,9% раствор хлорида натрия, дистиллированная вода, раствор новокаина для инъекций, раствор Рингера, раствор глюкозы, специфические добавки для растворения. При введении в организм глутарилгистамина или его солей в виде таблеток и суппозиториев их количество составляет 10-300 мг на стандартную лекарственную форму.
Лекарственные формы настоящего изобретения получают по стандартным методикам, таким как, например, процессы смешивания, гранулирования, формирования драже, растворения и лиофилизации.
Следует отметить, что при длительном применении глутарилгистамина или его солей в терапевтических дозах и в дозах, на порядок превышающих терапевтические, не выявлено отрицательных побочных действий.
Осуществление изобретения
Далее приведено детальное описание экспериментальных примеров, подтверждающих эффективность глутарилгистамина для профилактики и лечения заболеваний в соответствии с данным изобретением, где приведенные примеры не предназначены для ограничения объема изобретения.
Пример 1
Противовирусное действие глутарилгистамина в отношении риновируса человека на экспериментальной модели in vivo
Для проведения исследований был использован штамм риновируса человека (HRV 1B), предварительно адаптированный к размножению в легких у мышей.
Специфичность HRV контролировали путем постановки полимеразной цепной реакции (ПЦР), Real-time ПЦР (АмплиСенс, Россия) и двухраундовой ПЦР со специфическими праймерами с РНК, выделенной с помощью «Рибо-сорб» производства «Амплисенс» из суспензии легких и трахеи зараженных HRV мышей.
Белых мышей Balb/c, самцов, весом 8-10 г заражали вируссодержащим материалом интраназально, под легким эфирным наркозом в объеме 0,05 мл/мышь.
Работу с мышами проводили согласно инструкциям по работе с лабораторными животными. Перед исследованием животных подвергали 5-дневному карантину.
Животные получали стандартный рацион питания и содержались в равноценных условиях. Мышей в опытах распределяли в группы по 10 животных в каждой.
Глутарилгистамин вводили перорально 1 раз в сутки, начиная через 12 часов после инфицирования мышей HRV в течение 3 последующих дней. Мышам контрольной группы вводили в тех же условиях физраствор.
Глутарилгистамин вводили в дозе 15 и 30 мг/кг.
Для определения инфекционного титра HRV в суспензиях трахеи и легких мышей через 48 и 72 часа после инфицирования, исследовали 10% суспензии индивидуально от каждой особи серией 10-кратных разведении на культуре клеток Hela. Результат учитывали в ПЦР через 2 суток инкубации при 33°C.
Для каждого разведения изучаемой пробы использовали четыре лунки планшета для которых вычисляли среднее значение титра вируса. За титр вируса принимали то наибольшее разведение супернатанта зараженной культуры, в котором идентифицировалась РНК вируса в ПЦР. Титр выражали обратным значением разведения вируса, в котором определяли РНК HRV (lg/мл представлен как среднее значение lg±m).
Статистический анализ результатов проведен с применением ПО Microsoft Excel
Эффективность глутарилгистамина оценивали по подавлению репродукции вируса в легких через 48 и 72 часа после инфицирования вирусом HRV.
Критериями оценки эффективности глутарилгистамина in vivo являлись снижение накопления вируса в легких, определяемое по инфекционному титру в культуре клеток Hela и непосредственно в суспензиях легких мышей методом ПЦР.
Результаты определения инфекционной активности HRV в суспензиях легких мышей на культуре клеток Hela представлены в таблице 1.
Титрование суспензии легких зараженных HRV мышей показало, что вирус размножается в легких, достигая через 48 часов максимального значения 4,1 lg, а через 72 часа значения 3,2 lg в контрольных группах. Применение глутарилгистамина приводило к достаточно выраженному снижению инфекционной активности HRV на 2,6 и 2,2 lg соответственно, при использовании глутарилгистамина в дозе 30 мг/кг.
При изучении эффективности глутарилгистамина в отношении HRV инфекции у мышей по подавлению и активности вируса непосредственно в суспензиях легких методом ПЦР получены аналогичные результаты. При проведении ПЦР в реальном времени зафиксировано значительное снижение количества копий вирусной РНК через 48 и 72 часа после инфицирования - от 10 до 100 раз в группах мышей, которым вводили глутарилгистамин, по сравнению с контрольными группами.
Таким образом, в настоящем примере показана возможность использования глутарилгистамина в качестве эффективного противовирусного средства, специфически снижающего репродукцию риновируса человека.
Пример 2
Изучение эффективности глутарилгистамина в отношении экспериментальной формы лихорадки Западного Нила (ЛЗН).
В работе использовали вирус западного Нила, штамм Eg101. Наблюдение за инфицированными животными проводили в течение 21 суток. При этом контролировали их гибель, оценивали показатель среднего времени жизни белых мышей в опытной и контрольных группах.
Основными критериями оценки эффективности in vivo являлись показатели защиты лабораторных животных от гибели и среднее время жизни животных в группе.
Для оценки протективной эффективности глутарилгистамина белых мышей инфицировали подкожно в дозе 10ЛД50. Глутарилгистамин вводили перорально по следующим схемам: профилактика - в дозе 5 мг/кг в течение 4 суток до инфицирования раз в день и за 1 ч до инфицирования; в дозе 30 мг/кг однократно 1 раз в неделю; лечение - в дозе 5 мг/кг через 24 ч после инфицирования и далее в течение 7 суток; в дозе 30 мг/кг 1 раз в сутки через 24 и 48 ч после инфицирования, затем 15 мг/кг 1 раз через 72, 96 и 120 ч.
Результаты оценки эффективности, представленные в таблице 2, свидетельствуют о том, что глутарилгистамин эффективно защищает инфицированных мышей от гибели при применении его по профилактической и лечебной схемам в дозе 5 мг/кг. Защита от гибели составила 42,9% и 37,8 соответственно. При этом наблюдали значительное (на 4,2 и 2,8 суток, соответственно) увеличение показателя времени жизни животных в группе.
При второй профилактической схеме (таблица 3) защитная эффективность глутарилгистамина в дозе 30 мг/кг в отношении экспериментальной формы лихорадки Западного Нила у белых мышей при однократном применении за 144 ч до заражения составила 40,0%, а удлинение среднего времени жизни животных - 3,7 суток.
Результаты оценки эффективности глутарилгистамина, представленные в таблице 4, свидетельствуют о том, что средство эффективно защищает инфицированных мышей от гибели при применении его по лечебной схеме (2 дня по 30 мг/кг ежедневно однократно, затем 3 суток по 15 мг/кг ежедневно однократно). Защита от гибели составила 50,0%, а увеличение показателя времени жизни животных в группе составило 3,5 суток. Препарат сравнения рибавирин защищал от гибели 50% животных при профилактике в дозе 20 мг/кг. Следует отметить, что при лечебной схеме защитная эффективность рибавирина составила всего 10,0%.
Таким образом, глутарилгистамин в отношении экспериментальной формы лихорадки западного Нила (ЛЗН) эффективно защищает от гибели инфицированных животных.
Пример 3
Изучение эффективности глутарилгистамина в отношении экспериментальной формы вируса клещевого энцефалита (КЭ)
Оценку эффективности глутарилгистамина в отношении экспериментальной формы КЭ проводили с использованием белых мышей массой 9-10 г, подкожно инфицированных вирусом КЭ, штамм Софьин, в дозе 30ЛД50. Глутарилгистамин вводили перорально в дозе 5 мг/кг: по профилактической схеме (за 5 суток до инфицирования, ежедневно один раз в сутки); по лечебно-профилактической схеме (за 5 суток до инфицирования, в течение 7 суток после инфицирования, ежедневно один раз в сутки); по лечебной схеме (через 24 ч после инфицирования, в течение 7 суток, ежедневно 1 раз в сутки). По профилактической схеме в дозе 30 мг/кг однократно 1 раз в неделю. По лечебной схеме в дозе 30 мг/кг 1 раз в сутки через 24 и 48 ч после инфицирования, затем 15 мг/кг 1 раз через 72, 96 и 120 ч.
В качестве референс-препарата использован рибавирин - по схеме экстренной профилактики в дозе 20 мг/кг.
Результаты исследований, представленные в таблице 5, свидетельствуют о том, что наибольшая противовирусная эффективность глутарилгистамина выявлена при применении его по лечебно-профилактической схеме. Показано, что защита от гибели составляет 40%, увеличение показателя СВЖ - 4,2 суток. При применении по лечебной или профилактической схемам защитная эффективность глутарилгистамина составила 35%.
При второй профилактической схеме (таблица 6) защитная эффективность глутарилгистамина в дозе 30 мг/кг в отношении экспериментальной формы клещевого энцефалита у белых мышей при однократном применении за 144 ч до заражения составила 30,0%, а удлинение среднего времени жизни животных - 3,1 суток.
Результаты оценки эффективности, представленные в таблице 7 свидетельствуют о том, что глутарилгистамин эффективно защищает инфицированных мышей от гибели при применении его по лечебной схеме (2 дня по 30 мг/кг ежедневно однократно, затем 3 суток по 15 мг/кг ежедневно однократно). Защита от гибели составила 40,0%, а увеличение показателя времени жизни животных в группе составило 3,2 суток. Следует отметить, что при лечебной схеме защитная эффективность рибавирина составила всего 15,0%.
Таким образом, глутарилгистамин в отношении экспериментальной формы клещевого энцефалита эффективно защищает от гибели инфицированных животных.
Пример 4
Изучение эффективности глутарилгистамина в отношении экспериментальной формы лихорадки денге
Для оценки противовирусной активности белых мышей инфицировали интрацеребрально вирусом лихорадки денге. Глутарилгистамин вводили перорально по следующим схемам: профилактика - в дозе 5 мг/кг в течение 4 суток до инфицирования раз в день и за 1 ч до инфицирования; в дозе 30 мг/кг однократно 1 раз в неделю; лечение - в дозе 5 мг/кг через 24 ч после инфицирования и далее в течение 7 суток; в дозе 30 мг/кг 1 раз в сутки через 24 и 48 ч; затем 15 мг/кг 1 раз в сутки через 72, 96 и 120 ч после инфицирования. Наблюдение за инфицированными животными проводили в течение 21 суток. Изучение биопроб осуществляли на 5 сутки после заражения.
Результаты оценки эффективности, представленные в таблице 8, свидетельствуют о том, что глутарилгистамин эффективно подавляет размножение вируса денге в крови белых мышей при применении его по профилактической и лечебной схемам в дозе 5 мг/кг. Коэффициент ингибирования накопления вируса составил 95,5%.
Результаты оценки эффективности, представленные в таблице 9, свидетельствуют о том, что глутарилгистамин эффективно подавляет размножение вируса денге в крови белых мышей при применении его по лечебной схеме (2 дня по 30 мг/кг ежедневно однократно, затем 3 суток по 15 мг/кг ежедневно однократно). Коэффициент ингибирования накопления вируса составил 99,6%. Следует отметить, что при лечебной схеме коэффициент подавления размножения вируса в крови животных для рибавирина составил лишь 83,4%.
Таким образом, глутарилгистамин в отношении лихорадки денге эффективно подавляет репликацию вируса у инфицированных животных.
Пример 5
Противовирусное действие глутарилгистамина в отношении вируса Коксаки
Коксакивирусная инфекция (HCXV) представляет собой большую группу заболеваний, характеризующихся выраженным клиническим полиморфизмом. Манифестация Коксакивирусной инфекции может выражаться менингитом, параличами, острыми респираторными расстройствами, пневмонией, геморрагическим конъюнктивитом, миокардитом, гепатитом, диабетом и другими синдромами. В соответствии с современной классификацией вирусов - энтеровирусы человека в составе рода Enterovirus разделены на пять видов (14): 1) полиовирус; 2) энтеровирус человека A; 3) энтеровирус человека B; 4) энтеровирус человека C; 5) энтеровирус человека D. Различные серотипы вируса Коксаки вошли в следующие виды энтеровирусов: энтеровирус человека A (Коксаки A2-8, 10, 12, 14, 16); энтеровирус человека B (Коксаки A9, Коксаки B1-6); энтеровирус человека C (Коксаки A1, 11, 13, 15, 17-22, 24).
Для проведения исследований был использован трипсинзависимый штамм HCXV, предварительно адаптированный и вызывающий гибель мышей от коксакивирусной инфекции.
Эксперимент проводили на белых мышах самцах, весом 6-7 г.
Животных инфицировали вирусом внутримышечно в объеме 0,1 мл/мышь. В опыте использовали дозу для заражения 10LD50, вызывающую 70-80% летальность у мышей.
О способности глутарилгистамина оказывать лечебный эффект судили по гибели инфицированных вирусом HCXV мышей в опытной группе по сравнению с группой животных, не получавших лечение.
Исследуемые препараты и плацебо вводили животным перорально по лечебной схеме. В качестве плацебо мышам вводили физиологический раствор. В качестве отрицательного контроля использовали интактных животных, в количестве 14 мышей, которые содержались в тех же условиях, что и опытные группы в отдельном помещении.
Для проведения эксперимента было сформировано 4 группы по 14 мышей в каждой. Животные первой группы получали глутарилгистамин в дозе 30 мг/кг массы тела, второй группы - глутарилгистамин в дозе 3 мг/кг, третьей группы - глутарилгистамин в дозе 0,3 мг/кг, четвертой контрольной группы - физиологический раствор. Препараты вводили перорально, 1 раз в сутки, в течение 5 дней (первое введение - через 24 часа после инфицирования). Наблюдение за животными осуществляли на протяжении 20 дней, срока в течение которого ежедневно взвешивали и регистрировали смертность животных.
В ходе опыта по определению эффективности глутарилгистамина при HCXV вирусной инфекции у животных случаев неспецифической смертности в контрольной группе интактных животных не зарегистрировано.
Результаты опыта показали, что в группе мышей, зараженных вирусом и не получавших глутарилгистамин, гибель началась на 7 день после заражения, к 9 дню погибло 78,6% мышей. Средняя продолжительность жизни в группе контроля составила 10,0 дней.
Глутарилгистамин оказал достоверное защитное действие в отношении экспериментальной коксакивирусной инфекции, снижая гибель животных и увеличивая среднюю продолжительность жизни животных.
Высокая противовирусная активность глутарилгистамина, описанная в примере свидетельствует о том, что он может быть использован в качестве эффективного лекарственного средства при HCXV энтеровирусных инфекциях.
Пример 6
Изготовление лекарственных форм глутарилгистамина
Лекарственные формы глутарилгистамина для использования в соответствии с настоящим изобретением получают по стандартным методикам, таким как, например, процессы смешивания, гранулирования, формирование драже, растворение и лиофилизация.
Таблетированная форма
Таблетированную форму получают, используя приведенные ниже ингредиенты:
Глутарилгистамин или его фармацевтически
Компоненты смешивают и прессуют для образования таблеток весом 300 мг каждая.
Желатиновые капсулы
Глутарилгистамин или его соль - 90 мг,
Лактоза (сахар молочный), крахмал картофельный, кремния диоксид коллоидный (аэросил), магния стеарат - до получения массы содержимого капсулы 220 мг
Указанные выше ингредиенты смешивают, гранулируют, гранулы помещают в твердые желатиновые капсулы в количестве 220 мг.
Суппозитории
Пример состава суппозитория:
При необходимости возможно изготовление ректальных, вагинальных и уретральных суппозиториев с соответствующими наполнителями.
Раствор для инъекций
Пример 1 состава раствора для инъекций:
Глутарилгистамин или его фармацевтически
В качестве растворителя при приготовлении раствора для инъекций могут быть использованы - 0,9% раствор натрия хлорида, дистиллированная вода, раствор новокаина. Форма выпуска - ампулы, флаконы, шприц-тюбики, «insert».
Состав 1 раствора для инъекций:
Глутарилгистамин или его соль - 100 мг
Вода дистиллированная - 5 мл
В качестве растворителя при приготовлении раствора для инъекций могут быть использованы - 0,9% раствор натрия хлорида, изотонический фосфатный буфер, HEPES. Форма выпуска - ампулы, флаконы, шприц-тюбики, «insert».
Возможно изготовление различных лекарственных форм для инъекций - стерильных растворов, стерильных порошков и таблеток.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ПОЛИМЕРАЗЫ | 2011 |
|
RU2718690C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ПОЛИМЕРАЗЫ | 2011 |
|
RU2599013C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ СИЛИКАТИРОВАННЫЙ ВИРУС, И СПОСОБЫ ПРИМЕНЕНИЯ | 2014 |
|
RU2676083C2 |
| АМИДНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ РНК-СОДЕРЖАЩИМИ ВИРУСАМИ | 2014 |
|
RU2628800C2 |
| РЕКОМБИНАНТНЫЕ ФЛАВИВИРУСНЫЕ ВАКЦИНЫ | 2006 |
|
RU2465326C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО, СОДЕРЖАЩИЕ НОВЫЕ ПРОИЗВОДНЫЕ ФАВИПИРАВИРА | 2023 |
|
RU2832326C1 |
| ДНК-КОНСТРУКТ ЖИЗНЕСПОСОБНОГО ХИМЕРНОГО РЕКОМБИНАНТНОГО ФЛАВИВИРУСА, ВАКЦИНА ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, СПОСОБ ПРЕДОТВРАЩЕНИЯ ИНФИЦИРОВАНИЯ МЛЕКОПИТАЮЩЕГО ВИРУСОМ КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1998 |
|
RU2208635C2 |
| ИНАКТИВИРОВАННЫЕ ХИМЕРНЫЕ ВАКЦИНЫ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ ПРИМЕНЕНИЯ | 2006 |
|
RU2436591C2 |
| ФЛАВИВИРУС С ДВУХКОМПОНЕНТНЫМ ГЕНОМОМ И ЕГО ИСПОЛЬЗОВАНИЕ | 2008 |
|
RU2527891C2 |
| Иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита, на основе мРНК | 2024 |
|
RU2823754C1 |
Предложены: способ профилактики или лечения заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими роду энтеровирусов или роду флавивирусов (вирус рода энтеровирусов выбран из группы, включающий риновирусы и энтеровирус типа 71, вирус рода флавивирусов выбран из группы, включающей вирус Западного Нила, вирус денге, вирус клещевого энцефалита, вирус энцефалита Сент-Луис, вирус энцефалита долины Муррей и вирус желтой лихорадки), предусматривающий использование эффективного количества глутарилгистамина или его фармацевтически приемлемой соли. Также предложены: фармацевтическая композиция вышеуказанного назначения и состава и набор, применение глутарилгистамина или его фармацевтически приемлемой соли для производства фармацевтической композиции для профилактики или лечения заболеваний, вызываемых (+)РНК-содержащими вирусами рода энтеровирусов или рода флавивирусов. Показано, что глутарилгистамин подавлял репликацию вируса лихорадки денге, на 40% защищал от гибели инфицированных вирусом клещевого энцефалита мышей (защитная активность рибавирина составляла 15%). 4 н.п. ф-лы, 18 з.п. ф-лы, 8 табл.
1. Способ профилактики или лечения заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими роду энтеровирусов или роду флавивирусов, включающий введение пациенту эффективного количества глутарилгистамина или его фармацевтически приемлемой соли.
2. Способ по п.1, где вирус, принадлежащий роду энтеровирусов, выбран из группы, включающей риновирусы и энтеровирус типа 71.
3. Способ по п.1, где заболевания представляют собой обострения астмы, бронхита и муковисцидоза, вызванных риновирусом.
4. Способ по п.1, где вирус, принадлежащий роду флавивирусов, выбран из группы, включающей вирус Западного Нила, вирус денге, вирус клещевого энцефалита, вирус энцефалита Сент-Луис, вирус энцефалита долины Муррей и вирус желтой лихорадки.
5. Способ по п.1, где глутарилгистамин вводится в твердой лекарственной форме.
6. Способ по п.1, где доза глутарилгистамина или его фармацевтически приемлемой соли составляет 0,1-10 мг/кг массы тела.
7. Способ по п.1, где разовая доза глутарилгистамина составляет 100 мг.
8. Способ по п.1, где длительность приема глутарилгистамина составляет от 5 дней до 12 месяцев.
9. Фармацевтическая композиция для профилактики или лечения заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими роду энтеровирусов или роду флавивирусов, содержащая эффективное количество глутарилгистамина или его фармацевтически приемлемой соли.
10. Композиция по п.9, в которой эффективное количество глутарилгистамина или его фармацевтически приемлемой соли составляет 0,1-10 мг/кг массы тела.
11. Композиция по п.9, где доза глутарилгистамина составляет 100 мг при введении 1 раз в день.
12. Композиция по п.9, где вирус, принадлежащий роду энтеровирусов, выбран из группы, включающей риновирусы и энтеровирус типа 71.
13. Композиция по п.9, где вирус, принадлежащий роду флавивирусов, выбран из группы, включающей вирус Западного Нила, вирус денге, вирус клещевого энцефалита, вирус энцефалита Сент-Луис, вирус энцефалита долины Муррей и вирус желтой лихорадки.
14. Композиция по п.9, где заболевания представляют собой обострения астмы, бронхита и муковисцидоза, вызванных риновирусом.
15. Набор для профилактики или лечения заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими роду энтеровирусов или роду флавивирусов, включающий композицию по любому из п.п.9-14 и инструкции по ее применению.
16. Набор по п.15, где вирус, принадлежащий роду энтеровирусов, выбран из группы, включающей риновирусы и энтеровирус типа 71.
17. Набор по п.15, где вирус, принадлежащий роду флавивирусов, выбран из группы, включающей вирус Западного Нила, вирус денге, вирус клещевого энцефалита, вирус энцефалита Сент-Луис, вирус энцефалита долины Муррей и вирус желтой лихорадки.
18. Набор по п.15, где заболевания представляют собой обострения астмы, бронхита и муковисцидоза, вызванных риновирусом.
19. Применение глутарилгистамина или его фармацевтически приемлемой соли для производства фармацевтической композиции для профилактики или лечения заболеваний, вызываемых (+)РНК-содержащими вирусами, принадлежащими роду энтеровирусов или роду флавивирусов.
20. Применение по п.19, где вирус, принадлежащий роду энтеровирусов, выбран из группы, включающей риновирусы и энтеровирус типа 71.
21. Применение по п.19, где вирус, принадлежащий роду флавивирусов, выбран из группы, включающей вирус Западного Нила, вирус денге, вирус клещевого энцефалита, вирус энцефалита Сент-Луис, вирус энцефалита долины Муррей и вирус желтой лихорадки.
22. Применение по п.19, где заболевания представляют собой обострения астмы, бронхита и муковисцидоза, вызванных риновирусом.
| СРЕДСТВО И СПОСОБ ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ К ИНФЕКЦИИ | 2001 |
|
RU2191594C1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| АБАТУРОВ А.Е | |||
| и др | |||
| Роль интерферонов в защите респираторного тракта | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Каскад возбуждения системы интерферонов | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2014-06-10—Публикация
2012-08-30—Подача