[001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США № 61/393522, поданной 15 октября 2010 года, и предварительной заявки на патент США № 61/492054, поданной 1 июня 2011 года, содержание каждой из которых включено в настоящее описание посредством ссылки.
[002] Полное содержание всех патентов, заявок на патент и публикаций, указанных в настоящем описании, включено в настоящее описание посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[003] Вирусные заболевания ответственны как за глобальные пандемии, так и ежегодные сезонные эпидемии, такие как грипп. Вспышки заболеваний могут характеризоваться усиленной вирулентностью и могут происходить внезапно, приводя к высокой смертности. Важным является то, что вирусные заболевания не ограничиваются заболеваниями у людей. Например, грипп также поражает скот и птиц, что может оказывать значительное влияние на продовольственное снабжение в дополнение к увеличению риска передачи людям. Типичные состояния, относящиеся к вирусной инфекции, включают, например, грипп, оспу, энцефалит, лихорадку Западного Нила, желтую лихорадку, лихорадку Денге, гепатит, вирус иммунодефицита человека, полиомиелит и вирус Коксаки.
[004] Геном вируса гриппа А содержит РНК-зависимую РНК-полимеразу, которая представляет собой гетеротримерный комплекс из трех субъединиц (PA, PB1 и PB2). РНК-полимераза катализирует транскрипцию и репликацию вирусной РНК. Поскольку транскрипция и репликация вируса зависят от активности РНК-полимеразы, данный фермент стал представлять интерес в качестве мишени для разработки новых противовирусных соединений, особенно в свете появления в последнее время вирусов, резистентных к лекарственным средствам.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[005] Согласно настоящему изобретению предложены способы и композиции для ингибирования вирусных полимераз нуклеиновых кислот, и способы и композиции, которые подходят для лечения, подавления и/или предотвращения вирусных инфекций у субъектов. Указанные способы включают введение субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли или гидрата, или композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель. Композиция или способ может содержать (включать) один или более дополнительных противовирусных агентов. Способы и композиции подходят для лечения, подавления и/или предотвращения вирусных инфекций у субъектов, которые могут возникать в результате инфицирования одним или более типами вируса. Таким образом, способы и композиции подходят для противовирусного лечения, подавления и/или предотвращения широкого спектра.
[006] Настоящее изобретение отчасти основано на некоторых обнаружениях, более подробно описанных в разделе «Примеры» в настоящей заявке. Например, настоящее изобретение отчасти основано на обнаружении того, что уровни титра вируса в клетках заметно снижались при лечении соединением формулы I. Таким образом, согласно настоящему изобретению также предложены способы уменьшения титра вируса в жидкости или клетке организма, включающие приведение указанной жидкости или клетки в контакт с соединением формулы I. Настоящее изобретение также отчасти основано на обнаружении того, что уровни титра вируса в клетках для некоторых вирусов заметно снижались при лечении соединением формулы I, что указывает на противовирусную активность соединения формулы I широкого спектра в отношении различных штаммов вируса. Таким образом, согласно настоящему изобретению также предложены способы уменьшения титра вируса для нескольких типов, подтипов и/или штаммов вирусов в жидкости или клетке организма, заключающиеся в приведении указанной жидкости или клетки в контакт с соединением формулы I.
[007] В некоторых вариантах реализации настоящего изобретения предложен способ ингибирования вирусной РНК- или ДНК-полимеразы, включающий приведение указанной полимеразы в контакт с эффективным ингибирующим количеством соединения формулы I или его фармацевтически приемлемой соли, сольвата или гидрата.
[008] В некоторых вариантах реализации указанный способ осуществляют in vivo.
[009] В некоторых вариантах реализации настоящего изобретения предложен способ лечения субъекта, страдающего РНК-вирусной инфекцией, включающий введение указанному субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
[0010] В некоторых вариантах реализации жидкость организма представляет собой кровь. В некоторых вариантах реализации жидкость организма представляет собой плазму. В некоторых вариантах реализации жидкость организма представляет собой сыворотку крови.
[0011] В некоторых вариантах реализации субъект представляет собой млекопитающее. В некоторых вариантах реализации субъект представляет собой человека. В некоторых вариантах реализации субъект представляет собой птицу. В некоторых вариантах реализации субъект представляет собой свинью.
[0012] Эти и другие варианты реализации настоящего изобретения дополнительно описаны в следующих разделах заявки, включая «Подробное описание», «Примеры» и «Формулу изобретения».
[0013] Другие задачи и преимущества настоящего изобретения будут очевидны специалисту в данной области техники исходя из описания, приведенного в настоящем документе, которое является лишь иллюстративным и не ограничивающим. Таким образом, другие варианты реализации в пределах сущности и объема настоящего изобретения будут очевидны специалисту в данной области техники.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0014] На ФИГ. 1 показано фосфорилирование соединения 1 в клетках печеночно-клеточной карциномы человека (Huh-7).
[0015] На ФИГ. 2 показано фосфорилирование 3Н аденозина в клетках Huh-7.
[0016] На ФИГ. 3 показано фосфорилирование 3Н соединения 1 в клетках Huh-7.
[0017] На ФИГ. 4 показано включение тотальной РНК и геномной ДНК 3Н соединения 1 и 3Н аденозина в клетках Huh-7 через 24 часа.
[0018] На ФИГ. 5 показано влияние комбинации соединения 1 и перамивира (ингибитор нейраминидазы) на грипп in vitro.
[0019] На ФИГ. 6 показано влияние соединения 1 (внутримышечно) на потерю массы тела у мышей, инфицированных вирусом гриппа H3N2 A/Виктория/3/75.
[0020] На ФИГ. 7 показано влияние соединения 1 (перорально) на потерю массы тела у мышей, инфицированных вирусом гриппа H3N2 A/Виктория/3/75.
[0021] На ФИГ. 8 показано влияние соединения 1 (интраперитонеально, внутримышечно и перорально) на выживаемость мышей, инфицированных вирусом Эбола.
[0022] На ФИГ. 9 показано влияние соединения 1 (интраперитонеально, внутримышечно и перорально) на потерю массы тела у мышей, инфицированных вирусом Эбола.
[0023] На ФИГ. 10 показано влияние соединения 1 (внутримышечно и перорально) на выживаемость мышей, инфицированных вирусом Эбола.
[0024] На ФИГ. 11 показано влияние соединения 1 (внутримышечно и перорально) на потерю массы тела у мышей, инфицированных вирусом Эбола.
[0025] На ФИГ. 12 показано влияние соединения 1 на выживаемость хомяков, инфицированных вирусом желтой лихорадки.
[0026] На ФИГ. 13 показано влияние соединения 1 на потерю массы тела у хомяков, инфицированных вирусом желтой лихорадки.
[0027] На ФИГ. 14 показана фармакокинетическая кривая соединения 1 в дозе 10 мг/кг, измеренная у крыс.
ПОДРОБНОЕ ОПИСАНИЕ
[0028] Согласно настоящему изобретению предложены способы и композиции для ингибирования вирусных полимераз нуклеиновых кислот, таких как РНК- и ДНК-полимеразы, и способы и композиции, которые подходят для лечения вирусных инфекций у субъектов. Указанные способы включают введение субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли или гидрата, или композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель. Композиция или способ может содержать (включать) один или более дополнительных противовирусных агентов. Способы и композиции подходят для лечения, подавления и/или предотвращения вирусных инфекций у субъектов, которые могут возникать в результате инфицирования одним или более типами вируса. Таким образом, способы и композиции подходят для противовирусного лечения, подавления и/или предотвращения широкого спектра.
[0029] В частности, настоящее изобретение относится к способам лечения, подавления и/или предотвращения заболеваний или состояний, связанных с вирусной инфекцией, включающим введение соединения формулы I или его фармацевтически приемлемой соли, или гидрата.
[0030] Соединения формулы (I) являются следующими:
[0031] 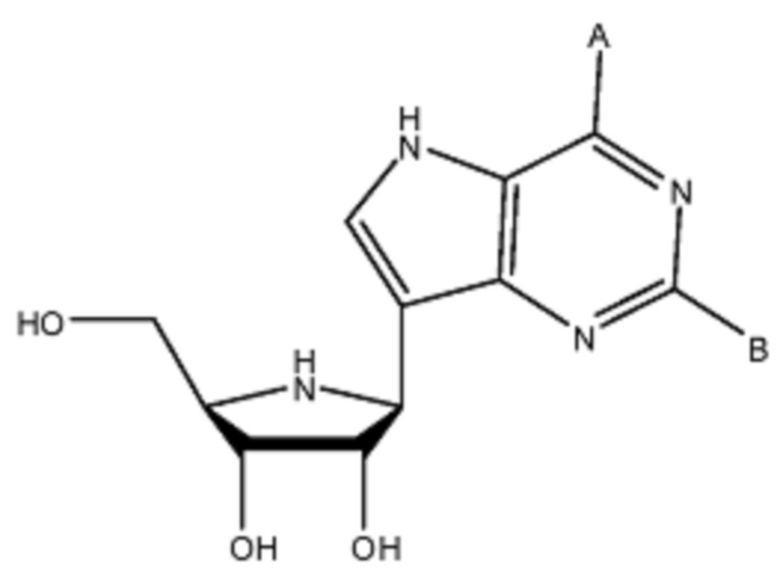 (I),
(I),
где A представляет собой OH или NH2, и B представляет собой H или NH2.
[0032] Таким образом, в некоторых вариантах соединения формулы (I) A представляет собой NH2.
[0033] В некоторых вариантах соединения формулы (I) В представляет собой NH2.
[0034] В некоторых вариантах соединения формулы (I) A представляет собой OH.
[0035] В некоторых вариантах соединения формулы (I) В представляет собой Н.
[0036] В некоторых вариантах соединения формулы (I) А представляет собой NH2, и В представляет собой H.
[0037] В некоторых вариантах соединения формулы (I) А представляет собой ОН, и В представляет собой NH2.
[0038] В некоторых вариантах соединения формулы (I) А представляет собой NH2, и В представляет собой NH2.
[0039] В некоторых вариантах соединения формулы (I) А представляет собой ОН, и В представляет собой H.
[0040] Настоящее изобретение отчасти основано на некоторых обнаружениях, более полно описанных в разделе «Примеры» в настоящей заявке. Например, настоящее изобретение отчасти основано на обнаружении того, что уровни титра вируса в клетках заметно снижались при лечении соединением формулы I. Таким образом, в некоторых вариантах реализации настоящего изобретения предложены способы уменьшения титра вируса в жидкости или клетке организма, заключающиеся в приведении указанной жидкости или клетки в контакт с соединением формулы I. Настоящее изобретение также отчасти основано на обнаружении того, что уровни титра вируса в клетках для некоторых вирусов заметно снижались при лечении соединением формулы I, что, таким образом, указывает на противовирусную активность соединения формулы I широкого спектра в отношении различных штаммов вируса. Таким образом, согласно настоящему изобретению также предложены способы уменьшения титра вируса для нескольких типов, подтипов и/или штаммов вирусов в жидкости или клетке организма, заключающиеся в приведении указанной жидкости или клетки в контакт с соединением формулы I.
[0041] Соединения согласно настоящему изобретению получают в разных формах, таких как соли, гидраты, сольваты или комплексы, и настоящее изобретение включает композиции и способы, включающие все вариантные формы соединений. В некоторых вариантах реализации соединения получают в виде гидратов солей.
Сокращения и определения
[0042] Сокращение «PNP» относится к пуриннуклеозидфосфорилазе.
[0043] В настоящем описании термин «соединение (соединения) согласно настоящему изобретению» означает соединение формулы I и может включать его соли, таутомерные формы, гидраты и/или сольваты. Соединения формулы I также могут включать сольваты или гидраты их солей.
[0044] В настоящем описании термин «сольват» означает соединение формулы I или его фармацевтически приемлемую соль, в которой молекулы подходящего растворителя включены в кристаллическую решетку. Подходящий растворитель является физиологически переносимым в вводимой дозе. Примерами подходящих растворителей являются этанол, вода и т.п. В случае, когда вода является растворителем, молекула называется «гидратом».
[0045] Термин «фармацевтическая композиция» относится к смеси одного или более соединений, описанных в настоящем документе, или их фармацевтически приемлемых солей, или гидратов с другими химическими компонентами, такими как физиологически приемлемые носители и наполнители. Целью фармацевтической композиции является облегчение введения соединения в организм.
[0046] Термин «фармацевтически приемлемая соль» включает соли, полученные из неорганических или органических кислот, включая, например, соляную, бромистоводородную, серную, азотную, хлорную, фосфорную, муравьиную, уксусную, молочную, малеиновую, фумаровую, янтарную, винную, гликолевую, салициловую, лимонную, метансульфоновую, бензолсульфоновую, бензойную, малоновую, трифторуксусную, трихлоруксусную, нафталин-2-сульфоновую и другие кислоты. Формы фармацевтически приемлемых солей также могут включать формы, в которых соотношение молекул, составляющих соль, не составляет 1:1. Например, соль может содержать более одной молекулы неорганической или органической кислоты на молекулу основания, например, две молекулы соляной кислоты на молекулу соединения формулы (I). В качестве другого примера, соль может содержать менее одной молекулы неорганической или органической кислоты на молекулу основания, например, две молекулы соединения формулы (I) на молекулу винной кислоты. Соли также могут существовать в виде сольватов или гидратов.
[0047] Термин «кислота» предполагает все фармацевтически приемлемые неорганические или органические кислоты. Неорганические кислоты включают минеральные кислоты, такие как галогенводородные кислоты, такие как бромистоводородная и соляная кислоты, серные кислоты, фосфорные кислоты и азотные кислоты. Органические кислоты включают все фармацевтически приемлемые алифатические, алициклические и ароматические карбоновые кислоты, дикарбоновые кислоты, трикарбоновые кислоты и жирные кислоты. Предпочтительные кислоты представляют собой линейные или разветвленные, насыщенные или ненасыщенные С1-С20 алифатические карбоновые кислоты, которые возможно содержат в качестве заместителей галоген или гидроксильные группы, или C6-C12 ароматические карбоновые кислоты. Примерами таких кислот являются угольная кислота, муравьиная кислота, фумаровая кислота, уксусная кислота, пропионовая кислота, изопропионовая кислота, валериановая кислота, альфа-гидроксикислоты, такие как гликолевая кислота и молочная кислота, хлоруксусная кислота, бензойная кислота, метансульфоновая кислота и салициловая кислота. Примеры дикарбоновых кислот включают щавелевую кислоту, яблочную кислоту, янтарную кислоту, винную кислоту и малеиновую кислоту. Примером трикарбоновой кислоты является лимонная кислота. Жирные кислоты включают все фармацевтически приемлемые насыщенные или ненасыщенные алифатические или ароматические карбоновые кислоты, содержащие от 4 до 24 атомов углерода. Примеры включают масляную кислоту, изомасляную кислоту, втор-масляную кислоту, лауриновую кислоту, пальмитиновую кислоту, стеариновую кислоту, олеиновую кислоту, линолевую кислоту, линоленовую кислоту и фенилстеариновую кислоту. Другие кислоты включают глюконовую кислоту, гликогептоновую кислоту и лактобионовую кислоту.
[0048] В настоящем описании термин «примерно» означает приблизительно, ориентировочно, около или приближенно. В случае, когда термин «примерно» употребляется в сочетании с числовым диапазоном он модифицирует данный диапазон путем расширения границ выше и ниже указанных числовых значений. В целом, в настоящем описании термин «примерно» употребляется для модификации числового значения выше и ниже указанного значения на величину колебания 20 процентов вверх или вниз (выше или ниже).
[0049] В настоящем описании термин «эффективное количество», «достаточное количество» или «терапевтически эффективное количество» представляет собой количество соединения, которое является достаточным для обеспечения полезных или желаемых результатов, включая клинические результаты. По существу, эффективное количество может быть достаточным, например, для уменьшения или облегчения тяжести и/или продолжительности вирусной инфекции, или одного или более ее симптомов, предотвращения распространения вирусной инфекции, предотвращения рецидива, развития или появления одного или более симптомов, связанных с вирусной инфекцией, предотвращения или уменьшения репликации или размножения вируса, предотвращения или уменьшения продуцирования и/или высвобождения вирусной частицы, усиления или иного повышения профилактического или терапевтического эффекта (эффектов) другой терапии. Эффективное количество также включает количество соединения формулы I, позволяющее избежать или по существу ослабляющее нежелательные побочные эффекты.
[0050] В настоящем описании и как хорошо известно в данной области техники, «лечение» представляет собой подход для получения полезных или желаемых результатов, включая клинические результаты. Полезные или желаемые клинические результаты могут включать, но не ограничиваются ими, облегчение или уменьшение интенсивности одного или более симптомов, или состояний, уменьшение степени заболевания, стабилизированное (т.е. не ухудшающееся) состояние заболевания, предотвращение распространения заболевания, отсрочивание или замедление прогрессирования заболевания, уменьшение или ослабление болезненного состояния и ремиссию (частичную или полную), которая обнаруживается или не обнаруживается. Термин «лечение» также может означать увеличение продолжительности жизни по сравнению с ожидаемой продолжительностью жизни в случае неполучения лечения.
[0051] Термин «носитель» относится к разбавителю, адъюванту, наполнителю или носителю, с которым вводят соединение. Не ограничивающие примеры таких фармацевтических носителей включают жидкости, такие как вода и масла, включая масла минерального, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Фармацевтические носители также могут представлять собой физиологический раствор, аравийскую камедь, желатин, крахмальную пасту, тальк, кератин, коллоидный диоксид кремния, мочевину и т.п. Кроме того, могут быть использованы вспомогательные агенты, стабилизаторы, загустители, смазывающие вещества и красители. Другие примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences" E.W. Martin; полное содержание которого включено в настоящее описание посредством ссылки.
[0052] В настоящем описании термины «животное», «субъект» и «пациент» включают всех членов царства животных, включая, но не ограничиваясь ими, млекопитающих, животных (например, кошки, собаки, лошади, свиньи и т.п.) и людей.
Описание
[0053] Согласно настоящему изобретению предложены способы и композиции для ингибирования вирусных полимераз нуклеиновых кислот, таких как ДНК- и/или РНК-вирусные полимеразы, и способы и композиции, которые подходят для лечения вирусных инфекций у субъектов. Указанные способы включают введение субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль, или гидрат и фармацевтически приемлемый носитель. Композиция или способ может содержать (включать) один или более дополнительных противовирусных агентов. Способы и композиции подходят для лечения, подавления и/или предотвращения вирусных инфекций у субъектов, которые могут возникать в результате инфицирования одним или более семействами, родами, подтипами, серотипами или штаммами вируса.
[0054] Соединения формулы I представляют собой производные 9-деазааденина, в целом, известные как иммуциллины, синтезы которых описаны, например, в WO 03/80620 и Evans et al, in Tetrahedron 2000, 56, 3053 и J. Org. Chem. 2001, 66(17), 5723 (полное содержание каждого из которых включено в настоящее описание посредством ссылки). Синтезы подобных структур рассмотрены, например, в патенте США № 5985848; 6066722; 6228741 и публикациях РСТ WO 2003/080620 и 2008/030119 (полное содержание каждого из которых включено в настоящее описание посредством ссылки). Производные иммуциллина исследовали в качестве ингибиторов PNP (см., Kicska et al, J. Biol. Chem. 2002, 277, 3219-3225 и Kicska et al, J. Biol. Chem. 2002, 277, 3226-3231; полное содержание каждого из которых включено в настоящее описание посредством ссылки). Некоторые иммуциллины также были исследованы в качестве ингибиторов 5'-метилтиоаденозинфосфорилазы (MTAP) или 5'-метилтиоаденозиннуклеозидазы (MTAN). Такие механизмы были вовлечены в лечение рака и бактериальных инфекций (Cм., WO 03/080620, полное содержание которого включено в настоящее описание посредством ссылки).
[0055] Соединения формулы I могут проявлять таутомерные свойства. Таким образом, настоящее изобретение также включает таутомерные формы соединений формулы I и их смеси. Также очевидно, что некоторые соединения существуют в виде фармацевтически приемлемых солей, сольватов и/или гидратов, каждый из которых также входит в варианты реализации настоящего изобретения.
[0056] В некоторых вариантах реализации соединение формулы I существует в виде фармацевтически приемлемой соли. В некоторых вариантах реализации указанная форма соли представляет собой соотношение кислоты и соединения формулы I примерно 1:1. В некоторых вариантах реализации указанная форма соли представляет собой соотношение кислоты и соединения формулы I больше примерно 1:1. В некоторых вариантах реализации указанная форма соли представляет собой соотношение кислоты и соединения формулы I примерно 2:1. В некоторых вариантах реализации указанная форма соли существует в виде гидрата.
[0057] В некоторых вариантах реализации соединение формулы I существует в виде гидрата или сольвата.
[0058] Следовательно, соединения согласно настоящему изобретению подходят для лечения и/или предотвращения вирусных инфекций у хозяина или субъекта. Способы согласно настоящему изобретению можно использовать для лечения и/или предотвращения болезненных состояний или состояний, вызванных и/или связанных с такими вирусными инфекциями. Примеры таких вирусных инфекций включают, но не ограничиваются ими, аденовирус, риновирус, гепатит, вирус иммунодефицита, вирус полиомиелита, вирус кори, вирус Эбола, вирус Коксаки, риновирус, вирус Западного Нила, вирус оспы, вирус энцефалита, вирус желтой лихорадки, вирус лихорадки Денге, вирус гриппа (включая грипп человека, птичий и свиной), вирус Ласса, вирус лимфоцитарного хориоменингита, вирус Хунин, вирус Мачупо, вирус Гуанарито, хантавирус, вирус лихорадки долины Рифт, вирус Ла-Кросс, вирус калифорнийского энцефалита, вирус Конго, вирус Марбург, вирус японского энцефалита, вирус киасанурской лихорадки, вирус венесуэльского энцефалита лошадей, вирус восточного энцефалита лошадей, вирус западного энцефалита лошадей, вирус тяжелого острого респираторного синдрома (ТОРС), вирус парагриппа, респираторно-синцитиальный вирус, вирус Пунта-Торо, вирус Такарибе и вирус Пичинде.
[0059] В некоторых вариантах реализации соединения согласно настоящему изобретению используют для лечения или предотвращения вирусной инфекции, связанной с вирусом. В некоторых вариантах реализации вирусная инфекция включает инфекцию, вызванную одним или более типами вируса. В некоторых вариантах реализации вирусная инфекция включает инфекцию, вызванную одним или более вирусами, выбранными из группы, состоящей из ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов. В некоторых вариантах реализации вирусная инфекция включает инфекцию, вызванную одним или более вирусами, выбранными из группы, состоящей из аденовируса, риновируса, гепатита, вируса иммунодефицита, вируса полиомиелита, вируса, вируса Эбола, вируса Коксаки, риновируса, вируса Западного Нила, вируса оспы, вируса энцефалита, вируса желтой лихорадки, вируса лихорадки Денге, вируса гриппа (включая грипп человека, птичий и свиной), вируса Ласса, вируса лимфоцитарного хориоменингита, вируса Хунин, вируса Мачупо, вируса Гуанарито, хантавируса, вируса лихорадки долины Рифт, вируса Ла-Кросс, вируса калифорнийского энцефалита, вируса Конго, вируса Марбург, вируса японского энцефалита, вируса киасанурской лихорадки, вируса венесуэльского энцефалита лошадей, вируса восточного энцефалита лошадей, вируса западного энцефалита лошадей, вируса тяжелого острого респираторного синдрома (ТОРС), вируса парагриппа, респираторно-синцитиального вируса, вируса Пунта-Торо, вируса Такарибе и вируса Пичинде.
[0060] В некоторых вариантах реализации вирусная инфекция включает инфекцию, вызванную одним или более вирусами, выбранными из группы, состоящей из аденовируса, вируса лихорадки Денге, вируса гриппа А и гриппа В (включая грипп человека, птичий и свиной), вируса Хунин, кори, вируса парагриппа, вируса Пичинде, вируса Пунта-Торо, респираторно-синцитиального вируса, риновируса, вируса лихорадки долины Рифт, вируса тяжелого острого респираторного синдрома (ТОРС), вируса Такарибе, вируса венесуэльского энцефалита лошадей, вируса Западного Нила и вируса желтой лихорадки.
[0061] В некоторых вариантах реализации вирус представляет собой вирус Эбола, вирус Марбург, вирус желтой лихорадки, вирус гриппа А или гриппа В. В некоторых вариантах реализации вирус представляет собой вирус Эбола. В некоторых вариантах реализации вирус представляет собой вирус Марбург. В некоторых вариантах реализации вирус представляет собой вирус желтой лихорадки. В некоторых вариантах реализации вирус представляет собой вирус грипп А или грипп В.
[0062] В некоторых вариантах реализации вирус представляет собой вирус Западного Нила или лихорадки Денге. В некоторых вариантах реализации вирус представляет собой вирус Западного Нила. В некоторых вариантах реализации вирус представляет собой вирус лихорадки Денге.
[0063] В некоторых вариантах реализации соединения согласно настоящему изобретению используют для ингибирования репликации или инфекционности вируса. В некоторых вариантах реализации соединения согласно настоящему изобретению используют для ингибирования роста клетки, инфицированной вирусом. Примеры указанных вирусов включают, но не ограничиваются ими, вирусы семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов. Конкретные примеры вирусов включают, но не ограничиваются ими, аденовирус, риновирус, гепатит, вирус иммунодефицита, полиомиелит, корь, вирус Эбола, вирус Коксаки, риновирус, вирус Западного Нила, вирус оспы, вирус энцефалита, вирус желтой лихорадки, вирус лихорадки Денге, вирус гриппа (включая грипп человека, птичий и свиной), вирус Ласса, вирус лимфоцитарного хориоменингита, вирус Хунин, вирус Мачупо, вирус Гуанарито, хантавирус, вирус лихорадки долины Рифт, вирус Ла-Кросс, вирус калифорнийского энцефалита, вирус Конго, вирус Марбург, вирус японского энцефалита, вирус киасанурской лихорадки, вирус венесуэльского энцефалита лошадей, вирус восточного энцефалита лошадей, вирус западного энцефалита лошадей, вирус тяжелого острого респираторного синдрома (ТОРС), вирус парагриппа, респираторно-синцитиальный вирус, вирус Пунта-Торо, вирус Такарибе и вирус Пичинде.
[0064] Таким образом, в некоторых вариантах реализации вирус выбран из группы, состоящей из вирусов семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов. В некоторых вариантах реализации вирусная инфекция включает вирус, выбранный из группы, состоящей из гепатита, вируса иммунодефицита, вируса полиомиелита, вируса кори, вируса Эбола, вируса Коксаки, риновируса, вируса Западного Нила, вируса оспы, вируса энцефалита, вируса желтой лихорадки, вируса лихорадки Денге, вируса гриппа (включая грипп человека, птичий и свиной), вируса Ласса, вируса лимфоцитарного хориоменингита, вируса Хунин, вируса Мачупо, вируса Гуанарито, хантавируса, вируса лихорадки долины Рифт, вируса Ла-Кросс, вируса калифорнийского энцефалита, вируса Конго, вируса Марбург, вируса японского энцефалита, вируса киасанурской лихорадки, вируса венесуэльского энцефалита лошадей, вируса восточного энцефалита лошадей, вируса западного энцефалита лошадей, вируса тяжелого острого респираторного синдрома (ТОРС), вируса парагриппа, респираторно-синцитиального вируса, вируса Пунта-Торо, вируса Такарибе и вируса Пичинде.
[0065] В некоторых вариантах реализации вирусная инфекция включает вирус, выбранный из группы, состоящей из аденовируса, вируса лихорадки Денге, вируса гриппа А и вируса гриппа В (включая грипп человека, птичий и свиной), вируса Хунин, вируса кори, вируса парагриппа, вируса Пичинде, вируса Пунта-Торо, вируса респираторно-синцитиального вируса, риновируса, вируса лихорадки долины Рифт, вируса тяжелого острого респираторного синдрома (ТОРС), вируса Такарибе, вируса венесуэльского энцефалита лошадей, вируса Западного Нила и вируса желтой лихорадки.
[0066] В некоторых вариантах реализации вирус представляет собой вирус Эбола, вирус Марбург, вирус желтой лихорадки, вирус гриппа А или вирус гриппа В. В некоторых вариантах реализации вирус представляет собой вирус Эбола. В некоторых вариантах реализации вирус представляет собой вирус Марбург. В некоторых вариантах реализации вирус представляет собой вирус желтой лихорадки. В некоторых вариантах реализации вирус представляет собой вирус гриппа А или вирус гриппа В.
[0067] В некоторых вариантах реализации вирус представляет собой вирус Западного Нила или вирус лихорадки Денге. В некоторых вариантах реализации вирус представляет собой вирус Западного Нила. В некоторых вариантах реализации вирус представляет собой вирус лихорадки Денге.
[0068] В некоторых вариантах реализации настоящего изобретения предложен способ ингибирования вирусной РНК или ДНК-полимеразы у субъекта, включающий введение указанному субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или гидрата.
[0069] В соответствии с системой классификации по Балтимору, вирусы РНК-полимеразы можно разделить на такие группы, как, например, двухцепочечные вирусы, вирусы, содержащие одну цепь положительной полярности, и вирусы, содержащие одну цепь отрицательной полярности. Семейства вирусов, содержащих одну цепь положительной полярности, включают, например, коронавирусы, пикорнавирусы, тогавирусы, флавивирусы и т.п. Семейства вирусов, содержащих одну цепь отрицательной полярности, включают, например, парамиксовирусы, аренавирусы, буньявирусы, ортомиксовирусы, филовирусы и т.п. Каждое из семейств вирусов можно дополнительно разделить на роды, виды и серотип (или подтип). Другие обозначения таксономических обозначений вирусов установлены руководством по классификации в соответствии с Международным комитетом по таксономии вирусов.
[0070] В некоторых вариантах реализации РНК-полимераза является двухцепочечной. В некоторых вариантах реализации РНК-полимераза является одноцепочечной. В некоторых вариантах реализации РНК-полимераза содержит одну цепь положительной полярности. В некоторых вариантах реализации РНК-полимераза содержит одну цепь отрицательной полярности.
[0071] В некоторых вариантах реализации способы согласно настоящему изобретению обеспечивают ингибирование широкого спектра вирусов и/или РНК-полимераз одного или более семейств, родов, подтипов, штаммов и/или серотипов вируса. В некоторых вариантах реализации указанные способы обеспечивают лечение, подавление или предотвращение широкого спектра инфекции, вызванной одним или более семействами, родами, подтипами, штаммами или серотипами вируса. В некоторых вариантах реализации широкий спектр включает более двух семейств, родов, подтипов, штаммов и/или серотипов вируса.
[0072] В некоторых вариантах реализации настоящего изобретения предложен способ ингибирования вирусных полимераз одного или более семейств, родов, подтипов, серотипов или штаммов вируса. В некоторых вариантах реализации настоящего изобретения предложен способ лечения, подавления и/или предотвращения вирусной инфекции, при этом указанная вирусная инфекция является результатом инфицирования одним или более семействами, родами, подтипами, серотипами или штаммами вируса.
[0073] В некоторых вариантах реализации вирусные полимеразы или вирусы принадлежат одному или более родам вируса. В некоторых вариантах реализации вирусные полимеразы или вирусы принадлежат одному или более видам вируса. В некоторых вариантах реализации вирусные полимеразы или вирусы выбраны из одного или более подтипов или серотипов. В некоторых вариантах реализации вирусные полимеразы или вирусы выбраны из одного или более штаммов.
[0074] В некоторых вариантах реализации вирусная РНК-полимераза выбрана из группы, состоящей из полимераз семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов. В некоторых вариантах реализации вирусная РНК-полимераза выбрана из группы, состоящей из полимераз семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов и коронавирусов. В некоторых вариантах реализации вирусная РНК-полимераза включает полимеразу, выбранную из группы, состоящей из вирусной полимеразы вируса гепатита, вируса иммунодефицита, вируса полиомиелита, вируса кори, вируса Эбола, вируса Коксаки, риновируса, вируса Западного Нила, вируса оспы, вируса энцефалита, вируса желтой лихорадки, вируса лихорадки Денге, вируса гриппа (включая грипп человека, птичий и свиной), вируса Ласса, вируса лимфоцитарного хориоменингита, вируса Хунин, вируса Мачупо, вируса Гуанарито, хантавируса, вируса лихорадки долины Рифт, вируса Ла-Кросс, вируса калифорнийского энцефалита, вируса Конго, вируса Марбург, вируса японского энцефалита, вируса киасанурской лихорадки, вируса венесуэльского энцефалита лошадей, вируса восточного энцефалита лошадей, вируса западного энцефалита лошадей, вируса тяжелого острого респираторного синдрома (ТОРС), вируса парагриппа, респираторно-синцитиального вируса, вируса Пунта-Торо, вируса Такарибе и вируса Пичинде.
[0075] В некоторых вариантах реализации вирусная РНК-полимераза выбрана из группы, состоящей из вирусной полимеразы аденовируса, вируса лихорадки Денге, вируса гриппа А и вируса гриппа В (включая грипп человека, птичий и свиной), вируса Хунин, вируса кори, вируса парагриппа, вируса Пичинде, вируса Пунта-Торо, респираторно-синцитиального вируса, риновируса, вируса лихорадки долины Рифт, вируса тяжелого острого респираторного синдрома (ТОРС), вируса Такарибе, вируса венесуэльского энцефалита лошадей, вируса Западного Нила и вируса желтой лихорадки.
[0076] В некоторых вариантах реализации вирусная РНК-полимераза представляет собой вирусную полимеразу вируса Эбола, вируса Марбург, вируса желтой лихорадки, вируса гриппа А или гриппа В. В некоторых вариантах реализации вирусная РНК-полимераза представляет собой вирусную полимеразу вируса Эбола. В некоторых вариантах реализации вирусная РНК-полимераза представляет собой вирусную полимеразу вируса Марбург. В некоторых вариантах реализации вирусная РНК-полимераза представляет собой вирусную полимеразу вируса желтой лихорадки. В некоторых вариантах реализации вирусная РНК-полимераза представляет собой вирусную полимеразу вируса гриппа А или вирусную полимеразу вируса гриппа В. В некоторых вариантах реализации вирусная полимераза представляет собой вирусную полимеразу вируса Западного Нила или вируса лихорадки Денге. В некоторых вариантах реализации вирусная полимераза представляет собой вирусную полимеразу вируса Западного Нила. В некоторых вариантах реализации вирусная полимераза представляет собой вирусную полимеразу вируса лихорадки Денге.
[0077] В некоторых вариантах реализации вирусы выбраны из группы, состоящей из семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов. В некоторых вариантах реализации вирусы выбраны из группы, состоящей из вируса гепатита, вируса иммунодефицита, вируса полиомиелита, вируса кори, вируса Эбола, вируса Коксаки, риновируса, вируса Западного Нила, вируса оспы, вируса энцефалита, вируса желтой лихорадки, вируса лихорадки Денге, вируса гриппа (включая грипп человека, птичий и свиной), вируса Ласса, вируса лимфоцитарного хориоменингита, вируса Хунин, вируса Мачупо, вируса Гуанарито, хантавируса, вируса лихорадки долины Рифт, вируса Ла-Кросс, вируса калифорнийского энцефалита, вируса Конго, вируса Марбург, вируса японского энцефалита, вируса киасанурской лихорадки, вируса венесуэльского энцефалита лошадей, вируса восточного энцефалита лошадей, вируса западного энцефалита лошадей, вируса тяжелого острого респираторного синдрома (ТОРС), вируса парагриппа, респираторно-синцитиального вируса, вируса Пунта-Торо, вируса Такарибе и вируса Пичинде.
[0078] В некоторых вариантах реализации вирусы выбраны из группы, состоящей из аденовируса, вируса лихорадки Денге, вируса гриппа А и вируса гриппа В (включая грипп человека, птичий и свиной), вируса Хунин, вируса кори, вируса парагриппа, вируса Пичинде, вируса Пунта-Торо, респираторно-синцитиального вируса, риновируса, вируса лихорадки долины Рифт, вируса тяжелого острого респираторного синдрома (ТОРС), вируса Такарибе, вируса венесуэльского энцефалита лошадей, вируса Западного Нила и вируса желтой лихорадки.
[0079] В некоторых вариантах реализации вирус представляет собой вирус Эбола, вирус Марбург, вирус желтой лихорадки, вирус гриппа А или гриппа В. В некоторых вариантах реализации вирус представляет собой вирус Эбола. В некоторых вариантах реализации вирус представляет собой вирус Марбург. В некоторых вариантах реализации вирус представляет собой вирус желтой лихорадки. В некоторых вариантах реализации вирус представляет собой вирус гриппа А или гриппа В.
[0080] В некоторых вариантах реализации вирус представляет собой вирус Западного Нила или вирус лихорадки Денге. В некоторых вариантах реализации вирус представляет собой вирус Западного Нила. В некоторых вариантах реализации вирус представляет собой вирус лихорадки Денге.
[0081] Геном вируса гриппа А содержит РНК-зависимую РНК-полимеразу, которая катализирует транскрипцию и репликацию вирусной РНК. Поскольку транскрипция и репликация вируса зависят от активности РНК-полимеразы, данный фермент стал представлять интерес в качестве мишени для разработки новых противовирусных соединений в свете появления в последнее время вирусов, резистентных к лекарственным средствам. Вирусы могут развивать резистентность к одному лекарственному средству при лечении, таким образом, снижая эффективность указанного лекарственного средства и требуя лечения субъекта другим противовирусным лекарственным средством. Таким образом, было бы полезно разработать лекарственное средство или лечение, которое демонстрировало бы эффективность одновременно в отношении широкого спектра вирусных штаммов.
[0082] Кроме того, композиция или способ может дополнительно содержать (включать) один или более дополнительных противовирусных агентов в комбинации с соединением формулы I. Примеры таких противовирусных агентов включают, но не ограничиваются ими, Цитовен, Ганцикловир, фосфоноформиат тринатрия, рибавирин, интерферон, d4T, ddl, AZT и Амантадин, Римантадин и другие агенты против гриппа; Ацикловир и родственные агенты, Фоскарнет и другие агенты против вируса герпеса. Не ограничивающие примеры ингибиторов нейраминидазы включают ланинамивир, осельтамивир, занамивир и перамивир.
[0083] Соединения, относящиеся к ингибированию полимеразы гриппа, описаны, например, в патенте США № 7388002; 7560434; и в заявке на патент США № 12/440697 (опубликованной как заявка на патент США № 20100129317); и 12/398866 (опубликованной как заявка на патент США № 20090227524), полное содержание каждой из которых включено в настоящее описание посредством ссылки. В настоящее время существует один ингибитор полимеразы гриппа в клинических исследованиях, известный как T-705 (фавипиравир ; 6-фтор-3-гидрокси-2-пиразинкарбоксамид). T-705 обладает мощной противовирусной активностью широкого спектра в отношении нескольких штаммов инфекции вируса гриппа in vitro и in vivo (Kiso et al, PNAS 2010, 107, 882-887; полное содержание включено в настоящее описание посредством ссылки). T-705 характеризуется механизмом действия, который отличается от большинства лекарственных средств против вируса гриппа.
[0084] Другой класс соединений, используемых в качестве противовирусных средств, представляет собой ингибиторы М2 (см., Pielak, R., Schnell, J., & Chou, J. (2009) Proceedings of the National Academy of Sciences, 106 (18), 7379-7384 (полное содержание включено в настоящее описание посредством ссылки)). Типичные члены данного класса включают амантадин и римантадин.
[0085] Таким образом, в некоторых вариантах реализации способы согласно настоящему изобретению также включают введение одного или более дополнительных противовирусных агентов.
[0086] В некоторых вариантах реализации дополнительный противовирусный агент выбран из группы, состоящей из Цитовена, Ганцикловира, фосфоноформиата тринатрия, рибавирина, интерферона, d4T, ddl, AZT и амантадина, римантадина, T-705 и других агентов против гриппа; Ацикловира и родственных агентов, Фоскарнета и других агентов против вируса герпеса.
[0087] В некоторых вариантах реализации дополнительный противовирусный агент представляет собой агент против гриппа. В некоторых вариантах реализации дополнительный противовирусный агент представляет собой ингибитор нейраминидазы. В некоторых вариантах реализации дополнительный противовирусный агент выбран из группы, состоящей из ланинамивира, осельтамивира, занамивира и перамивира. В некоторых вариантах реализации дополнительный противовирусный агент представляет собой перамивир. В некоторых вариантах реализации дополнительный противовирусный агент представляет собой ланинамивир. В некоторых вариантах реализации дополнительный противовирусный агент представляет собой осельтамивир. В некоторых вариантах реализации дополнительный противовирусный агент представляет собой занамивир.
[0088] В некоторых вариантах реализации дополнительный противовирусный агент представляет собой ингибитор М2. В некоторых вариантах реализации дополнительный противовирусный агент выбран из группы, состоящей из амантадина и римантадина.
[0089] В некоторых вариантах реализации способы согласно настоящему изобретению включают введение двух дополнительных противовирусных агентов. В некоторых вариантах реализации дополнительные противовирусные агенты представляют собой ингибитор нейраминидазы и ингибитор M2. В некоторых вариантах реализации дополнительные противовирусные агенты выбраны из групп, состоящих из 1) ланинамивира, осельтамивира, занамивира и перамивира; и 2) амантадина и римантадина. В некоторых вариантах реализации дополнительные противовирусные агенты представляют собой перамивир и амантадин. В некоторых вариантах реализации дополнительные противовирусные агенты представляют собой перамивир и римантадин.
[0090] Согласно настоящему изобретению предложены способы ингибирования вирусной РНК- или ДНК-полимеразы, включающие приведение указанной полимеразы в контакт с эффективным ингибирующим количеством соединения формулы I или его фармацевтически приемлемой соли, или сольвата.
[0091] В некоторых вариантах реализации согласно настоящему изобретению предложен способ лечения субъекта, страдающего вирусной инфекцией, включающий введение указанному субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или гидрата.
[0092] В некоторых вариантах реализации согласно настоящему изобретению предложен способ подавления вирусной инфекции у субъекта, включающий введение указанному субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или гидрата.
[0093] В некоторых вариантах реализации согласно настоящему изобретению предложен способ лечения субъекта, страдающего РНК-вирусной инфекцией, включающий введение указанному субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли или сольвата.
[0094] В некоторых вариантах реализации указанная вирусная инфекция включает инфекцию, вызванную одним или более вирусами.
[0095] В некоторых вариантах реализации вирусные инфекции представляют собой инфекции, выбранные из вирусов семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов или коронавирусов, или любой комбинации указанных вирусов. В некоторых вариантах реализации вирусные инфекции представляют собой инфекции, выбранные из вирусов гепатита, вируса иммунодефицита, вируса полиомиелита, вируса кори, вируса Эбола, вируса Коксаки, риновируса, вируса Западного Нила, вируса оспы, вируса энцефалита, вируса желтой лихорадки, вируса лихорадки Денге, вируса гриппа (включая грипп человека, птичий и свиной), вируса Ласса, вируса лимфоцитарного хориоменингита, вируса Хунин, вируса Мачупо, вируса Гуанарито, хантавируса, вируса лихорадки долины Рифт, вируса Ла-Кросс, вируса калифорнийского энцефалита, вируса Конго, вируса Марбург, вируса японского энцефалита, вируса киасанурской лихорадки, вируса венесуэльского энцефалита лошадей, вируса восточного энцефалита лошадей, вируса западного энцефалита лошадей, вируса тяжелого острого респираторного синдрома (ТОРС), вируса парагриппа, респираторно-синцитиального вируса, вируса Пунта-Торо, вируса Такарибе и вируса Пичинде или любой комбинации указанных вирусов.
[0096] В некоторых вариантах реализации вирусная инфекция включает инфекцию, вызванную одним или более вирусами, выбранными из группы, состоящей из аденовируса, вируса лихорадки Денге, вируса гриппа А и вируса гриппа В (включая грипп человека, птичий и свиной), вируса Хунин, вируса кори, вируса парагриппа, вируса Пичинде, вируса Пунта-Торо, респираторно-синцитиального вируса, риновируса, вируса лихорадки долины Рифт, вируса тяжелого острого респираторного синдрома (ТОРС), вируса Такарибе, вируса венесуэльского энцефалита лошадей, вируса Западного Нила и вируса желтой лихорадки.
[0097] В некоторых вариантах реализации вирус представляет собой вирус Эбола, вирус Марбург, вирус желтой лихорадки, вирус гриппа А или вирус гриппа В. В некоторых вариантах реализации вирус представляет собой вирус Эбола. В некоторых вариантах реализации вирус представляет собой вирус Марбург. В некоторых вариантах реализации вирус представляет собой вирус желтой лихорадки. В некоторых вариантах реализации вирус представляет собой вирус гриппа А или гриппа В.
[0098] В некоторых вариантах реализации вирус представляет собой вирус Западного Нила или вирус лихорадки Денге. В некоторых вариантах реализации вирус представляет собой вирус Западного Нила. В некоторых вариантах реализации вирус представляет собой вирус лихорадки Денге.
[0099] В некоторых вариантах реализации вирусные инфекции представляют собой инфекции, выбранные из вирусов гриппа А, гриппа В, парагриппа (PIV), респираторно-синцитиального вируса (РСВ), вируса Хунин, вируса Пичинде, лихорадки долины Рифт, лихорадки Денге, оспы, желтой лихорадки и ТОРС-CoV или любой комбинации указанных вирусов. В некоторых вариантах реализации вирусные инфекции представляют собой инфекции, выбранные из вирусов гриппа А и В, их подтипов, их штаммов или любой комбинации указанных вирусов. В некоторых вариантах реализации вирусные инфекции представляют собой инфекции, выбранные из вируса Эбола, вируса Марбург или вируса желтой лихорадки. В некоторых вариантах реализации вирусная инфекция представляет собой вирус Эбола. В некоторых вариантах реализации вирусная инфекция представляет собой вирус Марбург. В некоторых вариантах реализации вирусная инфекция представляет собой вирус желтой лихорадки. В некоторых вариантах реализации вирусная инфекция представляет собой вирус Западного Нила или вирус лихорадки Денге. В некоторых вариантах реализации вирусная инфекция представляет собой вирус Западного Нила. В некоторых вариантах реализации вирусная инфекция представляет собой вирус лихорадки Денге.
[00100] В некоторых вариантах реализации согласно настоящему изобретению предложено применение фармацевтических композиций и/или лекарственных средств, состоящих из соединения формулы I или его фармацевтически приемлемой соли, или гидрата, в способе лечения вирусной инфекции и/или болезненного состояния, и/или состояния, вызванного или связанного с указанной вирусной инфекцией.
[00101] В некоторых вариантах реализации указанный способ лечения включает этапы: i) идентификации субъекта, нуждающегося в таком лечении; (ii) обеспечения соединения формулы I или его фармацевтически приемлемой соли, или гидрата, или композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль, или гидрат; и (iii) введение указанного соединения или композиции в терапевтически эффективном количестве для лечения вирусной инфекции у субъекта или для ингибирования активности вирусной ДНК или РНК-полимеразы у субъекта, нуждающегося в таком лечении.
[00102] В некоторых вариантах реализации эффективность лечения является следствием ингибирования вирусной ДНК- или РНК-полимеразы. В некоторых вариантах реализации эффективность лечения является следствием ингибирования вирусных полимераз одного или более семейств вирусов.
[00103] В некоторых вариантах реализации вирусные полимеразы или вирусы принадлежат одному или более родам вируса. В некоторых вариантах реализации вирусные полимеразы или вирусы принадлежат одному или более видам вируса. В некоторых вариантах реализации вирусные полимеразы или вирусы выбраны из одного или более подтипов, серотипов или штаммов.
[00104] В некоторых вариантах реализации указанный способ осуществляют in vivo.
[00105] В некоторых вариантах реализации субъект представляет собой млекопитающее. В некоторых вариантах реализации субъект представляет собой человека. В некоторых вариантах реализации субъект представляет собой птицу. В некоторых вариантах реализации субъект представляет собой свинью.
[00106] В некоторых вариантах реализации жидкость организма представляет собой кровь. В некоторых вариантах реализации жидкость организма представляет собой плазму. В некоторых вариантах реализации жидкость организма представляет собой сыворотку крови.
[00107] В некоторых вариантах реализации соединение или композицию вводят внутривенно, интраперитонеально, внутримышечно или перорально.
[00108] В некоторых вариантах реализации соединение или композицию вводят внутривенно.
[00109] В некоторых вариантах реализации соединение или композицию вводят интраперитонеально.
[00110] В некоторых вариантах реализации соединение или композицию вводят внутримышечно.
[00111] В некоторых вариантах реализации соединение или композицию вводят перорально.
[00112] Способы включают введение субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Фармацевтически приемлемые носители хорошо известны специалисту в данной области техники и включают, например, адъюванты, разбавители, вспомогательные вещества, наполнители, смазывающие вещества и основы. Часто фармацевтически приемлемый носитель является химически инертным по отношению к активным соединениям и нетоксичен в условиях использования. Примеры фармацевтически приемлемых носителей могут включать, например, воду или физиологический раствор, полимеры, такие как полиэтиленгликоль, углеводы и их производные, масла, жирные кислоты или спирты. В некоторых вариантах реализации носитель представляет собой физиологический раствор или воду. В некоторых вариантах реализации носитель представляет собой физиологический раствор. В некоторых вариантах реализации носитель представляет собой воду.
[00113] В некоторых вариантах реализации способ предотвращения или подавления вирусной инфекции или болезненного состояния включает этапы: i) идентификация субъекта, нуждающегося в таком лечении; (ii) обеспечение соединения формулы I или его фармацевтически приемлемой соли, или гидрата, или композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль, или гидрат; и (iii) введение указанного соединения или композиции в терапевтически эффективном количестве для предотвращения или подавления вирусной инфекции или болезненного состояния у субъекта, или для ингибирования активности вирусной ДНК или РНК-полимеразы у субъекта, нуждающегося в таком лечении.
[00114] Соединения согласно настоящему изобретению получают в разных формах, таких как соли, гидраты, сольваты, таутомеры или комплексы, и настоящее изобретение включает способы, включающие все вариантные формы соединений.
[00115] В некоторых вариантах реализации способы согласно настоящему изобретению включают фармацевтически приемлемые соли соединения формулы I. Соединение формулы I также может быть включено в состав в виде фармацевтически приемлемой соли, например, соли присоединения кислоты, и его комплексов. Получение таких солей может облегчать применение в фармакологии за счет изменения физических характеристик агента без препятствования его физиологическому действию. Примеры подходящих изменений физических свойств включают, но не ограничиваются ими, снижение температуры плавления для облегчения трансмукозального введения и увеличение растворимости для облегчения введения более высоких концентраций лекарственного средства.
[00116] Субъекты согласно настоящему изобретению представляют собой системы in vitro и in vivo, включая, например, выделенные или культивированные клетки или ткани, неклеточные системы анализа in vitro и животных (например, амфибия, птица, рыба, млекопитающее, сумчатое, человек, домашнее животное, такое как, например, кошка, собака, обезьяна, мышь или крыса; или товарное животное, такое как, например, корова или свинья).
[00117] Соединения согласно настоящему изобретению могут быть включены в состав фармацевтических композиций для введения субъектам в биологически совместимой форме, подходящей для введения in vivo. В соответствии с другим аспектом настоящего изобретения предложена фармацевтическая композиция, содержащая соединения формулы I в смеси с фармацевтически приемлемым разбавителем и/или носителем. Фармацевтически приемлемый носитель должен быть «приемлемым» в смысле совместимости с другими ингредиентами композиции и не оказывать вредного воздействия на реципиента. Фармацевтически приемлемые носители, используемые согласно настоящему изобретению, могут быть выбраны из различных органических или неорганических веществ, которые используют в качестве веществ для фармацевтических составов и которые включают в качестве анальгетиков, буферов, связующих веществ, разрыхлителей, разбавителей, эмульгаторов, наполнителей, добавок, веществ, способствующих скольжению, солюбилизаторов, стабилизаторов, суспендирующих агентов, веществ, регулирующих тоничность, носителей и агентов, повышающих вязкость. Также могут быть добавлены фармацевтические добавки, такие как антиоксиданты, ароматизаторы, красители, агенты, улучшающие вкус, консерванты и подсластители. Примеры приемлемых фармацевтических носителей включают в том числе карбоксиметилцеллюлозу, кристаллическую целлюлозу, глицерин, аравийскую камедь, лактозу, стеарат магния, метилцеллюлозу, порошки, физиологический раствор, альгинат натрия, сахарозу, крахмал, тальк и воду. В некоторых вариантах реализации термин «фармацевтически приемлемый» означает разрешенный Управлением федерального или государственного правительства по контролю или перечисленный в Фармакопее США, или другой общепризнанной фармакопее для применения у животных и, в частности, у людей.
[00118] Поверхностно-активные вещества, такие как, например, детергенты, также подходят для использования в составах. Конкретные примеры поверхностно-активных веществ включают поливинилпирролидон, поливиниловые спирты, сополимеры винилацетата и винилпирролидона, полиэтиленгликоли, бензиловый спирт, маннитол, глицерин, сорбитол или полиоксиэтиленированные эфиры сорбитана; лецитин или карбоксиметилцеллюлозу натрия; или акриловые производные, такие как метакрилаты и другие, анионные поверхностно-активные вещества, такие как стеараты щелочных металлов, в частности, стеарат натрия, калия или аммония; стеарат кальция или стеарат триэтаноламина; алкилсульфаты, в частности, лаурилсульфат натрия и цетилсульфат натрия; додецилбензолсульфонат натрия или диоктилсульфосукцинат натрия; или жирные кислоты, в частности, полученные из кокосового масла, катионные поверхностно-активные вещества, такие как водорастворимые соли четвертичного аммония формулы N+R'R"R'"R""Y-, в которой радикалы R представляют собой одинаковые или разные возможно содержащие заместители гидроксилированные углеводородные радикалы, и Y- представляет собой анион сильной кислоты, такой как галогенидные, сульфатные и сульфонатные анионы; цетилтриметиламмонийбромид представляет собой один из катионных поверхностно-активных веществ, которые можно использовать, соли аминов формулы N+R'R"R'", в которой радикалы R представляют собой одинаковые или разные возможно содержащие заместители гидроксилированные углеводородные радикалы; гидрохлорид октадециламина представляет собой одно из катионных поверхностно-активных веществ, которые можно использовать, неионные поверхностно-активные вещества, такие как возможно полиоксиэтиленированные эфиры сорбитана, в частности, Полисорбат 80 (Polysorbate 80), или полиоксиэтиленированные алкиловые эфиры; стеарат полиэтиленгликоля, полиоксиэтиленированные производные касторового масла, полиглицериновые эфиры, полиоксиэтиленированные жирные спирты, полиоксиэтиленированные жирные кислоты или сополимеры этиленоксида и пропиленоксида, амфотерные поверхностно-активные вещества, такие как содержащие заместители лаурильные соединения бетаина.
[00119] При введении субъекту соединения формулы I и фармацевтически приемлемые носители могут быть стерильными. В некоторых вариантах реализации вода является носителем, когда соединение формулы I вводят внутривенно. В некоторых вариантах реализации носитель представляет собой физиологический раствор, когда соединение формулы I вводят внутривенно. Также в качестве жидких носителей могут быть использованы водные растворы декстрозы и глицерина, в частности, для растворов для инъекций. Подходящие фармацевтические носители также могут включать вспомогательные вещества, такие как крахмал, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, полиэтиленгликоль 300, вода, этанол, полисорбат 20 и т.п. Композиции согласно настоящему изобретению при необходимости также могут содержать малые количества смачивающих агентов или эмульгаторов, или рН буферных агентов.
[00120] Фармацевтические составы согласно настоящему изобретению получают способами, хорошо известными в области фармации. Например, соединения формулы I объединяют с носителем и/или разбавителем, в виде суспензии или раствора. Возможно также добавляют один или более вспомогательных ингредиентов (например, буферы, ароматизаторы, поверхностно-активные агенты и т.п.). Выбор носителя определяется растворимостью и химической природой соединений, выбранным путем введения и стандартной фармацевтической практикой. В некоторых вариантах реализации состав содержит соединение формулы I и воду. В некоторых вариантах реализации состав содержит соединение формулы I и физиологический раствор.
[00121] Кроме того, соединения согласно настоящему изобретению вводят субъекту, представляющему собой человека или животное, с помощью известных процедур, включая, без ограничения, пероральное введение, сублингвальное или трансбуккальное введение, парентерального введение, трансдермальное введение, введение путем ингаляции или интраназально, вагинально, ректально и внутримышечно. Соединения согласно настоящему изобретению вводят парентерально, путем эпифасциальной, интракапсулярной, внутричерепной, внутрикожной, интратекальной, внутримышечной, внутриглазничной, интраперитонеальной, интраспинальной, интрастернальной, внутрисосудистой, внутривенной, паренхиматозной, подкожной или сублингвальной инъекции, или посредством катетера. В некоторых вариантах реализации соединение вводят субъекту путем внутримышечной доставки. В некоторых вариантах реализации соединение вводят субъекту путем интраперитонеальной доставки В некоторых вариантах реализации соединение вводят субъекту путем внутривенной доставки. В некоторых вариантах реализации соединение вводят перорально.
[00122] Для перорального введения состав, содержащий соединения согласно настоящему изобретению, может быть представлен в виде капсул, таблеток, порошков, гранул или в виде суспензии или раствора. Составы в виде капсул могут представлять собой желатиновые, мягкие гелевые или твердые капсулы. Составы в виде таблеток и капсул могут дополнительно содержать один или более адъювантов, связующих веществ, разбавителей, разрыхлителей, вспомогательных веществ, наполнителей или смазывающих веществ, каждое из которых известно в данной области техники. Примеры указанных веществ включают углеводы, такие как лактоза или сахароза, безводный двухосновный фосфат кальция, кукурузный крахмал, маннит, ксилит, целлюлозу или ее производные, микрокристаллическую целлюлозу, желатин, стеараты, диоксид кремния, тальк, натрия крахмалгликолят, камедь, ароматизаторы, консерванты, буферные агенты, разрыхлители и красители. Перорально вводимые композиции могут содержать один или более дополнительных агентов, таких как, например, подсластители, такие как фруктоза, аспартам или сахарин; ароматизаторы, такие как перечная мята, масло грушанки или вишни; красители; и консерванты, для получения фармацевтически приятного на вкус препарата.
[00123] Для парентерального введения (т.е. введения путем инъекции через путь, отличный от пищеварительного тракта) соединения согласно настоящему изобретению можно комбинировать со стерильным водным раствором, который находится с состоянии изотоничности с кровью субъекта. Такой состав получают путем растворения твердого активного ингредиента в воде, содержащей физиологически совместимые вещества, такие как хлорид натрия, глицин и т.п., и имеющей рН, совместимый с физиологическими условиями, для получения водного раствора, затем путем приведения указанного раствора в стерильное состояние. Состав может быть представлен в однодозовых или многодозовых емкостях, таких как герметически закрытые ампулы или флаконы. Состав может быть доставлен в организм субъекта с помощью любого типа инъекции, включая, без ограничения, эпифасциальную, интракапсулярную, внутричерепную, внутрикожную, интратекальную, внутримышечную, внутриглазничную, интраперитонеальную, интраспинальную, интрастернальную, внутрисосудистую, внутривенную, паренхиматозную, подкожную или сублингвальную, или посредством катетера.
[00124] Парентеральное введение включает водные и неводные растворы. Примеры таких растворов включают, например, воду, физиологический раствор, водный раствор сахара или раствор сахарных спиртов, спиртовой раствор (такой как этиловый спирт, изопропанол, гликоли), простые эфиры, масла, глицериды, жирные кислоты и сложные эфиры жирных кислот. В некоторых вариантах реализации воду используют для парентерального введения. В некоторых вариантах реализации физиологический раствор используют для парентерального введения. Масла для парентеральной инъекции включают животные, растительные, синтетические или минеральные масла. Примеры сахаров для раствора включают сахарозу, лактозу, декстрозу, маннозу и т.п. Примеры масел включают минеральное масло, вазелин, соевое, кукурузное, хлопковое, арахисовое масло и т.п. Примеры жирных кислот и сложных эфиров включают олеиновую кислоту, миристиновую кислоту, стеариновую кислоту, изостеариновую кислоту и сложные эфиры указанных кислот.
[00125] Для трансдермального введения соединения согласно настоящему изобретению комбинируют с усилителями проникновения через кожу, такими как пропиленгликоль, полиэтиленгликоль, изопропанол, этанол, олеиновая кислота, N-метилпирролидон и т.п., которые увеличивают проницаемость кожи для соединений согласно настоящему изобретению и позволяют соединениям проникать через кожу и в кровоток. Композиции соединение/усиливающий агент также можно дополнительно комбинировать с полимерным веществом, такими как этилцеллюлоза, гидроксипропилцеллюлоза, этилен/винилацетат, поливинилпирролидон и т.п. для получения композиции в форме геля, которые растворяют в растворителе, таком как метиленхлорид, выпаривают до желаемой вязкости, а затем наносят на материал-основу с получением пластыря.
[00126] В некоторых вариантах реализации композиция представлена в единичной лекарственной форме, такой как таблетка, капсула или флакон, содержащий разовую дозу. Подходящие единичные дозы, т.е. терапевтически эффективные количества, могут быть определены в ходе клинических исследований, предназначенных соответственно для каждого из состояний, для которых показано введение выбранного соединения, и, конечно, будут варьироваться в зависимости от желаемого клинического результата.
[00127] Согласно настоящему изобретению также предложены готовые продукты для лечения и предотвращения заболеваний, таких как вирусные заболевания, у субъекта. Указанные готовые продукты включают фармацевтическую композицию, содержащую соединения формулы I, возможно дополнительно содержащую по меньшей мере одно дополнительное противовирусное соединение, описанное в настоящем документе. Готовые продукты упакованы с показаниями для различных расстройств, которые фармацевтические композиции могут лечить и/или предотвращать. Например, готовые продукты включают однократную дозу соединения, описанного в настоящем документе, которая может лечить или предотвращать определенное расстройство, и указание того, что указанная однократная доза может лечить или предотвращать определенное расстройство, например, вирусную инфекцию.
[00128] В соответствии со способом согласно настоящему изобретению соединения формулы I вводят субъекту (или приводят в контакт с клетками субъекта) в количестве, эффективном для ограничения или предотвращения повышения уровня вируса у субъекта, в частности, в клетках субъекта. Данное количество может быть легко определено специалистом в данной области техники на основе известных процедур, включая анализ кривых титрования, полученных in vivo, и методов и анализов, описанных в настоящем документе. В некоторых вариантах реализации подходящее количество соединений согласно настоящему изобретению, эффективное для ограничения или предотвращения повышения уровня вирусных частиц у субъекта, находится в диапазоне от примерно 0,01 мг/кг/сутки до 1000 мг/кг/сутки, и/или представляет собой количество, достаточное для достижения уровней в плазме крови в диапазоне от примерно 300 нг/мл до примерно 1000 нг/мл или выше. В некоторых вариантах реализации количество соединений согласно настоящему изобретению находится в диапазоне от примерно 5 мг/кг/сутки до примерно 1000 мг/кг/сутки. В некоторых вариантах реализации вводят от примерно 0,01 мг/кг/сутки до примерно 500 мг/кг/сутки. В некоторых вариантах реализации вводят от примерно 0,01 мг/кг/сутки до примерно 300 мг/кг/сутки. В некоторых вариантах реализации вводят от примерно 0,01 мг/кг/сутки до примерно 200 мг/кг/сутки. В некоторых вариантах реализации вводят от примерно 0,05 мг/кг/сутки до примерно 100 мг/кг/сутки. В некоторых вариантах реализации вводят от примерно 0,05 мг/кг/сутки до примерно 50 мг/кг/сутки. В некоторых вариантах реализации вводят от примерно 0,05 мг/кг/сутки до примерно 30 мг/кг/сутки. В некоторых вариантах реализации вводят от примерно 0,05 мг/кг/сутки до примерно 10 мг/кг/сутки.
[00129] Точная доза, используемая в композициях, также будет зависеть от пути введения и тяжести инфекции или расстройства, и должна быть определена по усмотрению врача и в соответствии с обстоятельствами каждого пациента. Однако подходящие эффективные диапазоны доз для внутримышечного введения, в целом, составляют от примерно 0,5 до примерно 1000 мг соединения формулы I на килограмм массы тела. В конкретных вариантах реализации доза для внутримышечного введения составляет от примерно 500 до примерно 1000 мг/кг, от примерно 300 до примерно 500 мг/кг, от примерно 200 до примерно 300 мг/кг, от примерно 100 до примерно 200 мг/кг, от примерно 50 до примерно 100 мг/кг, от примерно 10 до примерно 50 мг/кг или от примерно 5 до примерно 10 мг/кг (или эквивалентные дозы в расчете на квадратный метр площади поверхности тела). В качестве альтернативы, подходящий диапазон доз для внутривенного введения может быть получен с использованием доз от примерно 5 до примерно 1000 мг без поправки в отношении массы тела или площади поверхности тела пациента. В качестве альтернативы, подходящий диапазон доз для интраперитонеального введения может быть получен с использованием доз от примерно 5 до примерно 1000 мг без поправки в отношении массы тела или площади поверхности тела пациента. Композиции для перорального введения могут содержать от примерно 10 масс.% до примерно 95 масс.% одного или более соединений формулы I отдельно или в комбинации с другим терапевтическим агентом. В некоторых вариантах реализации настоящего изобретения подходящие диапазоны доз для перорального, интраперитонеального или внутримышечного введения, в целом, составляют от примерно 5 до примерно 1000 мг, предпочтительно от примерно 5 до примерно 500 мг соединения на килограмм массы тела или эквивалентные им дозы в расчете на квадратный метр площади поверхности тела. В некоторых вариантах реализации доза для перорального, интраперитонеального или внутримышечного введения составляет от примерно 5 до примерно 50 мг/кг, от примерно 50 до примерно 80 мг/кг, от примерно 80 до примерно 150 мг/кг, от примерно 150 до примерно 250 мг/кг, от примерно 250 до примерно 350 мг/кг, от примерно 350 до примерно 450 мг/кг, от примерно 450 до примерно 550 мг/кг, от примерно 550 до примерно 700 мг/кг, от примерно 700 до примерно 1000 мг/кг (или эквивалентные дозы в расчете на квадратный метр площади поверхности тела). В некоторых вариантах реализации подходящий диапазон доз для перорального, интраперитонеального или внутримышечного введения составляет от примерно 5 до примерно 2000 мг без поправки в отношении массы тела или площади поверхности тела пациента. Другие эффективные дозы могут быть экстраполированы из кривых доза-эффект, полученных in vitro или из систем тестирования с использованием моделей у животных. Такие модели у животных и системы хорошо известны в данной области техники.
[00130] В соответствии с некоторыми аспектами «эффективное количество» соединения в контексте вирусной инфекции представляет собой количество, достаточное для уменьшения одного или более следующих этапов жизненного цикла вируса: «причаливание» вирусной частицы к клетке, введение генетической информации вируса в указанную клетку, экспрессия вирусных белков, продуцирование новых вирусных частиц и высвобождение вирусных частиц из клетки на по меньшей мере 5%, предпочтительно по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или 100%. В некоторых вариантах реализации эффективное количество соединения в контексте вирусной инфекции уменьшает репликацию, размножение или распространение вируса на по меньшей мере 5%, предпочтительно по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или 100%. В некоторых вариантах реализации эффективное количество соединения в контексте вирусной инфекции увеличивает коэффициент выживаемости инфицированных субъектов на по меньшей мере 5%, предпочтительно по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или 100%.
[00131] Специалисту в данной области техники очевидно или он сможет определить с использованием не более чем обычных экспериментов многие эквиваленты конкретных вариантов реализации настоящего изобретения, описанных в настоящем документе. Такие эквиваленты включены в объем настоящего изобретения.
[00132] Далее настоящее изобретение описано с помощью следующих не ограничивающих Примеров.
ПРИМЕРЫ
[00133] Пример 1: Синтез (2S, 3S, 4R, 5R)-2-(4-амино-5H-пирроло[3,2-d] пиримидин-7-ил)-5-(гидроксиметил)пирролидин-3,4-диола [соединение 1 (формула I, где A=NH2 и B=H) в виде соли с HCl].
[00134] 1-7 1
[00135] Стадия-1:
[00136] К раствору 7-((2S, 3S, 4R, 5R)-3,4-дигидрокси-5-(гидроксиметил) пирролидин-2-ил)-3Н-пирроло[3,2-d]пиримидин-4(5Н)-она (1-1) [(полученного в соответствии со способом, описанным в публикации Evans, Gary В.; Furneaux, Richard H.; Hutchison, Tracy L.; Kezar, Hollis S.; Morris, Philip E., Jr.; Schramm, Vern L.; Tyler, Peter С в Journal of Organic Chemistry (2001), 66(17), 5723-5730; полное содержание которой включено в настоящее описание посредством ссылки) 115 г, 390 ммоль] в воде и метаноле (1:1, 2,4 л) добавляли при комнатной температуре триэтиламин (113 мл, 1,12 моль), а затем - (Вос)2О (227 г, 1,04 моль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Твердый продукт собирали посредством фильтрования, промывали водой и сушили в вакууме с получением (2R, 3R, 4S, 5S)-трет-бутил-3,4-дигидрокси-2-(гидроксиметил)-5-(4-оксо-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-7-ил) пирролидин-1-карбоксилата (1-2) (100%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО) δ 7,85 (с, 1H), 7,35 (с, 1H), 4,73-4,53 (м, 1H), 4,29 (с, 1H), 4,03 (с, 1H), 3,97 (с, 1H), 3,70-3,53 (м, 2H), 1,36 и 1,04 (с, ЗН, 6Н для ротамеров).
[00137] Стадия-2:
[00138] К раствору (2R, 3R, 4S, 5S)-трет-бутил- 3,4-дигидрокси-2-(гидроксиметил)-5-(4-оксо-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-7-ил)пирролидин-1-карбоксилата (1 2) в пиридине (184 ммоль, 2,26 моль) добавляли при комнатной температуре DMAP (0,79 г, 6,46 ммоль) и уксусный ангидрид (107 мл, 1131 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли хлороформом и промывали водой, водной HCl, водой и насыщенным водным раствором бикарбоната натрия. Органический слой сушили, фильтровали и концентрировали в вакууме с получением (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-l-(трет-бутоксикарбонил)-5-(4-оксо-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-7-ил)пирролидин-3,4-диилдиацетата (1-3) (150 г), который был достаточно чистым для непосредственного использования на следующей стадии. МС (ЭС+) 493,1 (M+1), 515,1 (M+Na); (ЭС-) 491,4 (М-1).
[00139] Стадия-3:
[00140] К раствору (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-l-(трет-бутоксикарбонил)-5 (4-оксо-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-7-ил)пирролидин-3,4-диилдиацетата (1-3) (150 г, 300 ммоль) в ацетонитриле (660 мл) добавляли при комнатной температуре хлорид бензилтриэтиламмония (137 г, 600 ммоль), диметиланилин (57 мл, 450 ммоль), а затем - POCl3 (164 мл, 1800 ммоль). Реакционную смесь нагревали при 80 °С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали досуха под вакуумом. Полученный остаток растворяли в хлороформе и промывали насыщенным водным раствором бикарбоната натрия, солевым раствором, сушили, фильтровали и концентрировали досуха. Остаток (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-l-(трет-бутоксикарбонил)-5-(4-хлор-5H-пирроло[3,2-d]пиримидин-7-ил)пирролидин-3,4 диилдиацетата (1-4) использовали непосредственно на следующей стадии без очистки. 1Н ЯМР (300 МГц, ДМСО) δ 12,54 (с, 1H), 8,65 (с, 1H), 7,92 (с, 1H), 5,85 (м, 1H), 5,45 (м, 1H), 5,10 (м, 1H), 4,49 (м, 2H), 4,07 (м, 1H), 2,07-1,99 (м, 9Н), 1,19 (2 уш с, 9Н, ротамеры).
[00141] Стадия-4:
[00142] К раствору (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-l-(трет-бутоксикарбонил)-5- (4-хлор-5H-пирроло [3,2-d]пиримидин-7-ил)пирролидин-3,4-диилдиацетата (1-4) (300 ммоль) в ДМФ (540 мл) добавляли азид натрия (97,5 г, 1500 ммоль) и нагревали при 80 °С в течение ночи. Реакционную смесь концентрировали в вакууме, и остаток растворяли в хлороформе. Слой хлороформа промывали водой, сушили, фильтровали и концентрировали в вакууме. Очищали посредством кристаллизации из смеси (ацетон:гексан=1:2), получали (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-азидо-5H-пирроло [3,2-d]пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетата (1-5). 1H ЯМР (300 МГц, ДМСО) δ 13,56-13,00 (уш с, 1H), 9,86 (с, 1H), 7,95 (с, 1H), 5,78 (м, 1H), 5,40 (м, 1H), 5,26-5,14 (м, 1H), 4,54 (м, 1H), 4,42 (м, 1H), 4,16-4,03 (м, 1H), 2,06 (с, 3Н), 2,02 (с, 6H), 1,14 (уш с, 9Н); МС (ЭС+) 540,0 (M+1); (ЭС-) 515,9 (М-1).
[00143] Стадия-5:
[00144] К раствору (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-амино-5H-пирроло[3,2-d] пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетата (1-5) (300 ммоль) в метаноле (1 л) добавляли Pd(OH)2 (30 г). Реакционную смесь гидрировали при давлении (160 фунтов на квадратный дюйм) в течение ночи и фильтровали через целит для удаления катализатора. Фильтрат концентрировали в вакууме с получением (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-амино-5H-пирроло[3,2-d]пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетата (1-6) (113 г). 1Н ЯМР (300 МГц, ДМСО) δ 12,47-11,92 (м, 1H), 8,84-8,03 (м, 3H), 7,90-7,68 (м, 1H), 5,70-5,51 (м, 1H), 5,38 (м, 1H), 5,12 (м, 1H), 4,42 (м, 2H), 4,17-4,00 (м, 1H), 2,07 (с, 3Н), 2,05 (с, 3Н), 2,00 (с, 3Н), 1,14 (с, 9H); МС (ЭС+) 492,1 (M+1), (ЭС-) 490,0 (М-1).
[00145] Стадия-6:
[00146] К раствору (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-амино-5H-пирроло[3,2-d] пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетата (1-6) (111 г, 226 ммоль) в метаноле (500 мл) добавляли при комнатной температуре NaOMe (25% масс./масс. в метаноле, 4,88 г, 22,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и концентрировали в вакууме с получением (2S, 3S, 4R, 5R)-трет-бутил-2-(4-амино-5H-пирроло[3,2-d]пиримидин-7-ил)-3,4 дигидрокси-5-(гидроксиметил)пирролидин-l-карбоксилата (1-7). 1Н ЯМР (300 МГц, ДМСО) δ 11,40-10,73 (уш с, 1H), 8,01 (с, 1H), 7,39 (2с, 1H), 6,90 (с, 2H), 4,83 (м, 2H), 4,45 (м, 2H), 3,96 (с, 2H), 3,58 (м, 3H), 1,31 и 0,99 (с, ЗН, 6H, ротамеры); МС (ЭС+) 366,0 (M+1), 388,0 (M+Na); (ЭС-) 363,8 (М-1).
[00147] Стадия-7:
[00148] Раствор (2S, 3S, 4R, 5R)-трет-бутил-2-(4-амино-5H-пирроло[3,2-d] пиримидин-7-ил)-3,4-дигидрокси-5-(гидроксиметил)пирролидин-l-карбоксилата (1-7) в водной HCl (160 мл конц. HCl и 400 мл воды) перемешивали при комнатной температуре в течение 30 мин и далее концентрировали в вакууме досуха. Полученный остаток растворяли в воде, обрабатывали активированным углем и кипятили в течение 30 мин. Горячий раствор фильтровали через целит и концентрировали в вакууме с получением полутвердого продукта, который перекристаллизовывали из воды и этанола с получением (2S, 3S, 4R, 5R)-2-(4-амино-5H-пирроло[3,2-d]пиримидин-7-ил)-5-(гидроксиметил)-пирролидин-3,4-диола (1) (50 г, общий выход на 7 стадий: 42,6%) в виде белого кристаллического вещества. 1H ЯМР (300 МГц, D2O) δ 8,41 (с, 1H), 8,02 (с, 1H), 4,99 (д, J=9 Гц, 1H), 4,78 (м, 1H), 4,45 (дд, J=3, 1,5 Гц, 1H), 3,97 (м, 2H), 3,90 (м, 1H); МС (ЭС+) 266,2 (M+1), (ЭС-) 264,0 (М-1); Анализ: Вычислено для C11H15N5O3 • 2HCl: С, 39,07; H, 5,07; N, 20,71; Cl, 20,97; Найдено: C, 39,09; H, 5,10; N, 20,49; Cl, 20,84.
[00149] Пример 2: Крупномасштабный синтез (2S, 3S, 4R, 5R)-2-(4-амино-5H-пирроло[3,2-d]пиримидин-7-ил)-5-(гидроксиметил)пирролидин-3,4-диола [соединение 1 (формула I, где A=NH2 и В=H) в виде соли с HCl].
[00150] Стадия-1:
К суспензии 7-((2S, 3S, 4R, 5R)-3,4-дигидрокси-5-(гидроксиметил)пирролидин-2-ил)-3Н-пирроло[3,2-d]пиримидин-4(5Н)-она (1-1) [(полученного в соответствии со способом, описанным в публикации Evans, Gary В.; Furneaux, Richard H.; Hutchison, Tracy L.; Kezar, Hollis S.; Morris, Philip E., Jr.; Schramm, Vern L.; Tyler, Peter С в Journal of Organic Chemistry (2001), 66(17), 5723-5730), 500,0 г, 1,474 моль, 1 экв.)] в смеси вода:метанол (1:1, 10,4 л) добавляли при комнатной температуре триэтиламин (621 мл, 4,422 моль, 3,0 экв.), а затем - (Вос)2O (987 г, 4,53 моль, 3,1 экв.). Реакционная смесь превратилась в прозрачный окрашенный раствор после добавления (Вос)2O с небольшим повышением внутренней температуры от 28°C до 33 °C. Раствор стал несколько мутным после 1 часа перемешивания. Раствор перемешивали при комнатной температуре в течение ночи. Твердый продукт собирали посредством фильтрования и промывали водой (5,0 л), сушили в высоком вакууме при 50 °С с получением (2R, 3R, 4S, 5S)-трет-бутил-3,4-дигидрокси-2-(гидроксиметил)-5-(4-оксо-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-7-ил)пирролидин-1-карбоксилата (1-2) (482 г, 89%).
[00151] 1H ЯМР (300 МГц, ДМСО) δ 11,92 (с, 2H), 7,81 (с, 1H), 7,32 (д, J=22,7 Гц, 1H), 5,73-5,20 (м, 1H), 5,05-4,91 (м, 1H), 4,87-4,76 (м, 1H), 4,74-4,49 (м, 1H), 4,33-4,17 (м, 1H), 4,09-3,86 (м, 2H), 3,64-3,48 (м, 2H), 1,39-1,00 (м, 9Н); МС (ЭС+) 755,1 (2М+Na), (ЭС-) 731,7 (2М-1); Анализ: Вычислено для C16H22N4O6: С, 52,45; Н 6,05; N, 15,29; Найдено: С, 52,24; Н, 6,02; N, 15,05.
[00152] Стадия-2:
[00153] К суспензии (2R, 3R, 4S, 5S)-трет-бутил-3,4-дигидрокси-2-(гидроксиметил)-5-(4-оксо-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-7-ил)пирролидин-1-карбоксилата (1 2) (482 г, 1,32 моль, 1,0 экв.) в пиридине (740 мл, 9,21 моль, 7 экв.) добавляли при комнатной температуре DMAP (3,22 г, 26,32 ммоль, 0,02 экв.) и уксусный ангидрид (435 мл, 4,61 ммоль, 3,5 экв.). При добавлении уксусного ангидрида началось повышение внутренней температуры, поэтому применяли охлаждение с помощью водно-ледяной бани. По окончании добавления ангидрида температура поднялась до 67 °С, а затем понизилась до комнатной температуры. Водно-ледяную баню удалили после того, как температура реакции достигла 25 °C. Суспензия не превратилась в прозрачный раствор, но наблюдали образование более светлой суспензии. Реакционную смесь перемешивали при комнатной температуре в течение 14 ч с получением непрозрачного раствора. Анализ обработанной аликвоты посредством ТСХ (9:1 хлороформ:метанол) показал отсутствие исходного вещества и наличие двух основных пятен, анализ посредством МС показал наличие двух основных пиков при (493,0, M+1) для продукта и тетраацетилированного продукта (M+1=535). Реакционную смесь разбавляли 3,0 л хлороформа, перемешивали в течение 10 минут, затем добавляли 2,0 л деионизированной воды. На поверхности раздела водной и органической фаз образовался воскообразный белый продукт. Указанный продукт оставался в водной фазе после разделения. Органическую фазу отделяли и снова промывали 2,0 л воды. Объединенные водные промывки снова экстрагировали 1,0 л хлороформа. Объединенные органические фазы промывали водным 2,0 N HCl (2×1,0 л), водой (2×1,0 л), насыщенным раствором бикарбоната натрия (2×1,0 л) и солевым раствором (2×1,0 л). Органический слой сушили над MgSO4, фильтровали и концентрировали досуха под вакуумом и в водяной бане с температурой 50-55 °С. Вакуум переключили на масляный насос высокого вакуума до прекращения появления дистиллята с получением плотного липкого продукта. Продукт оставляли в высоком вакууме, создаваемом с помощью масляного насоса, на 14 часов с целью минимизации количества остаточного пиридина. Получали смесь твердой пены, которая превратилась в приятное белое твердое вещество и плотный остаток (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-l-(трет-бутоксикарбонил)-5-(4-оксо-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-7-ил)пирролидин-3,4-диилдиацетата (1-3) (715, 110% выход). Указанная процентная величина отражает количество тетраацетилированного соединения. Продукт был достаточно чистым для непосредственного использования на следующей стадии. Аналитический образец получали путем очистки смеси с применением колоночной флэш-хроматографии [силикагель, элюируя смесью 0-100% (9:1) этилацетат/метанол в гексане] с получением (2R, 3R, 4S, 5S)-2 (ацетоксиметил)-l-(трет-бутоксикарбонил)-5-(4-оксо-4,5-дигидро-3Н-пирроло[3,2-d]-пиримидин-7-ил)пирролидин-3,4-диилдиацетата (1-3) в виде белого твердого вещества; 1H ЯМР (300 МГц, ДМСО) δ 12,13 (с, 1H, вступает в обмен с D2O), 11,98 (с, 1H, вступает в обмен с D2O), 7,82 (с, 1H), 7,29 (с, 1H), 5,76 (с, 1H), 5,37 (т, J=4,5 Гц, 1H), 4,99 (с, 1H), 4,55 (дд, J=11,3, 6,6 Гц, 1H), 4,34 (д, J=8,3 Гц, 1H), 4,03 (д, J=7,1 Гц, 1H), 2,01 (д, J=12,6 Гц, 9Н), 1,23 (дд, J=39,9, 32,8 Гц, 9Н); МС (ЭС+) 493,0 (M+1); (ЭС-) 526,7 (M+Cl); Анализ: Вычислено для C22H28N4O9: С, 53,65; Н, 5,73; N, 11,38; Найдено: С, 53,18; Н, 5,89; N, 11,10.
[00154] Стадия-3:
[00155] К раствору (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-l-(трет-бутоксикарбонил)-5- (4-оксо-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-7-ил)пирролидин-3,4-диилдиацетата (1 3) (622 г, 1,26 моль, 1,0 экв.) в ацетонитриле (2,75 л) добавляли при комнатной температуре бензилтриэтиламмония хлорид (575 г, 2,5 моль, 2,0 экв.), диметиланилин (240 мл, 1,9 моль, 1,5 экв.), а затем - POCl3 (706 мл, 7,58 моль, 6,0 экв.). Получали прозрачный светло-желтый раствор. Реакционную смесь медленно нагревали до 80°C и выдерживали при этой температуре в течение 10 минут. Анализ посредством ТСХ в системе 9:1 хлороформ:метанол показал, что реакция прошла на более чем 98%. Черный гомогенный раствор охлаждали до 50,0°C и концентрировали под вакуумом (водяная баня с температурой 70-73 °C), для удаления POCl3 остаток помещали под высокий вакуум, создаваемый с помощью масляного насоса, до прекращения появления дистиллята. Остаток растворяли в 3,0 л хлороформа и быстро тщательно промывали насыщенным водным раствором бикарбоната натрия до получения нейтрального рН. Органический слой отделяли, промывали водой (2 л), солевым раствором (2 л), сушили над MgSO4, фильтровали и концентрировали в вакууме досуха (водяная баня при 50-53 °C). Черный продукт (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-l-(трет-бутоксикарбонил)-5 (4-хлор-5H-пирроло[3,2-d]пиримидин-7-ил)пирролидин-3,4-диилдиацетата (1-4) непосредственно использовали на следующей стадии без очистки.
[00156] Стадия-4:
[00157] К раствору (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-l-(трет-бутоксикарбонил)-5 (4-хлор-5H-пирроло[3,2-d]пиримидин-7-ил)пирролидин-3,4-диилдиацетата (1-4) (622 г, 1,26 моль, 1 экв.) в ДМФ (1,5 л) добавляли азид натрия (411 г, 6,32 моль, 5 экв.) и нагревали с перемешиванием при 60°C в течение 10 часов, за время которых реакция завершилась (ТСХ в системах 9:1 хлороформ:метанол и 1:1 гексан:этилацетат). Реакционную смесь охлаждали до 25 °C, вылили в лед (2 л) и экстрагировали хлороформом (2×1 л). Слои хлороформа объединяли, промывали водой (2×2 л), солевым раствором (2 л), сушили, фильтровали и концентрировали в вакууме (водяная баня с температурой 70-80 °C) с получением черного илообразного остатка. Очистки остатка добивались посредством колоночной хроматографии (987 г черного илообразного остатка, колонка 8×30 дюймов, наполовину заполненная силикагелем, профиль элюции гексан:этилацетат; 9:1 (40,0 л), 7:3 (20,0 л); 6:4 (20,0 л), 1:1 (20 л), 4:6 (20,0 л) и 2:8 (20,0 л). Соответствующие фракции объединяли и концентрировали в вакууме (водяная баня с температурой 50,0 °C) с получением (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-азидо-5H-пирроло[3,2-d]пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетата (1-5) (407,05 г, выход на две стадии 62,3%) в виде плотного красноватого напоминающего мед продукта. Аналитический образец готовили путем очистки смеси посредством колоночной флэш-хроматографии [силикагель, 0-100% этилацетат в гексане] с получением (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-азидо-5H-пирроло[3,2-d]пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетата (1-5) в виде оранжевого твердого вещества. 1H ЯМР (300 МГц, ДМСО) δ 13,08 (д, J=155,6 Гц, 1H, вступает в обмен с D2O), 9,86 (с, 1H), 7,61 (д, J=76,8 Гц, 1H), 5,78 (т, J=4,5 Гц, 1H), 5,41 (т, J=4,3 Гц, 1H), 5,21 (с, 1H), 4,55 (дд, J=11,4, 6,4 Гц, 1H), 4,41 (дд, J=11,4, 3,9 Гц, 1H), 4,07 (д, J=16,5 Гц, 1H), 2,06 (с, 3Н), 2,01 (д, J=9,9 Гц, 6H), 1,23 (дд, J=39,8, 32,7 Гц, 9Н); МС (ЭС+) 518,0 (M+1), 540 (M+23); (ЭС-) 516,4 (М-1); Анализ: Вычислено для C22H27N7O8: C, 51,06; H 5,26; N, 18,95; Найдено: C, 50,97; H, 5,30; N, 18,62.
[00158] Стадия-5:
[00159] (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-азидо-5H-пирроло[3,2-d]пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетат (1-5) восстанавливали в трех разных партиях следующим образом:
[00160] Партия 1: В гидрогенизатор Парра объемом 2,0 л с вкладышем с тефлоновым покрытием добавляли (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-азидо-5H-пирроло[3,2-d]пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетат (1-5) (108,01 г, 300 ммоль в метаноле, 800 мл), Pd(OH)2 (21,6 г, 20% масс./масс.).
[00161] Партия 2: В гидрогенизатор Парра объемом 2,0 л с вкладышем с тефлоновым покрытием добавляли (1-5) (140,70 г, 271,9 ммоль в метаноле, 1,0 л), Pd(OH)2 (28,14 г, 20% масс./масс.).
[00162] Партия 3: В гидрогенизатор Парра объемом 2,0 л с вкладышем с тефлоновым покрытием добавляли (1-5) (140,7 г, 271,9 ммоль в метаноле, 1,0 л), Pd(OH)2 (28,14 г, 20% масс./масс.).
[00163] Реакционные смеси гидрировали при давлении 150 фунтов на квадратный дюйм в течение 15-18 часов. Реакционную смесь фильтровали через целит для удаления катализатора. Фильтрат концентрировали в вакууме (водяная баня с температурой 60 70 °С) до постоянной массы с получением темного окрашенного продукта (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-амино-5H-пирроло[3,2-d]пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетата (1-6) (328,8 г, 89%). Продукт был достаточно чистым для непосредственного использования на следующей стадии. Аналитический образец готовили путем очистки смеси с применением колоночной флэш-хроматографии (0-10% метанол в хлороформе). 1H ЯМР (300 МГц, ДМСО) δ 11,06 (с, 1H), 8,12 (с, 1H), 7,49 (с, 1H), 6,94 (с, 2H), 5,86 (с, 1H), 5,44 (т, J=4,2 Гц, 1H), 5,02 (с, 1H), 4,56 (дд, J=11,3, 6,9 Гц, 1H), 4,40 (дд, J=11,3, 4,2 Гц, 1H), 4,16-3,98 (м, 1H), 2,09-1,94 (м, 9Н), 1,48-1,14 (м, 9Н); МС (ЭС+) 492,1 (M+1); (ЭС-) 526,4 (M+Cl); Анализ: Вычислено для C22H29N5O8 ⋅ 1,25H2O: C, 51,41; H, 6,18; N, 13,62; Найдено: С, 51,24; Н, 5,92; N, 13,33.
[00164] Стадия-6:
Партия 1. К (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-амино-5H-пирроло[3,2 d] пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетату (1-6) (81,5 г, 165,8 ммоль) добавляли при комнатной температуре безводный метанол (370 мл) с последующим добавлением NaOMe (метоксид натрия, раствор 25 масс. % в метаноле, 4,49 г, 20,76 ммоль). Реакционную смесь перемешивали при комнатной температуре до тех пор, пока анализ посредством ТСХ (хлороформ:метанол 9:1) не показал, что все исходное вещество вступило в реакцию.
Партия 2. К (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-амино-5H-пирроло[3,2 d] пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетату (1-6) (117,8 г, 239,6 ммоль) добавляли при комнатной температуре безводный метанол (530 мл) с последующим добавлением NaOMe (метоксид натрия, раствор 25 масс. % в метаноле, 6,58 г, 30,45 ммоль). Реакционную смесь перемешивали при комнатной температуре до тех пор, пока анализ посредством ТСХ (хлороформ:метанол 9:1) не показал, что все исходное вещество вступило в реакцию.
Партия 3. -К (2R, 3R, 4S, 5S)-2-(ацетоксиметил)-5-(4-амино-5H-пирроло[3,2 d] пиримидин-7-ил)-l-(трет-бутоксикарбонил)пирролидин-3,4-диилдиацетату (1-6) (129,5 г, 263,5 ммоль) добавляли при комнатной температуре безводный метанол (584 мл) с последующим добавлением NaOMe (метоксид натрия, раствор 25 масс. % в метаноле, 6,99 г, 32,35 ммоль). Реакционную смесь перемешивали при комнатной температуре до тех пор, пока анализ посредством ТСХ (хлороформ:метанол 9:1) не показал, что все исходное вещество вступило в реакцию (7-8 часов).
[00165] Вышеописанные растворы концентрировали (водяная баня с температурой 65-75 °С) с получением (2S, 3S, 4R, 5R)-трет-бутил-2-(4-амино-5H-пирроло[3,2-d] пиримидин-7-ил)-3,4-дигидрокси-5-(гидроксиметил)пирролидин-l-карбоксилата (1-7), который был достаточно чистым для непосредственного использования на следующей стадии. Аналитический образец готовили путем очистки смеси с применением колоночной флэш-хроматографии (0-10% метанол в хлороформе). 1H ЯМР (300 МГц, ДМСО) δ 10,77 (с, 1H), 8,01 (с, 1H), 7,40 (с, 1H), 6,82 (с, 3Н), 5,04-4,91 (м, 1H), 4,87 4,74 (м, 1H), 4,56-4,35 (м, 2H), 4,04-3,90 (м, 2H), 3,72-3,63 (м, 1H), 3,59-3,41 (м, 1H), 1,15 (2с, 9Н); МС (ЭС+) 366,1 (M+1); (ЭС-) 400,3 (M+Cl); Анализ: Вычислено для C16H23N5O5 ⋅ 0,25H2O: C, 51,33; H, 6,46; N, 18,71; Найдено: С, 51,04; Н, 6,43; N, 18,48.
[00166] Стадия-7:
[00167] (2S, 3S, 4R, 5R)-трет-бутил-2-(4-амино-5H-пирроло[3,2-d]пиримидин-7-ил)-3,4-дигидрокси-5-(гидроксиметил)пирролидин-l-карбоксилат (1-7) обрабатывали следующим образом в трех партиях.
[00168] Партия 1. (1-7) растворяли в водн. HCl (118 мл конц. HCl и 293 мл воды).
[00169] Партия 2. (1-7) растворяли в водн. HCl (169 мл конц. HCl и 421 мл воды).
[00170] Партия 3. (1-7) растворяли в водн. HCl (186 мл конц. HCl и 468 мл воды).
[00171] Реакционные смеси перемешивали при комнатной температуре в течение 30 мин (интенсивное выделение газообразного CO2) и затем каждую партию концентрировали в вакууме досуха (80-90 °C). Партии 2 и 3 объединяли с получением 226 г влажного прозрачного желтого продукта. Партия 1 дала 91,4 г темного сероватого продукта. Кристаллизацию выполняли следующим образом: Для влажного продукта из партий 2 и 3: к продукту добавляли 226 мл воды, далее нагревали до температуры 50 °C, по достижении которой медленно добавляли горячий этанол, пока не начиналась кристаллизация. Смесь выдерживали при 50 °С в течение 10 минут, затем оставляли остывать до 25 °С с интенсивным перемешиванием перед фильтрованием с получением светло-желтого порошка (2S, 3S, 4R, 5R)-2-(4-амино-5H-пирроло[3,2-d]пиримидин-7-ил)-5-(гидроксиметил)пирролидин-3,4-диола (1) (88 г). Партию один очищали таким же способом с получением 33,0 г светлого сероватого продукта. Общий выход составлял 121,0 г после высушивания при 55°C в высоком вакууме. Маточный раствор после перекристаллизаций партий 1 и 2 повторно обрабатывали с получением 15,0 г светлого желтоватого порошкообразного продукта (1). 1H ЯМР (300 МГц, ДМСО) δ 14,60 (с, 1H), 13,25 (с, 1H), 10,23 (с, 1H), 9,13 (с, 2H), 8,84 (с, 1H), 8,63 (с, 1H), 8,11 (д, J=3,1 Гц, 1H), 5,55 (с, 2H), 4,78 (д, J=4,4 Гц, 1H), 4,44 (дд, J=8,8, 5,0 Гц, 1H), 4,14-4,02 (м, 1H), 3,73 (д, J=5,1 Гц, 2H), 3,52 (с, 1H); 1H ЯМР (300 МГц, D2O) δ 8,33 (с, 1H), 7,94 (с, 1H), 4,90 (д, J=8,9 Гц, 1H), 4,65 (с, 1H), 4,37 (дд, J=4,8, 3,4 Гц, 1H), 3,89 (с, 1H), 3,88 (с, 1H), 3,81 (дд, J=8,1, 4,5 Гц, 1H); МС (ЭС+) 266,3 (M+1); Оптическое вращение -52,69; (H2O, C=1,15); Тпл.: 238 °C; Анализ: Вычислено для С11Н15N5O3 ⋅ 2НС1 ⋅ 0,25Н2O: С, 38,55; Н, 5,15; Cl, 20,44; N, 20,69; Найдено: C, 38,67; H 5,05; Cl, 20,45; N, 20;42.
[00172] Пример 3: Фосфорилирование соединения 1 (формула I, где A=NH2 и В=H) и исследования включения в ДНК/РНК.
[00173] Клетки гепатоцеллюлярной карциномы человека (Huh-7) инкубировали с меченным 3Н-соединением 1 в течение 24 ч с последующей экстракцией метанолом и анализом посредством ВЭЖХ с применением колонки SAX и детектора радиоактивного излучения. ФИГ. 1 иллюстрирует фосфорилирование соединения 1 в клетках Huh-7, показывая эффективное фосфорилирование в клетках.
[00174] Фигуры 2-4 иллюстрируют, что соединение 1 фосфорилируется, но не включается в РНК или ДНК млекопитающих (ДФ обозначает дифосфат и ТФ обозначает трифосфат). ФИГ. 2 иллюстрирует фосфорилирование аденозина в клетках Huh-7. ФИГ. 3 иллюстрирует фосфорилирование соединения 1 в клетках Huh-7. ФИГ. 4 иллюстрирует включение соединения 1 и аденозина в тотальную РНК и геномную ДНК в клетках Huh-7.
[00175] Пример 4: Влияние ингибитора вирусной РНК-полимеразы (формула I, где A=NH2 и В=H: соединение 1) на репликацию вируса кори в почечных клетках африканской зеленой мартышки.
[00176] Материалы и методы: клетки Vero 76 (почечные клетки африканской зеленой мартышки) были получены от Американской коллекции типовых культур (АТСС, Manassas, VA). Клетки обычно культивировали в минимальной питательной среде Игла (MEM с 0,15% NaHCO3; Hyclone Laboratories, Logan, UT, USA) с добавлением 5% фетальной бычьей сыворотки (ФБС, Hyclone). При оценке соединений содержание сыворотки уменьшали до конечной концентрации, составляющей 2,5%, и к опытной среде добавляли гентамицин до конечной концентрации, составляющей 50 мкг/мл. Вирус кори (ВК), штамм Chicago, был получен от Центров контроля и профилактики заболеваний (Atlanta, GA).
[00177] Методики исследования противовирусной активности
[00178] Анализ ингибирования цитопатического эффекта (визуальный анализ)
[00179] Клетки высевали в 96-луночные плоскодонные планшеты для культур тканей (Corning Glass Works, Corning, NY), 0,2 мл/лунка, в подходящей концентрации клеток, и инкубировали в течение ночи при 37°C для образования монослоя клеток. Когда монослой был получен, ростовую среду декантировали и добавляли различные разведения исследуемого соединения в каждую лунку (3 лунки/разведение, 0,1 мл/лунка). Среду, разбавляющую соединения, добавляли к клеткам и в лунки контроля вируса (0,1 мл/лунка). Вирус, разбавленный в опытной среде, добавляли в лунки с исследуемыми соединениями (3 лунки/разведение соединения) и в лунки контроля вируса (6 лунок) в количестве 0,1 мл/лунка. Вирус (множественность заражения (MOI) вируса=0,001) добавляли приблизительно через 5 минут после добавления соединения. Опытную среду без вируса добавляли во все лунки контроля токсичности (2 лунки/разведение каждого исследуемого соединения) и в лунки контроля роста клеток (6 лунок) в количестве 0,1 мл/лунка. Планшеты инкубировали при 37°C в увлажненном инкубаторе с атмосферой, содержащей 5% CO2 и 95% воздуха, до тех пор, пока считывания для лунок контроля вируса не показали требуемый цитопатический эффект (ЦПЭ) (80-100% разрушение клеток). Этот эффект был достигнут начиная от 4-11 дней после воздействия вируса на клетки, в зависимости от вируса. Затем клетки исследовали под микроскопом на ЦПЭ, оценивая последний по шкале от 0 (нормальные клетки) до 4 (максимальный, 100% ЦПЭ). Клетки в лунках контроля токсичности исследовали под микроскопом на морфологические изменения, обусловленные цитотоксичностью. Эту цитотоксичность (разрушение клеток и/или изменение морфологии) также оценивали по степени проявления как 100% токсичность, 80% цитотоксичность, 60% цитотоксичность, 40% цитотоксичность, 20% цитотоксичность и 0 (нормальные клетки). 50% эффективную дозу (ЕС50) и 50% цитотоксичную дозу (IC50) вычисляли с применением регрессионного анализа данных для ЦПЭ вируса и данных для контролей токсичности, соответственно. Индекс селективности (ИС) для каждого исследуемого соединения рассчитывали с применением формулы: ИС=CC50 ÷ EC50.
[00180] Исследование ингибирования ЦПЭ посредством анализа поглощения нейтрального красного (НК)
[00181] Окрашивание нейтральным красным было выбрано в качестве количественного метода с применением красителя для оценки противовирусных лекарственных препаратов, основанного на данных, полученных Smee et al (J. Virol. Methods 2002, 106: 71-79; полное содержание публикации включено в настоящее описание посредством ссылки). Указанный анализ проводили на тех же самых планшетах для исследования ингибирования ЦПЭ, описанных выше, для подтверждения ингибиторной активности и цитотоксичности, определенных посредством визуального наблюдения. Анализ поглощения НК выполняли с применением модифицированного метода Cavenaugh et al. (Invest. New Drugs 1990, 8:347-354; полное содержание публикации включено в настоящее описание посредством ссылки), описанного в Barnard et al. (Antiviral Chem. Chemother. 2001, 12:220-231; полное содержание публикации включено в настоящее описание посредством ссылки). Кратко, среду удаляли из каждой лунки планшета, оцененной на ЦПЭ посредством анализа ингибирования ЦПЭ, 0,034% НК добавляли в каждую лунку планшета и планшет инкубировали в течение 2 ч при 37°C в темноте. Затем раствор НК удаляли из лунок. После промывки (иногда клетки вымывались из планшета, приводя к ошибочно низкому поглощению нейтрального красного) и аспирации жидкости досуха оставшийся краситель экстрагировали из клеток в течение 30 мин при комнатной температуре в темноте с применением абсолютного этанола, забуференного цитратным буфером Серенсена. Считывали поглощение при 540 нм/405 нм с помощью устройства для прочтения микропланшетов (OpSys MR™, Dynex Technologies, Chantilly, VA, USA). Величины поглощения выражали в виде процентов от необработанных контролей, и значения EC50, CC50 и ИС рассчитывали, как описано выше.
[00182] Анализ снижения урожая вируса
[00183] Анализы снижения урожая вируса выполняли фактически с применением анализа 50% инфекционной дозы для клеточной культуры (CCID50), описанного ранее (Antimicrob. Agents Chemother. 1992, 3:1837-1842; полное содержание публикации включено в настоящее описание посредством ссылки). Кратко, супернатанты из каждой лунки серийно разводили в трех повторностях в лунках 96-луночных планшетов, содержащих клетки Vero-76. Планшеты инкубировали в течение 6 дней и затем проверяли на индуцированный вирусом ЦПЭ. Количественное определение титров урожая вируса осуществляли посредством метода конечной точки Мюнха-Рида (Am. J. Hyg. 1938, 27:493 498; полное содержание публикации включено в настоящее описание посредством ссылки). Величину EC90 вычисляли с применением линейной регрессии для оценки концентрации, необходимой для ингибирования урожая вируса на 90% или уменьшения титра вируса на единицу по шкале log 10.
[00184] Результаты и обсуждение
[00185] Вирус кори активно подавлялся соединением 1 (Таблица 1). Значения EC50 против вируса кори составляли 0,6 и 1,4 мкг/мл для визуального анализа и анализа поглощения НК, соответственно. Соединение не обладало какой-либо цитотоксичностью ни в визуальном анализе, ни в анализе поглощения НК (IC50 > 100). Таким образом, индексы селективности, полученные в результате обоих анализов, позволили предположить, что соединение 1 являлось высокоактивным против вируса кори (ВК). Мощным ингибиторная активность против ВК была подтверждена посредством анализа снижения урожая вируса с EC90=0,36 мкг/мл, что представляет уменьшение выработки вируса в зараженных клетках на единицу по шкале log 10.
[00186] Выводы
[00187] Соединение 1 демонстрировало высокую и селективную ингибиторную активность. Согласно анализу снижения урожая вируса, соединение 1 также является высокоактивным ингибитором ВК (EC90=0,37 мкг/мл). Таким образом, было обнаружено, что соединение 1 представляет собой высокоактивный ингибитор многих РНК-содержащих вирусов, и, как предполагают, соединение 1 требует проведения дальнейшей оценки in vitro и in vivo в качестве ингибитора широкого спектра отдельных РНК-содержащих вирусов.
[00188] Пример 5: Влияние ингибитора вирусной РНК-полимеразы (формула I, где A=NH2 и В=H: соединение 1) на репликацию различных РНК-содержащих вирусов.
[00189] Материалы и методы
[00190] Клетки и вирусы
[00191] Почечные клетки африканской зеленой мартышки (MA-104) были получены от Whitaker MA Bioproducts, Walkersville, MD, USA). Все клетки Vero (почечные клетки африканской зеленой мартышки, клетки карциномы гортани человека (А-549) и клетки Мадин-Дарби почек собак (MDCK) были получены от Американской коллекции типовых культур (АТСС, Manassas, VA). Клетки A-549 культивировали в модифицированной по способу Дульбекко минимальной питательной среде Игла (DMEM) с добавлением 0,15% NaHCO3 (Hyclone Laboratories, Logan, UT, USA) и 10% фетальной бычьей сыворотки (ФБС, Hyclone). Остальные клетки обычно культивировали в минимальной питательной среде Игла (MEM с 0,15% NaHCO3; Hyclone Laboratories, Logan, UT, USA) с добавлением 5% фетальной бычьей сыворотки (ФБС, Hyclone).
[00192] При оценке соединений содержание сыворотки уменьшали до конечной концентрации, составляющей 2,5%, и к опытной среде добавляли гентамицин до конечной концентрации, составляющей 50 мкг/мл. Опытная среда для анализов вирусов гриппа состояла из среды MEM без сыворотки, 0,18% NaHCO3, 20 мкг трипсина/мл, 2,0 мкг EDTA/мл и 50 мкг гентамицина/мл.
[00193] Для оценки токсичности в активно растущих клетках, цитотоксичность оценивали путем определения общего количества клеток, отражаемого посредством анализа поглощения НК после 3-дневного воздействия нескольких концентраций соединений. Для количественного определения интенсивности роста клеток за 72 ч в присутствии или отсутствии лекарственных препаратов планшеты засеивали клетками MDCK в количестве 1×103 и через 4 ч (после которых все клетки прикрепились к лункам планшетов) клетки подвергали воздействию выбранных концентраций лекарственных препаратов в среде MEM или MEM. Через 72 ч планшеты обрабатывали, как описано выше для анализа поглощения НК. Величины поглощения выражали в виде процентов от необработанных контролей, и значения CC50 вычисляли с применением регрессионного анализа.
[00194] Вирус Денге типа 2 (ВД-2), штамм New Guinea C, респираторно-синцитиальный вирус (РСВ) A2, риновирус типа 2 (РВ-2), штамм HGP, вирус Такарибе (TCV), штамм TRVL 11573, вирус венесуэльского конского энцефалита (VEE) и вирус желтой лихорадки (ВЖЛ), штамм 17D были все приобретены у американской коллекции типовых культур (АТСС, Manassas, VA). Все вирусы гриппа, вирус кори (ВК), штамм Chicago, коронавирус тяжелого острого респираторного синдрома (ТОРС) (ТОРС-CoV), штамм Urbani и вирус лихорадки Западного Нила (ЛЗН), прототипный изолят, выделенный в Нью-Йорке в 1999 году, обозначенный как штамм 996625, были получены от Центров контроля и профилактики заболеваний (Atlanta, GA). Вирус Пунта-Торо (PTV), штамм Adames был получен от Dr. Dominique Pifat из Медицинского исследовательского института инфекционных заболеваний армии США (U.S. Army Medical Research Institute for Infectious Diseases), Ft. Detrick (Frederick, MD). Вирус лихорадки Рифт-Валли (ЛРВ), вакцинный штамм MP-12 и вирус Хунин (JUNV), вакцинный штамм Candid 1 были любезно предоставлены Dr. Robert Tesh (Всемирный справочный центр по возникающим инфекциям, вирусам и арбовирусам, Медицинское отделение Техасского университета (World Reference Center for Emerging and Viruses and Arboviruses, University of Texas Medical Branch), Galveston, TX). Вирус Пичинде (PICV), штамм 4763, была предоставлена Dr. David Gangemi (Clemson University, Clemson, South Carolina). Вирус парагриппа типа 3 (ВПГ-3), штамм 14702/5/95 был получен от Jacquelin Boivin (Hospitale St. Justin, Montreal, Canada). Аденовирус типа 1 (АВ-1), штамм Chicago/95, был выделен из промывок трахеи пациента-ребенка и был предоставлен M. F. Smaron (Медицинский факультет, Университет Чикаго (Department of Medicine, University of Chicago), Chicago IL).
[00195] Методика исследования противовирусной активности
[00196] Анализ ингибирования цитопатического эффекта (визуальный анализ)
[00197] Клетки высевали в 96-луночные плоскодонные планшеты для культур тканей (Corning Glass Works, Corning, NY), 0,2 мл/лунка, в подходящей концентрации клеток, и инкубировали в течение ночи при 37°C для образования монослоя клеток. Когда монослой был получен, ростовую среду декантировали и добавляли различные разведения исследуемого соединения в каждую лунку (3 лунки/разведение, 0,1 мл/лунка). Среду, разбавляющую соединения, добавляли к клеткам и в лунки контроля вируса (0,1 мл/лунка). Вирус, разбавленный в опытной среде, добавляли в лунки с исследуемыми соединениями (3 лунки/разведение соединения) и в лунки контроля вируса (6 лунок) в количестве 0,1 мл/лунка. Вирус (MOI вируса=0,001) добавляли приблизительно через 5 минут после добавления соединения. Опытную среду без вируса добавляли во все лунки контроля токсичности (2 лунки/разведение каждого исследуемого соединения) и в лунки контроля роста клеток (6 лунок) в количестве 0,1 мл/лунка. Планшеты инкубировали при 37°C в увлажненном инкубаторе с атмосферой, содержащей 5% CO2 и 95% воздуха, до тех пор, пока считывания для лунок контроля вируса не показали требуемый цитопатический эффект (ЦПЭ) (80-100% разрушение клеток). Этот эффект был достигнут начиная от 4-11 дней после воздействия вируса на клетки, в зависимости от вируса. Затем клетки исследовали под микроскопом на ЦПЭ, оценивая последний по шкале от 0 (нормальные клетки) до 4 (максимальный, 100% ЦПЭ). Клетки в лунках контроля токсичности исследовали под микроскопом на морфологические изменения, обусловленные цитотоксичностью. Эту цитотоксичность (разрушение клеток и/или изменение морфологии) также оценивали по степени проявления как 100% токсичность, 80% цитотоксичность, 60% цитотоксичность, 40% цитотоксичность, 20% цитотоксичность и 0 (нормальные клетки). 50% эффективную дозу (ЕС50) и 50% цитотоксичную дозу (IC50) вычисляли с применением регрессионного анализа данных для ЦПЭ вируса и данных для контролей токсичности, соответственно. Индекс селективности (ИС) для каждого исследуемого соединения рассчитывали с применением формулы: ИС=CC50 ÷ EC50.
[00198] Исследование ингибирования ЦПЭ посредством анализа поглощения нейтрального красного (НК) и цитотоксичность соединений
[00199] Окрашивание нейтральным красным было выбрано в качестве количественного метода с применением красителя для оценки противовирусных лекарственных препаратов, основанного на данных, полученных Smee et al (см. выше). Этот анализ проводили на тех же самых планшетах для исследования ингибирования ЦПЭ, описанных выше, для подтверждения ингибиторной активности и цитотоксичности, определеных посредством визуального наблюдения. Анализ поглощения НК выполняли с применением модифицированного метода Cavenaugh et al. (см. выше), описанного в Barnard et al. (см. выше). Кратко, среду удаляли из каждой лунки планшета, оцененной на ЦПЭ посредством анализа ингибирования ЦПЭ, 0,034% НК добавляли в каждую лунку планшета и планшет инкубировали в течение 2 ч при 37°C в темноте. Затем раствор НК удаляли из лунок. После промывки (иногда клетки вымывались из планшета, приводя к ошибочно низкому поглощению нейтрального красного) и аспирации жидкости досуха оставшийся краситель экстрагировали из клеток в течение 30 мин при комнатной температуре в темноте с применением абсолютного этанола, забуференного цитратным буфером Серенсена. Считывали поглощение при 540 нм/405 нм с помощью устройства для прочтения микропланшетов (OpSys MR™, Dynex Technologies, Chantilly, VA, USA). Величины поглощения выражали в виде процентов от необработанных контролей, и значения EC50, CC50 и ИС рассчитывали, как описано выше.
[00200] Таблица 1. Действие ингибитора полимеразы (соединения 1) на репликацию различных вирусов.
(мкг/мл)
EC50 IC50 ИС
EC50 IC50 ИС
[00201] Другие вирусы, которые были рассмотрены как значительно ингибируемые соединением 1 (ИС > 10), представляли собой ВД-2 (EC50=15, 13 мкг/мл), JUNV (EC50=29, 16 мкг/мл, ВЖЛ (EC50=8,3, 8,3 мкг/мл) (Таблица 1). Следующие вирусы были незначительно ингибируемыми соединением 1 (10 < СИ > 3): ВПГ-3 (EC50=7,1, 10 мкг/мл), ТОРС-CoV (EC50=14, 16 мкг/мл), PIСV (EC50=61, 28 мкг/мл) и ЛРВ (EC50=75, 64 мкг/мл). Соединение 1 было исследовано на активность против подгруппы штаммов вируса гриппа (Таблица 2) и показало широкий спектр активности против вируса гриппа в отношении нескольких штаммов.
[00202] Таблица 2. Широкий спектр активности соединения 1 против вируса гриппа.
[00203] Выводы
[00204] Соединение 1 демонстрировало высокую активность против всех исследованных вирусов гриппа. Было обнаружено, что соединение 1 представляет собой мощный ингибитор репликации вируса гриппа, и, как предполагают, соединение 1 эффективно в качестве ингибитора широкого спектра отдельных РНК-содержащих вирусов, включая все вирусы гриппа.
[00205] Пример 6: Противовирусная активность соединения 1 in vitro.
[00206] Противовирусную активность соединения 1 оценивали in vitro с применением нескольких вирусов. Величины EC50 находились в диапазоне от примерно 10 мкг/мл до примерно > 300 мкг/мл против вирусов Марбург (филовирус), Хунин Candid 1 (аренавирус), Пичинде (аренавирус), Чикунгунья 181/25 (тогавирус) и осповакцины NYCBH (поксвирус).
[00207] Пример 7: Синергетическая противовирусная активность соединения 1 и ингибитора нейраминидазы в клетках MDCK.
[00208] Клетки Мадин-Дарби почек собак (MDCK) инфицировали вирусом гриппа типа H3N2 (A/Victoria/3/75) и обрабатывали различными комбинациями соединения 1 и перамивира в течение 72 ч. Цитопатический эффект определяли посредством анализа поглощения красителя нейтрального красного. Данные приведены в Таблице 3.
[00209] Таблица 3: Процент ингибирования цитопатического эффекта в клетках, инфицированных вирусом гриппа.
[00210] Экспериментальные данные оцененивали посредством трехмерного анализа с применением программного обеспечения Mac Synergy II™ (Prichard and Shipman, 1990; полное содержание включено в настоящее описание посредством ссылки). Программа вычисляет теоретические аддитивные взаимодействия из кривых зависимости ʺдоза-эффектʺ для индивидуальных лекарственных препаратов. Расчетную аддитивную поверхность, которая представляет предсказанные аддитивные взаимодействия, затем вычитают из экспериментальной поверхности для выявления областей больших (синергия) или меньших (антагонизм) взаимодействий по сравнению с ожидаемыми взаимодействиями. Комбинация перамивира и соединения 1 в исследованиях на клеточных культурах продемонстрировала синергетический противовирусный эффект с объемом синергии, составляющим 92 мкМ2 единиц % (ФИГ. 5).
[00211] Пример 8: Эффективность внутримышечной инъекции (ВМ) соединения 1 в мышиной модели гриппа.
[00212] Мыши линии Balb/C в возрасте 6-8 недель были адаптированы к вирусу H3N2 (A/Victoria/3/75). Дозы, составляющие 0, 30, 100 и 300 мг/кг/сут, ежедневно, вводили путем внутримышечной (ВМ) инъекции в течение 5 дней, начиная с 1 ч до инфицирования. N=50 животных. Все животные находились под наблюдением в течение 16 дней. Конечные точки включали смертность, среднее число дней до смерти и потерю массы. Эффекты показаны на Фигуре 6.
[00213] Результаты для соединения 1 (ВМ) в мышиной модели вируса гриппа также приведены в Таблице 4. Соединение 1, вводимое внутримышечно, улучшало выживаемость и потерю массы у мышей, инфицированных вирусом гриппа.
[00214] Таблица 4: Соединение 1 (ВМ) в мышиной модели вируса гриппа - H3N2 A/Vic/3/75.
*P < 0,001 по сравнению с инфицированной группой, обработанной носителем (логарифмический ранговый
критерий)
**P < 0,001 по сравнению с инфицированной группой, обработанной носителем (t-тест)
[00215] Пример 9: Эффективность перорального введения соединения 1 в мышиной модели гриппа.
[00216] Мыши линии Balb/C в возрасте 6-8 недель были адаптированы к вирусу H3N2 (A/Victoria/3/75). Дозы, составляющие 0, 30, 100 и 300 мг/кг/сут, ежедневно, и 100 мг/кг/сут, два раза в сутки, вводили перорально. N=60 животных. Все животные находились под наблюдением в течение 16 дней. Конечные точки включали смертность, среднее число дней до смерти и потерю массы. Эффекты перорально вводимого соединения 1 на потерю массы у мышей, инфицированных вирусом гриппа типа H3N2 (A/Victoria/3/75), показаны на Фигуре 7.
[00217] Результаты для перорального введения соединения 1 в мышиной модели вируса гриппа также приведены в Таблице 5. Соединение 1, вводимое перорально, улучшало выживаемость и потерю массы у мышей, инфицированных вирусом гриппа.
[00218] Таблица 5: Соединение 1 (пероральное введение) в мышиной модели вируса гриппа - H3N2 A/Vic/3/75.
*P < 0,001 по сравнению с инфицированной группой, обработанной носителем (логарифмический ранговый
критерий)
**P < 0,001 по сравнению с инфицированной группой, обработанной носителем (t-тест)
[00219] Пример 10: Фармакокинетические исследования на мышах.
[00220] Мышам-самкам линии Balb/C (N=30) вводили перорально соединение 1 в дозе 100 мг/кг. У мышей забирали кровь из ретроорбитального синуса через t=0,17, 0,5, 1,0, 3, 6 и 24 ч (5 мышей на каждую временную точку), центрифугировали и плазму хранили при температуре -80 °C. Уровни препарата в плазме измеряли посредством анализа с применением ЖХ/МС/МС.
[00221] Уровни соединения 1 в плазме мышей после перорального введения приведены в Таблице 6.
[00222] Таблица 6: Уровни соединения 1 в плазме мышей после перорального введения.
(Среднее ± СО)
[00223] Пример 11: Исследование профилактики заражения вирусом Эбола на мышах.
Соединение 1 вводили интраперитонеально (и.п.), внутримышечно (в.м.) и перорально (300 мг/кг/сут, два раза в сутки) мышам линии C57BI/6 в возрасте 8-12 недель (N=10 животных в группе, 4 группы - одна группа, обрабатываемая солевым раствором, и 3 группы, обрабатываемые лекарственным препаратом). Восьмидневную обработку начинали за 4 часа до инфицирования. Адаптированный к мышам вирус Эбола (Заир), используемый для заражения, вводили интраперитонеально. Смертность и массу отслеживали в течение 14 дней после инфицирования.
[00224] Процент выживаемости мышей показан на Фигуре 8. Все мыши, зараженные вирусом Эбола и получавшие солевой раствор, умерли к 8 дню. Все мыши, получавшие соединение 1 интраперитонеально или внутримышечно, выжили в конечной точке исследования (14 день). Восемьдесят процентов мышей, получавших соединение 1 перорально, выжили в конечной точке исследования (14 день).
[00225] Изменение веса мышей показано на Фигуре 9. Мыши, зараженные вирусом Эбола и получавшие солевой раствор, демонстрировали общую потерю массы до 8 дня (все контрольные мыши умерли к 8 дню). Мыши, получавшие соединение 1 интраперитонеально или внутримышечно, сохраняли более чем 95% от начальной массы на 12 день. Мыши, получавшие соединение 1 перорально, сохраняли более чем 80% от начальной массы на 12 день. Все мыши, обработанные лекарственным препаратом, продолжали набирать массу после 12 дня.
[00226] Пример 12: Исследование профилактики заражения вирусом Эбола на мышах.
Соединение 1 вводили в.м. и перорально (ПО) мышам линии C57BI/6 в возрасте 8-12 недель. Субъекты исследования были разделены на 6 групп (N=10 животных в группе). Группа 1 представляла собой контроль, получавший солевой раствор, группе 2 вводили 150 мг/кг соединения 1 (ПО, два раза в сутки); группе 3 вводили 250 мг/кг соединения 1 (ПО, два раза в сутки); группе 4 вводили 150 мг/кг соединения 1 (ВМ, два раза в сутки). Группа 5 представляла собой неинфицированных мышей, получавших солевой раствор (ПО, два раза в сутки), и группа 6 представляла собой неинфицированных мышей, получавших 250 мг/кг соединения 1 (ПО, два раза в сутки). Обработку проводили в течение девяти дней, начиная за 4 ч до инфицирования. Адаптированный к мышам вирус Эбола (Заир), используемый для заражения, вводили интраперитонеально (1000 БОЕ). Смертность и массу отслеживали в течение 14 дней после инфицирования.
[00227] Процент выживаемости мышей показан на Фигуре 10. Все мыши, зараженные вирусом Эбола и получавшие солевой раствор, умерли к 8 дню. Все мыши, получавшие соединение 1 внутримышечно, выжили в конечной точке исследования; этот факт указывает на то, что ВМ дозирование соединения 1 являлось полностью защищающим. Восемьдесят или более процентов мышей, получавших соединение 1 перорально, выжили в конечной точке исследования.
[00228] Изменение веса мышей показано на Фигуре 11. Мыши, зараженные вирусом Эбола и получавшие солевой раствор, демонстрировали общую потерю массы до 7 дня (все контрольные мыши умерли к 8 дню). Мыши, получавшие соединение 1 внутримышечно, демонстрировали прибавление в массе, сходное с таковым для неинфицированной контрольной группы на 11 день. Мыши, получавшие соединение 1 перорально, демонстрировали обратимую потерю массы и сохраняли более чем 100% от начальной массы на 11 день.
[00229] Пример 13: Исследование временного окна для вируса желтой лихорадки (ВЖЛ) на золотистых хомяках.
Вирус желтой лихорадки (штамм Jimenez) вводили ИП сирийским золотистым хомякам-самкам (99 г) в дозе 20 x CCID50 на хомяка (~6,25 х LD50). Животные были разделены на группы следующим образом: 1) соединение 1 начинали вводить за 4 ч до инфицирования (N=15); 2) соединение 1 начинали вводить на 1 день после инфицирования (д.п.и.) (N=10); 3) соединение 1 начинали вводить на 2 д.п.и. (N=10); 4) соединение 1 вводили на 3 д.п.и. (N=10); 5) соединение 1 вводили на 4 д.п.и. (N=10); 6) рибавирин начинали вводить за 4 ч до инфицирования (N=10); 7) солевой раствор-носитель начинали вводить за 4 ч до инфицирования (N=16); 8) неинфицированным хомякам соединение 1 начинали вводить за 4 ч до инфицирования (N=3); 9) неинфицированным хомякам солевой раствор-носитель начинали вводить за 4 ч до инфицирования (N=3); и 10) неинфицированные, необработанные нормальные контрольные животные (N=3). Лечебная доза составляла 100 мг/кг ИП, 2 раза в сутки в течение 7 дней. Конечными точками исследования являлись смертность на 21 день, масса, измеряемая на 0, 3, 5, и 6 дни; титры вируса в сыворотке и печени (4 день, соединение 1, введение которого начинали за 4 ч до инфицирования, и носитель, введение которого начинали за 4 ч до инфицирования); и уровни АЛТ и АСТ на 6 день.
[00230] Исследование показало повышенную выживаемость для соединения 1 с отсроченным лечением по сравнению с плацебо (Фигура 12). Показана выживаемость хомяков, инфицированных ВЖЛ и получавших соединение 1 дважды в сутки в течение 7 дней, начиная с различных моментов времени после заражения вирусом (***P < 0,001, **P < 0,1 по сравнению с плацебо). Доля выживших животных составляла 100% для соединения 1, введение которого начинали до инфицирования, и лечения, отсроченного на вплоть до 3 дней после инфицирования. Доля выживших животных составляла 80% для соединения 1, введение которого начинали через 4 дня после инфицирования, что указывало на значительное улучшение по сравнению с плацебо в группах с отсроченным лечением. Для сравнения, рибавирин обеспечивал 90% выживаемость, если его введение начинали до инфицирования, и носитель обеспечивал 12,5% выживаемость при начале его введения до инфицирования. Большинство смертей произошли в течение 10 дней развития инфекции. Выжившие животные будут снова заражены ВЖЛ на 21 день после инфицирования.
[00231] Изменение массы хомяков показано на Фигуре 13. Хомяки, инфицированные ВЖЛ и начавшие получать соединение 1 от момента времени до инфицирования до 4 дней после инфицирования, демонстрировали прибавление в массе по сравнению с плацебо и рибавирином, вводимыми до инфицирования. Показан процент изменения массы хомяков, инфицированных ВЖЛ и получавших соединение 1 дважды в сутки в течение 7 дней, начиная с различных моментов времени до и после заражения вирусом.
[00232] Пример 14: Пероральная биодоступность соединения 1 у крыс.
[00233] Соединение 1 вводили перорально крысам в дозе 10 мг/кг. Фармакокинетическая кривая измерения концентрации соединения 1 в плазме крыс в течение 6 часов показана на Фигуре 14.
[00234] Пример 15: Исследование действия соединения 1 на вирус Марбург.
[00235] Соединение 1 вводили ВМ мышам линии BALB/c в возрасте 10-12 недель, зараженным (интраперитонеально) введением 1000 БОЕ вируса MARV-Ravn, адаптированного к мышам. Исследование было разделено на 10 групп (N=10 животных на группу). Режимы дозирования, пути введения и дозы приведены в Таблице 7. Соединение 1 растворяли в 0,9% солевом растворе перед введением, и состояние здоровья и массу отслеживали в течение 14 дней после инфицирования.
[00236] Таблица 7: Дизайн исследования для профилактики и лечения инфекции Марбург с применением соединения 1.
дни 1-8 ПИ
*Обработку в 0 день начинали за 4 часа до инфицирования за исключением группы 6.
Обработку группы 6 начинали через 4 ч после инфицирования в 0 день.
PI=после инфекции
[00237] Процент выживаемости для 10 групп в данном исследовании на 12 день приведен в Таблице 8. Доля выживших мышей, получавших только носитель (0,9% солевой раствор) составляла 60% на 7 день и 30% на 8-12 дни. Было показано, что соединение 1 увеличивало выживаемость до по меньшей мере 90% на 7 день и по меньшей мере 80% на 8-12 дни во всех дозах.
[00238] Таблица 8: Процент выживаемости для профилактики и лечения инфекции Марбург с применением соединения 1.
8
(150 мг/кг)
(50 мг/кг)
(15 мг/кг)
(5 мг/кг)
(150 мг/кг)
+ 4 ч
(150 мг/кг)
+ 24 ч
(150 мг/кг)
+ 48 ч
(150 мг/кг)
+ 72 ч
(150 мг/кг)
+ 96 ч
[00239] Несмотря на то что изобретение было описано и проиллюстрировано в вышеизложенных иллюстративных вариантах реализации, следует понимать, что настоящее описание было составлено исключительно в качестве примера и что многочисленные изменения в деталях реализации изобретения могут быть сделаны без выхода за рамки настоящего изобретения, которое ограничивается исключительно следующей ниже формулой изобретения. Признаки предложенных вариантов реализации могут быть объединены и перегруппированы различными способами без выхода за рамки настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ПОЛИМЕРАЗЫ | 2011 |
|
RU2599013C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ВИРУСНОЙ ПОЛИМЕРАЗЫ | 2013 |
|
RU2654482C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ СИЛИКАТИРОВАННЫЙ ВИРУС, И СПОСОБЫ ПРИМЕНЕНИЯ | 2014 |
|
RU2676083C2 |
| ПРОТИВОВИРУСНАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2740660C1 |
| ПРОТИВОВИРУСНАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2740657C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО, СОДЕРЖАЩИЕ НОВЫЕ ПРОИЗВОДНЫЕ ФАВИПИРАВИРА | 2023 |
|
RU2832326C1 |
| СПОСОБ ПОЛУЧЕНИЯ НОВЫХ ПРОИЗВОДНЫХ ФАВИПИРАВИРА | 2023 |
|
RU2828875C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МОДУЛЯТОРЫ СИНТЕЗА ЛИПИДОВ ДЛЯ ПРИМЕНЕНИЯ ПРОТИВ РАКА И ВИРУСНЫХ ИНФЕКЦИЙ | 2015 |
|
RU2766087C2 |
| ПРИМЕНЕНИЕ ТИЛВАЛОСИНА В КАЧЕСТВЕ ПРОТИВОВИРУСНОГО АГЕНТА | 2007 |
|
RU2412710C2 |
| ИНАКТИВИРОВАННЫЕ ХИМЕРНЫЕ ВАКЦИНЫ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ ПРИМЕНЕНИЯ | 2006 |
|
RU2436591C2 |
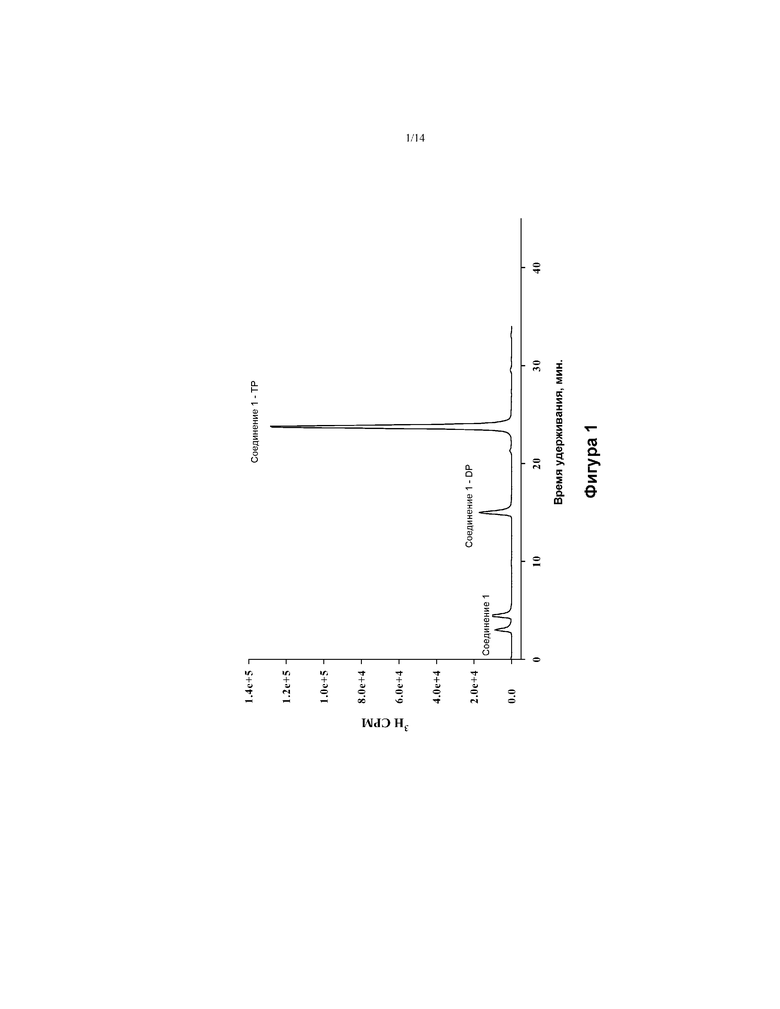
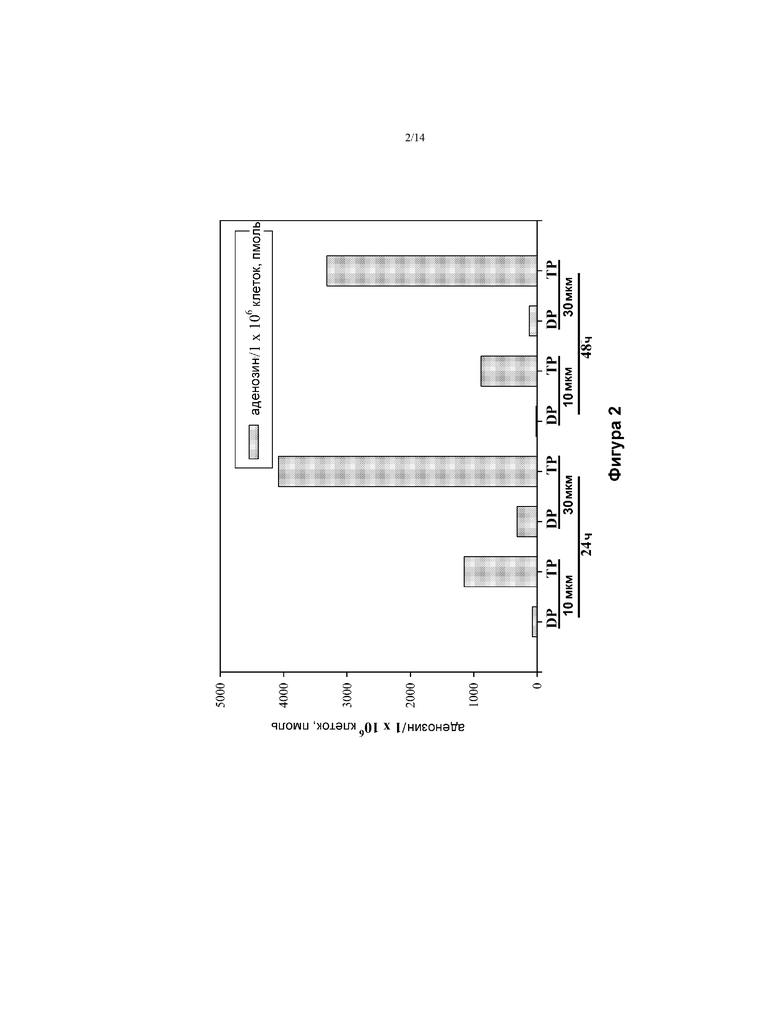
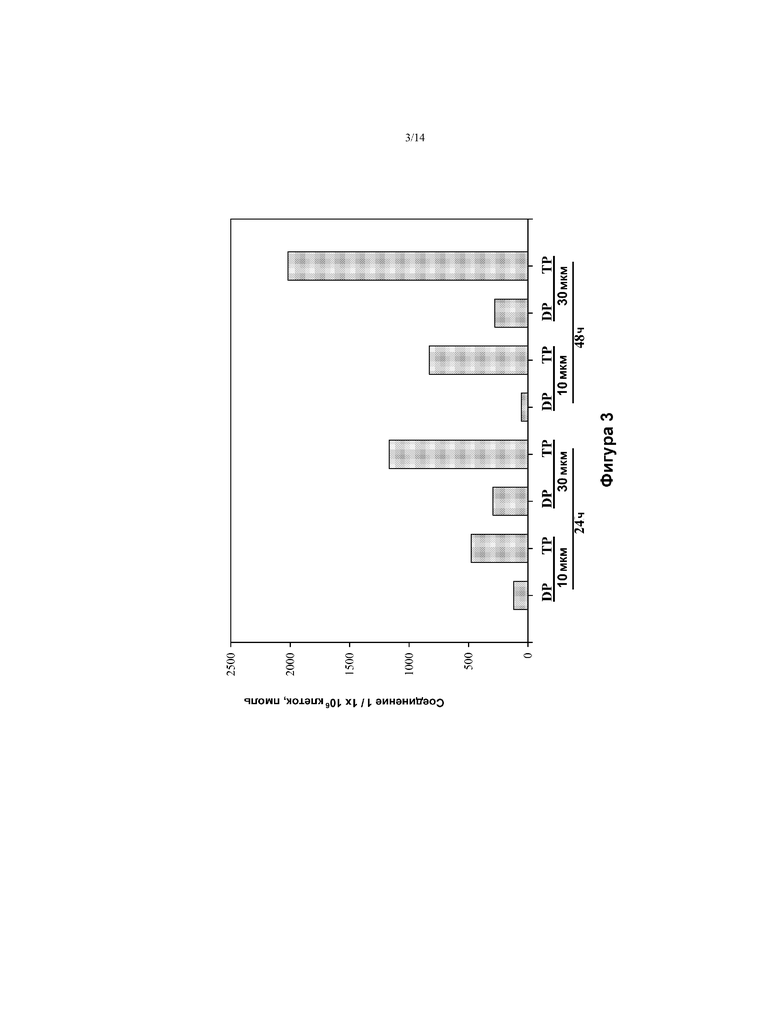
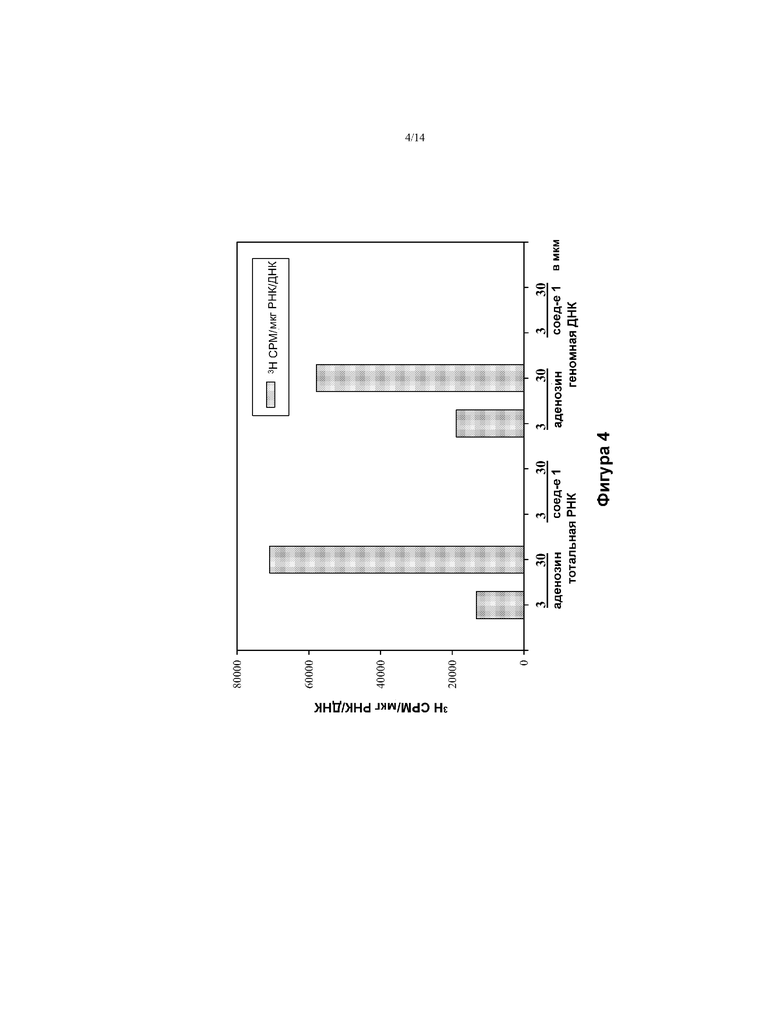
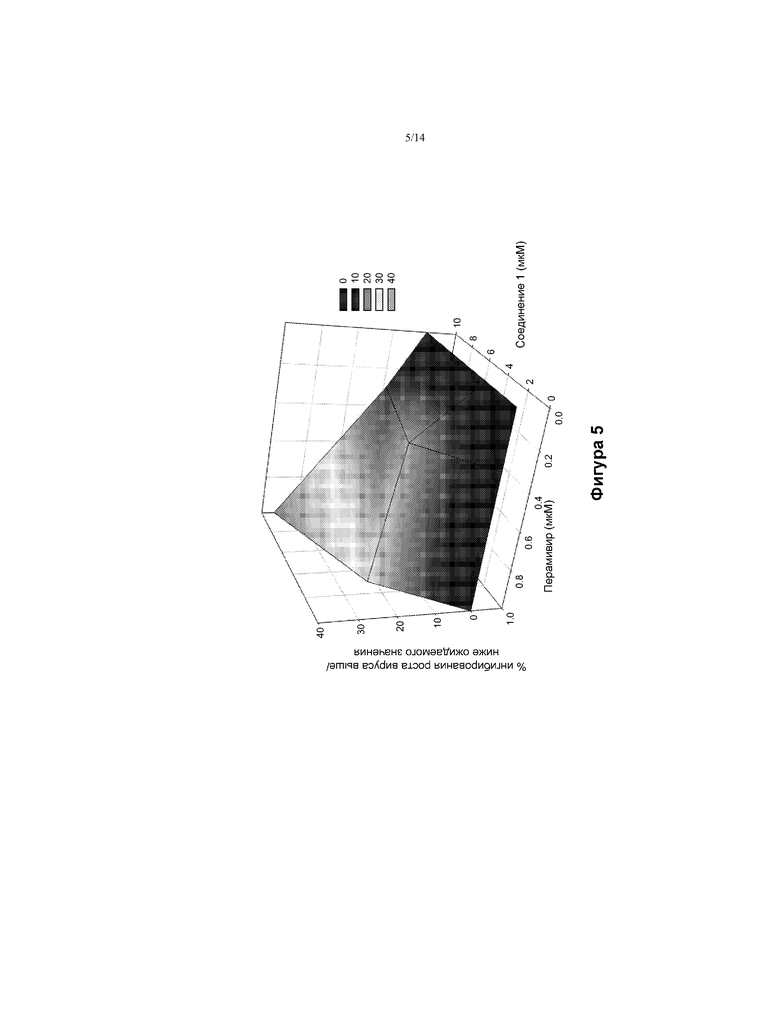
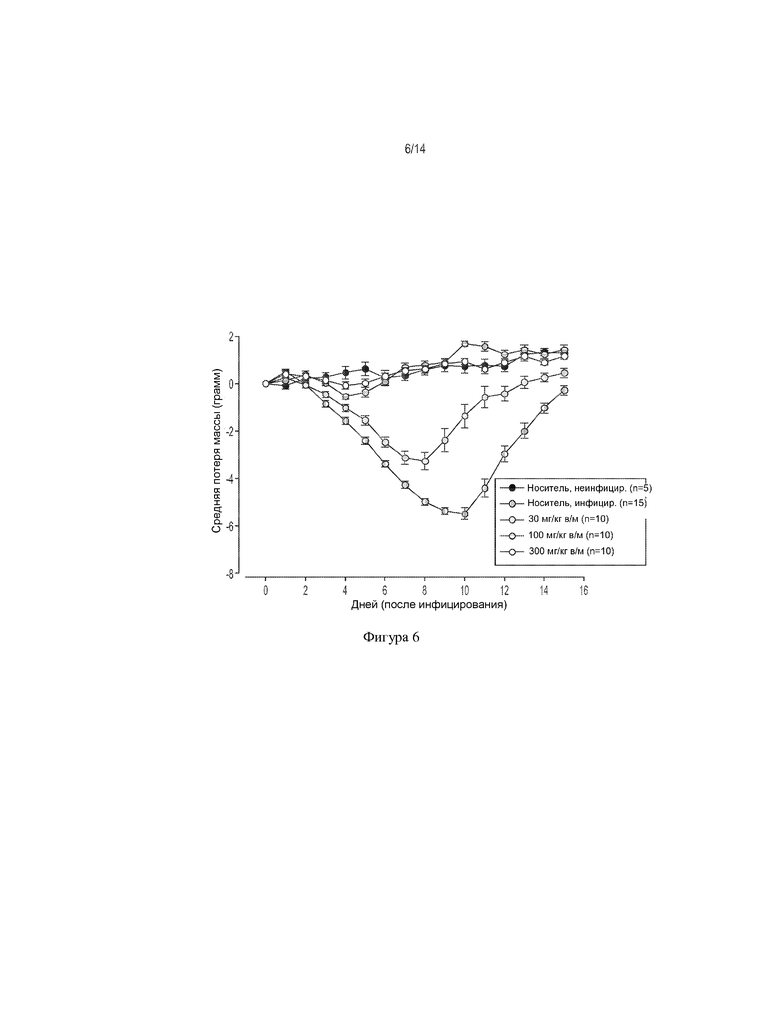
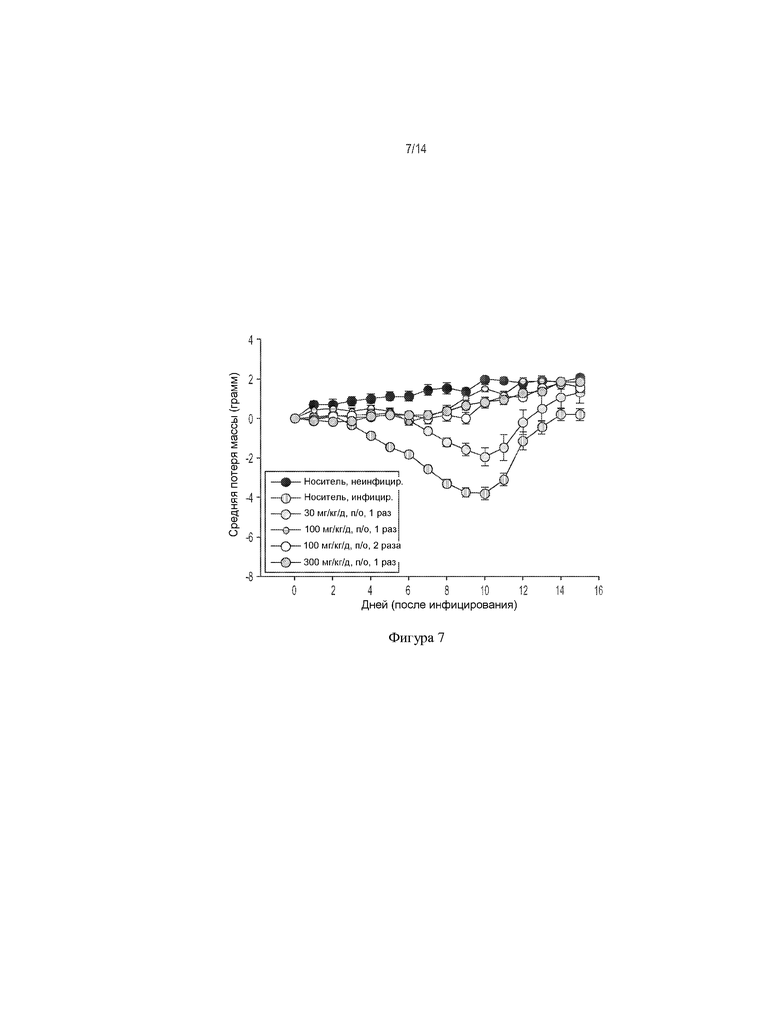
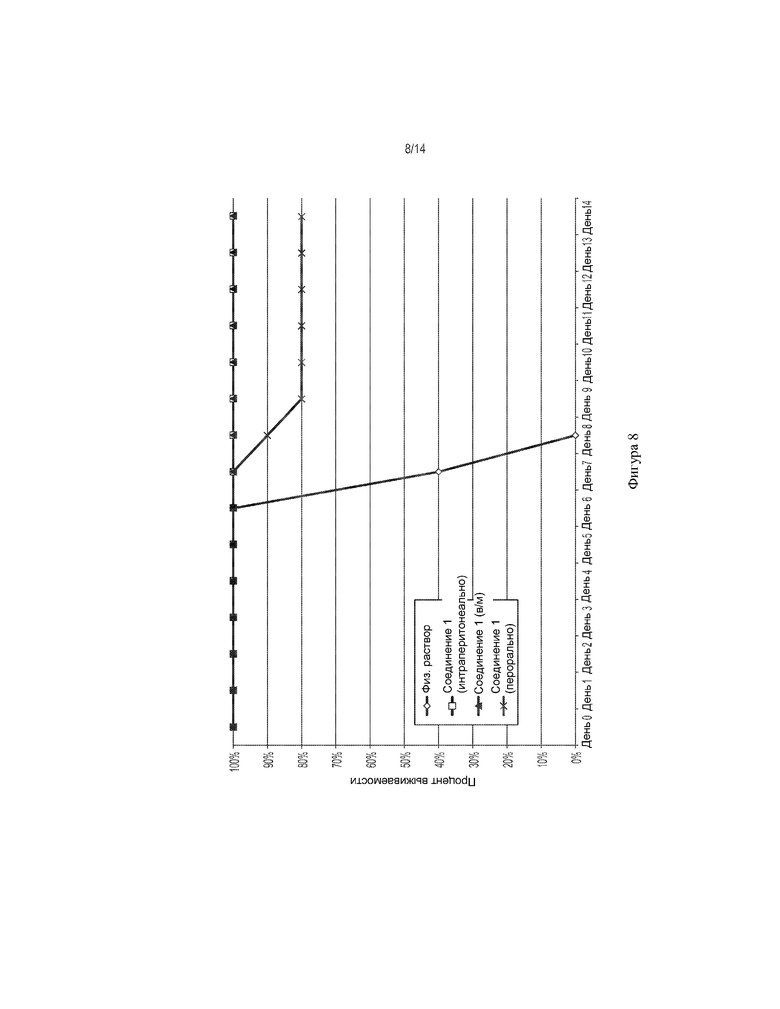

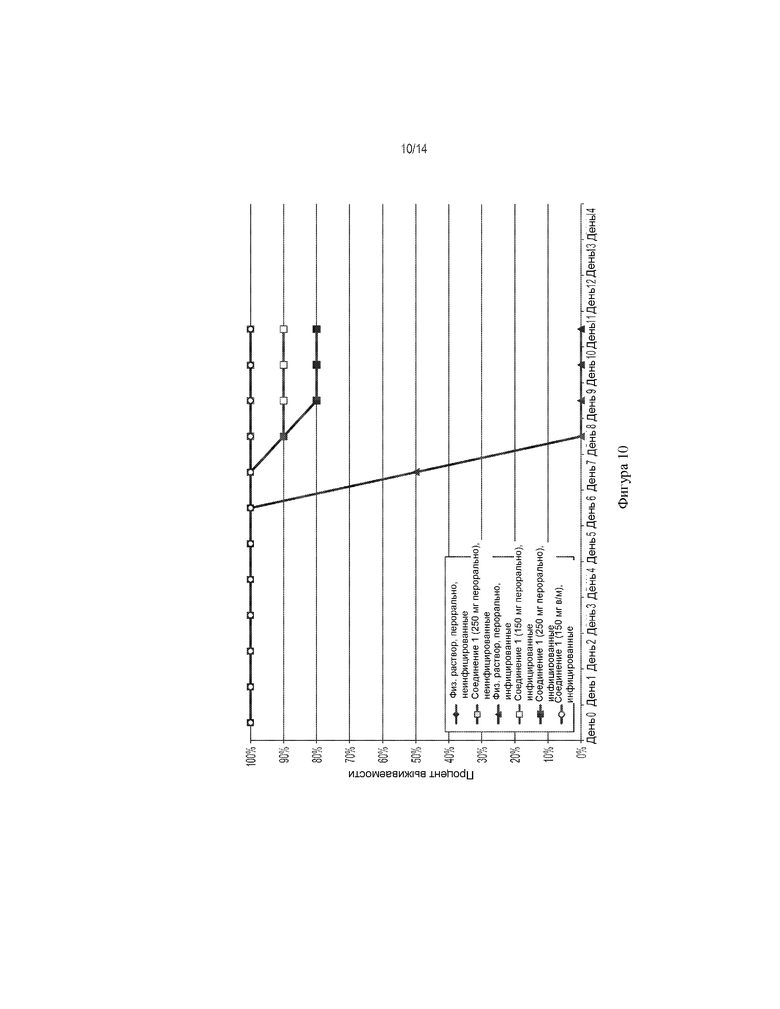


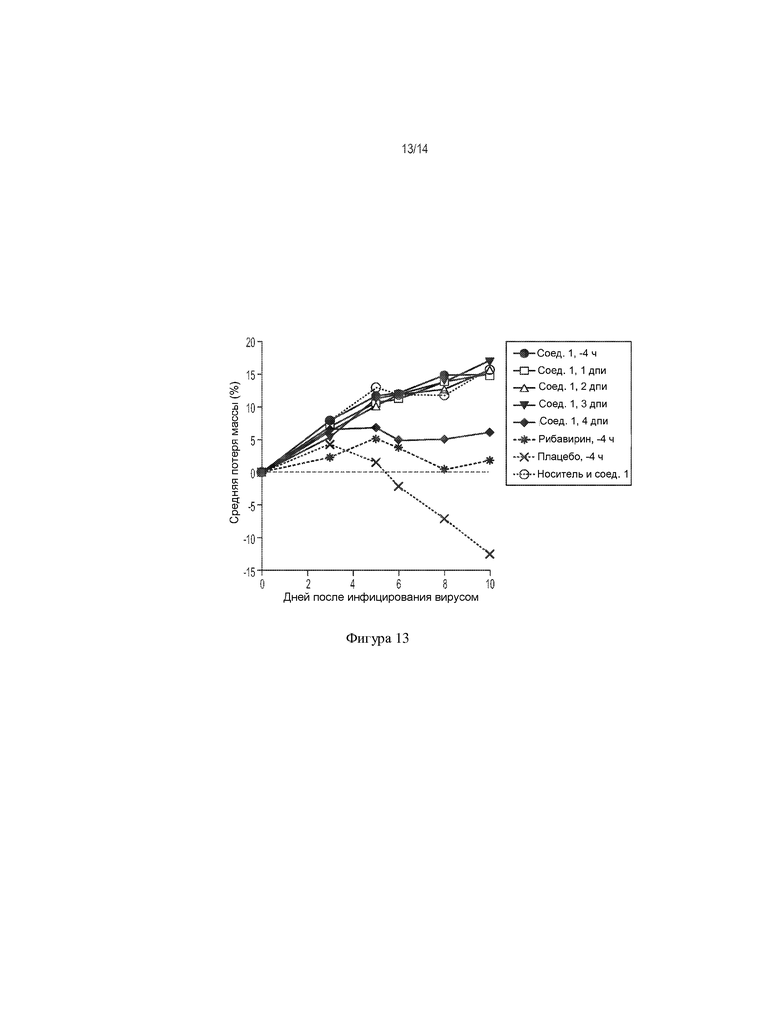

Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для применения соединения формулы I для лечения вирусных инфекций у субъектов. Применяют соединение формулы I или его фармацевтически приемлемой соли или гидрата для ингибирования вирусных полимераз нуклеиновых кислот у субъекта, где вирусная инфекция включает вирус, выбранный из группы, состоящей из семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов. Группа изобретений позволяет применять соединение формулы I в качестве ингибитора широкого спектра РНК-содержащих вирусов. 4 н. и 76 з.п. ф-лы, 15 пр., 8 табл.., 14 ил.
1. Применение соединения формулы I:
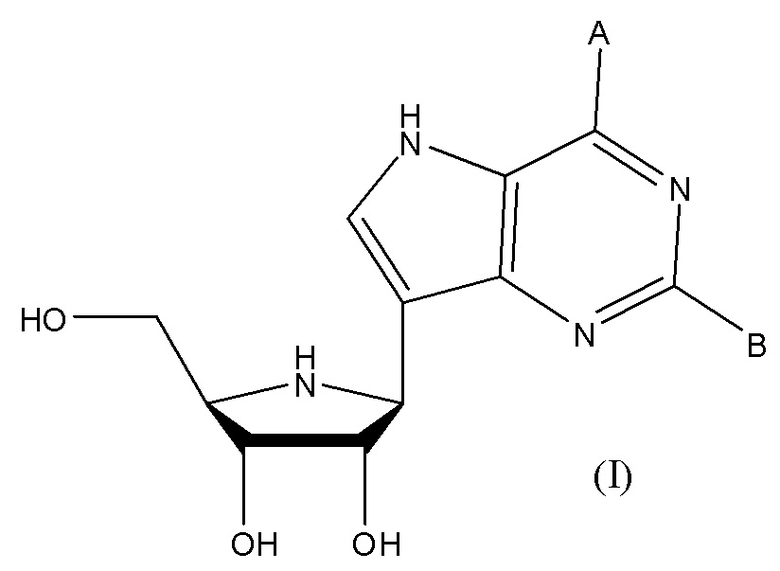
где A представляет собой NH2; и B представляет собой H; или его фармацевтически приемлемой соли или гидрата для ингибирования вирусной РНК-полимеразы у субъекта, где вирусная РНК-полимераза представляет собой:
(а) полимеразу, выбранную из группы, состоящей из вирусных полимераз ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов, или
b) полимеразу, выбранную из группы, состоящей из вирусных полимераз риновируса, полиомиелита, вируса кори, вируса Эбола, вируса Коксаки, вируса Западного Нила, вируса оспы, вируса желтой лихорадки, вируса лихорадки Денге, вируса гриппа А, вируса гриппа В, вируса Ласса, вируса лимфоцитарного хориоменингита, вируса Хунин, вируса Мачупо, вируса Гуанарито, хантавируса, вируса лихорадки долины Рифт, вируса Ла-Кросс, вируса калифорнийского энцефалита, вируса Конго, вируса Марбург, вируса японского энцефалита, вируса киасанурской лихорадки, вируса венесуэльского энцефалита лошадей, вируса восточного энцефалита лошадей, вируса западного энцефалита лошадей, вируса тяжелого острого респираторного синдрома (ТОРС), вируса парагриппа, респираторно-синцитиального вируса, вируса Пунта-Торо, вируса Такарибе и вируса Пичинде.
2. Применение по п. 1, где вирусная РНК-полимераза представляет собой полимеразу, выбранную из группы, состоящей из вирусных полимераз ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов.
3. Применение по п. 1, где вирусная РНК-полимераза представляет собой полимеразу, выбранную из группы, состоящей из вирусных полимераз вируса лихорадки Денге, вируса гриппа А, вируса гриппа В, вируса Хунин, кори, вируса парагриппа, вируса Пичинде, вируса Пунта-Торо, респираторно-синцитиального вируса, риновируса, вируса лихорадки долины Рифт, ТОРС-CoV, вируса Такарибе, вируса венесуэльского энцефалита лошадей, вируса Западного Нила и вируса желтой лихорадки.
4. Применение по п. 3, где вирусная РНК-полимераза представляет собой полимеразу вируса Западного Нила.
5. Применение по п. 3, где вирусная РНК-полимераза представляет собой полимеразу вируса лихорадки Денге.
6. Применение по п. 3, где вирусная РНК-полимераза представляет собой полимеразу вируса лихорадки долины Рифт.
7. Применение по п. 1, где вирусная РНК-полимераза представляет собой полимеразу, выбранную из группы, состоящей из вирусных полимераз вируса Эбола, вируса желтой лихорадки, вируса Марбург, вируса гриппа А и вируса гриппа В.
8. Применение по п. 7, где вирусная РНК-полимераза представляет собой вирусную полимеразу вируса Эбола.
9. Применение по п. 7, где вирусная РНК-полимераза представляет собой вирусную полимеразу вируса Марбург.
10. Применение по п. 7, где вирусная РНК-полимераза представляет собой вирусную полимеразу вируса желтой лихорадки.
11. Применение по п. 7, где вирусная РНК-полимераза представляет собой вирусную полимеразу вируса гриппа А или вируса гриппа В.
12. Применение по любому из пп. 1-11, где указанный субъект представляет собой млекопитающее.
13. Применение по любому из пп. 1-11, отличающееся тем, что указанный субъект представляет собой человека.
14. Применение по любому из пп. 1-11, также включающее введение дополнительного противовирусного агента.
15. Применение по п. 14, где указанный дополнительный противовирусный агент представляет собой ланинамивир, осельтамивир, занамивир и перамивир.
16. Применение по п. 14, где указанный дополнительный противовирусный агент представляет собой перамивир.
17. Применение по любому из пп. 1-11, где соединение составлено для внутривенного, интраперитонеального, внутримышечного или перорального введения.
18. Применение по п. 17, где соединение составлено для внутривенного введения.
19. Применение по п. 17, где соединение составлено для внутримышечного введения.
20. Применение по п. 17, где соединение составлено для перорального введения.
21. Применение соединения формулы I:

где А представляет собой NH2; и B представляет собой Н; или его фармацевтически приемлемой соли или гидрата для лечения вирусной инфекции у субъекта, где вирусная инфекция включает:
(а) вирус, выбранный из группы, состоящей из семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов; или
(b) вирус выбранный из группы, состоящей из аденовируса, риновируса, вируса гепатита, вируса иммунодефицита, вируса полиомиелита, вируса кори, вируса Эбола, вируса Коксаки, вируса Западного Нила, вируса оспы, вируса желтой лихорадки, вируса лихорадки Денге, вируса гриппа А, вируса гриппа В, вируса Ласса, вируса лимфоцитарного хориоменингита, вируса Хунин, вируса Мачупо, вируса Гуанарито, хантавируса, вируса лихорадки долины Рифт, вируса Ла-Кросс, вируса калифорнийского энцефалита, вируса Конго, вируса Марбург, вируса японского энцефалита, вируса киасанурской лихорадки, вируса венесуэльского энцефалита лошадей, вируса восточного энцефалита лошадей, вируса западного энцефалита лошадей, вируса тяжелого острого респираторного синдрома (ТОРС), вируса парагриппа, респираторно-синцитиального вируса, вируса Пунта-Торо, вируса Такарибе и вируса Пичинде.
22. Применение по п. 21, где вирусная инфекция содержит вирус, выбранный из группы, состоящей из семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов.
23. Применение по п. 21, где вирусная инфекция выбрана из группы, состоящей из аденовируса, вируса лихорадки Денге, вируса гриппа А, вируса гриппа В, вируса Хунин, вируса кори, вируса парагриппа, вируса Пичинде, вируса Пунта-Торо, респираторно-синцитиального вируса, риновируса, вируса лихорадки долины Рифт, вируса ТОРС, вируса Такарибе, вируса венесуэльского энцефалита лошадей, вируса Западного Нила и вируса желтой лихорадки.
24. Применение по п. 23, где вирусная инфекция представляет собой вирус Западного Нила.
25. Применение по п. 23, где вирусная инфекция представляет собой вирус лихорадки Денге.
26. Применение по п. 23, где вирусная инфекция представляет собой вирус лихорадки долины Рифт.
27. Применение по п. 21, где вирусная инфекция выбрана из группы, состоящей из вируса Эбола, вируса желтой лихорадки, вируса Марбург, вируса гриппа А и вируса гриппа В.
28. Применение по п. 27, где вирусная инфекция представляет собой вирус Эбола.
29. Применение по п. 27, где вирусная инфекция представляет собой вирус Марбург.
30. Применение по п. 27, где вирусная инфекция представляет собой вирус желтой лихорадки.
31. Применение по п. 27, где вирусная инфекция представляет собой вирус гриппа А или гриппа В.
32. Применение по любому из пп. 21-31, где указанный субъект представляет собой млекопитающее.
33. Применение по любому из пп. 21-31, отличающееся тем, что указанный субъект представляет собой человека.
34. Применение по любому из пп. 21-31, дополнительно включающее введение дополнительного противовирусного агента.
35. Применение по п. 34, где указанный дополнительный противовирусный агент выбран из группы, состоящей из ланинамивира, осельтамивира, занамивира и перамивира.
36. Применение по п. 34, где указанный дополнительный противовирусный агент представляет собой перамивир.
37. Применение по любому из пп. 21-31, где соединение составлено для внутривенного, интраперитонеального, внутримышечного или перорального введения.
38. Применение по п. 37, где соединение составлено для внутривенного введения.
39. Применение по п. 37, где соединение составлено для внутримышечного введения.
40. Применение по п. 37, где соединение составлено для перорального введения.
41. Применение соединения формулы I:

где А представляет собой NH2; и B представляет собой Н; или его фармацевтически приемлемой соли или гидрата для подавления вирусной инфекции у субъекта, где вирусная инфекция включает:
(а) вирус, выбранный из группы, состоящей из семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов; или
(b) вирус, выбранный из группы, состоящей из аденовируса, риновируса, вируса гепатита, вируса иммунодефицита, вируса полиомиелита, вируса кори, вируса Эбола, вируса Коксаки, вируса Западного Нила, вируса оспы, вируса желтой лихорадки, вируса лихорадки Денге, вируса гриппа А, вируса гриппа В, вируса Ласса, вируса лимфоцитарного хориоменингита, вируса Хунин, вируса Мачупо, вируса Гуанарито, хантавируса, вируса лихорадки долины Рифт, вируса Ла-Кросс, вируса калифорнийского энцефалита, вируса Конго, вируса Марбург, вируса японского энцефалита, вируса киасанурской лихорадки, вируса венесуэльского энцефалита лошадей, вируса восточного энцефалита лошадей, вируса западного энцефалита лошадей, вируса тяжелого острого респираторного синдрома (ТОРС), вируса парагриппа, респираторно-синцитиального вируса, вируса Пунта-Торо, вируса Такарибе и вируса Пичинде.
42. Применение по п. 41, где вирусная инфекция содержит вирус, выбранный из группы, состоящей из семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов.
43. Применение по п. 41, где вирусная инфекция выбрана из группы, состоящей из аденовируса, вируса лихорадки Денге, вируса гриппа А, вируса гриппа В, вируса Хунин, вируса кори, вируса парагриппа, вируса Пичинде, вируса Пунта-Торо, респираторно-синцитиального вируса, риновируса, вируса лихорадки долины Рифт, вируса ТОРС, вируса Такарибе, вируса венесуэльского энцефалита лошадей, вируса Западного Нила и вируса желтой лихорадки.
44. Применение по п. 43, где вирусная инфекция представляет собой вирус Западного Нила.
45. Применение по п. 43, где вирусная инфекция представляет собой вирус лихорадки Денге.
46. Применение по п. 43, где вирусная инфекция представляет собой вирус лихорадки долины Рифт.
47. Применение по п. 41, где вирусная инфекция выбрана из группы, состоящей из вируса Эбола, вируса желтой лихорадки, вируса Марбург, вируса гриппа А и вируса гриппа В.
48. Применение по п. 47, где вирусная инфекция представляет собой вирус Эбола.
49. Применение по п. 47, где вирусная инфекция представляет собой вирус Марбург.
50. Применение по п. 47, где вирусная инфекция представляет собой вирус желтой лихорадки.
51. Применение по п. 47, где вирусная инфекция представляет собой вирус гриппа А или гриппа В.
52. Применение по любому из пп. 41-51, где указанный субъект представляет собой млекопитающее.
53. Применение по любому из пп. 41-51, отличающееся тем, что указанный субъект представляет собой человека.
54. Применение по любому из пп. 41-51, дополнительно включающее введение дополнительного противовирусного агента.
55. Применение по п. 54, где указанный дополнительный противовирусный агент выбран из группы, состоящей из ланинамивира, осельтамивира, занамивира и перамивира.
56. Применение по п. 54, где указанный дополнительный противовирусный агент представляет собой перамивир.
57. Применение по любому из пп. 41-51, где соединение составлено для внутривенного, интраперитонеального, внутримышечного или перорального введения.
58. Применение по п. 57, где соединение составлено для внутривенного введения.
59. Применение по п. 57, где соединение составлено для внутримышечного введения.
60. Применение по п. 57, где соединение составлено для перорального введения.
61. Применение соединения формулы I:

где А представляет собой NH2; и B представляет собой Н; или его фармацевтически приемлемой соли или гидрата для предотвращения вирусной инфекции у субъекта, где вирусная инфекция включает:
(а) вирус, выбранный из группы, состоящей из семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов; или
(b) вирус, выбранный из группы, состоящей из аденовируса, риновируса, вируса гепатита, вируса иммунодефицита, вируса полиомиелита, вируса кори, вируса Эбола, вируса Коксаки, вируса Западного Нила, вируса оспы, вируса желтой лихорадки, вируса лихорадки Денге, вируса гриппа А, вируса гриппа В, вируса Ласса, вируса лимфоцитарного хориоменингита, вируса Хунин, вируса Мачупо, вируса Гуанарито, хантавируса, вируса лихорадки долины Рифт, вируса Ла-Кросс, вируса калифорнийского энцефалита, вируса Конго, вируса Марбург, вируса японского энцефалита, вируса киасанурской лихорадки, вируса венесуэльского энцефалита лошадей, вируса восточного энцефалита лошадей, вируса западного энцефалита лошадей, вируса тяжелого острого респираторного синдрома (ТОРС), вируса парагриппа, респираторно-синцитиального вируса, вируса Пунта-Торо, вируса Такарибе и вируса Пичинде.
62. Применение по п. 61, где вирусная инфекция содержит вирус, выбранный из группы, состоящей из семейств ортомиксовирусов, парамиксовирусов, аренавирусов, буньявирусов, флавивирусов, филовирусов, тогавирусов, пикорнавирусов и коронавирусов.
63. Применение по п. 61, где вирусная инфекция выбрана из группы, состоящей из аденовируса, вируса лихорадки Денге, вируса гриппа А, вируса гриппа В, вируса Хунин, вируса кори, вируса парагриппа, вируса Пичинде, вируса Пунта-Торо, респираторно-синцитиального вируса, риновируса, вируса лихорадки долины Рифт, вируса ТОРС, вируса Такарибе, вируса венесуэльского энцефалита лошадей, вируса Западного Нила и вируса желтой лихорадки.
64. Применение по п. 63, где вирусная инфекция представляет собой вирус Западного Нила.
65. Применение по п. 63, где вирусная инфекция представляет собой вирус лихорадки Денге.
66. Применение по п. 63, где вирусная инфекция представляет собой вирус лихорадки долины Рифт.
67. Применение по п. 61, где вирусная инфекция выбрана из группы, состоящей из вируса Эбола, вируса желтой лихорадки, вируса Марбург, вируса гриппа А и вируса гриппа В.
68. Применение по п. 67, где вирусная инфекция представляет собой вирус Эбола.
69. Применение по п. 67, где вирусная инфекция представляет собой вирус Марбург.
70. Применение по п. 67, где вирусная инфекция представляет собой вирус желтой лихорадки.
71. Применение по п. 67, где вирусная инфекция представляет собой вирус гриппа А или гриппа В.
72. Применение по любому из пп. 61-71, где указанный субъект представляет собой млекопитающее.
73. Применение по любому из пп. 61-71, отличающееся тем, что указанный субъект представляет собой человека.
74. Применение по любому из пп. 61-71, дополнительно включающее введение дополнительного противовирусного агента.
75. Применение по п. 74, где указанный дополнительный противовирусный агент выбран из группы, состоящей из ланинамивира, осельтамивира, занамивира и перамивира.
76. Применение по п. 74, где указанный дополнительный противовирусный агент представляет собой перамивир.
77. Применение по любому из пп. 61-71, где соединение составлено для внутривенного, интраперитонеального, внутримышечного или перорального введения.
78. Применение по п. 77, где соединение составлено для внутривенного введения.
79. Применение по п. 77, где соединение составлено для внутримышечного введения.
80. Применение по п. 77, где соединение составлено для перорального введения.
| WO03100009 A2, 04.12.2003 | |||
| US2007099942 A1, 03.05.2007 | |||
| US5912252 A, 15.06.1999 | |||
| WO9919338 A1, 22.04.1999. |
Авторы
Даты
2020-04-13—Публикация
2011-10-14—Подача