Притязание на приоритет
По данной заявке испрашивается преимущество приоритета в соответствии с предварительной заявкой США с регистрационным номером 60/848348, поданной 29 сентября 2006 года, и патентной заявкой США с регистрационным номером 11/855944, поданной 14 сентября 2007 года, посредством этого упоминания раскрытие обеих заявок включено в данное описание в их полноте.
Область техники
Настоящее изобретение относится к молекулам, которые модулируют (например, вызывают, усиливают, подавляют нежелательную активность и т.д.) клеточно-опосредованный иммунитет у субъекта, включая способы для производства и получения таких молекул, препаратам и композициям, которые включают такие молекулы, способам для оценки эффективности таких молекул и способам применения. Более конкретно, настоящее изобретение относится к низкомолекулярным соединениям, которые обозначают в настоящем документе как молекулы «нанофракции», которые модулируют клеточно-опосредованный иммунитет.
Уровень техники
Способность антител обеспечивать и переносить иммунитет хорошо известна и широко исследована в виде характеристик антител и механизмов, с помощью которых образуются антитела. Не так хорошо известна или не так широко исследована роль факторов переноса, которые включают семейство молекул, обладающих молекулярными массами между 3500 Да и 7500 Да, участвующих в модулировании клеточного или T-клеточно-опосредованного иммунитета. Со временем улучшилось и продолжает улучшаться понимание о характеристиках факторов переноса и их роли в иммунной системе организма, которым обладают специалисты в соответствующей области.
Несмотря на то, что продолжаются исследования с целью пролить свет на характеристики и функции широкого многообразия компонентов иммунной системы, может присутствовать большое количество малопонятных или даже нераспознанных молекул, которые могут иметь влияние на развитие иммунной системы, поддержание, передачу и перенос, а также на эффекты иммунитета при долгожительстве.
Раскрытие изобретения
Эффективность различных молекул в модулировании клеточно-опосредованного иммунитета недавно была охарактеризована количественным образом. Молекулы, которые могут напрямую или не напрямую модулировать клеточно-опосредованный иммунитет, известны в данной области как «иммунные модуляторы». Один класс иммунных модуляторов включает маленькую, или с низкой молекулярной массой, нанофракцию (например, до 3000 Да, до 3500 Да, от 250 Да до 2000 Да, от 2000 Да до 4000 Да) молекул, которые вызывают, усиливают, подавляют или иным образом модулируют клеточно-опосредованный иммунный ответ. Из-за относительно малых размеров или молекулярной массы таких иммунных модуляторов их обозначают в настоящем документе как «нанофракция» иммунных модуляторов и как «нанофракция» молекул.
Нанофракция иммунных модуляторов может быть получена из множества различных типов животных источников. Примеры животных источников включают, в качестве не ограничивающих примеров, млекопитающих (например, коров) и птиц (например, кур). Без ограничения объема настоящего изобретения, нанофракция иммунных модуляторов может быть получена из молозива, или даже молока, образованного млекопитающим. В качестве другого не ограничивающего примера, нанофракция иммунных модуляторов может быть получена из яиц, отложенных птицами или любым другим типом животных. Молозиво, яйца и другие источники молекул нанофракции в целом обозначаются здесь как «источники нанофракции».
Естественное производство нанофракции иммунных модуляторов с помощью животного-источника может быть усилено посредством воздействия на животное-источник большими количествами, или концентрацией, одного или нескольких антигенов, чем количество(а) такого антигена(ов), которым(и) животное-источник будет сенсибилизироваться в обычных условиях. Например, если особенный тип животного-источника, или даже особенное животное-источник, будет в его обычной среде обычно сенсибилизироваться точным количеством или концентрацией данного антигена, продукция иммунных модуляторов в животном-источнике, включая молекулы нанофракции, может быть усилена посредством сенсибилизации животного-источника даже большим количеством (например, концентрацией) этого антигена (например, с помощью вакцинирования животного-источника, с помощью помещения животного-источника в среду, где присутствует большее количество или концентрация этого антигена, и т.д.). В качестве другого примера, если особенный тип животного-источника, или даже особенное животное-источник, были типично вакцинированы данным антигеном, продукция животным-источником одной или нескольких нанофракций иммунных модуляторов может быть усилена с помощью увеличения сенсибилизации животного-источника антигеном (например, воздействуя на животное-источник увеличенной концентрацией антигена, более эффективной или более вирулентной формой антигена, и т.д.), хотя не полагается, что сами молекулы нанофракции являются антигенспецифичными.
Можно использовать известные процессы для частичной, существенной или полной очистки нанофракции иммунных модуляторов от других молекул, присутствующих в животном-источнике нанофракции, из которого они получены и, необязательно, для концентрирования нанофракции иммунных модуляторов. Такие процессы включают, без ограничения, механическое разделение, фазовое разделение (например, отделение водных и неводных компонентов друг от друга), преципитацию, центрифугирование, фильтрацию (включая микрофильтрацию, с порогом молекулярной массы (ПММ) в пределах от 12000 Да приблизительно до 4000 Да, и нанофильтрацию с ПММ менее чем приблизительно 4000 Да), диализ, процессы хроматографической и электрофоретической очистки. Такие процессы могут осуществляться отдельно или в любой комбинации для производства препарата, в котором присутствует один или несколько типов иммунных модуляторов. В одном из аспектов, настоящее изобретение относится к препаратам, по меньшей мере, частично очищенных, в значительной степени очищенных (например, до степени, принятой в соответствующей области), и полностью очищенных иммунных модуляторов. Дополнительно, настоящее изобретение относится к композиции, которая включает молекулы нанофракции. В дополнение к молекулам нанофракции, такие композиции могут включать другие компоненты, полезные для поддержания или модулирования иммунной системы субъекта (например, фактор переноса, антитела и т.д.), а также компоненты, которые могут другим образом принести субъекту пользу.
Способы, которые включают использование или введение молекул нанофракции или композиции, включающей таковые, по отдельности или с другими иммунными модуляторами, также входят в объем настоящего изобретения. Способы использования включают введение одного или нескольких типов иммунных модуляторов (например, в сырой, частично очищенной, в значительной степени очищенной или полностью очищенной форме, в препарате, в композиции и т.д.) субъекту (например, человеку или любому виду животных, что предположительно принесет пользу за счет иммунной модуляции, обеспеченной молекулами нанофракции). Иммунные модуляторы вводятся субъекту в количестве, которое увеличивает уровень (например, концентрацию) особого, введенного типа иммунного модулятора в тело субъекта до количества, превышающего норму для субъекта. Без ограничения объема этого аспекта по настоящему изобретению, субъект может принимать дозу одного или нескольких иммунных модуляторов, которые клинически эффективны для того, чтобы в иммунной системе субъекта вызвать клеточно-опосредованный иммунный ответ, или дозу, которая эффективно увеличивает клеточно-опосредованный иммунный ответ субъекта.
Кроме того, тесты и способы тестирования, которые оценивают эффективность иммунных модуляторов, входят в объем настоящего изобретения. В качестве примера, оценку иммунной функции T-клеток можно использовать для оценки способности потенциального иммунного модулятора модулировать активность (например, продукцию аденозинтрифосфата (АТФ)) одного или нескольких типов клеток, которые участвуют в клеточно-опосредованном иммунитете, или отдельно или в сочетании с другими молекулами (например, антигенами, митогенами (которые индуцируют митоз, или клеточную репликацию, и т.д.).
Другие особенности и преимущества будут понятны специалистам в данной области при анализе следующего описания и прилагаемой формулы изобретения.
Краткое описание чертежей
Чертежи, фиг.1-4, представляют собой графические изображения результатов различных тестов, выполненных на композициях, которые соответствуют настоящему изобретению.
Способ(ы) осуществления изобретения
Недавно было открыто, что низкомолекулярные соединения во множестве диапазонов молекулярных масс являются полезными в модулировании активности иммунных клеток. Следующий набор примеров приводит действия, которые были выполнены для достижения этих выводов.
Пример 1
Используя известные процессы, включая фазовое разделение, преципитацию, фильтрацию, микрофильтрацию или нанофильтрацию и диализ, было приготовлено множество фракций по молекулярным массам из коровьего молозива и куриных яиц. Фракции по молекулярной массе, полученные из коровьего молозива, были: от 250 Да до 2000 Да, от 2000 Да до 4000 Да, от 4000 Да до 8000 Да (которая включает фактор переноса и была включена с целью сравнения), и от 8000 Да до 12000 Да. Сходным образом из желтков куриных яиц были приготовлены фракции по молекулярной массе от 2000 Да до 4000 Да, от 4000 Да до 8000 Да (которая включает фактор переноса и была включена с целью сравнения), и от 8000 Да до 12000 Да. Затем фракции по молекулярной массе были высушены до порошкообразного состояния (например, с помощью распылительной сушки, сублимационной сушки и т.д.).
Затем провели различные исследования с использованием этих препаратов для оценки эффектов молекул в каждой фракции для модулирования активности клеток, которые переносят клеточный иммунитет (например, CD4+ T-хелперные клетки). В частности, исследования описываемого в патентах США 5773232 и 6630316 и в публикации патентной заявки США 2005/0260563 вида были изменены и использованы для оценки активностей различных фракций по молекулярной массе из примера 1 во множестве условий. Указанные выше исследования использовались для оценки продукции аденозинтрифосфата (АТФ) иммунными клетками (например, CD4+ T-хелперными клетками, CD3+ клетками (которые включают все T-клетки), и т.д.). Количество АТФ, произведенного клетками, может быть измерено образом, известным в данной области (например, посредством использования так называемой «люцифериновой реакции» с люменометром).
Пример 2
Первая серия исследований была проведена с использованием лейкоцитов здоровых людей, которые содержат, или экспрессируют, так называемые «CD4» гликопротеины на их поверхностях, с применением теста ImmuKnow™, который производится в Cylex Incorporated of Columbia, Maryland. Лейкоциты также обозначают как "CD4+" клетки благодаря экспрессии ими CD4 гликопротеинов. Экспрессия CD4 гликопротеина отличает так называемые «T-хелперные» клетки от других типов лейкоцитов, включая другие T-клетки.
Компоненты набора аналитического теста ImmuKnow™ представляли собой стандартную 96-луночную «аналитическую плашку», включая съемные восьмилуночные полоски; «разбавитель образца», который содержит среду для выращивания и консервант; «стимулятор», который содержит фитогемагглютинин-L (ФГА-L) (субстанция из бобов (например, красной фасоли), которая, как известно, неспецифически стимулирует митоз (процесс, в ходе которого клетка растет и делится на две новые клетки) и, таким образом, подготовительную выработку аденозинтрифосфата (АТФ) в лейкоцитах (т.е. «митоген»)), растворенный в среде для выращивания, и консервант; «Dynabeads®* CD4», которые представляют собой магнитные бусы для очистки образца, покрытые мышиными моноклональными антителами к человеческому CD4 и содержащиеся в буферированном солевом растворе с бычьим сывороточным альбумином (БСА) и консервантом; «промывочный буфер», который содержит буферированный солевой раствор с БСА; «реактив для лизиса», который содержит гипотонический щелочной раствор с детергентом, «панель для калибровки» с концентрациями АТФ 0, 1, 10, 100 и 1000 нг/мл; «люминесцентный реактив», содержащий люциферин и люциферазу в буферированном растворе, которые взаимодействуют с АТФ для образования свечения в количестве, которое указывает на количество АТФ, которое воздействовало на люминесцентный реактив; и «измерительную панель» с 96 лунками с непрозрачными границами (т.е., стенкой и дном).
Одна восьмилуночная полоска из 96-луночной аналитической плашки, которая может быть обозначена как «контрольная полоска», использовалась для обеспечения контроля, включая четыре «нестимулированные» (НС) контрольные лунки и четыре «стимулированные» контрольные лунки.
Другая восьмилуночная полоска из 96-луночной аналитической плашки, которая может быть обозначена как «тестовая полоска», использовалась для каждого исследуемого образца. Четыре лунки из каждой полоски были обозначены как «нестимулированные» лунки, тогда как другие четыре лунки каждой полоски были «стимулированными» лунками. Пятьдесят микролитров (50 мкл) разбавителя образца было введено в каждую из четырех «нестимулированных» лунок контрольной полоски, в то время как 25 мкл разбавителя образца было введено в каждую «нестимулированную» лунку на каждой тестовой полоске. Двадцать пять микролитров (25 мкл) стимулятора было введено в каждую из четырех «стимулированных» лунок контрольной полоски и в каждую из четырех «стимулированных» лунок каждой тестовой полоски.
В дополнение к разбавителю образца или стимулятору в каждую из восьми лунок каждой тестовой полоски было добавлено 25 мкл образца одной из фракций по молекулярной массе, установленных в примере 1. Более конкретно, каждая из фракций по молекулярной массе из примера 1 была восстановлена в разбавителе образца и разбавлена объемом разбавителя образца для обеспечения трех различных концентраций, которые будут в конечном счете, при добавлении в лунку 25 мкл образца, соответствовать добавлению в лунку 10 мкг, 100 мкг и 1000 мкг сухого порошка.
Было приготовлено разведение образца крови 1:3 (кровь:«разбавитель образца»), которое было осторожно перемешано для равномерного распределения его компонентов, включая лейкоциты. Семьдесят пять микролитров (75 мкл) разведенной крови было добавлено в каждую лунку на каждой полоске. Затем содержимое лунок было перемешано (например, посредством размещения плашки на плашечном шейкере примерно на 30 секунд), затем инкубировано при температуре 37°C в среде с 5% CO2 в течение примерно 18 часов.
Когда инкубация была завершена, содержимое лунок было снова перемешано (например, посредством размещения плашки на плашечном шейкере примерно на три минуты). После этого раствор, включая бусы для очистки образца Dynabeads®, был перемешан до гомогенной суспензии бус для очистки образца Dynabeads® в жидкости, в которой они были внесены (например, с помощью вортекса). Как указано выше, бусы для очистки образца Dynabeads® в этом примере включают магнитные бусы, покрытые мышиными моноклональными антителами к CD4 человека. Пятьдесят микролитров (50 мкл) раствора, в котором содержатся бусы для очистки образца Dynabeads®, было добавлено в каждую лунку на каждой полоске. Содержимое лунок каждой полоски снова перемешали (например, на плашечном шейкере в течение примерно 15 секунд), затем позволили отстояться, или инкубироваться, при комнатной температуре на протяжение примерно 15 минут. Затем процесс перемешивания и инкубации повторили. Мышиные антитела к CD4 человека на бусах для очистки образца Dynabeads® связывались только с лейкоцитами, экспонировавшими гликопротеин CD4. В ходе этой инкубации CD4+ лейкоциты, которые включают T-хелперные клетки, были иммобилизированы, или связаны, мышиными моноклональными антителами к CD4 человека на бусах для очистки образца Dynabeads®.
После инкубации содержимое каждой лунки было снова перемешано (например, в течение примерно от 15 секунд приблизительно до 30 секунд на плашечном шейкере) для ресуспендирования бус для очистки образца Dynabeads®. Затем содержимое каждой плашки было внесено в магнитное поле (например, посредством размещения каждой восьмилуночной полоски на магнитный поддон, доступный в Cylex), в соответствии с протоколом, изложенным в инструкциях, которые сопровождают тест ImmuKnow™. Под воздействием магнитного поля бусы для очистки образца Dynabeads® притянулись к одному краю каждой из лунок, в которых они присутствовали. Оставшееся содержимое лунки может быть удалено (например, аспирировано пипеткой и т.д.), и бусы, и T-хелперные клетки промывали один или несколько раз (например, три раза, каждый раз с 200 мкл промывочного буфера), чтобы основательно промыть их.
Затем было добавлено двести микролитров (200 мкл) реактива для лизиса в каждую лунку. После удаления содержимого каждой плашки из магнитного поля содержимое каждой плашки (т.е. бусы для очистки образца Dynabeads®, прикрепленные к ним клетки и реактив для лизиса) было перемешано (например, в течение примерно пяти минут на плашечном шейкере). Реактив для лизиса разрушил мембраны CD4+ клеток, которые были иммобилизированы с помощью антител на бусах для очистки образца Dynabeads®. В частности, из лизированных клеток высвободился АТФ. Как только лизис клеток был завершен, содержимое каждой плашки было снова внесено в магнитное поле, притягивающее бусы для очистки образца Dynabeads® внутри каждой лунки на один край лунки. Затем 50 мкл образца было перенесено из каждой лунки в соответствующую лунку измерительной панели. В дополнение к переносимым образцам, некоторые лунки 96-луночной измерительной панели были зарезервированы для 50 мкл образцов с разными концентрациями АТФ из растворов для калибровочной панели.
Затем сто пятьдесят микролитров (150 мкл) люминесцентного реактива было добавлено в каждую лунку измерительной панели, которая содержала или тестовый образец, или образец раствора из калибровочной панели. Затем была измерена люминесценция в каждой лунке. Измеренная в каждой лунке люминесценция обеспечивает индикацию количества АТФ, присутствующего в этой лунке. Количество АТФ, присутствующего в каждой лунке, в свою очередь, является показателем степени метаболической активности внутри клеток (т.е., CD4+ клеток), из которых содержимое каждой плашки измерительной панели. Ожидалось, что в образцах, полученных из клеток, которые были неспецифически стимулированы с помощью ФГА, должен присутствовать относительно высокий уровень АТФ. Добавление иммунного модулятора (например, из одной из фракций, установленных в примере 1) будет увеличивать или снижать, или модулировать, метаболическую активность в CD4+ клетках, которые были неспецифически стимулированы с помощью ФГА.
Результаты такого тестирования изложены в следующей таблице, снабженной цифрами, показывающими среднее (среднее арифметическое) количество АТФ, образованного лейкоцитами каждой подгруппы.
Эти данные показывают, что в нестимулированных тестах, в которых клетки не подвергались воздействию ФГД, каждая из фракций по молекулярной массе от 4000 Да до 8000 Да (из молозива и яиц), про обе известно, что они содержат фактор переноса, стимулировала дополнительную метаболическую активность в CD4+ лейкоцитах. Эти данные подтверждают способность фактора переноса стимулирующе регулировать клеточно-опосредованный иммунитет.
Наоборот, фракции молозива и яиц от 4000 Да до 8000 Да угнетающе регулируют (подавляют) неспецифическую способность ФГА стимулировать метаболическую активность в CD4+ клетках. Так как ФГА представляет собой искусственный неспецифический стимулятор, угнетающая регуляция его активности фактором переноса, который участвует в клеточно-опосредованном иммунитете, не является удивительной. Полагают, и предыдущее исследование показало, что фактор переноса помогает уравновешивать, и даже фокусировать, иммунную активность с помощью T-клеток (например, помогая клеткам «помнить» их первичную цель, снижая аутоиммунитет и связанные расстройства, одновременно улучшая активность против нежелательных организмов, таких как инфекция организма субъекта микроорганизмами (бактериями, вирусами и т.д.), и т.д.). Угнетающая регуляция ФГА-стимулированной активности с помощью T-клеток похоже подтверждает эту роль фактора переноса в клеточно-опосредованном иммунитете.
Сходные результаты были получены для многих других фракций по молекулярной массе, которые не содержат фактора переноса, включая фракцию молозива от 250 Да до 2000 Да (и стимулирующая регуляция, и угнетающая регуляция), фракцию молозива от 2000 Да до 4000 Да (стимулирующая регуляция), и фракцию яиц от 2000 Да до 4000 Да (стимулирующая регуляция и угнетающая регуляция). Фракция молозива от 8000 Да до 10000 Да также приводит к стимулирующей регуляции активности CD4+ лейкоцитов, которые не были стимулированы с помощью ФГА, и угнетающей регуляции ФГА-стимуляции метаболической активности в CD4+ лейкоцитах.
Эти данные устанавливают то, что иммунные модуляторы, отличные от фактора переноса, присутствуют, по меньшей мере, во фракции молозива от 250 Да до 2000 Да, фракции молозива от 2000 Да до 4000 Да, и фракции яиц от 2000 Да до 4000 Да. Способности к иммунной модуляции «молекул нанофракции», присутствующие в каждой из этих фракций, были, по меньшей мере, частично подтверждены экспериментом, который приводится в примере 3.
Пример 3
Была проведена вторая серия исследований активности, вызванной в лейкоцитах здоровых людей, экспонирующих гликопротеин CD3 (т.е. CD3+ клетки), которые, как известно, включают все T-клетки, включая так называемые «T-клетки памяти». Конкретно, использовался тест Cylex′s T-Cell Memory™. Протокол теста Cylex′s T-Cell Memory™ очень похож на таковой, приведенный в примере 2, со следующими исключениями: 25 мкл стимулятора, который содержал конковалин A (ConA) вместо ФГА, вводили только в «стимулированные» лунки контрольной полоски, тогда как 25 мкл разведения 1:10 вакцины цитомегаловируса (ЦМВ) добавляли к «стимулированным» лункам каждой тестовой полоски (в итоге, разведение на лунку равно 1:50); мышиные антитела к CD3 человека были иммобилизированы на поверхности магнитных бус (по инструкции, сопровождающей тестовый набор T-Cell Memory™) для того, чтобы приготовить бусы для очистки образца Dynabeads®; и бусы для очистки образца Dynabeads® добавляли в образцы крови, разбавитель образца, стимулятор (если он имел место) и фракцию образца (если она имела место) перед начальной инкубацией.
В тесте T-Cell Memory™ антиген использовался вместо митогена (например, ФГА), так что способность T-клеток памяти распознавать конкретный антиген могла быть оценена. В особенности, интенсивность свечения, испускаемого из каждой лунки измерительной панели, ниже, так как T-клетки памяти составляют только часть клеток, которые были связаны с молекулами антител на Dynabeads®.
Результаты этих исследований приведены в следующей таблице, снабженной цифрами, показывающими среднее (среднее арифметическое) количество АТФ, образованного лейкоцитами для каждого протестированного образца (и количества).
Данные, полученные при тестировании, проведенном в примере 3, показывают, что в присутствии антигена (т.е. специфического стимулятора, противопоставленного неспецифичности митогена, такого как ConA или ФГА) три фракции молозива, не содержащие фактора переноса, усиливают активность тестированных T-клеток памяти к ЦМВ до уровня, сравнимого (10 мкг образцы фракций молозива от 250 Да до 2000 Да и от 8000 Да до 12000 Да) или превышающего (10 мкг и 100 мкг образцы фракции молозива от 2000 Да до 4000 Да) способность сравнимых по размерам образцов фракций молозива от 4000 Да до 8000 Да, содержащих фактор переноса, усиливать активность тестируемых клеток при воздействии ЦМВ.
Пример 4
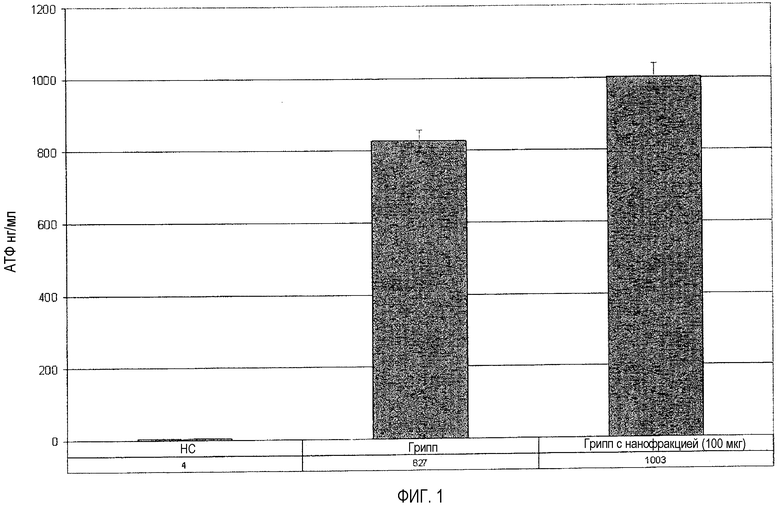
Другой набор исследований был проведен для определения, может ли нанофракция иммуномодулирующих молекул (т.е. иммунных модуляторов фракции молозива от 2000 Да до 4000 Да) или содержащая фактор переноса фракция (т.е. фракция молозива от 4000 Да до 8000 Да) модулировать (например, усиливать) иммунную память субъекта, который недавно подвергался воздействию высокой дозы специфического антигена. Более точно, образец крови был получен от индивидуума, который подвергся воздействию вируса гриппа, которое вызвало системную инфекцию, и страдал от симптомов простуды в течение четырех недель.
Исследование было проведено способом, описанным в примере 3, с использованием теста Cylex T-Cell Memory™ в соответствии с инструкциями, предоставленными с этим тестом и приведенными в примере 3, за исключением гриппозного антигена в виде разведения 1:25 вакцины против гриппа, произведенной в Aventis Pasteur of Paris, France, для сезона гриппа 2006-2007 г. (в итоге, разведение на лунку равно 1:125), который был использован вместо вакцины против ЦМВ из примера 3.
Результаты этого исследования приведены в следующей таблице.
4000 Да
Результаты, приведенные в таблице 3 (которая также графически изображена на фиг.1), показывают, что когда T-клетки памяти субъекта, который недавно подвергался воздействию специфического антигена, подвергаются воздействию этого антигена, особенно в присутствии молекул нанофракции или фактора переноса, активность CD3+ T-клеток памяти значительно увеличивается. Фактически, относительно малые количества молекул нанофракции и фактора переноса приводят примерно к 20% увеличению активности T-клеток памяти. Фактически, это выглядит так, будто в модулировании активности протестированных клеток иммунные модуляторы фракции от 2000 Да до 4000 Да являются примерно такими же эффективными, как фактор переноса и любые другие молекулы, присутствующие в фракции от 4000 Да до 8000 Да.
Результаты из примеров 1-4 показывают, что иммунные модуляторы, имеющие молекулярные массы в пределах от 250 Да до 2000 Да, от 2000 Да до 4000 Да, и от 8000 Да до 12000 Да, являются эффективными в модулировании иммунной активности различных типов T-клеток. Таким образом, вводя субъекту такие иммунные модуляторы или препараты или композиции, содержащие иммунные модуляторы, клеточно-опосредованный иммунитет субъекта может быть модулирован.
На основании этих результатов был разработан процесс производства различных добавок к рациону (например, из (коровьего) молозива, (куриных) яиц, и т.д.), которые содержат молекулы с предопределенным ПММ. Например, и не с целью ограничения, жидкий препарат источника нанофракции иммунных модуляторов, из которого были удалены, по меньшей мере, макроскопические частицы (например, твердые частицы молозива/молока, яичные мембраны и оболочки и т.д.) (например, с помощью фазового разделения, процесса фильтрации и т.д.), может быть принудительно профильтрован через поры, подобранные для обеспечения предопределенного верхнего предела ПММ. В качестве не ограничивающего примера, можно использовать фильтр, который обеспечивает порог молекулярной массы примерно в 3000 Да. Альтернативно, можно использовать процессы диализа, которые включают использование диализных мембран, обладающих порами, которые обеспечивают желаемый ПММ. Применение таких процессов предоставляет «нанофракцию», из которой исключены большие молекулы, включая фактор переноса, антитела, и множество других молекул, обладающих молекулярными массами больше чем приблизительно 3000 Да. (Например, были произведены молозиво, куриные и различные порошкообразные композиции. Затем фильтрат (т.е. часть жидкости, которая прошла через фильтр) может быть дополнительно обработан с помощью известных технологий (например, сублимационной сушки, распылительной сушки, выпаривания для образования более концентрированной жидкости, встраивание в гель и т.д.). Затем полученный «нанофракционный продукт» может быть использован в отдельности или встроен в другую композицию.
Полагают, что включая молекулы нанофракции, даже в очень маленьких количествах, в препараты, которые также содержат фактор переноса (и которые также могут включать в себя базовые уровни (т.е. такие уровни уже присутствуют в источнике (например, молозиве, яйцах и т.д.), из которого получен фактор переноса), полученные композиции будут угнетающе регулировать нежелательную активность с помощью T-клеток (например, аутоиммунитет и связанные расстройства и т.д.), наряду с улучшением, или стимулирующей регуляцией, желательной T-клеточной активности. Были разработаны композиции нанофракции и фактора переноса, которые приведены в таблицах 4 и 5.
КОМПОЗИЦИЯ A
Композиция из таблицы 4 также может обозначаться как «иммуномодулирующий компонент». Такой «иммуномодулирующий компонент» в основном может состоять из комбинации источников иммунных модуляторов (включая источники нанофракции иммунных модуляторов) или экстрактов источников иммунных модуляторов, таких как те, что перечислены в таблице 4, или могут включать другие ингредиенты.
Также композиция, которая содержит исследования по настоящему изобретению, в основном может состоять из «иммуномодулирующего компонента», такого как тот, что описан в таблице 4, или он может включать другие ингредиенты, как приведено в таблице 5.
КОМПОЗИЦИЯ B
Композиция по настоящему изобретению может быть воплощена в виде жидкости (например, в напитке RioVida®, доступном в 4Life Research, LC, of Sandy, Utah), порошка (который может включать дополнительные ингредиенты для обеспечения желаемых вкусовых качеств и растворимости и т.п.), таблеток (которые дополнительно содержат другие ингредиенты, такие как связующие вещества (например, крахмал) и т.п., геля (в который могут быть добавлены желатин или другие ингредиенты), или в любой другой подходящей форме. Следует понимать, что в целях этого раскрытия, дополнительные ингредиенты, которые используются для производства таких вариантов осуществления композиции по настоящему изобретению, для целей этого раскрытия могут только предполагаться необязательными и второстепенными для композиции, если иное не требуется прилагаемой формулой изобретения.
Пример 5
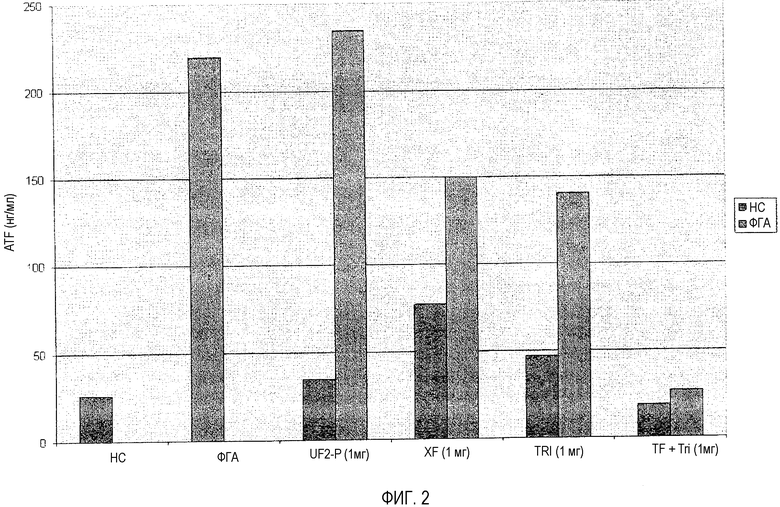
Кровь была получена от индивидуума, который страдал от симптомов опоясывающего лишая (инфекция вирусом ветряной оспы (BBO)) в течение примерно четырех недель. Затем кровь была исследована с использованием теста ImmuKnow™ способом, описанным в примере 2, за исключением того, что фракции образца из примера 2 были заменены следующими: (a) контроль, который не содержал иммунные модуляторы; (b) фракция молозива, обладающая ПММ, равным примерно 3000 Да, которая была высушена распылением; (c) добавили Фактор Переноса XF®, который в настоящее время доступен в 4Life Research и содержит экстракт коровьего молозива с верхним ПММ, примерно равным 10000 Да; (d) композиция из таблицы 4, которая обозначена как «Композиция A»; и (e) композиция из таблицы 5, которая обозначена как «Композиция B». Каждый с (b) по (e) был восстановлен в разбавителе образца, который прилагается к тесту ImmuKnow™, и разведен до концентрации, которая была получена в финале, концентрация на лунку составила 1 мг/мл на образцы крови и все другие жидкости были добавлены в каждую лунку.
Результаты этих тестов приведены в следующей таблице.
Эти результаты также представлены на графике на фиг.2.
Повторимся, что эти результаты были получены в момент времени (примерно четыре недели после начальной инфекции; т.е. в процессе выздоровления), когда в отсутствие стимуляции предполагалось, что активность T-хелперных (CD4+) клеток снизится, несмотря на то, что большое количество T-хелперных клеток осталось в крови субъекта. Активность T-хелперных клеток была простимулирована лишь слегка, в отсутствие неспецифического стимулятора ФГА, с помощью нанофракции, TF XF и композиции A, и не похоже, чтобы стимулировалась с помощью композиции B. Неспецифическая стимуляция T-хелперных клеток с помощью ФГА была, однако, значительно снижена с помощью TF XF и композиции A, и даже больше увеличена с помощью композиции B, чем можно было предположить, исходя из результатов примера 2, как приведено в таблице 1.
Пример 6
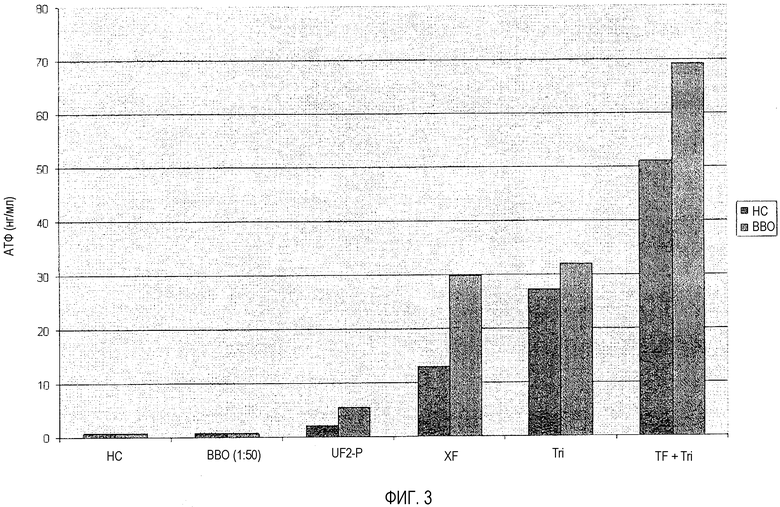
В более ранний момент времени (примерно одна неделя после начала симптомов опоясывающего лишая) предполагалось, что T-клетки памяти, несмотря на то, что они не присутствуют в крови субъекта в большой концентрации из-за локального характера инфекции ВВО, что вызывает опоясывающий лишай (т.е. относительно низкие титры ВВО в крови), уже будут распознавать инфекцию ВВО и будут быстро стимулироваться в присутствии антигена ВВО. Таким образом, тест T-Cell Memory™ был проведен для определения влияния нанофракции, TF XF, композиции A и композиции B на T-клетки памяти из крови того же пациента, что тестировался в примере 5. Протокол, приведенный в примере 3, был выполнен со следующими оговорками: вакцина BBO, которая была разведена 1:10, использовалась вместо вакцины ЦМВ (в итоге, разведение на лунку 1:50); и фракции образца из примера 3 были заменены контролем и иммунными модуляторами, использованными в примере 5, причем каждый иммунный модулятор был разведен до конечной концентрации на лунку, равной 100 мкг/мл.
В следующей таблице приведены результаты исследования.
Также эти данные изображены графически на фиг.3.
Как предполагалось, фактор переноса, который присутствует в TF XF, стимулировал активность с помощью T-клеток памяти. Добавление маленького количества дополнительных молекул нанофракции к фактору переноса значительно увеличивало активность T-клеток памяти, как в присутствии, так и в отсутствие дополнительной стимуляции BBO. Таким образом, результаты примеров 5 и 6 подтверждают, что добавление дополнительных молекул нанофракции к препаратам, которые также содержат фактор переноса, даже в очень маленьких количествах, будет угнетающе регулировать нежелательную активность с помощью T-клеток (например, аутоиммунитет и связанные расстройства и т.д.), при этом улучшая, или стимулирующе регулируя, желательную T-клеточную активность.
Пример 7
В другом исследовании, которое было проведено для определения способностей различных композиций, включая композиции, содержащие фактор переноса и дополнительные молекулы нанофракции, приведенные в таблицах 4 и 5, стимулировать клеточную активность естественных киллеров (ЕК) против человеческой эритробластомной лейкозной клеточной линии K-562, которая чувствительна к клеткам ЕК, была проведена оценка. Таким образом. Клетки ЕК также упоминаются здесь как «эффекторные клетки», тогда как клетки K-562 также упоминаются здесь как «опухолевые клетки» и как «клетки-мишени». В частности, использовался способ анализа с MTT, в котором 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид (MTT), обладающий желтой окраской, восстанавливается до формазина, обладающего пурпурной окраской, с помощью ферментов редуктаз в активных митохондриях живых клеток. Прямо перед анализом на цитотоксичность раствор (например, диметилсульфоксид, додецилсульфат натрия (SDS) в растворе соляной кислоты (HCl), и т.д.), который будет растворять формазан, добавляют в каждую лунку. Спектрофотометрия, в которой измеряют количество света определенной длины волны (например, длина волны в пределах приблизительно от 500 нм приблизительно до 600 нм), поглощенного раствором в каждой лунке, которое затем используется для определения количества живых клеток в анализируемых лунках, по отношению к количеству живых клеток в одной или нескольких контрольных лунках, в которые не добавляли тестируемые композиции.
Композиции, которые оценивались, содержали Transfer Factor Advanced™, доступный в 4Life Research; Transfer Factor Plus Advanced™, также доступный в 4Life Research; композицию A, которая содержит и фактор переноса, и повышенное количество молекул нанофракции; композицию B, которая содержит фактор переноса, повышенное количество молекул нанофракции и другие ингредиенты, которые предположительно усиливают активность иммунной системы; молекулы нанофракции из коровьего молозива; молекулы нанофракции из куриных яиц; и интерлейкин-2 (ИЛ-2), доступный под торговым названием Proleukin в Chiron of the Netherlands, который, как известно, вовлекает клетки ЕК против злокачественных клеток.
Кровь была получена от пяти здоровых доноров. Были использованы известные процессы для отделения лейкоцитов от других компонентов крови. Известный способ центрифугирования в градиенте плотности (например, с использованием градиента плотности Histopaque®, доступного в Sigma-Aldrich Corporation of St. Louis, Missouri) использовался для отделения мононуклеарных клеток, включая клетки ЕК, от других типов лейкоцитов. Мононуклеарные клетки были введены в RPMI 1640 среду для выращивания с 10% фетальной телячьей сыворотки (ФТС). Равные объемы этой смеси, включая концентрацию примерно в 60000 лейкоцитов в 100 мкл среды для культивирования, были введены в различные лунки стандартной 96-луночной плашки. Восстановленные образцы фактора переноса и/или композиции, содержащей молекулы нанофракции, идентифицированные выше, каждый имеет концентрацию, равную 0,100 мг порошка в 1 мл стерильной деионизированной воды, были добавлены в три разные лунки, содержащие лейкоциты и среду для выращивания, всего в восемнадцать лунок. Кроме того, 1000 МЕ/мл ИЛ-2 ввели в три лунки с положительным контролем, содержащие смесь сред для выращивания мононуклеарных клеток. Три лунки с отрицательным контролем содержали только смесь сред для выращивания мононуклеарных клеток без иммунных модуляторов. Три лунки с отрицательным контролем на эффекторные клетки также содержали только смесь сред для выращивания мононуклеарных клеток, тогда как три лунки с отрицательным контролем на клетки-мишени содержали только 100 мкл среды для выращивания.
Мононуклеарные клетки инкубировали с их соответствующими композициями для иммунной модуляции (за исключением трех лунок с отрицательным контролем) в присутствии 5% CO2 при температуре 37°C и 100% влажности в течение 48 часов.
После инкубации примерно 30000 K-562 клеток ввели в каждую лунку, за исключением трех лунок с отрицательным контролем на эффекторные клетки, которые содержали мононуклеарные клетки и среду для выращивания. 96-луночная плашка и смеси в ее лунках снова инкубировали в присутствии 5% CO2 при температуре 37°C и 100% влажности в течение 48 часов.
Раствор MTT, имеющий концентрацию 5 мг MTT/мл солевой раствор Хенка, приготовили в соответствии с известными, стандартными способами. Двадцать микролитров (20 мкл) раствора MTT ввели в каждую лунку 96-луночной плашки, содержащую мононуклеарные клетки, среду для выращивания и опухолевые клетки. Плашку и содержимое ее лунок снова инкубировали в присутствии 5% CO2 при температуре 37°C и 100% влажности в течение примерно четырех часов.
После этой финальной инкубации 96-луночную плашку центрифугировали примерно при 1500 об./мин в течение примерно пяти минут. После этого супернатант (жидкость) удалили из каждой лунки и 150 мкл диметилсульфоксида (ДМСО) ввели в каждую лунку, содержащую мононуклеарные клетки и опухолевые клетки. Затем использовали спектрофотометр для измерения оптической плотности при длине волны 540 нм в каждой лунке, содержащей клетки. Затем измеренную оптическую плотность использовали для определения показателя цитотоксичности (%) (ПЦ (%)) клеток ЕК после активации каждой тестированной субстанцией, используя следующую формулу:
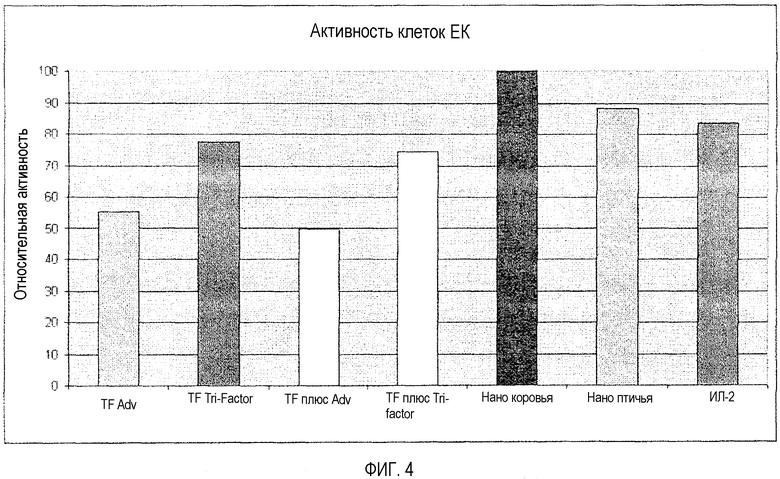
ПЦ (%) = [1-(ODe+t-ODe)/ODt]×100, где Ode+t представляет собой оптическую плотность каждой тестированной лунки, соответствующей протестированной композиции, включая ИЛ-2 позитивного контроля, ODe представляет собой среднюю оптическую плотность трех лунок с отрицательным контролем на эффекторные клетки и ODt представляет собой среднюю оптическую плотность трех лунок с отрицательным контролем на клетки-мишени. ПЦ (%) означает процент клеток-мишеней, которые были убиты клетками ЕК в каждой лунке, которые также содержали тестируемую иммуномодулирующую композицию. Результаты представлены в следующей таблице.
Эти данные, которые также изображены на диаграмме на фиг.4, показывают, что композиции, содержащие молекулы нанофракции, особенно те, что из коровьего молозива, примерно так же эффективны или более эффективны, чем ИЛ-2, в выявлении активности ЕК клеток против опухолевых клеток K-562, тогда как композиции, которые включают фактор переноса из молозива и яиц и молекулы нанофракции из молозива (т.е., композиция A и композиция B) активируют клетки ЕК более эффективно, чем композиции, испытывающие недостаток в молекулах нанофракции.
При добавлении дополнительных всего 2% молекул нанофракции, по весу, к композиции, которая содержит фактор переноса, молекулы нанофракции могут усиливать действие с помощью неспецифических компонентов (например, клеток ЕК) клеточно-опосредованной части иммунной системы субъекта, дополняя способность фактора переноса вызывать активность с помощью антиген-специфических компонентов клеточно-опосредованной части иммунной системы субъекта.
При совместном рассмотрении результаты примеров с 5 по 7 показывают, что факторы переноса регулируют и первичные T-хелперные клетки, которые делают иммунную систему субъекта способной отвечать быстрее и эффективнее на патогены и другие нежелательные организмы. Кроме того, примеры с 5 по 7 показывают, что фактор переноса может усиливать активность T-клеток памяти.
Примеры с 5 по 7 также показывают, что добавление дополнительных иммуномодулирующих молекул нанофракции к композиции, которая содержит фактор переноса, может укреплять и усиливать иммунную модуляцию (например, T-хелперных клеток, T-клеток памяти и клеток ЕК) фактора переноса и существующих композиций, которые содержат фактор переноса.
Способ модулирования клеточно-опосредованного иммунитета субъекта включает введение субъекту (например, энтерально, парентерально и т.д.) композиции, содержащей молекулы нанофракции. Молекулы нанофракции могут быть введены по отдельности или в качестве части композиции, которая главным образом состоит из молекул нанофракции, или они могут быть введены с композицией (например, композицией, такой как та, что приведена в таблице 4 или таблице 5), которая содержит фактор переноса. Введение может происходить на постоянной основе с целью поддержания общего баланса в клеточно-опосредованном иммунитете субъекта, или оно может осуществляться в ответ на инфекцию, аутоиммунное заболевание, тканевой трансплантат или другое событие, которое оказывает влияние (активирует или подавляет) клеточно-опосредованный иммунитет субъекта.
Введение композиции, которая содержит нанофракцию иммуномодулирующих молекул в соответствии с исследованиями по настоящему изобретению, предположительно модулирует клеточно-опосредованную иммунную активность, основанную на физиологической потребности. Например, может быть снижена нежелательная клеточно-опосредованная иммунная активность (например, аутоиммунитет и т.д.).
В качестве другого примера, способность T-клеток убирать нежелательные патогены, а также другие нежелательные сущности, такие как злокачественные клетки и другие абберантные или мутировавшие клетки, из тела субъекта (например, посредством активации T-хелперных (CD4+) клеток, которые, в свою очередь, активируют клетки естественные киллеры (ЕК), увеличивая антигенспецифичный иммунитет, способствуя T-клеткам памяти, и т.д.) также может быть сосредоточена и усилена, особенно когда фактор переноса введен с дополнительным количеством нанофракции иммуномодулирующих молекул.
Хотя предшествующее описание содержит много подробностей, они не должны восприниматься в качестве ограничения объема настоящего изобретения, но только в качестве снабжения иллюстрациями некоторых из ныне предпочтительных вариантов осуществления. Подобным образом, могут быть разработаны другие варианты осуществления изобретения, которые не отступают от сущности или объема настоящего изобретения. Признаки из различных вариантов осуществления могут быть использованы в сочетании. Поэтому объем изобретения обозначен и ограничен только прилагаемой формулой изобретения и ее правовыми эквивалентами, а не предшествующим описанием. Таким образом, должны быть включены все дополнения, исключения и модификации изобретения, как описано в настоящем документе, которые вписываются в смысл и объем формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУННЫЕ МОДУЛЯТОРЫ, ПРЕПАРАТЫ И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИММУННЫЕ МОДУЛЯТОРЫ, ТЕСТЫ ДЛЯ ОЦЕНКИ АКТИВНОСТИ ИММУННЫХ МОДУЛЯТОРОВ И ПРЕПАРАТОВ, И КОМПОЗИЦИЙ, СОДЕРЖАЩИХ ИХ, И СПОСОБЫ | 2014 |
|
RU2619555C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОБИОТИЧЕСКИЕ БАКТЕРИИ, ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ИММУННЫХ РАССТРОЙСТВ | 2011 |
|
RU2605293C2 |
| Композиция, содержащая пробиотические бактерии, для применения в лечении иммунных расстройств | 2011 |
|
RU2712751C2 |
| ПРИМЕНЕНИЕ ЭКЗОСОМ РАСТЕНИЙ ДЛЯ ДЕМОНСТРАЦИИ МОДУЛИРУЮЩИХ ЭФФЕКТОВ НА КЛЕТКИ ИММУННОЙ СИСТЕМЫ | 2019 |
|
RU2806367C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИММУННЫХ ЗАБОЛЕВАНИЙ | 2000 |
|
RU2203682C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ПРОИЗВОДСТВА Т-КЛЕТОК | 2018 |
|
RU2793344C2 |
| ИММУННАЯ МОДУЛЯЦИЯ | 2014 |
|
RU2709771C2 |
| ИММУНОСТИМУЛИРУЮЩИЕ И ВАКЦИННЫЕ КОМПОЗИЦИИ | 2011 |
|
RU2578420C2 |
| ИММУННАЯ МОДУЛЯЦИЯ | 2014 |
|
RU2662927C2 |
| УЛУЧШЕННЫЕ ИММУННЫЕ КЛЕТКИ С ДВОЙНОЙ кшРНК И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2019 |
|
RU2793922C2 |
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для получения композиции для стимуляции иммунной системы. Для этого композиция содержит: первый экстракт из источников иммунных модуляторов, содержащий экстракт молозива или яиц и имеющий верхний предел молекулярной массы 10000 Да, где первый экстракт содержит фактор переноса и нанофракцию иммуномодулирующих молекул, обладающих молекулярными массами 3000 Да или менее; и второй экстракт из источника иммунных модуляторов, содержащий экстракт молозива или яиц и имеющий верхний предел молекулярной массы 3000 Да, где второй экстракт не содержит фактор переноса, но содержит нанофракцию иммуномодулирующих молекул, обладающих молекулярными массами 3000 Да или менее. Группа изобретений относится также к вариантам указанной композиции и способу модулирования иммунной системы. Использование данных композиций, содержащих нанофракции иммуномодулирующих молекул и фактор передачи, позволяет угнетающе регулировать нежелательную Т-клеточную активность, при этом увеличивая, или стимулирующе регулируя активность Т-хелперных клеток, Т-клеток памяти и ЕК-клеток против патогенов. 4 н. и 9 з.п. ф-лы, 8 табл., 7 пр., 4 ил.
1. Композиция для улучшения иммунной функции, содержащая:
иммуномодулирующий компонент, включающий
первый экстракт из источника иммунных модуляторов, содержащий экстракт молозива или яиц и имеющий верхний предел молекулярной массы 10000 Да, где первый экстракт содержит фактор переноса и нанофракцию иммуномодулирующих молекул, обладающих молекулярными массами 3000 Да или менее; и
второй экстракт из источника иммунных модуляторов, содержащий экстракт молозива или яиц и имеющий верхний предел молекулярной массы 3000 Да, где второй экстракт не содержит фактор переноса, но содержит нанофракцию иммуномодулирующих молекул, обладающих молекулярными массами 3000 Да или менее.
2. Композиция по п.1, где первый экстракт содержит экстракт коровьего молозива.
3. Композиция по п.1, где первый экстракт содержит экстракт куриных яиц.
4. Композиция по любому из пп.1-3, где второй экстракт представляет собой экстракт коровьего молозива.
5. Композиция по п.4, где второй экстракт содержит по массе, по меньшей мере, два процента иммуномодулирующего компонента.
6. Композиция по п.5, где первый экстракт включает:
экстракт коровьего молозива, который содержит по массе 68% иммуномодулирующего компонента; и
экстракт куриных яиц, который содержит по массе 30% иммуномодулирующего компонента.
7. Композиция для улучшения иммунной функции, содержащая:
иммуномодулирующий компонент, в основном состоящий из:
первого порошкообразного экстракта коровьего молозива, имеющего верхний предел молекулярной массы 10000 Да;
второго порошкообразного экстракта коровьего молозива, содержащего нанофракцию иммуномодулирующих молекул, имеющих верхний предел молекулярных масс 3000 Да; и
порошкообразного яичного желтка.
8. Композиция по п.7, где второй порошкообразный экстракт коровьего молозива содержит по массе, по меньшей мере, два процента иммуномодулирующего компонента.
9. Композиция по п.7, где:
первый порошкообразный экстракт коровьего молозива содержит по массе 68% иммуномодулирующего компонента;
второй порошкообразный экстракт коровьего молозива содержит по массе 2% иммуномодулирующего компонента; и
порошкообразный яичный желток содержит по массе 30% иммуномодулирующего компонента.
10. Композиция для улучшения иммунной функции, содержащая:
иммуномодулирующий компонент, в основном состоящий из экстракта по меньшей мере одного из молозива и яиц, имеющего верхний предел молекулярной массы 3000 Да или менее.
11. Способ модулирования иммунной системы субъекта, включающий введение субъекту композиции по любому из пп.1-10.
12. Способ по п.11, где введение увеличивает активность, по меньшей мере, одной из Т-клеток памяти, Т-хелперных клеток и клеток естественных киллеров против патогенов, злокачественных клеток и абберантных или мутировавших клеток.
13. Способ по п.12, где введение снижает нежелательную клеточно-опосредованную иммунную активность.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| FERDINANDI ES et al | |||
| Virulizin(R)-A review of its antineoplastic activity // Expert Opin | |||
| Investig | |||
| Drugs, 1999, v.8, N10, p.p.1721-1735 | |||
Авторы
Даты
2014-06-10—Публикация
2007-09-19—Подача