ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к углеводным полимерам, содержащим маннозу, в частности, к маннанам, их получению и применению в иммуностимулирующих и вакцинных композициях.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Показано, что некоторые полисахариды (полимеры углеводов), содержащие маннозу (например, маннаны), β(1,3) глюкозу (например, глюканы), β(1,4) ацетилированную маннозу (ацеманнаны), β(1,4) N-ацетил-глюкозамин (хитины), и гетерополисахариды, такие как рамногалактуронаны (пектины), оказывают стимулирующее воздействие на иммунную систему.
Связывание полисахаридов с рецепторами лектинов C-типа индуцирует иммуностимулирование, о чем свидетельствует усиление фагоцитоза, пролиферативных ответов, высвобождения цитокинов и других активностей иммунной системы. Благодаря этой иммуностимулирующей активности, было предложено применять эти полисахариды в вакцинных композициях. Особый интерес представляет маннан.
Маннан - это полиманноза, которая узнаваема рецепторами пектинов C-типа, такими как рецептор маннозы (CD206) и DC-SIGN (CD209). Благодаря их присутствию на антиген-презентирующих клетках, эти рецепторы были охарактеризованы по их способности поглощать соединения, содержащие маннозу, фукозу или глюкозу. Например, связывание маннана с рецептором маннозы индуцирует эндоцитоз, после чего он передается в эндосомальный метаболический путь. Ранние исследования маннозилированных антигенов показали, что присутствие остатков маннозы на антигене значительно усиливало поглощение антигена и рестриктированное по главному комплексу гистосовместимости (ГКГ) класса II присутствие антигена дендритными клетками. Конъюгация маннана с по меньшей мере одним антигеном также усиливает его поглощение и презентацию.
Хотя об иммуностимулирующих свойствах некоторых полисахаридов известно достаточно давно, их применение было в существенной степени ограничено научно-исследовательскими задачами. Это вызвано, в частности, жесткими правилами, регулирующими их применение в клинических условиях, в частности, в отношении людей. В результате, существует потребность в дополнительных иммуностимулирующих и вакцинных композициях для применения с целью лечения или профилактики заболеваний, а также в надежных способах их получения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Стремясь разработать способы получения композиций, содержащих углеводные полимеры, включающие маннозу, с воспроизводимыми характеристиками для применения в терапевтических целях, авторы настоящего изобретения с удивлением обнаружили, что субпопуляция маннанов, имеющих определенный размер и/или содержание альдегидов, обладает усиленными свойствами по сравнению с другими субпопуляциями, а также по сравнению с исходной популяцией.
Таким образом, первым объектом настоящего изобретения является создание иммуностимулирующей композиции, содержащей маннаны, в которой по меньшей мере 75% маннанов имеет вес более чем приблизительно 1000 кДа.
В одном из вариантов осуществления данного изобретения маннаны окислены и, следовательно, содержат альдегидные группы. Эта особенно удобно, если маннаны предназначены для конъюгации с по меньшей мере одним антигеном или кодирующей его нуклеиновой кислотой.
В одном из варианте осуществления распределение маннанов по размерам с последующим мечением аминонафталин-1,3,6-трисульфоновой кислотой (АНТС) охватывает диапазон от приблизительно 150 до приблизительно 250 Да (по белковым стандартам) и/или от приблизительно 800 до приблизительно 3000 кДа (по углеводным стандартам).
Другим объектом настоящего изобретения является то, что оно направлено на создание иммуностимулирующей композиции, содержащей окисленные маннаны, при этом по меньшей мере 75% маннанов содержит по крайне мере 150 альдегидных групп.
Другим объктом настоящего изобретения является то, что оно направлено на создание иммуностимулирующей композиции, содержащей окисленные маннаны, при этом по меньшей мере 75% маннанов имеет вес более чем приблизительно 1000 кДа и содержит по меньшей мере 150 альдегидных групп.
Более того, предложена вакцинная композиция, содержащая маннаны и по меньшей мере один антиген или кодирующую его нуклеиновую кислоту, при этом по меньшей мере 75% маннанов имеет вес более чем приблизительно 1000 кДа.
В одном из вариантов осуществления маннаны окислены.
В следующем варианте осуществления окисленные маннаны ковалентно конъюгированы с по меньшей мере одним антигеном.
В другом варианте осуществления окисленные маннаны конъюгированы с по меньшей мере одной нуклеиновой кислотой через поликатионы.
В одном из вариантов осуществления по меньшей мере 75% окисленных маннанов содержит по меньшей мере 150 альдегидных групп до конъюгации с по меньшей мере одним антигеном или кодирующей его нуклеиновой кислотой.
В одном из вариантов осуществления распределение маннанов по размерам до конъюгации с по меньшей мере одним антигеном или кодирующей его нуклеиновой кислотой и после мечения аминонафталин-1,3,6-трисульфоновой кислотой (АНТС) охватывает диапазон от приблизительно 150 до приблизительно 250 Да (по белковым стандартам) и/или от приблизительно 800 до приблизительно 3000 кДа (по углеводным стандартам).
Маннаны могут быть получены из любого источника, такого как грибы, более предпочтительно - дрожжи.
Антиген может быть получен из любого источника, например, вирусный, бактериальный, протозойный, грибной, опухолевый антиген, аутоантиген или аллерген. Антиген может быть, например, целым организмом, белком или антигенным пептидом.
В одном из вариантов осуществления композиция по изобретению разработана для введения через слизистую оболочку, местного, внутрикожного, внутримышечного, подкожного или внутривенного введения.
В одном из вариантов осуществления композиция по изобретению дополнительно содержит по меньшей мере один приемлемый носитель.
Другим объектом является то, что настоящее изобретение направлено на создание способа индуцирования и/или усиления иммунного ответа у субъекта, данный способ включает введение субъекту композиции по изобретению.
В одном из вариантов осуществления способ включает введение по меньшей мере одного антигена или кодирующей его нуклеиновой кислоты.
В одном из вариантов осуществления маннаны и по меньшей мере один антиген или нуклеиновую кислоту вводят последовательно или одновременно. В предпочтительном варианте осуществления их вводят в составе одной и той же композиции.
В одном из вариантов осуществления маннаны и по меньшей мере один антиген или кодирующую его нуклеиновую кислоту вводят в виде вакцинной композиции по изобретению.
В одном из вариантов осуществления, когда антиген происходит из инфекционного агента или является его мутантной/производной формой, способ позволяет провести иммунизацию субъекта против патогена (инфекционного агента). В другом варианте осуществления, когда антиген происходит из раковой клетки или является ее мутантной/производной формой, способ применяется для лечения рака.
В одном из вариантов осуществления изобретения композицию вводят через слизистую оболочку, местно, внутрикожно, внутримышечно, подкожно или внутривенно.
Также предложено применение композиции по изобретению для изготовления лекарственного препарата для индуцирования и/или усиления иммунного ответа у субъекта.
Дополнительно предложено применение композиции по изобретению для индуцирования и/или усиления иммунного ответа у субъекта.
Композиции по изобретению также можно применять для прайминг-методов in vitro или ex vivo. Соответственно, дополнительным объектом настоящего изобретения является создание способа активации макрофагов, дендритных клеток и/или цитотоксических T-лимфоцитов (ЦТЛ) in vitro или ex vivo, включающего контактирование клеток с композицией по изобретению. Праймированные клетки можно вводить субъекту, нуждающемуся в этом.
Популяция маннанов по изобретению, отобранная по размеру и/или альдегидному содержанию, также может применяться для доставки по меньшей мере одной нуклеиновой кислоты в клетку. Таким образом, дополнительным объектом изобретения является создание композиции для доставки по меньшей мере одной нуклеиновой кислоты в клетку, при этом композиция содержит по меньшей мере одну нуклеиновую кислоту и маннаны, в которой 75% маннанов имеет вес более чем приблизительно 1000 кДа.
В одном из вариантов осуществления изобретения маннаны окислены.
В дополнительном варианте осуществления окисленные маннаны конъюгированы с по меньшей мере одной нуклеиновой кислотой через поликатионные области.
В дополнительном варианте осуществления по меньшей мере 75% окисленных маннанов содержит по меньшей мере 150 альдегидных групп перед конъюгацией с по меньшей мере одной нуклеиновой кислотой.
Другим объектом настоящего изобретения является способ доставки по меньшей мере одной нуклеиновой кислоты в клетку, включающий установление контакта клетки с композицией по изобретению, указанной выше.
В одном из вариантов осуществления изобретения клетка находится в системе in vitro или ex vivo. В другом варианте осуществления клетка находится в системе in vivo.
В одном из вариантов осуществления изобретения нуклеиновую кислоту доставляют в клетку с целью осуществления генной терапии или генетической вакцинации.
Также предложено применение композиции для изготовления лекартсвенного средства для генной терапии или генетической вакцинации.
Дополнительно предложено применение композиции для генной терапии или генетической вакцинации.
Другим объектом настоящего изобретения является способ получения композиции по изобретению, включающий:
i) получение композиции, содержащей маннаны,
и) фракционирование композиции, полученной на этапе i), на основании размера,
iii) выделение одной или нескольких фракций, содержащих маннаны, при этом по меньшей мере 75% маннанов в одной или нескольких фракциях имеет вес более чем приблизительно 1000 кДа, и
iv) необязательно, смешивание фракции, полученной на этапе iii), с по меньшей мере одним другим соединением.
В одном из вариантов осуществления изобретения способ дополнительно включает этап окисления маннанов перед этапом iv). В дополнительном варианте осуществления по меньшей мере 75% окисленных маннанов содержит по меньшей мере 150 альдегидных групп.
В одном из вариантов осуществления изобретения по меньшей мере одно другое соединение является антигеном или кодирующей его нуклеиновой кислотой.
Другим объектом настоящего изобретения является способ получения вакцинной композиции по изобретению, включающий:
i) получение композиции, содержащей маннаны, при этом по меньшей мере 75% маннанов имеет вес более чем приблизительно 1000 кДа; и
ii) смешивание или конъюгацию композиции, полученной на этапе i), с по меньшей мере одним антигеном или кодирующей его нуклеиновой кислотой с целью получения вследствие этого вакцинной композиции.
В одном из вариантов осуществления изобретения способ дополнительно включает окисление маннанов перед этапом ii). В дополнительном варианте осуществления по меньшей мере 75% окисленных маннанов содержит по меньшей мере 150 альдегидных групп.
Для получения композиций по изобретению и, в более широком смысле, композиций, содержащих углеводный полимер, включающий маннозу, предпочтительно, чтобы исходная популяция (популяции) углеводного полимера, содержащего маннозу (например, маннана), была схожей в разных сериях и/или имела в существенной степени высокое содержание соединений углеводного полимера с повышенным молекулярным весом.
Соответственно, другим объектом настоящего изобретения является способ выбора композиции, содержащей углеводный полимер, включающий маннозу, способ включает:
i) получение композиции, содержащей углеводный полимер, включающий маннозу,
ii) анализ распределения по размеру и/или содержанию альдегида композиции, полученной на этапе i), и
iii) выбор композиции, если она имеет требуемое распределение по размеру и/или содержание альдегида.
В одном из вариантов осуществления изобретения распределение по размеру анализируют при помощи:
i) окисления части композиции,
ii) мечения окисленного продукта, полученного на этапе i), с помощью АНТС и
iii) анализа распределения по размеру при помощи разделения меченного АНТС продукта, полученного на этапе ii), с помощью ДСН-ПААГ.
В одном из вариантов осуществления изобретения содержание альдегидных групп анализируют при помощи:
i) окисления части композиции,
ii) проведения реакции окисленного продукта, полученного на этапе i), с 3-(2-пиридилдитио)пропионилгидразидом (ПДПГ),
iii) проведения реакции продукта, полученного на этапе ii), с восстанавливающим агентом для отщепления 2-пиридинтиона и
iv) измерения количества отщепившегося 2-пиридинтиона.
В одном из вариантов осуществления изобретения восстанавливающий агент является дитиотреитолом (ДТТ).
В одном из вариантов осуществления изобретения количество отщепившегося 2-пиридинтиона измеряют при помощи спектрофотометрии с плотностью поглощения при длине волны 343 нм (OD343).
В одном из вариантов осуществления изобретения композицию окисляют при помощи перйодата натрия.
В одном из вариантов осуществления изобретения способ дополнительно включает определение чистоты композиции, полученной на этапе i). Например, чистоту можно определить с помощью количественной оценки содержания сахара углеводного полимера при помощи:
i) реакции композиции с резорцинол-(1,3-дигидроксибензолом) в присутствии гидратированной серной кислоты,
ii) измерения плотности поглощения при 430-480 нм (OD430-480) и
iii) сравнения показателя плотности поглощения со стандартной пробой.
Важным требованием для получения разрешения регуляторного органа является соблюдение правил надлежащей практики организации производства фармацевтических продуктов. Однако получение многих, если не всех, композиций, содержащих углеводные полимеры, включающие маннозу, дает в результате в высокой степени гетерогенные популяции, что затрудняет их четкую и стабильную идентификацию. Особенно это касается полимеров, полученных из природных источников, таких как дрожжи. В настоящем изобретении не только идентифицирована новая композиция, содержащая маннаны с более выраженными свойствами, но изобретение также направлено на создание способа получения таких композиций и, в более широком смысле, композиций, содержащих углеводный полимер, включающий маннозу, с четко установленными свойствами, что делает их более пригодными для получения разрешения регуляторного органа.
Соответственно, другим объектом настоящего изобретения является способ получения композиции, включающей углеводный полимер, содержащий маннозу, способ включает:
i) получение композиции, содержащей углеводный полимер, включающий маннозу, при этом углеводный полимер содержит альдегидные группы,
ii) фракционирование композиции на основании размера и
iii) выбор одной или нескольких фракций, содержащих углеводный полимер с требуемым распределением по размеру, полученных на этапе ii), с целью получения композиции.
В соответствии с другим вариантом изобретения, процесс включает:
i) получение композиции, содержащей углеводный полимер, включающий маннозу,
ii) фракционирование композиции на основании размера,
iii) окисление одной или нескольких фракций, полученных на этапе ii), и
iv) выбор одной или нескольких фракций, содержащих углеводный полимер с требуемым распределением по размеру и/или содержанием альдегида, полученных на этапе iii), с целью получения композиции.
В одном из вариантов осуществления альтернативного способа одну или несколько фракций окисляют с помощью перйодата натрия.
В одном из вариантов осуществления альтернативного способа перед этапом ii) композицию выбирают при помощи способа по изобретению.
Этап ii) в любом способе можно проводить при помощи любого подходящего способа, включая в качестве неограничивающих примеров фильтрацию тангенциальную поточную фильтрацию, эксклюзионную хроматографию и/или ультрафильтрацию.
В другом варианте осуществления любой способ дополнительно включает проведение анализа альдегидного содержания в одной или нескольких фракциях перед отбором. В одном из вариантов осуществления альдегидное содержание анализируют при помощи:
i) проведения реакции части одной или нескольких фракций с ПДПГ,
ii) проведения реакции продукта, полученного на этапе i), с восстанавливающим агентом для отщепления 2-пиридинтиона, и
iii) измерения количества отщепившегося 2-пиридинтиона.
В одном из вариантов осуществления изобретения восстанавливающий агент является ДТТ.
В одном из вариантов осуществления изобретения количество высвободившегося 2-пиридинтиона измеряют при помощи спектрофотометрии с плотностью поглощения при длине волны 343 нм (OD343).
В дальнейшем варианте осуществления любой способ дополнительно включает проведение анализа распределения по размеру для выбранных одной или нескольких фракций. Например, распределение по размеру анализируется при помощи;
i) мечения части одной или нескольких фракций с помощью АНТС, и
ii) анализа распределения по размеру при помощи разделения одной или нескольких фракций, меченных АНТС, полученных на этапе i), с помощью ДСН-ПААГ.
В одном из вариантов осуществления изобретения углеводный полимер, содержащий маннозу, является маннаном, и
а) молекулярный вес маннана в выбранной фракции составляет более чем приблизительно 1000 кДа, и распределение по размеру после мечения с помощью АНТС охватывает диапазон от приблизительно 150 до приблизительно 250 кДа (по белковым стандартам) и/или от приблизительно 800 до приблизительно 3000 кДа (по углеводным стандартам),
б) молекулярный вес маннана в выбранной фракции составляет от приблизительно 300 до приблизительно 1000 кДа, и распределение по размеру после мечения с помощью АНТС охватывает диапазон от приблизительно 150 до приблизительно 175 кДа (по белковым стандартам) и/или от приблизительно 400 до приблизительно 1000 кДа (по углеводным стандартам),
в) молекулярный вес маннана в выбранной фракции составляет от приблизительно 100 до приблизительно 300 кДа, и распределение по размеру после мечения с помощью АНТС охватывает диапазон от приблизительно 80 до приблизительно 125 кДа (по белковым стандартам) и/или от приблизительно 90 до приблизительно 400 кДа (по углеводным стандартам),
г) молекулярный вес маннана в выбранной фракции составляет от приблизительно 50 до приблизительно 100 кДа, и распределение по размеру после мечения с помощью АНТС охватывает диапазон от приблизительно 60 до приблизительно 80 кДа (по белковым стандартам) и/или от приблизительно 50 до приблизительно 175 кДа (по углеводным стандартам), или
д) молекулярный вес маннана в выбранной фракции составляет от приблизительно 30 до приблизительно 50 кДа, и распределение по размеру после мечения с помощью АНТС охватывает диапазон от приблизительно 50 до приблизительно 60 кДа (по белковым стандартам) и/или от приблизительно 20 до приблизительно 50 кДа (по углеводным стандартам).
Любое описанное в этом документе осуществление следует рассматривать как применимое, с внесением соответствующих изменений, к любому другому осуществлению, если особо не указано иначе.
Настоящее изобретение не ограничено по объему конкретными осуществлениями, описанными в этом документе, которые предназначены исключительно в качестве примеров. Функционально эквивалентные продукты, композиции и способы полностью находятся в объеме изобретения, как описано в настоящем описании.
В описании настоящего изобретения термин «содержать» или его варианты, такие как «содержит» или «содержащий», следует понимать как означающие включение указанного элемента, целого или этапа или группы элементов, целых или этапов, но не исключение любого другого элемента, целого или этапа, или группы элементов, целых или этапов.
Далее изобретение описывается посредством последующих неограничивающих примеров и со ссылками на сопутствующие фигуры.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1: Способ фракционирования при помощи концентраторов Centriprep.
Фиг.2: Схематическое изображение способа количественного определения альдегидных остатков в окисленном маннане.
Фиг.3: Схематическое изображение модификации окисленного маннана с помощью АНТС.
Фиг.4: Схематическое изображение конъюгации белков с окисленным маннаном.
Фиг.5: Маннаны пометили с помощью флуоресцеинизотиоцианата (ФИТЦ) и связывание при различных концентрациях с клетками гепатомы человека huh7 измерили при помощи проточной цитометрии.
Фиг.6: Созревание дендритных клеток костномозгового происхождения (ДККП) в присутствии цельного препарата маннана и фракций маннана. Увеличение количества ко-стимулируемых молекул, CD40, CD80 и CD86 измеряли при помощи проточной цитометрии во временных точках 6 (фиг.6A), 24 (фиг.6B) и 48 (фиг.6C) часов. Пробы анализировали при различных дозах.
Фиг.7: Созревание клеток ДККП в присутствии цельного препарата маннана, фракции маннана >1000 кДа и фракции маннана >300 кДа. Повышение экспрессии ко-стимулируемых молекул CD40 (фиг.7A) и CD86 (фиг.7B) измеряли при помощи проточной цитометрии. Пробы анализировали при различных дозах во временной точке 48 ч.
Фиг.8: Кривая зависимости поглощения от концентрации для анализа при помощи резорцинола, демонстрирующая различное содержание маннозы во фракциях маннана.
Фиг.9: Анализ меченных АНТС фракций маннана в ДСН-ПАА геле в нативных условиях.
Фиг.10: Анализ меченных АНТС фракций маннана в ДСН-ПАА геле.
Фиг.11: Сканированные ДСН-ПАА гели с меченными АНТС фракциями маннана с указанием относительной подвижности.
Фиг.12: Стандартные кривые, полученные при помощи программного обеспечения Quantity one.
Фиг.13: Относительный молекулярный вес (по белковым стандартам).
Фиг.14: Относительный молекулярный вес (по углеводным стандартам).
Фиг.15: Анализ цельного маннана и фракций маннана, конъюгированных с MUC1-FP в ДСН-ПАА гелях. Звездочкой отмечены конъюгаты, имеющие такое же соотношение MUC1-FP: маннан, как и цельный конъюгат маннан-MUC1-FP.
Фиг.16: MUC1-специфические ответы с участием IFNγ в спленоцитах мышей, иммунизированных в 0, 10, 17 день при помощи 10 нг MUC1-FP, MFP или >1000 MFP.
Фиг.17: Общее содержание IgG, IgG1 и IgG2a в сыворотке, выработанной против MUC1 у мышей, иммунизированных в 0, 10, 17 день при помощи 10 нг MUC1-FP, MFP или >1000 MFP.
Фиг.18: Спецификации маннана, полученные от поставщика.
Фиг.19A: Анализ серий маннана при помощи теста с резорцинолом.
Фиг.19B: Стандартная кривая для маннозы, полученная при помощи теста с резорцинолом.
Фиг.20: Сравнение различных серий маннана, полученных от компании Sigma, при помощи количественного определения остатков альдегида после окисления перйодатом.
Фиг.21: Кривая зависимости уровня флуоресценции от концентрации для различных серий маннана после проведения реакции с АНТС.
Фиг.22: Конъюгация FP с окисленным маннаном фракции >1000 кДа. Молекулярный вес стандартов, FP и >1000 MFP разделяли в ДСН-ПАА гелях (4-20%) и окрашивали кумасси голубым.
Фиг.23: MUC1-специфические вторичные иммунные ответы T-клеток. На аллогенные дендритные клетки (BC16) импульсно воздействовали 10 и 20 мкг/мл >1000 MFP или FP и применяли для индукции вторичных иммунных ответов с участием внутриклеточного IFNγ в MUC1-специфичной линии CD8 (A) и CD4 (B) T-клеток.
Фиг.24: Конъюгация pTrc (MUC1-VNTR) с окисленным маннаном фракции >1000 кДа. Стандарты молекулярного веса, pTrc, и >1000 pTrc разделяли в ДСН-ПАА гелях (4-20%) и окрашивали кумасси голубым.
Фиг.25: MUC1-специфические вторичные иммунные ответы T-клеток. На аллогенные дендритные клетки (BC17A) импульсно воздействовали 20 и 40 мкг/мл фракции >1000 кДа pTrc или pTrc и применяли для индукции вторичных иммунных ответов с участием внутриклеточного IFNγ в pTrc(MUC1)-специфичной линии CD8 T-клеток, полученной от донора BC13.
Фиг.26: MUC1-специфические вторичные иммунные ответы T-клеток. На аутологические дендритные клетки импульсно воздействовали 20 мкг/мл фракцией>1000 кДа окисленного маннана в конъюгате с pTrc или pTrc и применяли для индукции вторичных иммунных ответов с участием внутриклеточного IFNγ в MFP-специфичной линии CD8 T-клеток, полученной от донора BC17K.
Фиг.27: Конъюгация MART-1 с окисленным маннаном фракции >1000 кДа. Стандарты молекулярного веса, MART-1, фракции >1000 маннан-MART-1 разделяли в ДСН-ПАА гелях (4-20%) и окрашивали кумасси голубым.
Фиг.28: Праймирование MART-1-специфических ответов (1 стимуляция). Мононуклеарные клетки периферической крови (PBMCs), полученные от донора BC28, праймировали с помощью белка MART-1 или конъюгата MART-1 с фракцией окисленного маннана >1000 кДа, как описано в Примере 1. Продемонстрирована индукция MART-1-специфических опосредованных CD8 вторичных иммунных ответов с участием внутриклеточного IFNγ в клетках T2, импульсно обработанных аналогом MART-1 и пептидным аналогом.
Фиг.29: Праймирование MART-1-специфических ответов (2 стимуляции). Мононуклеарные клетки периферической крови (РВМС), полученные от донора BC28 и BC29, праймировали с помощью белка MART-1 или конъюгата MART-1 с фракцией окисленного маннана >1000 кДа, как описано в Примере 1. Продемонстрирована индукция MART-1-специфичнеских опосредованных CD8 вторичных иммунных ответов с участием внутриклеточного IFNγ белком MART-1 и конъюгатом фракции окисленного маннана >1000 кДа.
Фиг.30: H1N1-специфические гуморальные иммунные ответы на H1N1 и смесь H1N1 с фракцией маннана >1000 кДа. Мышей иммунизировали посредством интраназального введения на 0 и 14 день 1 мкг H1N1 либо отдельно, либо в смеси с фракцией маннана >1000 кДа. Через десять дней после заключительной иммунизации отбирали пробы сыворотки и легочного смыва и проводили испытание на активность антител против H1N1, IgG1, IgG2a и IgA при помощи анализа ELISA.
ОПИСАНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1; пептид HLA-A2-эпитопа, специфического в отношении белка Мелан/MART-1 (нативный)
SEQ ID NO: 2: пептид HLA-A2-эпитопа, специфического в отношении белка Мелан/MART-1 (аналог)
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Общие способы и определения
Если специально не указано иначе, все технические и научные термины, использованные в этом документе, необходимо рассматривать как имеющие общепринятые значения для специалиста в данной области техники (например, в области клеточных культур, молекулярной генетики, технологии вакцин, иммунологии, иммуногистохимии, белковой химии и биохимии).
Если не указано иначе, способы в отношении рекомбинантных белков, клеточных культур и иммунологические способы, применяемые в настоящем изобретении, являются стандартными способами, хорошо известными специалистам в данной области. Такие способы описаны и объяснены в таких литературных источниках, как: J. Perbal, A Practical Guide to Molecular Cloning, John Wiley and Sons (1984), Maniatis et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory Press (1982), J. Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory Press (1989), T.A. Brown (editor), Essential Molecular Biology: A Practical Approach, Volumes 1 and 2, IRL Press (1991), D.M. Glover and B.D. Hames (editors), DNA Cloning: A Practical Approach, Volumes 1-4, IRL Press (1995 and 1996), F.M. Ausubel et al. (editors). Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience (1988, включая все обновленные издания до настоящего времени), Е. Harlow and D. Lane (editors), Antibodies: A Laboratory Manual, Cold Spring Harbour Laboratory (1988) and J.E. Coligan et al. (editors). Current Protocols in Immunology, John Wiley & Sons (1991, включая все обновленные издания до настоящего времени).
Использованные в этом документе термины «приблизительно» и «примерно» в общем случае будут означать в пределах 20%, более предпочтительно - в пределах 10% и еще более предпочтительно - в пределах 5% от указанного значения или диапазона.
Термин «и/или», например, «X и/или Y» следует понимать как обозначающий «X и Y» или «X или Y» и следует трактовать как четко раскрывающий оба значения или каждое значение по отдельности.
«Субъект» может являться любым организмом, при этом при введении композиции по изобретению его иммунный ответ индуцируется и/или усиливается. В предпочтительном варианте осуществления субъект является животным, более предпочтительно - млекопитающим или птицей. В наиболее предпочтительном варианте осуществления субъект является человеком. Другие предпочтительные варианты осуществления включают домашних/ручных животных, таких как кошки и собаки; домашний скот, такой как лошади, крупный рогатый скот, овцы, свиньи и козы, домашнюю птицу или диких животных.
Маннаны и другие углеводные полимеры, содержащие маннозу
Авторы настоящего изобретения неожиданно обнаружили, что высокомолекулярные маннаны (т.е., обладающие весом более чем приблизительно 1000 кДа) обладают более высокой иммуностимулирующей активностью по сравнению с меньшими маннанами или их смесью. Таким образом, композиции по изобретению содержат маннаны, при этом по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 99%, и еще более предпочтительно, все маннаны в составе композиции имеют вес более чем приблизительно 1000 кДа.
Также авторы настоящего изобретения неожиданно обнаружили, что окисленные маннаны, содержащие по меньшей мере 150 альдегидных групп, обладают более высокой стимулирующей активностью, чем окисленные маннаны, содержащие менее 150 альдегидных групп, или их смесь. Таким образом, композиции по изобретению содержат маннаны, при этом по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 99%, и еще более предпочтительно все маннаны в составе композиции содержат по меньшей мере 150 альдегидных групп каждый.
Термин «маннаны», использованный в настоящем документе, обозначает линейные или разветвленные полисахариды, состоящие только из маннозы, и не относится к полисахаридам из модифицированной, например, ацетилированной маннозы (ацеманнанам) или к замещенным маннанам, имеющим маннозный остов, но не маннозные боковые группы (например, галактоманнаны, состоящие из маннозного остова с галактозными боковыми группами).
Маннаны, применимые в композициях по изобретению, обнаружены, например, в грибах, более предпочтительно - в дрожжах. В случае разветвленных маннанов из Saccharomyces cerevisiae (пекарских дрожжей) маннаны состоят из соединенных α-(1→6) маннопиранозильных остатков, образующих структуру остова, замещенных по O-2 атомам боковыми цепями α-D-маннопиранозила, α-D-маннопиранозил-α-(1→2)-α-D-маннопиранозила и α-D-маннопиранозил-α-(1→3)-α-D-маннопиранозил-α-(1→2)-α-D-маннопиранозила. Кроме того, маннаны из S. cerevisiae также могут быть фосфорилированы (Barreto-Bergter and Gorin, 1983; Vinogradov et al., 1998).
Маннаны, предпочтительно, выделены из клеточных стенок грибов, более предпочтительно - дрожжей. В одном из вариантов осуществления изобретения маннаны могут быть выделены из генетически модифицированных дрожжей, созданных преимущественно для экспрессии высокомолекулярных маннанов, предпочтительно - маннанов с весом более чем 1000 кДа.
Маннаны, содержащие альдегидные группы, могут быть получены посредством окисления маннанов, полученных, например, из дрожжей. Наиболее распространенным способ введения альдегидов в углеводный полимер является опосредованное перйодатом (NaIO4) окисление вицинальных диолов (см. схему на фиг.2). Другие способы окисления доступны в публикациях: М.L. Wolfrom (editor), Periodate oxidation of carbohydrates, Advances in Carbohydrate Chemistry, Volume 11, pages 1-40 (1956).
В предпочтительном варианте осуществления изобретения маннаны окисляют с помощью NaIO4 с получением полиальдегидов, которые затем конъюгируют с по меньшей мере одним антигеном или кодирующей его нуклеиновой кислотой.
В одном из вариантов осуществления изобретения высокомолекулярные маннаны (т.е., с весом более чем приблизительно 1000 кДа) получают фракционированием по размеру цельного экстракта маннана, полученного, например, из дрожжей, таких как Saccharomyces cerevisiae. В этом примере цельный маннан может быть получен из S. cerevisiae способами, известными специалистам в данной области, включая экстрагирование горячей водой культивируемых клеток или высушенных распылением клеток и экстрагирование растворителем. Маннаны, полученные из S. cerevisiae, можно приобрести у поставщика, например, у компании Sigma (Сент-Луис, Миссури, США), и в одном из вариантов осуществления изобретения далее их можно фракционировать с получением композиции высокомолекулярных маннанов.
В одном из вариантов осуществления изобретения композиция высокомолекулярных маннанов в значительной степени свободна от рибозы, нуклеиновых кислот, рибонуклеиновых кислот, белка и/или других углеводов.
Способы по изобретению относятся к получению композиций по изобретению и, в более широком смысле, композиций, содержащих углеводные полимеры, включающие маннозу.
Под термином «углеводный полимер, включающий маннозу» подразумевается любое мультисубъединичное соединение, содержащее, более предпочтительно - состоящее из, субъединиц маннозы (т.е., маннозных мономерных единиц), или его варианты. Неограничивающими примерами являются маннан, галактоманнан и ацеманнан. В одном из вариантов осуществления изобретения углеводный полимер содержит альдегидные группы. В предпочтительном варианте осуществления углеводный полимер окислен с получением полиальдегида.
Получение углеводных полимеров, содержащих маннозу
Способы для разделения углеводов и Сахаров хорошо известны специалистам в данной области техники (см. Z. El Rassi (editor). Carbohydrate analysis by modern chromatography and electrophoresis. Journal of Chromatography, volume 66, Elsevier Science (2002)).
Фракционирование по размеру
В одном из вариантов осуществления изобретения фракционирование по размеру композиции, содержащей углеводный полимер, включающий маннозу, более предпочтительно - композиции, содержащей маннаны, проводят при помощи тангенциальной поточной фильтрации (TFF), также называемой фильтрованием в перекрестном потоке (CFF). Тангенциальная поточная фильтрация - это способ, при котором поток продукта (исходного) подают тангенциально вдоль поверхности мембраны, при этом большая часть раствора циркулирует обратно в подающий резервуар. Быстрый поток исходного раствора вдоль мембраны «вычищает» поверхность, снижая концентрационную поляризацию (концентрации продукта на поверхности мембраны). Это предотвращает образование загрязняющих веществ, которые могут закупоривать поры на поверхности мембраны. Быстрый поперечный поток создает спад давления, в результате чего часть исходного раствора и растворенных молекул, размер которых меньше пор мембраны, проходит через мембранный фильтр. Раствор, который проходит через мембрану, называют фильтратом или пермеатом. Молекулы или частицы, превосходящие по размеру поры мембраны, остаются в исходном растворе и эффективно концентрируются.
Мембранную фильтрацию можно классифицировать как способ «микрофильтрации» либо «ультрафильтрации». Мембраны для микрофильтрации с размером пор обычно от 0,1 микрона до 1 микрона, в основном применяют для очистки от примесей, стерилизации и удаления микрочастиц или для сбора клеток. Мембраны для ультрафильтрации с намного более мелкими порами, имеющими размеры от 0,001 до 0,1 микрона, используют для концентрирования и обессоливания растворенных молекул (белков, пептидов, нуклеиновых кислот, углеводов и других биомолекул), замены буферов, фракционирования и очистки воды. Мембраны для ультрафильтрации в скорее классифицируют по границе отсечки по молекулярному весу задерживаемых компонентов (MWCO), чем по размеру пор.
В другом варианте осуществления изобретения фракционирование по размеру композиции, содержащей углеводный полимер, включающий маннозу, проводят при помощи эксклюзионной хроматографии.
Основные принципы эксклюзионной хроматографии хорошо известны специалистам в данной области техники и объяснены в публикации: «Gel filtration: Principles and Methods, GE Healthcare». Можно легко выбрать и эффективно применять подходящие колонки для фракционирования в конкретных диапазонах с целью разделения указанных выше фракций, например, сефакрил S-100 HR, сефакрил S-200 HR, сефакрил S-300 HR, сефакрил S-400 HR и сефакрил S-500 HR или их эквивалентнов. Аналогично, можно использовать сефарозные среды или их эквивалентны, например, сефарозу 6B, 4B, 2B. В одном из вариантов осуществления изобретения сефакрил S-400 HR используют для фракционирования композиции, включающей углеводный полимер, содержащий маннозу.
В еще одном варианте осуществления изобретения фракционирование по размеру композиции, включающей углеводный полимер, содержащий маннозу, проводят при помощи ультрафильтрации.
Ультрафильтрацию пробы можно проводить при помощи молекулярных мембран с соответствующей границей отсечки по молекулярному весу задерживаемых компонентов. Конкретные мембраны и способы, используемые для воздействия на фракционирование, широко известны специалистам в данной области.
Специалист в данной области техники также сможет определить, что фракционирование по размеру композиции, включающей углеводный полимер, содержащей маннозу, также можно проводить при помощи центрифугирования в градиенте плотности.
В предпочтительных осуществлениях пробу перед фракционированием подвергают по меньшей мере частичной очистке для удаления примесей, например, рибозы, нуклеиновых кислот, включая ДНК и РНК, белков и/или углеводов, не содержащих маннозу. Очистку можно проводить в сочетании с другими хроматографическими способами, включая аффинную, ионообменную и гидрофобную хроматографию. Чистоту композиции можно определить, измерив содержание в ней маннозы, как описано ниже.
Одним из способов удаления неуглеводных компонентов является применение пищеварительных ферментов для расщепления неуглеводных компонентов с последующим фракционированием по размеру для удаления продуктов расщепления. Пищеварительные ферменты, включая проназу, рибонуклеазу, ДНКазу и протеазы, хорошо известны специалистам в данной области и описаны в различных учебниках, например, в Maniatis et al. (1982), см. выше. Протеазы, используемые для расщепления белков, включают эндо- и экзо-пептидазы, проназу, сериновые протеазы, такие как трипсин, химотрипсин и субтилизин, тиоловые протеазы, такие как папаин, и кальций-зависимые протеазы, такие как термолизин.
В другом варианте, неуглеводные компоненты можно удалять при помощи аффинной хроматографии, например, при помощи ДНК- или РНК-связывающих матриц (Maniatis et al., 1982, см. выше). Другим способом является очистка углеводного полимера от загрязняющих компонентов при помощи матриц, связывающих полисахариды, таких как пектины.
Согласно способам по изобретению в выбранной фракции можно определить распределение по размеру, содержание альдегидов и/или маннозы в углеводном полимере, включающем маннозу. Проведение такой валидации может быть важным для получения разрешения регуляторного органа для использования препарата на людей.
Распределение по размеру
Перед и/или после разделения на фракции можно провести определение распределения молекул в пробе по размеру. Если этот анализ проводят перед разделением на фракции, он помогает выбрать исходную композицию углеводного полимера для разделения на фракции. Например, если в исходной композиции большинство видов полимера имеет молекулярный вес ниже 1000 кДа, то композицию можно отбраковать и выбрать для разделения на фракции другую серию, обладающую более высоким содержанием высокомолекулярных видов углеводного полимера. В противоположность этому, анализ распределения по размерам извлеченной фракции необходим для подтверждения или валидации способа разделения на фракции. Это будет важно при получении разрешения регуляторного органа для применения этих углеводных полимеров на людях.
Распределение по размеру углеводных полимеров в составе композиции можно определить при помощи реакции окисленной пробы с АНТС (см. схему на фиг.3) и разделения меченной АНТС пробы в ДСН-ПААГ. Сравнение подвергнутой разделению меченной АНТС пробы с белковыми и/или углеводными стандартами позволит определить распределение по размерам для указанной пробы.
Использованное в настоящем документе выражение «белковые и/или углеводные стандарты» относится к композиции известных белков или углеводов с различным молекулярным весом, предназначенной для использования в качестве стандартов молекулярного веса в ДСН-ПААГ. Композиция разработана таким образом, что она дает четкие, хорошо разделяемые полосы, которые служат маркерами для оценки молекулярного веса проб, подвергнутых электрофоретическому разделению на соседних дорожках одного и того же геля. Стандарты могут быть предварительно окрашены (чтобы можно было легко проводить визуальное определение диапазонов молекулярного веса во время электрофореза) или не окрашены. Для применения при электрофорезе доступно множество стандартов, которые можно приобрести, например, у компании Invitrogen или Bio-rad. Обычно стандарты поставляют в готовой к применению форме, при этом нет необходимости восстанавливать, предварительно смешивать или добавлять наполняющие красители. Эти стандарты сохраняют стабильность от лота к лоту и подвергаются строгому контролю качества в соответствующих гелях, чтобы обеспечить постоянство скорости перемещения и интенсивности полос.
Содержание альдегидов
Содержание альдегидов в пробе также можно определять перед и/или после разделения на фракции с целью отбора серии и/или валидации фракции.
В одном из вариантов осуществления изобретения содержание альдегиднов в пробе определяют с помощью количественной оценки числа альдегидных остатков в пробе после окисления с помощью NaIO4. Например, композиция, содержащая маннаны, может быть выбрана для разделения на фракции, если каждый маннан содержит приблизительно 90-200 альдегидных остатков.
Способ включает изначально окисление пробы, например, с помощью реакции 1,4 мг пробы в 100 мкл 0,1 М фосфатного буфера при pH 6,0 с 0,01 М NaIO4 в течение 1 ч на льду в темноте. После этого реакцию останавливают добавлением 10 мкл этандиола и оставляют реакцию еще на 1/2 ч перед нанесением на колонку PD1O, предварительно уравновешенную 0,1 М ацетатным буфером при pH 4,8 для удаления избытка NaIO4.
После этого можно определить количество альдегидных групп методом спектрофотометрии, определяя уровень отщепления пиридин-2-тиона при обработке ПДПГ.
Как будет понятно специалистам в данной области техники, для количественного определения альдегидов можно применять ряд других способов. Например, оксимы, гидразиды, семикарбазид и карбогидразиды легко вступают в реакцию с альдегидами и могут присоединяться к репортерным молекулам (например, флуоресцентным соединениям) для количественного определения альдегидных групп в углеводном полимере. Варианты флуоресцентных соединений, которые можно применять, подробно описаны на сайте: www.invitrogen.com/site/us/en/home/References/Molecular-Probes-The-Handbook/Reagents-for-Modifying-Groups-Other-Than-Thiols-or-Amines/Hydrazines-Hydroxylamines-and-Aromatic-Amines-for-Modifying-Aldehydes-and-Ketones.html. Примеры включают флуоресцеин-5-тиосемикарбазид, Alexa Fluor 488, Alexa Fluor 555, Alexa Fluor 568, Alexa Fluor 594, Alexa Fluor 633, Alexa Fluor 647 и Texas Red.
Кроме того, 2,4-динитрофенилгидразин вступает в реакцию с альдегидами с образованием окрашенного красным цветом гидразона, который также можно использовать для количественного определения числа альдегидных групп в углеводном полимере по поглощению при помощи спектрофотометрии (Apostolopoulos et al., 2000).
Содержание маннозы
В одном из вариантов осуществления изобретения содержание маннозы в композиции определяют методом колориметрического анализа на нейтральные сахара, при котором нейтральные сахара вступают в реакцию с резорцинолом в присутствии гидратированного раствора серной кислоты.
Например, 200 мкл раствора 6 мг/мл резорцинола и 1 мл 75% раствора серной кислоты добавляют в пробирку, содержащую пробу (растворенную в 0,01 М уксусной кислоте), включающую от 5 до 100 нмоль нейтральных Сахаров в объеме 200 мкл. После этого раствор перемешивают на вортексной мешалке и нагревают при 90°C на водяной бане с возможностью регуляции температуры в течение 30 мин, после чего помещают в баню с холодной водой на 30 мин в темноте. Затем определяют оптическую плотность смеси при 430 или 480 нм. Тот же анализ можно проводить при помощи половины объемов, указанных выше, при этом получают схожие результаты.
В другом варианте, анализ можно проводить в формате микропланшета. В данном варианте осуществления 20 мкл раствора 6 мг/мл резорцинола и 100 мкл раствора 75% серной кислоты и 50 мл пристина добавляют в U-образную лунку 96-луночного титрационного микропланшета, содержащую пробу (растворенную в 0,01 М уксусной кислоте), включающую от 1 до 100 нмоль нейтральных Сахаров в объеме 20 мкл. Затем растворы перемешивают встряхиванием планшета с помощью вортексной мешалки и нагревают в термостате при 90°C в течение 30 мин с последующим выдерживанием при комнатной температуре в течение 30 мин в темноте. Затем определяют оптическую плотность смеси при 430 или 480 нм с помощью ридера титрационного микропланшета. Для количественного определения «холостые» пробы, стандарты нейтральных Сахаров и пробы анализируют в двух повторах, более предпочтительно - в трех повторах, более предпочтительно - в четырех повторах.
Содержание маннозы можно также определить с помощью ферментативного или кислотного гидролиза углеводных полимеров с последующим анализом методом ВЭЖХ, масс-спектрометрии, капиллярного электрофореза или тонкослойной хроматографии (Wang et al., 2007; Anumula, 1994; R. Townsend, Chromatography in Biotechnology, C. Horvath and L.S. Ettre (editors), American Chemical Society, Washington, D.C. (1993) pp.86-101).
Иммуностимулирующие и вакцинные композиции
Использованный в настоящем описании термин «иммуностимулирующая композиция» обозначает способность композиции индуцировать и/или усиливать иммунный ответ.
Термин «иммунный ответ» имеет свое общепринятое в области техники значение и включает как гуморальный, так и клеточный иммунный ответ. Иммунный ответ может проявляться в виде одного или нескольких следующих явлений: выработка антител против антигена, увеличение количества антиген-специфических T-клеток, повышение количества противоопухолевых эффекторных лимфоцитов (TIL); развитие ответа в форме гиперчувствительность замедленного типа (DTH) против опухоли или противоопухолевого антигена, клиренс патогена, подавление патогена и/или роста и/или распространения опухоли, уменьшение размера опухоли, уменьшение или элиминация метастазов, увеличение времени до рецидива, увеличение времени выживания без патогена или опухоли, и увеличение времени выживания. Иммунный ответ может быть опосредован одним или несколькими из следующих факторов: активацией B-клеток, активацией T-клеток, активацией природных клеток-киллеров, активацией антиген-презентирующих клеток (например, B-клеток, дендритных клеток, моноцитов и/или макрофагов), выработкой цитокинов, выработкой хемокинов, экспрессией специфических маркеров клеточной поверхности, в частности, экспрессией ко-стимулирующих молекул. Иммунный ответ может характеризоваться присутствием гуморального, клеточного, Th1- или Th2-ответа или их сочетания.
Гуморальный ответ
В одном из вариантов осуществления изобретения введение композиции или вакцины вызывает гуморальный ответ, при этом стимулируется выработка одного или нескольких антител IgA, IgG, IgM и, необязательно, IgE.
Иммуноглобулины могут включать один или несколько подклассов внутри каждого класса антител, например, IgG2a и IgG1.
В одном из вариантов осуществления стимулируется выработка IgG1 и/или IgA.
В некоторых случаях стимуляция выработки IgE может быть полезна, например, для иммунизации против инфекций, вызванных червями.
В других случаях может быть полезно снижение общей выработки IgE или снижение уровня IgE относительно уровней антител других классов, например, для предотвращения или уменьшения интенсивности гиперчувствительности I типа или атопии, например, поллиноза, приступов астмы или пищевых и других типов аллергии. Связывание IgE с рецептором и последующее перекрестное взаимодействие с аллергеном отвечают за запуск иммунных ответов, лежащих в основе таких заболеваний, как астма, включая атопическую астму, аллергические риниты и атопический дерматит, которые являются проблемами со здоровьем эпидемического масштаба. Таким образом, в одном из вариантов осуществления изобретения иммунный ответ развивается таким образом, что выработка IgE снижается.
В другом варианте осуществления титр IgE относительно одного или нескольких антител IgA, IgG, IgM или их подклассов снижается. Уровень выработки IgE может оставаться неизменной, тогда как выработка одного или нескольких других антител повышается при иммунизации соединением.
В одном из вариантов осуществления изобретения иммунизация избирательно стимулирует выработку одного или нескольких антител IgA, IgG и IgM относительно IgE.
В одном из вариантов осуществления изобретения стимулируется выработка IgA, и повышается титр IgA в области одной или нескольких слизистых оболочек и/или в сыворотке.
В одном из вариантов осуществления изобретения выработка IgA после иммунизации выше по сравнению с выработкой IgG, IgM и IgE.
В другом варианте осуществления изобретения иммунизация приводит к усилению выработки IgA по сравнению с усилением выработки IgG1 и/или выработки IgG2a.
В еще одном варианте осуществления изобретения стимулируется выработка IgG, и повышается титр IgG в одной или нескольких системных областях и/или в сыворотке.
В одном из вариантов осуществления изобретения выработка IgG после иммунизации выше по сравнению с выработкой IgA, IgM и IgE.
В другом варианте осуществления изобретения иммунизация приводит к усилению выработки IgG по сравнению с усилением выработки IgA.
В одном из вариантов осуществления изобретения иммунизация приводит к усилению выработки IgG2a по сравнению с усилением выработки IgG1.
Клеточный иммунный ответ
В одном из вариантов осуществления введение композиции или вакцины по изобретению приводит к клеточному ответу, при котором активируются одна или несколько антиген-презентирующих клеток.
В одном из вариантов осуществления изобретения активируются макрофаги и/или дендритные клетки.
Активация дендритных клеток может приводить к повышению уровня поверхностной экспрессии ко-стимулирующих молекул, включая, например, CD40, CD80 и CD86, и/или к повышению количества провоспалительных цитокинов, например, IL-12 и/или IL-4, и/или к увеличению количества молекул ГКГ класса I и/или II.
В дополнительном варианте осуществления изобретения иммунизация приводит к T-клеточным ответам CD8 и/или CD4.
В дополнительном варианте осуществления изобретения иммунизация приводит к ответам с выработкой цитотоксических Т-лимфоцитов (ЦТЛ).
В одном из вариантов осуществления изобретения дендритные клетки активируют наивные T-клетки. Считается, что дендритные клетки выполняют по меньшей мере три различные функции в праймировании иммунной системы к антигену вакцины:
1) рестриктированная по ГКГ класса II презентация антигена вакцины, процессированного в эндогенном пути после его эндоцитоза;
2) рестриктированная по ГКГ класса I и/или II презентация антигена вакцины после прямой трансфекции дендритных клеток с, например, плазмидной ДНК, кодирующей антиген;
3) рестриктированная по ГКГ класса I «кросс»-презентация антигена вакцины.
Th1/Th2
В одном из вариантов осуществления введение композиции или вакцины по изобретению стимулирует посредников гуморального и/или клеточного иммунитета.
В одном из вариантов осуществления введение композиции или вакцины по изобретению вызывает опосредованный клетками ответ Th1-типа.
В еще одном варианте осуществления введение композиции или вакцины по изобретению вызывает опосредованный антителами ответ Th2-типа.
В одном из вариантов осуществления введение композиции или вакцины по изобретению приводит к выработке Th1-индуцирующих цитокинов, таких как IL-2, IL-12, IL-15, IL-18 и IFNγ. Эти цитокины как правило повышают клеточно-опосредованный иммунитет.
В еще одном варианте осуществления введение композиции или вакцины по изобретению приводит к выработке Th2-индуцирующих цитокинов, таких как IL-4, IL-5 и IL-10. Эти цитокины как правило повышают гуморальный иммунитет.
В одном из вариантов осуществления изобретения активация макрофагов приводит к выработке IL-12 и/или IL-18. Это, в свою очередь, может активировать выработку IFN-γδ природными клетками-киллерами (NK), вызывая дифференциацию к Th1-опосредованному иммунному ответу, который поддерживает клеточно-опосредованный иммунный ответ, и/или выработку комплементсвязывающих антител.
Вакцина
Термин «вакцинная композиция» обозначает композицию, которую можно применять для вызывания защитного иммунного ответа у субъекта-реципиента. Следует отметить, что вакцина по изобретению может считаться эффективной, если она вызывает иммунный ответ у части популяции, так как у некоторых индивидуумов может наблюдаться неспособность развивать надежный или защитный иммунный ответ, или, в некоторых случаях, любой иммунный ответ на вакцину. Такая неспособность может быть вызвана генетическим фоном индивидуума или возникать из-за состояния иммунодефицита (приобретенного или врожденного) или иммуносупрессии (например, при лечении иммуносупрессорными лекарственными препаратами для предотвращения отторжения органа или подавления аутоиммунного состояния). Эффективность можно выявить в моделях на животных.
Вакцина может быть «моновалентной» (также называется унивалентной) или «мультивалентной» (также называется поливалентной). Моновалентная вакцина содержит один антиген. Мультивалентная или поливалентная вакцина содержит два или более антигена, которые могут, например, вызывать иммунизацию против двух или более штаммов одного и того же патогена, или против двух или более патогенов.
Композицию или вакцину можно применять для того, чтобы проводить иммунизацию, вызывать толерантность, лечить или защищать субъекта, например, от патогена или опухоли.
Термин «иммунизировать» в настоящем описании обозначает: вызывать защитный иммунный ответ у субъекта, обеспечивать субъект устойчивостью против специфеского патогена или заболевания.
Термин «вызывать толерантность» в настоящем описании обозначает: индуцировать иммунологическую толерантность у субъекта. Вызывать у субъекта толерантность обозначает индуцировать предотвращение или супрессию специфического иммунного ответа у субъекта. Иммунологическая толерантность может применяться для предотвращения или уменьшения интенсивности, например, отторжения трансплантата, аутоиммунного ответа или аллергической реакции.
Термин «лечить» в настоящем описании обозначает частичное или полное разрушение инфицированных патогеном клеток или опухолевых клеток в организме субъекта, предпочтительно - с минимальным разрушающим воздействием на неинфицированные клетки. Терапевтическое введение композиции по изобретению может обеспечить лечение субъекта-реципиента, инфицированного патогеном или имеющего рак. В соответствии с другим вариантом осуществления, антиген-презентирующие клетки, например, макрофаги и дендритные клетки, приводят в контакт in vitro или ex vivo с композицией по изобретению, а потом вводят субъекту. Как известно специалистам в данной области техники, способ, осуществляемый in vitro, осуществляется не в живом организме, а в контролируемой среде. Такие способы in vitro можно проводить в или на тканях или клетках, полученных из организма, и обычно их называют способами ex vivo.
Термин «защищать» в настоящем описании обозначает предотвратить инфекцию патогеном или начало роста опухоли (т.е., предотвратить возникновение рака) или отсрочить начало роста опухоли. Профилактическое введение композиции по изобретению может защитить субъекта-реципиента от указанной инфекции или роста опухоли.
Антигены
Настоящее изобретение обеспечивает применение маннанов в сочетании с по меньшей мере одним антигеном в вакцинной композиции. Маннаны можно смешать или конъюгировать с по меньшей мере одним антигеном для выработки защитного иммунного ответа после вакцинации.
Под «по меньшей мере, одним антигеном» подразумевается один или несколько типов антигенов или антигенных детерминант. Кроме того, специалистам в данной области техники понятно, что с маннановым полимером можно конъюгировать более чем одну молекулу антигена (т.е., конъюгат может содержать более одной молекулы антигена, конъюгированной с маннановым полимером, и может содержать один или несколько типов антигена или антигенных детерминант).
Вакцину можно вводить субъекту, у которого имеется заболевание, предрасположенность к заболеванию или риск его развития. Заболевание может быть связано с патогенной инфекцией. В этом варианте осуществления изобретения введение вакцины может предотвратить или уменьшить проявления инфекции, вызванной патогеном.
Используемый в настоящем описании термин «антиген» обозначает субстанцию, которая способна индуцировать специфический иммунный ответ. Антиген может быть целым организмом на любой из стадий его жизненного цикла, инактивированным целым организмом, фрагментами или компонентами, выделенными из целого организма, лизатом организма или опухолевым лизатом, специфическими антигенами, созданными генно-инженерными или синтетическими способами, известными специалистам в данной областит техники. Кроме того, выбранный антиген может быть получен либо из зрелого целого организма, либо из спорозоитов (ооцист), либо из обоих указанных источников.
Антиген для применения в композициях и способах по настоящему изобретению также может состоять из целых клеток и их субклеточных фракций. Такие клетки или их субклеточные фракции могут быть получены, например, из опухоли или инфицированной ткани.
Предпочтительные выбранные антигены включают, например, антигены из:
пыльцы;
аллергенов, особенно тех, которые вызывают астму;
вирусов, таких как вирус гриппа, вирус лейкоза кошек, вирус иммунодефицита кошек, ВИЧ-1, ВИЧ-2, вирус бешенства, вирус кори, вирус гепатита B, вирус ящура, вирус папилломы, цитомегаловирус, вирус простого герпеса, вирус гепатита A, вирус гепатита C, вирус T-клеточного лейкоза человека-1 (HTLV-1) и вирус T-клеточного лейкоза человека-2 (HTLV-2);
бактерий, таких как этиологические агенты сибирской язвы, проказы, туберкулеза, дифтерии, болезни Лайма, сифилиса, брюшного тифа и гонореи;
простейших, таких как Babeosis bovis, Plasmodium, Leishmania spp. Toxoplasma gondii и Trypanosoma cruzi;
грибов, таких как Aspergillus sp., Candida albicans, Cryptococcus neoformans и Histoplasma capsulatum;
паразитов, таких как гельминты; и
опухолевых антигенов, таких как муцин-1 (MUC-1), карциноэмбриональный антиген, простатоспецифический мембранный антиген, простатоспецифический антиген, белок MZ2-E, полиморфный эпителиальный муцин (РЕМ), фолат-связывающий белок LK26, процессированный рецептор эпидермального фактора роста (EGRF), антиген Томсона-Фриденрайха (T-антиген), теломераза, сурвивин, мелан-A/MART-1, WT1, LMP2, белок папилломавируса человека (HPV) E6 E7, рецептор эпителиального фактора роста человека (HER-2/neu), идиотип, меланомна-ассоциированный антиген 3 (MAGE-3), p53, NY-ESO-1, простатическая кислая фосфатаза (PAP), антигены рака яичек, 5T4 и ганглиозиды GM-2 и GD-2.
Антиген может являться белком, пептидом, полисахаридом или олигосахаридом (свободным или конъюгированным с белковым носителем) или их смесью. Белки и пептиды могут являться частью экстракта или лизата, очищены из природного источника, синтезированы посредством твердофазного синтеза или могут быть получены посредством рекомбинантных генетических способов. Полисахариды и олигосахариды могут быть выделены из природного источника или могут быть синтезированы при помощи ферментативных способов и/или способов органического синтеза.
Антиген может образовывать часть гибридного белка с целью облегчения экспрессии и очистки при выработке гибридного белка в рекомбинантных клетках-хозяевах. Не являющаяся антигеном часть гибридного белка в основном будет представлять собой N-концевую область гибридного белка, при этом карбоксиконцевые последовательности содержат последовательности антигена. Гибридные белки могут быть выбраны из глутатион-S-трансферазы, β-галактозидазы или любого другого белка или его части, в частности, таких, которые делают возможным проведение аффинной очистки при помощи связывания или других характеристик аффинности белка для очистки конечного гибридного белка. Белок также может быть присоединен к C-концу или N-концу белка-носителя. Природа гибридного белка будет зависеть от векторной системы, при помощи которой получают гибридные белки. Примером бактериального экспрессионного вектора является pGEX, который при субклонировании представляющего интерес гена в этот вектор вырабатывает гибридный белок, состоящий из глутатион-S-трансферазы и представляющего интерес белка. Примеры других векторных систем, которые позволяют получать гибридные белки с представляющим интерес белком, описаны в Sambrook et al., 1989, см. выше.
В соответствии с другим вариантом, в изобретении могут применяться синтетические пептиды или полипептиды, необязательно соединенные с белком-носителем. Синтетические пептиды или полипептиды могут быть получены в соответствии со стандартными способами.
Полезные пептиды или полипептиды могут содержать несущую эпитоп часть полипептида, известная способностью вызывает образование антител и/или антиген-специфический ответ ЦТЛ (цитотокеических T-лимфоцитов) при введении животному целого полипептида. Эпитоп этой части полипептида является иммуногенным или антигенным эпитопом полипептида.
«Иммуногенный эпитоп» определяется как часть белка, которая вызывает образование антител и/или антиген-специфический ответ ЦТЛ, когда цельный белок является иммуногеном. С другой стороны, область белковой молекулы, с которой могут связываться антитело или молекула ГКГ, определяется как «антигенный эпитоп». Количество иммуногенных эпитопов в белке обычно меньше, чем количество антигенных эпитопов.
Относительно выбора пептидов или полипептидов, несущих антигенный эпитоп, специалистам в данной области хорошо известно, что относительно короткие синтетические пептиды, которые имитируют часть белковой последовательности, обычно вызывают образование антисыворотки, которая вступает в реакцию с частично имитированным белком (см., например, Sutcliffe et al., 1983). Пептиды, способные вызывать образование сыворотки, реактивной к белку, часто встречаются в первичной последовательности белка, могут быть охарактеризованы с помощью ряда простых химических правил и не ограничены ни иммунодоминантными областями интактных белков (т.е., иммуногенными эпитопами), ни амино- или карбокси-концами.
Антигенные эпитоп-несущие пептиды и полипептиды по изобретению предпочтительно содержат последовательность по меньшей мере из семи, более предпочтительно по меньшей мерет из девяти, и наиболее предпочтительно - от приблизительно 15 до 30 аминокислот, входящих в состав аминокислотной последовательности конкретного полипептида.
Эпитопы, узнаваемые T-клеточными рецепторами на клетках ЦТЛ, могут отличаться от эпитопов, узнаваемых антителами. Обычно клетки ЦТЛ распознают пептиды (полученные из белков, ферментативно расщепленных в цитозольном компартменте), которые связаны с молекулами ГКГ класса I и экспонированы на клеточной поверхности. Эти распознаваемые клетками ЦТЛ пептиды избирательно связываются с молекулами ГКГ класса I в соответствии с аллельспецифическими последовательностями мотивов ГКГ. Эти пептиды можно выявить с помощью экспрессионного клонирования (см. van der Bruggen et al., 1991) и предсказать при помощи различных алгоритмов для пептидов, связывающихся с классом I и классом II (Pietersz et al., 2006).
В соответствии с другим вариантом, распознаваемые клетками ЦТЛ пептиды можно выявить с помощью индукции цитотоксических T-лимфоцитов посредством стимуляции in vitro или ex vivo пептидами, полученными из белкового антигена, применяемого для иммунизации. Отдельные пептиды и полипептиды по изобретению, содержащие узнаваемый клетками ЦТЛ эпитоп, предпочтительно являются последовательностями из по меньшей мере шести аминокислот, и более предпочтительно в диапазоне от приблизительно от 7 до 20 аминокислот.
Содержащие эпитоп пептиды и полипептиды могут быть получены любым стандартным способом.
Бактериальные антигены
Антиген может быть получен из бактерий, включая в качестве неограничивающих примеров: Helicobacter pylori, Chlamydia pneumoniae, Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma pneumoniae, Staphylococcus spp., Staphylococcus aureus, Streptococcus spp., Streptococcus pyogenes, Streptococcus pneumoniae, Streptococcus viridans, Enterococcus faecalis, Neisseria meningitidis, Neisseria gonorrhoeae, Bacillus anthracis, Salmonella spp., Salmonella typhi, Vibrio cholera, Pasteurella pestis, Pseudomonas aeruginosa, Campylobacter spp., Campylobacter jejuni, Clostridium spp., Clostridium difficile, Mycobacterium spp., Mycobacterium tuberculosis, Treponema spp., Borrelia spp., Borrelia burgdorferi, Leptospira spp., Hemophilus ducreyi, Corynebacterium diphtheria, Bordetella pertussis, Bordetella parapertussis, Bordetella bronchiseptica, Hemophilus influenza, Escherichia coli, Shigella spp., Erlichia spp. и Rickettsia spp.
Бактериальный антиген может быть нативным, рекомбинантным или синтетическим. Такие бактериальные антигены включают в качестве неограничивающих примеров селектины или лектины из бактерий, которые связываются с углеводными детерминантами, присутствующими на поверхности клеток, и рецепторы бактерий для белков, таких как фибронектин, ламинин и коллагены.
Вирусные антигены
Антиген может происходить из вирусов, включая в качестве неограничивающих примеров вирусы гриппа, вирусы парагриппа, вирус эпидемического паротита, аденовирусы, респираторно-синцитиальный вирус, вирус Эпштейна-Барр, риновирусы, полиовирусы, вирусы коксаки, ECHO-вирусы, вирус кори, вирус краснухи, вирус ветряной оспы, вирусы герпеса (человека и животных), вирус простого герпеса, парвовирусы (человека и животных), цитомегаловирус, вирусы гепатита, папилломавирус человека, альфа-вирусы, флавивирусы, буньявирусы, вирус бешенства, аренавирусы, филовирусы, ВИЧ-1, ВИЧ-2, вирус T-клеточного лейкоза человека-I (HTLV-I), вирус T-клеточного лейкоза человека-II (HTLV-II), вирус лейкоза кошек (FeLV), вирус коровьего лейкоза, вирус иммунодефицита кошек (FeIV), вирус чумы собак, вирус инфекционного гепатита собак, калицивирус кошек, вирус ринотрахеита кошек, вирус трансмиссивного гастроэнтерита (свиней) и вирус ящура.
Вирусные антигены могут быть нативными, рекомбинантными или синтетическими. Такие вирусные антигены включают в качестве неограничивающих примеров вирусные белки, которые отвечают за присоединение к рецепторам клеточной поверхности при инициации инфекционного процесса, такие как (i) оболочковые гликопротеины ретровирусов (ВИЧ, HTLV, ВЛК и других) и вирусов герпеса и (ii) нейраминидаза вирусов гриппа.
Опухолевые антигены
В одном из осуществлений настоящего изобретения субъект страдает раком или имеет повышенный риск развития рака.
Под термином «рак» имеется в виду любое из множества злокачественных новообразований, характеризующихся пролиферацией клеток, которые обладают способностью проникать в окружающую ткань и/или образовывать метастазы в новых областях образования колоний. Рак может быть, например, раком груди, желудка, толстой кишки, поджелудочной железы, мочевого пузыря или легких. В предпочтительном варианте осуществления изобретения онкологическое заболевание является раком груди.
Хорошо известны многие «факторы риска» для развития рака, такие как семейный анамнез рака, анамнез рака, обнаружение ранее при биопсии пролиферативного заболевания, такого как атипическая гиперплазия. Известны также отдельные генетические факторы риска, примеры для рака груди включают мутации в BRCA1, BRCA2, ATM, CHEK-2 и p53. Также могут учитываться факторы риска, связанные с образом жизни. Факторы риска, связанные с образом жизни, для рака груди у женщин включают рождение детей после достижения возраста 30 лет и длительное применение гормонозаместительной терапии. Квалифицированный практикующий врач может оценить эти и другие факторы риска для определения того, будет ли субъекту полезно применение вакцинной композиции по изобретению в профилактических целях.
Противораковые вакцины по изобретению могут содержать один или несколько опухолеассоциированных антигенов. Опухолеассоциированные антигены могут быть нативными, рекомбинантными или синтетическими. Такие Опухолеассоциированные антигены включают в качестве неограничивающих примеров MUC-1 и его пептидные фрагменты, белок MZ2-E, полиморфный эпителиальный муцин, фолат-связывающий белок LK26, MAGE-1 или MAGE-3 и их пептидные фрагменты, хорионический гонадотропин человека (HCG) и его пептидные фрагменты, карциноэмбриональный антиген (КЭА) и его пептидные фрагменты, альфа-фетопротеин (АФП) и его пептидные фрагменты, панкреатический онкофетальный антиген и его пептидные фрагменты, СА 125, 15-3,19-9, 549, 195 и их пептидные фрагменты, простатоспецифические антигены (ПСА) и их пептидные фрагменты, простатоспецифический мембранный антиген (ПСМА) и его пептидные фрагменты, антиген плоскоклеточной карциномы (SCCA) и его пептидные фрагменты, антиген рака яичников (ОСА) и его пептидные фрагменты, антиген, ассоциированный с раком поджелудочной железы (РаА) и его пептидные фрагменты, Her1/neu и его пептидные фрагменты, gp-100 и его пептидные фрагменты, мутантные белки K-ras и их пептидные фрагменты, мутантный p53 и его пептидные фрагменты, немутантный р53 и его пептидные фрагменты, усеченный рецептор эпидермального фактора роста (РЭФР), химерный белок p210BCR-ABL, теломераза и ее пептидные фрагменты, сурвивин и его пептидные фрагменты, белок Мелан-A/MART-1 и его пептидные фрагменты, белок WT1 и его пептидные фрагменты, белок LMP2 и его пептидные фрагменты, белок HPV E6 E7 и его пептидные фрагменты, белок HER-2/neu и его пептидные фрагменты, идиотипический белок и его пептидные фрагменты, белок NY-ESO-1 и его пептидные фрагменты, белок PAP и его пептидные фрагменты, белки рака яичка и их пептидные фрагменты и белок 5T4 и его пептидные фрагменты. Другие примеры опухолевых антигенов описаны в Cheever et al., 2009.
Муцин
В предпочтительном варианте осуществления изобретения антиген является муцином или его антигенным фрагментом или его иммуногенной мутантной или производной формой. Многие онкологические заболевания сопровождаются избыточным образованием муцина человека. Муцины - это сильно гликозилированные белки (с весом более 100 кДа), которые вырабатываются многими эпителиальными клетками и опухолями. Муцины, обнаруживаемые на поверхности раковых клетках, в некоторой степени отличаются от муцинов нормальных эпителиальных клеток тем, что некоторые муцины имеют менее выраженную углеводную оболочку, в результате чего белковый кор оказывается незащищенным. Известна 21 форма муцинов человека, которые обозначаются MUC-1, MUC-2, MUC-3, MUC-4, MUC-5 MUC-6 и MUC-7 и т.д. MUC-1 является самым распространенным. Свойства всех различных муцинов очень схожи, а именно: они являются трансмембранными гликопротеинами, при этом все содержат различное количество повторяющихся аминокислотных последовательностей с высоким содержанием серина, треонина и пролина. Избыточное образование аномально гликозилированных муцинов (либо негликозилированных, либо недостаточно гликозилированных) является характерным признаком опухолей груди, яичника, поджелудочной железы, толстой кишки, легких, простаты и других опухолей секреторных тканей. Последовательности кДНК соответствующих белковых коров муцинов человека с MUC-1 по MUC-21 были клонированы и охарактеризованы, и было обнаружено, что они содержат высокоповторяющиеся центральные части, включающие различное число повторов определенных аминокислотных мотивов (известных как VNTR). Например, MUC-1 состоит из уникальных амино- и карбоксиконцевых последовательностей, разделенных высокоповторяющейся центральной частью, включающей от сорока до восьмидесяти тандемно расположенных копий мотива из двадцати аминокислот.
В одном из вариантов осуществления настоящего изобретения опухолеассоциированный антиген является одним или несколькими муцинами человека от MUC-1 до MUC-21, которые, как указано выше, все содержат высокоповторяющиеся центральные части повторных аминокислотных последовательностей с повышенным содержанием серина, треонина и пролина. В частности, вакцины по изобретению могут содержать полипептид муцина человека (включающий различное число повторов, ассоциированных с нормальной аллельной вариацией) или могут содержать одну или несколько повторных последовательностей муцина человека, предпочтительно - от двух до восьми, более предпочтительно - от двух до двенадцати, и еще более предпочтительно - от двух до десяти повторных субъединиц муцина человека. Муцин человека и его субъединицы предпочтительно негликозилированы или аномально гликозилированы таким образом, что они способны вызывать иммунный ответ на муцин, обнаруживаемый на раковых клетках, дефицитных по углеводной оболочке, в результате чего белковый кор оказывается незащищенным. Применение муцина человека MUC-1, в частности, является предпочтительным, хотя очевидно, что изобретение относится также и к применению любого антигена, особенно к применению муцинов человека с MUC-1 по MUC-21.
Антиген MUC-1 может быть таким, как описано, например, в WO 95/108145, US 6 054 438, US 6 222, 020, WO 98/50527, WO 01/18035, WO 00/63363, WO 95/03825, WO 00/06723 и WO 04/016643. Также предполагается применение пептидов или пептидных аналогов, производных от эпитопов MUC-1 для T-клеток, раскрытое в WO 2008/011672.
Конъюгаты маннана с антигеном
Эффективность доставки по меньшей мере одного антигена, например, в макрофаги и дендритные клетки может быть повышена, если по меньшей мере один антиген конъюгирован с маннанами. Не ограничиваясь какой-либо теорией, можно предположить, что макрофаги и дендритные клетки имеют на клеточной поверхности рецепторы, которые узнают углеводные группы (в основном происходящие из микроорганизмов) и опосредуют фагоцитоз, а также пиноцитоз - два процесса, вовлеченных в презентацию антигена. По существу, конъюгаты маннан-антиген по изобретению обеспечивают эффективный механизм для нацеливания на антиген-презентирующие клетки (АПК).
В предпочтительном варианте осуществления изобретения полисахаридные цепи маннанов окислены, например, с помощью NaIO4 перед конъюгацией с по меньшей мере одним антигеном (см. схему на фиг.4). В одном из вариантов осуществления по меньшей мере один антиген конъюгирован с окисленными маннанами способом, схожим с описанным в WO 95/18145. Также можно применять восстановленные маннаны, и содержащее их соединение может быть получено путем добавления боргидрида натрия или цианоборгидрида натрия к конъюгатам окисленных маннанов с антигеном.
В другом варианте осуществления полисахаридные цепи маннанов могут быть предварительно активированы с помощью цианогенбромида, после чего активированные полисахаридные цепи вступают в реакцию с диамином с последующей конъюгацией с по меньшей мере одним антигеном с образованием конъюгатов, которые затем, необязательно, могут быть окислены.
Из маннанов и по меньшей мере одного антигена могут быть получены производные с бифункциональными агентами с целью осуществления поперечной сшивки маннанов и по меньшей мере одного антигена. Стандартно используемые агенты для поперечной сшивки включают 1,1-бис-(диазоацетил)-2-фенилэтан, глутаральдегид, сложные эфиры N-гидроксисукцинимида, например, сложные эфиры с 4-азидосалициловой кислотой, гомобифункциональные имидоэфиры, включая сложные эфиры дисукцинимидила, такие как 3,3'-дитио-бис-(сукцинимидил-пропионат), и бифункциональные имиды малеиновой кислоты, такие как бис-N-малеимидо-1,8-октан. Агенты для получения производных, такие как метил-3-[(п-азидофенил)дитио]пропиоимидат, дают фотоактивируемые промежуточные продукты, которые способны образовывать поперечные сшивки в присутствии света. Окисленные маннаны могут вступать в реакцию с гидразиновыми производными антигена с образованием конъюгатов. В соответствии с другим вариантом можно сначала провести реакцию маннанов с такими реагентами, как карбонилдиимидазол, а затем провести реакцию с антигеном, а также окисление с получением конъюгатов.
Конденсация по меньшей мере одного антигена с маннанами включает осуществление реакции функциональных групп на углеводе с функциональными группами на антигене. Углеводные полимеры насыщены гидроксильными группами. Эти группы можно активировать в соответствии со стандартными химическими процедурами. Например, гидроксильные группы могут вступать в реакцию с галидами водорода, такими как йодид водорода, бромид водорода и хлорид водорода, с образованием функционально активного галогенированного полисахарида. Гидроксильные группы могут быть активированы при помощи тригалидов фосфора, активных металлов (таких как этоксид натрия, изопропоксид алюминия и трет-бутоксид калия) или эстерифицированы (при помощи таких групп, как тозилхлорид или уксусная кислота) с образованием функциональных групп, которые затем могут вступать в реакцию с функциональными группами на полипептиде с формированием одной или нескольких связей.
Нуклеиновая кислота, кодирующая антиген
В одном из вариантов осуществления настоящего изобретения вакцинная композиция содержит нуклеиновую кислоту, кодирующую антиген. Для получения поливалентной по антигену вакцины в нее добавляют множество нуклеиновых кислот. В одном из вариантов осуществления вакцина является ДНК-вакциной.
По меньшей мере, одна нуклеиновая кислота может быть присоединена к маннанам, например, через поликатионы, такие как поли-L-лизин, полиэтиленимин или ПАМАМ дендример. В одном из вариантов осуществления положительные заряды поликатиона окисленного маннана взаимодействуют с отрицательно заряженной ДНК с образованием полиплекса, который можно применять для трансфекции (Tang et al., 2008; Tang et al., 2007; Tang et al., 2009).
ДНК-вакцинация обычно включает прямое внедрение in vivo ДНК, кодирующей антиген, например, в мышцу или кожу субъекта для экспрессии антигена клетками субъекта. После того, как ДНК, кодирующая антиген, будет процессирована и презентирована трансфецированными клетками, может быть спровоцирован клеточный и/или гуморальный иммунный ответ. ДНК-вакцины описаны в US 5939400, US 6110898, WO 95/20660 и WO 93/19183.
В настоящее время в большинстве ДНК-вакцин для млекопитающих применяются вирусные промоторы, полученные из цитомегаловируса (ЦМВ). Эти промоторы демонстрируют хорошую эффективность как при мышечной, так и при кожной инокуляции у ряда видов млекопитающих. Фактором, предположительно влияющим на иммунный ответ, вызываемый ДНК-иммунизацией, является способ доставки ДНК, например, парентеральные пути введения могут давать низкую степень переноски генов и вызывать существенную изменчивость генной эксрпесии. Высокоскоростная инокуляция плазмид, при помощи генной пушки, усиливает иммунные ответы у мышей, предположительно, из-за более высокой эффективности трансфекции ДНК и более эффективной антиген-презентации дендритными клетками. Векторы, содержащие вакцину по изобретению на основе нуклеиновой кислоты, также могут быть внедрены в организм представляющего интерес хозяина другими способами, известными специалистам в данной области техники, например, трансфекцией, электропорацией, микроинъекцией, трансдукцией, слиянием клеток, с помощью ДЭАЭ-декстрана, преципитацией с фосфатом кальция, липофекцией (слиянием липосом) или с помощью переносчика ДНК-вектора. Механизмы введения ДНК-вакцин более подробно описаны ниже.
Другие компоненты
Композиции по изобретению могут включать по меньшей мере один фармацевтически приемлемый носитель. Термин «фармацевтически приемлемый носитель» относится к молекулярным субстанциям и композициям, которые не вызывают аллергическую, токсическую или иную нежелательную реакцию при введении субъекту, в частности, млекопитающему, и более предпочтительно -человеку. Фармацевтически приемлемый носитель может являться твердым веществом или жидкостью. Полезные примеры фармацевтически приемлемых носителей включают в качестве неограничивающих примеров разбавители, вспомогательные вещества, растворители, поверхностно-активные вещества, суспендирующие агенты, буферные вещества, смазывающие вещества, носители, эмульгаторы, абсорбенты, диспергенты, оболочки, стабилизаторы, защитные коллоиды, адгезивы, загустители, тиксотропные вещества, агенты, способствующие проникновению, связывающие вещества, изотонические и замедляющие абсорбцию вещества, которые не влияют на активность веществ по изобретению.
Носитель может быть любым стандартно применяемым носителем, и его применение ограничивается только физико-химическими соображениями, такими как растворимость и отсутствие реактивности в отношении активного агента, а также путем введения. Пригодные носители по изобретению включают стандартно применяемые носители, например, воду, соль, водный раствор декстрозы, лактозу, раствор Рингера, буферизированный раствор, гиалуроновую кислоту, гликоли, крахмал, целлюлозу, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, магния стеарат, натрия стеарат, моностеарат глицерола, натрия хлорид, глицерол, пропиленгликоль, воду, этанол и т.п. Липосомы также могут применяться в качестве носителей.
Соединения, которые могут дополнительно усиливать иммуногенность или эффективность композиций по изобретению, также могут включаться в их состав или могут вводиться совместно с ними. Например, композиции могут включать одно или несколько масел (например, полный или неполный адъювант Фрейнда), сапонины, модифицированные сапонины, липосомы, минеральные соли (например, AlK(SO4)2, AlNa(SO4)2, AlNH4(SO4), кремнезем, квасцовую муку, Al(OH)3, Ca3(PO4)2, каолин и уголь), полинуклеотиды (например, полиинозиновую-полицитидиловую и полиадениловую-полиуридиловую кислоты) и некоторые природные субстанции (например, липид A, воск D из Mycobacterium tuberculosis, a также субстанции, обнаруженные в Corynebacterium parvum, Bordetella pertussis и членах рода Brucella), альбумин бычьей сыворотки, дифтерийный анатоксин, столбнячный анатоксин, эдестин, гемоцианин фиссуреллы, псевдомонадный токсин A, холерагеноид, холерный токсин, коклюшный токсин, вирусные белки и эукариотические белки, такие как интерфероны, интерлейкины или фактор некроза опухолей. Такие белки могут быть получены из природных или рекомбинантных источников согласно способам, известным специалистам в данной области техники. Другие известные иммуногенные макромолекулы включают полисахариды, тРНК, неметаболизируемые синтетические полимеры, такие как поливиниламин, полиметакриловая кислота, поливинилпирролидон, смешанные поликонденсаты (с относительно высоким молекулярным весом) 4',4-диаминодифенилметан-3,3'-дикарбоновой кислоты и 4-нитро-2-аминобензойной кислоты или гликолипиды, липиды или углеводы.
Введение
Композицию или вакцину по изобретению можно вводить субъекту соответствующим путем, либо отдельно, либо в сочетании с еще одним соединением.
В одном из вариантов осуществления изобретения соединение является антигеном или кодирующей его нуклеиновой кислотой. В одном из вариантов осуществления маннаны и по меньшей мере один антиген или кодирующую его нуклеиновую кислоту вводят последовательно или одновременно в различных композициях. В предпочтительном варианте осуществления их вводят в составе одной и той же композиции.
Маннаны можно вводить в качестве добавки с по меньшей мере одним антигеном или кодирующей его нуклеиновой кислотой или, в соответствии с другим вариантом осуществления, маннаны могут быть конъюгированы с по меньшей мере одним антигеном или кодирующей его нуклеиновой кислотой.
Возможны различные пути введения, включая в качестве неограничивающих примеров оральный путь введения, введение с пищей, местный, парентеральный (например, внутривенная, внутриартериальная, внутримышечная, внутрикожная, внутрисосудистая или подкожная инъекция) и ингаляционный (например, интрабронхиальная, интраназальная или пероральная ингаляция или интраназальные капли) пути введения.
В одном из вариантов осуществления изобретения соединение или вакцину вводят в область слизистой оболочки. Примеры областей слизистой оболочки включают в качестве неограничивающих примеров дыхательные пути, такие как область носа (например, нос), трахей, бронхи и легкие, буккальная ткань или ткани ротовой полости, включая ротовую (например, рот и десны) и ротоглоточную полости, глотку, включая миндалины, слизистую оболочку глаз, желудочно-кишечный тракт (например, пищевод, желудок, двенадцатиперстную кишку, тонкий и толстый кишечник, толстую кишку и прямую кишку), половые пути или ткани (включая в качестве неограничивающих примеров мочевой пузырь, мочеточник, уретру и ассоциированные ткани, пенис, вульву/вагину и цервико-вагинальные ткани, а также матку и фаллопиевы трубы).
Готовая лекарственная форма композиции или вакцины для введения будет меняться в зависимости от выбранного способа введения (например, раствор, эмульсия, капсула).
Соединение или вакцину можно приготовить в физиологически приемлемом носителе. В случае растворов или эмульсий пригодные носители включают водные или спиртоводные растворы, эмульсии или суспензии, в том числе солевые и буферизированные среды. Парентеральные носители включают раствор хлористого натрия, декстрозу в растворе Рингера, декстрозу и натрия хлорид, раствор Рингер с лактатом или нелетучие масла. Внутривенные носители включают различные добавки, консерванты или текучие среды, питательные или электролитические компенсирующие добавки и т.п. (см., в общем случае, Remington's Pharmaceutical Sciences, 1985). В случае ингаляции растворимая композиция или вакцина могут быть помещены в подходящий распылитель для введения (например, пульверизатор, небулайзер или аэрозольный распылитель под давлением).
Нуклеиновая кислота, кодирующая антиген, может напрямую доставляться в клетки путем вставки в ретровирусный, аденовирусный или другой подходящий вектор или в другие различные комплексы для доставки генов на основе белков или на основе липидов, а также с помощью применения способов, облегчающих доставку «голых» полинуклеотидов (таких как электропорация или доставка с помощью «генной пушки»), В соответствии с другим вариантом осуществления, нуклеиновая кислота может быть внедрена в клетку-хозяина, способную экспрессировать белок для доставки. Эти трансфецированные или трансформированные клетки затем можно имплантировать (сами по себе или в защитном устройстве), инъецировать или иным способом внедрять в количестве, эффективном для экспрессии антигена в терапевтически эффективном количестве.
В соответствии с другим вариантом осуществления, антиген-презентирующие клетки, например, макрофаги и/или дендритные клетки, можно привести в контакт с соединением в условиях in vitro или ex vivo для эффективной нагрузки антигеном, а затем ввести субъекту. В одном из вариантов осуществления антиген-презентирующие клетки получены от субъекта или аутологического донора и нагружены антигеном ех vivo. Например, у субъекта или аутологического донора можно отобрать кровь и провести насыщение мононуклеарными клетками периферической крови (МКПК) с помощью центрифугирования в градиенте плотности с последующей адгезией на пластиковой поверхности для обогащения моноцитами. Затем адгезивные клетки можно культивировать в присутствии смеси цитокинов для индукции дифференциации, например, незрелых дендритных клеток, и полученные в результате незрелые дендритные клетки можно привести в контакт с вакцинным антигеном и маннанами или, в соответствии с другим вариантом осуществления, трансфецировать нуклеиновой кислотой, кодирующей указанный антиген. Аликвоты (например, криоконсервированные аликвоты) полученных в результате препаратов зрелых/активированных дендритных клеток (т.е., характеризующихся повышенным содержанием ко-стимулирующих молекул CD40, CD80 и CD86) затем можно вводить субъекту, например, путем внутрикожной инъекции (или инъекций) согласно указанному в протоколе графику.
Введение композиции или вакцины может быть разовым или многократным, либо может являться частью прайм-буст протокола, сочетанием этих способов друг с другом или каждого из них с другими стандартными способами введения/вакцинации. Прайм-буст протокол может, например, включать праймирование, например, посредством внутримышечного, внутрикожного, внутрисосудистого, подкожного или внутривенного введения, и вторичную инъекцию антигена при помощи, например, интраназального, внутримышечного, внутрикожного, внутрисосудистого, подкожного или внутривенного введения. Одна или обе композиции для праймирования и вторичной инъекции могут включать антиген или кодирующую его нуклеиновую кислоту и маннаны. В одной из композиций для праймирования и вторичной инъекции могут отсутствовать маннаны.
Количество и частота введений композиции или вакцины по изобретению, эффективные для конкретного применения, будут меняться в зависимости от факторов, известных специалистам в данной области техники, включая в качестве неограничивающих примеров физическую и химическую природу маннанов и/или по меньшей мере одного антигена или кодирующей его нуклеиновой кислоты, природы носителя, намеченного режима дозирования, состояния иммунной системы субъекта (например, супрессированное, аномальное, стимулированное), способа введения композиции или вакцины, а также биологического вида, которому вводиться композиция или вакцина. Соответственно, практически невозможно указать в общем количество маннанов и/или по меньшей мере одного антигена или кодирующей его нуклеиновой кислоты для всех возможных применений. Количество и частота могут быть определены при посещении врача или ветеринара.
Вводится эффективное количество композиции. «Эффективное количество» - это количество, достаточное для достижения требуемого иммуностимулирующего эффекта, с учетом условий введения.
Например, субъекту можно вводить от приблизительно 100 нг/кг до приблизительно 50 мг/кг маннанов, предпочтительно - от приблизительно 10 мкг/кг до приблизительно 10 мг/кг. Еще более предпочтительно, предусматривается доза от приблизительно 1 мг/кг до приблизительно 10 мг/кг маннанов, в частности, для человека.
Например, субъекту можно ввести от приблизительно 1 мкг/кг до приблизительно 10000 мкг/кг антигена, предпочтительно - от приблизительно 5 мкг/кг до приблизительно 5000 мкг/кг, более предпочтительно - от приблизительно 8 мкг/кг до приблизительно 1000 мкг/кг, и наиболее предпочтительно - от приблизительно 400 мкг/кг до приблизительно 600 мкг/кг. Еще более предпочтительно, предусматривается доза от приблизительно 100 мкг/кг до приблизительно 200 мкг/кг антигена, в частности, для человека.
Композиция и вакцина по изобретению также могут быть введены субъектам в сочетании с другими модификаторами иммунного ответа, например, цитокинами, протеин-связывающимися хелперными молекулами HLA класса II, агонистами CD40, антагонистами рецепторов контрольной точки (например, CTLA-4, PD-1, Stat3), ко-стимулирующими молекулами B7, агонистами FLt3 и агонистами CD40L.
Присутствие хелперных молекул, связывающихся с белками HLA класса II, эффективно при стимуляции хелперных (CD4+) T-клеток. Хелперная молекула, связывающаяся с белками HLA класса II, может являться любой из известных специалистам в данной области молекул, включая, например, гемоцианин моллюска фиссуреллы (ГМФ), столбнячный анатоксин (СА), дифтерийный анатоксин или более мелкие вспомогательные эпитопы для T-клеток, такие как пептиды PADRE, а также их сочетания.
Соединения, которые могут дополнительно усиливать иммуногенность или эффективность композиций по изобретению и/или фармацевтически приемлемые носители также могут включаться в их состав, или могут вводиться совместно с ними.
Композиции по изобретению также можно применять в сочетании с другими иммунотерапевтическими способами, например, химиотерапией, если субъект страдает раком и вакцина является противораковой вакциной.
Доставка нуклеиновой кислоты в клетку
В одном из вариантов осуществления изобретение относится к композиции для доставки нуклеиновой кислоты в клетку, при этом композиция содержит по меньшей мере одну нуклеиновую кислоту и маннаны, и при этом по меньшей мере 75% маннанов имеет вес более чем приблизительно 1000 кДа. По меньшей мере одна нуклеиновая кислота может быть конъюгирована с маннанами через поликатионы.
В одном из вариантов осуществления нуклеиновая кислота кодирует антиген.
В другом варианте осуществления нуклеиновая кислота кодирует ген.
Фраза «внедрение нуклеиновой кислоты в клетку» обозначает внедрение последовательностей нуклеиновых кислот при помощи рекомбинантных способов.
Термин «нуклеиновая кислота» является синонимом ДНК, РНК и полинуклеотидов во всех их формах, т.е. одно- и двуцепочечной ДНК, кДНК, мРНК, миРНК и т.п.
Способы доставки нуклеиновых кислот в организм субъекта включают прямую доставку нуклеиновой кислоты и доставку клеток, трансфецированных или трансформированных нуклеиновой кислотой. Клетки или нуклеиновые кислоты могут быть доставлены напрямую в требуемый орган или опухоль, например, с помощью инъекции, катетеризации или эндоскопии. Их также можно доставлять внутривенно, интрабронхиально, внутриопухолево, интратекально, внутримышечно, внутриглазно, местно, подкожно, трансдермально или перорально.
Примерами носителей для доставки нуклеиновых кислот являются липосомы, биосовместимые полимеры, включая природные полимеры и синтетические полимеры, липопротеины, полипептиды, полисахариды, липополисахариды, искусственно созданные вирусные оболочки, металлические частицы, бактерии, вирусы, такие как бакуловирус, аденовирус и ретровирус, бактериофаги, космиды, плазмиды, векторы грибов и другие рекомбинационные носители, обычно применяемые в данной области, которые были описаны для экспрессии в различных эукариотических и прокариотических хозяевах, и могут применяться для генной терапии, генетической вакцинации (например, ДНК-вакцинации), а также для экспрессии простых белков.
Используемый в настоящем описании термин «вектор» обозначает отдельные элементы, которые применяют для внедрения гетерологичной нуклеиновой кислоты в клетки для ее экспрессии или репликации. Например, вектор может являться искусственной хромосомой, плазмидой, космидой, бактериофагом или вирусом и может быть способен стабильно интегрировать в геном клетки-хозяина или может существовать как независимый генетический элемент (например, эписома, плазмида). Вектор может существовать в виде одиночного полинуклеотида или в качестве двух или более отдельных полинуклеотидов. Векторы, присутствующие в клетке-хозяине, могут быть однокопийными векторами или мультикопийными векторами. Предпочтительными векторами для применения в настоящем изобретении являются экспрессионные векторы, в которых один или несколько функциональных генов можно вставить внутрь вектора, в правильной ориентации и рядом с контролирующими экспрессию регуляторными элементами, таким образом, чтобы осуществлять экспрессию одного или нескольких белков в клетке-хозяине.
Термин «регуляторные элементы» обозначает последовательности нуклеиновых кислот, необходимые для экспрессии функционально присоединенной кодирующей нуклеотидной последовательности в конкретной клетке-хозяине. Регуляторные последовательности, пригодные для экспрессии в прокариотах, включают, например, точки начала репликации, промоторы, сайты связывания рибосомы и сайты терминации транскрипции. Регуляторные последовательности, пригодные для экспрессии в эукариотах, включают, например, ориджины репликации, промоторы, сайты связывания рибосомы, сигналы полиаденилирования и энхансеры.
«Промотор» управляет транскрипцией нуклеиновой кислоты. При использовании в настоящем документе термин «промотор» включает необходимую последовательность нуклеиновой кислоты рядом с сайтом начала транскрипции, такую как, в случае промотора для полимеразы II, ТАТА-элемент.
Промотор также, необязательно, включает дистальные «энхансерные или репрессорные элементы», которые могут располагаться на расстоянии до нескольких тысяч пар оснований от сайта начала транскрипции. Промотор может быть либо гомологичным, либо гетерологичным. «Конститутивный» промотор - это промотор, который активен в выбранном организме при большинстве условий внешней среды и на большинстве стадий развития. «Индуцибельный» промотор - это промотор, который находится в выбранном организме под влиянием условий внешней среды и стадии развития.
Вектор может быть вирусным или невирусным вектором, включая аденовирусные векторы, векторы аденосателлитных вирусов, ретровирусные векторы, лентивирусные векторы и плазмидные векторы. Примеры типов вирусов включают ВПГ (вирус простого герпеса), аденовирус, АСВ (аденосателлитный вирус), ВИЧ (вирус иммунодефицита человека), БВИ (бычий вирус иммунодефицита) и ВЛМ (вирус лейкемии мышей). Нуклеиновые кислоты можно вводить в любом необходимом формате, который обеспечивает эффективные уровни доставки, в том числе в вирусных частицах, в липосомах, в наночастицах и в комплексе с полимерами. Доставка генов, перенос генов и т.п., при использовании в настоящем документе, являются терминами, обозначающими внедрение нуклеиновой кислоты (иногда называемой «трансгеном») в клетку-хозяина, независимо от способа, применяемого для внедрения. Такие способы включают различные широко известные способы, такие как вектор-опосредованный перенос генов (например, с помощью вирусной инфекции/трансфекции или других различных комплексов для доставки генов на основе белков или на основе липидов), а также способы, облегчающие доставку «голых» полинуклеотидов (такие как электропорация, доставка с помощью «генной пушки» и другие различные способы, применяемые для внедрения нуклеиновых кислот). Внедренный полинуклеотид может стабильно или кратковременно сохраняться в клетке-хозяине. Для стабильного сохранения обычно необходимо, чтобы внедренный полинуклеотид либо содержал ориджин репликации, совместимый с клеткой-хозяином, либо интегрировал в репликон клетки-хозяина, такой как экстрахромосомный репликон (например, в плазмиду) или ядерная или митохондриальная хромосома. Известен ряд векторов, которые способны опосредовать перенос генов в клетки млекопитающих, как известно специалистам в данной области техники и описано в настоящем изобретении. ПРИМЕРЫ
Пример 1: Материалы и методы
Среды и химикаты
Полную среду RPMI-1640 готовили добавлением 2% ГЭПЭС, 0,1 мМ 2-меркаптоэтанола, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ глутамина и 10% (об/об) фетальной телячьей сыворотки. Рекомбинантный гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), применяемый для культивирования дендритных клеток, был приобретен у компании BD-Pharmingen (Сан-Диего, США) и восстановлен в фосфатно-буферном солевом растворе (ФБСР). Липополисахарид (ЛПС) (L3137, Sigma, Castle Hill, Австралия) восстановили в стерильной дистиллированной воде. Антитело против CDllc-APC было приобретено у компании BD Pharmingen (Сан-Диего, Калифорния, США). Антитела против CD40, CD80 и CD86 получали самостоятельно. Маннан, NaIO4, AHTC, этан-1,2-диол приобретали у компании Sigma.
Маннан, применяемый в данных исследованиях, был получен из пекарских дрожжей (Saccharomyces cerevisae). Маннан является сильногетерогенным, включая в себя богатые маннозой полисахариды с различным молекулярным весом в диапазоне от 50 до >1000 кДа.
Способ фракционирования
Раствор маннана (Sigma) в концентрации 20 мг/мл в бидистиллированной воде (БДВ) добавляли в концентраторы Vivaspin объемом 20 мл с номинально отсекаемым молекулярным весом 300 кДа (Sartorius), центрифугировали при 2500 об/мин в течение 15-20 мин и концентрировали до объема 1-2 мл (фиг.1). Концентратор повторно наполняли, пока не была израсходована вся проба. Было необходимо несколько центрифугирований. Фильтрат собирали и проводили 2 промывки бидистиллированной водой, но прошедший раствор отбрасывали. Сконцентрированная фракция (ретентат) представляет собой фракцию >300 кДа. После этого фильтрат внесли в центрифужный концентратор Amicon вместимостью 15 мл с номинально отсекаемым молекулярным весом 100 кДа (Millipore) и выполнили процедуру как подробно описано выше. После этого маннан последовательно фракционировали при помощи двух центрифужных концентраторов Amicon вместимостью 15 мл с номинально отсекаемым молекулярным весом 50 кДа (Millipore), а затем при помощи двух центрифужных концентраторов Amicon вместимостью 15 мл с номинально отсекаемым молекулярным весом 30 кДа (Millipore). В результате получали фракции >300, 100-300, 50-100, 30-50 и <30 кДа. Фракции ретентата и конечный фильтрат лиофилизировали с получением белого рыхлого порошка, за исключением фракции <30 кДа, которая была клейкой и посему не применялась. Пробы взвешивали и регистрировали степени восстановления.
При проведении фракционирования в дальнейшем в качестве первого этапа фракционирования применяли два концентратора Vivaspin вместимостью 20 мл с номинально отсекаемым молекулярным весом 1000 кДа (Sartorius), после чего применяли другие концентраторы в последовательности, описанной выше. В результате получали фракции >1000, 300-1000, 100-300, 50-100, 30-50 и <30 кДа.
Как указано ранее, фракции ретентата и конечный фильтрат лиофилизировали с получением белого рыхлого порошка, а фракцию <30 кДа не применяли. Пробы взвешивали и регистрировали степени восстановления. При некоторых прогонах во фракции 300-1000 кДа не было получено порошка, и в этих прогонах данную фракцию не применяли для проведения анализа.
Количественное определение альдегидных остатков в маннанах при помощи способа количественного определения с ПДПГ
Способ определения количества альдегидных групп в окисленных маннанах схематически изображен на фиг.2. Применяется одна и та же молярная концентрация NaIO4, чтобы степень окисления зависела от молекулярного веса маннана. Маннан и фракции маннана 1,4 мг/0,1 мл в 0,1 М фосфатном буфере, при pH 6,0 окисляли с помощью 0,01 М NaIO4 и давали реакции проходить в течение 1 ч на льду в темноте. Реакцию останавливали добавлением 10 мкл этан-1,2-диола и осталвляи реакцию еще на 1/2 ч перед пропусканием через колонку PD10, уравновешенную 0,1 М ацетатным буфером при pH 4,8.
Один миллилитр из 2 мл окисленного маннана в концентрации 0,7 мг/мл применяли для реакции с 0,1 мг ПДПГ, при вращении в течение ночи при комнатной температуре, после чего пропускали через колонку PD10 с бидистиллированной водой. Количество альдегидных групп можно определить с помощью реакции с 0,01 М ДТТ в течение 15 мин. и измерения поглощения при 343 нм (OD343). При этом высвобождается 2-пиридин, который является индикатором альдегидных групп (фиг.2).
Количество альдегидных остатков
= концентрация 2-пиридинтиона (М) / концентрация маннана (М)
= [OD343/8080] / [концентрация маннана (мг/мл) / молекулярный вес маннана].
Средние значения молекулярного веса, применяемые для различных фракций, составляют: цельный препарат маннана = 500 кДа, >1000=1000 кДа, >300=650 кДа, 100-300=200 кДа, 50-100=75 кДа, 30-50=40 кДа.
Химическая модификация маннанов при помощи АНТС и количественное определение
Химическая модификация окисленного маннана при помощи АНТС схематично изображена на фиг.3. Маннан и фракции маннана 1,4 мг/0,1 мл в 0,1 М фосфатном буфере с рН 6,0 окисляли с помощью 0,01 М NaIO4 и давали реакции проходить в течение 1 ч на льду в темноте. Реакцию останавливали добавлением этан-1,2-диола и оставляли реакцию еще на 1/2 ч перед пропусканием через колонку PD10, уравновешенную 0,1 М ацетатным буфером, при pH 4,8.
Один миллилитр раствора 0,7 мг/мл окисленного маннана, фракций >300 кДа, 100-300 кДа, 50-100 кДа и 30-50 кДа применяли для реакции с 0,288, 0,184, 0,598, 1,59 и 2,99 мг АНТС (при 400-кратном избытке) в смеси 3:17 уксусной кислоты и бидистиллированной воды, соответственно. Добавляли цианоборгидрид натрия (50 мкл, 1 М; Sigma) и проводили реакцию при вращении в течение ночи при комнатной температуре, после чего пропускали через колонку PD10, уравновешенную бидистиллированной водой. Определяли флуоресценцию конъюгатов с АНТС в сравнении со стандартом АНТС при возбуждении при длине волны 405 нм и испускании при длине волны 520 нм.
Тест с резорцинолом для количественного определения остатков маннозы
Проводили количественное определение маннана и фракций маннана при помощи теста с резорцинолом (Monsigny et al., 1988). В качестве стандарта использовали маннозу. Планшет считывали при поглощение при 450 нм (т.к. не было 430 или 480 нм).
Конъюгация антигенов с маннаном
Конъюгация белков с окисленным маннаном схематически изображена на фиг.4. Маннан и фракции >1000 кДа, 300-1000 кДа (или >300 в более ранних прогонах), 100-300 кДа, 50-100 кДа, 30-50 кДа в концентрации 14 мг/мл в 0,1 М фосфатном буфере при рН 6,0 (кроме фракции 30-50, концентрация которой составляла 14 мг/0,5 мл) окисляли добавлением 0,1 М NaIO4: 100, 77, 250, 600 мкл и 1,25 мл, соответственно, и доводили до конечного объема 1,6 мл.
Смесь помещали на 1 ч на лед в темноте, останавливали реакцию этан-1,2-диолом и оставляли реакцию дополнительно на 1/2 ч, как описано выше. Конъюгаты разделяли на колонке PD10 (GE Biosciences), предварительно уравновешенной с 0,05 М бикарбонатным буфером с pH 9,0, для удаления непрореагировавшего материала и побочных продуктов. При прогоне через колонку пропускали 1,6 мл пробы, затем пропускали через колонку 0,9 мл буферного раствора и отбрасывали. Следующие 2 мл собирали и проводили реакцию 1 мл окисленного маннана или фракции с рассчитанным количеством 0,35, 0,3, 0,495, 0,735 и 0,59 мг FP и OVA, соответственно. Конъюгаты инкубировали в течение ночи при комнатной температуре и разделяли в 4-12% или 4-20% ДСН-ПАА геле для проверки успешности конъюгации. Свидетельством удачной конъюгации является наличие размазанного пятна и отсутствие четко выраженной белковой полосы.
Для получения конечного конъюгата >1000 MFP, применяемого в исследованиях in vivo, проводили реакцию 0,7 мг FP (5,45 мг/мл, 128 мкл) с 2 мл окисленного маннана. Схожим образом, для получения конъюгата >1000 ManRSVg проводили реакцию 0,25 мг RSVg (0,37 мг/мл, 367 мкл) с 2 мл окисленного маннана.
Молярная концентрация маннана в >1000 MFP составляет половину от концентрации в MFP, следовательно, для исследований иммуногенности in vivo применяли 10 мкг FP.
Гель-электрофорез в нативных и денатурирующих условиях
Проводили визуализацию маннана и фракций в ДСН-ПААГ или в геле в нативных условиях. Готовые (ПАА гели) с ДСН 4-12% или 4-20% градиентные гели (ПАА гели) прогоняли через колонку электродного буфера 1 × MOPS с ДСН. В соответствии с другим вариантом, применяли 12% геля при нативных условиях (основные условия), состоящего из 5% концентрирующего геля, приготовленного в 0,063 М трис-HCl при pH 6,8, и разделяющего геля, приготовленного в TBE. Электрофорез проводили в TBE с добавлением 0,19 М глицина (Sharma et al., 2003).
Для окрашивания белков и сахаров в геле применяли окрашивание кумасси и окрашивание Шифф-йодной кислотой (ШИК-окрашивание), соответственно.
Определение молекулярного веса фракций маннана при помощи денситометрии
Фракции маннана окисляли при помощи NaIO4 и метили с помощью АНТС, как описано выше. Пробы меченного АНТС маннана анализировали в ДСН-ПААГ после окрашивания Шифф-йодной кислотой. Высушенные гели сканировали и анализировали при помощи денситометрии с помощью программного обеспечения Quantity One (Bio-Rad).
Получение дендритных клеток костномозгового происхождения
Дендритные клетки мышей были получены, как описано ранее (Apostolopoulos et al., 2006). Кратко, клетки костного мозга экстрагировали из полости бедренной кости и большой берцовой кости. Затем клетки костного мозга обрабатывали стерильным раствором 0,73% (мас./об.) NH4C1 в течение 10 мин. при 37°C для того, чтобы лизировать эритроциты. Клетки промывали и ресуспендировали в полной среде (2×106 клеток/3 мл) с добавлением 10 нг/мл ГМ-КСФ. Эти клетки культивировали в течение 4 дней в 24-луночном планшете (1 мл/лунку). Клетки собирали с помощью осторожного отбора культуральной среды пипеткой. Культивируемые в присутствии ГМ-КСФ клетки костного мозга дают большое количество дендритных клеток, экспрессирующих ГКГ класса II, которые являются стимулирующими клетками для реакции смешанной культуры лимфоцитов (РСКЛ).
Исследования in vitro созревания дендритных клеток
Для исследований созревания применяли полученные от мышей C57BL/6 дендритные клетки. Дендритные клетки извлекали из культуральных планшетов и ресуспендировали 1×105 дендритных клеток в 150 мл полной среды RPMI с добавлением 10 нг/мл ГМ-КСФ и высевали в 48-луночные планшеты. Маннан и различные фракции маннана добавляли таким образом, чтобы конечные концентрации в лунках составляли 800, 400 и 200 мкг/мл. ЛПС (1 мкг/мл) применяли в качестве положительного контроля и тоже добавляли в соответствующие лунки и инкубировали при 37°C в течение 18 ч. Клетки собирали и окрашивали антителом против CD11c-APC, вместе с антителом против CD86, против CD40 или против CD80, которое было конъюгировано с флуоресцеинизотиоцианатом (ФИТЦ). Клетки CDllchigh гейтировали и определяли интенсивность ФИТЦ при помощи анализа гистограмм с целью оценки состояния созревания дендритных клеток.
Исследование иммуногенности in vivo на мышах
Мыши и иммунизации
Мышей HLA-A2/Kb приобретали у компании Animal Resources Centre (Перт, Австралия). Для определения эффекторных иммунных ответов, индуцированных MFP, >1000 MFP и неконъюгированным FP, мышей HLA-A2/Kb иммунизировали внутрикожно у основания хвоста объемом 100 мкл на 0, 10 и 17 день и проводили оценку иммунных ответов через 10-14 дней при помощи иммуноферментного спот-анализа. У мышей отбирали пробы крови после 2ой и 3ей инъекции и определяли содержание специфических к MUC1 антител: суммарного Ig, IgG2a и IgG1, при помощи анализа ELISA.
Антиген-специфические T-клеточные ответы in vivo
Клетки селезенки выделяли из иммунизированных мышей HLA-A2/Kb и проводили оценку на антиген-специфичную секрецию IFN-γ при помощи иммуноферментного спот-анализа. В планшетах смешанного ацетата (MAIP Millipore) иммобилизовали в течение ночи антитела против IFN-γ мыши (AN18, 5 мкг/мл, Mabtech, Германия). Добавляли по 5×105 клеток селезенки в лунку и инкубировали в 10% FCS среде RPMI 1640 в присутствии MUC-FP (20 мкг/мл) в течение 18 ч. В качестве положительного и отрицательного контролей применяли ConA (1 мкг/мл) или только клетки, соответственно. Клетки отбирали и после промывки (0,05% Твин-20/ФБСР) добавляли конъюгат антитела против IFN-γ мыши с биотином (R4-6A2, Mabtech, Калифорния, США) на 2 ч, после чего добавляли конъюгат экстравидина с щелочной фосфатазой (ЩФ) в концентрации 0,1 мкг/мл (Sigma, Великобритания) на 2 ч при комнатной температуре. Оценку активности по пятнам проводили при помощи набора для колориметрического определения ЩФ (Biorad, Hercules, Калифорния, США). Количественную оценку пятен, соответствующих цитокинам, проводили при помощи системы AID ELISpot Reader (Autoimmun Diagnostika GmbH, Германия). Данные представлены как средние значения пятнообразующих единиц (ПОЕ) на 0,5×106 клеток +/- стандартное отклонение от среднего (СО).
Исследование иммуногенности у человека in vitro для белковых антигенов, связанных с окисленным маннаном >1000 кДа
Белковые/пептидные антигены
Белок MART-1 приобретали у компании Biovision, США. GST-MUC1-VNTR (FP) получали как описано в Apostolopoulos et al., 1993. His-меченный MUC1-VNTR (pTrc) получали самостоятельно в векторе pTrcB (Invitrogen) (Loveland et al., 2006). Пептиды эпитопов HLA-A2, специфические для белка Мелан-A/MART-1 [EAAGIGILTV (нативный) (SEQ ID NO: 1), ELAGIGILTV (аналог) (SEQ ID NO: 2)] были синтезированы компанией Genscript, США.
Конъюгация GST-MUC1-VNTR (FP), MUC1-VNTR (pTrc) и MART-1 с окисленным маннаном >1000 кДа
Конъюгацию антигенов с окисленным перйодатом маннаном >1000 кДа проводили, как описано ранее. Соотношение маннана >1000 кДа к антигену составляло 40:1.
Получение пептид-специфических CD8 T-клеток
МКПК отделяли от лейкоцитной пленки при помощи центрифугирования в градиенте плотности с помощью Ficoll-Paque PLUS (GE Healthcare). Статус HLA-A2 оценивали при помощи проточной цитометрии. МКПК ресуспендировали при плотности 5×106/мл в полной среде AB (RPMI1640, 10% сыворотка AB, пенициллин/стрептомицин, ГЭПЭС, L-глутамин, аминокислоты, не являющиеся незаменимыми, пируват натрия (Invitrogen), 2-меркаптоэтанол) и стимулировали с помощью 10 мкг/мл пептидного аналога MART-1 (ELAGIGILTV) (SEQ ID NO: 2) и 3 мкг/мл R848 (InvivoGen) в 24-луночном планшете. Через три дня добавляли еще 1 мл полной среды AB с добавлением 50 ед./мл IL-2 (R&D Systems), 20 нг/мл IL-15 и 20 нг/мл IL-7 (Peprotech). Через семь-десять дней после начального праймирования клетки повторно стимулировали с помощью облученных аутологических МКПК (1:100), стимулированных с помощью 2 мкг/мл FMP или 10 мкг/мл пептидного аналога MART-1 (ELA). На следующий день 1 мл супернатанта заменили на свежую порцию полной среды AB, содержащей 25 ед./мл IL-2. Эту манипуляцию повторяли каждые 3-4 дня.
Клоны MART-1-специфических T-клеток получали при помощи флуоресцентно-активированного клеточного сортинга. Секретирующие IFNγ клетки, специфические к пептиду ELAGIGILTV (SEQ ID NO: 2) отсортировывали при помощи FACS Aria после 4 ч инкубации с облученными (6000 с Гр) T2-клетками, стимулированными пептидом. Секретирующие IFNγ клетки выявляли при помощи теста для секреции и детекции IFNγ (Miltenyi Biotech), который проводили согласно протоколу производителя.
Праймирование T-клеточного ответа, специфичного к белковому антигену
Моноциты очищали от МКПК при помощи разделения на AutoMACS с помощью микрошариков CD 14 (Miltenyi Biotech). Полученные из моноцитов дендритные клетки (MoDC) получали культивированием моноцитов (5×105/мл) в полной среде FCS (RPMI1640+10% FCS+L-глутамин, пенициллин/стрептомицин, ГЭПЭС, аминокислоты, не являющиеся незаменимыми, пируват натрия, 2-меркаптоэтанол), содержащей 50 нг/мл ГМ-КСФ и 20 нг/мл IL-4 (R&D Systems), в течение 5-6 дней культуральном флаконе T75.
MoDC при плотности 2×105/мл (для соотношения MoDC:T-клетки 1:20) в полной среде AB добавляли в 24-луночный планшет (1 мл на одно испытание), после чего добавляли белок или конъюгат окисленного маннана >1000 кДа (10-20 мкг/мл). Через четыре часа добавляли 4×106 МКПК, обедненных CD14, в лунки в 1 мл полной среды AB. Через 3 дня добавляли 25 ед./мл IL-2, 10 нг/мл IL-7 и 10 нг/мл IL-15. Т-клетки повторно стимулировали через 7-10 дней с помощью 1×105 MoDC, нагруженных антигеном. Через двадцать четыре часа после повторной стимуляции в культуру добавляли 25 ед./мл IL-2, и еще раз - через 3-4 дня. Культуры T-клеток в типичном случае анализировали после 1 или 2 повторных стимуляций.
Анализ антиген-специфических T-клеточных ответов
В случае пептидов эпитопов для T-клеток: нагруженные пептидами T2-клетки (2×105/лунку) готовили, стимулируя не целевым пептидом (например, CAP-1, 10 мкг/мл или без пептида), и в одной пробе - целевым пептидом (5 мкг/мл) в течение 1 ч в бессывороточной среде с 1,25 мкг/мл β2-микроглобулина. T2-клетки добавляли в соотношении приблизительно 1:5 (4×104/лунку) в 100 мкл в лунки для T-клеток в двух повторах и инкубировали в течение 1 ч при 37°C, 5% CO2. Добавляли 50 мкл среды, содержащей реактив Golgi-Stop (0,1 мкл на 200 мкл совместной культуры T-клеток и MoDC), и инкубировали клетки в течение последующих 3-4 ч при 37°C, 5% CO2.
В случае белкового антигена и конъюгатов: антиген или конъюгаты маннана >1000 кДа (20 мкг/мл) добавляли в 96-лу ночные планшеты с V-образным дном, содержащие 2×104 MoDC/лунку (аутологических или сингенных по A2) в 75-100 мкл полной среды и инкубировали в течение 2 ч. Добавляли 2×105 стимулированных T-клеток в 75-100 мкл полной среды в каждую лунку и инкубировали клетки в течение 15-16 ч при 37°C, 5% CO2. Добавляли 50 мкл среды, содержащей реактив Golgi-Stop (0,1 мкл на 200 мкл совместной культуры T-клеток и MoDC), и инкубировали клетки в течение последующих 4-5 ч при 37°C, 5% CO2.
Анализ ответов с внутриклеточным интерфероном-гамма (IFNγ)
Клетки окрашивали на поверхностные маркеры CD8 и CD4, фиксировали и вызывали повышение проницаемости, затем окрашивали на скопления внутриклеточного IFN-γ при помощи CD4 APC-Cy7, CD8 ФИТЦ и IFN-γ PE-Cy7 (BD) с набором Cytofix/CytoPerm Kit (BD). Антиген-специфические Т-клетки выявляли проточной цитометрией, сравнивая положительные по IFNγ CD4 и CD8 T-клетки в присутствии целевого пептида/белка с контрольными пробами, содержащими не целевой пептид/белок.
Пример 2: Фракционирование маннана
Первоначально маннан последовательно фильтровали через мембраны, как описано в разделе «Материалы и методы», для выделения фракций маннана >300 кДа, 100-300 кДа, 50-100 кДа, 30-50 кДа, 4-30 кДа. В дальнейшем выделяли фракции >1000 кДа, 100-300 кДа, 50-100 кДа и 30-50 кДа. Фракция 4-30 кДа имела вид смолянистого осадка, поэтому не была включена в последующие исследования.
Разделение осуществляли посредством последовательного фракционирования известного объема маннана с известной концентрацией через мембраны 300 кДа, 100 кДа, 50 кДа, 30 кДа (фиг.1). Проточную и промывные фракции с каждой мембраны пропускали через следующую мембрану. Все разделения проводили при помощи воды и в конце все пробы лиофилизировали и регистрировали вес белых порошков (таблица 1).
В различных фракциях анализировали содержание альдегидных остатков, образованных после проведения реакции с 0,01 М NaIO4, как описано в разделе способов. Как видно из таблицы 1, цельный препарат маннана, фракции >300 кДа, 100-300 кДа, 50-100 кДа и 30-50 кДа дают результат 73, 82, 35, 19 и 9 альдегидных остатков, соответственно (например, прогон 7).
Пример 3: Связывание различных фракций маннана с рецептором маннозы
Клетки Huh-7 - это клетки гепатоцеллюлярной карциномы человека, которые экспрессируют рецепторы маннозы. Известно, что комплекс манноза-БСА связывается с рецептором маннозы, и он был включен в данные исследования в качестве положительного контроля. Цельный препарат маннана и различные фракции метили с помощью ФИТЦ и наблюдали связывание с клетками huh-7 при помощи проточной цитометрии (фиг.5).
Связывание цельного препарата маннана и всех фракций с клетками huh-7 является дозо-зависимым. Следовательно, независимо от размера, все фракции маннана связываются с рецептором маннозы или другими маннозо-связывающими пектинами.
Пример 4: Активация дендритных клеток костномозгового происхождения маннаном и различными фракциями маннана
Для определения, способны ли различные фракции маннана активировать дендритные клетки костномозгового происхождения (ДККП), и превосходит ли по этой характеристике какая-либо фракция цельный препарат маннана, фракции инкубировали с дендритными клетками в различных дозировках и в течение различных периодов времени, и проводили мониторинг маркеров созревания: CD40, CD80 и CD86, при помощи проточной цитометрии (фиг.6). Как видно на фиг.6, все фракции активировали дендритные клетки, при этом активация зависела от дозы и времени. Фракция >300 кДа превосходила по этой характеристике цельный препарат маннана.
Пример 5: Выделение фракции маннана >1000 кДа
Так как фракция маннана >300 кДа активировала дендритные клетки костномозгового происхождения более эффективно, чем цельный препарат маннана, для анализа выделили фракцию с более высоким молекулярным весом. Для выделения фракции с еще более высоким молекулярным весом цельный препарат маннана пропустили через концентратор Centriprep с мембраной с номинально отсекаемым молекулярным весом 1000 кДа. Выход различных фракций показан в таблице 2. Интересно отметить, что размер фракции 300-1000 кДа был существенно снижен, что свидетельствует о том, что маннаны >1000 кДа преобладают в ранее выделяемой фракции маннана >300 кДа.
Пример 6: Сравнение активности фракции маннана >1000 кДа с цельным препаратом маннана и фракцией маннана >300 кДа
Способность различных доз фракции >1000 кДа стимулировать дендритные клетки костномозгового происхождения измеряли путем наблюдения увеличения уровня CD40 и CD86 через 48 ч при помощи проточной цитометрии (фиг.7A и 7B, соответственно). Сравнивали фракцию >1000 кДа с фракцией >300 кДа и цельным препаратом маннана, и было очевидно, что фракция >1000 кДа была более активна, чем цельный препарат маннана, и схожа с фракцией >300 кДа.
Пример 7: Анализ молекулярного веса фракций маннана
Как указано выше, различные фракции маннана могут активировать дендритные клетки костномозгового происхождения, связываться с рецептором маннозы, а фракция маннана >1000 кДа является наиболее биологически активной фракцией. Однако, важно иметь возможность проводить анализ биохимических свойств фракций, а также получать значения относительного молекулярного веса фракций, чтобы можно было установить спецификации. В настоящем изобретении уже было показано, что различные маннаны дают различное количество альдегидных групп при окислении с помощью NaIO4 (таблицы 1 и 2).
Тест с резорцинолом, в котором измеряют содержание маннозы в маннане, также можно применять как способ выявления различных фракций маннана (фиг.8).
Маннаны - это углеводы, которые не несут заряда и являются высоко гидрофильными и, в результате, они не мигрируют в ДСН-ПАА гелях, применяемых для анализа белков. Часто углеводы подвергают модификации с целью внесения зарядов и придания гидрофобных свойств для проведения анализа. Для придания таких свойств проводили реакцию окисленных маннанов с АНТС. Анализ фракций маннана, меченных АНТС, в ПАА геле в нативных условиях (фиг.9) не позволил разделить маннаны на основании их относительного молекулярного веса.
Однако, при анализе меченных АНТС фракций в ДСН-ПААГ они мигрировали образом, схожим с фракционированием по молекулярному весу (согласно номинально отсекаемому молекулярному весу мембран) (фиг.10). ДСН-ПАА гели сканировали и применяли для денситометрического анализа (фиг.11). Также применяли обычные белковые стандарты. Это позволило оценить диапазоны молекулярного веса для полос, которые, в отличие от указанных белков, были протяженными (широкими полосами). Для валидации анализа проанализировали маннаны из прогонов нескольких фракций. Стандартные кривые строили на основании данных об известном молекулярном весе (белка или фракций маннана) и относительной подвижности (Rf). Rf определяют как частное от деления суммарно пройденного расстояния на расстояние, пройденное конкретной полосой (фиг.12). На основании стандартных кривых вычислили относительный молекулярный вес различных фракций маннана (фиг.13 и 14).
Пример 8: Конъюгация MUC1-FP с маннаном
Различные фракции маннана конъюгировали с MUC1-FP, как описано в разделе способов. Так как молекулярный вес и количество образованных альдегидных групп различаются в цельном препарате маннана, по сравнению с фракциями, количество применяемого FP было нормировано как молярное соотношение MUC1-FP с альдегидами. Кроме того, конъюгированию и анализу в ДСН-ПААГ подвергли разные количества MUC1-FP в определенном диапазоне (фиг.15).
Пример 9: Активность in vivo >1000 MFP и MFP у мышей
Цельный препарат маннана и маннан >1000 кДа получали, как описано выше, и применяли для исследования иммуногенности in vivo.
Для определения иммуногенности MUC1, соединенного с цельным препаратом маннана, маннаном >1000 кДа, конъюгаты или MUC1-FP инъецировали мышам внутрикожно в дозировке 10 мкг на 0, 10, 17 и 14 день. Мышей подвергали эвтаназии для проведения анализа клеточных ответов при помощи метода иммуноферментных пятен (фиг.16). Антиген-специфические ответы с участием IFN-γ на различные дозы MUC1-FP измеряли в культурах спленоцитов, полученных от иммунизированных мышей. Как показано на фиг.16, клеточные ответы значимо не различались между мышами, иммунизированными MUC1-FP, MFP и >1000 MFP. Сыворотку, полученную от иммунизированных мышей, испытывали на содержание специфических антител против MUC1: суммарных IgG, IgG1 и IgG2a (фиг.17). Интересно отметить, что у мышей, иммунизированных >1000 MFP титр специфических антител IgG2a против MUC1 был приблизительно в 10 раз выше, чем у других групп. Схожее отличие уровня IgG2a было продемонстрировано в сыворотке, полученной от мышей после 2 иммунизации (данные не приведены).
Пример 10: Определение параметров маннана и возможные способы анализа для контроля качества
В настоящее время маннан приобретается у компании Sigma. Он не соответствует стандарту надлежащей производственной практики (GMP), и единственная предоставляемая о нем информация показана на фиг.18. В случае дрожжевого маннана, который приобретен у производителя, будет важно убедиться, что он соответствует определенному стандарту. Тест с ПДПГ можно применять для измерения количества альдегидов, тест с резорцинолом - для измерения содержания маннозы, и тест с АНТС - для определения параметров различных серий маннана.
Пять серий маннана, приобретенных у компании Sigma, проанализировали при помощи теста с резорцинолом. Как показано на фиг.19A, все серии продемонстрировали одинаковые кривые зависимости поглощения от концентрации, что свидетельствует об одинаковом содержании маннозы в маннанах. На фиг.19B представлена стандартная кривая для маннозы, полученная в тесте с резорцинолом. Схожим образом, все 5 серий проанализировали на содержание альдегидных остатков после окисления NaIO4 (фиг.20).
По данным трех независимых измерений можно видеть, что число альдегидных остатков варьирует от 90 до 155. Следовательно, можно установить, что маннан считается соответствующим спецификации, если количество образующихся альдегидных остатков составляет 125±20%. Схожим образом, можно провести реакцию окисленного маннана с АНТС вместо ПДПГ для измерения флуоресценции (фиг.21). Интересно отметить, что разброс значений во всех сериях при этом тесте также составляет приблизительно ±20%.
Пример 11: GST-MUC1-VNTR (FP):
Конъюгация
FP конъюгировали с окисленным маннаном >1000 кДа (>1000 MFP), как описано ранее (фиг.22).
Иммуногенность FP, соединенного с окисленным маннаном фракции >1000 кДа
Линию MUC1-специфических T-клеток получали при помощи повторной стимуляции конъюгатом окисленный маннан-pTrc с последующим сортингом MUC1-специфических T-клеток и их размножением. Исследовали способность аллогенных дендритных клеток (BC16), стимулированных конъюгатами маннана, презентировать MUC1 линии MUC1-специфических T-клеток. Конъюгат >1000 MFP был способен стимулировать линию MUC1-специфических T-клеток, как показано на фиг.23. Конъюгат >1000 MFP имел более высокую эффективность при стимуляции T-клеток, чем неконъюгированный FP при дозировках 10 и 20 мкг/мл.
Пример 12: MUC1-VNTR (pTrc):
Конъюгация
MUC1-VNTR (PTrc) конъюгировали с окисленным маннаном >1000 кДа (фиг.24). Провели реакцию различных количеств pTrc с окисленным маннаном >1000 кДа для определения оптимального соотношения. Для исследований иммуногенности применяли конъюгаты с соотношением антиген : маннан, составлявшим 1:40 (1/2×, дорожка 5).
Иммуногенность MUC1-VNTR, конъюгированного с окисленным маннаном фракции >1000 кДа
Иммуногенность in vitro pTrc, соединенного с окисленным маннаном фракции >1000 кДа определяли при помощи линии pTrc (MUC1)-специфических T-клеток (полученных от донора BC13), у которых был вызван вторичный иммунный ответ с помощью MoDC (замороженных, BC17K) (фиг.25). Как показано, pTrc не был эффективно процессирован и презентирован для MUC1-специфических T-клеток. Однако конъюгат >1000 кДа стимулировал MUC1-специфические T-клетки более эффективно, чем неконъюгированный pTrc. Аутологические MoDC, стимулированные с помощью 20 мкг/мл pTrc, конъюгатов >1000 кДа - pTrc применяли для вторичных иммунных MUC1-специфических CD8-ответов у линии MUC1-специфических T-клеток, полученных от здорового донора BC17K (фиг.26). Конъюгаты окисленного маннана >1000 кДа эффективно стимулировали внутриклеточное выделение IFNγ в CD8 T-клетках, по сравнению с неконъюгированным антигеном.
Пример 13: MART-1
Конъюгация
Рекомбинантный белок MART-1 также присоединяли к окисленному маннану >1000 кДа, как описано выше (фиг.27). С белком MART-1 было приготовлено два типа конъюгатов: нормальный и восстановленный. В составе белка MART-1 содержится несколько цистеинов, и следовательно, он склонен к окислению на воздухе и агрегации. Для облегчения конъюгации белок MART-1 сначала восстановили с помощью ДТТ, а затем применяли для конъюгации.
Иммуногенность конъюгатов MART-1 с окисленным маннаном >1000 кДа
Праймирование T-клеток и вторичный иммунный ответ, вызванный пептидами
МКПК и MoDC, полученные от 2 доноров (BC28 и BC29), применяли для праймирования с конъюгатами MART-1 и окисленного маннана >1000 кДа (20 мкг/мл), как описано в примере 1. После 1 стимуляции измеряли ответы T-клеток, специфические к аналогу или нативному MART-1 пептиду, применяя стимулированные T2-клетки (фиг.28). T-клетки донора BC28, праймированные окисленным маннаном >1000 кДа-MART-1, эффективно отвечали на аналоговый или нативный MART-1-пептиды, презентированные T2-клетками (фиг.28). Культуры BC28 и BC29 повторно стимулировали соответствующими белками и конъюгатами и испытывали на MART-1-специфические ответы T-клеток при помощи аутологических стимулированных MoDC в качестве антиген-презентирующих клеток (фиг.29). Стимулированные MoDC были способны вызывать MART-1-специфические вторичные иммунные ответы в CD8 T-клетках, полученных от доноров BC28 и BC29 и стимулированных с помощью конъюгата окисленного маннана >1000 кДа. Праймирование с помощью конъюгата MART-1 с окисленным маннаном >1000 кДа было более эффективным, чем Праймирование с помощью неконъюгированного белка.
Пример 14: Исследования иммуногенности in vivo при помощи смеси инактивированного вируса гриппа (H1N1) и маннана >1000 кДа
Вирус гриппа и мыши
Выращенный в яйцах вирус H1N1 (А/Новая Каледония/20/1999) очищали в градиенте сахарозы, концентрировали и инактивировали с помощью β-пропиолактона, для получения препарата зонального пула вируса гриппа (ЗПГ), который был любезно предоставлен д-ром Ианом Барром (Ian Barr), заместителем директора центра сотрудничества в области сбора информации и исследования вируса гриппа (Северный Мельбурн, Австралия). Все мыши были самками линии BALB/c, предоставленными компанией WEHI (Мельбурн, Австралия), и на момент первой иммунизации их возраст составлял 8-10 недель.
Получение смесей H1N1 с маннаном >1000 кДа
Смеси H1N1 с маннаном >1000 кДа получали путем разведения исходного препарата H1N1 (от 2,7 мг/мл) и исходного препарата маннана >1000 кДа (от 14 мг/мл) в стерильном буфере ФБСР таким образом, чтобы требуемая доза каждого соединения находилась в пределах 50 мкл. Маннан >1000 кДа выделяли, как описано ранее.
Иммунизации
Все иммунизации осуществляли интраназальным путем. При полной анестезии (при помощи ингаляции метоксифлуораном) и поддерживая мышей в вертикальном положении, аккуратно с помощью пипетки поочередно вносили капли приблизительно по 5 мкл в каждую ноздрю.
Отбор проб сыворотки и БАС (бронхоальвеолярного смыва/легочного смыва)
Сыворотку собирали путем забора крови из ретро-орбитального синуса, как описано. Перед сбором БАС мышам проводили эвтаназию при помощи смеси кетамина и ксилазила. Удаляли ткани для экспонирования верхней части трахеи и делали в ней небольшой надрез. С помощью тупоконечной иглы, присоединенной к шприцу объемом 1 мл, аккуратно вводили 1 мл ФБСР в легкие и отбирали обратно.
Определение титра антител при помощи анализа ELISA
Анализ ELISA проводили при помощи системы HRP/TMB. Планшеты покрывали цельным инактивированным вирусом H1N1 (А/Новая Каледония/20/1999) в концентрации 1 мкг/мл. Суммарные антитела IgG против H1N1 выявляли при помощи крысиных антител против IgG мыши, конъюгированных напрямую с HRP (GE healthcare, продукт №RPN1231V), а антитела IgG1, IgG2a и IgA выявляли при помощи меченных биотином первых антител компании Pharmingen (продукты №553441, 553388 и 556978) и вторичного конъюгата стрептавидин-HRP компании GE healthcare (продукт №346480). Конечный титр измеряли как последнее значение при титровании, которое остается выше значения в соответствующей контрольной пробе, при этом значение в контрольной пробе вычисляли как значения оптической плотности (OD) + 2 стандартных отклонения для сыворотки не подверженных ранее экспериментам мышей (3-5 мышей) в каждой титрационной точке.
Группы из 4 мышей BALB/c иммунизировали интраназально с помощью H1N1 (1 мкг) или H1N1 в смеси с маннаном >1000 кДа (100 мкг) на 0, 14 день. Через 10-14 дней после иммунизации анализировали сыворотку и легочный секрет мышей на специфические к H1N1 антитела IgG1, IgG2a и IgA. Как видно на фиг.30, маннан >1000 кДа усиливал ответ с участием IgG1 сыворотки. Еще более важно, что маннан >1000 кДа был эффективен в усилении образования сывороточных и легочных H1N1-специфических антител IgA.
Специалистам в данной области техники будет понятно, что в изобретение могут быть внесены различные вариации и/или модификации, как показано в конкретных примерах осуществления, которые сохраняются в пределах сущности более широко описанного изобретения. Следовательно, настоящие варианты осуществления следует рассматривать во всех смыслах как иллюстративные и не ограничивающие.
Все публикации, которые обсуждаются и/или цитируются в настоящем описании, включены полностью в виде ссылок.
Все обсуждения документов, актов, материалов, устройств, статей и т.п., которые были включены в настоящее описание изобретения, приведены исключительно с целью предоставления контекста настоящего изобретения. Это не должно трактоваться как признание того, что какие-либо из этих вопросов являются частью известного уровня техники или были общеизвестны специалистам в данной области, к которой относится настоящее изобретение, поскольку они существовали до даты приоритета каждого пункта формулы настоящего изобретения.
Настоящая заявка испрашивает приоритет от заявок US 61/333086, поданной 10 мая 2010 г., AU 2010901997, поданной 10 мая 2010 г. и AU 2010904060, поданной 9 сентября 2010 г., содержание каждой из которых полностью включено в настоящее изобретение посредством ссылок.
СПИСОК ЦИТИРОВАННЫХ ИСТОЧНИКОВ
Anumula, Analytical Biochemistry (1994) 220:275 Apostolopoulos et al, Br. J. Cancer (1993) 67:713 Apostolopoulos et al., Vaccine (2000) 18:3174 Apostolopoulos et al, Vaccine (2006) 24:3191
Barreto-Bergter and Gorin, Adv. Carbohydr. Chem. Biochem. (1983) 41:67
Cheever et al., Clin. Cancer Res (2009) 15:5323
Loveland et al., Clin. Cancer Res (2006) 123:869
Monsigny et al, Analytical Biochemistry (1988) 175:525
Pietersz et al., Current Medicinal Chemistry (2006) 13(14):1591
Sharma et al., Electrophoresis (2003) 24:2733
Sutcliffe et al., Science (1983) 219:660
Tang et al., Immunology (2007) 120:325
Tang et al., Vaccine (2008) 26:3827
Tang et al., Biomaterials (2009) 30:1389
van der Bruggen, et al. Science (1991) 245
Vinogradov et al, Carbohydr. Res. (1998) 307
Wang et al., Journal of Chromatographic Science (2007) 45:200

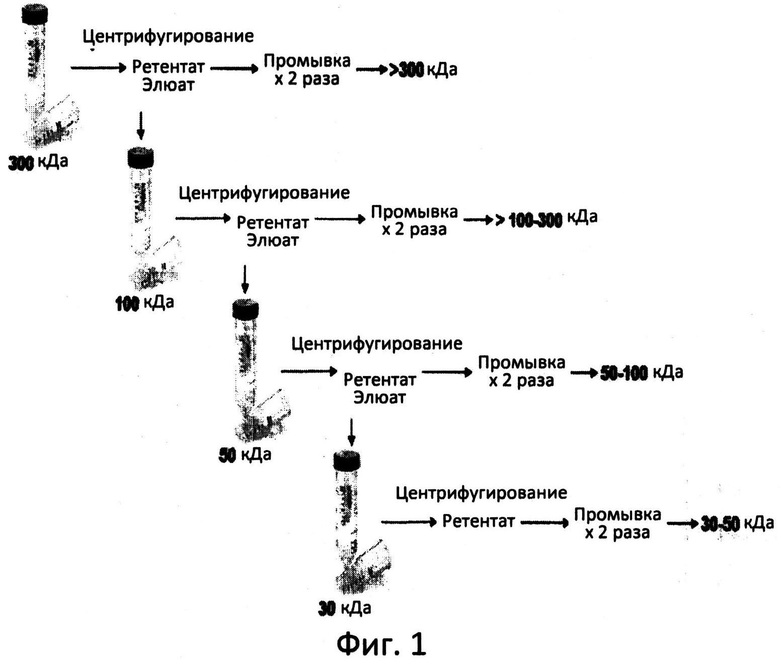
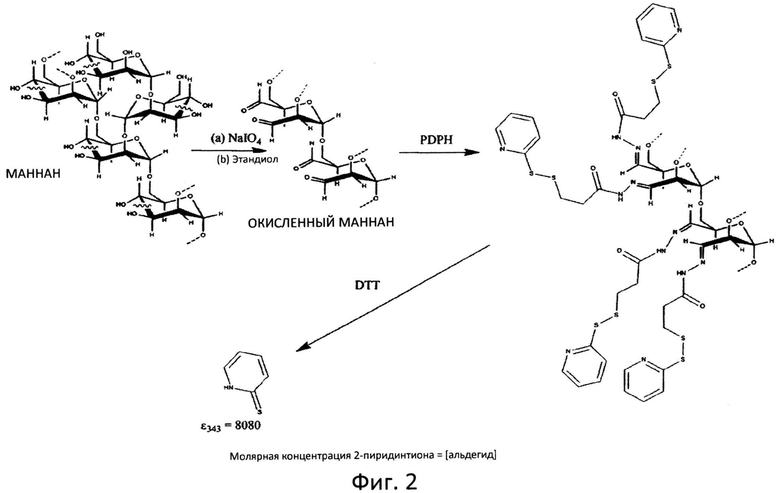
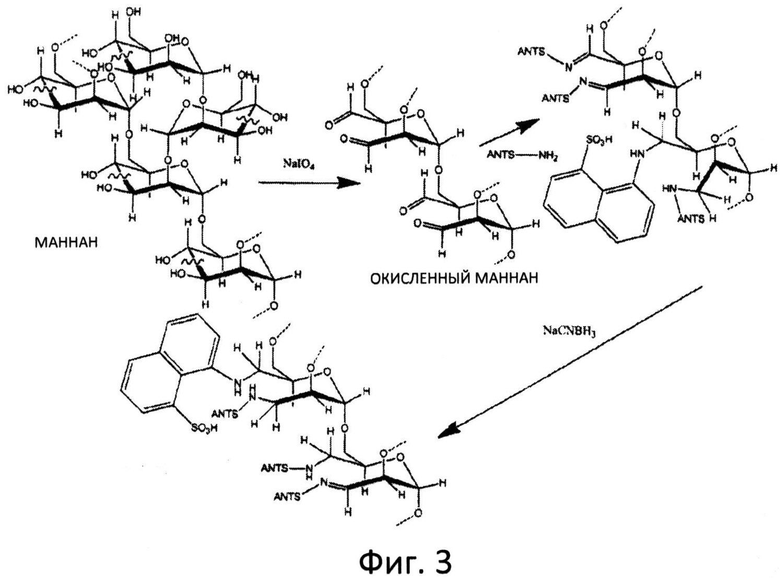
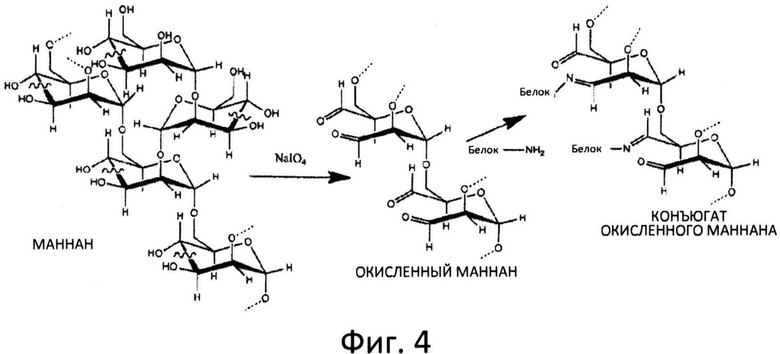
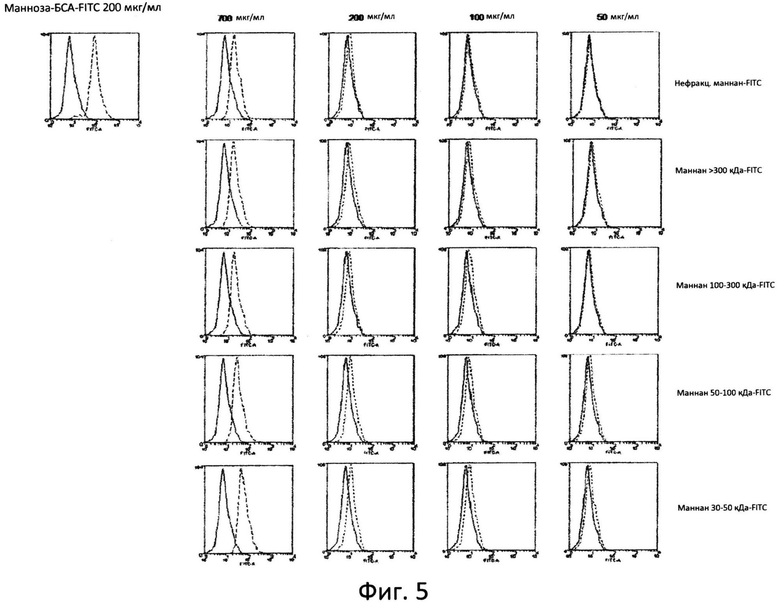
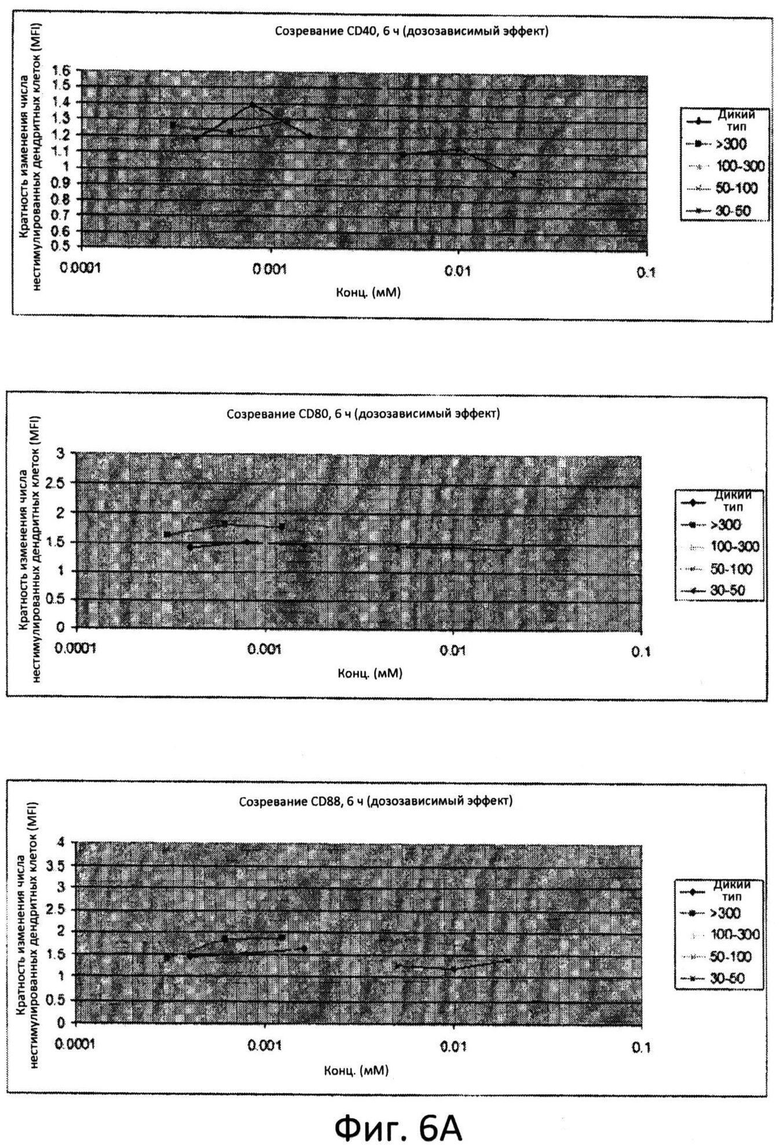
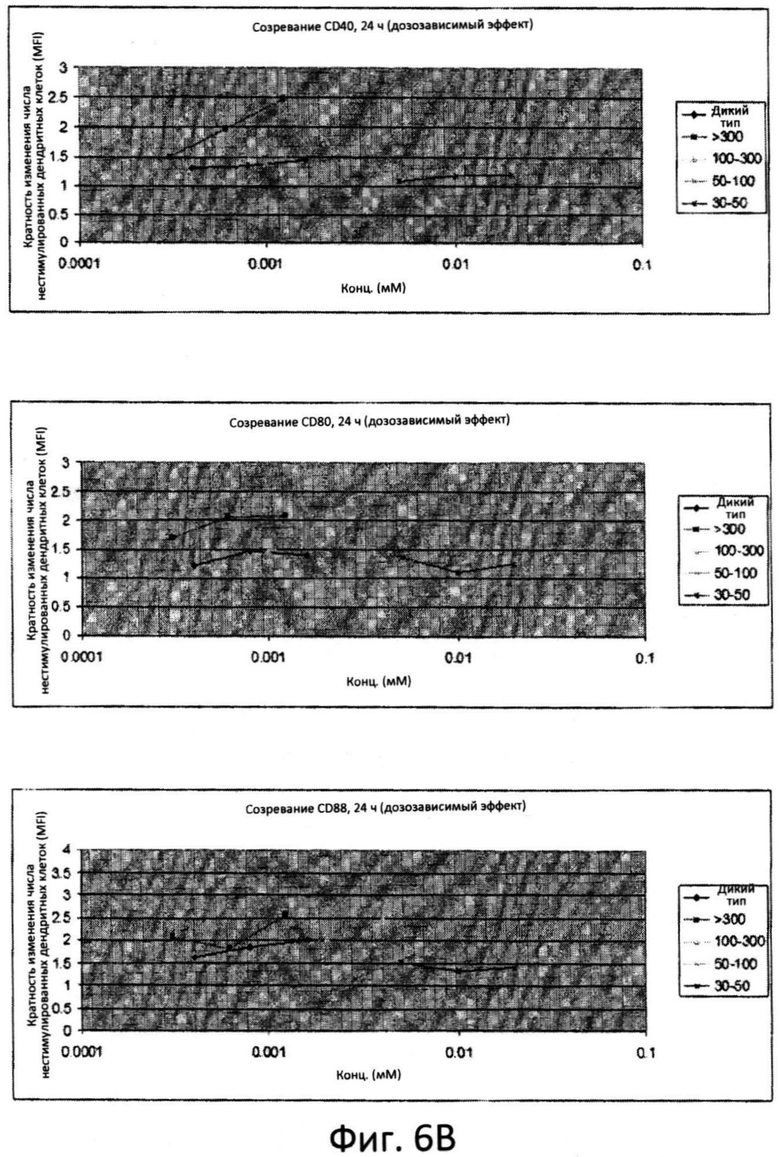
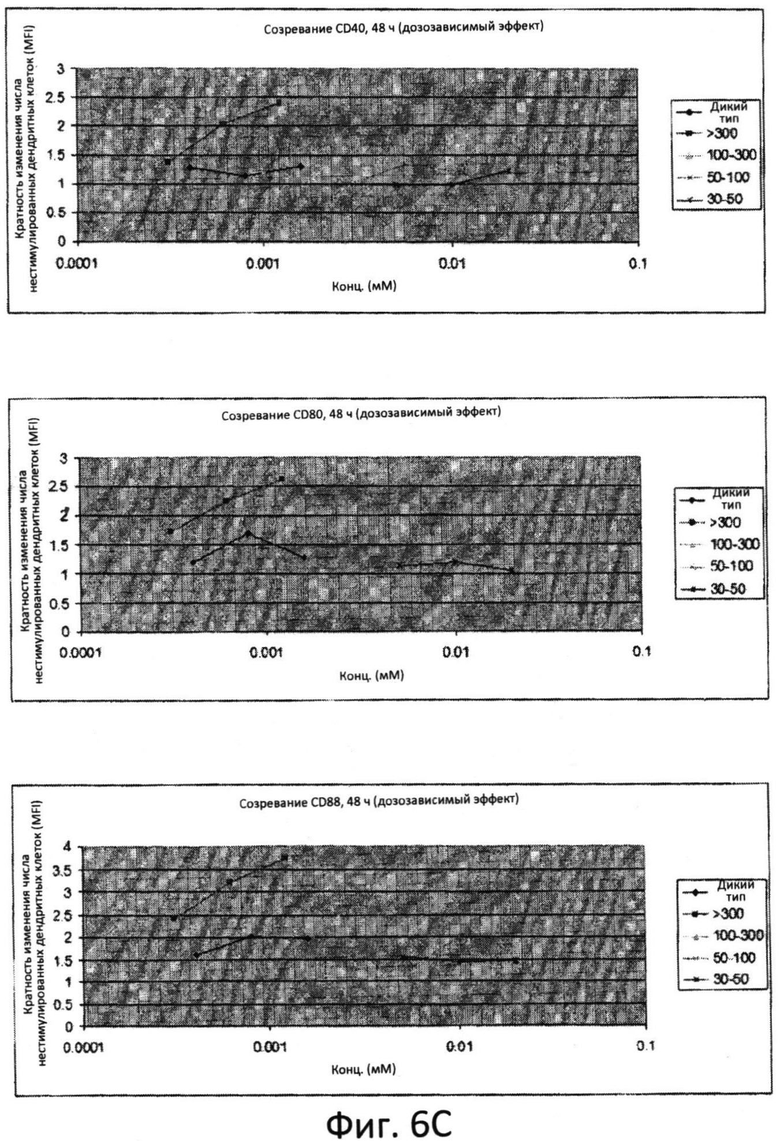


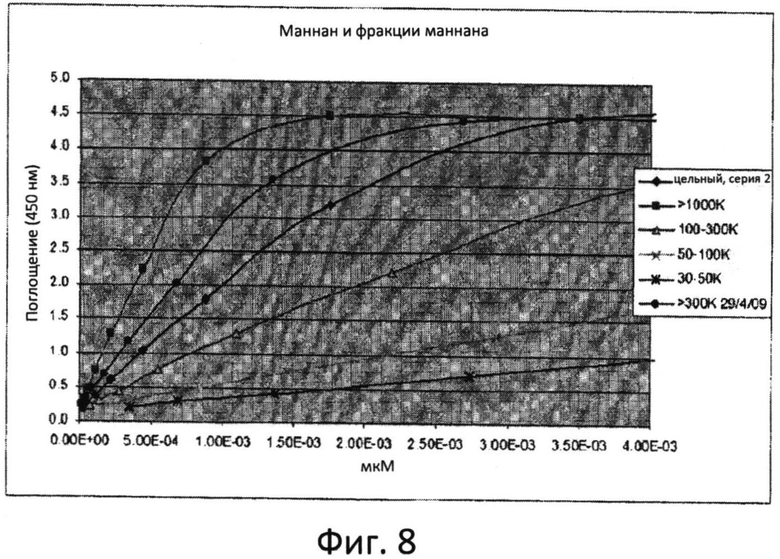
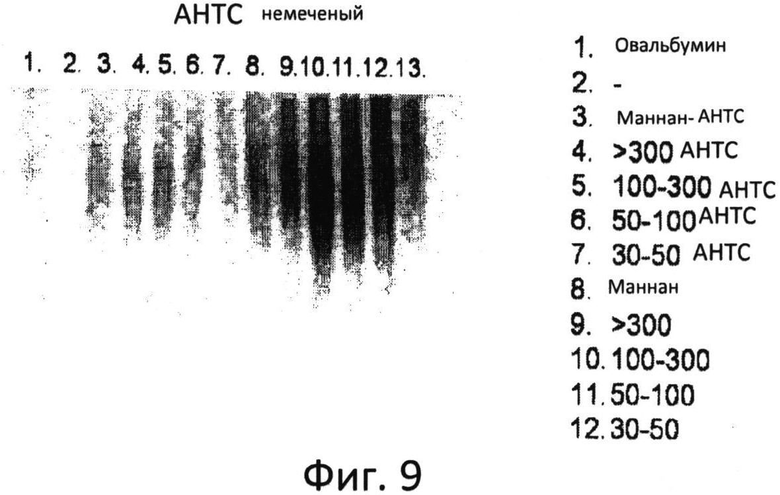
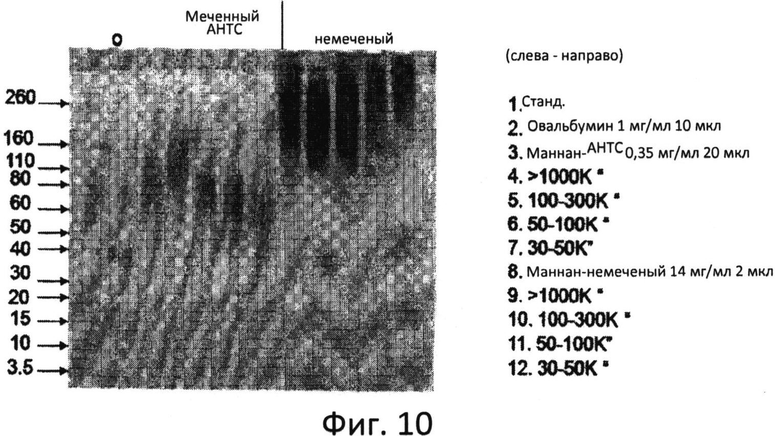
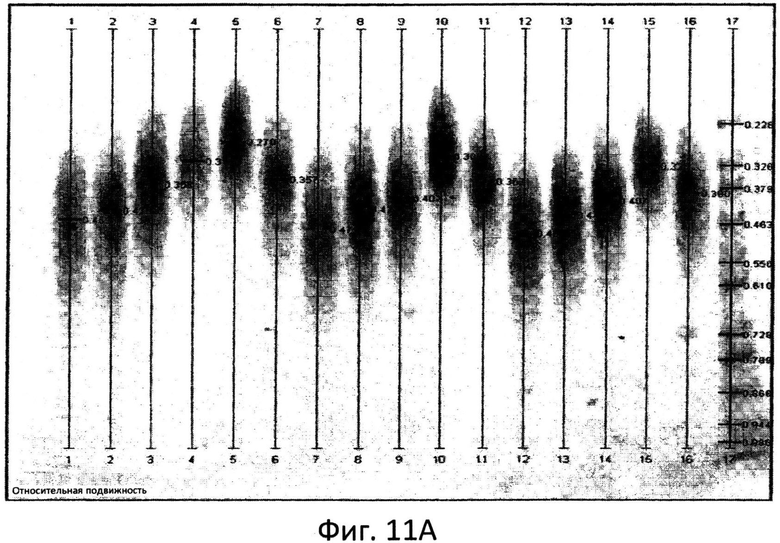
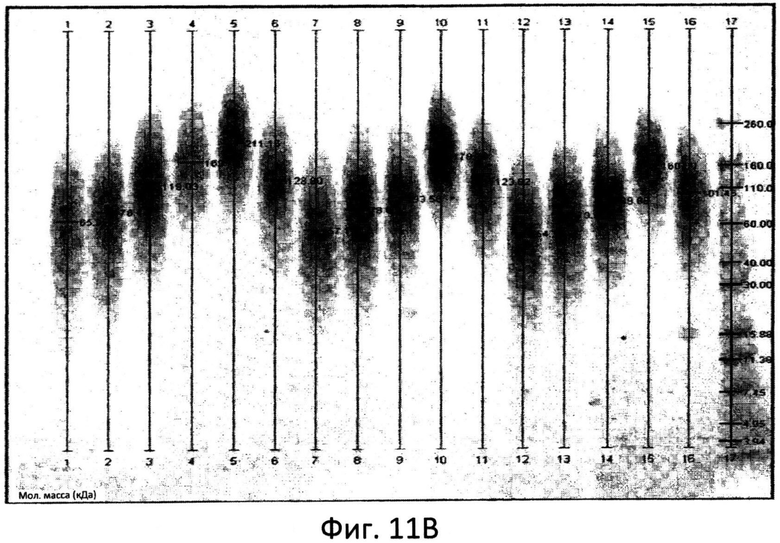
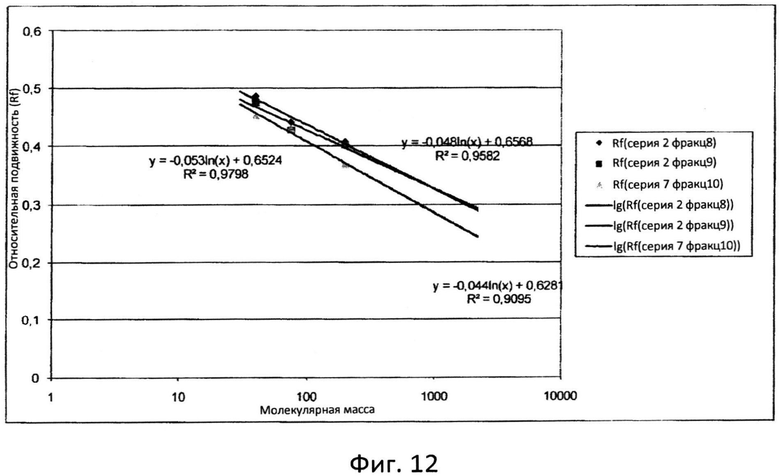

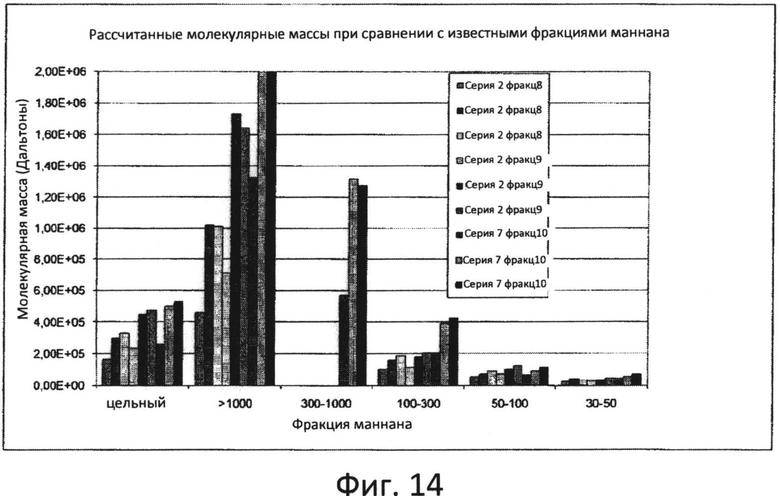
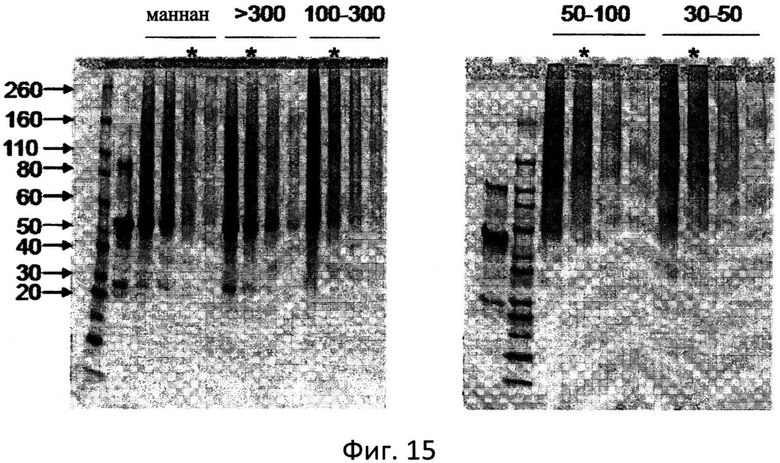
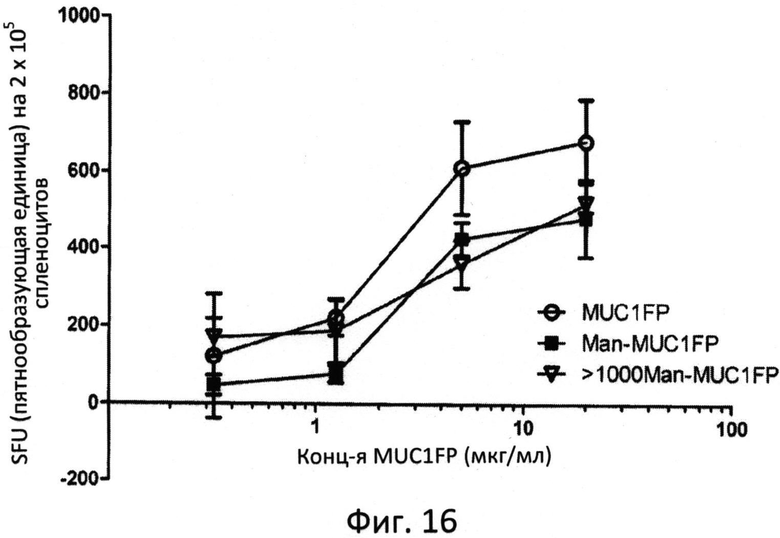


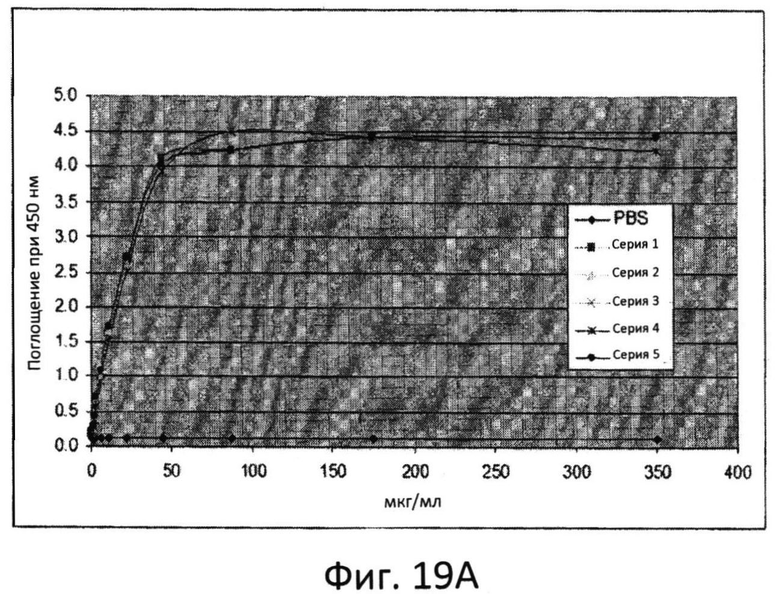
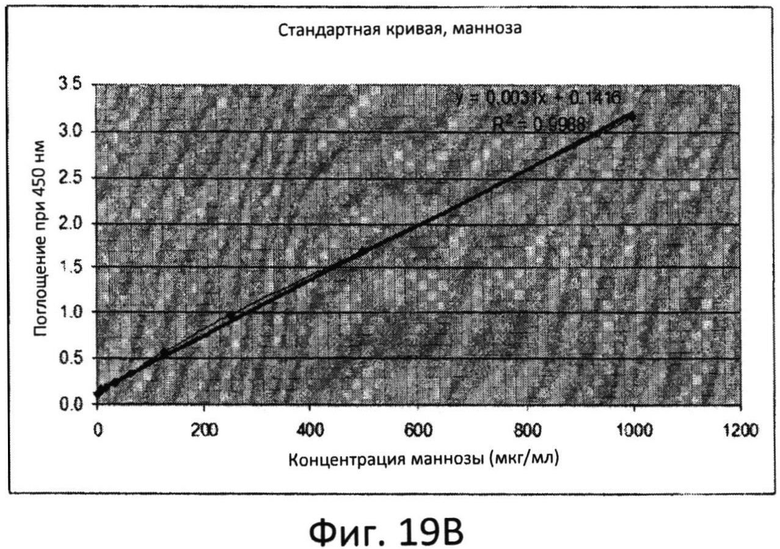

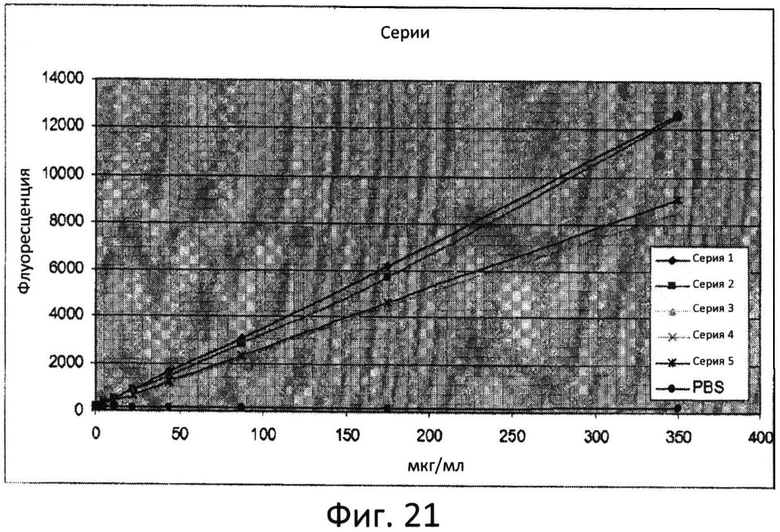
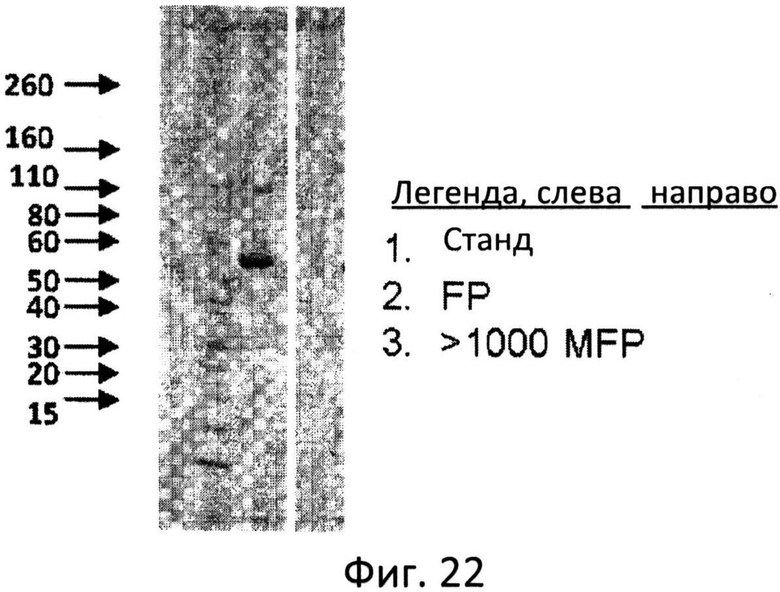
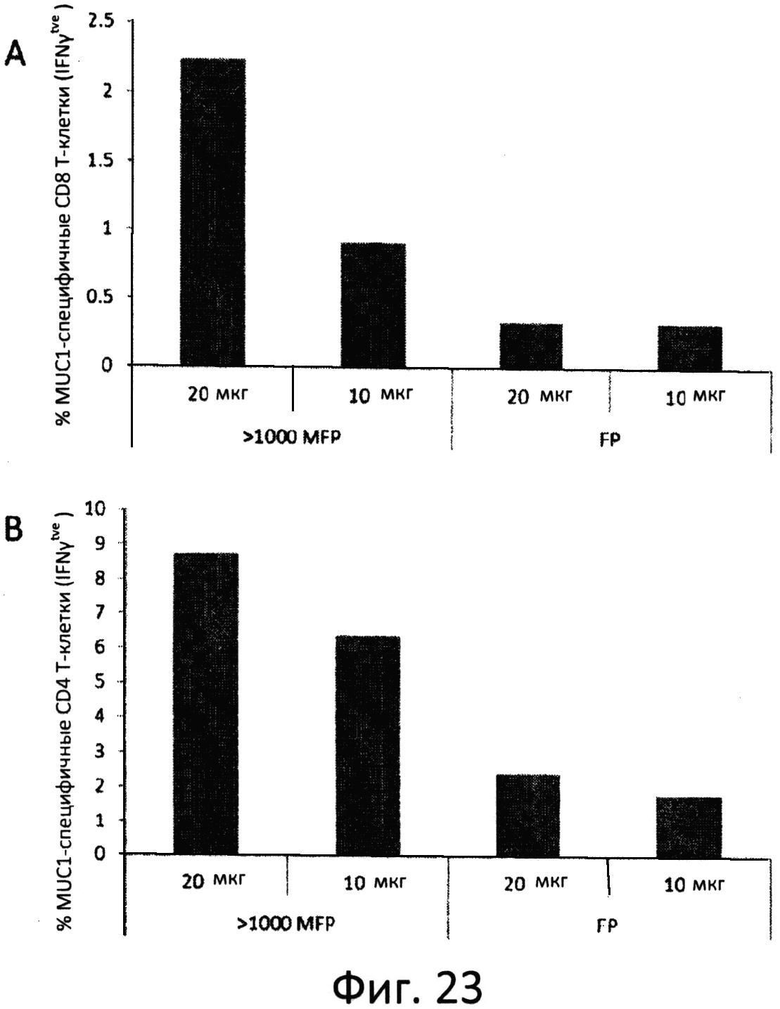
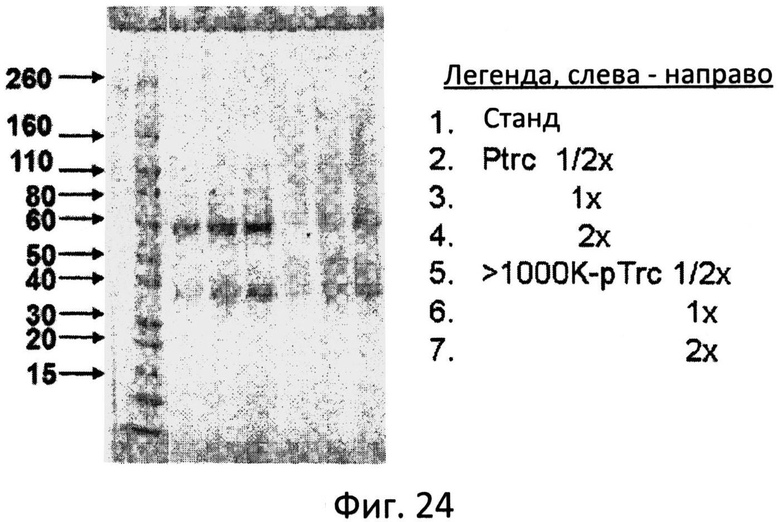
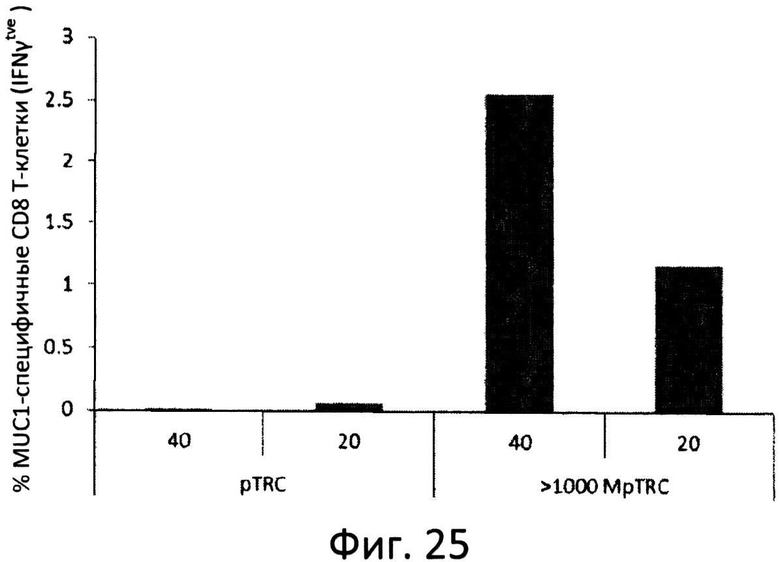
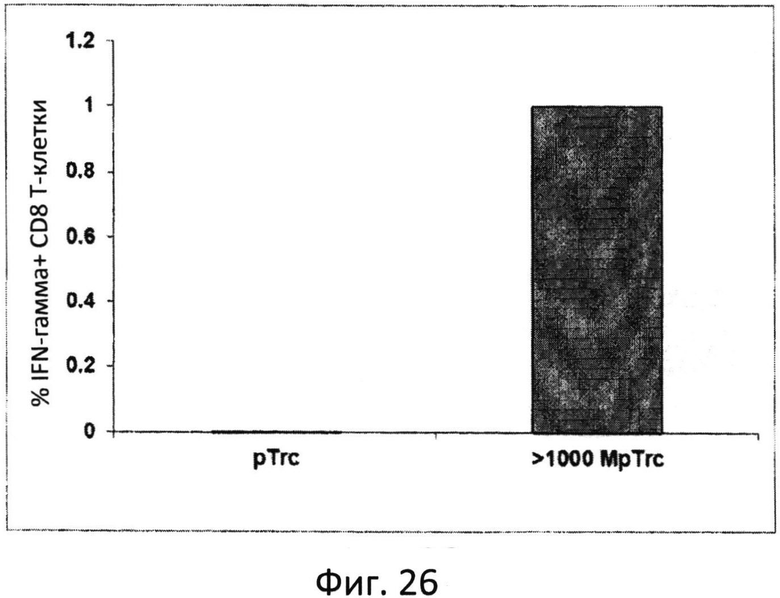
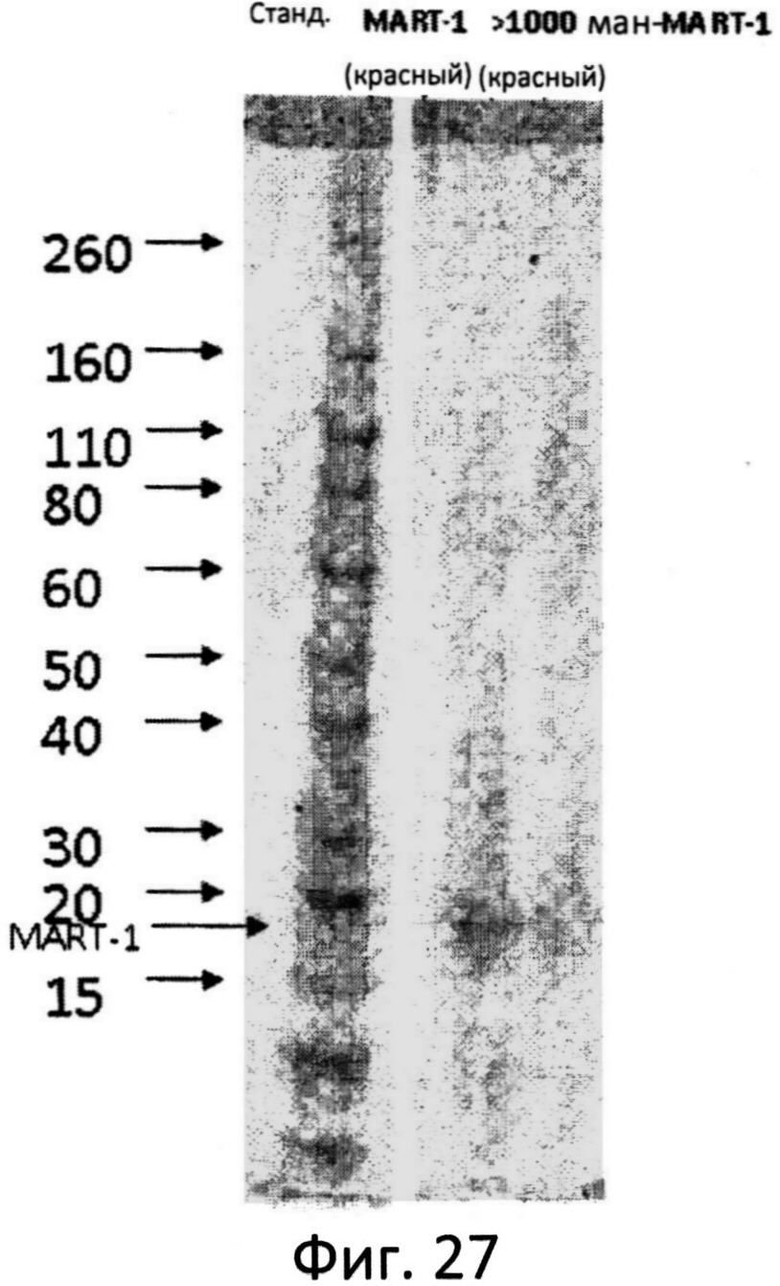
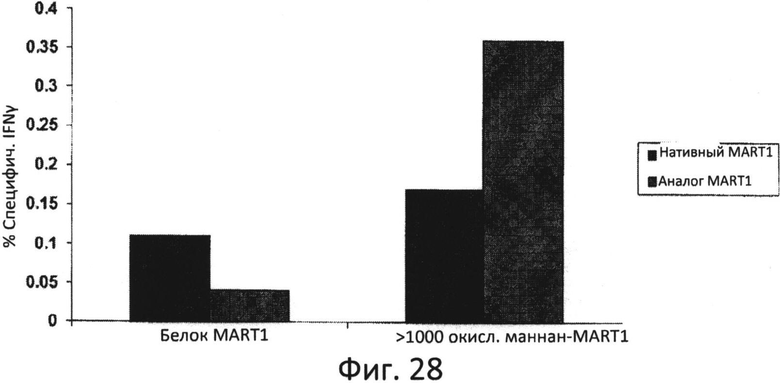
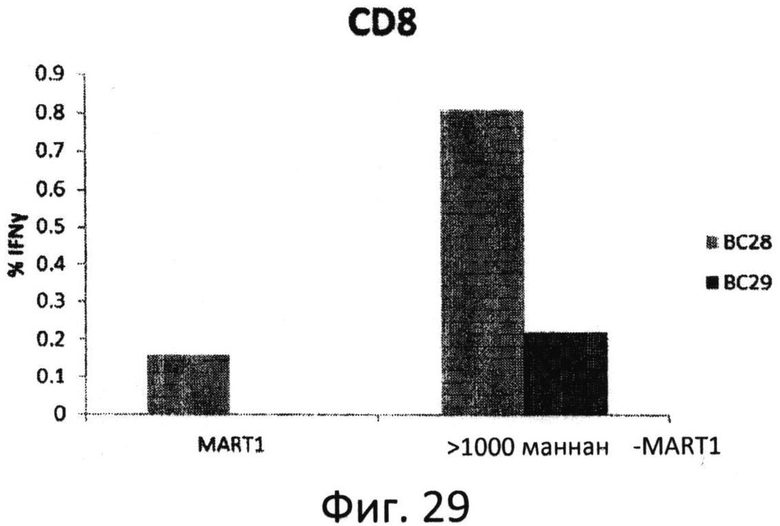
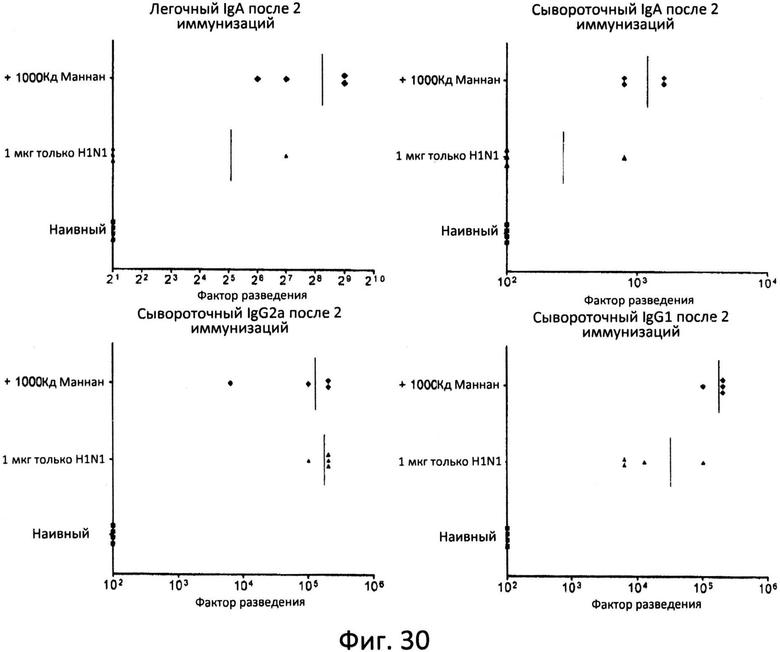
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для создания иммуностимулирующей композиции. Иммуностимулирующая композиция содержит маннаны, при этом по меньшей мере 75% маннанов имеет вес более чем приблизительно 1000 кДа. Группа изобретений обеспечивает применение этой композиции в способах индуцирования иммунного ответа у субъекта и генной терапии, а также способы для ее получения. Использование данной группы изобретений позволяет получить композицию, содержащую субпопуляцию маннанов с определенным размером больше 1000 кДА и обладающую более высокой иммуностимулирующей активностью, чем маннаны с более низной молекулярной массой или полноразмерные маннаны. 14 н. и 33 з.п. ф-лы, 14 пр., 2 табл., 30 ил.
1. Иммуностимулирующая композиция, содержащая маннаны, при этом по меньшей мере 75% маннанов имеет вес более чем приблизительно 1000 кДа.
2. Композиция по п. 1, отличающаяся тем, что маннаны окислены.
3. Иммуностимулирующая композиция, содержащая окисленные маннаны, при этом по меньшей мере 75% маннанов содержит по крайней мере 150 альдегидных групп.
4. Иммуностимулирующая композиция, содержащая окисленные маннаны, при этом по меньшей мере 75% маннанов имеет вес более чем приблизительно 1000 кДа и содержит по крайней мере 150 альдегидных групп.
5. Вакцинная композиция, содержащая маннаны и по меньшей мере один антиген или кодирующую его нуклеиновую кислоту, при этом по крайней мере 75% маннанов имеет вес более чем приблизительно 1000 кДа.
6. Композиция по п. 5, отличающаяся тем, что маннаны окислены.
7. Композиция по п. 6, отличающаяся тем, что окисленные маннаны ковалентно конъюгированы с по меньшей мере одним антигеном.
8. Композиция по п. 6, отличающаяся тем, что окисленные маннаны конъюгированы с по меньшей мере одной нуклеиновой кислотой через поликатионы.
9. Композиция по п. 7, отличающаяся тем, что по меньшей мере 75% окисленных маннанов содержат по крайней мере 150 альдегидных групп перед их конъюгацией с по меньшей мере одним антигеном.
10. Композиция по п. 8, отличающаяся тем, что по меньшей мере 75% окисленных маннанов содержит по крайней мере 150 альдегидных групп перед их конъюгацией с по меньшей мере одной нуклеиновой кислотой.
11. Композиция по любому из пп. 1, 3, 4 или 5, отличающаяся тем, что маннаны получены из дрожжей.
12. Композиция по любому из пп. 1, 3, 4 или 5, отличающаяся тем, что по меньшей мере 90% маннанов имеет вес более чем приблизительно 1000 кДа.
13. Композиция по любому из пп. 1, 3, 4 или 5, отличающаяся тем, что по меньшей мере 95% маннанов имеет вес более чем приблизительно 1000 кДа.
14. Композиция по любому из пп. 4, 9 или 10, отличающаяся тем, что по меньшей мере 90% окисленных маннанов содержит по крайней мере 150 альдегидных групп.
15. Композиция по любому из пп. 4, 9 или 10, отличающаяся тем, что по меньшей мере 95% окисленных маннанов содержит по крайней мере 150 альдегидных групп.
16. Композиция по любому из пп. 1, 3, 4 или 5, отличающаяся тем, что распределение маннанов по размерам после мечения аминонафталин-1,3,6-трисульфоновой кислотой (АНТС) охватывает диапазон от приблизительно 150 до приблизительно 250 Да по белковым стандартам и/или от приблизительно 800 до приблизительно 3000 кДа по углеводным стандартам.
17. Композиция по п. 5, отличающаяся тем, что антиген является вирусным, бактериальным, протозойным, грибным или опухолевым антигеном, аутоантигеном или аллергеном.
18. Композиция по любому из пп. 1, 3, 4 или 5, отличающаяся тем, что ее рецептура разработана для введения через слизистую оболочку, местного, внутрикожного, внутримышечного, подкожного или внутривенного введений.
19. Композиция по любому из пп. 1, 3, 4 или 5, отличающаяся тем, что дополнительно содержит по меньшей мере один приемлемый носитель.
20. Способ индуцирования и/или усиления иммунного ответа у субъекта, включающий введение субъекту композиции по любому из пп. 1-19.
21. Способ по п. 20, отличающийся тем, что включает введение по меньшей мере одного антигена или кодирующей его нуклеиновой кислоты.
22. Способ по п. 21, отличающийся тем, что маннаны и по меньшей мере один антиген или кодирующую его нуклеиновую кислоту вводят последовательно или одновременно.
23. Способ по п. 21, отличающийся тем, что маннаны и по меньшей мере один антиген или кодирующую его нуклеиновую кислоту вводят в виде вакцинной композиции по любому из пп. 5-19.
24. Способ по любому из пп. 20-23, иммунизирующий субъекта против патогена.
25. Способ по любому из пп. 20-23 для применения в противораковой терапии.
26. Способ по любому из пп. 20-23, отличающийся тем, что композицию вводят через слизистую, местно, внутрикожно, внутримышечно, подкожно или внутривенно.
27. Способ по любому из пп. 20-23, отличающийся тем, что субъект является птицей или млекопитающим.
28. Способ по п. 26, отличающийся тем, что млекопитающее является человеком.
29. Применение композиции по любому из пп. 1-19 для получения лекарственного препарата для индуцирования и/или усиления иммунного ответа у субъекта.
30. Применение композиции по любому из пп. 1-19 для индуцирования и/или усиления иммунного ответа у субъекта.
31. Способ активации макрофагов, дендритных клеток и/или клеток ЦТЛ in vitro или ex vivo, включающий контактирование клеток с композицией по любому из пп. 1-19.
32. Композиция для доставки по меньшей мере одной нуклеиновой кислоты в клетку, содержащая по меньшей мере одну нуклеиновую кислоту и маннаны, отличающаяся тем, что по меньшей мере 75% маннанов имеет вес более чем приблизительно 1000 кДа.
33. Композиция по п. 32, отличающаяся тем, что маннаны окислены.
34. Композиция по п. 33, отличающаяся тем, что окисленные маннаны конъюгированы с по меньшей мере одной нуклеиновой кислотой через поликатионы.
35. Композиция по п. 34, отличающаяся тем, что по меньшей мере 75% окисленных маннанов содержит по крайней мере 150 альдегидных групп перед конъюгацией с по меньшей мере одной нуклеиновой кислотой.
36. Способ доставки по меньшей мере одной нуклеиновой кислоты в клетку, включающий контактирование клетки с композицией по любому из пп. 32-35.
37. Способ по п. 36, отличающийся тем, что клетка находится в системе in vitro, ex vivo, или in vivo.
38. Способ по любому из пп. 36 или 37, отличающийся тем, что по меньшей мере одну нуклеиновую кислоту доставляют в клетку с целью проведения генной терапии или генетической вакцинации.
39. Применение композиции по любому из пп. 32-35 для получения лекарственного препарата для генной терапии или генетической вакцинации.
40. Применение композиции по любому из пп. 32-35 для генной терапии или генетической вакцинации.
41. Способ получения композиции по любому из пп. 1-19 или 32-35, включающий:
i) получение композиции, содержащей маннаны,
ii) фракционирование композиции, полученной на этапе i), на основании размера,
iii) выделение одной или нескольких фракций, содержащих маннаны, при этом по меньшей мере 75% маннанов в одной или нескольких фракциях имеет вес более чем приблизительно 1000 кДа, и
iv) необязательно, смешивание или конъюгирование маннана, полученного на этапе iii), с по меньшей мере одним другим соединением.
42. Способ по п. 41, отличающийся тем, что по меньшей мере одно другое соединение является антигеном или кодирующей его нуклеиновой кислотой.
43. Способ по любому из пп. 41 или 42, отличающийся тем, что дополнительно включает этап окисления маннанов перед этапом iv).
44. Способ по п. 43, отличающийся тем, что по меньшей мере 75% окисленных маннанов содержит по крайней мере 150 альдегидных групп.
45. Способ получения вакцинной композиции по любому из пп. 5-19, включающий:
i) получение композиции, содержащей маннаны, при этом по меньшей мере 75% маннанов имеет вес более чем приблизительно 1000 кДа; и
ii) смешивание или конъюгацию композиции, полученной на этапе i), с по меньшей мере одним антигеном или кодирующей его нуклеиновой кислотой с целью получения таким образом вакцинной композиции.
46. Способ по п. 45, который дополнительно включает окисление маннанов перед этапом ii).
47. Способ по п. 46, отличающийся тем, что по меньшей мере 75% окисленных маннанов содержит по крайней мере 150 альдегидных групп.
| WO 2005047507 A1, 26.05.2005 | |||
| US 4749566 A, 07.06.1988 | |||
| WO 2008037033 A1, 03.04.2008 | |||
| Apostolopoulos V | |||
| Et al | |||
| Aldehyde-mannan antigen complexes target the MHC class I antigen-presentation pathway // Eur J Immunol., 2000, Jun;30(6):1714-23. |
Авторы
Даты
2016-03-27—Публикация
2011-05-10—Подача