Данное изобретение относится к фармацевтической композиции, содержащей вещество, обладающее активностью, которая модулирует биологическую активность AILIM (индуцируемая активацией иммуномодулирующая лимфоцитарная молекула; альтернативно называемая "JTT-1-антигеном", "JTT-2-антигеном", "ICOS (индуцируемый костимулятор)" или "8F4"), особенно сигнальную трансдукцию, опосредуемую AILIM.
В частности, данное изобретение относится к фармацевтической композиции, содержащей вещество, обладающее активностью, которая модулирует (например, ингибирует) пролиферацию AILIM-экспрессирующих клеток или модулирует (например, ингибирует) продукцию цитокина (например, интерферона γ) или интерлейкина 4) AILIM-экспрессирующими клетками.
Более конкретно данное изобретение относится (1) к фармацевтической композиции для предотвращения, лечения или профилактики артроза, например, ревматоидного артрита (РА), остеоартрита (ОА), (2) к фармацевтической композиции для предотвращения, лечения или профилактики воспаления (например, гепатита), (3) фармацевтической композиции для предотвращения, лечения или профилактики реакции трансплантат против хозяина (реакции ТПХ), болезни трансплантат против хозяина (ТПХБ) или иммунного отторжения, сопровождающего трансплантацию ткани или органа, (4) фармацевтической композиции для предотвращения или профилактики иммунного ответа, запускаемого чужеродным антигеном или аутоантигеном (например, продукции антитела против антигена, пролиферации клеток, продукции цитокина).
Живой организм млекопитающих обладает системами иммунного ответа, которые не впускают патогенные микроорганизмы (вирусы, бактерии, паразиты и т.д.) или чужеродные тела (оба в последующем называются "антигеном"), которые вторглись в живой организм. Одна из них называется системой естественного иммунного ответа, другая системой приобретенного иммунного ответа. Первая представляет собой механизм удаления, включающий в себя фагоцитоз фагоцитами (полиморфно-ядерные лейкоциты, моноциты, макрофаги и т.д.), атаку природными киллерными клетками (NK) и неспецифическое распознавание, такое как опсонизация антигена комплементом. Последняя, система приобретенного иммунного ответа, представляет собой механизм удаления лимфоцитами (главным образом, Т-клетками и В-клетками), которые приобрели специфичность к антигену (то есть активированные лимфоциты). В-клетки, которые приобрели специфичность к антигену, атакуют антиген, находящийся вне клеток, посредством продукции антител, специфических для антигена. Т-клетки, которые приобрели специфичность к антигену (то есть активированные Т-клетки), делятся на хелперные Т-клетки и цитотоксические Т-клетки (цитотоксические лимфоциты, CTL). Хелперные Т-клетки регулируют дифференцировку В-клеток и продукцию антител и разрушают антиген в кооперации с фагоцитами. Последние, CTL, сами атакуют инфицированные вирусом клетки и так далее (Experimental Medicine: SUPPLEMENT, "Bio Science Term Library, Immunity", Yodosha, pp.14-17 (1995)).
Такое приобретение Т-клетками специфичности к антигену (то есть активация Т-клеток) инициируется посредством распознавания Т-клетками антигена, представленного антигенпредставляющими клетками (АРС), такими как макрофаги, В-клетки или дендритные клетки. Антигенпредставляющие клетки процессируют антигены, включенные таким образом, и представляют эти процессированные антигены посредством их связывания с главным комплексом гистосовместимости (МНС). Т-клетки получают первичный сигнал активации клеток (или приобретения специфичности) при распознавании процессированных антигенов, представленных антигенпредставляющими клетками, благодаря комплексу между рецептором Т-клеток (TcR) и СD3-антигеном, присутствующим на поверхности клеточной мембраны (TcR/CD3-комплекс).
Однако опосредованный TcR/CD3-комплексом первичный сигнал сам по себе не может в достаточной степени активировать Т-клетки и приводит к иммунологической толерантности или клональной анергии, так что клетки впоследствии не могут реагировать на какую-либо полученную стимуляцию. Аутокринный фактор, интерлейкин 2 (IL-2), необходим для того, чтобы Т-клетки были активированы, дифференцированы в клоны Т-клеток, специфичные для антигена, и пролиферировали. При клональной анергии Т-клетки инактивированы вследствие отсутствия продукции IL-2 и ему подобных и отсутствия клеточного деления. То есть активация Т-клеток, сопровождаемая продукцией цитокинов, таких как IL-2, требует вторичного сигнала после первого сигнала через TcR/CD3-комплекс. Этот вторичный сигнал называют костимулирующим сигналом.
Т-клетки получают этот вторичный сигнал и передают его в клетки путем взаимодействия (клеточной адгезии) с другими молекулами, отличными от МНС, на антигенпредставляющих клетках, посредством молекул, отличных от комплекса TcR/CD3 на поверхности Т-клеток. Этот вторичный сигнал отменяет клеточную анергию (клональную анергию) и активирует клетки.
Хотя некоторая часть механизма передачи вторичного сигнала между антигенпредставляющими клетками и такими лимфоцитами, как Т-клетки, еще детально не выяснена, проведенные до настоящего времени исследования показали, что важным фактором для передачи вторичного сигнала является взаимодействие CD28 (также называемого Тр44, Т44 или 9.3 антигеном), который представляет собой молекулу на клеточной поверхности, экспрессируемую главным образом на Т-клетках и клетках тимуса, с CD80 (также называемым В7-1, В7, ВВ1 или В7/ВВ1), который представляет собой молекулу на клеточной поверхности, экспрессируемую на антигенпредставляющих клетках (макрофагах, моноцитах, дендритных клетках и т.д.), и с CD86 (также называемым В7-2 или В70), который также представляет собой молекулу на клеточной поверхности антигенпредставляющих клеток (то есть адгезия клеток посредством связывания между этими молекулами). Кроме того, экспериментально было показано, что взаимодействие ассоциированного с цитолитическими Т-лимфоцитами антигена 4 (CTLA-4), экспрессия которого, как полагают, усиливается в зависимости от вторичного сигнала, с CD80 (В7-1) и CD86 (В7-2) (то есть адгезия клеток посредством связывания между этими молекулами) также играет важную роль в регуляции активации Т-клеток вторичным сигналом. Другими словами, регуляция активации Т-клеток передачей вторичного сигнала вовлекает по меньшей мере взаимодействие между CD28 и CD80/CD86, усиление экспрессии CTLA-4, которое, как считают, зависит от взаимодействия, и взаимодействие между CTLA-4 и CD80/CD86.
Известно, что CD28 является молекулой-костимулятором передачи вторичного сигнала (костимулирующий сигнал), необходимой для активации Т-клеток и для отмены анергии. Вторичный сигнал, передаваемый путем связывания этой молекулы с костимулирующими молекулами, CD80 (В7-1) и CD86 (В7-2), на антигенпредставляющих клетках (адгезия клеток посредством связывания между этими молекулами), стабилизирует мРНК цитокинов Th1-типа и в результате способствует продукции Т-клетками большого количества цитокинов Th1-типа, таких как IL-2, IFNγ и TNFα. Экспрессия CTLA-4 индуцируется первичным сигналом, переданным через TcR/CD3, и экспрессия также усиливается вторичным сигналом, переданным путем связывания между CD28 и CD80. Обнаруживается, что CTLA-4 получает эти сигналы к работе, чтобы ингибировать функцию Т-клеток, которая противоположна активации Т-клеток вторичным сигналом, передаваемым CD28.
CD28 и CTLA-4 человека являются гликопротеидами типа I, молекулярные массы которых составляют 44 кД и от 41 до 43 кД соответственно. Оба гликопротеида имеют домен, подобный иммуноглобулину, относящийся к иммуноглобулиновому супер-семейству, и обладают как функцией молекулы клеточной адгезии, так и функцией молекулы передачи сигнала.
CD28 человека формирует гомодимер с дисульфидной связью, в то время как CTLA-4 существует в виде мономера. И CD28, и CTLA-4 гены локализованы в "2q33" на хромосоме человека и в "1С" на хромосоме мыши и состоят из четырех (4) экзонов. CD28 и CTLA-4 человека состоят из 220 и 223 аминокислот соответственно, включая лидерные последовательности, и гомология аминокислот между ними составляет от 20 до 30%.
Лигандами CD28 и CTLA-4 у человека и мыши являются CD80 (В7-1) и CD86 (В7-2). CTLA-4 обладает примерно в 20 раз большим сродством к обоим лигандам, чем CD28. Было выяснено, что структура аминокислотной последовательности "MYPPPY (Met-Tyr-Pro-Pro-Pro-Tyr)", консервативная среди видов животных, важна для связывания CD28 и CTLA-4 с CD80 (В7-1). Также сообщалось, что в случае, когда стимулирован CD28, киназа PI3 (фосфоинозитид-3-киназа, PI3K) связывается с фосфорилированным остатком тирозина в неполной последовательности "YMNM (Tyr-Met-Asn-Met)" CD28, и что CD28 играет важную роль во внутриклеточной передаче сигнала посредством данной "YxxM" структуры. Кроме того, сообщалось, что CTLA-4 также имеет последовательность, представленную "YxxM", a именно "YVKM (Tyr-Val-Lys-Met)" в его цитоплазматическом районе, и что после стимуляции SYP связывается с данной последовательностью.
CD28, в частности, экспрессируется в тимоцитах и Т-клетках периферической крови, а CTLA-4, в частности, экспрессируется в активированных Т-клетках (Cell Engineering: SUPPLEMENT, "Handbook of Adhesion Molecule", Shujunsha, pp. 93-102 (1994); ibid. pp.120-136; Experimental Medicine: SUPPLEMENT, "BIO SCIENCE Term Library, Immunity", Yodosha, pp.94-98 (1995); Experimental Medicine: SUPPLEMENT, "BIO SCIENCE Term Library, Intracellular Signal Transduction", Yodosha, pp.58-59 (1997); Nihon Rinsho, Vol. 55, No. 6, pp. 215-220 (1997)).
Таким образом, в регуляции функции Т-клеток (активации и ингибировании функции Т-клеток) выявлено важное значение взаимодействий между многочисленными молекулами, такими как молекулы-костимуляторы (CD28, CD80 (В7-1), CD86 (В7-2) и т.д.), и CTLA-4, который взаимодействует с ними (другими словами, адгезия клеток посредством связывания между этими молекулами), и этo привлекло внимание к взаимосвязи между этими молекулами и болезнями и лечению болезней путем регулирования функций этих молекул.
Как описано выше, хотя живой организм активирует свою систему приобретенного иммунного ответа, направленного против антигенов, которые являются чужеродными телами для живого организма, он также обладает иммунологической толерантностью, так что не проявляет иммунного ответа против своего собственного компонента (аутоантигена). Если по некоторым причинам иммунологическая толерантность нарушается, возникает иммунный ответ на аутоантиген, аутоантигенреактивные Т-клетки индуцируются посредством того же механизма, который указан выше, что относится к аномальному состоянию иммунитета и вызывает различные аутоиммунные заболевания.
Другими словами, так как не стимулированные антигенпредставляющие клетки (АРС) в нормальных тканях не экспрессируют костимулирующие молекулы в том случае, когда иммунная система живого организма нормальна, Т-клетки находятся в состоянии неотвечаемости, сохраняя иммунологическую толерантность, даже если существуют аутоантигенреактивные Т-клетки, которые реагируют с аутоантигеном. Было высказано мнение, что при аномальном состоянии иммунитета активируется больше аутоантигенреактивных Т-клеток вследствие аномального избытка и непрерывной экспрессии костимулирующих молекул, вызывая, таким образом, аутоиммунные заболевания.
Недавно на основании такой точки зрения предложены многие попытки лечения различных аутоиммунных болезней путем модулирования передачи костимулирующих сигналов, например указанной выше передачи сигналов между CD28/CTLA-4 и CD80/CD86.
Результаты таких попыток еще не объяснили детально механизм активации Т-клеток посредством взаимодействия между костимулирующими молекулами и связанными молекулами (другими словами, адгезию клеток посредством связывания между этими молекулами). В этот механизм могут быть вовлечены другие неизвестные молекулы.
Недавно авторы данного изобретения успешно идентифицировали и выделили новую молекулу на поверхности клеточной мембраны, полученную из млекопитающих (человек, мышь и крыса), которая считается молекулой, которая передает вторичный сигнал (костимулирующий сигнал), необходимый для активации лимфоцитов, например Т-клеток, и контролирует функцию активированных лимфоцитов, например активированных Т-клеток, перерабатывая сигнал таким же образом, как в случае указанных выше "CD28" и "CTLA-4", и назвали молекулой "JTT-1-антигена" или "JTT-2-антигена" (не прошедшая экспертизу опубликованная заявка на патент Японии (JP-A) No. Hei 11-29599; WО98/38216; Int. Immunology, Vol. 12, No. 1, pp.51-55, 2000). Позже авторы данного изобретения изменили название этих молекул на AILIM (индуцируемая активацией иммуномодулирующая лимфоцитарная молекула).
На основании исследований авторов данного изобретения были получены следующие сведения об этой новой молекуле AILIM.
(1) AILIM обладает следующим сходством с "CD 28", молекулой клеточной поверхности лимфоцита, например, Т-клеток, которая передает костимулирующий сигнал, важный для активации Т-клеток, опосредованной межклеточной адгезией, и с "CTLA-4", молекулой клеточной поверхности лимфоцита, например, Т-клеток, которая контролирует функцию активированных лимфоцитов, таких как активированные Т-клетки, перерабатывая сигнал.
1. 20 или более аминокислотных остатков, включая остатки цистеина, высоко консервативны.
2. Последовательность повторяющихся пролинов "Pro-Pro-Pro (РРР)", необходимая в качестве лигандсвязывающего района, консервативна во внеклеточном районе.
3. Последовательность "Tyr-Xaa-Xaa-Met (YxxM) (Xaa и х представляет собой любую аминокислоту), последовательность, необходимая в качестве района передачи сигнала, консервативна в цитоплазматическом районе.
4. Ген, кодирующий "AILIM мыши (антиген JTT-1 мыши)", в хромосоме мыши локализован в положении "1С3", таком же, как положение "CD28" и "CTLA-4" мыши.
(2) Так же, как "CD28" и "CTLA-4", обладающие функцией опосредования межклеточной адгезии, "AILIM (JTT-1-антиген)" обладает способностью опосредовать клеточную адгезию между клетками тимуса и лимф областными клетками и клетками тимомы, стимулируемыми митогеном, например, КонА.
(3) AILIM строго экспрессируется по меньшей мере в клетках тимуса, лимфобластных клетках, стимулированных митогеном, таким как КонА (активированные Т-лимфобластные клетки и активированные В-лимфобластные клетки), лимфоцитах периферической крови и клетках тимомы.
(4) Антитело против AILIM (JTT-1-антигена) существенно повышает пролиферацию лимфоцитов периферической крови человека, и более высокая пролиферация индуцируется, когда оно одновременно присутствует вместе с моноклональным антителом против CD3, образующего комплекс TcR/CD3 на Т-клетках, который получает первый сигнал от антигенпредставляющих клеток, необходимый для активации Т-клеток.
(5) Состояние экспериментального аллергического энцефаломиелита (ЕАЕ) облегчается при введении антитела против AILIM (JTT-1-антигена).
(6) При введении антитела против AILIM (JTT-1-антигена) в крысиной модели нефрита, поражающего гломерулярную базальную мембрану (GMB), состояние облегчается.
После сообщения об идентификации и анализе характеристик AILIM авторами данного изобретения группа Kroczek et al. сообщила об идентификации молекулы, названной ICOS (индуцируемый костимулятор), или 8F4, молекулы, идентичной AILIM, полученной от человека, или молекулы, названной 8F4 (Nature, Vol. 397, pp.263-266, 1999; W099/15553).
Об AILIM (альтернативно названной JTT-1-антигеном, JTT-2-антигеном, ICOS или 8F4) сообщалось только вышеуказанное, а ее биологические функции и взаимосвязь с заболеваниями еще детально не выяснены.
С другой стороны, новые молекулы, названные B7h, B7RP-1, GL50 или LICOS, которые, как предполагают, являются лигандами, взаимодействующими с данной ко стимулирующей передающей молекулой AILIM, были совсем недавно идентифицированы (Nature, Vol. 402, No. 6763, pp.827-832, 1999; Nature Medicine, Vol. 5, No. 12, pp.1365-1369, 1999; J. Immunology, Vol. 164, pp.1653-1657, 2000; Curr. Biol., Vol. 10, No. 6, pp.333-336, 2000).
Идентификация этих двух новых видов молекул, а именно AILIM (ICOS) и B7RP-1 (B7h, GL50, LICOS), как пути сигнальной трансдукции костимулирующего сигнала, необходимого для указанной выше активации лимфоцитов, таких как Т-клетки, и контроля функции активированных Т-клеток, показала, что существует новый третий путь за счет взаимодействия между AILIM (ICOS) и B7RP-1 (B7h, GL50, LICOS), помимо известных первого и второго сигнальных путей, которые представляют собой уже известный путь трансдукции между CD28 и CD80 (В7-1)/CD86 (В7-2), и путь между CTLA-4 и CD80 (В7-1)/ CD86 (В7-2).
Проводятся исследования биологических функций данных новых молекул, функции контроля лимфоцитов, таких как I-клетки, посредством данного третьего пути трансдукции костимулирующего сигнала молекулами и взаимосвязи между новым путем сигнальной трансдукции и заболеваниями.
Раскрытие сути изобретения
Целью данного изобретения, в частности, является выяснение биологических функций новой молекулы AILIM, которая, подобно "CD28" и "CTLA-4", считается молекулой, которая передает вторичный сигнал (ко стимулирующий сигнал), необходимый для активации лимфоцитов, таких как Т-клетки, и которая контролирует функции активированных лимфоцитов, таких как активированные Т-клетки, при переработке сигнала; выявление взаимосвязей между экспрессией AILIM и болезнями и предоставление способа и фармацевтического средства, которые ингибируют развитие различных заболеваний, в зависимости от характера экспрессии AILIM, или которые лечат заболевания посредством контролирования биологических функций AILIM, используя медицинские и фармацевтические способы (например, лекарственное средство, такое как низкомолекулярное соединение и антитело).
Авторы данного изобретения исследовали биологические функции AILIM млекопитающих, характер экспрессии AILIM в различных клетках, взаимосвязи между экспрессией AILIM и заболеваниями, обнаружив следующие сведения в дополнение к указанным выше сведениям, полученным до настоящего времени, для завершения данного изобретения.
(I) В Т-клетках тимуса, одной из лимфоидных тканей нормальной мыши, наблюдается строгая экспрессия AILIM таким же образом, как в клетках, которые строго экспрессируют CD3, что подтверждает корреляцию между обеими экспрессиями. Напротив, экспрессия CD28, костимулирующей молекулы, снижается по мере того, как экспрессия CD3 увеличивается. В Т-клетках, полученных из нормального тимуса мышей, экспрессии AILIM и CD28 проявляют противоположный характер движения. В CD4-негативных CD8-негативных Т-клетках не наблюдается экспрессии ни AILIM, ни CD28. В Т-клетках, полученных из тимуса нормальных мышей, наиболее высокая экспрессия CD28 имеет место в CD4-позитивных CD8-позитивных Т-клетках, и экспрессия в CD4-негативных CD8-позитивных Т-клетках, или CD4-позитивных CD8-негативных клетках, которые претерпели последующую клеточную дифференцировку, была пониженной. Напротив, в клетках тимуса нормальных мышей экспрессия AILIM в CD-4 позитивных CD8-позитивных клетках только незначительно выявлялась, но высокая экспрессия была обнаружена в CD4-негативных CD8-позитивных Т-клетках, или CD4-позитивных CD8-негативных Т-клетках, которые претерпели последующую клеточную дифференцировку. Экспрессия AILIM в Т-клетках тимуса нормальных мышей отличается от экспрессии CD28 не только в связи с экспрессией CD3, но также с экспрессией CD4 и CD8.
(II) Экспрессия AILIM в Т-клетках селезенки и лимфатических узлов, которые являются одними из нормальных лимфоидных тканей мышей, была небольшой, по сравнению с экспрессией в Т-клетках, полученных из тимуса мышей, и экспрессия AILIM обнаруживается в очень небольшом количестве СD4-позитивных Т-клеток (примерно от 1 до 3% CD4-позитивных Т-клеток).
(III) Четко видимая экспрессия AILIM наблюдается в Т-клетках (мононуклеарных клетках), полученных из тканей печени в модели гепатита мышей, индуцированного введением Р. acnes (Propionibacterium acnes) и ЛПС (липополисахарида). Экспрессия намного выше по сравнению с СD4-позитивными клетками, полученными из селезенки нормальных мышей, или Т-клетками, полученными из лимфатического узла.
(IV) В клетках, полученных из периферической крови человека с нормальным здоровьем, большинство AILIM-позитивных клеток является СD4-позитивными CD8-негативными клетками, и большинство AILIM-позитивных клеток является Т-клетками. В В-клетках, полученных из периферической крови человека с нормальным здоровьем, экспрессия AILIM также наблюдается незначительно.
(V) В Т-клетках, инфильтрирующих ткань сустава, в синовиальной жидкости пациентов с ревматоидным артритом (РА) (СD4-позитивные Т-клетки и СD4-негативные Т-клетки) обнаруживается значительно более высокая экспрессия AILIM по сравнению с Т-клетками в периферической крови этого же пациента и Т-клетками в периферической крови нормального здорового человека.
(VI) В CD4-позитивных Т-клетках синовиальной жидкости пациентов с остеоартритом (ОА) значительно увеличивается доля AILIM-позитивных клеток. Доля AILIM-позитивных клеток также значительно возрастает в CD4-позитивных Т-клетках у пациентов с прогрессирующим системным склерозом (ПСС).
(VII) Повышенная экспрессия AILIM наблюдается в Т-клетках, полученных из лимфоидных тканей мыши через 3-6 часов после стимуляции с использованием ионофора с анти-СD3-антителом, конканавалина А (КонА) или ФМА (форболмиристатацетата), и максимальная экспрессия AILIM устанавливается примерно через 12 часов после стимуляции. Высокая экспрессия AILIM удерживается через 24 часа или более после стимуляции, и экспрессия сохраняется на таком же уровне даже примерно через 48 часов после стимуляции.
(VIII) При активации Т-клеток периферической крови человека (СВ4-позитивные клетки и CD8-позитивные Т-клетки) ФМА и ионофором, AILIM экспрессируется на высоком уровне примерно через 8 часов после стимуляции. В клетках периферической крови человека высокий уровень экспрессии AILIM также индуцируется стимуляцией либо анти-СО3-антителом и анти-AILIM-антителом, либо анти-СD3-антителом и анти-СD28-антителом.
(IX) Конститутивная экспрессия AILIM наблюдается в линиях Т-клеток, которые обладают свойством продуцировать цитокин типа Th2 (например, DC10, MS202, CD28KO, EL-4). Экспрессия AILIM в этих линиях клеток высока, на таком же уровне или даже выше, чем экспрессия CD28.
(X) В том случае, когда Т-клетки, полученные из селезенки или тимуса нормальной мыши или крысы, или Т-клетки, полученные из периферической крови нормального здорового человека, культивируют на чашках, покрытых как анти-AILIM-антителом, так и анти-СD3-антителом, составляющими предмет данного изобретения, индуцируется продукция Т-клетками цитокина (IFNγ, IL-4, TNFα, IL-2, IL-10) и пролиферация Т-клеток.
(XI) В том случае, когда Т-клетки периферической крови, стимулированные КонА или ФМА, культивируют на чашках, покрытых как анти-АILIМ-антителом, так и анти-СD3-антителом, составляющими предмет данного изобретения, индуцируются продукция цитокина Т-клетками и пролиферация клеток. Данный результат имеет место на таком же уровне, как и в случае культивирования Т-клеток, полученных из периферической крови, стимулированных КонА или ФМА, на чашках, покрытых обоими антителами - анти-СВ-28- и анти-СD3-антителом.
(XII) В том случае, когда анти-АILIМ-антитело, составляющее предмет данного изобретения, добавляют к Т-клеткам, в которых был запущен Т-клеточный ответ культивированием клеток тимуса и клеток селезенки, выделенных из нормальной селезенки и нормального тимуса (адгезивные клетки удаляют в каждом случае) на чашках, покрытых анти-СD3-антителом, ингибируется продукция цитокина[например, интерферона γ (INF-γ), интерлейкина 4 (IL-4)] Т-клетками, и ингибируется пролиферация Т-клеток. Кроме того, ингибирование Т-клеточного ответа анти-AILIM-антителом (например, указанной выше продукции цитокина, пролиферации клеток) зависит от концентрации антитела. Напротив, в случае, когда вместо анти-AILIМ-антитела добавляют анти-СD28-антитело, ответ Т-клеток усиливается, в отличие от результата использования анти-АILIМ-антитела.
(XIII) Когда анти-АILIМ-антитело, составляющее предмет данного изобретения, вводят животному в модели гепатита, индуцированного введением Р. acnes (Propionibacterium acnes) и ЛПС (липополисахарида), увеличение IFN-γ в крови в значительной мере ингибируется в зависимости от концентрации антитела, и увеличение GOP/GPT существенным образом ингибируется.
(XIV) Когда анти-АILIМ-антитело, составляющее предмет данного изобретения, вводят животному в модели артрита, индуцированного введением мертвых туберкулезных палочек, опухание лапы в значительной мере ингибируется в зависимости от концентрации антитела, и увеличение различных параметров при артрите существенным образом ингибируется.
(XV) Когда анти-АILIМ-антитело, составляющее предмет данного изобретения, вводят животному в модели болезни трансплантат против хозяина (ТПХБ), продукция IgG и IgE, которые являются продуктами реакции трансплантат против хозяина (ТПХР), в значительной мере ингибируется, и существенным образом ингибируется повышенная продукция анти-днДНК (двунитевая ДНК)антитела, показателя валентности аутоантитела.
(XVI) Когда анти-АILIМ-антитело, составляющее предмет данного изобретения, вводят модельному животному, у которого продукция антитела против избыточных чужеродных антигенов индуцирована сенсибилизацией эритроцитами барана (ЭБ) в качестве чужеродного антигена (сразу же или через несколько дней после сенсибилизации), увеличение продукции антитела против ЭБ, чужеродного антигена, существенным образом ингибируется. Ингибирующее действие выше, чем действие в случае введения CTLA4-Ig.
(XVII) Когда анти-АILIМ-антитело, составляющее предмет данного изобретения, вводят модельному животному, у которого продукция антитела против избыточных чужеродных антигенов индуцирована сенсибилизацией NP-KLH в качестве чужеродного антигена (сразу же или через несколько дней после сенсибилизации), увеличение продукции антитела против NP-KLH, чужеродного антигена, существенным образом ингибируется.
(XVIII) Анти-АILIМ-антитело значительно ингибирует клеточную пролиферацию Т-клеток в реакции аллогенной смешанной культуры лимфоцитов (РСКЛ) с моноцитами периферической крови (РВМС) и Т-клетками, полученными от различных нормальных доноров.
Фармацевтическая композиция данного изобретения пригодна в качестве фармацевтического средства модулирования различных реакций in vivo, в которые вовлечена трансдукция костимулирующего сигнала к AILIM-экспрессирующим клеткам, опосредованная AILIM (например, клеточная пролиферация AILIM-экспрессирующих клеток, продукция цитокина(нов) AILIM-экспрессирующими клетками, иммунный цитолиз или апоптоз AILIM-экспрессирующих клеток и активность в индукции антитело-зависимой клеточной цитотоксичности, направленной против AILIM-экспрессирующих клеток) и/или в качестве фармацевтического средства для предотвращения внезапного приступа и/или прогрессирования различных болезней, в которые вовлечена сигнальная трансдукция, опосредованная AILIM, и лечения или профилактики заболеваний.
В частности, фармацевтическая композиция данного изобретения может модулировать пролиферацию AILIM-экспрессирующих клеток (ингибирование или стимулирование) или может модулировать (ингибировать или стимулировать) продукцию цитокинов AILIM-экспрессирующими клетками (например, интерферона γ или интерлейкина 4), и может предотвращать различные патологические состояния, запускаемые различными физиологическими явлениями, в которые вовлечена сигнальная трансдукция, опосредованная AILIM, и может лечить или предотвращать различные заболевания.
При использовании фармацевтической композиции данного изобретения можно ингибировать, предотвращать и/или лечить, например, артроз (например, ревматоидный артрит (РА), остеоартрит (ОА), воспаление (например, гепатит), реакцию трансплантат против хозяина (ТПХ), болезнь трансплантат против хозяина (ТПХБ), ответ иммунного отторжения, сопровождающий трансплантацию ткани или органа, иммунный ответ, запускаемый чужеродным антигеном или аутоантигеном (например, продукцию антитела против антигена, пролиферацию клеток, продукцию цитокина(ов)).
Кроме того, фармацевтическая композиция данного изобретения может применяться для лечения или профилактики произвольного воспаления, при котором применяются различные стероиды в качестве противовоспалительного средства.
Кроме того, фармацевтическая композиция данного изобретения может применяться для лечения или предотвращения воспалительных заболеваний, например воспаления, сопровождающего различные артриты (например, ревматоидный артрит, остеоартрит), пневмонии, гепатита (включая вирусный гепатит), воспаления, сопровождающего инфекционные болезни, воспалительных заболеваний кишечника, энтерита тонкого кишечника, нефрита (воспаление, сопровождающее гломерулярный нефрит, фиброз почек), гастрита, ангиита, панкреатита, перитонита, бронхита, миокардита, энцефалита, воспаления при постишемическом реперфузионном повреждении (ишемическое реперфузионное повреждение миокарда), воспаления, приписываемого иммунному отторжению после трансплантации ткани или органа, ожога, различных воспалений кожи (псориаз, аллергический дерматит контактного типа, красный плоский лишай, который является хроническим воспалительным заболеванием кожи), воспаления при множественной органной недостаточности, воспаления после операции РТСА или PTCR и воспаления, сопровождающего артериосклероз и аутоиммунный тиреоидит.
Данное изобретение, в частности, является изобретением, описываемым следующими пунктами от (1) до (32).
(1) Фармацевтическая композиция для предотвращения, лечения или профилактики артроза, содержащая вещество, обладающее активностью в модулировании сигнальной трансдукции, опосредованной AILIM, и фармацевтически приемлемый носитель.
(2) Фармацевтическая композиция по п. (1), где вещество обладает активностью в ингибировании пролиферации AILIM-экспрессирующих клеток или в ингибировании продукции цитокина AILIM-экспрессирующими клетками.
(3) Фармацевтическая композиция по п. (1) или (2), где цитокином является интерферон γ, который является цитокином, продуцируемым Т-клетками Th1-типа, или интерлейкин 4, который является цитокином, продуцируемым Т-клетками Тh2-типа.
(4) Фармацевтическая композиция по любому из пп. с (1) по (3), где артрозом является ревматоидный артрит.
(5) Фармацевтическая композиция по любому из пп. с (1) по (3), где артрозом является остеоартрит.
(6) Фармацевтическая композиция по любому из пп. с (1) по (5), в которой веществом является белковое вещество.
(7) Фармацевтическая композиция по п. (6), в которой белковое вещество выбирают из группы, состоящей из
a) антитела, которое связывается с AILIM или его частью;
b) полипептида, содержащего полностью или частично внеклеточный район AILIM;
c) слитого полипептида, содержащего полностью или частично внеклеточный район AILIM и полностью или частично константный район тяжелой цепи иммуноглобулина, и
d) полипептида, который связывается с AILIM.
(8) Фармацевтическая композиция по любому из пп. с (1) по (5), в которой веществом является небелковое вещество.
(9) Фармацевтическая композиция по п. (8), в которой небелковым веществом является ДНК, РНК или химически синтезируемое соединение.
(10) Фармацевтическая композиция для предотвращения, лечения или профилактики воспаления, содержащая вещество, обладающее активностью в модулировании сигнальной трансдукции, опосредованной AILIM, и фармацевтически приемлемый носитель.
(11) Фармацевтическая композиция по п. (10), в которой вещество обладает активностью в ингибировании пролиферации AILIM-экспрессирующих клеток или в ингибировании продукции цитокина AILIM-экспрессирующими клетками.
(12) Фармацевтическая композиция по п. (11), где цитокином является интерферон γ, который является цитокином, продуцируемым Т-клетками Th1-типа, или интерлейкин 4, который является цитокином, продуцируемым Т-клетками Тh2-типа.
(13) Фармацевтическая композиция по любому из пп. с (10) по (12), где воспалением является гепатит.
(14) Фармацевтическая композиция по любому из пп. с (10) по (13), где веществом является белковое вещество.
(15) Фармацевтическая композиция по п. (14), в которой белковое вещество выбирают из группы, состоящей из
a) антитела, которое связывается с AILIM или его частью;
b) полипептида, содержащего полностью или частично внеклеточный район AILIM;
c) слитого полипептида, содержащего полностью или частично внеклеточный район AILIM и полностью или частично константный район тяжелой цепи иммуноглобулина, и
d) полипептида, который связывается с AILIM.
(16) Фармацевтическая композиция по любому из пп. с (10) по (13), в которой веществом является небелковой вещество.
(17) Фармацевтическая композиция по п. (16), в которой небелковым веществом является ДНК, РНК или химически синтезируемое соединение.
(18) Фармацевтическая композиция для предотвращения, лечения или профилактики реакции трансплантат против хозяина и иммунного отторжения, сопровождающего реакцию трансплантат против хозяина или трансплантацию ткани или органа, содержащая вещество, обладающее активностью в модулировании сигнальной трансдукции, опосредованной AILIM, и фармацевтически приемлемый носитель.
(19) Фармацевтическая композиция по п. (18), в которой вещество обладает активностью в ингибировании пролиферации AILIM-экспрессирующих клеток или в ингибировании продукции цитокина AILIM-экспрессирующими клетками.
(20) Фармацевтическая композиция по п. (19), где цитокином является интерферон γ, который является цитокином, продуцируемым Т-клетками Th1-типа, или интерлейкин 4, который является цитокином, продуцируемым Т-клетками Тh2-типа.
(21) Фармацевтическая композиция по любому из пп. с (18) по (20), в которой веществом является белковое вещество.
(22) Фармацевтическая композиция по п. (21), в которой белковое вещество выбирают из группы, состоящей из
а) антитела, которое связывается с AILIM или его частью;
b) полипептида, содержащего полностью или частично внеклеточный район AILIM;
c) слитого полипептида, содержащего полностью или частично внеклеточный район AILIM и полностью или частично константный район тяжелой цепи иммуноглобулина, и
d) полипептида, который связывается с AILIM.
(23) Фармацевтическая композиция по любому из пп. с (18) по (20), в которой веществом является небелковое вещество.
(24) Фармацевтическая композиция по п. (23), в которой небелковым веществом является ДНК, РНК или химически синтезируемое соединение.
(25) Фармацевтическая композиция для предотвращения иммунного ответа, запускаемого чужеродным антигеном или аутоантигеном, содержащая вещество, обладающее активностью в модулировании сигнальной трансдукции, опосредованной AILIM, и фармацевтически приемлемый носитель.
(26) Фармацевтическая композиция по п. (25), где иммунным ответом является продукция антитела против антигена, пролиферация клеток или продукция цитокина.
(27) Фармацевтическая композиция по п. (25) или (26), в которой вещество обладает активностью в ингибировании пролиферации AILIM-экспрессирующих клеток или в ингибировании продукции цитокина AILIM-экспрессирующими клетками.
(28) Фармацевтическая композиция по п. (27), где цитокином является интерферон γ, который является цитокином, продуцируемым Т-клетками Th1-типа, или интерлейкин 4, который является цитокином, продуцируемым Т-клетками Тh2-типа.
(29) Фармацевтическая композиция по любому из пп. с (25) по (28), в которой веществом является белковое вещество.
(30) Фармацевтическая композиция по п. (29), в которой белковое вещество выбирают из группы, состоящей из
a) антитела, которое связывается с AILIM или его частью;
b) полипептида, содержащего полностью или частично внеклеточный район AILIM;
c) слитого полипептида, содержащего полностью или частично внеклеточный район AILIM и полностью или частично константный район тяжелой цепи иммуноглобулина, и
d) полипептида, который связывается с AILIM.
(31) Фармацевтическая композиция по любому из пп. с (25) по (28), в которой веществом является небелковое вещество.
(32) Фармацевтическая композиция по п. (31), в которой небелковым веществом является ДНК, РНК или химически синтезируемое соединение.
Данное изобретение описано здесь детально ниже посредством определения общих способов получения антител и в терминологии данного изобретения.
"Млекопитающее" здесь означает человека, быка, козу, кролика, мышь, крысу, хомячка и морскую свинку; предпочтительно является человеком, кроликом, крысой, мышью или хомячком и особенно предпочтительно является человеком.
Используемый здесь термин "AILIM" означает "индуцируемую активацией иммуномодулирующую лимфоцитарную молекулу".
Данная AILIM означает новую молекулу на поверхности клеточной мембраны млекопитающих, которая была недавно идентифицирована, выделена, опубликована в JP-A Hei 11-29599 (заявка на патент Японии No. Hei 10-62217), которая соответствует WО98/38216 (PCT/JP98/00837) и названа авторами данного изобретения "JTT-1-антигеном" или "JTT-2-антигеном".
В частности, в указанных выше заявках на патент "AILIM" данного изобретения означает AILIM человека, содержащую аминокислотную последовательность SEQ ID NO: 1 (антиген JTT-1 человека), AILIM крысы, содержащую аминокислотную последовательность SEQ ID NO: 4 или 6 (антиген JTT-1 крысы), AILIM мыши, содержащую аминокислотную последовательность SEQ ID NO: 5 (антиген JTT-1 мыши).
О молекуле, полученной от человека, полностью идентичной AILIM человека, сообщили Kroczek et al. в двух работах, опубликованных после того, как указанные выше две заявки на патент были представлены общественности авторами данного изобретения. Они назвали полученную от человека молекулу ICOS (индуцируемый костимулятор) или 8F4 (WO99/15553; Nature Vol.397, pp.263-266, 1999). Полученная от человека молекула, названная ICOS или 8F4, включена как молекула, идентичная AILIM человека.
Кроме того, используемый здесь термин "AILIM" также включает в себя полипептид, имеющий по существу такую же аминокислотную последовательность, как аминокислотная последовательность AILIM каждого млекопитающего, описанная в работах, на которые даны ссылки, и особенно предпочтительно, последовательность AILIM человека (аминокислотная последовательность SEQ ID NO: 2 в JP-A Hei 11-29599, которая соответствует WО98/38216).
"Имеющий по существу такую же аминокислотную последовательность" здесь означает, тот полипептид, который имеет аминокислотную последовательность, где различные аминокислоты, предпочтительно от 1 до 10 аминокислот, особенно предпочтительно от 1 до 5 аминокислот, в аминокислотной последовательности, показанной в ссылках, заменены, делетированы и/или модифицированы, и полипептид, имеющий аминокислотную последовательность, где различные аминокислоты, предпочтительно от 1 до 10 аминокислот, особенно предпочтительно от 1 до 5 аминокислот добавлены к аминокислотной последовательности, показанной в ссылках, данные полипептиды также включены в понятие "AILIM" данного изобретения при условии, что полипептид имеет по существу такие же биологические свойства, как полипептид, содержащий аминокислотную последовательность, показанную в ссылках.
Такая замена, делеция или инсерция аминокислот может быть достигнута обычным способом (Experimental Medicine: SUPPLEMENT, "Handbook of Genetic Engineering" (1992), и т.д.).
Примерами способов являются сайт-специфичный мутагенез с использованием синтетических олигонуклеотидов (метод дуплекса с пробелом), точковый мутагенез, при котором точечные мутации вводят случайно обработкой нитритом или сульфитом, способ, при котором делеционные мутанты получают с помощью фермента Ва131 и ему подобных, кассетный мутагенез, метод линкерного сканирования, метод включения с пропусками, метод ошибочно спаривающегося праймера, метод синтеза фрагмента ДНК и т.д.
Сайт-специфичный мутагенез с использованием синтетических нуклеотидов (метод дуплекса с пробелом) может быть, например, выполнен следующим образом. Район, в который желательно ввести мутацию, клонируют в М13 фаговом векторе, имеющим амбермутацию, получая однонитевую фаговую ДНК. После РФ I ДНК М13 вектора без амбер-мутации переводят в линейную форму обработкой ферментом рестрикции, ДНК смешивают с однонитевой фаговой ДНК, указанной выше, денатурируют и отжигают, образуя при этом "дуплекс ДНК с пробелом". Синтетический олигонуклеотид, в который введены мутации, гибридизуют с дуплексом ДНК, имеющим пробел, и замкнутые кольцевые двунитевые ДНК получают посредством реакций с ДНК-полимеразой и ДНК-лигазой. Клетки Е. coli mutS, дефицитные по активности в репарации ошибочно спаренных оснований, трансфицируют данной ДНК. Клетки Е. coli без супрессорной активности инфицируют выросшими фагами и отбирают только фаги без амбер-мутации.
В способе, при котором точковую мутацию вводят с помощью нитрита, используют, например, принцип, приведенный ниже. Если ДНК обрабатывают нитритом, основания дезаминируются с превращением аденина в гипоксантин, цитозина в урацил и гуанина в ксантин. Если дезаминированную ДНК вводят в клетки, "А:Т" и "G: C" заменяются "G: C" и "А:Т" соответственно, поскольку гипоксантин, урацил и ксантин при репликации ДНК образуют пары оснований с цитозином, аденином и тимином соответственно. Обычно однонитевые фрагменты ДНК, обработанные нитритом, гибридизуют с "дуплексом ДНК, имеющим пробел", и после мутантные штаммы отбирают, манипулируя таким же образом, как при сайт-специфичном мутагенезе с синтетическими олигонуклеотидами (способ дуплекса с пробелом).
Используемый здесь термин "митоген" также называют митогенным фактором и он означает вещество, которое индуцирует деление клеток. Иммунологически это означает вещество, индуцирующее поликлональный бластогенез лимфоцитов и индуцирующее деление клеток. Примерами митогена являются лектины, такие как ФГА и PWM (митоген лаконоса), конканавалин А (КонА), липополисахариды, стрептолизин S и антилимфоцитарное антитело. Известно, что конканавалин А и ФГА действуют только на Т-лимфоциты, что липополисахариды действуют только на В-лимфоциты и что PWM действует на оба типа лимфоцитов.
Используемый здесь термин "лимфобластная клетка" также называют крупным лимфоцитом, лимфобластом или иммунобластом и он означает лимфоцит, относящийся к крупным лимфоцитам среди лимфоцитов, имеющихся в лимфоидных тканях (лимфатическом узле, селезенке, тимусе, костном мозге, лимфатическом протоке, миндалине и т.д.) и крови.
Используемый здесь термин "активированный лимфоцит" означает, например, лимфоцит, указанный ниже, но этим не ограничен. Например, термин означает лимфоцит, активированный при какой-либо стимуляции. Лимфоциты классифицируют на Т-клетки, В-клетки и природные киллерные клетки. Т-клетки делятся на СD4-позитивные клетки и CD8-позитивные клетки. Поэтому "активированный лимфоцит" данного изобретения включает главным образом активированные Т-клетки, активированные В-клетки и активированные природные киллерные клетки, и активированные Т-клетки включают в себя активированные CD4-позитивные клетки и активированные CD8-позитивные клетки.
При реагировании с антигенами, представленными антиген-представляюшими клетками, CD4-позитивные Т-клетки секретируют различные цитокины (IFNγ, IL-4 и т. д. ), заново экспрессируют рецепторы этих цитокинов, увеличивают свой собственный размер, начинают клеточное деление, пролиферируют и становятся активированными. Активированные CD4-позитивные Т-клетки включают в себя Т-клетки в таком состоянии.
CD8-позитивные Т-клетки экспрессируют IL-2R, когда они реагируют с антигенами. Когда IL-2 действует на IL-2R, клетки дифференцируются в CTL, которые обладают клеточной цитотоксичностью. CTL разрушают свои клетки-мишени, убивая их в том случае, когда они встречают комплекс такого же пептидного антигена/МНС класса I. В том случае, когда CD8-позитивные Т-клетки дифференцируются в CTL, увеличиваются гранулы в цитоплазме. Эти гранулы содержат различные высокомолекулярные белки, представленные перфорином. Перфорин обладает сходством с MAC, состоящим из компонентов комплемента с пятого по девятый, и делает отверстия в клеточной мембране клеток-мишеней. Гранулы также содержат сериновые протеазы, LT и протеогликан. Если CD8-позитивные клетки получают антигенную стимуляцию и дифференцируются в CTL, они также секретируют лимфокины, такие как IFNγ, LT, TNF или IL-2. Активированные CD8-позитивные Т-клетки включают в себя клетки в таком состоянии.
Т-клетки демонстрируют явление бластообразования, когда они реагируют с гемагглютинином (фитогемагглютинин, ФГА) или конканавалином А (КонА). Активированные Т-клетки включают в себя клетки в таком состоянии.
В-клетки экспрессируют молекулы В7, активируют хелперные Т-клетки посредством стимулирования CD28 на их поверхности с помощью TCR, давая возможность хелперным Т-клеткам экспрессировать CD40L или продуцировать лимфокины. Когда клетки получают стимуляцию, они изменяются, увеличивая свой размер, или пролиферируют. Активированные В-клетки включают в себя клетки в таком состоянии. В данном изобретении активированные В-клетки включают в себя В-клетки, секретирующие антитела (антителосекретирующие клетки и плазматические клетки).
Активированные клетки природные киллеры означают клетки, проявляющие цитотоксическое действие на клетки опухоли или клетки, инфицированные вирусом, как указано выше. В данном изобретении активированные лимфоциты включают в себя клетки тимуса, стимулированные конканавалином А (КонА).
Используемый здесь термин "активированная лимфобластная клетка" включает в себя активированный "лимфобласт", который образуется, когда указанный выше лимфобласт стимулируют "митогеном", указанным выше, таким как конканавалин А.
Используемый здесь термин "покоящийся лимфоцит" означает в
некоторых случаях неактивированный лимфоцит, который не получал стимуляции, для того чтобы активировать клетки, в противоположность активированному лимфоциту, указанному выше.
"Цитокин" в выражении "продукция цитокина AILIM-экспрессирующими клетками", составляющими предмет данного изобретения, означает произвольный цитокин, который продуцируется AILIM-экспрессирующими клетками (особенно Т-клетками).
Примерами Т-клеток являются Т-клетки Th1-типа и Th2-типа, и под цитокином данного изобретения, в частности, подразумевается цитокин, продуцируемый Т-клетками Th1-типа и/или произвольный цитокин, продуцируемый Т-клетками Th2-типа.
Примерами цитокинов, продуцируемых клетками Th1-типа, являются IFN-γ, IL-2, TNF, IL-3 и примерами цитокинов, продуцируемых Т-клетками Тh2-типа, являются IL-3, IL-4, IL-5, IL-10, TNF (Cell, Vol.30, No.9, pp.343-346, 1998).
"Вещество", составляющее предмет данного изобретения, в частности "вещество, обладающее активностью в модулировании сигнальной трансдукции, опосредованной AILIM", и более конкретно "вещество, обладающее активностью в ингибировании пролиферации AILIM-экспрессирующих клеток, или в ингибировании продукции цитокина AILIM-экспрессирующими клетками" означает естественное вещество, присутствующее в природе, или искусственно полученное произвольное вещество.
"Сигнальная трансдукция, опосредованная AILIM" здесь означает сигнальную трансдукцию посредством AILIM, приводящую к изменению произвольно выбранного фенотипа AILIM-экспрессирующих клеток, описанных выше, или в последующих примерах (пролиферации клеток, активации клеток, инактивации клеток, апоптозу и/или изменению способности продуцирования произвольно выбранного цитокина AILIM-экспрессирующими клетками).
"Вещество" в основном можно классифицировать на "белковое вещество" и "небелковое вещество". Примерами "белковых веществ" являются нижеследующий полипептид, антитело (поликлональное антитело, моноклональное антитело или часть моноклонального антитела).
В том случае, когда вещество представляет собой антитело, вещество предпочтительно является моноклональным антителом. В том случае, когда вещество представляет собой моноклональное антитело, вещество включает в себя не только моноклональное антитело, полученное от другого млекопитающего, отличного от человека, но также приведенное далее рекомбинантное химерное моноклональное антитело, рекомбинантное гуманизированное моноклональное антитело и моноклональное антитело человека.
В том случае, когда вещество представляет собой полипептид, вещество включает в себя нижеследующий полипептид, фрагмент полипептида (олигопептид), слитый полипептид, их химически модифицированные формы. Примерами олигопептида являются пептиды, содержащие от 5 до 30 аминокислот, предпочтительно от 5 до 20 аминокислот. Химическая модификация может быть разработана в зависимости от разных целей, например увеличенного полупериода жизни в крови в случае введения in vivo, или увеличенной толерантности к деградации или повышенного поглощения в пищеварительном тракте при пероральном введении.
Примерами полипептида являются следующие полипептиды:
(1) полипептид, содержащий полностью или частично внеклеточный район AILIM;
(2) слитый полипептид, содержащий полностью или частично внеклеточный район AILIM и полностью или частично константный район тяжелой цепи иммуноглобулина, или
(3) полипептид, который связывается с AILIM.
Примерами "небелковых" веществ являются ДНК, РНК и химически синтезированное соединение.
"ДНК" здесь означает "ДНК, содержащую неполную нуклеотидную последовательность ДНК или ее химически модифицированную ДНК", используемую в качестве фармацевтического средства на основе антисмысловой ДНК, сконструированного на основании нуклеотидной последовательности ДНК (включая кДНК и геномную ДНК), кодирующей указанный выше AILIM (предпочтительно AILIM человека). В частности, антисмысловая ДНК может ингибировать транскрипцию ДНК, кодирующей AILIM, в мРНК или трансляцию мРНК в белок посредством гибридизации с ДНК или РНК, кодирующей AILIM.
"Неполная нуклеотидная последовательность", как здесь указано, означает неполную нуклеотидную последовательность, содержащую произвольное количество нуклеотидов в произвольно выбранном районе. Неполная нуклеотидная последовательность состоит из 5-100 последовательных нуклеотидов, предпочтительно от 5 до 70 последовательных нуклеотидов, более предпочтительно от 5 до 50 последовательных нуклеотидов и еще более предпочтительно от 5 до 30 последовательных нуклеотидов.
В том случае, когда ДНК используют в качестве фармацевтического средства на основе антисмысловой ДНК, последовательность ДНК может быть химически модифицирована отчасти для продления времени полужизни (стабильности) концентрации введенной пациентам ДНК в крови, для увеличения мембранной проницаемости для ДНК внутрь цитоплазмы или для увеличения устойчивости к деградации или поглощения при пероральном введении ДНК в органы пищеварения. Химическая модификация включает в себя, например, модификацию фосфатных связей, рибоз, нуклеотидных оснований, сахарного компонента, 3'-конца и/или 5'-конца в структуре олигонуклеотидной ДНК.
Модификация фосфатной связи включает в себя, например, превращение одной или большего количества связей в фосфо-диэфирные связи (D-олиго), фосфоротиоатные связи, фосфоро-дитиоатные связи (S-олиго), метилфосфонатные (МФ-олиго), фосфороамидатные связи, нефосфатные связи или метилфосфоно-тиоатные связи или их комбинации. Модификация рибозы включает в себя, например, превращение в 2'-фторрибозу или 2'-О-метилрибозу. Модификация нуклеотидного основания включает в себя, например, превращение в 5-пропинилурацил или 2-аминоаденин.
"РНК" здесь означает "РНК, содержащую неполную нуклеотидную последовательность РНК или ее химически модифицированную РНК", используемую в качестве фармацевтического средства на основе антисмысловой РНК, сконструированного на основе нуклеотидной последовательности РНК, кодирующей указанный выше AILIM (предпочтительно AILIM человека). Антисмысловая РНК может ингибировать транскрипцию ДНК, кодирующей AILIM, в мРНК или трансляцию мРНК в белок посредством гибридизации с ДНК или РНК, кодирующей AILIM.
"Неполная нуклеотидная последовательность", как здесь указано, означает неполную нуклеотидную последовательность, содержащую произвольное количество нуклеотидов в произвольно выбранном районе. Неполная нуклеотидная последовательность содержит от 5 до 100 последовательных нуклеотидов, предпочтительно от 5 до 70 последовательных нуклеотидов, более предпочтительно от 5 до 50 последовательных нуклеотидов и еще более предпочтительно от 5 до 30 последовательных нуклеотидов.
Последовательность антисмысловой РНК может быть химически модифицирована отчасти для продления времени полужизни (стабильности) концентрации введенной пациентам РНК в крови, для увеличения мембранной проницаемости для РНК внутрь цитоплазмы или для увеличения устойчивости к деградации или поглощения при пероральном введении РНК в орган пищеварения. Примером химической модификации является химическая модификация, используемая для указанной выше антисмысловой ДНК.
Примером "химически синтезированного соединения" является произвольное соединение, за исключением указанных выше веществ ДНК, РНК и белка, имеющее молекулярную массу примерно от 100 до 1000, предпочтительно соединение, имеющее молекулярную массу примерно от 100 до 800 и более предпочтительно молекулярную массу примерно от 100 до 600.
"Полипептид", включенный в определение указанного выше "вещества", означает часть (фрагмент) полипептидной цепи, составляющей AILIM (предпочтительно AILIM человека), предпочтительно полностью или частично внеклеточный район полипептида, составляющего AILIM (от 1 до 5 аминокислот могут быть необязательно добавлены в N-конец и/или С-конец района).
AILIM, включенный в данное изобретение, является трансмембранной молекулой, пронизывающей клеточную мембрану, содержащей 1 или 2 полипептидные цепи.
"Трансмембранный белок" здесь означает белок, который соединяется с мембраной посредством гидрофобного пептидного района, пронизывающего липидный бислой мембраны один или несколько раз, и структура которого, в полном виде, построена из трех основных районов, которыми являются внеклеточный район, трансмембранный район и цитоплазматический район, как видно во многих рецепторах или молекулах клеточной поверхности. Такой трансмембранный белок образует каждый рецептор или молекулу клеточной поверхности в виде мономера, гомодимера, гетеродимера или олигомера с другой цепью(ями), имеющей такую же или другую аминокислотную последовательность.
"Внеклеточный домен" здесь означает всю или часть неполной структуры (неполного района) из полной структуры указанного выше трансмембранного белка, где неполная структура находится снаружи мембраны. Другими словами, он означает весь или часть района трансмембранного белка, за исключением района, включенного в мембрану (трансмембранный район), и района, находящегося в цитоплазме, следующего за трансмембранным районом (цитоплазматический район).
"Слитый полипептид", включенный в указанное выше "белковое вещество", означает слитый полипептид, содержащий полностью или частично внеклеточный район полипептида, составляющего AILIM (предпочтительно AILIM человека), и "полностью или частично константный район тяжелой цепи иммуноглобулина (Ig, предпочтительно Ig человека)". Предпочтительно слитый полипептид представляет собой слитый полипептид с внеклеточным районом AILIM и частью константного района тяжелой цепи IgG человека и особенно предпочтительно слитый полипептид внеклеточного района AILIM и района (Fc) тяжелой цепи IgG человека, содержащего шарнирный участок, СН2-домен и СD3-домен. В качестве IgG предпочтителен IgG1, а в качестве AILIM предпочтителен AILIM человека, мыши или крысы (предпочтительно человека).
Используемый здесь термин "полностью или частично константный район тяжелой цепи иммуноглобулина (Ig) человека" означает константный район или Fc-район тяжелой цепи (Н-цепи) иммуноглобулина, полученного от человека, как описано, или его часть. Иммуноглобулином может быть любой иммуноглобулин, относящийся к любому классу и любому подклассу. В частности, примерами иммуноглобулина являются IgG (IgG1, IgG2, IgG3 и IgG4), IgM, IgA (IgA1 и IgA2), IgD и IgE. Предпочтительно иммуноглобулином является IgG (IgG1, IgG2, IgG3 и IgG4) или IgM. Примерами особенно предпочтительного иммуноглобулина данного изобретения являются иммуноглобулины, относящиеся к IgG (IgG1, IgG2, IgG3 и IgG4), полученному от человека.
Иммуноглобулин имеет Y-образную конструкцию, в которой четыре цепи, состоящие из двух гомологичных легких цепей (L-цепей) и двух гомологичных тяжелых цепей (Н-цепей), связаны посредством дисульфидных связей (S-S-связей). Легкая цепь состоит из вариабельного района легкой цепи (VL) и константного района легкой цепи (СL). Тяжелая цепь состоит из вариабельного района тяжелой цепи (VH) и константного района тяжелой цепи (СH).
Константный район тяжелой цепи состоит из нескольких доменов, имеющих аминокислотные последовательности, присущие каждому классу (IgG, IgM, IgA, IgD и IgE) и каждому подклассу (IgG1, IgG2, IgG3 и IgG4, IgA1 и IgA2).
Тяжелая цепь IgG (IgG1, IgG2, IgG3 и IgG4) состоит из VH, CH1-домена, шарнирного района, СН2-домена и СН3-домена в таком порядке от N конца.
Сходным образом, тяжелая цепь IgG1 состоит из VH, Cγ11-домена, шарнирного района, Cγ12-домена и Cγ13-домена в таком порядке от N-конца. Тяжелая цепь IgG2 состоит из VH, Cγ21-домена, шарнирного района, Cγ22-домена и Cγ23-домена в таком порядке от N-конца. Тяжелая цепь IgG3 состоит из VH, Cγ31-домена, шарнирного района, Cγ32-домена и Cγ33-домена в таком порядке от N-конца. Тяжелая цепь IgG4 состоит из VH, Cγ41-домена, шарнирного района, Cγ42-домена и Cγ43-домена в таком порядке от N-конца.
Тяжелая цепь IgA состоит из VH, Cα1-домена, шарнирного района, Cα2-домена и Cα3-домена в таком порядке от N-конца.
Сходным образом, тяжелая цепь IgA1 состоит из VH, Cα11-домена, шарнирного района, Cα12-домена и Cα13-домена в таком порядке от N-конца. Тяжелая цепь IgA2 состоит из VH, Cα21-домена, шарнирного района, Cα22-домена и Cα23-домена в таком порядке от N-конца.
Тяжелая цепь IgA состоит из VH, Cα1-домена, шарнирного района, Cα2-домена и Cα3-домена в таком порядке от N-конца.
Тяжелая цепь IgD состоит из VH, Cδ1-домена, шарнирного района, Cδ2-домена и Cδ3-домена в таком порядке от N-конца.
Тяжелая цепь IgM состоит из VH, Cμ1-домена, Cμ2-домена, Cμ3-домена и Cμ4-домена в таком порядке от N-конца и не имеет шарнирного района, как видно в IgG, IgA и IgD.
Тяжелая цепь IgE состоит из VH, Cε1-домена, Cε2-домена, Cε3-домена и Cε4-домена в таком порядке от N-конца и не имеет шарнирного района, как видно в IgG, IgA и IgD.
Если, например, IgG обрабатывают папаином, он расщепляется не очень далеко с N-концевой стороны от дисульфидных связей, имеющихся в шарнирном районе, где дисульфидные связи соединяют две тяжелые цепи, образуя два гомологичных Fab, в которых фрагмент тяжелой цепи, состоящий из VH и СН1, соединен с одной легкой цепью посредством дисульфидной связи, и один Fc, в котором два гомологичных фрагмента тяжелой цепи, состоящие из шарнирного района, СН2-домена и СН3-домена соединены посредством дисульфидных связей (смотри "Immunology Illustrated", original 2nd ed. , Nankodo, pp.65-75 (1992), и "Focus of Newest Medical Science 'Recognition Mechanism of Immune System'", Nankodo, pp.4-7 (1991), и т.д.).
То есть "часть константного района тяжелой цепи иммуноглобулина", указанная выше, означает часть константного района тяжелой цепи иммуноглобулина, имеющую структурные особенности, как указано выше, и предпочтительно является константным районом без Cl-домена, или Fc-районом. В частности, примером этого является район, состоящий из шарнирного района, С2-домена и С3-домена из каждого IgG, IgA и IgD, и район, состоящий из С2-домена, С3-домена и С4-домена из каждого IgM и IgE. Особенно предпочтительным примером такого района является Fc-район IgG1, полученного от человека.
Указанный выше слитый полипептид обладает тем преимуществом, что слитый полипептид может быть очищен очень легко с использованием аффинной хроматографии на колонках на основе свойства белка А, который специфично связывается с фрагментом иммуноглобулина, так как гибридный полипептид данного изобретения имеет в качестве партнера в слиянии часть константного района (например, Fc) иммуноглобулина, такого как IgG, как указано выше. Кроме того, так как имеются различные антитела против Fc различных иммуноглобулинов, иммуноанализ слитых полипептидов может быть легко выполнен с помощью антител против Fc.
"Полипептид, который связывается с AILIM", включают в понятие "полипептид", включенное в приведенное выше определение "вещества".
Конкретными примерами "полипептида, который связывается с AILIM", являются полностью или частично полипептиды, образующие известные B7h, B7RP-1, GL50 или молекулу, называемую LICOS, которые являются лигандами, взаимодействующими с AILIM (Nature, Vol.402, No.6763, pp.827-832, 1999); Nature Medicine, Vol. 5, No.12, pp.1365-1369, 1999; J. Immunology, Vol.164, pp.1653-1657, 2000; Curr. Biol., Vol.10, No.6, pp. 333-336, 2000).
Предпочтительно полипептидом является полипептид, содержащий полностью или частично внеклеточный район указанных выше лигандов (B7h, B7RP-1, GL50, LICOS), или слитый полипептид, содержащий полипептид и полностью или частично константный район тяжелой цепи иммуноглобулина (предпочтительно иммуноглобулина человека). Здесь термины "внеклеточный район" и "константный район тяжелой цепи иммуноглобулина" имеют такое же значение, которое указано выше.
Полипептид, часть полипептида (фрагмент) и слитый полипептид, указанные выше, могут быть получены не только с помощью технологии рекомбинантных ДНК, как указано ниже, но также способом, хорошо известным в данной области, таким как способ химического синтеза и способ культивирования клеток, или модификации этих способов.
"Антитело" данного изобретения может быть поликлональным антителом (антисывороткой) или моноклональным антителом против AILIM млекопитающих (особенно предпочтительна AILIM человека), определенной выше, и предпочтительно моноклональным антителом.
В частности, антителом является антитело, обладающее активностью в ингибировании пролиферации AILIM-экспрессирующих клеток посредством связывания с AILIM, или в ингибировании продукции интерферона γ или интерлейкина 4 AILIM-экспрессирующими клетками посредством связывания с AILIM.
Антителом данного изобретения могут быть природные антитела, полученные иммунизацией млекопитающих, таких как мыши, крысы, хомячки, морские свинки и кролики, антигеном, таким как клетки (природные клетки, клеточные линии, опухолевые клетки и т.д.), экспрессирующие AILIM данного изобретения, трансформанты, полученные с использованием технологии рекомбинантных ДНК так, чтобы они сверхэкспрессировали AILIM на своей поверхности, полипептиды, составляющие AILIM, или указанные выше слитые полипептиды, содержащие полипептид AILIM или внеклеточный район AILIM. Антитело данного изобретения также включает химерные антитела и гуманизированные антитела (антитела с привитыми CDR), которые могут быть получены с помощью технологии рекомбинантных ДНК, и антитела человека, которые могут быть получены с использованием трансгенных животных, продуцирующих антитела человека.
Моноклональное антитело включает в себя антитела, имеющие любой изотип IgG, IgM, IgA, IgD или IgE, IgG или IgM предпочтительны.
Поликлональное антитело (антисыворотка) или моноклональное антитело может быть получено известными способами, а именно млекопитающее, предпочтительно мышь, крысу, хомячка, морскую свинку, кролика, кошку, собаку, свинью, козу, лошадь или крупный рогатый скот или более предпочтительно мышь, крысу, хомячка, морскую свинку или кролика, иммунизируют, например, антигеном, указанным выше, с адъювантом Фрейнда, если это необходимо.
Поликлональное антитело может быть получено из сыворотки, полученной от животных, иммунизированных таким образом. Кроме того, моноклональные антитела получают следующим образом. Готовят гибридомы из антителопродуцирующих клеток, полученных от животных, иммунизированных таким образом, и клеток миеломы, которые не способны продуцировать аутоантитела. Гибридомы клонируют и отбирают клоны, продуцирующие моноклональные антитела, проявляющие специфичное сродство к антигену, используемому для иммунизации млекопитающего.
В частности, моноклональное антитело может быть получено следующим образом. Иммунизации выполняют путем инъекции или имплантации однократно или несколько раз антигеном, приведенным выше в качестве иммуногена, при необходимости с адъювантом Фрейнда, подкожно, внутримышечно, внутривенно, в подушечку лапы или внутрибрюшинно не человеку, а другому млекопитающему, в частности мыши, крысе, хомячку, морской свинке или кролику, предпочтительно мыши, крысе или хомячку (включая трансгенное животное, созданное так, чтобы оно продуцировало антитела другого животного, такое как трансгенная мышь, продуцирующая указанное ниже антитело человека). Обычно иммунизации проводят от одного до четырех раз каждые от одного до четырнадцати дней после первой иммунизации. Антителопродуцирующие клетки получают от иммунизированного таким образом млекопитающего примерно на первый - пятый день после последней иммунизации. Частота и интервалы иммунизации могут быть соответственно установлены, в зависимости, например, от качества используемого иммуногена. Гибридомы, которые секретируют моноклональное антитело, могут быть получены способом Köhler and Milstein (Nature, Vol.256, pp.495-497 (1975)) и его модифицированным способом. А именно, гибридомы готовят путем слияния антителопродуцирующих клеток, находящихся в селезенке, лимфатическом узле, костном мозге или миндалине, полученных от другого млекопитающего, отличного от человека, иммунизированного, как указано выше, предпочтительно в селезенке, с миеломами, не обладающими способностью продуцировать аутоантитела, которые получают предпочтительно из млекопитающего, такого как мышь, крыса, морская свинка, хомячок, кролик или человек, или более предпочтительно мышь, крыса или человек.
Например, в качестве миеломы, используемой для слияния клеток, может быть использована миелома, полученная от мыши P3/X63-AG8,653 (653), P3/NSI/1-Ag4-1 (NS-1), P3/X63-Ag8.U1 (P3U1), SP2/0-Ag14 (Sp2/0, Sp2), PAI, F0 или BW5147, миелома, полученная от крысы 210RCY3-Ag.2.3 или миелома, полученная от человека U-266AR1, GM1500-6TG-A1-2, UC729-6, CEM-AGR, D1R11 или CEM-T15.
Гибридомные клоны, продуцирующие моноклональные антитела, могут быть отобраны при культивировании гибридом, например, в планшетах для микротитрования и путем измерения реактивности надосадка культуры в лунке, в которой наблюдается рост гибродомы, по отношению к иммуногену, используемому для иммунизации, указанной выше, например, иммуноферментным анализом, таким как РИА и ELISA.
Моноклональные антитела могут быть получены из гибридом посредством культивирования гибридом in vitro и in vivo, такого как в асцитной жидкости мыши, крысы, морской свинки, хомячка или кролика, предпочтительно мыши или крысы, более предпочтительно мыши, и выделения антител из полученного в результате надосадка культуры или асцитной жидкости млекопитающего.
Культивирование гибридом in vitro может быть выполнено в зависимости, например, от качества культивируемых клеток, цели тестового исследования и различных условий способа культивирования, с использованием известных питательных сред или любой питательной среды, полученной из известных основных сред для выращивания, поддержания и хранения гибридом, чтобы получить моноклональные антитела в надосадке культуры.
Примерами основных сред являются среды с низким содержанием кальция, такие как среда Хама F12, среда MCDB153 или среда MEM с низким содержание кальция и среды с высоким содержанием кальция, такие как среда MCDB104, среда MEM, среда D-MEM, среда RPMI1640, среда ASF104 или среда RD. Основные среды могут, например, содержать сыворотку, гормоны, цитокины и/или различные неорганические или органические вещества в зависимости от цели.
Моноклональные антитела могут быть выделены и очищены из надосадка культуры или асцитной жидкости, указанных выше, осаждением насыщенным сульфатом аммония, методом осаждения эуглобулинов, методом с применением капроновой кислоты, методом с применением каприловой кислоты, ионообменной хроматографией (ДЭАЭ или DE52), аффинной хроматографией с использованием антииммуноглобулиновой колонки или белок А-колонки.
"Рекомбинантным химерным моноклональным антителом" является моноклональное антитело, полученное с помощью генной инженерии, и, в частности, означает химерное антитело, такое как химерное моноклональное антитело мышь/человек, вариабельные районы которого получены из иммуноглобулина не человека, а другого млекопитающего (мышь, крыса, хомячок и т.д.) и константные районы которого получены из иммуноглобулина человека.
Константный район, полученный из иммуноглобулина человека, имеет аминокислотную последовательность, свойственную каждому изотипу, такому как IgG (IgG1, IgG2, IgG3, IgG4), IgM, IgA, IgD и IgE. Константным районом рекомбинантного химерного моноклонального антитела может быть константный район иммуноглобулина человека, относящегося к любому изотипу. Предпочтительно это константный район IgG человека.
Химерное моноклональное антитело может быть, например, получено следующим образом. Излишне говорить, что способ получения этим не ограничен.
Химерное моноклональное антитело мышь/человек можно получить, ссылаясь на Experimental Medicine: SUPPLEMENT, Vol. 1.6., No. 10 (1988), и прошедшую экспертизу опубликованную заявку на патент Японии (JP-B) No. Hei 3-73280. А именно, его можно получить встраиванием СН-гена (С-ген, кодирующий константный район Н-цепи), полученного из ДНК, кодирующей иммуноглобулин человека, в один оперон ниже по течению активных VH-генов (перестроенный ген VDJ, кодирующий вариабельный район Н-цепи), полученных из ДНК, кодирующей моноклональное антитело мыши, выделенной из гибридомы, продуцирующей моноклональное антитело мыши, и СL-гена (С-ген, кодирующий константный район L-цепи), полученного из ДНК, кодирующей иммуноглобулин человека, ниже по течению активных VL-генов (перестроенный VJ-ген, кодирующий вариабельный район L-цепи), полученных из ДНК, кодирующей моноклональное антитело мыши, выделенной из гибридомы, в один и тот же или в разные векторы, так, чтобы они экспрессировались, с последующей трансформацией клеток хозяина, экспрессирующим вектором, и затем культивированием трансформантов.
В частности, ДНК сначала экстрагируют из гибридом мыши, продуцирующих моноклональные антитела, обычным способом переваривают соответствующими ферментами рестрикции (например EcoRI и HindIII), подвергают электрофорезу (используя, например, 0,7% агарозный гель) и анализируют с помощью Саузерн-блоттинга. После электрофореза гели красят, например, бромидом этидия и фотографируют, в геле устанавливают положения маркеров, дважды промывают водой и замачивают в 0,25 М НСl в течение 15 минут. Затем гель замачивают в 0,4 н. растворе NaOH в течение 10 минут при осторожном перемешивании. ДНК переносят на фильтры в течение 4 часов обычным способом. Фильтр извлекают и дважды промывают 2хSSC. Затем фильтр достаточно сушат, спекают при 75oС в течение 3 часов. После спекания фильтр обрабатывают 0,1хSSC/0,1% SDS при 65oС в течение 30 минут. Затем его замачивают в 3хSSC/0,l% SDS. Полученный фильтр обрабатывают раствором для предгибридизации в целлофановом пакете при 65oС в течение от 3 до 4 часов.
Затем добавляют в пакет 32Р-меченную пробу ДНК, раствор для гибридизации и проводят реакцию при 65oС примерно 12 часов. После гибридизации фильтр промывают при подходящей концентрации соли, температуре реакции и времени (например, 2хSSC-0,1% SDS, комнатная температура, 10 минут). Фильтр кладут в целлофановый пакет с небольшим количеством 2хSSC и подвергают авторадиографии после герметизации пакета.
Перестроенные VDJ-ген и VJ-ген, кодирующие Н-цепь и L-цепь моноклонального антитела мыши, идентифицируют Саузерн-блоттингом, указанным выше. Район, содержащий идентифицированный фрагмент ДНК, фракционируют центрифугированием в градиенте плотности сахарозы и встраивают в фаговый вектор (например, Charon 4А, Charon 28, λEMBL3, λEMBL4 и т.д.). Е. coli (например, LE392, NM539 и т.д.) трансформируют фаговым вектором, чтобы создать геномную библиотеку. Проводят скрининг геномной библиотеки гибридизацией в бляшках, такой как способ Benton-Davis (Science, Vol.196, pp.180-182 (1977)), используя соответствующие пробы (J-ген Н-цепи, J-ген L-цепи (k) и т.д.), чтобы получить позитивные клоны, содержащие перестроенный ген VDJ или ген VJ. Рестрикционным картированием и определением нуклеотидной последовательности полученных клонов подтверждают, что получены гены, содержащие требуемый перестроенный ген VH(VDJ) или ген VL (VJ).
Отдельно выделяют ген СH человека и ген СL человека, используемые для получения химер. Например, когда получают химерное антитело с IgG1 человека, выделяют Cγ1-ген в качестве СH-гена и Ck-ген в качестве СL-гена. Данные гены могут быть выделены из геномной библиотеки человека с использованием в качестве зондов Cγ1-гена мыши и Ck-гена мыши, соответствующих Cγ1-гену человека и Ck-гену человека соответственно, воспользовавшись преимуществом высокой гомологии между нуклеотидными последовательностями гена иммуноглобулина мыши и гена иммуноглобулина человека.
В частности, ДНК-фрагменты, содержащие ген Ck человека и энхансерный район, выделяют из геномной библиотеки λ Charon 4A HaeIII-AluI человека (Cell, Vol. 15, pp.1157-1174 (1978)), например, с использованием в качестве зондов HindIII-BamHI-фрагмента клона Ig146 длиной 3 т.п.н. (Рrос. Natl. Acad. Sci. USA, Vol. 75, pp.4709-4713 (1978)) и EcoRI фрагмента клона МЕР10 длиной 6,8 т. п.н. (Рrос. Natl. Acad. Sci. USA, Vol.78, pp.474-478 (1981)). Кроме того, например, после того как ДНК гепатоцитов плода человека переваривают HindIII и фракционируют при электрофорезе в агарозном геле, фрагмент длиной 5,9 т.п. н. встраивают в λ788, и затем ген Cγ1 человека выделяют с помощью указанного выше зонда.
С использованием полученных таким образом гена VH мыши, гена VL мыши, гена CH человека и гена CL человека и, принимая во внимание промоторный район и энхансерный район, ген CH человека встраивают ниже по течению гена VH мыши и ген CL человека встраивают ниже по течению гена VL мыши в экспрессирующий вектор, такой как pSV2gpt или pSV2neo с помощью подходящих ферментов рестрикции и ДНК-лигазы обычным способом. В данном случае химерные гены - ген VH мыши/ген СH человека и ген VL мыши/ген CL человека могут быть соответственно встроены в один и тот же экспрессирующий вектор или в различные экспрессирующие векторы.
Полученный таким образом экспрессирующий вектор(ры) со встроенными химерными генами вводят в миеломы, которые не продуцируют антитела, например клетки Р3Х63•Аg•653 или клетки SP210, методом слияния протопластов, ДЭАЭ-декстрановым способом, кальций-фосфатным способом или методом электропорации. Скрининг трансформантов проводят при культивировании в средах, содержащих лекарственное средство, соответствующее гену устойчивости к лекарству, встроенному в экспрессирующий вектор, и затем получают клетки, продуцирующие желаемые химерные моноклональные антитела.
Требуемые химерные моноклональные антитела получают из надосадка культуры отобранных таким образом клеток, продуцирующих антитела.
"Гуманизированным моноклональным антителом (антителом с привитым CDR)" данного изобретения является моноклональное антитело, полученное с помощью генной инженерии, и это, в частности, означает гуманизированное моноклональное антитело, в котором часть или полные районы гипервариабельной области, определяющие комплементарность, получают из определяющих комплементарность районов гипервариабельной области моноклонального антитела не человека, а другого млекопитающего (мыши, крысы, хомячка и т.д.), каркасные районы вариабельной области получают из каркасных районов вариабельной области иммуноглобулина человека и константный район получают из константного района иммуноглобулина человека.
Определяющие комплементарность районы гипервариабельной области существуют в гипервариабельной области в вариабельной части антитела и означают три района, которые непосредственно и комплементарно связываются с антигеном (остатки, определяющие комплементарность, CDR1, CDR2 и CDR3). Каркасные районы вариабельной области означают четыре сравнительно консервативных района, лежащих выше по течению, ниже по течению или между тремя районами, определяющими комплементарность (каркасный район, FR1, FR2, FR3 и FR4).
Другими словами гуманизированное моноклональное антитело означает антитело, в котором все районы, за исключением части или полных определяющих комплементарность районов гипервариабельной области моноклонального антитела, полученного не от человека, а от другого млекопитающего, были заменены соответствующими им районами, полученными из иммуноглобулина человека.
Константный район, полученный из иммуноглобулина человека, имеет аминокислотную последовательность, присущую каждому изотипу, такому как IgG (IgG1, IgG2, IgG3, IgG4), IgM, IgA, IgD и IgE. Константный район гуманизированного моноклонального антитела в данном изобретении может быть районом из иммуноглобулина человека, относящегося к любому изотипу. Предпочтительно он представляет собой константный район IgG человека. Каркасные районы константного участка, полученного из иммуноглобулина человека особым образом, не ограничены.
Гуманизированное моноклональное антитело может быть получено, например, следующим образом. Излишне говорить, что способ получения при этом не ограничен.
Например, рекомбинантное гуманизированное моноклональное антитело, полученное из моноклонального антитела мыши, можно приготовить с помощью генной инженерии, обратившись к опубликованному переводу на японский международной заявки (JP-WA) No. Hei 4-506458 и JP-A Sho 62-296890. А именно, по меньшей мере один ген CDR Н-цепи мыши и по меньшей мере один ген CDR L-цепи мыши, соответствующий гену CDR Н-цепи мыши, выделяют из гибридом, продуцирующих моноклональное антитело мыши, и ген Н-цепи человека, кодирующий полные районы, за исключением CDR Н-цепи человека, соответствующего CDR Н-цепи мыши, указанному выше, и ген L-цепи человека, кодирующий полный район, за исключением CDR L-цепи человека, соответствующего CDR L-цепи мыши, указанному выше, выделяют из генов иммуно-глобулинов человека.
Выделенные таким образом ген(ны) CDR Н-цепи мыши и ген(ны) Н-цепи человека встраивают в один оперон в подходящий вектор так, чтобы они могли экспрессироваться. Сходным образом ген(ны) CDR L-цепи мыши и ген(ны) L-цепи человека оперативно встраивают в другой подходящий вектор так, чтобы они могли экспрессироваться. В альтернативном случае ген(ны) CDR Н-цепи мыши/ген(ны) Н-цепи человека и ген(ны) CDR L-цепи мыши/ген(ны) L-цепи человека могут быть оперативно встроены в один и тот же экспрессирующий вектор так, чтобы они могли экспрессироваться. Клетки хозяина трансформируют приготовленным таким образом экспрессирующим вектором, чтобы получить трансформанты, продуцирующие гуманизированное моноклональное антитело. При культивировании трансформантов требуемое гуманизированное моноклональное антитело получают из надосадка культуры.
"Моноклональным антителом человека" является иммуноглобулин, в котором полные районы, содержащие вариабельную и константную область Н-цепи и вариабельную и константную область L-цепи, составляющие иммуноглобулин, получены из генов, кодирующих иммуноглобулин человека.
Антитело человека (предпочтительно моноклональное антитело человека) может быть получено таким же способом, как способ получения поликлональных или моноклональных антител, указанный выше, путем иммунизации антигеном трансгенного животного, у которого, например, по меньшей мере ген(ны) иммуноглобулина человека был интегрирован в локус не человека, а другого млекопитающего, такого как мышь, обычным способом.
Например, трансгенную мышь, продуцирующую антитела человека, получают способами, описанными в Nature Genetics, Vol.7, pp.13-21 (1994); Nature Genetics, Vol. 15, pp.146-156 (1997); JP-WA Hei 4-504365; JP-WA Hei 7-509137; Nikkei Science, No. 6, pp.40-50 (1995); W094/25585; Nature, Vol. 368, pp. 856-859 (1994), и JP-WA No. Hei 6-500233.
Кроме того, также может быть применена недавно разработанная технология получения белка человека из молока трансгенных коров или свиней (Nikkei Science, pp.78-84 (April, 1997)).
Используемый в данном изобретении термин "часть антитела" означает неполный район моноклонального антитела, указанного выше, и, в частности, означает F(ab')2, Fab', Fab, Fv (вариабельный фрагмент антитела), sFv, dsFv (Fv, стабилизированный дисульфидной связью) или dAb (однодоменное антитело) (Exp. Opin. Ther. Patents, Vol.6, No. 5, pp.441-456 (1996)).
"F(ab')2" и "Fab'" могут быть получены обработкой иммуноглобулина (моноклонального антитела) протеазой, такой как пепсин и папаин, и означает фрагмент антитела, образованный при переваривании иммуноглобулина вблизи дисульфидных связей в шарнирных районах, существующих между каждой из двух Н-цепей. Например, папаин расщепляет IgG выше по течению дисульфидных связей в шарнирных районах, имеющихся между каждой из двух Н-цепей, создавая два гомологичных фрагмента антитела, в которых L-цепь, состоящая из VL (вариабельного района L-цепи) и CL (константного района L-цепи), и фрагмент Н-цепи, состоящий из VH (вариабельного района Н-цепи) и CHγ1 (γ1-район в константной области Н-цепи), соединены своими С-концевыми районами посредством дисульфидной связи. Каждый из этих двух гомологичных фрагментов антитела называется Fab'. Пепсин также расщепляет IgG ниже по течению дисульфидных связей в шарнирных районах, имеющихся между каждой из двух Н-цепей, создавая фрагмент антитела, немного больший, чем фрагмент, в котором два указанных выше Fab' связаны у шарнирного района. Данный фрагмент называется F(ab')2.
"Фармацевтическая композиция" данного изобретения представляет собой фармацевтическую композицию, содержащую "вещество", указанное выше, в частности "вещество, обладающее активностью в модулировании сигнальной трансдукции, опосредованной AILIM", более конкретно "вещество, обладающее активностью в ингибировании пролиферации AILIM-экспрессирующих клеток или в ингибировании продукции цитокина AILIM-экспрессирующими клетками", а также фармацевтически приемлемый носитель. В частности, фармацевтическая композиция данного изобретения представляет собой фармацевтическую композицию, содержащую "белковое вещество" или "небелковое вещество", определяемые выше, и фармацевтически приемлемый носитель. Более конкретно, фармацевтическая композиция данного изобретения представляет собой фармацевтическую композицию, содержащую любой из полипептидов, часть полипептида (фрагмент), слитый полипептид, поликлональное антитело, моноклональное антитело или часть моноклонального антитела, определяемые выше, и фармацевтически приемлемый носитель.
"Фармацевтически приемлемый носитель" включает в себя наполнитель, разбавитель, средство, способствующее распространению, разлагающее средство, стабилизатор, консервант, буфер, эмульгатор, ароматизатор, красящее средство, подсластитель, средство, увеличивающее вязкость, корригент вкуса и запаха, средство, увеличивающее растворимость, или другие добавки. Используя один или большее количество таких носителей, фармацевтическую композицию можно приготовить в виде таблеток, пилюль, порошков, гранул, инъекций, растворов, капсул, пастилок, эликсиров, суспензий, эмульсий или сиропов. Фармацевтическую композицию можно вводить перорально или парентерально. Другие формы парентерального введения включают в себя раствор для наружного применения, суппозиторий для ректального введения и пессарий, назначаемые обычным способом, которые содержат один или большее количество активных ингредиентов.
Дозу может варьировать в зависимости от возраста, пола, веса и симптомов у пациента, результата лечения, пути введения, периода лечения или вида активного ингредиента (полипептид или антитело, указанные выше), содержащегося в фармацевтической композиции. Обычно фармацевтическую композицию можно вводить взрослым в дозе от 10 мкг до 1000 мг (или от 10 мкг до 500 мг) на одно введение. В зависимости от различных состояний в некоторых случаях достаточной может быть доза, меньшая, чем указанные выше, и в некоторых случаях может быть необходима доза, большая, чем указанные выше.
В частности, инъекционный препарат может быть получен путем растворения или суспендирования антитела в нетоксичном, фармацевтически приемлемом носителе, таком как физиологический раствор соли или коммерчески доступная дистиллированная вода для инъекции, при доведении концентрации до значения от 0,1 мкг антитела/мл носителя до 10 мг антитела/мл носителя. Полученный таким образом инъекционный препарат можно вводить больным людям, нуждающимся в лечении, в дозе от 1 мкг до 100 мг/кг массы тела, предпочтительно от 50 мкг до 50 мг/кг массы тела, однократно или несколько раз в сутки. Примерами путей введения являются подходящие с медицинской точки зрения пути введения, такие как внутривенная инъекция, подкожная инъекция, интрадермальная инъекция, внутримышечная инъекция или внутрибрюшинная инъекция, предпочтительно внутривенная инъекция.
Инъекционный препарат также может быть приготовлен в неводном разбавителе (например, пропиленгликоле, полиэтилен-гликоле, растительном масле, таком как оливковое масло, и спирте, таком как этанол), суспензии или эмульсии.
Инъекционный препарат можно стерилизовать фильтрацией через непроницаемый для бактерий фильтр, смешиванием с бактерицидным средством или облучением. Инъекционный препарат может быть получен в форме, которая готовится перед использованием. А именно, препарат лиофильно сушат до стерильной твердой композиции, и его можно растворять в стерильной дистиллированной воде для инъекций или другом растворителе перед использованием.
Фармацевтическая композиция данного изобретения пригодна для лечения или профилактики различных аутоиммунных заболеваний, аллергических заболеваний или воспалительных заболеваний, вызываемых активацией лимфоцитов, таких как Т-клетки, и нарушением регуляции функций активированных лимфоцитов.
Примерами заболеваний являются артроз (например, ревматоидный артрит, остеоартрит), воспаление [например, энцефалит, бронхит, ангиит, пневмония, гепатит, миокардит, панкреатит, энтерит тонкого кишечника, гастрит, перитонит, нефрит (например, гломерулонефрит), артрит (например, ревматоидный артрит), воспаление при постишемическом реперфузионном повреждении (ишемическое реперфузионное повреждение миокарда), воспаление, приписываемое иммунному отторжению, воспалительные заболевания кишечника, ожог, воспаление при множественной органной недостаточности, воспаление после операций РТСА или PTCR, воспаление, сопровождающее артериосклероз], различные состояния, вызванные бактериальной или вирусной инфекцией (например, воспаление), реакция трансплантат против хозяина, иммунное отторжение, сопровождающее реакцию трансплантат против хозяина, трансплантацию ткани(ней) и органа(нов), различные заболевания, сопровождающиеся избыточной продукцией антитела против чужеродного антигена, вызванной иммунизацией чужеродным антигеном, множественный склероз, аутоиммунный тиреоидит, различные воспаления кожи (аллергический дерматит контактного типа, красный плоский лишай, который является хроническим воспалительным заболеванием кожи, псориаз, склеродермия) и системная красная волчанка.
Как острые, так и хронические воспаления включены в понятие "воспаление" данного изобретения. В общем, острым воспалением является воспаление, при котором проявление воспалительного ответа происходит относительно быстро, прогрессирование также происходит быстро и исход его очевиден. С другой стороны, хроническое воспаление означает воспаление, при котором проявление воспалительного ответа происходит относительно медленно, или постепенно, или даже наличие проявления слишком слабое, чтобы его четко обнаружить, и проявление продолжается от нескольких недель до нескольких лет, и исход не ясен.
Воспаление, вызываемое в произвольной ткани, включено в понятие воспаления данного изобретения. В частности, например, воспаление в тканях мозга, глаза, бронхов, кровеносного сосуда, легкого, печени, сердца, поджелудочной железы, желудка, кишечника, брыжейки, почки, кожи, слизистой оболочки носа или сустава.
Терапевтическое действие фармацевтической композиции данного изобретения на симптомы различных заболеваний можно тестировать обычным способом при ее введении в известные модели болезней на животных.
Краткое описание рисунков
Фигура 1 показывает характер экспрессии CD3, CD28 и AILIM (альтернативно называемой ThA) в Т-клетках, полученных из тимуса нормальный мыши.
Субфигура (а) показывает характер экспрессии CD3 и AILIM (альтернативно называемой ThA). Субфигура (b) показывает характер экспрессии CD3 и CD28.
Фигура 2 показывает характер экспрессии CD28 и AILIM в Т-клетках, полученных из тимуса нормальной мыши на каждой стадии дифференцировки Т-клеток, распределенных по стадиям с использованием в качестве показателя экспрессии CD4 и CD8.
С R2 по R8 показано следующее.
R2: Характер экспрессии AILIM и CD28 в CD4-негативных CD8-негативных Т-клетках.
R3: Характер экспрессии AILIM и CD28 в CD4-слабопозитивных CD8-слабопозитивных Т-клетках.
R4: Характер экспрессии AILIM и CD28 в CD4-позитивных CD8-позитивных клетках.
R5: Характер экспрессии AILIM и CD28 в CD4-позитивных CD8-слабопозитивных Т-клетках.
R6: Характер экспрессии AILIM и CD28 в CD4-позитивных CD8-негативных клетках.
R7: Характер экспрессии AILIM и CD28 в CD4-слабопозитивных CD8-позитивных Т-клетках.
R8: Характер экспрессии AILIM и CD28 в CD4-негативных CD8-позитивных Т-клетках.
Фигура 3 показывает характер экспрессии AILIM в CD4-позитивных Т-клетках, содержащихся в тканях селезенки нормальной мыши.
Фигура 4 показывает характер экспрессии AILIM в CD4-позитивных Т-клетках, инфильтрующих ткань печени хозяина, страдающего гепатитом.
Фигура 5 показывает характер экспрессии AILIM и CD28 в каждой из групп СD4-позитивных Т-клеток и СD4-негативных Т-клеток, содержащихся в Т-клетках периферической крови и Т-клетках, инфильтрирующих синовиальную жидкость у пациентов, страдающих ревматоидным артритом соответственно.
Фигура 6 показывает характер экспрессии AILIM в течение времени в Т-клетках, полученных из лимфоидной ткани нормальных мышей, активированных стимуляцией различными стимуляторами.
На фигуре 7 схематично показан характер экспрессии и различные свойства AILIM в различных линиях Т-клеток и полученных на основе Т-клеток гибридомах мыши.
На фигуре 8 показана активация (индукция продукции IFNγ) Т-клеток, полученных из селезенки мыши, посредством перекрестной сшивки CD3 и AILIM, выполненной с использованием планшетов, покрытых анти-СD3-антителом и анти-АILIМ-антителом.
На фигуре 9 показана активация (индукция продукции IFNγ) Т-клеток, полученных из селезенки крысы, посредством перекрестной сшивки CD3 и AILIM, выполненной с использованием планшетов, покрытых анти-СD3-антителом и анти-АILIМ-антителом.
На фигуре 10 показана активация (индукция продукции IFNγ) Т-клеток, полученных из периферической крови человека, посредством перекрестной сшивки CD3 и AILIM, выполненной с использованием планшетов, покрытых анти-СD3-антителом и анти-АILIМ-антителом.
На фигуре 11 показано ингибирующее действие анти-AILIM-антитела на повышенную продукцию IFNγ, один из ответов Т-клеток, в Т-клетках, полученных из периферической крови человека, активированных стимуляцией анти-СD3-антителом.
На фигуре 12 показано ингибирующее действие анти-AILIM-антитела на повышенную продукцию IL-4, один из ответов Т-клеток, в Т-клетках, полученных из периферической крови человека, активированных стимуляцией анти-СD3-антителом.
На фигуре 13 показано ингибирующее действие анти-AILIM-антитела на повышенную продукцию IL-4, один из ответов Т-клеток, в Т-клетках, полученных из тимуса мыши, активированных стимуляцией анти-СD3-антителом.
На фигуре 14 показано ингибирующее действие анти-AILIM-антитела на повышенную продукцию IL-4, один из ответов Т-клеток, в Т-клетках, полученных из селезенки мыши, активированных стимуляцией анти-СD3-антителом.
На фигуре 15 показано терапевтическое действие на опухание лапы, которое является параметром артроза у хозяина, страдающего артрозом, при введении анти-АILIМ-антитела несколько раз.
На фигуре 16 показано терапевтическое действие анти-AILIM-антитела на повышенную продукцию IFNγ, которая является параметром ухудшения состояния у хозяина, страдающего гепатитом.
На фигуре 17 показано ингибирующее действие анти-AILIM-антитела на повышенную продукцию GPT и GOT, которые являются параметром ухудшения состояния у хозяина, страдающего гепатитом.
На фигуре 18 показано ингибирующее действие анти-AILIM-антитела на повышенную продукцию IgG, которая является одной из реакций трансплантат против хозяина (реакций ТПХ) при болезни трансплантат против хозяина (ТПХБ).
На фигуре 19 показано ингибирующее действие анти-AILIM-антитела на повышенную продукцию IgE, которая является одной из реакций трансплантат против хозяина (реакций ТПХ) при болезни трансплантат против хозяина (ТПХБ).
На фигуре 20 показано ингибирующее действие анти-AILIM-антитела на повышенный титр анти-днДНК-антител, который является одной из реакций трансплантат против хозяина (реакций ТПХ) при болезни трансплантат против хозяина (ТПХБ).
На фигуре 21 показано ингибирующее действие анти-AILIM-антитела in vivo у хозяина, иммунизированного ЭБ, которые являются чужеродным антигеном, на продукцию антитела (при введении сразу после сенсибилизации антигеном) против чужеродного антигена.
На фигуре 22 показано ингибирующее действие анти-AILIM-антитела in vivo у хозяина, сенсибилизированного ЭБ, которые являются чужеродным антигеном, на продукцию антитела (при введении через 7 дней после сенсибилизации антигеном) против чужеродного антигена.
На фигуре 23 схематично показан характер экспрессии AILIM и CD28 в нормальных тканях (тимус, лимфатический узел и периферическая кровь) и пораженных частях.
На фигуре 24 показан характер экспрессии AILIM, CD28, CD4, CD8, CD19 и CTLA-4 в Т-клетках, полученных из периферической крови нормального здорового человека и в AILIM-позитивных клетках, отобранных из Т-клеток, соответственно.
Субфигура (а) показывает распределение различных Т-клеток, полученных из периферической крови.
Субфигура (b) показывает распределение AILIM-позитивных клеток, выделенных из Т-клеток, полученных из периферической крови.
Субфигура (с) показывает характер экспрессии CD4 и CD8 в Т-клетках, полученных из периферической крови.
Субфигура (d) показывает характер экспрессии CD4 и CD8 в AILIM-позитивных клетках, отобранных из Т-клеток, полученных из периферической крови.
Субфигура (е) показывает характер экспрессии AILIM и CD4 в Т-клетках, полученных из периферической крови.
Субфигура (f) показывает характер экспрессии AILIM и CD4 в AILIM-позитивных клетках, отобранных из Т-клеток, полученных из периферической крови.
Субфигура (g) показывает характер экспрессии AILIM и CD8 в Т-клетках, полученных из периферической крови.
Субфигура (h) показывает характер экспрессии AILIM и CD8 в AILIM-позитивных клетках, отобранных из Т-клеток, полученных из периферической крови.
Субфигура (i) показывает характер экспрессии AILIM и CTLA-4 в Т-клетках, полученных из периферической крови.
Субфигура (j) показывает характер экспрессии AILIM и CTLA-4 в AILIM-позитивных клетках, отобранных из Т-клеток, полученных из периферической крови.
Субфигура (к) показывает характер экспрессии AILIM и CD19 в Т-клетках, полученных из периферической крови.
Субфигура (l) показывает характер экспрессии AILIM и CD19 в AILIM-позитивных клетках, отобранных из Т-клеток, полученных из периферической крови.
На фигуре 25 показана интенсивность экспрессии AILIM в Т-клетках, полученных из периферической крови нормального здорового человека, СD4-позитивных Т-клетках, CD8-позитивных Т-клетках и в AILIM-позитивных клетках каждого типа, отобранных из Т-клеток каждого типа.
На субфигуре (а) показана интенсивность экспрессии AILIM в Т-клетках периферической крови и AILIM-позитивных клетках, отобранных из Т-клеток, соответственно.
На субфигуре (b) показана интенсивность экспрессии AILIM в CD4-позитивных Т-клетках периферической крови и CD4-позитивных AILIM-позитивных Т-клетках, отобранных из Т-клеток, соответственно.
На субфигуре (с) показана интенсивность экспрессии AILIM в СD8-позитивных Т-клетках периферической крови и CD8-позитивных AILIM-позитивных Т-клетках, отобранных из Т-клеток, соответственно.
На фигуре 26 показан характер экспрессии AILIM в Т-клетках, полученных из периферической крови, и Т-клетках, полученных из синовиальной жидкости, каждого пациента, страдающего хроническим ревматоидным артритом (РА) и остеоартритом (ОА), и в Т-клетках периферической крови каждого пациента, страдающего прогрессирующим системным склерозом (склеродермия; ПСС) и системной красной волчанкой (СКВ), соответственно.
На фигуре 27 показаны характеры экспрессии AILIM в Т-клетках (СD4-позитивные Т-клетки, CD8-позитивные Т-клетки), полученных из каждой ткани - тимуса, селезенки, лимфатического узла и периферической крови в модели индуцированного адъювантом артрита крыс.
На фигуре 28 показаны характеры экспрессии каждого AILIM и CTLA-4 в Т-клетках, полученных из периферической крови нормального здорового человека, активированных различными стимулами.
На субфигуре (а) показана интенсивность экспрессии AILIM в Т-клетках, активированных стимуляцией ФМА и ионофором.
На субфигуре (b) показана интенсивность экспрессии CTLA-4 в Т-клетках, активированных стимуляцией ФМА и ионофором.
На субфигуре (с) показана интенсивность экспрессии AILIM в CD4-позитивных Т-клетках, активированных стимуляцией ФМА и ионофором.
На субфигуре (d) показана интенсивность экспрессии CTLA-4 в СD4-позитивных Т-клетках, активированных стимуляцией ФМА и ионофором.
На субфигуре (е) показана интенсивность экспрессии AILIM в Т-клетках, активированных стимуляцией либо анти-СD3-антителом и анти-АILIМ-антителом, либо анти-СD3-антителом и анти-СD28-антителом.
На субфигуре (f) показана интенсивность экспрессии CTLA-4 в Т-клетках, активированных стимуляцией либо анти-СD3-антителом и анти-АILIМ-антителом, либо анти-СD3-антителом и анти-СD28-антителом.
На фигуре 29 показана индукция продукции различных цитокинов Т-клетками периферической крови человека в каждом случае при стимуляции различными антителами.
На фигуре 30 показана индукция клеточной пролиферации Т-клеток периферической крови человека в каждом случае при стимуляции различными антителами в различных концентрациях.
На фигуре 31 показана индукция в течение времени клеточной пролиферации Т-клеток периферической крови человека в каждом случае при стимуляции различными антителами.
На фигуре 32 показаны уровни клеточной пролиферации клеток селезенки мыши и Т-клеток, полученных из селезенки мыши, культивируемых на микропланшетах, покрытых анти-СD3-антителом и анти-АILIМ-антителом.
Субфигура (а) показывает уровни пролиферации клеток селезенки мыши.
Субфигура (b) показывает уровни пролиферации Т-клеток, полученных из селезенки мыши.
На фигуре 33 для каждого случая показаны уровни пролиферации клеток селезенки мыши, культивируемых с использованием микрошариков (постоянная концентрация), покрытых анти-СD3-антителом (постоянная концентрация) и анти-AILIM-антителом (различные концентрации).
На фигуре 34 для каждого случая показаны уровни пролиферации клеток селезенки мыши, культивируемых с использованием микрошариков (различные концентрации), покрытых анти-СD3-антителом (постоянная концентрация) и анти-АILIМ-антителом (постоянная концентрация).
На фигуре 35 для каждого случая показаны уровни пролиферации Т-клеток, полученных из селезенки мыши, культивируемых с использованием микрошариков (различные концентрации), покрытых анти-СD3-антителом (постоянная концентрация) и анти-АILIМ-антителом (постоянная концентрация).
На фигуре 36 для каждого случая показана индукция клеточной пролиферации Т-клеток, полученных из лимфатического узла крыс, при стимуляции различными антителами в различных концентрациях.
На фигуре 37 показано терапевтическое действие однократного введения (постоянная концентрация) анти-AILIM-антитела на опухание лапы, которое является параметром артроза у хозяина, страдающего артрозом.
На фигуре 38 показано терапевтическое действие однократного введения (различные концентрации) анти-АILIМ-антитела на опухание лапы, которое является параметром артроза у хозяина, страдающего артрозом.
На фигуре 39 показано ингибирующее действие анти-AILIM-антитела на повышенную продукцию IgG, которая является одной из реакций трансплантат против хозяина (реакции ТПХ) при болезни трансплантат против хозяина (ТПХБ).
На фигуре 40 показано ингибирующее действие анти-AILIM-антитела на повышенную продукцию IgE, которая является одной из реакций трансплантат против хозяина (реакции ТПХ) при болезни трансплантат против хозяина (ТПХБ).
На фигуре 41 показано ингибирующее действие анти-AILIM-антитела на повышенный титр анти-днДНК-антител, который является одной из реакций трансплантат против хозяина (реакции ТПХ) при болезни трансплантат против хозяина (ТПХБ).
На фигуре 42 показано ингибирующее действие анти-AILIM-антитела у хозяина in vivo, сенсибилизированного NP-KHL, который является чужеродным антигеном, на продукцию IgG1-антитела против чужеродного антигена.
На фигуре 43 показано ингибирующее действие анти-AILIM-антитела у хозяина in vivo, сенсибилизированного NP-KHL, который является чужеродным антигеном, на продукцию IgM-антитела против чужеродного антигена.
На фигуре 44 показано ингибирующее действие анти-AILIM-антитела у хозяина in vivo, сенсибилизированного NP-KHL, который является чужеродным антигеном, на продукцию IgG1-антитела против чужеродного антигена.
На фигуре 45 показано ингибирующее действие анти-AILIM-антитела у хозяина in vivo, сенсибилизированного NP-KHL, который является чужеродным антигеном, на продукцию IgG2b-антитела против чужеродного антигена.
На фигуре 46 показано ингибирующее действие анти-AILIM-антитела у хозяина in vivo, сенсибилизированного NP-KHL, который является чужеродным антигеном, на продукцию IgG2a-антитела против чужеродного антигена.
На фигуре 47 показано ингибирующее действие на пролиферацию Т-клеток различными тестируемыми образцами в случае культивирования Т-клеток нормального здорового человека "донора А" с РВМС нормального здорового человека "донора D" в тесте на пролиферацию Т-клеток посредством реакций смешанных культур лимфоцитов (РСКЛ).
На вертикальной оси указано количество включения [3H]-тимидина в качестве индекса, показывающего уровень пролиферации клеток, и на горизонтальной оси показана концентрация тестируемых образцов.
Каждое описание на фигурах показывает следующее.
"CD80+86": Смесь анти-СD80-антитела и анти-СВ86-антитела "mIgGI": IgG1-моноклональное антитело мыши против CD34 человека.
"CTLA-4-Ig": CTLA-4-IgFc химерная молекула человека.
"SA12": Моноклональное антитело мыши против AILIM человека.
На фигуре 48 показано ингибирующее действие на пролиферацию Т-клеток различных тестируемых образцов в случае культивирования Т-клеток нормального здорового человека "донора D" с РВМС нормального здорового человека "донора В" в тесте на пролиферацию Т-клеток посредством реакции смешанной культуры лимфоцитов (РСКЛ).
На вертикальной оси указано количество включения [3Н]-тимидина в качестве индекса, показывающего уровень пролиферации клеток, и на горизонтальной оси показана концентрация тестируемых образцов.
Каждое описание на фигурах показывает следующее.
"CD80+86": Смесь анти-СD80-антитела и анти-СD86-антитела "mIgGI": IgGl-моноклональное антитело мыши против CD34 человека.
"CTLA-4-Ig": CTLA-4-IgFc химерная молекула человека.
"SA12": Моноклональное антитело мыши против AILIM человека.
На фигуре 49 показано ингибирующее действие на пролиферацию Т-клеток различных тестируемых образцов в случае культивирования Т-клеток нормального здорового человека "донора С" с РВМС нормального здорового человека "донора А" в тесте на пролиферацию Т-клеток посредством реакции смешанной культуры лимфоцитов (РСКЛ).
На вертикальной оси указано количество включения [3H]-тимидина в качестве индекса, показывающего уровень пролиферации клеток, и на горизонтальной оси показана концентрация тестируемых образцов.
Каждое описание на фигурах показывает следующее.
"CD80+86": Смесь анти-СD80-антитела и анти-СD86-антитела "mIgG1": IgG1-моноклональное антитело мыши против CD34 человека.
"CTLA-4-Ig": CTLA-4-IgFc химерная молекула человека.
"SA12": Моноклональное антитело мыши против AILIM человека.
На фигуре 50 показано ингибирующее действие на пролиферацию Т-клеток различных тестируемых образцов в случае культивирования Т-клеток нормального здорового человека "донора Е" с РВМС нормального здорового человека "донора G" в тесте на пролиферацию Т-клеток посредством реакции смешанной культуры лимфоцитов (РСКЛ).
На вертикальной оси указано количество включения [3H]-тимидина в качестве индекса, показывающего уровень пролиферации клеток, и на горизонтальной оси показана концентрация тестируемых образцов.
Каждое описание на фигурах показывает следующее.
"Контроль mIgG": IgGl-моноклональное антитело мыши против CD34 человека.
"CD80+86 Ат": Смесь анти-СD80-антитела и анти-СD86-антитела.
"SA12": Моноклональное антитело мыши против AILIM человека. "CTLA-4-Ig": CTLA-4-IgFc химерная молекула человека.
На фигуре 51 показано ингибирующее действие на пролиферацию Т-клеток различных тестируемых образцов в случае культивирования Т-клеток нормального здорового человека "донора F" с РВМС нормального здорового человека "донора Е" в тесте на пролиферацию Т-клеток посредством реакции смешанной культуры лимфоцитов (РСКЛ).
На вертикальной оси указано количество включения [3H]-тимидина в качестве индекса, показывающего уровень пролиферации клеток, и на горизонтальной оси показана концентрация тестируемых образцов.
Каждое описание на фигурах показывает следующее.
"Контроль mIgG": IgGl-моноклональное антитело мыши против CD34 человека.
"CD80+86 Ат": Смесь анти-СD80-антитела и анти-СD86-антитела.
"SA12": Моноклональное антитело мыши против AILIM человека "CTLA-4-Ig": CTLA-4-IgFc химерная молекула человека.
На фигуре 52 показано ингибирующее действие на пролиферацию Т-клеток различных тестируемых образцов в случае культивирования Т-клеток нормального здорового человека "донора G" с РВМС нормального здорового человека "донора F" в тесте на пролиферацию Т-клеток посредством реакции смешанной культуры лимфоцитов (РСКЛ).
На вертикальной оси указано количество включения [3H]-тимидина в качестве индекса, показывающего уровень пролиферации клеток, и на горизонтальной оси показана концентрация тестируемых образцов.
Каждое описание на фигурах показывает следующее.
"Контроль mIgG": IgGl-моноклональное антитело мыши против CD34 человека.
"CD80+86 Ат": Смесь анти-СD80-антитела и анти-СD86-антитела.
"SA12": Моноклональное антитело мыши против AILIM человека "CTLA-4-Ig": CTLA-4-IgFc химерная молекула человека.
Наилучший способ выполнения изобретения
Ниже данное изобретение иллюстрировано более детально со ссылками на примеры, но при этом оно не должно считаться ограниченным.
Пример 1
Подготовка экспериментального материала
Если не оговорено особо, экспериментальные материалы (животные, антитела, клетки), используемые в тестах, описанных ниже, получали следующим образом.
<1-1> Животные.
Мышей C57BL/6 (самцы, от 5- до 8-недельного возраста) и мышей BALB/c (самцы, от 5- до 8-недельного возраста) приобретали из JAPAN SLC. Крыс Wistar (самцы, от 5- до 6-недельного возраста) приобретали из Charles River Japan Inc.
<1-2> Получение моноклональных антител против AILIM крыс.
Гибридомы, обозначенные "JTT-1" и "JTT-2", способные продуцировать моноклональное антитело мыши против AILIM крысы (мышиное моноклональное антитело против JTT-1-антигена крысы), которые были созданы и описаны ранее авторами данного изобретения, были помещены на хранение для международного пользования (с 11 октября 1996 г. обе гибридомы были размещены на хранение для международного доступа в The National Institute of Bioscience and Human-Technology, The Agency of Industrial Science and Technology, The Ministry of International Trade and Industry (1-1-3 Higashi, Tsukuba, Ibaraki, Japan (почтовый индекс 305-8566)), который по Будапештскому соглашению является международным депозитарным учреждением). Моноклональные антитела, очищенные из культуральных надосадков "JTT-1" (международный инвентарный номер FERM ВР-5707) и "JTT-2" (международный инвентарный номер FERM BP-5708) in vitro или in vivo, или асцитов, использовали в тестах, описанных ниже (JP-A 11-29599 (примеры 1 и 2) и W098/38216 (примеры 1 и 2)).
Ниже данные мышиные моноклональные антитела против AILIM крыс обозначаются "JTT-1-антитело" и "JTT-2-антитело" (IgG1) соответственно. В некоторых случаях "JTT-1-антитело" и "JTT-2-антитело" также обозначаются "JMab49" и "JMab50" соответственно.
Если не оговорено особо, антителом против AILIM крысы, используемым в следующих тестах, является "JTT-2-антитело" (также называемое JMab50; IgG1).
<1-3> Получение моноклональных антител против AILIM человека.
Каждую из гибридом, называемых "SA12" и "SG430", продуцирующих мышиное моноклональное антитело против AILIM человека (мышиное моноклональное антитело против JTT-1-антигена человека), которые были созданы и описаны ранее авторами данного изобретения, вводили мышам ICR nu/nu (самки, от 7- до 8-недельного возраста) путем внутрибрюшинной инъекции (от 106 до 107 клеток/0,5 мл/мышь для каждой гибридомы). Через 10-20 дней после инъекции собирали асцит от каждой мыши путем лапаротомии под анестезией традиционно используемым способом. Затем соответствующие мышиные моноклональные антитела против AILIM человека получали в большом масштабе (JP-A 11-29599 (пример 12) и WO98/38216 (пример 12)).
Ниже данные два типа мышиных моноклональных антител против AILIM человека обозначаются "SА12-антитело" (IgG1) и "SG430-антитело" (IgG1). Оба были использованы в тестах, описанных ниже.
<1-4> Получение моноклональных антител против AILIM мыши.
Антитела получали следующим образом.
В соответствии с традиционно применяемым способом на основе технологии генетической рекомбинации была получена трансформированная клетка, способная экспрессировать AILIM мыши, с использованием кДНК, кодирующей полноразмерную аминокислотную последовательность AILIM мыши (мышиный JTT-1-антиген) (JP-A 11-29599 (SEQ ID NO: 5)), и WO98/38216 (SEQ ID NO:5)), которая ранее была клонирована авторами данного изобретения.
Трансформированные клетки гомогенизировали и затем подвергали ультрацентрифугированию (100000 x g). Полученный в результате осадок, содержащий фракцию клеточных мембран, извлекали и затем суспендировали в PBS. Полученную фракцию клеточных мембран вместе с полным адъювантом Фрейнда вводили крысам Wistar инъекцией в подушечку лапы для первичной иммунизации (день 0). Антиген фракции клеточных мембран повторно давали крысам посредством инъекции в подушечку лапы на седьмой день, четырнадцатый день и двадцать восьмой день после первичного введения. Через два дня после последней иммунизации собирали клетки лимфатического узла крыс.
Клетки лимфатического узла смешивали с клетками миеломы мышей PAI (JCR No. B0113; Res. Disclosure, Vol.217, pp.155, 1982) в соотношении 5:1. Клетки сливали друг с другом, используя полиэтиленгликоль 4000 (Boehringer Mannheim) в качестве агента слияния, чтобы получить гибридомы, способные продуцировать моноклональные антитела. Селекцию гибридом проводили при культивировании слитых клеток в среде ASF104 (Ajinomoto), содержащей в HAT 10% околоплодной сыворотки теленка и аминоптерин.
Реактивность против AILIM мыши (мышиный JTT-1-антиген) каждого моноклонального антитела в надосадке культуры гибридомы тестировали следующим образом: каждому надосадку культуры давали возможность реагировать с трансформированными клетками, экспрессирующими указанный выше рекомбинантный AILIM мыши; затем клеткам еще давали возможность реагировать с ФИТЦ-меченным антителом против IgG крыс (Cappel); интенсивности флюоресценции окрашенных клеток измеряли в проточном цитометре EPICS-ELITE. Скрининг давал множественные гибридомы, способные продуцировать моноклональные антитела, реагирующие с AILIM мыши (мышиным JTT-1-антигеном).
Две отдельные гибридомы, отобранные из них, были названы "В10.5" и "В9В6". Каждую из гибридом (от 106 до 107 клеток/0,5 мл/мышь для каждой) вводили мышам ICR nu/nu (самки, от 7- до 8-недельного возраста) путем внутрибрюшинной инъекции. Через 10-20 дней после инъекции собирали асциты от каждой мыши путем лапаротомии под анестезией традиционно используемым способом. Затем крысиные моноклональные антитела против AILIM мыши получали в большом масштабе. Ниже данные два типа крысиных моноклональных антител против AILIM мыши, продуцируемых гибридомами "В10.5" и "В9В6" будут обозначаться "В10.5-антитело" (IgG2a) и "В9В6-антитело" (IgG2a). Оба антитела были использованы в тестах, описанных ниже.
<1-5> Получение лимфоцитов.
Мышей забивали декапитацией. Затем обычно применяемым способом извлекали тимус и периферические лимфоидные ткани (селезенку и лимфатический узел). Ткани нарезали маленькими кубиками на стальном сите. Клеточные суспензии готовили суспендированием кубиков ткани в среде RPMI1640, содержащей 10% околоплодной сыворотки теленка (FCS). Суспензии клеток (от 1•107 до 3•107 клеток/мл в каждом случае) помещали в чашки и затем культивировали в течение 2 часов в CO2-инкубаторе. После завершения культивирования неадгезивные клетки осторожно извлекали из чашки и затем промывали средой RPMI1640. Таким образом получали клетки мышей из различных тканей.
Клетки различных тканей крыс также получали из тимуса и периферических лимфоидных тканей (селезенки и лимфатического узла) тем же способом, который описан выше.
Т-клетки периферической крови человека (людей с нормальным здоровьем и больных) получали обычно применяемым способом. В частности, гепаринизированный образец крови, собранный от нормального здорового человека или больного, подвергали обработке для разделения с помощью lymphoprep (Nycomed), чтобы получить мононуклеарные клетки периферической крови. Затем Т-клетки извлекали, используя набор для выделения пан Т-клеток (Miltenyi).
<1-6> Получение стабильных линий Т-клеток.
Последующие тесты проводили с использованием различных линий Т-клеток мыши (D10, MS202, CD28KO, EL-4, 2L2 и ВС3С13), а также различных гибридом на основе Т-клеток мышей (KV24, D0.11.10, 8-4-31, 3Н10-11, 61-21-25, 1-2-66 и 6-13-64), которые берут начало от гибридомы, полученной на основе Т-клеток мыши BW5147, все они были созданы авторами данного изобретения.
Пример 2
Анализ экспрессии AILIM в клетках ряда тканей и в различных клеточных линиях
Обычным способом проводили эксперименты по окрашиванию клеток и проточной цитометрии, чтобы проанализировать различия в характере экспрессии AILIM в клетках из нормальных и пораженных заболеванием тканей животных (мыши, крысы или человека), различий в характере экспрессии AILIM между не стимулированными Т-клетками и стимулированными Т-клетками (активированными Т-клетками), а также различий среди различных Т-клеточных линий.
На основании результатов, полученных в описанном ниже тесте, сравнивали характер экспрессии AILIM в тканях и клетках с характером экспрессии CD28. Сравнение схематично показано на фигуре 23. Однако следует отметить, что схематичная иллюстрация является только примером; само собой разумеется, иллюстрацию не следует трактовать как используемую для ограничения объясняемых данных, полученных в показанных ниже тестах.
<2-1> Окрашивание клеток и проточная цитометрия.
Если не оговорено особо, анализы с помощью окрашивания клеток и проточного цитометра выполняли следующим образом.
Клетки, полученные из различных тканей описанными выше способами, а также Т-клетки или различные Т-клеточные линии, не стимулированные или стимулированные каждым из стимулирующих веществ (анти-СD3-антителом, КонА или ФМА и ионофором и т.д.), ресуспендировали в фосфатном буфере (PBS, не содержащий Са2+, Mg2+; PBS-), содержащем 0,5% бычьего сывороточного альбумина (БСА) и 5 мМ ЭДТА. Затем первое антитело, выбранное из антител, указанных ниже, (А) или (В), добавляли к суспензии клеток, и смеси инкубировали при 4oС в течение 30 минут:
(A) Меченые антитела указанных выше различных AILIM-антител (антитела против AILIM мыши, антитела против AILIM крысы, антитела против AILIM человека), которые метили ФИТЦ или фикоэритрином (РЕ).
(B) Немеченые антитела указанных выше различных AILIM-антител (антитела против AILIM мыши, антитела против AILIM крысы, антитела против AILIM человека).
Затем клетки 3 раза промывали указанным выше фосфатным буфером и затем ресуспендировали в таком же буфере.
В том случае, когда используемым первым антителом было немеченое анти-АILIМ-антитело (то есть одно из указанных выше антител (В)), далее к суспензиям клеток в качестве второго антитела добавляли антитело против Ig мыши или антитело против Ig крысы, меченное ФИТЦ, РЕ или биотином. Суспензии инкубировали таким же образом, как описано выше.
В том случае, когда вторым антителом было антитело, меченное биотином, к суспензии клеток добавляли РЕ-меченый стрептавидин (Pharmingen) и их инкубировали таким же образом, как описано выше. Затем клетки повторно суспендировали в указанном выше фосфатном буфере.
Размер клеток, окрашенных указанным выше способом, и интенсивности их флюоресценции измеряли в сортере клеток FACSort (Becton Dekinson). Распределение экспрессии AILIM анализировали с помощью компьютерной программы Lysis II.
<2-2> Анализ экспрессии AILIM в Т-клетках, полученных из тимуса мыши.
Экспрессия AILIM в Т-клетках, выделенных из тимуса мыши, являющейся нормальной лимфоидной тканью, анализировали таким же способом, как способ, описанный выше в <2-1>. Одновременно проводили сходные измерения для того, чтобы проанализировать корреляцию между характером экспрессии AILIM и экспрессии других молекул (молекула CD3, функционирующая в проведении первичного сигнала к Т-клетке, молекула CD28, функционирующая в проведении вторичного стимулирующего сигнала, CD4 и CD8, которые являются поверхностными маркерами T-клеток).
Результаты показаны на фигурах 1 и 2. Новый факт, указанный ниже, был обнаружен на основе данного результата.
Прежде всего одним из выявленных фактов относительно корреляции между экспрессией СD3-молекулы и AILIM-молекулы является то, что уровни экспрессии AILIM являются высокими в тех клетках, в которых имеют место высокие уровни экспрессии CD3, и таким образом, уровни экспрессии двух молекул коррелируют друг с другом (фигура 1(а)). В противоположность экспрессии упомянутой выше молекулы, уровень экспрессии костимулирующей молекулы CD28 был ниже, когда уровень экспрессии CD3 был выше (фигура 1(b)). Приведенные результаты показывают, что характеры экспрессии AILIM и CD28 проявляют реципрокную корреляцию с экспрессией CD3 по меньшей мере в Т-клетках нормального тимуса.
Известно, что дифференцировка и созревание Т-клетки тимуса достигается в течение следующих главных этапов.
(1) СD4-негативная СD8-негативная клетка (R2 на фигуре 2) дифференцируется в CD4-слабо позитивную CD8-слабо позитивную клетку (R3 на фигуре 2), в которой распознается экспрессия каждой молекулы, но слабо.
(2) СD4-слабо позитивная CD8-слабо позитивная клетка (R3 на фигуре 2) дифференцируется в CD4-позитивную CD8-позитивную клетку (R4 на фигуре 2), в которой обе молекулы экспрессируются на высоком уровне.
(3) Экспрессия одной из двух молекул CD4 и CD8 снижается (R5 или R7 на фигуре 2) посредством позитивной селекции; каждый тип клеток, в конце концов, дифференцируется в CD4-позитивную CD8-негативную (R6 на фигуре 2) или CD4-негативную CD8-позитивную (R8 на фигуре 2) клетку, и созревание, таким образом, завершается.
Ни AILIM, ни CD28 не экспрессируются на распознаваемом уровне в CD4-негативных CD8-негативных клетках, но слабые уровни экспрессии наблюдались в CD4-слабо позитивных CD8-слабо позитивных клетках. Экспрессия CD28 была максимальной в CD4-позитивных CD8-позитивных клетках и затем снижалась по мере того, как клетки далее дифференцировались до созревания.
С другой стороны, только низкий уровень экспрессии AILIM был обнаружен даже в CD4-позитивных CD8-позитивных клетках. Однако уровень экспрессии AILIM повышался в ходе последующих процессов клеточной дифференцировки; а именно, по мере того как уровень экспрессии CD4 или CD8 снижался, уровень экспрессии AILIM повышался и затем достигал максимума на конечной стадии дифференцировки лимфоцита, позитивная селекция которого завершена; зрелый лимфоцит называется SP-клеткой (СВ4-позитивная CD8-негативная клетка или СВ4-негативная CD8-позитивная клетка).
Результат эксперимента показывает, что характер экспрессии AILIM отличается от характера экспрессии CD28 в отношении корреляции с экспрессией CD4 и CD8, а также CD3.
<2-3> Анализ экспрессии AILIM в Т-клетках, полученных из нормальных лимфоидных тканей мыши.
Экспрессию AILIM в Т-клетках селезенки и лимфатического узла, которые являются нормальными лимфоидными тканями мыши, анализировали указанным выше способом. Результаты показаны на фигуре 3.
Популяция AILIM-позитивных Т-клеток среди Т-клеток, полученных из селезенки, меньше, чем популяция в тимусе, и доля составляла около 3%. Большинство AILIM-позитивных клеток были CD4-позитивными CD8-негативными.
Характер экспрессии AILIM в Т-клетках, полученных из лимфатического узла, и процент популяции были сравнимы с таковыми в указанных выше Т-клетках, полученных из селезенки.
<2-4> Анализ экспрессии AILIM в Т-клетках, полученных из пораженных болезнью тканей в модели гепатита мыши.
Модельных мышей с гепатитом получали следующим образом.
Суспензию Propionibacterium acnes (P. acnes; 5 мг/мл) в фосфатном буфере (PBS; 0,2 мл) инъецировали внутривенно в хвост мыши C57BL/6. Через одну неделю мыши внутривенно инъецировали раствор ЛПС (липополисахарид; 1,5 мкг/мл) в фосфатном буфере (PBS; 0,2 мл), чтобы индуцировать гепатит. Мышь использовали в качестве модельного животного с гепатитом.
Через 6,5 часов после введения ЛПС вырезали печень мыши; Т-клетки получали из клеток описанным выше способом, чтобы анализировать экспрессию AILIM. Результат показан на фигуре 4.
Уровень экспрессии AILIM был сильно повышен в Т-клетках (мононуклеарные клетки), полученных из ткани печени мыши с моделью гепатита; большинство Т-клеток экспрессировали AILIM на заметно высоких уровнях. Уровень экспрессии AILIM в Т-клетках, полученных из печени в модели гепатита, был значительно более высоким, чем уровень в Т-клетках, полученных из селезенки (CD4 позитивные клетки) и Т-клетках, полученных из лимфатического узла нормальной мыши.
<2-5> Анализ экспрессии AILIM в Т-клетках, полученных из периферической крови нормальных здоровых людей.
Выполняли анализы с использованием проточного цитометра, чтобы оценить уровни экспрессии AILIM в Т-клетках, полученных из периферической крови нормальных здоровых людей и мононуклеарных клетках человека, выделенных из образцов периферической крови, собранных от нормальных здоровых людей, а также экспрессию различных маркеров клеточной поверхности на клетках. Т-клетки периферической крови нормальных здоровых людей получали приведенным выше способом.
С другой стороны, AILIM-экспрессирующие Т-клетки (AILIM-позитивные клетки) получали следующим образом: фракцию мононуклеарных клеток, отделенную от периферической крови нормального здорового человека, суспендировали в PBS, который содержал 0,5% БСА и 5 мМ ЭДТА, и к ней добавляли анти-AILIM-антитело (SG430; 50 мкг). Смесь инкубировали при 4oС в течение 30 минут. Затем после того, как клетки 3 раза промывали тем же самым буфером, к ним добавляли микрошарики с иммобилизованным антителами козы против IgG мыши (от 100 до 500 мкл; Miltenyi). Смесь инкубировали таким же способом и затем промывали тем же самым буфером. На следующем этапе клетки подвергали обработке с использованием магнитной сепарирующей колонки (дважды) обычным способом, чтобы выделить AILIM-позитивные клетки. Выделенные AILIM-позитивные клетки красили каждым видом меченых антител и анти-АILIМ-антителами; окрашенные клетки анализировали в проточном цитометре. Результат показан на фигуре 24.
Т-клетки периферической крови в основном распределяются по группам СD4-позитивных CD8-негативных клеток и CD4-негативных CD8-позитивных клеток. В тесте с двойным окрашиванием ФИТЦ-меченным анти-АILIМ-антителом (SA12) и анти-СD4-антителом экспрессию AILIM идентифицировали главным образом в CD4-позитивных клетках. Двойное окрашивание анти-AILIM-антителом и анти-СD28-антителом показало, что почти все AILIM-позитивные клетки, полученные из периферической крови, экспрессировали CD28. Доля популяции AILIM-позитивных клеток в Т-клетках периферической крови грубо была оценена от 0,5 до 5%.
С другой стороны, были получены следующие данные на основе результатов анализа поверхностных маркеров AILIM-позитивных клеток, непосредственно выделенных из фракции мононуклеарных клеток периферической крови человека:
(1) большинство AILIM-позитивных клеток были CD4-позитивными CD8-негативными клетками;
(2) среди AILIM-позитивных клеток распознавали наличие CD4-негативных CD8-позитивных клеток, а также CD4-негативных CD8-негативных клеток, но их популяции были маленькими;
(3) двойное окрашивание анти-АILIМ-антителом и анти-СD28-антителом показало, что большинство AILIM-позитивных клеток экспрессировали CD28, и поэтому большинство AILIM-позитивных клеток отнесены к классу Т-клеток;
(4) некоторые AILIM-позитивные клетки были окрашены антителом против CD19, который является поверхностным маркером В-клеток. Это свидетельствует о том, что В-клетки также слабо экспрессируют AILIM;
(5) экспрессия CTLA-4, который является костимулирующей молекулой, выявлена во многих AILIM-позитивных клетках.
Кроме того, был проведен анализ, чтобы оценить уровень экспрессии AILIM в Т-клетках периферической крови и AILIM-позитивных клетках. Результат показан на фигуре 25.
При сравнении экспрессии AILIM в AILIM-позитивных клетках с экспрессией в Т-клетках периферической крови, пики сдвигались в различные положения друг от друга, свидетельствуя о том, что уровень экспрессии AILIM выше в AILIM-позитивных клетках.
Затем был выполнен сходный сравнительный анализ между CD4-позитивными клетками и CD8-позитивными клетками. В этих двух фракциях наблюдали сходные уровни экспрессии AILIM. Среди AILIM-позитивных клеток популяция CD8-позитивных клеток была небольшой, но уровень экспрессии AILIM в CD8-позитивных клетках был сходным с уровнем экспрессии в остальных клетках.
<2-6> Анализ экспрессии AILIM в Т-клетках пациентов, пораженных различными поражениями кожи ревматического или подагрического происхождения или аутоиммунными заболеваниями.
Экспрессию AILIM и долю AILIM-экспрессирующих клеток анализировали в Т-клетках пациентов с артритами (ревматоидный артрит (РА) и остеоартрит (ОА)) или аутоиммунными заболеваниями (прогрессирующий системный склероз (ПСС) и системная красная волчанка (СКВ)), согласно указанному выше способу.
Т-клетки отделяли от каждой из тканей - синовиальной жидкости и периферической крови больных артритом; также выделяли Т-клетки из периферической крови пациентов с аутоиммунным заболеванием. Кроме того, Т-клетки периферической крови нормальных здоровых людей использовали в качестве контроля. Результат показан на фигурах 5 и 26.
Экспрессия AILIM в Т-клетках, полученных из периферической крови пациентов с РА, была сравнима с экспрессией в клетках нормальных здоровых людей. Между пациентами и нормальными людьми уровни экспрессии в CD4-позитивных Т-клетках, а также в CD4-негативных Т-клетках (а именно CD4-негативных CD8-позитивных Т-клетках) существенно не отличались.
Однако популяция AILIM-экспрессирующих клеток была существенно увеличена среди CD4-позитивных Т-клеток, а также среди CD4-негативных Т-клеток в Т-клетках, полученных из синовиальных жидкостей пациентов с РА. В частности, усредненная доля AILIM-экспрессирующих клеток была увеличена примерно до 20% от общего количества CD4-позитивных Т-клеток. Кроме того, было обнаружено, что уровень экспрессии AILIM был существенно повышен в CD4-позитивных Т-клетках и CD4-негативных Т-клетках из синовиальной жидкости пациентов с РА, по сравнению с уровнем в CD4-позитивных Т-клетках и CD4-негативных Т-клетках, полученных из периферической крови нормальных здоровых людей. Уровень экспрессии CD28 не менялся в CD4-позитивных Т-клетках пациентов с РА.
С другой стороны, в единственном случае с пациентом с ОА, популяция AILIM-позитивных клеток была заметно увеличена среди CD4-позитивных клеток, полученных из синовиальной жидкости.
Популяция AILIM-позитивных клеток среди CD4-негативных Т-клеток периферической крови пациентов с аутоиммунными заболеваниями была сравнима с таковой среди клеток от людей с нормальным здоровьем. Однако популяция AILIM-позитивных клеток была существенно увеличена среди CD4-позитивных Т-клеток от пациентов с ПСС, по сравнению с популяцией среди клеток людей с нормальным здоровьем.
<2-7> Анализ экспрессии AILIM в модели индуцированного адъювантом артрита у крыс.
В качестве адъюванта использовали мертвую туберкулезную бациллу (М. Tuberculosis H37Ra; Difco) в концентрации 10 мг/мл в жидком парафине (химически чистый, Wako). Адъювант инъецировали внутрикожно крысам Wistar (самцы 5-недельного возраста, Charles River) в концентрации 1 мг/0,1 мл/особь в область начала хвоста, чтобы индуцировать артрит. Объем обеих задних конечностей измеряли с использованием плетизмометра. Определенный объем использовали в качестве показателя возникновения артрита.
В течение времени после введения адъюванта (0 день) собирали тимус, селезенку, лимфатический узел и периферическую кровь. Суспензии Т-клеток готовили в соответствии с описанным выше способом. Т-клетки красили каждым из антител: анти-СD4-антителом, анти-CD8-антителом и анти-АILIМ-антителом, указанным выше способом. Затем анализировали экспрессию CD4, CD8 и AILIM в проточном цитометре.
Используемыми для контроля клетками были клетки, полученные из тимуса, селезенки, лимфатического узла и периферической крови нормальных крыс. Результат показан на фигуре 27.
Не было существенных выявляемых различий в экспрессии AILIM в CD4-позитивных Т-клетках и CD8-позитивных Т-клетках тимуса, селезенки и периферической крови по сравнению с экспрессией в контрольных клетках.
С другой стороны, популяция AILIM-позитивных клеток была значительно увеличена среди CD4-позитивных Т-клеток, полученных из лимфатического узла, а также среди CD8-позитивных Т-клеток, по сравнению с популяцией среди контрольных клеток. В частности, экспрессия AILIM достигала пикового уровня в СD4-позитивных Т-клетках на пятый день после введения адъюванта.
<2-8> Анализ варьирующего уровня экспрессии AILIM, ассоциированной с активацией Т-клеток мыши.
Т-клетки мыши, полученные из лимфоидных тканей, активировали в различных условиях. Анализировали варьирующий уровень экспрессии AILIM, ассоциированной с активацией Т-клеток.
Т-клетки активировали добавлением анти-СD3-антитела (конечная концентрация от 1 до 10 мкг/мл), конканавалина А (КонА; конечная концентрация от 1 до 5 мкг/мл) или ФМА (форболмиристатацетат; конечная концентрация 20 нг/мл) и Са-ионофора (конечная концентрация 200 нг/мл) к суспензии Т-клеток в среде RPMI1640, содержащей 10% FCS, для стимуляции. Экспрессию AILIM анализировали в течение времени (через 0, 6, 12, 24 и 48 часов) после добавления активирующего агента. Результат показан на фигуре 6.
Экспрессия AILIM начинала повышаться примерно от 3 до 6 часов после стимуляции при любых условиях активации и была максимальной через 12 часов после стимуляции. Уровень экспрессии AILIM оставался высоким примерно 24 часа после стимуляции, высокий уровень еще сохранялся через 48 часов после стимуляции.
<2-9> Анализ индукции экспрессии AILIM, ассоциированной с активацией Т-клеток человека.
Т-клетки, полученные из периферической крови нормальных здоровых людей таким же образом, как описано выше, активировали способом (А) или (В), как описано ниже. Проводили анализ ассоциированной с активацией Т-клеток экспрессии AILIM и CTLA-4, который является костимулирующей молекулой.
(A) Активация Т-клеток ФМА и Са-ионофором.
ФМА (конечная концентрация 20 нг/мл) и Са-ионофор (конечная концентрация 200 нг/мл) добавляли в качестве активирующих агентов к суспензии Т-клеток человека (1•105 клеток) в среде RPMI1640, содержащей 10% FCS, для стимуляции. Через 8 часов после добавления активирующих агентов анализировали экспрессию AILIM и CTLA-4 в проточном цитометре.
(B) Активация Т-клеток анти-СD3-антителом/анти-АILIМ-антителом или анти-СD3-антителом/анти-СD28-антителом.
Аликвоты растворов (1) анти-СD3-антитела (клон ОКТ3; 200 нг/лунку) и анти-АILIМ-антитела (клон SA12; 1 мкг/лунку) или растворов (2) анти-СD3-антитела (клон ОКТ3; 200 нг/лунку) и анти-СD28-антитела (клон CD28.2; 1 мкг/лунку), разбавленные в D-PBS добавляли в каждую лунку 96-луночного планшета для микротитрования и планшет инкубировали при комнатной температуре в течение 3 часов. Таким образом, планшет покрывали каждым антителом.
Суспензию Т-клеток, полученных из периферической крови человека (1•105 клеток/мл, 0,1 мл/лунку) в среде RPMI1640, содержащей 10% FCS, добавляли в каждый планшет. Клетки собирали после культивирования в течение от 2 до 3 дней. Экспрессию AILIM и CTLA-4 анализировали с использованием проточного цитометра указанным выше способом. Результат показан на фигуре 28.
Значительно высокий уровень экспрессии AILIM был индуцирован через 8 часов после стимуляции для активации Т-клеток ФМА и ионофором. Уровень экспрессии был намного выше, чем уровень экспрессии CTLA-4, которая также индуцировалась при стимуляции. Кроме того, экспрессия AILIM была индуцирована почти во всех Т-клетках. К тому же тест с двойным окрашиванием на CD4 и AILIM или на CD28 и AILIM, показал, что активация индуцировала значительный уровень экспрессии AILIM в СD4-позитивных Т-клетках, а также в СD8-позитивных Т-клетках.
С другой стороны был получен нижеследующий результат в тесте по активации с использованием микропланшета, который был покрыт анти-СD3-антителом/анти-АILIМ-антителом или анти-СD3-антителом/анти-СD28-антителом.
(1) Значительный высокий уровень экспрессии AILIM был индуцирован в Т-клетках, активированных анти-СD3-антителом/анти-АILIМ-антителом, а также в Т-клетках, активированных анти-СD3-антителом/анти-СD28-антителом. Уровень индуцированной экспрессии был выше в Т-клетках, активированных анти-СD3-антителом/анти-СD28-антителом, чем уровень в Т-клетках, активированных анти-СD3-антителом/анти-АILIМ-антителом.
(2) Экспрессия CTLA-4 была индуцирована в Т-клетках, активированных анти-СD3-антителом/анти-АILIМ-антителом, а также в Т-клетках, активированных анти-СD3-антителом/анти-CD28-антителом. Однако не было существенных различий в уровне индуцированной экспрессии между Т-клетками, активированными
анти-СD3-антителом/анти-АILIМ-антителом, и клетками, активированными анти-СD3-антителом/анти-СD28-антителом.
<2-10> Анализ экспрессии AILIM в различных линиях Т-клеток.
Известно, что линии Т-клеток создаются главным образом благодаря спонтанной иммортализации либо как Т-клеточные линии, иммортализованные химическим агентом, либо как I-клеточные гибридомы посредством слияния Т-клетки с клеткой миеломы. Т-клеточные линии группируют в два класса на основании свойства продуцировать цитокин, а именно Т-клеточные линии Thl-типа и Т-клеточные линии Тh2-типа.
Экспрессию AILIM и CD28 в различных известных линиях Т-клеток мышей, которые описаны выше в <1-6>, анализировали в проточном цитометре таким же способом, который описан выше. Результат показан на фигуре 7.
Было выявлено, что AILIM экспрессировался конститутивно в линиях Т-клеток, проявляющих свойство линии Т-клеток Th2-типа относительно продукции цитокина (D10, MS202, CD28KO, EL-4 и т.д.). Уровень экспрессии AILIM был сравним или был выше уровня экспрессии СВ28 в этих линиях клеток.
С другой стороны, экспрессия AILIM не выявлялась, хотя уровень экспрессии CD28 был высоким, в линиях Т-клеток Thl-типа, за исключением 6-13-64.
Пример 3
Анализ активности анти-АILIМ-антитела, модулирующей Т-клеточный ответ
Было проанализировано, обладало ли анти-АILIM-антитело данного изобретения или не обладало активностями в модулировании (усилении и/или подавлении) ответа Т-клеток (продукция цитокина, такого как IFN-γ и IL-4, пролиферация клеток и т.д.), а именно способно ли антитело или не способно регулировать трансдукцию опосредованного AILIM костимулирующего сигнала в клетку. Анализ выполняли с использованием в качестве показателей количества цитокинов (IFN-γ и IL-4), продуцируемых клетками, и степени пролиферации клеток.
<3-1> Способ тестирования.
В зависимости от целей каждого теста выбирали один или два типа антител (одно анти-СD3-антитело, одно анти-СD28-антитело, анти-СD3-антитело и анти-АILIМ-антитело или анти-СD3-антитело и анти-СD28-антитело), приготовленных, как указано выше, и добавляли в лунки 96-луночного микропланшета. Планшет инкубировали при 37oС в течение 1 часа или более, чтобы покрыть планшет одним или двумя антителами. Затем планшет достаточно промывали PBS. Затем в планшет добавляли клетки тимуса (5•105 клеток/лунку), клетки селезенки (2•105 клеток/лунку) или очищенные Т-клетки (от 1•105 до 3•105 клеток/лунку), которые были получены указанным выше способом.
В тесте, в котором планшет не был предварительно покрыт анти-АILIМ-антителом или анти-СD28-антителом, а какое-либо из антител было просто добавлено в планшет позже, антитело добавляли в планшет после посева клеток. Кроме того, в качестве контроля использовали CTLA4-Ig (слитый белок между растворимым районом CTLA4 и IgFc) вместо анти-АILIМ-антитела в тесте. Тест выполняли таким же способом.
Планшет инкубировали от 2 до 4 дней в СО2-инкубаторе. Концентрации цитокинов (IFN-γ IL-4) в культуральном надосадке определяли традиционно используемым способом ELISA. Кроме того, оценивали степень пролиферации клеток при культивировании обычным способом, используя включение меченного тритием тимидина (3H-TdR).
<3-2> Анализ индукции продукции Т-клетками цитокина посредством трансдукции костимулирующего сигнала в клетки, опосредуемой анти-СD3-антителом и анти-АILIМ-антителом.
Известно, что Т-клетки продуцируют специфичные цитокины в ответ на опосредуемый рецепторами Т-клеток первичный сигнал и вторичный сигнал, опосредуемый костимулирующими молекулами, такими как CD28 и CTLA-4.
Продукцию различных цитокинов, индуцированную стимуляцией рядом антител, анализировали с использованием Т-клеток периферической крови, клеток тимуса или клеток селезенки, выделенных из мыши, крысы и человека, согласно указанному выше способу тестирования, как описано в <3-1>.
<3-2-1> Индукция IFNγ в Т-клетках, полученных из селезенки мыши.
Т-клетки, полученные из селезенки мыши, добавляли в (1) микропланшет, покрытый анти-СD3-антителом (клон 145-2С11; Pharmingen; от 0 до 3 мкг/мл) и анти-СD28-антителом (клон CD28.2; 1 мкг/лунку); (2) микропланшет, покрытый анти-СD3-антителом и антителом против AILIM мыши (клон В10.5; 1 мкг/лунку), и (3) микропланшет, покрытый одним анти-СD3-антителом. Планшеты инкубировали для культивации клеток и затем с помощью ELISA определяли количества IFNγ в культуральных надосадках. Результат показан на фигуре 8.
Продукция IFNγ не индуцировалась при стимуляции одним анти-СD3-антителом. Однако продукция IFNγ в значительной степени индуцировалась при стимуляции анти-СD3-антителом/анти-АILIМ-антителом или анти-СD3-антителом/анти-СD28-антителом. Индукция усиливалась в зависимости от концентрации анти-СD3-антитела.
<3-2-2> Индукция продукции IFNγ в Т-клетках, полученных из селезенки крыс.
Т-клетки, полученные из селезенки крыс, добавляли в (1) микропланшет, покрытый анти-СD3-антителом (клон G4.18; 50 нг/лунку) и анти-СD28-антителом (клон JJ316; 1 мкг/лунку); (2) микропланшет, покрытый анти-СD3-антителом и антителом против AILIM крысы (клон JTT1; 1 мкг/лунку); (3) микропланшет, покрытый одним анти-СD3-антителом; (4) микропланшет, покрытый одним анти-АILIМ-антителом, и (5) микропланшет, покрытый одним анти-СD28-антителом. Планшеты инкубировали для культивации клеток и затем с помощью ELISA определяли количества IFNγ в культуральных надосадках. Результат показан на фигуре 9.
Продукция IFNγ существенно не индуцировалась при стимуляции одним анти-СD3-антителом, одним анти-АILIМ-антителом или одним анти-СD28-антителом. Однако продукция IFNγ в значительной степени индуцировалась при стимуляции анти-СD3-антителом/анти-АILIМ-антителом или анти-СD3-антителом/анти-CD28-антителом. Уровень продукции в результате индукции повышался во времени.
<3-2-3> Индукция продукции IFNγ в Т-клетках человека, полученных из периферической крови.
Т-клетки человека, полученные из периферической крови, добавляли в (1) микропланшет, покрытый анти-СD3-антителом (клон ОКТЗ; постоянная концентрация) и анти-АILIМ-антителом (клон SA12; различные концентрации), и (2) микропланшет, покрытый одним анти-СD3-антителом. Планшеты инкубировали для культивации клеток и затем с помощью ELISA определяли количества IFNγ в культуральных надосадках. В тесте (2) раствор анти-АILIМ-антитела добавляли после того, как были добавлены клетки. Результат показан на фигуре 10.
Даже когда концентрация анти-АILIМ-антитела была повышена до 20 мкг/мл, индукция продукции IFNγ в клетках не выявлялась в тесте, в котором Т-клетки добавляли в микропланшет, покрытый анти-СD3-антителом в постоянной концентрации, и раствор анти-АILIМ-антитела добавляли в планшет после того, как были добавлены клетки.
С другой стороны, значительно высокий уровень индукции продукции IFNγ был обнаружен в Т-клетках человека, культивируемых в микропланшете, покрытом как анти-СD3-антителом, так и анти-АILIМ-антителом, когда концентрация анти-AILIM-антитела составляла 5 мкг/мл или выше.
Было обнаружено, что продукция цитокина и пролиферация клеток была повышена в Т-клетках в том случае, когда Т-клетки, полученные из периферической крови, стимулированные КонА или ФМА, культивировали в планшете, покрытом обоими антителами - анти-АILIМ-антителом и анти-СD3-антителом, тем же способом, который показан выше. Результат по существу был таким же, как результат, полученный в том случае, когда Т-клетки, полученные из периферической крови, стимулированные КонА или ФМА, культивировали в планшете, покрытом как анти-СD28-антителом, так и анти-СD3-антителом.
<3-2-4> Индукция продукции TNFα, IFNγ, IL-2, IL-4 и IL-10 в Т-клетках человека, полученных из периферической крови.
Т-клетки, полученные из периферической крови одного из двух неродственных нормальных здоровых доноров, добавляли в (1) микропланшет, покрытый одним анти-СD3-антителом (клон ОКТ3; 200 нг/лунку); (2) микропланшет, покрытый одним анти-СD28-антителом (клон CD28.2; 1 мкг/лунку); (3) микропланшет, покрытый антителом против AILIM человека (клон SA12; 1 мкг/мл); (4) микропланшет, покрытый анти-СD3-антителом и анти-СD28-антителом; (5) микропланшет, покрытый анти-СD3-антителом и анти-АILIМ-антителом, и (6) микропланшет, покрытый анти-СD3-антителом, анти-АILIМ-антителом и анти-СD28-антителом. Планшеты инкубировали для культивации клеток и затем с помощью ELISA в течение времени (18, 40 и 64 часа) измеряли количества TNFα (фактора α некроза опухолей), IFNγ (интерферона-γ), IL-2 (интерлейкина-2), IL-4 (интерлейкина-4) и IL-10 (интерлейкина-10) в культуральных надосадках.
Следует отметить, что TNFα, IFNγ и IL-2 являются цитокинами, продуцируемыми Т-клетками Th1-типа, a IL-4 и IL-10 являются цитокинами, продуцируемыми Т-клетками Тh2-типа.
Результат показан на фигуре 29. Был получен следующий результат.
(1) Не было различий в уровнях индукции продукции TNFα, IFNγ и IL-2 между донорами.
(2) Уровни продукции TNFα и IFNγ были индуцированы даже в том случае, когда стимуляцию выполняли одним анти-СD3-антителом.
(3) Уровни индукции продукции TNFα и IFNγ дополнительно повышались при стимуляции анти-СD3-антителом и анти-СD28-антителом или анти-СD3-антителом и анти-AILIM, по сравнению с уровнями при стимуляции одним анти-СD3-антителом.
(4) Что касается IL-2, продукция была индуцирована при стимуляции анти-СD3-антителом и анти-СD28-антителом, анти-СD3-антителом и анти-АILIM-антителом или анти-СD3-антителом, анти-СD28-антителом и анти-АILIМ-антителом. Уровень индуцированной продукции IL-2 был наибольшим при стимуляции анти-СD3-антителом, анти-СD28-антителом и анти-АILIМ-антителом.
(5) В отношении IL-4 и IL-10, которые являются Th2-цитокинами, имеются различия в индукции продукции между донорами. Это свидетельствует о возможности того, что различия отражают различие в популяции Т-клеток между индивидуальными организмами человека.
(6) Что касается IL-4, продукция была индуцирована при стимуляции анти-СD3-антителом и анти-СD28-антителом, анти-СD3-антителом и анти-АILIМ-антителом или анти-СD3-антителом, анти-СD28-антителом и анти-АILIМ-антителом. Уровень индуцированной продукции IL-4 был наибольшим при стимуляции анти-СD3-антителом, анти-СD28-антителом и анти-АILIМ-антителом.
(7) Что касается IL-10, продукция была индуцирована при стимуляции анти-СD3-антителом и анти-СD28-антителом, анти-СD3-антителом и анти-AILIM-антителом или анти-СD3-антителом, анти-СD28-антителом и анти-АILIМ-антителом. Стимуляция анти-СD28-антителом и анти-АILIМ-антителом приводила к продукции IL-10 на значительно высоком уровне. Кроме того, уровень индукции продукции IL-10 был наибольшим при стимуляции тремя антителами: анти-СD3-антителом, анти-СD28-антителом и анти-AILIM-антителом.
Указанный выше тест свидетельствует о том, что анти-СD3-антитело, иммобилизованное на планшете, функционировало как МНС на антигенпредставляющей клетке, также анти-AILIM-антитело, иммобилизованное на планшете, функционировало как лиганд AILIM, приводя в результате к тому, что первичный сигнал и вторичный стимулирующий сигнал (костимулирующий сигнал), которые ответственны за активацию Т-клеток, были трансдуцированы в добавленные Т-клетки.
<3-3> Ингибирование анти-АILIМ-антителом индукции продукции цитокина как ответа Т-клеток, индуцированного опосредуемым CD3-сигналом.
Было проведено тестирование с целью выяснения того, способны или не способны каждое из антител - анти-AILIM-антитело и анти-СD28-антитело - ингибировать индукцию продукции IFNγ и IL-4 как ответа Т-клеток, индуцированного в том случае, когда Т-клетки были культивированы в микропланшете, покрытом анти-СD3-антителом.
Т-клетки, полученные из периферической крови, Т-клетки, полученные из тимуса, или Т-клетки, полученные из селезенки, высевали в микропланшет, покрытый одним анти-СD3-антителом, и затем к ним добавляли одно из антител - анти-AILIM-антитело (различные концентрации), анти-СD28-антитело (различные концентрации) или CTLA4-IgFc (контроль). Количества IFNγ или IL-4 в культуральном надосадке определяли согласно способу, описанному выше в <3-1>. Результат показан на фигурах с 11 по 14.
Добавление анти-АILIМ-антитела в значительной степени ингибировало продукцию как IFNγ, так и IL-4, индуцированную при стимуляции анти-СD3-антителом в Т-клетках, полученных из периферической крови (фигуры 11 и 12). Добавление анти-AILIM-антитела также ингибировало пролиферацию клеток. С другой стороны, добавление анти-СD28-антитела не ингибировало ни продукцию цитокинов, ни пролиферацию клеток.
Добавление анти-АILIМ-антитела заметно ингибировало индуцированную анти-СD3-антителом продукцию IL-4 в Т-клетках, полученных из тимуса (фигура 13). Добавление анти-AILIM-антитела также ингибировало пролиферацию клеток. С другой стороны, добавление CTLA4-IgFc в качестве контроля не приводило ни к существенному ингибированию продукции IL-4, ни к существенному ингибированию пролиферации клеток.
Добавление анти-АILIМ-антитела заметно ингибировало индуцированную анти-СD3-антителом продукцию IL-4 в Т-клетках, полученных из селезенки (фигура 14). Добавление анти-АILIМ-антитела также ингибировало пролиферацию клеток. С другой стороны, добавление CTLA4-IgFc в качестве контроля не приводило ни к существенному ингибированию продукции IL-4, ни к существенному ингибированию пролиферации клеток.
<3-4> Анализ индукции пролиферации Т-клеток посредством трансдукции костимулирующего сигнала, опосредуемой анти-СD3-антителом и анти-АILIМ-антителом, в Т-клетку.
Т-клетки пролиферируют в ответ на опосредуемый рецептором Т-клеток первичный сигнал и вторичный сигнал, опосредуемый костимулирующими молекулами, такими как CD28 и CTLA-4.
Пролиферацию клеток, индуцированную стимуляцией различными антителами, анализировали, используя Т-клетки, полученные из периферической крови людей с нормальным здоровьем, клеток селезенки мыши, Т-клеток, полученных из селезенки мыши, и Т-клеток лимфатического узла крыс, согласно указанному выше способу тестирования, который описан в <3-1>.
<3-4-1> Индукция пролиферации Т-клеток человека, полученных из периферической крови.
Т-клетки человека, полученные из периферической крови, добавляли в (1) микропланшет, покрытый одним анти-СD3-антителом (клон ОКТЗ; 200 нг/лунку; Ortho Diagnostic Systems); (2) микропланшет, покрытый анти-СD3-антителом и анти-СD28-антителом (клон CD 28.2; различные концентрации; Pharmingen); (3) микропланшет, покрытый анти-СD3-антителом (200 нг/лунку) и анти-АILIМ-антителом (клон SA12; различные концентрации), и (4) микропланшет, покрытый анти-СD3-антителом (200 нг/лунку), антителом против AILIM человека (различные концентрации) и анти-СD28 -антителом (1 мкг/лунку). Планшеты инкубировали для культивации клеток и затем в течение времени оценивали степень пролиферации с помощью тестирования включения меченного тритием тимидина (3H-TdR) в соответствии с традиционно используемым способом.
Результат показан на фигуре 30. Результат данного тестирования представляет собой следующее.
(i) Пролиферация Т-клеток человека, полученных из периферической крови, была в значительной степени повышена при любой из указанных выше стимуляций с (2) по (4). Пролиферация зависела от концентрации анти-АILIМ-антитела или анти-СD28-антитела, иммобилизованного на планшете.
(ii) Максимальные степени индуцированной пролиферации Т-клеток были сравнимы друг с другом при стимуляциях на указанных выше покрытых антителами планшетах с (2) по (4).
Затем степень пролиферации Т-клеток оценивали, используя микропланшеты, которые указаны ниже в пунктах (5), (6) и (7) таким же способом, который описан выше, чтобы исследовать временной ход пролиферации Т-клеток, полученных из периферической крови человека, индуцированных при стимуляции различными указанными выше антителами.
(5) микропланшет, покрытый анти-СD3-антителом (200 нг/лунку) и анти-СD28-антителом (1 мкг/лунку); (6) микропланшет, покрытый анти-СD3-антителом (200 нг/лунку) и анти-AILIM-антителом (1 мкг/лунку), и (7) микропланшет, покрытый анти-СD3-антителом (200 нг/лунку), антителом против AILIM человека (1 мкг/лунку) и анти-СD28-антителом (1 мкг/лунку). Результат показан на фигуре 31.
Пролиферация Т-клеток выявлялась через 18 часов после стимуляции любой комбинацией антител. Стимуляция комбинацией анти-СD3-антитела и анти-СD28-антитела (как описано выше в (5)) индуцировала самый высокий уровень пролиферации Т-клеток через 40 часов после стимуляции антителами, но активность индуцирования Т-клеточной пролиферации предварительно достигала равновесия с комбинацией.
С другой стороны, уровень пролиферации Т-клеток, индуцированной при стимуляции анти-СD3-антителом и анти-AILIM-антителом (как описано выше в (6)) или тремя антителами (как описано выше в (7)), достигал пика через 60 часов после стимуляции. При этих двух типах комбинаций пролиферация Т-клеток, индуцированная через 60 часов после стимуляции антителами, была значительно выше, чем пролиферация комбинацией анти-СD3-антитела и анти-СD28-антитела.
<3-4-2> Индукция пролиферации клеток селезенки мыши и Т-клеток, полученных из селезенки мыши.
<3-4-2-1> Индукция пролиферации клеток в микропланшетах с иммобилизованным антителом.
96-луночные микропланшеты покрывали анти-СD3-антителом (клон 145-2С11; Pharmingen; 50 нг/лунку). Затем планшеты дополнительно покрывали различными концентрациями антитела против AILIM мыши (клон В10.5) или анти-NР-КНL-антителом в качестве контрольного антитела. К планшетам, покрытым каждым из антител, добавляли клетки селезенки мыши или Т-клетки, полученные из селезенки мыши. Планшеты инкубировали для культивации клеток и затем контролировали степень пролиферации с помощью тестирования включения меченного тритием тимидина (3H-TdR) в соответствии с традиционно используемым способом.
Используемое в качестве контроля анти-NР-КLН-антитело готовили, используя антиген NP-KLH, который представляет собой KLH (гемоцианин морского моллюска "блюдечко"; PIERCE), связанный с NP (нитрофенол), который является гаптеном. Результат показан на фигуре 32.
Стимуляция используемым в качестве контрольного антитела анти-NР-КLН-антителом не приводила ни к пролиферации клеток селезенки мыши, ни к пролиферации Т-клеток, полученных из селезенки мыши. С другой стороны, значительная пролиферация, которая зависела от концентрации анти-АILIМ-антитела, наблюдалась во всех клетках, стимулированных анти-АILIМ-антителом.
<3-4-2-2> Индукция пролиферации клеток с использованием микрошариков с иммобилизованными антителами (часть 1).
Вместо микропланшета в качестве носителя, на котором иммобилизовано антитело, использовали латексный микрошарик. Тестирование пролиферации клеток выполняли, используя шарик, таким же способом, который описан выше.
В D-PBS 1•107 микрошариков обрабатывали (1) 1 мкг/мл анти-СD3-антитела (клон 145-2С11; Pharmingen) и различными концентрациями анти-АILIМ-антитела (клон В10.5) или (2) 1 мкг/мл анти-СD3-антитела и различными концентрациями анти-NP-KLH-антитела. Смеси, содержащие шарики, инкубировали в течение 1 часа или больше и затем шарики промывали D-PBS. Таким образом, антитела иммобилизовывали на шариках.
Клетки селезенки мыши C57BL/6 (1•l05/лyнкy), суспендрованные в среде RPMI1640, содержащей 10% FCS, добавляли в каждую лунку 96-луночного микропланшета и туда же добавляли шарики (1•105 частиц/лунку). Смесь инкубировали в течение 56 часов. Степень пролиферации клеток после реакции определяли по тестированию включения меченного тритием тимидина (3H-TdR) обычным способом. Результат показан на фигуре 33.
Пролиферация клеток селезенки мыши C57BL/6 была одинаково индуцирована либо при стимуляции анти-СD3-антителом и анти-АILIМ-антителом, либо при стимуляции анти-СD3-антителом и анти-СD28-антителом. Степень пролиферации клеток возрастала в зависимости от увеличения концентрации анти-АILIМ-антитела или анти-СD28-антитела, иммобилизованного на шариках (увеличение отношения концентрации анти-АILIМ-антитела или анти-СD28-антитела к концентрации анти-СD3-антитела). Кроме того, степень пролиферации клеток была максимальной в том случае, когда оба отношения - отношение концентрации анти-СD3-антитела к концентрации анти-АILIМ-антитела и отношение концентрации анти-СD3-антитела к концентрации анти-СD28-антитела - составляли 1:9.
<3-4-2-3> Индукция пролиферации клеток с использованием микрошариков с иммобилизованными антителами (часть 2).
На основании результата, описанного выше в <3-4-2-2> пролиферацию клеток мыши анализировали тем же способом, который описан выше, используя латексные шарики, покрытые антителами, при условии, когда оба отношения концентрации анти-СD3-антитела к концентрации анти-АILIМ-антитела и концентрации анти-СD3-антитела к концентрации анти-СD28-антитела составляли 1:9.
Данный тест проводили, используя различные концентрации покрытых антителами микрошариков, добавляемых к суспензии клеток селезенки мыши (1•105 клеток/лунку).
Кроме того, клетками мышей, используемыми в тесте, были клетки селезенки мышей BALB/C и Т-клетки, полученные из селезенки мышей BALB/C.
В тесте контрольный эксперимент проводили сходным образом с использованием микрошариков, на которых было иммобилизовано только одно анти-СD3-антитело. Результат показан на фигурах 34 и 35.
Пролиферация как клеток селезенки мыши BALB/C, так и Т-клеток, полученных из селезенки мыши BALB/C, была одинаково индуцируема либо (1) при стимуляции одним анти-СD3-антителом; (2) при стимуляции анти-СD3-антителом и анти-AILIM-антителом либо (3) при стимуляции анти-СD3-антителом и анти-СD28-антителом.
Степень пролиферации клеток возрастала в зависимости от увеличения концентрации микрошариков (то есть концентрации антител), добавленных в культуру клеток.
Пролиферация как клетки селезенки мыши BALB/C, так и Т-клетки, полученной из селезенки мыши BALB/C, была максимальной, когда концентрация микрошариков, добавленных в культуру клеток, составляла 30000 частиц/лунку. Один и тот же результат был получен при использовании шариков, покрытых анти-СD3-антителом и анти-АILIМ-антителом, а также при использовании микрошариков, покрытых анти-СD3-антителом и анти-СD28-антителом.
<3-4-3> Индукция пролиферации Т-клеток лимфатического узла крысы.
Т-клетки лимфатического узла крысы (1•105 клеток/лунку), суспендированные в среде RPMI1640, содержащей 10% FCS, добавляли в (1) микропланшет, покрытый анти-СD3-антителом (клон G4.18; 50 нг/лунку) и анти-СD28-антителом (клон JJ319; различные концентрации; Pharmingen); (2) микропланшет, покрытый анти-СD3-антителом (50 нг/лунку) и анти-AILIM-антителом (различные концентрации), и (3) микропланшет, покрытый анти-СD3-антителом (50 нг/лунку), антителом МОРС21, являющимся негативным контролем (различные концентрации, Pharmingen). Планшеты инкубировали для культивации клеток при 37oС в течение 44 часов. За 6 часов до конца культивирования в каждую лунку добавляли меченный тритием тимидин (3H-TdR) при концентрации 0,5 мкКи/лунку. После завершения культивирования клетки собирали и затем исследовали количество включенного в клетки меченного тритием тимидина (3H-TdR) в TOPCOUNT (PACKARD). Степень пролиферации клеток анализировали на основании включенного количества, используемого в качестве индикатора.
Результат показан на фигуре 36. В данном тесте был получен следующий результат.
Хотя пролиферация Т-клеток лимфатического узла крысы не была индуцирована одним только анти-СD3-антителом, пролиферация была одинаково значительно усилена при стимуляции либо анти-СD3-антителом и анти-АILIМ-антителом, либо при стимуляции анти-СD3-антителом и анти-СD28-антителом. Пролиферация зависела от концентрации анти-АILIМ-антитела или анти-СD28-антитела, которое было иммобилизовано на планшете.
Пример 4
Терапевтическое действие анти-АILIМ-антитела на артроз
<4-1> Тестирование при многократном введении анти-AILIM-антитела.
В качестве адъюванта использовали 10 мг/мл мертвой туберкулезной бациллы (М. Tuberculosis H37Ra; Difco) в жидком парафине. Адъювант инъецировали внутрикожно крысам Wistar (самцы, 5-недельного возраста, Charles River Inc.) в дозе 0,1 мл/особь (1 мг/0,1 мл/особь) в область основания хвоста, чтобы индуцировать артроз. Через 7 дней после введения адъюванта (0 день) измеряли объем обеих задних конечностей, используя плетизмометр. Крыс делили на группы (8 особей в каждой группе) на основании объема обеих задних конечностей, используемого в качестве показателя.
Через 7 дней после введения адъюванта (0 день) крысам, относящимся к одной из групп, внутривенно вводили антитело против AILIM крыс (JTT-2-антитело; также называемое JMab50; 20 мг/кг). После первичного введения антитело вводили повторно дважды в неделю в течение периода от начала до двадцатого дня. Используя плетизмометр, измеряли объем обеих задних конечностей в течение времени, начиная с первичного введения адъюванта.
Контрольный эксперимент проводили в группе нормальных крыс (4 особи), которым не давали ни адъюванта, ни антитела, и в группе крыс, являющихся негативным контролем, которым вводили мышиное антитело против СЕТР человека (клон JHC1, также называемый JMabl09; JP-A 9-20800), вместо антитела против AILIM крыс. Используя плетизмометр, измеряли объем обеих задних конечностей тем же самым способом. Результат показан на фигуре 15.
Неожиданно опухание лапы полностью подавлялось в группе, подвергавшейся введению анти-АILIМ-антитела; наблюдаемый результат по существу был таким же, как результат, наблюдаемый в группе нормальных крыс, у которых не индуцировали артрит.
<4-2> Тест с однократным введением анти-АILIМ-антитела (часть 1).
На основании указанного выше результата терапевтическое действие однократного введения анти-АILIМ-антитела исследовали таким же образом, как описано выше.
В данном тесте анти-АILIМ-антитело или антитело для негативного контроля вводили внутривенно только один раз на третий, пятый или седьмой день после введения адъюванта (0 день); используемыми анти-АILIМ-антителом и антителом негативного контроля были соответственно антитело против AILIM крыс (JTT-2-антитело; также называемое JMab50; 20 мг/кг) и антитело против СЕТР крыс (JHC1; 20 мг/кг). Результат показан на фигуре 37.
Хотя введение анти-АILIМ-антитела проводили только один раз, но опухание лапы было существенно подавлено во всех случаях, когда антитело вводили однократно на третий, пятый или седьмой день после введения адъюванта. В частности, в группе, в которой анти-АILIМ-антитело вводили на седьмой день после введения адъюванта, опухание лапы было почти полностью ингибировано. Степень ингибирования была по существу такой же, как в группе нормальных крыс, у которых не индуцировали артрит.
<4-3> Тест с однократным введением анти-АILIМ-антитела (часть 2).
На основании результата, описанного выше в <4-2>, определяли эффективную дозу анти-АILIМ-антитела при терапии артрита на модели артрита при тестировании таким же образом, как описано выше.
В данном тесте антитело против AILIM крыс (JTT-2-антитело; также называемое JMab50) в дозе 1, 3, 10 или 20 мг/кг вводили внутривенно только один раз на седьмой день после введения адъюванта.
Кроме того, для сравнения в дополнение к JTT-2 вводили другое антитело против AILIM крыс (JTT-1, также называемое JMab-49; 29 мг/кг) только один раз тем же способом.
В качестве негативного контроля внутривенно только один раз вводили антитело против СЕТР крыс (JHC1; 20 мг/кг). Результат показан на фигуре 38.
Даже в том случае, когда анти-АILIМ-антитело вводили только один раз в дозе 1, 3, 10 или 20 мг/кг, опухание лапы было почти полностью ингибировано. Степень опухания лапы была ингибирована по существу до такого уровня, как в группе нормальных крыс, у которых не индуцировали артрит. Неожиданно антитело оказывало ингибирующее действие даже при очень низкой дозе (1 мг/кг).
Пример 5
Терапевтическое действие анти-АILIМ-антитела на гепатит
Раствор Р. acnes (Propionibacterium acnes) в фосфатном буфере (PBS) внутривенно вводили мышам C57BL/6. Через одну неделю после введения Р. acnes (0 день) мышам внутривенно вводили раствор ЛПС (липополисахарида) в PBS, чтобы индуцировать гепатит. Через 6,5 часов после введения ЛПС отбирали кровь из глазного дна и затем методом ELISA определяли концентрацию IFN-γ в плазме. Дополнительно в биохимическом анализаторе (Fara) измеряли концентрации GOT (трансаминаза глутаминовой кислоты - щавелевоуксусной кислоты) и GPT (трансаминаза глутаминовой кислоты - пировиноградной кислоты) в плазме.
На 1, 2 и 3 день после введения Р. acnes (0 день) мышам внутрибрюшинно вводили моноклональное антитело против AILIM мыши (В10.5-антитело; 5, 50 или 500 мкг/особь) и затем оценивали ослабляющее действие анти-АILIМ-антитела на гепатит.
Контрольной группе не давали антитело против AILIM мыши. Результат показан на фигурах 16 и 17.
Введение анти-АILIМ-антитела существенно ингибировало повышение уровня IFN-γ в крови зависимым от концентрации антитела образом. Введение анти-АILIМ-антитела (50 мкг/особь) также в значительной степени ингибировало повышение уровней GOT и GPT.
Пример 6
Терапевтическое действие анти-АILIМ-антитела при заболевании трансплантат против хозяина (ТПХБ)
<6-1> Тест 1.
Чтобы индуцировать ТПХБ клетки селезенки мыши BALB/c (8•107 клеток/особь) внутривенно вводили мышам F1 (от 8- до 10-недельного возраста, 3 особи), полученным при скрещивании мыши BALB/c и мыши C57BL/6. Сразу же и через 12 часов после введения клеток селезенки (0 часов) мышам внутривенно вводили моноклональное антитело против AILIM мыши (В10.5 антитело; 400 мкг/особь). Через 24, 48 и 72 часа после введения клеток селезенки мышам внутрибрюшинно вводили В10.5-антитело (200 мкг/особь).
Сразу же, через 1, 2, 3 и 6 недель после введения клеток селезенки (0 день) у мышей брали кровь. Титр IgG1, IgE и анти-днДНК-антитела в сыворотке определяли согласно стандартному способу. Значения титра анти-днДНК-антитела нормировали, используя анти-днДНК-антитело в сыворотке мыши со спонтанным аутоиммунным заболеванием в качестве стандарта.
Вместо анти-АILIМ-антитела мышам в группе позитивного контроля таким же образом давали hCTLA4-Ig (слитый белок между растворимым районом CTLA4 человека и константным районом иммуноглобулина). Дополнительно вместо анти-AILIM-антитела в группе негативного контроля таким же образом давали PBS. Результат показан на фигурах с 18 по 20.
Повышение титра IgG, IgE и анти-днДНК-антитела в сыворотке как показатель ТПХ реакции (реакции трансплантат против хозяина) было в значительной степени подавлено в группе, подвергнутой введению анти-АILIМ-антитела, по сравнению с негативным контролем. Кроме того, супрессирующее действие было сравнимо с таковым, наблюдаемым в группе позитивного контроля, подвергнутой введению hCTLA4-Ig.
<6-2> Тест 2.
Чтобы индуцировать ТПХБ, клетки селезенки мыши BALB/c (1•108 клеток/особь) внутривенно вводили мышам F1 (от 8 до 10-недельного возраста, 3 особи), полученным при скрещивании мыши BALB/c и мыши C57BL/6. Сразу же и через 12 часов после введения клеток селезенки (0 часов) мышам внутривенно вводили моноклональное антитело против AILIM мыши (В10.5-антитело; 200 мкг/особь). Через 24, 48 и 72 часа после введения клеток селезенки мышам внутрибрюшинно вводили В10.5-антитело (100 мкг/особь).
Сразу же, через 1, 2, 3, 6, 9 и 12 недель после введения клеток селезенки (0 день) у мышей брали кровь. Титр IgG1, IgE и анти-днДНК-антитела в сыворотке определяли согласно стандартному способу. Значения титра анти-днДНК-антитела нормировали, используя анти-днДНК-антитело в сыворотке мыши со спонтанным аутоиммунным заболеванием в качестве стандарта.
Вместо анти-АILIМ-антитела мышам в группе позитивного контроля таким же образом давали hCTLA4-Ig (слитый белок между растворимым районом CTLA4 человека и константным районом иммуноглобулина). Дополнительно вместо анти-AILIM-антитела в группе негативного контроля таким же образом давали PBS. Результат показан на фигурах с 39 по 41.
Повышение титра IgG, IgE и анти-днДНК-антитела в сыворотке как показатель реакции ТПХ (реакции трансплантат против хозяина) было в значительной степени подавлено в группе, подвергнутой введению анти-АILIМ-антитела, по сравнению с группой негативного контроля. Кроме того, супрессирующее действие было сравнимо с таковым, наблюдаемым в группе позитивного контроля, подвергнутой введению hCTLA4-Ig.
Пример 7
Ингибирующее действие анти-АILIМ-антитела на продукцию антитела против чужеродного антигена
<7-1> Ингибирующее действие анти-АILIМ-антитела на продукцию анти-ЭБ - антитела у мышей, иммунологически сенсибилизированных эритроцитами барана (ЭБ).
Эритроциты барана (ЭБ; 1•108 клеток/особь) внутривенно вводили мышам BALB/c (самки 5-недельного возраста). Сразу же или через 7 дней после введения ЭБ (0 день) мышам внутривенно вводили моноклональное антитело против AILIM мыши (В10.5-антитело; 50 или 500 мкг/особь). В течение времени после введения ЭБ брали кровь. Анти-ЭБ-антитело, продуцируемое в сыворотке, оценивали обычно используемым методом ELISA.
Вместо анти-АILIМ-антитела мышам в группе позитивного контроля таким же образом давали hCTLA4-Ig (слитый белок между растворимым районом CTLA4 человека и константным районом иммуноглобулина). Дополнительно вместо анти-AILIM-антитела в группе негативного контроля таким же образом давали PBS. Результат показан на фигурах 21 и 22.
Продукция IgG-антитела, специфичного для чужеродного антигена ЭБ, была в значительной степени ингибирована в группе, подвергнутой введению анти-АILIМ-антитела в каждом случае, когда антитело вводили сразу же после сенсибилизации ЭБ, или когда его вводили через 7 дней после сенсибилизации, по сравнению с продукцией в группе негативного контроля. Ингибирующее действие было сильнее, чем действие в группе позитивного контроля, подвергнутой введению hCTLA4-Ig.
С другой стороны, продукция анти-ЭБ-антитела была в значительной степени ингибирована в группе, подвергнутой введению hCTLA4-Ig, в случае, где hCTLA4-Ig давали сразу же после сенсибилизации ЭБ, по сравнению с продукцией в группе негативного контроля. Однако не было обнаружено существенного ингибирования в случае, когда его вводили через 7 дней после сенсибилизации ЭБ.
<7-2> Ингибирующее действие анти-АILIM-антитела на продукцию анти-NР-КLH-антитела у мышей, иммунологически сенсибилизированных NP-KLH.
CFA (полный адъювант Фрейнда) и NP-KLH (KLH - гемоцианин морского моллюска блюдечко), химически связанный с гаптеном NP (нитрофенол; 100 мкг/мышь), внутрибрюшинно вводили мышам C57BL/6. Сразу же или через 12 часов после введения антигена (0 час) в хвостовую вену вводили антитело против AILIM мыши (один из клонов В10.5 и В9.В6; 200 мкг/мышь). Через 24 и 48 часов после введения антигена одно из двух анти-AILIM-антител вводили мышам внутрибрюшинно.
Кровь брали в течение периода после введения NP-KLH. Количество каждого специфичного для NP-KLH-антитела (IgG1, IgG2a, IgG2b или IgM), продуцируемого в сыворотке, оценивали обычно используемым методом ELISA. В данном эксперименте ELISA в качестве иммобилизованного антигена использовали NP-конъюгированный бычий сывороточный альбумин (БСА).
В данном тесте эксперименты для негативного и позитивного контроля проводили, используя соответственно фосфатный буфер и hCTLA4-Ig (слитый белок между растворимым районом CTLA4 человека и константным районом иммуноглобулина), при таком же способе обработки, который описан выше. Результат показан на фигурах с 42 по 46.
Количество вырабатываемого анти-NР-КLH-антитела возрастало в течение времени в группе, подвергнутой введению антитела для негативного контроля. Данное антитело негативного контроля не ингибировало продукцию анти-NР-КLH-антитела.
С другой стороны, продукция анти-NP-KLH-антитела была существенно ингибирована в группе, подвергнутой введению анти-АILIМ-антитела. Степень ингибирования была почти сравнима с ингибирующим действием на продукцию анти-NР-КLH-антитела, которое оказывал CTLA4-IgFc, представляющий собой позитивный контроль.
Продукция любого из анти-NР-КLH-антител, относящихся к антителам классов IgG1, IgG2a, IgG2b или IgM, была в значительной степени ингибирована в группе, подвергнутой введению анти-АILIМ-антитела.
Пример 8
Анализ активности анти-АILIМ-антитела, модулирующего реакцию смешанной культуры лимфоцитов (РСКЛ)
Проведен анализ того, обладает ли анти-АILIМ-антитело или не обладает активностями при модулировании (усилении и/или подавлении) Т-клеточного ответа (продукции цитокина, такого как IFN-γ и IL-4, пролиферации клеток и т. д. ), а именно обладает ли антитело или не обладает способностью модулировать трансдукцию опосредуемого AILIM костимулирующего сигнала в клетки. Анализ проводили, используя в качестве показателя наличие или отсутствие активности в модулировании пролиферации Т-клеток (а именно синтеза ДНК в клетке) в ответ на реакцию смешанной культуры аллогенных лимфоцитов (аллогенная РСКЛ).
<8-1> Подготовка РВМС и Т-клеток человека.
Образцы периферической крови (200 мл), собранные от людей с нормальным здоровьем (7 человек, названных донорами А, В, С, D, Е, F и G) наносили на слои lymphoprep (15 мл; Nycomed) в микропробирках (50 мл; Falcon). Затем пробирки центрифугировали (при 1600 об/мин в течение 10 минут) и затем полученные в результате промежуточные слои извлекали. Выделенные клетки разводили в 2 раза или больше фосфатным буфером и затем центрифугировали (при 1800 об/мин в течение 10 мин), чтобы получить РВМС (мононуклеарные клетки периферической крови; от 2•108 до 5•108 клеток). Количество клеток определяли с помощью гемоцитометра. Отбирали аликвоту клеток (1,08•108 клеток в 9 микропланшетах) для теста на РСКЛ и хранили на льду. Оставшиеся клетки использовали для выделения Т-клеток следующим образом.
Выделение Т-клеток из РВМС выполняли, используя набор для выделения пан Т-клеток (Miltenyi Biotech). Согласно технологической инструкции, прилагаемой к набору, оставшиеся РВМС добавляли и давали возможность реагировать в растворе, имеющимся в наборе. Потом клетки промывали PBS, содержащим 5 мМ ЭДТА и 0,5% БСА, и затем повторно суспендировали в PBS. Затем суспензию клеток добавляли к колонке VS+ для позитивной селекции (Miltenyi Biotech) после ее набухания в PBS. Получали неадсорбированную фракцию. Колонку промывали PBS. Промывочный раствор собирали. Снова проводили процедуру промывки. Извлеченные растворы объединяли вместе, чтобы получить фракцию Т-клеток. Т-клеточную фракцию центрифугировали и затем клетки повторно суспендировали в PBS. Полученные в результате Т-клетки подсчитывали, используя гемоцитометр. Клетки использовали в следующем тесте.
<8-2> Реакция смешанной культуры лимфоцитов (РСКЛ).
Как описано ранее, в качестве путей передачи костимулирующих сигналов, необходимых для активации лимфоцитов, таких как Т-клетка и т.д., известны два пути передачи сигнала между CD28 и CD80 (B7-1/CD86 (В7-2) и между CTLA4 и CD80 (B7-1)/CD86 (B7-2), для которых ранее был проведен детальный сравнительный анализ. То есть пролиферация Т-клеток в ответ на реакцию смешанной культуры лимфоцитов (РСКЛ) также может быть индуцирована при сигнальной трансдукции посредством каждого из двух известных путей.
Поэтому с использованием веществ, указанных ниже, данный тест был проведен для того, чтобы проанализировать (1) ингибирование РСКЛ посредством блокирования опосредованного CTLA4 сигнального пути; (2) ингибирование РСКЛ посредством блокирования опосредованного СВ80 (B7-1)/CD86 (В7-2) сигнального пути и (3) ингибирование РСКЛ посредством блокирования третичного сигнального пути, ассоциированного с AILIM.
Следующие вещества использовали в качестве тестируемых веществ:
(1) мышиное моноклональное антитело SA12 против AILIM человека (такое же, как в указанном выше примере);
(2) мышиное IgG-антитело (антитело против CD34 человека; негативный контроль; Immunotech);
(3) смесь моноклонального антитела против CD80 человека (Pharmingen) и моноклонального антитела против CD86 человека (Pharmingen);
(4) xимерная молекула CTLA4-IgFc человека (Ancell).
Реакцию смешанной культуры лимфоцитов (РСКЛ) проводили в следующих 6 комбинациях с использованием РВМС и Т-клеток, полученных от доноров, описанных выше в <8-1>:
(i) Т-клетка (донор А)/РВМС (донор D)
(ii) Т-клетка (донор D)/PBMC (донор В)
(iii) Т-клетка (донор C)/РВМС (донор А)
(iv) Т-клетка (донор Е)/РВМС (донор G)
(v) Т-клетка (донор F)/РВМС (донор Е)
(vi) Т-клетка (донор G)/PBMC (донор F)
Концентрации РВМС и Т-клеток, используемые в тесте, доводили, как описано ниже.
РВМС суспендировали в PBS и затем переносили в чашки для культивирования (60-миллиметровые). Клетки подвергали облучению X-излучением (50 Гр) облучателем (Hitachi MEDICO). Клетки извлекали, центрифугировали и затем добавляли в среду RPMI1640, содержащую 10% FCS. Количество клеток доводили до 2•105 клеток/50 мкл.
Полученные в результате Т-клетки от каждого донора также добавляли в среду RPMI1640, содержащую 10% FCS, и количество клеток доводили до 1•105 клеток/50 мкл.
<8-2-1> Ингибирование РСКЛ анти-АILIМ-антителом.
Среду RPMI1640, содержащую 10% FCS, добавляли в каждую лунку 96-луночного микропланшета, имеющего U-образные лунки. Раствор мышиного моноклонального антитела против AILIM человека SA12 разбавляли средой RPMI1640, содержащей 10% FCS, чтобы получить растворы с различными концентрациями антитела. Разведенные растворы антитела добавляли в лунки (конечная концентрация 0; 0,31; 1,25; 5 и 20 мкг/мл). Затем в лунки добавляли Т-клетки (50 мкл). Планшет инкубировали при 37oС в течение 1 часа в СО2-инкубаторе (NAPCO). После завершения реакции РВМС (50 мкл), полученные от другого донора, добавляли в лунки, чтобы инициировать РСКЛ.
В том случае, когда РСКЛ проводили с использованием в качестве тестируемого вещества не античеловеческого-АILIМ-антитела, а другого вещества, Т-клеткам, полученным от другого донора, давали возможность реагировать после инкубации РВМС с тестируемым веществом.
На пятый день культивирования в каждую лунку добавляли меченный тритием тимидин (3H-тимидин; 20 мкл; 1 мкКи/лунку), разведенный в среде RPMI1640, содержащей 10% FCS. Культивирование продолжали в течение одного дня. После завершения культивирования клетки собирали, используя устройство для сбора клеток (Packard). Радиоактивность включенного в клетки 3H-тимидина измеряли в β-счетчике (TOP COUNT; Packard), чтобы проанализировать степень пролиферации Т-клеток после культивирования. Результат показан на фигурах с 47 по 52.
Подведен следующий итог.
(1) CTlA4-IgFc блокирует опосредованную CTLA-4 сигнальную трансдукцию, ингибируя таким образом пролиферацию Т-клетки, индуцированную аллогенной РСКЛ.
(2) Анти-СD80-антитело и анти-СD86-антитело ингибируют сигнальную трансдукцию, опосредованную CD80/CD86, которые являются лигандом CTLA4 и CD28, ингибируя таким образом пролиферацию Т-клетки, индуцированную аллогенной РСКЛ.
(3) Антитело против AILIM человека, подобно CTLA4-IgFc, анти-СD80-антителу и анти-СD86-антителу, существенно ингибирует пролиферацию Т-клеток, индуцированную аллогенной РСКЛ, посредством AILIM-опосредованной сигнальной трансдукции зависимым от концентрации анти-АILIМ-антитела образом.
(4) Значительное ингибирование РСКЛ анти-AILIМ-антителом может быть достигнуто при любой комбинации РВМС или Т-клеток, полученных от доноров.
Другими словами, полученные результаты показывают, что пути передачи костимулирующего сигнала, необходимые для активации Т-клеток, включают третичный путь, при котором сигнал опосредован AILIM и его лигандом, в дополнение к известным путям - пути, опосредованному CTLA4/CD80/CD86, и пути, опосредованному CD28/CD80/CD86, а также, что опосредованный AILIM сигнальный путь ингибируется антителом против AILIM.
Кроме того, это увеличивает вероятность того, что вклад AILIM-опосредованного пути в трансдукцию сигнала может быть сравним с вкладом пути, опосредованного CTLA4/CD80/CD86, и пути, опосредованного CD28/CD80/CD86.
Промышленное применение
Терапевтическая композиция данного изобретения применима для лечения или профилактики различных указанных ниже аутоиммунных болезней или воспалительных заболеваний, вызванных активацией лимфоцитов, таких как Т-клетки, и нарушением регуляции функций активированных лимфоцитов.
Примерами заболеваний являются артроз (например, ревматоидный артрит, остеоартрит), воспаление [например, энцефалит, бронхит, ангиит, пневмония, гепатит, миокардит, панкреатит, энтерит тонкого кишечника, гастрит, перитонит, нефрит (например, гломерулонефрит), артрит (например, ревматоидный артрит), воспаление при постишемическом реперфузионном повреждении (ишемическое реперфузионное повреждение миокарда), воспаление, приписываемое иммунному отторжению, воспалительные заболевания кишечника, ожог, воспаление при множественной органной недостаточности, воспаление после операций РТСА или PTCR, воспаление, сопровождающее артериосклероз], различные состояния, вызванные бактериальной или вирусной инфекцией (например, воспаление), реакция трансплантат против хозяина, иммунное отторжение, сопровождающее реакцию трансплантат против хозяина, трансплантацию ткани(ней) и органа(нов), различные заболевания, сопровождающиеся избыточной продукцией антитела против чужеродного антигена, вызванной иммунизацией чужеродным антигеном, множественный склероз, аутоиммунный тиреоидит, различные воспаления кожи (аллергический дерматит контактного типа, красный плоский лишай, который является хроническим воспалительным заболеванием кожи, псориаз, склеродермия) и системная красная волчанка.
Фармацевтическая композиция, содержащая антитело человека против AILIM, включенная в фармацевтическую композицию данного изобретения, чрезвычайно полезна в качестве лекарственного средства, поскольку она полностью исключает какие-либо побочные эффекты, например аллергию при введении человеку антитела, полученного на мышах.
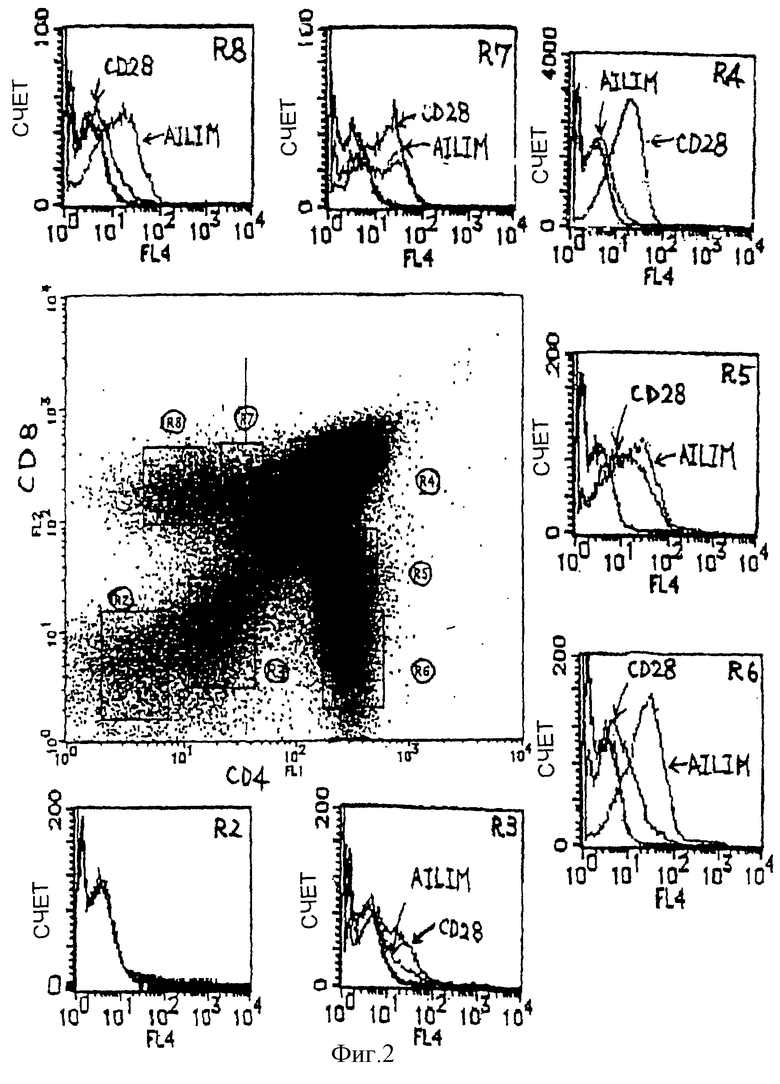
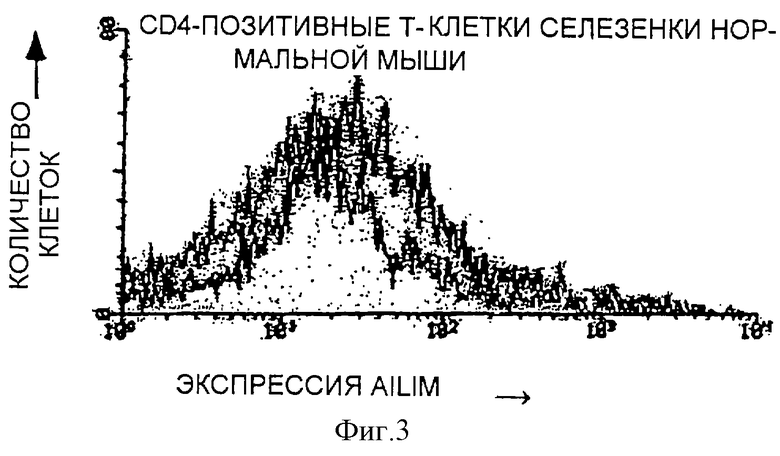
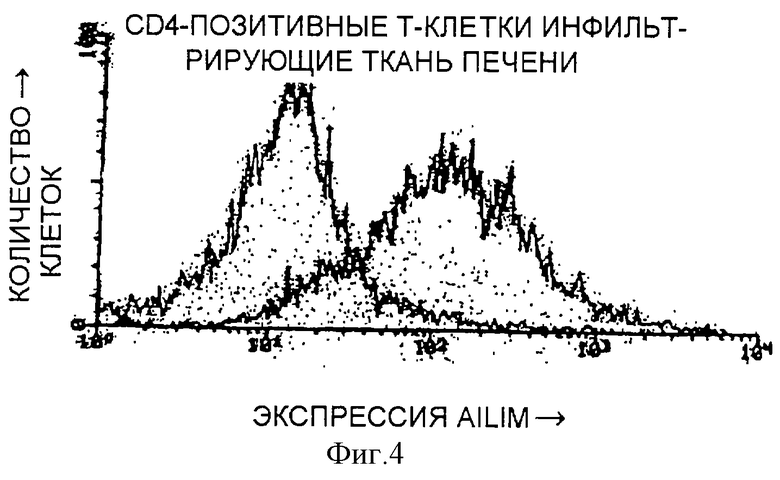
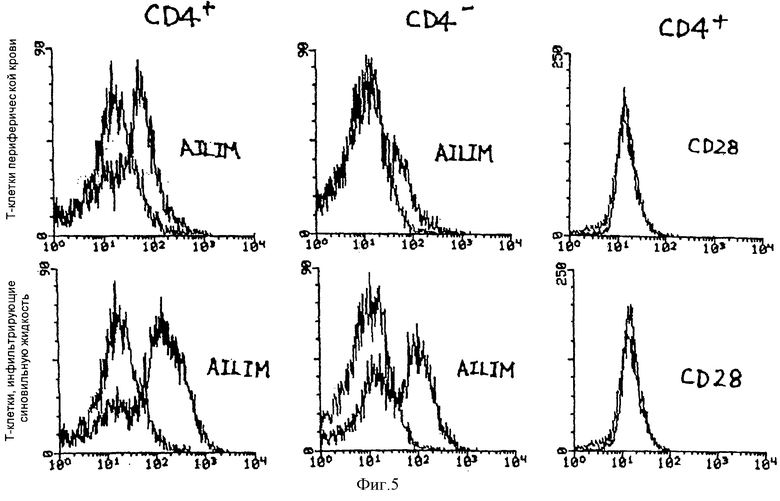
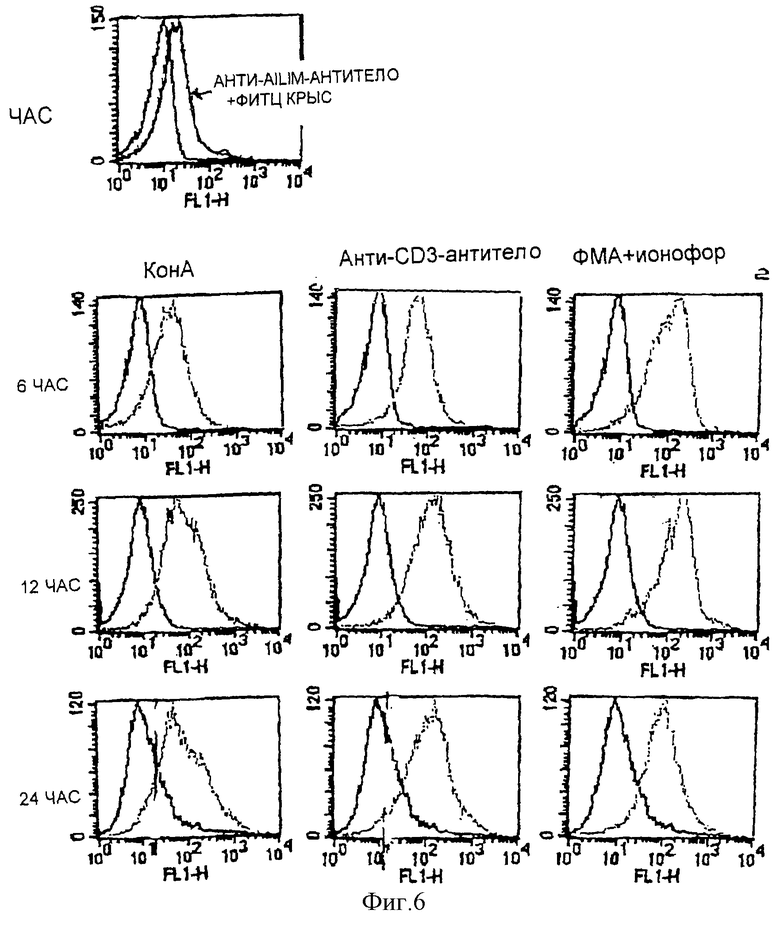
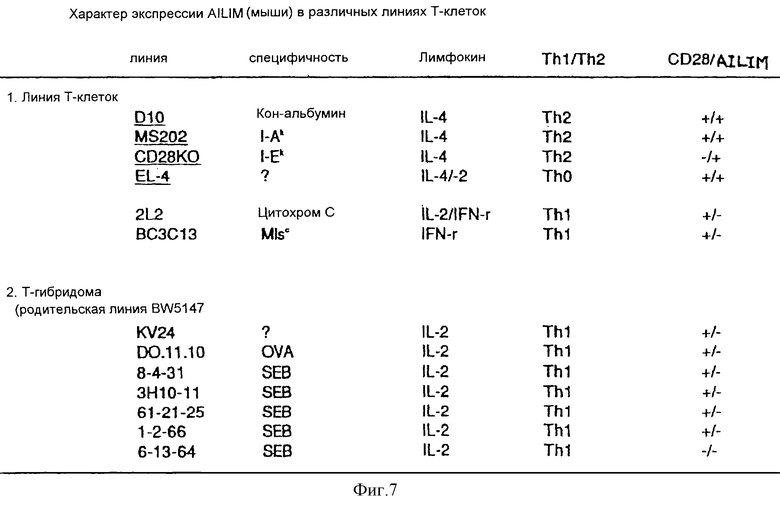
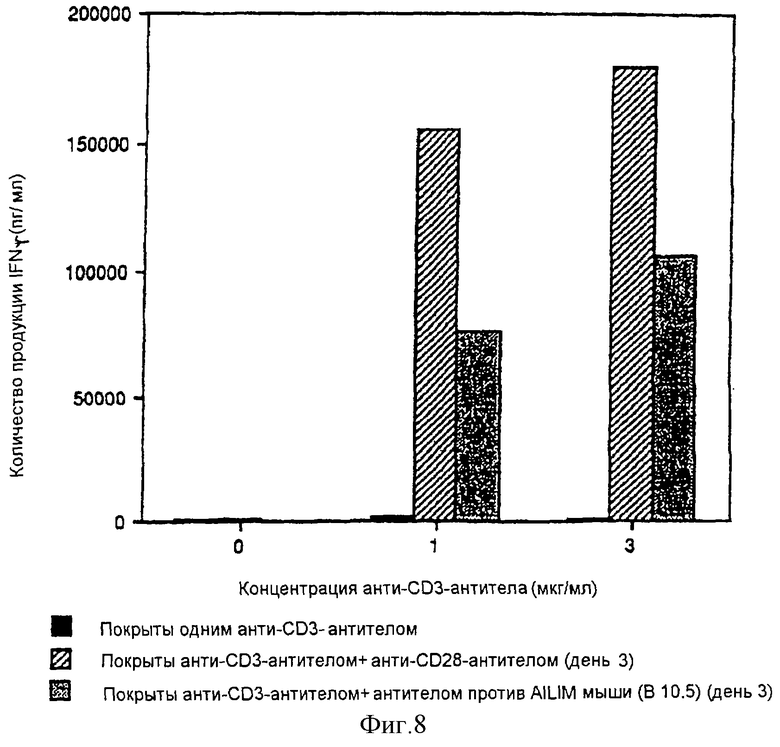
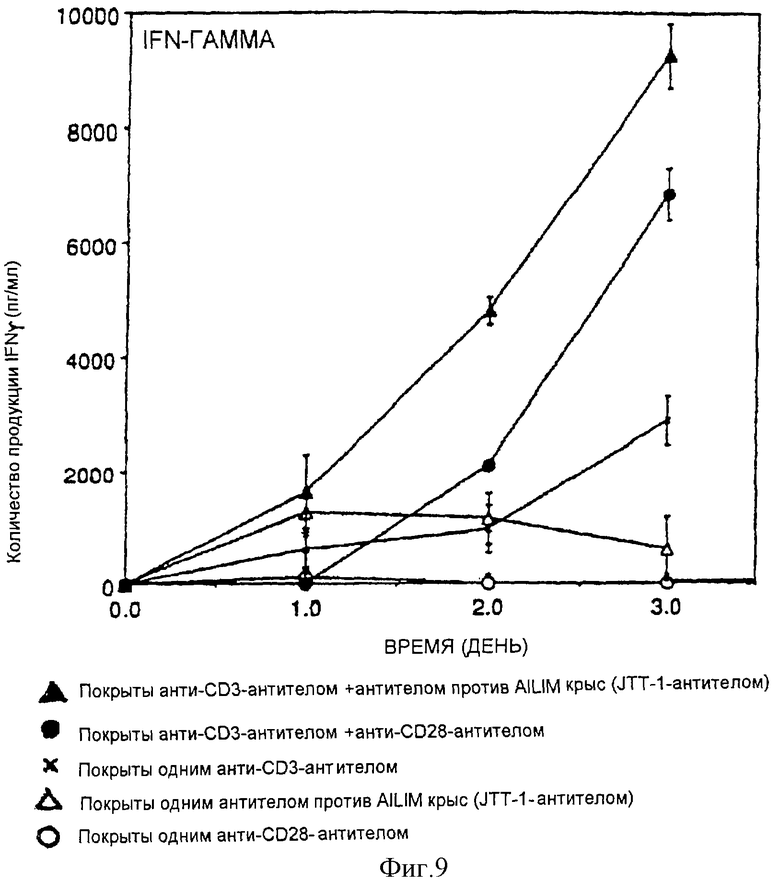
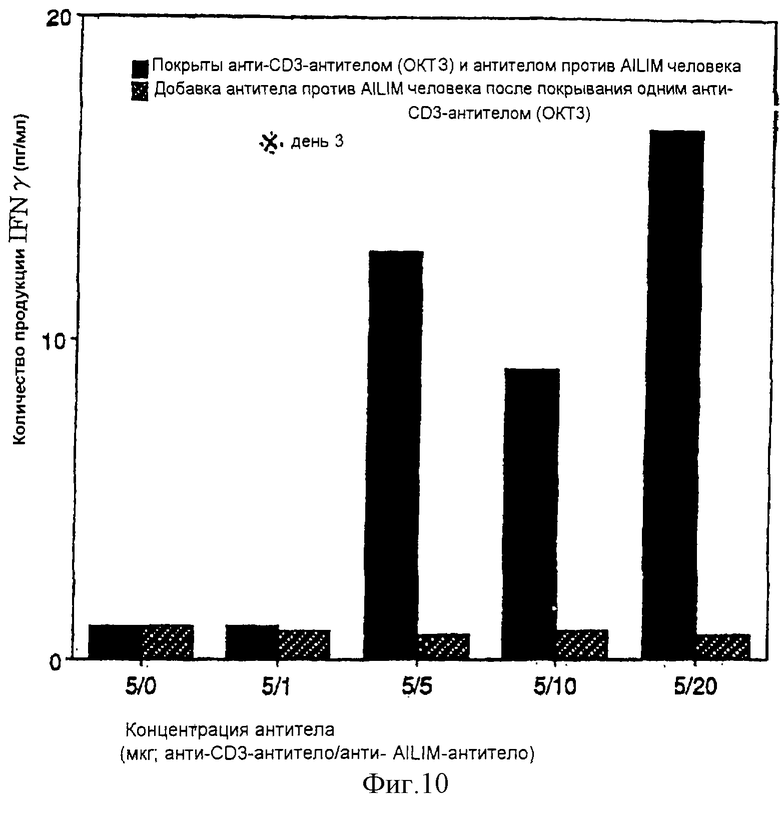
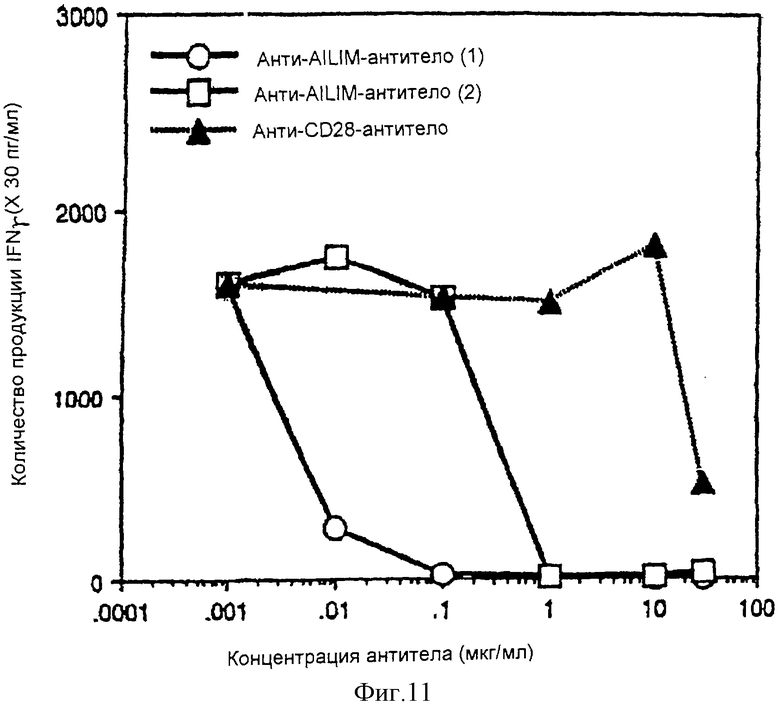
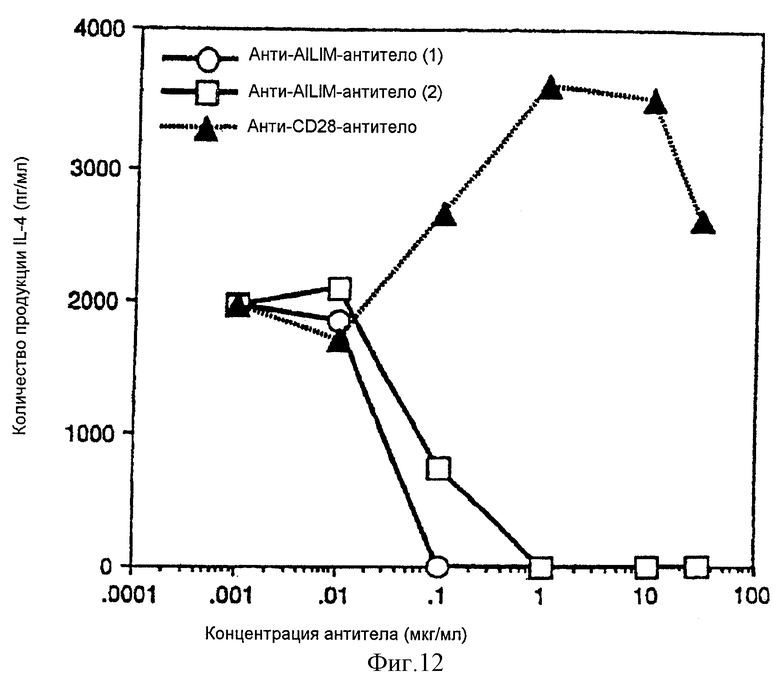
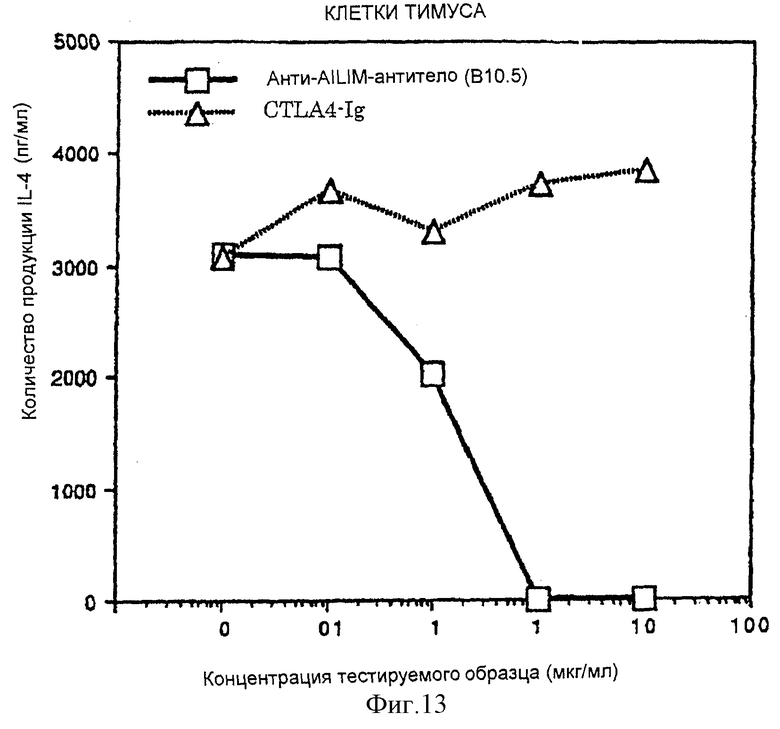
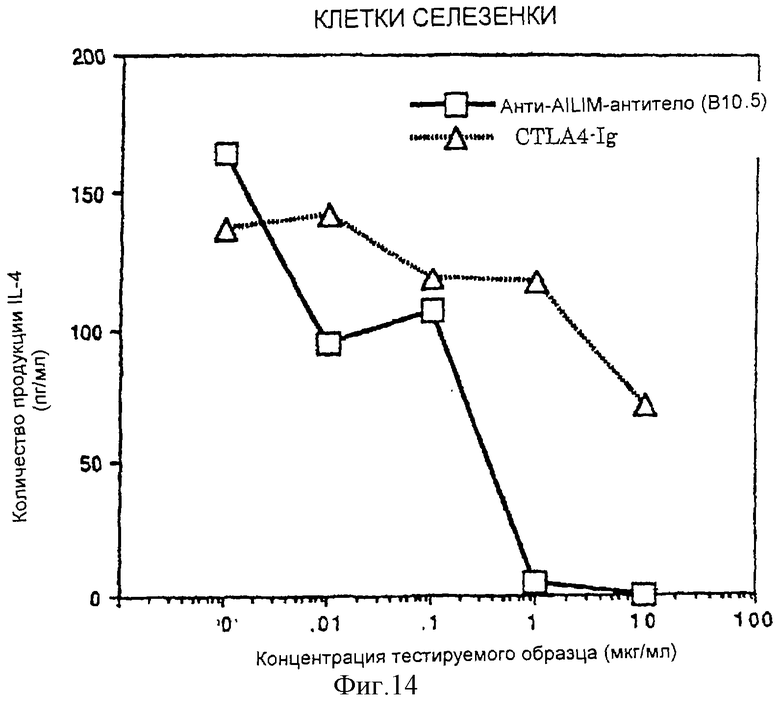
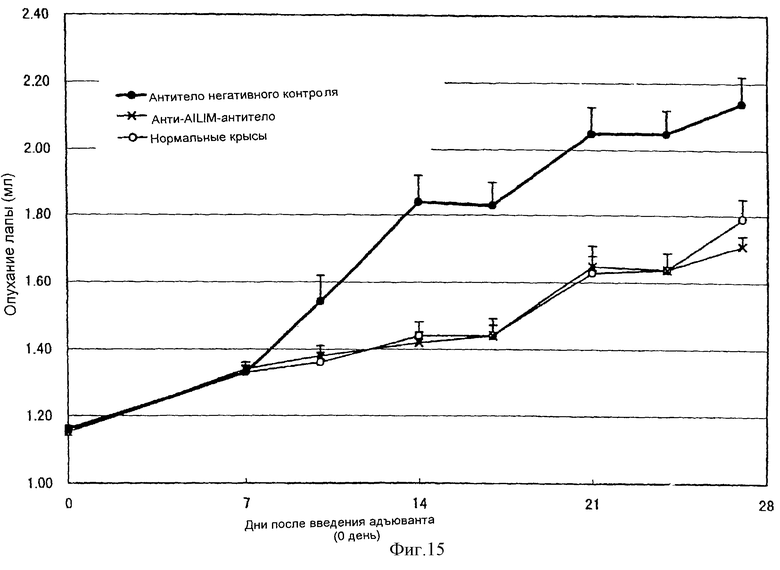
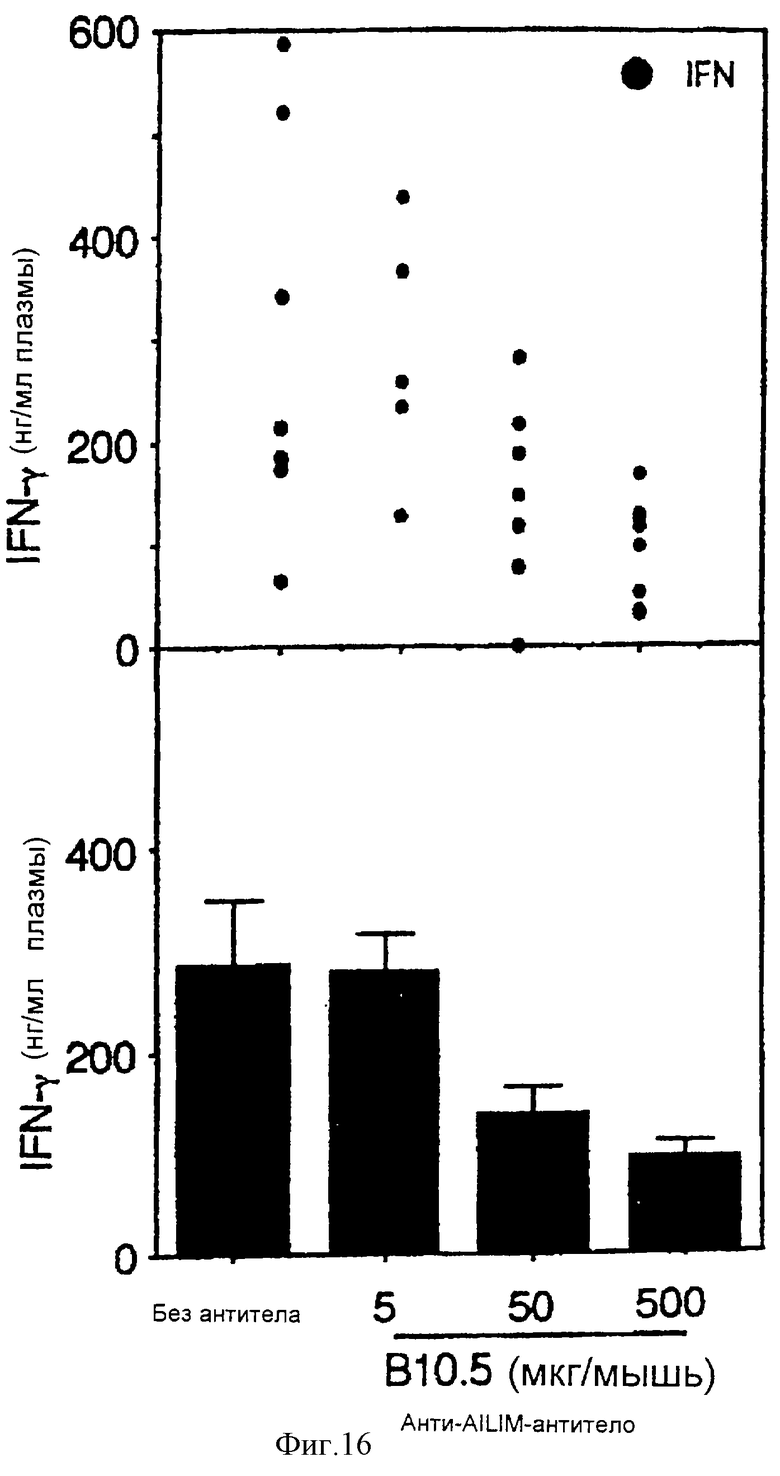
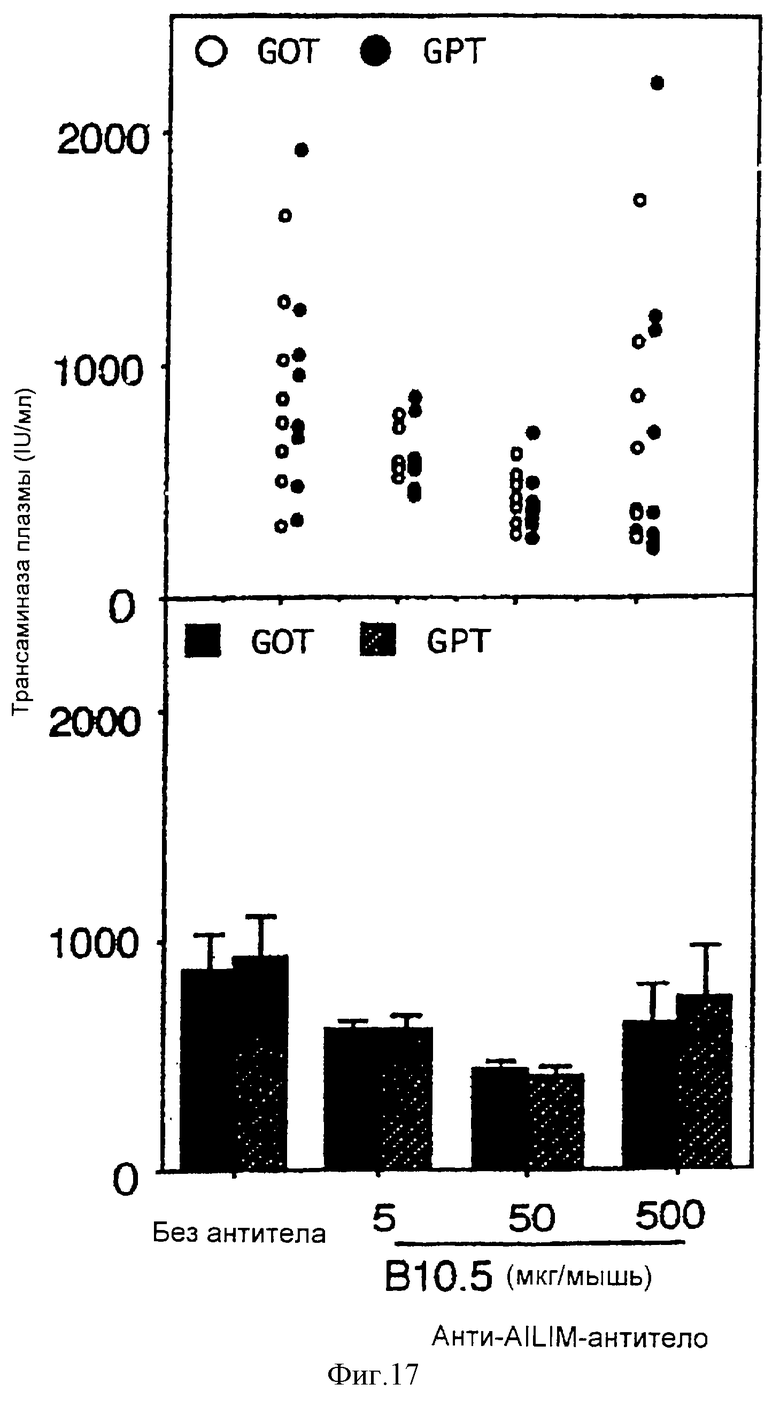
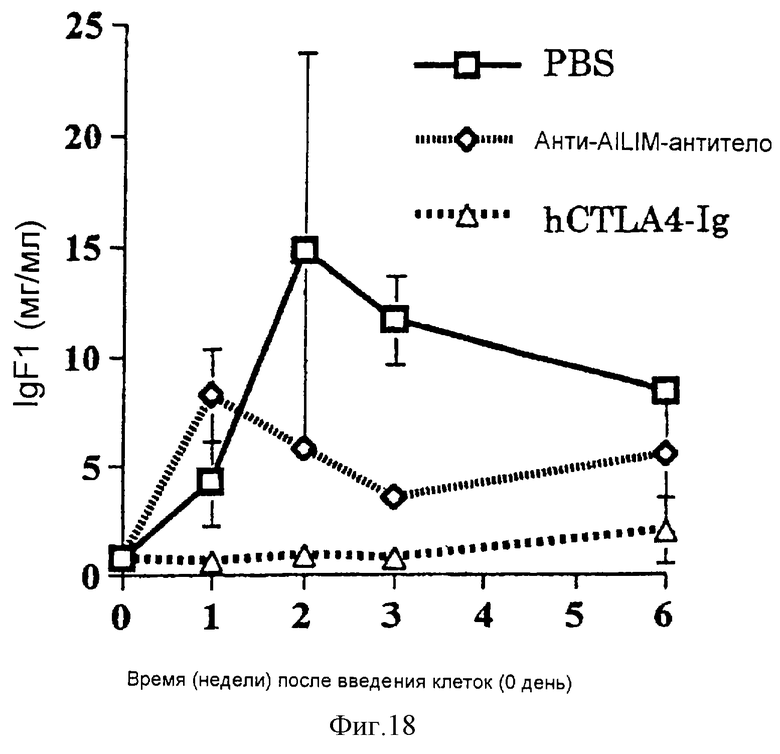
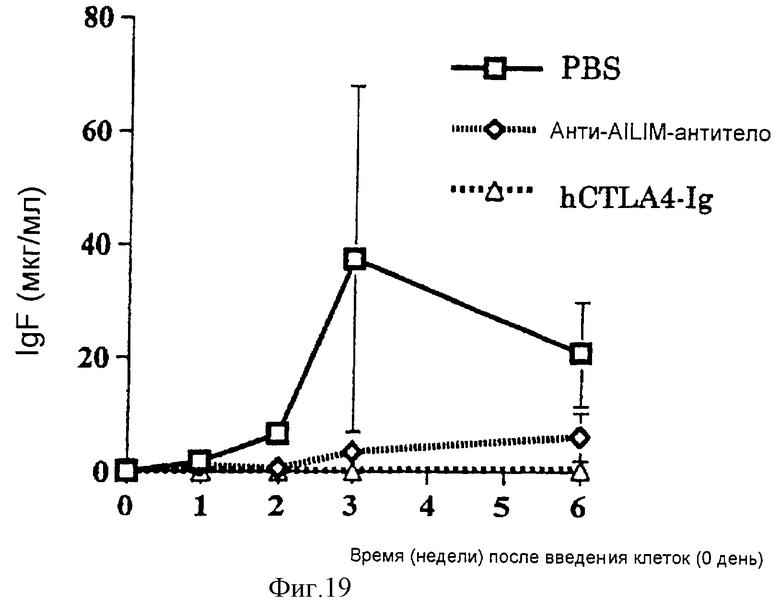
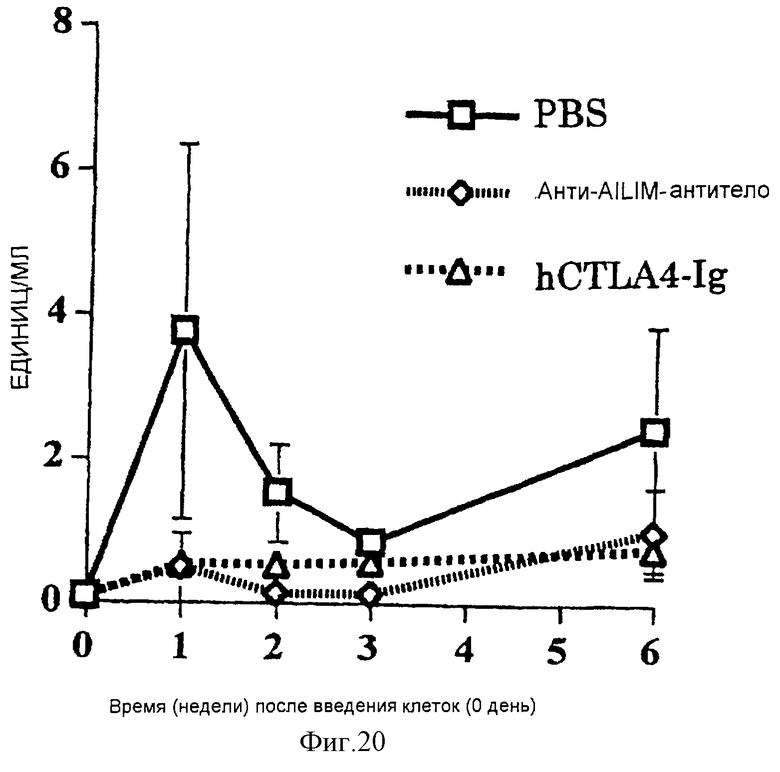
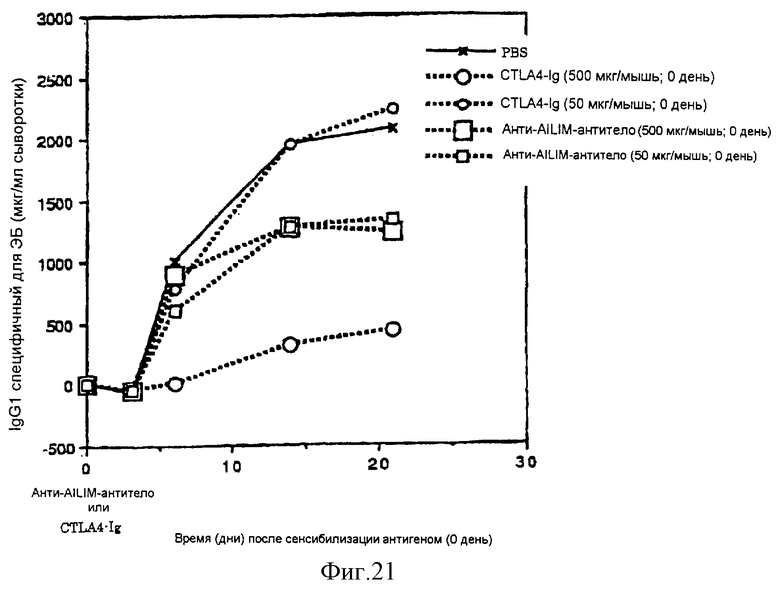
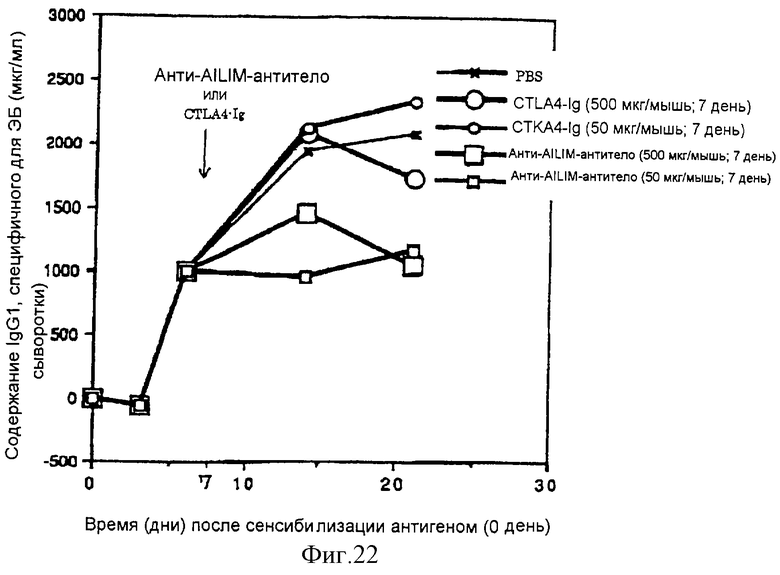
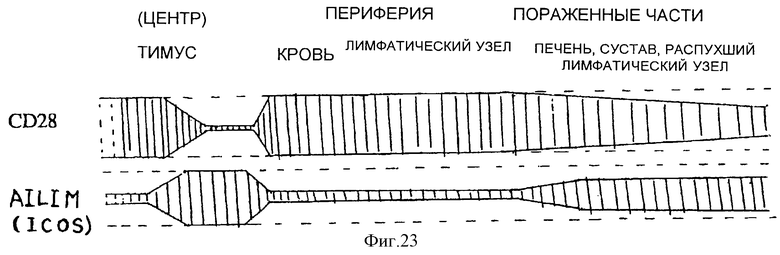
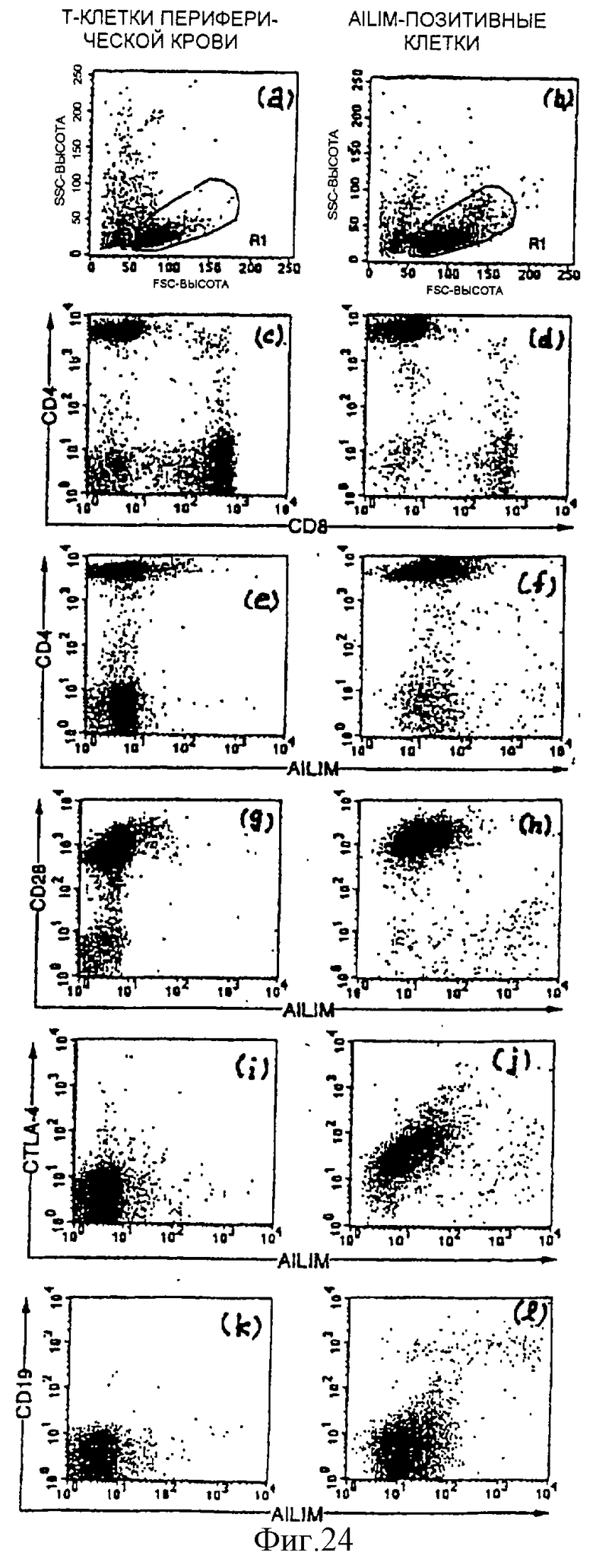
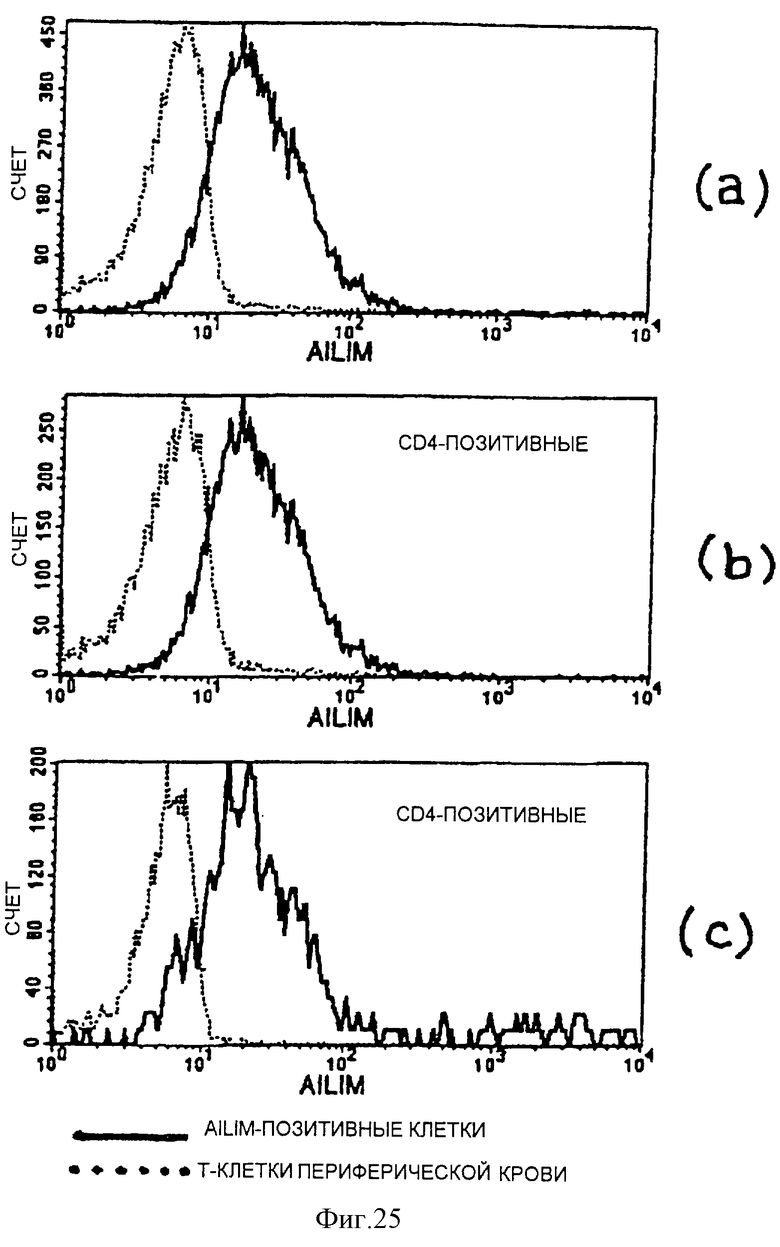
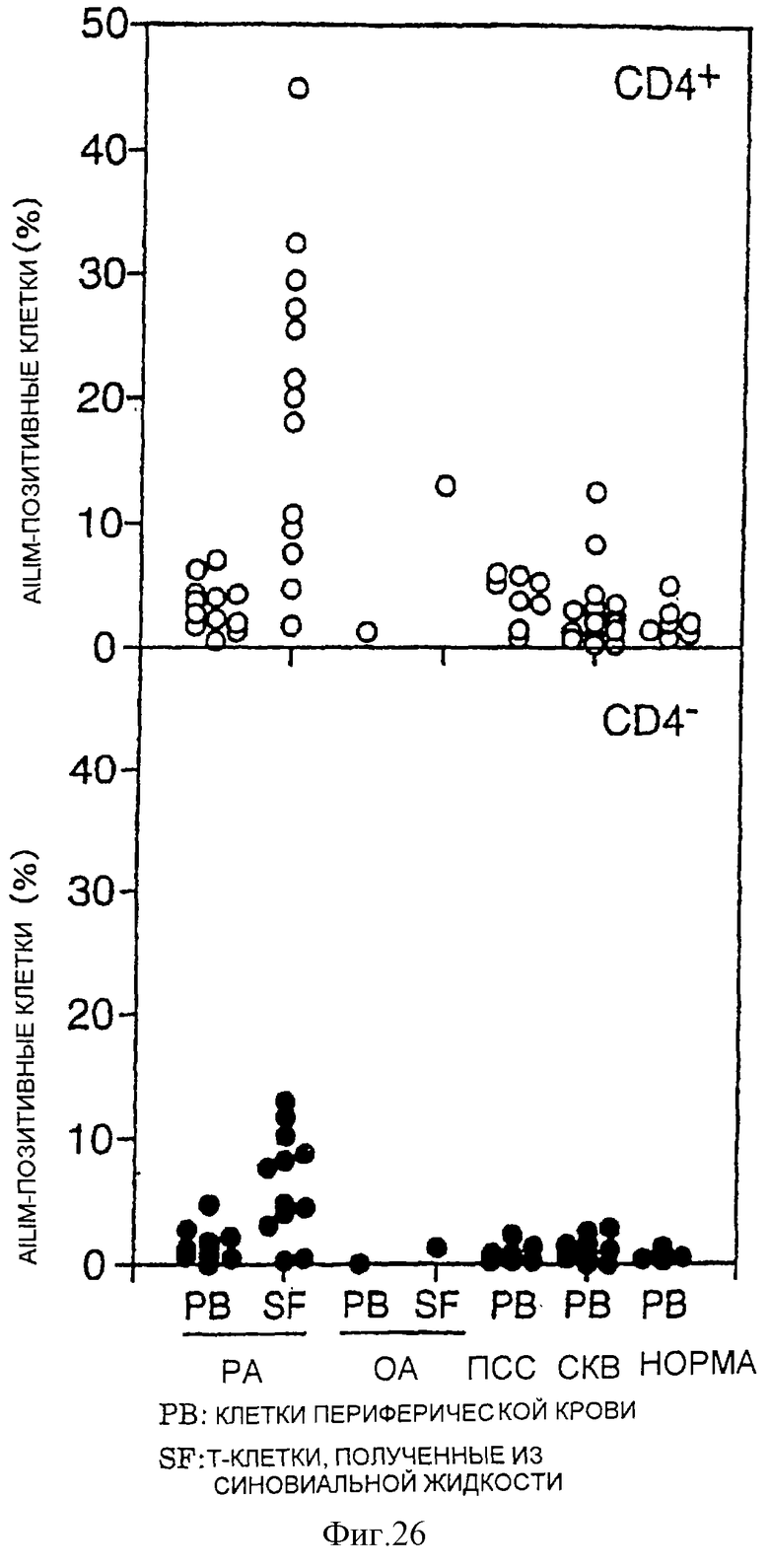
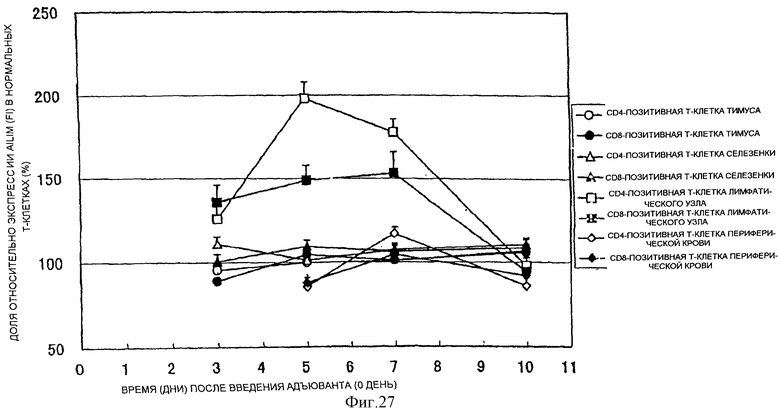
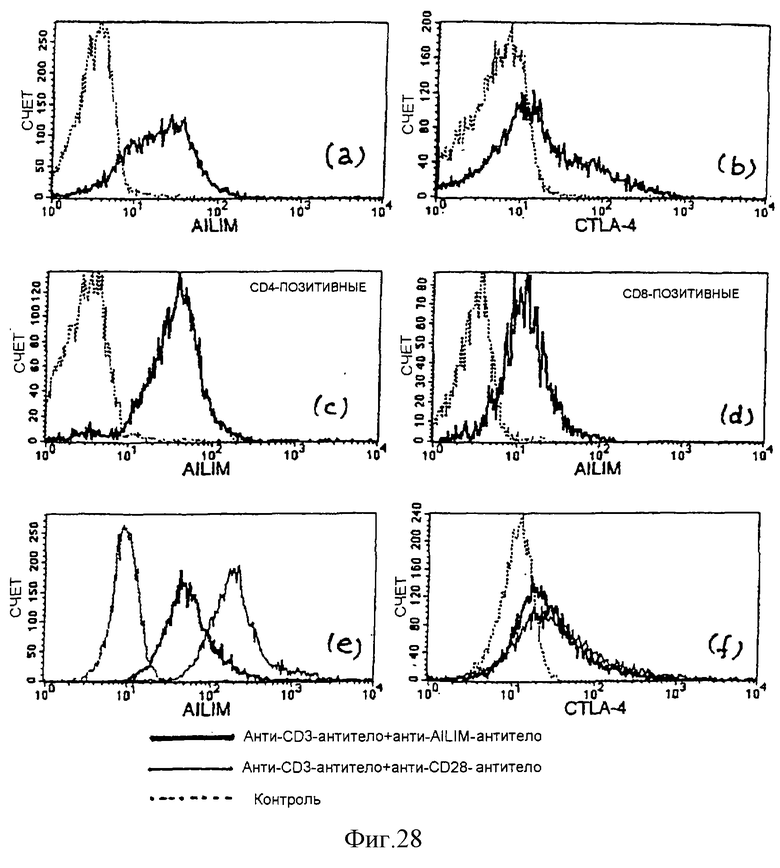
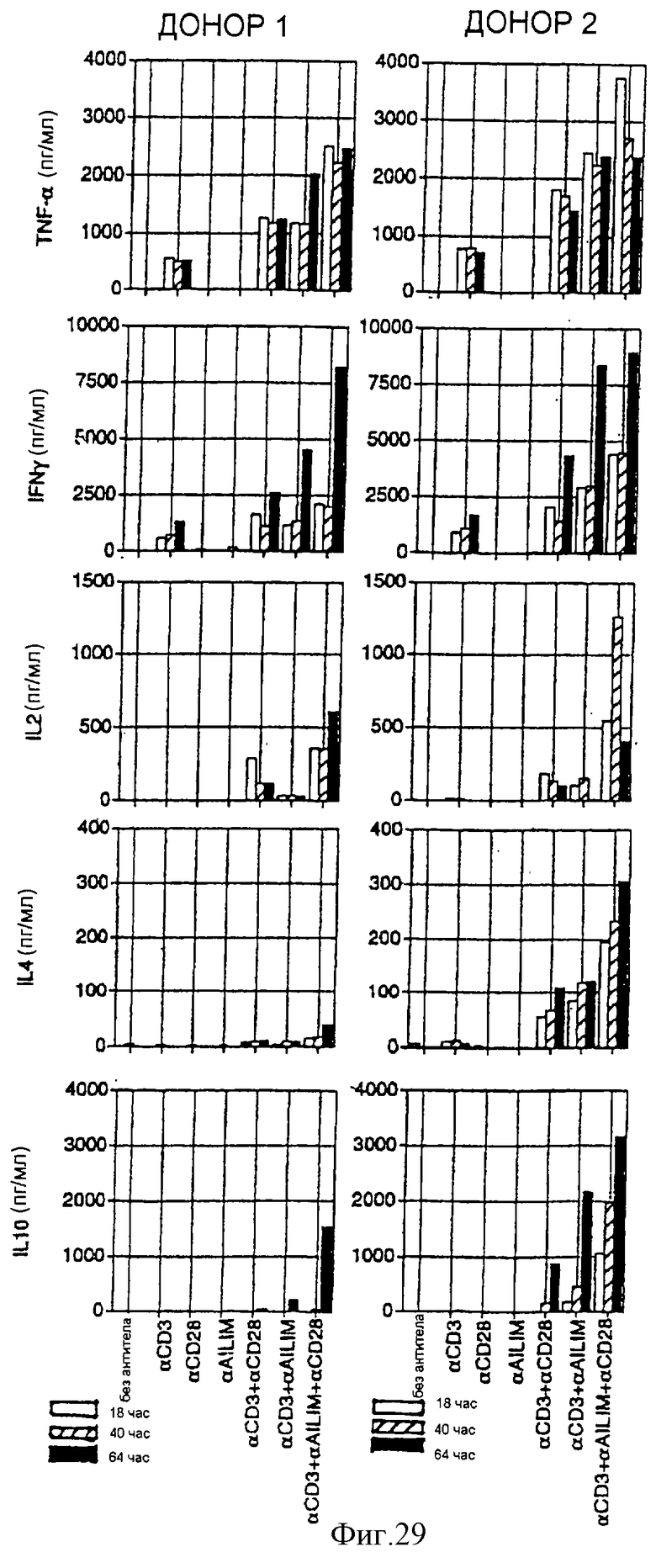
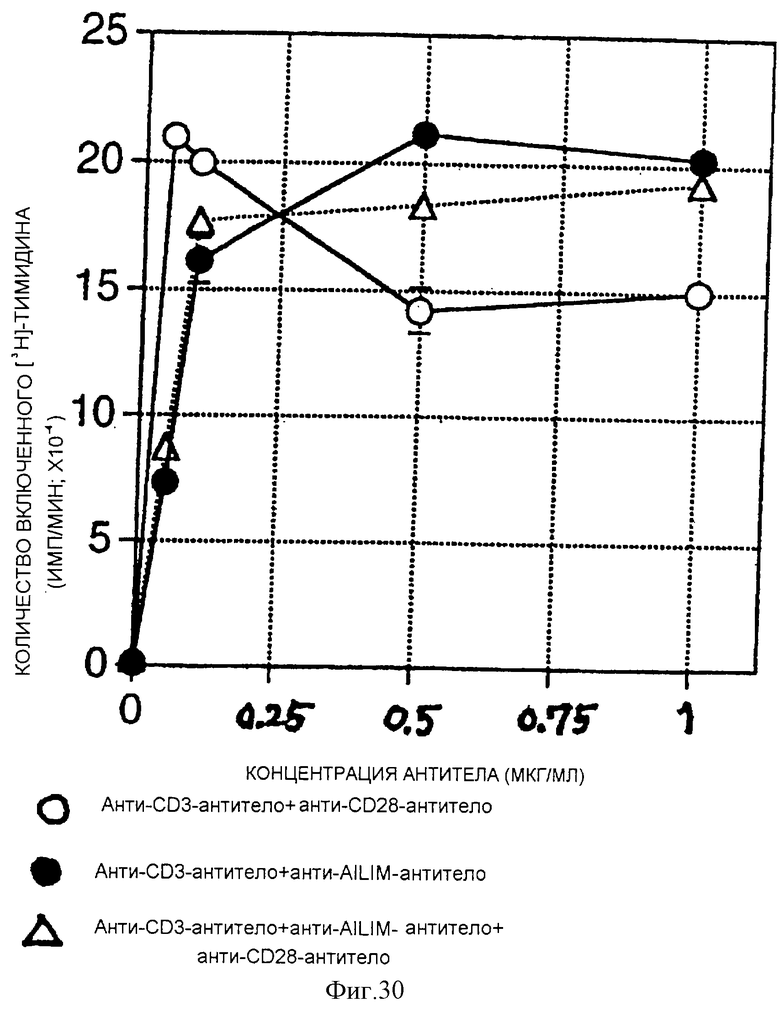
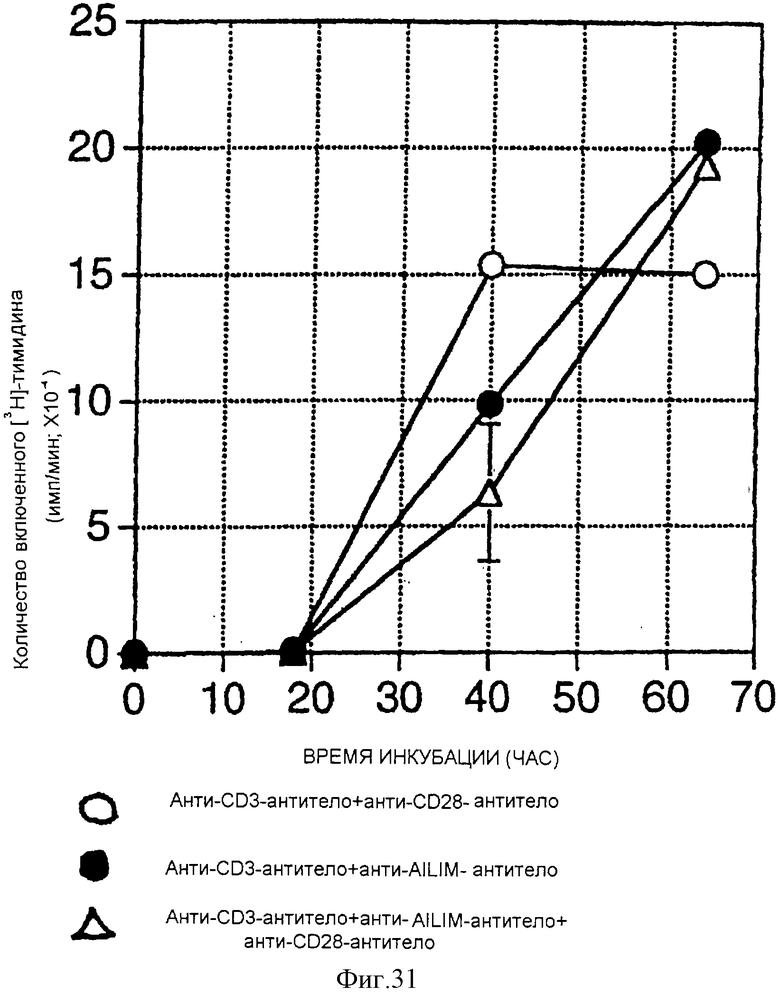
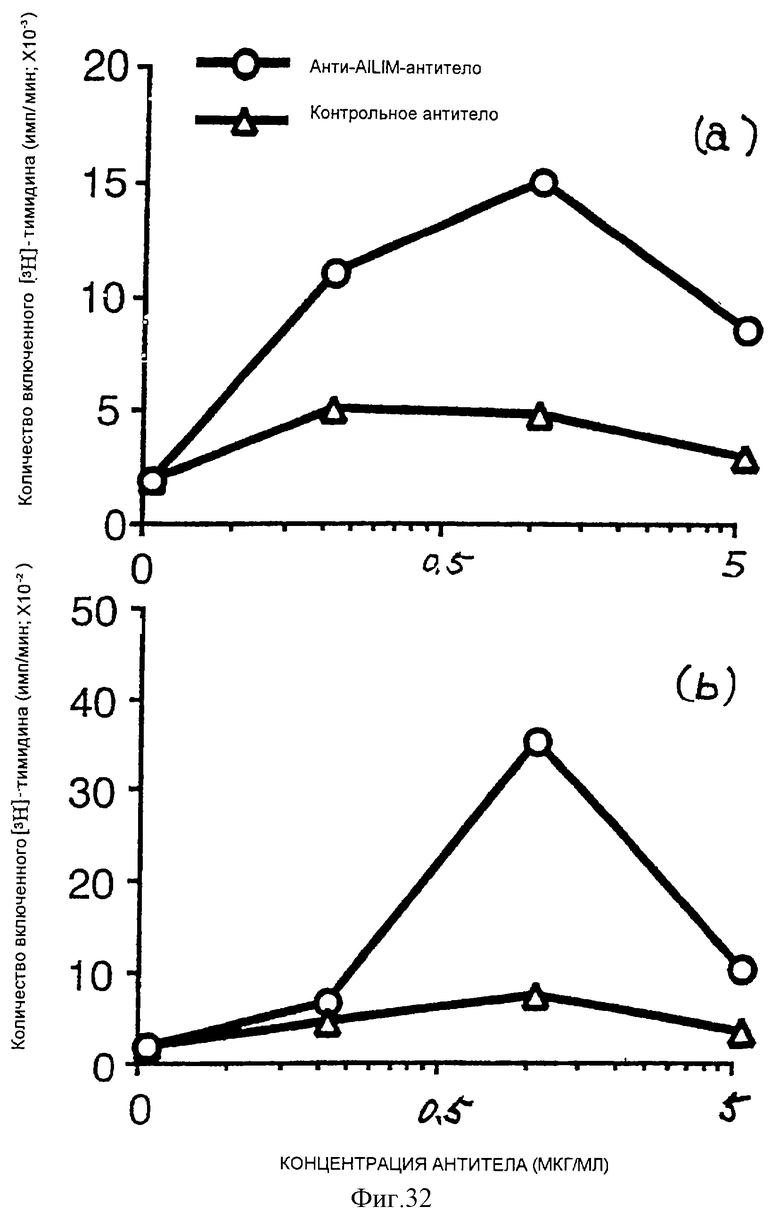
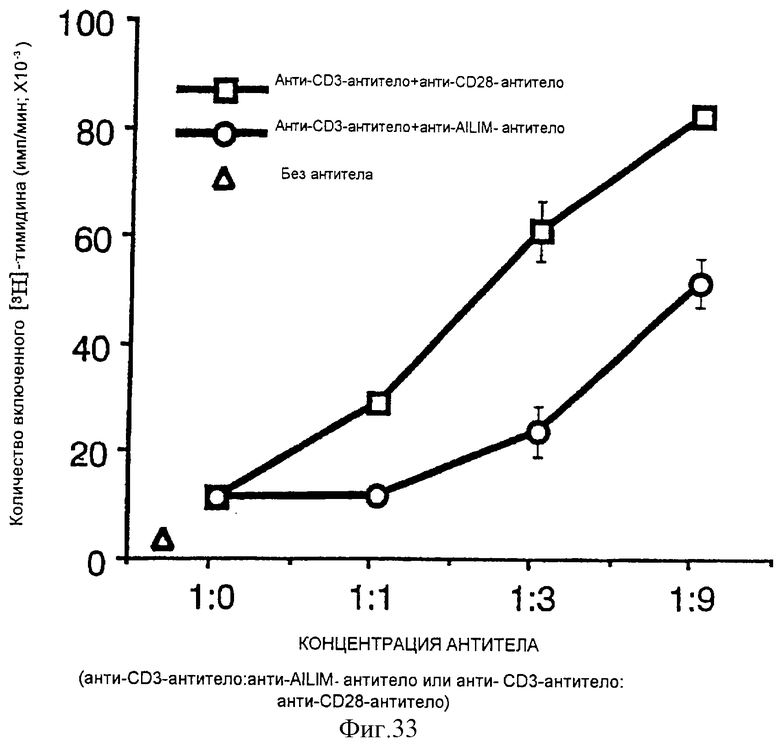
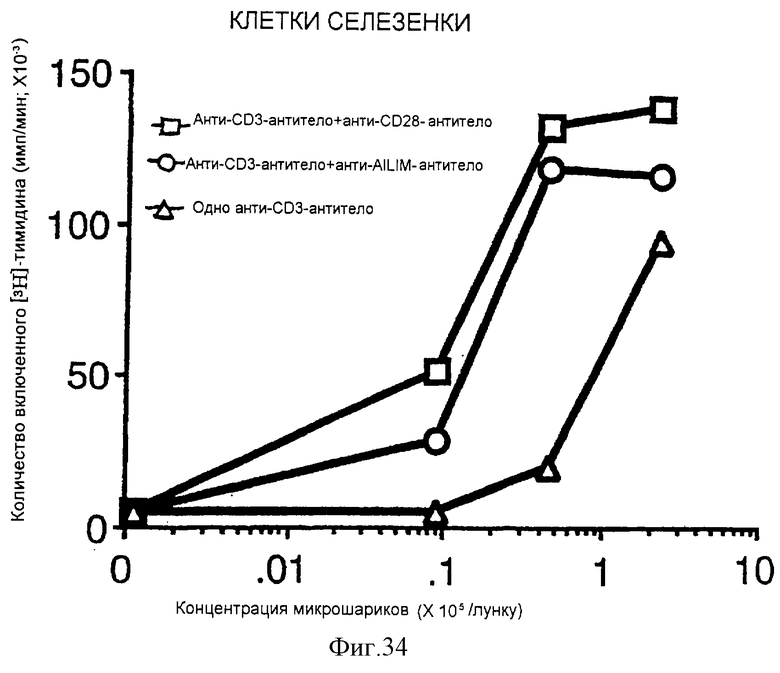
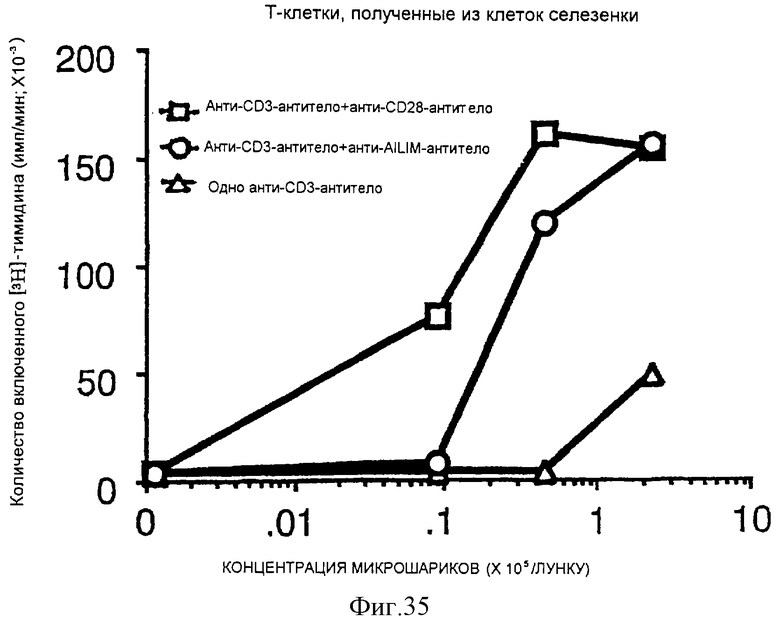
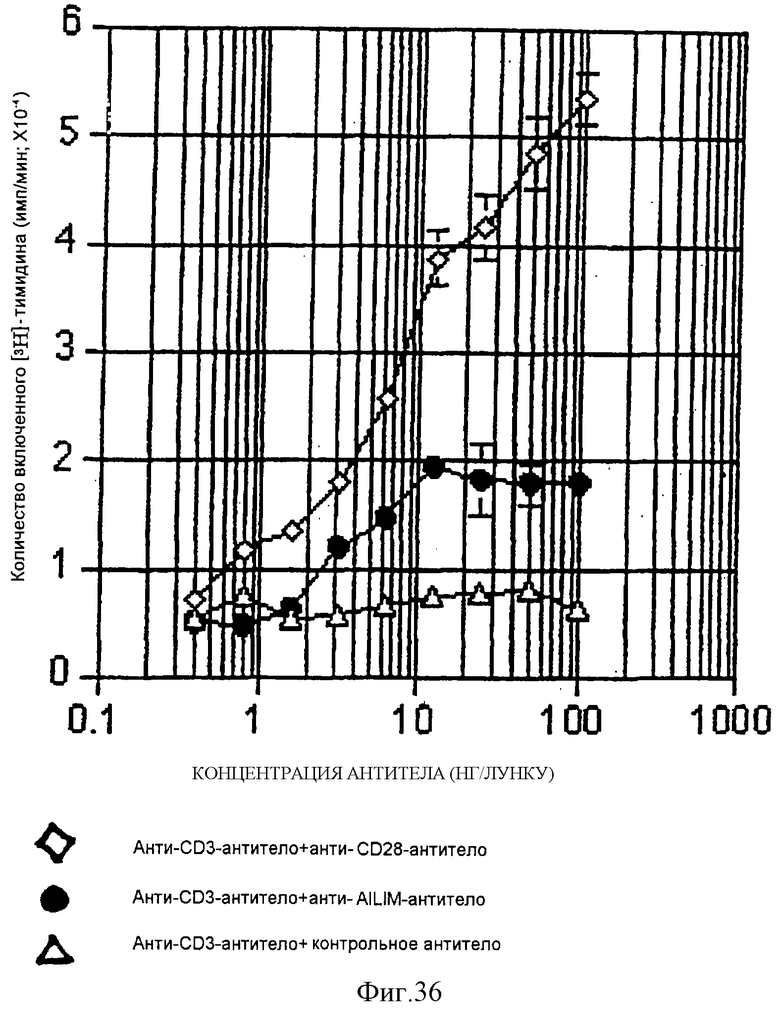
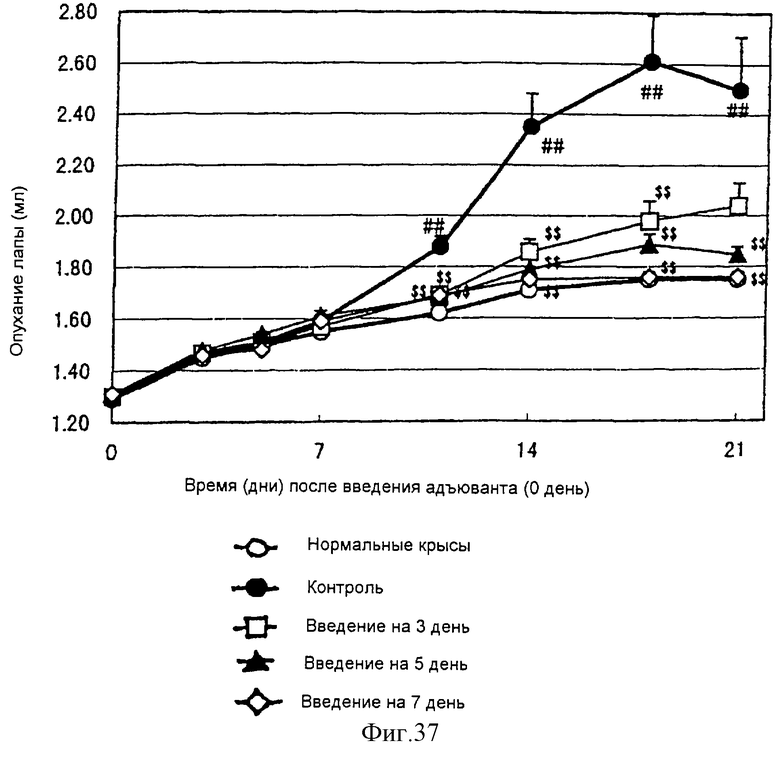
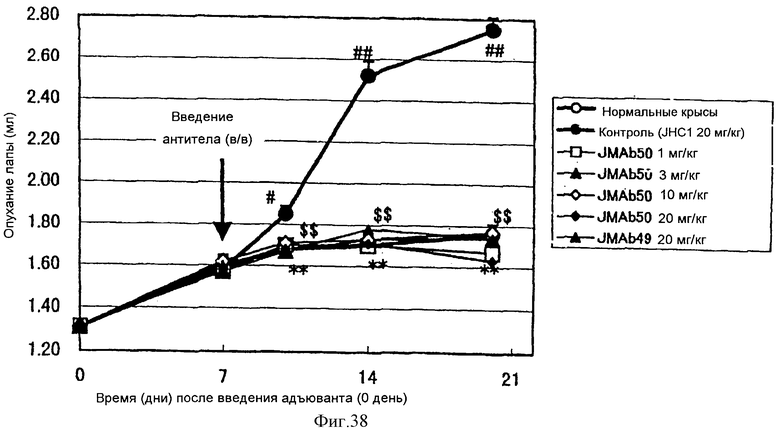
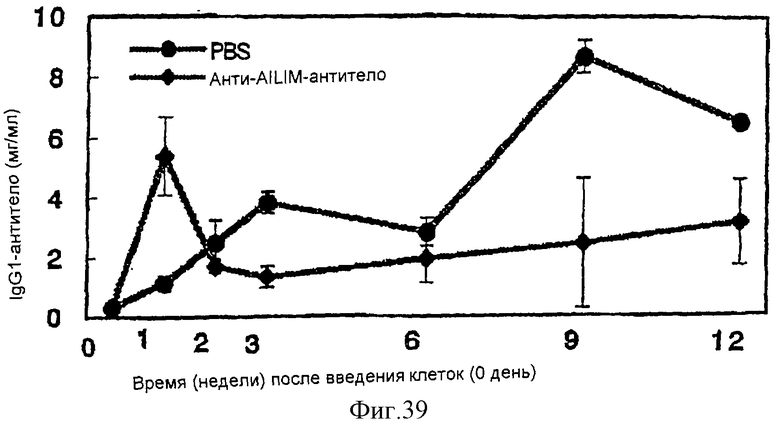
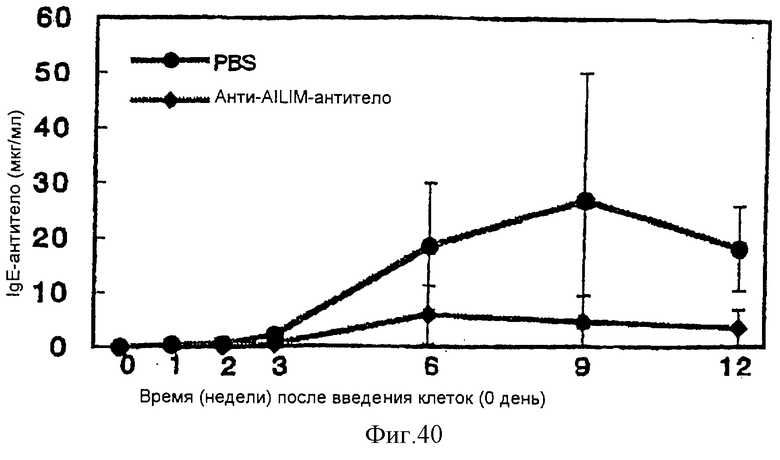
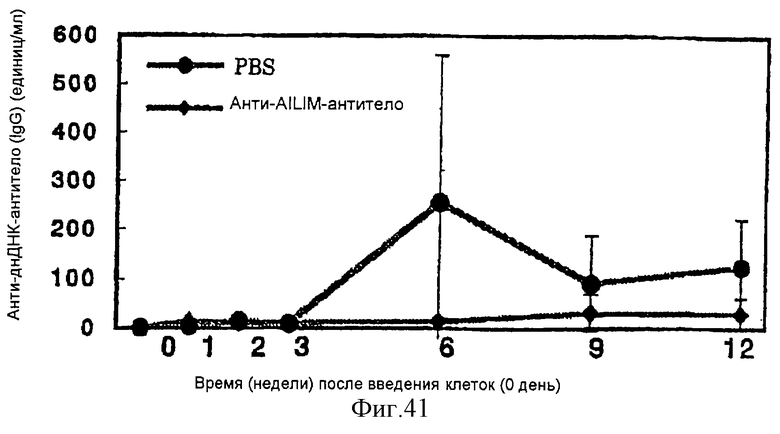
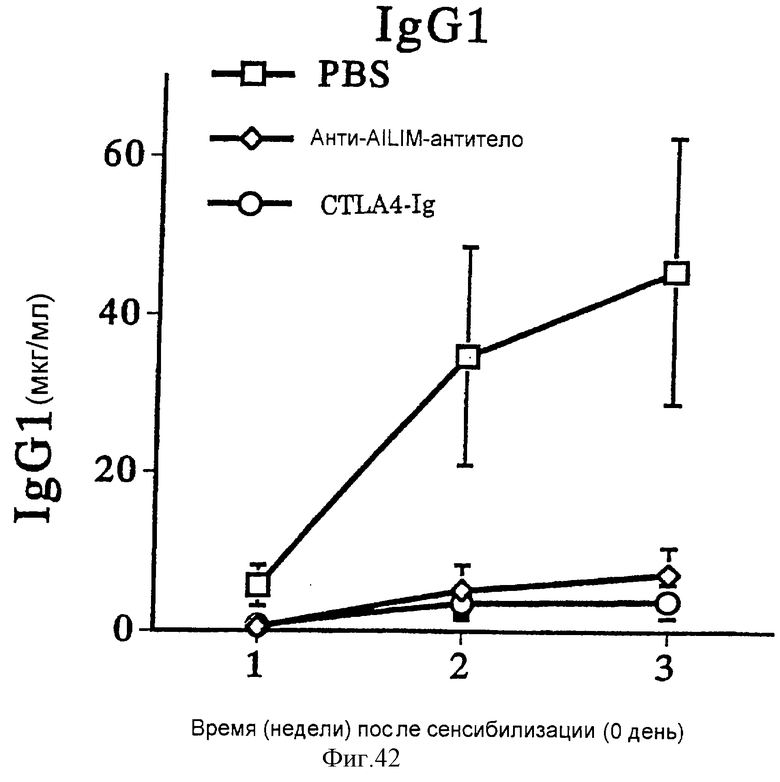
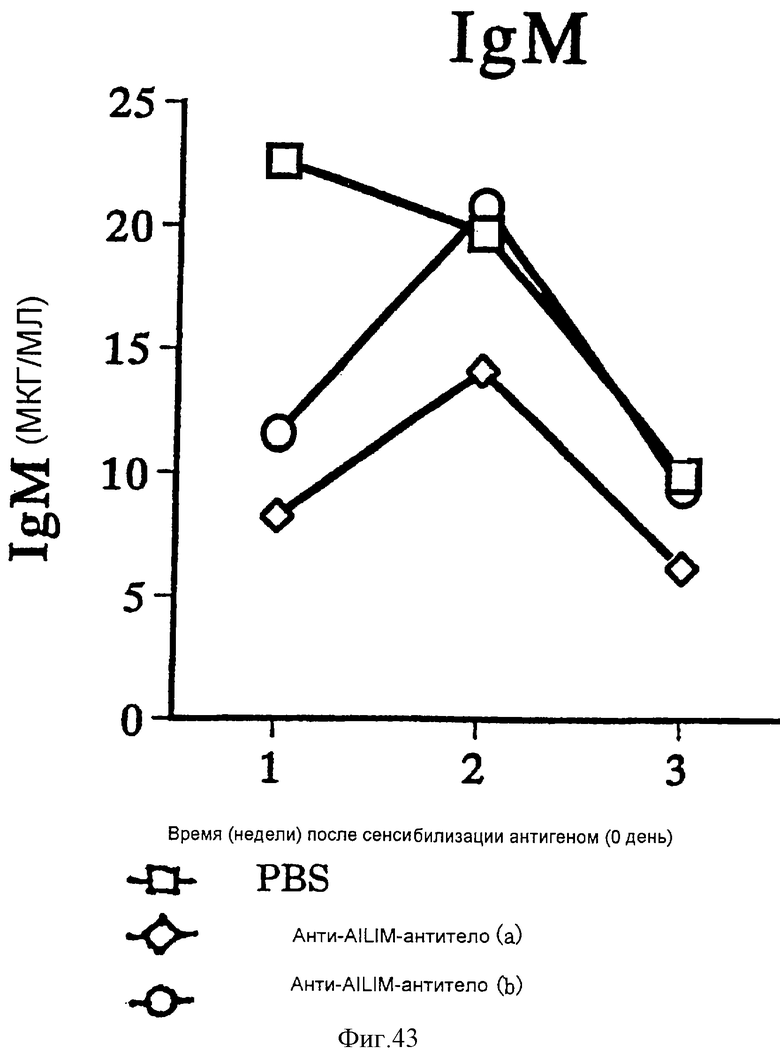
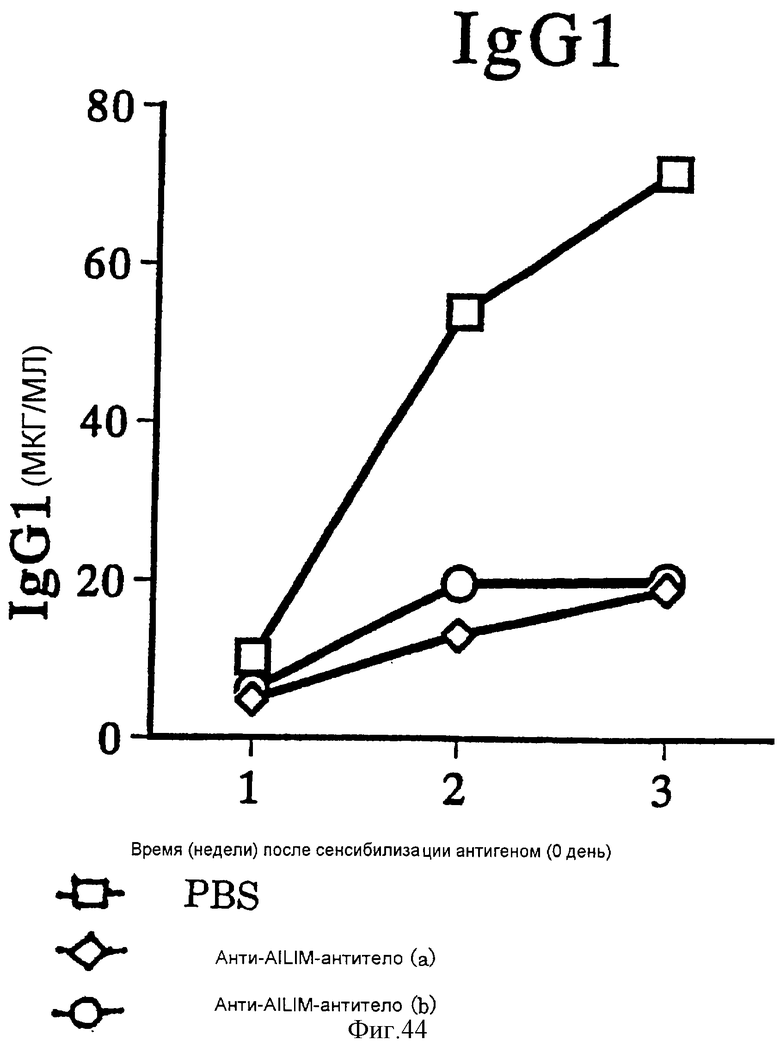
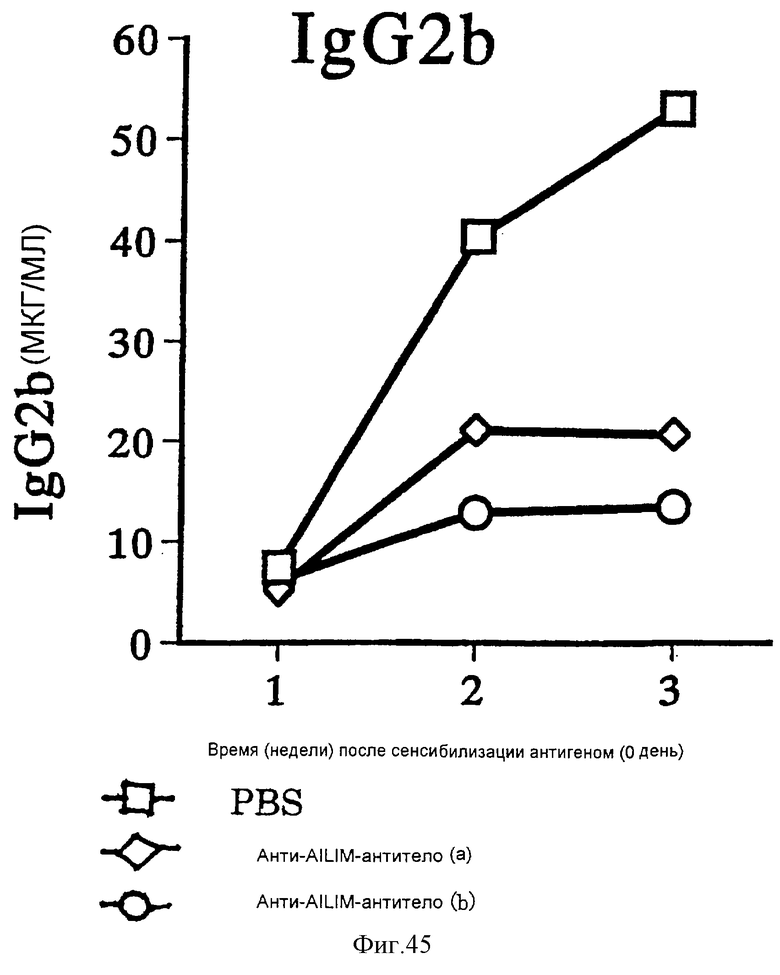
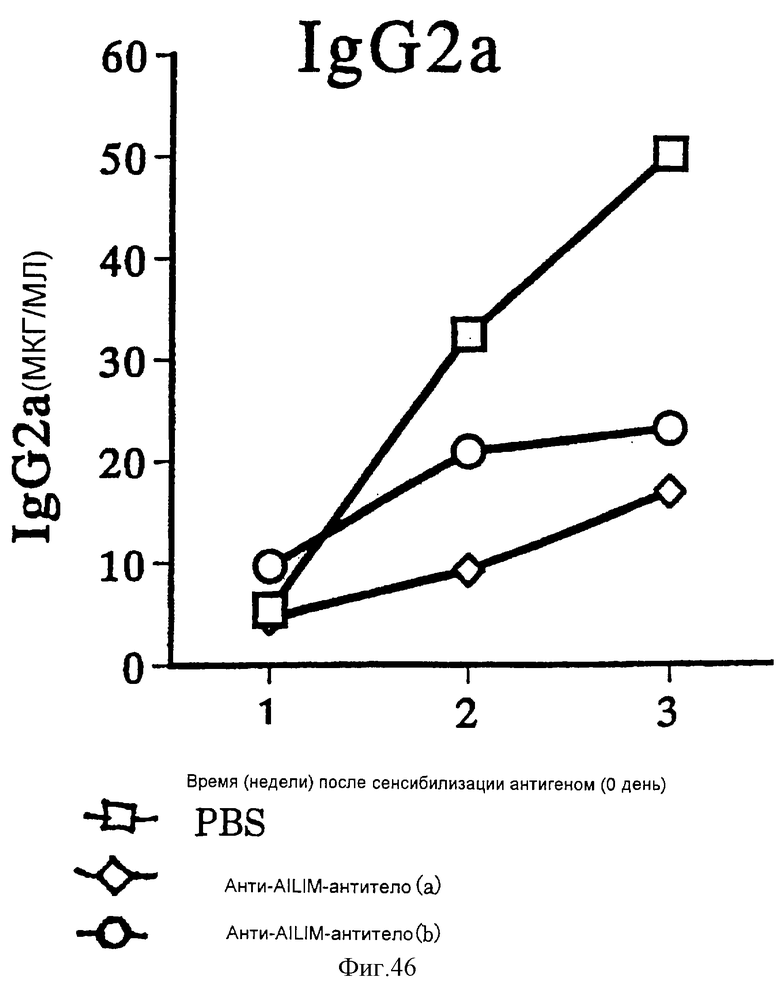
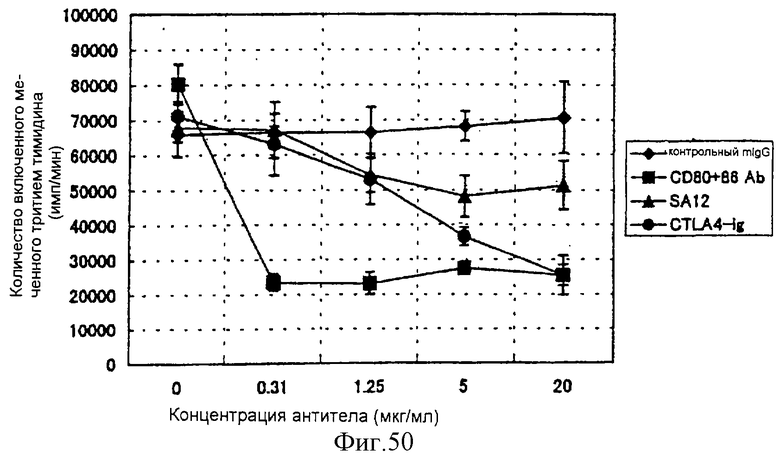
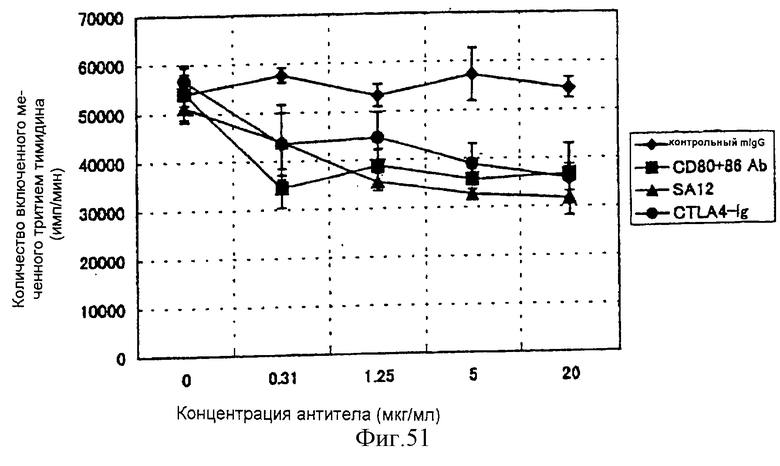
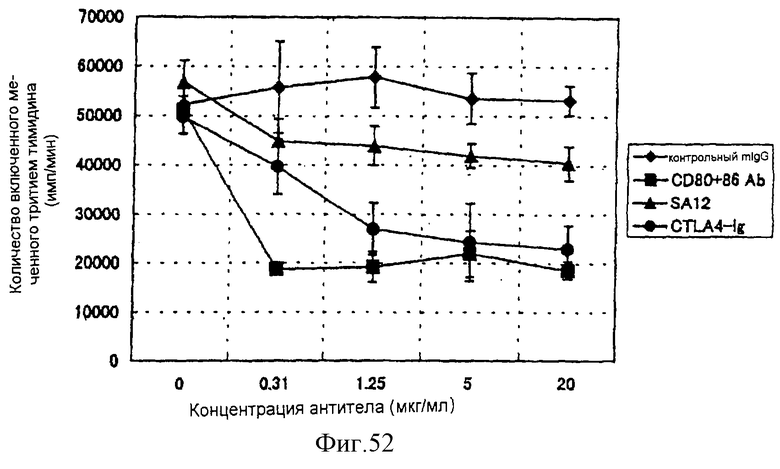
Изобретение относится к медицине. Заявлена композиция, содержащая антитело против AILIM (альтернативно называемой JTT-1-антигеном, JTT-2-антигеном, ICOS и 8F4), которое обладает существенным терапевтическим действием на артроз, например ревматоидный артрит и остеоартрит, болезнь трансплантат против хозяина, иммунное отторжение трансплантата, воспаление (гепатит и воспалительные заболевания кишечника), патологическое состояние, сопровождающееся избыточной продукцией антитела против чужеродного антигена, запускаемой при иммунологической сенсибилизации антигеном. Изобретение обеспечивает получение композиции, не имеющей побочных эффектов. 4 с. и 20 з.п.ф-лы, 52 ил.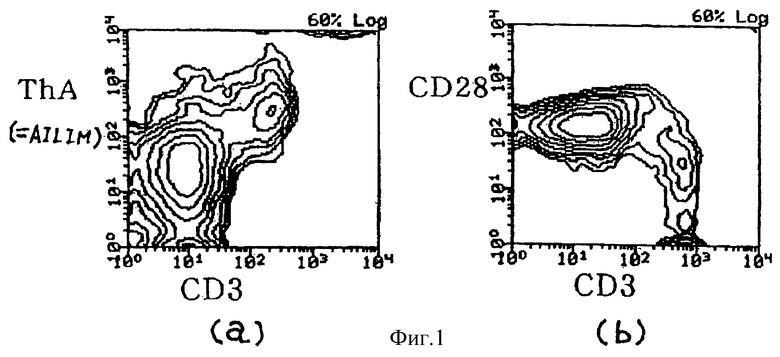
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| RU 97101868 А, 10.05.1999. | |||
Авторы
Даты
2003-05-10—Публикация
2000-08-30—Подача