Изобретение относится к области медицины, а именно к использованию при хирургических вмешательствах, в том числе в сердечно-сосудистой хирургии, где гидрогелевые биорезорбируемые полимерные композиции могут быть использованы самостоятельно в виде пленок в качестве биофизического барьера для уменьшения образования спаек после кардиохирургических операций, для систем с контролируемым выделением биологически активных веществ в качестве покрытия для имплантируемых сосудистых протезов, кардиохирургических заплат, манжет для искусственных клапанов сердца и др. (Мясников А.Д., Липатов В.А. К вопросу о современных принципах профилактики послеоперационного спаечного процесса брюшной полости. Современные подходы науки и практики в хирургии: Материалы межрегиональной конференции, посвященной 70-летию заслуженного деятеля науки РФ, профессора В.И.Булынина.: Сборник. Воронеж, 2002. - С.154-157; Ю.А.Кудрявцева, М.В.Насонова, И.Ю.Журавлева Послеоперационные спайки в кардиохирургии: проблемы и решения. // Патология кровообращения и кардиохирургия. - 2011. - №1. - С.100-104; Рубцов О.Ю. Профилактика спайкообразования в брюшной полости при перитоните (экспериментальное исследование). Автореф. дисс. д.м.н., Саранск.- 2005 г.).
Известны полимерные композиции для предотвращения спаек, состоящие из сшитого коллагена («Cova-CARD»), и не биорезорбируемые композиции из политетрафторэтилена - ПТФЭ («Preclude®») в виде пленок, которые сравнивали между собой и с аутологичным перикардом (Alain Bela, Massimo Riccic, Julie Piquetc, Patrick Brunevald Prevention of postcardiopulmonary bypass pericardial adhesions by a new resorbable collagen membrane // Interact. CardioVasc. Thorac. Surg. 2012. - 14(4). - P.469-473; Hiroyuki Tsukihara, Shinichi Takamoto, Kazuo Kitahori, Kazuhisa Matsuda, Arata Murakami, Richard J. Novick, Yoshihiro Suematsu. Prevention of Postoperative Pericardial Adhesions With a Novel Regenerative Collagen Sheet // Ann. Thorac. Surg. 2006. - №81. - Р.650-657). В опытах на животных через 4 месяца показано, что минимальное образование спаек наблюдалось после применения коллагеновой композиции «Cova-CARD», которая за этот срок полностью резорбировалась.
Недостатком предложенных композиций является отсутствие в их составе биологически активных веществ, которые могли бы усилить положительный эффект.
Известно применение полимерных композиций, состоящих из сшитого коллагена с добавлением, как минимум, одного клеточного компонента, например клеток фибробластов, сосудистых гладкомышечных клеток, с добавлением гликопротеинов и протеогликанов (US №2004018175 (А1), дата публикации 29.01.2004 г.), используемых для уменьшения спаек в виде имплантируемых антиадгезионных заплат.
Недостатком предложенных композиций является технологическая сложность их получения, трудность практической реализации и отсутствие комплекса биологически активных веществ.
Известны полимерные композиции на основе сшитого желатина в виде пленок для уменьшения спаек после хирургических операций (Kei Sakuma, Atsushi Iguchi, Yoshito Ikada, Koichi Tabayashi Closure of the Pericardium Using Synthetic Bioabsorbable Polymers Ann. Thorac. Surg. - 2005. - №80. - P.1835-1840; Goki Matsumura, Toshiharu Shin′oka, Yoshito Ikada, Takahiko Sakamoto, Hiromi Kurosawa. Novel Anti-Adhesive Pericardial Substitute for Multistage Cardiac. Surgery. // Asian. Cardiovasc. Thorac. Ann. - 2008. - №16. - P.309-312) и композиции, включающие желатин в сочетании с полигликолевой кислотой (Ichiro Yoshioka, Yoshikatsu Saiki, Kei Sakuma, Atsushi Iguchi, Takuya Moriya, Yoshito Ikada, Koichi Tabayashi. Bioabsorbable Gelatin Sheets Latticed With Polyglycolic Acid Can Eliminate Pericardial Adhesion. // Ann. Thorac. Surg. - 2007. - №84. - Р.864-870).
Недостатком данных композиций является то, что в их составе отсутствуют биологически активные вещества, что не обеспечивает антикоагулянтный, противовоспалительный, антимикробный и др. эффекты.
Известна полимерная композиция, состоящая из гиалуроновой кислоты и карбоксиметилцеллюлозы «Seprafilm», используемая для предотвращения послеоперационных спаек и выполненная в виде мембраны (Yuji Naito, Toshiharu Shin′oka, Narutoshi Hibino, MD, PhD, Goki Matsumura, Hiromi Kurosawa. A novel method to reduce pericardial adhesion: A combination technique with hyaluronic acid biocompatible membrane // J. Thorac. Cardiovasc. Surg. - 2008. - №135. - Р.850-856).
Также известна полимерная композиция, состоящая из различных эфирных производных гиалуроновой кислоты, выполненная в виде пленок, гелей, сеток, тканого и нетканого полотна на основе этих производных гиалуроновой кислоты и не подвергающихся биорезорбции полимеров (политетрафторэтилена - ПТФЭ, полиэтилена, полипропилена, полиэфира - дакрон (RU №2177332 (А1), дата публикации 27.12.2001 г.).
Недостатками композиций является то, что гиалуроновая кислота сама характеризуется очень быстрым временем адсорбции в организме, которое несопоставимо с временем сохранения, необходимым для предотвращения спаек, она содержит также низкомолекулярные олигомеры, что может отразиться на ее биосовместимости. Кроме того, гиалуроновая кислота трудно подвергается технологической переработке, чтобы из нее создать полимерную композицию в виде пленки (мембраны). Эти технологии многостадийные, сложные. Ограничен набор депонированных биологически активных веществ - вводили только гепарин.
Все вышеперечисленные композиции, использование которых связано с попытками уменьшить образование спаек после хирургических операций, касались индивидуального применения какого-либо одного вида природного полимера, кроме того, не использовался комплекс биологически активных веществ, которые могли бы также оказать влияние на предупреждение спаечного процесса.
Известны полимерные композиции, применяемые в качестве покрытий для имплантируемых сосудистых протезов и кардиохирургических заплат, состоящие из биорезорбируемого полимера - высокоочищенного желатина, антимикробных лекарственных препаратов широкого спектра действия и препаратов антикоагулянтного и антиагрегантного действия (Протезы кровеносных сосудов и кардиохирургические заплаты с тромборезистентными, антимикробными свойствами и нулевой хирургической пористостью. Бокерия Л.А., Новикова С.П. // Бюллетень НЦССХ им. А.В.Бакулева РАМН «Сердечно-сосудистые заболевания». - 2008. - Т.9. - №4. - С.5-20).
Недостатком данных композиций является то, что при их использовании в качестве покрытия для синтетических текстильных имплантируемых медицинских изделий - протезов кровеносных сосудов «БАСЭКС», кардиоваскулярных заплат, в составе композиции в качестве основного компонента используют только желатин и ограниченный спектр введенных в композицию биологически активных веществ, что недостаточно обеспечивает регулируемую биорезорбцию композиций и пролонгированность выделения биологически активных веществ.
Наиболее близким техническим решением, взятым за прототип, является биологически активная полимерная медицинская композиция (RU №2447902 (С2), дата публикации 20.04.2012 г.), состоящая из сополимера 3-гидроксибутирата и 3-гидроксивалерата (3-ПГБ/3-ПГВ) и, по меньшей мере, одного биологически активного вещества, выбранного из группы антибиотиков (гентамицин, тиенам, рифампицин и ванкомицин) или из группы нестероидных противовоспалительных препаратов, состоящей из мелоксикама, диклофенака, ибупрофена и индометацина, а в качестве растворителя используют дихлорметан или хлороформ при следующем соотношении компонентов, мас.%: 3-ПГБ/3-ПГВ - 1-6; биологически активное вещество 1-5; растворитель - остальное. Также в композиции используются поверхностно-активное вещество - поливиниловый спирт или полиоксиэтилен-20-сорбит моноолеат, также - полиэтиленгликоль (1-20) и желатин (1-6). Композиция выполнена в виде микрочастиц, пленок или мембран. Композиция предназначена для депонирования и доставки лекарственных средств, в качестве покрытий медицинских устройств, самостоятельных пленочных изделий (как противоспаечное средство в качестве барьера), матрикса для культивирования клеток.
Недостатки композиции:
1) ПГБ и его сополимеры очень медленно резорбируются в организме, поэтому из них трудно получить пленочные композиции с заданными, в т.ч. короткими, сроками рассасывания, а длительное пребывание инородного материала в организме нежелательно.
2) Гидрофобность данной композиции, несмотря на добавки гидрофильных компонентов, мешает выделению лекарств, скорость выделения лекарственных веществ слишком низкая, из-за этого композиции с антимикробными препаратами имеют маленькую антимикробную активность - зона лизиса - 2-8 мм.
3) ПГБ - высококристаллический полимер, поэтому пленки на его основе жесткие, эластичность очень низкая, что снижает технологические возможности при использовании.
4) В качестве биологически активных веществ использованы препараты узкого спектра назначения - только антибиотики или противовоспалительные вещества, нет антикоагулянтов, антиоксидантов, антиагрегантов, антиадгезионных веществ.
5) Способность ПГБ и его сополимеров растворяться только в органических растворителях приводит к использованию нескольких химических реагентов на разных технологических стадиях (дихлорметан или хлороформ, гексан или изопропанол), что усложняет стадии очистки.
6) Полимерные композиции на основе ПГБ имеют плохую адгезию к подложкам, например, к полимерам, что значительно усложняет использование этих композиций.
Техническим результатом предлагаемого изобретения является создание биорезорбируемых гидрогелевых полимерных композиций с биологически активными веществами, с регулируемыми сроками биорезорбции, пролонгированными сроками выделения биологически активных веществ, с биосовместимыми и тромборезистентными свойствами, повышенной антимикробностью, улучшенными механическими характеристиками - повышенной мягкостью и эластичностью.
Технический результат достигается тем, что:
- в биорезорбируемых гидрогелевых полимерных композициях, включающих природные полимеры, биологически активные вещества, растворитель и пластификатор, в качестве полимеров используют сшитые биорезорбируемые полимеры или их смеси, в качестве которых используют белки - желатин, полисахариды - хитозан и его производные, полиэфиры - полигидроксибутират, а в качестве биологически активных веществ или их смесей используют антиоксиданты, и/или антикоагулянты, и/или антиагреганты, и/или нестероидные противовоспалительные вещества, и/или антимикробные препараты, причем в качестве антиоксидантов используют пептиды - L-карнозин, в качестве антикоагулянтов - гепарин, в качестве антиагрегантов - дипиридамол, ацетилсалициловую кислоту, в качестве нестероидных противовоспалительных веществ - ацетилсалициловую кислоту, в качестве антимикробных препаратов - ципрофлоксацин, метронидазол;
- количество биологически активных веществ в предложенных композициях выбраны следующие: для композиции на основе желатина: 1-2 мас.%, для композиции на основе хитозана: 4-8 мас.%, для композиции на основе хитозана и желатина: 4-8 мас.%, для композиции на основе хитозана и полигидроксибутирата: 4-8 мас.%;
- суммарное количество полимеров или их смесей с биологически активными веществами должно быть таковым, чтобы механическая прочность пленки была не менее 1,2 МПа, относительное удлинение - не более 160%, модуль упругости - 0,4-5 МПа;
- при совместном использовании хитозана и желатина желатина в композиции должно быть не менее 20%;
- при совместном использовании хитозана и полигидроксибутирата полигидроксибутирата в композиции должно быть не более 30%;
- в качестве сшивающего агента может быть использован природный сшивающий агент из класса гликозидов - генипин;
- для получения композиций, при совместном использовании хитозана и желатина, в качестве растворителя используют воду. Получение полимерных композиций заключается в следующем.
1. Готовят растворы полимеров
Раствор желатина: 5-10 мас.% раствор желатина с молекулярной массой 60-80 кДа в дистиллированной воде.
Раствор хитозана: 3-6 мас.% раствор хитозана с молекулярной массой 200-300 кДа в 1-3 мас.% уксусной кислоте.
Смесь растворов хитозана и желатина: в 3-6 мас.% раствор хитозана с молекулярной массой 200-300 кДа в 1-3 мас.% уксусной кислоте добавляют желатин не менее 20% от массы хитозана.
Смесь растворов хитозана и полигидроксибутирата: в 3-6 мас.% раствор хитозана с молекулярной массой 200-300 кДа в 1-3 мас.% уксусной кислоте добавляют 0,5-1,5 мас.% р-р ПГБ в хлороформе.
Композиции с сочетанием полимеров желатина и полигидроксибутирата не рассматривали, т.к. приготовление смеси их растворов связано с технологическими трудностями. При приготовлении смеси растворов желатина и полигидроксибутирата происходит сильное пенообразование, если желатина в смеси присутствует более 60-70 мас.%, в результате полимерная композиция в виде пленки получается непрочная. Если желатина в смеси менее 50-60%, пенообразование - минимальное, но пленочная композиция получается жесткая, сроки гидролитической деструкции будут очень длительные.
2. Полимерные композиции получают методом полива из растворов на различную подложку (полиэтилен, полипропилен, стекло).
3. Высушивают полимерные композиции при температуре не выше 30°С в течение 3-5 дней.
4. Для перевода в водонерастворимое состояние полимерные композиции обрабатывают растворами сшивающих агентов (глутарового альдегида или генипина) или подвергают термообработке.
5. Биологически активные вещества в композиции вводят или на стадии приготовления раствора полимера или после перевода полимерной композиции в водонерастворимое состояние - путем хемосорбции.
6. В полимерные композиции вводят пластификатор - глицерин.
Полимерные композиции на основе желатина обладают эластичностью, мягкостью при достаточной для гидрогелевых структур прочности, регулируемой скоростью гидролитической деструкции, которая определяется толщиной пленки, составом и количеством введенных биологически активных веществ, степенью сшивки. Природный сшивающий агент - генипин менее токсичен, чем синтетический - глутаровый альдегид. Желатин обладает способностью образовывать термолабильные студни, что позволяет применять композиции на его основе в качестве покрытий для текстильной основы протезов кровеносных сосудов, кардиохирургических заплат.
Полимерные композиции на основе хитозана более прочные, чем композиции на основе желатина, но менее эластичные. Сшивка проводится термообработкой, без использования химических реагентов. Биологически активные вещества вводят как в раствор полимера, так и хемосорбцией в готовые пленки. Хитозан обладает бактериостатическими свойствами - не является питательной средой для патогенных микроорганизмов. Хитозановые композиции меньше подвержены гидролитической деструкции, набухание в 3 раза меньше, выделение биологически активных веществ происходит медленнее, чем у пленок из желатина.
Хитозан и желатин относятся к разным классам полимеров и имеют различную структуру, хитозан - полисахарид, а желатин - белок. Сочетание этих полимеров позволило усилить положительные свойства каждого: увеличить депонирование биологически активных веществ и срок биорезорбции за счет добавления в композицию хитозана, увеличить гидрофильность и совместимость с различными биологически активными веществами, улучшить механические свойства (мягкость, эластичность) за счет добавления в композицию желатина.
В случае применения композиций в качестве покрытия текстильной основы - протезов кровеносных сосудов, кардиохирургических заплат, желатина в композиции должно быть не менее 20 мас.%, так как при меньшем содержании желатина студнеобразующие свойства композиции нарушаются.
Сочетание хитозана с желатином позволило переводить композиции в водонерастворимое состояние термообработкой, т.е. без использования химических сшивающих реагентов.
Полимерные композиции на основе поли-3-гироксибутирата (ПГБ) в виде пленок получают из растворов в хлороформе. Они жесткие из-за высокой степени кристалличности, вводить биологически активные вещества можно только в исходный раствор полимера. ПГБ является гидрофобным, слабо набухающим полимером и имеет уменьшенную скорость выделения лекарственных веществ, что обеспечивает их выделение в отдаленные сроки. Выделение биологически активных веществ из композиции на основе полигидроксибутирата очень медленное, не обеспечиваются терапевтически значимые концентрации биологически активных веществ. Скорость биорезорбции очень низкая, поэтому полимер, как инородный материал, находится в организме долго.
Сочетание полиэфира - поли-3-гидроксибутирата (ПГБ) с полисахаридом - хитозаном - позволило при необходимости обеспечить увеличенное депонирование биологически активных веществ (по сравнению с хитозановыми композициями). Набухающий гидрогелевый слой хитозана обеспечивает выделение необходимых первоначальных терапевтических количеств биологически активных веществ с большей скоростью на начальных сроках, а введение полигидроксибутирата в композицию позволило увеличить сроки выделения биологически активных веществ в 1,5 раза. Содержание полигидроксибутирата в композиции не должно превышать 30 мас.%, что обусловлено совместимостью полимеров в композиции. Так как полигидроксибутират является гидрофобным полимером, а хитозан - гидрофильным, то значительное фазовое разделение композиции наблюдается уже при содержании полигидроксибутирата более 30 мас.% и это отрицательно влияет на механические свойства композиции. Сущность изобретения поясняется иллюстрациями.
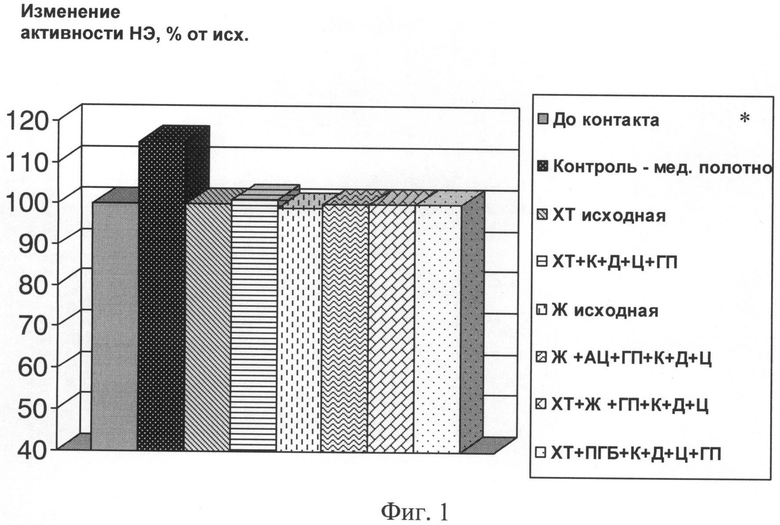
Фиг.1. Изменение активности нейтрофильной эластазы (НЭ) после контакта с пленочными композициями
(V крови = 2 мл, S образца = 1 см2, h (толщина пленки) = 60-90 мкм; время контакта с кровью = 60 мин, контроль-медицинское полотно)
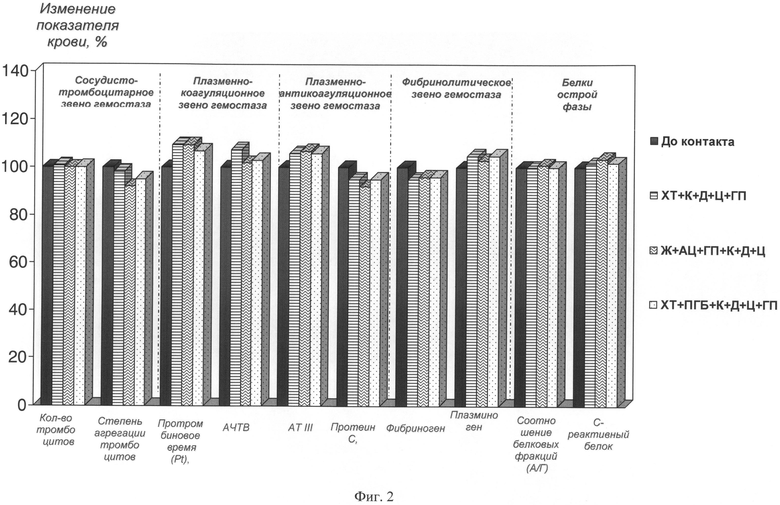
Фиг.2. Показатели крови после контакта с разработанными композициями (V крови = 2 мл, S образца = 1 см2, h (толщина пленки) = 60-90 мкм;
Время контакта с кровью=60 мин)
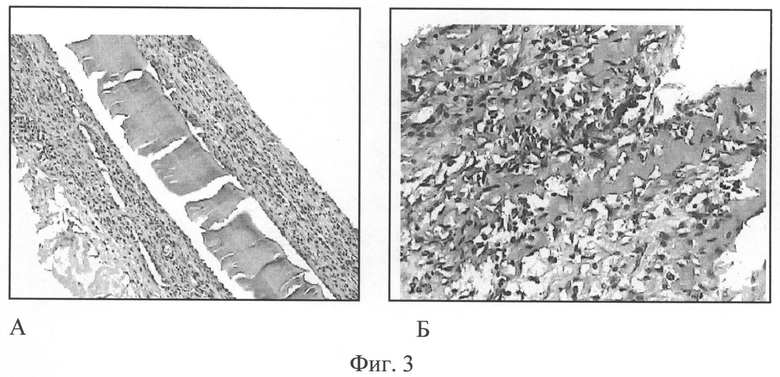
Фиг.3. Композиции в виде пленок на основе хитозана без биологически активных веществ через 1 неделю после имплантации (А), через 2 недели (Б). Окраска гематоксилином и эозином, увеличение 200.
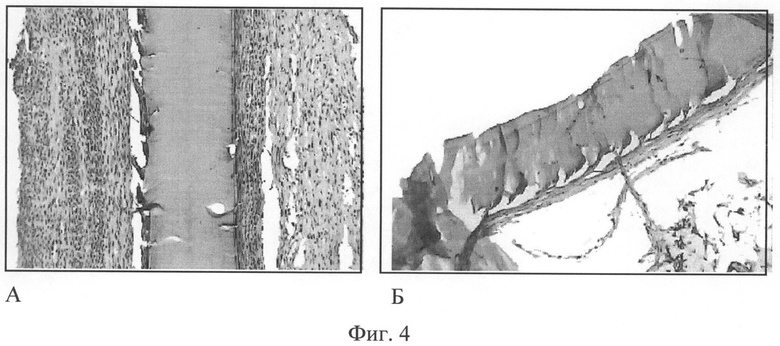
Фиг.4. Композиции в виде пленок на основе хитозана с биологически активными веществами (К, Д, Ц, ГП) через 1 неделю после имплантации (А), увеличение 200, через 2 недели (Б), увеличение 400. Окраска гематоксилином и эозином.
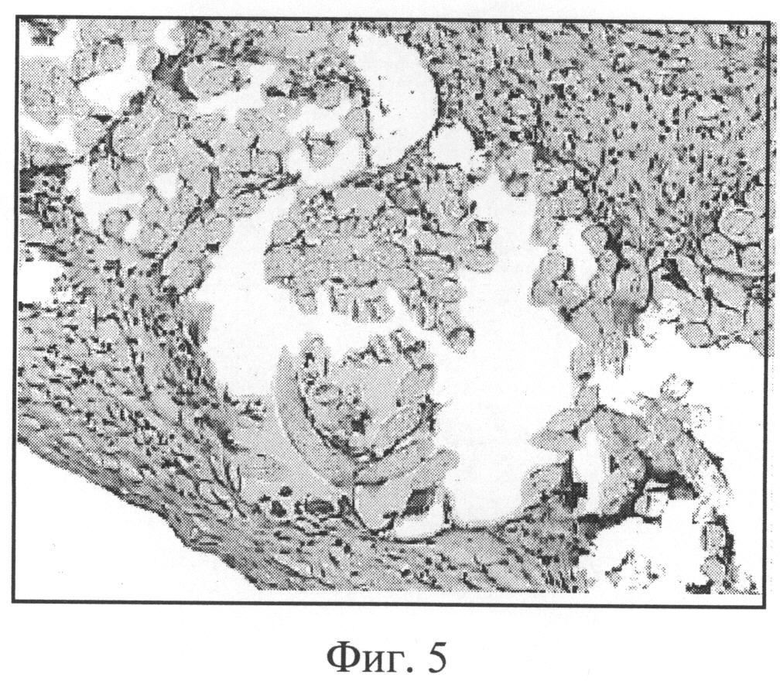
Фиг.5. Лавсановое медицинское полотно с покрытием из желатиновой композиции с биологически активными веществами (АЦ, К, Д, Ц, ГП) 1 неделя после имплантации. Окраска гематоксилином и эозином, увеличение 200.
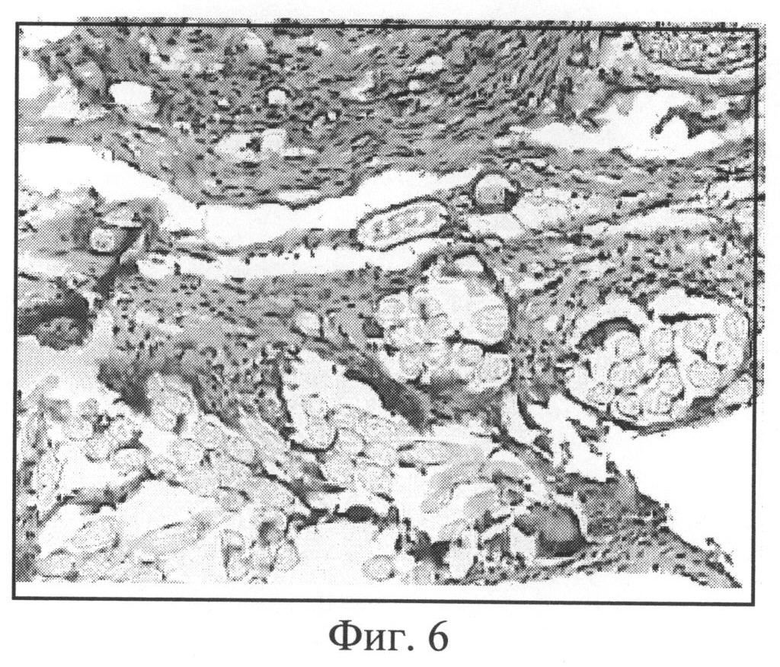
Фиг.6. Лавсановое медицинское полотно с покрытием из желатиновой композиции с биологически активными веществами (АЦ, К, Д, Ц, ГП) 2 недели после имплантации. Окраска гематоксилином и эозином, увеличение 200.
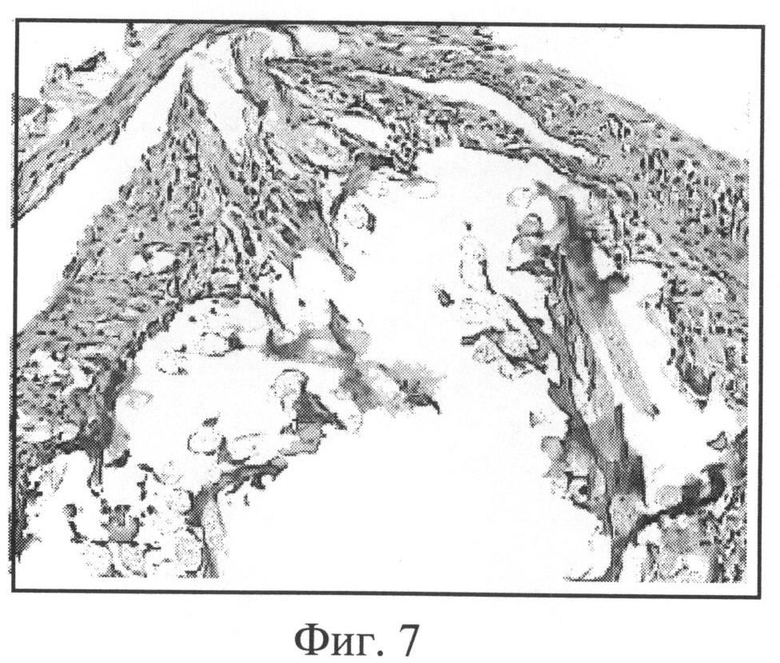
Фиг.7. Лавсановое медицинское полотно с покрытием из хитозан-желатиновой композиции с биологически активными веществами (К, Д, Ц, ГП), 1 неделя после имплантации. Окраска гематоксилином и эозином, увеличение 200.
Фиг.8. Лавсановое медицинское полотно с покрытием из хитозан-желатиновой композиции с биологически активными веществами (К, Д, Ц, ГП) 2 недели после имплантации. Окраска гематоксилином и эозином, увеличение 200.
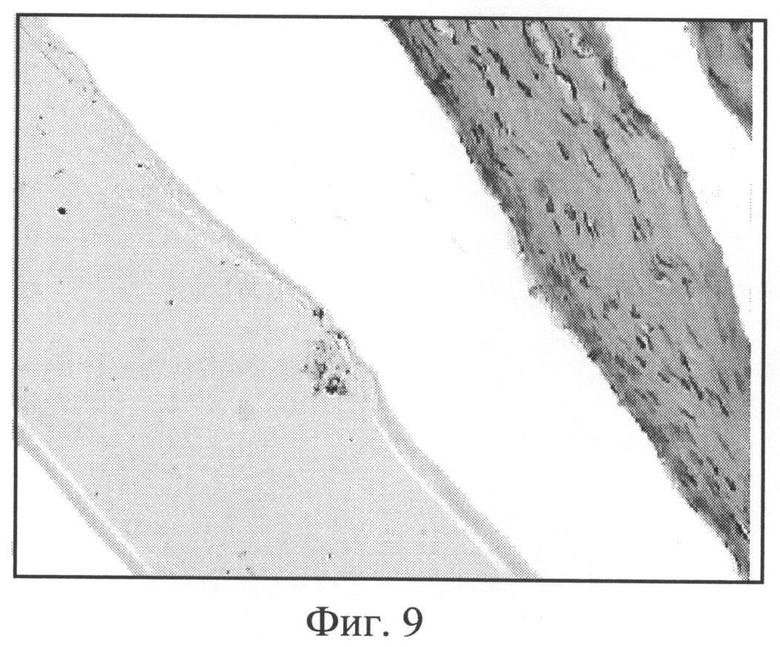
Фиг.9. Композиции в виде пленок на основе полигидроксибутирата (АЦ, К, Д, Ц, ГП), 3 месяца после имплантации. Окраска гематоксилином и эозином, увеличение 400.
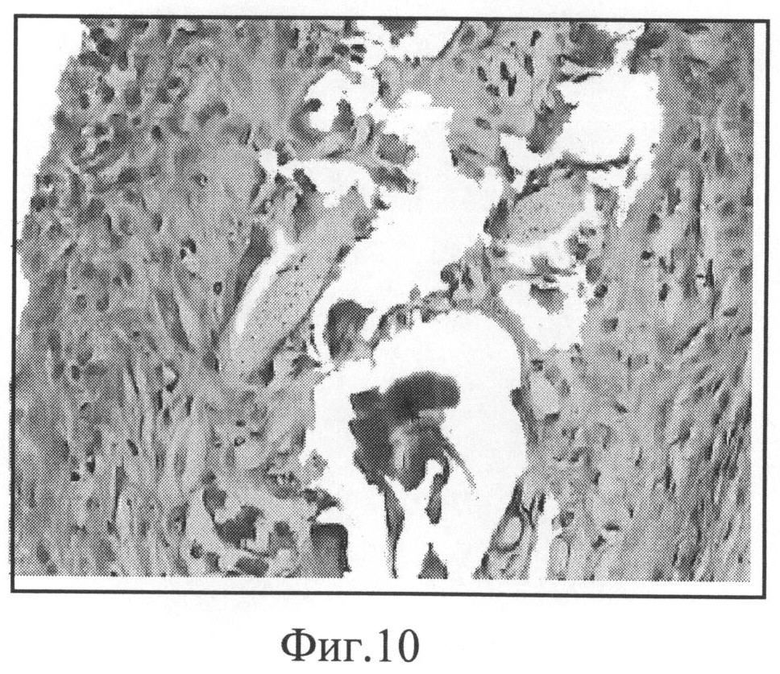
Фиг.10. Лавсановое медицинское полотно с покрытием из хитозан-полигидроксибутиратной композиции с биологически активными веществами (К, Д, Ц, ГП) 2 недели после имплантации. Окраска гематоксилином и эозином, увеличение 400.
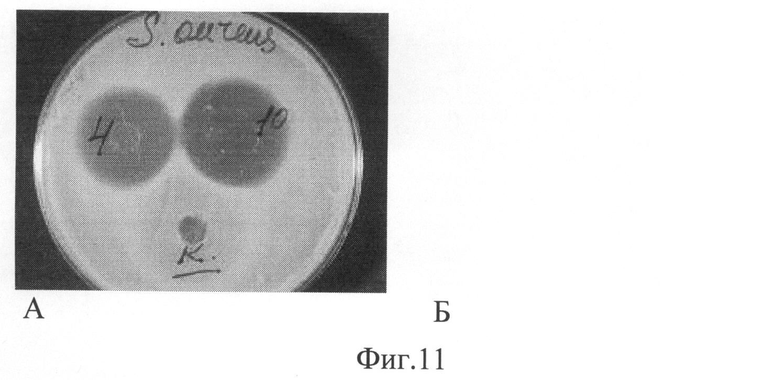
Фиг.11. Антимикробные свойства полимерных композиций в виде пленок
А - Штамм Escherichia coli,
Б - Staphylococcus aureas.
4 - Желатин+АЦ+ГП+К+Д+Ц;
10 - XT+К+Д+Ц+ГП;
К - XT без биологически активных веществ;
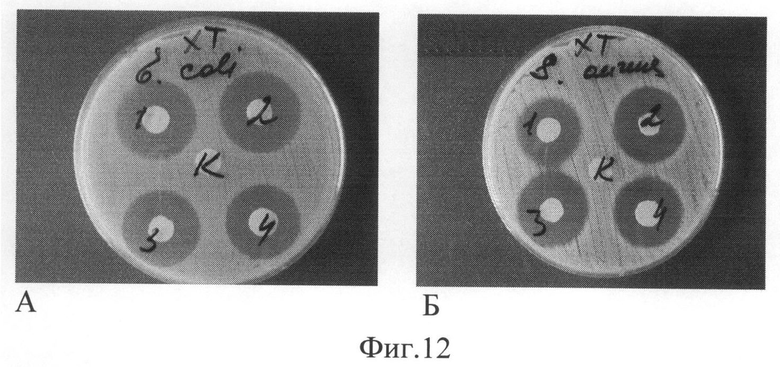
Фиг.12. Антимикробные свойства модифицированного полимерными композициями медицинского полотна
А - штамм Escherichia coli,
Б - штамм Staphylococcus aureas.
1 - Желатин+АЦ+ГП+К+Д+Ц;
2 - ХТ+К+Д+Ц+ГП;
3 - Хитозан+Желатин+ГП+К+Д+Ц;
4 - Хитозан+ПГБ+К+Д+Ц+ГП;
К - исходное полотно.
1. Биосовместимость, тромборезистентность, подтвержденные in vitro (фиг.1, 2).
Определяли основные показатели крови при контакте с разработанными композициями - степень гемолиза, влияние на белки и форменные элементы крови (изменение количества тромбоцитов и степени АДФ индуцированной агрегации тромбоцитов), белки острой фазы - альбумин, С - реактивный белок - СРБ, протеин С), параметры свертывающей системы (активированное частичное тромбопластиновое время - АЧТВ, протромбиновое время - Pt), фибринолитической системы (изменение содержания фибриногена, плазминогена, активности антитромбина III) и системы комплемента (иммуноглобулины G, М).
Определяли влияние разработанных композиций на нейтрофильную эластазу (НЭ), которая является индикатором активации нейтрофилов. НЭ является одним из основных показателей биосовместимости и тромборезистентности инородного материала при контакте с кровью.
Образцы полимерных композиций площадью 1 см2 инкубировали в крови, плазме или сыворотке объемом = 2 мл в статических условиях при 37°С, исследуемые показатели оценивали через 30, 60 минут контакта.
Показатели крови определяли по стандартным методикам с использованием следующего оборудования: автоматического гематологического анализатора «Nihon Konden»; анализатора агрегации тромбоцитов «Solar» АР 2110; биохимического анализатора «Synchron 7»; иммунохимического анализатора «Array»; автоматического коагулометра ACL - 2000; гематологического анализатора «Культер». Изменение показателей крови выражали в % от исходных значений показателей в интактных образцах крови, плазмы, сыворотки, принимая значения исходных показателей за 100%. Гемолиз - все разработанные композиции не вызывали гемолиза. Активация нейтрофильной эластазы (фиг 1.) - разработанные композиции не увеличивают активность НЭ по сравнению с интактной кровью, что свидетельствует о биосовместимости и тромборезистентности. Показатели крови при контакте с разработанными композициями (фиг.2) - разработанные композиции не влияют на содержание и соотношение белковых фракций, СРБ. Незначительно увеличивается активность плазминогена и снижается степень АДФ индуцированной агрегации тромбоцитов по сравнению с интактной кровью, что свидетельствует о гемосовместимости образцов.
2. Биосовместимость и сроки биодеградации in vivo (фиг.3-10).
В эксперименте на мелких лабораторных животных (крысах) проводили подкожную имплантацию полимерных композиции в виде пленок на основе хитозана, полигидроксибутирата, желатина и полиэфирного медицинского полотна с покрытием на основе композиций из хитозана, хитозан+желатин, хитозан+ПГБ. Сроки наблюдения от 1 недели до 3-х месяцев. После выведения животных из эксперимента образец имплантата с окружающей тканью фиксировался в формалине. Срезы толщиной 4-5 мкм окрашивались гематоксилином и эозином. Оценивали реакцию окружающих тканей, толщину и состав фиброзной капсулы, степень резорбции композиций.
Фиг.3А. Композиция в виде пленки на основе хитозана без биологически активных веществ через 1 неделю имплантации частично фрагментировалась, наблюдалась инфильтрация в капсулу макрофагов, фибробластов, лимфоцитов.
Фиг.3Б. Хитозановая композиция без биологически активных веществ через 2 недели имплантации - происходит значительная резорбция макрофагами. Целостность пленочной композиции полностью нарушена, присутствуют отдельные гигантские многоядерные клетки инородного тела (ГМКИТ).
Фиг.4А. Композиция в виде пленки на основе хитозана с биологически активными веществами (ацетилсалициловая кислота (АЦ), L-карнозин (К), дипиридамол (Д), ципрофлоксацин (Ц), гепарин (ГП)) через 1 неделю имплантации - гомогенная, не фрагментированная. Вокруг нее сформировалась соединительно-тканая капсула без инфильтрата.
Фиг.4Б. Пленочная хитозановая композиция, содержащая биологически активные вещества (L-карнозин (К), дипиридамол (Д), ципрофлоксацин (Ц), гепарин (ГП)), через 2 недели имплантации сохранила целостность и окружена тонкой соединительно-тканой капсулой.
Все имплантированные пленочные композиции на основе хитозана на сроках 1-2 недели не вызывали значительной воспалительной реакции. Введение комплекса биологически активных веществ способствовало минимизации воспалительной реакции, формированию более тонкой соединительно-тканой капсулы.
Фиг.5. Композиция на основе желатина с биологически активными веществами в виде покрытия текстильного полотна (срок имплантации 1 неделя). В имплантированном медицинском полотне содержатся единичные небольшие фрагменты покрытия. Поры полотна частично проращены соединительной тканью, много ГМКИТ. Капсула состоит из незрелой соединительной ткани.
Фиг.6. Композиция на основе желатина с биологически активными веществами в виде покрытия текстильного полотна (срок имплантации 2 недели). Полотно проращено соединительно-ткаными перегородками, видны единичные ГМКИТ. Желатиновая композиция полностью резорбировалась.
Фиг.7. Композиция на основе хитозана в сочетании с желатином и с биологически активными веществами в виде покрытия тканого полотна (срок имплантации 1 неделя). Медицинское полотно содержит значительные фрагменты покрытия - хитозан-желатиновой композиции. Видны многочисленные ГМКИТ. Соединительно-тканая капсула тонкая.
Фиг.8. Композиция на основе хитозана в сочетании с желатином и с биологически активными веществами в виде покрытия тканого полотна (срок имплантации 2 недели). Медицинское полотно с покрытием в значительной мере проросло соединительной тканью, хитозан - желатиновая композиция наблюдается в очень малых количествах. Капсула очень тонкая.
Композиции на основе сочетания двух полимеров - хитозана и желатина - биорезорбировались быстрее, чем композиции на основе хитозана. Воспалительная реакция на покрытия на сроках 1-2 недели - минимальная. Капсулы тонкие.
Фиг.9. Пленочные композиции на основе полигидроксибутирата (срок имплантации 3 месяца). Даже на сроке 3 месяца признаков биорезорбции пленочной композиции (толщина 70 мкм) на основе полигидроксибутирата не наблюдается. Соединительно-тканая капсула плотная, относительно толстая, зрелая, содержит фибробласты и макрофаги.
Фиг.10. Композиция на основе хитозана в сочетании с полигидроксибутиратом и биологически активными веществами в виде покрытия на медицинском полотне (срок имплантации 2 недели). Полимерная композиция значительно резорбировалась, с обеих сторон медицинского полотна образовалась тонкая соединительно-тканая капсула.
Сочетание в полимерной композиции хитозана с полигидроксибутиратом значительно сокращает сроки биорезорбции по сравнению с композицией на основе только полигидроксибутирата. Введение биологически активных веществ в композицию, содержащую полигидроксибутират, позволяет снизить толщину капсулы более чем в два раза.
Таким образом, все исследуемые композиции биосовместимы, проявляют минимальную воспалительную реакцию, характерную для инородного материала. Резорбция быстрее происходит у композиций на основе желатина, несколько медленнее - у композиций на основе хитозана, самая медленная - у композиций на основе полигидроксибутирата. Композиция на основе хитозана в сочетании с желатином удлиняет сроки биорезорбции по сравнению с композицией на основе желатина. Композиция на основе хитозана в сочетании с полигидроксибутиратом подвергается биорезорбции быстрее по сравнению с композицией на основе полигидроксибутирата.
3. Гидрогелевые свойства (набухание композиций) приведены в табл.1.
Гидрогелевые свойства - влагопоглощение - оценивали по степени равновесного набухания композиций гравиметрически после инкубации образца композиции в физиологическом растворе при 37°.
Степень равновесного набухания желатина самая высокая - 500-600%, по сравнению с композициями на основе хитозана - 140-170% и хитозана в сочетании с желатином - 320-350%, хитозана в сочетании с полигидроксибутиратом - 100-120%.
4. Количество депонированных в полимерные композиции биологически активных веществ и пролонгированность их выделения приведены в табл.1.
Количество депонированных в композицию биологически активных веществ и их десорбцию определяли гравиметрически и спектрофотометрически на спектрофотометре «Shimadzu UV1240» в физиологическом растворе при 37°С.
Количество биологически активных веществ (БАВ) в предложенных композициях выбраны следующие:
Суммарное количество выбранных БАВ и полимеров (или их смесей) позволяют получать полимерные композиции с заданными физико-механическими характеристиками: механической прочностью - не менее 1,2 МПа, относительным удлинением - не более 160%, модулем упругости - 0,4-5 МПа. Меньшее количество БАВ в композициях не обеспечит заданные свойства композиции - биосовместимость, тромборезистентность, антимикробность, заданные сроки биорезорбции, пролонгированное и регулируемое выделение БАВ. Большее количество - не обеспечит заданные механические свойства (эластичность, прочность, мягкость), сроки гидролитической деструкции (биорезорбции).
Особенности композиций на основе предложенных полимеров или их смесей позволяют регулировать сроки выделения биологически активных веществ.
5. Сроки гидролитической деструкции (in vitro) приведены в табл.1. Деструкцию полимерных композиций исследовали в модельных средах (стерильный подкисленный физиологический раствор) при температуре 37°.
Сроки гидролитической деструкции для композиций в виде пленок толщиной 80=±10 мкм: для желатина - 35-50 сут, для хитозана - 65-75 сут, хитозан+желатин - 50-55 сут, хитозан+полигидроксибутират - 75-85 сут.
6. Антимикробная активность полимерных композиций приведена в табл.2, фиг.11-12.
Антимикробную активность образцов композиций на основе желатина, хитозана и полигидроксибутирата с биологически активными веществами определяли диско-диффузионным методом («Методы определения чувствительности к антибактериальным препаратам», методические указания МУК 4.2.1890-04.). Использовали референтные штаммы 4-х видов патогенных бактерий: Streptococcus aureas, Klebsiella pneumoniae, Escherichia coli, Enterococcus. На агаризованную среду с культурами помещали образцы изделий площадью 1×1 см. Зону задержки роста микроорганизмов (зону лизиса) оценивали на 1, 2, 3, 5 сутки. Антибиотическую активность выражали в миллиметрах диаметра зоны лизиса. Зона лизиса должна быть не менее 15 мм. Композиции на основе желатина, хитозана и полигидроксибутирата с биологически активными веществами имели зону лизиса в пределах 20-31 мм.
7. Физико-механические свойства композиций приведены в табл.1.
Деформационно-прочностные свойства полимерных композиций определяли на универсальной испытательной машине "ZWICK/ROELL" Z 2,5/TN1S с программным обеспечением Text Expert в условиях одноосного растяжения, датчик силы 500кН, скорость испытаний 10 мм/мин, испытания поводились при комнатной температуре - 25°С. По деформационным кривым рассчитывали величины максимальной прочности при разрыве, относительное удлинение (характеристика эластичности), модуль Юнга (характеристика мягкости). Для получения статистически достоверных результатов проводили испытания не менее 10 образцов.
Выбранные составы предложенных композиций - сочетание природных полимеров, сшивающих агентов, биологически активных веществ, их количеств позволяют получать полимерные композиции с заданными физико-механическими характеристиками: механическая прочность - не менее 1,2 МПа, относительное удлинение - не более 160%, модуль упругости - 0,4-5 МПа.
Получение заявляемых композиций иллюстрируется следующими вариантами примеров.
Пример 1
Получение полимерных композиций желатина, желатина с биологически активными веществами (БАВ):
Готовят 5-10 мас.% раствор желатина с молекулярной массой 60-80 кДа в дистиллированной воде. Раствор нагревают до температуры 40°С до полного растворения желатина.
Затем раствор выливают на подложку из полипропилена, полиэтилена. Высушивание композиции осуществляют при температуре не выше 30°С в течение 3-5 дней. Для перевода в водонерастворимое состояние полимерные композиции обрабатывают 0,05-0,1 мас.% растворами сшивающих агентов - глутарового альдегида или генипина при комнатной температуре. Полимерную композицию промывают дистиллированной водой для удаления не прореагировавших остатков сшивающего агента. Контроль содержания остатков сшивающего агента в промывных водах оценивали спектрофотометрически - для глутарового альдегида при длине волны 263 нм и 321 нм; для генипина - 240 нм и 640 нм. Для пластифицирования полимерных композиций их погружают в растворы пластификатора с концентрацией 7-10 мас.%. Композиции получают в виде пленок.
Для получения композиции желатина с биологически активными веществами готовят 5-10 мас.% раствор желатина с молекулярной массой 60-80 кДа в дистиллированной воде. Раствор нагревают до температуры 40°С до полного растворения желатина, затем выливают на подложку из полипропилена, полиэтилена. Высушивание композиции осуществляют при температуре не выше 30°С в течение 3-5 дней. Для перевода в водонерастворимое состояние полимерные композиции обрабатывают 0,05-0,1 мас.% растворами сшивающих агентов - глутарового альдегида или генипина при комнатной температуре. Полимерную композицию промывают дистиллированной водой для удаления непрореагировавших остатков сшивающего агента (контроль промывных вод - спектрофотометрический). Введение в полимерную композицию БАВ - ацетилсалициловой кислоты, гепарина, дипиридамола, L-карнозина, ципрофлоксацина, метронидазола осуществляли путем хемосорбции. Полимерные композиции погружали в раствор БАВ с концентрацией 0,05-1,0 мас.%. Для пластифицирования полимерных композиций их погружают в растворы пластификатора с концентрацией - 7-10 мас.%. Композиции получают в виде пленок. Состав композиций, физико-химические и физико-механические свойства композиций представлены в табл.1 (примеры 1-6), медико-биологические свойства композиций представлены в табл.2 и проиллюстрированы фиг.1, 2, 5,6,11,12.
Пример 2
Получение полимерных композиций хитозана и хитозана с биологически активными веществами:
Для получения композиций на основе хитозана готовят 2-5 мас.% раствор хитозана с молекулярной массой 200-300 кДа в 1-3 мас.% уксусной кислоте. Раствор оставляют на сутки при комнатной температуре для полного растворения хитозана, затем раствор выливают на подложку (полипропилен, стекло) и сушат при температуре не выше 30°С в течение 3-5 дней. Перевод хитозановых композиций в водонерастворимое состояние осуществляют путем термообработки при 95-100°С - 2-1,5 ч. Затем композиции промывают 0,25 мас.% раствором соды для нейтрализации остатков уксусной кислоты, затем дистиллированной водой. Для пластифицирования полимерных композиций их погружают в растворы пластификатора с концентрацией - 10-20 мас.%.
Для получения композиций на основе хитозана с биологически активными веществами готовят 2-5 мас.% раствор хитозана с молекулярной массой 200-300 кДа в 1-3 мас.% уксусной кислоте. Раствор оставляют на сутки при комнатной температуре для полного растворения хитозана. В готовый раствор хитозана вводят биологически активные вещества - дипиридамол, ципроф-локсацин, L-карнозин, метронидазол. Концентрация биологически активных веществ в растворе хитозана - 4-8 мас.% от полимера. Раствор полимера с биологически активными веществами тщательно перемешивают до полного растворения биологически активных веществ, затем выливают на подложку (полипропилен, стекло) и сушат при температуре не выше 30°С в течение 3-5 дней. Перевод хитозановых композиций в водонерастворимое состояние осуществляют путем термообработки при 95-100°С - 2-1,5 ч. Затем композиции промывают 0,25 мас.% раствором соды для нейтрализации остатков уксусной кислоты, затем дистиллированной водой. Путем хемосорбции дополнительно в композицию вводят гепарин и пластификатор, для чего полимерную композицию погружают в раствор гепарина с концентрацией 50-100 МЕ/мл и пластификатора - глицерина с концентрацией 10-20 мас.%. Композиции получают в виде пленок.
Состав композиций, физико-химические и физико-механические свойства композиций представлены в табл.1 (примеры 7-9), медико-биологические свойства композиций представлены в табл.2 и проиллюстрированы фиг.1-4, 11, 12.
Пример 3
Получение полимерных композиций хитозана с желатином и биологически активными веществами:
Готовят раствор: в 2-5 мас.% раствор хитозана с молекулярной массой 200-300 кДа в 1-3 мас.% уксусной кислоте (как в варианте 2), в него добавляют желатин с молекулярной массой 60-80 кДа, не менее 20 мас.% от массы хитозана. Раствор нагревают до температуры 40°С в течение 1-2-х часов и затем отставляют на сутки при комнатной температуре до полного растворения полимеров, затем тщательно перемешивают магнитной мешалкой. В готовый раствор хитозана и желатина вводят биологически активные вещества - дипиридамол, ципрофлоксацин, L-карнозин, метронидазол. Концентрация биологически активных веществ - 4-8 мас.% от полимера. Раствор полимера с биологически активными веществами тщательно перемешивают до полного растворения биологически активных веществ, затем выливают на подложку (полипропилен, полиэтилен) и сушат при температуре не выше 30°С в течение 3-5 дней. Перевод композиций в водонерастворимое состояние осуществляют путем термообработки при 95-100°С - 2-1,5 ч. Затем композиции промывают 0,25 мас.% раствором соды для нейтрализации остатков уксусной кислоты, затем дистиллированной водой. Путем хемосорбции дополнительно в композицию вводят гепарин и пластификатор, для чего полимерную композицию погружают в раствор гепарина с концентрацией 50-100 МЕ/мл и пластификатора - глицерина с концентрацией 10-20 мас.%. Композиции получают в виде пленок. Состав композиций, физико-химические и физико-механические свойства композиций представлены в табл.1 (примеры 10, 11), медико-биологические свойства композиций представлены в табл.2 и проиллюстрированы фиг.1, 2, 7, 8, 11, 12.
Пример 4
Получение полимерных композиций хитозана с поли-3-гидроксибутиратом и биологически активными веществами:
Готовят 2-5 мас.% раствор хитозана с биологически активными веществами (как в варианте 2). Готовят 0,5-1,5 мас.% раствор поли-3-гидроксибутирата с молекулярной массой 300-600 кДа в хлороформе, тщательно перемешивают магнитной мешалкой до полной гомогенизации, в него вводят биологически активные вещества дипиридамол, ципрофлоксацин, L-карнозин в количестве - 4-8 мас.% от полимеров, тщательно перемешивают магнитной мешалкой. Растворы хитозана и поли-3-гидроксибутирата смешивают и затем тщательно перемешивают магнитной мешалкой до получения устойчивой эмульсии. Затем выливают на подложку (полипропилен, стекло) и сушат при температуре не выше 30°С в течение 3-5 дней. Перевод композиций в водонерастворимое состояние осуществляют путем термообработки при 95-100° - 2-1,5 ч. Затем композиции промывают 0,25 мас.% раствором соды и воды для нейтрализации остатков уксусной кислоты. Путем хемосорбции дополнительно в композицию вводят гепарин и пластификатор, для чего полимерную композицию погружают в раствор гепарина с концентрацией 50-100 МЕ/мл и пластификатора - глицерина с концентрацией - 10-20 мас.%.
Композиции получают в виде пленок
Состав композиций, физико-химические и физико-механические свойства композиций представлены в табл.1 (примеры 12, 13), медико-биологические свойства композиций представлены в табл.2 и проиллюстрированы фиг.1, 2, 10-12.
Вариант 5
Получение полимерных композиций на основе хитозана и желатина с биологически активными веществами в качестве покрытий медицинского текстильного полотна.
Готовят раствор: в 2-5 мас.% раствор хитозана с молекулярной массой 200-300 кДа в 1-3 мас.% уксусной кислоте, в него добавляют желатин с молекулярной массой 60-80 кДа, не менее 20 мас.% от массы хитозана (как в варианте 3). Раствор нагревают до температуры 40°С в течение 1-2-х часов и затем отставляют на сутки при комнатной температуре до полного растворения полимеров, затем тщательно перемешивают магнитной мешалкой. В готовый раствор хитозана и желатина вводят биологически активные вещества - дипиридамол, ципрофлоксацин, L-карнозин, метронидазол. Концентрация биологически активных веществ - 4-8 мас.% от полимера. Раствор полимера с биологически активными веществами тщательно перемешивают до полного растворения биологически активных веществ, затем наносят на полиэфирное медицинское полотно и сушат при температуре не выше 30°С в течение суток. Перевод композиции в виде покрытия в водонерастворимое состояние осуществляют путем термообработки при 95-100°С - 1 ч. Затем промывают 0,25 мас.% раствором соды для нейтрализации остатков уксусной кислоты, затем дистиллированной водой. Путем хемосорбции дополнительно в покрытие вводят гепарин и пластификатор, для чего полотно с покрытием погружают в раствор гепарина с концентрацией 50-100 МЕ/мл и пластификатора - глицерина с концентрацией 10-20 мас.%.
Композиции получают в виде покрытия на медицинском текстильном полотне.
Состав композиции в виде покрытия:
суммарное количество полимеров - 2-5 мас.%,
суммарное количество биологически активных веществ (БАВ) - 4-8 мас.% от полимеров,
толщина покрытия - 50±10 мкм,
продолжительность выделения БАВ - 40 суток,
срок гидролитической деструкции композиции в виде покрытия - 45 суток.
Медико-биологические свойства композиций проиллюстрированы фиг.7, 8, 12.
Таким образом, сочетание выбранных природных полимеров и сочетание выбранных биологически активных веществ для получения биорезорбируемых полимерных композиций позволило получить композиции с заданными медико-биологическими, физико-химическими и физико-механическими свойствами.
Предлагаемые композиции являются:
- биосовместимыми,
- тромборезистентными,
- с гидрогелевыми свойствами,
- с заданными сроками биорезорбции,
- с пролонгированным и регулируемым выделением БАВ,
- с расширенным комплексом БАВ: антиоксиданты, антикоагулянты, антиагреганты, антимикробные, антиадгезионные и противовоспалительные препараты,
- с оптимальными механическими свойствами (эластичность, прочность, мягкость).
Заявляемые биорезорбируемые гидрогелевые полимерные композиции с биологически активными веществами предназначены:
- для покрытий имплантируемых изделий и устройств, предназначенных для контакта с кровью (манжеты для искусственных клапанов сердца, кардиохирургические заплаты, протезы кровеносных сосудов и др.);
- для использования в качестве биофизического барьера для профилактики спаечных процессов после хирургических вмешательств;
- для создания систем с контролируемым высвобождением биологически активных и лекарственных веществ.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБРАБОТКИ СИНТЕТИЧЕСКИХ ТЕКСТИЛЬНЫХ ИМПЛАНТИРУЕМЫХ МЕДИЦИНСКИХ ИЗДЕЛИЙ, КОНТАКТИРУЮЩИХ С КРОВЬЮ | 2011 |
|
RU2462273C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БИОДЕГРАДИРУЕМЫХ МЕМБРАН ДЛЯ ПРЕДОТВРАЩЕНИЯ ОБРАЗОВАНИЯ СПАЕК ПОСЛЕ КАРДИОХИРУРГИЧЕСКИХ ОПЕРАЦИЙ | 2013 |
|
RU2525181C1 |
| БИОИНТЕГРИРУЕМЫЙ КОМПОЗИТНЫЙ МАТЕРИАЛ И СПОСОБ ФОРМИРОВАНИЯ ПОКРЫТИЯ НА ИЗДЕЛИЯХ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ БИОИНТЕГРИРУЕМОГО КОМПОЗИТНОГО МАТЕРИАЛА | 2013 |
|
RU2535067C1 |
| СЕТЧАТЫЙ ЭНДОПРОТЕЗ ДЛЯ ВОССТАНОВИТЕЛЬНОЙ ХИРУРГИИ | 2005 |
|
RU2316290C2 |
| Способ повышения регенерационного потенциала имплантируемого материала для восстановительной хирургии (варианты) | 2019 |
|
RU2721880C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БИОРЕЗОРБИРУЕМОГО ГИБРИДНОГО СОСУДИСТОГО ИМПЛАНТА МАЛОГО ДИАМЕТРА | 2012 |
|
RU2504406C1 |
| БИОДЕГРАДИРУЕМАЯ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКАЯ ГИДРОГЕЛЕВАЯ ПЛАСТИНА И СПОСОБ ЕЁ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2020 |
|
RU2732241C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ПОЛИМЕРНАЯ МЕДИЦИНСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) | 2010 |
|
RU2447902C2 |
| СПОСОБ МОДИФИКАЦИИ ПОВЕРХНОСТИ ЭНДОКАРДИАЛЬНЫХ ЭЛЕКТРОДОВ | 2010 |
|
RU2452516C1 |
| ТКАНЕИНЖЕНЕРНЫЙ БИОДЕГРАДИРУЕМЫЙ СОСУДИСТЫЙ ИМПЛАНТ | 2016 |
|
RU2642259C2 |

Изобретение относится к области медицины. Описана биорезорбируемая гидрогелевая полимерная композиция для сердечно-сосудистой хирургии в виде пленки, полученная взаимодействием природных полимеров, биологически активных веществ, растворителя и пластификатора, где в качестве полимеров используют сшитые биорезорбируемые полимеры - желатин, хитозан, или смеси - хитозан и желатин, хитозан и полигидроксибутират, в качестве биологически активных веществ или их смесей используют антиоксидант - L-карнозин, антикоагулянт - гепарин, антиагрегант - дипиридамол, ацетилсалициловую кислоту, нестероидное противовоспалительное вещество - ацетилсалициловую кислоту, антимикробные препараты - ципрофлоксацин, метронидазол, при этом механическая прочность пленки не менее 1,2 МПа, относительное удлинение - не более 160%, модуль упругости - 0,4-5 МПа. Используются гидрогелевые полимерные композиции с регулируемыми сроками биорезорбции, пролонгированными сроками выделения биологически активных веществ, с биосовместимыми и тромборезистентными свойствами, повышенной антимикробностью, улучшенными механическими характеристиками - повышенной мягкостью и эластичностью. 6 з.п. ф-лы, 12 ил., 2 табл. 4 пр.
1. Биорезорбируемая гидрогелевая полимерная композиция для сердечно-сосудистой хирургии в виде пленки, полученная взаимодействием природных полимеров, биологически активных веществ, растворителя и пластификатора, отличающаяся тем, что в качестве полимеров используют сшитые биорезорбируемые полимеры - желатин, хитозан, или смеси - хитозан и желатин, хитозан и полигидроксибутират, в качестве биологически активных веществ или их смесей используют антиоксидант - L-карнозин, антикоагулянт - гепарин, антиагрегант - дипиридамол, ацетилсалициловую кислоту, нестероидное противовоспалительное вещество - ацетилсалициловую кислоту, антимикробные препараты - ципрофлоксацин, метронидазол, при этом механическая прочность пленки не менее 1,2 МПа, относительное удлинение - не более 160%, модуль упругости - 0,4-5 МПа.
2. Композиция по п.1, отличающаяся тем, что при совместном использовании хитозана и желатина желатина в композиции должно быть не менее 20%, биологически активных веществ 4-8 мас.%.
3. Композиция по п.1, отличающаяся тем, что при совместном использовании хитозана и полигидроксибутирата полигидроксибутирата в композиции должно быть не более 30%, биологически активных веществ 4-8 мас.%.
4. Композиция по п.1, отличающаяся тем, что количество биологически активных веществ в композиции на основе желатина составляет 1-2 мас.%.
5. Композиция по п.1, отличающаяся тем, что количество биологически активных веществ в композиции на основе хитозана составляет 4-8 мас.%.
6. Композиция по п.1, отличающаяся тем, что для сшивки полимера - желатина используют природный сшивающий агент из класса гликозидов - генипин.
7. Композиция по п.1, отличающаяся тем, что для сшивки полимера - хитозана, хитозана с желатином, хитозана с полигидроксибутиратом используют термообработку.
| БИОРАЗРУШАЕМОЕ СРЕДСТВО ДЛЯ ПОДДЕРЖАНИЯ ПРОСВЕТА СОСУДОВ | 2008 |
|
RU2452517C2 |
| Способ защиты котельных швов от воздействия пламени | 1927 |
|
SU9809A1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ПОЛИМЕРНАЯ МЕДИЦИНСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) | 2010 |
|
RU2447902C2 |
Авторы
Даты
2014-06-10—Публикация
2012-08-13—Подача