Перекрестная ссылка на родственные заявки
Для данной заявки испрашивается приоритет по предварительной заявке США № 61/020541, зарегистрированной 11 января 2008 года, и предварительной заявке США № 61/033184, зарегистрированной 3 марта 2008 года, таким образом, включенными в качестве ссылки.
Область изобретения
Изобретение относится к изоляту оплодотворенных яиц, включая изолят, полученный любым из способов, указанных в описании, и его применению для лечения психических расстройств.
Предпосылки изобретения
Большое депрессивное расстройство (также известное как большая депрессия, клиническая депрессия, униполярная депрессия и униполярное расстройство) является очень распространенным среди всего населения. Самые последние североамериканские данные свидетельствуют о 14,5% риске возникновения большой депрессии в течение жизни у взрослых и 8,1% ежегодной заболеваемости (данные из 2004 National Survey on Drug Use and Health: National findings; Revisions as of 9/8/2005; Department of Health and Human Services. Substance Abuse and Mental Health Services Administration Office of Applied Studies).
Средняя продолжительность эпизода депрессии с применением современных лекарственных средств составляет приблизительно 16 недель, хотя некоторые данные свидетельствуют о большей продолжительности эпизода, составляющей приблизительно 6-8 месяцев, что существенно меньше, чем в эпоху до терапии антидепрессантами, когда продолжительность эпизода составляла приблизительно 18 месяцев (Kendler, McLeod, Patten).
Антидепрессанты оказывают очень выраженное положительное воздействие на лечение депрессии и снижение страдания пациентов. У пациентов с депрессией часто ослаблена деятельность, и у них часто присутствуют коморбидные расстройства, такие как наркотическая зависимость и токсикомания, которые можно отнести к исходной депрессии. Депрессия приводит к повышенному использованию услуг в области здравоохранения и оказывает разрушительное влияние на общественную структуру и общественную экономику.
Причина депрессии известна не полностью. В течение последних нескольких десятилетий главной этиологической теорией депрессии являлось нарушение синтеза и активности моноаминов, и подтверждение этому было подкреплено эффективностью лекарственных средств, которые усиливают активность моноаминов, в особенности серотонинергических и/или норадренергических. Однако тот или иной антидепрессант эффективен только в какой-либо из подгрупп пациентов с депрессией и часто только частично. Существующие средства, применяемые в контролируемых исследованиях в экспериментальных условиях с выбранными образцами, демонстрируют эффективность только приблизительно для 60% пациентов и только приблизительно половина из них достигали полной ремиссии симптомов. Это важно, поскольку наличие остаточных симптомов является серьезным прогностическим признаком рецидива. Также существуют другие физиологические изменения, связанные с депрессией и свидетельствующие о более сложном взаимодействии этиологических факторов, включая роль вторичных мессенджеров, опосредующих мембраносвязанные и внутриклеточные процессы. Это привело к исследованию гормональных путей, таких как гипоталамо-гипофизарно-надпочечниковая система (ΗΡΑ) (активность которой повышена у 20-40% пациентов с депрессией, находящихся вне медицинских учреждений), система щитовидной железы (5-10% пациентов с депрессией имеют ранее не обнаруженную дисфункцию щитовидной железы), гормон роста, пролактин, и роли воспалительных процессов и их маркеров, таких как интерлейкин 1 и 6 и фактор некроза опухоли.
У большинства индивидуумов с большим депрессивным расстройством происходит возвращение симптомов в определенной степени, и у 20-30% течение является хроническим (определяемое как уровень тяжести симптомов депрессии на уровне синдрома за два года и более (Treatment of Chronic Depression (Editorial))).
Все индивидуумы с депрессией нуждаются в продолжении медикаментозного лечения для предотвращения рецидива и обеспечения выздоровления. Значительная часть пациентов с депрессией нуждаются в поддержании медикаментозного лечения для предотвращения рецидива и закрепления психологического выздоровления. Однако, несмотря на то что одним из основных факторов эффективной терапии антидепрессантами является поддержание достаточной для пациента дозы в течение достаточного периода времени, часто это бывает затруднительным. Многие пациенты боятся принимать существующие антидепрессанты из-за реальных или мнимых физических эффектов. Некоторые пациенты предпочитают применять так называемые натуральные укрепляющие здоровье вещества и нефармакологические вмешательства. Пациенты, готовые принимать антидепрессанты, часто сталкиваются с широким спектром побочных эффектов, которые заставляют их не соблюдать терапию или полностью отказываться от нее. Например, селективные ингибиторы обратного захвата серотонина (SSRI), как правило, вызывают желудочно-кишечное расстройство, головные боли, нарушение сна и значительные половые расстройства, наряду со многими другими побочными эффектами. Многие антидепрессанты обладают, по меньшей мере, некоторыми значительными побочными эффектами, что ограничивает способность врача эффективно лечить многих пациентов.
Депрессия может быть ассоциирована с другими расстройствами и/или синдромами, включая тревожность, такую как генерализованное тревожное расстройство, половую дисфункцию, сезонную депрессию, социальное тревожное расстройство, также известное как социофобия, биполярное расстройство и деменцию.
Широко известно, что ограниченная эффективность, частые нежелательные побочные эффекты и физиологические факторы, которые могут вызывать депрессию или иным образом воздействовать на ее течение, делают необходимым продолжение поиска новых соединений с новыми фармакологическими эффектами для решения значительной для здравоохранения проблемы депрессии.
Краткое описание фигур
Специалисту в соответствующих областях понятно, что описанные ниже фигуры приведены только в иллюстративных целях. Фигуры не предназначены для какого-либо ограничения объема изобретения.
Фиг.1 является изображением эмбриона, удаленного из яйца в соответствии с вариантами осуществления настоящего изобретения.
Фиг.2 является изображением лиофилизированного эмбриона в соответствии с вариантами осуществления настоящего изобретения.
Фиг.3 является изображением лиофилизированных эмбрионов в соответствии с вариантами осуществления настоящего изобретения.
Фиг.4 является изображением лиофилизированного эмбриона в соответствии с вариантами осуществления настоящего изобретения.
Фиг.5 является изображением суспензии некоторого количества эмбрионов в соответствии с вариантами осуществления настоящего изобретения.
На фиг.6 представлена ВЭЖХ изолята оплодотворенных яиц в соответствии с вариантами осуществления настоящего изобретения.
На фиг.7 приведены результаты анализа изолята оплодотворенных яиц в соответствии с вариантами осуществления настоящего изобретения.
На фиг.8 представлена диаграмма эффекта различных концентраций верхнего изолята образца #20 (мкг/мл) изолята оплодотворенных яиц на связывание меченного радиоактивным изотопом CGP 39653 с участком связывания агониста (инотропным) NMDA-рецептора глутамата (измеряемое в процентах специфического связывания), а также IC50 и Ki для NMDA и верхнего изолята образца #20.
На фиг.9 представлена диаграмма эффекта различных концентраций верхнего изолята образца #20 (мкг/мл) изолята оплодотворенных яиц на связывание меченной радиоактивным изотопом каиновой кислоты с каинатным (ионотропным) участком связывания каинатного рецептора глутамата (измеряемое в процентах специфического связывания), а также IC50 и Ki для каиновой кислоты и верхнего изолята образца #20.
На фиг.10 представлена диаграмма эффекта различных концентраций верхнего изолята образца #20 (мкг/мл) изолята оплодотворенных яиц на связывание меченного радиоактивным изотопом α-амино-3-гидроксил-5-метил-4-изоксазол-пропионата (AMPA) с участком связывания AMPA (ионотропным) AMPA-рецептора (измеряемое в процентах специфического связывания), а также IC50 и Ki для (+/-) AMPA HBr и верхнего изолята образца #20.
На фиг.11 представлена диаграмма эффекта различных концентраций верхнего изолята образца #20 (мкг/мл) изолята оплодотворенных яиц на связывание меченного радиоактивным изотопом MDL-105,519 с глициновым участком связывания, который является стрихнин-нечувствительным (ионотропным) участком NMDA-рецептора глутамата (измеряемое в процентах специфического связывания), а также IC50 и Ki для MBL-105,519 и верхнего изолята образца #20.
На фиг.12 представлена диаграмма эффекта различных концентраций верхнего изолята образца #20 (мкг/мл) изолята оплодотворенных яиц на связывание нейрокинина A (NKA) с NK2-рецепторами (измеряемое в процентах специфического связывания), а также IC50 и Ki для нейрокинина A и верхнего изолята образца #20.
Подробное описание изобретения
По настоящему изобретению описаны изоляты оплодотворенных яиц и их применение для лечения психических расстройств.
Изоляты оплодотворенных яиц - получение
По одному из аспектов изобретения представлен способ получения измельченного образца, по меньшей мере, одного эмбриона или получение измельченного образца из части или всего содержимого оплодотворенного яйца. По меньшей мере, одно оплодотворенное яйцо инкубируют где угодно приблизительно от 3 приблизительно до 15 дней, более предпочтительно приблизительно от 3 приблизительно до 5 дней, или более предпочтительно приблизительно от 6 приблизительно до 12 дней, и даже более предпочтительно приблизительно от 7 приблизительно до 9 дней со дня, когда яйцеклетку оплодотворили. Как правило, оплодотворенное яйцо инкубируют в течение периода времени, позволяющего начинаться ангиогенезу и/или созревать эмбриону до такого момента, когда эмбрионы становятся видны невооруженным взглядом. Яйца могут представлять собой яйца различного происхождения, например от птиц, рептилий или яйцекладущих млекопитающих. Как правило, подходит любое яйцо, из которого можно удалить эмбрион или кровеносные сосуды, ассоциированные с эмбрионом. Яйца предпочтительно представляют собой яйца птиц, и их можно получать от любой птицы, выведенной для получения яиц, такой как курица, гусыня, утка и т.п. Яйца кур предпочтительны по причинам, включающим их доступность и возможность их массового производства. Инкубация может происходить в любой среде, при условии, что яйца хранят при температуре в течение длительного периода времени, что позволяет эмбриону созреть. Подходящая для инкубации температура находится в диапазоне приблизительно от 20°C приблизительно до 60°C, более предпочтительно в диапазоне приблизительно от 25°C приблизительно до 55°C и более предпочтительно в диапазоне приблизительно от 35°C приблизительно до 45°C. Как только яйца проинкубированы в течение периода времени, их необязательно можно обрабатывать для уменьшения внешней микрофлоры или же стерилизовать подходящими способами, такими как мытье яичной скорлупы растворителями, такими как, например, приблизительно от 50% приблизительно до 95% раствор этанола, с последующим периодом времени, позволяющим обеспечить выпаривание и высушивание растворителя, или посредством вращения яиц под ультрафиолетовым (UV) источником света в течение подходящего периода времени. Перед дальнейшими манипуляциями с яйцом предпочтительно выпарить любой растворитель. Затем яйца разбивают для получения внутреннего содержимого. Яйца можно разбивать в стерильных условиях либо вручную, либо с применением подходящего механического устройства. Эта процедура и/или все или большинство из описанных выше и ниже процедур можно производить в охлажденной атмосфере, такой как атмосфера при приблизительно 5°C.
По одному из аспектов изобретения содержимое яйца собирают в контейнер, такой как контейнер из нержавеющей стали, который предпочтительно простерилизован и/или охлажден. Содержимое из контейнера или из яйца необязательно можно подвергать фильтрации, например, поместив в сито. Отверстия сита могут составлять приблизительно от 0,5 приблизительно до 4 мм, более предпочтительно приблизительно 1 мм. Предпочтительно стерильное сито.
Необязательно, содержимое яйца и/или некоторое количество или всю разбитую скорлупу можно помещать непосредственно в сито. Содержимому яйца и/или некоторому количеству или всей разбитой скорлупе позволяют профильтроваться сквозь сито в течение такого периода времени, чтобы по существу не было дальнейшего просачивания жидкости сквозь сито. Разбитую скорлупу можно удалить из содержимого яйца до, во время или после фильтрации. После фильтрации твердый или твердый и полутвердый ретентат может содержать эмбрион, сосудистую соединительную ткань, значительную часть или весь яичный белок, значительную часть или всю халазу и чистый желточный мешок. Полутвердый ретентат может содержать твердый материал, а также вязкий материал, такой как студенистый материал, например, яичный белок. Ретентат или полутвердый ретентат необязательно можно промывать, по меньшей мере, однократно с подходящим растворителем, таким как буферный раствор, стерильная деионизированная вода или любой подходящий солевой раствор. Например, можно использовать стерильный натрий-фосфатный буфер (PBS).
Ретентат можно собирать из одного яйца, а затем лиофилизировать способами, описываемыми в настоящем документе, или ретентат можно собирать из одного или нескольких яиц вместе и затем лиофилизировать способами, описываемыми в настоящем документе.
По другому аспекту изобретения яичный белок и/или эмбрион по существу можно отделять от остального содержимого яйца. Яичный белок по существу можно отделять от остального содержимого яйца любым подходящим способом, таким как переливание яичного белка или отсасывание. Эмбрион по существу можно отделять от яичного белка вручную или другим подходящим способом, определяемым специалистом. На фиг.1 представлен пример удаленного из яйца и промытого буфером эмбриона. Специалистам в данной области будет понятно, что эмбрион по существу можно отделять от яичного белка и остального внутреннего содержимого одновременно. Например, эмбрион можно удалять вручную из яичного белка и остального внутреннего содержимого с применением щипчиков или другого подходящего инструмента. В некоторых случаях эмбрион можно очищать от желточного мешка, который формирует часть остального внутреннего содержимого.
Как только эмбрион по большей части отделили от яичного белка и остального внутреннего содержимого яйца, его необязательно можно промывать, по меньшей мере, однократно с подходящим растворителем, таким как буферный раствор, стерильная деионизированная вода или любой подходящий солевой раствор. Например, можно использовать стерильный натрий-фосфатный буфер (PBS).
Следует понимать, что в том случае, когда содержимое подвергали фильтрации, приведенные ниже способы, применяемые для содержимого яйца, фактически можно применять для ретентата. Также понятно, что для получения изолята оплодотворенных яиц по настоящему изобретению целое оплодотворенное яйцо можно разбивать, удалять скорлупу и подвергать очищенное от скорлупы яйцо заморозке и лиофилизации по любому из способов, описанных выше и ниже. Кроме того, можно разбивать более одного яйца, удалять скорлупу, объединять целые очищенные от скорлупы оплодотворенные яйца, перемешивать их до образования суспензии, замораживать и лиофилизировать по любому из способов, описанных выше и ниже.
Содержимое яиц или эмбрионы помещают, по меньшей мере, в один замораживаемый контейнер. Контейнер может представлять собой, например, пробирку, чашку Петри, лабораторный стакан, лоток из нержавеющей стали или пластиковый контейнер. Предпочтительно, замораживать содержимое или эмбрионы очень быстро после удаления скорлупы, например, в течение приблизительно 2 часов, более предпочтительно в течение приблизительно 1 часа, и даже более предпочтительно в течение приблизительно 0,5 часа или настолько быстро насколько возможно. В зависимости от того, как долго содержимое или эмбрионы замораживали, температура заморозки должна находиться в диапазоне приблизительно от -50°C приблизительно до 10°C, более предпочтительно в диапазоне приблизительно от -40°C приблизительно до 5°C и даже более предпочтительно в диапазоне приблизительно от -35°C приблизительно до -25°C. Предпочтительно, замораживать содержимое или эмбрионы, по меньшей мере, приблизительно на 6 часов, более предпочтительно - по меньшей мере, приблизительно на 12 часов, даже более предпочтительно - по меньшей мере, приблизительно на 24 часа. Замороженное содержимое или эмбрионы можно лиофилизировать после периода времени. Содержимое или эмбрионы можно полностью замораживать до этапа лиофилизации. На фиг.2 и 3 представлены примеры эмбрионов после лиофилизации.
Необязательно можно складывать замороженное и незамороженное содержимое и эмбрионы в подходящий контейнер, такой как лабораторный стакан или пластиковый контейнер, перемешивать или смешивать с подходящим растворителем, если необходимо, для получения суспензии. Растворитель может быть водным для увлажнения перемешанного содержимого или эмбрионов и замораживаемым в стандартных лабораторных морозильных камерах. Подходящие растворители включают воду, водный буфер и т.п. Для получения суспензии предпочтительно смешивать содержимое и/или эмбрионы. Содержимое или эмбрионы можно смешивать или гомогенизировать, например, с применением переносного измельчителя или других подходящих способов. Можно замораживать суспензию, как описано выше, и лиофилизировать. Предпочтительно осуществлять лиофилизацию при предельных температурах в диапазоне приблизительно от -80°C приблизительно до -10°C, более предпочтительно в диапазоне приблизительно от -65°C приблизительно до -15°C и даже более предпочтительно в диапазоне приблизительно от -40°C приблизительно до -20°C и при давлении приблизительно 500 мм рт.ст. или другом подходящем давлении, определяемом специалистом. Лиофилизацию проводят при предельных температурах в течение периода времени в диапазоне приблизительно от 1 приблизительно до 6 часов, более предпочтительно в диапазоне приблизительно от 2 приблизительно до 5 часов, и даже более предпочтительно в диапазоне приблизительно от 3 приблизительно до 4 часов. Полную лиофилизацию, как правило, проводят в течение периода времени в диапазоне приблизительно от 15 приблизительно до 45 часов, более обычно приблизительно от 25 приблизительно до 35 часов, и даже более обычно в диапазоне приблизительно от 28 приблизительно до 32 часов.
По другому аспекту изобретения лиофилизированное содержимое, лиофилизированный эмбрион или лиофилизированную суспензию рассеивают и/или распыляют, если необходимо, для получения по существу гомогенного порошка. Содержимое, замороженное индивидуально или в меньших группах, можно объединять вместе до или после этапа распыления для получения по существу гомогенного порошка. Распыление можно осуществлять, например, механически, используя подходящий прибор, такой как кофейная мельница или молотковая мельница, или вручную, используя подходящий инструмент, такой как стеклянный штабик. На фиг.4 представлен пример распыленного лиофилизированного эмбриона. Порошок необязательно можно стерилизовать перед хранением или использованием. Подходящая стерилизация не должна отрицательно влиять на определенные лиофилизированные компоненты
Применительно к любому описываемому в настоящем документе способу для контроля роста микроорганизмов в порошок или концентрат перед их хранением можно примешивать консерванты. Вместо добавления в порошок или в концентрат или в дополнение к нему консерванты также можно добавлять на другом этапе получения, в том числе перед лиофилизацией или стадией концентрации. Подходящие консерванты включают обычные пищевые консерванты, такие как 0,5% масс./масс. бензоат натрия и 0,2% масс./масс. сорбат калия. Специалист может выбрать другие подходящие консерванты.
Полученные описываемыми в настоящем документе способами порошки можно хранить в подходящих по существу герметичных контейнерах. Подходящие контейнеры включают пластиковые пакеты, бочки, пластиковые контейнеры, флаконы, их сочетания и т.п. Например, порошок можно упаковывать в контролируемых асептических условиях в стерильные полиэтиленовые/полипропиленовые флаконы с защищающими от неумелого обращения пломбами. Порошок можно хранить в атмосфере по существу сухого инертного газа, такого как азот. Предпочтительно хранить порошок при комнатной температуре или холоднее, например, при температуре в диапазоне приблизительно от 10°C приблизительно до 25°C, более предпочтительно в диапазоне приблизительно от 15°C приблизительно до -20°C. При длительном хранении предпочтительно хранить порошок при температуре приблизительно -10°C или ниже или более предпочтительно -20°C или ниже. Можно хранить порошок в течение периода времени по существу в сухой атмосфере. Порошок также можно хранить в вакуумной упаковке.
По другому варианту осуществления настоящего изобретения получают суспензию, как описано выше, или могут получать ее отделением содержимого или эмбрионов от яичной скорлупы, по меньшей мере, из одного оплодотворенного яйца, и складывают отделенное содержимое или эмбрионы в подходящий контейнер. На этом этапе можно охлаждать отделенное содержимое или эмбрионы. Например, можно помещать контейнер в лед для облегчения охлаждения. Для получения суспензии можно перемешивать содержимое и эмбрионы с применением способов, описанных выше. На фиг.5 представлен пример контейнера с суспензией эмбрионов. Можно лиофилизировать суспензию как описано выше или частично или полностью использовать для экстракции следующим образом.
Водную экстракцию можно проводить, смешивая суспензию с водным раствором в течение периода времени. Водный раствор может содержать воду, водный буфер или любой другой водный растворитель. Если водный раствор содержит воду, предпочтительно дистиллировать воду, а более предпочтительно также деионизировать воду перед применением. Например, воду можно обрабатывать, используя обратный осмос (R.O.). Можно перемешивать суспензию и водный раствор, например, посредством встряхивания в течение периода времени, где период времени находится в диапазоне приблизительно от 5 приблизительно до 60 минут, более предпочтительно в диапазоне приблизительно от 10 приблизительно до 45 минут и даже более предпочтительно в диапазоне приблизительно от 15 приблизительно до 40 минут. Желательно, чтобы водный раствор обладал достаточным воздействием на содержимое суспензии, с тем чтобы любые по существу гидрофильные молекулы в растворе были растворены в водном растворе. Можно использовать объем водного раствора по существу эквивалентный объему суспензии, но можно использовать объем в 1,5 раза, 2 раза или даже 3 раза превосходящий объем суспензии. Необязательно можно слегка нагревать смесь на этапе перемешивания. После перемешивания водный раствор можно по существу очищать, удаляя любую твердую фракцию в смеси с применением подходящих способов, таких как центрифугирование или фильтрация. Затем очищенную водную фракцию замораживают и лиофилизируют для получения порошка, который необязательно можно стерилизовать способами, описываемыми в настоящем документе.
По другому аспекту изобретения, полученную описываемыми выше способами суспензию можно перемешать по существу с гидрофобным растворителем. Предпочтительно охлаждать по существу гидрофобный растворитель. Подходящие гидрофобные растворители включают, например, простой эфир, хлороформ, гексан, петролейный эфир или ацетонитрил. Например, можно использовать простой эфир, особенно простой диэтиловый эфир. Суспензию перемешивают с гидрофобным растворителем в течение периода времени, как описано выше. Специалисту в соответствующих областях будет понятно, что любые этапы способа с применением по существу гидрофобного растворителя нужно проводить в вытяжном шкафу или подобном устройстве, и растворители необходимо держать вдали от открытого пламени и источников тепла. После периода перемешивания твердые фракции смеси можно по существу удалить из фракции растворителя подходящими способами, такими как центрифугирование и фильтрация. Фракция растворителя будет содержать по существу гидрофобный растворитель, а также может содержать водную фракцию. Фракцию растворителя можно переносить в делительную воронку или по существу эквивалентное устройство для разделения водной фракции и фракции гидрофобного растворителя. Если верхним слоем является фракция гидрофобного растворителя, то ее можно пропускать через сифон или удалять из делительной воронки после удаления нижней водной фракции. Альтернативно, можно замораживать нижнюю водную фракцию, тем самым позволяя верхнему основанному на эфире слою отстояться. Водную порцию можно экстрагировать с гидрофобным растворителем несколько раз, например, приблизительно 3 раза. Можно использовать объем гидрофобного растворителя, по существу эквивалентный объему водной фракции, но можно использовать объем, в 1,5 раза, 2 раза или даже 3 раза превосходящий объем водного растворителя. Также подходят и другие соотношения.
После экстракции все гидрофобные изоляты можно объединять и концентрировать подходящим способом. Концентрированные изоляты можно хранить при температуре ниже комнатной, такой как приблизительно 5°C, в подходящем контейнере, который по существу герметичен, такой как герметичный.
По другому аспекту изобретения полученную любым из вышеописанных способов суспензию можно очищать перед экстракцией. Предпочтительные этапы очистки включают способы фильтрации с применением таких фильтров, как сито или фильтровальная бумага или подушка. Другие этапы очистки могут включать способы центрифугирования. К фильтрату, полученному на этапе фильтрования до этапа очистки, можно добавлять ускоритель фильтрования, такой как Superflow DE™. Некоторое количество полученного в результате фильтрата можно замораживать в подходящем контейнере для лиофилизации. Также некоторое количество полученного в результате фильтрата можно перемешивать с гидрофобным растворителем, как описано выше, так чтобы сформировать водный слой и гидрофобный слой. Слои можно разделять, концентрировать и хранить, как описано в настоящем документе.
Чтобы увеличить эффективность, изолят оплодотворенных яиц, полученный различными способами, описываемыми в настоящем документе, можно составлять, повторяя и/или сочетая способы. Например, экстракцию водного и/или гидрофобного растворителя можно повторять на одном и том же образце для концентрирования активных соединений.
Изолят оплодотворенных яиц - применение
Изолят оплодотворенных яиц, полученный способами, описываемыми в настоящем документе, или полученный сходными способами, которые очевидны для специалиста на основе настоящего изобретения, можно использовать для лечения пациентов, страдающих психическими расстройствами, включая депрессивные аффективные расстройства, такие как большое депрессивное расстройство, дистимию, депрессивную фазу биполярного расстройства, депрессию, обусловленную общим состоянием здоровья, такую как депрессия, связанная с деменцией или шизоаффективное расстройство, депрессию, вызванную приемом веществ и сезонную депрессию, тревожное расстройство, такое как генерализованное тревожное расстройство, социофобия и паническое расстройство, и половую дисфункцию. Как будет понятно специалисту в соответствующих областях, лечение таких расстройств, как депрессия или тревожность, может стать удобным подходом для лечения других расстройств и/или синдромов, с которыми они могут быть ассоциированы, такими как те, что приведены выше. В одном из вариантов осуществления пациент является человеком.
Как подробно описано в настоящем документе, определяли, что изолят оплодотворенных яиц по настоящему изобретению противодействует связывающим взаимодействиям определенных лигандов с их рецепторами. В частности, обнаружили, что изолят оплодотворенных яиц по настоящему изобретению обладает способностью вытеснять глутамат из четырех его главных рецепторов. Кроме того, изолят оплодотворенных яиц может вытеснять нейромедиатор нейрокинин A (NKA) из его рецептора, нейрокинин 2 (NK2-рецептор). По данным авторов настоящего изобретения, это первый известный случай, когда этим двум группам рецепторов противодействует одно вещество.
Глутаминовая кислота (глутамат) является одним из наиболее возбуждающих веществ в головном мозге человека. Известно, что ряд заболеваний и состояний регулируются или связаны с активацией одного или нескольких рецепторов глутамата. Эти заболевания и состояния включают депрессию (см., например, Paul, Toro, Mathew 2005, Krystal, Sanacora 2003, Svenningsson, McNally), большое депрессивное расстройство (см., например, Maeng, Chourbaji, Mathew 2008), тревожность (см., например, Rorick-Kehn), болезнь Альцгеймера (см., например, Walton, Koch, Hynd), эпилепсию (см. например, Kew, Vincent), шизофрению (см., например, McCullumsmith, Lewis, MacDonald, Javitt), нарушение функций клеток головного мозга после инсульта/ишемии (см., например, Ginsberg, Kew), боковой амиотрофический склероз (болезнь Лу Герига) (см., например, Mathew 2008, Miller), латиризм (см., например, Spencer, Ravindranath), аутизм (см., например, Chez), задержку умственного развития (см., например, Bowie), нарушение восприятия (см., например, Cheon), биполярную депрессию (см., например, Mathew 2008) и манию (см., например, Krystal). Кроме того, показано, что антагонисты рецептора глутамата, такие как кетамин и рилузол, можно использовать для лечения депрессии (Mathew 2008), большого депрессивного расстройства (Maeng, Mathew 2008, Zarate 2004, Sanacora 2007), бокового амиотрофического склероза (Mathew 2008, Miller) и биполярной депрессии (Mathew 2008, Zarate 2005). Ингибирование активации одного или нескольких рецепторов глутамата посредством ингибирования связывания глутамата с его рецептором может ослабить или устранить состояния или заболевания, регулируемые или ассоциированные с одним или несколькими рецепторами глутамата. Поскольку было определено, как описано в настоящем документе, что изолят оплодотворенных яиц по настоящему изобретению связывается с одним или несколькими рецепторами глутамата, то изолят оплодотворенных яиц по настоящему изобретению можно использовать для лечения заболеваний и состояний, связанных или регулируемых одним или несколькими рецепторами глутамата.
Таким образом, другой аспект изобретения описывает способ лечения заболевания или состояния, ассоциированного или регулируемого рецептором глутамата, с применением изолята оплодотворенных яиц, способ, включающий этап введения терапевтически эффективного количества изолята оплодотворенных яиц нуждающемуся в этом пациенту. Среди таких рецепторов глутамата существуют ионотропные рецепторы глутамата, например, рецептор α-амино-3-гидроксил-5-метил-4-изоксазол-пропионата (AMPA), каинатный рецептор и рецептор N-метил-D-аспарагиновой кислоты (NMDA). Заболевание или состояние, ассоциированное или регулируемое рецептором глутамата, может включать депрессию, большое депрессивное расстройство, тревожность, болезнь Альцгеймера, эпилепсию, шизофрению, нарушение функций клеток головного мозга после инсульта/ишемии, боковой амиотрофический склероз (болезнь Лу Герига), латиризм, аутизм, задержку умственного развития, нарушение восприятия, биполярную депрессию или манию.
Также известен ряд заболеваний и состояний, регулируемых или связанных с активацией NK2-рецепторов. Такие заболевания или состояния включают депрессию (см., например, Dableh, Ahlstedt, Michale, Louis, Steinberg, Salome, Holmes, Steinberg, Husum), тревожность (см., например, Ahlstedt, Michale, Louis, Greibel, Steinberg, Stratton, Teixeira, Walsh, Salome, Holmes), синдром раздраженного или воспаленного кишечника (см., например, Ahlstedt, Lecci, Evangelista, Toulouse), воспалительные заболевания дыхательных путей (см., например, Bai) и недержание мочи (см., например, Ahlstedt, Rizzo). Кроме того, показано, что антагонисты NK2-рецепторов, такие как саредутант (SR 48964), можно использовать для повышения антидепрессант-подобных эффектов (Salome, Dableh, Steinberg, Michale, Louis) и анксиолитических эффектов (Teixeira, Salome, Griebel, Michale, Louis) на животных моделях, также проводили исследования на людях. Ингибирование активации NK2-рецепторов посредством ингибирования связывания эндогенного лиганда (лигандов) NK2, например NKA, с его рецептором может ослабить состояния или заболевания, регулируемые или ассоциированные с NK2-рецепторами. Поскольку было определено, как описано в настоящем документе, что изолят оплодотворенных яиц по настоящему изобретению связывается с NK2-рецепторами, то изолят оплодотворенных яиц по настоящему изобретению можно использовать для лечения заболеваний и состояний, ассоциированных или регулируемых NK2-рецепторами.
Таким образом, другой аспект изобретения описывает способ лечения заболевания или состояния, ассоциированного или регулируемого NK2-рецепторами, с применением изолята оплодотворенных яиц, способ, включающий этап введения терапевтически эффективного количества изолята оплодотворенных яиц нуждающемуся в этом пациенту. Заболевания или состояния, ассоциированные или регулируемые NK2-рецепторами, могут включать депрессию, тревожность, синдром раздраженного кишечника или недержание мочи.
Изолят оплодотворенных яиц, используемый для лечения заболевания или состояния, ассоциированного или регулируемого одним или несколькими рецепторами глутамата и NK2-рецепторами, может содержать лиофилизированный эмбрион, овальбумин и чистый желточный мешок из оплодотворенного яйца или он может быть получен так, что не содержит существенного количества желтка из оплодотворенного яйца. Изолят оплодотворенных яиц можно получать способами, описываемыми в настоящем документе, или сходными способами, известными специалистам в данной области. В способах лечения заболевания или состояния, ассоциированного или регулируемого рецепторами глутамата или NK2-рецепторами, пациент может проходить или не проходить психотерапию одновременно с лечением.
Другим аспектом изобретения являются способы лечения психических расстройств, включающие введение изолята оплодотворенных яиц нуждающемуся в этом пациенту и применение изолята оплодотворенных яиц для таких целей.
Изолят оплодотворенных яиц, описываемый в настоящем документе, можно составлять и вводить в различных лекарственных формах, таких как пригодные для введения пероральным (включая буккальным и сублингвальным), ректальным, назальным, местным (включая буккальный, сублингвальный и трансдермальный), вагинальным, ректальным или парентеральным (включая подкожный, внутримышечный, внутривенный или внутрикожный) путями. Особенно предпочтительны лекарственные формы, пригодные для введения пероральным путем. Другие предпочтительные лекарственные формы включают пригодные для введения вагинальным или ректальным путем, такие как суппозитории.
Составы изолята оплодотворенных яиц, пригодные для перорального введения, можно выпускать в виде отдельных единиц, таких как капсулы, таблетки, микрочастицы, порошки, гранулы, растворы или суспензии в водных или неводных жидкостях, съедобных пен или муссов, или эмульсии "масло-в-воде" или "вода-в-масле". Изолят оплодотворенных яиц можно сочетать с подходящим пероральным фармацевтически приемлемым инертным носителем. В случае капсул подходящий инкапсулятор, такой как желатиновая оболочка, можно использовать для заключения в капсулу исключительно изолят оплодотворенных яиц или в сочетании с подходящим нетоксичным фармацевтически приемлемым инертным носителем (носителями). В отношении таблеток и капсул, например, приемлемые носители могут включать в качестве неограничивающих примеров съедобный углевод, такой как, например, крахмал или маннит, ароматизаторы, консерванты, дисперсанты, связывающие средства и красители, и может включать коллоидальную двуокись кремния. Также можно получать состав для продления или поддержания высвобождения изолята оплодотворенных яиц способами, известными специалисту в технологиях приготовления лекарственных средств.
Эффективная доза для лечения зависит от пациента. Эффективная доза может находиться в диапазоне приблизительно от 200 приблизительно до 6000 мг/день, или приблизительно от 500 приблизительно до 4000 мг/день, или приблизительно от 750 мг/день приблизительно до 3500 мг/день, или приблизительно от 800 до 3000 мг/день, или приблизительно от 1000 до 2500 мг/день. Например, эффективная доза может составлять приблизительно 2000 мг/день.
Термин "лечить" означает улучшение заболевания или состояния пациента, которому вводят изолят оплодотворенных яиц по настоящему изобретению. Этот термин включает улучшение заболевания или состояния, и такое улучшение можно определить стандартными тестами, известными в данной области. Термин также включает предотвращение возникновения или повторного возникновения заболевания или состояния, как при профилактической и поддерживающей терапии.
Другой аспект изобретения описывает способ ингибирования активности рецепторов глутамата, включающий контакт рецепторов глутамата с эффективным количеством изолята оплодотворенных яиц. Этот способ можно исполнить с применением ионотропного рецептора глутамата, например, AMPA-рецептора, каинатного рецептора или NMDA-рецептора.
Кроме того, изобретение описывает способ ингибирования активности NK2-рецепторов, включающий контакт NK2-рецепторов с эффективным количеством изолята оплодотворенных яиц.
Активность рецептора глутамата или NK2-рецептора можно ингибировать, например, ингибированием связывания рецептора с его эндогенным лигандом (лигандами) (например, глутамата для рецепторов глутамата и NKA для NK2-рецепторов) или коммерчески доступными экзогенными лигандами, такими как AMPA, NMDA, каинат, CGP 39653 или MDL-105,509 для рецепторов глутамата, и саредутант для NK2-рецепторов. Способы ингибирования таких связывающих взаимодействий и определения таких связывающих взаимодействий известны специалистам в данной области и также описаны в настоящем документе. Активность рецепторов глутамата или NK2-рецепторов можно ингибировать на 100% или менее чем 100% (например, на 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20% или 10%). Способы ингибирования активности рецепторов глутамата или NK2-рецепторов можно исполнять in vitro (например, на клетках, клеточном лизате или образце, содержащем фракцию клеток, например, с точно соответствующим рецептором) или in vivo (например, на пациенте человеке).
По дополнительному варианту осуществления изобретения изолят оплодотворенных яиц можно смешивать с другими соединениями, пригодными для лечения психических расстройств. Например, изолят оплодотворенных яиц можно смешивать с соединениями, которые могут ингибировать распад серотонина, такими как ингибиторы моноаминоксидазы.
Однако другие задачи и преимущества настоящего изобретения будут очевидны специалистам в данной области из подробного описания, где описаны только предпочтительные варианты осуществления просто в качестве иллюстрации. Как будет понятно, возможны другие и иные варианты осуществления изобретения и возможна модификация нескольких его деталей в различных наглядных отношениях, все без отклонения от изобретения. Таким образом, описание и примеры ниже являются иллюстративными и неограничивающими.
ПРИМЕРЫ
Пример 1
Отбирали 8-9 дневные оплодотворенные яйца курицы. Целое яйцо дезинфицировали 70% этанолом и оставляли в вытяжном шкафу, позволяя 70% этанолу испариться. Яйца разбивали и содержимое пропускали через стерильное 1,0 мм сито. Скорлупки и фильтрат выбрасывали. Ретентат, и твердый, и жидкий, собирали и охлаждали на льду. Ретентат гомогенизировали при 5°C. Гомогенат (суспензию) выливали в стерильные лотки из нержавеющей стали, замораживали и лиофилизировали. Высушенный продукт распыляли мельницей. В порошок добавляли консерванты 0,5% масс./масс. бензоат натрия и 0,2% масс./масс. сорбат калия и перемешивали смесь. Конечный порошок хранили при 2-8°C (короткий период) или -20°C (долгий период).
Пример 2
Эмбрионы курицы собирали на 8 день из оплодотворенных яиц курицы следующим способом:
(i) получали 24 коричневых яйца;
(ii) при разбивании обнаруживали, что только 22 из 24 яиц оплодотворены и содержат развивающийся эмбрион (91,6% процент оплодотворения);
(iii) в кратком изложении эмбрионы удаляли и промывали (x2) в стерильном PBS и немедленно замораживали при -20°C в индивидуальных 50 мл (миллилитр) пробирках;
(iv) 10 пробирок лиофилизировали в лиофилизаторе (температура полки = -40°C, температура конденсора -52°C);
(v) в конце цикла отдельные эмбрионы (пока в пробирках) измельчали стерильным стеклянным штабиком, полученный порошок (1,7 г) упаковывали;
(vi) 12 оставшихся эмбрионов складывали в маленький лабораторный стакан и смешивали с небольшим количеством воды с применением переносного измельчителя;
(vii) полученную суспензию немедленно замораживали и впоследствии лиофилизировали, как описано выше.
Результаты
Однократно высушенный порошок (1,7 г) рассеивали и гомогенизировали стеклянным штабиком = Lot# A. Каждый эмбрион давал 0,17 г порошка.
Высушенную суспензию (1,6 г) распыляли и гомогенизировали стеклянным штабиком = Lot# B. Каждый эмбрион давал 0,14 г порошка (влагосодержание неизвестно).
Пример 3
Получали 60 оплодотворенных яиц (8-дневные эмбрионы). Далее приведено получение водного и эфирного изолятов.
Все яйца опрыскивали 70% (об./об.) этанолом для стерилизации внешней поверхности и оставляли для испарения спирта в ламинарном шкафу. Яйца разбивали, и эмбрионы и прикрепленный чистый желточный мешок с его чистым водянистым содержимым аккуратно отделяли от остального желтка и сосудистого материала. Затем весь материал, представляющий собой эмбрион и чистые желточные мешки, складывали в охлажденный на льду лабораторный стакан. После сбора материал смешивали с помощью переносного измельчителя, получая суспензию.
Полученную суспензию (приблизительно 200 мл) распределяли на две одинаковые половины; одна была использована для экстракции с водой, другая - для экстракции с простым эфиром.
Водный изолят
К 100 мл суспензии добавляли 100 мл R.O. воды и материал перемешивали при комнатной температуре в течение 30 минут. Материал очищали посредством центрифугирования и собирали водный верхний слой (200 мл 1,1% сухого остатка). Затем водный верхний слой замораживали и впоследствии лиофилизировали. Сухой порошок весил 1,0 г.
Эфирный изолят
К 100 мл суспензии добавляли 100 мл предварительно охлажденного простого эфира. Смесь встряхивали при комнатной температуре и затем подвергали центрифугированию. В конце периода центрифугирования (15 минут при 5°C) верхний водный/эфирный слой переносили в делительную воронку и собирали верхний слой простого эфира, либо пропуская через сифон, либо отстаивая его после замораживания при -20°C, когда нижний мутный водяной слой замерзает, оставляя верхний чистый желтый слой простого эфира незамороженным.
Снова экстрагировали нижний водный слой эквивалентным объемом простого эфира, как описано выше, и способ повторяли три раза. Эфирный изолят концентрировали и высушивали в устройстве Rotavap™ до небольшого объема (приблизительно 1 мл). Образец хранили при 5°C.
Пример 4
Четыреста двадцать оплодотворенных яиц (8-9-дневные эмбрионы) опрыскивали 70% (об./об.) этанолом для стерилизации внешней поверхности настолько, насколько это возможно, и яйца оставляли для испарения спирта в вытяжном шкафу.
Яйца разбивали (обнаруживали, что 62 из 420 не оплодотворены, процент оплодотворения = 85,2%) и эмбрионы с их прикрепленным желточным мешком с его чистым водянистым содержимым аккуратно отделяли от остального желтка и сосудистого материала, и весь материал, который представляет собой эмбрион и чистые мешки, складывали в охлажденный на льду лабораторный стакан. Собранный материал (приблизительно 2 л) хранили при 5°C.
Водный изолят
После сбора материал смешивали переносным измельчителем, получая суспензию. Полученную суспензию (приблизительно 2 л) пропускали через металлическое сито (сито № 20). Далее фильтрат очищали с применением бумажной фильтровальной подушки и DE 6000. Осадок, оставшийся на фильтре, выбрасывали. К фильтрату добавляли Superflow DE™, затем материал очищали, пропуская через фильтрационную подушку. Всю фильтрацию проводили с помощью воронки Бюхнера на лабораторном уровне. Большинство (приблизительно 1200-1300 мл) полученного фильтрата отделяли и немедленно замораживали для лиофилизации в лотках (1,9% сухого остатка). Оставшиеся 500 мл перемешивали с эквивалентным объемом предварительно охлажденного этилового эфира в 1 л бутылке и хранили при 5°C до разделения двух слоев.
Эфирный изолят
К 500 мл суспензии добавляли 500 мл предварительно охлажденного простого эфира, смесь встряхивали при комнатной температуре и затем подвергали центрифугированию. В конце периода центрифугирования (15 минут при 5°C) верхний водный/эфирный слой переносили в делительную воронку и верхний слой простого эфира собирали, либо пропуская через сифон, либо отстаивая его после замораживания при -20°C, когда нижний мутный водяной слой замерзает, оставляя верхний чистый желтый слой простого эфира не замороженным.
Водный нижний слой снова экстрагировали 300 мл простого эфира, как описано выше, и изолят складывали в предварительно охлажденную круглодонную колбу. Эфирный изолят концентрировали и высушивали в устройстве Rotavap™ до небольшого объема. Образец хранили при 5°C.
Пример 5
Изолят оплодотворенных яиц A
Для получения изолята оплодотворенных яиц A 8-9-дневные целые оплодотворенные яйца курицы дезинфицировали 70% этанолом и оставляли в вытяжном шкафу, позволяя растворителю испариться. Яйца разбивали и содержимое пропускали через стерильное 1,0 мм сито. Скорлупки и фильтрат выбрасывали. Ретентат, содержащий эмбрион, чистый желточный мешок и весь или значительную часть яичного белка, состоящего из твердой, полутвердой и/или жидкой фракций, охлаждали на льду и гомогенизировали при 5°C. Гомогенат (суспензию) выливали в стерильные лотки из нержавеющей стали и лиофилизировали. Для получения изолята А высушенный продукт распыляли в мельнице. К изоляту А добавляли консерванты бензоат натрия (0,5% масс./масс.) и сорбат калия (0,2% масс./масс.) и смесь перемешивали. Конечный порошок хранили при 2-8°C (короткий период) или -20°C (долгий период).
Анализ с применением ВЭЖХ
Конечный порошок, содержащий изолят оплодотворенных яиц A, анализировали с применением высокоэффективной жидкостной хроматографии (ВЭЖХ). Результаты измеряли с применением многоволнового детектора поглощения. Поглощение считывали при 215 нм. Для фракционирования использовали эксклюзионную колонку Pharmacia Superdex 200 10/300GL (10 мм i.d. × 300 мм). Диапазон разделения колонки составляет 10 кДа-600 кДа. Колонку уравновешивали 20 мМ фосфат + 0,3 Μ NaCl, pH 7,5. Образец анализировали при скорости потока 0,5 мл/мин. Характерная хроматограмма представлена на фиг.6.
Сертификат анализа
Конечный порошок, содержащий изолят A, подвергали стандартному анализу измерения чистоты и содержания белков, жиров, карбоната калия, влаги и различных примесей. Характерный образец результатов представлен на фиг.7.
Состав капсулы А
Для получения капсулы состава A 4000,0 г (+/- 2%) конечного порошка, содержащего изолят A, бензоат натрия (0,5% масс./масс.) и сорбат калия (0,2% масс./масс.) смешивали с 40 г (+/- 2%) коллоидальной двуокисью кремния с применением геометрического разведения. Смесь процеживали, затем повторяли смешивание и процеживание, получая состав A. Смесь состава A помещали в капсулу с применением белых капсул Mini-Cap 300#0 для достижения массы наполнения 505 мг и получения капсулы состава А.
Пример 6
Исследование состава A для лечения большого депрессивного расстройства (MDD) и относящихся к нему расстройств/симптомов
Исследовали эффективность и безопасность фиксированных доз состава А для лечения психических расстройств, таких как MDD и связанных с ним расстройств и симптомов. Это исследование включает оценку эффекта состава A на снижение симптомов тревожности, улучшение качества жизни и улучшение симптомов половой дисфункции.
Описание способов оценки
Шкала Гамильтона для оценки депрессии-17 пунктов - "HAM-D" или "HAM-D 17"
Это ведущая оценочная шкала, применяемая в Северной Америке для оценки депрессии у пациента. Итоговые показатели интерпретируют следующим образом: очень тяжелая, >23; тяжелая, 19-22; умеренная, 14-18; средняя, 8-13; и нет депрессии, 0-7.
Шкала Гамильтона для оценки тревожности-14 пунктов - "HAM-A"
По этой шкале оценивают тревожность пациента. Уровень баллов интерпретируют следующим образом: <17, легкая; 18-24, от мягкой до умеренной; и 25-30, от умеренной до тяжелой.
Шкала Монтгомери-Асберга для оценки депрессии - "MADRS"
Это ведущая оценочная шкала, применяемая в Северной Америке для оценки депрессии у пациента. Следующие средние баллы по данному исследованию соотносятся с мировыми критериями тяжести: очень тяжелая, 44; тяжелая, 31; умеренная, 25; легкая, 15; и выздоровление, 7.
Шкала депрессии Бека - "BDI"
Это повсеместно применяемый критерий симптомов депрессии, как правило, используемый в качестве средства самообследования. Итоговый показатель является простой суммой баллов по 21 пункту. Как правило, показатель <9 свидетельствует об отсутствии или минимальной депрессии, 10-18 свидетельствует о легкой-умеренной депрессии, 19-29 свидетельствует об умеренной-тяжелой депрессии и >30 свидетельствует о тяжелой депрессии. Однако показатель 0-4 может означать возможное отрицание депрессии и показатель 40-63 может означать возможное преувеличение депрессии или гистрионного или пограничного расстройства личности.
Аризонская шкала сексуального опыта - "ASEX"
Это оценочная шкала из 5 пунктов, которая определяет половое влечение и оценивает уровни возбуждения, вагинальной смазки/эрекции, способности достичь оргазма и удовлетворения от оргазма.
Возможный итоговый результат находится в диапазоне от 5 до 30, где более высокий показатель свидетельствует о большей половой дисфункции.
Общий опросник здоровья - "GHQ"
Определение качества жизни можно проводить с применением краткой формы 36 (SF-36). По этому опроснику оценивают такие проблемы, как способность к концентрации, чувство беспокойства, низкую уверенность в себе, низкую самооценку, несчастье и депрессию. Показатели оценивают следующим образом:
Шкала Ликерта 0, 1, 2, 3 слева направо.
12 пунктов, от 0 до 3 каждый пункт.
Диапазон показателей от 0 до 36.
Показатели изменяются при исследованиях на популяции. Типичны показатели приблизительно 11-12.
Показатель >15 является свидетельством расстройства.
Показатель >20 свидетельствует о тяжелых проблемах и психологическом стрессе.
Диагностическое и статистическое руководство по психическим расстройствам - IV - переработанное издание - "DSM-IV TR"
Это стандартное диагностическое руководство для специалистов по психическому здоровью в Северной Америке, которое всесторонне классифицирует психические расстройства и предоставляет широко распространенные критерии для их диагностики, основанные на лучших доступных опытных доказательствах.
Измеренный первичный эффект представлял собой многократный дисперсионный анализ со шкалой HAM-D в качестве переменной исходов. Измерения вторичных эффектов включают CGI-S и CGI-I, MADRS, SF36, BDI, HAMA и ASEX.
Описание исследования
В госпитале Mount Sinai Hospital (MSH), Торонто, Онтарио, Канада проводили открытое клиническое исследование. Пациентов набирали посредством объявления в средствах массовой информации, направлений от врача из амбулаторной программы MSH и из других клинических центров.
Данный протокол описывает опытное пилотное исследование для изучения потенциальной антидепрессантной активности состава А. Целью данного исследования является демонстрация того, что состав А обладает потенциалом для значительного снижения MDD помимо уровней известного эффекта плацебо, установленного в других исследованиях, и того, что состав А является подходящим лечением для этой группы пациентов. Второй целью данного пилотного исследования является оценка эффекта состава А на снижение симптомов тревожности и улучшение качества жизни.
Каждого пациента обследовали на наличие MDD с применением критериев DSM-IV TR и HAM-D. Однократно поступив, они подписывались на открытое клиническое исследование состава А на период 8 недель. Затем пациентов обследовали с применением глобальной меры, шкал тяжести CGI (GCI-S) и улучшения (CGI-I). Побочные эффекты систематически оценивали с применением оценочной шкалы побочных эффектов The Udvalg for Kliniske Undersogelser (UKU) (Lingjaerde). Вторичные измерения симптомов депрессии проводили с применением шкалы Монтгомери-Асберга для оценки депрессии (MADRS) и шкалы депрессии Бека (BDI) в качестве средств самообследования. Определение качества жизни проводили с применением краткой формы 36 (SF-36). Тревожность оценивали с применением 14-пунктной HAM-A.
В открытом исследовании фиксированной дозы пациентов лечили от депрессии, основываясь на стандартных протоколах лечения депрессии. Исследователи определяли тяжесть депрессии с применением оценочной шкалы в начале исследования и при повторных посещениях на 2, 4, 6 и 8 неделях (W). В промежуточных неделях для оценки депрессии и толерантности к лекарственным средствам проводили краткие клинические обследования пациентов (V).
Дозировка состава A
Дозировка состава A составляла приблизительно 2000 мг/день (2 капсулы состава A приблизительно 500 мг каждая, принимаемые перорально дважды в сутки).
Критерии включения пациентов
Для включения в данное исследование пациенты должны обладать рядом критериев включения, включая критерии (i)-(vi), как описано ниже.
(i) Клинический диагноз удовлетворяет критериям DSM-IV TR для большого депрессивного расстройства, единичного эпизода или рецидива.
(ii) Итоговый показатель 17-пунктной шкалы Гамильтона для оценки депрессии (HAM-D 17 пунктов) в начале исследования составляет 18 или выше.
(iii) Мужчины/женщины возрастом 18-65 лет, нуждающиеся в новом или измененном медикаментозном лечении диагностированной большой депрессии. Решения о лечении принимали исключительно на основе клинических стандартов ухода, адекватных для пациента. Однако стратегию интенсификации в течение 8-недельного клинического исследования не допускали.
(iv) Грамотный английский язык.
(v) Полученное подписанное информированное согласие.
(vi) Отрицательный тест на беременность.
Критерии исключения
Пациентов исключали из данного исследования, если они обладали рядом критериев исключения, включая критерии (i)-(xiii), как описано ниже.
(i) Любой другой диагноз DSM IV TR включает клинический диагноз депрессия, отличающийся от DSM-IV TR MDD (единичный эпизод/рецидив, например исключали хроническую депрессию и/или резистентную депрессию).
(ii) Имеется значительный риск суицида (пункт суицида HAMD >1) или история, свидетельствующая о значительной существующей возможности самоповреждения.
(iii) Прием любых антидепрессантов, кроме состава А.
(iv) Индивидуумы, принимающие и неспособные или нежелающие прерывать прием натуральных продуктов для здоровья, используемых при депрессии.
(v) Беременные, кормящие, собирающиеся забеременеть в следующие 12 месяцев или недостаточно предохраняющиеся женщины.
(vi) Клинически значимые заболевания систем органов, например сердечно-сосудистые, заболевания печени, заболевания почек, эндокринные, желудочно-кишечные, заболевания обмена веществ или другие системные заболевания.
(vii) Курс электросудорожной терапии (ЕСТ) в обозримый период.
(viii) Страдающие от больших неврологических заболеваний (т.е. болезни Паркинсона, болезни Гентингтона), цереброваскулярной болезни (т.е. инсульта), болезней обмена веществ (т.е. дефицита витамина B12), аутоиммунных заболеваний (т.е. системной красной волчанки), вирусной или другой инфекции (т.е. гепатита, мононуклеоза, иммунодефицита человека) или рака.
(ix) Клинический или субклинический гипо/гипертиреоидизм (например, повышенный тиреотропин).
(x) Аллергия на птицу или яйца.
(xi) Индивидуумы, проходящие психотерапию или начинающие проходить психотерапию во время исследования.
(xii) Индивидуумы с клинически значимыми ненормальными результатами анализов крови и мочи.
(xiii) Индивидуумы, чье состояние ухудшилось в течение периода вымывания.
Дизайн исследования
Проводили одностороннее, открытое, рандомизированное исследование 25 пациентов, предназначенное для валидации эффективности и безопасности монотерапии составом А.
Исследование заключалось в 8-недельном оценочном периоде, предваряемом в случае необходимости 2-недельным периодом вымывания антидепрессантов.
Скрининг
Как только врач и/или координатор исследования полностью информировали индивидуума об исследовании, характере лечения и других доступных ему опциях и индивидуум подписывал документ об информированном согласии, врач ставил клинический диагноз DSM IV TR и проводил HAM-D 17. После осмотра составляли медицинскую и психиатрическую историю болезни и обзор сопутствующей терапии подходящих индивидуумов. Кроме того, координатор исследования проводил начальные лабораторные анализы, включая анализ мочи (общий и микроскопический), клинический анализ крови и тромбоцитов, анализы на электролиты, билирубин, остаточный азот, тиротропин, креатинин, функциональные тесты печени, сывороточный креатинин и ЭКГ. Тестирование на беременность пациентов женского пола проводили с применением теста на содержания хорионического гонадотропина в крови. Исключали беременных пациенток и пациентов с ненормальными результатами лабораторных анализов.
Неделя 0
Пациенты возвращались для начального посещения (неделя 0), и врач назначал им монотерапию составом A. Пациентам с депрессией и принимающим неэффективный антидепрессант предлагали перейти на состав А.
Следующие недели
После исходного назначения и начала терапии составом А (V1 и V2) каждую неделю в течение 8 недель происходили плановые посещения (W2-W8, V3-V6). Те, кто принимал другой антидепрессант и решил участвовать в исследовании, проходили 1-2-недельный период вымывания до начала 8-недельного активного исследования лекарственного средства. Период вымывания проводили по усмотрению врача. В течение этого времени при посещении на одной неделе периода вымывания пациентов контролировал психиатр, а затем в середине недели по телефону контролировал координатор исследования. Установлено, что депрессия может ухудшаться в течение периода вымывания. Однако если первичное лекарственное средство было неэффективным или частично неэффективным, риски того, что 1-2-недельный перерыв значительно стимулирует ухудшение депрессии по данному протоколу незначительно выше, чем при обычном наблюдении при условии, что индивидуумов тщательно контролируют в течение этого времени и осуществляют адекватное вмешательство по мере необходимости. Если состав A является неэффективным антидепрессантом для отдельного пациента, то может возникнуть риск чрезмерной пролонгации депрессии. Однако депрессия является хроническим расстройством, которое, как правило, существует месяцами до постановки диагноза или лечения, таким образом, дополнительные 8 недель при тщательном мониторинге и приеме состава А, потенциально эффективного лекарственного средства не должны существенно отличаться от стандартного лечения.
Кроме того, стандартное лечение, как уже указано, эффективно только для приблизительно 60% пациентов и таким образом часто требует такой же возможной переоценки и изменения медикаментозного лечения.
С V2 (можно комбинировать с V1 (W0)) до V6 (W8) наблюдающий психиатр (PI) и/или координатор исследования проводили следующие процедуры:
- Вес
- Рост
- Показатели жизненно важных функций
- Шкала Гамильтона для оценки депрессии (17 пунктов) (HAM-D 17) (Hamilton 1967)
- Общее клиническое впечатление (CGI-S, CGI-I) (Guy)
- Шкала Монтгомери-Асберга для оценки депрессии (MADRS) (Montgomery)
- Шкала Бека для оценки депрессии (BDI) (10) - Качество жизни (SF-36) (Ware)
- Шкала Гамильтона для оценки тревожности (HAMA) (Hamilton 1959)
- Udvalg for Kliniske Undersogelser (UKU) (Lingjaerde) (Отчет о побочных эффектах) (кроме V2)
- Приверженность лечению (кроме V2)
Посещения в ходе исследования продолжались приблизительно один час за исключением начального посещения, которое могло занять 2 часа.
Если индивидуумы во время исследования становились более подавленными, их обследовал главный исследователь для определения лучшего клинического подхода. Если считали необходимым, состав A отменяли в пользу лечения другим антидепрессантом. Решения о лечении делали исключительно на основе лучших способов лечения депрессии и в лучших клинических интересах пациента.
Врач и координатор исследования осуществляли общий поддерживающий контакт с пациентами и контакт, как правило, ограничивали ответами на соответствующие вопросы о течение болезни пациента и лечении. Формальную психотерапию не проводили.
Статистические способы
Первичный эффект тестировали с применением повторного дисперсионного анализа со шкалой HAM-D в качестве переменной исходов. Значимый временной эффект подтверждает гипотезу. Предполагаемый общий объем выборки в 25 пациентов был достаточно большим для определения изменений по HAM-D 17, а именно стандартных отклонений 0,65 (двусторонний тест по одной выборке P<0,05). Указанные стандартные отклонения по HAM-D-17 находились в диапазоне 4,5-6,5. Таким образом, дизайн данного исследования обладал 80% мощностью для определения средних изменений настолько небольших, как 4,3 пункта на этой шкале, состоящей из 52-х пунктов. Согласно критериям включения каждый участник обладал показателем HAM-D 17 больше 17. Критерий Франка для ремиссии имел значение по HAM-D 17, составляющее 9 или ниже. В исследовании применяли более консервативный и общепринятый уровень 7 или ниже. Величина эффекта 4,3 была достаточно чувствительна для определения клинического улучшения от показателей выше 17 до показателей меньше 10. Положительный результат статистически основан на ожидаемой доле плацебо ответа в диапазоне от 30% до 50% в исследованиях лечения депрессии. В данном исследовании предполагали долю плацебо ответа 40%. При необходимости проводили некоторый анализ отвечающих и индивидуумов в стадии ремиссии.
Результаты
В исследование входили 23 человека. Три индивидуума (#104, #105 и #118) никогда не лечились, и, таким образом, их результаты нельзя анализировать. Из 20 индивидуумов, получавших, по меньшей мере, одну дозу состава А, 16 завершили 8-недельное исследование. Оставшиеся 4 индивидуума не завершили 8-недельное исследование, но поскольку каждый из них получил, по меньшей мере, одну дозу состава А, их результаты считали анализируемыми. Причины, по которым эти 4 индивидуума не завершили полное исследование, включают несоблюдение приема лекарственных средств и/или назначений, нетерпеливость в отношении результатов и то, что индивидуум покинул страну.
Результаты для 20 индивидуумов, которые получали, по меньшей мере, одну дозу состава A представлены в таблицах ниже.
Доля ответа и интенсивность ответа
Для оценки ответа каждого индивидуума на лечение составом А применяли следующие определения. "Отвечающим" или "когда-либо отвечающим" является индивидуум, по меньшей мере, с 50% улучшением по шкале Гамильтона для оценки депрессии (HAM-D показатель) по сравнению с начальным показателем в любое время в течение исследования. "Клинически отвечающим" является индивидуум, обладающий критериями "отвечающего", у которого, по мнению главного исследователя, положительный клинический исход. "Отвечающим в конце исследования" является индивидуум, обладающий критериями ответа в конце исследования (или при последнем исследовании). "Ремиссией" является снижение показателя HAM-D до менее чем 8.
Вышеописанное исследование показало, что из 20 индивидуумов, которые получали, по меньшей мере, одну дозу состава А, 15 (75%) являлись когда-либо отвечающими и 14 (70%) являлись клинически отвечающими. Кроме того, среди 16 индивидуумов, завершивших 8-недельное исследование, число когда-либо отвечающих составляло 13/16 (81,3%) и число клинически отвечающих составляло 12/16 (75%). Кроме того, из 16 индивидуумов, завершивших исследование, общее снижение показателя HAM-D (включая не отвечающих) являлось значительным для 56,08%. Снижение показателя HAM-D среди когда-либо отвечающих, закончивших 8-недельное исследование, было выше для 68,1%, картина, находящаяся далеко за пределами минимального 50% падения, необходимого для когда-либо отвечающих.
Необходимо сделать замечание о двух индивидуумах, на чей ответ повлияли окружающие условия. Индивидуум #114, не включенный в число клинически отвечающих, являлся отвечающим до недели 2, когда ее показатель HAM-D упал более чем на 50% по составу A; но вмешались внешние факторы. Она начала сталкиваться с медицинскими проблемами (не относящимися к составу A) и трудностями на работе, когда она воспользовалась страховкой на случай нетрудоспособности. Эти факторы окружающих условий полностью поглотили ее хороший эмоциональный ответ на состав А.
Основываясь на точном критерии 50% снижения показателя HAM-D, индивидуума #106 не отнесли к отвечающим на 8 неделе, т.к. к этому времени ее показатель составлял 12, что меньше, чем 50% снижение по отношению к ее исходному показателю 21. Однако на всем протяжении 8-недельного исследования индивидуум #106 отвечал по показателям 4 (неделя 2), 8 (неделя 4) и 10 (неделя 6). К тому же в течение исследования индивидуум #106 считали клинически отвечающим по PI и взяли в расширенное клиническое исследование (см. пример 7), где зафиксировали показатели 1, 11, 7 и 9. После начала расширенного клинического исследования индивидуум #106 столкнулся со значительными семейными неурядицами, которые нарушили ее положительный ответ на состав A. Когда эти неурядицы утихли, она продолжала поддерживать ответную реакцию на состав А. Ни одно лекарственное средство не может полностью компенсировать повреждающий эффект окружающих условий. Состав A вполне может снизить эмоциональную травму индивидуума #106 от этих обстоятельств.
Доля ремиссии
Не все когда-либо отвечающие достигали ремиссии и не все из тех, кто достиг ремиссии, оставались в ней до конца 8-недельного исследования. Девять из 15 когда-либо отвечающих (60%) достигали ремиссии в какой-либо момент в течение 8-недельного исследования. Семь из этих девяти индивидуумов (77,8% или 46,7% всех участников исследования), достигавших ремиссии, оставались в стадии ремиссии к концу 8-недельного исследования.
Таблица ниже описывает всех участников исследования, которые достигали ремиссии, и всех, кто оставался в стадии ремиссии. Галочки обозначают тех индивидуумов, которые достигли ремиссии или оставались в стадии ремиссии, в то время как отметки X обозначают тех индивидуумов, которые не достигали ремиссии или не оставались в стадии ремиссии до 8 недели исследования.
















(60%)
(46,7%)
Кроме того, большой вторичный результат, снижение тревожности, достигали все когда-либо отвечающие, кроме одного. Эти результаты показывают, что состав А эффективен для лечения большого депрессивного расстройства и тревожности. Кроме того, не было серьезных побочных эффектов, могущих быть отнесенными к лекарственному средству. Не было ни увеличения веса, ни снижения половой функции индивидуумов, участвующих в исследовании.
Пример 7
Результаты по положительной эффективности и безопасности, описанные в примере 6, делали необходимым проведение расширенного клинического исследования. Десять индивидуумов из исследования, описанного в примере 6, взяли в расширенное клиническое исследование. Расширенное клиническое исследование проводили только на тех индивидуумах из исследования, описанного в примере 6, которые являлись клинически отвечающими в конце 8-недельного исследования. Состав A вводили, как описано в примере 6, и индивидуумов в расширенном клиническом исследовании анализировали на месячной основе 10 месяцев. В таблице ниже представлены показатели HAM-D индивидуумов в расширенном клиническом исследовании.
Четырех из десяти индивидуумов отозвали из расширенного клинического исследования из-за появления исключающих критериев для продолжения исследования. Результаты расширенного клинического исследования показали, что все индивидуумы в исследовании по определению являлись отвечающими на состав А. Шесть из десяти клинически отвечающих (60%) находились в ремиссии на начало расширенного клинического исследования. Восемь из десяти индивидуумов (80%) находились в ремиссии на последний день оценки. Двое из десяти индивидуумов являлись клинически отвечающими в начальном 8-недельном исследовании, но не вошли в стадию ремиссии до расширенного клинического исследования. Только у одного индивидуума (#113), включенного в расширенное клиническое исследование, произошел рецидив после вступления в расширенное клиническое исследование. Результаты по положительной эффективности и безопасности исследования, описанного в примере 6 и расширенного клинического исследования, делали необходимым дополнительное расширенное клиническое исследование.
Пример 8
Как описано в примерах выше, состав A обладает продемонстрированным терапевтическим действием. Проводили исследования для изучения механизма действия состава А. В частности, проводили исследования для определения ингибирования связывающих взаимодействий между радиолигандами и их рецепторами или ингибирования меченных радиоактивным изотопом ферментов для того, чтобы подействовать составом А на ассоциированные с ними белки-мишени. Определяли уровень ингибирования составом А (измеряемого как процент ингибирования составом А специфического связывания с каждым рецептором). Тестирование ингибирования связывающих взаимодействий и ферментативной активности проводили в двух параллелях для каждого образца при двух разных концентрациях состава А (1,0 мкг/мл и 10,0 мкг/мл). Эти концентрации состава A получали растворением содержимого капсулы состава А в диметилсульфоксиде и последующем разведением раствора либо до 1,0 мкг/мл, либо до 10,0 мкг/мл состава A. Эти разведенные растворы называли изолятом А. Анализ связывания радиолиганда проводили с использованием рецепторов и ферментов, приведенных в таблице ниже. Определяли средний процент ингибирования специфического связывания при каждой концентрации изолята А. Результаты данного исследования представлены в таблице ниже.
В основном, ингибирование связывания или ингибирование ферментативной активности на 20% или меньше свидетельствует о том, что данное тестируемое соединение неактивно в отношении конкретного участка связывания рецептора или белка-мишени. Ингибирование связывания или ингибирование ферментативной активности более чем на 20% свидетельствует о том, что тестируемое соединение обладает активностью в отношении конкретного участка связывания и ферментативного участка. Вышеописанное исследование ингибирования связывания показало, что изолят А вытесняет глутамат из четырех его главных ионотропных рецепторов. В присутствии изолята А (10 мкг/мл) связывание меченного радиоактивным изотопом AMPA с AMPA-рецептором ингибировано на 29,05%. В присутствии изолята А (10 мкг/мл) связывание меченной радиоактивным изотопом каиновой кислоты с каинатным рецептором ингибировано на 22,38%. В присутствии изолята А (10 мкг/мл) связывание меченного радиоактивным изотопом CGP 39653 с участком связывания агониста NMDA-рецептора ингибировано на 34,59%. В присутствии изолята А (10 мкг/мл) связывание меченного радиоактивным изотопом MDL-105,519 с глициновым участком, который является стрихнин-нечувствительным участком NMDA-рецептора ингибировано на 27,45%. Кроме того, в присутствии изолята А (10 мкг/мл) связывание нейрокинина А с NK2-рецепторами ингибировано на 32,15%. Дополнительные детали, имеющие отношение к экспериментам по ингибированию связывания для каждого из пяти описанных выше рецепторов, представлены в следующей таблице.
В дополнительных анализах связывания рецепторов использовали ионотропные рецепторы глутамата, NK2-рецепторы и рецепторы нейрокинина 1 (NK1). Для оценки способности различных изолятов содержимого капсулы состава А противодействовать связыванию лиганда различными рецепторами глутамата и NK2-рецепторами проводили контролируемый эксперимент с одной концентрацией. В этом анализе изучали AMPA-рецептор, каинатный рецептор, участок связывания агониста и глициновый (стрихнин-нечувствительный) участок связывания NMDA-рецептора, а также NK2-рецептор. Содержимое капсулы состава А растворяли с применением различных растворителей и экстрагировали с применением четырех различных способов, как подробно описано выше. Данная экстракция имела результатом ряд изолятов оплодотворенных яиц. Данные изоляты обозначали: верхний изолят образца #19, нижний изолят образца #19, верхний изолят образца #20, нижний изолят образца #20, изолят фракции X и изолят образца #2. Данные изоляты тестировали с применением анализа связывания радиолиганда.
Взвешиванием 103 мг содержимого капсулы состава А получали образец #19. Добавляли воду (10,3 мл) и раствор перемешивали на центрифуге типа вортекс в течение одной минуты. В раствор добавляли тридцать мл этилацетата и снова перемешивали раствор на центрифуге типа вортекс в течение 1 минуты. Затем образец центрифугировали с применением настольной центрифуги Бекман (Beckman). В результате получали три фракции. Верхнюю (органическую) и нижнюю (водную) фракции собирали раздельно и выбрасывали среднюю фракцию. Высушивали верхнюю и нижнюю фракции. Нижнюю (водную) фракцию растворяли до исходной концентрации в 2,06 мл воды. Образец оказался нечистым, и его центрифугировали при 10000 об/мин в течение десяти минут с применением микроцентрифуги. Удаляли супернатант, обозначали как образец 085426-4 (нижний изолят образца #19) и использовали в исследованиях связывания с рецептором. Верхнюю (органическую) фракцию растворяли до исходной концентрации в 1,245 мл 20% ацетонитрила в воде. Образец оказался нечистым, и его центрифугировали при 10000 об/мин в течение десяти минут с применением микроцентрифуги. Удаляли супернатант, обозначали как образец 085426-3 (верхний изолят образца #19) и использовали в исследованиях связывания с рецептором. Также получали контрольный образец для образца #19. Данный контрольный образец состоял из 20% ацетонитрила в воде, и его обозначали как образец 085426-5 в исследованиях связывания с рецептором.
Взвешиванием 249,7 мг содержимого капсулы состава А получали образец #20. Добавляли десять мл смеси 1:1 метанол:дихлорметан и раствор перемешивали на центрифуге типа вортекс. Затем в раствор добавляли десять мл дихлорметана и снова перемешивали на центрифуге типа вортекс. Образец центрифугировали при 3500 об/мин в течение пятнадцати минут с применением настольной центрифуги Бекман (Beckman). В результате получали три фракции. Верхнюю и нижнюю органическую фракции собирали раздельно. Среднюю фракцию выбрасывали. Верхнюю и нижнюю фракции высушивали и разводили до исходной концентрации в 2,49 мл 100% метанол в воде. Верхняя метаноловая фракция оказалась наполовину чистой, и нижняя дихлорметановая фракция оказалась нерастворенной. Оба образца центрифугировали при 10000 об/мин в течение десяти минут с применением микроцентрифуги. Удаляли супернатант каждого образца. Супернатант из верхней метаноловой фракции обозначали как 085426-6 (верхний изолят образца #20) и использовали в исследованиях связывания с рецептором. Супернатант из верхней дихлорметановой фракции обозначали как образец 085426-7 (нижний изолят образца #20) и использовали в исследованиях связывания с рецептором. Также получали контрольный образец для образца #20. Данный контрольный образец состоял из 10% метанола в воде, и его обозначали как образец 085426-9 в исследованиях связывания с рецептором.
Образец фракции X получали, как указано далее. Взвешивали сто двадцать один мг содержимого капсулы состава А. Добавляли 10 мл воды. Затем добавляли десять мл дихлорметана и перемешивали на центрифуге типа вортекс. Раздельно удаляли водную и органическую фракции. Выделение изолята растворителем повторяли посредством добавления 10 мл дихлорметана к водной фракции и перемешивания раствора на центрифуге типа вортекс. Водную и органическую фракции снова раздельно удаляли.
Объединяли органические фракции из двух выделений изолята и объединяли водные фракции из двух выделений изолята. Водную и органическую фракции высушивали и взвешивали. Водная фракция весила 116,4 мг и органическая фракция весила 1,3 мг. Органическую фракцию растворяли до исходной концентрации в 1,3 мл 10% метанола в воде (до концентрации 0,1 мг/мл), обозначали как образец 085426-8 (изолят фракции X) и использовали в исследованиях связывания с рецепторами. Также получали контрольный образец для образца фракции X. Данный контрольный образец состоял из 10% метанола в воде, и его обозначали как образец 085426-9 (необходимо отметить, что это тот же контрольный образец, что и для образца #20) в исследованиях связывания с рецептором.
Образец #2 получали, как указано далее. Взвешивали порцию (1,8 мг) содержимого капсулы состава А. Добавляли сорокапроцентный PEG в воде и 0,25% Tween 80 (3,6 мл) (до концентрации 0,5 мг/мл) и образец перемешивали на центрифуге типа вортекс. Данный препарат обозначали как образец 085426-1 (изолят образца #2) и тестировали в исследованиях связывания с рецептором. Также получали контрольный образец для образца #2. Данный контрольный образец состоял из 40% PEG в воде и 0,25% Tween 80, его обозначали как образец 085426-2 в исследованиях связывания с рецептором.
Результаты исследования связывания рецептора (полученные на двух параллелях образцов каждого изолята при максимальной концентрации) представлены в следующей таблице.
Данные, выделенные жирным шрифтом, свидетельствуют о более чем 50% ингибировании при тестируемой концентрации.
Связывание меченного радиоактивным изотопом AMPA с AMPA-рецептором ингибировано на 97% в присутствии верхнего изолята образца #20. Связывание меченной радиоактивным изотопом каиновой кислоты с каинатным рецептором ингибировано на 101% в присутствие верхнего изолята образца #20. Связывание меченного радиоактивным изотопом CGP 39653 с участком связывания агониста NMDA-рецептора ингибировано на 110% в присутствии верхнего изолята образца #20. Связывание меченного радиоактивным изотопом MDL-105,519 с глициновым участком, который является стрихнин-нечувствительным участком NMDA-рецептора, ингибировано на 92% в присутствии верхнего изолята образца #20. Кроме того, изолят фракции X ингибировал связывание нейрокинина с его NK2-рецепторами на 55%. Согласно данным заявителя, данный случай является первым, в котором показано, что рецепторам глутамата и NK2-рецепторам противодействует одно вещество.
Исследования ответа в зависимости от дозы проводили для дальнейшего подтверждения того, что верхний изолят образца #20, полученный как описано выше, противодействует связыванию и активации рецепторов глутамата, обсужденных выше, и NK2-рецепторов. Ингибирование связывания AMPA рецептора, каинатного рецептора, участка связывания агониста NMDA-рецептора, глицинового (стрихнин-нечувствительного) участка NMDA-рецептора и NK2-рецептора оценивали в присутствии следующих концентраций верхнего изолята #20 (основанных на количестве состава A, содержащегося в образце #20 перед экстракцией): 0,1, 0,3, 1,0, 3,0, 10, 30, 100 и 300 мкг/мл.
На фиг.8 представлены результаты анализа, проведенного для участка связывания агониста (ионотропного) NMDA-рецептора. Верхний изолят образца #20 ингибировал способность CGP 39653 связываться с участком связывания агониста NMDA-рецептора в зависимости от концентрации, когда более высокая концентрация верхнего изолята образца #20 обеспечивает большее ингибирование связывания и более низкая концентрация обеспечивает меньшее ингибирование связывания. IC50 NMDA определяли как 1,11×10-5 мкг/мл и Ki определяли как 9,02×10-6 M. IC50 верхнего изолята образца #20 определяли как 5,78 мкг/мл и Ki определяли как 4,69 M.
На фиг.9 представлены результаты анализа, проведенного на каинатном рецепторе. Верхний изолят образца #20 ингибировал способность каиновой кислоты связываться с каинатным рецептором в зависимости от концентрации, когда более высокая концентрация верхнего изолята образца #20 обеспечивает большее ингибирование связывания и более низкая концентрация обеспечивает меньшее ингибирование связывания. IC50 каиновой кислоты определяли как 1,77×10-8 мкг/мл и Ki определяли как 1,08×10-8 M. IC50 верхнего изолята образца #20 определяли как 12,0 мкг/мл и Ki определяли как 7,32 M.
На фиг.10 представлены результаты анализа, проведенного на AMPA-рецепторе. Верхний изолят образца #20 ингибировал способность AMPA связываться с AMPA-рецептором в зависимости от концентрации, когда более высокая концентрация верхнего изолята образца #20 обеспечивает большее ингибирование связывания и более низкая концентрация обеспечивает меньшее ингибирование связывания. IC50 (+/-) AMPA HBr определяли как 3,54×10-8 мкг/мл и Ki определяли как 3,00×10-8 M. IC50 верхнего изолята образца #20 определяли как 11,7 мкг/мл и Ki определяли как 9,91 M.
На фиг.11 представлены результаты анализа, проведенного на глициновом (стрихнин-нечувствительном) участке связывания NMDA-рецептора. Верхний изолят образца #20 ингибировал способность MDL-105,519 связываться с глициновым (стрихнин-нечувствительным) участком связывания NMDA-рецептора в зависимости от концентрации, когда более высокая концентрация верхнего изолята образца #20 обеспечивает большее ингибирование связывания, а более низкая концентрация обеспечивает меньшее ингибирование связывания. IC50 MDL-105,519 определяли как 2,8×10-8 мкг/мл и Ki определяли как 2,36×10-8 M. IC50 верхнего изолята образца #20 определяли как 21,9 мкг/мл и Ki определяли как 18,4 M.
На фиг.12 представлены результаты анализа, проведенного на NK2-рецепторах. Верхний изолят образца #20 ингибировал способность нейрокинина A связываться с NK2-рецептора в зависимости от концентрации, когда более высокая концентрация верхнего изолята образца #20 обеспечивает большее ингибирование связывания и более низкая концентрация обеспечивает меньшее ингибирование связывания. IC50 нейрокинина A определяли как 6,84×10-10 мкг/мл и Ki определяли как 5,76×10-10 M. IC50 верхнего образца изолята #20 определяли как 4,15×102 мкг/мл и Ki определяли как 3,49×102 M.
Список литературы
Ahlstedt I, Engberg S, Smith J, Perey C, Moody A, Morten J, Lagerström-Fermèr M, Drmota T, von Mentzer B, Pählman I, Lindström E, Occurrence and pharmacological characterization of four human tachykinin NK2 receptors. Biochenical Pharmacology 2008 76:476-481.
Bai, T, Zhou D, Weir T, Hegele R, Hayashi S, McKay K, Bondy G, Fong T, Substance P (NK1) - and neurokinin A (NK2) - receptor gene expression in inflammatory airway diseases. Am J Physiol. Lung Cell Mol. Physiol. 1995 269:L309-L317.
Beck A.T, Ward C.H, Mock J, Erbaugh J, An inventory for measuring depression. Archives of General Psychiatry 4:561-571, 1961.
Bowie D, Ionotropic glutamate receptors & CNS disorders. CNS Neurol Disord Drug Targets. 2008 Apr; 7(2):129-43.
Cheon Y, Park J, Joe K.H, Kim D.J, The effect of 12-week open-label memantine treatment on cognitive function improvement in patients with alcohol-related dementia. Int J Neuropsychopharmacol. 2008 Nov; 11(7):971-83. Epub 2008 Mar 17.
Chez M.G, Burton Q, Dowling T, Chang M, Khanna P, Kramer C.J, Memantine as adjunctive therapy in children diagnosed with autistic spectrum disorders: an observation of initial clinical response and maintenance tolerability. Child Neurol. 2007 May; 22(5):574-9.
Chourbaji S, Vogt M.A, Fumagalli F, Sohr R, Frasca A, Brandwein C, Hörtnagl H, Riva M.A, Sprengel R, Gass P, AMPA receptor subunit 1 (GluR-A) knockout mice model the glutamate hypothesis of depression. FASEB J. 2008 Sep; 22(9):3129-34. Epub 2008 May 20.
Dableh LJ, Yashpal K, Rochford J, Henry J.L, Antidepressant-like effects of neurokinin receptor antagonists in the forced swim test in the rat. Eur J Pharmacol. 2005 Jan 10; 507(1-3):99-105. Epub 2004 Dec 28.
Davidson J.R, Preliminary report: Prevention, control and treatment of human cancer as a deficiency disease. CMAJ 1941; 45:308-312.
Evangelista S, Involvement of tachykinins in intestinal inflammation. Curr Pharm Des. 2001 Jan; 7(1):19-30.
Ginsberg M.D, Neuroprotection for ischemic stroke: past, present and future. Neuropharmacology. 2008 Sep; 55(3):363-89. Epub 2008 Mar 4.
Griebel G, Perrault G, Soubrie P, Effects of SR48968, a selective non-peptide NK2 receptor antagonist on emotional processes in rodents. Psychopharmacology (Berl). 2001 Nov; 158(3):241-251.
Guy W: ECDEU Assessment Manual for Psychopharmacology - Revised (DHEW Publ No ADM 76-338). Rockville, MD, U.S. Department of Health, Education, and Welfare, Public Health Service, Alcohol, Drug Abuse, and Mental Health Administration, NIMH Psychopharmacology Research Branch, Division of Extramural Research Programs, 1976, pp.218-222.
Hamilton, Development of a rating scale for primary depressive illness. Br J Soc Clin. Psychiatry 1967; 6:278-279.
Hamilton M, The assessment of anxiety states by rating. Br J Med Psychol. 1959; 32:50-55.
Holmes A, Heilig M, Rupniak N.M, Steckler T, Griebel G, Neuropeptide systems as novel therapeutic targets for depression and anxiety disorders. Trends Pharmacol. Sci. 2003 Nov; 24(11):580-8.
Husum H, Wörtwein G, Andersson W, Bolwig T.G, Mathe A.A, Gene-environment interaction affects substance P and neurokinin A in the entorhinal cortex and periaqueductal grey in a genetic animal model of depression: implications for the pathophysiology of depression. Int J Neuropsychopharmacol. 2008 Feb; 11(1):93-101. Epub 2007 May 4.
Hynd M.R, Scott H.L, Dodd P.R, Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer's disease. Neurochem Int. 2004 Oct; 45(5):583-95.
Javitt D.C, Glutamate as a therapeutic target in psychiatric disorders. Mol Psychiatry. 2004 Nov; 9(11):984-97, 979.
Kendler K.S, Walters Е.Е, Kessler R.C, The prediction of length of major depressive episodes: results from an epidemiological sample of female twins. Psychol. Med 1997; 27:107-117.
Kew J.N, Kemp J.A, Ionotropic and metabotropic glutamate receptor structure and pharmacology. Psychopharmacology (Berl). 2005 Apr; 179(1):4-29. Epub 2005 Feb 25.
Koch H.J, Uyanik G, Fischer-Barnicol D, Memantine: a therapeutic approach in treating Alzheimer's and vascular dementia. Curr Drug Targets CNS Neurol Disord. 2005 Oct; 4(5):499-506.
Krystal J.H, Sanacora G, Blumberg H, Anand A, Charney D.S, Marek G, Epperson C.N, Goddard A, Mason G.F, Glutamate and GABA systems as targets for novel antidepressant and mood-stabilizing treatments. Mol Psychiatry. 2002;7 Suppl 1:S71-80.
Lecci A, Capriati A, Maggi C.A, Tachykinin NK2 receptor antagonists for the treatment of irritable bowel syndrome. Br J Pharmacol. 2004 Apr; 141 (8):1249-63. Epub 2004 Mar 22.
Lewis D.A, Gonzalez-Burgos G, Neuropsychopharmacology. Neuroplasticity of neocortical circuits in schizophrenia. 2008 Jan; 33(1):141-65. Epub 2007 Sep 5.
Lingjaerde O, Ahlfors U.G, Bech P, et al, The UKU Side Effect Rating Scale: a new comprehensive rating scale for psychotrepic drugs, and a cross-sectional study of side effects in neuroleptic-treated patients. Acta Psychiatrica Scandinavica Suppl 76:1-100, 1987.
Louis C, Stemmelin J, Boulay D, Bergis O, Cohen C, Griebel G, Additional evidence for anxiolytic- and antidepressant-like activities of saredutant (SR48968), an antagonist at the neurokinin-2 receptor in various rodent-models. Pharmacol. Biochem Behav. 2008 Mar; 89(1):36-45. Epub 2007 Nov 5.
MacDonald A.W 3rd, Chafee M.V, Translational and developmental perspective on N-methyl-D-aspartate synaptic deficits in schizophrenia. Dev Psychopathol. 2006 Summer; 18(3):853-76.
Maeng S, Zarate C.A Jr, The role of glutamate in mood disorders: results from the ketamine in major depression study and the presumed cellular mechanism underlying its antidepressant effects. Curr Psychiatry Rep. 2007 Dec; 9(6):467-74.
Mathew S.J, Manji H.K, Charney D.S, Novel drugs and therapeutic targets for severe mood disorders. Neuropsychopharmacology. 2008 Aug; 33(9):2080-92. Epub 2008 Jan 2.
Mathew S.J, Keegan K, Smith L, Glutamate modulators as novel interventions for mood disorders. Rev Bras Psiquiatr. 2005 Sep; 27(3):243-8. Epub 2005 Oct 4.
McCullumsmith R.E, Clinton S.M, Meador-Woodruff J.H, Schizophrenia as a disorder of neuroplasticity. Int Rev Neurobiol. 2004; 59:19-45.
McNally L, Bhagwagar Z, Hannestad J, Inflammation, glutamate, and glia in depression: a literature review. CNS Spectr. 2008 Jun; 13(6):501-10.
McLeod J.D, Kessler R.C, Landis K.R, Recovery from major depressive episodes in a community sample of married men and women. J Abnorm Psychol. 1992; 101:277-286.
Micale V, Tamburella A, Leggio G.M, Mazzola C, Li Volsi V, Drago F, Behavioral effects of saredutant, a tachykinin NK2 receptor antagonist, in experimental models of mood disorders under basal and stress-related conditions. Pharmacol. Biochem. Behav. 2008 Sep; 90(3):463-9. Epub 2008 Apr 12.
Miller R.G, Mitchell J.D, Lyon M, Moore D.H, Riluzole for amyotrophic lateral sclerosis (ALS)/motor neuron disease (MND). Cochrane Database Syst Rev. 2007 Jan 24; (1):CD001447.
Montgomery S.A, Asberg M, A new depression scale designed to be sensitive to change. British Journal of Psychiatry 134:382-389, 1979.
Patten S, The duration of major depressive disorders in the Canadian general population. Chronic Dis Canada 22:1.2001.
Paul I.A, Skolnick P, Glutamate and depression: clinical and preclinical studies. Ann N Y Acad Sci. 2003 Nov; 1003:250-72.
Ravindranath V, Neurolathyrism: mitochondrial dysfunction in excitotoxicity mediated by L-beta-oxalyl aminoalanine. Neurochem Int. 2002 May; 40(6):505-9.
Rizzo С.A, Hey J.A, Activity of nonpeptide tachykinin antagonists on neurokinin a induced contractions in dog urinary bladder. J Urol. 2000 Jun; 163(6):1971-4.
Rorick-Kehn L.M, Hart J.C, McKinzie D.L, Pharmacological characterization of stress-induced hyperthermia in DBA/2 mice using metabotropic and ionotropic glutamate receptor ligands. Psychopharmacology (Berl). 2005 Dec; 183(2):226-40. Epub 2005 Nov 9.
Salomè N, Stemmelin J, Cohen C, Griebel G, Selective blockade of NK2 or NK3 receptors produces anxiolytic- and antidepressant-like effects in gerbils. Pharmacol. Biochem. Behav. 2006 Apr; 83(4):533-9. Epub 2006 Apr 19.
Sanacora G, Rothman D.L, Mason G, Krystal J.H, Clinical studies implementing glutamate neurotransmission in mood disorders. Ann N Y Acad Sci. 2003 Nov; 1003:292-308.
Sanacora G, Kendell S.F, Levin Y, Simen A.A, Fenton L.R, Coric V, Krystal J.H, Preliminary evidence of riluzole efficacy in antidepressant-treated patients with residual depressive symptoms. Biol Psychiatry. 2007 Mar 15; 61(6):822-5. Epub 2006 Dec 4.
Spencer P.S, Food toxins, ampa receptors, and motor neuron diseases. Drug Metab Rev. 1999 Aug; 31(3):561-87.
Steinberg R, Alonso R, Griebel G, Bert L, Jung M, Oury-Donat F, Poncelet M, Gueudet C, Desvignes C, Le Fur G, Soubrie P, Selective blockade of neurokinin-2 receptors produces antidepressant-like effects associated with reduced corticotropin-releasing factor function. J Pharmacol. Exp. Ther. 2001. Nov; 299(2):449-58.
Stratton S.C, Beresford I.J, Harvey F.J, Turpin M.P, Hagan R.M, Tyers M.B, Anxiolytic activity of tachykinin NK2 receptor antagonists in the mouse light-dark box. Eur J Pharmacol. 1993 Dec 21; 250(3):R11-2.
Svenningsson P, Bateup H, Qi H, Takamiya K, Huganir R.L, Spedding M, Roth B.L, McEwen B.S, Greengard P, Involvement of AMPA receptor phosphorylation in antidepressant actions with special reference to tianeptine. Eur J Neurosci. 2007 Dec; 26(12):3509-17.
Teixeira R.M, Santos A.R, Ribeiro S.J, Calixto J.B, Rae G.A, De Lima T.C, Effects of central administration of tachykinin receptor agonists and antagonists on plus-maze behavior in mice. Eur J Pharmacol. 1996 Sep 5; 311(1):7-14.
Toro C.T, Hallak J.E, Dunham J.S, Leite J.P, Sakamoto A.C, Guarnieri R, Fong V, Deakin J.F, The NR1 N-methyl-D-aspartate subunit and brain-derived neurotrophic factor in temporal lobe epilepsy hippocampus: a comparison of patients with and without coexisting psychiatric symptoms. Epilepsia. 2007 Dec; 48(12):2352-6. Epub 2007 Oct 5.
Toulouse M, Coelho A, Fioramonti J, Lecci A, Maggi C, Bueno L, Role of tachykinin NK2 receptors in normal and altered rectal sensitivity in rats. Br J Pharmacology 2000 129, 193-199.
Treatment of Chronic Depression (Editorial), NEJM 342:1518-1520, 2000.
Walsh D.M, Stratton S.C, Harvey F.J, Beresford I.J, Hagan R.M, The anxiolytic-like activity of GR159897, a non-peptide NK2 receptor antagonist, in rodent and primate models of anxiety. Psychopharmacology (Berl). 1995 Sep; 121 (2):186-91.
Walton H.S, Dodd P.R, Glutamate-glutamine cycling in Alzheimer's disease. Neurochem Int. 2007 Jun; 50(7-8):1052-66. Epub 2006 Dec 1.
Ware J.E Jr, Sherbourne C.D, The MOS 36-item short-form health survey (SF-36). 1. Conceptual framework and item selection Medical Care 1992, 30:473-483.
Zarate C.A Jr, Payne J.L, Quiroz J, Sporn J, Denicoff K.K, Luckenbaugh D, Charney D.S, Manji H.K, An open-label trial of riluzole in patients with treatment-resistant major depression. Am J Psychiatry. 2004 Jan; 161(1):171-4.
Zarate C.A Jr, Quiroz J.A, Singh J.B, Denicoff K.D, De Jesus G, Luckenbaugh D.A, Charney D.S, Manji H.K, An open-label trial of the glutamate-modulating agent riluzole in combination with lithium for the treatment of bipolar depression. Biol. Psychiatry. 2005 Feb 15; 57(4):430-2.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПЕЦИФИЧЕСКИЕ СОЕДИНЕНИЯ ДИАРИЛГИДАНТОИНА И ДИАРИЛТИОГИДАНТОИНА | 2010 |
|
RU2548918C2 |
| ЦИКЛОПРОПИЛПИПЕРИДИНОВЫЕ ИНГИБИТОРЫ ТРАНСПОРТЕРА ГЛИЦИНА | 2005 |
|
RU2387644C2 |
| КОМБИНАЦИЯ, СОДЕРЖАЩАЯ ДЕКАНОВУЮ КИСЛОТУ, ДЛЯ ЛЕЧЕНИЯ ЭПИЛЕПСИИ | 2018 |
|
RU2779202C2 |
| СПОСОБ РЕПЛИКАЦИИ ВИРУСА ГРИППА В КУЛЬТУРЕ | 2007 |
|
RU2491339C2 |
| (4-МЕТОКСИ-7-МОРФОЛИН-4-ИЛ-БЕНЗОТИАЗОЛ-2-ИЛ)АМИД 4-ГИДРОКСИ-4-МЕТИЛПИПЕРИДИН-1-КАРБОНОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ ПОСТТРАВМАТИЧЕСКОГО СТРЕССОВОГО РАССТРОЙСТВА | 2008 |
|
RU2500401C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ ПТИЦ С ИСПОЛЬЗОВАНИЕМ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2007 |
|
RU2473688C2 |
| КОМПОЗИЦИИ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2017 |
|
RU2764716C2 |
| СПОСОБЫ ЛЕЧЕНИЯ НАРУШЕНИЙ С ПРИМЕНЕНИЕМ СЕЛЕКТИВНОГО АНТАГОНИСТА NR2B-ПОДТИПА NMDA РЕЦЕПТОРОВ | 2009 |
|
RU2499598C2 |
| ПЕПТИДНЫЙ АНТАГОНИСТ НМДА-РЕЦЕПТОРА | 2019 |
|
RU2716258C1 |
| НОВЫЙ ПТИЧИЙ АСТРОВИРУС | 2009 |
|
RU2547589C2 |

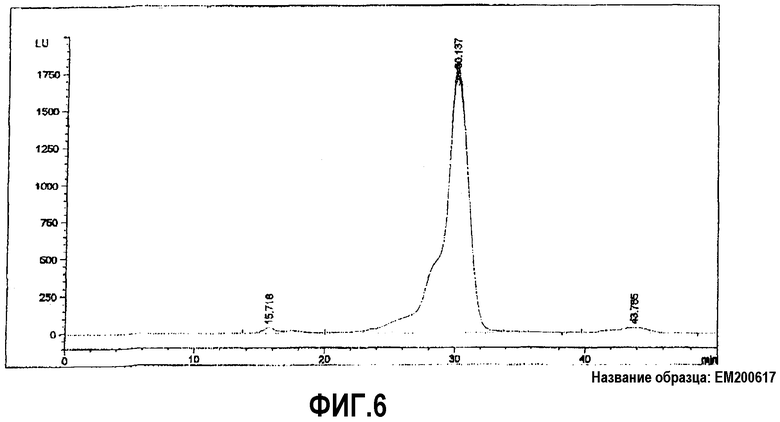
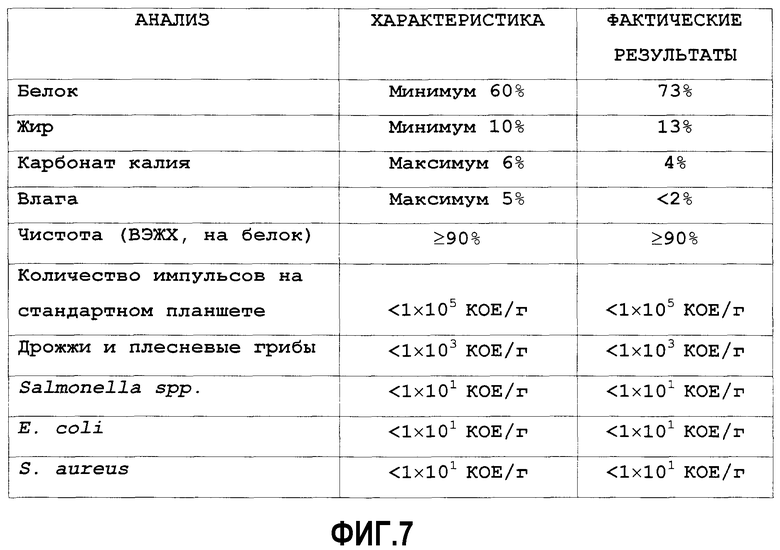
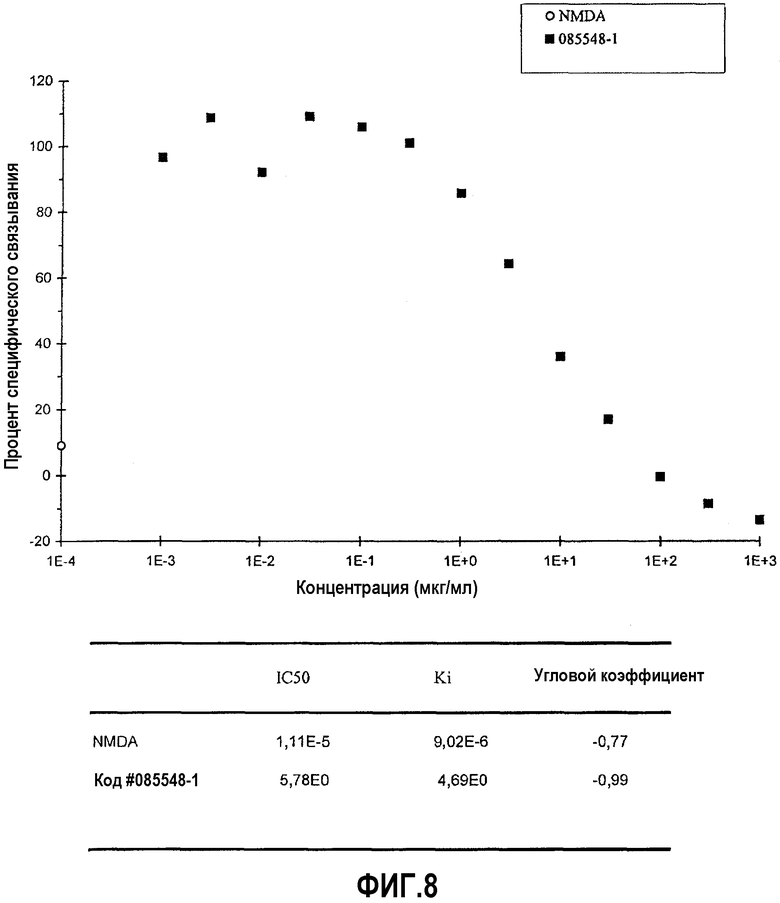
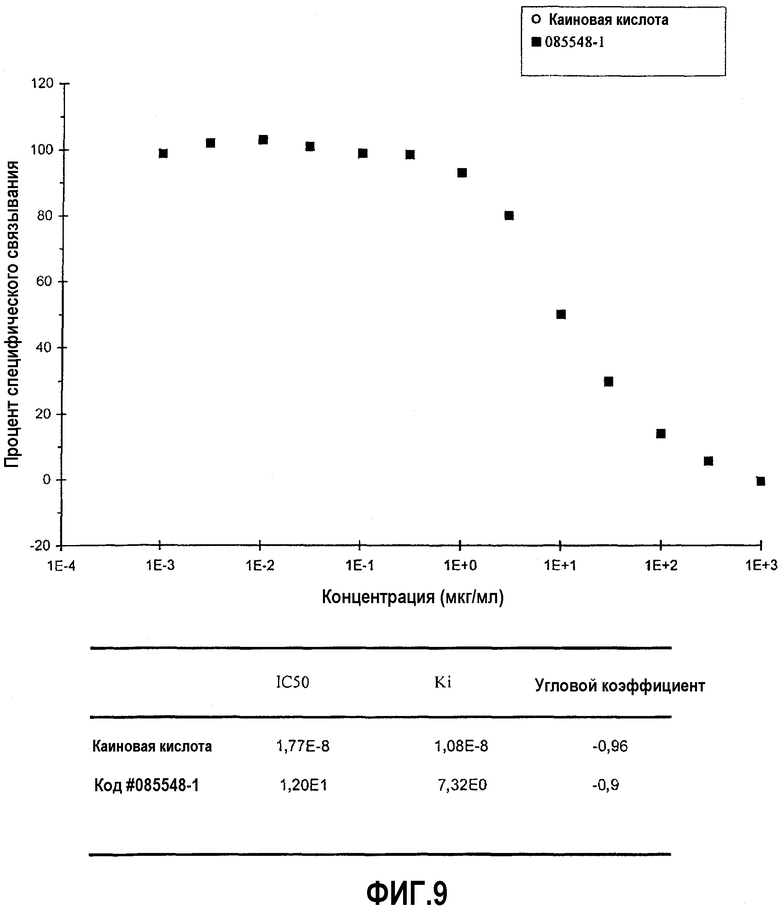
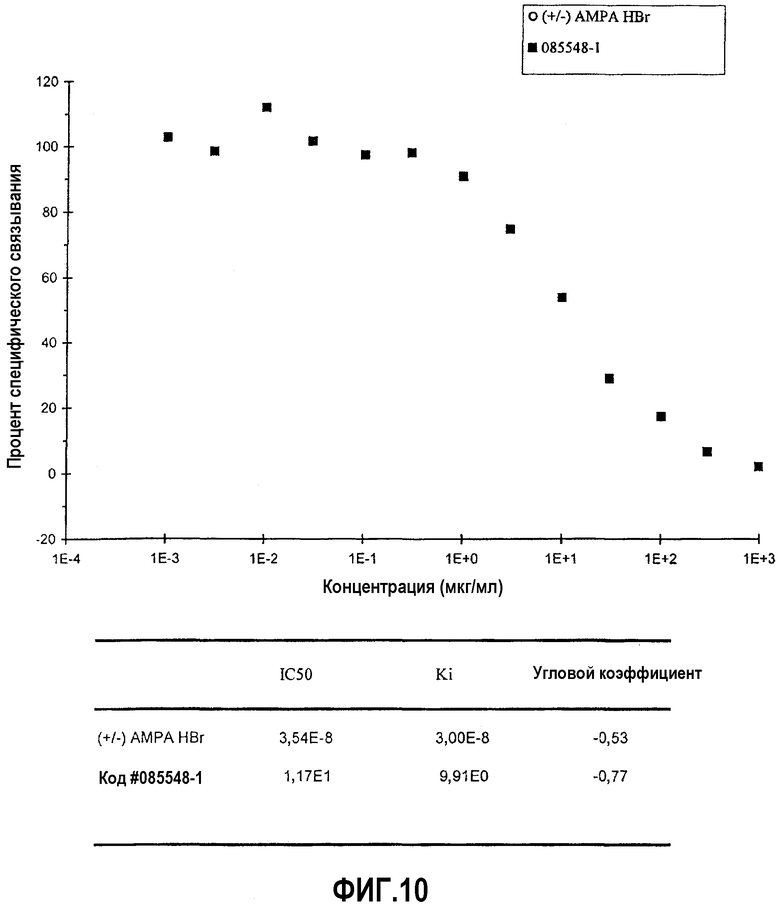
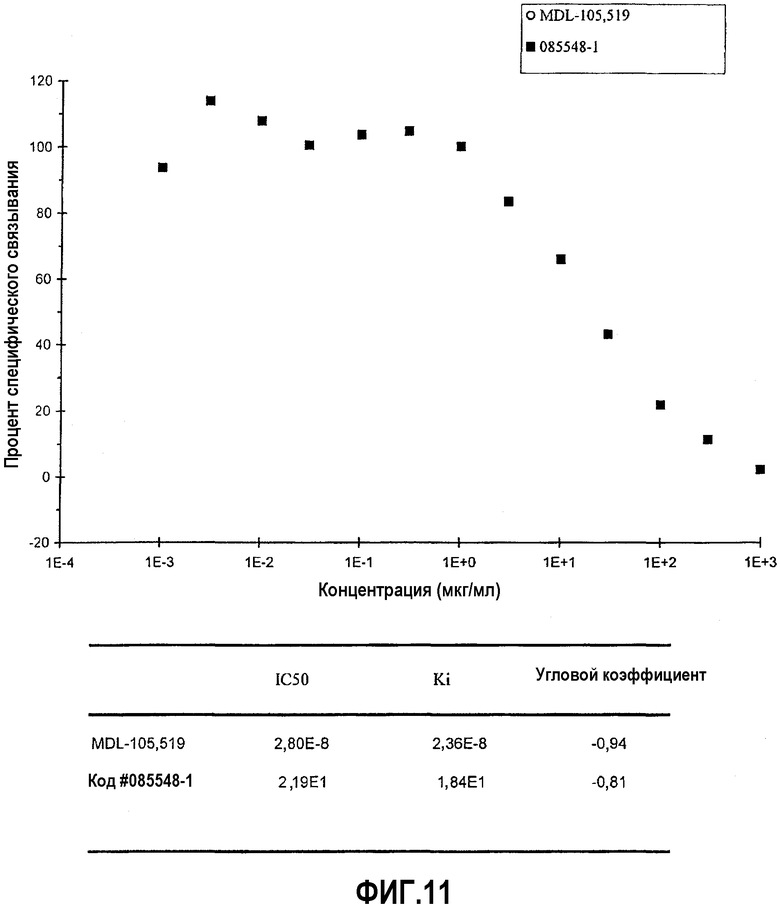
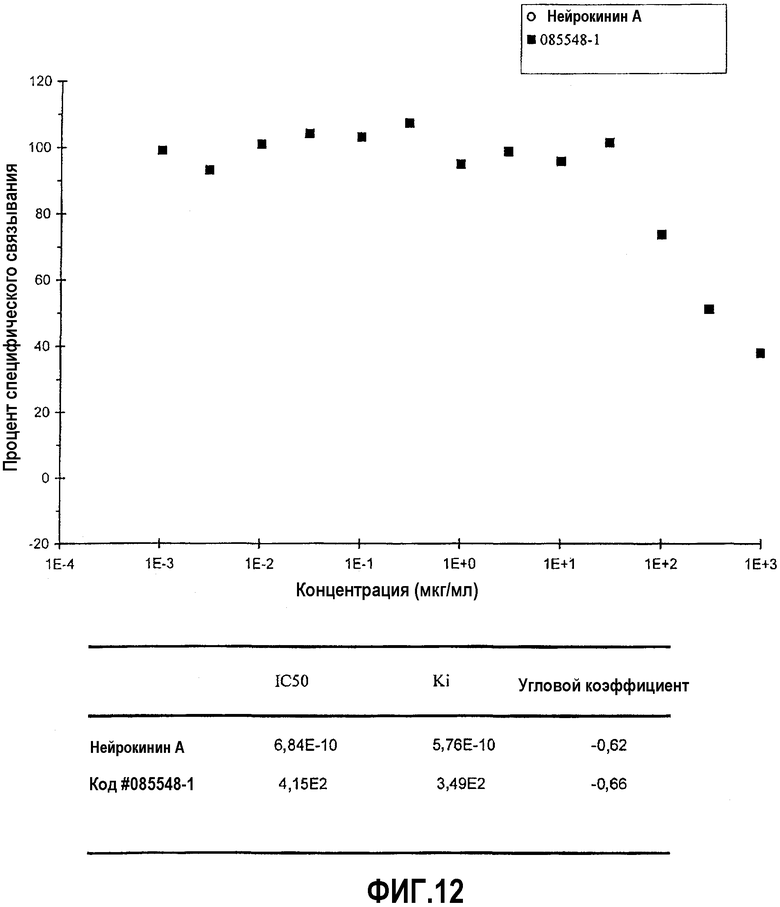
Группа изобретений относится к медицине, а именно к психиатрии, и может быть использована для лечения или профилактики расстройств, выбранных из группы, состоящей из депрессивных аффективных и тревожных расстройств, в частности большого депрессивного расстройства. Для этого в терапию пациенту включают этап введения терапевтически эффективного количества изолята оплодотворённых яиц птиц. Группа изобретений обеспечивает лечение указанной патологии, в том числе за счёт ингибирования рецепторов глутамата и нейрокинина 2 (NK2). 3 н. и 12 з.п. ф-лы, 12 ил., 11 табл., 8 пр.
1. Способ лечения или профилактики расстройства с применением изолята оплодотворенных яиц птиц, где указанное расстройство выбрано из группы, состоящей из депрессивных аффективных расстройств и тревожных расстройств, а указанный способ включает этап введения терапевтически эффективного количества изолята оплодотворенных яиц нуждающемуся в этом пациенту.
2. Способ по п.1, где изолят оплодотворенных яиц содержит лиофилизированные эмбрион, овальбумин и чистый желточный мешок из оплодотворенного яйца.
3. Способ по п.1, где расстройство является большим депрессивным расстройством.
4. Способ по п.1, где расстройство является тревожностью.
5. Способ по п.1, где изолят оплодотворенных яиц является водным изолятом, полученным способом, включающим этапы (i) по существу отделения от скорлупы содержимого, по меньшей мере, одного оплодотворенного яйца птицы; (ii) необязательной фильтрации содержимого для получения ретентата; (iii) объединения содержимого или ретентата в контейнере; (iv) смешивания, необязательно с добавлением растворителя, содержимого или ретентата для получения суспензии; (v) перемешивания суспензии с водным раствором в течение периода времени; (vi) очистки смеси для получения водного раствора, по существу не содержащего твердый материал; (vii) отделения водного раствора от твердого материала, (viii) замораживания водного раствора; и (ix) лиофилизации водного раствора для получения изолята оплодотворенных яиц птиц.
6. Способ по п.5, где расстройство является большим депрессивным расстройством.
7. Способ по п.5, где расстройство является тревожностью.
8. Способ по п.1, где изолят оплодотворенных яиц птиц является изолятом в растворителе, полученным способом, включающим этапы (i) по существу отделения от скорлупы содержимого, по меньшей мере, одного оплодотворенного яйца птицы; (ii) необязательной фильтрации содержимого для получения ретентата; (iii) объединения содержимого или ретентата в контейнере; (iv) смешивания, необязательно с добавлением растворителя, содержимого или ретентата для получения суспензии; (v) перемешивания суспензии с гидрофобным растворителем в течение периода времени; (vi) очистки смеси для получения раствора, по существу не содержащего твердый материал; (vii) отделения раствора от твердого материала; (viii) отделения фракции гидрофобного растворителя от любой фракции водного растворителя; и (ix) концентрации фракции гидрофобного растворителя для получения изолята оплодотворенных яиц птиц в растворителе.
9. Способ по п.8, где расстройство является большим депрессивным расстройством.
10. Способ по п.8, где расстройство является тревожностью.
11. Способ лечения или профилактики заболевания или состояния, ассоциированного с рецепторами глутамата, с применением изолята оплодотворенных яиц птиц, где указанный способ включает этап введения терапевтически эффективного количества изолята оплодотворенных яиц птиц нуждающемуся в этом пациенту, где указанное заболевание или состояние является большим депрессивным расстройством.
12. Способ по п.11, где указанный рецептор глутамата является АМРА-рецептором, каинатным рецептором или NMDA-рецептором.
13. Способ по п.12, где изолят оплодотворенных яиц птиц содержит лиофилизированные эмбрион, овальбумин и чистый желточный мешок из оплодотворенного яйца птицы.
14. Способ лечения или профилактики заболевания или состояния, ассоциированного с рецептором нейрокинина 2 (NK2), с применением изолята оплодотворенных яиц птиц, где указанный способ включает этап введения терапевтически эффективного количества изолята оплодотворенных яиц птиц нуждающемуся в этом пациенту, где указанное заболевание или состояние является большим депрессивным расстройством.
15. Способ по п.14, где изолят оплодотворенных яиц птиц содержит лиофилизированные эмбрион, овальбумин и чистый желточный мешок из оплодотворенного яйца птицы.
| МОРОЗОВ П.В | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ БИОСТИМУЛЯТОРА ЭМБРИОНАЛЬНОГО | 2001 |
|
RU2197251C2 |
| ПРОИЗВОДНЫЕ ОКСИМА ПИПЕРАЗИНА, ОБЛАДАЮЩИЕ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ НЕЙРОКИНИНА-1 (НК-1). | 2002 |
|
RU2273639C2 |
| WO 9822119 A1 28.05.1998 | |||
| WO 9403192 A1 | |||
Авторы
Даты
2014-06-27—Публикация
2009-01-09—Подача