Настоящее изобретение относится к группе новых производных оксима пиперазина, обладающих представляющей интерес НК-1 антагонистической активностью.
Изобретение также относится к способу получения новых соединений и к фармацевтическим композициям, включающим, по меньшей мере, одно из новых соединений в качестве активного ингредиента, и к применению данных композиций для лечения расстройств, в которые включены рецепторы нейрокинина-1.
ЕР 0899270 относится к производным 2-(3-индолилметил)-1-бензоил-4-[(2-(бензиламино)этил)аминокарбонил)]пиперазина, обладающим НК-1 антагонистической активностью.
В настоящее время обнаружено, что соединения, в которых группа [(бензиламино)этиламинокарбонила] при N-4 замещена оксимной группой, также обладают очень интересными НК-1 антагонистическими свойствами.
Изобретение относится к соединениям общей формулы (1)
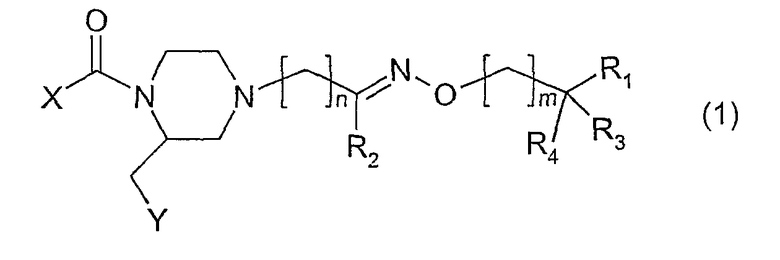
где:
- Х представляет фенил или пиридил, замещенные 1 или 2 заместителями из группы CH3, CF3, OCH3, галоген, циано и 5-CF3-тетразол-1-ил;
- Y представляет группы 2- или 3-индолила, фенила, 7-аза-индол-3-ила или 3-индазолила, 2-нафтила, 3-бензо[b]тиофенила или 2-бензофуранила, которые могут быть замещены одним или более галогенами или алкилами(1-3С);
- n имеет значение 0-3;
- m имеет значение 0-2;
- R1 представляет NH2, NH-алкил(1-3С), диалкил(1-3С)N, морфолино или морфолино, замещенный одной или двумя метильными и/или метоксиметильными группами, тиоморфолино, 1,1-диоксотиоморфолино, 2-, 3- или 4-пиридил или 4-CH3-пиперазинил;
- R2 является водородом, алкилом(1-4С) или фенилом или R2 вместе с (СН2)m, где m равно 1, и промежуточными атомами углерода, азота и кислорода образует изоксазолильную или 4,5-дигидроизоксазолильную группу,
- R3 и R4 независимо представляют водород или метил или R3 и R4 вместе являются кислородом
и его физиологически приемлемые соли.
В описании заместителей сокращение "алкил(1-3С)" означает: "метил, этил, н-пропил или изопропил", а сокращение "алкил(1-4С)" означает " метил, этил, н-пропил, изопропил, 1-бутил, 2-бутил, 1-(2-метил)пропил и 2-(2-метил)пропил".
Изобретение, в частности, относится к соединениям, имеющим формулу (1), где Y представляет группы 2- или 3-индолила, фенила, 7-аза-индол-3-ила или 3-индазолила, которые могут быть замещены галогеном или алкилом(1-3С); R1 представляет NH2, NH-алкил(1-3С), диалкил(1-3С)N, морфолино или морфолино, замещенный одной или двумя метильными и/или метоксиметильными группами, тиоморфолино, 2-, 3- или 4-пиридил или 4-CH3-пиперазинил, и R3 и R4 являются водородом, а Х, n, m и R2 имеют значения, данные выше.
Более конкретно изобретение относится к соединениям, имеющим формулу (1), где X представляет фенил, замещенный 2 заместителями из группы CF3 и галогена, Y представляет собой 3-индолил, m равно 1 или 2, n равно 1 или 2, а R1, R2, R3 и R4 имеют значения, данные выше.
Еще более конкретно изобретение относится к таким соединениям, имеющим формулу (1), где Х представляет фенил, замещенный в положениях 3 и 5 CF3 группой или галогеном.
В данной предпочтительной группе соединений, имеющих формулу (1), m и n имеют значение 1 или 2, R1 представляет собой амино, диметиламино или морфолино, R2 является водородом, метилом или фенилом или R2 вместе с (СН2)m, где m=1, и промежуточными атомами углерода, азота и кислорода образует изоксазолильную или дигидроизоксазолильную группу.
Как соединения, имеющие формулу (1), где группа -СН2-Y имеет R-конфигурацию или S-конфигурацию, так и E- и Z-энантиомеры оксим-эфира включены в объем изобретения.
Соединения, имеющие формулу (1), и их соли могут быть получены в соответствии с, по меньшей мере, одним из следующих способов, известных для соединений данного типа.
Соединения, имеющие формулу (1), где n имеет значение 1-3, может быть получено посредством реакции соединения, имеющего формулу (2)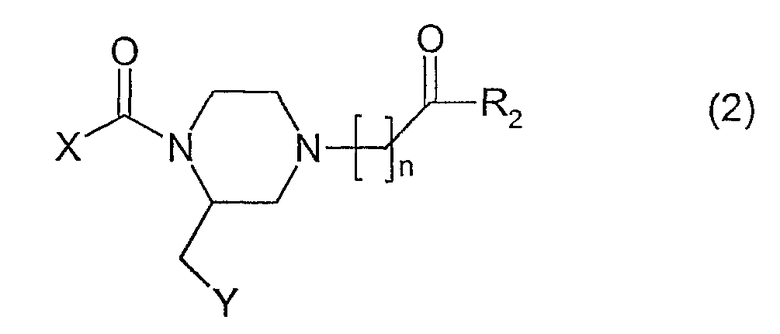
с соединением формулы (3)
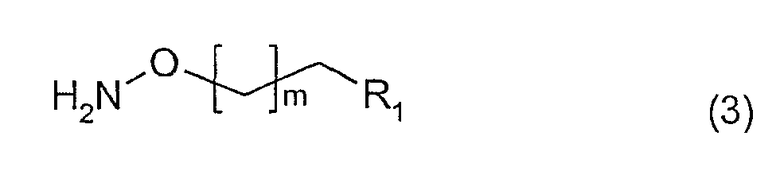
где X, Y, m, R1 и R2 имеют вышеприведенные значения. Данную реакцию предпочтительно проводят в растворителе, таком как метанол или этанол в присутствии ацетата натрия.
Соединения, имеющие формулу (1), где n=0, могут быть получены посредством реакции соединения, имеющего формулу (4)
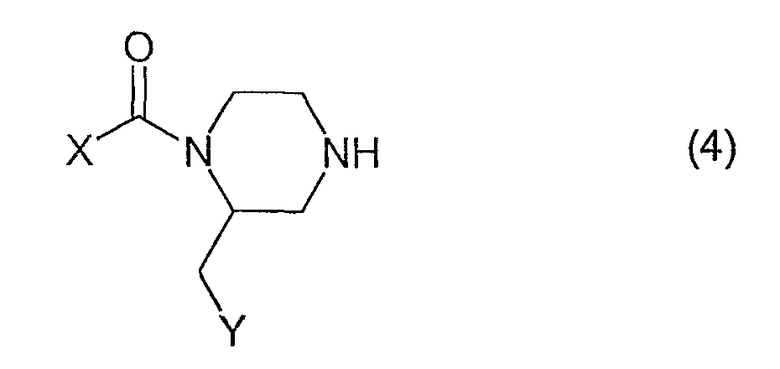
с диметилацеталем N,N-диметилформамида, предпочтительно в ацетонитриле при температуре кипячения с обратным холодильником с последующей реакцией с соединением, имеющим формулу (3), например, в ТГФ при температуре кипячения с обратным холодильником.
Соединения, имеющие формулу (1), где n=1, R2 является водородом и R1 является морфолино, могут быть получены посредством реакции соединения, имеющего формулу (2), с соединением, имеющим формулу (7)
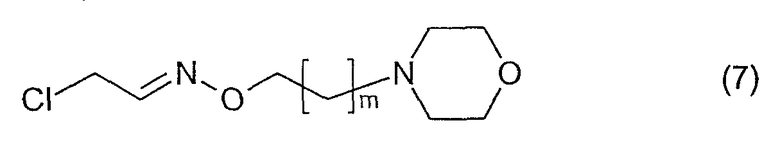
Данная реакция может быть проведена в растворителе, таком как ацетонитрил, в присутствии основания, такого как триэтиламин, и KI при температурах в интервале между комнатной температурой и 80°С.
Соединения, имеющие формулу (1), где R2 вместе с (СН2)m и промежуточными атомами образует изоксазолильную или 4,5-дигидроизоксазолильную группу, могут быть получены посредством реакции соединения, имеющего формулу (4), с соединением, имеющим формулу (9)
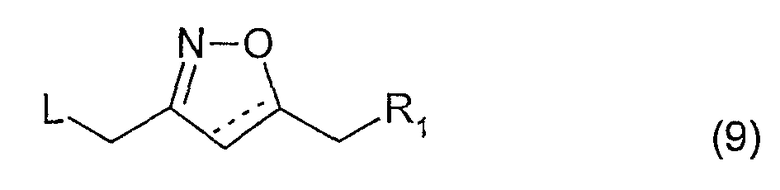
где L представляет собой так называемую уходящую группу, например, хлор или бром, а пунктирная линия является связью или отсутствует.
Исходные вещества, имеющие формулу (2), могут быть получены
а) посредством реакции соединения, имеющего формулу (4), с соединением, имеющим формулу (5)
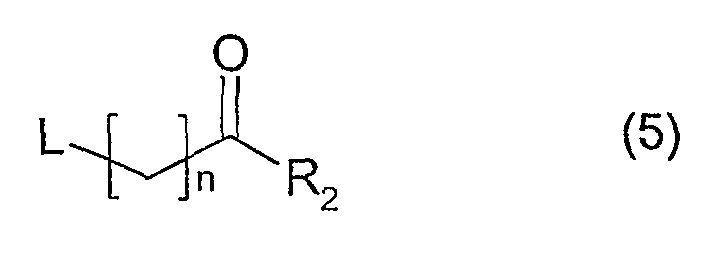
где L представляет собой так называемую уходящую группу, например, хлор или бром. Данную реакцию проводят в растворителе, таком как ацетонитрил, в присутствии основания, такого как триэтиламин, и KI при температурах в интервале между комнатной температурой и 80°С; или
b) посредством кислотного гидролиза соединения, полученного в результате реакции между соединением, имеющим формулу (4), и соединением, имеющим формулу (6)
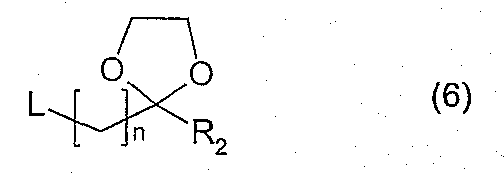
где символы имеют вышеприведенные значения.
Реакция алкилирования может быть проведена в растворителе, таком как ацетонитрил или диметилформамид в присутствии основания, такого как триэтиламин, и KI при температурах в интервале между комнатной температурой и 80°С. Реакция гидролиза полученного продукта может быть проведена в растворителе, таком как 1,4-диоксан с 6М HCl (водный) или
с) посредством реакции соединения, имеющего формулу (4), с метилвинилкетоном. Данную реакцию предпочтительно проводят в растворителе, таком как толуол, при комнатной температуре.
Исходные вещества, имеющие формулу (3), могут быть получены
а) посредством реакции соединения, имеющего формулу (8)

с оксимом 1-фенилэтанона, с последующим кислотным гидролизом, где формула L представляет собой так называемую уходящую группу, например, бром или хлор.
Реакция алкилирования может быть проведена в двухфазной системе, состоящей из растворителя, такого как толуол, и водного NaOH и бромида тетрабутиламмония при температуре, равной примерно 90°С. Гидролиз может быть проведен в 6М HCl (водный); или
b) в соответствии со способом, описанным Henmi et al (Org. Prep. Proceed. Int. 1994, 26, 111).
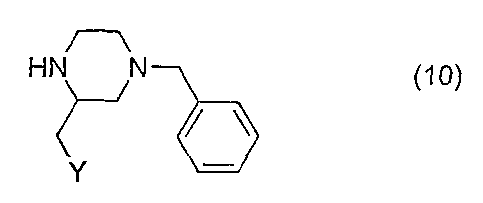
Исходные вещества, имеющие формулу (4), могут быть получены из соединений, имеющих формулу (10), аналогично тому, как описано в ЕР 0655442
Исходные вещества, имеющие формулу (7), могут быть получены аналогично синтезу 1-хлор-2-метоксииминоэтана, как описано в J. Chem. Soc. Perkin Trans. 1, 1991, 1721.
Исходные вещества, имеющие формулу (9), могут быть получены из 2-нитроэтил-2-тетрагидропиранильного эфира и соответствующего аллил- или пропаргиламина, способом, аналогичным способу, описанному в J. Med. Chem. 1995, 38, 4198.
Исходные вещества, имеющие формулу (10), могут быть получены аналогично тому, как описано в ЕР 0655442 или из трет-бутилового эфира 4-бензилпиперазин-1-карбоновой кислоты посредством алкилирования с последующей кислотной обработкой.
Алкилирование трет-бутилового эфира 4-бензилпиперазин-1-карбоновой кислоты (Т.R. Herrin, J.M. Pauvlik, E.V. Schuber, A.O. Geiszler J. Med. Chem. 1975, 18, 1216) может быть проведено в диэтиловом эфире посредством образования аниона под действием сильного основания, такого как втор-бутиллитий в присутствии тетраметилэтилендиамина при низкой температуре с последующим добавлением подходящего алкилирующего агента формулы (11)

Удаление трет-бутилоксикарбонильной группы может быть проведено с использованием известных методик (T.W. Greene, P.G.M. Wuts Protective groups in organic synthesis, 3nd ed., John Wiley & Sons, 1999).
Подходящие соли присоединения кислот могут быть образованы с неорганическими кислотами, такими как хлористоводородная кислота, серная кислота, фосфорная кислота и азотная кислота или с органическими кислотами, такими как лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, уксусная кислота, трифторуксусная кислота, бензойная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота и нафталинсульфоновая кислота.
Соединения изобретения общей формулы (1) так же, как их соли, обладают НК-1 антагонистической активностью и проявляют хорошую биодоступность. Они являются полезными при лечении нарушений, в которые включены нейрокинины, которые взаимодействуют с НК-1 рецепторами, например нейрокинин-1 (= вещество Р), или таких нарушений, которые можно лечить посредством воздействия на такие рецепторы. Например, острая и хроническая боль, рвота, воспалительные заболевания, такие как менингит, артрит, астма, псориаз и (солнечные) ожоги; желудочно-кишечные расстройства, в особенности, синдром раздраженного кишечника, воспалительное заболевание кишечника (болезнь Крона), язвенный колит; нарушения, связанные с гиперподвижностью мочевого пузыря или желудочно-кишечного тракта, воспаление мочевыводящих путей; аллергические ответы, такие как экзема и ринит; сердечно-сосудистые нарушения, такие как гипертензия, атеросклероз, водянка, стенокардия; кластерная головная боль и мигрень; кожные заболевания, такие как крапивница, красная волчанка и зуд; респираторные нарушения, включающие хроническую обструктивную легочную болезнь, бронхоспазмы, бронхопневмонию, бронхит, респираторный дистресс-синдром и кистозный фиброз; различные неопластические заболевания; психиатрические и/или неврологические заболевания, такие как шизофрения и другие психические нарушения; нарушения настроения, такие как биполярные нарушения I, биполярные нарушения II и униполярные депрессивные нарушения как минорная депрессия, сезонное аффективное нарушение, постнатальная депрессионная дистимия и общая депрессия; тревожные состояния, включающие паническое состояние (с агорафобией или без нее), социальная фобия, обсессивное компульсивное нарушение (с сопутствующими заболеванию хроническим тиком или шизотипальным нарушением или без них), посттравматическое стрессовое нарушение и общее состояние тревоги; нарушения, связанные с веществами, включая нарушения при приеме веществ (как зависимость и злоупотребление) и нарушения, индуцированные веществами (как синдром отмены); нарушения первазивного развития, включая аутизм и нарушение Ретта, дефицит внимания и нарушения, связанные с разрушительным поведением, такие как гиперактивность дефицита внимания; нарушения импульсного контроля, такие как агрессия, патологическая страсть к игре; расстройства, связанные с едой, как анорексия и булимия; нарушения сна как бессонница; нарушения, связанные с тиком, как расстройство Туретта; синдром усталости ног; расстройства, связанные с нарушением узнавания и памяти, такие как болезнь Альцгеймера, болезнь Крейтцфельдта-Якоба, болезнь Хантингтона, болезнь Паркинсона и нейрореабилитация (посттравматические повреждения мозга).
НК-1 антагонистические свойства соединений изобретения тестируют, используя методы, приведенные ниже.
Фармакологические методы
Связывание с рецептором в случае НК-1 рецепторов человека
Сродство соединений к НК-1 рецепторам человека оценивают с использованием анализа радиорецепторного связывания. Мембранные препараты получают из фибробластных клеток яичника китайского хомяка (СНО-клетки), в которых стабильно экспрессируется НК-1 рецептор человека. Мембраны инкубируют с [3H]-веществом Р в отсутствие или присутствии установленных концентраций соединений, разводят в подходящем буфере в присутствии ингибитора пептидазы в течение 10 мин при 25°С. Разделение связанной радиоактивности от свободной проводят фильтрацией через фильтры из стекловолокна Whatman GF/B с двумя промывками в течение 5 сек. Связанную радиоактивность определяют посредством жидкостного сцинтилляционного счета, используя счетчик Betaplate. Получают зависимость измеренной радиоактивности от концентрации вытесняющего тестируемого соединения и рассчитывают кривые вытеснения методом четырехпараметрической логистической регрессии, приводящей к значениям IC50, т.е. такой концентрации вытесняющего соединения, при которой вытесняется 50% радиолиганда. Значения рК1 сродства рассчитывают корректировкой значений IC50 для концентрации радиолиганда и его сродства к НК-1 рецептору человека в соответствии с уравнением Ченга-Прусоффа:
рК1=-log(IC50/(1+S/Kd))
в котором IC50 такое, как описано выше, S представляет концентрацию [3H]-вещества Р, применяемого в анализе, выраженного в моль/л, и Kd представляет равновесную константу диссоциации [3H]-вещества Р для НК-1 рецепторов человека (в моль/л).
Функциональные методы in vitro для НК-1 рецепторов
Метаболизм ФИ
Воздействия тестируемых соединений на оборот фосфатидилинозита (ФИ) оценивают в СНО-клетках, стабильно экспрессирующих клонированные человеческие нейрокининовые НК-1 рецепторы. В данных клетках НК-1 рецепторы положительно связаны с фосфолипазой С, высвобождающей инозитфосфаты из мембранных фосфолипидов. Фосфаты инозита могут аккумулироваться в клетках, когда инозит-1-фосфатаза ингибируется посредством предварительной инкубации клеток с литием. Для тестов клетки культивируют в 24-луночных планшетах и инкубируют в течение ночи с [3H]-миоинозитом, который метаболически встраивается в мембранные фосфолипиды. После мечения клетки дважды промывают физиологическим раствором, забуференным фосфатом (рН 7,4), и инкубируют в течение 1 часа в α-DMEM. Далее добавляют LiCl и через 20 мин к инкубационной среде добавляют тестируемые соединения и инкубируют в течение 1 часа. Как LiCl, так и вещество Р в отсутствие или присутствии тестируемых соединений (при установленных концентрациях) разводят до нужных концентраций в свободном от сыворотки α-DMEM таким образом, чтобы LiCl имел конечную концентрацию 5 мМ.
После инкубации среду аспирируют и клетки экстрагируют 5% трихлоруксусной кислотой. Фосфаты инозита извлекают из экстракта последовательной органической экстракцией, используя дихлорметан и воду, и ионообменной хроматографией на колонках AG-1X2 DOWEX, которые элюируют 1М формиатом аммония (рН 7). Радиоактивность в элюированных фракциях подсчитывают с помощью жидкостного сцинтилляционного счета и получают зависимость радиоактивности от концентраций соединений для построения зависимости концентрация-эффект. Проводят четырехпараметрическую логистическую регрессию, позволяющую провести оценки эффективности и характеристической активности соединений.
Получают значения IC50, то есть такой концентрации соединения, которая на 50% проявляет антагонистический эффект по отношению к индуцированной веществом Р аккумуляции фосфатов инозита, и рассчитывают значения антагонистической эффективности (рА2), используя уравнение:
рА2=IC50/(1+[SP]/EC50)
в котором IC50 для тестируемого соединения получают из зависимостей концентрация-эффект, [SP] представляет концентрацию вещества Р (в мол/л; обычно 10 нМ) и EC50 является эффективностью вещества Р по отношению к человеческим клонированным НК-1 рецепторам.
Измерения цАМФ
Воздействия тестируемых соединений на образование циклического АМФ (цАМФ) оценивают, используя фибробластные СНО-клетки, стабильно экспрессирующие клонированные человеческие НК-1 рецепторы. В дополнение к связыванию с фосфолипазой С, человеческие НК-1 рецепторы также способны стимулировать аденилатциклазу, которая преобразует АТФ в цАМФ. Для тестов клетки культивируют в 24-луночных планшетах. Перед экспериментами среду заменяют на свободную от сыворотки культуральную среду с α-DMEM, содержащую [3H]-аденин, который поглощается клетками и последовательно преобразуется в радиоактивно меченный аденозин, АМФ, АДФ и, в конечном счете, в радиоактивно меченный АТФ. Через 2 часа клетки дважды промывают физиологическим раствором, забуференным фосфатом (рН 7,4), в присутствии 1 мМ изобутилметилксантина (ИБМК; ингибитор фосфодиэстераз, которые гидролизуют цАМФ в АМФ). Последовательно клетки стимулируют 10 нМ веществом Р в отсутствие или в присутствии тестируемых соединений в соответственных разведениях в ФБФР/ИБМК в течение 20 мин. После стимуляции среду аспирируют и клетки экстрагируют 5% трихлоруксусной кислотой. Радиоактивно меченные АТФ и цАМФ извлекают из экстрактов, используя последовательную колоночную хроматографию. Экстракты разделяют ионообменной хроматографией на колонках DOWEX 50WX4, позволяющих извлечь АТФ. Колонки последовательно помещают на верхнюю часть колонок с оксидом алюминия и элюируют водой. Извлечение цАМФ проводят элюированием колонок с оксидом алюминия 100 мМ имидазолом (рН 7,4). Во фракциях с АТФ и цАМФ радиоактивность подсчитывают с помощью жидкостного сцинтилляционного счета и степени конверсии рассчитывают по уравнению:
v=[цАМФ]x100%/([АТФ]+[цАМФ])
Зависимости концентрация-отклик создают посредством построения графика зависимости конверсии цАМФ от концентраций соединения и концентрации IC50 рассчитывают, используя четырехпараметрическую логистическую регрессию. Значения антагонистической эффективности (рА2) рассчитывают, используя уравнение:
рА2=IC50/(1+[SP]/EC50)
в котором IC50 для тестируемого соединения получают из зависимостей концентрация-эффект, [SP] представляет концентрацию вещества Р (в мол/л; обычно 10 нМ) и EC50 является эффективностью вещества Р по отношению к клонированным НК-1 рецепторам человека.
Индуцированный агонистом НК-1 парацентез ступни у песчанок
Продемонстрирована способность антагонистов НК-1 проявлять антагонистический эффект по отношению к парацентезу ступни, индуцированному центрально введенными агонистами НК-1 (Rupniak and Williams, 1994 (Eur. J. Pharmacol. 265: 179); Bristow and Young, 1994 (Eur. J. Pharmacol. 254: 245)). Поэтому авторы использовали эту модель для оценки in vivo активности соединений изобретения.
За 60 мин перед анестезией N2O (0,8 л/мин), галотаном (3%) и О2 (0,8 л/мин) самцам песчанок (40-60 г; Charles River) вводят инъекционно носитель или тестируемое соединение (перорально). При удачном наркозе расход анестетиков приводят к значениям для N2O (0,6 л/мин), галотана (1,5%) и О2 (0,6 л/мин) и проводят срединное рассечение скальпа. Проводят инфузию GR 73632 в церебровентрикулярное пространство (АР - 0,5 мм, L - 1,2 мм и вертикальное 4,5 мм от брегмы). После восстановления от анестезии (приблизительно 3-4 мин) регистрировали ответный парацентез ступни в течение 5 мин. Предварительно определенный критерий для оценки антагонизма данного ответа определяют по ингибированию парацентеза ступни в течение 5 минут.
Соединения изобретения имеют высокое сродство к НК-1 рецепторам в анализе на связывание, описанном выше. Соединения изобретения также активны в анализе на цАМФ, их значения рА2 находятся в соответствии с их значениями рК1. Некоторые из соединений согласно изобретению проникают через гематоэнцефалический барьер, что, очевидно, следует из их активности в тесте на индуцированный агонистом нейрокинина парацентез ступни. Данное свойство позволяет применять их при лечении нарушений ЦНС.
Изобретение далее иллюстрируют посредством следующих конкретных примеров. Подразумевают, что данные примеры далее только иллюстрируют изобретение более подробно, и, поэтому, не считают, что они каким-либо образом ограничивают объем изобретения.
Пример 1
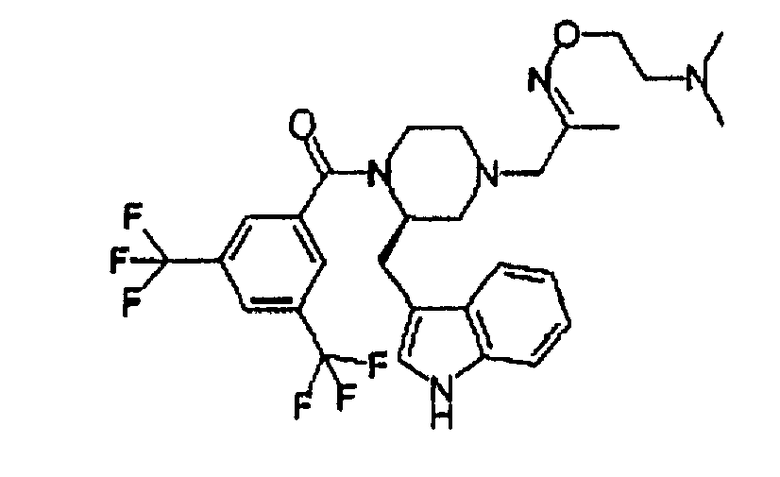
Смесь (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазина (255 мг), дигидрохлорида О-[2-(диметиламино)этил]гидроксиламина (89 мг), ацетата натрия (каталитическое количество) и метанола (10 мл) нагревают при кипячении с обратным холодильником в течение 2 часов. Растворитель удаляют в вакууме, и остаток обрабатывают дихлорметаном и NaOH (водный, 2N). Слои разделяют, органический слой сушат и концентрируют в вакууме. Остаток очищают флэш-хроматографией (SiO2, СН2Cl2/MeOH/NH4OH 92/7,5/0,5) c получением 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(диметиламино)этил]оксима 0,31 г (> 95%) в виде смеси E/Z. Rf 0,26 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
Следующие соединения получают в соответствии с аналогичной методикой:
1) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-фенил-2-этанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 702; Rf 0,27+0,34 (E+Z изомер) (СН2Cl2/MeOH 95/5).
2) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-фенил-2-этанон О-[2-(диметиламино)этил]оксим. МН+ 660; Rf 0,50 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
3) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-фенил-2-этанон О-[2-аминоэтил]оксим. Rf 0,30 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
4) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-фенил-2-этанон О-[3-(морфолин-4-ил)пропил]оксим. МН+ 716; Rf 0,30 (СН2Cl2/MeOH 95/5).
4а) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-фенил-2-этанон О-[3-(диметиламино)пропил]оксим. МН+ 674; Rf 0,40 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
5) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-метилоксим. МН+ 541; Rf 0,55 (EtOAc).
6) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 640; Rf 0,30 (СН2Cl2/MeOH 95/5).
7) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(1-тиоморфолин-4-ил)этил]оксим. МН+ 656; Rf 0,70 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
8) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(4-метил-1-пиперазинил)этил]оксим. МН+ 653; Rf 0,30 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
9) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-аминоэтил]оксим. МН+ 570.
10) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(метиламино)этил]оксим. МН+ 584; Rf 0,43 (СН2Cl2/MeOH/NH4OH 85/15/1).
11) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[3-(морфолин-4-ил)пропил]оксим. Rf 0,35 (СН2Cl2/MeOH 95/5).
12) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[3-(диметиламино)пропил]оксим. МН+ 611; Rf 0,35 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
13) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-3-бутанон О-[2-(диметиламино)этил]оксим. МН+ 612; Rf 0,10 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
14) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-3-бутанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 654; Rf 0,37 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
15) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-3-бутанон О-[2-аминоэтил]оксим. МН+ 584; Rf 0,16 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
16) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-3-бутанон О-[3-(диметиламино)пропил]оксим. МН+ 626; Rf 0,20 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
17) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-3-бутанон О-[3-(морфолин-4-ил)пропил]оксим. МН+ 668; Rf 0,50 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
18) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-4-пентанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 668; Rf 0,33 (СН2Cl2/MeOH 8/2).
19) 3-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}пропаналь О-[2-(диметиламино)этил]оксим. МН+ 598; Rf 0,29 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
20) 3-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}пропаналь О-[2-(морфолин-4-ил)этил]оксим. МН+ 640; Rf 0,33 (СН2Cl2/MeOH 9/1).
21) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-3-фенил-3-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 716; Rf 0,26 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
22) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-3-фенил-3-пропанон О-[3-(морфолин-4-ил)пропил]оксим. МН+ 730; Rf 0,23 (СН2Cl2/MeOH 95/5).
23) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(2-пиридил)этил]оксим. МН+ 632; Rf 0,12 (СН2Cl2/MeOH 98/2).
24) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-пиридилметил]оксим. МН+ 618; Rf 0,24 (СН2Cl2/MeOH 97/3).
25) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[3-пиридилметил]оксим. МН+ 618; Rf 0,27 (СН2Cl2/MeOH 97/3).
26) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[4-пиридилметил]оксим. МН+ 618; Rf 0,19 (СН2Cl2/MeOH 97/3).
27) 1-{(2R)-1-[3,5-дифторбензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 540; Rf 0,61 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
28) 1-{(2R)-1-[3,5-дихлорбензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 572; Rf 0,20 (СН2Cl2/MeOH 95/5).
29) 1-{(2R)-1-[3,5-дибромбензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 662; Rf 0,44 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
30) 1-{(2R)-1-[3,5-дицианобензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 554.
31) 1-{(2R)-1-[2-метокси-5-(5-трифторметилтетразол-1-ил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим.
32) 1-{(2R)-1-[3-фтор-5-(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим.
33) 1-{(2R)-1-[(2,6-дихлорпиридин-4-ил)карбонил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим.
34) 1-{(2R)-1-[2,4-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 640; Rf 0,74 (СН2Cl2/MeOH 97/3).
35) 1-{(2R)-1-[2,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 640; Rf 0,64 (СН2Cl2/MeOH 97/3).
36) 1-{(2R)-1-[3,5-диметилбензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 532; Rf 0,57 (СН2Cl2/MeOH 97/3).
37) 1-{(2R)-1-[2-хлор-5-(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 606; Rf 0,75 (СН2Cl2/MeOH 97/3).
38) 1-{(2R)-1-[2-метоксибензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 534; Rf 0,63 (СН2Cl2/MeOH 97/3).
39) 1-{1-[3,5-бис(трифторметил)бензоил]-2-(5-фтор-1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 658; Rf 0,33 (СН2Cl2/MeOH 9/1).
40) 1-{1-[3,5-бис(трифторметил)бензоил]-2-(5-фтор-1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(диметиламино)этил]оксим. МН+ 616; Rf 0,15 (СН2Cl2/MeOH 9/1).
41) 1-{1-[3,5-бис(трифторметил)бензоил]-2-(5-метил-1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 654; Rf 0,22 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
42) 1-{1-[3,5-бис(трифторметил)бензоил]-2-(5-метил-1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(диметиламино)этил]оксим. МН+ 612; Rf 0,09 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
43) 1-{1-[3,5-бис(трифторметил)бензоил]-2-(7-аза-1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 641; Rf 0,34 (СН2Cl2/MeOH 9/1).
44) 1-{1-[3,5-бис(трифторметил)бензоил]-2-бензилпиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 601; Rf 0,45 (СН2Cl2/MeOH 97/3).
45) 1-{1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-2-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 640; Rf 0,46 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
46) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)-2-оксоэтил]оксим. Rf 0,25 (СН2Cl2/MeOH 97/3).
47) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)пропил]оксим. МН+ 654; Rf 0,19 (СН2Cl2/MeOH 97/3).
48) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-метил-2-(морфолин-4-ил)пропил]оксим. МН+ 668; Rf 0,45 (СН2Cl2/MeOH 97/3).
49) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(2,6-диметилморфолин-4-ил)этил]оксим. МН+ 668; Rf 0,34 (СН2Cl2/MeOH/NH4OH 96/3,75/0,25).
50) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(1,1-диоксо-1-тиоморфолин-4-ил)этил]оксим. МН+ 688; Rf 0,34 (СН2Cl2/MeOH/NH4OH 96/3,75/0,25).
51) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(3,5-диметилморфолин-4-ил)этил]оксим (Изомер 1). МН+ 668; Rf 0,20+0,28 (Е+Z изомер) (СН2Cl2/MeOH/NH4OH 96/3,75/0,25).
52) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(3,5-диметилморфолин-4-ил)этил]оксим (Изомер 2). МН+ 668; Rf 0,21+0,31 (Е+Z изомер) (СН2Cl2/MeOH/NH4OH 96/3,75/0,25).
53) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(3-метоксиметилморфолин-4-ил)этил]оксим. МН+ 684; Rf 0,46+0,54 (Е+Z изомер) (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
54) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(цис-3,5-бис-метоксиметилморфолин-4-ил)этил]оксим. Rf 0,17+0,23 (Е+Z изомер) (СН2Cl2/MeOH/NH4OH 96/3,75/0,25).
55) 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(транс-3,5-бис-метоксиметилморфолин-4-ил)этил]оксим. МН+ 728.
56) 1-{1-[3,5-бис(трифторметил)бензоил]-2-(4-хлорбензил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 635. Rf 0,28 (СН2Cl2/MeOH 95/5).
57) 1-{1-[3,5-бис(трифторметил)бензоил]-2-(3,4-дихлорбензил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 669. Rf 0,63 (СН2Cl2/MeOH 95/5).
58) 1-{1-[3,5-бис(трифторметил)бензоил]-2-(нафталин-2-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 651; Rf 0,65 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
59) 1-{2-(бензо[b]тиофен-3-илметил-1-[3,5-бис(трифторметил)бензоил]пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 657; Rf 0,30 (СН2Cl2/MeOH 95/5).
60) 1-{1-[3,5-бис(трифторметил)бензоил]-2-(1H-индазол-3-илметил)пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 641; Rf 0,40 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
61) 1-{2-(бензофуран-2-илметил)-1-[3,5-бис(трифторметил)бензоил]пиперазин-4-ил}-2-пропанон О-[2-(морфолин-4-ил)этил]оксим. МН+ 641; Rf 0,30 (СН2Cl2/MeOH 95/5).
Пример 2
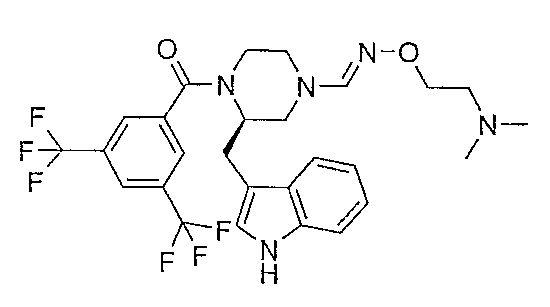
Смесь (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазина (0,47 г), диметилацеталя N,N-диметилформамида (0,12 г) и ацетонитрила (15 мл) нагревают при кипячении с обратным холодильником в течение 24 часов. После охлаждения до комнатной температуры летучие вещества удаляют в вакууме. Остаток растворяют в безводном тетрагидрофуране, добавляют дигидрохлорид О-[2-(диметиламино)этил]гидроксиламина (547 мг) и диизопропилэтиламин (1,1 мл), и полученную в результате смесь нагревают при кипячении с обратным холодильником в течение двух часов. Растворитель удаляют в вакууме и остаток очищают флэш-хроматографией (SiO2, СН2Cl2/MeOH/NH4OH 85/15/1) c получением 0,79 г 1-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-метанон О-[2-(диметиламино)этил]оксима в виде смеси E/Z. МН+ 570; Rf 0,32+0,49 (Е+Z изомер) (СН2Cl2/MeOH/NH4OH 85/15/1).
Пример 3
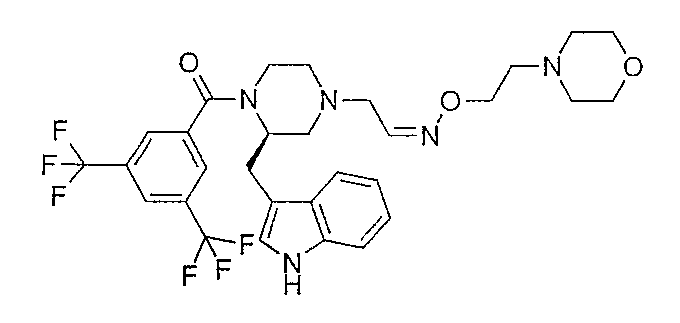
Смесь 2-хлорэтаналь О-[2-(морфолин-4-ил)этил]оксима (0,13 г), (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазина (0,29 г), диизопропилэтиламина (0,11 мл) и ацетонитрила (10 мл) нагревают при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры растворитель удаляют в вакууме и остаток обрабатывают дихлорметаном и K2CO3 (водный). Слои разделяют, органический слой сушат (Na2SO4) и концентрируют в вакууме. Остаток очищают флэш-хроматографией (SiO2, СН2Cl2/MeOH/NH4OH 92/7,5/0,5) c получением 0,38 г 2-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}-этаналь О-[2-(морфолин-4-ил)этил]оксима (95%) в виде смеси E/Z. МН+ 626; Rf 0,53+0,66 (Е+Z изомер) (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
Следующие соединения получают в соответствии с аналогичной методикой:
1) 2-{(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазин-4-ил}этаналь О-[3-(морфолин-4-ил)пропил]оксим. Rf 0,63+0,72 (E+Z изомер) (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
2) (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-{[5-((морфолин-4-ил)метил)-4,5-дигидроизоксазол-3-ил]метил}пиперазин. МН+ 638; выделяют два изомера Rf 0,51 (изомер 1), Rf 0,61 (изомер 2) (СН2Cl2/MeOH/NH4OH 96/3,75/0,25).
3) (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-{[5-((морфолин-4-ил)метил)изоксазол-3-ил]метил}пиперазин. Выделяют в виде HCl-соли: температура плавления 182-184°С, МН+ 636; Rf 0,28 (СН2Cl2/MeOH/NH4OH 96/3,75/0,25).
Пример 4
Получение промежуточных соединений формулы (2)
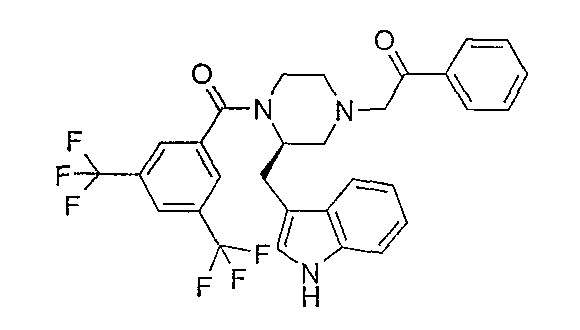
Смесь фенацилбромида (0,88 г), (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазина (2 г), иодида калия (каталитическое количество), диизопропилэтиламина (0,77 мл) и ацетонитрила (20 мл) перемешивают при комнатной температуре в течение ночи. После охлаждения до комнатной температуры растворитель удаляют в вакууме и остаток обрабатывают дихлорметаном и NaOH (2N). Слои разделяют, органический слой сушат (Na2SO4) и концентрируют в вакууме. Остаток очищают флэш-хроматографией (SiO2, СН2Cl2/MeOH 97/3) c получением 2,16 г (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(2-фенил-2-этанон-1-ил)пиперазина (85%). МН+ 574; Rf 0,44 (СН2Cl2/MeOH 97/3).
Следующие соединения получают в соответствии с аналогичной методикой:
(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин. МН+ 512; Rf 0,38 (СН2Cl2/MeOH 97/3).
(2R)-1-[3,5-дифторбензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин. Rf 0,72 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
(2R)-1-[3,5-дихлорбензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин. Rf 0,50 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
(2R)-1-[3,5-дибромбензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
(2R)-1-[2-метокси-5-(5-трифторметилтетразол-1-ил)бензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
(2R)-1-[3-фтор-5-(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
(2R)-1-[2,6-дихлорпиридин-4-ил)карбонил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
(2R)-1-[3,5-дицианобензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
(2R)-1-[2,4-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
(2R)-1-[3,5-диметилбензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
(2R)-1-[2-хлор-5-(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
(2R)-1-[2,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
(2R)-1-[2-метоксибензоил]-2-(1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
1-[3,5-бис(трифторметил)бензоил]-2-бензил-4-(2-пропанон-1-ил)пиперазин. МН+ 473; Rf 0,65 (СН2Cl2/MeOH 97/3).
1-[3,5-бис(трифторметил)бензоил]-2-(4-хлорбензил)-4-(2-пропанон-1-ил)пиперазин. МН+ 507; Rf 0,89 (СН2Cl2/MeOH 95/5).
1-[3,5-бис(трифторметил)бензоил]-2-(3,4-дихлорбензил-4-(2-пропанон-1-ил)пиперазин. Rf 0,63 (СН2Cl2/MeOH 95/5).
1-[3,5-бис(трифторметил)бензоил]-2-(нафталин-2-илметил)-4-(2-пропанон-1-ил)пиперазин. Rf 0,77 (СН2Cl2/MeOH 95/5).
1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-2-илметил)-4-(2-пропанон-1-ил)пиперазин.
1-[3,5-бис(трифторметил)бензоил]-2-(5-фтор-1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин.
1-[3,5-бис(трифторметил)бензоил]-2-(5-метил-1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин. МН+ 526; Rf 0,52 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
1-[3,5-бис(трифторметил)бензоил]-2-(7-аза-1Н-индол-3-илметил)-4-(2-пропанон-1-ил)пиперазин. МН+ 513; Rf 0,38 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индазол-3-илметил)-4-(2-пропанон-1-ил)пиперазин. МН+ 513; Rf 0,32 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
2-(бензо[b]тиофен-3-илметил)-1-[3,5-бис(трифторметил)бензоил]-4-(2-пропанон-1-ил)пиперазин. Rf 0,73 (СН2Cl2/MeOH 95/5).
2-(бензофуран-2-илметил)-1-[3,5-бис(трифторметил)бензоил]-4-(2-пропанон-1-ил)пиперазин.
(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(3-фенил-3-пропанон-1-ил)пиперазин. МН+ 588; Rf 0,50 (СН2Cl2/MeOH 95/5).
(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(3-бутанон-1-ил)пиперазин.
Пример 5
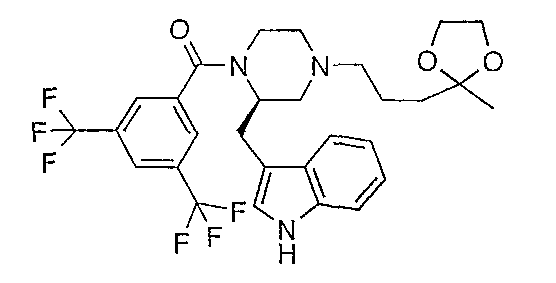
Смесь этиленкеталя 5-хлор-2-пентанона (0,54 г), (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазина (1,37 г), диизопропилэтиламина (0,6 мл) и диметилформамида (25 мл) нагревают в течение ночи при 90°С. После охлаждения до комнатной температуры смесь выливают в воду и экстрагируют этилацетатом. Органический слой сушат (Na2SO4) и концентрируют в вакууме. Остаток очищают флэш-хроматографией (SiO2, СН2Cl2/MeOH 95/5) c получением (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-[3-(2-метил-1,3-диоксолан-2-ил)пропил]пиперазина (0,7 г, 40%). МН+ 584.
Следующее соединение получают в соответствии с аналогичной методикой:
(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-[2-(1,3-диоксолан-2-ил)этил]пиперазин. Rf 0,30 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
Пример 6
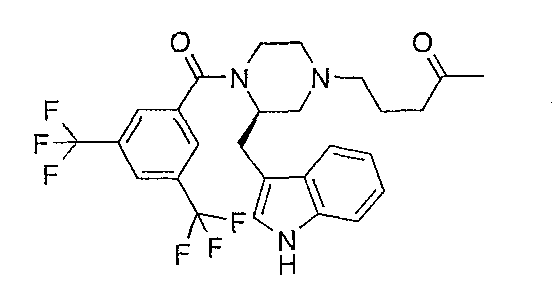
Смесь (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-[3-(2-метил)-1,3-диоксолан-2-ил)пропил]пиперазина (0,7 г), 1,4-диоксана (6 мл) и хлористоводородной кислоты (6N, 5 мл) нагревают при 50°С в течение 2 часов. После охлаждения до комнатной температуры смесь выливают в гидроксид аммония и экстрагируют этилацетатом. Органический слой сушат и концентрируют в вакууме c получением неочищенного (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(4-пентанон-1-ил)пиперазина, который используют как таковой. МН+ 540, Rf 0,51 (СН2Cl2/MeOH/NH4OH 93/7/0,5).
Следующее соединение получают в соответствии с аналогичной методикой:
(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(3-пропаналь-1-ил)пиперазин. Rf 0,33 (СН2Cl2/MeOH 95/5).
Пример 7
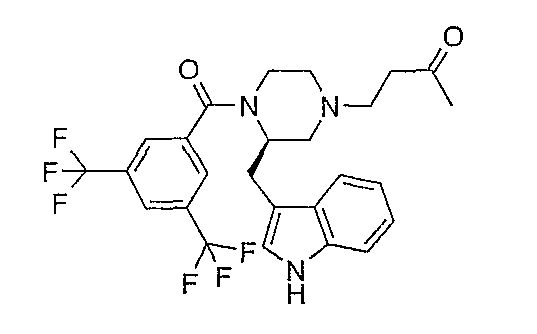
К раствору (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-[4-пентанон-1-ил]пиперазина (1,37 г) в толуоле (15 мл) по каплям добавляют метилвинилкетон (0,3 г). После 2,5 часов при комнатной температуре раствор концентрируют с получением неочищенного (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(3-бутанон-1-ил)пиперазина, который используют как таковой. Rf 0,55 (СН2Cl2/MeOH 95/5).
Пример 8
Получение промежуточных соединений формулы (7)
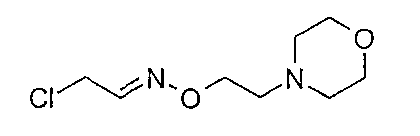
Смесь ацетальдегида (0,1 мл 50% раствора в воде), дигидрохлорида О-[2-(морфолин-4-ил)этил]гидроксиламина (0,14 г), NaOH (2N, 0,64 мл) и воды (5 мл) перемешивают при комнатной температуре в течение ночи. Раствор подщелачивают NaOH (1N) и экстрагируют дихлорметаном. Органический слой сушат (Na2SO4) и концентрируют в вакууме c получением 2-хлорэтаналя О-[2-((морфолин-4-ил))этил]оксима (0,13 г, ˜100%), который используют как таковой.
Следующее соединение получают в соответствии с аналогичной методикой:
2-хлорэтаналь О-[3-(морфолин-4-ил)пропил]оксим.
Пример 9
Получение промежуточных соединений формулы (9)
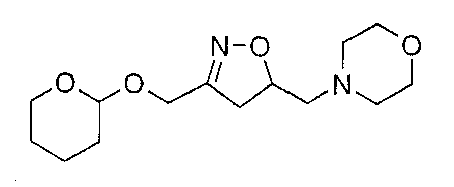
К раствору N-аллилморфолина (0,76 г, 5,0 ммоль) в толуоле (10 мл) добавляют 2-(2-нитроэтокси)тетрагидропиран (1,34 г, 7,7 ммоль), фенилизоцианат (2,43 г, 20,1 ммоль) и триэтиламин (52 мг; 0,5 ммоль). Полученную в результате смесь нагревают при 55°С в течение ночи. После охлаждения до комнатной температуры образующийся осадок удаляют фильтрацией и оставшийся раствор концентрируют в вакууме. Остаток очищают флэш-хроматографией (SiO2, СН2Cl2/MeOH/NH4OH 96/3,75/0,25) c получением 0,63 г (44%) 2-тетрагидропиранильного эфира [5-((морфолин-4-ил)метил)-4,5-дигидроизоксазол-3-ил]метила. МН+ 285, Rf 0,34 (СН2Cl2/MeOH/NH4OH 96/3,75/0,25).
Следующее соединение получают в соответствии с аналогичной методикой:
2-тетрагидропиранильный эфир [5-((морфолин-4-ил)метил)изоксазол-3-ил]метила. Rf 0,18 (EtOAc/MeOH 99/1).
Пример 10
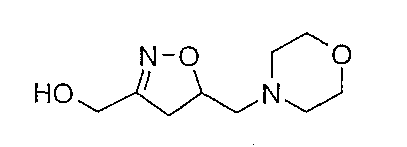
Смесь 2-тетрагидропиранильного эфира [5-((морфолин-4-ил)метил)-4,5-дигидроизоксазол-3-ил]метила (0,63 г) с п-толуолсульфонатом пиридиния (10 мол. %) в метаноле нагревают при кипячении с обратным холодильником в течение 24 часов. После охлаждения до комнатной температуры растворитель удаляют в вакууме и остаток очищают флэш-хроматографией (SiO2, СН2Cl2/MeOH/NH4OH 92/7,5/0,5) c получением [5-((морфолин-4-ил)метил)-4,5-дигидроизоксазол-3-ил]метанола (95%). Rf 0,17 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
Пример 11
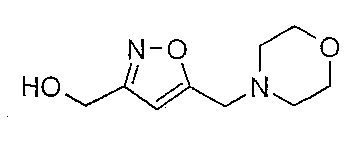
2-Тетрагидропиранильный эфир [5-((морфолин-4-ил)метил)изоксазол-3-ил]метила (1,0 г) растворяют в метаноле (2 мл) и обрабатывают 1М HCl (водный, 10 мл). Смесь перемешивают при комнатной температуре в течение 1 часа, далее подщелачивают K2CO3 и экстрагируют дихлорметаном. Органические слои сушат (Na2SO4) и концентрируют в вакууме. Остаток очищают флэш-хроматографией (SiO2, СН2Cl2/MeOH/NH4OH 92/7,5/0,5) c получением [5-((морфолин-4-ил)метил)изоксазол-3-ил]метанола (53%). МН+ 199, Rf 0,24 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
Пример 12
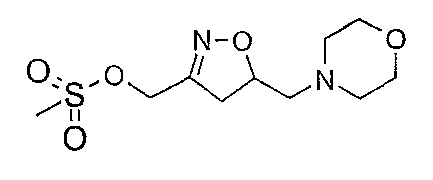
К раствору [5-(морфолин-4-илметил)-4,5-дигидроизоксазол-3-ил]метанола (0,38 г) в дихлорметане добавляют по каплям диизопропилэтиламин (0,33 мл) и метансульфонилхлорид (0,15 мл). Полученный в результате раствор перемешивают при комнатной температуре в течение 3 часов и обрабатывают водой. Слои разделяют и органический слой сушат (Na2SO4) и концентрируют в вакууме c получением метансульфоната [5-((морфолин-4-ил)метил)-4,5-дигидроизоксазол-3-ил]метанола, 0,52 г (˜100%). Rf 0,63 (СН2Cl2/MeOH/NH4OH 92/7,5/0,5).
Следующее соединение получают в соответствии с аналогичной методикой:
метансульфонат [5-((морфолин-4-ил)метил)изоксазол-3-ил]метанола. Rf 0,62 (СН2Cl2/MeOH/NH4OH 96/3,75/0,25).
Пример 13
Получение промежуточных соединений формулы (3)
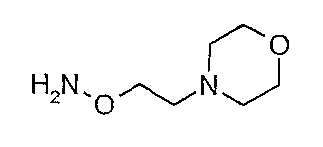
К раствору оксима ацетофенона (20 г) в толуоле (700 мл) добавляют последовательно бромид тетрабутиламмония (4,77 г), воду (8 мл), гидрохлорид 4-(2-хлорэтил)морфолина (30,31 г) и окончательно 50% гидроксид натрия (водный, 52 мл). Полученную в результате смесь нагревают при 75°С в течение ночи. После охлаждения до комнатной температуры добавляют воду для растворения всех солей, разделяют слои и водный слой экстрагируют толуолом. Органические слои сушат (MgSO4) и концентрируют в вакууме. Остаток очищают флэш-хроматографией (SiO2, СН2Cl2/MeOH 95/5) c получением О-[2-(морфолин-4-ил)этил]оксима в виде масла. Полученное масло растворяют в 6М HCl (водный, 500 мл) и нагревают с обратным холодильником в течение 5 часов с последующим перемешиванием в течение ночи при комнатной температуре. Смесь экстрагируют эфиром и концентрируют в вакууме. Осадок кристаллизуют из этанола с получением дигидрохлорида О-[2-(морфолин-4-ил)этил]гидроксиламина. 24,8 г (77%).
Следующие соединения получают в соответствии с аналогичной методикой:
дигидрохлорид О-[2-(диметиламино)этил]гидроксиламина
дигидрохлорид О-[2-(метиламино)этил]гидроксиламина
дигидрохлорид О-[3-(диметиламино)этил]гидроксиламина
дигидрохлорид О-[3-(морфолин-4-ил)пропил]гидроксиламина
дигидрохлорид О-[2-пиридилметил]гидроксиламина
дигидрохлорид О-[3-пиридилметил]гидроксиламина
дигидрохлорид О-[4-пиридилметил]гидроксиламина.
Пример 14
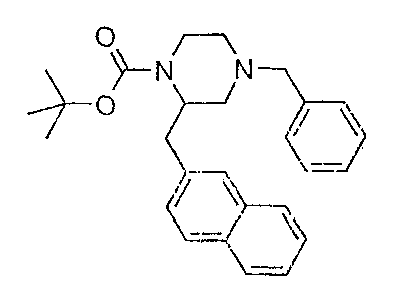
К раствору трет-бутилового эфира 4-бензилпиперазин-1-карбоновой кислоты (2 г) в диэтиловом эфире (35 мл) добавляют тетраметилендиамин (1,4 мл). Полученную в результате смесь охлаждают до -70°С и по каплям добавляют втор-бутиллитий (7 мл 1,3 M раствора), после окончания добавления раствор медленно нагревают до -10°С, и при этой температуре смесь перемешивают в течение одного часа. Последовательно смесь повторно охлаждают до -70°С; далее по каплям добавляют раствор 2-(бромметил)нафталина (2 г) в диэтиловом эфире и продолжают перемешивание при -70°С в течение одного часа. Полученную в результате смесь перемешивают и доводят до комнатной температуры в течение ночи, далее распределяют между насыщенным хлоридом аммония (водный) и этилацетатом. Органический слой сушат над сульфатом магния, отфильтровывают и концентрируют в вакууме. Остаток очищают флэш-хроматографией (SiO2, CH2Cl2/MeOH 99/1) c получением трет-бутилового эфира 4-бензил-2-(нафталин-2-илметил)пиперазин-1-карбоновой кислоты в виде масла. 0,8 г (27%) Rf 0,47 (CH2Cl2/MeOH 99/1), MH+ 417.
Следующие соединения получают в соответствии с аналогичной методикой:
трет-бутиловый эфир 2-(7-аза-1-(толуол-4-сульфонил)-1Н-индол-3-илметил)-4-бензилпиперазин-1-карбоновой кислоты; Rf 0,28 (CH2Cl2/MeOH 99/1);
трет-бутиловый эфир 2,4-дибензилпиперазин-1-карбоновой кислоты; MH+ 367, Rf 0,84 (CH2Cl2/MeOH/NH4OH 93/7/0,5);
трет-бутиловый эфир 4-бензил-2-(1-(толуол-4-сульфонил)-1Н-индол-2-илметил)пиперазин-1-карбоновой кислоты; MH+ 560, Rf 0,70 (CH2Cl2/MeOH 95/5);
трет-бутиловый эфир 4-бензил-2-(4-хлорбензил)пиперазин-1-карбоновой кислоты; MH+ 401, Rf 0,26 (CH2Cl2/MeOH 99/1);
трет-бутиловый эфир 4-бензил-2-(3,4-дихлорбензил)пиперазин-1-карбоновой кислоты; Rf 0,77 (CH2Cl2/MeOH/NH4OH 93/7/0,5);
трет-бутиловый эфир 2-(бензо[b]тиофен-3-илметил)-4-бензилпиперазин-1-карбоновой кислоты; MH+ 423, Rf 0,30 (CH2Cl2/MeOH 99/1);
трет-бутиловый эфир 3-(4-бензил-1-трет-бутоксикарбонилпиперазин-2-илметил)индазол-1-карбоновой кислоты; MH+ 507;
трет-бутиловый эфир 2-(бензофуран-2-илметил)-4-бензилпиперазин-1-карбоновой кислоты; MH+ 407, Rf 0,33 (CH2Cl2/MeOH 99/1).
Пример 15
Получение промежуточных соединений формулы (10)
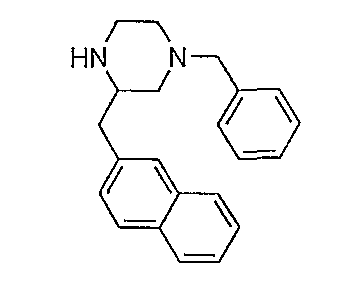
К раствору трет-бутилового эфира 4-бензил-2-(нафталин-2-илметил)пиперазин-1-карбоновой кислоты (0,75 г) в дихлорметане (3 мл) по каплям добавляют трифторуксусную кислоту (3 мл). После 75 минут при комнатной температуре смесь выливают на лед и подщелачивают добавлением гидроксида аммония (25% раствор). Слои разделяют и водный слой экстрагируют дихлорметаном. Объединенные органические слои сушат над сульфатом магния, отфильтровывают и концентрируют в вакууме с получением 1-бензил-3-(нафталин-2-илметил)пиперазина в виде масла; 0,53 г (93%) МН+ 317, Rf 0,61 (CH2Cl2/MeOH/NH4OH 93/7/0,5), который используют как таковой.
Следующие соединения получают в соответствии с аналогичной методикой:
3-(7-аза-1-(толуол-4-сульфонил)-1Н-индол-3-илметил)-1-бензилпиперазин; Rf 0,13 (CH2Cl2/MeOH 95/5).
1,3-дибензилпиперазин пиперазин; МН+ 267, Rf 0,19 (CH2Cl2/MeOH/NH4OH 93/7/0,5).
1-бензил-3-(1-(толуол-4-сульфонил)-1Н-индол-2-илметил)пиперазин; МН+ 460, Rf 0,56 (CH2Cl2/MeOH/NH4OH 93/7/0,5).
1-бензил-3-(4-хлорбензил)пиперазин; МН+ 301, Rf 0,26 (CH2Cl2/MeOH/NH4OH 95/4,5/0,5).
1-бензил-3-(3,4-дихлорбензил)пиперазин; МН+ 335, Rf 0,35 (CH2Cl2/MeOH/NH4OH 93/7/0,5).
3-(бензо[b]тиофен-3-илметил)-1-бензилпиперазин; МН+ 323, Rf 0,35 (CH2Cl2/MeOH/NH4OH 95/4,5/0,5).
1-бензил-3-(1Н-индазол-3-илметил)пиперазин; МН+ 307, Rf 0,10 (CH2Cl2/MeOH 9/1).
3-(бензофуран-2-илметил)-1-бензилпиперазин; МН+ 307, Rf 0,26 (CH2Cl2/MeOH/NH4OH 93/7/0,5).
Пример 16
К раствору 3-(7-аза-1-(толуол-4-сульфонил)-1Н-индол-3-илметил)-1-бензилпиперазина (0,65 г) в метаноле (28 мл) добавляют 3М водный гидроксид натрия (5,6 мл) и полученную в результате смесь нагревают 90 мин при 60°С. После охлаждения до комнатной температуры большую часть метанола удаляют в вакууме и остаток экстрагируют дихлорметаном. Органический слой сушат над сульфатом магния, отфильтровывают, концентрируют в вакууме и остаток очищают флэш-хроматографией (SiO2, CH2Cl2/MeOH/NH4OH 85/15/1) c получением 3-(7-аза-1Н-индол-3-илметил)-1-бензилпиперазина (0,3 г); MH+ 307, Rf 0,51 (CH2Cl2/MeOH/NH4OH 85/15/1).
Следующее соединение получают в соответствии с аналогичной методикой:
1-бензил-3-(1Н-индол-2-илметил)пиперазин); МН+ 306, Rf 0,32 (CH2Cl2/MeOH/NH4OH 93/7/0,5).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ДИАЗАБИЦИКЛИЧЕСКИХ АЛКАНОВ С NK-АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2310656C2 |
| ПРОИЗВОДНЫЕ ГЕКСА- И ОКТАГИДРОПИРИДО[1,2-а]ПИРАЗИНА С NK-АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ | 2004 |
|
RU2349591C2 |
| ЗАМЕЩЕННЫЕ ПИРАЗОЛЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ КАТЕПСИНА S | 2001 |
|
RU2278863C2 |
| ПРОИЗВОДНЫЕ АРОИЛПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2258702C2 |
| ПРОИЗВОДНЫЕ N-ТРИАЗОЛИЛМЕТИЛПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО, ПРОИЗВОДНЫЕ ПИПЕРАЗИНА | 2001 |
|
RU2288918C2 |
| СЕЛЕКТИВНЫЕ К BCL-2 АГЕНТЫ, ВЫЗЫВАЮЩИЕ АПОПТОЗ, ДЛЯ ЛЕЧЕНИЯ РАКА И ИММУННЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2621052C2 |
| АПОПТОЗ-ИНДУЦИРУЮЩИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ РАКА И ИММУННЫХ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2527450C2 |
| BCL-2-СЕЛЕКТИВНЫЕ АПОПТОЗ-ИНДУЦИРУЮЩИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ РАКА И ИММУННЫХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2542994C2 |
| ИНДОЛЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ 5-HT | 2007 |
|
RU2449990C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2556984C2 |
Настоящее изобретение относится к производным оксима пиперазина общей формулы I
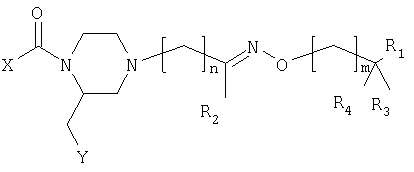
в которой Х - фенил или пиридил, замещенный 1 или 2 заместителями;
- Y - 2- или 3-индолил, фенил, 7-аза-индол-3-ил, 3-индазолил, 2-нафтил, 3-бензо[b]тиофенил или 2-бензофуранил, которые могут быть замещены;
n=0-3; m=0-2;
- R1 - NH2, морфолино, тиоморфолино, 2-, 3- или 4-пиридил или 4-СН3-пиперазинил.
Соединения обладают антагонистической активностью по отношению к рецептору нейрокинина и могут быть использованы для лечения состояний тревоги. Описана также фармацевтическая композиция на основе соединений формулы I, способ ее получения и применения. 5 н. и 2 з.п. ф-лы.
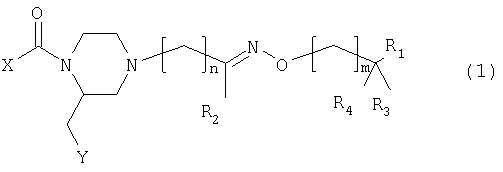
где
X представляет фенил или пиридил, замещенный 1 или 2 заместителями из группы СН3, CF3, ОСН3, галоген, циано и 5-CF3-тетразол-1-ил,
Y представляет 2- или 3-индолил, фенил, 7-аза-индол-3-ил или 3-индазолил, 2-нафтил, 3-бензо[b]тиофенил или 2-бензофуранил, которые могут быть замещены одним или более галогенами или алкилами(1-3С),
n имеет значение 0-3,
m имеет значение 0-2,
R1 представляет NH2, NH-алкил(1-3С), диалкил(1-3C)N, морфолино или морфолино, замещенный одной или двумя метильными и/или метоксиметильными группами, тиоморфолино, 1,1-диоксотиоморфолино, 2-, 3- или 4-пиридил или 4-СН3-пиперазинил,
R2 является водородом, алкилом(1-4С) или фенилом или R2 вместе с (CH2)m, где m равно 1, и промежуточными атомами углерода, азота и кислорода образует изоксазолильную или 4,5-дигидроизоксазолильную группу,
R3 и R4 независимо представляют водород или метил или R3 и R4 вместе являются кислородом,
и их физиологически приемлемые соли.
| Установка для футеровки сталеразливочных ковшей | 1979 |
|
SU899270A1 |
| US 6001833 А, 14.12.1999. | |||
Авторы
Даты
2006-04-10—Публикация
2002-07-03—Подача