ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В этой заявке на патент заявляется приоритет к Предварительной заявке на патент Соединенных штатов Америки № 61/155119, поданной 24 февраля 2009, и предварительной заявке на патент Соединенных штатов Америки № 61/156398, поданной 27 февраля 2009. Содержание этих заявок полностью включено в настоящий документ в качестве ссылки.
ЗАЯВЛЕНИЕ ОТНОСИТЕЛЬНО СПОНСИРОВАННЫХ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИЙ ИЛИ РАЗРАБОТОК
Не применяется.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Представлены три специфических соединения диарилгидантоина и два специфических соединения диарилтиогидантоина, и фармацевтические композиции и другие формы, содержащие эти специфические соединения. Также представлены способы профилактики и/или лечения состояний у млекопитающих, таких как болезнь Паркинсона, болезнь Альцгеймера и рак простаты.
УРОВЕНЬ ТЕХНИКИ
Соединения диарилгидантоина, включая соединения диарилтиогидантоина, описаны в публикациях США №№ 2007/0004753, 2007/0254933 и 2009/0111864. Тем не менее, остается необходимость в новых методах терапии различных заболеваний, включая рак простаты. Новые методы терапии болезни Паркинсона и болезни Альцгеймера также ищутся.
(MI)-(MV), как подробно описано в настоящем описании, являются метаболитами RD162', описанного в публикации США № 2007/0004753, и могут найти применение в терапии.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Описаны соединения (MI)-(MV). Формула (I), представленная в настоящем описании, описывает и предназначена для формулы (MI)-(MV). Соединение (MI) действует через транспортер норэпинефрина. Модуляторы транспортера норэпинефрина применяют в терапии для лечения депрессии, болезни Альцгеймера, расстройств дефицита внимания и болезни Паркинсона. Соединение (MII) действует через рецептор прогестерона. Модуляторы рецептора прогестерона применяют в терапии заболеваний, в которые вовлечен прогестерон. Модуляторы рецептора прогестерона потенциально могут применяться для контроля рождаемости, либо для предотвращения беременности, либо для прерывания беременности. Соединение (MIV) действует на сигма-рецептор. Модуляторы сигма-рецептора применяют в терапии для лечения депрессии. Соединения (MI)-(MV) являются метаболитами соединения RD162'. RD162' применяют для лечения рака простаты.
Также описаны способы и композиции. В одном варианте, способ включает введение соединения формулы (MI), (MII), (MIII), (MIV) или (MV) индивидууму в количестве, эффективном для модулирования рецептора, такого как рецепторы, перечисленные в таблицах 5 и 9. Также подробно описаны способы выделения соединения формулы (MI), (MII), (MIII), (MIV) или (MV). Также представлены способы применения соединения формулы (MI), (MII), (MIII), (MIV) или (MV) в терапии. В одном аспекте, терапия представляет собой лечение болезни Паркинсона, болезни Альцгеймера или рака простаты. Также представлены фармацевтические композиции, содержащие соединение формулы (MI), (MII), (MIII), (MIV) или (MV) и фармацевтически приемлемый носитель в виде выделенной и/или очищенной форм соединения формулы (MI), (MII), (MIII), (MIV) или (MV). Также описаны единичные лекарственные формы соединения формулы (MI), (MII), (MIII), (MIV) или (MV).
Следовательно, в одном аспекте представлены соединения формулы (I):
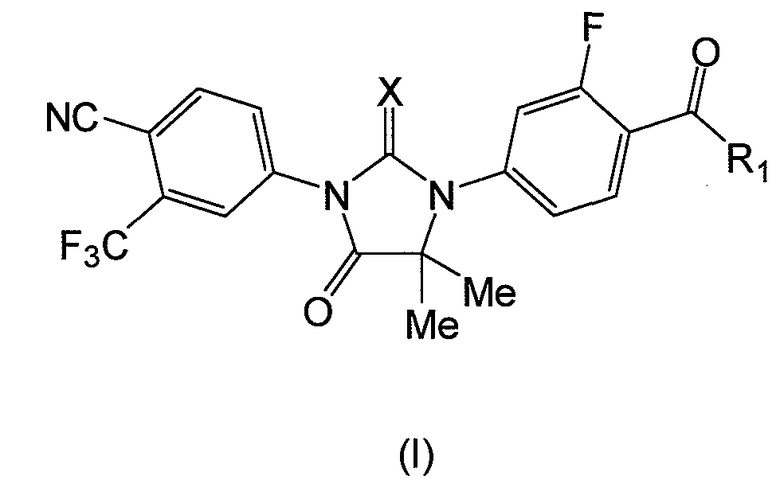
где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe,
или его фармацевтически приемлемая соль или сольват.
Таким образом, описаны соединения формул (MI), (MII), (MIII), (MIV) и (MV):
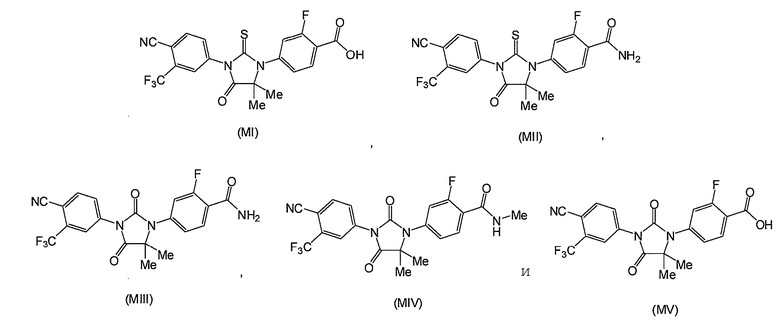
Понятно, что также представлены соли соединений, такие как фармацевтически приемлемые соли.
Соединения формулы (I) идентифицированы как метаболиты соединения RD162', которое применяется в лечении рака простаты и описано в публикации заявки США № 2007/0004753. Как описано в примерах ниже, RD162' и его метаболиты выделяют вызванным ацетонитрилом белковым осаждением 100 мкл плазмы. Метаболиты идентифицированы сканированием времени прохождения для положительных ионов от 55 до 800 а.е.м. Конкретная молекула идентифицирована как потенциальный метаболит RD162', если ее фрагментация дает подвиды, имеющие схему, соответствующую исходному RD162'. Пять предполагаемых метаболитов присутствуют в плазме крыс, собак и/или человека: (MI), (MII), (MIII), (MIV) и (MV). Структуры метаболитов были установлены анализом масс-спектра, и затем были синтезированы предполагаемые метаболиты. Молекулярную структуру метаболитов подтвердили через совместное элюирование ЖХ/МС/МС, при котором синтезированные молекулы непосредственно сравнивали со структурами, выделенными из образцов плазмы крысы, собаки и человека.
Соединения формулы (I) также применяются в терапии, например, для лечения рака простаты или для лечения других показаний, соответствующих активности таких соединений, такой как рецептор-связывающая активность, подробно описанная ниже.
В одном варианте, по отношению к соединениям формулы (I) (т.е. соединениям (MI)-(MV)), соединения представлены в по существу чистой форме.
В одном аспекте представлены композиции, содержащие соединения, где композиции не содержат кровь или другие жидкости организма.
В другом аспекте представлены фармацевтические композиции, содержащие соединение формулы (I), и фармацевтически приемлемый носитель. Фармацевтическая композиция может содержать одно или более из описанных в настоящем описании соединений, или их соли или сольваты.
В другом аспекте представлены способы профилактики или лечения состояния из перечисленных в настоящем описании и особенно такого состояния, которое может быть связано с, например, депрессией, дисфункцией памяти, такой как болезнь Альцгеймера и болезнь Паркинсона, и раком простаты, где способ включает введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I), или его соли или сольвата, или содержащей его фармацевтической композиции.
Данное изобретение также включает применение любого из соединений в соответствии с данным изобретением для получения лекарственных средств, которые могут вводиться для терапии, такой как лечение показаний, описанных в настоящем описании, включая рак простаты.
В дополнительных аспектах представлены способы синтеза соединений, описанных в настоящем описании, с соответствующими протоколами и путями синтеза, которые описаны ниже.
Представлена фармацевтическая композиция, содержащая (a) соединение формулы (I):

где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемую соль или сольват, и (b) фармацевтически приемлемый носитель. В одном аспекте формулы (I), X является S, и R1 является OH или NH2. В другом аспекте формулы (I), X является O, и R1 является OH, NH2 или NHMe. В конкретном варианте формулы (I) соединение имеет формулу (MI):
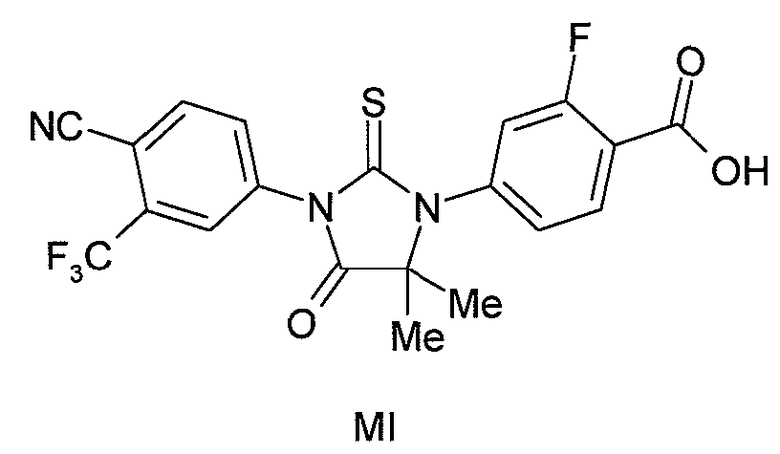
или его фармацевтически приемлемая соль или сольват. В другом варианте формулы (I), соединение имеет формулу (MII):
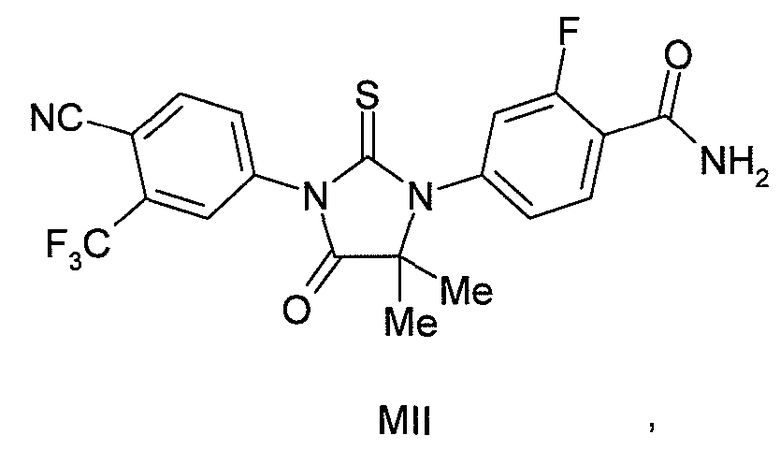
или его фармацевтически приемлемая соль или сольват. В другом варианте формулы (I), соединение имеет формулу (MIII):
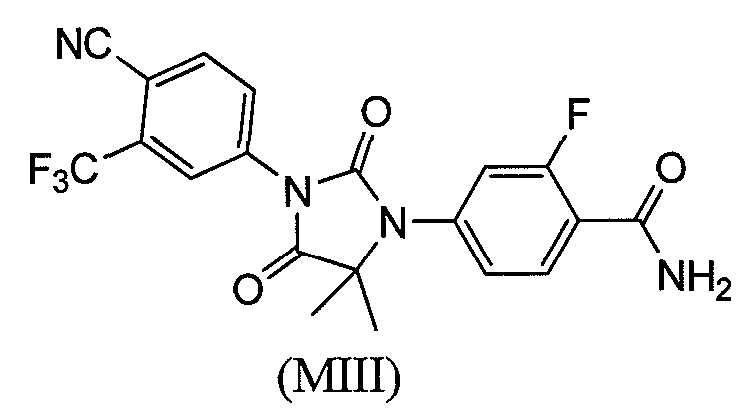
или его фармацевтически приемлемая соль или сольват. В еще одном варианте формулы (I), соединение имеет формулу (MIV):
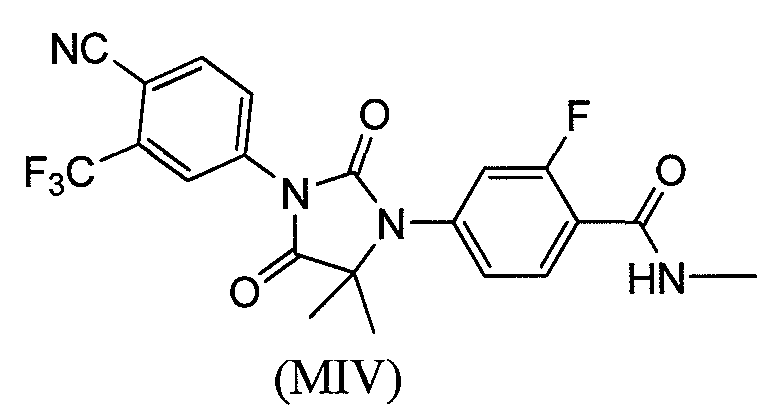
или его фармацевтически приемлемая соль или сольват. В еще одном варианте формулы (I), соединение имеет формулу (MV):
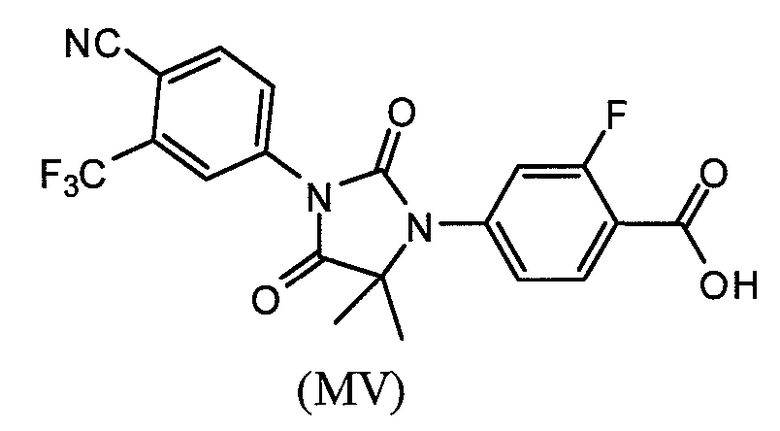
или его фармацевтически приемлемая соль или сольват.
Также представлена композиция по существу чистого соединения, где соединение имеет формулу I:

где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемая соль или сольват. В одном аспекте формулы (I), X является S, и R1 является OH или NH2. В другом аспекте формулы (I), X является O, и R1 является OH, NH2 или NHMe. В конкретном варианте формулы (I), соединение имеет формулу (MI):
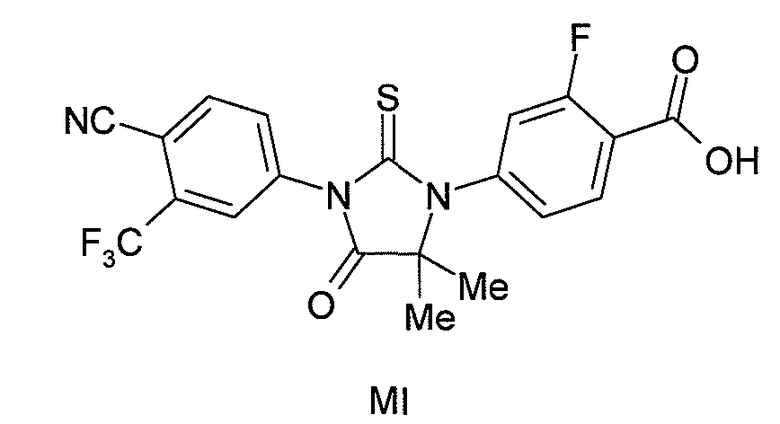
или его фармацевтически приемлемая соль или сольват. В другом варианте формулы (I), соединение имеет формулу (MII):

или его фармацевтически приемлемая соль или сольват. В другом варианте формулы (I), соединение имеет формулу (MIII):
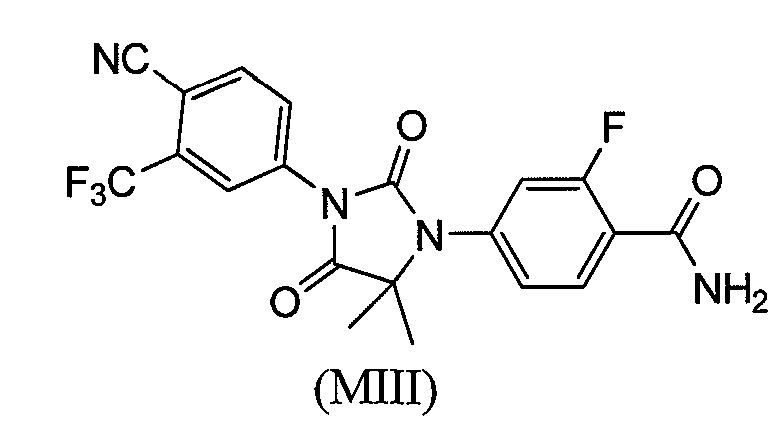
или его фармацевтически приемлемая соль или сольват. В еще одном варианте формулы (I), соединение имеет формулу (MIV):
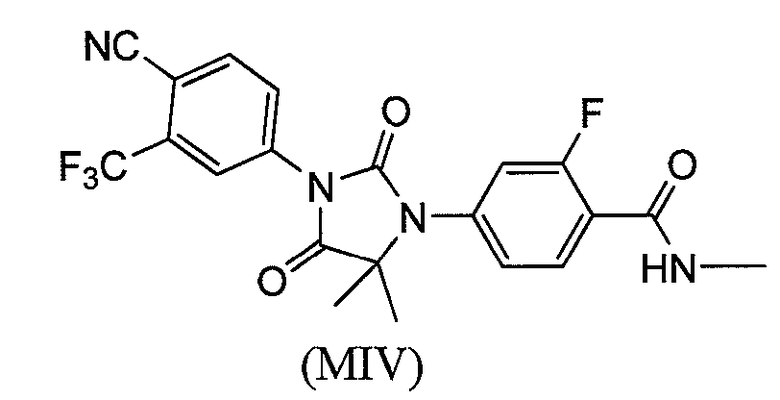
или его фармацевтически приемлемая соль или сольват. В еще одном варианте формулы (I), соединение имеет формулу (MV):
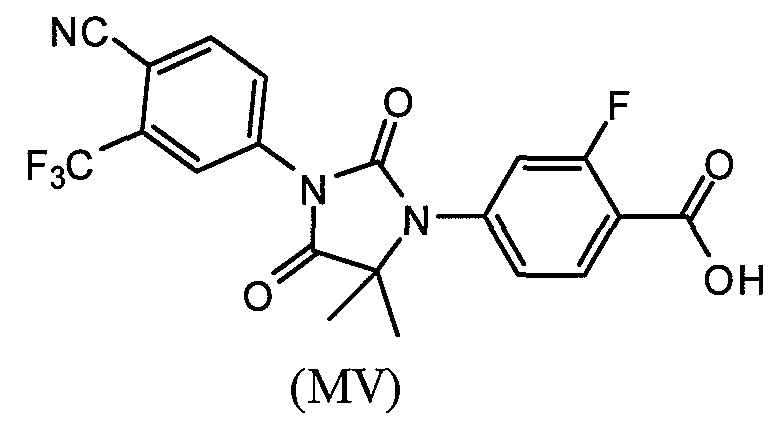
или его фармацевтически приемлемая соль или сольват. Также представлена композиция любого из представленных выше вариантов и вариаций, где композиция содержит менее приблизительно 10 массовых процентов примесей.
В данном изобретении также представлен способ введения соединения формулы (I):
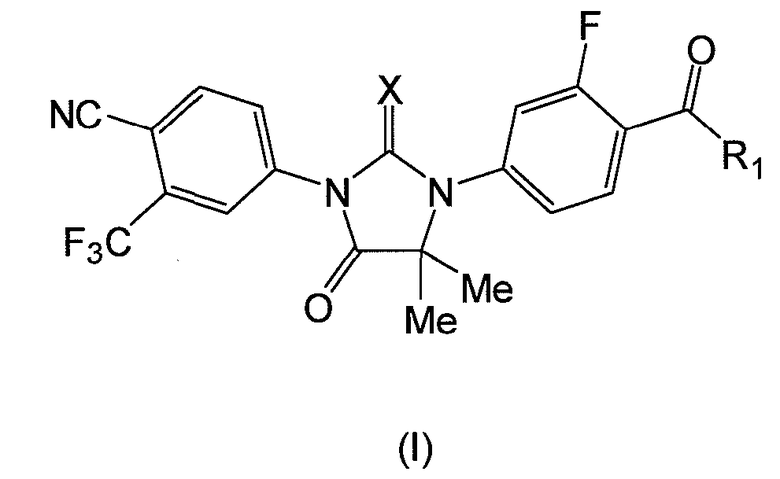
где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемой соли или сольвата, индивидууму для терапии. В одном аспекте формулы (I), X является S, и R1 является OH или NH2. В другом аспекте формулы (I), X является O, и R1 является OH, NH2 или NHMe. В конкретном варианте, терапией является лечение рака простаты. В другом варианте, терапией является лечение болезни Паркинсона или болезни Альцгеймера.
Также представлен набор, содержащий соединение формулы (I):
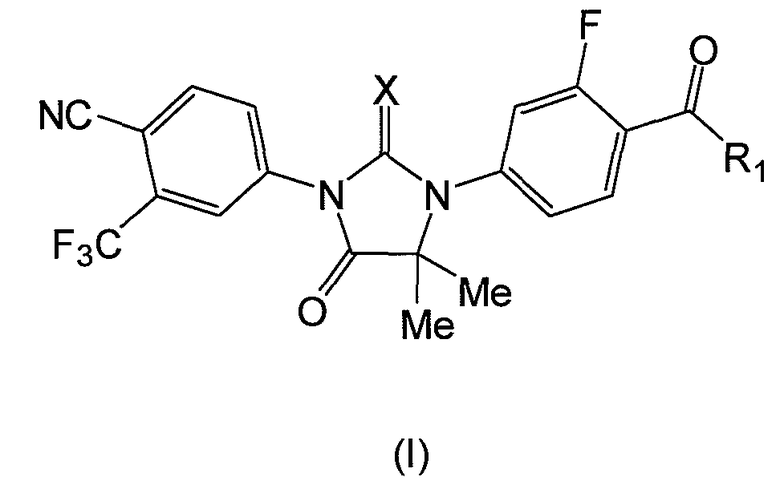
где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемую соль или сольват. В конкретном варианте, X является S, и R1 является OH или NH2. В другом аспекте формулы (I), X является O, и R1 является OH, NH2 или NHMe. В одном варианте набор также содержит инструкции по применению, которые в одном варианте являются инструкциями по применению соединения для лечения рака простаты, или инструкции по применению соединения для лечения болезни Паркинсона или болезни Альцгеймера.
Также представлена единичная лекарственная форма, содержащая соединение формулы (I):
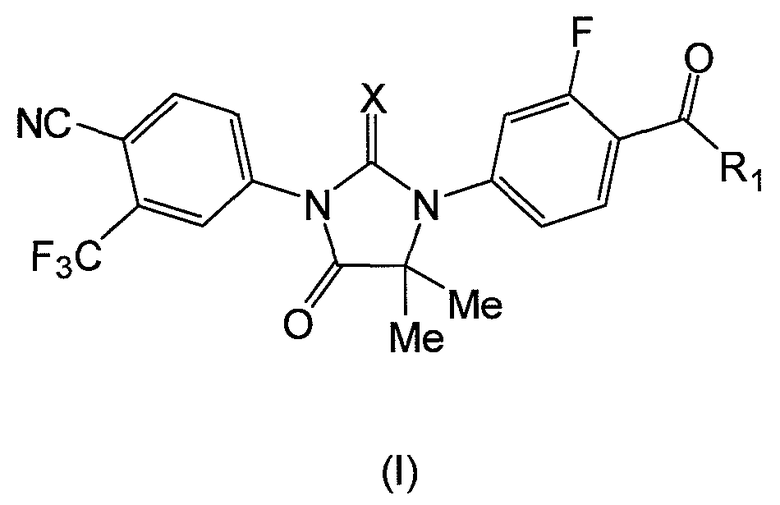
где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемую соль или сольват. В одном варианте, X является S, и R1 является OH или NH2. В другом аспекте формулы (I), X является O, и R1 является OH, NH2 или NHMe.
Также представлено выделенное соединение формулы (I):

где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемую соль или сольват. В одном варианте, X является S, и R1 является OH или NH2. В другом аспекте, X является O, и R1 является OH, NH2 или NHMe.
Другие объекты и преимущества станут очевидны специалисту в данной области техники при прочтении подробного описания.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Определения
Термин "приблизительно" в отношении значения или параметра включает (и описывает) варианты, которые связаны с самим этим значением или параметром. Например, описание, относящееся к "приблизительно X", включает описание самого "X".
В настоящем описании под "фармацевтически приемлемым" понимают, что вещество не является биологически или другим образом нежелательным, например, вещество может быть введено в фармацевтическую композицию, вводимую пациенту, не причиняя любых значительных нежелательных биологических эффектов или не взаимодействуя отрицательным образом с любым другим компонентом композиции, в которую оно введено. Фармацевтически приемлемые носители или эксципиенты предпочтительно отвечают требуемым стандартам токсикологического и производственного тестирования и/или включены в справочник Inactive Ingredient Guide, подготовленный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.
"Фармацевтически приемлемыми солями" являются соли, которые сохраняют, по меньшей мере, некоторую биологическую активность сводного (не соли) соединения, и которые могут вводиться в качестве лекарственных средств или фармацевтических средств индивидууму. Фармацевтически приемлемая соль подразумевает ионное взаимодействие и не содержит ковалентной связи. Такие соли, например, включают: (1) кислотно-аддитивные соли, полученные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные; или полученные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, пропионовая кислота, янтарная кислота, малеиновая кислота, винная кислота и подобные; (2) соли, полученные, если кислотный протон, содержащийся в исходном соединении, либо замещен ионом металла, например ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; либо координируется с органическим основанием. Приемлемые органические основания включают этаноламин, диэтаноламин, триэтаноламин и подобные. Приемлемые неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия, гидроксид натрия и подобные. Другие примеры фармацевтически приемлемых солей включают соли, перечисленные у Berge et al. Pharmaceutical Salts, J Pharm. Sci. 1977 Jan; 66(1): 1-19. Фармацевтически приемлемые соли могут быть получены in situ в процессе производства, или отдельным взаимодействием очищенного соединения в соответствии с данным изобретением в форме свободной кислоты или основания с подходящим органическим или неорганическим основанием или кислотой, соответственно, и выделением полученной соли во время последующей очистки. Должно быть понятно, что ссылка на фармацевтически приемлемую соль включает аддитивные формы в растворителе или кристаллические формы, особенно сольваты или полиморфы. Сольваты содержат либо стехиометрические, либо не стехиометрические количества растворителя, и часто образуются во время процесса кристаллизации. Гидраты получают, если растворителем является вода, или алкоголяты получают, когда растворителем является спирт. Полиморфы включают различное расположение упаковки кристаллов в одной элементной композиции соединения. Полиморфы обычно имеют различные дифракционные рентгенограммы, инфракрасные спектры, температуры плавления, плотность, твердость, кристаллическую форму, оптические и электрические свойства, стабильность и растворимость. Различные факторы, такие как растворитель перекристаллизации, скорость кристаллизации и температура хранения, могут вызывать доминирование единственной кристаллической формы.
Термин "эксципиент" применяют взаимозависимо с "носителем", и он подразумевает инертное или неактивное вещество, которое может применяться при производстве лекарственного или фармацевтического средства, такого как таблетки, содержащие соединение в соответствии с данным изобретением в качестве активного ингредиента. Различные вещества могут быть охвачены термином "эксципиент", включая, без ограничений, любое вещество, применяемое в качестве связующего агента, разрыхлителя, покрытия, добавки для прессования/инкапсулирования, крема или лосьона, смазывающего агента, растворов для парентерального введения, материалов для жевательных таблеток, подсластителей или вкусовых добавок, суспендирующего/желирующего агента, или агента для влажного гранулирования. Связующие агенты включают, например, карбомеры, повидон, ксантановую камедь и т.д.; покрытия включают, например, фталат ацетата целлюлозы, этилцеллюлозу, геллановую камедь, мальтодекстрин, энтеросолюбильные покрытия и т.д.; добавки для прессования/инкапсулирования включают, например, карбонат кальция, декстрозу, фруктозу пп (пп = "прямого прессования"), мед пп, лактозу (ангидрат или моногидрат; необязательно в сочетании с аспартамом, целлюлозой или микрокристаллической целлюлозой), крахмал пп, сахарозу и т.д.; разрыхлители включают, например, кроскармеллозу натрия, геллановвую камедь, гликолят крахмала натрия и т.д.; кремы или лосьоны включают, например, мальтодекстрин, каррагенаны и т.д.; смазывающие агенты включают, например, стеарат магния, стеариновую кислоту, стеарилфумарат натрия и т.д.; вещества для жевательных таблеток включают, например, декстрозу, фруктозу пп, лактозу (моногидрат, необязательно в сочетании с аспартамом или целлюлозой) и т.д.; суспендирующие/желирующие агенты включают, например, каррагинан, гликолят крахмала натрия, ксантановую камедь и т.д.; подсластители включают, например, аспартам, декстрозу, фруктозу пп, сорбит, сахарозу пп и т.д.; и агенты для влажного гранулирования включают, например, карбонат кальция, мальтодекстрин, микрокристаллическую целлюлозу и т.д.
Если четко не указано иначе, термин "индивидуум" означает млекопитающее, включает, но не ограничивается ими, человека, корову, примата, лошадь, собаку, кошку, свинью и овцу. Таким образом, данное изобретение может применяться в медицине и ветеринарии, включая применение у сельскохозяйственных животных и домашних животных.
Термин "эффективное количество" или "терапевтически эффективное количество" означает такое количество соединения, которое будет эффективным в данной терапевтической форме. Как известно в данной области техники, эффективное количество может быть в одной или нескольких дозах, например однократная дозе или многократные дозы могут потребоваться для достижения желаемого итога лечения. Стандартные способы могут применяться для измерения величины этого эффекта, такие как анализы in vitro с очищенным ферментом, анализы на основе клеток, животные модели или тестирование на человеке.
В данном описании "лечение" или "лечить" представляет собой подход к получению благоприятного или желаемого результата, включая клинические результаты. Для целей данного изобретения благоприятный или желаемый клинический эффект включает, но не ограничивается ими, облегчение симптома и/или уменьшение силы симптома и/или профилактику ухудшения симптома, связанного с заболеванием или состоянием.
В данном описании соединение, которое является "модулятором" рецептора, означает и включает соединение, которое связывается или ингибирует связывание лиганда с рецептором, или снижает, или исключает, или повышает, или имитирует активность рецептора. Как таковой "модулятор рецептора" охватывает антагонист рецептора и агонист рецептора.
В данном описании "единичная лекарственная форма" относится к физически отдельным единицам, подходящим в качестве лекарственных форм, где каждая единица содержит предопределенное количество активного ингредиента, рассчитанное для получения желаемого терапевтического эффекта в сочетании с требуемым фармацевтическим носителем.
Под композицией "по существу чистого" соединения подразумевается, что композиция содержит менее приблизительно 35%, или менее приблизительно 20%, или менее приблизительно 15% или, предпочтительно, менее приблизительно 10%, или более предпочтительно менее приблизительно 5%, или даже более предпочтительно менее приблизительно 3% и наиболее предпочтительно менее приблизительно 1% примесей.
Понятно, что если соединение описано с применением термина "включая", он также включает другие аналогичные варианты, описанные терминами "содержащее" и/или "по существу содержащее".
Соединения и композиции
В определенных аспектах в настоящем описании представлены соединения и композиции, содержащие такие соединения, например, в качестве фармацевтических композиций. Соединения и композиции могут применяться в терапии, например, для лечения рака простаты, болезни Паркинсона или болезни Альцгеймера. Также представлены композиции по существу чистых соединений в виде выделенных и синтетических соединений. Также представлены единичные лекарственные формы соединений.
Способы выделения соединения формулы (MI), (MII), (MIII), (MIV) и/или (MV) подробно представлены ниже, например способ выделения соединений из крови или другой жидкости организма. Также описаны фармацевтические композиции, содержащие соединение формулы (MI), (MII), (MIII), (MIV) или (MV) и фармацевтически приемлемый носитель, в виде выделенной и/или очищенной форм соединения формулы (MI), (MII), (MIII), (MIV) или (MV).
В одном аспекте данного изобретения описаны формулы (MI), (MII), (MIII) и (MIV) и их соли. Также представлено соединение формулы (MV). Соединение формулы (MI), (MII), (MIII) или (MIV) может быть в выделенной форме, и также описаны композиции, содержащие выделенные формы. Также представлены выделенные формы соединения (MV). Соединение формулы (MI), (MII), (MIII) или (MIV) может быть в очищенной форме, и в настоящем описании также описаны композиции, содержащие соединение в очищенной форме. Также представлены очищенные формы соединения (MV) и композиции, содержащие (MV) в очищенной форме.
В одном аспекте представлена композиция, содержащая соединение формулы (I), где композиция не содержит кровь или другую жидкость организма. В одном аспекте представлена композиция, содержащая очищенную форму соединения формулы (I). Такая композиция может содержать другие компоненты, такие как фармацевтически приемлемый носитель. В другом аспекте представлена композиция, содержащая по существу чистую форму соединения формулы (I), где композиция содержит менее приблизительно 15%, 10%, 5%, 3% и 1% примесей, где примесью может быть, например, соединение, не принадлежащее к формуле (I), или кровь или другая жидкость организма. В одном аспекте композиция по существу чистого соединения содержит только одно из (MI), (MII), (MIII), (MIV) и (MV).
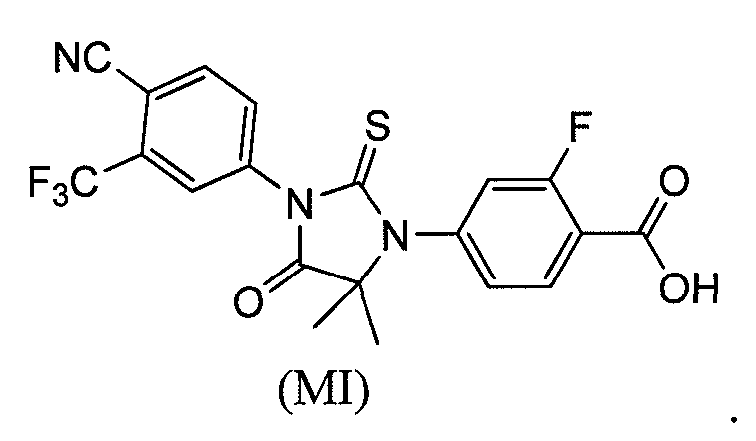
Соединение (MI) имеет формулу:
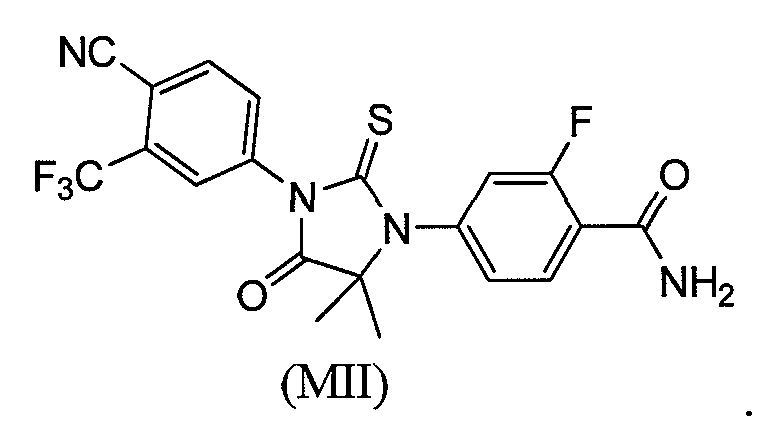
Соединение (MII) имеет формулу:
Соединение (MIII) имеет формулу:
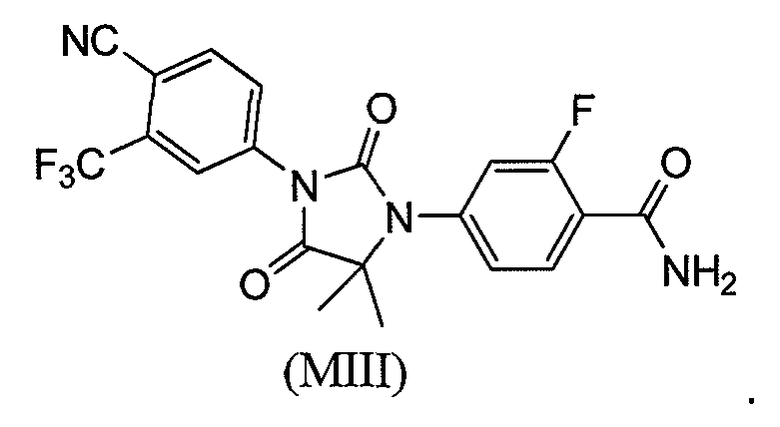
Соединение (MIV) имеет формулу:
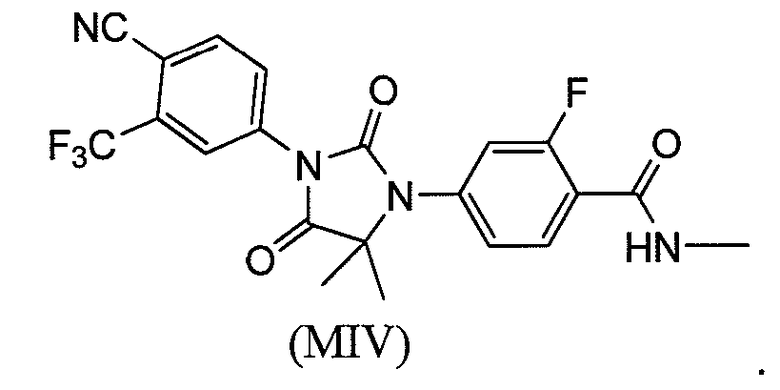
Соединения (MI)-(MIV) могут присутствовать в виде солей, таких как фармацевтически приемлемые соли.
Соединение (MV) имеет формулу:
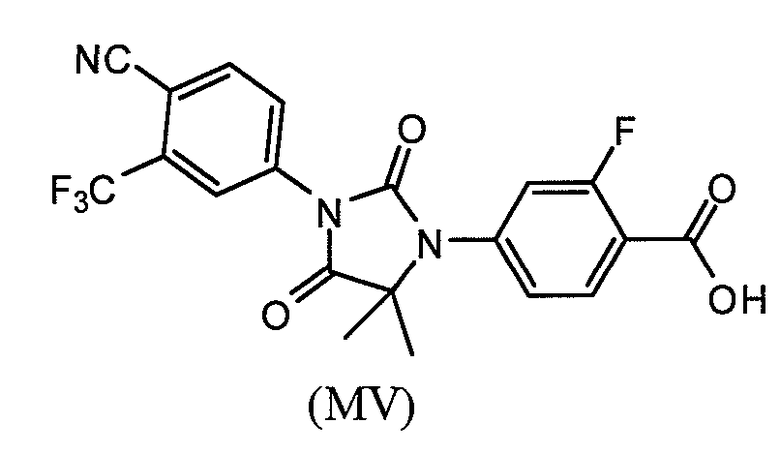
и может также присутствовать в виде соли, такой как фармацевтически приемлемая соль.
В другом аспекте данного изобретения представлено соединение формулы (I):
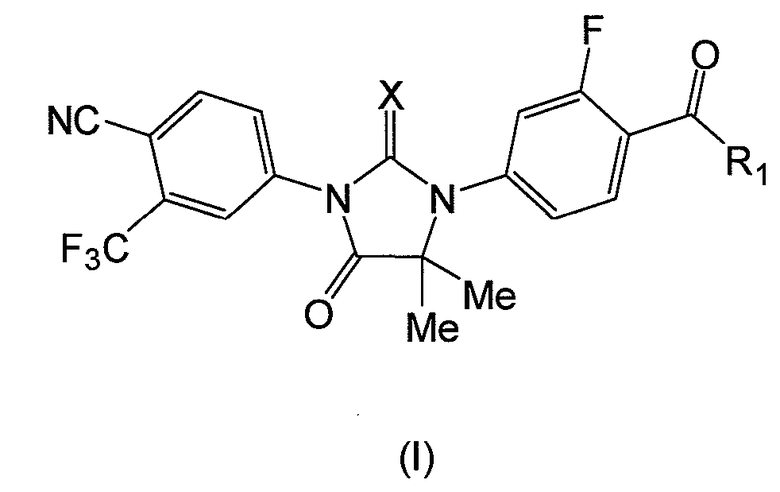
где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемая соль или сольват.
Таким образом, представлены соединения формул (MI), (MII), (MIII), (MIV) и (MV):
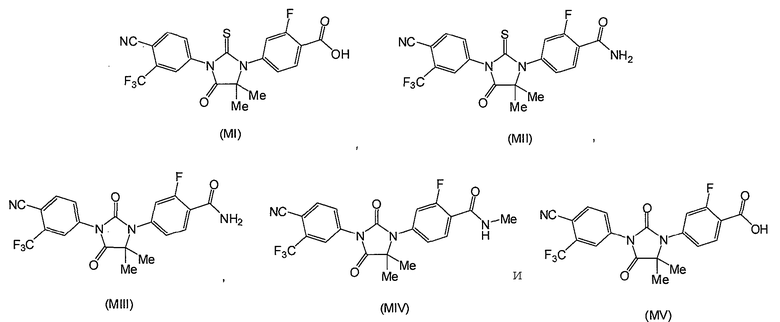
которые могут применяться в композициях и способах, описанных в настоящем описании.
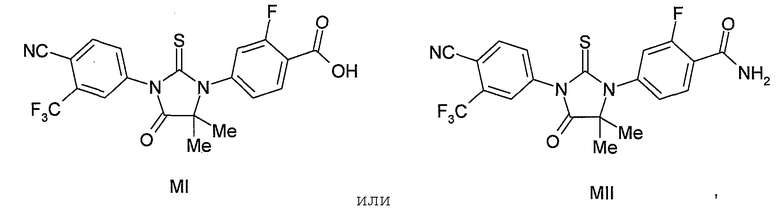
В одном варианте для соединений формулы (I), X является S, и R1 является OH или NH2. Таким образом, в одном варианте соединения формулы (I) имеют формулы (MI) или (MII):
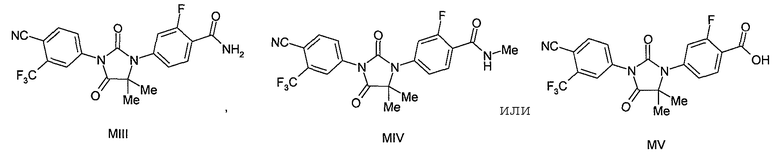
В одном варианте для соединений формулы (I), X является O, и R1 является OH, NH2 или NHMe. Таким образом, в одном варианте соединения формулы (I) имеют формулы (MIII), (MIV) или (MV):
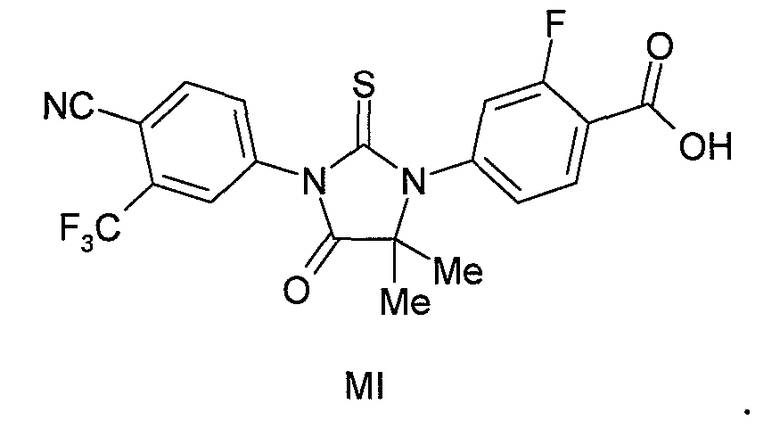
В одном конкретном варианте для соединений формулы (I), X является S, и R1 является OH. Таким образом, в одном варианте соединение формулы (I) имеет формулу (MI):
В другом конкретном варианте для соединений формулы (I), X является S, и R1 является NH2. Таким образом, в одном варианте соединение формулы (I) имеет формулу (MII):
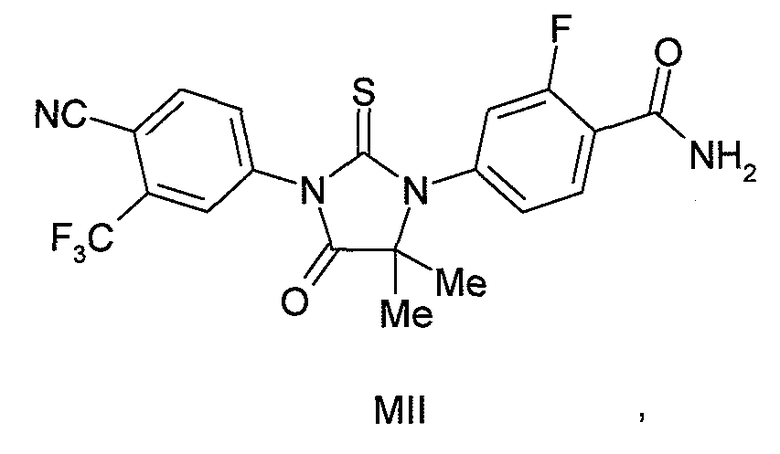
В еще одном конкретном варианте для соединений формулы (I), X является O, и R1 является NH2. Таким образом, в одном варианте соединение формулы (I) имеет формулу (MIII):
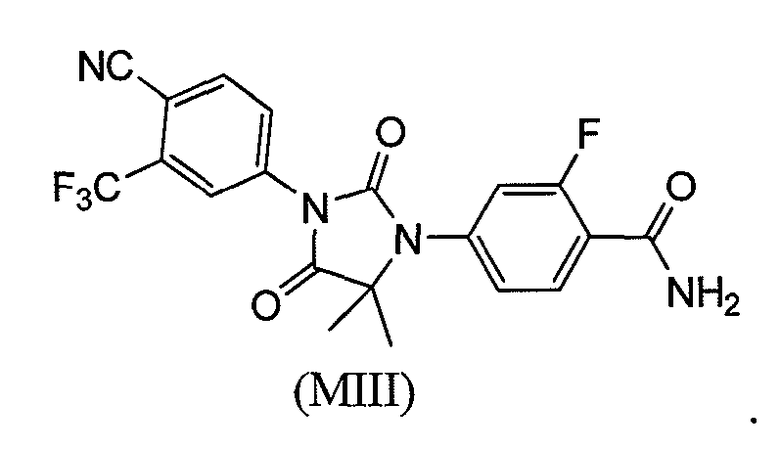
В еще одном конкретном варианте для соединений формулы (I), X является O, и R1 является NHMe. Таким образом, в одном варианте соединение формулы (I) имеет формулу (MIV):
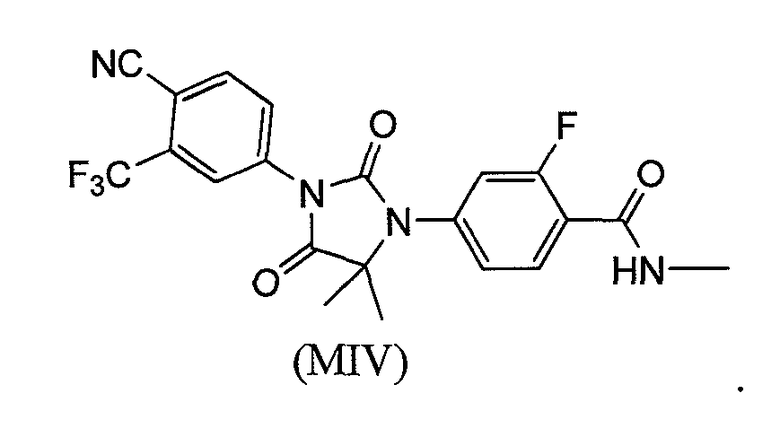
В еще одном конкретном варианте для соединений формулы (I), X является O, и R1 является OH. Таким образом, в одном варианте соединение формулы (I) имеет формулу (MV):
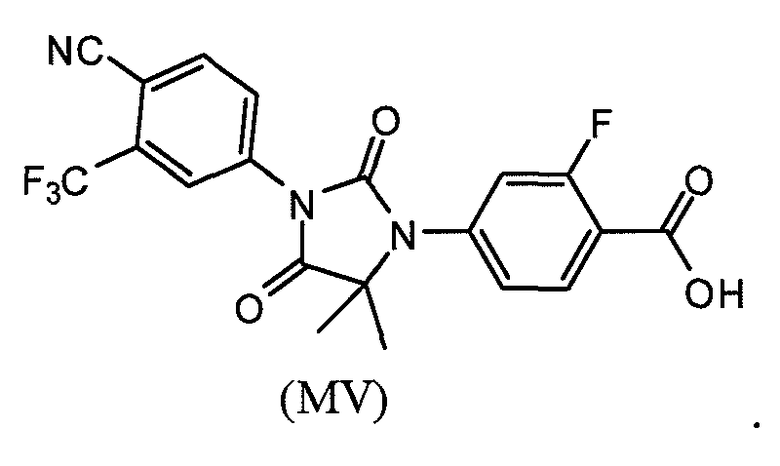
В другом аспекте данного изобретения представлена фармацевтически приемлемая соль соединения формул (MI), (MII), (MIII), (MIV) или (MV). В одном варианте, фармацевтически приемлемой солью является соединение формулы (MI) или (MII). В другом варианте фармацевтически приемлемой солью является соединение формулы (MIII), (MIV) или (MV).
Описаны соединения формул (MI), (MII), (MIII), (MIV) и (MV) и их соли. Таким образом, соединения (MI)-(MV) могут присутствовать в виде солей, таких как фармацевтически приемлемые соли. Соединение формулы (MI), (MII), (MIII), (MIV) или (MV) может быть в выделенной форме, и описаны композиции, содержащие выделенные формы. Соединение формулы (MI), (MII), (MIII), (MIV) или (MV) может быть в очищенной форме, и описаны композиции, содержащие соединение в очищенной форме.
Представлена композиция по существу чистого соединения формулы (I) или его соль. В одном аспекте композиция является по существу чистой композицией соединения (MI) или (MII). В другом аспекте описана композиция по существу чистого (MIII), (MIV) или (MV), или его соль. По существу чистые композиции в одном аспекте содержат менее приблизительно 10 массовых процентов, или 5 массовых процентов, или 1 массового процента примесей.
Таким образом, представлены композиции, содержащие соединение формулы (MI), (MII), (MIII), (MIV) или (MV) или его соль, такие как композиции по существу чистых соединений. В некоторых вариантах композиция содержит соединение формулы (MI), (MII), (MIII), (MIV) или (MV) или его соль в по существу чистой форме. В одном варианте "по существу чистая" означает композицию, которая содержит менее приблизительно 35% примесей, где примесью является соединение, отличное от соединения формулы (MI), (MII), (MIII), (MIV) или (MV) или его соли. В одном варианте представлена композиция по существу чистого соединения формулы (MI), (MII), (MIII), (MIV) или (MV) или его соли, где композиция содержит менее приблизительно 25% примесей. В другом варианте представлена композиция по существу чистого соединения формулы (MI), (MII), (MIII), (MIV) или (MV) или его соли, где композиция содержит менее приблизительно 20% примесей. В еще одном варианте представлена композиция по существу чистого соединения формулы (MI), (MII), (MIII), (MIV) или (MV) или его соли, где композиция содержит менее приблизительно 10% примесей. В еще одном варианте представлена композиция по существу чистого соединения формулы (MI), (MII), (MIII), (MIV) или (MV) или его соли, где композиция содержит менее приблизительно 5% примесей. В еще одном варианте представлена композиция по существу чистого соединения формулы (MI), (MII), (MIII), (MIV) или (MV) или его соли, где композиция содержит менее приблизительно 3% примесей. В еще одном варианте представлена композиция по существу чистого соединения формулы (MI), (MII), (MIII), (MIV) или (MV) или его соли, где композиция содержит менее приблизительно 1% примесей. В еще одном варианте представлена композиция по существу чистого соединения формулы (MI), (MII), (MIII), (MIV) или (MV) или его соли, где композиция содержит менее приблизительно 0,5% примесей. В одном аспекте % примесей означает количество примесей, определенное в массовых процентах.
Представлены фармацевтические композиции, где композиция содержит соединение формулы (MI), (MII), (MIII), (MIV) или (MV) или его соль и фармацевтически приемлемый носитель. В другом аспекте данного изобретения представлена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (MI), (MII), (MIII), (MIV) или (MV), или его фармацевтически приемлемую соль или сольват.
В одном варианте для фармацевтической композиции, носитель или эксципиент подходит для парентерального введения. В одном варианте для фармацевтической композиции, носитель подходит для перорального введения. В одном варианте для фармацевтической композиции, носитель подходит для местного введения.
В одном варианте фармацевтическая композиция содержит соединение формулы (MI) или (MII). В другом варианте фармацевтическая композиция содержит соединение формулы (MIII), (MIV) или (MV). В одном аспекте фармацевтическая композиция не содержит соединение формулы (MI) или (MII). В другом аспекте фармацевтическая композиция не содержит соединение формулы (MIII), (MIV) или (MV).
В одном варианте представлена фармацевтическая композиция по существу чистой формы соединения формул (MI) или (MII). В другом варианте представлена фармацевтическая композиция по существу чистой формы соединения формул (MIII), (MIV) или (MV).
Соединение формулы (I) может быть составлено с подходящими носителями для любого доступного способа введения, включая пероральное, слизистое (например, назальное, подъязычное, вагинальное, буккальное или ректальное), парентеральное (например, внутримышечное, подкожное или внутривенное), местное или чрескожное введение. Соединение формулы (I) может быть составлено с подходящими носителями для получения лекарственных форм, которые включают, но не ограничены ими: таблетки, каплеты, капсулы (такие как твердые желатиновые капсулы и мягкие желатиновые капсулы), саше, лепешки, пастилки, жевательные резинки, дисперсии, суппозитории, мази, катаплазмы (горячие компрессы), пасты, порошки, повязки, кремы, растворы, пластыри, аэрозоли (например, назальный спрей или ингаляторы), гели, суспензии (например, водные или неводные жидкие суспензии, эмульсии масло-в-воде или жидкие эмульсии вода-в-масле), растворы и эликсиры.
Фармацевтические композиции могут быть получены объединением соединения формулы (I) в качестве активного ингредиента с фармакологически приемлемым носителем, который известен в данной области техники. В зависимости от терапевтической формы системы (например, пероральной таблетки) носитель может быть в различных формах. Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, повторно смачивающие агенты, эмульгаторы, подсластители, красители, регуляторы, буферы, оболочки или антиоксиданты. Препараты, содержащие соединение формулы (I) в качестве активного ингредиента, также могут содержать другие вещества, которые имеют ценные терапевтические свойства. Терапевтические формы могут быть представлены в стандартной дозированной форме и могут быть получены известными фармацевтическими методами. Подходящие композиции могут быть найдены, например, в Remington's Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, PA, 21st ed. (2005), которая включена в настоящий документ в качестве ссылки.
Количество соединения формулы (I) в фармацевтической или другой композиции, включая единичную лекарственную форму, может быть эффективным количеством. В одном варианте композиция, такая как фармацевтическая композиция, содержит соединение формулы (I) в лекарственной форме в количестве от приблизительно 10 нг до приблизительно 1500 мг или более.
Представлены изделия, содержащие соединение в соответствии с данным изобретением или его соль или сольват в подходящем контейнере. Контейнер может быть флаконом, сосудом, ампулой и тому подобным.
Представленные в настоящем описании способы и наборы могут содержать соединение, описанное в настоящем описании, или его соль или сольват, так же, как если каждый в качестве любого варианта перечислен специально и отдельно. Также способ и наборы, представленные в настоящем описании, могут содержать композицию, описанную в настоящем описании, так же, как если каждая в качестве любого варианта перечислена специально и отдельно.
Способы
Соединения формулы (I) (т.е., соединения (MI)-(MV)) являются активными в отношении одной или более молекулярных целей и поэтому могут применяться в терапии. Соединения (MI)-(MV) или их соль или сольват могут применяться для модулирования рецепторов из таблиц 5 и 9, в данном описании представлены способы модулирования таких рецепторов.
Представлены способы терапии, включающие введение соединения формулы (I) или его соли или сольвата, или фармацевтической композиции любого из указанного выше индивидууму. В одном варианте способ включает введение соединения формулы (MI), (MII), (MIII), (MIV) или (MV) индивидууму в количестве, эффективном для модулирования рецептора, такого как рецептор, указанный в таблицах 5 и 9. В одном аспекте представлен способ модулирования транспортера норэпинефрина у индивидуума, где способ включает введение соединения формулы (MI) или его соли или сольвата индивидууму. В другом аспекте представлен способ модулирования рецептора прогестерона у индивидуума, где способ включает введение соединения формулы (MII) или его соли или сольвата индивидууму. В другом аспекте представлен способ модулирования сигма-рецептора у индивидуума, где способ включает введение соединения формулы (MIV) или его соли или сольвата индивидууму.
В некоторых вариантах соединение, описанное в настоящем описании как модулирующее рецептор (модулятор рецептора), ингибирует связывание лиганда на, по меньшей мере, приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100%, что определяется в описанных в настоящем описании анализах. В некоторых вариантах модулятор рецептора снижает активность рецептора на, по меньшей мере, приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% по сравнению с соответствующей активностью у того же субъекта до лечения модулятором рецептора, или по сравнению с соответствующей активностью у других субъектов, не получающих модулятор рецептора. В некоторых вариантах модулятор рецептора усиливает активность рецептора на, по меньшей мере, приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100, или 200%, или 300%, или 400%, или 500%, или более по сравнению с соответствующей активностью у того же субъекта до лечения модулятором рецептора, или по сравнению с соответствующей активностью у других субъектов, не получающих модулятор рецептора. В некоторых вариантах модулятор рецептора способен связывать активный центр рецептора (например, центр связывания для лиганда). В некоторых вариантах модулятор рецептора способен связываться с аллостерическим центром рецептора.
В другом аспекте данного изобретения представлен способ профилактики или лечения заболевания или состояния, описанного в настоящем описании, у индивидуума, где способ включает введение индивидууму эффективного количества соединения формул (MI), (MII), (MIII), (MIV) или (MV), или его соли, или фармацевтической композиции, содержащей любое из указанного выше.
В другом аспекте изобретения представлен способ лечения рака простаты, включающий введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения формул (MI), (MII), (MIII), (MIV) или (MV), или его соли, или фармацевтической композиции, содержащей любое из указанного выше. В одном конкретном варианте, относящемся к способу лечения рака простаты у индивидуума, соединение имеет формулу (MI) или (MII), или является его солью или сольватом. В одном конкретном варианте, относящемся к способу лечения рака простаты у индивидуума, соединение имеет формулу (MIII), (MIV) или (MV), или является его солью или сольватом. В одном конкретном варианте, относящемся к способу лечения рака простаты у индивидуума, соединение имеет формулу (MII), (MIII), или (MIV), или является его солью или сольватом.
В одном варианте, относящемся к способу лечения, заболевание или состояние выбирают из болезни Паркинсона и болезни Альцгеймера. Таким образом, в одном варианте представлен способ лечения болезни Паркинсона, где способ включает введение индивидууму терапевтически эффективного количества соединения формулы (I), или его соли или сольвата. В другом варианте представлен способ лечения болезни Альцгеймера, где способ включает введение индивидууму терапевтически эффективного количества соединения формулы (I), или его соли или сольвата.
В конкретном варианте представлен способ лечения болезни Паркинсона, где способ включает введение индивидууму, нуждающемуся в этом, соединения формулы (MI) или его соли или сольвата, или фармацевтической композиции, содержащей любое из указанного выше. В другом варианте представлен способ лечения болезни Альцгеймера, где способ включает введение индивидууму, нуждающемуся в этом, соединения формулы (MI) или его соли или сольвата, или фармацевтической композиции, содержащей любое из указанного выше.
Также представлены способы лечения рака простаты, облысения, печеночно-клеточной карциномы или акне, где способ включает введение индивидууму терапевтически эффективного количества соединения формулы (I) или его соли или сольвата. В одном аспекте способ включает введение соединения формулы (MI), (MII), (MIII) или (MIV). В одном варианте способ является способом лечения рака простаты. В другом варианте способ является способом лечения облысения. В еще одном варианте способ является способом лечения печеночно-клеточной карциномы. В еще одном варианте способ является способом лечения акне.
В конкретном варианте представлен способ лечения рака простаты, облысения, печеночно-клеточной карциномы или акне, где способ включает введение индивидууму соединения формулы (MI) или его соли или сольвата. В другом варианте представлен способ лечения рака простаты, облысения, печеночно-клеточной карциномы или акне, где способ включает введение индивидууму соединения формулы (MII) или его соли или сольвата. В другом варианте представлен способ лечения рака простаты, облысения, печеночно-клеточной карциномы или акне, где способ включает введение индивидууму соединения формулы (MIII) или его соли или сольвата. В другом варианте представлен способ лечения рака простаты, облысения, печеночно-клеточной карциномы или акне, где способ включает введение индивидууму соединения формулы (MIV) или его соли или сольвата.
В другом варианте представлен способ контроля рождаемости у женщин, где способ включает введение индивидууму соединения формулы (MII). В одном варианте соединение вводят индивидууму в количестве, предотвращающем беременность. В другом варианте соединение вводят индивидууму в количестве, достаточном для прерывания беременности. В одном варианте соединение (MII) дают женщине, которая беременна. В другом варианте соединение (MII) дают женщине, которая не беременна.
В другом варианте представлен способ лечения депрессии, где способ включает введение индивидууму терапевтически эффективного количества соединения формулы (MIV) или его соли или сольвата, или фармацевтической композиции, содержащей любое из представленного выше.
В другом варианте представлен способ лечения расстройства дефицита внимания, где способ включает введение индивидууму терапевтически эффективного количества соединения формулы (MI) или его соли или сольвата, или фармацевтической композиции, содержащей любое из представленного выше.
В любом из представленных способов в одном аспекте индивидуумом является человек.
В одном варианте лечение заболевания или состояния соединением в соответствии с настоящим изобретением или его фармацевтически приемлемой солью не сопровождается или сопровождается незначительными побочными эффектами, которые характерны для применяемых в настоящее время способов терапии заболевания или состояния, и/или улучшает качество жизни индивидуума.
Режим лечения соединением формулы (I) может включать введение соединения индивидууму, такому как человек, в дозе от приблизительно 0,01 до приблизительно 10 мг/кг массы тела, по меньшей мере, один раз в сутки в течение периода времени, требуемого для достижения терапевтического эффекта. В других вариантах суточная доза (или другая частота дозирования) соединения формулы (I) составляет от приблизительно 0,01 до приблизительно 8 мг/кг; или от приблизительно 0,01 до приблизительно 6 мг/кг; или от приблизительно 0,01 до приблизительно 4 мг/кг; или от 0,01 до приблизительно 2 мг/кг; или от приблизительно 0,01 до приблизительно 1 мг/кг; или от приблизительно 0,03 до приблизительно 10 мг/кг; или от приблизительно 1 до приблизительно 10 мг/кг; или от приблизительно 2 до приблизительно 10 мг/кг; или от приблизительно 4 до приблизительно 10 мг/кг; или от приблизительно 6 до приблизительно 10 мг/кг; или от приблизительно 8 до приблизительно 10 мг/кг; или от приблизительно 0,1 до приблизительно 5 мг/кг; или от приблизительно 0,1 до приблизительно 4 мг/кг; или от приблизительно 0,5 до приблизительно 5 мг/кг; или от приблизительно 1 до приблизительно 5 мг/кг; или от приблизительно 1 до приблизительно 4 мг/кг; или от приблизительно 2 до приблизительно 4 мг/кг; или от приблизительно 1 до приблизительно 3 мг/кг; или от приблизительно 1,5 до приблизительно 3 мг/кг; или от приблизительно 2 до приблизительно 3 мг/кг; или от приблизительно 0,03 до 4 мг/кг; или от приблизительно 0,03 мг/кг до 2 мг/кг; или от приблизительно 0,05 до 10 мг/кг; или от приблизительно 0,05 до 8 мг/кг; или от приблизительно 0,05 до 4 мг/кг; или от приблизительно 0,05 до приблизительно 3 мг/кг; или от приблизительно 10 мг/кг до приблизительно 50 мг/кг; или от приблизительно 10 до приблизительно 100 мг/кг или от приблизительно 10 до приблизительно 250 мг/кг; или от приблизительно 50 до приблизительно 100 мг/кг или от приблизительно 50 до 200 мг/кг; или от приблизительно 100 до приблизительно 200 мг/кг или от приблизительно 200 до приблизительно 500 мг/кг; или в дозе около 100 мг/кг; или в дозе около 500 мг/кг.
Соединение формулы (I) может вводиться индивидууму в соответствии с эффективным режимом дозирования в течение желательного периода времени или в продолжении, например, по меньшей мере, приблизительно одной недели, по меньшей мере, приблизительно 2 недель, по меньшей мере, приблизительно трех недель, по меньшей мере, приблизительно одного месяца, по меньшей мере, приблизительно 2 месяцев, по меньшей мере, приблизительно 3 месяцев, по меньшей мере, приблизительно 6 месяцев, или, по меньшей мере, приблизительно 12 месяцев или дольше. В одном варианте соединение формулы (I) вводят индивидууму в соответствии с суточным или периодическим порядком приема в течение жизни индивидуума.
Частота дозирования соединения формулы (I) может быть равна приблизительно однократному приему в неделю. Частота дозирования соединения формулы (I) может быть равна приблизительно однократному приему в сутки, двукратному приему в сутки или трехкратному приему в сутки. Частота дозирования соединения формулы (I) может быть равна приблизительно трехкратному приему в неделю или приблизительно четырехкратному приему в неделю, или приблизительно два раза в неделю. Частота дозирования соединения формулы (I) может составлять более одного раза в неделю, но менее приблизительно одного раза в сутки. Частота дозирования соединения формулы (I) может быть равна приблизительно одному разу в месяц. Частота дозирования соединения формулы (I) может быть равна приблизительно двукратному приему в неделю. Частота дозирования соединения формулы (I) может составлять более одного раза в месяц, но менее приблизительно одного раза в неделю. Частота дозирования соединения формулы (I) может быть периодической (например, один раз в сутки в течение 7 дней, затем перерыв на 7 дней, затем повторение в течение любых 14 дней, например, в течение приблизительно 2 месяцев, приблизительно 4 месяцев, приблизительно 6 месяцев или более). Частота дозирования соединения формулы (I) может быть непрерывной (например, один раз в неделю в течение нескольких недель). Любая частота дозирования может применяться для любого из описанных в настоящем описании соединений или их соли или сольвата вместе с любыми из режимов дозирования, описанных в настоящем описании.
Наборы
В данном изобретении также представлены наборы, содержащие соединение формулы (I). Наборы могут необязательно включать набор инструкций, обычно письменных инструкций, хотя также могут применяться электронные носители (например, дискета или оптический диск). Инструкции, включенные в набор, обычно содержат информацию о компонентах и их введении индивидууму, такую как информация относительно дозирования, режима дозирования и способа введения. В некоторых вариантах набор включает (a) соединение формулы (I) или его фармацевтически приемлемую соль; и (b) инструкции по применению при состоянии или расстройстве, описанных в настоящем описании, таких как рак простаты, болезнь Альцгеймера и болезнь Паркинсона. Наборы могут применяться для любого из описанных в настоящем описании соединений и, следовательно, могут содержать инструкции по одному или более из указанных способов применения (например, лечению и/или профилактике и/или задержке наступления и/или развитию любого из указанных в настоящем описании показаний).
В некоторых вариантах количество соединения формулы (I) в наборе является количеством, достаточным для получения желаемого терапевтического эффекта (например, снижения тяжести или длительности, стабилизации тяжести или превращения одного или более симптомов лечимого показания).
Наборы обычно имеют подходящую упаковку. Наборы могут включать один или более контейнеров, содержащих любое соединение, описанное в настоящем описании. Подходящая упаковка включает, но не ограничена ими, флаконы, бутылки, сосуды, гибкую упаковку (например, пластиковые пакеты) и подобные. Каждый компонент (если содержится более одного компонента) может быть упакован в отдельный контейнер, или несколько компонентов могут быть объединены в одном контейнере, если позволяет перекрестная реакционноспособность и срок годности. Наборы необязательно могут содержать дополнительные компоненты, такие как эксципиенты.
Контейнеры могут представлять собой единичные лекарственные формы, объемные упаковки (например, упаковки с множественной дозой) или подъединицы дозы. Например, могут быть представлены наборы, которые содержат достаточные дозы соединения формулы (I) для эффективного лечения индивидуума, имеющего лечимое показание, в течение длительного периода, например недели, 2 недель, 3 недель, 4 недель, 6 недель, 8 недель, 3 месяцев, 4 месяцев, 5 месяцев, 7 месяцев, 8 месяцев, 9 месяцев или более. Наборы также могут включать множественные лекарственные формы соединений и инструкции по применению в количествах, достаточных для хранения и применения в аптеках (например, аптеках при больницах и отделах по изготовлению лекарственных форм).
Способы получения и выделения соединений в соответствии с настоящим изобретением
Способы синтеза для получения соединений диарилгидантоина описаны в публикациях США №№ 2007/0004753, 2007/0254933 и 2009/0111864, которые полностью включены в настоящий документ в качестве ссылки и отдельно в отношении способов синтеза. Соединения (MI)-(MV) также могут быть получены способами, подробно описанными в представленных ниже примерах.
Представленные ниже примеры даны для иллюстрации и не ограничивают данное изобретение.
Пример 1. Выделение и идентификация соединений из плазмы крысы
Метаболиты RD162' выделяют и идентифицируют в стационарных образцах плазмы, взятых у групп, которым вводили высокие дозы, при 26-недельном пероральном токсикологическом исследовании на самцах и самках крыс Sprague Dawley.
Образцы плазмы крыс хранят при приблизительно -20°C или ниже. Образцы получают у объектов, получающих RD162'. Образцы для исследования готовят для ВЭЖХ впрыскивания осаждением каждого образца (100 мкл) с 3 объемами (300 мкл) ацетонитрила. Образцы центрифугируют при 16000 g в течение 5 мин. После центрифугирования 380 мкл каждой надосадочной жидкости переносят в новую пробирку и выпаривают досуха в Speed-Vac. Выпаренные образцы восстанавливают в 50 мкл 0,2% муравьиной кислоты в воде.
Образцы анализируют с применением следующих условий ЖХ/МС/МС: ВЭЖХ: система Shimadzu VP System; подвижная фаза: 0,2% муравьиной кислоты в воде (A) и 0,15% муравьиной кислоты в метаноле (B); колонка: 1×50 мм TITAN C18 (Peeke Scientific); объем вспрыскивания: 20 мкл; градиент: 5-75% B за 30 мин; скорость потока: 100 мкл/мин; масс-спектрометр: Applied Biosystems/MDS SCIEX Q-STAR; интерфейс: IonSpray сплит при ~1/10; скан исходного иона: TOF положительный из 100-900 а.е.м.; скан иона продукта: TOF ион продукта из 60-900 а.е.м. наиболее интенсивного иона в скане исходного иона; калибровка TOF: внешняя калибровка с применением субстрата Renin.
Образцы получают для впрыскивания и анализируют в один и тот же день. В таблице 1 суммированы результаты этого анализа.
Метаболиты RD162', идентифицированные ЖХ/МС/МС в образцах плазмы крысы
(время образца ТК)
Пример 2. Выделение и идентификация соединений в плазме собак
Метаболиты RD162' выделяют и идентифицируют в стационарных образцах плазмы, взятых у групп, которым вводили высокие дозы, при 13-недельном пероральном токсикологическом исследовании на самцах собак породы бигль.
Образцы плазмы собак хранят при приблизительно -20°C или ниже. Образцы получают у объектов, получающих RD162'. Образцы для исследования готовят для ВЭЖХ впрыскивания осаждением каждого образца (100 мкл) с 3 объемами (300 мкл) ацетонитрила. Образцы центрифугируют при 16000 g в течение 5 мин. После центрифугирования 380 мкл каждой надосадочной жидкости переносят в новую пробирку и выпаривают досуха в Speed-Vac. Выпаренные образцы восстанавливают в 50 мкл 0,2% муравьиной кислоты в воде.
Образцы анализируют с применением следующих условий ЖХ/МС/МС: ВЭЖХ: система Shimadzu VP System; подвижная фаза: 0,2% муравьиной кислоты в воде (A) и 0,15% муравьиной кислоты в метаноле (B); колонка: 1×50 мм TITAN C18 (Peeke Scientific); объем вспрыскивания: 20 мкл; градиент: 5-75% B за 30 мин; скорость потока: 100 мкл/мин; масс-спектрометр: Applied Biosystems/MDS SCIEX Q-STAR; интерфейс: IonSpray сплит при ~1/10; скан исходного иона: TOF положительный из 100-900 а.е.м.; скан иона продукта: TOF ион продукта из 60-900 а.е.м. наиболее интенсивного иона в скане исходного иона; калибровка TOF: внешняя калибровка с применением субстрата Renin.
Образцы получают для впрыскивания и анализируют в один и тот же день. В таблице 2 суммированы результаты этого анализа.
Метаболиты RD162', идентифицированные ЖХ/МС/МС в образцах плазмы собаки
(время образца ТК)
(2 ч)
(4 ч)
(2 ч)
(4 ч)
Пример 3. Выделение и идентификация соединений в плазме человека
Метаболиты RD162' выделяют и идентифицируют в стационарных образцах плазмы, взятых у пациентов с раком простаты, которым вводили RD162'. Стационарные образцы человека состоят из пяти образцов Cmax, которые получают на приблизительно 84 день лечения в дозе 240 мг/день.
Образцы плазмы человека хранят при приблизительно -20°C или ниже. Образцы получают у субъектов, получающих RD162'. Образцы для исследования готовят для ВЭЖХ впрыскивания осаждением каждого образца (100 мкл) с 3 объемами (300 мкл) ацетонитрила. Образцы центрифугируют при 16000 g в течение 5 мин. После центрифугирования 380 мкл каждой надосадочной жидкости переносят в новую пробирку и выпаривают досуха в Speed-Vac. Выпаренные образцы восстанавливают в 50 мкл 0,2% муравьиной кислоты в воде.
Образцы анализируют с применением следующих условий ЖХ/МС/МС: ВЭЖХ: система Shimadzu VP System; подвижная фаза: 0,2% муравьиной кислоты в воде (A) и 0,15% муравьиной кислоты в метаноле (B); колонка: 1×50 мм TITAN C18 (Peeke Scientific); объем вспрыскивания: 20 мкл; градиент: 5-75% B за 30 мин; скорость потока: 100 мкл/мин; масс-спектрометр: Applied Biosystems/MDS SCIEX Q-STAR; интерфейс: IonSpray сплит при ~1/10; скан исходного иона: TOF положительный из 100-900 а.е.м.; скан иона продукта: TOF ион продукта из 60-900 а.е.м. наиболее интенсивного иона в скане исходного иона; калибровка TOF: внешняя калибровка с применением субстрата Renin.
Образцы получают для впрыскивания и анализируют в один и тот же день. В таблице 3 суммированы результаты этого анализа.
Метаболиты RD162', идентифицированные ЖХ/МС/МС в образцах плазмы человека
(время образца ТК)
Пример 4: Количественная оценка соединений в плазме человека
Для оценки концентраций метаболитов в плазме человека ЖХ/МС/МС анализы для (MI), (MII) и (MIII) подготавливают и применяют для анализа плазмы у 18 пациентов с раком простаты, которые получали RD162' в дозе от 150 до 480 мг в сутки в течение приблизительно трех месяцев. Результаты этого анализа (таблица 4) показали, что (MI) и (MII) присутствуют в высоких концентрациях в плазме, и (MIII) присутствует в низких концентрациях.
Концентрации метаболитов RD162' в плазме пациентов, леченных RD162' в течение, по крайней мере, трех месяцев
Способ, применяемый для получения представленных выше данных, следующий. Анализ ЖХ/МС/МС с электрораспылением метаболитов RD162' ((MI), (MII), (MIII)):
Методика экстрагирования плазмы для определения концентрации: образец плазмы человека (50 мкл) добавляют в 10-мл стеклянную колбу. В колбу добавляют 10 мкл исходного раствора IS, затем добавляют 1M фосфатный буфер при pH 3,0 (400 мкл). Смесь встряхивают и добавляют тетрабутилметиловый эфир (5 мл). Колбу встряхивают в течение 30 сек и затем центрифугируют при 4540 g в течение 10 мин. Растворитель переносят в стеклянную пробирку и сушат в потоке воздуха при 35-40°C. Образец восстанавливают 100 мкл метанола:0,1% муравьиной кислоты в воде (7:3), встряхивают в течение 30 сек и обрабатывают ультразвуком в течение 5 мин. Образец переносят в колбу для образца ВЭЖХ и центрифугируют при 4540 g в течение 5 мин. Затем 20 мкл объем впрыскивают в систему ЖХ/МС/МС для анализа.
Параметры ЖХ/МС/МС для метаболитов RD162' ((MII) и (MIII)): параметры инструмента для режима положительного иона - функция 1; полярность: ES+; тип данных: данные MRM; тип функции: MRM 8 каналов.
Исходные условия HP1100 LC помпы: колонка ВЭЖХ: ACE C18, 5 мкМ, 150×2,1 мм в.д. Растворители: A% 40,0; B% 60,0; C% 0,0; D% 0,0; клапан A установлен на канал 1; клапан B установлен на канал 1. Поток: 0,300 мл/мин; время остановки: 9,0 мин; минимальное давление: 0 бар; максимальное давление: 300 бар; температура печи левая: 30,0°C; температура печи правая: 30,0°C.
Расписание градиента помпы HP1100 LC:
Параметры ЖХ/МС/МС для метаболита RD162' (MI)
Параметры инструмента - функция 1: полярность ES-; тип данных: данные MRM; тип функции: MRM 5 каналов.
Колонка ВЭЖХ: ACE C18, 5 мкМ, 150×2,1 мм в.д.; режим помпы HP1100 LC: изократный; условия изократного растворителя: A% 25,0; B% 75,0; C% 0,0; D% 0,0; клапан A установлен на канал 1; клапан B установлен на канал 1; поток: 0,300 мл/мин; время остановки: 4,5 мин; минимальное давление: 0 бар; максимальное давление: 300 бар: температура печи левая: 30,0°C; температура печи правая: 30,0°C.
Синтез соединений в соответствии с настоящим изобретением
Пример 5. Получение 4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)-2-фторбензойной кислоты (Соединение (MI)):
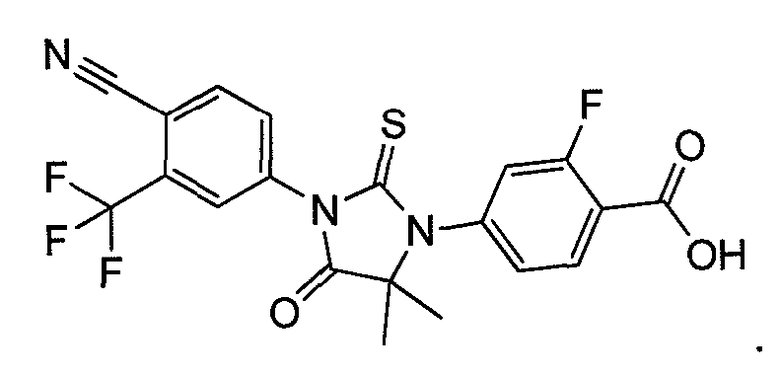
4-(3-(4-Циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)-2-фтор-N-метилбензамид суспендируют в концентрированной HCl и нагревают при 120°C в сосуде под давлением в течение 48 ч. Реакцию отслеживают тонкослойной хроматографией (ТСХ). Реакционную смесь охлаждают до температуры окружающей среды. Остаток фильтруют и очищают хроматографией на силикагеле (100-200 меш, элюент: 0-5% метанол-дихлорметан). МС (m/z): 452 (M+1). ВЭЖХ: колонка, YMC ODS AQ, 4,6×250 мм, 5 мкм, подвижная фаза A: 10 мМ ацетата аммония, подвижная фаза B: ацетонитрил, градиент, изократный: 55% A:45% B, время удержания, 3,804 мин, чистота ВЭЖХ, 95,82%, скорость потока, 1 мл/мин.
1H ЯМР (CDCl3, свободное основание): δ (ч/млн) 8,22 (т, 1H), 8,0 (д, 1H), 7,98 (с, 1H), 7,82 (д, 1H), 7,2 (м, 2H), 1,6 (с, 6H).
Пример 6. Получение 4-(3-(4-Циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)-2-фторбензамида (Соединение (MII))
Пример 6a. Получение 4-бром-2-фторбензамида:
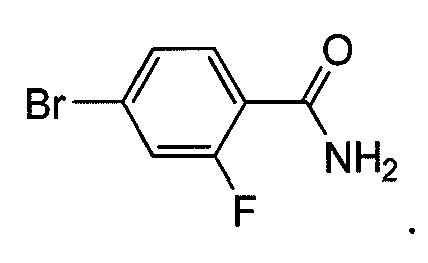
К перемешиваемому раствору 4-бром-2-фторбензойной кислоты (1,5 г, 6,84 ммоль) в ДХМ (15 мл) по каплям добавляют оксалилхлорид (3,45 г, 27,39 ммоль) при 0°C. После завершения добавления добавляют 2-3 капли ДМФ при 0°C, и реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении, и остаток растворяют в сухом ТГФ (20 мл). К этому раствору добавляют водн. аммиак (50 мл) при 0°C. Реакционную смесь нагревают до и перемешивают при комнатной температуре в течение 30 мин. Растворитель удаляют при пониженном давлении, и остаток подвергают азеотропной перегонке с толуолом с получением 1,3 г продукта.
1H ЯМР (CDCl3, свободное основание): δ (ч/млн) 8,0 (т, 1H), 7,40 (д, 1H), 7,30 (д, 1H), 6,60 (ушир.с, 1H), 5,9 (ушир.с, 1H).
Пример 6b. Получение 2-(4-карбамоил-3-фторфениламино)-2-метилпропановой кислоты:
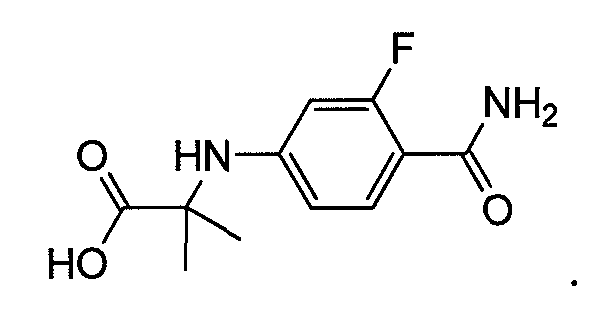
4-Бром-2-фторбензамид (0,5 г, 2,29 ммоль), 2-аминоизомасляную кислоту (0,354 г, 3,54 ммоль), CuI (87 мг, 0,458 ммоль) и K2CO3 (0,790 г, 5,72 ммоль) смешивают в ДМФ (5 мл). Добавляют H2O (0,5 мл) и ТЭА (11 мг, 0,1 ммоль), затем 2-ацетилциклогексанон (60 мг, 0,428 ммоль). Реакционную смесь нагревают до 95-100°C в течение 48 ч. Реакционную смесь разбавляют H2O (20 мл), и водный слой промывают этилацетатом (20 мл). Водный слой подкисляют 1M лимонной кислотой до pH 4, и продукт экстрагируют этилацетатом (20 мл × 3). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют при пониженном давлении с получением продукта.
1H ЯМР (ДМСО, свободное основание): δ (ч/млн) 7,55-7,45 (т, 1H), 7,20 (ушир.с, 1H), 7,05 (ушир.с, 1H), 6,80 (ушир.с, 1H), 6,35-6,30 (д, 1H), 6,18-6,10 (д, 1H), 1,42 (с, 6H).
Пример 6c. Получение метил 2-(4-карбамоил-3-фторфениламино)-2-метилпропаноата:
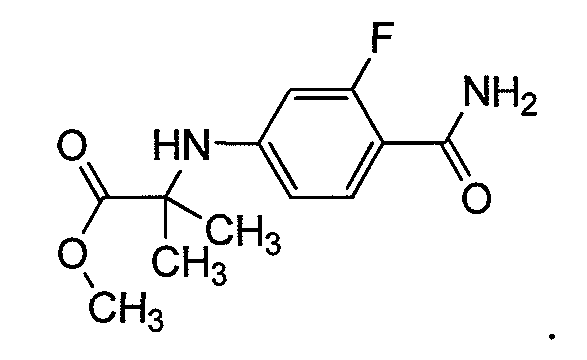
Раствор 2-(4-карбамоил-3-фторфениламино)-2-метилпропановой кислоты и K2CO3 (1,5 эквивалента) в ДМФ (10-кратное) перемешивают при КТ в течение 10 мин. Добавляют MeI (1,5 эквивалента), и реакционную смесь нагревают при 55-60°C в течение 2 ч. Растворитель удаляют при пониженном давлении, и реакционную смесь выливают в воду, экстрагируют этилацетатом (100 мл × 2), сушат над Na2SO4, концентрируют и очищают хроматографией на колонке.
1H ЯМР (CDCl3, свободное основание): δ (ч/млн) 7,9 (т, 1H), 6,5 (ушир.с, 1H), 6,4 (д, 1H), 6,2 (д, 1H), 5,6 (ушир.с, 1H), 4,6 (ушир.с, 1H), 3,75 (с, 3H), 1,6 (с, 6H).
Пример 6d. Получение 4-изотиоцианато-2-(трифторметил)бензонитрила:
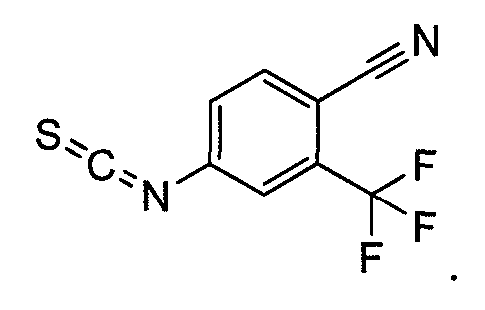
Тиофосген (10 г, 87,71 ммоль) растворяют в воде и перемешивают при комнатной температуре в течение 10 мин. Порциями добавляют 4-амино-2-трифторметилбензонитрил при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Продукт экстрагируют дихлорметаном, и органический слой промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и выпаривают с получением 12 г продукта.
1H ЯМР (CDCl3): δ (ч/млн) 7,84 (д, 1H), 7,58 (с, 1H), 7,48 (д, 1H).
Пример 6e. Получение 4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)-2-фторбензамида (Соединение (MII)):
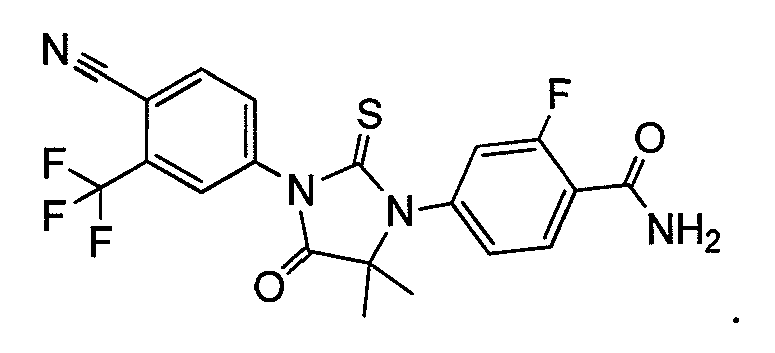
Раствор метил 2-(4-карбамоил-3-фторфениламино)-2-метилпропаноата и 2-(трифторметил)-4-изотиоцианатобензонитрила (1,5 эквивалента) в сухом ДМСО (5 мл на ммоль) нагревают до 80-82°C в течение 12 ч. Реакционную смесь разбавляют водой и экстрагируют этилацетатом. Объединенный органический слой концентрируют при пониженном давлении, и остаток очищают хроматографией на силикагеле, элюируя 40% ацетоном-гексанами. МС (m/z): 451 (M+1). ВЭЖХ: колонка, YMC ODS A, 4,6×150 мм, 5 мкм, подвижная фаза A: 10 мМ ацетата аммония, подвижная фаза B: ацетонитрил, градиент,: 10% В вплоть до 2 мин, от 10% до 90% В за 3 мин, выдержка 3 мин, от 90% до 10% В за 5 мин, время удержания, 2,782 мин, чистота ВЭЖХ, 99,4%, скорость потока, 1 мл/мин.
1H ЯМР (CDCl3, свободное основание): δ (ч/млн) 8,3 (т, 1H), 8,0 (д, 1H) 7,98 (с, 1H), 7,8 (д, 1H), 7,27 (д, 1H), 7,2 (д, 1H), 6,65 (д, 1H), 6,0 (с, 1H), 1,62 (с, 6H).
Пример 7. Получение 4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-2,4-диоксоимидазолидин-1-ил)-2-фторбензамида (Соединение (MIII)):
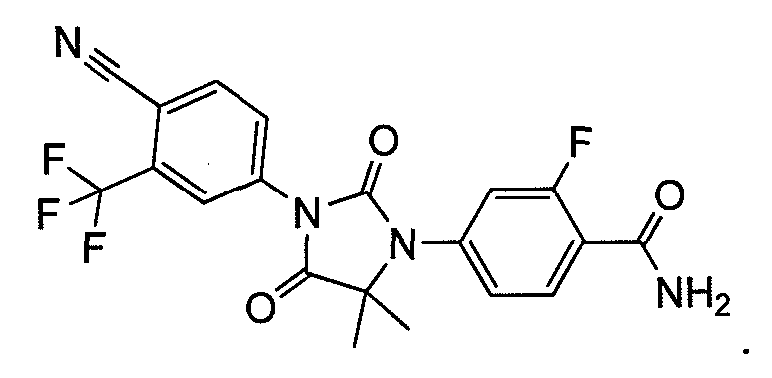
К раствору 4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)-2-фторбензамида (Соединение (MII)) (1,48 г, 3,4 ммоль) в этаноле (60 мл) добавляют 30% водную H2O2 (30 мл) при комнатной температуре. Раствор нагревают до кипения с обратным холодильником в течение 1 ч. После удаления этанола добавляют насыщенный раствор соли (100 мл), и водный слой экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении с получением неочищенного продукта, который очищают хроматографией на силикагеле. МС (m/z): 435 (M+1). ВЭЖХ: колонка, YMC ODS A, 4,6×150 мм, 5 мкм, подвижная фаза A: 10 мМ ацетата аммония, подвижная фаза B: ацетонитрил, градиент,: 10% В вплоть до 2 мин, от 10% до 90% В за 6 мин, выдержка 10 мин, от 90% до 10% В за 4 мин, время удержания, 9,548 мин, чистота ВЭЖХ, 98,08%, скорость потока, 1 мл/мин.
1H ЯМР (CDCl3, свободное основание): δ (ч/млн) 8,3 (т, 1H), 8,18 (с, 1H), 8,2 (д, 1H), 7,96 (д, 1H), 7,25 (м, 2H), 6,65 (ушир.д, 1H), 5,9 (ушир.с, 1H) 1,65 (с, 6H).
Пример 8. Получение 4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-2,4-диоксоимидазолидин-1-ил)-2-фтор-N-метилбензамида (Соединение (MIV)):
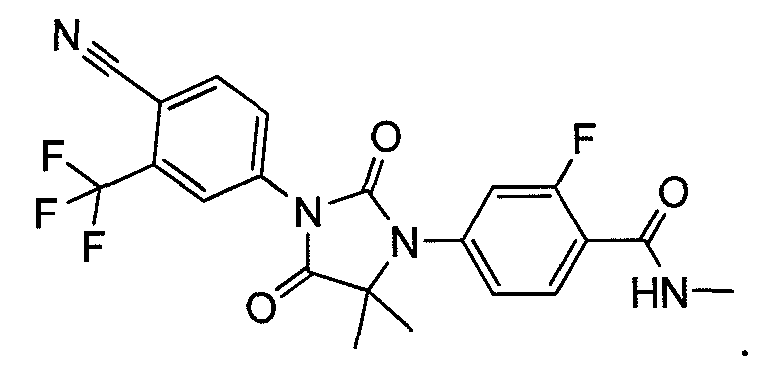
К раствору 4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)-2-фтор-N-метилбензамида (1,52 г, 3,4 ммоль) в этаноле (60 мл) добавляют 30% водную H2O2 (30 мл) при комнатной температуре. Раствор нагревают до температуры кипения с обратным холодильником в течение 1 ч. После удаления этанола добавляют насыщенный раствор соли (100 мл), и водный слой экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении с получением неочищенного продукта, который очищают хроматографией на силикагеле. МС (m/z): 449 (M+1). ВЭЖХ: колонка, YMC ODS A, 4,6×150 мм, 5 мкм, подвижная фаза A: 10 мМ ацетата аммония, подвижная фаза B: ацетонитрил, градиент,: 10% В вплоть до 2 мин, от 10% до 90% В за 3 мин, выдержка 3 мин, от 90% до 10% В за 5 мин, время удержания, 8,976 мин, чистота ВЭЖХ, 98,46%, скорость потока, 1 мл/мин.
1H ЯМР (CDCl3, свободное основание): δ (ч/млн) 8,22 (т, 1H), 8,18 (с, 1H), 8,04 (д, 1H), 7,95 (д, 1H), 7,28 (д, 1H), 7,22 (д, 1H), 6,70 (м, 1H), 3,05 (д, 3H), 1,65 (с, 6H).
Пример 9. Получение 4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-2,4-диоксоимидазолидин-1-ил)-2-фторбензойной кислоты (Соединение (MV)):

Раствор 4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)-2-фторбензойной кислоты (50 мг, 0,11 ммоль) в тионилхлориде (0,5 мл, 67,7 ммоль) перемешивают при 90°C в течение 15 ч. Реакционную смесь концентрируют при пониженном давлении досуха. Лед-воду (20 мл) добавляют в остаток, и продукт экстрагируют этилацетатом (60 мл). Органический слой сушат над безводным сульфатом натрия и выпаривают при пониженном давлении с получением неочищенного продукта, который очищают ВЭЖХ с обращенной фазой с получением 4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-2,4-диоксоимидазолидин-1-ил)-2-фторбензойной кислоты.
1H ЯМР (ДМСО-d 6 , свободное основание): δ (ч/млн) 8,39 (д, 1H), 8,25 (с, 1H), 8,1 (д, 1H), 8,0 (т, 1H), 7,45 (д, 1H), 7,4 (д, 1H), 1,58 (с, 6H).
Биологическая активность тестируемых соединений
Представленные ниже примеры иллюстрируют биологическую активность Соединений (MI)-(MIV). Стандартные анализы связывания и ферментные анализы, такие как описаны ниже, могут быть проведены практиками, такими как, например, Cerep, Inc. (Redmond, WA, USA); MDS Pharma Services (King of Prussia, PA, USA); NovaScreen Biosciences/Caliper Life Sciences (Mountain View, CA, USA); и EuroScreen FAST (Gosselies, Belgium).
Определения:
Следующие аббревиатуры рецепторов применяют в следующих примерах: аденозин для A1, A2a и A3; адренергический для α1 и α2; ангиотензин для AT1 и AT2; бензодиазепин для BZD; брадикинин для B1 и B2; каннабиноид для CB1 и CB2; холецистокинин для CCK1 и CCK2; фактор выделения кортикотропина для CRF1; допамин для D1, D2S, D3, D4.4; эндотелин для ETA и ETB; гамма-аминомасляная кислота для GABA; ионотропная гамма-аминомасляная кислота для GABAA; альфа-амино-3-гидроксил-5-метил-4-изоксазолпропионат для AMPA; N-метил-D-аспартиновая кислота для NMDA; гистамин для H1, H2 и H3; лейкотриен для LTB4 и LTD4; гормон, высвобождающий гонадотропин, для GnRH; меланокортин для MC4; мускариновый для M; нейрокинин для NK1, NK2 и NK3; нейропептид для Y; опиоид ноцицептина для NOP; фенциклидин для PCP; пуринергический для P2X и P2Y; серотонин для 5-HT; соматостатин для sst5; глюкокортикоид для GR; эстроген для ER; прогестерон для PR; тироидный гормон для TR; гормон, высвобождающий тиротропин, для TRH1; вазопрессин для V1a и V2; ATP-чувствительный K+ для KATP; потенциалозависимый K+ для Kv; и Ca2+-зависимый малой проводимости для SKCa. Следующие аббревиатуры ферментов используют в следующих примерах: фосфодиэстераза для PDE1B, PDE2A, PDE3A, PDE4D, PDE5; протеинкиназа C альфа для PKCα; катехол-O-метилтрансфераза для COMT; моноаминоксидаза для MAO-A и MAO-B; и фенилэтаноламин-N-метилтрансфераза для PNMT.
Пример B1. In-Vitro фармакология: активность связывания соединений (MI)-(MIV)
Соединения (MI)-(MIV) оценивают скринингом при 10 мкМ в отношении целей, показанных в таблице 5. Методы анализа радиолигандного связывания применяют для измерения активности соединений в соответствии с настоящим изобретением, и они знакомы специалистам в данной области техники. Для каждого анализа связывания общая методика и условия эксперимента суммированы в таблицах 5 и 6, соответственно. В каждом анализе компоненты анализа, такие как, например, тип клеток, лиганд, ссылочное соединение и тому подобное, хорошо знакомы специалистам, практикующим такие анализы.
Общие методики
1. hr - рекомбинантный человека; 2. ns - неселективный
Условия эксперимента
Анализ и результаты: Соединения в соответствии с настоящим изобретением тестируют в биохимических анализах и определяют процент специфического связывания. Специфическое связывание лиганда с рецепторами определяют как разницу между общим связыванием и неспецифическим связыванием, определенным в присутствии избытка не меченного лиганда. Результаты выражают как процент ингибирования контрольного специфического связывания (100-((измеренное специфическое связывание/контрольное специфическое связывание) × 100)), полученного в присутствии тестируемых соединений. Результаты анализов суммированы в таблице 7.
Результаты анализов связывания
Результаты фармакологии in vitro: результаты, показывающие ингибирование (или стимулирование для начала анализа в базовых условиях) более 50% обычно считаются значительными для тестируемых соединений. Результаты, показывающие ингибирование (или стимулирование) от 20% до 50%, обычно являются показательными от слабого до умеренного эффекта. Результаты, показывающие ингибирование (или стимулирование) ниже 20%, обычно считаются менее значимыми.
Биология выбранных целей суммирована следующим образом. Рецептор аденозина A3: рецептор, сопряженный с G-белком, с плохо определенной ролью в функциях сердечных, воспалительных и нейронных клеток (Fishman, et al. "Pharmacology and therapeutic applications of A3 receptor subtype." Curr. Top. Med. Chem. (2003), 3(4):463-9); каннабиноидный рецептор CB2: рецептор, сопряженный с G-белком, вовлечен в ноцицепцию и функцию иммунных клеток (Jhaveri, et al. "Cannabinoid CB2 receptor-mediated anti-nociception in models of acute and chronic pain." Mol Neurobiol. (2007), 36(1):26-35; Marriott, et al. "Recent advances in the development of selective ligands for the cannabinoid CB(2) receptor." Curr. Top. Med. Chem. (2008), 8(3): 187- 204); Cl- канал (крысы): GABA-регулируемый хлоридный канал регулирует активность нейронной клетки (Treiman, D. "GABAergic Mechanisms in Epilepsy." Epilepsia (2001), 42(3):8-12); адренергический α1 (неселективный, крыса): рецептор, сопряженный с G-белком для катехоламинов. Эти рецепторы регулируют сокращение гладких мышц и выделение нейротрансмиттера (Michelotti, et al. "Alpha 1 -Adrenergic receptor regulation: basic science and clinical implications." Pharmacol. Ther. (2000), 88(3):281-309); сигма (неселективный): связанный с мембраной рецептор ЦНС, модулирующий поведение, связанное с депрессией (Stahl, S. "Antidepressant Treatment of Psychotic Major Depression: Potential Role of the Sigma Receptor." CNS Spectr. (2005), 10(4):319-323); транспортер норэпинефрина: переносит норадреналин и в меньшей степени допамин из синапса обратно во внутринейронные пузырьки для хранения до дальнейшего применения (Mandela, et al. "The Norepinephrine Transporter and Its Regulation." J. Neurochemistry (2006), 97(2):310-333); прогестерон PR: экспрессируется во всех основных физиологических системах с пиками в матке/яичниках, мозжечке, спинном мозге и гипоталамусе (Edwards, et al. "Progesterone receptor transcription and non-transcription signaling mechanisms." Steroids (2003), 68(10-13):761-770).
Пример B2: Фармакология in vitro: связывание рецептора андрогена человека (AR)
Препарат ткани: рецептор андрогена человека экспрессируется в клетках LNCAP, которые культивируют и собирают трипсинизацией из колб T-175. Замороженную лепешку оттаивают и повторно суспендируют ультразвуком, затем разводят до подходящей концентрации. Гомогенат центрифугируют при 48000 g в течение 10 мин при 4°C. Используют надосадочную жидкость. Определяют белок. Ткань разводят до 0,325 мг/мл буфером для анализа так, чтобы в каждой пробирке было 65 мкг белка, или конечная концентрация анализа составляла 0,260 мг/мл.
Материалы и реагенты: [3H]-Метилтриенолон разводят до концентрации 5 нМ в 25 мМ HEPES pH 7,4 (содержащем 1,0 мМ EDTA, 10 мМ молибдата натрия, 10% глицерин, 0,5 мМ PMSF) так, чтобы конечная концентрация радиолиганда в анализе составляла 0,5 нМ. Неспецифическое связывание определяют как связывание, остающееся в присутствии 2×10-7 M Метилтриенолона (R1881). Ссылочным соединением является Метилтриенолон (R1881), исследуемый при конечных концентрациях: 2×10-11, 5×10-11, 1×10-10, 2×10-10, 5×10-10, 1×10-9, 2×10-9, 5×10-9, 1×10-8, 2×10-8, 5×10-8 и 1×10-7 M.
Буферы: 25 мМ HEPES pH 7,4; 1,0 мМ EDTA; 10 мМ молибдата натрия; 10% глицерин; 0,5 мМ PFSM (сначала PMSF растворяют в EtOH, затем добавляют в оставшийся буфер).
Реакция связывания: (Liao, et al. "The Use of a Hydroxylapatite-Filter Steroid Receptor Assay Method in the Study of the Modulation of Androgen Receptor Interaction." J. Steroid Biochem. (1984), 20:11-17 (с модификациями)). Каждый флакон содержит следующие компоненты: тестируемое/ссылочное соединение или носитель (25 мкл); [3H]-Метилтриенолон (25 мкл); суспензию ткани (200 мкл). Реакцию связывания инициируют добавлением ткани и инкубируют при 0-4°C (в холодильнике) в течение 18-22 ч (в течение ночи). Реакцию связывания заканчивают быстрой фильтрацией содержимого пробирки в обработанные 0,1% PEI фильтры GF/B. Пробирки для анализа один раз промывают ледяным 25 нМ HEPES, затем быстро ополаскивают 6×1 мл/пробирку того же промывочного буфера. Радиоактивность, оставшуюся на фильтрах, оценивают с применением жидкостной сцинтилляционной спектрофотометрии после пропитки фильтров в течение, по меньшей мере, 1 ч в сцинтилляционном коктейле. Неспецифическое связывание определяют как количество радиоактивности, оставшейся в присутствии 2×10-7M не меченного Метилтриенолона (R1881). Специфическое связывание рассчитывают из разницы между общим и неспецифическим связыванием. Значения IC5O определяют построением графика специфического связывания как функции от концентрации тестируемого соединения. Значения Ki получают непосредственно из значений IC50 с применением уравнения Ченга-Прусоффа (Ki=IC50/(1+(L/KD)), где L - концентрация радиолиганда в анализе и KD - сродство радиолиганда для рецептора, определенного независимо. Примеры результатов анализа показаны в Таблице 8.
Активность связывания AR соединений (MI)-(MIV)
Данные в таблице 8 показывают, что соединения MII-MIV обладают активностью в отношении рецептора андрогена.
Пример B3: Фармакология in vitro: Ферментные анализы
Представленные ниже ферментные анализы знакомы специалистам в данной области техники. Для каждого ферментного анализа общие методики и условия эксперимента суммированы в Таблицах 9 и 10, соответственно.
Общие методики
Условия эксперимента
Анализ и результаты: Результаты выражают как процент от контрольной специфической активности ((измеренная специфическая активность/контрольная специфическая активность) × 100), полученной в присутствии тестируемых соединений. Результаты представлены в таблице 11.
Результаты ферментных анализов
Пример B4: Анализ ядерной транслокации рецептора андрогена
Работа с клетками: Линии клеток PathHunter NHRPro выращивают из замороженных исходных растворов в колбах T25 согласно стандартным методикам и хранят в селективной среде для роста до анализа. Как только установлено, что клетки здоровые и выращены нормально, клетки переносят из колб с применением не содержащего трипсин буфера для разъединения клеток и высевают в 384-луночные микропланшеты с белыми стенками и прозрачным дном для профилирования соединения. Для профилирования клетки высевают при плотности 10000 клеток на лунку в общем объеме 50 мкл, и им дают слипнуться и восстановиться в течение ночи до добавления соединения. Добавляют среду, содержащую отфильтрованную на угле-декстране сыворотку, для снижения уровня присутствующих гормонов.
Тип скрининга: соединения тестируют в режиме агониста и антагониста в следующих эффектах дозы: 60, 20, 6,67, 2,22, 0,74, 0,25, 0,08, 0,03, 0,009 и 0,003 мкМ, дважды, с трехкратными серийными разведениями с получением EC50 и IC50.
Формат агониста: промежуточное разведение исходных растворов соединения проводят так, чтобы 5,5 мкл 10× соединения было добавлено в каждую лунку при конечной концентрации ДМСО 1% от общего объема. Для профилирования соединения в режиме агониста клетки инкубируют в присутствии соединения при 37°C в течение 5 ч.
Формат антагониста: Кривые дозы агониста строят для определения значения EC80 для последующего тестирования антагониста с соединениями. 5,5 мкл 10× агониста добавляют в каждую лунку при равной концентрации носителя. EC80 концентрации агониста определяют непосредственно из кривой дозы агониста. Для определения антагониста клетки предварительно инкубируют с антагонистом после стимула агонистом при концентрации EC80: 5,5 мкл 10× соединения добавляют в клетки и инкубируют при 37°C в течение 1 ч; 5,5 мкл 11× EC80 агониста добавляют в клетки и инкубируют при 37°C в течение 5 ч.
Определение сигнала: после подходящего инкубирования соединения создают сигнал анализа через однократное добавление 30 мкл (50% об./об.) коктейля реагента для определения PathHunter для анализа агонистов и антагонистов, соответственно, с последующим инкубированием в течение 1 часа при комнатной температуре. Микропланшеты считывают после создания сигнала с применением инструмента PerkinElmer ViewLux™ для определения хемилюминесцентного сигнала.
Анализ данных: Кривые дозы в присутствии и отсутствии соединения строят с применением GraphPad Prism. Суммарные результаты анализа представлены в таблице 12.
Результаты анализа ядерной транслокациии рецептора андрогена для соединений (MI)-(MIV)
Пример B5: Функциональный анализ GABA A
Целью этого анализа является оценка функционального действия MI-MIV на человеческие ионотропные рецепторы GABAA. Человеческие рецепторы GABAA α1β3 и α1β3γ2 экспрессируются в ооцитах Xenopus. Эффект сильного воздействия применяют для оценки возможного агонистического действия соединений, а предварительное или совместное воздействие с GABA применяют для оценки возможного ингибирующего действия соединений.
Получение ооцитов: все эксперименты проводят на человеческих GABAA, экспрессированных в ооцитах Xenopus с применением способа экспрессии кДНК. Ооциты Xenopus получают и впрыскивают с применением стандартных методик. Кратко, яичники собирают у самок Xenopus Laevis, которым делают глубокую анестезию и хранят согласно правилу по правам животных Женевского кантона. Небольшой кусок яичника выделяют для немедленного получения препарата, оставшуюся часть помещают при 4°C в стерильный раствор Барта, содержащий NaCl (88 мМ), KCl (1 мМ), NaHCO3 (2,4 мМ), HEPES (10 мМ), MgSO4·7H2O (0,82 мМ), Ca(NO3)2·4H2O (0,33 мМ), CaCl2·6H2O (0,41 мМ) при pH 7,4 и добавляют 20 мкг/мл канамицина, 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина. Все записи проводят при 18°C, и клетки обливают средой OR2, содержащей NaCl (82,5 мМ), KCl (2,5 мМ), HEPES (5 мМ), CaCl2·2H2O (1,8 мМ), MgCl2·6H2O (1 мМ), pH 7,4.
Электрофизиологические записи: токи, вызываемые GABA, записывают с применением автоматизированного аппарата, оборудованного стандартной конфигурацией с двухэлектродным режимом фиксации потенциала (TVEC). Если не указано, клетки хранят при -80 мВ. Данные собирают и анализируют с применением программного обеспечения для сбора и анализа собственных данных HiQScreen, работающего под Matlab (Mathworks Inc.).
Получение агониста: GABA получают в виде концентрированного исходного раствора (10-1 M) в воде и затем разводят в среде для записи с получением желаемой для тестирования концентрации. Соединения получают в виде исходного раствора (10-2 M) в ДМСО и затем разводят средой для записи с получением желаемой для тестирования концентрации. Остаточный ДМСО не превышает концентрации 1%, которая не оказывает влияние на функции ооцитов Xenopus.
Анализ данных и статистика: Для статистического анализа значения обрабатывают на компьютере либо с помощью Excel (Microsoft), либо Matlab (Mathworks Inc.). Для получения статистической значимости все эксперименты проводят с применением, по меньшей мере, трех клеток. Значения представлены как среднее + SEM.
Методики эксперимента: Инъекции кодирующих кДНК для подъединиц человеческой GABAA проводят в, по меньшей мере, одной сотне ооцитов с применением запатентованного автоматизированного устройства для инъекций (Hogg et al., J. Neurosci. Methods, 2008), и экспрессию рецептора изучают, по меньшей мере, через два дня. Ооциты записывают с применением двух электродов, и их потенциал мембраны поддерживают на фиксированном уровне (-80 мВ) в течение всего эксперимента.
Измерение агонистического действия MI-MIV: Действие MI-MIV на функцию рецептора GABAA оценивают с применением протокола однократного воздействия (30 сек). В этом протоколе клетки сначала сенсибилизируют ссылочным тестовым импульсом GABA (10 мкМ, 5 сек), и их реакцию используют в качестве контроля. GABA удаляют, и клетки затем обрабатывают в течение 30 сек тестируемым соединением, во время чего измеряют записи канала. Наконец, тестируемое соединение удаляют, и повторно применяют GABA (3 мкМ, 5 сек) в конце инкубирования. Записи, полученные во время 30-секундного периода в присутствии MI-MIV, не показали определяемые входящие токи, показывающие, что эти соединения не активируют α1β3 рецептор GABAA. M4 также тестируют на агонистическое действие на α1β3γ2 рецептор GABAA. Как и в результатах, полученных для α1β3 рецептора GABAA, M4 не вызывают определяемые входящие токи на α1β3γ2 рецепторе GABAA, показывая, что эти соединения не активируют ни одну форму рецептора GABAA.
Измерение антагонистического действия MI-MIV: Для оценки возможного ингибирующего действия различных MI-MIV разработаны протоколы концентрации ингибирования. В этом протоколе ооциты, показывающие устойчивые реакции GABA, обрабатывают в течение 45 сек данной концентрацией рассматриваемого соединения, и реакцию записывают на фиксированную концентрацию GABA, примененную в присутствии соединения. После быстрой промывки для удаления GABA клетки возвращают еще на 45 сек в ту же концентрацию, и затем процесс повторяют с более высокими концентрациями соединения. Так как ооциты постоянно подвергаются воздействию тестируемого соединения, суммарный результат получают для наиболее высоких концентраций. Положительный контроль в этом анализе, антагонистический трет-бутилбициклофосфоротионат (TBPS), показал зависящее от концентрации ингибирующее действие на α1β3 рецептор. Полученные IC50 для TBPS составляют 0,6±0,06 мкМ. Эти значения IC50 сопоставимы с теми, которые были описаны в литературе [Hamann et al., Mol. Pharmacol. (1990), 37(4):578-582].
Результаты: M1 демонстрирует зависимое от концентрации ингибирование α1β3 рецептора и α1β3γ2 рецептора с полученными значениями IC50 20,7±6 мкМ и 68,3±6,0 мкМ. При наиболее высокой концентрации достигается по существу полное ингибирование (75±18,4%). M2 демонстрирует зависимое от концентрации ингибирование α1β3 рецептора с полученным значением IC50 2,3±0,3 мкМ. При наиболее высокой концентрации достигается по существу полное ингибирование (80±10%). M3 демонстрирует зависимое от концентрации ингибирование α1β3 рецептора с полученным значением IC50 4,0±3,15 мкМ. При наиболее высокой концентрации достигается частичное ингибирование (57±7%). M4 демонстрирует зависимое от концентрации ингибирование α1β3 с полученным значением IC50 1,55±0,19 мкМ. При наиболее высокой концентрации достигается по существу полное ингибирование (78±3%).
Заключение: Агонистическое действие: краткая обработка MI-MIV не вызывает определяемые входящие токи на либо α1β3, либо α1β3γ2 рецептора GABAA, показывая что эти соединения не активируют ни одну из двух форм рецептора GABAA. Антагонистическое действие: MI-MIV антагонизирует α1β3 рецептор GABAA со значениями IC50 и значениями % ингибирования, показанными в таблице 13. Так как ингибирование отмечается в мкМ интервале, эти данные показывают, что MI-MIV являются функциональными антагонистами рецептора GABAA.
Результаты функционального анализа GABAA для MI-MIV
75±2,1
44,98±4,62
Пример B6. Идентификация (MI)-(MV) в плазме крысы
Метаболиты RD162' выделяют и идентифицируют в стационарных образцах плазмы у трех самцов крыс Sprague Dawley, которым перорально дают смесь нерадиомеченных RD162' и радиомеченных RD162' ([14C]RD162') при 100 мг/кг/сутки (всего RD162') и 250 мкКи/кг/сутки ([14C] радиоактивность). Крысам дают препарат один раз в день в течение семи последовательных дней; спустя четыре часа после дозирования на седьмой день плазму собирают у всех трех крыс. Образцы плазмы хранят при приблизительно -70°C или ниже.
[14C] RD162' имеет удельную активность 57,6 мКи/ммоль и по анализу ВЭЖХ является на >98% чистым. Положение атома [14C] показано ниже, где * означает положение радиометки:
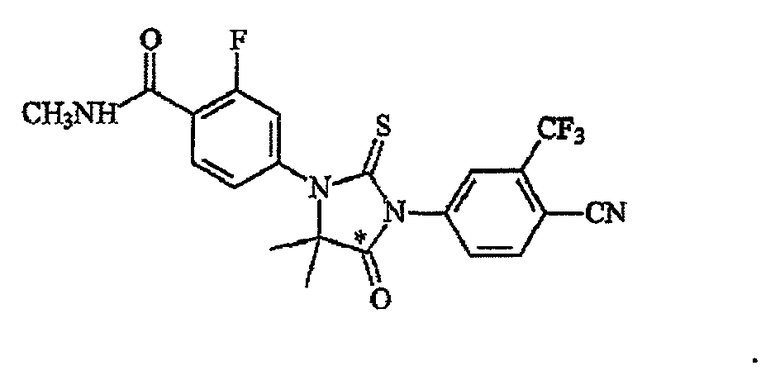
Образцы плазмы от трех животных объединяют в смеси 1:1:1 (названной в настоящем описании "объединенная плазма крыс") и анализируют концентрацию RD162' и его метаболитов. Идентификация [14C]RD162' и метаболитов [14C]RD162' в объединенной плазме крыс основана на совместном элюировании ВЭЖХ со ссылочными стандартами или на масс-спектральном анализе. ЖХ/МС с электрораспылением положительного иона и ЖХ/МС/МС применяют для анализа метаболитов.
Для получения объединенной плазмы крыс для анализа ВЭЖХ приблизительно 1 г образца плазмы объединяют с ацетонитрилом (ACN, образец:ACN, 1:3, об./об.), смешивают при встряхивании, обрабатывают ультразвуком в холодной воде, центрифугируют и удаляют надосадочные жидкости. Экстрагирование повторяют дважды, и соответствующие надосадочные жидкости объединяют. Двойные аликвоты анализируют подсчетом импульсов в жидкой фазе (LSC) для определения эффективности экстракции, которая составляет 100%. Объединенные надосадочные жидкости выпаривают досуха и восстанавливают в 1 мл 0,1% муравьиной кислоты в обратном осмосе (RO) вода:ACN:метанол (MeOH, 50:45:5, об./об./об.). Образец смешивают при встряхивании, облучают ультразвуком, микрофугируют и двойные аликвоты анализируют путем LSC для определения эффективности экстракции, которая составляет 98,1%. Восстановленный образец анализируют ВЭЖХ для определения профиля метаболитов с фракциями, собранными с 10-секундными интервалами, и анализируют подсчетом импульсов в твердой фазе.
Готовые образцы анализируют с применением следующих условий ЖХ/МС/МС: ВЭЖХ: Hewlett Packard 1100 серия; подвижная фаза: 0,1% муравьиной кислоты в обратном осмосе вода, (A) и ацетонитрил (B); колонка: Agilent Eclipse XDB-Cl 8, 4,6×150 мм, 5 мкм; защитная колонка: Phenomenex Security Guard Cartridge C18, 3×4 мм; температура колонки: 20°C; градиент: 20-80% B в 40 мин; скорость потока: 1,5 мл/мин.
Для экспериментов с совместным элюированием время элюирования определяют для RD162' и его метаболитов. RD162' и метаболиты (MI), (MII), (MIII), (MIV) и (MV) впрыскивают во время ВЭЖХ, и время элюирования из колонки измеряют определением в ультрафиолетовом свете при 254 нм. Полученное время удержания, которое суммировано в таблице 14, применяют для качественного определения продуктов.
ВЭЖХ хроматографический процент радиоактивности образца в виде [14C]RD162' или метаболитов [14C]RD162' в объединенных образцах плазмы в стационарном состоянии при пероральном введении самцам крыс [14C]RD162'
Структуры (MI), (MII), (MIII), (MIV) и (MV) подтверждают масс-спектральным анализом.
B7. Определение значений IC 50 и/или EC 50
Соединения в соответствии с настоящим изобретением могут быть далее оценены через определение значений IC50 и/или EC50 из кривых концентрация-реакция. Способ определения значений IC50 и/или EC50 может быть известным способом.
Хотя представленное выше изобретение детально описано с помощью иллюстраций и примеров, данных в целях ясности понимания, специалистам в данной области техники очевидно, что определенные незначительные изменения и модификации могут быть осуществлены. Поэтому описание и примеры не должны рассматриваться как ограничивающие объем данного изобретения.
Все ссылки, такие как публикации, патенты, заявки на патенты и опубликованные заявки на патенты, полностью включены в настоящий документ в качестве ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2654942C2 |
| СОЕДИНЕНИЯ-АНТАГОНИСТЫ Н4 | 2021 |
|
RU2837355C1 |
| СПИРООКСИНДОЛЬНЫЕ АНТАГОНИСТЫ MDM2 | 2010 |
|
RU2553269C2 |
| ВЫСОКОАКТИВНЫЙ МАТЕРИАЛ, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ СМЕШАННЫЙ ОКСИД ПЕРЕХОДНЫХ МЕТАЛЛОВ, ВЫСОКОАКТИВНЫЕ ЧЕТВЕРТИЧНЫЕ МЕТАЛЛИЧЕСКИЕ МАТЕРИАЛЫ, ИСПОЛЬЗУЮЩИЕ СОЕДИНЕНИЯ КОРОТКОЦЕПОЧЕЧНОГО ЧЕТВЕРТИЧНОГО АЛКИЛАММОНИЯ | 2018 |
|
RU2757295C1 |
| ИНДАЗОЛ-КАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ | 2005 |
|
RU2404179C2 |
| СЛИТЫЕ ТРИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ИНТЕГРАЗЫ ВИЧ | 2016 |
|
RU2740187C2 |
| ЭЛЕКТРОЛЮМИНЕСЦЕНТНОЕ УСТРОЙСТВО | 2006 |
|
RU2413335C2 |
| 4-ГИДРОКСИБЕНЗОМОРФАНЫ | 2005 |
|
RU2480455C2 |
| КОНЪЮГАТЫ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ | 2014 |
|
RU2669812C2 |
| СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВ НА ОСНОВЕ МАЙТАНЗИНОИДА | 2018 |
|
RU2783076C2 |
Группа изобретений относится к фармацевтической композиции на основе соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, где X является S или O, и если X является S, R1 является OH или NH2; и если X является O, R1 является OH, NH2 или NHMe. Также изобретение относится к соединению формулы (I) и набору на его основе. Технический результат: получены новые производные имидазолидина, полезные при лечении рака простаты. 5 н. и 23 з.п. ф-лы, 14 табл., 14 пр.
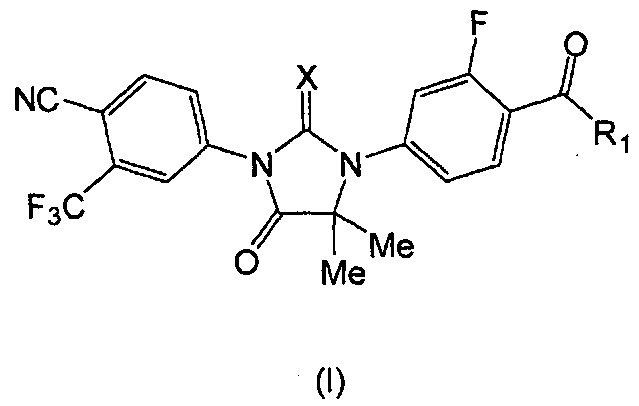
1. Фармацевтическая композиция для лечения рака простаты, содержащая (a) терапевтически эффективное количество соединения формулы (I):

где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемую соль или сольват, и (b) фармацевтически приемлемый носитель.
2. Фармацевтическая композиция по п.1, где X является S, и R1 является OH или NH2.
3. Фармацевтическая композиция по п.1, где X является О, и R1 является OH, NH2 или NHMe.
4. Фармацевтическая композиция по п.1, где соединение имеет формулу (MI):
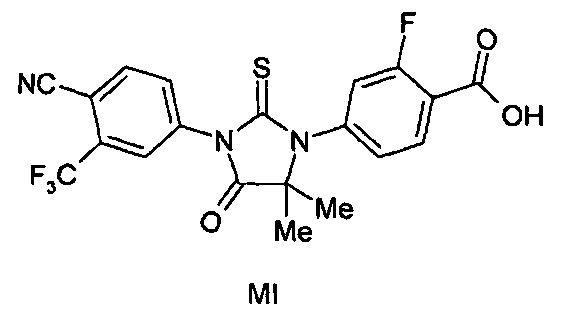
или его фармацевтически приемлемая соль или сольват.
5. Фармацевтическая композиция по п.1, где соединение имеет формулу (MII):
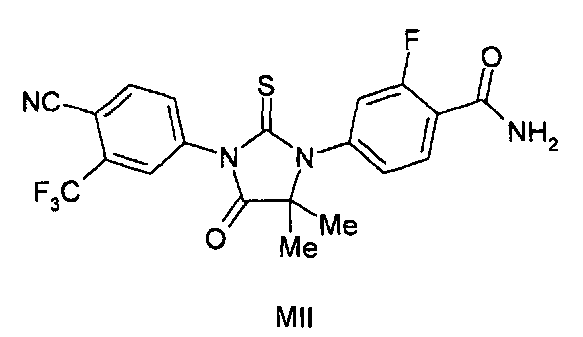 ,
,
или его фармацевтически приемлемая соль или сольват.
6. Фармацевтическая композиция по п.1, где соединение имеет формулу (MIII):

или его фармацевтически приемлемая соль или сольват.
7. Фармацевтическая композиция по п.1, где соединение имеет формулу (MIV):
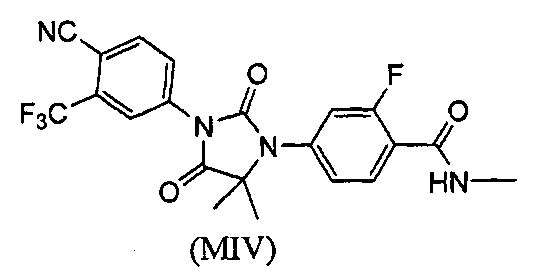
или его фармацевтически приемлемая соль или сольват.
8. Фармацевтическая композиция по п.1, где соединение имеет формулу (MV):
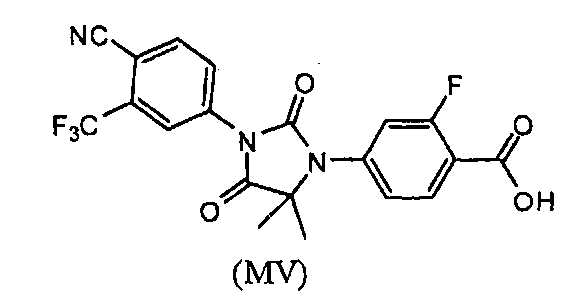
или его фармацевтически приемлемая соль или сольват.
9. Соединение в по существу чистой форме, где соединение имеет формулу (I):
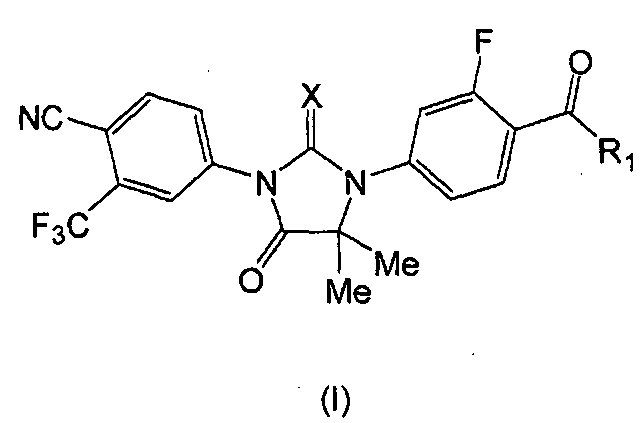
где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемая соль или сольват.
10. Соединение по п.9, где X является S, и R1 является OH или NH2.
11. Соединение по п.9, где X является O, и R1 является OH, NH2 или NHMe.
12. Соединение по п.9, где соединение имеет формулу (MI):
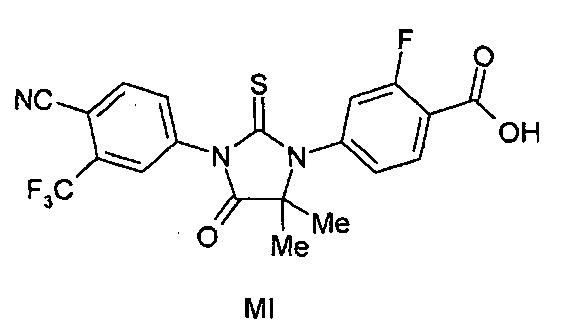
или его фармацевтически приемлемая соль или сольват.
13. Соединение по п.9, где соединение имеет формулу (MII):
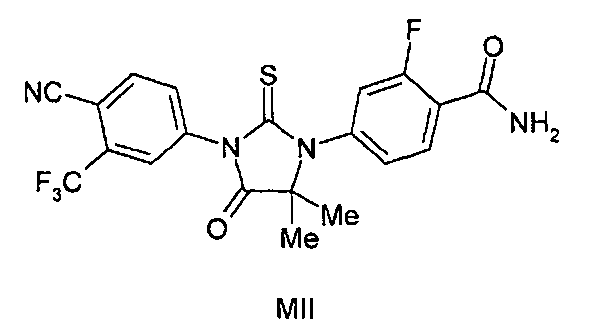 ,
,
или его фармацевтически приемлемая соль или сольват.
14. Соединение по п.9, где соединение имеет формулу (MIII):
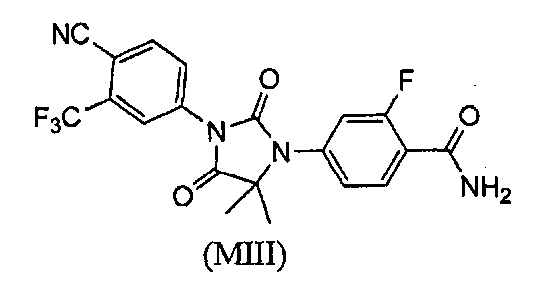
или его фармацевтически приемлемая соль или сольват.
15. Соединение по п.9, где соединение имеет формулу (MIV):
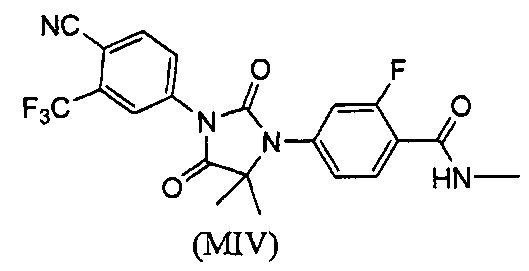
или его фармацевтически приемлемая соль или сольват.
16. Соединение по п.9, где соединение имеет формулу (MV):
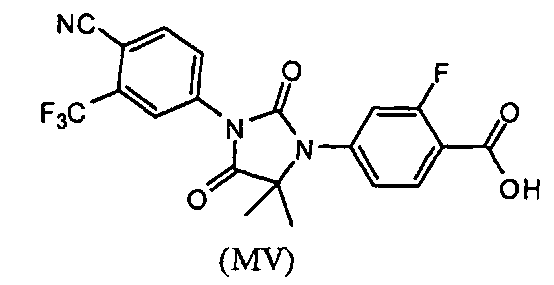
или его фармацевтически приемлемая соль или сольват.
17. Соединение по любому из пп.9-16, содержащее менее приблизительно 10 массовых процентов примесей.
18. Способ лечения рака простаты, включающий введение нуждающемуся в этом индивидууму терапевтически эффективного количества соединения формулы (I):
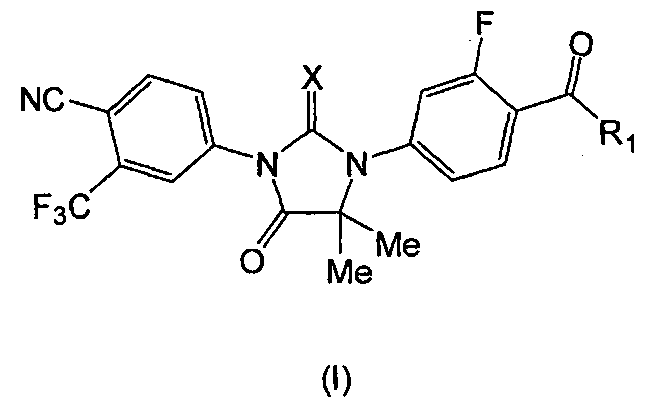
где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемой соли или сольвата.
19. Способ по п.18, где X является S, и R1 является OH или NH2.
20. Способ по п.18, где X является O, и R1 является OH, NH2 или NHMe.
21. Набор для лечения рака простаты, содержащий терапевтически эффективное количество соединения формулы (I):
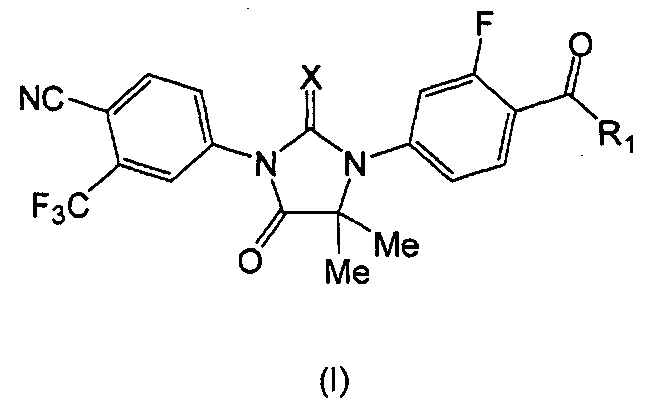
где:
X является S или О, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемую соль или сольват.
22. Набор по п.21, где X является S, и R1 является ОН или NH2.
23. Набор по п.21, где X является O, и R1 является OH, NH2 или NHMe.
24. Набор по любому из пп.21-23, где набор дополнительно содержит инструкции по применению.
25. Набор по п.24, где инструкцией является инструкция по применению соединения для лечения рака простаты.
26. Выделенное соединение формулы (I):
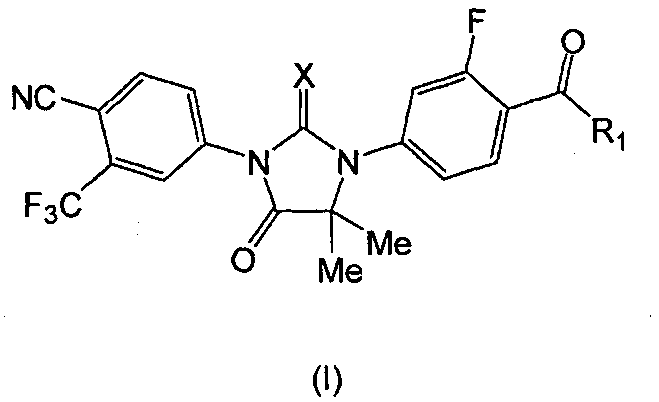
где:
X является S или O, и
если X является S, R1 является OH или NH2; и
если X является O, R1 является OH, NH2 или NHMe;
или его фармацевтически приемлемая соль или сольват.
27. Выделенное соединение по п.26, где X является S, и R1 является OH или NH2.
28. Выделенное соединение по п.26, где X является O, и R1 является OH, NH2 или NHMe.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ЗАМЕЩЕННЫЕ ФЕНИЛИМИДАЗОЛИДИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2152934C1 |
| Гербицидная композиция | 1971 |
|
SU578823A3 |
Авторы
Даты
2015-04-20—Публикация
2010-02-24—Подача